Мальтоза — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 февраля 2014; проверки требует 21 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 февраля 2014; проверки требует 21 правка.| Мальтоза | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | 4-О-α-D-глюкопиранозил-D-глюкоза, |
| Традиционные названия | Мальтоза |
| Хим. формула | C12H22O11 |
| Состояние | Белый порошок или кристаллы |
| Молярная масса | 342,32 г/моль |
| Плотность | 1.54 г/см³ |
| Температура | |
| • плавления | 160–165 °C (Дигидрат) 102-103 °C (Моногидрат) |
| Растворимость | |
| • в воде | 1.080 г/100 мл |
| Рег. номер CAS | 69-79-4 |
| PubChem | 439186 |
| Рег. номер EINECS | 200-716-5 |
| SMILES | |
| InChI | 1S/C12h32O11/c13-1-3-5(15)6(16)9(19)12(22-3)23-10-4(2-14)21-11(20)8(18)7(10)17/h4-20H,1-2h3/t3-,4-,5-,6+,7-,8-,9-,10-,11?,12-/m1/s1 |
| RTECS | LZ6600000 |
| ChEBI | 17306 |
| ChemSpider | 388329 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
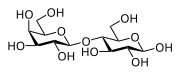
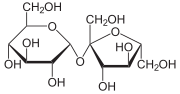
Мальто́за (от англ. malt — солод) — солодовый сахар, 4-О-α-D-глюкопиранозил-D-глюкоза, природный дисахарид, состоящий из двух остатков глюкозы; содержится в больших количествах в проросших зёрнах (солоде) ячменя, ржи и других зерновых; обнаружен также в томатах, в пыльце и нектаре ряда растений.
Биосинтез мальтозы из β-D-глюкопиранозилфосфата и D-глюкозы известен только у некоторых видов бактерий. В животном и растительном организмах мальтоза образуется при ферментативном расщеплении крахмала и гликогена (см. Амилазы).
Мальтоза легко усваивается организмом человека. Расщепление мальтозы до двух остатков глюкозы происходит в результате действия фермента a-глюкозидазы, или мальтазы, которая содержится в пищеварительных соках животных и человека, в проросшем зерне, в плесневых грибах и дрожжах. Генетически обусловленное отсутствие этого фермента в слизистой оболочке кишечника человека приводит к врождённой непереносимости мальтозы — тяжёлому заболеванию, требующему исключения из рациона мальтозы, крахмала и гликогена или добавления к пище фермента мальтазы.
α-Мальтоза — (2R,3R,4S,5R,6R)-5-[(2R,3R,4S,5R,6R)-2,3,4-тригидрокси-6-(гидроксиметил)оксанил]окси-6-(гидроксиметил)оксан-2,3,4-триол
β-Мальтоза — (2S,3R,4S,5R,6R)-5-[(2R,3R,4S,5R,6R)-2,3,4-тригидрокси-6-(гидроксиметил)оксанил]окси-6-(гидроксиметил)оксан-2,3,4-триол
Мальтоза легко растворима в воде, имеет сладкий вкус. Молекулярная масса мальтозы — 342,32. Температура плавления мальтозы — 102°C (безводная).

Мальтоза является восстанавливающим сахаром, так как имеет незамещённую полуацетальную гидроксильную группу.
При кипячении мальтозы с разбавленной кислотой и при действии фермента мальтоза гидролизуется (образуются две молекулы глюкозы C6H12O6).
C12h32O11+h3O→2C6h22O6.{\displaystyle {\mathsf {C_{12}H_{22}O_{11}+H_{2}O\rightarrow 2C_{6}H_{12}O_{6}}}.}
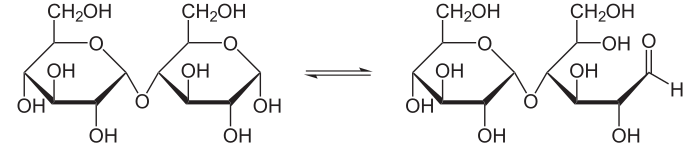 Баланс между циклической и открытой формой мальтозы
Баланс между циклической и открытой формой мальтозы- Химия углеводов. — М.:, 1967.
- Харрис Г. Основы биохимической генетики человека. Пер. с англ. — М.:, 1973.
Дисахарид — Википедија

Дисахарид (или биоза) е олигосахарид, односно јаглехидрат изграден од две моносахаридни единици. Најважните дисахариди се состојат од две хексози и нивната заедничка формула е C12H22O11, молекулската тежина им е 342, 2, а процентниот состав на одделните хемиски елементи е: C — 42, 08%, H — 6, 48%, O — 51, 44%.
Се разликуваат два типа на дисахариди:
Имињата на дисахаридите се образуваат така што името на моносахаридот, чијшто полуацетален хидроксил влегува во соединение, добива наставка «ид», а моносахаридот кој се сврзал со алкохолен хидроксил останува со непроменето име, на пример, малтозата е глукозидо — глукоза, а лактозата галактозидо — глукоза.
Некои дисахариди се наоѓаат слободни во природата (сахароза, лактоза, трехалоза), а други ги изградуваат полисахаридите (скроб, целулоза) или се составен дел на некој гликозид.
| ||||||||||||||||||||||||||||||||||||||||||||
Глюкоза — Википедия
| Глюкоза[1] | |
|---|---|
 | |
| Систематическое наименование | (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь (D-глюкоза), (2S,3R,4S,5S)-2,3,4,5,6-пентагидроксигексаналь (L-глюкоза) |
| Традиционные названия | Глюкоза, декстроза |
| Хим. формула | C6H12O6 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 180,16 г/моль |
| Плотность | 1,5620 г/см³ |
| Температура | |
| • плавления | α-D-глюкоза: 146 °C (моногидрат: 83 °C) β-D-глюкоза: 148–150 °C |
| Растворимость | |
| • в воде | 82 г/100 мл |
| • в 80 % этаноле | 2 г/100 мл |
| Вращение [α]D{\displaystyle [\alpha ]_{D}} | α-D-глюкоза: +112,2° β-D-глюкоза: +18,7° |
| Дипольный момент | 14,1 Д |
| Рег. номер CAS | 50-99-7 (D-глюкоза) 921-60-8 (L-глюкоза) |
| PubChem | 24895228 |
| Рег. номер EINECS | 200-075-1 |
| SMILES | |
| InChI | |
| RTECS | LZ6600000 |
| ChEBI | 17234 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Глюко́за, или виноградный сахар, или декстроза (D-глюкоза), C6H12O6 — органическое соединение, моносахарид (шестиатомный гидроксиальдегид, гексоза), один из самых распространённых источников энергии в живых организмах на планете[2]. Встречается в соке многих фруктов и ягод, в том числе и винограда, от чего и произошло название этого вида сахара. Глюкозное звено входит в состав полисахаридов (целлюлоза, крахмал, гликоген) и ряда дисахаридов (мальтозы, лактозы и сахарозы), которые, например, в пищеварительном тракте быстро расщепляются на глюкозу и фруктозу.
Вероятно, глюкоза известна человеку с древних времён, поскольку она кристаллизуется из мёда. Однако в чистом виде её выделили гораздо позже: немецкий химик Андреас Маргграф получил её в 1747 году из виноградного сока. Жозеф Луи Пруст в 1801 году осадил кристаллы α-D-глюкозы из того же виноградного сока. Благодаря этим экспериментам за глюкозой закрепилось название виноградного сахара[3].
Использование глюкозы в качестве подсластителя связано с тем, что во время Наполеоновских войн были заблокированы поставки тростникового сахара из Вест-Индии. Ещё в 1000 году до н. э. в Китае из крахмала (ферментацией риса) получали искусственный подсластитель — дисахарид мальтозу. К концу XVIII в. в Европе было известно, что крахмал можно обработать кислотой и получить сладкое вещество. Именно это позволило К. С. Кирхгофу нагреванием картофельного крахмала с серной кислотой получить сладкое сиропообразное вещество. В результате оптимизации процесса он получил сироп, который кристаллизовался при стоянии. Кроме того, была предпринята попытка прессовать получаемую массу в твёрдый продукт и в таком виде продавать. Однако организовать производство не удалось, поскольку Наполеон потерпел поражение и поставки сахара были восстановлены
Процесс получения глюкозы исследовал французский химик Соссюр. Он выяснил, что крахмал подвергается гидролизу, при котором разрушаются связи между углеводными фрагментами, причём на каждый разрыв расходуется по одной молекуле воды. Также было обнаружено, что конфеты, производимые из сиропов глюкозы, не такие сладкие, как те, что получают из сахарозы. Поэтому в Германии и других странах Европы было организовано производство глюкозы[3].
В то время промышленная глюкоза была недостаточно чистой и получалась в виде сиропов. Её приходилось многократно кристаллизовать из воды или использовать органические растворители. Единственной твёрдой формой, которую выпускали в большом количестве, была литая глюкоза: сироп заливали в формы, где он затвердевал[3].
В 1923 году в США Уильям Б. Ньюкирк (англ. William B. Newkirk) запатентовал промышленный способ получения глюкозы. Этот способ отличался тщательным контролем условий кристаллизации, благодаря чему глюкоза выпадала из раствора в виде чистых, крупных кристаллов[3].
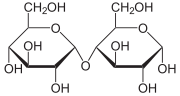
Глюкоза принадлежит к классу альдогексоз, то есть является полигидроксиальдегидом, содержащим шесть атомов углерода, альдегидную группу и пять гидроксильных групп. Четыре атома углерода в её структуре являются хиральными, поэтому существует 16 стереоизомерных альдогексоз: некоторые встречаются в природе, некоторые получены синтетически. Конкретную конфигурацию хиральных центров глюкозы в конце XIX в. установил немецкий химик Эмиль Фишер. Он сделал это при помощи реакций наращивания и деградации углеродной цепи сахаров. Наряду с наиболее распространённым в природе моносахаридом D-глюкозой существует также её энантиомер L-глюкоза,который в природе практически не встречается[4][5].
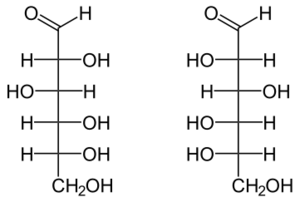 D-глюкоза (слева) и L-глюкоза (справа)
D-глюкоза (слева) и L-глюкоза (справа)Часто D-глюкозу изображают в линейной форме, однако в действительности D-глюкоза существует в циклической форме, образованной в результате присоединения ОН-группы при углероде С-5 к альдегидной группе. Образующийся при этом циклический полуацеталь устойчив: в растворах и кристаллической форме D-глюкоза более чем на 99 % находится в форме полуацеталя. В общем такую форму называют пиранозной (от названия пирана — шестичленного гетероцикла с одним атомом кислорода), а циклическую D-глюкозу называют D-глюкопиранозой[6].
При описанной циклизации возникает новый стереоцентр при полуацетальном атоме углерода, поэтому D-глюкопираноза может существовать в виде двух диастереомеров, называемых аномерами: α-D-глюкопиранозы и β-D-глюкопиранозы (или кратко: α-D-глюкозы и β-D-глюкозы; α-аномера и β-аномера). Изображать циклические формы углеводов удобно при помощи проекций Хеуорса — идеализированных шестичленных циклов с заместителями над и под плоскостью цикла[6][5].
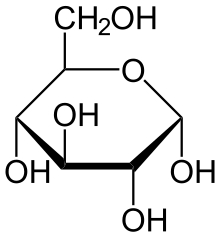 α-D-Глюкопираноза α-D-Глюкопираноза | 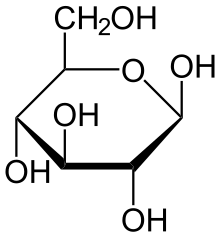 β-D-Глюкопираноза β-D-Глюкопираноза |
Наиболее близко к истине структуру молекулы глюкозы можно изобразить, используя конформацию «кресло». В таком представлении все гидроксильные группы D-глюкопиранозы находятся в экваториальных положениях (кроме аномерной, которая может находиться в экваториальном либо аксиальном положении в зависимости от аномера). Экваториальные положения более выгодны по сравнению с аксиальными: это объясняет, почему глюкоза является наиболее распространённым моносахаридом[6].
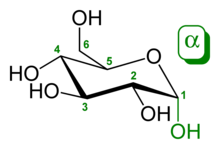 α-D-Глюкопираноза α-D-Глюкопираноза |  β-D-Глюкопираноза β-D-Глюкопираноза |
В растворах α-D-глюкопираноза и β-D-глюкопираноза существуют в равновесии и взаимопревращаются через образование открытоцепной формы. Равновесная доля α-аномера при 31 °С составляет 38 %, а более устойчивого β-аномера — 62 %[7]. Чистые аномеры можно получить в кристаллическом виде: α-аномер кристаллизуется из воды в виде моногидрата, а β-аномер кристаллизуется из пиридина[8].
Глюкоза — бесцветное кристаллическое вещество без запаха. Обладает сладким вкусом. D-глюкоза представлена в виде трёх кристаллических форм: безводной α-D-глюкопиранозы, моногидрата α-D-глюкопиранозы и безводной β-D-глюкопиранозы (хотя описан также моногидрат β-D-глюкопиранозы). Безводные формы имеют орторомбические кристаллы, а гидрат — моноклинные[7]. Все три формы отличаются температурой плавления: α-аномер плавится при 146 °С, его моногидрат — при 83 °С, β-аномер — при 148–150 °С[8].
Аномеры D-глюкопиранозы оптически активны: удельное вращение α-аномера составляет +112,2°, β-аномера — +18,9°[8]. Оба аномера при растворении претерпевают мутаротацию, то есть превращаются в равновесную смесь, состоящую из 62 % β-аномера и 38 % α-аномера[7]. Удельное вращение этой смеси составляет +52,7°[8].
Производство глюкозных сиропов[править | править код]
Кислотный гидролиз крахмала[править | править код]
Единственным сырьём для производства глюкозы является крахмал, хотя делаются попытки использовать другой природный полимер глюкозы — целлюлозу. Основным источником крахмала является кукуруза: 100 % глюкозных подсластителей в США и 84 % в Японии производят из кукурузного крахмала. Также 70 % производимой в мире кукурузы идёт на производство глюкозы. В Европе постепенно возрастает использование пшеничного крахмала, хотя в основном используется также кукурузный крахмал. В Австралии глюкозу получают только из пшеничного крахмала. В Азии используют крахмал из саго, тапиоки и кукурузы[9].
Для получения глюкозы крахмал гидролизуют в присутствии кислот или ферментов. При этом происходит разрыв связей между глюкозными звеньями полимерных амилозы и амилопектина — компонентов крахмала — и образуется мономер (D-глюкоза) с некоторым содержанием димеров: мальтозы и изомальтозы. Для кислотного гидролиза готовят суспензию крахмала в воде (30-40 мас. %) и доводят pH до 2 или ниже. При атмосферном давлении кислотный гидролиз протекает 6 ч, однако современные установки позволяют проводить процесс при повышенном давлении и, соответственно, более высокой температуре. При давлении 415–620 кПа и температуре до 160 °С крахмал гидролизуется в течение нескольких минут. Останавливают реакцию добавлением нейтрализующего реагента (обычно карбоната натрия), и pH повышается до 4-5,5[10].
После гидролиза нерастворимые примеси, которые изначально присутствовали в крахмале, отделяют центрифугированием или фильтрованием, а растворимые примеси удаляют активированным углём и ионообменными смолами. Смолы также позволяют обесцветить полученную глюкозу. Конечный раствор упаривают. Большинство глюкозных сиропов продают в виде 70-85 % растворов, хотя их можно упарить и до твёрдого состояния[10].
Глюкозные сиропы отличаются по степени гидролиза крахмала: её оценивают по количеству присутствующих в конечном продукте восстанавливающих сахаров и выражают в декстрозных эквивалентах (DE). Интересно, что кислотный гидролиз является в целом случайным процессом, однако в данном случае при одинаковой степени конверсии получается очень воспроизводимый углеводный состав конечного продукта. В некоторых случаях этот факт является нежелательным ограничением, потому что производителю может понадобиться более гибко регулировать углеводный состав. Из-за этого в промышленности стали использовать ферментативный гидролиз крахмала[10].
Ферментативный гидролиз крахмала[править | править код]
Ферментативный гидролиз используют как дополнение к кислотному. Изначально таким способом пытались повысить степень конверсии и получить более сладкий и менее вязкий сироп с большим содержанием глюкозы. Однако ферментативный гидролиз позволяет также регулировать соотношение глюкозы и мальтозы в продукте. Для проведения ферментативного гидролиза pH повышают до 4-6, а температуру снижают до 60-70 °С, затем вносят необходимые ферменты, которые подбирают исходя из потребностей по составу. Бактериальные α-амилазы случайным образом расщепляют α-1,4-гликозидные связи в крахмале. β-Амилазы и грибковые α-амилазы расщепляют те же связи, но дают преимущественно мальтозу. Глюкоамилаза отщепляет по одной молекуле глюкозы с невосстанавливающего конца, но может расщеплять также α-1,6-связи. Пуллуланаза расщепляет α-1,6-связи. По окончании процесса ферменты дезактивируют нагреванием или изменением pH[10].
Открытие термоустойчивых α-амилаз позволило разработать полностью ферментативные процессы и ещё более точно контролировать степень конверсии и углеводный состав продукта. Ферменты вносят в суспензию крахмала при pH 6-6,5, после чего суспензию нагревают паром до 103-107 °С и выдерживают в течение 5-10 мин, а затем 1-2 ч при 95 °С. После этого проводят вторичный ферментативный гидролиз, как и в случае кислотного гидролиза[10].
Производство общего сахара[править | править код]
Большая часть глюкозы продаётся в виде сиропов, но существует небольшая потребность также в твёрдой глюкозе. Её производят как в чистом виде, так и в виде общего сахара (англ. total sugars) — отверждённого гидролизата крахмала. Общий сахар может содержать значительное количество мальтозы (DE<20), быть практически чистой глюкозой (95-99 %), а также содержать определённый процент фруктозы[11].
Производство кристаллической глюкозы[править | править код]
Изначально чистую кристаллическую глюкозу производили из крахмала, гидролизованного в кислой среде. В таких условиях удавалось добиться только 88 % содержания глюкозы, поскольку в условиях гидролиза образовывались побочные продукты, связанные с мутаротацией и изомеризацией. С 1938 года начали использовать ферментативный гидролиз, который позволил получать более чистую глюкозу[12].
Моногидрат α-D-глюкозы получают кристаллизацией из перенасыщенных сиропов с содержанием твёрдого вещества в 74-79 %, из которого глюкоза составляет 95-96 %. Такие сиропы производят ферментативным гидролизом, нацеленным на максимальную конверсию. Сироп охлаждают до 46-50 °С и смешивают с затравочными кристаллами из предыдущей партии. Сироп медленно охлаждают до 20-40 °С в течение 2-5 дней: при этом около 60 % кристаллизуется в виде моногидрата α-D-глюкозы. Маточный раствор отделяют на центрифугах, кристаллы глюкозы промывают водой и там же сушат до максимально сухого состояния (14 % влаги). Затем их досушивают потоком горячего воздуха до 8,5-9 % влаги (теоретическое содержание воды в моногидрате — 9,08 %). Кристаллизации не мешает наличие примесей, поэтому маточный раствор концентрируют и получают вторую порцию кристаллов либо объединяют его со следующей партией сиропа. Извлечение моногидрата глюкозы из сиропа достигает 87,5 %. При повторных кристаллизациях из маточного раствора степень выделения повышается до 100 %[12].
Безводную α-D-глюкозу кристаллизуют при 60-65 °С в условиях вакуума и испарения растворителя. Исходные сиропы должны быть достаточно чистые. Цикл кристаллизации значительно короче, чем для моногидрата, и составляет 6-8 ч. Выделяют и сушат кристаллы примерно так же, как описано выше. Содержание воды в конечном продукте не превышает 0,1 %[12].
Безводную β-D-глюкозу получают кристаллизацией выше 100 °С. Дополнительные сложности связаны с тем, что β-D-глюкоза значительно лучше растворима в воде, чем α-D-глюкоза (72 % против 30 % при 25 °С)[12].
Глюкоза может восстанавливаться в шестиатомный спирт (сорбит). Окисление глюкозы в зависимости от метода окисления может приводить к трём продуктам: глюконовой кислоте (окисление альдегидной группы), глюкаровой кислоте (дополнительно окисляется первичная OH-группа) либо глюкуроновой кислоте (окисление только первичной OH-группы)[8].
Как восстанавливающий сахар, глюкоза проявляет восстановительные свойства. Это проявляется в реакциях с реактивом Толленса (аммиачным раствором оксида серебра), реактивом Бенедикта и реактивом Фелинга (реагенты на основе меди).
Глюкоза — основной продукт фотосинтеза, образуется в цикле Кальвина.
В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза является субстратом гликолиза, в ходе которого она может окислиться либо до пирувата в аэробных условиях, либо до лактата в случае анаэробных условий. Пируват, полученный таким образом в гликолизе, далее декарбоксилируется, превращаясь в ацетил-КоА (ацетилкоэнзим А). Также в ходе окислительного декарбоксилирования пирувата восстанавливается кофермент НАД+. Ацетил-КоА далее используется в цикле Кребса, а восстановленный кофермент используется в дыхательной цепи.
Глюкоза депонируется у животных в виде гликогена, у растений — в виде крахмала, полимер глюкозы — целлюлоза является основной составляющей клеточных оболочек всех высших растений. У животных глюкоза помогает пережить заморозки. Так, у некоторых видов лягушек перед зимой повышается уровень глюкозы в крови, за счёт чего их тела способны выдержать заморозку во льду.
Глюкозу используют при интоксикации (например, при пищевом отравлении и инфекциях), вводят внутривенно струйно и капельно, так как она является универсальным антитоксическим средством. Также препараты на основе глюкозы и сама глюкоза используются эндокринологами при определении наличия и типа сахарного диабета у человека (в виде стресс-теста на ввод повышенного количества глюкозы в организм).
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник. — 2-е издание. — Химия, 1978.
- ↑ Степаненко Б. Н., Городецкий В. К., Ковалев Г. В. Глюкоза // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1978. — Т. 6. Гипотериоз — Дегенерация. — 528 с. — 150 000 экз.
- ↑ 1 2 3 4 5 Ullmann, 2006, p. 45–48.
- ↑ Терней, 1981, с. 444–447.
- ↑ 1 2 Робертс Дж., Касерио М. Основы органической химии / Пер. с англ. Ю. Г. Бунделя, под ред. А. Н. Несмеянова. — М. : Мир, 1978. — С. 10–27.
- ↑ 1 2 3 Терней, 1981, с. 424–429.
- ↑ 1 2 3 Ullmann, 2006, p. 48.
- ↑ 1 2 3 4 5 Химическая энциклопедия, 1988.
- ↑ Ullmann, 2016, p. 49–51.
- ↑ 1 2 3 4 5 Ullmann, 2016, p. 51–56.
- ↑ Ullmann, 2016, p. 56.
- ↑ 1 2 3 4 Ullmann, 2016, p. 56–58.
| Общие: | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия | |||||||||||||||
| Моносахариды |
| ||||||||||||||
| Мультисахариды | |||||||||||||||
| Производные углеводов | |||||||||||||||
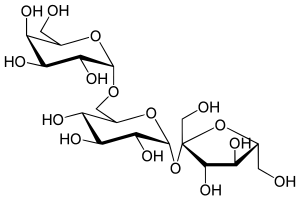
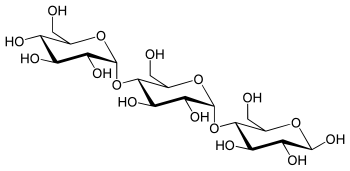
Трисахариды — Википедия
Материал из Википедии — свободной энциклопедии
Трисахари́ды (от tri: три, sacchar: сахар) — органические соединения, одна из групп углеводов; являются частным случаем олигосахаридов.
Молекулы трисахаридов состоят из трех остатков моносахаридов, соединённых друг с другом за счёт взаимодействия гидроксильных групп.
Молекулы трисахаридов состоят из трёх остатков моносахаридов, соединённых друг с другом за счёт взаимодействия гидроксильных групп. Общая формула трисахаридов, как правило, C18H36O18. Трисахариды могут отличаться одним от другого структурой входящих в них моносахаридов и их последовательностью в цепи, размером циклов (пятичленные фуранозные или шестичленные пиранозные), конфигурацией гликозидных центров и мест присоединения к агликонам гликозильных остатков. Это является причиной возникновения десятков тысяч возможных изомеров трисахаридов.[1]
Примеры трисахаридов
- Рафиноза — состоит из остатков D-галактозы, D-глюкозы и D-фруктозы.
- Мелицитоза — состоит из двух остатков D-глюкозы и одного остатка D-фруктозы.
- Трисахариды // Большая советская энциклопедия. — М.: Советская энциклопедия, 1969—1978.
- Xiaxi Liu. A Novel Procedure for Qualifying and Quantifying Carbohydrates: by Derivatization of Mono-, Di-, and Trisaccharides and Gas Chromatography. — LAP LAMBERT Academic Publishing, 2012. — 80 p. — ISBN 978-3847329725.
- ↑ Бочков, А. Ф. Углеводы / А. Ф. Бочков, В. А. Афанасьев, Г. Е. Заиков. – М. : Наука, 1980. – 176 с. – (Сер. «Наука и техн. прогресс»).
| Общие: | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Геометрия | |||||||||||||||
| Моносахариды |
| ||||||||||||||
| Мультисахариды | |||||||||||||||
| Производные углеводов | |||||||||||||||
Углеводный обмен — Википедия
Углеводный обмен, или метаболизм углеводов в организмах животных и человека. Метаболизм углеводов в организме человека состоит из следующих процессов:
- Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь.

- Синтез и распад гликогена в тканях
 (гликогенез и гликогенолиз), прежде всего в печени.
(гликогенез и гликогенолиз), прежде всего в печени. - Гликолиз — распад глюкозы.
 Первоначально под этим термином обозначали только анаэробное брожение, которое завершается образованием молочной кислоты (лактата) или этанола и углекислого газа. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозо-1,6-дифосфата и пирувата как в отсутствие, так и в присутствии кислорода. В последнем случае употребляется термин «аэробный гликолиз»,
Первоначально под этим термином обозначали только анаэробное брожение, которое завершается образованием молочной кислоты (лактата) или этанола и углекислого газа. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозо-1,6-дифосфата и пирувата как в отсутствие, так и в присутствии кислорода. В последнем случае употребляется термин «аэробный гликолиз», в отличие от «анаэробного гликолиза»,
в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
завершающегося образованием молочной кислоты или лактата. - Анаэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь (пентозный цикл).

- Взаимопревращение гексоз.
- Анаэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза — пирувата.
- Глюконеогенез — образование углеводов из неуглеводных продуктов
 (пирувата, лактата, глицерина, аминокислот, липидов, белков и т. д.).
(пирувата, лактата, глицерина, аминокислот, липидов, белков и т. д.).
Углеводы входят в состав живых организмов и вместе с белками, липидами и нуклеиновыми кислотами определяют специфичность их строения и функционирования. К углеводам относят соединения, обладающие разнообразными и зачастую сильно отличающимися функциями. Углеводы участвуют во многих метаболических процессах, но прежде всего они являются основными поставщиками энергии. На долю углеводов приходится примерно 75 % массы пищевого суточного рациона и более 50 % от суточного количества необходимых калорий. Однако неправильно сводить функцию углеводов только к энергетическому обеспечению процессов жизнедеятельности организма. Следует отметить и структурную роль углеводов. Так, в виде гликозаминогликанов углеводы входят в состав межклеточного матрикса. Большое число белков (ферменты, белки-транспортёры, белки-рецепторы, гормоны) — гликопротеины, углеводная составляющая которых повышает их специфичность. Например, различия в строении олигосахаридных фрагментов клеточной оболочки эритроцитов обеспечивают групповую принадлежность крови. Из углеводов в процессе метаболизма образуется большое число органических соединений, которые служат исходными субстратами для синтеза липидов, аминокислот, нуклеотидов. Производные углеводов — глюкурониды — участвуют в детоксикации ксенобиотиков и инактивации веществ эндогенного происхождения[1]. Углеводы могут быть синтезированы в организме с использованием других метаболитов: некоторых аминокислот, глицерина, молочной кислоты. Углеводы нельзя считать незаменимыми компонентами пищи. Однако если исключить углеводы из диеты, то следствием может быть гипогликемия, для компенсации которой будут расходоваться белки и липиды. Таким образом, углеводы — обязательные пищевые компоненты, потому что помимо их основной энергетической функции (клеточные «дрова») углеводы участвуют во многих метаболических клеточных процессах[2].
- Углеводы, потребляемые с пищей
-

Лактоза или молочный сахар, впервые была обнаружена в коровьем молоке, откуда и получила своё название.
-

Мальтоза или солодовый сахар, входит в состав семян зерновых культур (ячменя, ржи, пшеницы итд.).
-

Сахароза — один из самых потребляемых углеводов в мире.
Переваривание и всасывание углеводов[править | править код]
Пищеварение углеводов можно разделить на несколько этапов:
- Пищеварение, происходящее в полости рта
- Пищеварение в желудке
- Пищеварение и всасывание в тонком кишечнике.
Эпителиальные клетки кишечника способны всасывать только моносахариды. Поэтому процесс переваривания заключается в ферментативном гидролизе гликозидных связей в углеводах, имеющее олиго- или полисахаридное строение.
Переваривание углеводов в полости рта[править | править код]
В полости рта начинается расщепление крахмала (и гликогена) под действием фермента слюны — амилазы. Известны 3 вида амилаз, которые различаются главным образом по конечным продуктам их ферментативного действия:
- α-амилаза
- β-амилаза
- γ-амилаза
α-Амилаза (КФ 3.2.1.1) расщепляет в полисахаридах внутренние α-1,4-связи, поэтому её иногда называют эндоамилазой. Молекула α-амилазы содержит в своих активных центрах ионы Ca2+ необходимые для ферментативной активности. Кроме того, характерной особенностью α-амилазы животного происхождения является способность активироваться одновалентными анионами. Прежде всего Сl—.
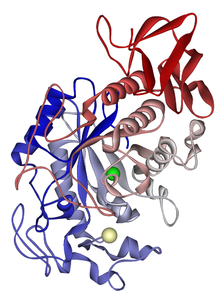 Структура α-амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.
Структура α-амилазы слюнных желез. Катион кальция показан жёлтым цветом, анион хлора — зелёным.Слюнная α-амилаза представляет собой смесь близких электрофоретически разделяемых изоферментов. Каждый из них — одноцепочечный полипептид (мол. масса 56000 Да), к которому присоединен олигосахарид. Структура этого олигосахарида, а также число его молекул на одну молекулу белка и способ прикрепления к белку неизвестны. Удивительно, что не существует соответствующих ферментов в слюне некоторых приматов, например у бабуинов или резусов.
В ротовой полости не может происходить полное расщепление крахмала, так как действие фермента на крахмал кратковременно. Кроме того, амилаза слюны не расщепляет α- 1,6-гликозидные связи (связи в местах разветвлений), поэтому крахмал переваривается лишь частично с образованием крупных фрагментов — декстринов и небольшого количества мальтозы. Следует отметить, что амилаза слюны не гидролизует гликозидные связи в дисахаридах.
Под действием β-амилазы от крахмала отщепляется дисахарид мальтоза, то есть β-амилаза является экзоамилазой. Она обнаружена у высших растений где играет важную роль в мобилизации резервного (запасного) крахмала.
γ-Амилаза отщепляет один за другим глюкозные остатки от конца полигликозидной цепочки. Различают 2 вида γ-амилаз: кислые и нейтральные, в зависимости от того в какой области pH они проявляют максимальную активность. В органах и тканях человека и млекопитающих кислая γ-амилаза локализована в лизосомах, а нейтральная — в микросомах и гиалоплазме. Амилаза слюны является α-амилазой. Под влиянием этого фермента происходят первые фазы распада крахмала (или гликогена) с образованием декстринов (в небольшом количестве образуется и мальтоза). Затем пища смешанная со слюной попадает в желудок.
Желудочный сок не содержит ферментов расщепляющие сложные углеводы (например целлюлозу). В желудке действие α-амилазы слюны прекращается так как желудочное содержимое имеет очень кислую среду (pH 1,5 — 2,5). Однако в более глубоких слоях пищевого комка, куда не сразу проникает желудочный сок, действие амилазы некоторое время продолжается и происходит расщепление полисахаридов с образованием декстринов и мальтозы. Наиболее важная фаза распада крахмала (или гликогена) протекает в двенадцатиперстной кишке под действием α-амилазы поджелудочного сока. Здесь pH возрастает до нейтральных значений, при этих условиях α-амилаза панкреатического сока обладает почти максимальной активностью. Этот фермент завершает превращение крахмала и гликогена в мальтозу, начатое амилазой слюны.
Переваривание углеводов в кишечнике[править | править код]
Расщепление крахмала и гликогена до мальтозы в кишечнике происходит под действием 3-х ферментов:
- панкреатической α-амилазы
- амило-1,6-глюкозидазы
- олиго-1,6-глюкозидазы
Образующаяся мальтоза оказывается только временным продуктом, так как она быстро гидролизуется под влиянием фермента мальтазы (α-глюкозидазы) на 2 молекулы глюкозы. Кишечный сок также содержит активную сахаразу, под действием которой образуются глюкоза и фруктоза.
Панкреатическая α-амилаза[править | править код]
В двенадцатиперстной кишке рН среды желудочного содержимого нейтрализуется, так как секрет поджелудочной железы имеет рН 7,5-8,0 и содержит гидрокарбонаты (НСО3—). С секретом поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент гидролизует α-1,4-гликозидные связи в крахмале и декстринах.
Продукты переваривания крахмала на этом этапе — дисахарид мальтоза, содержащая 2 остатка глюкозы, связанные α-1,4-связью. Из тех остатков глюкозы, которые в молекуле крахмала находятся в местах разветвления и соединены α-1,6-гликозидной связью, образуется дисахарид изомальтоза. Кроме того, образуются олигосахариды, содержащие 3-8 остатков глюкозы, связанные α-1,4- и α-1,6-связями
α-Амилаза поджелудочной железы, так же, как α-амилаза слюны, действует как эндогликозидаза. Панкреатическая α-амилаза не расщепляет α-1,6-гликозидные связи в крахмале. Этот фермент также не гидролизует β-1,4-гликозидные связи, которыми соединены остатки глюкозы в молекуле целлюлозы. Целлюлоза, таким образом, проходит через кишечник неизменённой. Тем не менее непереваренная целлюлоза выполняет важную функцию балластного вещества, придавая пище дополнительный объём и положительно влияя на процесс переваривания. Кроме того, в толстом кишечнике целлюлоза может подвергаться действию бактериальных ферментов и частично расщепляться с образованием спиртов, органических кислот и СО2. Продукты бактериального расщепления целлюлозы важны как стимуляторы перистальтики кишечника.
Мальтоза, изомальтоза и триозосахариды, образующиеся в верхних отделах кишечника из крахмала, — промежуточные продукты. Дальнейшее их переваривание происходит под действием специфических ферментов в тонком кишечнике. Дисахариды пищи сахароза и лактоза также гидролизуются специфическими дисахаридазами в тонком кишечнике.
Особенность переваривания углеводов в тонком кишечнике заключается в том, что активность специфических олиго- и дисахаридаз в просвете кишечника низкая. Но ферменты активно действуют на поверхности эпителиальных клеток кишечника.
Тонкий кишечник изнутри имеет форму пальцеобразных выростов — ворсинок, покрытых эпителиальными клетками. Эпителиальные клетки, в свою очередь, покрыты микроворсинками, обращёнными в просвет кишечника. Эти клетки вместе с ворсинками образуют щёточную каёмку, благодаря которой увеличивается поверхность контакта гидролитических ферментов и их субстратов в содержимом кишечника. На 1 мм2 поверхности тонкой кишки у человека приходится 80-140 млн ворсинок.
Ферменты, расщепляющие гликозидные связи в дисахаридах (дисахаридазы), образуют ферментативные комплексы, локализованные на наружной поверхности цитоплазматической мембраны энтероцитов.
Сахаразо-изомальтазный комплекс[править | править код]
Этот ферментативный комплекс состоит из двух полипептидных цепей и имеет доменное строение. Сахаразо-изомальтазный комплекс прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного (трансмембранного) домена, образованного N-концевой частью полипептида. Каталитический центр выступает в просвет кишечника. Связь этого пищеварительного фермента с мембраной способствует эффективному поглощению продуктов гидролиза клеткой.
Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу, расщепляя α-1,2- и α-1,6-гликозидные связи. Кроме того, оба ферментных домена имеют мальтазную и мальтотриазную активности, гидролизуя α-1,4-гликозидные связи в мальтозе и мальтотриозе (трисахарид, образующийся из крахмала). На долю сахаразо-изомальтазного комплекса приходится 80 % от всей мальтазной активности кишечника. Но несмотря на присущую ему высокую мальтазную активность, этот ферментативный комплекс назван в соответствии с основной специфичностью. К тому же сахаразная субъединица — единственный фермент в кишечнике, гидролизующий сахарозу. Изомальтазная субъединица с большей скоростью гидролизует гликозидные связи в изомальтозе, чем в мальтозе и мальтотриозе.
В тощей кишке содержание сахаразо-изомальтазного ферментативного комплекса достаточно высокое, но оно снижается в проксимальной и дистальной частях кишечника.
Гликоамилазный комплекс[править | править код]
Этот ферментативный комплекс катализирует гидролиз α-1,4-связи между глюкозными остатками в олигосахаридах, действуя с восстанавливающего конца. По механизму действия этот фермент относят к экзогликозидазам. Комплекс расщепляет также связи в мальтозе, действуя как мальтаза. В гликоамилазный комплекс входят две разные каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гликоамилазная активность комплекса наибольшая в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза)[править | править код]
Лактаза расщепляет β-1,4-гликозидные связи между глюкозой и галактозой в лактозе.
Этот ферментативный комплекс по химическому составу является гликопротеином. Лактаза, как и другие гликозидазные комплексы, связана с щёточной каёмкой и распределена неравномерно по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста. Так, активность лактазы у плода особенно повышена в более поздние сроки беременности и сохраняется на высоком уровне до 5-7 летнего возраста. Затем активность фермента снижается, составляя у взрослых 10 % от уровня активности, характерного для детей.
Трегалаза[править | править код]
Трегалаза (КФ 3.2.1.28) — также гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе — дисахариде, содержащемся в грибах.
Совместное действие всех перечисленных ферментов завершает переваривание пищевых олиго- и полисахаридов с образованием моносахаридов, основной из которых — глюкоза. Кроме глюкозы, из углеводов пищи также образуются фруктоза и галактоза, в меньшем количестве — манноза, ксилоза, арабиноза.
Всасывание моносахаридов в кишечнике[править | править код]
Моносахариды образовавшиеся в результате переваривания, всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны клеток.
Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться разными способами: путём облегчённой диффузии и активного транспорта. В случае активного транспорта глюкоза и Na+ проходят через мембраны с люминальной стороны, связываясь с разными участками белка-переносчика. При этом Na+ поступает в клетку по градиенту концентрации, и одновременно глюкоза транспортируется против градиента концентрации (вторично-активный транспорт). Следовательно, чем больше градиент Na+, тем больше поступление глюкозы в энтероциты. Если концентрация Na+ во внеклеточной жидкости уменьшается, транспорт глюкозы снижается. Градиент концентрации Na+, являющийся движущей силой активного сим-порта, создаётся работой Nа+, К+-АТФ-азы. Перенос в клетки слизистой оболочки кишечника по механизму вторично-активного транспорта характерен также для галактозы.
При разной концентрации глюкозы в просвете кишечника «работают» различные механизмы транспорта. Благодаря активному транспорту эпителиальные клетки кишечника могут поглощать глюкозу при её очень низкой концентрации в просвете кишечника. Если же концентрация глюкозы в просвете кишечника велика, то она может транспортироваться в клетку путём облегчённой диффузии. Таким же способом может всасываться и фруктоза. Следует отметить, что скорость всасывания глюкозы и галактозы гораздо выше, чем других моносахаридов.
После всасывания моносахариды (главным образом, глюкоза) покидают клетки слизистой оболочки кишечника через мембрану, обращённую к кровеносному капилляру, с помощью облегчённой диффузии. Часть глюкозы (более половины) через капилляры кишечных ворсинок попадает в кровеносную систему и по воротной вене доставляется в печень. Остальное количество глюкозы поступает в клетки других тканей.
Транспорт глюкозы из крови в клетки[править | править код]
Потребление глюкозы клетками из кровотока происходит также путём облегчённой диффузии. Следовательно, скорость трансмембранного потока глюкозы зависит только от градиента её концентрации. Исключение составляют клетки мышц и жировой ткани, где облегчённая диффузия регулируется инсулином (гормон поджелудочной железы). В отсутствие инсулина плазматическая мембрана этих клеток непроницаема для глюкозы, так как она не содержит белки-переносчики (транспортёры) глюкозы. Транспортёры глюкозы называют также рецепторами глюкозы. Например, описан транспортёр глюкозы, выделенный из эритроцитов. Это трансмембранный белок, полипептидная цепь которого построена из 492 аминокислотных остатков и имеет доменную структуру. Полярные домены белка расположены по разные стороны мембраны, гидрофобные располагаются в мембране, пересекая её несколько раз. Транспортёр имеет участок связывания глюкозы на внешней стороне мембраны. После присоединения глюкозы конформация белка изменяется, в результате чего глюкоза оказывается связанной с белком в участке, обращённом внутрь клетки. Затем глюкоза отделяется от транспортёра, переходя внутрь клетки. Считают, что способ облегчённой диффузии по сравнению с активным транспортом предотвращает транспорт ионов вместе с глюкозой, если она транспортируется по градиенту концентрации.
Глюкозные транспортёры[править | править код]
Глюкозные транспортёры или ГЛЮТ представляют собой несколько семейств мембранных белков, обнаруженных во всех тканях организма млекопитающих. На данный момент существуют несколько десятков разновидностей ГЛЮТ, они пронумерованы в соответствии с порядком их обнаружения[3].
Структура белков семейства ГЛЮТ отличается от белков, транспортирующих глюкозу через мембрану в кишечнике и почках против градиента концентрации. Описанные 4 типа ГЛЮТ имеют сходные первичную структуру и доменную организацию (все 4 типа относятся к I классу переносчиков глюкозы). ГЛЮТ-5 имеет несколько иную структуру и относится ко II классу переносчиков глюкозы.
Распределение белков-транспортёров глюкозы (ГЛЮТ)
| Типы ГЛЮТ | Локализация в органах |
|---|---|
| ГЛЮТ-1 | Преимущественно в мозге, плаценте, почках, толстом кишечнике. |
| ГЛЮТ-2 | Преимущественно в печени, почках, β-клетках островков Лангерганса, эритроцитах. |
| ГЛЮТ-3 | Во многих тканях, включая мозг, плаценту, почки. |
| ГЛЮТ-4(инсулинзависимый) | В мышцах (скелетных и сердечной), жировой ткани. Содержится в отсутствии инсулина почти полностью в цитоплазме. |
| ГЛЮТ-5 | В апикальном отделе энтероцитов тонкого кишечника. Является переносчиком фруктозы[4]. |
Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. ГЛЮТ-4 (и в меньшей мере ГЛЮТ-1) почти полностью находятся в цитоплазме клеток. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортёров в мембрану. После чего возможен облегчённый транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови транспортёры глюкозы снова перемещаются в цитоплазму, и поступление глюкозы в клетку прекращается.
Перемещение глюкозы из первичной мочи в клетки почечных канальцев происходит вторично-активным транспортом, подобно тому, как это осуществляется при всасывании глюкозы из просвета кишечника в энтероциты. Благодаря этому глюкоза может поступать в клетки даже в том случае, если её концентрация в первичной моче меньше, чем в клетках. При этом глюкоза реабсорбируется из первичной мочи почти полностью (99 %).
Известны различные нарушения в работе транспортёров глюкозы. Наследственный дефект этих белков может лежать в основе инсулинонезависимого сахарного диабета В то же время причиной нарушения работы транспортёра глюкозы может быть не только дефект самого белка. Нарушения функции ГЛЮТ-4 возможны на следующих этапах:
- передача сигнала инсулина о перемещении этого транспортёра к мембране;
- перемещение транспортёра в цитоплазме;
- включение в состав мембраны;
- отшнуровывание от мембраны и т. д.
Нарушения переваривания и всасывания углеводов[править | править код]
В основе патологии переваривания и всасывания углеводов могут быть причины двух типов:
- дефекты ферментов, участвующих в гидролизе углеводов в кишечнике;
- нарушение всасывания продуктов переваривания углеводов в клетки слизистой оболочки кишечника.
В обоих случаях возникает осмотическая диарея, которую вызывают нерасщеплённые дисахариды или невсосавшиеся моносахариды. Эти невостребованные углеводы поступают в дистальные отделы кишечника, изменяя осмотическое давление содержимого кишечника. Кроме того, оставшиеся в просвете кишечника углеводы частично подвергаются ферментативному расщеплению микроорганизмами с образованием органических кислот и газов. Всё вместе приводит к притоку воды в кишечник, увеличению объёма кишечного содержимого, усилению перистальтики, спазмам и болям, а также метеоризму.
Термином «мальабсорбция» называют недостаточное всасывание переваренных продуктов углеводов. Но поскольку клинические проявления при недостаточном переваривании и всасывании сходны, то термином «мальабсорбция» называют оба вида нарушений.
Нарушение переваривания углеводов в кишечнике[править | править код]
Нарушения переваривания могут быть связаны как с недостаточной активностью отдельных дисахаридаз, так и с недостаточностью всего ферментативного комплекса, например сахаразо-изомальтазного.
Известны наследственные и приобретённые формы недостаточности активности ферментов. Симптомы врождённых форм проявляются достаточно рано, например после первых кормлений грудным молоком (при дефиците лактазы), после перехода на искусственное вскармливание или при добавлении в рацион сахара и крахмала (при дефиците ос-амилазы или специфических дисахаридаз). В случае недостаточного лечения врождённые формы патологии сопровождаются хроническим дисбактериозом и нарушениями физического развития ребёнка.
Приобретённые формы патологии могут наблюдаться при кишечных заболеваниях, например гастритах, колитах, энтеритах. Следует заметить, что в этих случаях особенно заметно снижение активности лактазы. Как уже говорилось, активность лактазы в кишечнике ниже, чем других дисахаридаз, поэтому уменьшение её активности становится заметным для организма в первую очередь.
Дефицит лактазы у взрослых людей может иметь и другую причину. Возможно снижение экспрессии гена лактазы возрастного характера. Уже упоминалось, что активность лактазы у взрослых людей в норме значительно ниже, чем у детей. Поэтому снижение активности лактазы относительно уже имеющегося низкого уровня у отдельных людей может проявляться непереносимостью молока. Носителями патологии, связанной с дефицитом лактазы, являются чаще всего лица африканского и азиатского происхождения. Средняя частота данной формы патологии в странах Европы составляет 7-12 %, в Китае — 80 %, в отдельных районах Африки — до 97 %. Подобные наблюдения распространения лактазной недостаточности связывают с исторически сложившимся рационом питания и отсутствием молочного скотоводства в упомянутых регионах. Примеры и причины нарушения переваривания дисахаридов перечислены в таблице.
Существуют редкие формы нарушения переваривания углеводов. Например, известна наследственная недостаточность трегалазы, которая проявляется диспепсией после употребления грибов, содержащих трегалозу.
В отдельных случаях мальабсорбция может быть вызвана несколькими причинами. Например, после операции на желудке возможны ухудшение смешивания пищи с пищеварительными соками, снижение их секреции, ускорение прохождения пищи через кишечник, колонизация бактериями слепой и приводящей петель.
Нарушения всасывания моносахаридов[править | править код]
Для диагностики различных нарушений переваривания используют пробы с нагрузкой определёнными углеводами. Нарушения всасывания могут быть следствием дефекта какого-либо компонента (белка или фермента), участвующего в системе транспорта моносахаридов через мембрану. Описаны патологии, связанные с дефектом натрийзависимого белка переносчика глюкозы. Недостаточность кишечных дисахаридаз можно диагностировать с помощью введения дисахарида и последующего определения концентрации глюкозы в крови. Для большей чувствительности этот тест проводят, вводя сначала дисахарид (50 г), а затем эквивалентное количество составляющих его моносахаридов (по 25 г каждого). После нагрузки концентрация глюкозы в крови увеличивается примерно на 50 % относительно нормы. При патологии отмечают незначительную гипергликемию.
Нарушения переваревания дисахаридов
| Причина заболевания | Клинические проявления и лабораторные данные |
|---|---|
| Наследственный дефицит лактазы | Встречается относительно редко. После приёма молока наблюдаются рвота, диарея, спазмы и боли в животе, метеоризм. Симптомы развиваются сразу после рождения. |
| Недостаточность лактазы вследствие снижения экспрессии гена фермента в онтогенезе | Характерна для взрослых и детей старшего возраста. Является следствием возрастного снижения количества лактазы. Симптомы непереносимости молока аналогичны наследственной форме дефицита лактозы. |
| Недостаточность лактазы вторичного характера | Это временная, приобретённая форма. Непереносимость молока может быть следствием кишечных заболеваний, например, колитов, гастритов. Кроме того, временный дефицит лактазы может быть следствием операций на ЖКТ. |
| Наследственная недостаточность сахаразо-изомальтазного комплекса | Проявляется, когда в рацион детей добавляют сахарозу и крахмал. Больные дети обычно неохотно едят сладкое. После нагрузки сахарозой отмечается незначительная гипергликемия. Другие сахара (глюкоза, фруктоза, лактоза) переносятся хорошо. |
| Приобретённая недостаточность сахаразо-изомальтазного комплекса | Может возникать вследствие кишечных заболеваний. Проявляется диспепсией, провоцируемой крупами, крахмалом, а также пивом и другими напитками на основе солода. |
Если тест при нагрузке моносахаридом сопровождается адекватным повышением его концентрации в крови, а нагрузка дисахаридом не даёт нормальной реакции, то это, скорее всего, указывает на дефект кишечной дисахаридазы, а не системы транспорта.
О недостаточности лактазы можно судить, определяя водород в выдыхаемом воздухе (водородный тест). Водород образуется в результате действия бактериальных ферментов на лактозу.
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для её использования тканями по мере необходимости.
Гликоген — одна из самых главных форм запасания углеводов у грибов, животных и человека.
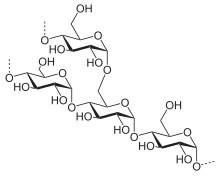
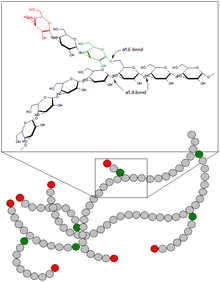 Структура гликогена
Структура гликогенаГликоген — разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы. Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец.
При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза.
После приёма пищи, богатой углеводами, запас гликогена в печени может составлять примерно 4 %-5 % от её массы. В мышцах запасается около 1 % гликогена, однако масса мышечной ткани значительно больше и поэтому общее количество гликогена в мышцах в 2 раза больше, чем в печени. Гликоген может синтезироваться во многих клетках, например в нейронах, макрофагах, клетках жировой ткани, но содержание его в этих тканях незначительно. В организме может содержаться до 450 г гликогена.
Запасы углеводов в организме нормального человека (массой 70 кг) после приёма пищи. В таблице приведены средние показатели.
| Углевод | Процентное содержание и масса |
|---|---|
| Гликоген печени | 4 % = 72 г |
| Мышечный гликоген | 0,7 % = 245 г |
| Внеклеточная глюкоза | 0,1 % = 10 г |
| Итого | 327 г |
Следует подчеркнуть, что синтез и распад гликогена в клетке осуществляется разными метаболическими путями. В частности считалось, что гликогенфосфорилаза (фосфорилаза а) катализирует как распад, так и синтез гликогена потому что в опытах in vitro, было доказано что гликогенфосфорилазная реакция обратима. Однако в дальнейшем было установлено, что в клетке (in vivo) фосфорилаза а катализирует только распад гликогена, синтез гликогена осуществляется совершенно другим ферментом. Оба эти процесса (синтез и распад) регулируют содержание глюкозы в крови и создают резерв глюкозы для интенсивной мышечной работы.
Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы — источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки.
Гликогеногенез[править | править код]
Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтез гликогена из глюкозы, как и любой анаболический процесс, является эндергоническим, то есть требующим затрат энергии.
Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ. Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1-фосфат под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования УДФ-глюкозы из УТФ и глюкозо-1-фосфата. Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата.
Реакция образования УДФ-глюкозы обусловливает необратимость всей серии реакций, протекающих при синтезе гликогена. Этим же объясняется невозможность протекания распада гликогена путём простого обращения процесса его синтеза.
Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена. Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называют синтазой, а не синтетазой. Нуклеотидная часть УДФ-глюкозы играет существенную роль в действии гликоген синтазы, выполняя функцию «рукоятки», при помощи которой фермент располагает глюкозу в полисахаридной цепи в нужном положении. Кроме того, нуклеотидная часть УДФ-глюкозы, по-видимому, необходима для узнавания субстрата при катализе.
Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой «затравка», или «праймер». К «затравке» последовательно присоединяются молекулы глюкозы. Строением молекулы «затравки» как бы предопределяется тип связи, который возникает в реакции трансгликозилирования. Таким образом, синтезируется полисахарид, аналогичный по строению с «затравочным». В состав «затравки» может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена.
Разветвлённая структура гликогена образуется при участии амило-1,4 → 1,6-глюкозилтрансферазы, называемой ферментом «ветвления» (от англ. branching enzyme). Как только гликогенсинтаза удлиняет линейный участок примерно до 11 глюкозных остатков, фермент ветвления переносит её концевой блок, содержащий 6-7 остатков, на внутренний остаток глюкозы этой или другой цепи. В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С6 положении с