Скорость химических реакций и факторы от которых она зависит
В жизни мы сталкиваемся с разными химическими реакциями. Одни из них, как ржавление железа, могут идти несколько лет. Другие, например, сбраживание сахара в спирт, — несколько недель. Дрова в печи сгорают за пару часов, а бензин в моторе — за долю секунды.
Чтобы уменьшить затраты на оборудование, на химических заводах повышают скорость реакций. А некоторые процессы, например, порчу пищевых продуктов, коррозию металлов, — нужно замедлить.
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) — сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt. Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т. е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени:
n
υ = –––––––––– = –––––––– = Δс/Δt (1)
(t2 − t1) • v Δt • v
где c = n / v — концентрация вещества,
Δ (читается «дельта») — общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль серни́стого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO2 + O2 = 2SO3
Скорость по кислороду будет: υ = 1 : (10 • 1) = 0,1 моль/л·с
Скорость по серни́стому газу: υ = 2 : (10 • 1) = 0,2 моль/л·с — это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt • S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
- твердое вещество с другим твердым, жидкостью или газом,
- две несмешивающиеся жидкости,
- жидкость с газом.
Гомогенные реакции протекают между веществами в одной фазе:
- между хорошо смешивающимися жидкостями,
- газами,
- веществами в растворах.
Условия, влияющие на скорость химических реакций
1) Скорость реакции зависит от природы реагирующих веществ. Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры. Например, для горения топлива необходимо его поджечь, т. е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1)! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Катализаторы — вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример — бурное разложение перекиси водорода при добавлении катализатора — оксида марганца (IV):
2H2O2 = 2H2O + O2↑
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы — вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров:
| Условия | Примеры |
| Природа реагирующих веществ | Многие вещества хранятся годами, а перекись водорода разлагается: 2Н2О2 = 2Н2О + О2↑ |
| Их концентрация | Чистая перекись водорода разлагается со взрывом, а в растворе — за несколько месяцев |
| Температура | В прохладном месте раствор Н2О2 сохраняется довольно долго |
| Присутствие катализаторов и ингибиторов | Раствор Н2О2, поступающий в продажу, содержит ингибиторы, чтобы лучше хранился. Но если к нему добавить щепотку MnO |
автор: Владимир Соколов
staminaon.com
Вопрос№25. Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
Обычно концентрацию выражают в моль/л, а время – в секундах или минутах. Если, например, исходная концентрация одного из реагирующих веществ составляла 1 моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость реакции будет равна (1-0,6)/4=0,1 моль/(л*с).
Средняя скорость реакции вычисляется по формуле:
Скорость химической реакции зависит от:
Вещества с полярной связью в растворах взаимодействуют быстрей, это объясняется тем, что такие вещества в растворах образуются ионы, которые легко взаимодействуют друг с другом.
Вещества с неполярной и малополярной ковалентной связью реагируют с различной скоростью, это зависит от их химической активности.
Пример:
H2 + F2 = 2HF (идёт очень быстро со взрывом при комнатной температуре)
H2 + Br2 = 2HBr (идет медленно, даже при нагревании)
Величины поверхностного соприкосновения реагирующих веществ (для гетерогенных)
Концентрации реагирующих веществ
Скорость реакции прямопропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
при повышении температуры на каждые 100 скорость большинства реакций увеличивается в 2-4 раза.
Катализаторами называются вещества, изменяющие скорость химической реакций.
Явление изменения скорости реакции в присутствии катализатора называется катализом.
При увеличение давления скорость реакции повышается (для гомогенных)
Вопрос№26. Закон действия масс. Константа скорости. Энергия активации.
Закон действия масс.
скорость, с которой вещества реагируют друг с другом, зависит от их концентрации
Константа скорости.
коэффициент пропорциональности в кинетическом уравнении химической реакции, выражающий зависимость скорости реакции от концентрации
Константа скорости зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Энергия активации.
энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные
Энергия активации зависит от природы реагирующих веществ и изменяется в присутствии катализатора.
Повышение концентрации увеличивается общее число молекул, а соответственно активных частиц.
Вопрос№27. Обратимые и необратимые реакции. Химическое равновесие, константа равновесия. Принцип Ле Шателье.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частью ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака их водорода и азота:
3H2 + N2 = 2NH3
Необратимыми называются такие реакции, при протекании которых:
Образующиеся продукты выпадают в осадок, или выделяются в виде газа, например:
BaCl2 + H2SO4 = BaSO4 + 2HCl
Na2CO3 + 2HCl = 2NaCl + CO2
Образование воды:
HCl + NaOH = H2O + NaCl
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия.
Химическое равновесие – это состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны между собой.
На состояние химического равновесия оказывает влияние концентрации реагирующих веществ, температура, а для газов – и давление. При изменении одного из этих параметров, химическое равновесия нарушается.
Константа равновесия.
Важнейший параметр, характеризующий обратимую химическую реакцию – константа равновесия К. Если записать для рассмотренной обратимой реакции A + D C + D условие равенства скоростей прямой и обратной реакции в состоянии равновесия – k1[A]равн[B]равн = k2[C]равн[D]равн, откуда [C]равн[D]равн/[A]равн[B]равн = k1/k2 = К, то величина К называется константой равновесия химической реакции.
Итак, при равновесии отношение концентрации продуктов реакции к произведению концентрации реагентов постоянно, если постоянна температура (константы скорости k1 и k2 и, следовательно, константа равновесия К зависят от температуры, но не зависят от концентрации реагентов). Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так для реакции 3h3 + N2 2Nh4 выражение для константы равновесия записывается в виде K = [Nh4]2 равн/[h3]3равн[N2]равн. Описанный способ вывода константы равновесия, основанный на скоростях прямой и обратной реакций, в общем случае использовать нельзя, так как для сложных реакций зависимость скорости от концентрации обычно не выражается простым уравнением или вообще неизвестна. Тем не менее, в термодинамике доказывается, что конечная формула для константы равновесия оказывается верной.
Для газообразных соединений вместо концентраций при записи константы равновесия можно использовать давление; очевидно, численное значение константы при этом может измениться, если число газообразных молекул в правой и левой частях уравнения не одинаковы.
Пинцип Ле Шателье.
если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие , то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На химическое равновесие влияет:
Изменение температуры. При повышении температуры равновесие смещается в сторону эндотермической реакции. При понижении температуры равновесие смещается в сторону экзотермической реакции.
Изменение давления. При повышении давления равновесие смещается в сторону уменьшения числа молекул. При понижении давления равновесие смещается в сторону увеличения числа молекул.
studfile.net
Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:

Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:

Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:

Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
A + B → C + D
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:

где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Вспомним про энергию активации Ea . Молекулы с энергией меньшей, чем энергия активации в отсутствие катализатора друг с другом взаимодействовать не могут. Катализаторы, изменяют путь, по которому протекает реакция подобно тому, как опытный проводник проложит маршрут экспедиции не напрямую через гору, а с помощью обходных троп, в результате чего даже те спутники, которые не имели достаточно энергии для восхождения на гору, смогут перебраться на другую ее сторону.
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
2Al + 6HCl → 2AlCl3 + 3H2↑
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит меду твердым веществом и жидкостью или газом перемешивание может ее ускорить.
scienceforyou.ru
8. Химическая кинетика. Скорость химической реакции и факторы, от которых она зависит.
Учение о скорости, механизме химических реакций и их зависимости от разных факторов (концентрации, температуры, катализатора и т. д.) называется химической кинетикой.
Скорость химической реакции определяется изменением концентрации реагирующего вещества в единицу времени в единице объема.
Различают истинную (vист) и среднюю (vср) скорость реакции:
 ,
,
где vист истинная скорость реакции; dc бесконечно малое изменение концентрации за бесконечно малый промежуток времени dt при постоянном объеме. Знак минус справа ставится при определении скорости реакции по одному из исходных веществ.
Средняя скорость реакции характеризует изменение концентрации за определенный промежуток времени
 .
.
Скорость химической реакции зависит от следующих факторов:
природы реакции;
концентрации;
температуры;
природы растворителя;
присутствия катализатора.
9.Влияние концентрации на скорость реакции. Закон действующих масс основной закон химической кинетики. Молекулярность и порядок реакции. Константы скорости I и II порядка. Период полураспада. Методы определения порядка реакции.
Основным законом химической кинетики является закон действующих масс:
Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени.

где k – константа скорости реакции.
Физический смысл k легко установить, приняв CA = CB = 1 моль/л. Тогда v = k, т. е. константа скорости равна скорости реакции при концентрации реагирующих веществ равных единице.
Химические реакции классифицируют по молекулярности и порядку. Молекулярностью реакции называется число частиц, принимающих участие в одном элементарном акте химического превращения.
Реакции бывают мономолекулярными, бимолекулярными, реже тримолекулярными.
Порядок реакции n равен сумме показателей степеней концентраций всех реагентов, которые входят в кинетическое уравнение для скорости реакции.
Показатель степени, в которой концентрация вещества входит в кинетическое уравнение, называется порядком реакции по данному веществу. Для элементарной реакции a и b являются частными порядками по веществу A и B. Порядок реакции совпадает с молекулярностью, если она протекает за один элементарный акт.
Порядок реакции может быть положительным, целым, дробным и нулевым. В зависимости от этого выражение для константы скорости будет различным.
Каждый тип реакции описывается определенным кинетическим уравнением, связывающим концентрации со временем.
Время, за которое исходная концентрация вещества уменьшается наполовину, называется периодом полураспада (τ).
Табл.1 Кинетические уравнения, выражения константы скорости и периода полураспада для реакций различных порядков
Порядок реакции |
| Константа скорости k, размерность | Период полураспада, τ |
0 |
|
|
|
1 |
|
|
|
2 |
|
|
|
С0 – исходная концентрация реагента; С – концентрация реагента в момент времени t.
studfile.net
Вопрос№25. Скорость химических реакций. Факторы, влияющие на скорость химической реакции.
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объеме системы.
Обычно концентрацию выражают в моль/л, а время – в секундах или минутах. Если, например, исходная концентрация одного из реагирующих веществ составляла 1 моль/л, а через 4 с от начала реакции она стала 0,6 моль/л, то средняя скорость реакции будет равна (1-0,6)/4=0,1 моль/(л*с).
Средняя скорость реакции вычисляется по формуле:
Скорость химической реакции зависит от:
Вещества с полярной связью в растворах взаимодействуют быстрей, это объясняется тем, что такие вещества в растворах образуются ионы, которые легко взаимодействуют друг с другом.
Вещества с неполярной и малополярной ковалентной связью реагируют с различной скоростью, это зависит от их химической активности.
Пример:
H2 + F2 = 2HF (идёт очень быстро со взрывом при комнатной температуре)
H2 + Br2 = 2HBr (идет медленно, даже при нагревании)
Величины поверхностного соприкосновения реагирующих веществ (для гетерогенных)
Концентрации реагирующих веществ
Скорость реакции прямопропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
при повышении температуры на каждые 100 скорость большинства реакций увеличивается в 2-4 раза.
Катализаторами называются вещества, изменяющие скорость химической реакций.
Явление изменения скорости реакции в присутствии катализатора называется катализом.
При увеличение давления скорость реакции повышается (для гомогенных)
Вопрос№26. Закон действия масс. Константа скорости. Энергия активации.
Закон действия масс.
скорость, с которой вещества реагируют друг с другом, зависит от их концентрации
Константа скорости.
коэффициент пропорциональности в кинетическом уравнении химической реакции, выражающий зависимость скорости реакции от концентрации
Константа скорости зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Энергия активации.
энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные
Энергия активации зависит от природы реагирующих веществ и изменяется в присутствии катализатора.
Повышение концентрации увеличивается общее число молекул, а соответственно активных частиц.
Вопрос№27. Обратимые и необратимые реакции. Химическое равновесие, константа равновесия. Принцип Ле Шателье.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частью ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака их водорода и азота:
3H2 + N2 = 2NH3
Необратимыми называются такие реакции, при протекании которых:
Образующиеся продукты выпадают в осадок, или выделяются в виде газа, например:
BaCl2 + H2SO4 = BaSO4 + 2HCl
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Образование воды:
HCl + NaOH = H2O + NaCl
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия.
Химическое равновесие – это состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны между собой.
На состояние химического равновесия оказывает влияние концентрации реагирующих веществ, температура, а для газов – и давление. При изменении одного из этих параметров, химическое равновесия нарушается.
Константа равновесия.
Важнейший параметр, характеризующий обратимую химическую реакцию – константа равновесия К. Если записать для рассмотренной обратимой реакции A + D C + D условие равенства скоростей прямой и обратной реакции в состоянии равновесия – k1[A]равн[B]равн = k2[C]равн[D]равн, откуда [C]равн[D]равн/[A]равн[B]равн = k1/k2 = К, то величина К называется константой равновесия химической реакции.
Итак, при равновесии отношение концентрации продуктов реакции к произведению концентрации реагентов постоянно, если постоянна температура (константы скорости k1 и k2 и, следовательно, константа равновесия К зависят от температуры, но не зависят от концентрации реагентов). Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так для реакции 3h3 + N2 2Nh4 выражение для константы равновесия записывается в виде K = [Nh4]2 равн/[h3]3равн[N2]равн. Описанный способ вывода константы равновесия, основанный на скоростях прямой и обратной реакций, в общем случае использовать нельзя, так как для сложных реакций зависимость скорости от концентрации обычно не выражается простым уравнением или вообще неизвестна. Тем не менее, в термодинамике доказывается, что конечная формула для константы равновесия оказывается верной.
Для газообразных соединений вместо концентраций при записи константы равновесия можно использовать давление; очевидно, численное значение константы при этом может измениться, если число газообразных молекул в правой и левой частях уравнения не одинаковы.
Пинцип Ле Шателье.
если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие , то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На химическое равновесие влияет:
Изменение температуры. При повышении температуры равновесие смещается в сторону эндотермической реакции. При понижении температуры равновесие смещается в сторону экзотермической реакции.
Изменение давления. При повышении давления равновесие смещается в сторону уменьшения числа молекул. При понижении давления равновесие смещается в сторону увеличения числа молекул.
studfile.net
1.3 Влияние различных факторов на скорость реакции
Факторов, влияющих на скорость реакции, очень много. К ним относятся природа реагирующих веществ, их концентрация, давление, температура, наличие катализатора; для некоторых реакций – степень измельчения, наличие перемешивания, внешнее излучение, материал и форма реакционного сосуда и др.
Влияние природы реагирующих веществ. Скорость реакции зависит от природы реагирующих веществ. Некоторые реакции, например, взрывы, протекают мгновенно, другие могут идти годами. Большую роль играет характер химических связей и строение молекул реагентов. Скорость реакции определяется скоростью разрыва одних и образования других химических связей. Величина энергии активации оказывается тем фактором, посредством которого сказывается влияние природы реагирующего вещества на скорость реакции.
Если энергия активации очень мала (меньше 40 кДж/моль), то значительная часть столкновений между частицами приводит к образованию продуктов. Скорость реакции в данном случае велика. Такими являются реакции между ионами в растворах электролитов, и протекают они практически мгновенно.
Напротив, если энергия активации реакции очень велика (больше 120 кДж/моль), то очень малая часть столкновений между реагирующими частицами приводит к образованию продуктов. Скорость такой реакции очень мала. Пример реакции – реакция синтеза аммиака:
3H2 + N2 = 2NH3 .
Эта реакция при комнатной температуре практически не протекает.
Наконец, если энергия активации не очень мала и не очень велика (40–120 кДж/моль), то такая реакция будет протекать не очень быстро и не очень медленно, например:
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S.
Влияние концентрации реагентов. Порядок реакции. С увеличением концентраций, т.е. числа частиц в единице объема, возрастает число столкновений между частицами, в том числе и доля активных соударений. Следовательно, с увеличением концентраций реагентов возрастает скорость реакции.
Для элементарных, т.е. протекающих в одну стадию, реакций справедлив закон действия масс (К. М. Гульдберг, П. Вааге, 1867 г.): при постоянной температуре скорость элементарной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам, перед формулами веществ в уравнении реакции.
Для простой гомогенной реакции
aA +bB → продукты
ее скорость, согласно закону действия масс, выразится уравнением
v = k . C(A)a . C(B)b ,
где v – скорость реакции; C(A) и C(B) – молярные концентрации реагирующих веществ А и В;
k– коэффициент пропорциональности, или константа скорости реакции.
Если C(A) = 1 и C(B) = 1, то v = k. Отсюда вытекает физический смысл константы скорости: константа скорости реакции – это скорость реакции, при которой молярные концентрации реагирующих веществ равны единице.
Константа скорости реакции не зависит от концентраций реагентов и тех факторов, которые меняют концентрацию (например, давление для газов), но зависит от всех других факторов, от которых зависит скорость реакции: природы реагирующих веществ, температуры, катализатора, площади поверхности раздела фаз (для гетерогенных реакций) и др.
Для обозначения молярной концентрации в химии часто применяют заключение формулы вещества в квадратные скобки, т.е. записи «С(А)» соответствует запись «[A]». Следовательно, для вышеприведенной реакции закон действия масс может быть записан в следующем виде:
v = k · [A]a· [B]b .
Для гетерогенной реакции, например горения угля,
С (Т) + О2(Г) = СО2 (Г)
закон действия масс запишется таким образом:
v = k′ · [C ·[O2] = k ·[O2] ,
поскольку k′ – постоянная величина и концентрация угля – постоянная величина (так как это твердое вещество), а произведение двух постоянных есть величина постоянная (k′ ·[C] = k).
Следовательно, концентрации твердых веществ, так как это постоянные величины, не входят в закон действия масс для гетерогенных реакций.
Выражение зависимости скорости реакции от концентраций реагентов называют кинетическим уравнением скорости реакции. Для простых реакций и отдельных стадий сложных реакций закон действия масс и кинетическое уравнение скорости совпадают.
Для сложных реакций, т. е. протекающих в несколько стадий, закон действия масс неприменим. Если реакция сложная, например:
aA +bB → cC + dD ,
то кинетическое уравнение скорости имеет вид:
v = k . [A]n(A) . [B]n(B) ,
где n(A) и n(B) – величины, называемые порядком реакции по веществу А и В соответственно.
Сумма порядков реакций по всем веществам называется порядком реакции: n = n(A) + n(B).
Теоретически предсказать порядок реакции сложно, его определяют экспериментально. В общем случае порядок реакции по веществам не равен коэффициентам перед этими веществами в уравнении реакции: n(A) ≠ a, n(B) ≠ b. Порядок реакции по веществу, как и общий порядок реакции, может быть целым, дробным и нулевым (т.е не зависеть от концентрации). Вместе с тем, реакций, имеющих порядок реакции больше трех, не найдено.
Только для элементарных реакций порядок реакции по веществам совпадает с коэффициентами в уравнении, а общий порядок реакции – с молекулярностью.
Константа скорости реакции, входящая в закон действия масс для элементарных или в кинетическое уравнение скорости для сложных реакций, имеет определенные единицы измерения. Единицы измерения константы скорости зависят как от порядка реакции (или молекулярности), так и от типа реакции (гомогенная или гетерогенная) (в указаниях не приводятся).
Влияние температуры. При увеличении температуры энергия молекул возрастает. Увеличивается число столкновений, а также доля активных, т. е. ведущих к взаимодействию соударений — скорость реакции увеличивается (рисунок 5).
EА – энергия активных молекул.
Рисунок 5 – Распределение молекул по энергиям при двух температурах Т2>Т1
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза:
,
где v(t2) и v(t1) – скорости реакции при температурах t2 и t1 соответственно;
γ – температурный коэффициент скорости данной реакции (или коэффициент Вант-Гоффа), показывающий, во сколько раз изменяется скорость реакции при изменении температуры на 10 градусов.
При изменении температуры меняется константа скорости: γ = kt+10 / kt .
Правило Вант-Гоффа соблюдается для ограниченного круга реакций, протекающих при температурах, близких к комнатным, и позволяет лишь примерно оценить влияние температуры на скорость реакции. Более точным является уравнение Аррениуса:
k = A ∙ e —Ea/RT ,
где A — постоянная, зависящая от природы реагирующих веществ;
е – основание натурального логарифма;
Ea – энергия активации;
R – универсальная газовая постоянная;
Т – абсолютная температура.
Из уравнения Аррениуса следует: даже небольшое снижение энергии активации приводит к значительному возрастанию скорости реакции; влияние температуры на скорость реакции тем сильнее, чем больше энергия активации реакции; реакции с высокими Еа при низких температурах протекают с малыми скоростями, однако влияние температуры на скорость таких реакций значительнее ( больше).
Катализ – явление изменения скорости химической реакции в присутствии веществ, называемых катализаторами. Катализаторы – вещества, не расходующиеся в ходе химической реакции, но влияющие на ее скорость. Каталитические реакции – реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) – убывает. Катализаторы, замедляющие химическую реакцию, называются ингибиторами. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты, примером отрицательного – снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Многие катализаторы обладают селективностью (избирательностью), то есть увеличивают выход определенных продуктов. Например, этанол в присутствии оксида алюминия при 350 ºС разлагается па этилен и воду, а в присутствии меди при 250 ºС – на уксусный альдегид и водород.
Каталитическая активность, т.е. способность ускорения реакции, многих положительных катализаторов возрастает при добавлении небольших количеств некоторых веществ, называемых промоторами (или активаторами), которые без катализатора могут быть каталитически неактивными. Например, скорость окисления SO2 на катализаторе V2O5 возрастает в сотни раз при добавлении сульфатов щелочных металлов. В то же время имеются вещества, которые ухудшают каталитическую активность. Их называют каталитическими ядами. Так, следы мышьяка, фосфора вызывают быструю потерю катализатором V2O5 активности.
Механизм многих каталитических реакций очень сложен и не для всех полностью выяснен, однако некоторые закономерности являются общепризнанными. Так, катализаторы не влияют на термодинамику реакции, т.е. не изменяют энтальпию и энергию Гиббса реакции. Если энергия Гиббса реакции положительна, т. е. реакция невозможна, то катализатор не вызовет ее протекание; экзотермическая реакция останется экзотермической с тем же тепловым эффектом. Ускоряющее действие катализатора, как правило, заключается в уменьшении энергии активации процесса, так как каталитический процесс идет по другому пути, через другое переходное состояние, с образованием других промежуточных частиц. В присутствии катализатора образуются другие активированные комплексы с меньшей энергией активации, чем для некаталитической реакции (рисунок 6).
Различают два типа катализа: гомогенный — катализатор и реагирующие вещества находятся в одной фазе; гетерогенный – в разных фазах.
Примером гомогенного катализа является окисление SO2 до SO3 при нитрозном способе получения серной кислоты. Катализатор – оксид азота (II). Реакция протекает в две стадии:
1) c образованием промежуточного соединения 2NO + O2 = 2NO2;
2) с образованием конечного продукта и выходом катализатора из реакции 2NO2 + 2SO2 = 2SO3 + 2NO.
EА– энергия активации некаталитической реакции;
EА.КАТ.– энергия активации каталитической реакции;
EКАТ– снижение энергии активации под влиянием катализатора;
ABDC* — активированный комплекс некаталитической реакции;
ABK* иABDCK* — первый и второй активированные комплексы каталитической реакции;
HХ.Р.– тепловой эффект реакции.
Рисунок 6 – Энергетическая диаграмма хода некаталитической (1) и каталитической (2) реакции AB+DCAD+BC(K– катализатор).
Механизм гомогенного катализа объясняется теорией промежуточных соединений.
Примером гетерогенного катализа является окисление SO2 до SO3 при контактном способе получения серной кислоты. Катализатор – V2O5 . При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор часто наносят на твердый пористый носитель. Механизм гетерогенного катализа значительно сложнее и зависит от природы реакции. Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции. Переходные состояния представляют собой поверхностные соединения катализатора с реагирующими веществами. Имеется несколько теорий гетерогенного катализа.
Примерно три четверти всех химических производств используют катализаторы. Их применяют при получении аммиака, азотной и серной кислот, метанола, водорода, хлора, этилена, при крекинге углеводородов, получении маргарина и др. Катализ используют при решении экологических задач, например, очистке автомобильных выбросов, сточных вод.
Большую роль играет катализ в живой природе. Большинство химических реакций, протекающих в биологических системах, являются каталитическими. Катализаторы в этом случае называют ферментами. В организме человека находится около 30 000 различных ферментов; каждый из них служит эффективным катализатором соответствующей реакции.
studfile.net
8)Скорость химической реакции и факторы, влияющие на нее. Закон действия масс, константа скорости, ее химический смысл.
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Основные факторы – это концентрация реагирующих веществ, температура, наличие катализатора.
Влияние концентрации. Зависимость скорости химических реакций от концентрации определяется законом действия масс, который в общем виде записывается так:
V = K Can Cвm , (2.14)
где К – коэффициент пропорциональности, называемый константой скорости реакции.
Ca и Cв – концентрации веществ а и в, участвующих в химической реакции.
n и m – стехиометрические коэффициенты.
Влияние температуры. С повышением температуры скорость реакции возрастает, что связано с увеличением константы скорости реакции. Согласно правилу Вант-Гоффа повышение температуры на 10 0 С увеличивает скорость реакции в 2-4 раза. Можно рассчитать температурный коэффициент скорости реакции:
g = Kt+10/Kt , где (2.15)
Kt+10 – константа при температуре t+10 0.
Kt – константа скорости реакции при температуре t.
Влияние катализатора. Катализатор – вещество, которое резко изменяет скорость реакции. При внесении катализатора реакция проходит через несколько промежуточных стадий, требующих меньшей энергии активации, чем прямая реакция без катализатора, что приводит к колоссальному возрастанию скорости реакции.
Медленно протекающий процесс, например реакция А + В = АВ
в присутствии катализатора К проходит в две стадии:
А + К = АК ( промежуточное соединение)
АК + В = АВ + К
Большинство каталитических реакций положительно, т. е. в присутствии катализатора их скорость возрастает. Однако встречается отрицательный катализ. В этом случае катализатор называют ингибитором. Если ингибитор тормозит процесс окисления, его называют антиоксидантом.
Гидролиз – реакция разложения сложных веществ ( белков, жиров, углеводов) до более простых под действием кислот и щелочей с присоединением молекулы воды.
Меланоидинообразование (реакция Майара) – это сложный окислительно-восстановительный процесс, включающий в себя ряд последовательно и параллельно протекающих реакций.
Сущность реакции. Низкомолекулярные продукты распада белков (пептиды, аминокислоты), содержащие свободную аминную группу (- Nh3), могут вступать в реакцию с соединениями, в состав которых входит карбонильная группа=С=О, например, с альдегидами и восстанавливающими сахарами(фруктозой, глюкозой, мальтозой), в результате чего происходит разложение как аминокислоты, так и сахара. Из аминокислоты образуются альдегид, аммиак и диоксид углерода, а из сахара-фурфурол и оксиметилфурфурол. Альдегиды придают аромат пищевым продуктам.Фурфурол и оксиметилфурфурол вступают в соединения с аминокислотами, образуя темно-окрашеные продукты, называемые меланоидинами.
Дегидратация. Одна из реакций, протекающих в процессе меланоидинообразования, связана с дегидратацией и разложением сахаров при нагревании. Она может протекать и самостоятельно под воздействием высоких температур на сахара (сахарозу, глюкозу, фруктозу), вызывая ряд их превращений. Характер этих превращений различен и зависит от условий нагревания, реакции среды и концентрации сахара. Моносахариды при нагревании в кислой или нейтральной среде дегидратируют, т.е. разлагаются с выделением одной или двух молекул воды и образованием ангидридов глюкозы. Эти соединения реакционно способны и могут соединяться друг с другом или с неизменной молекулой глюкозы и образовывать продукты конденсации ( реверсии). При длительном тепловом воздействии отщепляется третья молекула воды и образуется оксиметилфурфурол, который при дальнейшем нагревании может распадаться с разрушением углеродного скелета.
Сульфитация. При переработке плодов и овощей потемнение происходит за счет биохимических процессов и образования меланинов. Для предотвращения потемнения их сульфитируют, т.е. обрабатывают диоксидом серы или h3SO3.
При сульфитации продукта идет образование сернистой кислоты, которая является сильным восстановителем,
SO2 + h3O = h3SO3
Частично сернистая кислота переходит в серную:
h3SO3 + h3O = h3SO4 + 2H
Выделяющийся водород оказывает обесцвечивающее действие.
Органические красящие вещества всегда содержат непредельные
хромофорные группы (-С=С-), при восстановлении их h3SO3 по месту разрыва двойных связей присоединяется водород, окрашенные соединения превращаются в бесцветные лейкосоединения.Эффект обесцвечивания до 30 %.
В 1864—1867 гг. норвежские химики К. Гульдберг и П. Вааге установили химический закон действия масс (закон действующих масс).
Закон действия масс можно сформулировать так: скорость взаимодействия двух химических реагентов прямо пропорциональна их концентрациям в реакционной системе, а достижимое состояние химического равновесия зависит от скоростей прямой и обратной реакций (см. Обратимые реакции). Значит, в простом процессе A + B = C + D прямая реакция, согласно этому закону, будет идти со скоростью v1 = K1•[А]•[В], а обратная — со скоростью v2 = K2•[С]•[D]. Равновесие в системе установится тогда, когда v1=v2, и величину константы равновесия КР можно в наиболее общем виде выразить отношением:
Kр = ([С]•[D])/([А]•[В])
В этой формуле Kр — константа равновесия, Kр = К1/К2, a K1 и К2 — константы скоростей прямой и обратной реакций. Константами их называют условно: постоянное значение они сохраняют только для данной реакции и при постоянных условиях ее проведения. Они не зависят от концентрации реагентов, но изменяются с изменением температуры. Химические свойства реагентов, температура, наличие катализатора и т. д. могут сильно влиять на величины K1, К2 и Kр, а значит, на скорость химической реакции и положение равновесия в системе. Например, при химическом синтезе аммиака по уравнению:
N2 + 3h3 ←(K1/K2)→ 2Nh4
при комнатной температуре K1>K2, а при 450° С — наоборот.
Уравнение закона действия масс позволяет сделать несколько полезных выводов. Во-первых, для ускорения прямого процесса необязательно увеличивать концентрации исходных веществ А и В; вполне достаточно взять большой избыток одного из них — того, которое дешевле и проще получить. Во-вторых, чтобы уменьшить скорость обратной реакции, можно воспользоваться удалением одного из продуктов, например, испаряя его, удаляя осадок и т. д. В-третьих, поскольку константы скоростей K1 и К2 зависят от температуры, есть возможность регулировать скорости реакций с помощью нагрева, охлаждения и т. д. И наконец, самое существенное: таким же образом можно повлиять на положение химического равновесия, т. е. на выход целевого продукта.
Константа скорости реакции — является коэффициентом пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
studfile.net


 ;
; 


 ; с-1
; с-1

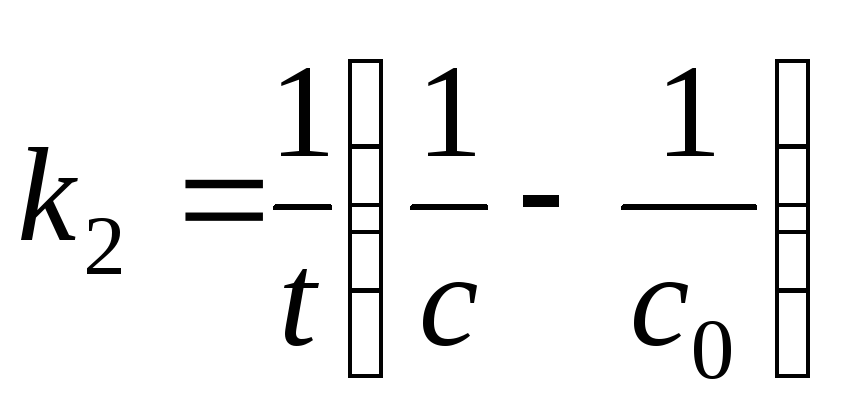 ;
; 
