Тема 6. Скорость химической реакции.
Часть I
1. Скорость химической реакции (Vp)– это изменение концентраций реагирующих веществ в единицу времени.
Формула для нахождения Vp = ΔC/Δt
2. Концентрация – это количество реагентов, участвующих в химической реакции.
3. Химическая кинетика – это раздел химии, в котором изучают скорости и механизмы реакций.
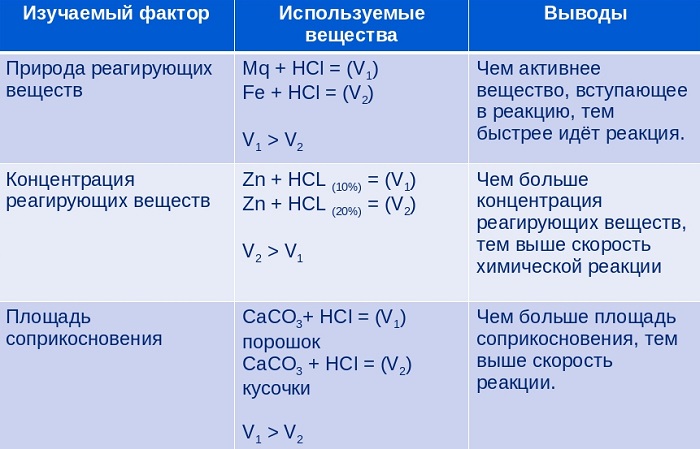
4. Зависимость Vp от природы реагирующих веществ на примере взаимодействия:
кислота + металл = соль + водород.
5. Зависимость Vp от концентрации – при увеличении Vp растёт.
6. Пути повышения Vp:
Зависимость Vp от концентрации и от температуры – прямо пропорциональная зависимость – это закон Вант-Гоффа.
Vp зависит от катализатора (см. тему следующего урока).
1. Единица измерения скорости химической реакции:
1) моль/л•с
2. Скорость любой химической реакции зависит от:
2) температуры
3. С наибольшей скоростью с водородом реагирует:
1) фтор
4. С наименьшей скоростью с водой реагирует:
1) литий
5. Одинаковые по размеру кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой, если:
2) увеличить концентрацию кислоты
6. Для увеличения скорости химической реакции
необходимо:
4) увеличить концентрацию кислоты
Создайте изображение, показывающее зависимость Vp от площади соприкосновения реагирующих веществ.
7. Какой график отражает зависимость Vp от t?
Ответ: 3.
superhimik.ru
XuMuK.ru — Скорость химической реакции
|
|
Скорость химической реакции, величина, характеризующая интенсивность реакции химической. Скоростью образования продукта реакции называется количество этого продукта, возникающее в результате реакции за единицу времени в единице объёма (если реакция гомогенна) или на единице площади поверхности (если реакция гетерогенна). Для исходных веществ аналогичным образом определяется скорость их расходования. Количества веществ выражают в молях. Тогда скорости образования продуктов и расходования исходных веществ относятся как стехиометрия, коэффициенты этих веществ в уравнении реакции. Например, в случае реакции N2 + ЗН2 = 2NH3 скорость расходования водорода в 3 раза, а скорость образования аммиака в 2 раза больше скорости расходования азота. Отношение скорости образования продукта реакции, или скорости расходования исходного вещества, к соответствующему стехиометрическому коэффициенту называется скоростью химической реакции. В случае гомогенной реакции, происходящей в закрытой системе постоянного объёма, скорость химической реакции , где c Для технических целей скорости гетерогенно-каталитических реакций обычно рассчитывают не на единицу поверхности катализатора, а на единицу массы катализатора или на единицу объёма слоя гранул катализатора. Скорость химической реакции может варьировать в чрезвычайно широких пределах — от очень малой (в случае геологического процессов, длящихся миллионы лет) до очень большой (в случае ионных реакций, завершающихся за миллионные доли секунды). О теории скорости химической реакции см. Кинетика химическая. Для измерения скорости химической реакции служат разнообразные методы. Выбор метода определяется характером реакции и её скоростью. Не затрагивая реакций специальных типов (электродные, фотохимические, радиационно-химические), охарактеризуем основные методы измерения скоростей обычных реакций, обусловленных энергией теплового движения. При использовании статического метода реакцию проводят в замкнутом сосуде. О её скорости судят по изменению состава реагирующей смеси на основании анализа проб или по какому-либо свойству реагирующей смеси, зависящему от состава. В случае газовых реакций, сопровождаемых изменением числа молекул, часто следят за реакцией по изменению давления. Проточный метод заключается в том. что реагирующую смесь пропускают с постоянной скоростью сквозь зону реакции: для гетерогенной реакции — это обычно объём, заполненный гранулами катализатора; в случае гомогенной реакции — область повышенной температуры. Степень превращения исходных веществ в продукты определяют по составу смеси, выходящей из зоны реакции. Оба указанных метода просты для осуществления, но не дают непосредственно значения скорости химической реакции. В статической системе состав реагирующей смеси, а следовательно и скорость химической реакции, изменяется во времени; поэтому требуется дифференцирование измеренной величины концентрации по времени для определения скорости реакции или интегрирование по времени теоретические выражения скорости реакции для сопоставления его с опытными данными. В случае проточного метода состав реагирующей смеси не зависит от времени, но различен в разных участках зоны реакции; поэтому сопоставление теоретического выражения для скорости химической реакции с результатами опыта требует предварительного интегрирования этого выражения по объёму зоны реакции. Прямое измерение скорости гомогенной реакции достигается с помощью проточного перемешиваемого реактора. В сосуд, снабженный мощной мешалкой, с постоянной скоростью вводят исходные вещества и выводят реагирующую смесь так, чтобы её количество в реакционном сосуде было постоянно. При установившемся стационарном состоянии анализ отбираемой смеси показывает состав реагирующей смеси. Зная, кроме того, скорость отбора этой смеси, определяют количество вещества, образовавшегося в результате реакции за единицу времени, а отсюда — скорость химической реакции. Для гетерогенно-каталитических процессов с неподвижным катализатором эквивалентом описанного метода является проточно-циркуляционный метод: однородность состава реагирующей смеси в зоне реакции достигается с помощью создаваемой насосом интенсивной циркуляции реагирующей смеси. Проточные перемешиваемые реакторы и проточно-циркуляционные системы принадлежат к классу безградиентных реакторов, называемых так потому, что в них практически отсутствуют градиенты (перепады) концентраций, а также температуры в зоне реакции. Особые трудности возникают при изучении очень быстрых реакций в растворах. Если реакция успевает пройти в значительной степени за время, которое требуется для смешения растворов исходных веществ, то обычные методы непригодны. Задача измерения скоростей таких реакций решается с помощью релаксационных методов, разработанных М. Эйгеном. Система, в которой может происходить обратимая реакция, вначале находится в состоянии равновесия химического. Затем весьма быстро изменяют параметр, влияющий на значение константы равновесия: температуру, давление или электрическое поле. Система переходит к новому состоянию равновесия в течение некоторого времени; этот процесс называется релаксацией. Следя за изменением состава каким-либо безынерционным методом (например, по электропроводности), определяют скорость химической реакции. Удаётся наблюдать время релаксации до 10 -6 сек: таким путём была измерена, например, скорость реакции Н++ OH— = H2O в воде.
Лит.: Кондратьев В. Н., Определение констант скорости газофазных реакций, М., 1971; Колдин Е., Быстрые реакции в растворе, пер. с англ., М., 1966; Проблемы теории и практики исследований в области катализа, под ред. В. А. Ройтера, К., 1973, гл. 3; Уэйт Н., Химическая кинетика, пер. с англ., М., 1974. М. И. Тёмкич.
|
www.xumuk.ru
Скорость химической реакции ⚗️ формула в гомогенной и гетерогенной системе, единица измерения, физический смысл константы в уравнении, факторы, влияющие на скорость
Скорость химической реакции — определение довольно древнее, но по-прежнему актуальное, так как является базовым понятием в химической науке и её прикладном значении. Сама возможность влияния человека на скорость и объем химического процесса позволила в свое время сделать резкий прорыв в этой и многих других областях, потому что больше не приходилось дожидаться результата так же долго, сколько он занимает в естественной природной среде.
Соответственно, наличие катализаторов позволяет ученым и сейчас ускорять прогресс науки, достигать поставленных задач. Такой раздел знаний изучает химическая кинетика — наука, определяющая закономерности влияния физических и химических условий на протекание химических реакций.
Скорость химической реакции — изменение количества одного из реагентов за промежуток времени в реакционном пространстве. Эта скорость является фундаментальным понятием химической кинетики. Она измеряется путём изменения концентрации одного из веществ. Как правило, рассчитывается в молях (классическая единица измерения) на литр за единицу времени.
Стоит сказать, что абсолютно все химические реакции рассматриваются только в системе, т. е. в совокупности отдельно взятых веществ и объектов.
Скорость реакции в гомогенной системе

В химии различают гомогенные (одинаковые фазы внешней среды) и гетерогенные (различающиеся фазы окружающей среды) реакции в зависимости от фаз среды.
Реакции в гомогенной системе происходят только в однородной фазе в общем объеме реакционной системы. Реакция происходит исключительно при взаимодействии растворов жидкостей или газов.
Скорость химической реакции в гомогенной системе — это изменение концентрации одного из веществ, участвующих в химической реакции, за единицу времени.
Ниже приведены примеры таких реакций и нужная формула:

Скорость реакции в гетерогенной системе
В гетерогенных же системах химические реакции протекают только на поверхности раздела разных фаз.

Поверхность раздела фаз — это граничная поверхность между двумя веществами, вступающими в реакцию, в контакт между собой.
Например, при взаимодействии железа с соляной кислотой: Fe + 2HCl → FeCl2 + H2.
Факторы, влияющие на скорость химической реакции
Как ранее было сказано, скорость химической реакции зависит от нескольких параметров:
-
температуры;
-
соотношения концентраций реагентов;
-
наличия катализаторов;
-
природы взятых реагентов;
-
площади соприкосновения реагентов;
-
давления (применимо, если в случае реагентов взяты газообразные вещества).
Температура
Правилом Вант-Гоффа и уравнением Аррениуса определяется скорость взаимодействия реагентов. Сванте Аррениус искал взаимосвязь скорости и температуры. Он установил, что химические процессы поддаются равенству константы скорости:
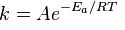
Пояснения:
-
Еа — min энергия для запуска реакции;
-
Т —температура;
-
R —постоянная газа;
-
A — постоянная, указывающая на вероятность возможного взаимодействия молекул.
Удобно пользоваться и правилом Якоба Вант-Гоффа, смысл которого гласит, что увеличивается v реакции от двух до четырех раз при росте температуры на десять градусов (по Цельсию). Для простоты расчётов было создано уравнение:
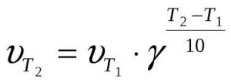
Соотношение концентраций реагентов
Обусловленность скорости от концентрации реагентов в системе известна в науке, как закон действующих масс. Его открыли Като Гульдберг и Петер Вааге.
Скорость этих реакций выражается уравнением:

Здесь:
-
v — скорость взаимодействия веществ;
-
cA и cB — концентрации реагентов;
-
k —коэффициент скорости.
Катализаторы
Самым распространённым способом изменить скорость реакции является добавление к ней катализатора (ускорителя) или ингибитора (замедлителя).

Основное преимущество таких веществ в том, что они не являются расходным материалом и не влияют на равновесие в продуктах внутри системы.
Для простоты возьмем реакцию разложения пероксида водорода: 2Н2О2 = 2Н2О + О2.
Без дополнительных веществ эта простая реакция протекает довольно медленно, но если добавить оксид марганца (MnO2), то сразу заметим наличие газа (O2).
Природа веществ
Скорость реакции также зависит от природы взятых веществ. Здесь тоже не все так просто, ведь имеет вес почти каждая мелочь этого вещества: характер и прочность кристаллической решетки и химических связей, строение оболочки атомов и расположения на ней электронов (согласно периодическому закону Д. И. Менделеева о порядке веществ в таблице).

Для простоты объяснения приведем пример: согласно строению веществ, натрий (Na) гораздо легче отдает свои электроны, чем олово (Sn), соответственно, реагировать с одним и тем же веществом он будет быстрее.
Площадь соприкосновения реагентов
Что касается смесей твердых и жидких фаз, то тут для увеличения скорости реакции поможет увеличение площади соприкосновения этих веществ.

Приведем пример: если мы возьмем часть щелочного метала в водном растворе, то реакция пойдет достаточно быстро, однако, если мы сделаем из кусочка металла порошок, то скорость взаимодействия увеличится.
Давление
В случае химической реакции, реагентами которой являются газы, то изменить скорость взаимодействия можно увеличением давления в системе, потому что таким образом повышается и концентрация газа. Зависимость скорости от давления будет прямо пропорциональной.
nauka.club
Измерение скорости химической реакции
Для экспериментального определения скорости химической реакции необходимо иметь данные об изменении концентрации исходных или конечных веществ во времени. Методы, с помощью которых это можно сделать, подразделяются на химическиеифизико-химические.
Химические методы основаны на непосредственном определении количества вещества или его концентрации в реакционном сосуде.
Чаще всего для этих целей используют такие виды количественного анализа, как титриметрия и гравиметрия. Если реакция протекает медленно, то для контроля за расходованием реагентов через определённые промежутки времени из реакционной среды осуществляют отбор пробы. Затем определяют в них содержание нужного вещества. Например, титрованием щёлочью определяют количество кислоты в системе по мере протекания реакции
R1 – COOH + R2 – OH → R1 – COO – R2 + H2O
Если реакция протекает с большой скоростью, то для отбора пробы её останавливают с помощью резкого охлаждения, быстрого удаления катализатора, разбавления либо перевода одного из реагентов в нереакционное состояние.
Химические методы анализа отличает простота, доступность и хорошая точность.
В современной экспериментальной кинетике чаще всего используют физико-химические методы анализа. Они позволяют контролировать изменение концентрации вещества непосредственно в ходе протекания реакции, не останавливая её и не делая отбора пробы.Эти методы основаны на измерении какого-либо физического свойства системы, меняющегося во времени и зависящего от количественного содержания в ней определённого соединения; например: давления (если в реакции участвуют газы), электропроводности, показателя преломления, спектра поглощения реагента или продукта реакции в ультрафиолетовой, видимой либо инфракрасной областях. Широко используются спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР).
Применение спектральных методов основано на том, что поглощение электромагнитного излучения пропорционально количеству вещества или его концентрации в системе.
Обычно экспериментально изучают реакции в замкнутой системе (т.е. при постоянном объёме) и представляют результаты графически в виде так называемой кинетической кривой, выражающей зависимость концентрации реагента или продукта реакции от времениt. Аналитический вид этой зависимости называетсяуравнением кинетической кривой. В отличие от основного кинетического уравнения, уравнения кривых расходования реагирующих веществ (или накопления продуктов реакции) содержат в качестве параметров начальные концентрации компонентов (С0) в момент времениt=0.
Из этих уравнений выводят формулы для расчёта константы скорости реакции и времени полупревращения(t½) – промежутка времени, в течение которого расходуется половина взятого исходного вещества, т.е. его концентрация уменьшится в 2 раза и станет равной Со/2.
В реакциях нулевого порядка концентрация исходного вещества линейно уменьшается со временем (рис. 37)

Рис. 37. Изменение концентрации исходного вещества от времени в реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
С = С0–kt
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени t.
Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k
=  (C0 – C).
(C0 – C).
Константа скорости нулевого порядка измеряется в моль/л ∙ с (моль · л-1· с-1).
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½=
Для реакций первого порядка кинетическая кривая в координатах С,tносит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
С = С0e—kt

Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах ℓnC,t. В этом случае наблюдается линейная зависимость ℓnС от времени (рис. 39)
ℓnС = ℓnС0–kt

ℓnС
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k
= 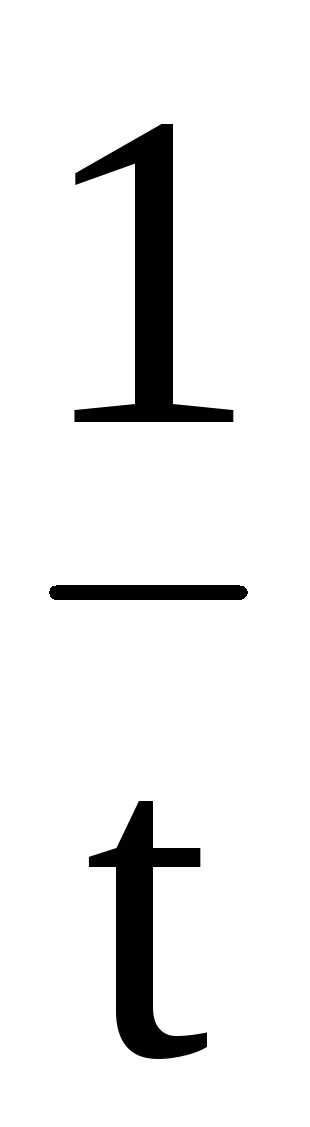 ℓn
ℓn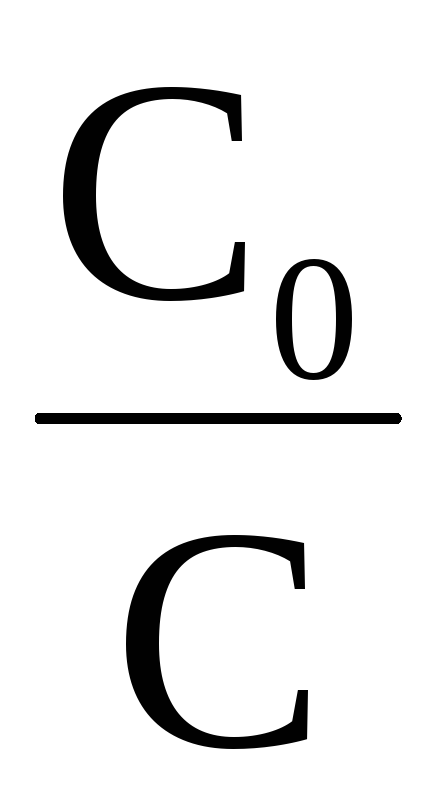 илиk= 2,303
илиk= 2,303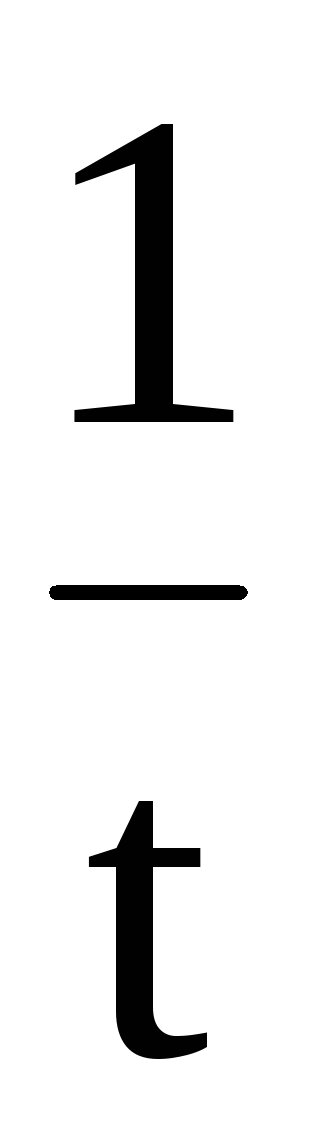 ℓg
ℓg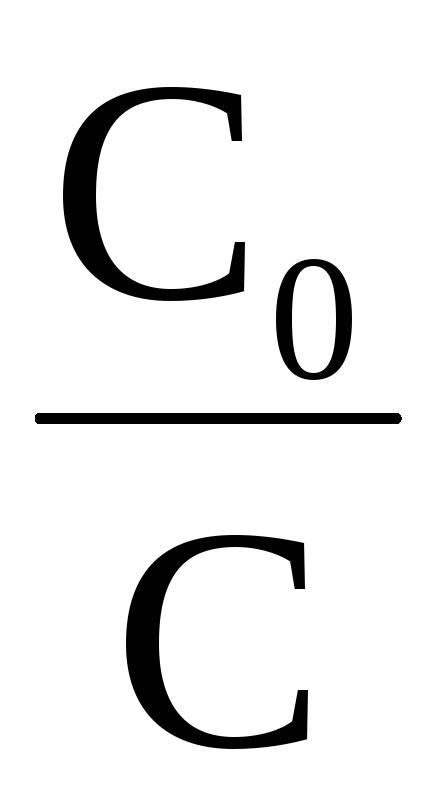
(при переходе от десятичного логарифма к натуральному).
t½ =
Константа скорости реакции первого порядка имеет размерность t –1 , т.е. 1/с и не зависит от единиц измерения концентрации.Она показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул реагента в системе. Таким образом, в реакциях первого порядка за одинаковые промежутки времени расходуются одинаковы доли взятого количества исходного вещества.
Второй отличительной особенностью реакций первого порядка является то, что t½ для них не зависит от начальной концентрации реагента, а определяется только константой скорости.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С,t(рис. 40). Математическое уравнение этой зависимости запишется следующим образом
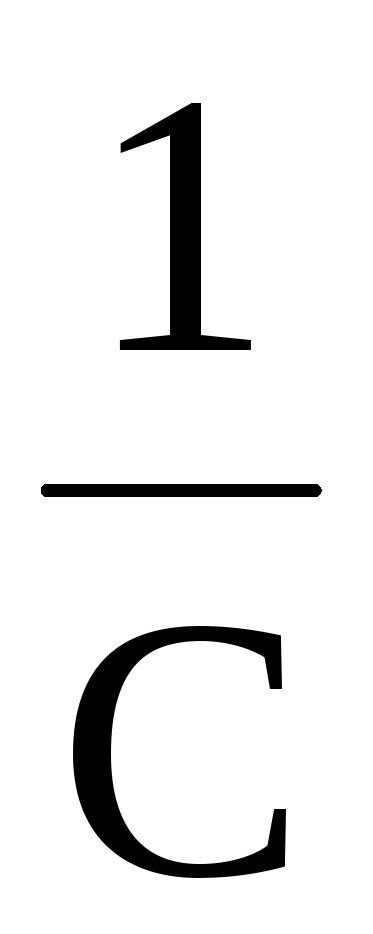 =
=  +kt
+kt
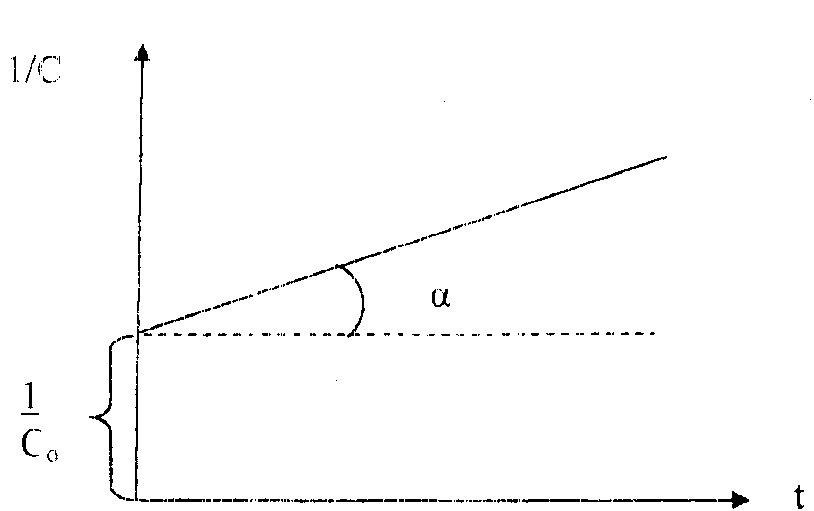
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
Константа скорости вычисляется по формуле
k=  (
( –
–  )
)
и измеряется в л∙с-1∙моль-1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества.
Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента
t½=
Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объема, т.е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
Реакции третьего порядка, как уже было сказано ранее, встречаются крайне редко и не представляют практического интереса. Поэтому в связи с этим мы их не будем рассматривать.
studfile.net
2.5 Константа скорости химической реакции
2.5 Константа скорости химической реакции
Согласно закону действия масс скорость простой реакции равна

Константа скорости
реакции k — коэффициент
пропорциональности между скоростью
химической реакции и произведением
концентраций реагирующих веществ: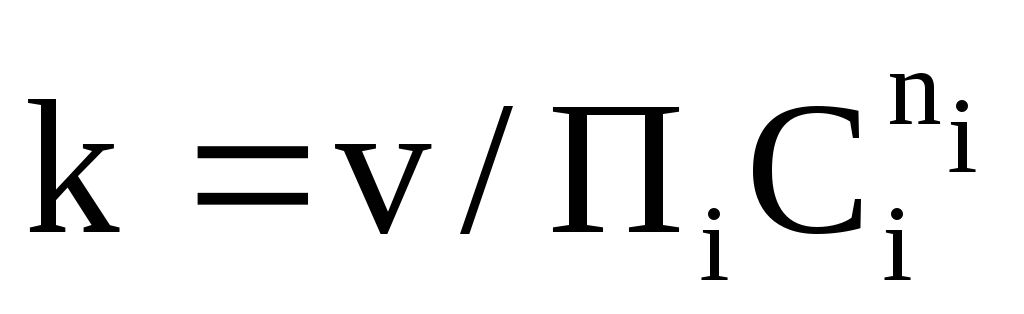 .
Константа скорости численно равна
скорости химической реакции, когда
концентрации всех реагентов равны
единице: W=k
при CA=CB=1.
Если реакция А с В по своему механизму
сложная (в ней участвуют активные
промежуточные продукты, катализатор и
т. д.), подчиняется уравнению
.
Константа скорости численно равна
скорости химической реакции, когда
концентрации всех реагентов равны
единице: W=k
при CA=CB=1.
Если реакция А с В по своему механизму
сложная (в ней участвуют активные
промежуточные продукты, катализатор и
т. д.), подчиняется уравнению 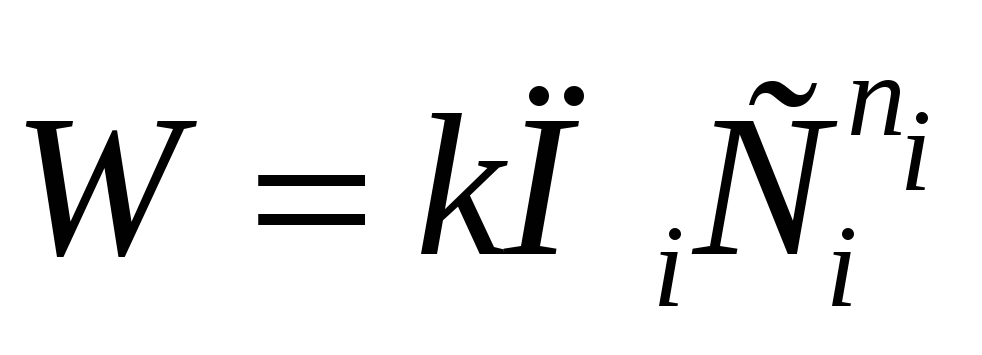 ,
то k
называют эффективной
константой скорости реакции; IUPAC
рекомендует называть k
в этом случае коэффициентом
скорости реакции. Нередко скорость сложной реакции не
подчиняется степенному уравнению, а
выражается иной зависимостью, например
v=k1C1C2(1+k2C2)–1.
Тогда k1 и k2 называют коэффициентами
в уравнении для скорости реакции.
,
то k
называют эффективной
константой скорости реакции; IUPAC
рекомендует называть k
в этом случае коэффициентом
скорости реакции. Нередко скорость сложной реакции не
подчиняется степенному уравнению, а
выражается иной зависимостью, например
v=k1C1C2(1+k2C2)–1.
Тогда k1 и k2 называют коэффициентами
в уравнении для скорости реакции.
Часто реакцию проводят в условиях, когда концентрации всех реагентов, кроме одного, взяты в избытке и в ходе опыта практически не меняются. В этом случае
 ,
,
а коэффициент
kнабл=k называют эффективной или наблюдаемой
константой скорости реакции при СB>>СA.
Для случая nA=1
такой коэффициент часто называют
коэффициентом скорости реакции
псевдопервого порядка. Константа
скорости реакции порядка
n
имеет размерность: (время)–1•(концентрация)–(n–1).
Численное значение зависит от единиц,
выбранных для измерения времени и
концентрации.
называют эффективной или наблюдаемой
константой скорости реакции при СB>>СA.
Для случая nA=1
такой коэффициент часто называют
коэффициентом скорости реакции
псевдопервого порядка. Константа
скорости реакции порядка
n
имеет размерность: (время)–1•(концентрация)–(n–1).
Численное значение зависит от единиц,
выбранных для измерения времени и
концентрации.
При вычислении константы скорости простой реакции необходимо учитывать два обстоятельства: помнить, по какому реагенту измеряется скорость реакции и чему равен стехиометрический коэффициент и порядок реакции по этому реагенту. Например, реакция 2,4,6-триалкилфеноксильного радикала с гидропероксидом протекает в две последовательные стадии:
PhО•+ROOH→PhOH+RO2•
PhO•+RO2•→ROOPhO
Стехиометрическое уравнение – 2PhО•+RООН=РhОН+ROОPhО, но поскольку первая стадия определяет скорость реакции, WROOH=k[ROOH][PhO•] и WPhO•=2k[ROOH][PhO•].
Таким образом, здесь не совпадают коэффициенты в кинетическом и стехиометрическом уравнениях для феноксильного радикала: порядок реакции по PhO• равен 1, а стехиометрический коэффициент для PhO• равен 2.
Методы вычисления константы скорости химической реакции. По кинетической кривой. Если n=1, то k=t–1ln 10 lg (CAo/CA). Если суммарный порядок реакции ‑ n, а порядок реакции по данному компоненту равен 1, и все реагенты, кроме А, взяты в избытке, то
 .
.
Для реакции А+В→продукты k находят из уравнения

При вычислении константы скорости по интегральной кинетической кривой в общем виде ставится задача по определению k в уравнении f(x)= –k`t (x ‑ относительная концентрация реагента).
Для реакции 1-го порядка f(x)=ln x, k`=k; для реакции 2-го порядка f(x)=x–1–1, k=Cok и т.д. Из эксперимента получаем ряд значений (t1, x1), (t2, x2), …, (tn, xn). Прямая, проведенная в координатах f(x)–t, должна удовлетворять условию i=f(xi)+kti, Σi=0. Отсюда следует, что k= Σf(xi)/Σti.
По периоду полупревращения. Период полупревращения однозначно связан с константой скорости и исходной концентрацией реагента, что позволяет вычислить k. Так, для реакции первого порядка k=ln 2/τ1/2, для реакции второго порядка k=Co–1τ1/2 и т.д.
По начальной скорости реакции. Поскольку в начальный момент времени расходование реагентов незначительно,
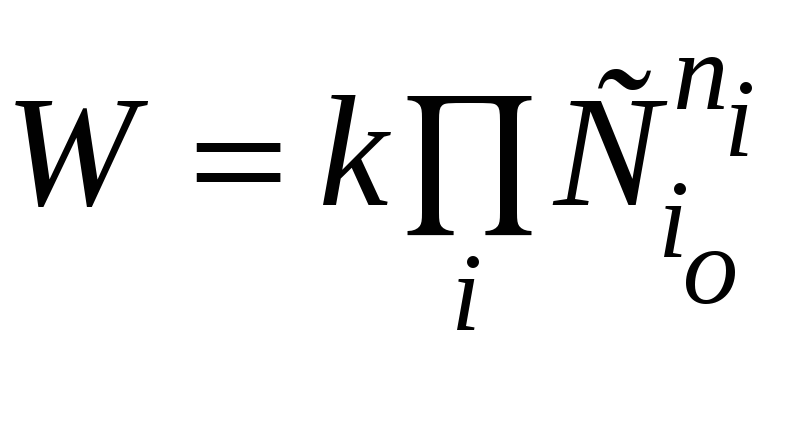 и
и 
По изменению скорости реакции во времени. Измерив концентрации реагентов в момент времени t` и t« (С` и С«), можно вычислить среднюю скорость реакции и найти k, при ν=1 имеем
 ,
, 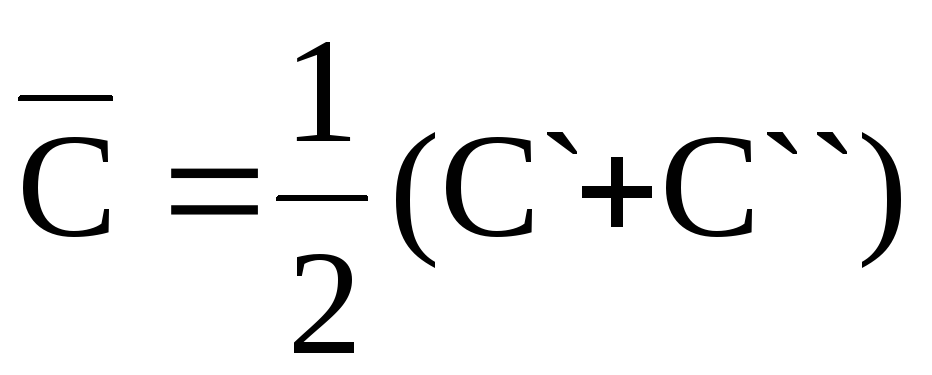 ,
,  .
.
Специальные методы обработки кинетических кривых. Если кинетика реакции регистрируется по изменению какого-либо физического свойства системы x (оптическая плотность, электрическая проводимость и т.д.), связанного с концентрацией реагирующего вещества С так, что при C=Co, x=xo, а при С=0, х=x∞, то k можно определить из кинетической кривой x(t) следующими методами:
Метод Гуггенгейма (для реакций первого порядка). Измеряют xi в момент ti и x1` в момент ti+ и т.д. Из графика lg (хi–хi`)–ti находят k:
lg (xi–xi`)=lg[(xo–x∞)(1–e–k)]–0,43kti.
Метод Мангельсдорфа (для реакций первого порядка). Измерения проводят как в методе Гуггенгейма, но график строят в координатах xi` – xi:
xi`=xie–k+x∞(1–e–k),
наклон прямой равен e–k, отсечение на оси ординат равно х∞(1–e–k).
Метод Розвери (для реакций второго порядка). Параметр х измеряют в моменты времени t1, t2, t3 разделенные постоянным интервалом времени . Константу скорости находят из уравнения:
 .
.
studfile.net
Химическая кинетика в курсе физической химии
данные с получением достаточных для большинства практических целей кинетических уравнений. Дадим определение основному понятию химической кинетики –
скорости химической реакции:
Скорость химической реакции – это число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции – это число актов превращения в единице объема в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Различия в способах расчета скорости могут привести к некоторым неопределенностям. Поэтому по правилам ИЮПАК рекомендовано использовать разные понятия для определения скорости. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени.
Например, для реакции (1) скорость
W |
| 1 |
| dN A |
| 1 |
| dN A | … | 1 |
| dNB | … | (1) |
| 1 |
| 2 |
| 1 | |||||||||
|
|
|
|
|
| |||||||||
х. р. |
| a1V dt |
| a2V dt |
| b1V dt |
|
| ||||||
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
| 11 |
|
|
|
|
|

Здесь Ni – число молекул i-го вещества, находящихся в системе; V – объем системы; t – время. Все Ni являются
функциями от t, V также может быть функцией от t. |
| ||||||||||||||
При | V = const |
| V | можно | внести под | знак | |||||||||
дифференциала. При этом, | учитывая, | что | N Ai | C , | где C | ||||||||||
| |||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| V | i | i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
— концентрация | вещества Ai, получаем для реагентов | ||||||||||||||
W |
|
| 1 |
| dCA |
| , |
|
|
| (2а) | ||||
|
|
|
| i |
|
|
|
| |||||||
|
|
|
|
|
|
|
|
| |||||||
х. р. |
|
| ai |
| dt |
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
| |||||
и для продуктов реакции |
|
|
|
|
| ||||||||||
W |
| 1 |
|
| dCB j | , |
|
|
| (2б). | |||||
|
|
|
|
|
|
|
|
| |||||||
х. р. |
| bj |
|
|
| dt |
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
| ||||
2.4. Скорость по компонентам химической реакции
Из уравнений (2а и 2б) видно, что изменение
концентрации | вещества | реакции | есть | скорость | |||
химической | реакции, | помноженная | на | ||||
стехиометрический коэффициент, т.е. |
|
| |||||
WA | ai W | dCA |
|
|
|
|
|
i |
|
|
|
|
| ||
|
|
|
|
|
|
| |
i |
| dt |
|
|
|
|
|
WB j | bj W | dCB | j |
|
|
| |
|
|
|
| ||||
dt
3. Методы измерения скорости химической реакции
12
3.1. Скорость химической реакции как тангенс угла наклона касательной линии к кинетической кривой
Так как скорость по компоненту есть | , то для ее | |||
нахождения необходимо знать | , тогда | |||
|
| | , |
|
|
|
|
| ||
что по определению является тангенсом угла наклона | ||||
касательной к функции | в точке | . | ||
Кроме того эту скорость легко определить, если есть экспериментальные данные по зависимости концентрации вещества от времени. По этим данным можно построить график, который называется кинетической кривой. Скорость реакции в заданной точке кинетической кривой определяется наклоном касательной в этой точке. Определение наклона касательной всегда связано с некоторой ошибкой. Точнее всего определяется начальная скорость реакции, поскольку вначале кинетическая кривая обычно близка к прямой; это облегчает проведение касательной в начальной точке кривой.
3.2. Графическое дифференцирование кинетической кривой. Метод зеркальца
Скорость реакции всегда положительна. Однако при протекании реакции во времени концентрации исходных веществ уменьшаются, а продуктов реакции возрастают
13
(рис.1, a). | В результате | соотношение | и |
производная | могут | быть положительными | или |
отрицательными в зависимости от того, изучают скорость реакции по изменению концентрации одного из продуктов реакции (знак «+») или одного из исходных веществ (знак «-«). Графический способ определения скорости реакции W показан на рис.1, б. Сама зависимость концентрации от времени называется кинетической кривой.
Величина dt всегда положительна, тогда как знак зависит от того, как изменяется со временем концентрация – уменьшается (для исходных веществ) или увеличивается (для продуктов реакции). Чтобы скорость реакции всегда оставалась величиной положительной, в случае исходных веществ перед производной ставят знак минус: – . Если реакция идет в газовой фазе, вместо концентрации веществ в уравнении скорости часто используют давление. Если газ близок к идеальному, то давление связано с концентрацией с простым уравнением:
.
14

C | a | 2 | C |
|
| ||
| C0 |
| |
|
|
| |
|
|
| C1 |
|
| 1 | C2 |
|
|
| t |
C0 | б |
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
| |
|
| W(t | ) = g | = C | / t | 1 |
| ||
|
| 1 |
|
| 1 |
|
|
| |
|
| W(t | ) = tg |
| = C | / t | 2 | ||
|
| 2 |
|
| 2 |
|
| ||
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
C1 |
|
|
|
|
|
|
|
|
|
t1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1 |
| C2 |
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
| ||
| t2 |
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
t1 |
| t2 |
|
|
|
|
|
| t |
Рис. 1. Кинетические кривые: (а) — изменение концентрации одного из исходных веществ (1) и одного из продуктов (2) реакции во времени; (б) — нахождение скорости реакции по изменению концентрации одного из исходных веществ во времени.
3.3. Численные методы дифференцирования экспериментальных данных
В настоящее время если имеется достаточно большое количество экспериментальных точек то можно воспользоваться программным обеспечением на ПК и подобрать функцию, которая бы хорошо описывала наблюдаемую кинетическую кривую. В другом случае прибегают к аппроксимации кинетической кривой по
методу наименьших квадратов (∑ | ) и исходя |
из полученных данных строят | . |
Если время измерять в секундах, а концентрацию – в молях на литр, то скорость реакции измеряется в единицах моль/(л·с). Таким образом, скорость реакции не зависит от объема реакционной смеси: при одинаковых
15

условиях она будет одинаковой и в маленькой пробирке, и в многотоннажном реакторе.
4. Понятие о механизме химической реакции
Механизм реакции – детальное ее описание с учетом
всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей, изменения энергии химической системы на всем пути ее перехода из исходного в конечное состояние.
Цель изучения механизма реакции – возможность управлять ходом реакции, ее направлением и эффективностью.
Реакции, протекающие в одну стадию, называют
простыми (элементарными) реакциями, а реакции,
включающие несколько стадий – сложными.
Пример. Реакция окисления водорода кислородом. Стехиометрическое уравнение:
Данное уравнение не описывает всех стадий процесса
и является брутто уравнением. | Механизм реакции: | ||||
(0) |
|
|
|
| ̇ |
– зарождение цепи. |
|
|
|
| |
Звено цепи (повторяется много раз): | |||||
| ̇ | → |
| ̇ | — продолжение цепи, |
|
|
| |||
| ̇ | → | ̇ | ̈ | — разветвление цепи, |
{ | ̈ | → | ̇ | ̇ | — продолжение цепи. |
|
|
|
| 16 |
|
и т. д.
Это – разветвленный цепной механизм. За открытие разветвленных цепных реакций советский ученый акад. Н. Н. Семенов и английский ученый С. Хиншельвуд были удостоены Нобелевской премии. Звено цепи
повторяется много | раз, пока не погибнут в | побочных | ||
реакциях промежуточные частицы – атомы | ̇ | ̈ | и | |
, |
| |||
свободный радикал | ̇ , или пока не израсходуется хотя | |||
бы одно из исходных веществ. |
|
|
| |
5. Элементарные химические реакции
Механизм реакции показывает последовательность превращения реагентов в продукты, раскрывая природу промежуточных химических соединений. А химические реакции, как правило, протекают через серию элементарных актов, химических реакций, которые не могут быть представлены более простыми химическими превращениями. Иногда вместо термина элементарная реакция пользуются терминами элементарная стадия
или просто стадия (сложной реакции). В элементарной реакции, как правило, разрывается или образуется не более одной-двух связей между атомами. Например, в элементарной химической реакции h3 + Ȯ = Ḣ + ȮH разрывается одна связь и образуется одна связь
.
17

Понятие элементарного акта возникло при рассмотрении химических превращений на атомномолекулярном уровне.
Совокупность однотипных элементарных актов называют элементарной реакцией или элементарной
стадией.
В ходе элементарной реакции преодолевается только один потенциальный барьер (рис.2, а) или ни одного (см. рис.2, б).
E
L L
Рис. 2. Возможные профили потенциальной энергии для элементарной реакции.
Пример реакции типа «а»:
̇
Пример реакции типа «б»:
̇̇ →
Впоследней реакции атом M нужен для того, чтобы
обеспечить отвод большого количества энергии, выделяющейся при рекомбинации.
18
Различие между простой и элементарной реакцией состоит в том, что простая реакция иногда может состоять из нескольких элементарных.
5.1. Молекулярность химической реакции
Молекулярность элементарной реакции – число
частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
В зависимости от числа молекул, участвующих в элементарной реакции, она может быть
мономолекулярной, бимолекулярной или тримолекулярной.
Мономолекулярные реакции – реакции, в которых
происходит химическое превращение одной частицы (изомеризация, диссоциация и т. д.):
→.
Бимолекулярные реакции – реакции, элементарный
акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
̇→ ̇.
Тримолекулярные реакции – реакции,
элементарный акт которых осуществляется при столкновении трех частиц:
̇̇ →
Элементарные реакции более высокой молекулярности
не | наблюдаются | ввиду | малой | статистической |
19
вероятности одновременного столкновения четырех частиц. Поэтому реакции с участием более чем трех частиц всегда не элементарные.
6. Кинетическое уравнение химической реакции
Кинетическое уравнение – это уравнение,
описывающее зависимость скорости химической реакции от концентраций компонентов реакционной смеси.
Изучение кинетики конкретных химических реакций начинается, как правило, с построения экспериментально определяемых зависимостей , которые носят название кинетических кривых. Далее начинается анализ этих данных и изучение механизма протекания реакции. Но это требует длительных и сложных исследований, поэтому после того, как получены кинетические кривые, можно обработать эти данные с получением достаточных для большинства практических целей кинетических уравнений.
На этом этапе кинетических исследований основным законом химической кинетики является закон действующих масс, сформулированный норвежскими учеными Гульдбергом и Вааге.
Закон Гульдберга и Вааге в химической кинетике гласит: скорость химической реакции
пропорциональна произведению текущих концентраций реагирующих веществ:
20
studfile.net
1.2. Понятие о скорости химической реакции
Любая реакция представляет собой результат совокупности элементарных актов, т.е. одновременных взаимодействий между несколькими частицами, при которых получаются продукты реакций. Продукты могут получаться за один или несколько последовательных элементарных актов (стадий).
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций).
Все способы выражения скорости реакции сводятся к изменению коли-чества вещества во времени. Для гетерогенных реакций скорость определяется
выражением v= Δn/(SΔτ), где Δnизменение количества вещества,Sплощадь поверхности раздела фаз, Δτпромежуток времени; для гомогенных
v= Δn/(VΔτ), здесьVобъем реакционной системы.
В последнем уравнении отношение изменения количества вещества к объему представляет собой изменение его концентрации, поэтому скорость гомогенной реакции обычно характеризуют изменением концентрации (моль/л) какого-либо из реагирующих веществ или продуктов реакции за единицу времени ( обычно в минутах или секундах).
Пусть в некоторой реакции А + В = АВ нас интересует изменение концентрации вещества А во времени. В начальный момент времени, когда эта концентрация максимальна, скорость вовлечения этого вещества в реакцию будет наибольшей. С течением времени в единице объема системы число молекул вещества А будет становиться все меньше и меньше. В связи с этим будет уменьшаться и число соударений молекул А и В в единицу времени. Скорость реакции в результате этого будет постепенно понижаться.
В общем, концентрация вещества А в реакционной смеси будет падать по некоторой кривой КL(рис.2), а концентрация продукта реакции (АВ) будет возрастать по некоторой кривойMN(рис.3). На рис.2 и 3 на осях ординат отложены концентрации веществ А и АВ, а на осях абсцисс – время (τ) протекания реакции.

Рис.2. Изменение концентрации одного Рис.3. Изменение концентрации
из исходных веществ во времени продукта реакции во времени.
Из рисунка видно, что некоторым моментам времени τ1и τ2соответствуют концентрации веществ А и АВ, соответственно равные С1и С2(точкиf и gна рис.2 и точкиаивна рис.3).
Если за промежуток времени Δτ = τ2– τ1концентрация одного из веществ, участвующих в реакции, уменьшится на С2 – С1, то средняя скорость его расходования за указанный промежуток времени составит:
 (1.1)
(1.1)
Скорость реакции всегда является величиной положительной. Поэтому, для того, чтобы скорость имела положительное значение, при измерении убы-
вающей концентрации вещества в правой части уравнения (1.1) ставится знак
минуса.
Концентрация продукта реакции с течением времени будет возрастать (рис. 3). Тогда в правой части уравнения скорости знак минуса не ставят:
 (1.2)
(1.2)
Величина 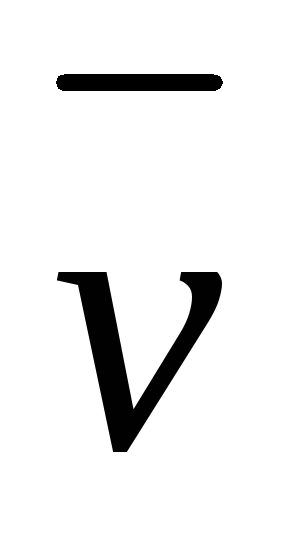 выражаетсреднюю скорость химического
процесса на некотором отрезке времени,
т.е. чем меньше величина Δτ и чем ближе
на кривойKLточкиm и n, тем средняя
скорость будет ближе к истинной. Если
брать изменение концентрации за
бесконечно малый промежуток времени,
то получим выражение дляистиннойскорости химической реакции в данный
момент времени. Истинная скорость
определяется пределом, к которому
стремится выражение
выражаетсреднюю скорость химического
процесса на некотором отрезке времени,
т.е. чем меньше величина Δτ и чем ближе
на кривойKLточкиm и n, тем средняя
скорость будет ближе к истинной. Если
брать изменение концентрации за
бесконечно малый промежуток времени,
то получим выражение дляистиннойскорости химической реакции в данный
момент времени. Истинная скорость
определяется пределом, к которому
стремится выражение при Δτ → 0.
при Δτ → 0.
Следовательно, истинная (мгновенная) скорость равна:
 (1.3)
(1.3)
Если замеряется изменение концентрации
одного из исходных веществ, то 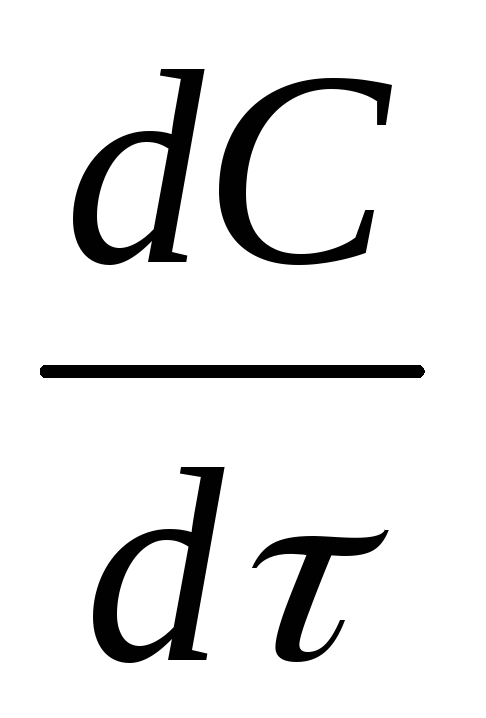 <0
(знак«–»),
если же одного из продуктов реакции, то
<0
(знак«–»),
если же одного из продуктов реакции, то >0
(знак «+»). Мгновенная скорость в каждый
момент времени равна тангенсу угла
наклона касательной в рассматриваемой
точке кривой (рис. 2 и 3):
>0
(знак «+»). Мгновенная скорость в каждый
момент времени равна тангенсу угла
наклона касательной в рассматриваемой
точке кривой (рис. 2 и 3):
 (1.4)
(1.4)
При практическом определении скорости химической реакции обычно измеряют ряд концентраций одного из реагирующих веществ в следующие друг за другом моменты времени.
Очевидно, что значение скорости реакции может быть получено по изменению концентрации любого компонента реакции, т.к. само стехиометрическое уравнение реакции показывает, что между концентрациями реагирующих веществ имеется простое соотношение.
Так, для реакции аА + вВ → сС + dDскорость можно вычислить
 (1.5)
(1.5)
Например, при изучении скорости образования воды из водорода и кислорода можно измерять или изменение концентрации водорода, или кислорода, или воды; при этом изменение концентрации водорода будет в два раза больше изменения концентрации кислорода, а изменение концентрации воды будет равно изменению концентрации водорода:
2H2 +O2 = 2H2O
Методы, с помощью которых определяют концентрации веществ, очень разнообразны и зависят от природы рассматриваемой реакции. За ее ходом можно следить, например, фиксируя изменение давления во времени, в других случаях можно регистрировать изменение во времени показателя преломления, вязкости, объема, плотности, интенсивности окраски, изменение температуры кипения или замерзания, электрической проводимости или вращения плоскости поляризации света (если продукты оптически активны).
Если соединения, образующиеся в ходе реакции, поглощают определенные излучения, то пользуются методами спектроскопии (в инфракрасной, видимой и ультрафиолетовой областях). Интенсивность поглощения зависит от концентрации соединений.
Если реакция протекает медленно, то можно воспользоваться методом отбора проб через определенные промежутки времени, измеряя процентный состав методами классического химического анализа или физико-химическими методами. Если реакция идет с большой скоростью, то для отбора пробы ее останавливают резким охлаждением, резким уменьшением концентрации, быстрым удалением катализатора или совместным действием указанных факторов.
studfile.net