Электродный потенциал — это… Что такое Электродный потенциал?
- Электродный потенциал
- разность электрических потенциалов между Электродом и находящимся с ним в контакте электролитом (См. Электролиты) (чаще всего между металлом и раствором электролита). Возникновение Э. п. обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина Э. п. в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически. Практическое значение имеют относительные Э. п., обычно называемые просто Э. п., представляющие собой разность Э. п. рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода (См. Водородный электрод)

,
где ν — стехиометрический коэффициент.
В случае, когда на электроде возможно одновременное протекание более одной электродной реакции, используется понятие стационарного Э. п. При пропускании электрического тока измеренный Э. п. будет отличаться от равновесного на величину поляризации (см. Поляризация электрохимическая).В. В. Городецкий.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Электродные процессы
- Электродоменная печь
Смотреть что такое «Электродный потенциал» в других словарях:
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — разность электрических потенциалов (напряжений) между электродом и находящимся с ним в контакте электролитом. Появление Э. п. вызвано образованием у поверхности электрода двойного электрического слоя. На практике используют значения так… … Большая политехническая энциклопедия
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — в электрохимии разность электрических потенциалов на границе фаз электрод электролит. На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарь
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, мера способности электрода вступать в реакцию. Электрод из элемента М, помещенный в раствор его ионов (М+), представляет собой ПОЛУЭЛЕМЕНТ. Теоретически в ходе реакций типа ММ++е между электродом и раствором всегда… … Научно-технический энциклопедический словарь
Электродный потенциал — мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов. Стандартные потенциалы электродов определяют относительно водородного электрода при определенных величинах температуры,… … Официальная терминология
электродный потенциал — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчика
электродный потенциал — [electrode potential] разность электрических потенциалов между электродами и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Практическое значение имеют относительные электродные потенциалы,… … Энциклопедический словарь по металлургии
электродный потенциал — 3.8 электродный потенциал: Мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов. Стандартные потенциалы электродов определяют относительно водородного электрода при определенных… … Словарь-справочник терминов нормативно-технической документации
Электродный потенциал — У этого термина существуют и другие значения, см. Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … Википедия
Электродный потенциал — Electrode potential Электродный потенциал. Потенциал электрода в электролизе измеренный относительно электрода сравнения. В электродный потенциал не входят потери противодействия потенциалу, как в растворе, так и внешней цепи. Он представляет… … Словарь металлургических терминов
электродный потенциал — elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Dydis, išreiškiamas potencialų skirtumu, susidarančiu tarp joninės terpės (elektrolito tirpalo ar lydalo) ir į ją įdėto elektrodo. atitikmenys: angl. electrode… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
электродный потенциал — elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Elektrodo potencialas kito kūno arba terpės, kurioje jis yra, atžvilgiu. atitikmenys: angl. electrode potential vok. Elektrodenpotential, n rus. потенциал электрода … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Электродный потенциал.
Одна из основных особенностей электрохимической системы состоит в пространственном разделении участников протекающей в ней реакции. Общая реакция распадается здесь на две частные реакции, каждая из которых совершается на отдельном электроде. В соответствии с этим ЭДС электрохимической системы также должен представлять собой сумму двух электродных потенциалов : Е = 1 + 2.
Скачок потенциала на границе электрод-раствор (как и разность потенциалов между двумя точками, находящимися в различных фазах) экспериментально измерить невозможно. Величина такого скачка потенциала может быть рассчитана теоретически, но лишь в том случае, если точно известно строение границы раздела двух фаз. Структура границы между электродом и раствором изучена до сих пор недостаточно.
Экспериментально можно измерить лишь общее значение Е цепи, т.е. только сумму электродных потенциалов. Для устранения неопределённости величин необходимо ввести дополнительное условие принять потенциал какого-либо электрода равным 0 и относить к нему значения потенциалов всех других электродов. В этом случае потенциалы электродов даются в некоторой условной шкале и их значения зависят от природы электрода, выбранного за основу шкалы.
Нернст предложил считать условным нулём потенциал водородного электрода при концентрации водородных ионов в растворе, равной 1, и давлении газообразного водорода 1 атм. Эта условная шкала потенциалов называется водородной шкалой. В настоящее время применяется главным образом условная водородная шкала, в которой при всех Т за ноль выбран потенциал стандартного водородного электрода. Она отличается от первоначальной водородной шкалы Нернста тем, что в ней вместо единичных концентраций и давления выбраны единичная активность и летучесть. Это условие позволяет определять потенциалы электродов в водородной шкале при любых Т, однако при каждой Т потенциал водородного электрода может быть иным, то есть условный нуль не будет одним и тем же при разных Т.
Т.о., электродным потенциалом электрода называется ЭДС элемента, составленного из этого электрода (справа) и стандартного водородного электрода (слева), например :
(+) Pt H2 H+, aq Zn2+ Zn ()
ЭДС этого элемента (Zn2+Zn) отрицательна (-0,763 В при активности ионов цинка в растворе, равной 1, это и есть стандартный электродный потенциал цинка). Чтобы найти электродный потенциал меди, нужно составить элемент:
() Pt H2 H+, aq Cu2+ Cu (+)
Здесь ЭДС цепи (Cu2+Cu) положительна (+0,337 В при активности ионов меди, равной 1, стандартный электродный потенциал меди).
Целесообразно в схеме полуэлемента записывать сочетание электрод + раствор иона в том порядке, который имеется в записи элемента, составленного из стандартного водородного электрода и данного; именно для записанного таким образом электрода следует приводить электродный потенциал с соответствующим знаком. При обратной записи следует изменить знак потенциала, например :
Zn2+, aq Zn ; = 0,763 B , (2) Zn Zn2+, aq ; = +0,763 B
Только первый тип записи приводит к тем знакам величин , которые соответствуют электродным потенциалам. Величины, соответствующие записи (2), не следует называть электродными потенциалами, но ими можно пользоваться при подсчете ЭДС цепи (для электродов, расположение которых в схеме цепи является обратным расположению их в сочетании с водородным электродом), например :
() Zn Zn2+, aq Cu2+, aq Cu (+)
+0,763 В +0,337 В
Е = 1 + 2 = 0,763 + 0,337 = 1,110 В
Диффузионный потенциал, возникающий на границе растворов ZnSO4CuSO4, усложняет расчет.
Диффузионный потенциал возникает на границе двух растворов, отличающихся друг от друга и качественно, и количественно. Причина его возникновения неодинаковая подвижность ионов электролита и наличие градиента их концентрации.
На границе двух растворов имеется некоторый переходный слой, где состав меняется от раствора I до раствора II и от раствора II до раствора I ; в этом переходном слое локализуется диффузионный потенциал. Ионы, обладающие большей подвижностью, диффундируют в более разбавленный раствор с большей скоростью, и поверхность соприкосновения двух растворов заряжается знаком этих ионов со стороны более разбавленного раствора и обратным знаком со стороны концентрированного. Образуется диффузный двойной электрический слой с соответствующим скачком потенциала. Возникающая разность потенциалов будет ускорять движение медленно движущегося иона и замедлять движение быстро движущегося, пока не наступит стационарное состояние, при котором скорости диффундирующих ионов сравняются. Дальнейшее взаимное удаление зарядов прекращается ; установившаяся в пограничном слое разность потенциалов и носит название диффузионного потенциала.
Диффузионный потенциал неравновесный. Точно его рассчитать в общем случае невозможно.
При измерениях невысокой точности можно существенно снизить диффузионный потенциал на границе двух растворов, включив между ними солевой мостик концентрированный электролит (насыщенный KCl или NH4NO3) с числами переноса ионов, близкими к 0,5. Резкое уменьшение диффузионного потенциала в этом случае связано с тем, что ионы концентрированного раствора проводят практически весь ток в зонах соприкосновения ; один диффузионный потенциал заменяется при введении солевого мостика двумя потенциалами меньшей величины, часто противоположными по знаку.
С этой же целью используется введение индифферентной соли во все растворы цепи.
Зависимость величины электродного потенциала от концентрации (активности) вещества в электролите может быть установлена методами термодинамики. На электроде Мn+М с равновесным потенциалом протекает электрохимическая реакция :
Мn+, aq + ne = М
Это реакция дегидратации иона металла и включения его в кристаллическую решетку.
Для равновесного процесса при постоянных Р и Т убыль изобарного потенциала равна максимальной полезной работе А работе электрического тока :
А = G = nF
При переходе 1 г-иона металла из раствора в электрод изменение изобарного потенциала равно разности химических потенциалов вещества в двух фазах : в растворе () и в электроде () :
G = + +
При Р,Т = const в электроде неизменного состава (чистый металл)
+ = +о = const
В растворе + = +о + RT ln a+
+о химический потенциал иона в растворе в стандартном состоянии; эта величина при заданной Т постоянна.
G = +o +o RT ln a+
Первый член правой части уравнения при постоянных Р и Т величина постоянная (для металлического электрода эта величина практически не зависит от давления). Можно обозначить ее символом о :
= о +
 ln
a+ (1)
ln
a+ (1)
В разбавленном растворе вместо активностей можно подставить концентрации (а+ m+ , c+ , N+) в зависимости от выбора меры концентрации и соответственно стандартного состояния для активности, например :
= о +
 ln m+ (2)
ln m+ (2)
Уравнение (2) было выведено Нернстом (1888) иным путем. Это уравнение, а также более общее уравнение (1) носит название уравнения электродного потенциала Нернста.
о это потенциал электрода относительно раствора с активностью соответствующих ионов, равной 1. Он называется стандартным электродным потенциалом и зависит от температуры.
Считая + и m+ m , для бинарного одно-одновалентного электролита (n = 1) имеем :
Подставляя значение F и переходя от натуральных логарифмов к десятичным, получаем для n = 1 и Т = 298 К :
= о + 0,0591 lg m
СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. Значение стандартного электродного потенциала не зависит от активностей участников электродной реакции и представляет собой константу, характерную для данного электрода. Стандартные потенциалы (табличные величины) отнесены к 25оС; их значения при других Т могут быть найдены по температурным коэффициентам, также сведенным в таблицу.
Стандартные потенциалы используются при решении многих проблем, связанных с химическим равновесием в растворах.
Любой электрод, расположенный ниже в ряду стандартных электродных потенциалов (т.е. более положительный), находится в более окисленном состоянии, чем электрод, расположенный выше (пример : элемент Даниэля-Якоби). Если из двух таких электродов составить электрохимическую систему, то на «нижнем» будет протекать реакция восстановления (Cu), а на «верхнем» реакция окисления (Zn). Процесс идет в том же направлении, если активные вещества обоих электродов находятся в непосредственном контакте друг с другом и реакция протекает по химическому пути. Равновесие в системе наступит в тот момент, когда потенциалы двух электродных реакций сделаются одинаковыми. Такое состояние достигается при определенном соотношении активностей участников реакции, отвечающем константе ее равновесия (примеры : системы Ce3+, Ce4+ и Fe2+, Fe3+ ; Fe2+, Fe3+ и Sn2+, Sn4+ ; ряд активности металлов).
studfile.net
Стандартный электродный потенциал — это… Что такое Стандартный электродный потенциал?
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0.036 В
Fe2+ + 2e− → Fe(тв) −0.44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
Основная статья: Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGo должна быть отрицательной, в соответствии со следующим уравнением:
- ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
- если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
- если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
См. также
- Таблица стандартных электродных потенциалов
- Восстановительный потенциал
- Абсолютный электродный потенциал
- Электрохимический потенциал
- Равновесный электродный потенциал
- Уравнение Нернста
- Электрохимическая ячейка
- Гальваническая ячейка
Литература
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
Ссылки
dic.academic.ru
Измерение электродных потенциалов
Абсолютное значение электродного потенциала непосредственно определить нельзя. Можно измерить лишь разность потенциалов, возникающую между двумя электродами, образующими замкнутую электрическую цепь:
Е = Е2– Е1
В связи с этим для практических целей применяют условную величину, характеризующую потенциал электрода относительно другого электрода взятого за стандарт (электрод сравнения). При этом потенциал электрода сравнения принимают равным 0. Тогда потенциал определяемого электрода будет равен измеренной Е (если Е определяемого электрода > Е электрода сравнения) или –Е (если Е определяемого электрода < Е электрода сравнения).
Обычно в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого принят равным нулю.
В одородный
электрод (рис. 89) представляет собой
специально обработанную платиновую
пластинку, которая опущена в раствор
кислоты (H2SO4илиHCl) с активностью ионов
Н+в нём равной 1 моль/дм3.
Через раствор с постоянной скоростью
про-
одородный
электрод (рис. 89) представляет собой
специально обработанную платиновую
пластинку, которая опущена в раствор
кислоты (H2SO4илиHCl) с активностью ионов
Н+в нём равной 1 моль/дм3.
Через раствор с постоянной скоростью
про-
Рис. 89. Водородный электрод: 1 – раствор Н2SO4; 2 – платиновая пластинка с проводом; 3 – сифон для соединения с другим электродом
пускается газообразный Н2под давлением 101,325 кПа. Молекулы Н2, адсорбируясь на поверхности платины, частично диссоциируют с образованием ионов Н+:
Н22Н++ 2ē,
которые могут обмениваться с аналогичными ионами, находящимися в растворе кислоты.
Таким образом водородный электрод подобен металлическому электроду первого рода. Его потенциал будет зависеть от концентрации ионов Н+в растворе кислоты.
Разность потенциалов, между металлом, погруженным в раствор своей соли с активностью ионов Men+ в нём равной 1 моль/дм3 и стандартным водородным электродом, измеренная при 298 K, называется стандартным или нормальным электродным потенциалом металла (Е0).
Если все металлы расположить последовательно по возрастающей величине их нормальных электродных потенциалов, то получится электрохимический ряд напряжений металлов или ряд их активности(табл.21).
Таблица 21. Электрохимический ряд напряжений металлов
Электрод | Электродная реакция | Е0, В | Электрод | Электродная реакция | Е0, В |
Li / Li+ | Li ↔ Li+ + ē | -3,045 | Cd / Cd2+ | Cd ↔ Cd2+ + 2ē | -0,403 |
K / K+ | K ↔ K+ + ē | -2,924 | Co / Co2+ | Co ↔ Co2+ + 2ē | -0,277 |
Ba / Ba2+ | Ba ↔ Ba2+ + 2ē | -2,900 | Ni / Ni2+ | Ni ↔ Ni2+ + 2ē | -0,250 |
Ca / Ca2+ | Ca ↔ Ca2+ + 2ē | -2,866 | Sn / Sn2+ | Sn ↔ Sn2+ + 2ē | -0,136 |
Na / Na+ | Na ↔ Na+ + ē | -2,714 | Pb / Pb2+ | Pb ↔ Pb2+ + 2ē | -0,126 |
Mg / Mg2+ | Mg ↔ Mg2+ + 2ē | -2,363 | Fe / Fe3+ | Fe ↔ Fe3+ + 3ē | -0,037 |
Al / Al3+ | Al ↔ Al3+ + 3ē | -1,663 | H2/2H+ | H2 ↔ 2H+ + 2ē | 0 |
Mn / Mn2+ | Mn ↔ Mn2+ + 2ē | -1,179 | Cu / Cu2+ | Cu ↔ Cu2+ + 2ē | 0,337 |
Cr / Cr2+ | Cr ↔ Cr2+ + 2ē | -0,913 | Ag / Ag+ | Ag ↔ Ag+ + ē | 0,799 |
Zn / Zn2+ | Zn ↔ Zn2+ + 2ē | -0,763 | Hg / Hg2+ | Hg ↔ Hg2+ + 2ē | 0,850 |
Cr / Cr3+ | Cr ↔ Cr3+ + 3ē | -0,744 | Pt / Pt2+ | Pt ↔ Pt2+ + 2ē | 1,188 |
Fe / Fe2+ | Fe ↔ Fe2+ + 2ē | -0,440 | Au / Au3+ | Au ↔ Au3+ + 3ē | 1,498 |
В этой таблице каждый электрод обозначен символом элемента, из которого он состоит, и соответствующего его катиона. Вертикальная черта изображает поверхность раздела двух фаз, где происходит скачок потенциала.
Значение нормального электродного потенциала количественно характеризует способность металла отдавать электроны, т.е. его восстановительные свойства.
В электрохимическом ряду напряжений восстановительная активность металлов в водных растворах уменьшается с ростом их нормального электродного потенциала. Металлы, стоящие в начале ряда, легко отдают свои валентные электроды и превращаются в положительно заряженные ионы. Металлы, стоящие в конце ряда, делают это с трудом.
Зная стандартный электродный потенциал металла, можно рассчитать по уравнению Нернста его электродный потенциал при любой концентрации или активности ионов Men+в растворе.
Следует отметить, что подготовка водородного электрода к работе сопряжена со значительными трудностями. Давление, под которым подаётся газообразным Н2к платиновой пластинке должно быть постоянным и равным 101,325 кПа. Кроме того, не должна изменяться и скорость подвода газа. Сам водород должен быть совершенно чистым, так как уже весьма малые количества примесей (особенноH2SиAsH3), «отравляют поверхность платины и тем самым препятствуют установлению равновесия
Н22Н++ 2ē
Получение Н2высокой степени чистоты связано со значительным усложнением аппаратуры и самого процесса работы. Поэтому на практике в качестве электродов сравнения часто используют каломельный или хлорсеребряный электроды. Они более компактные, обладают устойчивым потенциалом, мало зависящим от внешних условий.
Их стандартные электродные потенциалы определяют относительно водородного электрода.
При использовании насыщенного раствора KCl:
 =
0,222 B(222 мV),
=
0,222 B(222 мV), =
0,242B(242 мV)
=
0,242B(242 мV)
Особенно удобным является хлорсеребряный электрод, т.к. его составные части в отличие от каломельного электрода не являются токсичными и не требуют специальных мер предосторожности в работе.
studfile.net
Электродный потенциал — это… Что такое Электродный потенциал?
У этого термина существуют и другие значения, см. Потенциал.Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Измерение потенциалов
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Способы устранения омической составляющей при измерении
 Трёхэлектродная схема
Трёхэлектродная схема- Компенсационная схема
- Трёхэлектродная схема
См. также
dic.academic.ru
Факторы, от которых зависит величина электродного потенциала
Как отмечалось выше, знак и величина потенциала зависят от положения равновесия между металлом и раствором. Электродный потенциал зависит от следующих основных факторов:
От природы металла. Чем большей химической активностью обладает данный металл, т. е. чем легче он растворяется, тем в большей степени равновесие смещено вправо – тем отрицательнее потенциал.
От концентрации ионов металла в растворе. Переход ионов металла в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие смещается влево, и потенциал становится более положительным.
От температуры. С повышением температуры потенциал становится более положительным, т. е. равновесие смещается влево. Чтобы понять причины этого эффекта, необходимо учесть, что переход ионов в раствор связан с гидратацией, а гидратация – процесс экзотермический (действие принципа Ле Шателье).
Зависимость величины потенциала от указанных факторов выражается уравнением Нернста:
Е Men+/ Me = Е°Me n+/ Me+  ln a Me n+ (2.1)
ln a Me n+ (2.1)
Для разбавленных растворов a Me n+= [Ме n+], тогда:
Е Me n+/ Me = Е°Men+/ Me+  ln [Ме n+]
(2.2)
ln [Ме n+]
(2.2)
где a Me n+ – активность ионов металла в растворе, моль/л;
[Ме n+] – концентрация ионов металла, моль/л;
E Me / Men+ – электродный потенциал металла в растворе, содержащем катионы Ме n+, В;
E° Me / Men+ – стандартный электродный потенциал, В;
R – универсальная газовая постоянная, равная 8,314 Дж/моль∙К;
Т – температура по шкале Кельвина;
F – постоянная Фарадея, равная 96500 Кл/моль;
n – число электронов, участвующих в электродном процессе для одного атома металла (или заряд иона металла).
Если в уравнение (2.2) подставить численные значения постоянных R и F, принять температуру равной 298 К (25°С) и перейти от натурального логарифма к десятичному (коэффициент перехода равен 2,3), то получим:
Е Me n+/
Me = Е°Me n+/
Me+  lg [Ме n+]
(2.3)
lg [Ме n+]
(2.3)
Из уравнения (2.3) следует:
стандартный электродный потенциал E° – это потенциал электрода при стандартных условиях: [Ме n+] = 1 моль/л, Т =298 К, Р = 101кПа.
Величина E° характеризует химическую активность металла: чем активнее металл, тем отрицательнее его стандартный потенциал.
Измерение электродных потенциалов Ряд напряжений металлов
Измерить абсолютную величину электродного потенциала невозможно, а можно измерить только разность потенциалов между двумя электродами. Для определения электродного потенциала нужно составить гальванический элемент из исследуемого и стандартного водородного электродов и измерить его напряжение. Поскольку стандартный водородный электрод является эталоном, потенциал которого условно равен нулю:
E°2H+/H2= 0 В
то, измеренное напряжение будет представлять собою потенциал данного электродного процесса.
Тогда потенциал водородного электрода:
E2H+/H2= 0,059 1g а H+ = -0,059 рН (2.4)
Стандартный потенциал водородного электрода — это потенциал при температуре 298 К, давлении водорода 1,01·105Па и активности ионов водорода в растворе 1 моль/л.
По отношению к стандартному водородному электроду выражают потенциалы всех других электродов.
Если измерить стандартные электродные потенциалы различных металлов по отношению к потенциалу стандартного водородного электрода и расположить их в порядке увеличения, получим электрохимический ряд стандартных электродных потенциалов (ряд напряжений) металлов (см. приложение В):
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pt, Au
В этом ряду слева направо происходит уменьшение химической активности металлов. Положение металлов в ряду напряжений позволяет предсказать возможность самопроизвольного протекания реакции.
Самопроизвольно могут протекать те реакции, в которых восстановитель имеет более электроотрицательный потенциал, чем окислитель.
Чем меньше стандартный электродный потенциал металла, тем более сильным восстановителем он является, и тем слабее выражены окислительные свойства его ионов. И наоборот.
Таким образом, в ряду напряжений:
все металлы, имеющие отрицательный стандартный электродный потенциал (т.е. стоящие в ряду напряжений до водорода), могут вытеснять (восстанавливать) водород из растворов кислот;
металлы, имеющие низкий стандартный электродный потенциал (от начала ряда по магний включительно), вытесняют водород из воды;
каждый металл может вытеснять (восстанавливать) из растворов солей те металлы, которые имеют больший стандартный электродный потенциал (стоят в ряду напряжений после него).
Кроме того, ряд напряжений используют:
для выбора материала электродов при разработке гальванических элементов и аккумуляторов;
для выбора материала металлопокрытия (катодного или анодного), наносимого на металл, с целью защиты от коррозии;
при конструировании машин, механизмов, металлоконструкций для исключения контакта металлов с большой разницей электродных потенциалов;
для определения последовательности разряда ионов металлов при электролизе.
studfile.net
|
|
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ,
разность
электростатич. потенциалов между электродом и находящимся с ним в контакте
электролитом. Возникновение электродного потенциала обусловлено пространств. разделением
зарядов противоположного знака на границе раздела фаз и образованием
двойного
электрического слоя. На границе между металлич. электродом и р-ром
электролита пространств. разделение зарядов связано со след. явлениями:
переносом ионов из металла в р-р в ходе установления электрохим. равновесия,
кулоновской адсорбцией ионов из р-ра на пов-сть металла, смещением электронного
газа за пределы положительно заряженного ионного остова кристаллич. решетки,
специфич. (некулоновской) адсорбцией ионов или полярных молекул р-рителя
на электроде и др. Последние два явления приводят к тому, что электродный потенциал не
равен нулю даже при условиях, когда заряд пов-сти металла равен нулю (см.
Потенциал
нулевого заряда).
Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих электродный потенциал, равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение электродного потенциала наз. стандартным (обозначение E°). Оно связано со стандартным изменением энергии Гиббса и константой равновесия Кр электрохим. р-ции ур-нием: , где F — число Фарадея; п — число электронов, участвующих в р-ции; R — газовая постоянная; Т — абс. т-ра. Значения E° электрохим. систем по отношению к водородному электроду и протекающие на электродах р-ции сведены в спец. таблицы (подробнее см. Стандартный потенциал). Зависимость электродного потенциала от термодинамич. активностей ai участников электрохим. р-ции выражается Нернста уравнением: где vi — стехиометрич.
коэф. участника р-ции, причем для исходных в-в это отрицат. величина, а
для продуктов р-ции -положительная.
Лит.: Корыта И., Дворжак И., Богачкова В., Электрохимия, пер. с чеш., М., 1977; Антропов Л. И., Теоретическая электрохимия, 4 изд., М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия, М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988; Практикум по электрохимии, под ред. Б. Б. Дамаскина, М., 1991. О. А. Петрий.
|
www.xumuk.ru
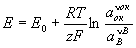
 ln
a+ (1)
ln
a+ (1)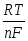 ln m+ (2)
ln m+ (2)