Электродный потенциал — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 мая 2017; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 мая 2017; проверки требуют 3 правки. У этого термина существуют и другие значения, см. Потенциал.Электро́дный потенциа́л — ЭДС элемента, составленного из данного электрода и стандартного водородного электрода, электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как «разность потенциалов на границе электрод – раствор», т.е. считают его тождественным потенциалу ЭДС, что не вполне правильно (хотя эти величины взаимосвязаны)..
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Способы устранения омической составляющей при измерении[править | править код]
 Трёхэлектродная схема
Трёхэлектродная схема- Компенсационная схема
- Трёхэлектродная схема
Стандартный электродный потенциал — Википедия
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Вычисление стандартных электродных потенциалов[править | править код]
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал принят равным 0,00 В, и любой электрод, для которого электродный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
Fe3+ + 3e− → Fe(тв) −0,036 В
Fe2+ + 2e− → Fe(тв) −0,44 В
Для получения третьего уравнения:
Fe3+ + e− → Fe2+ (+0,77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.[источник не указан 369 дней
Таблица стандартных электродных потенциалов[править | править код]
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔG o должна быть отрицательной в соответствии со следующим уравнением:
- ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
- если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
- если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Стандартные электродные потенциалы даны при стандартных условиях. Однако реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
E=E0+RTnFlnaOxaRed{\displaystyle E=E^{0}+{\frac {RT}{nF}}\ln {\frac {a_{\rm {Ox}}}{a_{\rm {Red}}}}}
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
Водородный электрод. Измерение электродных потенциалов. Стандартные электродные потенциалы.
Абсолютное значение электродных потенциалов измерить невозможно, поэтому измеряют ЭДС цепи, состоящей из исследуемого электрода и электрода сравнения.
Для водных растворов в качестве стандартного электрода сравнения обычно используют водородный электрод, потенциал которого при давлении водорода 0,101 МПа и термодинамической активности ионов водорода в растворе, равной единице, принимают условно равным нулю.
Водородный электрод представляет собой платиновую пластину, покрытую платиновой чернью. Пластинка опущена в раствор серной кислоты с концентрацией 1 моль/л и омывается струей газообразного водорода (рис. 29).

Рис. 29. Устройство водородного электрода.
При измерении электродных потенциалов возможны два случая. Если металл является активным, например Zn, то происходит процесс окисления металла (анодный процесс)
анодный процесс: Zn – 2e = Zn2+;
Водород в этом случае является катодом.
катодный процесс: 2H + 2e = H2 .
(А) Zn|ZnSO4 ||H2SO4|Pt(H2) (K)
E = EK – EA > 0, если EK = 0 EA < 0, т. е. потенциалы активных металлов имеют отрицательные значения.
2). Предположим, что исследуемый металл неактивен, например медь. Тогда происходит процесс окисления водорода – анодный процесс. Водородный электрод в этом случае будет являться анодом.
(А) Pt(H2)|H2SO4 ||CuSO4 |Cu (K)
анодный процесс: H2 – 2e = 2H+;
катодный процесс: Cu2++ 2e = Cu0.
E = EK – EА > 0, если EA = 0 EК > 0, т. е. потенциалы неактивных металлов имеют положительные значения.
Таким образом, составляется ряд напряжения металлов. Значения электродных потенциалов относительно водородного потенциала выводятся в таблицу.
Стандартный электродный потенциал – это потенциал данного электродного процесса, измеренный при стандартных условиях, т. е. концентрации ионов, участвующих в реакции составляет 1 моль/л, давление газов – 101325Па, Т = 298 К
Стандартные электродные потенциалы обозначаются так: E[B].
УРАВНЕНИЕ НЕРНСТА.
Значения электродных потенциалов зависят от природы металла, от концентрации веществ, участвующих в процессе и от температуры системы. Эта зависимость выражается уравнением Нернста:
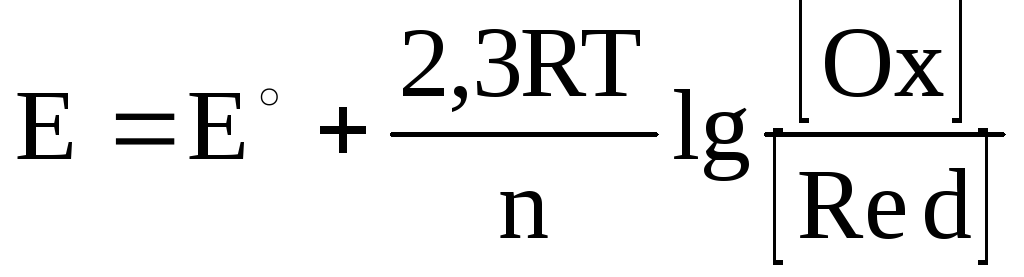
где: Е – стандартный электродный потенциал;
R –
универсальная газовая постоянная
≈ 8,314 ;
;
Т – абсолютная температура;
n – число электронов, участвующих в окислительно-восстановительном процессе.
[Ox] – концентрация ионов в окисленной форме;
[Red] – концентрация ионов в восстановленной форме.
При подстановке
постоянных уравнение принимает вид:  .
.
Для полуреакции окисления металла:
Me° – ne = Men+
Red Ox
.
Насколько же концентрация влияет на потенциал? Например, в медно-цинковом электроде, где анодом является цинк:
(А) Zn|ZnSO4|CuSO4|Cu (К) E0 = 0,34 – (–0,76) = 1,1B.
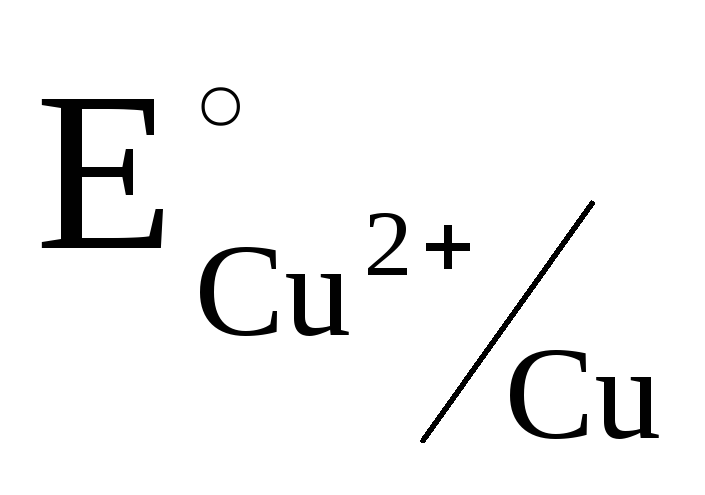 =
+ 0,34B;
=
+ 0,34B; 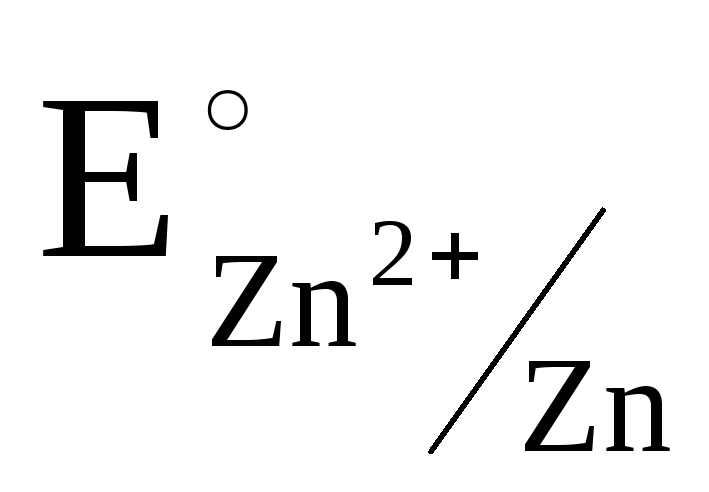 = – 0,76B;
= – 0,76B;
Пусть [ZnSO4] = 0,1 М; [CuSO4] = 0,01 M, тогда
ЭДС
= ЕK – EA=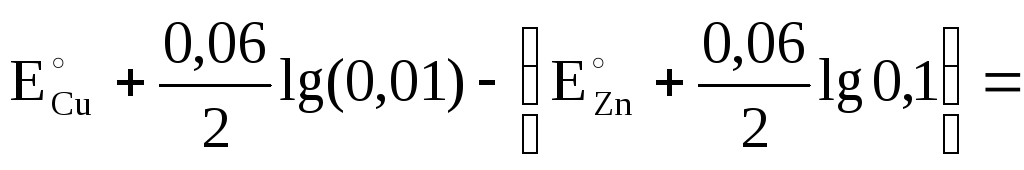 0,34
+0,3∙2 + 0,76 +0,03 =1,07 В.
0,34
+0,3∙2 + 0,76 +0,03 =1,07 В.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ ВОДОРОДНОГО ЭЛЕКТРОДА.
2H+ + 2e = H2
Ox Red
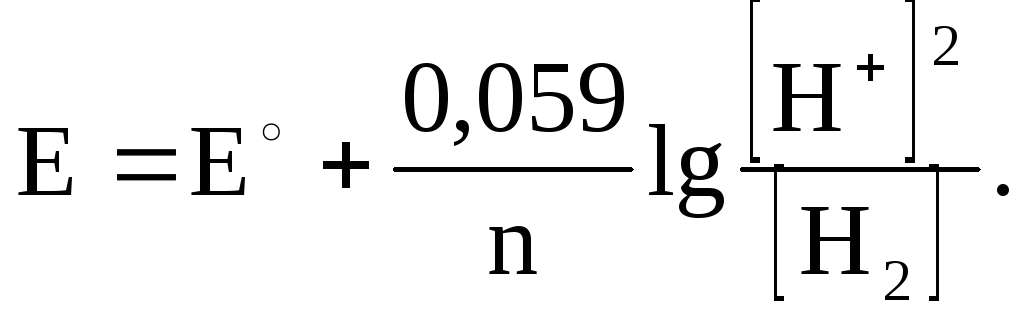 Если мы имеем дело
с газами, то заменяем концентрацию
парциальным давлением (P(H2)
= 1атм.).
Если мы имеем дело
с газами, то заменяем концентрацию
парциальным давлением (P(H2)
= 1атм.).
E = E° + 0,059 lg[H+]; Е° = 0; Е = 0,059 lg[H+] или Е = -0,059рН
В нейтральной среде: [H+] = 10–7; Е = – 0,41В.
КЛАССИФИКАЦИЯ ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМ.
Электрохимические системы могут быть равновесными и неравновесными. Равновесные — это системы, в которых возникновение электрического тока происходит за счет протекания химических реакций(гальванический элемент).
Неравновесные — в них превращения происходят за счет подвода из вне электрического тока (электролизер).
Тема 1. Электродные потенциалы. Электродвижущие силы
Рассматриваемые вопросы:
Электродные потенциалы и механизм их возникновения.
Водородный электрод. Стандартные электродные потенциалы металлов. Ряд стандартных электродных потенциалов.
Принцип действия и электродвижущие силы гальванического элемента.
Для определения направления и полноты протекания окислительно-восстановительных реакций между окислительно-восстановительными системами в водных растворах используются значения электродных потенциалов этих систем.
Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией.
К электрохимическим относятся явления, возникающие на границе двух фаз с участием заряженных частиц (ионов и электронов), например, при погружении металлической пластинки в воду.
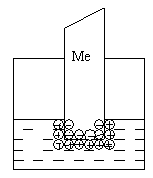
Для всех металлов характерно свойство в большей или меньшей степени растворяться в воде
. При этом в воду переходят положительно заряженные ионы металла, в результате чего пластинка (из-за появления в ней избыточных электронов) заряжается отрицательно. Гидратированные катионы металла скапливаются возле поверхности пластинки на границе раздела двух фаз (металл-раствор). Возникает двойной электрический слой, характеризующийся некоторой разностью электростатических потенциалов. Как известно, энергию, которую необходимо затратить (положительный потенциал) или которую можно получить (отрицательный потенциал) при переносе единицы электричества из бесконечности в данную точку, называют электрическим потенциалом. Между пластинкой и раствором устанавливается окислительно-восстановительное равновесие: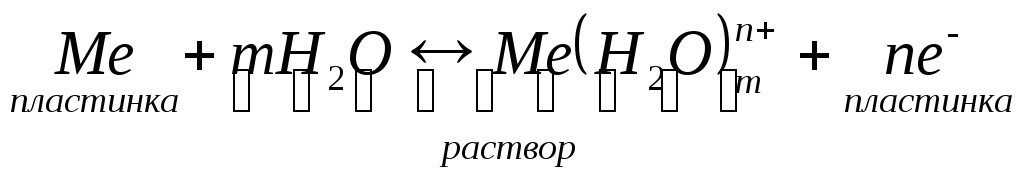 .(9.1)
.(9.1)
При погружении металла в раствор его соли также возникает двойной
электрический слой, но в этом случае возможны два механизма его образования. Если
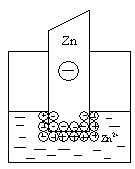
В том случае, когда концентрация катионов металла в растворе велика или металл малоактивный, равновесие указанного процесса сдвигается влево и металлическая пластинка заряжается положительно:
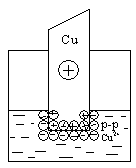
В любом случае на границе раздела двух фаз образуется двойной электрический слой. Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой, называется электродным потенциалом Е. Потенциалу металла приписывается тот знак, который возникает на его поверхности в двойном электрическом слое.
Пластинка металла и раствор его соли (т.е. катионы этого металла) вместе составляют единую окислительно-восстановительную систему, характеризующуюся определенным электродным потенциалом, который зависит от природы металла, концентрации его ионов в растворе, от температуры и рН среды.
При определении скачка потенциала в окислительно-восстановительных системах, не содержащих твердой фазы (например, MnO4—/Mn2+ или Cr2O72-/Cr3+), используют инертные электроды (благородные металлы, графит). В этом случае инертные электроды, адсорбируя из раствора молекулы, атомы или ионы, играют роль твердой фазы, обеспечивающей возникновение скачка потенциалов на межфазной границе.
Экспериментально определить абсолютное
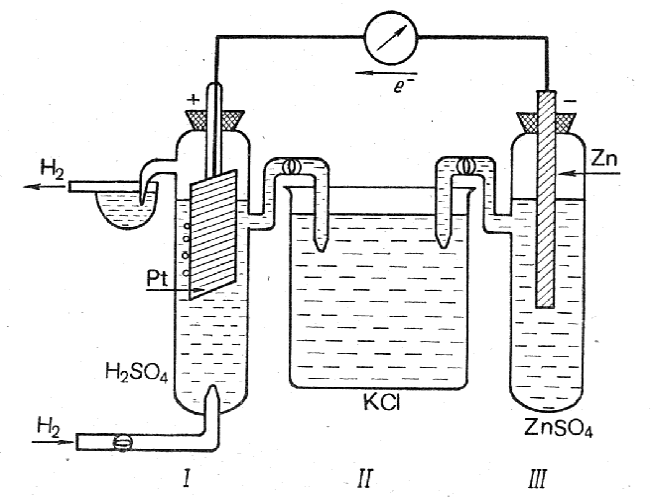 ой.
ой.Рис.9.1 Гальваническая цепь для измерения электродного потенциала:
I – водородный электрод, II – солевой мостик, III – измеряемый электрод.
Таким образом, поверхность платинового электрода фактически насыщена водородом, в результате чего в системе устанавливается равновесие:
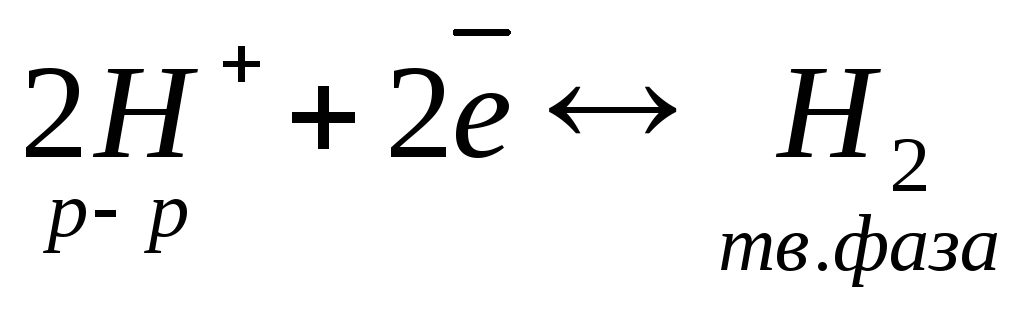 , (9.2)
, (9.2)
которое характеризуется
определенным значением скачка потенциала
на межфазной границе. Электродный
потенциал, отвечающий данным условиям,
получил название стандартного
водородного потенциала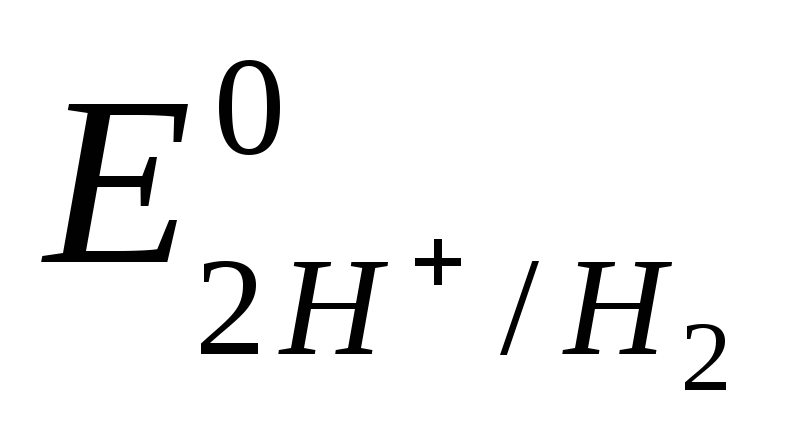 ,
а его численное значение условно приняторавным нулю. Потенциал водородного
электрода воспроизводится с очень
высокой точностью.
,
а его численное значение условно приняторавным нулю. Потенциал водородного
электрода воспроизводится с очень
высокой точностью.
Сочетая электрод, представляющий исследуемую окислительно-восстановительную систему, со стандартным водородным электродом, определяют электродный потенциал Е данной системы. Для того, чтобы можно было сравнивать окислительно-восстановительные свойства различных систем по их электродным потенциалам, необходимо, чтобы последние также были измерены при стандартных условиях. Таковыми обычно являются концентрация ионов, равная 1 моль/л, давление газообразных веществ 101,325 кПа и температура 298,15 К. Потенциалы, измеренные в таких условиях, носят название стандартных электродных потенциалови обозначаютсяЕо. Они часто называются такжеокислительно-восстановительнымиилиредокс-потенциалами, представляя собой разность между редокс-потенциалом системы при стандартных условиях и потенциалом стандартного водородного электрода.
Знак конкретного Еосоответствует заряду электрода по отношению к стандартному водородному электроду.
Стандартный электродный потенциал– это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице.
Стандартные электродные потенциалы окислительно-восстановительных систем приводятся в справочной литературе. Эти системы записаны в форме уравнений полуреакций восстановления, в левой части которых находятся атомы, ионы или молекулы, принимающие электроны (окисленная форма):
Ox+n =Red. (9.3)
=Red. (9.3)
Эти системы в таблицах расположены в порядке возрастания величин их потенциалов, что соответствует падению восстановительной и росту окислительной активности. Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом.
Выделяя из этого ряда окислительно-восстановительные системы типа Меn+/Me и располагая их в порядке возрастания стандартных электродных потенциалов, получаютэлектрохимический ряд напряжений металлов:Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Электрохимический ряд напряжений характеризует свойства металлов в водных растворах:
чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов;
металлы, имеющие отрицательные электродные потенциалы, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот;
каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
При
условиях, отличающихся от стандартных,
численное значение равновесного
электродного потенциала для
окислительно-восстановительной системы,
записанной в форме 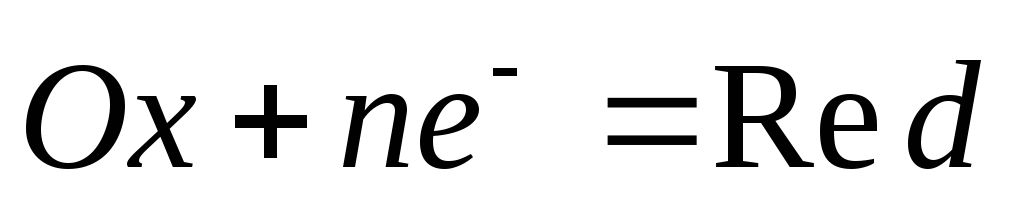 ,
определяется поуравнению Нернста:
,
определяется поуравнению Нернста:
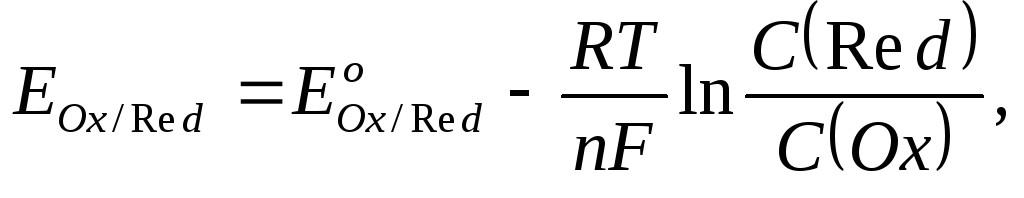 (9.4)
(9.4)
где  и
и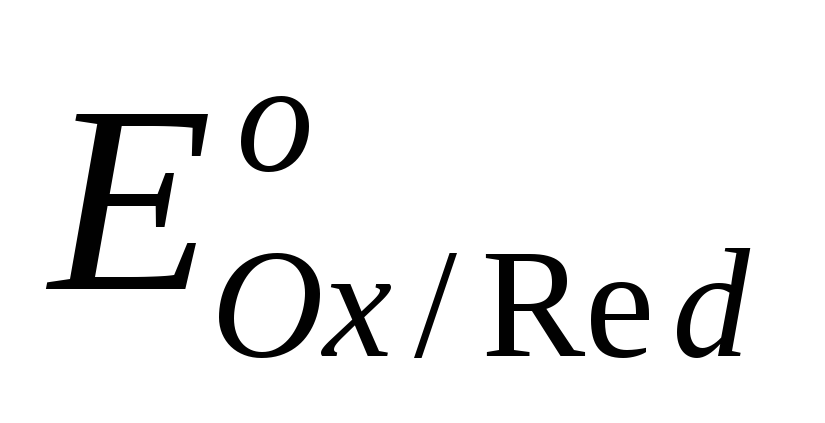 — соответственно электродный и стандартный
потенциалы системы; R – универсальная
газовая постоянная; Т – абсолютная
температура; F – постоянная Фарадея; n
– число электронов, участвующих в
окислительно-восстановительном процессе.
— соответственно электродный и стандартный
потенциалы системы; R – универсальная
газовая постоянная; Т – абсолютная
температура; F – постоянная Фарадея; n
– число электронов, участвующих в
окислительно-восстановительном процессе.
С(Red) и C(Ox) – молярные концентрации соответственно восстановленной и окисленной форм соединения.
 ,
когда C(Red) = C(Ox) = 1.
,
когда C(Red) = C(Ox) = 1.
При подстановке численных значенийR= 8,314 Дж/(мольК), F=96494 Кл и Т (298 К) и замене натуральных логарифмов на десятичные уравнение упрощается:
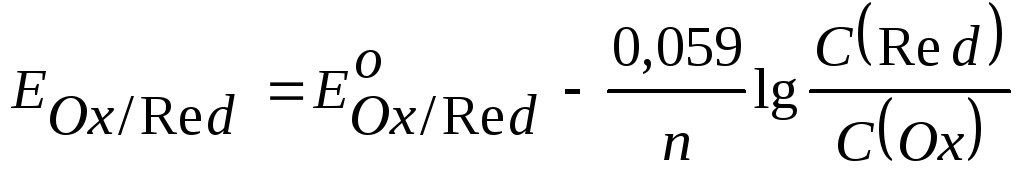 .
(9.5)
.
(9.5)
Например, для окислительно-восстановительной системы
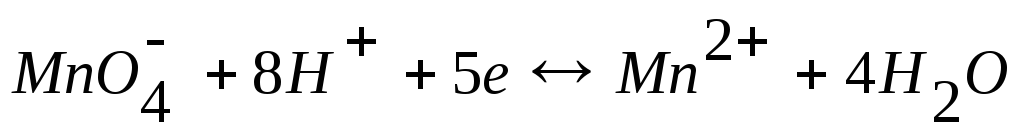
уравнение Нернста имеет вид
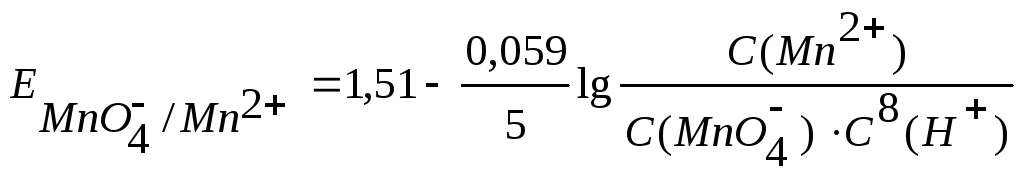 .
.
Ячейка для измерения электродного потенциала, например элемент Якоби-Даниэля, представляет собой пример электрохимического (гальванического) элемента– устройства, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Их называют такжехимическими источниками электрической энергии(ХИЭЭ).
Гальванический элемент
состоит из двух полуэлементов
(окислительно-восстановительных систем),
соединенных между собой металлическим
проводником и солевым мостиком. На
каждом полуэлементе (часто называемом
электродом) происходит полуреакция
(электродный процесс). Процесс окисления(отдача электронов) осуществляетсяна
аноде (отрицательный полюс), авосстановления(прием электронов)
–на катоде (положительный полюс).
Например, в представленном гальваническом
элементе анодом является цинковый
электрод: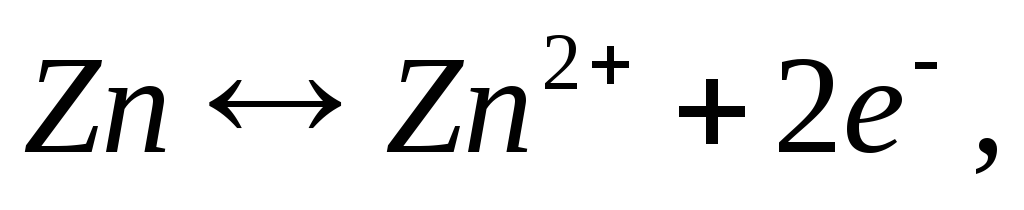
а катодом – водородный или медный электрод:
2Н++ 2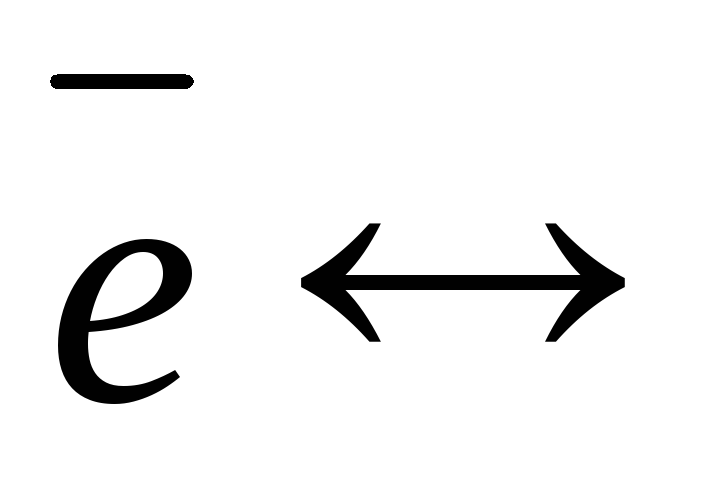 Н2
Н2

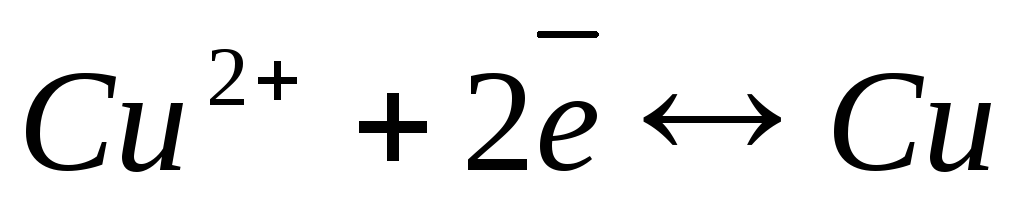 .
.
Электроны от анода по внешней цели протекают к катоду. Соответствующая схема такого гальванического элемента записывается следующим образом:
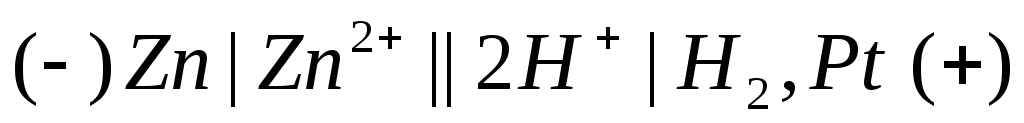 — водородный катод;
— водородный катод;
()
ZnZn2+  — медный катод.
— медный катод.
На схеме одна вертикальная линия изображает границу раздела фаз (элетрод-раствор), а две вертикальные линии – границу между растворами (на практике она обычно обеспечивается с помощью солевого мостика – U-образной трубки с раствором электролита, необходимого для замыкания цели между двумя электродами).
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов (э.д.с)двух окислительно-восстановительных систем, соединенных между собой. Э.д.с (Е) любого гальванического элемента определяется общей формулой:
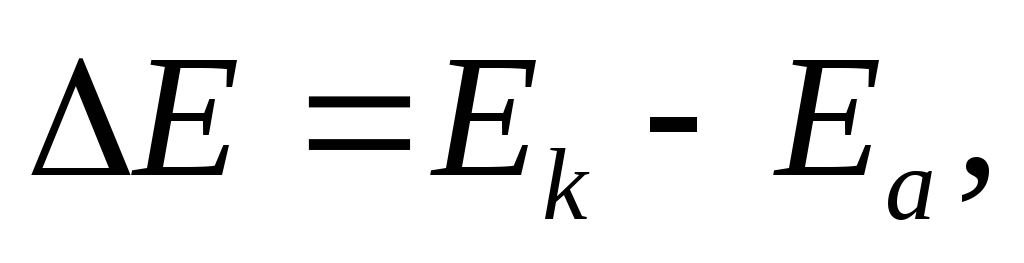
где Еки Еа– электродный потенциал соответственно на катоде и на аноде.
Так как  может иметь толькоположительное
значение, тоЕк > Еа,
т.е.катодом является электрод с более
высоким электродным потенциалом.
может иметь толькоположительное
значение, тоЕк > Еа,
т.е.катодом является электрод с более
высоким электродным потенциалом.
При таком осуществлении окислительно-восстановительной реакции ее энергия превращается в электрическую энергию, которую можно использовать, включив во внешнюю цель устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т.п.).
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление – на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи. Например, элемент Якоби-Даниэля:
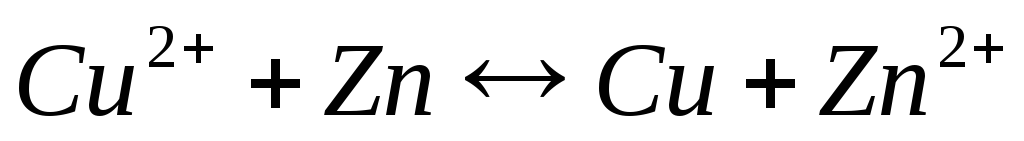 .
.
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако число реакций, практически используемых в химических источниках электрической энергии, невелико.
Все обычные ХИЭЭ не свободны от недостатков: стоимость веществ, необходимых для их работы (Pb, Cd и т.д.) высока; отношение количества энергии, которую может дать элемент, к его массе мало.
Протекание окислительно-восстановительных процессов в сильной степени зависит от различных условий, прежде всегоот природы реагирующих веществ, их концентрации, температуры и характера среды.
Так, концентрированная и разбавленная HNO3по-разному восстанавливаетсяпри взаимодействии с одним и тем же восстановителем:
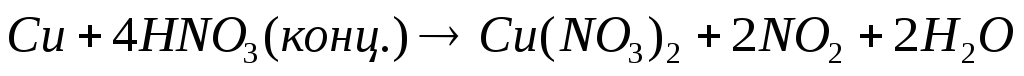 ;
;
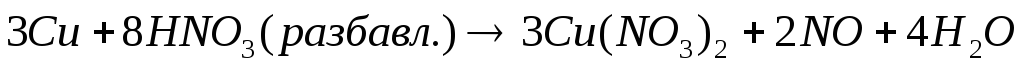 .
.
Классическим примером различия характера протекания реакций с одними и теми же окислителями и восстановителями является восстановление KМnO4в зависимости от реакции среды:
рН < 7 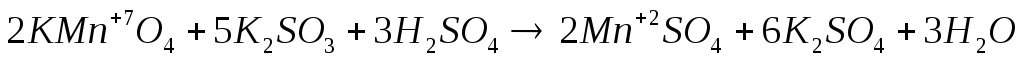
pH = 7 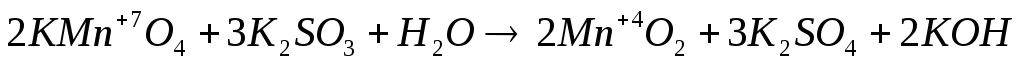
pH > 7 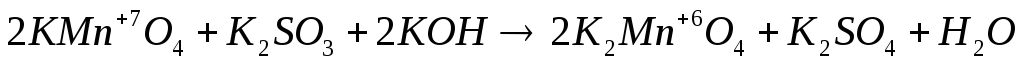
Как правило, для создания кислой среды используют относительно разбавленную Н2SO4(реже HCl). Щелочная среда обычно создается с помощью растворов КОН и NaОН.
Изменение величины электродного потенциала каждой из двух полуреакций суммарного окислительно-восстановительного процесса и даже смена его направления могут быть достигнуты также за счет изменения температуры:
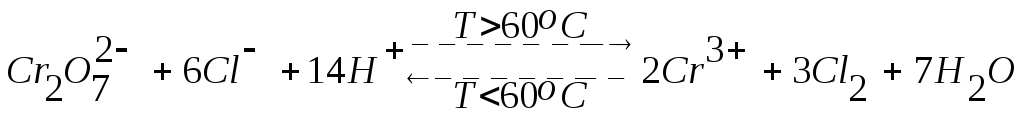 .
.
С помощью электродных потенциалов достаточно просто решается вопрос о составлении уравнений окислительно-восстановительных реакций, направлении и полноте их самопроизвольного протекания и т.п.
Как известно, термодинамическим условием самопроизвольного протекания химического процесса является отрицательное значение изменения изобарно-изотермического потенциала, т.е. G < 0. Взаимосвязь между этой термодинамической функцией и э.д.с. гальванического элемента, составленного из двух окислительно-восстановительных систем, выражается формулой;
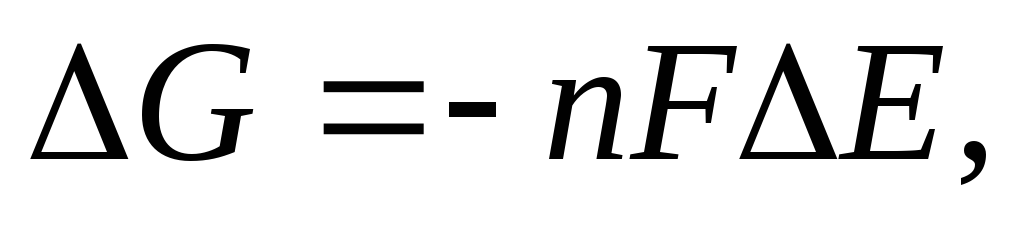
где n – число электронов, участвующих в суммарном окислительно-восстановительном процессе.
Из последнего выражения следует, что термодинамическим условием самопроизвольного протекания процесса в прямом направлении является положительное значение э.д.с(Е), когда система с более высоким значением электродного потенциала выступает в качестве окислителя, т.е. восстанавливается. Например, в гальваническом элементе, состоящем из двух электродов, характеризующихся следующими параметрами:

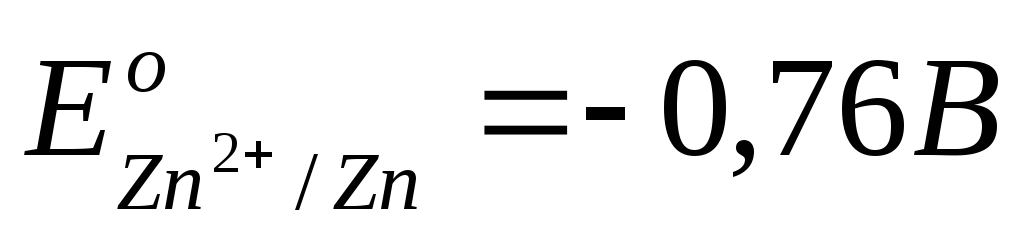
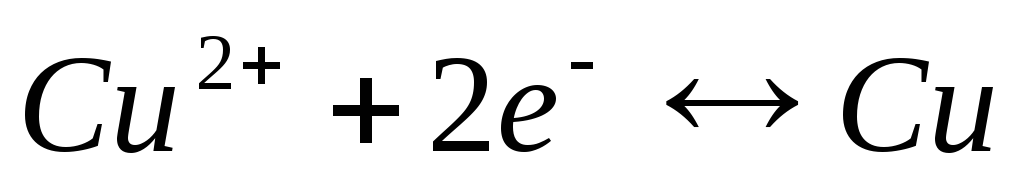
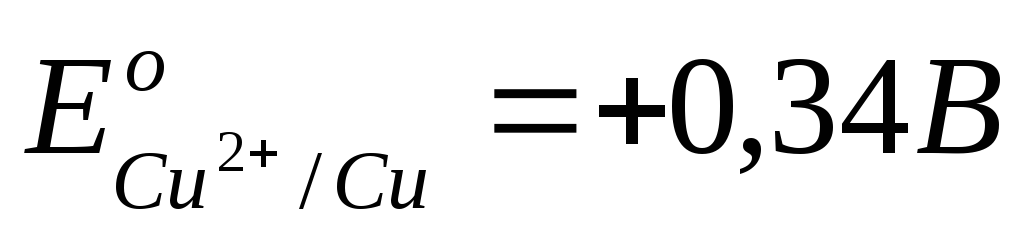
суммарный окислительно-восстановительный процесс самопроизвольно осуществляется при условии протекания восстановительной реакции только на медном электроде, а окислительной – на цинковом. Следовательно, в объединенном уравнении электродная реакция процесса с меньшим потенциалом записывается в обратном направлении, а процесса с большим потенциалом – в том виде, в каком она представлена в таблице, т.е. в форме процесса восстановления:

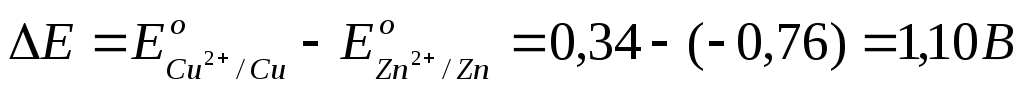 .
.
Если окислитель и восстановитель расположены достаточно далеко друг от друга в ряду стандартных электродных потенциалов, то направление окислительно-восстановительного процесса практически однозначно определяется их взаимным положением в этом ряду. При близких значениях Ео(разница меньше 0,3 В) необходимо учитывать, помимо рН среды и температуры, также концентрации реагирующих веществ, поскольку при изменении этих параметров процесса зачастую может изменяться и направление его протекания.
Применяя значение
Еоокислительно-восстановительной реакции,можно рассчитать ее константу
равновесия. Для суммарного процесса
типа уравнение Нернста (при 298,15 К) имеет вид
уравнение Нернста (при 298,15 К) имеет вид
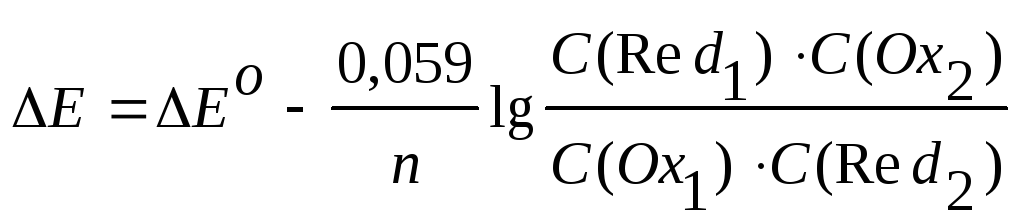 .
(9.6)
.
(9.6)
Отношение концентраций представляет собой выражение константы равновесия окислительно-восстановительного процесса:
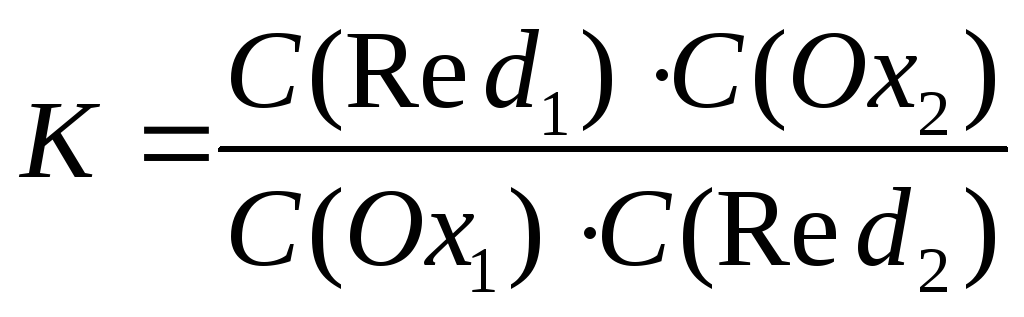
По мере протекания процесса концентрации Ох1и Red2уменьшаются, а Red1и Ох2 – увеличиваются, что приводит в результате к значениюЕ = 0 и, следовательно, кG = 0, характеризующему состояние равновесия:
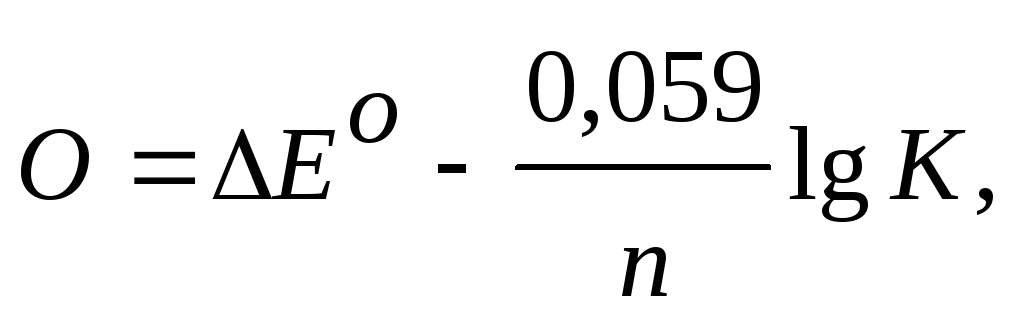 откуда К можно
рассчитать по выражению:
откуда К можно
рассчитать по выражению:
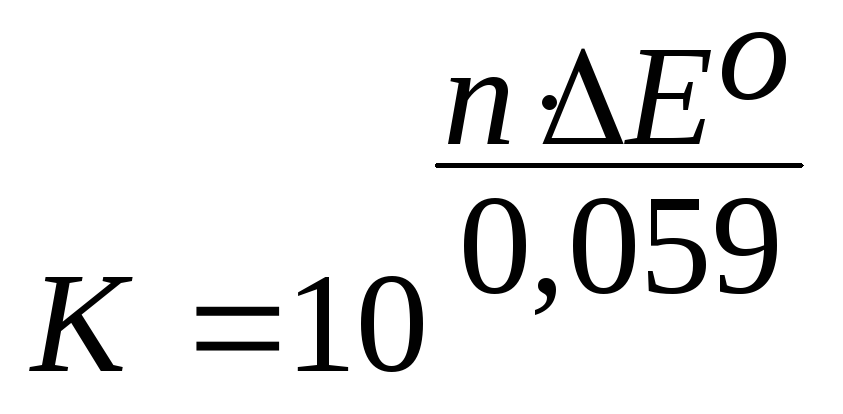 .
.
Литература
Глинка Н.Л. Общая химия. – Л.: Химия, 1978. – С. 270–290.
Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 142 – 155.
Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 75-81.
Электронные потенциалы и электродвижущие силы
При решении задач этого раздела см. табл. 8,
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Me
+ mH2O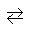
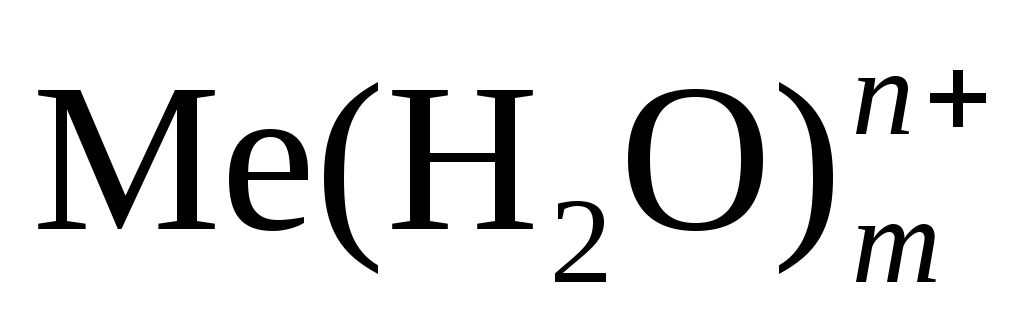 + ne–
+ ne–
в растворе на металле
где п – число электронов, принимающих участие в процессе. На границе металл – жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала – электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях – так называемые стандартные электродные потенциалы (Е°).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е° = 0; DG° = 0).
Располагая металлы в ряд по мере возрастания их t стандартных электродных потенциалов (E°), получаем так называемый ряд напряжений.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение E°, тем большими восстановительными способностями обладает данный металл в виде простого вещества, и тем меньшие окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае DG° < 0, так как DG° = = – nFE°.
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (табл. 8) . Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта – в растворе с концентрацией 0,1 моль/л?
Таблица 8.
Стандартные электродные потенциалы (e°) некоторых металлов (ряд напряжений)
Электрод | E°, В | Электрод | E°, В |
Li+/Li | -3,045 | Cd2+/Cd | -0,403 |
Rb+/Rb | -2,925 | Co2+/Co | -0,277 |
K+/K | -2,924 | Ni2+/Ni | -0,25 |
Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 |
Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
Na+/Na | -2,714 | 2H+/H2 | -0,000 |
Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 |
Mn2+/Mn | -1,18 | Hg2+2/2Hg | +0,79 |
V2+/V | -1,18 | Ag+/Ag | +0,80 |
Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 |
Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 |
Cr3+/Cr | -0,74 | Au3+/Au | +1,50 |
Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Решение. Электродный потенциал метала (E) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
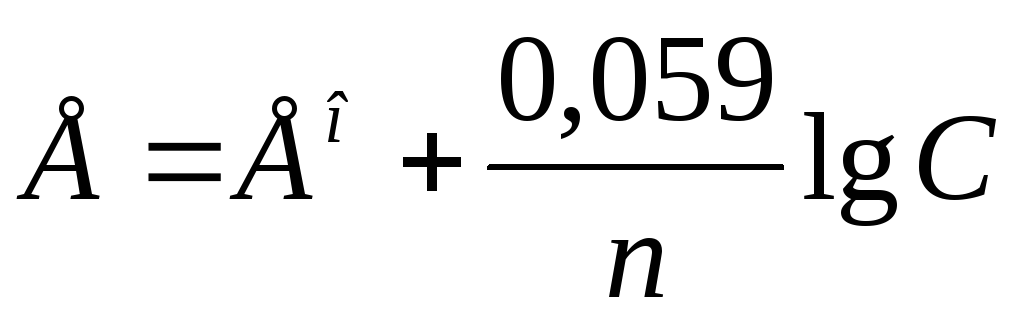 ,
,
где E° – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, моль/л; E° для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1):
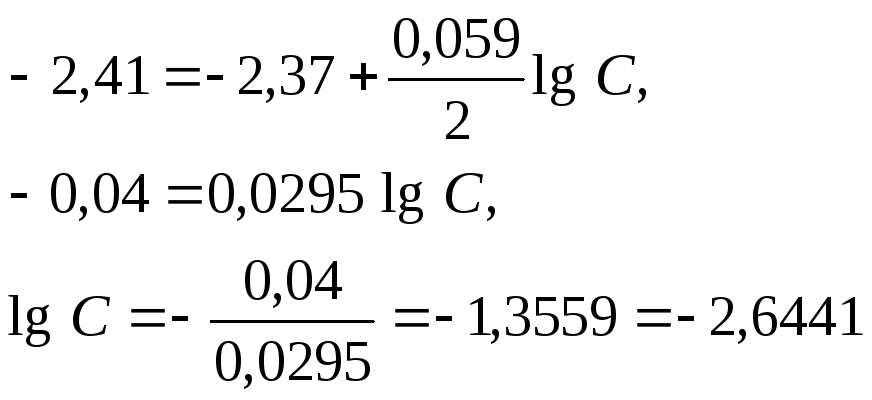
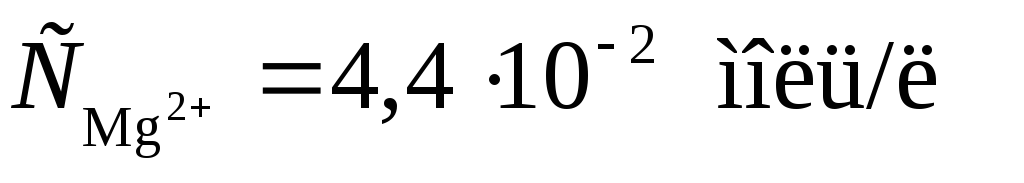 .
.
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(–) Mg |Mg2+| |Zn2+| Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (–2,37 в) и является анодом, на котором протекает окислительный процесс:
Mg0 – 2e– = Mg2+ (1)
Цинк, потенциал которого -0,763 В, – катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2++2е– = Zn0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg + Zn2+ = Mg2+ + Zn
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
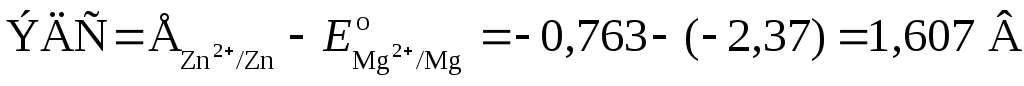 .
.
4.2. Электродные потенциалы металлических и газовых электродов
ЭДС элемента равна разности равновесных потенциалов положительного электрода (катода) и отрицательного электрода (анода). Если потенциал одного из электродов принять равным нулю, то относительный потенциал второго электрода будет равен ЭДС элемента. Таким образом, можно определить относительный потенциал любого электрода.
Стандартный водородный электрод. Равным нулю принят потенциал стандартного водородного электрода (Е02Н+/Н2 0,0В). Стандартный водородный электрод состоит из платиновой пластины, покрытой платиновой чернью (мелко раздробленной платиной), контактирующей с газообразным водородом под давлением 1атм и раствором серной кислоты, в котором активность ионов водорода Н+ равна единице (рис. 4.3).
В водородном электроде происходит реакция, аналогичная реакциям, протекающим на поверхности металлических электродов. Платина здесь играет только роль инертного проводника, а ее поверхностный слой адсорбирует (концентрирует) водород. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя на платине электроны.
При этом платина заряжается отрицательно, а раствор – положительно, Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода.
Равновесие на водородном электроде можно представить в виде
2Н+ + 2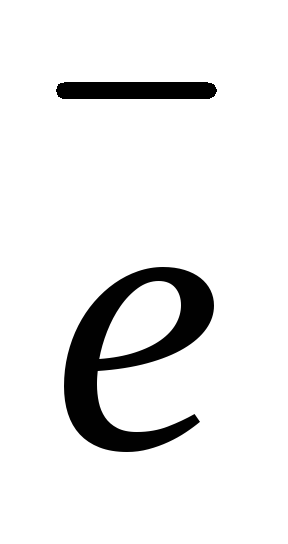
 Н2
Н2
Схематически водородный электрод обозначают 2Н+/Н2, где вертикальная черта обозначает поверхность раздела фаз.
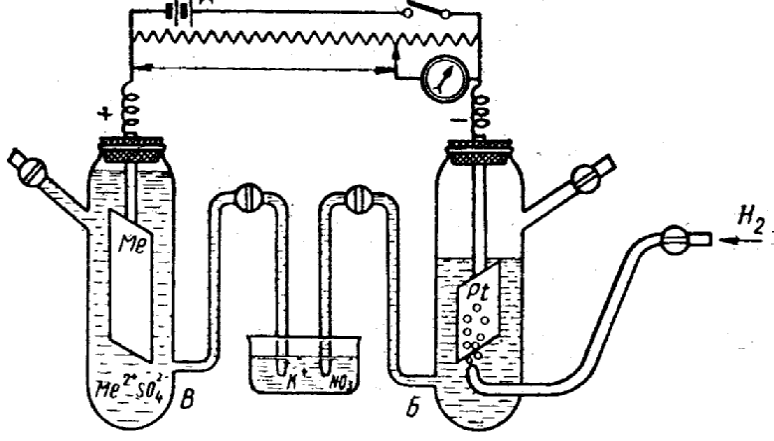
Рис. 4.3. Ячейка для измерения электродного потенциала металла:
а — аккумулятор; б – стандартный водородный
электрод; в–металлический электрод.
Потенциалы металлических электродов. При погружении металла в раствор, содержащий ионы этого металла, устанавливается равновесие:
Ме  Меn+ + n
Меn+ + n
При равновесии скорость растворения металла равна скорости разряда его ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом. Электродный потенциал металла определяют либо экспериментально компенсационным методом, либо вычисляют. Для его измерения составляется гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод:
(катод) Pt, H2/2H+II Men+/Me (анод)
р =
1 атм,aH+
=
1 атм,aH+ = 1 моль/л
= 1 моль/л
и
измеряется его электродвижущая сила
(ЭДС) в условиях обратимой работы
элемента (при отсутствии тока в цепи)
(рис. 4.3). Она равна разности равновесных
потенциалов катода и анода ЭДС = (│Ек— Еа│). Так как потенциал стандартного
водородного электрода равен нулю
(Е02Н /Н
/Н =0),
то ЭДС элемента будет равна потенциалу
измеряемого электрода.
=0),
то ЭДС элемента будет равна потенциалу
измеряемого электрода.
Для вычисления электродного потенциала применяют уравнение Нернста:

 +
+ 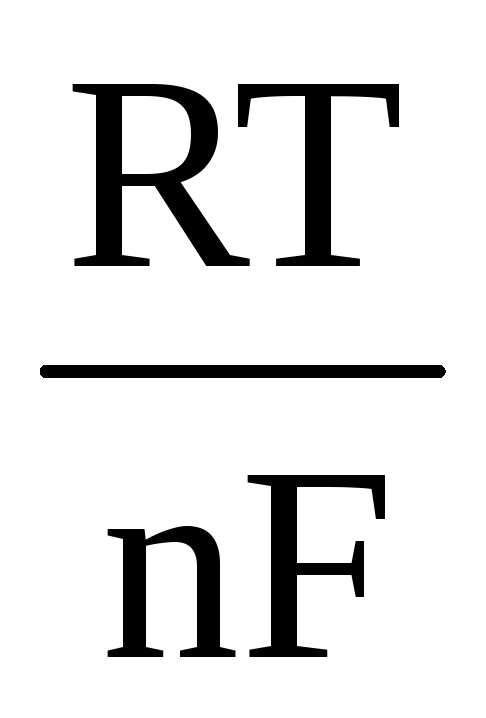 ln
ln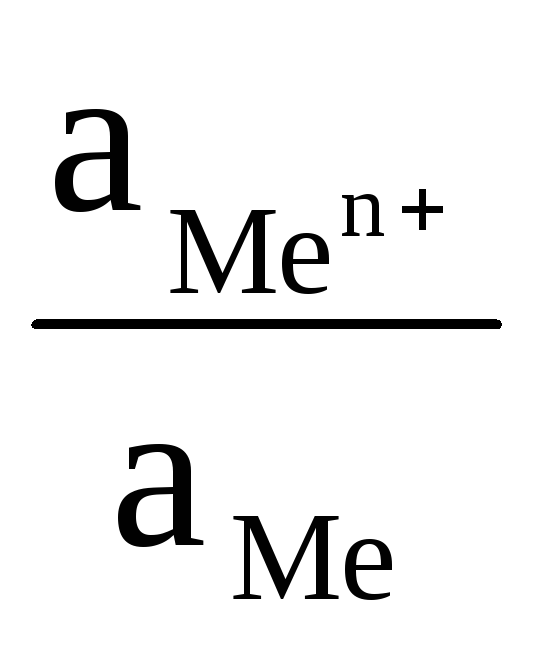 (4.12) ,
(4.12) ,
учитывая,
что активность твердой фазы постоянна
и равна 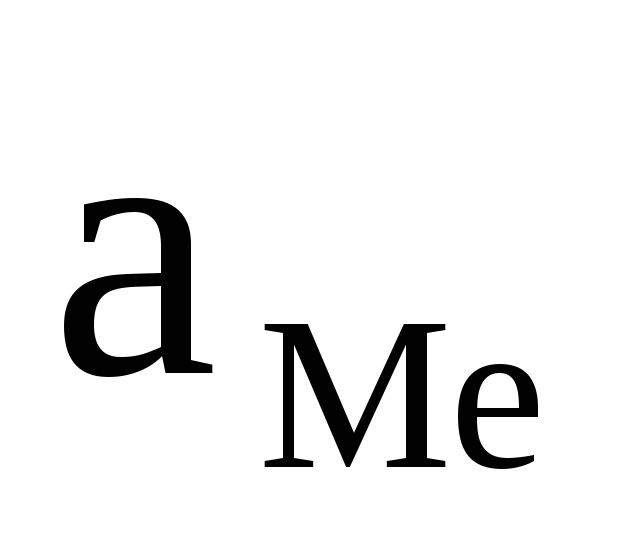 = 1 моль/л, получаем:
= 1 моль/л, получаем:

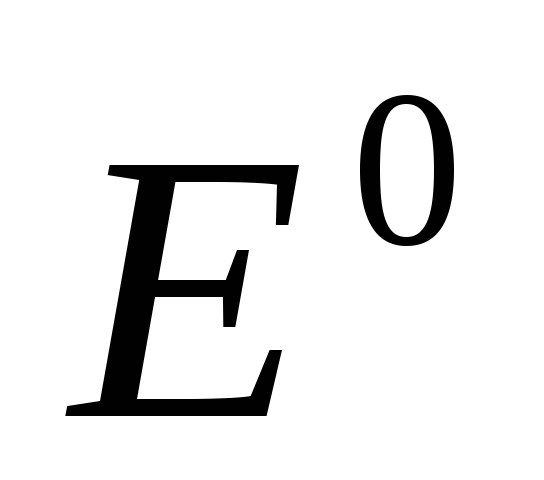 +
+ 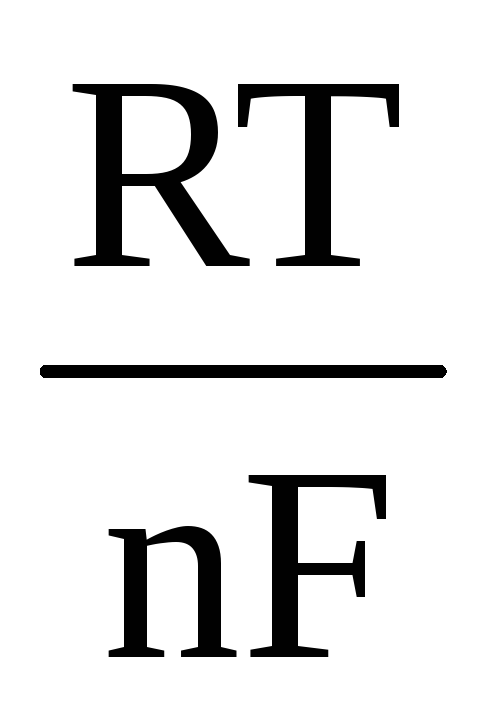 ln
ln (4.13),
(4.13),
где Е0 — стандартный электродный потенциал, В;
R — универсальная газовая постоянная, равная 8,314
Вт-с/моль ∙ К;
Т — температура, К;
n — число электронов, участвующих в электродном про-
цессе;
F — число Фарадея, равное 96500 Кл/моль;
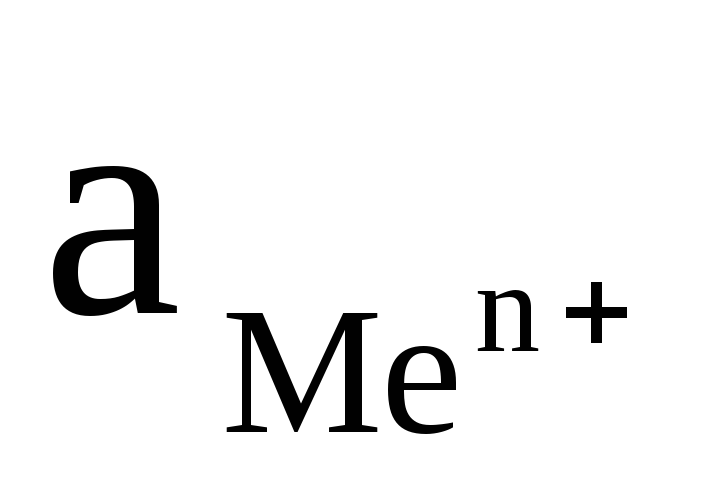 -активность
ионов металла, моль/л.
-активность
ионов металла, моль/л.
Переходя от натуральных логарифмов к десятичным и подставляя в уравнение Нернста Т = 298 К и соответствующие значения R и F уравнение приобретает более простой вид:

 +
+ 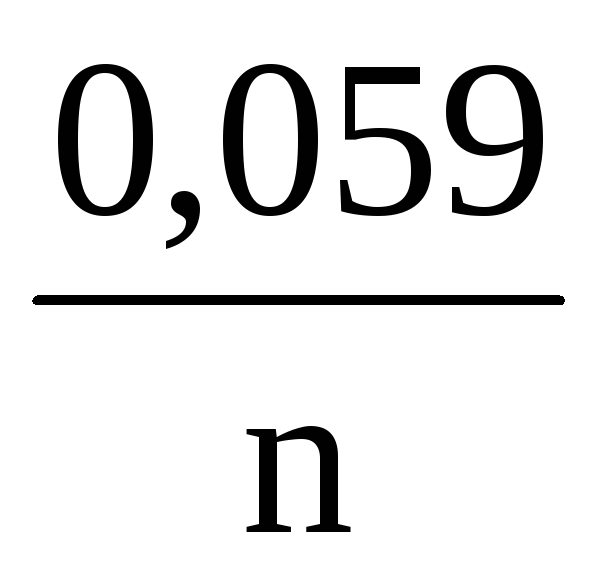
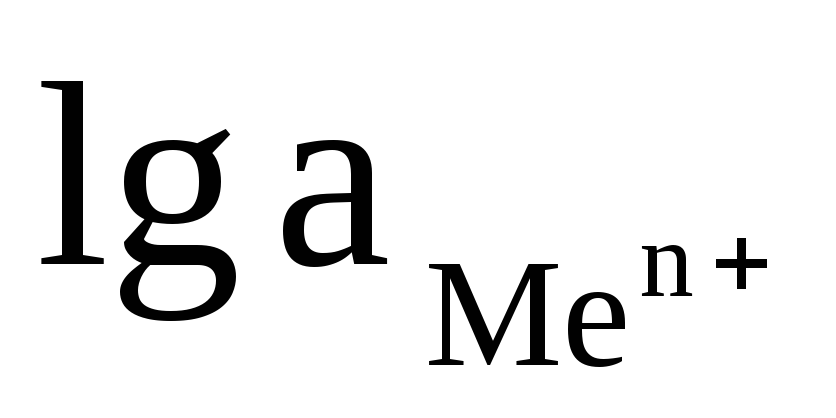 (4.14)
(4.14)
Для
разбавленных растворов, в которых
активности мало отличаются от концентраций
(аМе
 [Men+]),
в уравнении Нернста активность можно
заменить концентрацией:
[Men+]),
в уравнении Нернста активность можно
заменить концентрацией:

 +
+ 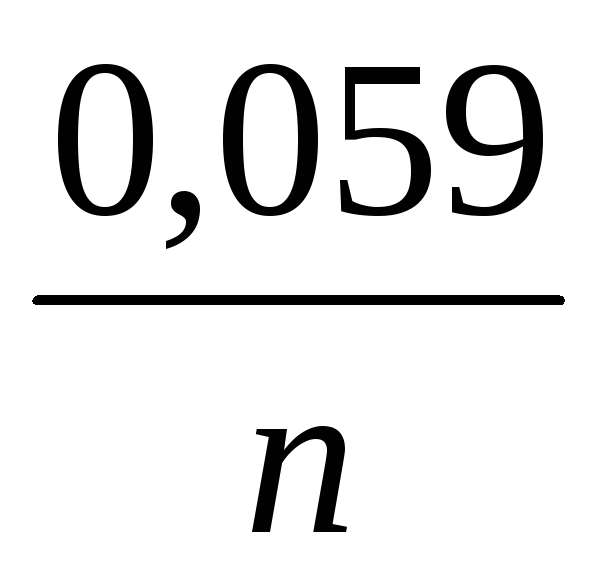
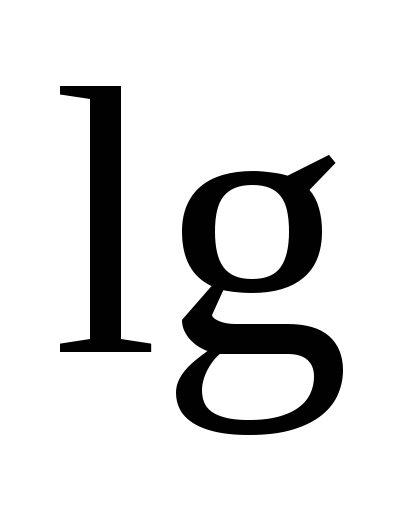 [
[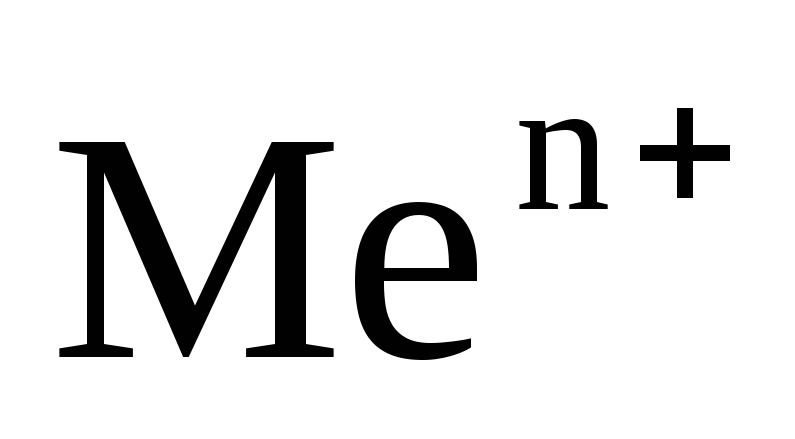 ]
(4.15)
]
(4.15)
Значение
стандартного электродного потенциала
металлического электрода 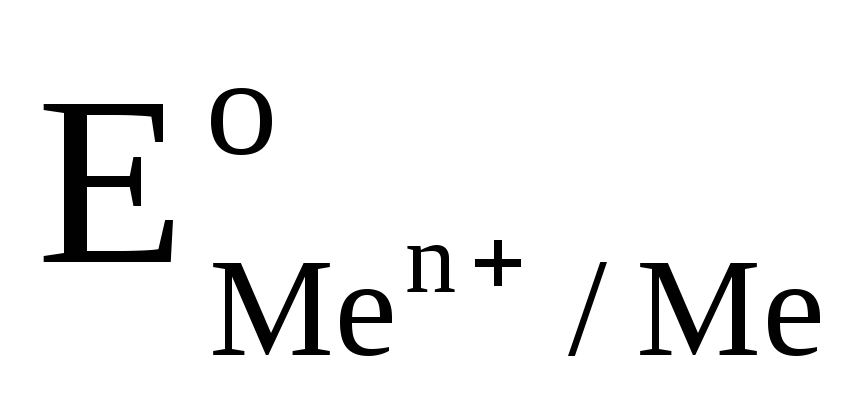 можно определить экспериментально,
описанным выше, компенсационным методом
при
можно определить экспериментально,
описанным выше, компенсационным методом
при  =
1 моль/л..
=
1 моль/л..
Стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с их активностью, равной 1 моль/л, определенный относительно стандартного водородного электрода.
Стандартные потенциалы металлических электродов в водных растворах (ряд стандартных электродных потенциалов) приведены в приложении 4.11. (табл. 4.1.).
Ряд стандартных электродных потенциалов (ряд напряжений металлов). Стандартные электродные потенциалы металлов являются мерой окислительно-восстановительной способности металла и его ионов. Металлы в виде простых веществ – восстановители, ионы металлов – окислители.
Знак электродного потенциала характеризует активность металла относительно водорода. Металлы имеют электродные потенциалы со знаком «минус», если их активность выше активности водорода и «плюс», если они менее активны, чем водород.
Чем отрицательнее значение электродного потенциала металла, тем более сильной восстановительной способностью он обладает. Например, литий, калий, натрий относятся к сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем большей окислительной способностью обладают его ионы.
Активные
металлы начала ряда, а также щелочные
и щелочно -земельные вытесняют водород
из воды. Например, 2K
+ 2H2O  2KOH
+ H2
2KOH
+ H2 .
.
Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием.
Все
металлы, стоящие в ряду стандартных
электродных потенциалов до водорода,
вытесняют его из растворов кислот с
концентрацией (активностью) ионов
водорода 1 моль/л. Например, Zn
+ HCl  ZnCl2 + H2
ZnCl2 + H2 .
.
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов кислот с концентрацией ионов водорода 1 моль/л.
Металлы
способны вытеснять друг друга из
растворов солей. Направление реакции
определяется при этом их взаимным
положением в ряду напряжений. Рассматривая
конкретные случаи таких реакций, следует
помнить, что активные металлы вытесняют
водород не только из воды, но и из любого
водного раствора. Поэтому взаимное
вытеснение металлов из растворов их
солей практически происходит лишь в
случае металлов, расположенных в ряду
после магния. Например, Zn
+ CuSO4  ZnSO4 +Cu.
ZnSO4 +Cu.
Окислительно-восстановительный (электродный) потенциал.
При обсуждении ОВР удобно процессы, происходящие с окислителем и восстановителем, записать в виде уравнений полуреакций восстановления окислителя и окисления восстановителя. Запишем простой пример:
Zn + 2HCl = ZnCl2 + H2
Ок-ль: 2Н+ + 2е = Н2 (восстановление)
Вос-ль: Zn -2e = Zn2+ (окисления)
Zn + 2H+ = Zn2+ + H2
В ОВП принимают участие две пары сопряженных окислителя и восстановителя, и направление реакции определяется тем, какой окислитель и какой восстановитель сильнее. Мерой силы окислителя является его стремление принять электроны, т.е. восстановиться, а мерой силы восстановителя – его стремление отдать электроны.
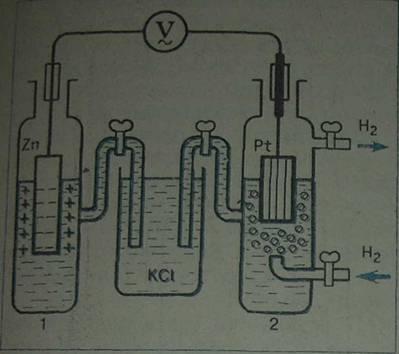
Рис. 1. Электрохимическая цепь со стандартным водородным электродом: -стандартный водородный электрод, 2-исследуемый электрод, 3 — электролитический ключ
Можно на опыте провести ОВП таким образом, чтобы электроны передавались от окислителя к восстановителю не непосредственно при столкновении, а через дополнительный проводник – металлическую проволоку. Для этого возьмем ту же систему, включающую две сопряженные пары окислитель-восстановитель, но разделим их пространственно, как показано на рисунке. В левый сосуд опущен цинк в раствор его соли (сульфата или нитрата цинка) – это цинковый электрод. Понятие электрод в электрохимии – это контакт электронного и ионного проводника (например, металла в растворе соли металла). Условное обозначение таких металлических электродов: Ме/Меп+. Чтобы стандартизировать измерения, концентрацию ионов цинка следует взять равной единице, а внешние условия – температуру и давление стандартными ( 298К, 1,01 Па).
Во второй сосуд помещен так называемый водородный электрод (нормальный водородный электрод). Он устроен намного сложнее. Немножко другая конструкция такого электрода представлена на рис.2.
Он представляет собой сосуд с одномолярным раствором серной кислоты, через который непрерывно пропускают водород под давлением 1 атмосфера при температуре 298К; в раствор опущена платиновая пластинка, покрытая черненной пористой платиной). Роль платины заключается в обеспечении проводимости между внешней цепью и раствором, а также катализе гетерогенного равновесного процесса окисления водорода и восстановления катионов водорода, т.е. реализации процесса:
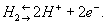
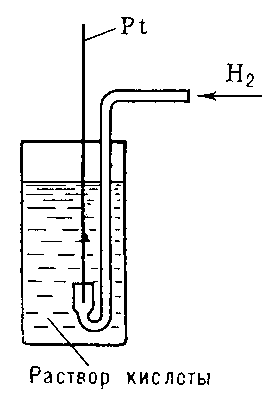
Рисунок 1. Нормальный водородный электрод
Между растворами помещен электролитический ключ, обеспечивающий контакт двух ионных проводников, который осуществляется через полупроницаемую мембрану или стеклянную трубочку (солевой мостик), заполненную раствором электролита (обычно хлоридом калия). Электролитический ключ обеспечивает проводимость между растворами.
Два электрода вместе с электролитическим ключом представляют собой гальванический элемент – устройство, способное преобразовывать энергию химических ОВ реакций в электрическую. Если соединить металлические части проводником, то цепь будет замкнута и электроны получат возможность переходить от цинка к платине. В сосуде с цинковым электродом пойдет процесс (1), а в сосуде с водородным электродом – процесс (2). ГЭ будет давать ток. Разность потенциалов может быть измерена высокоомным вольтметром. Реакция будет продолжаться, а ток будет идти (передаваться электроны от цинкового электрода к водородному) до тех пор, пока не раствориться весь цинк или не израсходуется кислота. Разность потенциалов подобных можно использовать в качестве меры окислительной способности окислителя и восстановительной способности восстановителя.
Вместо цинкового электрода можно брать любой металлический электрод и измерять разности потенциалов электрохимической цепи. ЭДС этой электрохимической цепи будет равна потенциалу измеряемого электрода, если принять за нулевое значение потенциал стандартного водородного электрода. Есть металлы, электродные потенциалы меньше потенциала водородного электрод, поэтому значение их электродных потенциалов приняты за отрицательные; например, алюминий, цинк, железо и др. У других металлов, менее химически активных больше потенциала водородного электрод, поэтому значение их электродных потенциалов — положительное.
Таким, образом, количественной характеристикой силы окислителя и восстановителя является окислительно-восстановительный (электродный) потенциал. Термин «электродный» относиться к возникновению электродного потенциала на границе металл-раствор в результате образования двойного электрического слоя (ДЭС). ДЭС образуется во всех случаях при погружении металла в раствор его соли. Если активность металла достаточно велика (например цинк в растворе сульфата цинка), то ионы металла начинают переходить в раствор под действием полярных молекул воды. Энергия гидратации у таких металлов больше энергии кристаллической решетки. Вследствие этого металл, в котором остается избыток электронов, заряжается отрицательно, а раствор положительно. Возникающий на металле отрицательный заряд начинает притягивать обратно положительные ионы металл, так что вскоре наступает состояние равновесия, при котором в единицу времени сколько ионов уходит из металла в раствор, столько же и возвращается в него, т.е. достигается состояния равновесия:
Ме + аq = Ме+п (аq)+ne — возникает ДЭС – тонкий слой между пространственно разделенными электрическими зарядами противоположного знака, образующийся на границе двух фаз за счет процесса обмена катионами между металлом и раствором электролита. Количественной характеристикой такого процесса служит электродный потенциал — определенная разность потенциалов между металлом и раствором. Возникает классический конденсатор. Одна обкладка конденсатора — это поверхность металла, имеющая отрицательный заряд; а вторая – положительно заряженный слой раствора. Часть положительно заряженных ионов раствора притягивается вплотную к поверхности металла (адсорбционная часть ДЭС). Из-за теплового движения частиц жидкости этот слой размыт, т.е. часть ионов находится на некотором расстоянии от поверхности (это диффузная часть ДЭС). В ДЭС, как в любом конденсаторе, должно быть падение потенциала между обкладками. Значение потенциала изменяется линейно, что соответствует адсорбционной части ДЭС, а затем имеет место более плавное изменение, что соответствует диффузной части ДЭС (рис.1б). Для некоторых металлов (менее т\д активных, у которых энергия кристаллической решетки больше энергии гидратации ионов) более вероятным является процесс перехода гидратированных положительно заряженных ионов металла раствора (например, медь в растворе сульфата меди) на поверхность металла, которая при этом приобретает положительный заряд, а прилегающий слой раствора – отрицательный (рис.1а). Знак и величина потенциала (обозначается Е) зависят от активности металла, температуры и концентрации ионов в растворе. Электродный потенциал – величина, отражающая свойства электрода, т.е. характеристика окислительно-восстановительного равновесия: Меп+ + ne ↔ Ме. Измерить его можно с помощью другого электрода – электрода сравнения, в качестве которого применяется водородный электрод. Потенциал водородного электрода (Н2|2H+) в стандартных условиях Е0 (Т=298К, Р (Н2)=1,01 105Па, концентрация катионов водорода в растворе 1 моль/1000г Н2О) принят равным нулю.
Существуют металлы, отличающиеся высокой химической стойкостью (платина, золото и др.), которые практически не могут обмениваться ионами в растворе. Подобные электроды называются инертным или индифферентными. Однако такие металлы могут адсорбировать на своей поверхности многие газы и, в частности, водород. Если платиновая пластина, насыщенная адсорбированным водородом, находится в растворе, содержащем катионы водорода Н+, то на ее поверхности будет протекать следующий процесс: 2Н+ + 2е = (Рt)Н2. Скачок потенциала будет отвечать равновесию между катионами водорода в растворе и газообразным водородом через посредство платиновой поверхности, адсорбирующей водород. Окислительно-восстановительный потенциал этого равновесия и принят равным нулю. Относительно водородного электрода измеряют потенциалы всех остальных окислительно-восстановительных систем. Понятие «окислительно-восстановительный потенциал (ОВП)» обычно используют для характеристики окислительно-восстановительных равновесий, требующих использования инертных электродов. Таким образом, ОВП – это характеристика обменного взаимодействия контактирующих фаз, которое заключается в установлении окислительно-восстановительного равновесия между окисленной (окислителя) и восстановленной (восстановителя) формами: ox + ne red
За меру окислительно-восстановительной способности окислителя и восстановителя принят стандартный ОВПОТ, включающий пару: окислитель и сопряженный с ним восстановитель.