Электродный потенциал и термодинамическая возможность коррозии
Основная причина коррозии металлов — их термодинамическая неустойчивость в обычных условиях. Металлы (за исключением благородных) в естественных условиях находятся в виде окислов, т.е. в земной коре металлы входят в состав химических соединений (руд).
Возможность протекания процесса коррозии и стремление металла, к самопроизвольному окислению зависит от степени его термодинамической неустойчивости в конкретных условиях, т.е. от величины изменения термодинамического (изобарно-изотермического) потенциала AG данного процесса. Эта величина — мера превращения потенциальной химической энергии в полезную работу данного химического | процесса (например, в гальванических источниках тока — в электрическую работу). Знак А свидетельствует о том, что от величины G в 1 конечном (окисленном) состоянии отнимается значение ее в начальном состоянии. Если при протекании химической или электрохимической реакции термодинамический потенциал возрастает ΔG>0, то самопроизвольный процесс невозможен, а если убывает ΔG < 0, то самопроизвольный процесс возможен.
При неизменности термодинамического потенциала (ΔG = 0) система находится в равновесии. Это означает, что в процессе самопроизвольного окисления металла (коррозии) скорости реакций окисления и восстановления металла равны. Какое число атомов металла за единицу времени окислилось (потеряло валентные электроны и перешло в виде положительно заряженных катионов в электролит), такое же число ионов металла восстановилось из электролита в кристаллическую решетку металла, получив недостающие электроны от электрода (металла).
Окисление металла в электролитах называют анодной реакцией ионизации металла, а обратную — катодной реакцией восстановления. Обозначая соответственно их скорости, т.е. скорости потока переноса массы ионов через единицу площади граничной поверхности в единицу времени, i а и iк, получаем в равновесном состоянии iа = iк и отсутствие коррозии (некомпенсированного переноса массы металла в среду). Важно, что в процессах переноса массы и электрических зарядов через границу раздела металл — электролит при равновесном (обратимом) состоянии происходит полный баланс переноса как по массе, так и по зарядам.
Следовательно, при этом не изменяются масса электрода и его заряд. Нарушение равновесия в каком-либо одном из двух направлений приведет к окислению или, наоборот, восстановлению металла.
При анализе электрохимических процессов на электроде, погруженном в электролит, величина термодинамического потенциала характеризуется однозначно связанной с ней величиной скачка равновесного (обратимого) электрического потенциала на границе металл — электролит Δφ
где z — валентность иона металла; F — число Фарадея.
Это выражение получено из условия равенства работы, произведенной химическими силами (-ΔG) в реакции окисления одного моля металла, работе, производимой электрическими силами при восстановлении одного моля металла (ΔφоzF).
Повышение потенциала электрода выше равновесного (обратимого) приведет к сдвигу равновесия в сторону анодной реакции окисления, снижение потенциала ниже равновесного сдвинет в сторону катодной реакции восстановления.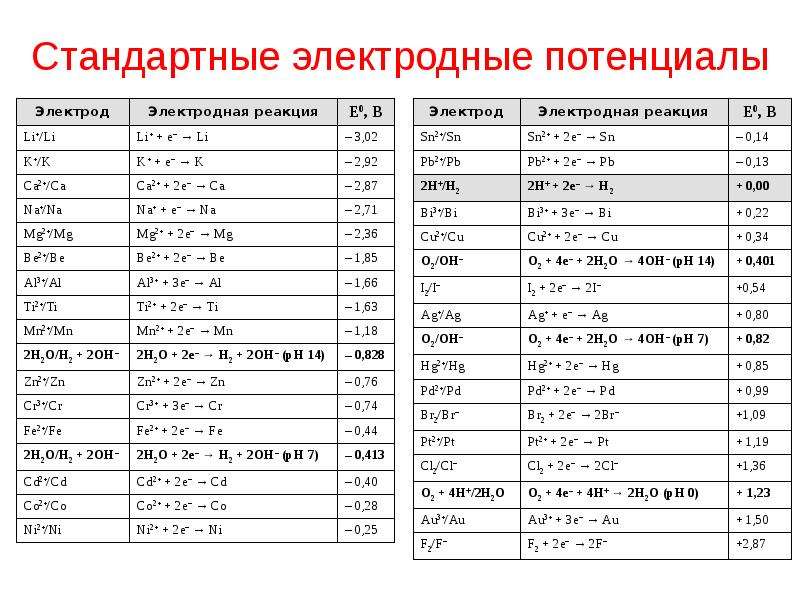
Появление электрических сил и скачка электродного потенциала границе металл — электролит вызвано переносом зарядов (катионов) из металла в прилегающую область электролита, которая совместно с оставшимися в электроде избыточными электронами образует обкладки двойного электрического слоя, внутри которого действует электрическое поле, направленное из электролита в электрод и стремящееся возвратить катионы металла из электролита в электрод. По мере накопления катионов в электролите устанавливается динамическое равновесие, характеризуемое величиной плотности тока обмена катионами: i о = iа = iк. Для большинства металлов, погруженных в водные растворы, эта величина находится в пределах от 10-8 до 10-5 А/см2.
Если бы при погружении идеального металлического электрода электролит на границе раздела всегда протекал только процесс ионизации — восстановления данного металла, то всегда достигалось бы равновесное (обратимое) состояние, достаточное для сформирования двойного электрического слоя. Однако в большинстве случаев на поверхности реальных электродов одновременно протекают процессы с участием посторонних ионов, что препятствует установлению равновесного состояния и вызывает некомпенсированный перенос массы металла из электрода в электролит, т.е. коррозию. При этом потенциал электрода будет уже неравновесным (необратимым), и что величина будет зависеть не только от обмена электрода с электролитом собственными ионами металла, но и от реакций с участием ионов металла но и от реакций с участием ионов других веществ. При неравновесном состоянии может быть достигнут баланс между электродом и электролитом в обмене электрическими зарядами, но будет нарушен баланс по массе, так как часть восстанавливающихся ионов металла может быть заменена другими ионами и анодный процесс ионизации металла станет превалировать над катодным. Соответствующее значение устанавливающегося необратимого (неравновесного) потенциала называется стационарным потенциалом или потенциалом коррозии металла.
Однако в большинстве случаев на поверхности реальных электродов одновременно протекают процессы с участием посторонних ионов, что препятствует установлению равновесного состояния и вызывает некомпенсированный перенос массы металла из электрода в электролит, т.е. коррозию. При этом потенциал электрода будет уже неравновесным (необратимым), и что величина будет зависеть не только от обмена электрода с электролитом собственными ионами металла, но и от реакций с участием ионов металла но и от реакций с участием ионов других веществ. При неравновесном состоянии может быть достигнут баланс между электродом и электролитом в обмене электрическими зарядами, но будет нарушен баланс по массе, так как часть восстанавливающихся ионов металла может быть заменена другими ионами и анодный процесс ионизации металла станет превалировать над катодным. Соответствующее значение устанавливающегося необратимого (неравновесного) потенциала называется стационарным потенциалом или потенциалом коррозии металла.
Рассмотрим простейший пример растворения металла в водном растворе кислоты, предполагая, что в процессе участвуют два вида ионов электролита — металла и водорода по реакциям
катодной
Н2О
Ме ⇄ Меz+ + Н2О + zе,
анодной
Н2О
Надс ⇄ Н+Н2О + е
Pages: 1 2
Что такое электродный потенциал?
Потенциал электрода представляет собой совокупный потенциал двух электродов, которые подвергаются реакциям в ячейке. Обычно измеряется в вольтах, он может отличаться в зависимости от вещества, из которого сделаны электроды. Водород часто считается стандартом с потенциалом ноль вольт, с которым сравниваются реакции других элементов. Электрохимические процессы могут быть предсказаны путем понимания электродного потенциала материала, а также шансов его коррозии при определенных обстоятельствах. Этот потенциал, также называемый электродвижущей силой (ЭДС), обычно измеряется с помощью гальванического элемента, который состоит из двух камер, каждая из которых имеет электрод, и соединен куском бумаги, называемым соляным мостиком.
Электрический ток ячейки обычно измеряется вольтметром. Там может быть нет тока; Разница потенциалов между электродами, в этом случае, обычно такая же, как ЭДС всей ячейки. ЭДС обычно измеряется при температуре 77 ° F (около 25 ° C) и типичном атмосферном давлении на уровне моря. Такие условия используются для измерения потенциала стандартного электрода в конфигурации с двумя полуэлементами. Водородный электрод обычно находится на одной стороне этой компоновки, в то время как потенциал того, что на другой стороне, обычно определяется экспериментом.
Как только это стандартное значение получено, тогда можно предсказать, как вещество будет реагировать. Обычно, чем выше отрицательное значение потенциала, тем больше вероятность того, что элемент растворяется в растворе. Нет реакции часто наблюдается в нереакционноспособных металлах. Они обычно размещаются в нижней части стандартной таблицы потенциалов электродов, которая идентифицирует ЭДС различных типов элементов.
Стандартные условия не всегда доступны, поэтому для определения потенциала электрода можно использовать расчет, называемый уравнением Нернста. Он учитывает температуру, газовую постоянную, количество частиц, называемых электронами, и концентрацию ионов. Хотя водород является стандартным эталоном, элементы, часто используемые для электродов, включают цинк и медь, железо, алюминий или кальций.
Электродный потенциал каждого из этих элементов используется для расчета напряжения гальванического элемента. Отдельный расчет атомных полуреакций иногда используется также для получения ЭДС. Поэтому процесс определения потенциала электродов может потребовать понимания научных принципов, а также математики.
ДРУГИЕ ЯЗЫКИ
Электродные потенциалы.
Если погрузить металлический электрод в раствор, содержащий ионы того же металла, атомы металлической решетки переходят в раствор и образуют гидратированные ионы металла.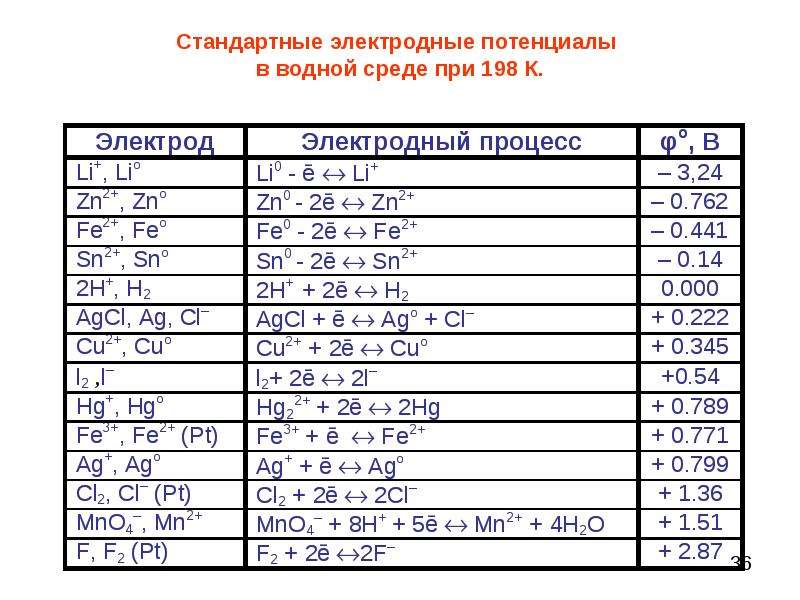 В то же время гидратированные ионы приобретают электроны на электроде и образуют атомы металла. В результате они становятся частью металлической решетки. В конце концов на электроде устанавливается равновесие
В то же время гидратированные ионы приобретают электроны на электроде и образуют атомы металла. В результате они становятся частью металлической решетки. В конце концов на электроде устанавливается равновесие
Процесс, идущий в прямом направлении (вправо), представляет собой восстановление, при котором гидратированные ионы металла в растворе отбирают электроны у электрода (рис. 10.16). Это приводит к дефициту электронов на рассматриваемом электроде и, следовательно, к возникновению на нем положительного заряда. Вместе с тем, в обратном процессе, т. е. в процессе окисления, атомы металлической решетки переходят в раствор, образуя гидратированные катионы. Это приводит к образованию избыточных электронов на данном электроде и возникновению на нем отрицательного заряда.
От того, какой из этих двух противоположно направленных процессов преобладает, а следовательно, от того, в какую сторону окажется смещено равновесие, зависит заряд рассматриваемого электрода. Положение равновесия зависит от целого ряда факторов, в том числе от химической природы металла, концентрации ионов в электролите и от температуры. Если равновесие сдвинуто вправо, восстановление преобладает над окислением и, следовательно, электрод приобретает положительный заряд. Если равновесие сдвинуто влево, окисление преобладает лад восстановлением и, следовательно, электрод приобретает отрицательный заряд.
Положение равновесия зависит от целого ряда факторов, в том числе от химической природы металла, концентрации ионов в электролите и от температуры. Если равновесие сдвинуто вправо, восстановление преобладает над окислением и, следовательно, электрод приобретает положительный заряд. Если равновесие сдвинуто влево, окисление преобладает лад восстановлением и, следовательно, электрод приобретает отрицательный заряд.
В любом случае происходит разделение зарядов, а значит, возникает разность потенциалов между электродом и ионами в растворе. Электродный потенциал полуэлемента-это электродвижущая сила (э.д.с.) гальванического элемента, в схематической записи которого слева находится водородный электрод, а справа-рассматриваемый электрод (полуэлемент). Для электрода M1 +(водн.)/М такой гальванический элемент изображается схемой
Электродный потенциал обозначается символом Eм*+/м и соответствует реакции восстановления, протекающей на электроде
Повышение температуры полуэлемента приводит к увеличению способности металла растворяться в растворе и образовывать гидратированные ионы металла. Это способствует протеканию обратной реакции и сдвигу равновесия влево. В результате возрастает разность потенциалов между электродом и раствором.
Это способствует протеканию обратной реакции и сдвигу равновесия влево. В результате возрастает разность потенциалов между электродом и раствором.
Рис. 10.16. Возникновение электродных потенциалов, а-на электроде, на котором происходит самопроизвольное восстановление ионов металла из раствора, они забирают электроны у электрода, и поэтому электрод приобретает положительный заряд; б-на электроде, на котором происходит самопроизвольное окисление, попы металла переходят с электрода в раствор, оставляя на электроде избыток электронов, вследствие чего он приобретает отрицательный заряд.
Если же увеличится концентрация гидратированных ионов металла в растворе, равновесие сдвинется вправо. В таком случае разность потенциалов между электродом и раствором уменьшится.
Поскольку электродные потенциалы зависят от температуры, концентрации, а также от давления, то прежде, чем сравнивать их друг с другом, необходимо их стандартизовать, т.е. привести к стандартным условиям. Напомним, что стандартными условиями являются температура 298 К, давление 1 атм и концентрация 1 моль/дм3. Это позволяет определить стандартный электродный потенциал электрода (или полуэлемента) как электродвижущую силу гальванического элемента, в схематической записи которого левым электродом является стандартный водородный электрод, а правым-стандартный рассматриваемый электрод. Для электрода М+/М такой гальванический элемент схематически записывается следующим образом:
Напомним, что стандартными условиями являются температура 298 К, давление 1 атм и концентрация 1 моль/дм3. Это позволяет определить стандартный электродный потенциал электрода (или полуэлемента) как электродвижущую силу гальванического элемента, в схематической записи которого левым электродом является стандартный водородный электрод, а правым-стандартный рассматриваемый электрод. Для электрода М+/М такой гальванический элемент схематически записывается следующим образом:
Стандартный электродный потенциал этого электрода обозначается символом ?м2+/м-Из приведенного выше определения следует, что стандартный электродный потенциал (стандартного) водородного электрода равен нулю
Оглавление:
Электродные потенциалы, нормальные — Энциклопедия по машиностроению XXL
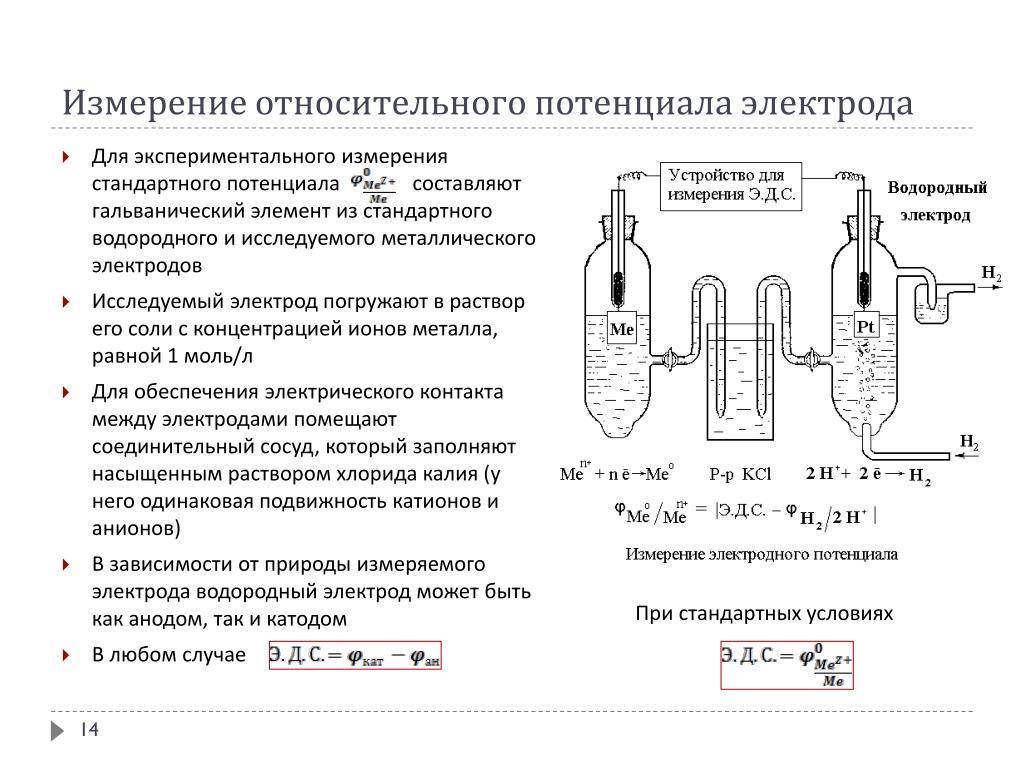
Равновесный водородный электрод при активности ионов водорода в растворе, равной 1 г-ион/л (рН = 0), и парциальном давлении водорода, равном 0,098 МПа, принят за эталон, по отношению к которому определяют значения всех других стандартных электродных потенциалов. Нормальный водородный электрод показан на рис. 1.3, а на рис. 1.3,6 показано, как составляется цепь из водородного и другого электрода при измерении относительных электродных потенциалов.
[c.33]
Нормальный водородный электрод показан на рис. 1.3, а на рис. 1.3,6 показано, как составляется цепь из водородного и другого электрода при измерении относительных электродных потенциалов.
[c.33]
Электродные потенциалы, нормальные 19 Электродренаж 67 Электролиты 14 сл. Электрохимическая зашита 40 Элементы [c.291]
Коррозионная стойкость металлов в водных растворах зависит от электролитической упругости растворения, т. е. от способности растворения металла в данной среде.. Электролитическая упругость растворения металла определяется его электродным потенциалом. Нормальным, или стандартным, потенциалом называется потенциал металла по отношению к раствору одноименных ионов с активностью,, равной единице. Ряд металлов, расположенных в порядке возрастания их потенциалов, называется рядом напряжений. В этом ряду каждый последующий металл вытесняет предыдущий из раствора металлы, стоящие в ряду выше водорода, вытесняют его из раствора. При этом онк переходят в раствор в виде ионов.. Ряд напряжений приведен в табл. 5.
[c.1331]
При этом онк переходят в раствор в виде ионов.. Ряд напряжений приведен в табл. 5.
[c.1331]
Титан и его сплавы относятся к числу химически активных материалов. В электрохимическом ряду напряжений титан находится между магнием, алюминием и бериллием, нормальный потенциал реакции Т -> — Тр +2е, отнесенный к нормальному водородному элементу, равен — 1,75 В, в то время как электродные потенциалы магния и алюминия равны соответственно —2,37 и —1,66 В. При этом высокая химическая активность титана сочетается с исключительно высокой коррозионной стойкостью. Последнее объясняется наличием на поверхности тонкой практически бездефектной пленки оксидов, мгновенно образующихся [c.114]
Механизм возникновения и действия коррозионных процессов в основном зависит от вида электролитов и значений электронных потенциалов. Разность потенциалов между металлом и электролитом называется электрохимическим или электродным потенциалом металла. Металлы, расположенные по возрастанию их нормальных потенциалов, образуют ряд активностей (табл. 4).
[c.4]
4).
[c.4]
Материалы настоящего подраздела позволяют учесть статистический характер стационарных электродных потенциалов металлов при расчете многоэлектродных систем. При этом стационарные электродные потенциалы отдельных электродов предполагаются статистически независимыми, а их средние значения характеризуются нормальным законом распределения вероятностей с параметрами — среднее значение (математическое ожидание) стационарного электродного потенциала /п-го электро-да 0 — среднеквадратичное отклонение стационарного электрода потенциала т-го электрода. [c.93]
| Таблица 1. Нормальные (стандартные) электродные потенциалы в воде при °С (ряд напряжении) |
Один из существенных недостатков паяных соединений алюминия и его сплавов — их низкая коррозионная устойчивость. Особенно низкую коррозионную устойчивость имеют соединения на мягком припое, что обусловлено большим различием между нормальными электродными потенциалами входящих [c.
 133]
133]В их состав компонентов — олова, кадмия, цинка и алюминия. Коррозию вызывают также трудноудаляемые остатки флюсов. Единственный способ защиты паяных соединений от коррозии— это лаковые покрытия. Наиболее устойчивыми в коррозионном отношении считаются соединения на алюминиевом припое вследствие незначительного различия между нормальными электродными потенциалами основного металла и припоя. [c.134]
Нормальные электродные потенциалы металлов при 23° С [c.569]
Каждый металл, стоящий выше другого в ряду нормальных электродных потенциалов, погруженный в раствор, будет вытеснять другой, более благородный металл из его солевого раствора. [c.19]
Цементацией называют процесс вытеснения из раствора одного металла другим, более электроотрицательным. Ниже приведены нормальные электродные потенциалы катионов некоторых металлов [c.285]
Энергетическая характеристика перехода ионов в раствор или обратно — электродный потенциал.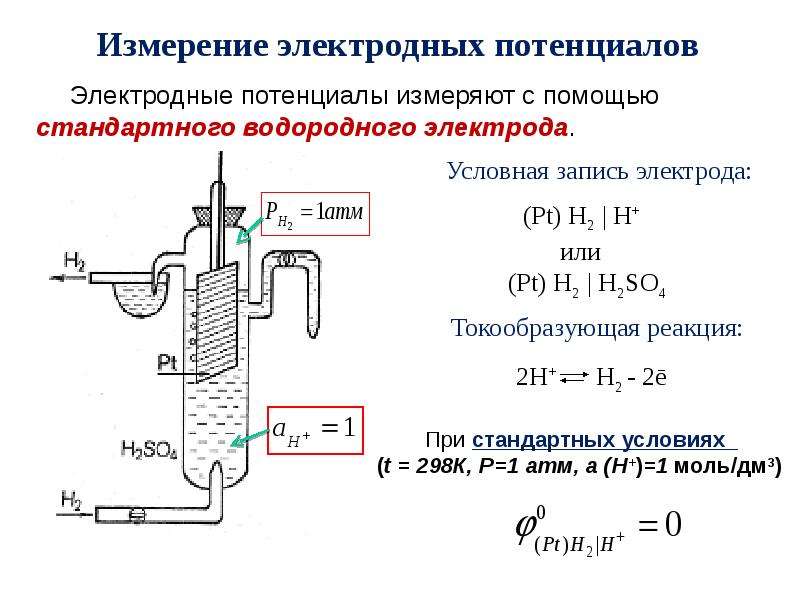 Стандартные (нормальные) потенциалы определены для большинства технических металлов (по отношению к раствору с активностью ионов, равной единице) и приведены в соответствующей литературе [2, 3, 13]. Однако в реальных процессах коррозии равновесные условия обычно не достигаются, так как реакции на поверхности металла идут различными путями. Поэтому важно знать неравновесные электродные потенциалы. металлов и сплавов в различных средах. Величина этих потенциалов зависит от температуры, концентрации раствора, состояния поверхности металла и других факторов неравновесные электродные потенциалы определяются опытным путем [2, 7].
[c.253]
Стандартные (нормальные) потенциалы определены для большинства технических металлов (по отношению к раствору с активностью ионов, равной единице) и приведены в соответствующей литературе [2, 3, 13]. Однако в реальных процессах коррозии равновесные условия обычно не достигаются, так как реакции на поверхности металла идут различными путями. Поэтому важно знать неравновесные электродные потенциалы. металлов и сплавов в различных средах. Величина этих потенциалов зависит от температуры, концентрации раствора, состояния поверхности металла и других факторов неравновесные электродные потенциалы определяются опытным путем [2, 7].
[c.253]
С нормальным электродным потенциалом металла (фнп) [c.77]
Измеряемые значения электродного потенциала по отношению к каломельному хлорсеребряному и другим электродам сравнения принято пересчитывать на значения по отношению к нормальному водородному полуэлементу и обозначать Ен- Значения электродных потенциалов некоторых электродов сравнения приведены в табл. 13.
[c.158]
13.
[c.158]
Электродные потенциалы некоторых вспомогательных электродов по отношению к нормальному водородному электроду [c.159]
Значения равновесных электродных потенциалов по отношению к нормальному водородному электроду сравнения [c.18]
В этой таблице значение потенциала водородного электрода равняется нулю. Это не значит, что абсолютное значение разности потенциалов в двойном слое, образованном с одной стороны растворенными в металле молекулами водорода, а со стороны раствора ионами водорода, равно нулю. Просто ввиду невозможности определения.абсолютного потенциала, потенциал водородного электрода, учитывая его хорошую воспроизводимость на платине, принят в качестве эталона сравнения. Все металлы, имеющие потенциал более электроотрицательный относительно нормального водородного электрода (НВЭ), вытесняют водород из воды. Невозможность определения абсолютного потенциала не имеет решающего значения при изучении коррозионных процессов, так как в этих случаях достаточно знать только относительные величины электродных потенциалов. [c.22]
[c.22]
Измерительная аппаратура. Для измерения электродных потенциалов при отсутствии специальных приборов (потенциометров, электродных вольтметров) можно пользоваться простыми установками, основанными на принципе компенсации. Такие компенсационные схемы собирают при помощи реохорда или двух сопротивлений и нормального элемента Вестона [13]. В установке с реохордом (рис. 72) исследуемый элемент присоединяется к компенсационной цепи так, чтобы положительный полюс ячейки был подключен навстречу положительному полюсу батареи. Переключатель Я включает в компенсационную цепь нормальный элемент ЯЭ передвижением подвижного контакта вдоль проволоки АБ находят положение, при котором стрелка гальванометра при замыкании цепи не отклоняется. Затем подключают в измерительную схему исследуемый элемент и снова находят место компенсации на реохорде. По соотношению плечей реохорда в первом и во втором случае ком- [c.128]
Разность потенциалов, создающаяся иа поверхности соприкосновения металла с жидкостью (электролитом) и характеризующая способность металла к растворению, называется электродным потенциалом.
 Величина его для данного металла зависит от состава электролита если погрузить металл в нормальный раствор его соли, то получится нормальный электрический потенциал. Электродные потенциалы металлов определяются экспериментально по отношению водородному потенциалу, значение которого принято за нуль.
[c.196]
Величина его для данного металла зависит от состава электролита если погрузить металл в нормальный раствор его соли, то получится нормальный электрический потенциал. Электродные потенциалы металлов определяются экспериментально по отношению водородному потенциалу, значение которого принято за нуль.
[c.196]Нормальные электродные потенциалы приняты в качестве характеристики сравнительной активности металлов. Величина равновесного электродного потенциала, измеряемая путем сравнения с нормальным водород- [c.566]
В табл. 11 приведены нормальные электродные потенциалы некоторых металлов, имеющих важное практическое значение, а также величина изменения их свободной энергии при переходе в ионные состояния. Для сравне- [c.120]
| Таблица 12 Нормальные электродные потенциалы некоторых металлов |
 Приведенные в табл. 12 и 13 данные представляют собой относительные значения нормальных электродных потенциалов, т. е. разность потенциалов между исследуемым электродом и стандартным электродом сравнения (за нуль принят электродный потенциал нормального водородного электрода). Если же стандартный электрод заменим вторым металлом, опустим их в раствор электролита и замкнем цепь, то получим гальванический элемент, электродвижущая сила
[c.121]
Приведенные в табл. 12 и 13 данные представляют собой относительные значения нормальных электродных потенциалов, т. е. разность потенциалов между исследуемым электродом и стандартным электродом сравнения (за нуль принят электродный потенциал нормального водородного электрода). Если же стандартный электрод заменим вторым металлом, опустим их в раствор электролита и замкнем цепь, то получим гальванический элемент, электродвижущая сила
[c.121]Значения электродных потенциалов даны относительно нормального водородного электрода сравнения. [c.34]
Потенциалы металлов, погруженных в I н. раствор своих ионов, называются нормальными электродными потенциалами. Если построить гальванический элемент из двух различных металлов, погруженных в 1 н. растворы своих ионов, то знак зарядов в таком элементе будет определяться относительным положением этих металлов в ряду напряжений (табл. 4-1), причем каждый металл — член этого ряда [c.147]
Таким образом, электрохимический заряд напряжений дает важные указания относительно поведения металла в гальванической паре с другим металлом и в соприкосновении с раствором ионов другого металла. В условиях эксплуатации металлы большей частью не находятся в растворах собственных ионов средой может служить конденсат, химически обработанная илн котловая вода. Электродные потенциалы металлов в этих случаях отличаются от нормальных потенциалов.
[c.149]
В условиях эксплуатации металлы большей частью не находятся в растворах собственных ионов средой может служить конденсат, химически обработанная илн котловая вода. Электродные потенциалы металлов в этих случаях отличаются от нормальных потенциалов.
[c.149]
Некоторое представление об электрохимическом поведении разнородных металлов при контакте их во время работы можно получить при сопоставлении соответствующих им значений нормальных электродных потенциалов. [c.7]
Нор.мальным электродным потенциалом называется потенциал металла, возникающий при погружении его в раствор, содержащий один грамм-ион данного металла. Значения нормальных электродных потенциалов некоторых металлов приведены в табл. 2. [c.7]
Ниже представлены нормальные электродные потенциалы (В) некоторых металлов. [c.175]
Кроме того, необходимо, чтобы сопрягающиеся детали и изделия изготовлялись из сплавов, близких по коррозионным характеристикам (нормальным электродным потенциалам). [c.180]
[c.180]
Стандартным или нормальным равновесным потенциалом металла называют потенциал при активности ионов данного металла в растворе, равной 1 г-ион/л. В табл. 1.2 приведены стандартные потенциалы некоторых металлов при 25 °С, рассчитанные из термодинамических данных. Значения стандартных электродных потенциалов являются относительными. Их определяют по сравнению с нормальным электродным потенциалом водорода (см. ниже), который условно принят равным нулю. [c.31]
Термодинамическая устойчивость металла приближенно оценивается значением нормального равновесного потенциала. Электрохимическая коррозия может протекать тогда, когда существует начальная разность потенциалов катодного и анодного процессов, т. е. когда анод имеет более отрицательный потенциал по сравнению с катодом. Границы термодинамической вероятности коррозионного процесса для каждого конкретного случая можно определить, рассчитывая начальные потенциалы катода и анода для данных условий. Результаты таких расчетов, представленные графически, получили наименование диаграмм Пурбэ. Наличие начальной разности потенциалов между катодом и анодом указывает на теоретическую возможность протекания коррозионного процесса. Однако реально устанавливающаяся скорость коррозии будет определяться в большей мере скоростями катодного и анодного процессов, чем начальными значениями электродных потенциалов.
[c.39]
Результаты таких расчетов, представленные графически, получили наименование диаграмм Пурбэ. Наличие начальной разности потенциалов между катодом и анодом указывает на теоретическую возможность протекания коррозионного процесса. Однако реально устанавливающаяся скорость коррозии будет определяться в большей мере скоростями катодного и анодного процессов, чем начальными значениями электродных потенциалов.
[c.39]
Титан имеет нормальные электродные потенциалы—1,63 в (Т1 = + 2е) и 1,21 в (Т1 = Т1 + + Зе). В соответствии с элек- [c.281]
Все тугоплавкие металлы обладают отрицательными нормальными электродными потенциалами и располагаются в ряду активности левее водорода. Высокая коррозионная стойкость тугоплавких металлов обусловлена образованием на поверхности плотной, химически устойчивой пленки, представляющей собой окисел данного металла для Та, Nb, Мо, Zr — это Ta Os, NbiOs, М0О3, Zr O и т.д. Так, например, тантал без окисной пленки обнаруживает сильную анодность по отношению к большинству металлов в течение нескольких секунд после погружения пары в электролит, но образование на его поверхности окисла Таг Os под действием анодного тока быстро изменяет потенциал тантала на обратный и тантал становится катодом (рис. 48). Этот процесс аналогичен процессу пассивации алюминия, но протекает быстрее (рис. 49).
[c.56]
48). Этот процесс аналогичен процессу пассивации алюминия, но протекает быстрее (рис. 49).
[c.56]
Как правило, значение потенциала нормального водородного электрода принимают а нуль. Электродные потенциалы относительно этой нулевой точки считают приведенными к водородной шкале и обозначают ],. В табл. 1 приведены электродные потенциалы пс водородной шкале для некоторых наиболее распространенных электродов сравнения. I технической и экспериментальной работе обычно не проводят измерений относительнс нормального водородного электрода. Зная электродный потенциал электрода сравнение по водородной шкале, можно легко перевести измеренное значение электродног[c.14]
Электродным потенциалом является электродвижущая сила гальванической цепи, составленной из электрода, потенциал которого подлежит апределению, и нормального водородного электрода. Потенциалы, отсчитанные от уровня Н-электрода, выражаются по, водородной шкале . Например, для депи
[c.25]
Например, для депи
[c.25]
Расчет электродных потенциалов и электродвижуш,ихсил по термодинамическим данным производится одинаковым путем. В шервом случае речь идет о вычислении э. д. с. гальванической дбпи с нормальным водородным электродом. При этом условно принимается, что для обратимой реакции на этом электроде [c.32]
Электродные потенциалы металлов существенно меняются от состояния поверхности образцов, состава и концентрации растворов, присутствия различных газов, температуры, движения жидкости. Определение электродных потенциалов производится компенсационным методом, заключающимся в том, что неизвестная электродвижущая сила компенсируется известным напряжением какого-либо постоянного источника тока. Для проведения измерений электродных потенциалов необходимы следующие электроизмерительные приборы чувствительный гальванометр или капиллярный электрометр, нормальный элемент Вестона, реохорд или мостик Уитстона, каломе-левый электрод, магазин сопротивлений. Для более точных измерений вместо мостика применяют компенсационные приборы — потенциометры.
[c.132]
Для более точных измерений вместо мостика применяют компенсационные приборы — потенциометры.
[c.132]
Потенциал металла, погруженного в раствор,. содержащий г-ион1л данного металла, называется нормальным (стандартным) электродным потенциалом. Электродный потенциал нормального водородного элевдрода условно принят равным 0,0. [c.134]
Определение электродного потенциала. Электродный потенциал измеряют у пяти образцов железного нефос-фатированного, фосфатированных нормальным и уско ренным методами — необработанных и обработанных. В качестве коррозионной среды берут 3%-ный раствор Na l. Измерение электродных потенциалов проводят на установке, показанной на рис. 14,а. Поочередно завешивают образцы в стакан с водным раствором хлорида натрия и с помощью потенциометра определяют потен- [c.228]
электродный потенциал
- электродный потенциал
- elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Elektrodo potencialas kito kūno arba terpės, kurioje jis yra, atžvilgiu.
 atitikmenys: angl. electrode potential vok. Elektrodenpotential, n rus. потенциал электрода, m; электродный потенциал, m pranc. potentiel d’électrode, m
atitikmenys: angl. electrode potential vok. Elektrodenpotential, n rus. потенциал электрода, m; электродный потенциал, m pranc. potentiel d’électrode, m
Penkiakalbis aiškinamasis metrologijos terminų žodynas. – Vilnius: Mokslo ir enciklopedijų leidybos institutas. Vytautas Valiukėnas, Pranas Juozas Žilinskas. 2006.
- потенциал электрода
- Elektrodenvorgang
Look at other dictionaries:
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — разность электрических потенциалов (напряжений) между электродом и находящимся с ним в контакте электролитом. Появление Э. п. вызвано образованием у поверхности электрода двойного электрического слоя. На практике используют значения так… … Большая политехническая энциклопедия
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — в электрохимии разность электрических потенциалов на границе фаз электрод электролит.
 На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарь
На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарьЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, мера способности электрода вступать в реакцию. Электрод из элемента М, помещенный в раствор его ионов (М+), представляет собой ПОЛУЭЛЕМЕНТ. Теоретически в ходе реакций типа ММ++е между электродом и раствором всегда… … Научно-технический энциклопедический словарь
Электродный потенциал — мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов. Стандартные потенциалы электродов определяют относительно водородного электрода при определенных величинах температуры,… … Официальная терминология
электродный потенциал — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.
 ] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчика
] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчикаэлектродный потенциал — [electrode potential] разность электрических потенциалов между электродами и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Практическое значение имеют относительные электродные потенциалы,… … Энциклопедический словарь по металлургии
электродный потенциал — 3.8 электродный потенциал: Мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов. Стандартные потенциалы электродов определяют относительно водородного электрода при определенных… … Словарь-справочник терминов нормативно-технической документации
Электродный потенциал — У этого термина существуют и другие значения, см. Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
 Возникновение… … Википедия
Возникновение… … ВикипедияЭлектродный потенциал — Electrode potential Электродный потенциал. Потенциал электрода в электролизе измеренный относительно электрода сравнения. В электродный потенциал не входят потери противодействия потенциалу, как в растворе, так и внешней цепи. Он представляет… … Словарь металлургических терминов
электродный потенциал — elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Dydis, išreiškiamas potencialų skirtumu, susidarančiu tarp joninės terpės (elektrolito tirpalo ar lydalo) ir į ją įdėto elektrodo. atitikmenys: angl. electrode… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Раздел долгосрочного плана: 10.3 А Окислительно-восстановительные реакции | Школа: средняя школа №10 | ||||||
Дата:
15. | ФИО учителя: Худашева М. Р. | ||||||
Класс: 10 «В» | Количество присутствующих: | отсутствующих: | |||||
Тема урока | Электродный потенциал | ||||||
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) | 10.2.3.3 описывать понятие «стандартный электродный потенциал» | ||||||
Цели урока | знать, что стандартные электродные потенциалы требуют стандартных условий -понимание того, как ячейки используются для измерения электродных потенциалов ввести стандартный водородный электрод и объяснить,
как его можно использовать для создания ряда стандартных электродных
потенциалов. Учащиеся должны признать, что список электродных потенциалов — это электрохимический ряд напряжения металлов и иметь возможность работать с ней, чтобы отвечать на вопросы | ||||||
Критерии достижения | 1. — Может дать определение стандартному электродному потенциалу 2. Знает единицу измерения электродного потенциала 3. Знает, что для стандартного потенциала необходимы стандартные условия 4. Может объяснить метод измерения стандартного электродного потенциала: — металлов с их ионами в водном растворе; 5. Использовать значения стандартного электродного потенциала для для создания электрохимического ряда напряжения металлов.
| ||||||
Языковые цели
| Окисление
это процесс …… | ||||||
Привитие ценностей | Трудолюбие, аккуратность | ||||||
Межпредметные связи | Физика. Электродинамика
| ||||||
Навыки использования ИКТ | Презентация Работа с интернет ресурсами | ||||||
Предварительные знания
| окислительно-восстановительные процессы | ||||||
Ход урока | |||||||
Запланированные этапы урока | Запланированная деятельность на уроке
| Ресурсы | |||||
Начало урока
| Приветствие. «Мозговой штурм» Как вы думате что такое химический источник электрической энергии? Простеший химический источник электрической энергии — это батарейки в часах, в сотовых телефонах. Как работают эти батарейки? Для начала ответим на вопросы: Какими частицами являются атомы? Какие электрические заряды у них есть? Как металлы проводят электричество? Какие ионы образуют металлы? Как ионные растворы проводят электричество? Сегодня на уроке мы будемизучать, что такое электродный потенциал, как его измеряют. | Bilimland
| |||||
Середина урока
| Индивидуальная работа. Напишите схему превращения атома натрия в ион натрия; Атома цинка в ион цинка; Атома алюминия в ион алюминия; Атома меди в иона меди (+2) Самооценивание: Na0 → Na+ +1ē Zn0 → Zn2+ +2ē Al0 → Al3+ +3ē Cu0 → Cu2+ +2ē Как называется процесс потери электронов? (окисление) Какие из данных металлов легко теряют свои электроны? Объяснение
возникновения электродного потенциала. Объяснение стандартного водородного электродного потенциала. запись уравнения реакции на электроде для стандартного схемы электрохимической ячейки для измерения стандартного электродного потенциала металла водородного потенциала. Объясняется на примере цинка Парная работа: запись схемы электрохимической ячейки для измерения стандартного электродного потенциала меди. Взаимооценивание пар. Групповая работа. Используя таблицу стандартных электродных потенциалов расположить металлы в порядке возрастания значений электродных потенциалов. Какой ряд у вас получился? Как применяли мы этот ряд? Какие металлы располагаются в начале ряда? Что мы можем сказать о металле зная значение го стандартного электродного потенциала? Как изменяются свойства металлов в начале ряда (слева)? Как изменяются оксилительно- восстановительные свойства? | https://bilimland. | |||||
Конец урока
| Рефлексия: — что узнал, чему научился? что осталось непонятным? Д/з написать схему электрохимической ячейки для определения стандартного электродного потенциала железного электрода
|
| |||||
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? | Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? | Здоровье и соблюдение техники безопасности | |||||
Все
учащиеся:знают и могут объяснить возникновение
электрического потенциала, измерение водородного электродного потенциала,
могут назвать стандартные условия, могут объяснить измерение электродного
потенциала различных металлов. Большинство учащихся Могут объяснить и записать схему электрохимической ячейки для стандартного водородного электрода Некоторые учащиеся: Могут объяснить и записать схему электрохимической ячейки Достигают учебным целям урока и делают выводы | (П)- работа в паре Работу каждого учащегося учитель поддерживает и просматривает, по необходимости дает дополнительные объяснения, учащиеся оценивают сами себя. (W) работа с классом В ходе урока ученики оценивают все выполненные действия по данным ответам.
| Физминутки и активные виды деятельности используются при необходимости (если учащиеся на уроке устали).
| |||||
Электродный потенциал и методы измерения
Существуют два принципиально различных метода измерения pH растворов: колориметрический и электрометрический. [ …]
[ …]
Колориметрический метод измерения pH, как и колориметрическое титрование, основан на свойстве определенных веществ (индикаторов) менять свой цвет в зависимости от значения pH раствора, к которому они добавляются. Окраску сравнивают с цветом того же индикатора в растворе с известным pH. Этот метод удобен для качественной оценки и ориентировочных количественных разовых измерений pH в производственных условиях.[ …]
Ей— нормальный, или стандартный, электродный потенциал; т. е. потенциал электрода при активной концентрации его ионов в растворе, равной единице.[ …]
Для металла с валентностью более единицы второй член правой части уравнения (1.7) следует разделить на его валентность.[ …]
Из уравнения (1.7) видно, что потенциал, возникающий на электроде, пропорционален логарифму концентрации ионов металла. Уравнение это справедливо для электродов не только металлических, но и водородных, применявшихся на первом этапе развития рН-метрии.[ …]
Потенциал так называемого нормального водородного электрода, по отношению к которому определены потенциалы всех других электродов, условно принят равным нулю. [ …]
[ …]
За последнее десятилетие потенциометрический метод измерения pH благодаря удобству и точности получил широкое применение как в исследовательской практике, так и в технике, почти совершенно вытеснив колориметрический метод. Этому способствовало появление стеклянного электрода и совершенных измерительных устройств, позволяющих измерять э. д. с. при сопротивлении цепи в несколько сотен мегом. Стеклянный электрод является наиболее универсальным, так как дает возможность измерять в широком диапазоне активность водородных ионов в растворах практически любого химического состава, и в том числе содержащих органические окислители и восстановители. Исключение составляют лишь растворы, содержащие соединения фтора. Свойства стеклянного электрода хорошо изучены экспериментально, но строгого теоретического обоснования пока еще не получили. В настоящее время наиболее обоснованными считаются теории Б. П. Никольского и М. Дола [4, 5]. Стеклянный электрод отличается от других электродов тем, что его потенциал возникает не вследствие окислительно-восстановительных процессов, а, вероятнее всего, в результате диффузионных явлений, протекающих на границе фаз.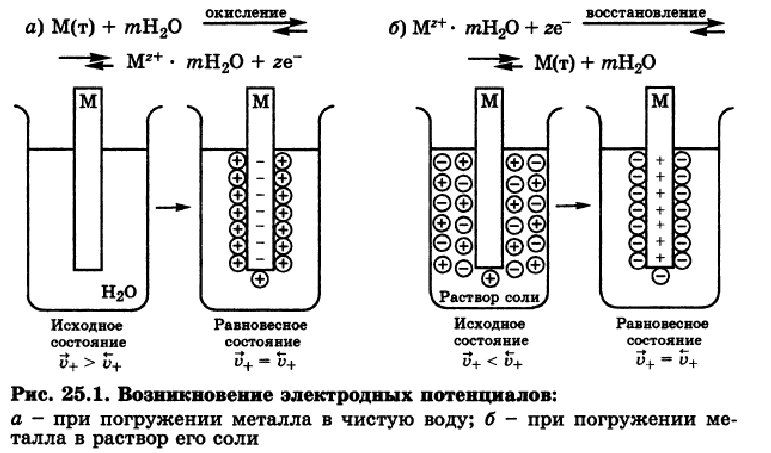 [ …]
[ …]
Обычно стеклянный электрод представляет собой тонкостенный шарик на конце толстостенной трубки (рис. 1.1).[ …]
Шарик сделан из стекла с большим содержанием натрия или лития и залит раствором с постоянным известным значением рНг. Для снятия потенциала с внутренней поверхности стекла в стеклянный электрод вставляется вспомогательный электрод (платиновая проволока). В качестве второго электрода (сравнения) применяется каломельный или хлоросеребряный электрод. В сущности каждый стеклянный электрод представляет электрическую цепь из двух пограничных слоев, образованных стеклянной мембраной (стенкой шарика).[ …]
В заключение отметим еще одно свойство стеклянного электрода. Если величина pH раствора, залитого во внутреннюю полость электрода, равна pH раствора, омывающего внешнюю поверхность шарика, то, хотя согласно последнему уравнений э. д. с. в этом случае должна быть равна нулю, на активных поверхностях электрода возникает разность потенциалов, достигающая 10 мв и более. Эта разность потенциалов получила название потенциала асимметрии. Его появление объясняют различием в свойствах внешней и внутренней поверхностей шарика, возникшим из-за неодинаковых условий охлаждения поверхностей электрода при его изготовления. Величина потенциала асимметрии увеличивается с утолщением стенки шарика электрода и зависит от состава стекла. Для компенсации потенциала асимметрии в схемах рН-метров обычно вводится дополнительное регулируемое напряжение. Кроме того, стабилизация и некоторое уменьшение ’потенциала асимметрии достигается путем ¡предварительного вымачивания электродов в ОД н. растворе соляной кислоты .в течение 7—10 дней.[ …]
Эта разность потенциалов получила название потенциала асимметрии. Его появление объясняют различием в свойствах внешней и внутренней поверхностей шарика, возникшим из-за неодинаковых условий охлаждения поверхностей электрода при его изготовления. Величина потенциала асимметрии увеличивается с утолщением стенки шарика электрода и зависит от состава стекла. Для компенсации потенциала асимметрии в схемах рН-метров обычно вводится дополнительное регулируемое напряжение. Кроме того, стабилизация и некоторое уменьшение ’потенциала асимметрии достигается путем ¡предварительного вымачивания электродов в ОД н. растворе соляной кислоты .в течение 7—10 дней.[ …]
Рисунки к данной главе:
Вернуться к оглавлениювведение в окислительно-восстановительные равновесия и электродные потенциалы
Различная реакционная способность металлов
Когда металлы вступают в реакцию, они отдают электроны и образуют положительные ионы. Эта конкретная тема касается сравнения легкости, с которой металл образует гидратированные ионы в растворе, например, Mg 2+ (водн.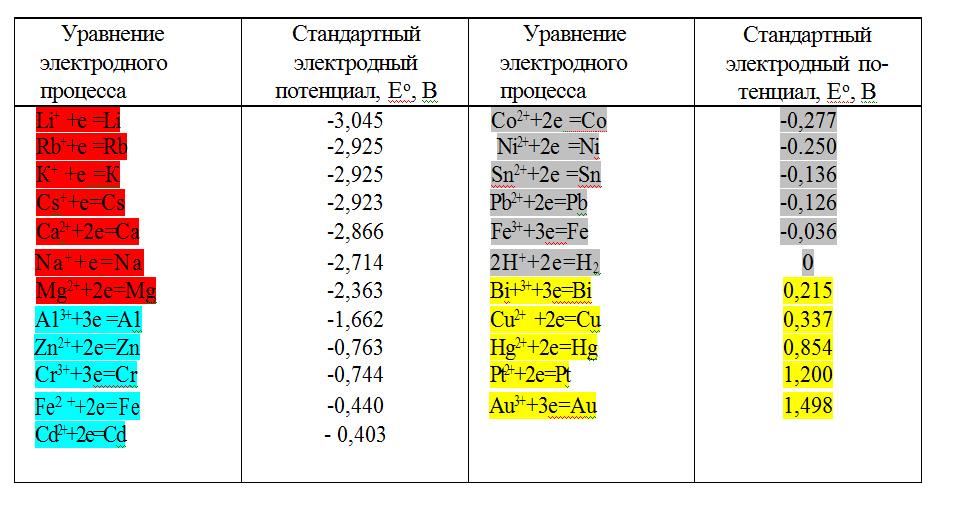 ) или Cu 2+ (водн.) .
) или Cu 2+ (водн.) .
Мы могли бы сравнить легкость, с которой происходят эти два изменения:
Каждый, кто занимается химией более нескольких месяцев, знает, что магний более активен, чем медь.Первая реакция протекает гораздо легче, чем вторая. Что эта тема делает, так это пытается выразить это с помощью некоторых цифр.
Взгляд на это с точки зрения равновесия
Предположим, у вас есть кусок магния в стакане с водой. У атомов магния будет некоторая тенденция терять электроны и переходить в раствор в виде ионов магния. Электроны останутся на магнии.
Через очень короткое время на магнии произойдет накопление электронов, и он будет окружен в растворе слоем положительных ионов.Они будут иметь тенденцию оставаться рядом, потому что их притягивает отрицательный заряд на куске металла.
Некоторые из них притянутся настолько, что вернут свои электроны и снова прилипнут к металлу.
Динамическое равновесие установится, когда скорость, с которой ионы покидают поверхность, в точности равна скорости, с которой они снова присоединяются к ней. В этот момент на магнии будет постоянный отрицательный заряд и постоянное количество ионов магния, присутствующих в растворе вокруг него.
Если упростить схему, чтобы избавиться от «укусов» магния, получится такая ситуация:
Не забывайте, что это всего лишь снимок динамического равновесия. Ионы постоянно уходят с поверхности и снова присоединяются к ней.
Как бы это изменилось, если бы вы использовали кусок меди вместо куска магния?
Медь менее реакционноспособна и поэтому менее легко образует свои ионы. Любые ионы, которые все-таки отрываются, с большей вероятностью вернут себе свои электроны и снова прилипнут к металлу.Вы все равно достигнете положения равновесия, но на металле будет меньше заряда, а в растворе меньше ионов.
Если мы запишем две реакции как равновесия, то мы сравниваем два положения равновесия.
Положение равновесия магния. . .
. . . лежит левее, чем равновесие меди.
Обратите внимание на то, как записаны два равновесия.По соглашению все эти равновесия записываются с электронами в левой части уравнения. Если вы в обязательном порядке придерживаетесь этого соглашения, вы обнаружите, что остальную часть этой темы гораздо легче визуализировать.
Все остальное, касающееся электродных потенциалов, является просто попыткой привязать некоторые числа к этим различным положениям равновесия.
В принципе, это довольно легко сделать. В случае с магнием существует большая разница между отрицательностью металла и положительностью раствора вокруг него.В медном корпусе разница намного меньше.
Эту разность потенциалов можно записать как напряжение — чем больше разница между положительностью и отрицательностью, тем больше напряжение. К сожалению, это напряжение невозможно измерить!
Было бы легко подключить вольтметр к куску металла, но как бы вы подключили его к раствору? Погружая зонд в раствор рядом с металлом? Нет — не получится!
Вокруг любого установленного вами зонда будет происходить подобное равновесие. Лучшее, что вы могли бы измерить, это какая-то комбинация эффектов на зонде и на металле, который вы тестируете.
Лучшее, что вы могли бы измерить, это какая-то комбинация эффектов на зонде и на металле, который вы тестируете.
Понимание идей электрода сравнения
Предположим, у вас есть оптическое устройство для измерения высоты на некотором расстоянии, и вы хотите использовать его, чтобы узнать, какого роста конкретный человек. К сожалению, вы не можете видеть их ноги, потому что они стоят в высокой траве.
Хотя вы не можете измерить их абсолютную высоту, вы можете измерить их высоту относительно удобной стойки.Предположим, что в этом случае человек оказался на 15 см выше столба.
Вы можете повторить это для разных людей. . .
. . . и получите такой набор результатов:
Что такое электродный потенциал?
Что означает потенциал электрода?
Электродный потенциал для любого данного электрода – это напряжение или разность потенциалов ячейки, собранной из стандартного водородного электрода и данного электрода с определяемым потенциалом.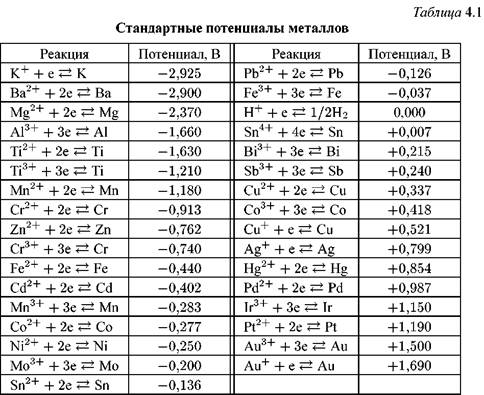 Это результирующая разность потенциалов между точкой на поверхности электрода и точкой в объеме электролита из-за переноса заряженных частиц, а также адсорбции некоторых полярных молекул.
Это результирующая разность потенциалов между точкой на поверхности электрода и точкой в объеме электролита из-за переноса заряженных частиц, а также адсорбции некоторых полярных молекул.
Стандартный водородный электрод всегда имеет нулевой потенциал.
Электродный потенциал используется, например:
- Предсказание связанных с коррозией химических или электрохимических реакций
- Используется для выбора веществ и устройств для управления реакциями изучается для контроля реакций
Corrosionpedia объясняет потенциал электрода
Потенциал электрода полезен в качестве индикатора вероятных реакций, ведущих к коррозии.Когда он находится в пределах защитного потенциала, то защитная система считается эффективной.
Потенциал электрода зависит от направления потока электронов — действует ли электрод как катод или анод в своей ячейке. Это также зависит от:
- Концентрации электролита
- Температуры
- Давления
Реакция окисления и коррозии на электродах может быть чрезмерной, если в объеме электролита постоянно колеблется напряжение. Скорость реакции можно контролировать с помощью ингибиторов и других методов, помогающих предотвратить реакции окисления.
Скорость реакции можно контролировать с помощью ингибиторов и других методов, помогающих предотвратить реакции окисления.
Популярным методом является катодная защита, которая создает пассивный слой на поверхности, предотвращая тем самым прямой доступ к агрессивным реагентам.
При изучении точечной коррозии электродный потенциал измеряется в поверхностных трещинах, ямках и щелях для определения эффективности покрытий и проблем, возникающих из-за дефектов и дефектов поверхности.
Для измерения электродного потенциала необходимо использовать стандартный электрод сравнения.Абсолютную электродвижущую силу (ЭДС) или напряжение электрода нельзя измерить напрямую. После определения потенциала стандартного электрода можно выполнить другие измерения напряжения относительно этого стандартного электрода сравнения. Если напряжение опорного электрода установлено равным нулю, измеренную ЭДС можно рассматривать как абсолютную ЭДС катода или анода.
| Cathode (уменьшение) Полуакция | Стандартный потенциал E ° (вольт) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LI + (AQ) + E — -> Li ( у) | -3.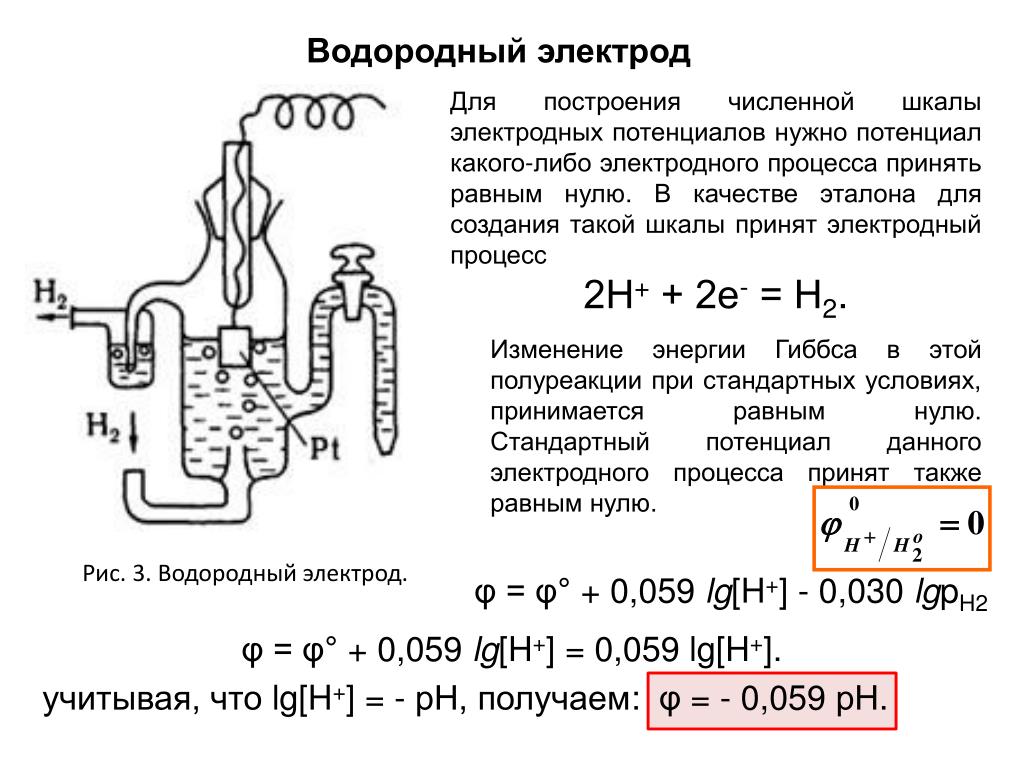 04 04 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K + (водн.) + e — -> K(s) | -2,92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ca 2+ (водн.) | -2.76 | -2.76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na + (AQ) + E — -> NA (S) | -2.71 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| мг 2+ (AQ) + 2E — -> мг (s) | -2,38 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Al 3+ (водн.) + 3e — -> Al(s) | -1.66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2H 2 O (L) + 2E — -> H 2 (G) + 2OH — (AQ) | -0.83 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ZN 2+ (AQ ) + 2E — -> Zn (S) | -0.76 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CR 3+ (AQ) + 3E — -> CR (S) | -0.74 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fe 2 + (водн.) + 2e — -> Fe(s) | -0,41 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cd 2+ (водн.) + 2e — -> Cd(s)
Потенциал электрода Разность потенциалов, измеряемая в вольт (v), зависит от конкретных веществ, из которых состоят электроды. EMF ячейка = EMF окисление + EMF восстановление ЭДС обозначает электродвижущую силу , другое название электрического потенциала. Химики измерили напряжение большого количества электродов, соединив каждый в ячейке со стандартным водородным электродом, который представляет собой газообразный водород при 1 атмосфере, барботирующий через платиновую проволоку, погруженную в 1 M H + ( aq ).Этому стандартному электроду произвольно назначается потенциал 0 вольт, а измерение ЭДС всей ячейки позволяет определить потенциал другого электрода. В таблице 1 перечислены некоторые стандартные потенциалы для электродов, при которых происходит восстановление. В середине списка вы увидите 0 вольт, произвольно присвоенный стандартному водородному электроду; все остальные потенциалы относятся к водородной полуреакции. имеет ЭДС -1,20 вольта, противоположное указанному в таблице 1. Посмотрите это в таблице, чтобы убедиться, что вы понимаете. Рассмотрим, как эти стандартные потенциалы используются для определения напряжения электрического элемента. В ячейке цинк-медь, описанной ранее, две полуреакции должны быть добавлены, чтобы определить ЭДС ячейки. (См. Таблицу 2.) Полный цинково-медный элемент имеет общий потенциал 1.10 вольт (сумма 0,76в и 0,34в). Обратите внимание, что знак потенциала цинкового анода противоположен знаку, указанному в таблице стандартных электродных потенциалов (см. Таблицу 1), потому что на аноде протекает реакция окисления. В таблице стандартных электродных потенциалов (см. табл. 1) реакции расположены в порядке их склонности к протеканию. Реакции с положительной ЭДС протекают легче, чем с отрицательной ЭДС. Рассчитайте общий потенциал аналогичной ячейки с цинковым и алюминиевым электродами. В таблице 3 показаны две соответствующие полуреакции. Такой элемент с цинковыми и алюминиевыми электродами будет иметь общий потенциал +0,90 вольт, при этом алюминий растворяется, а металлический цинк осаждается из раствора. Если выбрать любые две полуреакции из таблицы стандартных электродных потенциалов, то верхняя в списке полуреакция будет протекать как восстановление, а нижняя в списке — в обратном направлении, как окисление. Осторожно: В некоторых справочниках приводятся стандартные электродные потенциалы для полуреакций окисления, поэтому в правиле, изложенном в предыдущем предложении, вам придется поменять местами «выше» и «ниже», хотя это не является обычным явлением.
Гальваническая коррозия по сравнению сПотенциал электродаРазность потенциалов между анодом и катодом может быть измерена с помощью устройства для измерения напряжения, но поскольку абсолютный потенциал анода или катода нельзя измерить напрямую, все измерения потенциала выполняются относительно стандартного электрода. Стандартный электродный потенциал устанавливается равным нулю, а измеренная разность потенциалов может считаться абсолютной. Стандартный водородный электрод
Электрохимический ряд (электродвижущий ряд) представляет собой список металлов, расположенных в порядке их стандартных потенциалов к водородному электроду:
Внимание! — металлы, находящиеся выше в электрохимическом ряду, вытесняют металлы, находящиеся ниже в ряду — это означает, что при соединении двух металлов с разными потенциалами корродирует металл с самым низким потенциалом. Проблема коррозии при соединении меди и железа/сталиОчень распространенными соединениями в системах трубопроводов являются медь и железо/сталь. при таком соединении железо/сталь подвергается коррозии во много раз быстрее , чем железо/сталь по отдельности. Потенциал стандартного электрода – обзор9.3 Восстановление газообразным водородомСтандартные электродные потенциалы полуэлементов типа Me-Me + относятся к стандартному водородному электроду, определяемому соотношением (9.9)2H ++2e−→h3 , которому условно присвоили нулевое значение при всех температурах для 1 М раствора ионов H + ( a H+ = 1) при pH = 0 и p h3 = 0.1 МПа. Следовательно, это означает, что каждый металл с положительным электродным потенциалом может быть извлечен из раствора газообразным водородом. Даже металлы со слегка отрицательным электродным потенциалом можно экстрагировать водородом. Рис. 9.2. Электродный потенциал в зависимости от рН по водороду и функция активности ионов различных металлов в растворе сульфата при 25 и 200 °С [2]. Ионы металлов могут извлекаться из раствора водородом в условиях, описанных верхней частью диаграммы над водородными линиями, но видно, что концентрация ионов других металлов в растворе увеличивается с увеличением электроотрицательности металла, если равновесие устанавливается газообразным водородом. Другое осложнение возникает, когда рН раствора кислоты увеличивается, может быть достигнуто состояние, при котором оксиды или гидроксиды начинают осаждаться из раствора.Критические значения pH указаны для линий равновесия каждого металла на рис. 9.2 a . Понятно, что Co и Ni являются электроотрицательными элементами, которые могут осаждаться из кислых растворов с помощью водорода, но количество этих металлов, получаемых из раствора, незначительно. Эта проблема может быть устранена выщелачиванием в щелочных растворах, когда можно с высокой эффективностью получить Со и Ni восстановлением водородом из аммиачно-карбонатных растворов. Если в растворе присутствуют оба этих металла, то большая часть никеля может быть получена восстановлением водородом до начала осаждения металлического кобальта. В результате высокой энергии диссоциации молекулы водорода скорость восстановления водородом при комнатной температуре и давлении очень низкая. Поэтому восстановление обычно осуществляют при более высоких температурах и давлении в автоклаве, а систему перемешивают для увеличения контакта между жидкой и газообразной фазами. Также добавляется металлический порошок, так называемый модификатор, для преодоления барьера зародышеобразования при осаждении. В результате получается чистый металл, пригодный, например, для применения в порошковой металлургии. Газообразный водород также можно использовать для осаждения менее электроотрицательных примесей из растворов, содержащих более электроотрицательные металлы, но относительно высокая стоимость газа и риск взрыва, особенно если водород находится под давлением, ставит этот метод среди менее широко используемых процедур. Стандартный электродный потенциал — W3schools Потенциал стандартного электрода является мерой потенциала для состояния равновесия. В стандартных условиях стандартный электродный потенциал имеет место при заключении в электрохимическую ячейку с температурой = 298 К, концентрацией = 6 М, давлением = 1 атм. Символ «Eocell» обозначает стандартный электродный потенциал ячейки. Пример стандартного потенциала электрода Стандартный электрод Расчет потенциала цинкового электрода выполняется с использованием стандартного водородного электрода, как описано ниже:
Обратите внимание, что этот потенциал измеряется в стандартных условиях, когда давление 1 атм, температура 298К, концентрация электролитов 1М. Основой электрохимического элемента, как и гальванического элемента, является постоянно окислительно-восстановительная реакция, которую можно разделить на 2 полуреакции, а именно: процесс восстановления на катоде (прирост электронов) и процесс окисления на аноде (потеря электронов). Генерация электричества происходит из-за разности электрических потенциалов между двумя электродами. Возникает разность потенциалов вследствие разности потенциалов двух металлических электродов w.р.т электролит. Обратимый электрод относится к электроду, который обязан своему потенциалу изменять обратимое поведение, в отличие от электродов, используемых в гальванике, которые разрушаются во время их использования. Это измерение восстановительной способности соединения или любого элемента. Не существует простого способа точного измерения потенциалов электролита/электрода изолированно друг от друга. Однако можно измерить полный потенциал клетки. Электрический потенциал изменяется в зависимости от концентрации, давления и температуры. E°ячейка = E°катод-E°анод = 0,76 В
Несмотря на то, что реакция, протекающая на аноде, является окислением, ее значение Е° в табличном виде указано как потенциал восстановления. Потенциал полуреакции измеряется в отличие от SHE, следующие стандартные условия известны как стандартный электродный потенциал для этой конкретной полуреакции. В этом, например, стандартный восстановительный потенциал, как указано выше, для Zn2+(aq) + 2e- → Zn(s) равен -0.76 В , что означает, что стандартный электродный потенциал для реакции, происходящей на аноде, представляет собой окисление Zn до Zn2+, обычно определяемое как пара Zn/Zn2+ или окислительно-восстановительная пара Zn/Zn2+, равно −( −0,76 В) = 0,76 В. Следовательно, мы должны вычесть коэффициент E°anode из E°катода, чтобы получить E°cell: 0 − (−0,76 В) = 0,76 В. .  |
 atitikmenys: angl. electrode potential vok. Elektrodenpotential, n rus. потенциал электрода, m; электродный потенциал, m pranc. potentiel d’électrode, m
atitikmenys: angl. electrode potential vok. Elektrodenpotential, n rus. потенциал электрода, m; электродный потенциал, m pranc. potentiel d’électrode, m На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарь
На практике пользуются значениями т. н. относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарь ] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчика
] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчика Возникновение… … Википедия
Возникновение… … Википедия 01.2020
01.2020
 . электронов, восстановление это процесс …… электронов.
На катоде происходит ……….., на аноде происходит ……….
. электронов, восстановление это процесс …… электронов.
На катоде происходит ……….., на аноде происходит ……….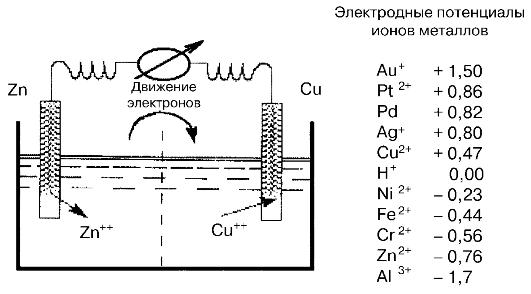 Организация урока.
Организация урока.  Если металлическую пластину поместить в
раствор его же соли, то в системе металл/ион металла возникает
электрический потенциал (напряжение).
Если металлическую пластину поместить в
раствор его же соли, то в системе металл/ион металла возникает
электрический потенциал (напряжение). kz/ru/courses/chemistry-ru/obshaya-ximiya/okislitelno-vosttanovitelnye-reakczii-ehlektroximiya/lesson/standartnyi-ehlektroximicheskii-potenczial
kz/ru/courses/chemistry-ru/obshaya-ximiya/okislitelno-vosttanovitelnye-reakczii-ehlektroximiya/lesson/standartnyi-ehlektroximicheskii-potenczial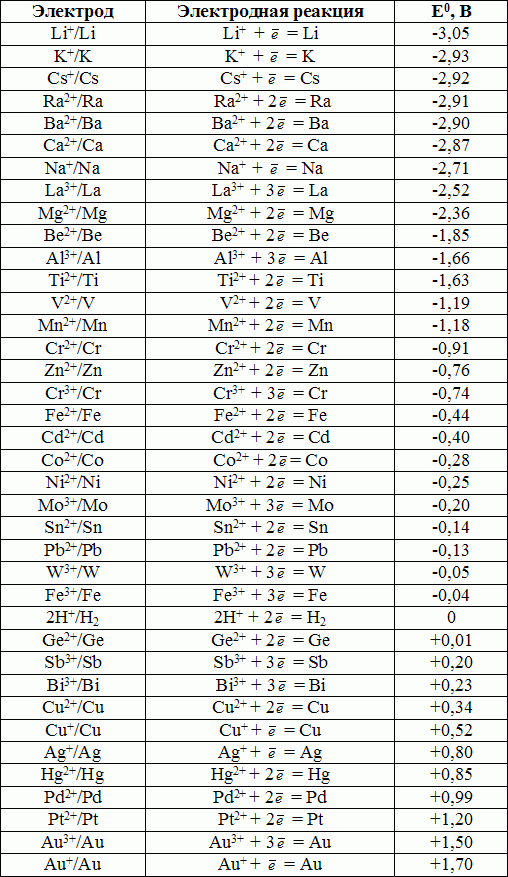 могут записать процессы окисления и
восстановления.
могут записать процессы окисления и
восстановления.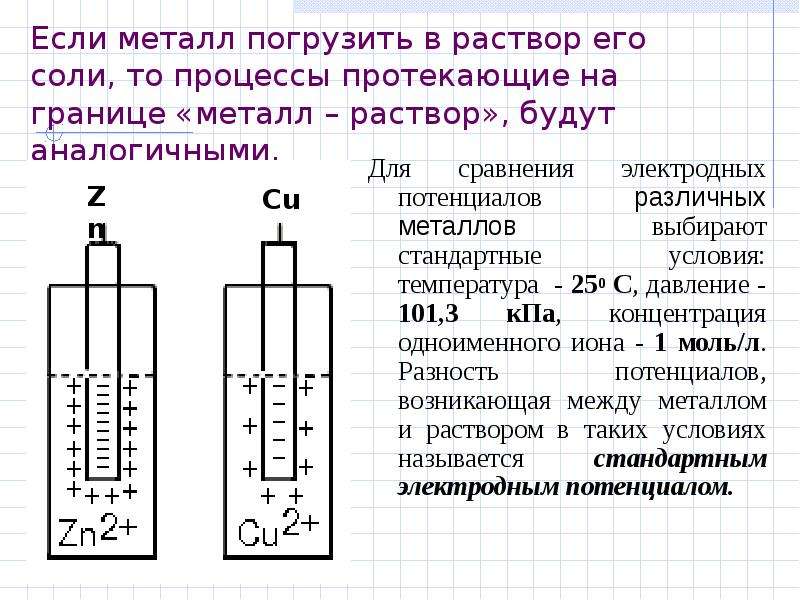 23
23 34
34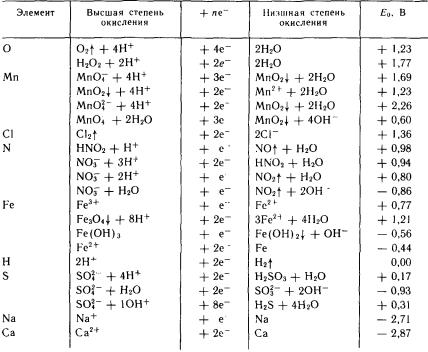 85
85 36
36 Для любой электрической ячейки общий потенциал представляет собой сумму потенциалов, произведенных реакциями на двух электродах:
Для любой электрической ячейки общий потенциал представляет собой сумму потенциалов, произведенных реакциями на двух электродах: Напряжению присваиваются знаки, соответствующие реакции восстановления.Для окисления знак меняется на противоположный; таким образом, полуреакция окисления,
Напряжению присваиваются знаки, соответствующие реакции восстановления.Для окисления знак меняется на противоположный; таким образом, полуреакция окисления, Цинк-медный элемент имеет общую ЭДС +1,10 вольт, поэтому может происходить растворение цинка и отложение меди.
Цинк-медный элемент имеет общую ЭДС +1,10 вольт, поэтому может происходить растворение цинка и отложение меди. Напишите две окислительно-восстановительные полуреакции и общую уравновешенную реакцию, объясняющую осаждение серебра из раствора.
Напишите две окислительно-восстановительные полуреакции и общую уравновешенную реакцию, объясняющую осаждение серебра из раствора. 04
04
 Уравнение Нернста для водородного электрода имеет вид положение нижней пунктирной линии на диаграммах E –pH, представленных в разделе термодинамики.Равновесный потенциал водородной полуячейки уменьшается, т. е. E становится более отрицательным, с увеличением давления газа и уменьшением активности иона водорода или с увеличением рН раствора. Равновесные потенциалы полуячеек металл-ион также уменьшаются с уменьшением активности металлического иона. На рисунке 9.2 a показано изменение потенциала в зависимости от значения pH водородного электрода и активности иона, связанной с бесконечно разбавленным стандартным состоянием для металлических электродов при 25 °C.
Уравнение Нернста для водородного электрода имеет вид положение нижней пунктирной линии на диаграммах E –pH, представленных в разделе термодинамики.Равновесный потенциал водородной полуячейки уменьшается, т. е. E становится более отрицательным, с увеличением давления газа и уменьшением активности иона водорода или с увеличением рН раствора. Равновесные потенциалы полуячеек металл-ион также уменьшаются с уменьшением активности металлического иона. На рисунке 9.2 a показано изменение потенциала в зависимости от значения pH водородного электрода и активности иона, связанной с бесконечно разбавленным стандартным состоянием для металлических электродов при 25 °C. Повышение давления газа до 10 МПа лишь незначительно влияет на концентрацию остаточных ионов. Повышение температуры до 200°С, рис. 9.2 б , оказывает более сильное действие, но восстановление сильно электроотрицательных элементов, таких как Al и Zn, невозможно даже при 200°С и давлении водорода 10 МПа.
Повышение давления газа до 10 МПа лишь незначительно влияет на концентрацию остаточных ионов. Повышение температуры до 200°С, рис. 9.2 б , оказывает более сильное действие, но восстановление сильно электроотрицательных элементов, таких как Al и Zn, невозможно даже при 200°С и давлении водорода 10 МПа.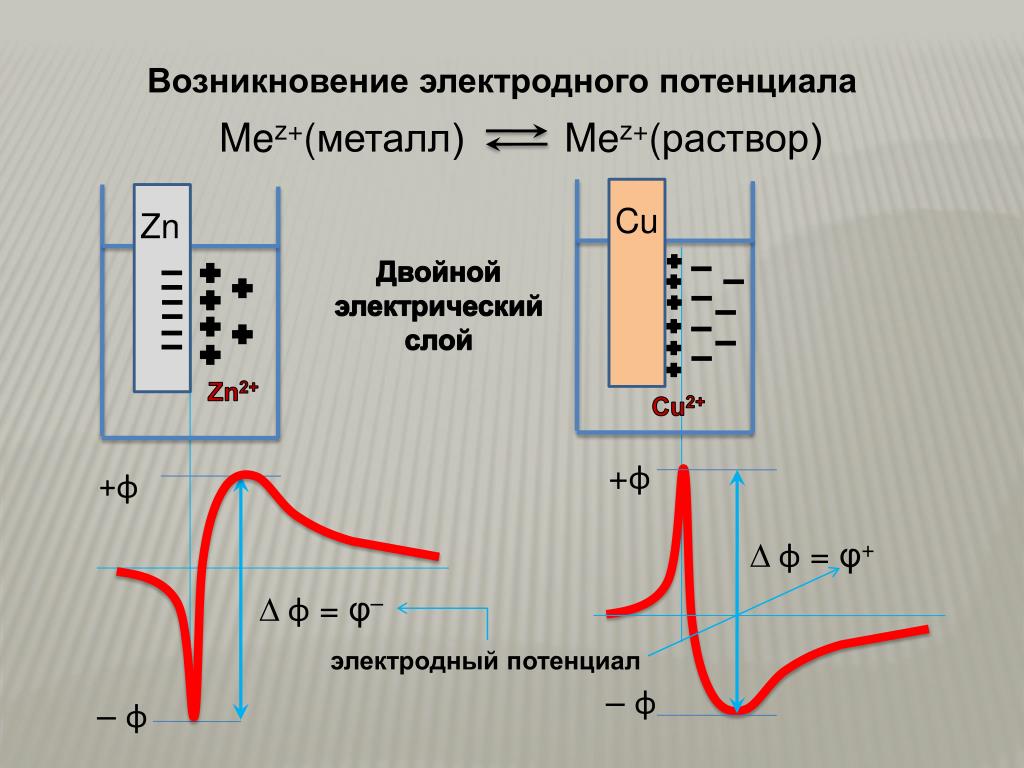
 Существует разница потенциалов, которая представляет собой разность потенциалов между электродами в дополнение к электролиту, известному как потенциал электрода.Когда есть концентрация, присутствующая в единстве всех видов, предающихся полуклетке, тогда электродный потенциал называется стандартным электродным потенциалом клетки.
Существует разница потенциалов, которая представляет собой разность потенциалов между электродами в дополнение к электролиту, известному как потенциал электрода.Когда есть концентрация, присутствующая в единстве всех видов, предающихся полуклетке, тогда электродный потенциал называется стандартным электродным потенциалом клетки.
 + + h3(г)
+ + h3(г)