Электролит: основа свинцово-кислотных автомобильных аккумуляторов
В качестве стартерных батарей в автотранспорте используются свинцово-кислотные аккумуляторы. Функционирование аккумулятора обеспечивается специальным раствором серной кислоты — электролитом. О том, что такое аккумуляторный электролит, каких типов он бывает, и как его использовать — читайте в статье.
Что такое электролит?
Аккумуляторный электролит — водный раствор серной кислоты, предназначенный для использования в свинцово-кислотных аккумуляторных батареях (АКБ). Электролит готовится путем растворения концентрированной серной кислоты в дистиллированной воде, молекулы кислоты в данном растворе диссоциируют (распадаются) на ионы — это явление наделяет электролит электропроводящими свойствами.
Аккумуляторный электролит имеет следующее назначение:
- Изготовление аккумуляторных батарей;
- Ввод в эксплуатацию сухозаряженных батарей;
- Восстановление АКБ при загрязнении или утечке электролита, коротких замыканиях между пластинами и других неисправностях.
Но прежде, чем применять электролит для той или иной цели, необходимо разобраться в его характеристиках и особенностях применения.
Зачем в аккумуляторе электролит?
Электролит, свинцовые пластины и пористый диоксид свинца (PbO2) — три основных компонента свинцово-кислотного аккумулятора. Именно в присутствии кислотного электролита протекают электрохимические реакции, делающие возможным накопление и отдачу аккумулятором электрического заряда.
Во время разряда АКБ металлический свинец и оксид свинца вступают в реакцию с серной кислотой (точнее — с ее отрицательными ионами SO4 и положительными ионами H), образуя сульфат свинца (PbSO4) и воду, при этом на анодных пластинах выделяются избыточные электроны. На катодных пластинах, напротив, наблюдается недостаток электронов, благодаря этому при замыкании анода и катода между ними возникает электрический ток. Во время заряда АКБ проходят обратные реакции — под действием тока от стороннего источника из сульфата свинца образуются чистый свинец, диоксид свинца и кислота.
В ходе данных реакций количество серной кислоты и воды в электролите изменяется, что приводит к изменению его плотности и объема. При разряде АКБ концентрация кислоты понижается, а концентрация воды немного увеличивается, что приводит к падению плотности и к некоторому увеличению объема электролита. В процессе заряда плотность повышается, а объем несколько понижается.
Типы и характеристики электролитов
Электролит изготавливается смешиванием концентрированной серной кислоты и дистиллированной воды в строго определенных пропорциях. Для изготовления электролита используется специальная аккумуляторная серная кислота (по ГОСТ 667-73) и дистиллированная вода (по ГОСТ 6709-72). Данный раствор используется во всех типах современных свинцово-кислотных аккумуляторов.
Главная характеристика электролита — плотность. Для нормальной работы АКБ плотность электролита должна лежать в пределах 1,23-1,4 г/куб. см, так как именно при такой плотности раствор имеет максимальную электропроводность. Однако плотность концентрированной серной кислоты составляет 1,83 г/куб. см, поэтому для достижения необходимой плотности кислота смешивается с водой.
Плотность электролита в значительной степени зависит от двух параметров: температуры и степени заряда аккумулятора.
О зависимости плотности электролита в зависимости от заряда АКБ мы сказали выше: при заряде плотность повышается, при разряде — понижается. Зависимость плотности электролита от температуры простая: при снижении температуры плотность падает, при повышении — возрастает. Поэтому нормальная плотность определяет при температуре +25°C, а чтобы верно измерять плотность при любой температуре, используют таблицу поправок к показаниям ареометра:
| Температура электролита, °C |
Поправка к показаниям ареометра, г/куб. см |
|---|---|
| -55 … -41 | -0,05 |
| -40 … -26 | -0,04 |
| -25 … -11 | -0,03 |
| -10 … +4 | -0,02 |
| +5 … +19 | -0,01 |
| +20 … +30 | 0 |
| +31 … +45 | +0,01 |
| +46 … +60 | +0,02 |
Например, если электролит при температуре +25°C имеет плотность 1,28 г/куб. см, то при температуре -15°C он имеет плотность 1,25 г/куб. см, а при нагреве до +50°C (что часто бывает в подкапотном пространстве автомобиля) плотность повышается до 1,3 г/куб. см.
Чтобы компенсировать изменение плотности электролита в АКБ транспортных средств, эксплуатируемых в различных климатических поясах, применяются электролиты большей или меньшей плотности:
- Летние и для жаркого климата — плотностью 1,23-1,24 г/куб.см;
- Для умеренного и холодного климата — 1,27-1,28 г/куб.см;
- Зимние и для холодного климата — 1,3-1,34 г/куб.см.
Кроме того, при повышении плотности электролита повышается его морозоустойчивость — более плотные электролиты устойчивы к замерзанию, поэтому они лучше подходят для эксплуатации в холодное время года и в холодных климатических поясах.
Сегодня можно купить электролит необходимой плотности, освободив себя от непростой процедуры приготовления правильного по характеристикам электролита из кислоты и воды. Электролит продается в тарах емкостью от 1 до 20 литров, поэтому всегда можно приобрести нужный для работы объем.
Использование аккумуляторного электролита
Сразу нужно отметить, что электролит не используется для текущего обслуживания аккумулятора. Наиболее часто в АКБ снижается уровень электролита и падает его уровень, в этом случае обслуживание выполняется добавлением воды. Дело в том, что в процессе работы аккумулятора из электролита испаряется вода, а кислота остается на месте. Также потеря воды может возникать в случае перезаряда аккумулятора — при достижении определенной плотности концентрация серной кислоты в электролите снижается и ее уже не хватает для нормального протекания указанных выше электролитических реакций. В этих условиях начинается процесс электрохимического разложения воды на водород и кислород — это проявляется «кипением» электролита, а образовавшиеся газы улетучиваются. В обоих случаях — при испарении и разложении воды — плотность электролита повышается, для ее восстановления необходимо использовать воду.
Наиболее часто электролит применяется для восстановления работы аккумулятора в случае замерзания электролита с последующей потерей его характеристик. Если электролит в АКБ замерз, то, прежде всего, необходимо занести его в теплое помещение и дождаться оттаивания. После этого аккумулятор следует поставить на зарядку с малым током — рекомендуется ток около 1 ампера и срок зарядки до 2 суток. В ходе зарядки нужно измерять плотность электролита, если она начнет повышаться, то его можно нормально зарядить и эксплуатировать.
Если же ни при каких условиях плотность не повышается, то следует произвести замену электролита. Это выполняется следующим образом:
- Слить электролит из всех банок батареи;
- Промыть банки дистиллированной водой;
- Добавить новый электролит до указанного уровня;
- Оставить аккумулятор на 2-3 часа для пропитки пластин электролитов;
- Зарядить АКБ малым током 0,5-1 ампер в течение 2 суток.
Зарядку следует остановить, когда плотность электролита и напряжение на клеммах будут стабильными в течение хотя бы двух часов.
Но если замерзание аккумулятора вызвало деформацию или разрушение пластин, то менять электролит уже бесполезно — нужно покупать новую батарею.
Аналогично устраняются и другие проблемы с аккумулятором — утечка или загрязнение электролита, ремонт АКБ после короткого замыкания и т.д. Но в этих случаях прежде нужно проверить аккумулятор на целостность и ремонтопригодность, при обнаружении трещин и других физических повреждений батарея ремонту не подлежит, ее нужно утилизировать.
Особый случай — ввод в эксплуатацию сухозаряженных аккумуляторов, которые поставляются без электролита. Обычно для подготовки такого аккумулятора его нужно заполнить электролитом и дождаться достижения необходимой плотности — все эти действия обязательно прописаны в инструкции к аккумулятору. Предварительную зарядку сухозаряженного АКБ проводить не нужно!
Во всех случаях необходимо правильно рассчитывать объем электролита, чтобы сделать правильную покупку. Объем электролита в АКБ зависит от его напряжения и электрической емкости. Наиболее распространенные 12-вольтовые аккумуляторные батареи емкостью 55-60 А·ч вмещают 2,5-3 литра, емкостью 75-90 А·ч — от 3,5 до 5 литров. Большие 24-вольтовые АКБ емкостью свыше 100 А·ч могут содержать 10 и более литров электролита. При покупке рекомендуется брать электролит с небольшим запасом, так как в процессе работы возможны непредвиденные потери и утечки.
Электролит для автомобильных аккумуляторов
Что такое электролит, его функции
Электролит в аккумуляторе автомобиля — это особая жидкость, обеспечивающая необходимое накопление энергии. От состава и качества такого проводника во многом зависит производительность и срок службы баратеи. Этот показатель измеряется циклами зарядка-разрядка и может отличаться для различных типов аккумулятора. Непосредственно в самом электролите происходит сохранение энергии после подзарядки. Большинство современных аккумуляторов работают с использованием электролитных растворов.
Отличия электролитов для разных типов аккумуляторов

Автомобильные аккумуляторные батареи можно классифицировать по типу используемых веществ. В основном они представлены двумя типами АКБ: щелочными и кислотными. Уже по названию становится понятно, что у них совершенно разная среда электролитного раствора. При покупке или замене жидкости необходимо учитывать этот момент, иначе батарея придет в негодность.
Состав электролитных растворов:
- Для щелочных АКБ используется смесь дистиллированной воды с растворенными в ней солями металлов.
- Кислотные аккумуляторы в качестве проводника используют раствор серной кислоты. Его плотность должна быть в пределах 1,1-1,3 гр/см³. Для самостоятельного приготовления раствора необходимо смешать кислоту и дистиллированную воду.
Недостатком подобных устройств можно считать необходимость регулярного осмотра и доливки в емкость дистиллированной воды. Батарея может выйти из строя при использовании обычной воды или другой подобной жидкости. Дело в том, что дистиллированная вода очищена от подавляющего большинства минеральных примесей. При использовании обычной жидкости, эти элементы вступают в реакцию с кислотой, что приводит к выпадению осадка и появлению налета на пластинах АКБ. Применение дистиллированной воды хорошего качества позволит избежать таких ситуаций и продлит срок полезной эксплуатации батареи.
Процесс изготовления электролита
Для дозаливки АКБ используется только дистиллированная вода, но этот момент относится к приобретенной батарее с уже набранным электролитным раствором. Если же аккумулятор продавался «сухим», приготовить раствор и осуществить его заливку придется самостоятельно. С этим справится любой человек, главное — соблюдать меры безопасности и пропорции разведения веществ.
Для приготовления такого раствора используется серная кислота именно для АКБ. Она подвергается более высокой степени очистки, а ее плотность обычно составляет 1,84 гр/см³. Применение других типов веществ не может обеспечить необходимую чистоту и концентрацию раствора. Если самостоятельное приготовление вызывает затруднения, можно также использовать готовую купленную жидкость для дозаливки АКБ.
Приготовление электролита с кислой средой:
- Емкость для разведения используется исключительно керамическая или из эбонита. Стекло быстро приходит в негодность вследствие агрессивного воздействия кислоты. Объем емкости также имеет значение и должен составлять не менее четырех литров.
- Подходящий инструмент для размешивания раствора. Он также должен обладать стойкостью к кислой среде.
- Ареометр — специальный прибор, измеряющий плотность жидкости. Для конкретного случая он должен определять плотность раствора кислоты (продается в автомагазинах).
- Защитное снаряжение, включающее не только плотную одежду (рабочий фартук), но и перчатки, а также очки для защиты органов зрения.
- В первую очередь необходимо промыть все элементы, с которыми будет впоследствии контактировать химикаты, дистиллированной водой. Это позволит избежать попадания в раствор посторонних примесей.
- Важный момент: в емкость сначала наливают воду, а уже затем добавляют кислоту. Обратная последовательность вызовет бурную химическую реакцию с сильным повышением температуры. При такой ситуации трудно будет избежать ожогов и порчи окружающей обстановки, поэтому это правило следует запомнить обязательно.
- При добавлении кислоты в жидкость, необходимо тщательно медленными движениями перемешать раствор, добиваясь однородного состояния.
- Плотность электролитного раствора зависит от марки АКБ, поэтому этот момент обязательно стоит посмотреть в инструкции оборудования.
- Для приготовления одного литра раствора следует взять 0,35 л серной кислоты и 0,7 — воды. При смешении, объем жидкости немного уменьшается. Кроме того, следует учитывать и температуру раствора, которая также влияет на его плотность. Желательно проводить замеры несколько раз, а использовать готовый раствор только после того, как окончательно убедитесь в его пригодности.
Заливка раствора в АКБ осуществляется при помощи воронки и все того же инструмента для помешивания. Делать это необходимо очень аккуратно, чтобы не вызвать нежелательных химических реакций в батарее. Остатки раствора не стоит утилизировать. Они пригодятся для дозаправки АКБ, поэтому их переливают в стеклянную емкость, плотно закрывают и обязательно маркируют с указанием даты приготовления. Это необходимо, чтобы исключить риск использования негодного уже раствора, а также не перепутать емкость с другими техническими веществами.
Срок службы электролита

Непосредственно сам раствор может храниться длительный срок без потери основных характеристик. Для того, чтобы предупредить выпадение осадка, следует прятать емкость от прямых солнечных лучей и сильных температурных перепадов. Что касается электролита, уже залитого в батарею, его пригодность определить будет сложней, ведь на это влияют многие факторы.
На срок полезной эксплуатации АКБ влияют следующие факторы:
- Регулярная зарядка батареи.
- Поддержание комфортного температурного режима.
- Осмотр и дозаправка электролитом.
- Использование исключительно качественных химических веществ для приготовления раствора.
Точный период использования аккумулятора определить достаточно сложно. На это также влияет марка машины, оснащение дополнительными функциями и интенсивность эксплуатации авто. Кроме того, не так уж редко встречается и заводской брак, при котором из строя выходит вроде бы недавно приобретенная батарея. Обычно производители рекомендуют заменять аккумулятор каждые три-пять лет, но в современных реалиях многие автолюбители не расстаются с ним на протяжении пяти-семи лет.
Как контролировать электролит
Электролит для кислотных аккумуляторов, впрочем, как и для его щелочных аналогов, не имеет фактического срока годности. Обычно сухозаряженная батарея заправляется только раз, после чего осуществляется доливка раствора при необходимости до нужного уровня. Полная замена раствора понадобится нечасто, обычно в случае его помутнения вследствие использования обычной или некачественной дистиллированной воды.
Плотность электролита летом и зимой
В зависимости от температурных режимов эксплуатации авто, необходимо контролировать и плотность используемого электролитного раствора. Для этого необходимо уяснить несколько правил, а также внимательно изучить инструкцию по эксплуатации именно вашего типа батареи.
Что важно знать:
- В северных регионах с суровыми зимами плотность электролита должна быть в пределах 1,27-1,29 гр/см³.
- Для Средней полосы с умеренным климатом предпочтительная плотность электролита от 1,25-1,27 гр/см³.
- В южной части страны плотность электролитного раствора варьируется в пределах 1,23-1,25 гр/см³.
Для продолжительной работы аккумулятора рекомендуется снимать устройство при длительном простое (например, на ночь). Считается, что окружающая температура ниже 30 градусов мороза отбирает у батареи более 50% заряда, что негативно влияет на ее дальнейшую эксплуатацию. Также необходимо знать, какой электролит заливать в аккумулятор летом. Он должен иметь меньшую плотность, нежели «зимний» вариант. Это облегчит прохождение и накопление разряда, а также положительно скажется на продолжительности эксплуатации батареи.
Как добиться нужной плотности в аккумуляторе

При самостоятельном изготовлении раствора, необходимо не только знать, из чего состоит электролит. Главное требование — обеспечение нужной плотности жидкости, чтобы заряд хорошо сохранялся в такой среде. Для контроля и проверки этого показателя применяется простой и доступный прибор — ареометр. Он работает по принципу закона Архимеда и показывает плотность жидкости. При недостаточном ее уровне, раствор разбавляется кислотой, а если необходимо понизить плотность — добавляется дистиллированная вода.
Электролитный раствор обеспечивает работу аккумуляторной батареи, а также определяет ее производительность. При правильном подходе, эта жидкость в обязательном порядке периодически тестируется, доливается, либо заменяется полностью. На работу АКБ в большей мере влияет и температура окружающего воздуха, поэтому в особо суровые морозы стоит заносить аккумулятор в тепло. Какой электролит заливать в аккумулятор зимой, а также другие нюансы приготовления и применения этого проводника рассмотрены в нашей информации.
Электролитический конденсатор — Википедия
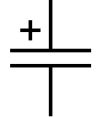 Обозначение на электрических схемах
Обозначение на электрических схемахЭлектролити́ческие конденсаторы — разновидность конденсаторов, в которых диэлектриком между обкладками является плёнка оксида металла, где анод выполнен из металла, а катод представляет собой твёрдый, жидкий или гелевый электролит. Слой оксида на поверхности анода получают методом электрохимического анодирования, что обеспечивает высокую однородность по толщине и диэлектрическим свойствам диэлектрика конденсатора. Технологическая лёгкость получения тонкой однородной плёнки диэлектрика на большой площади электрода позволила наладить массовое производство дешёвых конденсаторов с весьма высокими значениями показателями электрической ёмкости.
Наибольшее распространение получили алюминиевые электролитические конденсаторы (англ.)русск., в которых в качестве одной из обкладок применяется алюминиевая фольга. Также распространены танталовые (англ.)русск. и ниобиевые (англ.)русск. электролитические конденсаторы, в которых металлическим электродом выступает пористая металлическая губка из тантала или ниобия, поверхность которой покрыта оксидными плёнками. Второй обкладкой электролитического конденсатора служит жидкий или твёрдый электролит — вещество или композиция веществ, обеспечивающих электропроводность и сохранение оксидной плёнки.
Электрохимические процессы получения и стабилизации оксидной плёнки диэлектрика требует определённой полярности напряжения на границе металл-электролит. Металлический электрод должен быть анодом (то есть обладать положительным потенциалом), а электролит — катодом (отрицательный потенциал). Несоблюдение полярности вызывает потерю диэлектрических свойств оксидной плёнки и возможное короткое замыкание между обкладками. Если источник этого отрицательного напряжения не ограничивает ток на безопасном низком уровне, то электролит нагреется протекающим током, закипит и давление образующихся газов разорвёт корпус конденсатора. Выпускаются и так называемые неполярные электролитические конденсаторы, в которых конструктивно размещено два встречно-последовательно включённых обычных полярных электролитических конденсатора, которые допускают изменение полярности приложенного напряжения.
Состав электролита подбирается таким образом, чтобы в процессе работы восстанавливались мелкие повреждения в оксидной плёнке электрохимическим анодированием при рабочих напряжениях конденсатора. Однако при этом химическом процессе электролиза выделяется газ, давление которого приводит к вздутию корпуса и даже его возможному разрыву. Также к вскипанию электролита может приводить большой ток через конденсатор, например при обратной полярности включения или при протекании большого реактивного тока при больших пульсациях напряжения на конденсаторе.
Для конденсаторов с жидким электролитом существует проблема высыхания, когда растворитель из электролита испаряется из конденсатора через неплотности герметизации корпуса. При высыхании конденсатор теряет ёмкость и увеличивается последовательное паразитное сопротивление.
Конструкция электролитического конденсатора[править | править код]
Электролитические конденсаторы устроены, как правило, следующим образом: слой электролита заключается между электродами с металлическим типом проводимости, один из которых покрыт тонким слоем диэлектрика (оксидной плёнкой). За счёт чрезвычайно малой толщины диэлектрика, ёмкость конденсатора достигает значительных величин. Однако, соприкосновение двух проводящих пластин, разделённых тонким диэлектриком не является идеальным, для устранения воздушного зазора, в пространство между пластинами вводят электролит.
По типу наполнения электролитом электролитические конденсаторы можно разделить на: жидкостные, сухие, оксидно-полупроводниковые и оксидно-металлические.
В жидкостных конденсаторах используют жидкий электролит, для увеличения ёмкости анод изготавливают объёмно-пористым, например, путём прессования порошка металла и спекания его при высокой температуре. В сухих конденсаторах применяется вязкий электролит. В этом случае конденсатор, изготавливается из двух лент фольги (оксидированной и неоксидированной), между которыми размещается прокладка из бумаги или ткани, пропитанная электролитом.
В оксидно-полупроводниковых конденсаторах в качестве катода используется проводящий оксид (диоксид марганца).
В оксидно-металлических конденсаторах функции катода выполняет металлическая плёнка оксидного слоя.
Изготовляемые промышленностью алюминиевые электролитические конденсаторы состоят из двух тонких алюминиевых пластин фольги. Между пластинами помещается прокладка — пористая бумага, пропитанная электролитом. Фольга и прокладка сворачивается в рулон и помещается в корпус через который сделаны два электрических вывода. Под химическим действием электролита при приложении электрического напряжения поверхность алюминиевой фольги анода окисляется, — на поверхности фольги образуется тонкий слой диэлектрика — оксида алюминия.
При напряжении обратной полярности процесс регенерации диэлектрического слоя прекращается, он постепенно разрушается, приводя к повышенным значениям токов утечки, что может привести к повреждению электрической схемы, причем отказ конденсатора в сильноточных цепях сопровождается выделением тепла, выделением дыма и газов внутри конденсатора, что может привести к разрушению его корпуса. Поэтому электролитические конденсаторы предназначены для работы лишь в цепях с пульсирующим напряжением одной полярности, либо в цепях с постоянным током.
Особенности применения электролитических конденсаторов[править | править код]
 Современные конденсаторы, разрушившиеся без взрыва благодаря специальной разрывающейся конструкции верхней крышки. Конденсаторы со вздувшейся или разорванной крышкой обычно практически непригодны и требуют замены.
Современные конденсаторы, разрушившиеся без взрыва благодаря специальной разрывающейся конструкции верхней крышки. Конденсаторы со вздувшейся или разорванной крышкой обычно практически непригодны и требуют замены.Электролитические конденсаторы (в радиотехнике часто используется жаргонное название — «электролиты») являются низкочастотными элементами электрической цепи, их редко применяют для работы на частотах выше 30 кГц. В основном они служат для сглаживания пульсирующего тока в цепях выпрямителей переменного тока. Например, электролитические конденсаторы широко используются в звуковоспроизводящей и звукоусилительной технике. Межкаскадные в многокаскадных усилителях электролитические конденсаторы разделяют пульсирующий ток (ток звуковой частоты + постоянная составляющая) на переменную составляющую — ток звуковой частоты, который подаётся на следующий каскад усиления и постоянную составляющую, которая не проходит на последующий каскад усиления. Такие конденсаторы называют разделительными.
В связи с тем, что электролитические конденсаторы полярны, при работе на их обкладках должно поддерживаться не изменяющее знака напряжение, что является их некоторым недостатком. Включение конденсатора в электрическую цепь с обратной к рабочей полярностью вызывает увеличение тока утечки, деградации параметров, и даже может привести к взрыву конденсатора при достаточной мощности цепи. По этой причине их можно применять только в цепях, где полярность напряжения на конденсаторе неизменна (с пульсирующим или постоянным напряжением).
Электролитические конденсаторы обладают заметным последовательным паразитным сопротивлением, которое может достигать значения порядка 1 Ом на низких частотах и это сопротивление возрастает с ростом рабочей частоты. Причина этого эффекта — сравнительно низкая проводимость и подвижность ионов электролита. Обычно состав жидкого электролита — водный раствор борнокислого аммония, борной кислоты и этиленгликоля[1].
Широко распространённые алюминиевые конденсаторы по сравнению с другими конденсаторами имеют некоторые специфические свойства, которые следует учитывать при их использовании. За счёт того, что алюминиевые обкладки электролитических конденсаторов скручены в рулон для помещения в цилиндрический корпус, образуется паразитная последовательная индуктивность, эта индуктивность во многих применениях нежелательна.
На верхней части цилиндрического корпуса некоторых электролитических конденсаторов выполнена защитная насечка — предохранительный клапан. Если конденсатор работает в сильноточной цепи переменного напряжения, то он разогревается и жидкий электролит расширяется, испаряется. Корпус конденсатора может лопнуть от избыточного внутреннего давления. Поэтому и применяется защитный клапан, разрушающийся под действием избыточного давления и предотвращающий взрыв корпуса конденсатора с выпуском паров электролита наружу.
Из-за невозможности достичь достаточной герметизации корпуса в некоторых конструкциях электролитических конденсаторов жидкий электролит со временем высыхает. При этом теряется ёмкость конденсатора и увеличивается последовательное сопротивление. Также ускоренному высыханию электролита способствует повышенная температура эксплуатации. Поэтому на корпусе практически любого электролитического конденсатора обычно указывается допустимый диапазон рабочей температуры. Например, от −40 до +105 °C.
Вышедший из строя электролитический конденсатор в результате высыхания электролита в подавляющем числе случаев служит основной причиной отказа бытовой радиоэлектронной аппаратуры[2].
Приготовление электролита для аккумуляторов своими руками
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Что такое электролит?

Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ

Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ

Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.
Таблица 1. Рекомендуемая плотность электролита
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?

Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.

Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Как правильно приготовить электролит в домашних условиях: техника безопасности

Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.
Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
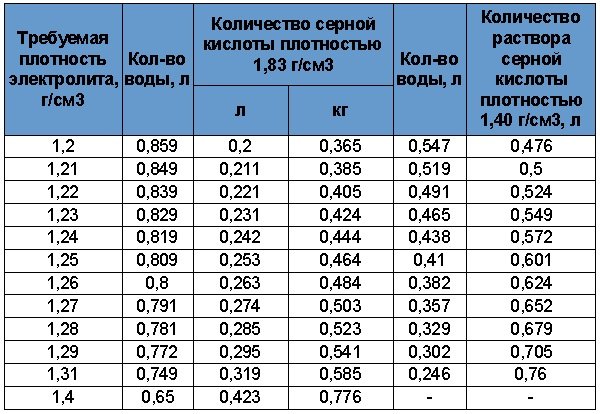
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
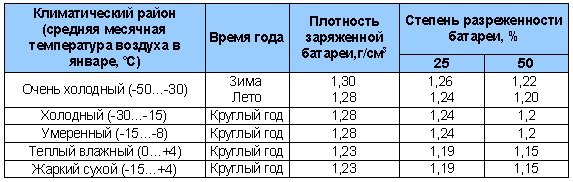
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.
Смотрите видео, как измерить плотность электролита.
Внимание! Вливать воду в кислоту нельзя! В результате этой химической реакции может возникнуть закипание состава, что приведёт к его расплескиванию и возможности получить кислотные ожоги!
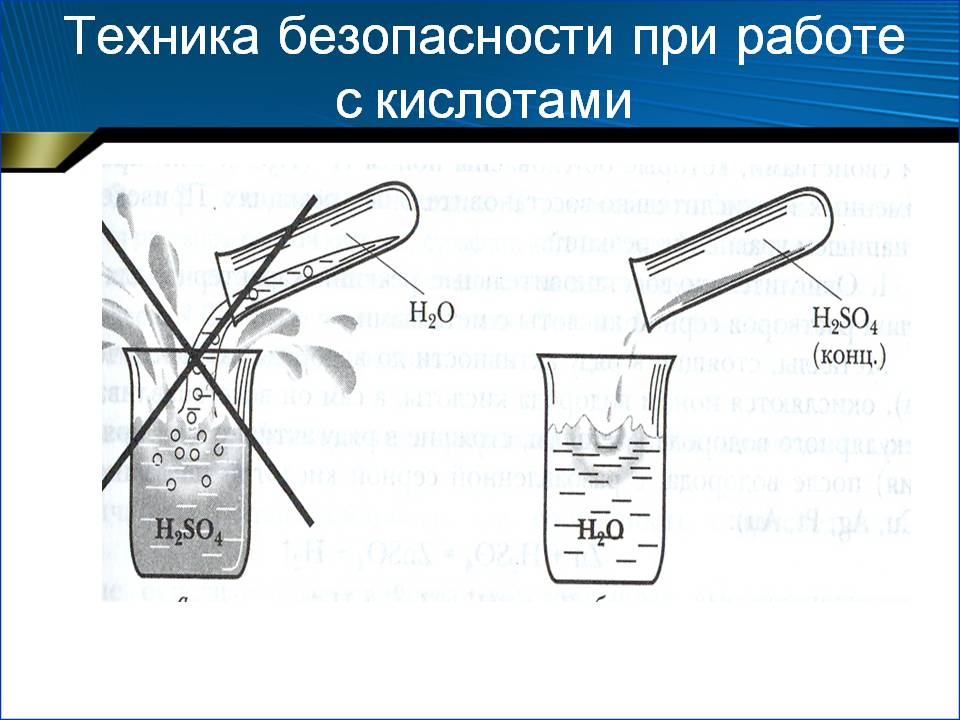
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
Необходимая плотность раствора | Количество твёрдой щелочи равняется количеству электролита, разделенному на |
1,17–1,19 г/см³ | 5 |
1,19–1,21 г/см³ | 3 |
1,25–1,27 г/см³ | 2 |
- Влейте в посуду дистиллированную воду.
- Добавьте щелочь.
- Смешайте раствор, герметично его закройте и дайте настояться в течение 6 часов.
- По истечении времени слейте образовавшийся светлый раствор — электролит готов.
При появлении осадка следует его перемешивать. Если к концу отстаивания он остаётся, слейте электролит так, чтобы осадок не попал в аккумулятор — это приведёт к уменьшению срока его эксплуатации.
Внимание! Во время работ температура щелочного раствора не должна превышать 25 градусов по Цельсию. Если жидкость чрезмерно нагревается, охладите её.
После приведения раствора к комнатной температуре и его заливке в аккумулятор, источник питания необходимо полностью зарядить током, составляющим 10% от ёмкости АКБ (60Ач — 6А).
Как видите, приготовление раствора электролита не такое сложное дело. Главное, следует чётко определиться с необходимым количеством ингредиентов и помнить о безопасности. Вы пробовали развести электролит своими руками? Поделитесь опытом с нашими читателями в комментариях.
Замена электролита аккумулятора — стоит ли доливать электролит и как это сделать?
Свинцовые автомобильные аккумуляторы накапливают энергию до тех пор, пока идет химическая реакция между электролитом и токопроводящими пластинами. При изменении плотности электролита, этот процесс нарушается. Неважно, по какой причине испортился электролит, аккумулятор не работает. Требуется замена электролита, корректировка плотности или приобретение новой АКБ. В случае если электролит приобрел черный цвет, в нем взвесь угля и окалины – аккумулятор придется менять.

Полная замена электролита в аккумуляторе
Электролит представляет смесь серной кислоты с водой в определенной пропорции. О концентрации раствора узнают по плотности, измеряемой ареометром. Показатель основной, даже сотые доли влияют на способность электролита работать на накопление энергии.

Признаки негодного электролита:
- Измерение плотности на заряженном аккумуляторе ареометром. Значение должно быть 1,25 -1,27 г/см3.
- Мутный электролит – свидетельство того что внутри идут паразитные процессы сульфатирования.
- Электролит перемерзал, но герметичность корпуса не нарушена.
- Раствор черный или темно-коричневый со взвесью угля и окалины.
Замена электролита в аккумуляторной батарее будет эффективна, когда полости банок обследованы, промыты, удален сульфатный осадок. Если разрушены пластины, осыпалось активное вещество – аккумулятор не ремонтопригоден.
В домашних условиях полная замена электролита в аккумуляторе автомобиля происходит в последовательности:
- Подготовить эмалированную или стеклянную посуду для слива электролита, средства личной защиты, место для работы, лучше, на открытом воздухе.
- Аккумулятор извлечь, из автомобиля, снять пробки или просверлить отверстия в необслуживаемом АКБ, слить жидкость в подготовленную тару, пользуясь грушей или шприцом.
- Аккумулятор промывается дистиллированной водой многократно, пока не удалится осадок. Возможно, придется удалять сульфат свинца, если есть осадок на пластинах. Нужно убедиться что активная замазка не осыпалась, угольная решетка цела.
- Медленно, с перерывами залить электролит нужной плотности в каждую банку выше пластин на 5-7 мм. Подождать 2-3 часа для выхода пузырьков, замерить плотность электролита, довести до нормы
- Зарядку аккумулятора после замены электролита вести малым током 0,1 А, не допуская закипания. После набора половины емкости, зарядка ведется циклично.
- Произвести герметизацию банок.

Сколько времени заряжать аккумулятор? Заряжать аккумулятор после замены электролита нужно бережно, как после глубокой разрядки. Операция замены электролита своими руками в автомобильном аккумуляторе считается законченной, если он полностью принимает ток длительное время. Зарядка ведется осторожно, кипение в банках недопустимо.
Предлагаем посмотреть видео по правильной замене электролита в автомобильном аккумуляторе.
Почему нельзя доливать электролит в аккумулятор
Вы замерили уровень в банках аккумулятора, он ниже нормы? Это значит, что часть воды испарилась. Если это обслуживаемый аккумулятор, нужно замерить уровень в каждой банке и долить электролит до нормы водой. В необслуживаемом АКБ сквозь стенки видно зеркало залива.
Упал уровень, значит в растворе мало воды и высокая плотность. Добавленный электролит повысит уровень, но плотность раствора останется высокой. Это пагубно для пластин АКБ, сокращается срок службы батареи. Поэтому следует электролит доводить до уровня, доливая дистиллированную воду.
Посмотрите видео о правилах замены электролита.
В каких случаях доливать электролит в аккумулятор?
Электролит в аккумулятор доливают, когда снижается емкость. При этом замеры ареометром содержимого каждой банки показывают снижение плотности. Возможно, в АКБ произошла сульфатация, связанный кислотный остаток в PbSO4 не участвует в реакции.
Если электролит, извлеченный из банок прозрачный, светлый, его можно использовать вторично, добавив корректирующий раствор, плотностью 1,4 г/см3. После снятия осадка на пластинах, батарея заливается прежним электролитом, но он низкой концентрации. Можно ли довести раствор до нужной плотности, доливая электролит? Какой состав взять, и сколько нужно долить в аккумулятор корректирующего раствора?
По технологии нужно заменить порцию слабого состава крепким. Долить и изъять электролит из банок раствор можно, воспользовавшись грушей и мерным цилиндром. Как поменять растворы, в какой пропорции видно из таблицы.

При этом следует использовать только электролит для корректировки. После операции замены, в течение получаса ведется подзарядка, чтобы жидкости смешались. Через два часа после отключения ЗУ проверяется плотность, если нужно, корректировка повторяется.
Предлагаем ознакомиться на видео, как долить электролит в аккумулятор.
Что доливать в аккумулятор, воду или электролит
При соблюдении условий эксплуатации, необслуживаемые аккумуляторы не требуют контроля плотности и уровня электролита. Обслуживаемые АКБ имеют специальные пробки – доступ к каждой банке. В них регулярно проверяются показатель качества и уровня электролита. Запас энергии батареи определяется по самому слабому элементу. Поэтому необходимо поддерживать плотность электролита во всех банках равной.
Плотность в банке может снизиться, если началась сульфатация. Тогда добавка электролита не поможет. Сильное сопротивление забитых пластин не пропускает заряд, добавленная кислота увеличит отложения. В этом случае заряд восстановит сульфатирование. Вот почему нельзя в АКБ с налетом сульфата свинца доливать электролит.

Доливать ли воду в аккумулятор? Если уровень электролита в банках низок, это указывает на интенсивное кипение батареи во время работы. Испаряется в основном водород. С оголенных пластин может осыпаться активная замазка, произойдет сульфатирование, коррозия. Поэтому подлить дистиллированную воду необходимо, но после этого аккумулятор нужно ставить на зарядку по полному циклу.
В период восстановления емкости частично разрушаются кристаллы свинца, происходит разбавление плотного раствора, происходит восстановление активности электролита. Доливают электролит или воду в АКБ в отверстия, прикрытые пробками, малой струей через воронку. Зарядку начинают не сразу, чтобы вышел воздух, смешались составы.
Контроль плотности следует произвести через полчаса после отключения ЗУ. При отклонениях плотности выполнить корректировку.

Когда доливать в электролит, а когда воду
Вопрос, чем долить, если мало электролита в банках аккумулятора требует особого освещения. Такие жидкости, как электролит или дистиллированная вода, нужно заливать в аккумулятор правильно. Корпус и воронка должны быть чистыми, заливаемая жидкость прозрачная, без взвеси. Долить электролит водой можно, используя медицинский шприц без иглы, если корректировка требуется незначительная.
В каких случаях можно доливать воду в электролит аккумулятора? Если в одной или нескольких банках уровень электролита в АКБ низкий. Это происходит из-за кипения банок в условиях повышенной температуры или глубокого разряда. Добавлением дистиллированной воды восполняются потери объема, уменьшается плотность электролита, предотвращается скорый износ батареи.
Нужно ли заряжать аккумулятор после добавления воды, или замены электролита? Любое изменение внутреннего баланса требует выравнивания и стабилизации. После изменения концентрации жидкости необходимо провести полный цикл зарядки, убедиться, что аккумулятор не потерял емкость, стабильно напряжение на клеммах, обеспечивает пусковой ток.
Можно ли долить электролит в аккумулятор, если случайно его выплеснули? Как это случилось? Возможно, перевернули прибор. Это один из немногих случаев, когда вытекший электролит заменяют точно таким же и даже температуру подгоняют. Но все равно потребуется подзарядка и проверка плотности.
Посмотрите видео, как правильно долить электролит в аккумулятор. Вода или электролит, что доливать?
Как долить электролит в необслуживаемый аккумулятор
Все намного сложнее, если потребовалось долить воду в электролит необслуживаемого аккумулятора автомобиля. Сквозь полупрозрачные стенки можно увидеть, сколько электролита в банках. Но как проникнуть в корпус необслуживаемого аккумулятора?
Есть модели, проникнуть внутрь в которых можно отрезав болгаркой верхнюю крышку. Но такие действия нужны, если нужно удалить накипь и промыть осевший внизу шлам. Для того чтобы долить жидкость до нужного уровня сверлят отверстие в корпусе. Позже его заклеивают эпоксидным клеем.
Полностью необслуживаемый аккумулятор требует бережного обращения, боится глубоких разрядов и нестабильной работы бортовой АКБ. Заявленные 5-7 лет он выдерживает только в идеальных условиях.
Как разобрать необслуживаемый аккумулятор чтобы долить электролит
В современных АКБ, таких как VARTA, под декоративной наклейкой можно увидеть 6 пластинок, плотно утопленных в корпус. Если подковырнуть кружок шилом, можно под ним обнаружить пробку резиновую. Тогда появится возможность отобрать пробу электролита, провести замер плотности, откорректировать состав. Если нет пробки – в каждой банке колется отверстие тонким шилом, а вода запускается из шприца, каплями.
Но если обнаружено, что в банках на пластинах белесые полосы – это сульфатация. Чтобы очистить полости, убрать осадок внизу, потребуется вскрыть крышку распиливанием.
Посмотрите видео, как долить электролит в необслуживаемый аккумулятор.
Долить электролит в гелевый аккумулятор
Необслуживаемый гелевый аккумулятор представляет тот же свинцовый аккумулятор, но электролит загустили, он находится в виде геля. С годами вследствие электрохимических паразитных реакций получается водород, выходящий из резинового вентиляционного клапана. Гель обезвоживается и уже неплотно прилегает к пластинам. Емкость АКБ уменьшается.
Долить воду в банки аккумулятора просто. Нужно снять наклейку на корпусе, снять колпачки-клапаны и закапать в каждую банку по 1,2 мл воды. Вода должна впитаться в желеобразную массу. Нужно время. Через полчаса, если вода выше поверхности пластин батареи – извлеките ее фильтром или шприцом.

Питьевые электролиты: особенности применения
Питьевые электролиты – это составы, призванные восполнять потерю природных электролитов (солей) в человеческом организме. Электролиты выпускаются в форме сухих составов (порошка, гранул, шипучих таблеток) для растворения в воде или готовых напитков.
Когда употреблять питьевые электролиты?
Питьевые электролиты иногда считают элементом только спортивного питания. Это логично объясняется интенсивной потерей солей при выделении пота во время интенсивных физических нагрузок. Солевые составы востребованы и необходимы во врачебной практике. Аптечный препарат регидрон, представляющий собой растворимую сухую смесь солей, назначают при диарее. На этот факт обратите внимание. Во время такого заболевания организм теряет соли вместе с выделяющейся жидкостью, но не может восполнить дефицит с помощью натуральных пищевых продуктов из-за назначенной диеты. Здоровый человек получает минеральные вещества с едой. Если занятия спортом ведутся на серьезном уровне, и рацион выбирается продуманно, соли поступают в достаточном количестве. Это не исключает вероятность резкого изменения концентрации электролитов, негативно сказывающегося на состоянии спортсмена. Необходимость употребления и дозировку питьевого электролита определяют с учетом интенсивности потери солей и состава напитка. Главный принцип – восполнять то, что потеряно.
Когда употреблять питьевые электролиты?
Виды питьевых электролитов
Питьевые электролиты в магазинах отличаются по составу и назначению. Базовая характеристика электролитических напитков — осмотическое давление раствора (ОД), указывающее на концентрацию частиц (солей, углеводов, подсластителей, консервантов и пр.).
- В состав изотонических напитков кроме солей входит 6-8% углеводов. Осмотическое давление – 270-330 мосм/кг. Такие смеси восстанавливают баланс жидкости и подпитывают организм с помощью углеводов. Изотоники рекомендуют легкоатлетам, бегунам, участникам командных спортивных игр.
- Для гипотонических смесей характерно минимальные содержание углеводов и значение ОД. Рекомендуются при необходимости восстановления баланса солей воды и строгом контроле калорий. Гипотонические электролитические напитки подходят для наездников, гимнастов.
- Гипертонические электролиты содержат максимум углеводов в сравнении с другими видами. Используются как источники мышечного гликогена, углеводные добавки. Составы калорийны. Во время тренировок гипертонические электролиты сочетают с изотониками. В чистом виде гипертонические электролиты рекомендуют пить после тренировки. Рекомендованы для занятий спортом, требующих выносливости.
Об изотониках, как их принимать, сколько и зачем. Смотрите.
Вредные вещества в составе электролитических напитков
Обращайте внимание на состав смеси при выборе электролита.
- Сахар. В некоторых электролита содержание сахара достигает 18%. «Сахарные» углеводы не полезны для спортсмена. Эти вещества лучше получать из круп, фруктов и пр. Сладкий вкус напитка мешает утолению жажды.
- Кофеин. Вещество дает мгновенный «вброс» энергии, но может повышать давление и негативно влиять на работу сердца. Кофеин характеризуется мочегонным действием, что снижает результат действия электролита. Обратное действие объясняется увеличением интенсивности выведения солей.
- Лимонная кислота. Не рекомендуется при заболеваниях желудка. Вызывает аллергию. Чтобы не допустить разъедания эмали зубов лимонной или другими кислотами, напитки рекомендуют пить через соломинку.
- Искусственные красители, ароматизаторы. Практической пользы не несут. Опасны канцерогенным действием. Честный производитель делает соответствующую пометку на упаковке. Консерванты добавляют в готовые жидкие смеси, поэтому лучше приобретать сухие составы, приготавливая электролиты порционно.
Дозировка электролитов
Для предотвращения обезвоживания за 20 минут до занятий пьют 250 мл электролитического напитка. Во время занятий практикуется следующий режим: по 120-180 мл один раз в 15-20 мин. В идеале дозировка должна корректироваться спортивным врачом. диетологом, принимающим во внимание нюансы (степень нагрузки, биометрические параметры спортсмена).
Самостоятельное приготовление
Напитки-электролиты готовят самостоятельно. На литр воды добавляют щепотку соли и апельсиновый сквош (концентрированный сок):
- для изотонических смесей – 200 мл,
- для гипотонических электролитов – 100 мл,
- для гипертонических составов – 400 мл.
Даже если такие напитки уступают по моментальному результату покупным электролитам, они безопасны и полезны.
Похожие статьи:
No tags for this post.XuMuK.ru — ЭЛЕКТРОЛИТЫ — Химическая энциклопедия
|
|
ЭЛЕКТРОЛИТЫ, в-ва, в к-рых в заметной
концентрации присутствуют ионы, обусловливающие прохождение электрич. тока
(ионную проводимость). Электролиты также наз. проводниками второго рода. В узком
смысле слова электролиты-в-ва, молекулы к-рых в р-ре вследствие электролитической
диссоциации распадаются на ионы. Различают электролиты твердые,
растворы электролитов и ионные расплавы. Р-ры электролитов часто
также наз. электролитами. В зависимости от вида р-рителя различают электролиты водные и электролиты
неводные. Особый класс составляют высокомол. электролиты- полиэлектролиты.
Электролиты по своей структуре представляют собой сложные системы, состоящие из ионов, окруженных молекулами р-рителя, недиссоциированных молекул растворенного в-ва, ионных пар и более крупных агрегатов. Св-ва электролитов определяются характером ион-ионных и ион-молекулярных взаимод., а также изменением св-в и структуры р-рителя под влиянием растворенных частиц электролитов. В полярных р-рителях благодаря интенсивному взаимод. ионов с молекулами р-рителя образуются сольватные структуры (см. Сольватация). Роль сольватации с увеличением валентности ионов и уменьшением их кристаллографич. размеров возрастает. Мерой взаимод. ионов с молекулами р-рителя является энергия сольватации. В зависимости от концентрации электролитов выделяют область разбавленных р-ров, к-рые по своей структуре близки к структуре чистого р-рителя, нарушаемой, однако, присутствием и влиянием ионов; переходную область и область концентрир. р-ров. Весьма разбавленные р-ры слабых электролитов по своим св-вам близки к идеальным р-рам и достаточно хорошо описываются классич. теорией электролитич. диссоциации. Разбавленные р-ры сильных электролитов заметно отклоняются от св-в идеальных р-ров, что обусловлено электростатич. межионным взаимод. Их описание проводится в рамках Дебая-Хюккеля теории, к-рая удовлетворительно объясняет концентрационную зависимость термодинамич. св-в — коэф. активности ионов, осмотич. коэф. и др., а также неравновесных св-в -электропроводности, диффузии, вязкости (см. Электропроводность электролитов). При повышении концентрации р-ров сильных электролитов возникает необходимость в учете размера ионов, а также влияния сольватационных эффектов на характер межионного взаимодействия. В переходной концентрационной области под влиянием ионов происходит существенное изменение структуры р-рителя. При дальнейшем увеличении концентрации электролита почти все молекулы р-рителя связаны с ионами в сольватационные структуры и обнаруживается дефицит р-рителя, а в области концентрированных р-ров структура р-ра все более приближается к структуре соответствующих ионных расплавов или кристаллосольватов. Данные компьютерного моделирования и спектроскопич. исследований, в частности методом рассеяния нейтронов с изотопным замещением, свидетельствуют о значит. степени упорядоченности в концентрированных р-рах электролитов и об образовании специфич. для каждой конкретной системы ионных структур. Напр., для водного р-ра NiCl2 характерен комплекс, содержащий ион Ni2+, окруженный 4 молекулами воды и 2 ионами Сl— в октаэдрич. конфигурации. Ионные комплексы связываются между собой посредством связей галоген — водород — кислород и более сложных взаимод., включающих молекулы воды. В ионных расплавах специфика упорядочения характеризуется структурными факторами и, описывающими флуктуации ионной плотности и заряда q как ф-ции волнового числа k, к-рое с точностью до постоянной Планка h совпадает с величиной импульса, передоваемого расплаву рассеивающей частицей, напр. нейтроном. Для бинарного электролита где
— парциальные структурные факторы, относящиеся к взаимод. катионов и анионов
между собой и друг с другом. Для расплавов типа NaCl ф-ция
близка к нулю, вследствие чего электролит можно рассматривать как смесь двух жидкостей,
одна из к-рых характеризуется упорядочением по ионной плотности через ф-цию,
а вторая -«зарядовым» упорядочением через ф-цию.
Ф-ция
имеет типичное поведение для систем с «плотностным» упорядочением, отражая
значит. степень беспорядка в расположении частиц. В отличие от этого
имеет резкий пик, отражающий сильное упорядочение в распределении заряда,
определяемое экранированием и требованиями локальной электронейтральности.
Такое упорядочение ионов приводит к возможности существования в электролитах коллективных
возбуждений, к-рые могут проявляться в виде пиков динамич. структурного
фактора
описывающего динамику флуктуации плотности заряда расплава (
— частота, связанная с энергией, передаваемой расплаву рассеивающей частицей).
Для ионных расплавов электролитов, катионы к-рых склонны к образованию ковалентных
связей с анионами (напр., для расплава CuCl), наблюдается сильная корреляция
взаимод. между анионами и довольно слабая — между катионами.
Лит.: Харнед Г., Оуэн Б., Физическая химия растворов электролитов, пер. с англ., М., 1952; Термодинамика и строение растворов. Материалы симпозиума «Химия водных систем при высоких температурах и давлениях», Иваново, 1986; March N.H., Тоsi M. P., Coulomb liquids, L.-[a.o.], 1984; см. также лит. к ст. Растворы электролитов, Электропроводность электролитов, Электролиты неводные, Электролиты твердые. М. Ф. Головко.
|