строение атома, аллотропные модификации, физические и химические свойства
I. Посмотрите научно-популярный фильм: “Сера”
Сейчас невозможно установить, когда человек впервые познакомился с серой и её соединениями. Произошло это очень давно. Она помогала нашим предкам получать огонь, вернее, снопы искр при ударе кресалом по обломку пирита. Использовали её для приготовления красок и косметических средств. Знали её и древние индийцы, именно они дали название — «сира» — означает «желтый». Химический символ произошел от латинского слова «сульфур». Древние римляне называли серу «желчью бога Вулкана» (покровителя огня).Картина Карла Брюллова «Гибель Помпеи».
Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точное время открытия серы не установлено, но, как сказано выше, этот элемент использовался до нашей эры, а значит, знаком людям с древнейших времён.
II. Положение серы в ПСХЭ, строение атома
В подгруппу кислорода(халькогены) входят элементы: кислород, сера, селен, теллур, полоний.
Химический элемент сера расположен в VIА-группе, 3 периоде ПСХЭ.
 На внешнем электронном слое атома серы находится 6 электронов. Относится к р-элементам. Неметалл.
На внешнем электронном слое атома серы находится 6 электронов. Относится к р-элементам. Неметалл.
Проявляя свойства окислителя при образовании веществ с металлами и водородом, сера приобретает степень окисления -2 (принимает 2 электрона).
|
Размещение электронов по |
Степень |
Валентность |
|
+2, -2 |
В основном состоянии II |
|
|
+4 |
Первое возбуждённое состояние IV |
|
|
+6 |
Второе возбуждённое состояние VI |
III. Сера в природе
Сера является шестнадцатым по химической распространённости элементом в земной коре. Встречается в свободном (самородном) состоянии и в связанном виде.
Самородная сера:
Украина, Поволжье, Центральная Азия и др.
Важнейшие природные минералы серы:
Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах.
Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обусловливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах, ногтях, кожных покровах. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Содержание серы в организме человека массой 70 кг — 140 г. В сутки человеку необходимо 1 г серы.
Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго. Соединения серы могут служить лекарственными препаратами.
Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Сульфаты
- CaSO4 x 2H2O — гипс
- MgSO4 x 7H2O – горькая соль (английская)
- Na2SO4 x 10H2O – глауберова соль (мирабилит)
IV. Физические свойства, аллотропия
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С
Аллотропия
Для серы характерны несколько аллотропных модификаций:
|
Ромбическая (a — сера) — S8 t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
|
Моноклинная (b — сера) — S8 темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. |
Пластическая Sn коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую. |
|
|
|
Опыт: “Получение пластической серы”
|
Взаимопревращение аллотропных модификаций серы
V. Получение серы
В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который ставили другой, с отверстием в дне. Последний заполняли породой, содержащей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок. В настоящее время серу получают главным образом путём выплавки самородной серы непосредственно в местах её залегания под землёй. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
1. Промышленный метод — выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода): 2H2S + O2 = 2S + 2H2O
3. Реакция Вакенродера: 2H2S + SO2 = 3S + 2H2O
VI. Химические свойства серы
|
Сера — окислитель S0 + 2ē -> S-2 |
Сера — восстановитель S — 2ē -> S+2; S — 4ē -> S+4; S — 6ē -> S+6 |
1) Сера реагирует со щелочными металлами без нагревания: Опыт: “Взаимодействие серы с натрием” 2Na + S -> Na2S c остальными металлами (кроме Au,Pt) — при повышенной t°: 2Al + 3S –t°-> Al2S3 Опыт: “Взаимодействие серы с цинком” Zn + S –t°-> ZnS Опыт: “Взаимодействие меди с серой” Cu + S –t°-> CuS 2) С некоторыми неметаллами сера образует бинарные соединения: H2 + S -> H2S 2P + 3S -> P2S3 C + 2S -> CS2 |
1) С кислородом: S + O2 –t°-> S+4O2 2S + 3O2 –t° ;pt-> 2S+6O3 2) С галогенами (кроме йода): S + Cl2 -> S+2Cl2 3) С кислотами — окислителями: S + 2H2SO4(конц) -> 3S+4O2 + 2H2O S + 6HNO3(конц) -> H2S+6O4 + 6NO2 + 2H2O 4) Реакции диспропорционирования: 4) 3S0 + 6KOH -> K2S+4O3 + 2K2S-2 + 3H2O
|
VII. Применение
Примерно половина производимой серы используется в производстве серной кислоты.
Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Получение эбонита, производство пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний). Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
Железный купорос FeSO4×7H2O используют при анемии.
BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
Алюмокалиевые квасцы KAI(SO4) 2×12H2O — кровоостанавливающее средство при порезах.
Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
Применение серы и её соединений
VIII. Тренажеры
Тренажёр №1 — Характеристика серы по её положению в периодической системе Д. И. Менделеева
Тренажёр №2 — Химические свойства серы
Тренажёр №3 — Взаимодействие серы с металлами
IX. Задания
№1. Закончите уравнения реакций:
S + O2 =
S + Na =
S + H2 =
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H2S → S → Al2S3 → Al(OH)3
№3. Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al + S = (при нагревании)
S + H2 = (150-200)
S + O2 = (при нагревании)
S + F2 = (при обычных условиях)
S + H2SO4(к) =
S + KOH =
S + HNO3 =
ЦОРы
Научно-популярный фильм: “Сера”
Видео: Получение пластической серы
Анимацмя: Взаимопревращение аллотропных модификаций серы
Опыт: “Взаимодействие серы с натрием”
Опыт: “Взаимодействие серы с цинком”
Опыт: “Взаимодействие меди с серой”
Применение серы и её соединений
Электронное строение атома серы. Сера
СЕРА — СЕРА, Sulfur, хим. элемент VІ гр. Менделеевской системы, символ S, порядковый номер 16, ат. в. 32,07. Известна с древнейших времен. В природе встречается в виде залежей водного (нептунического) и вулканического. происхождения. Встречается также в … Большая медицинская энциклопедия
СЕРА — хим. элемент, символ S (лат. Sulfur), ат. н. 16, ат. м. 32,06. Существует в виде нескольких аллотропных модификаций; среди них сера моноклинной модификации (плотность 1960 кг/м3, tпл = 119°С) и ромбическая сера (плотность 2070 кг/м3, ίπι = 112,8… … Большая политехническая энциклопедия
— (обозначается S), химический элемент VI группы ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, неметалл, известный с древности. Встречается в природе как в виде отдельного элемента, так и в виде сульфидных минералов, таких как ГАЛЕНИТ и ПИРИТ, и сульфатных минералов,… … Научно-технический энциклопедический словарь
В мифологии ирландских кельтов Сера отец Парталона (см. глава 6). Согласно некоторым источникам, именно Сера, а не Парталон был мужем Дилгнейд. (
ОПРЕДЕЛЕНИЕ
Сера расположена в третьем периоде VI группе главной (А) подгруппе Периодической таблицы.
Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название халькогены. Обозначение — S. Порядковый номер — 16. Относительная атомная масса — 32,064 а.е.м.
Электронное строение атома серы
Атом серы состоит из положительно заряженного ядра (+16), состоящего из 16 протонов и 16 нейтронов, вокруг которого по 3-м орбитам движутся 16 электронов.
Рис.1. Схематическое строение атома серы.
Распределение электронов по орбиталям выглядит следующим образом:
1s 2 2s 2 2p 6 3s 2 3p 4 .
На внешнем энергетическом уровне атома серы находится шесть электронов, все они считаются валентными. Энергетическая диаграмма принимает следующий вид:

Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять степень окисления +2. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d -орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d -орбитали, а после — электроны 3s -подуровня:

Этим объясняется наличие у серы ещё двух степеней окисления: +4 и +6.
Сера — одно из немногих веществ, которыми уже несколько тысяч лет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под №16. Вещества, содержащие серу, могут быть как полезны для человека, так и вредны.
Сера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности. Сера привлекала внимание характерной окраской, голубым цветом пламени и специфическим запахом, возникающим при горении (запах сернистого газа). Считалось, что горящая сера отгоняет нечистую силу. В Библии говорится об использовании серы для очищения грешников. У человека средневековья запах «серы» ассоциировался с преисподней. Применение горящей серы для дезинфекции упоминается Гомером. В Древнем Риме с помощью сернистого газа отбеливали ткани. Издавна использовалась сера в медицине — ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний. В 11 в. Авиценна (Ибн Сина), а затем и европейские алхимики, полагали, что металлы, в том числе золото и серебро, состоят из находящихся в различных соотношениях серы и ртути. Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные.
Данный элемент обладает сравнительно низкой атомной массой, она равняется тридцати двум граммам на моль. Характеристика элемента сера включает в себя такую особенность данного вещества, как способность обладать разной степенью окисления. То есть, она может проявлять и окислительные, и восстановительные свойства.
Находится в главной подгруппе шестой группы. Так как порядковый номер серы в таблице Менделеева — шестнадцать, то можно сделать вывод, что в ее ядре находится именно такое количество протонов. Исходя из этого, можно сказать, что и электронов, вращающихся вокруг, тоже шестнадцать. Количество же нейтронов можно узнать, отняв от молярной массы порядковый номер химического элемента: 32 — 16 = 16. Каждый электрон вращается не хаотично, а по определенной орбите. Так как сера — химический элемент, который относится к третьему периоду таблицы Менделеева, то и орбит вокруг ядра три. На первой из них расположено два электрона, на второй — восемь, на третьей — шесть. Электронная формула атома серы записывается следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 4 .
Как уже говорилось, сера может проявлять разные степени окисления. Это связано с строением ее атома. Атом серы может принять два электрона и будет иметь заряд -2. Сера может также отдать два электрона и тогда она примет степень окисления +2. Для того чтобы сера имела степень окисления +4 или +6, нужно задействовать d-орбиталь, на которую перейдут электроны. Сера имеет валентности II, IV, VI. Валентности IV соответствует степень окисления +4, валентности VI — +6. При валентности IV перейдет один электрон с p-орбитали на d-орбиталь, при валентности VI — один с p-орбитали и один с s-орбитали на d-орбиталь.
ОПРЕДЕЛЕНИЕ
Сера расположена в третьем периоде VI группе главной (А) подгруппе Периодической таблицы.
Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название халькогены. Обозначение — S. Порядковый номер — 16. Относительная атомная масса — 32,064 а.е.м.
Электронное строение атома серы
Атом серы состоит из положительно заряженного ядра (+16), состоящего из 16 протонов и 16 нейтронов, вокруг которого по 3-м орбитам движутся 16 электронов.
Рис.1. Схематическое строение атома серы.
Распределение электронов по орбиталям выглядит следующим образом:
1s 2 2s 2 2p 6 3s 2 3p 4 .
На внешнем энергетическом уровне атома серы находится шесть электронов, все они считаются валентными. Энергетическая диаграмма принимает следующий вид:

Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять степень окисления +2. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d -орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d -орбитали, а после — электроны 3s -подуровня:
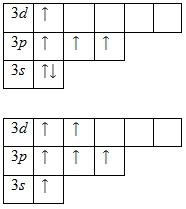
Этим объясняется наличие у серы ещё двух степеней окисления: +4 и +6.
Примеры решения задач
ПРИМЕР 1
Цель урока. Формирование мышления учащихся через активизацию представлений о взаимосвязи строения веществ с их свойствами; обобщение и систематизация знаний по теме «Соединения серы».
Задачи. Образовательные: повторить строение атома серы, строение молекул, особенности физических и химических свойств важнейших соединений серы; показать учащимся генетическую связь между соединениями серы; рассмотреть экологические проблемы, связанные с переработкой соединений серы.
Воспитательные: продолжить формирование научного мировоззрения учащихся, а также мировоззренческих идей о материальности мира, причинно-следственных связях явлений; воспитание культуры общения.
Развивающие : развитие познавательного интереса школьников, совершенствование умений анализировать и сравнивать, участвовать в проблемном диалоге.
Тип урока. Повторительно-обобщающий.
Методы и методические приемы. Фронтальный опрос, беседа, дидактические игры, самостоятельная работа учащихся со схемами-конспектами, демонстрация средств наглядности, лабораторный эксперимент.
Оборудование и реактивы. Схема «Семейный портрет серы» (генетическая связь соединений серы), заготовки для дидактических игр «Волшебный цветок» и «Химический поезд», «сульфурики» (дополнительный балл за правильный ответ – символ химического знака «S»), раздаточный материал для учащихся (схема-конспект), электронная презентация урока; шаростержневые модели молекул серы разных аллотропных модификаций;
н а д е м о н с т р а ц и о н н о м с т о л е – образцы серы, штатив с пробирками, растворы разбавленной серной кислоты, хлорида бария, сульфата натрия;
н а с т о л а х у ч а щ и х с я – штатив с пробирками, растворы разбавленной серной кислоты, хлорида бария, сульфата натрия.
ХОД УРОКА
Организационный момент
Вступительное слово учителя , в котором сообщаются цель и план урока, подчеркивается значение материала изученной темы.
Повторение и обобщение изученного материала
Рефлексия учащихся на начальном этапе урока
Учитель. Прошу вас, уважаемые ребята, в схемах-конспектах отметить свое настроение на данном этапе урока (рис. 1).
Учитель объясняет условия получения «сульфурика» и правила пользования им («сульфурик» дает право на дополнительный балл при дальнейшем изучении предмета).
Знакомство с семейным портретом серы
На доске – схема «Семейный портрет серы» (рис. 2). Все формулы на портрете закрыты.
Учитель. Сегодня на уроке мы должны назвать ближайших родственников серы. Вспомнить, каковы их имена (т.е. названия веществ), каковы особенности их характера, чем они полезны и где могут быть использованы. Перед вами схема «Семейный портрет серы». По ходу урока мы будем вспоминать соединения серы и к концу урока откроем все имена персонажей ф
формула, электронное строение, аллотропные модификации и влияние на здоровье человека
Сера является одним из распространенных химических элементов на нашей планете, который в прошлые эпохи сыграл важную роль в возникновении жизни. В настоящее время ее роль также остается важной не только для биологических процессов, протекающих в живых организмах, но и для развития индустрии и технологий. В статье приведены электронная формула серы, ее физические и химические свойства, а также влияние элемента на здоровье и окружающую среду.

Характеристики вещества
В периодической системе Д. И. Менделеева сера находится в третьем периоде и занимает клетку с номером 16. Эта цифра содержит полную информацию об электронной формуле элемента. Так, в ядре одного атома серы содержится 16 протонов. Количество нейтронов в большинстве случаев также составляет 16, однако, существую также другие стабильные изотопы, например, S33, S34 или S36. Где число указывает на атомную массу ядра. Изотоп S32 в образцах серы составляет 95%, 4% приходятся на стабильный изотоп S34.
Расположение в периодической таблице химических элементов позволяет записать электронную формулу рассматриваемого вещества. Поскольку сера находится в третьем периоде и VI группе, то ее атомы имеют три типа электронных уровней. Эти уровни обозначают латинскими символами, для серы это следующие:

Электронная формула обычно записывается так: S = [Ne] 3s2 3p4. То есть один атом S имеет внутреннюю электронную оболочку такую же, как у благородного газа неона. Внешняя оболочка содержит 6 электронов, из них 2 находятся на 3s уровне и полностью его заполняют, 4 расположены на трех 3p уровнях.
Записанная формула содержит ответ на вопрос о возможных степенях валентности. Поскольку 2 электрона на 3p уровнях не спарены, то оба они могут участвовать в образовании химических связей, то есть сера в этом случае будет проявлять валентность II. Если один из двух спаренных электронов 3p уровня перейдет на 3d, то рассматриваемый элемент будет проявлять валентность IV. Наконец, если удастся перебросить один электрон с уровня 3s на 3d, тогда получится шестивалентная сера.
Физические свойства

Рассматриваемый элемент относится к классу неметаллов, имеет желтый или оранжевый цвет, является мягким (по шкале Мооса относительная твердость равна 2), хрупким. Характерный запах серы знаком многим, в комбинации с водородом образуется газ h3S, который известен как неприятный запах тухлого яйца. Элемент способен окисляться до газообразного диоксида SO2. Этот процесс сопровождается горением с пламенем синего цвета. В воде растворимость S практически равна нулю. Средняя плотность твердой серы составляет 1,96 г/см3, то есть она практически в два раза плотнее жидкой воды.
Если вещество имеет одинаковый состав, но разное пространственное (графическое) строение, то говорят о наличии аллотропных модификаций. Сера их имеет несколько, причем их свойства и структура до конца еще не изучены в настоящее время. Особенностью этого элемента является то, что у него аллотропия наблюдается не только в твердом, но также в жидком и в газообразном агрегатных состояниях.
Твердая форма
Твердая сера представлена двумя стабильными кристаллическими решетками. Это следующие решетки:
- орторомбическая, или альфа-S;
- моноклинная, или бета-S.
Формула ромбической серы S8, она стабильна при температурах ниже 96 0C, если ее нагреть выше этого значения, то она плавно перестроится в моноклинную кристаллическую решетку бета-S. Разница в пространственном расположении атомов S в этих решетках приводит к тому, что некоторые их физические свойства начинают различаться. Например, орторомбическая сера является более пластичной при механических деформациях, чем моноклинная.

Отметим, что обе решетки имеют структурную одну и ту же единицу — это молекула S8, то есть 8 атомов S объединенных в замкнутую фигуру, которая представляет собой многоугольник в трех измерениях.
Аллотропия жидкости
Жидкая сера обладает удивительными физическими свойствами. Плавится моноклинная решетка при температуре 115 0C. Процесс плавления на атомном уровне заключается в разрушении устойчивых связей между кольцами S8 в твердой структуре. Расплав, структурной единицей в котором является молекула S8, обладает низкой вязкостью и высокой текучестью, он имеет желто-оранжевый цвет.

Дальнейший нагрев жидкой серы приводит к значительному уменьшению ее текучести и увеличению вязкости. При этом цвет вещества изменяется от оранжево-желтого к коричнево-красному. Эту трансформацию наука объясняет изменением молекулярной структуры. При увеличении температуры до 200 0C кольца S8 начинают разрушаться из-за воздействия температурного фактора. Разомкнутые остатки колец образуют длинные цепочки-молекулы, содержащие сотни и даже тысячи атомов S. Эти цепочки являются причиной снижения вязкости жидкости и появлению анизотропии в ее свойствах.
Если высокотемпературную жидкую серу резко охладить, например, вылить ее в холодную воду, то она перейдет в твердое состояние, основной характеристикой которого будет высокая пластичность. В отличие от стабильной и хрупкой альфа-S пластическая сера является метастабильным веществом, поэтому с течением времени при комнатной температуре из нее начинают выделяться орторомбические кристаллики.
Газообразное состояние
Проявляет свои удивительные свойства сера и в газообразном виде. Дело в том, что точка кипения ее находится при температуре 445 0C. Образующийся при этом газ имеет зеленый цвет и состоит из восьми атомных колец S8.
Дальнейшее увеличение температуры до 780 0C приводит к термическому разрушению этих колец и образованию диатомного газа S2, имеющего уже фиолетовый, а не зеленый цвет. Когда температура достигает значения 1800 0C, то уже никакой сложной структуры не наблюдается в газе. Он состоит исключительно из простых атомов серы и не имеет цвета.
Сера как химический элемент
Электронное атомное строение однозначно определяет химические свойства серы. Поскольку она может проявлять валентности II, IV и VI, то в своих соединениях она способна выступать как в роли окислителя, так и в роли восстановителя.
Примером окислительных реакций является образование сульфидов металлов, например, FeS или ZnS. Многие ученые считают, что на заре зарождения жизни на Земле именно окисление металлов серой сыграло главную роль в развитии живых организмов. Этот факт подтверждается рядом археологических находок в древних геологических пластах.

К восстановительным реакциям относительно серы можно назвать взаимодействия с такими сильными окислителями, как кислород или азот. При взаимодействии с O сера окисляется с образованием серного газа SO2. Он является основным компонентом в вулканических выбросах. Большой процент этого газа также содержится в выхлопах автомобилей при сгорании бензина и дизельного топлива. Если SO2 растворить в воде, то получается одна из самых сильных кислот — h3SO4, которая хорошо известна любителям не только химии, но и автомобилей, поскольку она является основным компонентом электролита в аккумуляторных батареях.
С азотом сера вступает в реакцию при определенных условиях с образованием соединения (SN)x. Оно представляет собой полимер, который впервые был получен в 1975 году. Особенностью этого нитрида является то, что он проявляет свойства металла, хотя состоит из двух неметаллических элементов.
Применение в индустрии
Сера используется во множестве индустриальных процессов и в конечных продуктах. Некоторые из них приводятся в списке:
- производство серной кислоты для аккумуляторов электроэнергии;
- вулканизация каучука для придания ему необходимых физических свойств;
- отбеливание бумаги;
- тиосульфат натрия применяется в индустрии фотографии как «закрепитель», способный растворять бромид серебра;
- сульфат магния используется в качестве важной составляющей в удобрениях для роста растений;
- серный ангидрид — хороший антисептик.

Отрицательное влияние на здоровье
Несмотря на то что сера является одним из важных элементов для живых существ на Земле (она содержится в яйцах, масле чеснока, горчице, протеинах и др.), использование ее соединений должно осуществляться с соблюдением техники безопасности и максимально осторожно. Практически все соединения этого элемента являются токсичными для человека и животных. В общем случае выделяют следующие негативные эффекты от воздействия серных соединений:
- влияние на нервную систему и поведение;
- нарушение кровяного тока;
- вред для сердца;
- негативное воздействие на органы зрения и слуха;
- вред для иммунной системы;
- нарушения в работе кишечника и желудка;
- повреждение печени и почек;
- нарушения в работе гормонов
- отрицательное воздействие на кожу, легкие.
Например, при вдыхании паров, содержащих соединения с серой, происходит настолько сильное раздражение альвеол легких, что возникает обильное кровотечение. Это может привести к удушью и летальному исходу.

Другой пример — это кислотные дожди, которые раздражают зрение, кожные покровы и дыхательную систему животных. Причиной их возникновения является серный газ SO2, который в большом количестве выбрасывается в атмосферу в результате деятельности человека.
Опасны серные соединения еще и тем, что при низких концентрациях человек способен чувствовать сильный неприятный запах. Однако, при умеренных и больших концентрациях происходит «притупление» обоняния вплоть до полного исчезновения чувствительности. В таком состоянии человек не может вовремя среагировать и принять меры безопасности.
Строение атома | CHEMEGE.RU
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.

И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.

Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это на заряженная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома (массовое число A) равна суммарной массе крупных частиц, которе входят в состав атома — протонов и нейтронов. Поскольку масса протона и нетрона примерно равна 1 атомной единице массы, можно использовать формулу: M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.

Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:

Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.

В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так:  , а не так:
, а не так: 
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:

Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s 
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s  2s
2s 
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s  2s
2s 
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s  2s
2s  2p
2p 
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s  2s
2s  2p
2p 
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s  2s
2s  2p
2p 
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s  2s
2s  2p
2p  3s
3s 
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s 
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s 
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s  3d
3d 
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s  3d
3d 
+23V [Ar]3d34s2 [Ar] 4s  3d
3d 
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s  3d
3d 
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбителей. Этот эффект так и называется — провал или проскок электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны. Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвоват ьв образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденнео состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s  2s
2s  2p
2p 
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s  2s
2s  2p
2p 
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора обраузется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому аргона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s  2s
2s  2p
2p 
6. Электронная формула кислорода:
+8О 1s22s22p4 1s  2s
2s  2p
2p 
7. Электронная формула фтора:

8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s  2s
2s  2p
2p  3s
3s 
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s  2s
2s  2p
2p  3s
3s  3p
3p 
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s  2s
2s  2p
2p  3s
3s  3p
3p 
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s  2s
2s  2p
2p  3s
3s  3p
3p 
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s  2s
2s  2p
2p  3s
3s  3p
3p 
13. Электронная формула хлора:

14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s  2s
2s  2p
2p  3s
3s  3p
3p 
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s  2s
2s  2p
2p 
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s  2s
2s  2p
2p 
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Урок по химии на тему «Сера. Строение атома, аллотропия, свойства и применение ромбической серы»
Тема урока: «Сера. Строение атома, аллотропия, свойства и применение ромбической серы».
Цель урока: Определить положение серы в периодической системе химических элементов Д.И. Менделеева, рассмотреть строение атома серы, физические и химические свойства, области применения серы.
Задачи урока:
Образовательные:
Рассмотреть строение атома серы согласно его положение в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации серы.
Изучить физические и химические свойства серы, нахождение в природе, его области применения.
Продолжить формирование умения учащихся работать с периодической системой химических элементов Д. И. Менделеева.
Совершенствовать умения составлять уравнения химических реакций.
Развивающие:
Развивать память и внимание учащихся.
Формировать положительную мотивацию на изучение предмета химии.
Учить применять имеющиеся знания в новой ситуации.
Воспитательные:
Показать значимость химических знаний для современного человека.
Ход урока
Организационный момент.
Актуализация знаний.
«В древней магии присутствую
при рождении огня,
называют серой издавна меня»
Итак, тема урока — «Сера. Строение атома, аллотропия, свойства и применение ромбической серы»
III. Изучение нового материала.
1. Положение серы в периодической системе химических элементов
Задание: Используя периодическую систему химических элементов, дайте характеристику химическим элементам сере и кислороду
Вариант 1 – положение в ПСХЭ и строение атома кислорода.
Вариант 2 – положение в ПСХЭ и строение атома серы.
Найдите черты сходства, различия между строением атома кислорода и серы.
Вывод: Оба элемента находятся в главной подгруппе VI группы ПСХЭ, на последнем энергетическом уровне по 6 электронов, имеют одинаковые значения низших степеней окисления -2 (если проявляют окислительные свойства, например, с металлами, водородом) и +6, кроме кислорода (если проявляют восстановительные свойства по отношению к более электроотрицательным элементам).
2. Валентное состояние атома серы — объяснение учителя.
3. Нахождение в природе – работа учащихся с текстом.
Задание классу:
В каком виде сера встречается в природе?
4. Физические свойства ( работа учащихся в парах)
Вывод: Сера-это твердое вещество, желтого цвета, в воде не растворяется.
5. Аллотропные модификации серы -объяснения учителя
А) ромбическая сера
Б) моноклинная
В) пластическая сера
Вывод: Три аллотропные модификации — кристаллическая, ромбическая, пластическая.
6. Химические свойства серы ( работа учащихся в группах)
1) Взаимодействие серы с простыми веществами:
А) с металлами, образуя сульфиды
Например, взаимодействие серы и ртути.
Задание: Используя учебник О.С. Габриелян, стр. 131, ответьте на вопросы:
Какое практическое значение имеет данная реакция?
Какая реакция называется демеркуризацией?
Запишите уравнение реакции, составьте уравнение электронного баланса.
Б) Взаимодействие серы с неметаллами.
1) Взаимодействие серы и водорода
Задание:
2) Взаимодействие серы и кислорода
Задание:
Запишите уравнения реакции, составьте уравнение электронного баланса.
Как горит сера на воздухе и в кислороде?
7. Применение серы– выступление учащегося.
Закрепление изученного материала (фронтальный опрос):
Охарактеризуйте положение серы в периодической системе химических элементов Д.И. Менделеева.
В каком соединении сера проявляет степень окисления +4?
А) H2S
Б) H2SO3
В) H2SO4
3. В каком виде сера находится в природе?
4. Охарактеризуйте физические свойства серы
5. С каким веществом реагирует сера, образуя сульфиды
А) водой
Б) водородом
В) натрием
Домашнее задание § 22, упр. 3, стр.134
Рефлексия
Что нового вы узнали на уроке?
Какой момент урока вам понравился?
Какое впечатление у вас осталось от урока?.
VI. Подведение итогов и выводы урока.
Сера, 6 электронная структура — Большая Химическая Энциклопедия
Оксид азота — это простейшая из известных термически стабильных молекул с нечетными электронами, и, соответственно, ее электронная структура и химия реакций были очень хорошо изучены. Это соединение является промежуточным продуктом при производстве азотной кислоты и его получают в промышленных масштабах путем каталитического окисления аммиака (стр. 466). В лабораторном масштабе он может быть синтезирован из водного раствора мягким восстановлением подкисленных нитритов йодидом или ферроцианидом или диспропорционированием азотистой кислоты в присутствии разбавленной серной кислоты… [Pg.445]Нормальная валентность (нормальная ковалентность) серы, соответствующая ее положению в периодической таблице, равна 2. Электронная структура нормального двухвалентного атома серы — это аргононная структура с орбиталями связи примерно … [Pg.618]
Резные деревянные медведи всех форм и размеров поразили меня и Ингве во время нашего визита в Ноборибецу в 1976 году. Перед открытием международного семинара «Одзи по теориям и расчетам молекулярной массы» оставалось свободное время. Электронная структура »в Томакомаи, Хоккайдо, осенью 1976 года, поэтому мы хотели испытать горячие источники.Поезд оставил нам выбор автобусов, название которых было четко указано японским письмом. Мы нашли нужный и приехали в город в каньоне, откуда выходили пары серы и горячая вода. Радостный прием Кимио Оно и Фукаши Сасаки в университете Хоккайдо остался ярким воспоминанием. [Стр.15]
С этими заданиями стал возможен анализ сверхтонких сдвигов. Fe (III) в тетраэдрических структурах железо-серных белков имеет высокоспиновую электронную структуру с незначительной магнитной анизотропией.Сверхтонкие сдвиги протонов под влиянием Fe (III), по существу, являются ферми-контактами по происхождению 21, 22). С другой стороны, Fe (II) имеет четыре неспаренных электрона и может иметь некоторую магнитную анизотропию, приводящую к псевдоконтактным сдвигам. Кроме того, имеется квинтетное состояние на нескольких сотнях см, что может усложнить анализ сверхтонких сдвигов, но основной вклад в сверхтонкие сдвиги по-прежнему вносят контактные сдвиги 21, 22). [Pg.252]
Контактные сдвиги дают информацию об электронной структуре атомов железа, особенно о валентном распределении и магнитной связи в полиметаллических системах.Схема магнитной связи, которая будет рассмотрена ниже, полностью учитывает все разнообразие наблюдаемых сверхтонких сдвигов и температурную зависимость. Таким образом, посредством анализа сверхтонких сдвигов ЯМР предоставляет подробную информацию о металлическом участке (ах) железо-серных белков и, благодаря прогрессу в ЯМР-спектроскопии, также о структуре раствора 23, 24). [Pg.252]
В этом разделе представлены характеристики спектров, отображаемых различными типами центров железо-сера, с особым упором на то, как они зависят от геометрической и электронной структуры центров.Однако электронная структура здесь упоминается лишь вкратце, а заинтересованные читатели могут найти отличные стандартные тексты, опубликованные по этой теме (3, 4). Точно так же описаны релаксационные свойства центров, но природа лежащих в основе процессов спин-решеточной релаксации подробно не анализируется. Однако краткое описание этих процессов приведено в Приложении. Таким образом, целью этого вводного раздела является описание инструментов, используемых в практических приложениях, представленных в разделах III и IV.Он заканчивается обсуждением некоторых вопросов, которые могут возникнуть, когда спектроскопия ЭПР используется для идентификации центров железо-сера. [Pg.423]
ЭПР-исследования систем электронного переноса, в которых соседние центры связаны посредством спин-спинового взаимодействия, могут дать полезные данные для анализа кинетики переноса электрона. В рамках приближения Кондона константа скорости электронного переноса, предсказываемая теориями переноса электрона, может быть выражена как произведение электронного фактора Tab на ядерный фактор, который явно зависит от температуры (258).С одной стороны, поскольку кластеры железо-сера являются пространственно протяженными окислительно-восстановительными центрами, электронный фактор сильно зависит от того, как различные участки кластера подвержены влиянию изменения электронной структуры между окисленной и восстановленной формами. Теорет -… [Pg.478]
.
Электронная структура и химическая связь нанокомпозита оксид графена с серой для использования в литий-серных элементах с превосходными характеристиками
Мы исследовали химическую связь и электронную структуру нанокомпозита оксид графена-сера (GO-S) методами рентгеновской фотоэлектронной спектроскопии (XPS), тонкой структуры поглощения рентгеновских лучей у ближнего края (NEXAFS) и рентгеновского излучения. Спектроскопия (XES). Нанокомпозит, синтезированный методом химической реакции-осаждения с последующей низкотемпературной термообработкой, состоит из тонкой и однородной пленки серы, закрепленной на листе оксида графена (GO).GO частично восстанавливается в процессе химического синтеза, что приводит к появлению связи C – H и увеличению упорядоченности листов GO. Умеренные химические взаимодействия между серой и GO могут сохранить внутреннюю электронную структуру GO и, с другой стороны, иммобилизовать серу на листах GO, что должно быть ответственным за отличные электрохимические характеристики литий-серных ячеек при использовании GO. Нанокомпозит –S в качестве материала катода.
У вас есть доступ к этой статье
 Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
.
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так. Попробуй еще раз?
.серы — Factorio Wiki
Рецепт | |
| 1 + 30 + 30 → 2 | |
Всего сырых | |
| 1 + 30 + 30 |
Размер стопки | 50 |
Опытный образец | товар |
Внутреннее имя | серы |
Требуемые технологии | |
Производитель | |
 | |
Потребляется | |
   | |
Сера является компонентом в производстве химического пакета, серной кислоты и взрывчатых веществ, причем последние два также являются промежуточными продуктами, используемыми в рецептах более высокого уровня.
Сера — это твердый элемент в цепочке производства на основе жидкости: сырая нефть → нефтяной газ → сера → серная кислота. Поэтому рекомендуется следить за производством серы на раннем этапе, чтобы убедиться, что оно не станет узким местом.
