Физические свойства металлов
9. Физические свойства металлов
Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
Именно строением металлической связи обусловлены физические свойства металлов.
К физическим свойствам металлов относятся:
Металлический блеск.
Электропроводность и теплопроводность.
Пластичность.
Твердость.
Высокая плотность и температура плавления.
Рассмотрим каждое из свойств более подробно.
Металлический блеск.Металлический блеск обусловлен металлической связью между атомами, для которой свойственны обобществленные электроны. Они как раз и испускают под воздействием света свои, вторичные волны излучения, которые мы воспринимаем как металлический блеск.
В порошкообразном состоянии большинство металлов теряют металлический блеск и приобретают серую или черную окраску.
Металлический блеск в порошкообразном состоянии сохраняют алюминий и магний.
Прекрасно отражают свет палладий Pd, ртуть Hg, серебро Ag, медь Cu.
Из алюминия, серебра и палладия, основываясь на их отражательной способности, изготавливают зеркала, в том числе и применяемые в прожекторах.
Электропроводность и теплопроводность.
Все металлы хорошо проводят электрический ток и имеют высокую теплопроводность, также благодаря наличию металлической связи. При нагревании металла, увеличивается скорость движения электронов. Быстро движущиеся по кристаллической решетке электроны выравнивают температуру по всей поверхности металла, проводя тепло. Высокая теплопроводность металлов используется для изготовления из них
Высокая электропроводность металлов обусловлена направленным движением электронов в кристаллической решетке при воздействии электрического тока. Серебро Ag, медь Cu, золото Au и алюминий Al обладают наибольшей электропроводностью, поэтому медь Cu и алюминий Al используют в качестве материала для изготовления электрических проводов.
Наименьшей электропроводностью обладают марганец Mn, свинец Pb, ртуть Hg и вольфрам W.
Пластичность.
Пластичность – это физической свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.Большинство металлов пластично, так как слои атом-ионов металлов легко смещаются относительно друг друга и между ними не происходит разрыва связи.
Наиболее пластичные металлы – золото Au, серебро Ag, медь Cu. Из золота Au можно изготовить тонкую фольгу толщиной 0,003 мм, которую используют для золочения изделий.
Именно на пластичности металлов основано кузнечное дело и возможность изготавливать различные предметы с помощью механического воздействия на металл.
Твердость.
Все металлы (кроме ртути) при нормальных условиях представляют собой твердые вещества. Твердость металлов различна. Наиболее твердыми являются металлы побочной подгруппы шестой группы Периодической системы Д.И. Менделеева. Наименее твердыми являются щелочные металлы.
Плотность.
По плотности металлы классифицируют на легкие (их плотность от 0,53 до 5 г/см3) и тяжелые (плотность этих металлов от 5 до 22,6 г/см3). Самым легким металлом является литий Li, плотность которого 0,53 г/см3. Самыми тяжелыми металлами в настоящее время считают осмий Os и иридий Ir (плотность около 22,6 г/см3).
Температура плавления.
Температура плавления металлов находится в диапазоне от 39 (ртуть Hg) до 3410оС (вольфрам W). Температура плавления большинства металлов высока, однако некоторые металлы, например, олово Sn и свинец Pl, можно расплавить на электрической плите.
Физические свойства металлов и в настоящее время широко используются в промышленности и электронике.
В технике все металлы делятся на черные, к ним относятся железо и его сплавы, и цветные.
Изделия из различных видов металлов используются повсеместно благодаря их пластичности, но чаще всего в сплавах.
К драгоценным металлам относят золото, серебро, платину и некоторые другие редко встречающиеся металлы.
videouroki.net
Физические свойства металлов
Наиболее характерными являются следующие физические свойства металлов:
- твердость,
- металлический блеск,
- ковкость,
- пластичность,
- хорошая проводимость электричества и тепла.
Для всех видов металлов характерна кристаллическая металлическая решетка. В ее узлах располагаются положительно заряженные ионы, между которыми свободно перемещаются электроны. Наличие электронов и объясняет высокую теплопроводность и электропроводность, а также возможность поддаваться механической обработке. Стоит рассмотреть более подробно общие физические свойства металлов.
Основные физические свойства металлов
Температура плавления чистых металлов находится в диапазоне от -39 до 3410°C. У большинства металлов температура плавления очень высока, исключения составляют щелочные металлы. Однако существуют и такие виды металлов, которые можно легко расплавить на обычной газовой плите. К таким металлам относятся, например, свинец или олово. В зависимости от плотности, все металлы делятся на тяжёлые (5/22,5 г/см3) и лёгкие (0,53/5 г/см3). Самый легкий из таких металлов — литий (0.53 г/см3). Практически все металлы обладают хорошей пластичностью. Происходит это из-за смещения слоёв атомов без разрыва между ними связи. Самые пластичные металлы — золото, серебро и медь. Пластичность также зависит и от чистоты металла. Очень чистым металлом считается хром, однако даже при небольшом загрязнении он становится более твердым и хрупким. Характеристика физических свойств металлов включает в себя и такое понятие, как теплопроводность. Она напрямую зависит от подвижности свободных электронов. Так, самым лучшим проводником электричества и тепла является серебро, следом за ним идет натрий. Он находит большое применение в клапанах автомобильных двигателей.
Физические свойства щелочных металлов
К этому виду металлов относятся:
- натрий,
- литий,
- калий,
- рубидий,
- цезий.
Все эти металлы очень пластичные и мягкие. Наибольшую твердость имеет литий, что касается остальных металлов, то они легко режутся ножом и даже могут быть раскатаны в фольгу. Все щелочные металлы в кристаллическом состоянии имеют объемоцентрированную кристаллическую решетку, обладающую металлическим типом химической связи. Это обуславливает высокую электро- и теплопроводность данного вида металлов. Щелочные металлы имеют крайне небольшую плотность. Так самый легкий из них – литий. Его плотность составляет 0,53 г/см
Химические свойства металлов
В химическом отношении металлы характеризуются легкостью отдачи валентных электронов, а также способностью образовывать положительно заряженные ионы. Таким образом, все металлы являются восстановителями в свободном состоянии. Их восстановительная способность неодинакова. Она определяется за счет положения в электрохимическом ряду напряжения металлов. Все металлы размещаются в порядке убывания относительно их восстановительных свойств, а также усиления окислительных свойств ионов. Такой ряд характеризует химическую активность металла исключительно в окислительно-восстановительных реакциях, которые протекают в водной среде. Так, характерными химическими свойствами для металлов являются их восстановление и взаимодействие с водой.
Восстановление неметаллов
Различные реакции с кислородом воздуха и галогенами протекают при разных скоростях и при различных температурах. Например, щелочные металлы легче всего окисляются кислородом воздуха, а также взаимодействуют с простыми веществами. Что касается меди и железа, то они взаимодействуют с простыми веществами при нагревании, а платиновые металлы и золото вообще не окисляются. Многие металлы могут образовывать на поверхности оксидную пленку, она защищает их от последующего окисления:
2К + Сl2 = 2КСl 2Мg + О2 = 2МgО
Взаимодействие с водой
С водой способны взаимодействовать щелочные металлы. Данный процесс происходит при обычных условиях с выделением водорода и образованием гидроксидов:
elhow.ru
«Металлы. Положение в ПС. Физические свойства», 9 класс
Урок №43 Класс: 9-Б
Тема урока: «Металлы. Положение в ПС. Физические свойства. Сплавы»
Цель урока:
Образовательная: рассмотреть положение металлов в ПСХЭ, особенности строения их атомов; повторить и обобщить сведения о металлической химической связи и кристаллической решетке. Сформировать представление об общих физических свойствах металлов. Познакомить с важнейшими сплавами и их свойствами.
Развивающая: совершенствовать умения экспериментально подтверждать химические свойства веществ, на основе теоретических знаний, выполнять практические задания, выявлять существенное, делать выводы, развивать экспериментальные умения, формировать мировоззренческие понятия о познаваемости природы.
Воспитательная: воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды тяжелыми металлами), ответственное отношение к собственному здоровью (в связи с необходимостью или вредом поступления в организм некоторых металлов).
Тип урока: усвоение новых знаний
Оборудование: мультимедиа, компьютер, проектор, экран, Периодическая Система химических элементов Д.И. Менделеева, образцы металлов и сплавов.
Ход урока
1.Организационный момент
Приветствие. Проверка готовности к уроку.
2. Актуализация знаний.
Мы познакомились с вами с неметаллами.
Сейчас нам следует приступить к новой теме «Металлы». Но прежде чем подробно приступить к изучению этого класса (соединения), рассмотрим строение и положение металлов в Периодической системе.
На какие группы делятся элементы по положению в периодической системе?
Вспомните, какие типы химической связи наиболее характерны для металлов?
Какие общие свойства характерны для Me?
Рассмотрим, в виде каких соединений встречаются Me в природе и каково процентное содержание соединение Me в земной коре.
3.Работа по теме урока.
Положение металлов в ПС, строение атомов. (Слайд 3)
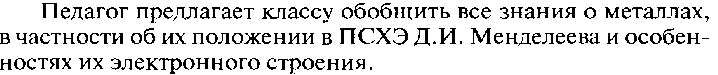
Металлы находятся в левой и нижней части ПС (1-3 гр)
Металлические свойства в периодах умень., в главных подгруппах – увелич.


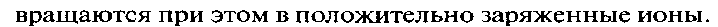
Металлическая связь (Слайд 5)

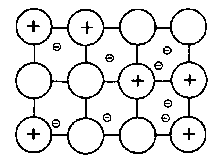
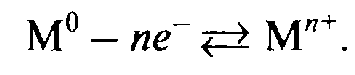
Металлическая связь – это связь, которая возникает в кристаллах в результате электростатического взаимодействия положительно заряженных ионов металла и отрицательно заряженных свободных электронов.
Физические свойства: (Слайд 7)
Агрегатное состояние – твердые, кроме Hg
Металлический блеск
Цвет — черные (Fe, Cr, Mg), цветные
Тепло- и электропроводность – наименьшая Hg, наибольшая Al, Cu, Ag
Пластичность, ковкость, прочность – высокая пластичность у Au, Ag, Cu
Плотность – легкие (Литий) и тяжелые (самый тяжелый Осмий)
Твердость – самый твердый Хром, самый мягкий ЩМ
Температура плавления – легкоплавкие (Цезий, Ртуть) и тугоплавкие (Вольфрам)
Сплавы – это системы, состоящие из двух или более Me и HeMe. (Слайд 15)
Важнейшими промышленными сплавами являются сталь – сплав Fe с (1,7%) C, Mn, Si, S, P.Специальные стали содержат до 10 различных компонентов. Чугун – сплав Fe с C (>2%), Si, Mn, P, S.
Из цветных сплавов отметим бронзу, латунь, мельхиор, дюралюминий.
Бронза — сплав на основе меди с добавлением (до 20%) олова. Бронза хорошо отличается, поэтому ее используют а машиностроении для изготовления подшипников, поршневых колец, клапанов, арматуры и т. д. Бронза — сплав меди с различными металлами с Sn (оловянная бронза), Pb (свинцовая), Al (алюминиевая).
Латунь – медный сплав, содержащий от 10 до 50% цинка. Применяют в моторостроении, для изготовления мебельной фурнитуры.
Мельхиор – сплав, содержащий около 80% меди и 20% никеля, похож по внешнему виду на серебро. Используют для изготовления сравнительно недорогих столовых приборов и художественных изделий.
Дюралюминий (дюраль, дуралюмин) – сплав на основе алюминия, содержащий медь, магний, марганец и никель. Применяют в самолето- и машиностроении.
4.Закрепление изученного материала (Слайд 16)
Вопросы:
Как называются металлы 1 группы главной подгруппы? (щелочные).
Как называется сплав меди с оловом? (бронза).
Какой металл самый тугоплавкий?(Вольфрам)
Какой металл самый легкий?(Литий)
Самый тяжелый металл?(Осмий)
Какой металл придает нашей крови красный цвет? (железо)
Самый твердый металл? (Хром)
Металлы, встречающиеся в самородном состоянии в природе (золото, серебро)
Сталь – это сплав… (железа с углеродом)
Самый распространенный металл в земной коре (Алюминий)
Самый тугоплавкий металл (Вольфрам)
Сплав меди и цинка (Латунь)
Анаграммы
Разгадать слова – анаграммы, в которых порядок букв переставлен. Переставив буквы в каждом слове, надо получить название металла.
1. ОРРЕБЕС – блестит, а не золото;
2. ЦИНВЕС – у этого элемента действительно большой удельный вес;
3. ТУРЬТ — жидкий металл;
4. АЛОЗОТ — этот металл придает ума глупцу, честь подлецу, трусливому геройства.
5.Домашнее задание: §39 и 42, задание №5, №6 и тесты на с.141 (Слайд 19
Литература и интернет ресурсы:
Рудзитис Г. Е, Фельдман Ф. Г. Химия. 9 класс. – 2-е изд. – М.: Просвещение, 2016. – 208 с.
М.Ю.Горковенко “Поурочные разработки по химии 9 класс”, М. “ВАКО”, 2005.
http://www.openclass.ru/node/270648
http://veronium.narod.ru/Razvletchenia.htm
http://chemistry-chemists.com/N4_2011/U11/ChemistryAndChemists_4_2011-U11.html
http://him.1september.ru/articlef.php?ID=200003504
infourok.ru
Свойства металлов: химические, физические, технологические

Содержание:
Не секрет, что все вещества в природе делятся на три состояния: твердые, жидкие и газообразные. А твердые вещества в свою очередь делятся на металлы и неметаллы, разделение это нашло свое отображение и в таблице химических элементов великого химика Д. И. Менделеева. Наша сегодняшняя статья о металлах, занимающих важное место, как в химии, так и во многих других сферах нашей жизни.
Химические свойства металлов
Все мы, так или иначе, но сталкиваемся с химией в нашей повседневной жизни. Например, во время приготовления еды, растворение поваренной соли в воде является простейшей химической реакцией. Вступают в разнообразные химические реакции и металлы, а их способность реагировать с другими веществами это и есть их химические свойства.
Среди основных химических свойств или качеств металлов можно выделить их окисляемость и коррозийную стойкость. Реагируя с кислородом, металлы образуют пленку, то есть проявляют окисляемость.
Аналогичным образом происходит и коррозия металлов – их медленное разрушение по причине химического или электрохимического взаимодействия. Способность металлов противостоять коррозии называется их коррозийной стойкостью.

Физические свойства металлов
Среди основных общих физических свойств металлов можно выделить:
- Плавление.
- Плотность.
- Теплопроводность.
- Тепловое расширение.
- Электропроводность.
Важным физическим параметром металла является его плотность или удельный вес. Что это такое? Плотность металла – это количество вещества, которое содержится в единице объема материала. Чем меньше плотность, тем металл более легкий. Легкими металлами являются: алюминий, магний, титан, олово. К тяжелым относятся такие металлы как хром, марганец, железо, кобальт, олово, вольфрам и т. д. (в целом их имеется более 40 видов).
Способность металла переходить из твердого состояния в жидкое, именуется плавлением. Разные металлы имеют разные температуры плавления.

Скорость, с которой в металле проводится тепло при нагревании, называется теплопроводностью металла. И по сравнению с другими материалами все металлы отличаются высокой теплопроводностью, говоря по-простому, они быстро нагреваются.
Помимо теплопроводности все металлы проводят электрический ток, правда, некоторые делают это лучше, а некоторые хуже (это зависит от строения кристаллической решетки того или иного металла). Способность металла проводить электрический ток называется электропроводностью. Металлы, обладающие отличной электропроводностью, это золото, алюминий и железо, именно поэтому их часто используют в электротехнической промышленности и приборостроении.
Механические свойства металлов
Основными механическими свойствами металлов является их твердость, упругость, прочность, вязкость и пластичность.
При соприкосновении двух металлов могут образоваться микро вмятины, но более твердый металл способен сильнее противостоять ударам. Такая сопротивляемость поверхности металла ударам извне и есть его твердость.
Чем же твердость металла отличается от его прочности. Прочность, это способность металла противостоять разрушению под действием каких-либо других внешних сил.
Под упругостью металла понимается его способность возвращать первоначальную форму и размер, после того как нагрузка, вызвавшая деформацию металла устранена.
Способность металла менять форму под внешним воздействием называется пластичностью.
Технологические свойства металлов
Технологические свойства металлов и сплавов важны в первую очередь при их производстве, так как от них зависит способность подвергаться различным видам обработки с целью создания разнообразных изделий.
Среди основных технологических свойств можно выделить:
- Ковкость.
- Текучесть.
- Свариваемость.
- Прокаливаемость.
- Обработку резанием.
Под ковкостью понимается способность металла менять форму в нагретом и холодном состояниях. Ковкость метала, была открыта еще в глубокой древности, так кузнецы, занимающиеся обработкой металлических изделий, превращением их в мечи или орала (в зависимости от потребности) на протяжении многих веков и исторических эпох были одной из самых уважаемых и востребованных профессий.

Способность двух металлических сплавов при нагревании соединяться друг с другом называют свариваемостью.
Текучесть металла тоже очень важна, она определяет способность расплавленного метала растекаться по заготовленной форме.
Свойство металла закаливаться называется прокаливаемостью.
Интересные факты о металлах
- Самым твердым металлом на Земле является хром. Этот голубовато-белый метал был открыт в 1766 году под Екатеринбургом.
- И наоборот, самыми мягкими металлами являются алюминий, серебро и медь. Благодаря своей мягкости они нашли широкое применение в разных областях, например, в электроаппаратостроении.
- Золото – которое на протяжении веков было самим драгоценным металлом имеет и еще одно любопытное свойство – это самый пластичный металл на Земле, обладающий к тому же отличной тягучестью и ковкостью. Также золото не окисляется при нормальной температуре (для этого его нужно нагреть до 100С), обладает высокой теплопроводностью и влагоустойчивостью. Наверняка все эти физические характеристики делают настоящее золото таким ценным.
- Ртуть – уникальный металл, прежде всего тем, что он единственный из металлов, имеющий жидкую форму. Причем в природных условиях ртути в твердом виде не существует, так как ее температура плавления -38С, то есть в твердом состоянии она может существовать в местах, где просто таки очень холодно. А при комнатной температуре 18С ртуть начинает испаряться.
- Вольфрам интересен тем, что это самый тугоплавкий металл в мире, чтобы он начал плавиться нужна температура 3420С. Именно по этой причине в электрических лампочках нити накаливания, принимающие основной тепловой удар, изготовлены из вольфрама.
Металлы, видео
И в завершение образовательное видео по теме нашей статьи.
www.poznavayka.org
Общие физические свойства металлов и их восстановительные свойства.
министерство образования Ставропольского края
ГБПОУ «нефтекумский региональный политехнический колледж»
Конспект урока по химии по тему:
Подготовила преподаватель высшей категории
Николайчук Людмила Николаевна
Тема урока: Общие физические свойства металлов и их восстановительные свойства.
Девиз урока: «Опыт – основа познания» (написан на доске).
Цель урока: повторить и обобщить сведения, полученные ранее о металлах; дополнить их познавательными опытами; закрепить и проверить знания о физических и химических свойствах.
Задачи.
Обучающие:
дать определение металлов, выяснить чем отличается строение атомов металлов от атомов неметаллов и как это отражается на их окислительно-восстановительных свойствах;
повторить понятие металлической связи;
рассмотреть типы кристаллических решеток разных металлов;
выяснить зависимость физических свойств металлов от их строения;
ознакомиться с распространением металлов в природе в зависимости от их активности.
Развивающие:
развивать умения характеризовать металлы малых и больших периодов по их положению в периодической системе;
развивать представления о связи между строением веществ и их свойствами;
совершенствовать умения находить главное в повторяемом материале и систематизировать полученные знания.
Воспитательные:
развивать умения работать в коллективе;
способствовать проявлению творческих способностей учащихся.
Материалы: коллекция “Металлы”, дидактические материалы на парте учащихся по теме; мультимедийный проектор, интерактивная доска, электронное приложение к учебнику:
Ход урока:
« Единственный путь, ведущий к знаниям – это деятельность»
Б. Шоу
І. Актуализация знаний. Цели и задачи урока.
(слайды 1, 2)
Учитель: Ребята посмотрите на экран. Как вы, думаете какова тема нашего урока? (учащиеся отвечают)
Открыли инструкционные карты и записали тему урока: Общие физические свойства металлов и их восстановительные свойства.
Учитель : Сегодня очень трудно представить, что люди когда-то могли обходиться без металлов. Давайте представим на минуту, что металлы вдруг исчезли из употребления. Что откроется перед вами? Страшный, пустынный мир. С улиц исчезнут все машины, не будут летать самолеты и мчаться по рельсам поезда. Вследствие разрушения всех подземных коммуникаций на улицах наших городов появятся ямы, провалы, трещины. Нет телевидения, радио, телефонов. Нет электричества – кругом воцаряется мрак и тишина. В руках женщины – каменная игла и каменный нож., а у мужчин – каменные топоры, деревянный лук. То есть мы снова вернемся к первобытному обществу. Поэтому эпиграфом к нашей сегодняшней игре мы взяли слова Георга Агриколы:
“Человек не может обойтись металлов….
Если бы не было металлов, люди
Влачили бы самую омерзительную и
Жалкую жизнь среди диких зверей…”
Георг Агрикола 1556
Так что же такое металлы?
Более 200 лет назад М.В. Ломоносов в труде «Первые основы металлургии» дал металлам такое определение: «Металлы – суть ковкие блестящие тела».
Для того времени эта краткая формулировка была достаточно верной.
Вы уже познакомились с Периодической системой химических элементов Д.И. Менделеева, с классификацией химических элементов и узнали, что из 109 известных в настоящее время элементов более 80 являются металлами.
Металлы – это химические элементы, атомы которых отдают электроны внешнего (а некоторые — и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Учитель объясняет строение кристаллической решетки металлов, используя соответствующую таблицу и каркас кристаллической решетки. Затем демонстрирует и комментирует слайд «Физические свойства металлов».
Физические свойства металлов:
Агрегатное состояние: кроме ртути, все металлы твердые.
Электро- и теплопроводны
Ag, Cu, Au, Al, Zn, Fe, Pb, Mg, Hg →
Электро- и теплопроводность уменьшаетсяТвердость различна.
Cr, W, Ni, Pt, Fe, Cu, Al, Ag, Zn, Au, Ca, Mg, Sn, Pb, K, Na →
Твёрдость уменьшаетсяПлотность различна.
Os, Pt, Au, Hg, Pb, Ag, Cu, Ni, Fe, Sn, Zn, Al, Mg, Ca, Na, K, Li →
Плотность уменьшается.Температуры плавления и кипения различны.
W (3420), Pt (1772), Fe, Ni, Cu, Au, Ag, Ca, Al, Mg, Zn, Pb, Sn, Na, K (63,5), Ga (29,7), Cs (28,5) ,Hg (-39).Ковкость, пластичность, прочность:
пластичные – Au, Ag, Cu.
хрупкие – Cr, Mn.Способность намагничиваться: Fe, Co, Ni;
слабо – Al, Cr, Ti;
не притягиваются – Sn, Cu, Bi.
После выполнения заданий учитель предлагает учащимся проверить некоторые физические свойства металлов на опытах.
Опыт 1. Теплопроводность металлов.
Металлические ложки из серебра, железа, алюминия и циркониевую трубку учитель опускает в стакан с кипятком и даёт одному из учащихся проверить, какой металлический предмет стал самым горячим. Учащиеся делают вывод.
Опыт 2. Легкоплавкость некоторых металлов.
Учитель берет в руку образец галлия, кому-то из учеников предлагает взять в ладонь цирконий. Пока металлы нагреваются, учитель напоминает, где располагаются эти элементы в Периодической системе Д.И.Менделеева, обращает внимание учащихся на электронные конфигурации валентных электронов их атомов:
31Ga 4s24p1
40Zr 4d25s2
Затем учащиеся выполняют задание 3.
Задание 3. Физические свойства металлов
Физические свойства металловОсобенности строения металлической кристаллической решетки,
Примеры металлов, у которых это свойство наиболее выражено
Область применения металлов, у которых выражено это свойство.
Металлический блеск
Электроны, заполняющие межатомное пространство, отражают световые лучи, причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо – белый или серый цвет. Строний, золото и медь в большей степени поглащают короткие волны и отражают длинные волны световаго спектра , поэтому имеют соответственно светло – желтый , желтый и медный цвета.
Наибольшую отражательную способность имеют серебро, алюминий , палладий.
Используют при изготовлении зеркал, в том числе и в прожекторах.
Тепло и электропроводность
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, то есть проводят электрический ток.
Серебро, медь, золото, алюминий.
радиотехника
Ковкость и пластичность
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион — атомов относительно друг друга, разрыв связей не происходит.
Золото, серебро, медь, олово, свинец, цинк
Ювелирные изделия
Химические свойства металлов можно охарактеризовать одним предложением: все металлы проявляют только восстановительные свойства.
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом рядом напряжений металлов.
Работая с электрохимическим рядом напряжений металлов, следует помнить:
— металлы расположены в порядке убывания восстановительных свойств при реакциях в растворах;
— металлы, стоящие левее, вытесняю правее стоящий металл из растворов их солей;
— металл, стоящий в ряду напряжений до водорода, вытесняет его из разбавленных кислот;
-металлы, стоящий в ряду напряжений до алюминия, взаимодействуют с водой с образованием щелочей и выделением водорода Остальные металлы взаимодействуют в жестких условиях с образованием оксида металла и водорода;
— металлы, стоящий в ряду напряжений за водородом не взаимодействуют с водой;
— на основании восстановительной способности металлов в ряду напряжений металлы условно можно разделить на три группы по активности:
От Li до Al – очень активные металлы
От Al до H2 – металлы средней активности
От H2 до Au – малоактивные металлы
1 Взаимодействие металлов с простыми веществами:
а) взаимодействие с кислородом (демонстрация виртуального опыта)
2Cs + O2= Cs2 O2
образуются оксиды и пероксиды
б) взаимодействие с серой
Zn + S= Zn S
Образуются сульфиды
в) взаимодействие с галогенами
2Fe + Cl2=2Fe Cl3
г) взаимодействие с водородом – только активные металлы:
2Na+ H2=2 NaOH
д) взаимодействие с азотом
6Li +N2=2Li 3N без нагревания. Остальные металлы реагируют с азотом при нагревании; образуют нитриды
2.Взаимодействие металлов со сложными веществами:
а) взаимодействие с водой: (демонстрация виртуального опыта)
2Na+ 2H2О=2 NaOH+ H2
2Al + 6 H2О=2Al (OH3) + 3H2
б) взаимодействие металлов с растворами кислот (демонстрация виртуального опыта)
Zn +2HCl = ZnCl2+H2
в) взаимодействие металлов с растворами солей (демонстрация виртуального опыта)
Zn +CuSO4= ZnSO4+Cu
VI Закрепление изученного материала. Написать графический диктант.
(приложение № 1)
VII Рефлексивное задание.
Выяснить, что учащиеся узнали поданной теме, и на какой вопрос так и не получили ответы. Оценить степень достижения целей.
2.Условие учебного материала
Если считать, что полное усвоение учебного материала уроки соответствует дистанции
A_______________________________B
То покажите точкой ваше место нахождения
VII Подведение итогов занятия
Проводится анализ и оценка деятельности
Домашнее задание:
&16,стр.163-173 №1,3,4,5,6,
Материалы инструкционной карты.
Инструкционная карта к уроку по теме: ____________________________________________________________________________________________________________________________________
Металлы -___________________________________________________________________________________________________________________________________________________________________________________________________
Физические свойства металлов
Физические свойства металловОсобенности строения металлической кристаллической решетки,
Примеры металлов, у которых это свойство наиболее выражено
Область применения металлов, у которых выражено это свойство.
Металлический блеск
Тепло и электропроводность
Ковкость и пластичность
1. Взаимодействие металлов с простыми веществами:
2.Взаимодействие металлов со сложными веществами:
Рефлексивное задание.
Если считать, что полное усвоение учебного материала уроки соответствует дистанции
A_______________________________B
То покажите точкой ваше место нахождения
Cu+HCl3Li +P
Fe+NiSO4
Au +HCl
3Li +P
Fe+NiSO4
infourok.ru
Краткий конспект подготовки к ЗНО по химии №13 Общие сведения о металлах
Конспект 13. Общие сведения о металлах
Физические свойства металлов
Металлами являются вещества, характеризующиеся в обычных условиях
1. высокими электро- и теплопроводностью,
2. ковкостью,
3. «металлическим» блеском,
4. непрозрачностью
Эти свойства обусловленными наличием в их кристаллической решетке большого количества не связанных с атомными ядрами подвижных электронов проводимости.
Свойства металлов объясняются особенностями их строения:
1. Расположением и характером движения электронов в атомах;
2. Расположением атомов, ионов и молекул в пространстве;
3. Размерами, формой и характером кристаллических образований.
Особенности атомного строения определяют характер взаимодействия металлов, способность их давать различного рода соединения, в которые входят несколько металлов, металлы с неметаллами и т. д.
При разных температурах некоторые химические элементы имеют 2 и более устойчивых типа кристаллических решеток.
Существование одного металла в различных кристаллических формах (модификациях) при разных температурах называется полиморфизмом, или аллотропией, а переход из одного строения в другое – полиморфным (аллотропическим) превращением.
Аллотропические формы, получающиеся в результате полиморфного превращения, обычно обозначают начальными буквами греческого алфавита α, β, γ, δ.
К таким полиморфным металлам относятся, например, кобальт (Со), олово (Sn), марганец (Мn), железо (Fe).
В свою очередь изменение строения кристаллической решетки вызывает изменение свойств – механических, химических и магнитных свойств, электропроводности, теплопроводности, теплоемкости и др. К металлам, которые имеют только один тип кристаллической решетки и называются изоморфными, относятся алюминий (А1), медь (Сu), никель (Ni), хром (Сr), ванадий (W) и др.
Металлы в природе
Металлы присутствуют в природе как в самородном состоянии (самородные металлы), так и в виде различных соединений.
В свободном состоянии присутствуют в природе металлы, которые либо плохо окисляются кислородом, либо совсем не окисляются. Например, платина, золото, серебро. Реже медь, ртуть и некоторые другие. Самородные металлы встречаются в природе в небольших количествах в виде зерен или вкраплении в различных минералах. Лишь изредка они образуют большие куски – самородки. Самый большой самородок золота весил 112 кг. Иногда металлы практически в чистом виде содержатся в метеоритах. Так некоторые предметы из высокочистого железа, найденные археологами, объясняются именно тем, что они были изготовлены из метеоритного железа.
Но чаще всего металлы существуют в природе в связанном состоянии в составе минералов.
Минерал – это химически и физически индивидуализированный продукт природной физико-химической реакции, находящийся в кристаллическом состоянии.
Очень часто это оксиды. Например, оксид железа(III) – гематит или красный железняк.
– магнетит или магнитный железняк. Нередко минералами являются сульфидные соединения: галенит ZnS, киноварь HgS.
Активные металлы часто присутствуют в природе в виде солей (сульфаты, нитраты, хлориды, карбонаты).
Получение металлов
Минералы входят в состав горных пород и руд.
Рудами называются природные образования, содержащие минералы в таком количестве, чтоб из этих руд было выгодно получать металлы. Обычно перед получением металла из руды, руду обогащают, удаляя пустую породу и различные примеси. При этом образуется концентрат, который и является исходным сырьем для металлургической промышленности.
Существуют различные способы обогащения руды. Один из них флотация.
Для получения металлов из руд необходимо перевести металлы из руд в какую-нибудь единую форму, чаще всего в форму оксидов.
Полученные оксиды можно восстанавливать несколькими способами.
1. Один из основных – это металлотермия.
А. Алюмотермия (алюминотермия)
Б. Магниетермия.
Можно проводить восстановление и другими веществами.
↑
2. Термическое разложение соединений металлов.
↑
↑
Этот метод применяется для получения высокочистых металлов.
3. Электролитическое получение металлов.
Металлы, особенно, активные можно получить при электролизе расплавов электролитов. Для щелочных металлов – это единственный способ их получения. Возможно получение металлов при электролизе водных растворов солей. Катионы металлов, расположенных в электрохимическом ряду напряжений до водорода, разряжаются на катоде в той или иной степени одновременно с молекулами воды. А в случае солей металлов, расположенных правее водорода, на катоде получается только соответствующий металл.
4. Более активный металл вытесняет менее активный из раствора его соли.
В таких реакциях нельзя использовать щелочные и щелочноземельные металлы, потому что они реагируют с водой.
Коррозия металлов
Коррозия – самопроизвольное разрушение металлов и сплавов под воздействием окружающей среды. Коррозию металлов и сплавов вызывают такие компоненты окружающей среды как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, морская вода и грунтовые воды.
По типу агрессивных сред, в которых протекает коррозия, она может быть следующих видов:
1. Газовая коррозия
2. Атмосферная коррозия
3. Коррозия в не электролитах
4. Коррозия в электролитах
5. Подземная коррозия
6. Биокоррозия
Чаще всего коррозии подвергаются изделия из железа.
Особенно сильно коррозируют металлы во влажном воздухе и в воде. В повседневной жизни для сплавов железа чаще всего использую термин «ржавление». Химически чистое железо ржавеет медленно, техническое железо, содержащее различные примеси ржавеет быстро. Коррозия зависит не только от химического состава объекта, но и от того какие примеси и в каком количестве этот объект содержит.
Способы борьбы с коррозией.
1. Нанесение различных покрытий на поверхность металла (краски, эмали, другой металл).
2. Использование нержавеющих сплавов, добавки к железу Cr, Ni, Ti.
3. Введение ингибиторов коррозии.
4. Контакт с более активным металлом, протектором. Сначала будет корродировать протектор, потом защищаемый металл.
vneshkoly.com.ua
План-конспект урока по химии (9 класс) на тему: Получение металлов. Физические свойства металлов.
Тема: «Получение металлов, физические свойства металлов»
Цель: ознакомить учащихся с рудами металлов, рассмотреть механизм получения металлов из их руд как частный случай окислительно-восстановительного процесса, научить учащихся подбирать восстановитель для производства металлов с точки зрения экономики, ознакомить учащихся с физическими свойствами металлов, развить умения прогнозировать область применения металлов исходя из их физических свойств.
Ход урока:
1. Оргмомент: приветствие, рассадка детей.
2. Актуализация знаний: объяснение целей урока, его этапов.
2.1 работа с таблицей Менделеева (индивидуально)
Заполните таблицу, пользуясь Т. Менделеева.
Сделайте вывод о количестве электронов на внешних слоях металлов.
3. Объяснение нового материала.
3.1. Нахождение металлов в природе
Распределение элементов металлов в земной коре:
Алюминий – 7,5%
Железо – 4,7%
Кальций – 4,4%
Натрий – 2,6%
Калий-2,4%
Магний – 1,9%
Титан – 0,6%
хром — 0,3%
никель – 0,2%
медь – 0,01%.
Металлы встречаются в природе как в свободном виде, так и в виде соединений.
Знаете ли вы, что означает слово «самородок»? Какие металлы на ваш взгляд могут быть самородными: золото, серебро, платина («серебришко») и др.
Бывает ли самородное железо или натрий? Только из метеоритов.
Таким образом, только некоторые металлы могут быть в самородном состоянии – это благородные металлы. Подавляющее большинство металлов находятся в природе в виде минералов. Вместе с тем, не всякий минерал годится для получения содержащегося в нем металла.
Определение: Горную породу или минерал, содержащий тот или иной металл в количестве, которое делает экономически выгодным его промышленное получение, называют рудой данного металла.
(Демонстрация коллекций руд).
Получение металла из его руды – задача металлургии.
Часто в названии руды имеется указание на то, какой металл из него можно получить. Выполняем упражнение №2 – соотнести формулу минерала и формулу химического соединения, содержащего металл.
Рассмотрим химизм получения металлов из руд.
1. если руда оксид – необходимо осуществить переход Ме+n → Ме0 , т.е. осуществить восстановление металла.
Выполняем упражнение №3 — написать схему процесса восстановления металлов из предложенных руд.
2. основной проблемой для металлургии является выбор реагента — восстановителя, отвечающего многим условиям: большие запасы, дешевизна, условие незагрязнения полученного металла продуктами реакции.
Выполняем упражнение №4 на доске:
оксиды | сульфиды | карбонаты |
h3, CO, Al, Cr, C | h3, CO, Al, Cr, C | h3, CO, Al, Cr, C |
Fe2O3 + ? → Fe + ? | ZnS + ? → ZnO + ? ZnO + ? → Zn + ? | FeCO3 → FeO + CO2 FeO+ ? → Fe + ? |
Выводы: 1. Только небольшая группа металлов находится в самородном состоянии – это малоактивные металлы.
2.Основным механизмом получения металла из его соединения является процесс восстановления.
3.2 Физические свойства металлов
Простые вещества металлы обладают рядом общих свойств. Нам известно, что физические свойства вещества определяются его строением – типом кристаллической решетки.
Мы видим, что большинство металлов имеют на внешнем слое 2-3 электрона, большие атомные радиусы по сравнению с неметаллами, т.е. металлы легко отдают внешние электроны – являются восстановителями.
В виде простого вещества атомы металлов связаны между собой так называемой металлической связью, которая обуславливает как физические так и химические свойства металлов. Тип кристаллической решетки – металлическая.
Металлическая связь – особый вид связи, присущий только металлам. Связь между положительными ионами металлов и свободно движущимися обобществленными электронами (электронный газ).
Рассмотрим физические свойства металлов: металлический блеск, пластичность, тепло- и электропроводность.
Более подробно остановимся на понятие пластичность – способность к сложной деформации без нарушения металлической прочности.
- Назовите все виды механической обработки металлов, с которыми вы познакомились в курсе технологии. Ковка, резка, шлифовка, сварка, прокат, волочение, прессование, штамповка, литье.
- Агрегатное состояние металла: жидкость – ртуть, Тпл= -39
твердые — все остальные, Тпл (W)= 3370
Из какого металла делают спираль накаливания в электрических лампочках? Вольфрам.
- Твердость металлов сравнивают с твердостью алмаза:
Твердый – хром, мягкий – натрий, калий и т.д.
- Плотность: тяжелые – ρ больше 3 г/мл; легкие — ρ меньше 1 г/мл
Какие металлы, на ваш взгляд, при взаимодействии с водой будут плавать по её поверхности? Щелочные металлы.
- Магнитные свойства: ферромагнитные ( намагничиваются и притягиваются магнитом) – железо, кобальт, никель и их сплавы.
Из какого металла необходимо делать сердечник в катушке индуктивности? Железо
- Наиболее электропроводные металлы: серебро, медь, алюминий.
Какие металлы являются самыми распространенными для производства металлических проводов? Медь и алюминий
Какое явление на ваш взгляд может мешать свободному движению электронов в металле?
Тепловое колебание атомов металлов в кристаллической решетке.
Как вы понимаете термин сверхпроводимость?
.
4. Закрепление материала:
Выполняем упражнение №5, заполняем таблицу:
Свойство | Металлы | Неметаллы |
Число внешних электронов | ||
Электроотрицательность | ≤ | ≥ |
Радиус атома | ||
Тип связи в простых веществах | ||
Кристаллическая решетка | ||
Физические свойства: | ||
Пластичность | ||
Блеск | ||
Цвет | Черные- Цветные- | |
Электрическая проводимость | ||
Теплопроводность |
5. Итог урока:
Оценивание учащихся.
Домашнее задание: §35 (полностью), вопросы для самостоятельного изучения: гидрометаллургия, электрометаллургия.
Рабочая инструкция к теме:
«Получение металлов, физические свойства металлов»
Упражнение №1.Заполните таблицу, пользуясь таблицей Д.И. Менделеева.
Вариант | 1 | 2 | 3 | 4 | 5 | 6 |
Группа, подгруппа | 1Б | 2Б | 3Б | 4Б | 5Б | 6Б |
Число вн. электронов | ||||||
ЭО | от до | От до | От до | От до | От до | От до |
Радиус атома | от до | от до | от до | от до | от до | от до |
Запомни! Распределение элементов металлов в земной коре:
Алюминий – 7,5%
Железо – 4,7%
Кальций – 4,4%
Натрий – 2,6%
Калий-2,4%
Магний – 1,9%
Титан – 0,6%
хром — 0,3%
никель – 0,2%
медь – 0,01%.
Горную породу или минерал, содержащий тот или иной металлов в количестве, которое делает экономически выгодным его промышленное получение, называют рудой данного металла.
Упражнение №2. Соотнести формулу минерала и название руды.
Название руды | Формула |
1. Цинковая обманка | А SnO2 |
2. Магнитный железняк | Б Al2O3. h3O |
3. Оловянный камень | В Cu2O |
4. Боксит | Г FeO.Fe2O3 |
5. Куприт | Д ZnS |
Сделайте вывод: к какому классу соединений относится большинство руд.
Упражнение №3. Определите степень окисления металла в руде.
Напишите схему процесса восстановления металлов из предложенных руд.
SnO2, Al2O3. h3O , Cu2O, FeO.Fe2O3, ZnS
Упражнение №4. Допишите уравнения восстановления металлов
оксиды | сульфиды | карбонаты |
h3, CO, Al, Cr, C | h3, CO, Al, Cr, C | h3, CO, Al, Cr, C |
Fe2O3 + ? → Fe + ? | ZnS + ? → ZnO + ? ZnO + ? → Zn + ? | FeCO3 → FeO + CO2 FeO+ ? → Fe + ? |
1.Назовите все виды механической обработки металлов, с которыми вы познакомились в курсе технологии.
2.Агрегатное состояние металла: жидкость – ртуть, Тпл= -39
твердые — все остальные, Тпл (W)= 3370
Из какого металла делают спираль накаливания в электрических лампочках?
3.Твердость металлов сравнивают с твердостью алмаза:твердый – хром, мягкий – натрий, калий и т.д.
Какой металл на ваш взгляд можно резать ножом?
4.Плотность: тяжелые – ρ больше 3 г/мл; легкие — ρ меньше 1 г/мл
Какие металлы при взаимодействии с водой будут плавать по её поверхности?
5.Магнитные свойства: ферромагнитные (намагничиваются и притягиваются магнитом) – железо, кобальт, никель и их сплавы.
Из каких металлов необходимо делать сердечник в катушке индуктивности?
6.Наиболее электропроводные металлы: серебро, медь, алюминий.
Какие металлы являются самыми распространенными для производства металлических проводов? Какое явление на ваш взгляд может мешать свободному движению электронов в металле?
7.Как вы понимаете термин сверхпроводимость?
Упражнение №5. Заполняем таблицу:
Свойство | Металлы | Неметаллы |
Тип связи в простых веществах | ||
Кристаллическая решетка | ||
Физические свойства: Пластичность | ||
Блеск | ||
Цвет | Черные- Цветные- | |
Электрическая проводимость | ||
Теплопроводность |
nsportal.ru