Формулы по физике 10-11 класс
Уравнение скорости при равноускоренном движении υ=υ0+a∙t
Ускорение a=(υ—υ 0)/t
Скорость при движении по окружности υ=2πR/Т
Центростремительное ускорение a=υ2/R
Связь периода с частотой ν=1/T=ω/2π
II закон Ньютона F=ma
Закон Гука Fy=-kx
Закон Всемирного тяготения F=G∙M∙m/R2
Вес тела, движущегося с ускорением а↑ Р=m(g+a)
Вес тела, движущегося с ускорением а↓ Р=m(g-a)
Сила трения Fтр=µN
Импульс тела p=mυ
Импульс силы Ft=∆p
Момент силы M=F∙ℓ
Потенциальная энергия тела, поднятого над землей Eп=mgh
Потенциальная энергия упруго деформированного тела Eп=kx2/2
Кинетическая энергия тела Ek=mυ2/2
Работа A=F∙S∙cosα
Мощность N=A/t=F∙υ
Коэффициент полезного действия η=Aп/Аз
Период колебаний математического маятника T=2π√ℓ/g
Период колебаний пружинного маятника T=2 π √m/k
Уравнение гармонических колебаний Х=Хmax∙cos ωt
Связь длины волны, ее скорости и периода λ= υТ
Количество вещества ν=N/ Na
Молярная масса М=m/ν
Cр. кин. энергия молекул одноатомного газа Ek=3/2∙kT
Основное уравнение МКТ P=nkT=1/3nm0υ2
Закон Гей – Люссака (изобарный процесс) V/T =const
Закон Шарля (изохорный процесс) P/T =const
Относительная влажность φ=P/P0∙100%
Внутр. энергия идеал. одноатомного газа U=3/2∙M/µ∙RT
Работа газа A=P∙ΔV
Закон Бойля – Мариотта (изотермический процесс) PV=const
Количество теплоты при нагревании Q=Cm(T2-T1)
Количество теплоты при плавлении Q=λm
Количество теплоты при парообразовании Q=Lm
Количество теплоты при сгорании топлива Q=qm
Уравнение состояния идеального газа PV=m/M∙RT
Первый закон термодинамики ΔU=A+Q
КПД тепловых двигателей η= (Q1 — Q2)/ Q1
КПД идеал. двигателей (цикл Карно) η= (Т1 — Т2)/ Т1
Закон Кулона F=k∙q1∙q2/R2
Напряженность электрического поля E=F/q
Напряженность эл. поля точечного заряда E=k∙q/R2
Поверхностная плотность зарядов σ = q/S
Напряженность эл. поля бесконечной плоскости E=2πkσ
Диэлектрическая проницаемость ε=E0/E
Потенциальная энергия взаимод. зарядов W= k∙q1q2/R
Потенциал φ=W/q
Потенциал точечного заряда φ=k∙q/R
Напряжение U=A/q
Для однородного электрического поля U=E∙d
Электроемкость C=q/U
Электроемкость плоского конденсатора C=S∙ε∙ε0/d
Энергия заряженного конденсатора W=qU/2=q²/2С=CU²/2
Сила тока I=q/t
Сопротивление проводника R=ρ∙ℓ/S
Закон Ома для участка цепи I=U/R
Законы послед. соединения I1=I2=I, U1+U2=U, R1+R2=R
Законы паралл. соед. U1=U2=U, I1+I2=I, 1/R1+1/R2=1/R
Мощность электрического тока P=I∙U
Закон Джоуля-Ленца Q=I2Rt
Закон Ома для полной цепи I=ε/(R+r)
Ток короткого замыкания (R=0) I=ε/r
Вектор магнитной индукции B=Fmax/ℓ∙I
Сила Ампера Fa=IBℓsin α
Сила Лоренца Fл=Bqυsin α
Магнитный поток Ф=BSсos α Ф=LI
Закон электромагнитной индукции Ei=ΔФ/Δt
ЭДС индукции в движ проводнике Ei=Вℓυsinα
ЭДС самоиндукции Esi=-L∙ΔI/Δt
Энергия магнитного поля катушки Wм=LI2/2
Период колебаний кол. контура T=2π ∙√LC
Индуктивное сопротивление XL=ωL=2πLν
Емкостное сопротивление Xc=1/ωC
Действующее значение силы тока Iд=Imax/√2,
Действующее значение напряжения Uд=Umax/√2
Полное сопротивление Z=√(Xc-XL)2+R2
Конспект «Термодинамика. Теория, формулы, схемы» для ОГЭ
Термодинамика – раздел физики, изучающий тела, находящиеся в состоянии термодинамического равновесия и явления, сопровождающие переходы между этими состояниями.
Термодинамическое равновесие – состояние тел (или частей тела), при котором остаются постоянными все величины, характеризующие эти тела (или части тела): объёмы, давления, расположение масс и др.
Температура – единственная физическая величина, всегда одинаковая у всех тел (или частей тела), находящихся в состоянии термодинамического равновесия.
Термометр – прибор для измерения температуры. Единица температуры – 1 кельвин (1 К). Также используется 1 °С, равный 1 К.
Теплообмен – переход внутренней энергии одного тела во внутреннюю энергию другого тела без совершения механической работы.
Количество теплоты – физическая величина, показывающая энергию, полученную (отданную) телом при теплообмене.
Калориметр – прибор для измерения количества теплоты. Единица количества теплоты – 1 джоуль (1 Дж).
Удельная теплоемкость вещества – физическая величина, показывающая количество теплоты, необходимое для изменения температуры 1 кг этого вещества на 1 °С. Единица удельной теплоёмкости – 1 Дж/(кг·°С).
Количество теплоты, полученное (отданное) телом при теплообмене, пропорционально массе тела и изменению его температуры. Коэффициент пропорциональности – удельная теплоёмкость вещества.
Превращение твёрдого тела в жидкость называют плавлением.Обратное явление называют отвердеванием. Если при этом получается кристаллическое тело, то отвердевание называют кристаллизацией.
Температура
Температурой плавления называют температуру, при которой нагреваемое кристаллическое тело тело начинает плавиться, и при этом одновременно существуют твёрдое и жидкое состояния его вещества.
Температурой кристаллизации называют температуру, при которой охлаждаемая жидкость начинает кристаллизоваться, и при этом одновременно существуют её твёрдое и жидкое состояния.
Как правило, температура кристаллизации вещества равна температуре его плавления. Температура плавления/кристаллизации вещества зависит от внешнего давления и других факторов.
Удельная теплота плавления – физическая величина, показывающая количество теплоты, необходимое для плавления или выделяющееся при кристаллизации 1 кг вещества, находящегося при температуре плавления/кристаллизации. Единица удельной теплоты плавления – 1 Дж/кг.
Количество теплоты, поглощаемое (выделяющееся) при плавлении (кристаллизации), пропорционально массе расплавившегося (кристаллизовавшегося) вещества. Коэффициент пропорциональности – удельная теплота плавления вещества.
Видами парообразования являются: испарение – парообразование, происходящее с поверхности жидкости; кипение – парообразование, происходящее по всему объёму жидкости вследствие возникновения и всплытия на поверхность пузырей пара; сублимация – парообразование, происходящее с поверхности твёрдого тела.
Температурой кипения называют температуру, при которой наблюдается кипение вещества (интенсивное парообразование по всему объёму этого вещества). Температура кипения зависит от внешнего давления и других факторов.
Удельная теплота парообразования – физическая величина, показывающая количество теплоты, необходимое для превращения в пар 1 кг вещества (как правило, при температуре кипения). Единица удельной теплоты парообразования – 1 Дж/кг.
Количество теплоты, поглощённое кипящей (или испаряющейся при постоянной температуре) жидкостью, прямо пропорционально массе образовавшегося пара.
Коэффициент пропорциональности – удельная теплота парообразования вещества.При охлаждении/кристаллизации/конденсации выделяется точно такое же количество теплоты, которое было затрачено для нагревания/плавления/парообразования вещества (если температуры и давления при прямом и обратном процессах соответствуют друг другу).Утверждение будет верным и наоборот.
Тепловые явления


Законы термодинамика
Первый закон термодинамики устанавливает равенство между изменением внутренней энергии тела и суммой полученной телом теплоты и совершённой над ним работы.
Тепловой двигатель – периодически действующее устройство, служащее для превращения внутренней энергии рабочего тела (как правило, газа или пара) в механическую энергию.
Количество теплоты, выделяющееся при полном сгорании вещества (топлива), прямо пропорционально массе сгоревшего вещества (топлива). Коэффициент пропорциональности – удельная теплота сгорания топлива.
Известно три способа теплопередачи (теплообмена) – теплопроводность, конвекция и излучение. При теплопроводности теплота проникает через вещество без его перемещения (в случае отсутствия вещества теплопроводность является нулевой). При конвекции теплота перемещается неравномерно нагретым движущимся веществом (в условиях, когда возможно возникновение архимедовой силы). При излучении теплота передаётся через пространство или вещество в виде электромагнитных волн (для излучения наличие вещества не является обязательным, в отличие от первых двух способов теплопередачи).
Второй закон термодинамики
гласит, что теплообмен самостоятельно протекает только в таком направлении, что температура менее нагретого тела возрастает, а более нагретого – уменьшается.
Дополнительные материалы по теме:





Конспект темы «Термодинамика. Теория, формулы, схемы»
Следующая тема «Электростатика. Теория, формулы, схемы для ОГЭ»
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
|
Конспект «Атомная физика (физика атома)»
Атомная физика (физика атома)
Ключевые слова конспекта «Атомная физика (физика атома)»: планетарная модель атома Резерфорда, постулаты Бора, постоянная Планка, формула Бальмера, серия Бальмера, Лаймана, Пашена.
Раздел ЕГЭ по физике: 5.2. Физика атома.
Планетарная модель атома Резерфорда
Резерфорд, изучая рассеяние быстрых альфа-частиц при прохождении их через тонкую золотую фольгу, обнаружил, что все альфа-частицы рассеиваются на всевозможные углы, вплоть до углов, близких к 180°.
Ядерная модель атома (по Резерфорду): тяжелое положительное ядро, содержащее почти всю массу атома и заряд Z•e, е — заряд электрона, имеет радиус порядка 10–15 м. Вокруг него движутся электроны в пределах объема радиусом 10–10 м. Заряд ядра равен суммарному заряду электронов в электронной оболочке атома, следовательно, атом электрически нейтрален.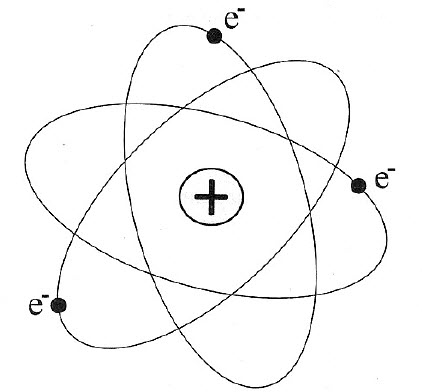
Противоречия модели атома (по Резерфорду)
- Обращающиеся вокруг ядра электроны обладают центростремительным ускорением, а значит, должны излучать. За счет кулоновских сил расстояние между электроном и ядром непрерывно уменьшается, а частота непрерывно растет и в рамках классической физики спектр излучения атома — непрерывный, что противоречит эксперименту.
- Атом с изменяющимися параметрами — неустойчив (электрон должен «упасть» на ядро), в действительности атомы устойчивы и в состоянии с минимальной энергией могут существовать неограниченно долго.
Оставаясь в рамках классической механики, Резерфорд не смог разрешить данные противоречия.
Постулаты Бора
- В атоме существуют устойчивые (стационарные) орбиты, движение электрона по которым не сопровождается излучением или поглощением энергии.
- При переходе атома из одного стационарного состояния в другое происходит излучение или поглощение кванта энергии:
h • vmn = Еm – Еn.
- Момент импульса электрона, находящегося на стационарной орбите, квантуется:
m • υn • rn = n • ħ,
где n — номер стационарной орбиты, ħ = h/2p = 1,05 • 10–34 Дж•с — постоянная Планка (аш (h) с чертой).
Боровская модель атома водорода. Серия Бальмера.
Спектры испускания и спектры поглощения
Атом с одним вращающимся вокруг ядра электроном называется водородоподобным атомом.
Боровская модель атома водорода описывает атом водорода и водородоподобные атомы.
Энергетический уровень — энергия, которой обладает электрон в атоме, находящемся в определенном стационарном состоянии.
Основное состояние атома — состояние с минимальной энергией.
Атом водорода имеет определенный спектр энергий. Состояние атома с n = 1 называют основным состоянием. Энергия основного состояния электрона в атоме водорода:
где k = 9•109 Н•м2/Кл2; m = 9,1 • 10–31 кг — масса электрона; е = –1,6 • 10–19 Кл — заряд электрона; h = 6,62 • 10–34 (Дж•с) — постоянная Планка.
Возбужденные состояния атома водорода — это состояния с номером п > 1, где п — главное квантовое число. Чем больше квантовое число п, тем дальше от ядра находится электрон, тем выше его энергетический уровень. Энергетический спектр атома водорода можно рассчитать:
Энергетический спектр водородоподобного атома рассчитывают с учетом Z —зарядового числа химического элемента:
Линейчатый спектр — спектр излучения, состоящий из отдельных узких спектральных линий различной интенсивности. Излучение, которое испускают атомы, образует линейчатый спектр.
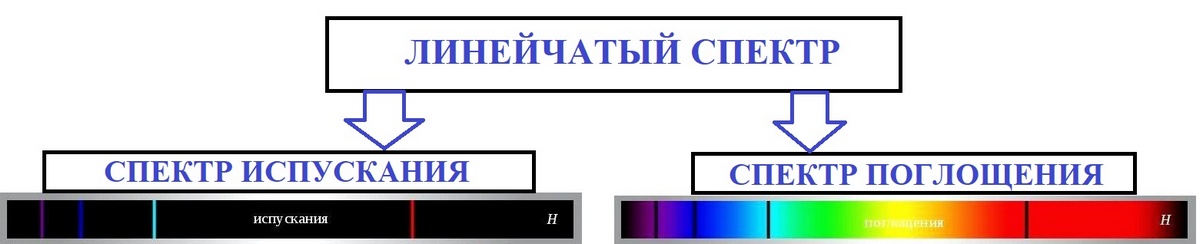
Линейчатый спектр включает в себя резко очерченные цветные линии, которые обязательно отделяются друг от друга широкими темными промежутками. Расположение спектральных линий строго упорядочено и индивидуально для каждого вещества.
Формула, позволяющая найти частоты или длины волн, соответствующие линиям водородного спектра: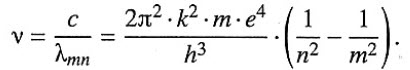
Атом испускает квант энергии, если m > n — все возможные частоты, вычисленные по данной формуле, дают спектр излучения атома водорода.
Атом поглощает квант энергии, если m < n. Спектр поглощения вещества получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии. Атом или молекула вещества поглощает излучение той же частоты, что и излучает, т. е. линии поглощения соответствуют линиям испускания — это закон обратимости спектральных линий Кирхгофа.
Энергетические уровни в атоме водорода принято обозначать горизонтальными линиями.

При n = 1 переходы с верхних уровней в основное состояние образуют серию Лаймана — ультрафиолетовая область спектра.

При n = 2 переходы с верхних уровней в первое возбужденное состояние образуют серию Бальмера — видимая часть спектра.
При n = 3 переходы с верхних уровней во второе возбужденное состояние образуют серию Пашена — инфракрасная часть спектра и т. д.
Формула Бальмера

Конспект урока по физике для класса «Атомная физика (физика атома)». Выберите дальнейшее действие: