Марганец -общая характеристика элемента, химические свойства хрома и его соединений
Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd54s2 ; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
+7 — Mn2O7 , MnO4— ,HMnO4 ,KMnO4
+ 6 — MnO42- , K2MnO4
+4 — MnO2 , Mn(SO4)2 ,MnF4 ,K3[MnF6]
+3 — Mn2O3, MnO(OH),Mn2(SO4)3 ,MnF , K3[MnF6]
+ 2 — Mn2+ , MnO, Mn(OH)2 , MnSO4 ,MnCl2
0 — Mn
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn‖‖
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn→(O2, до450oC) MnO2 →( O2, до 800oC) Mn 2O3
Mn→MnO+( MnIIMn2II)O4 “окалина “ ( O2, выше 800oC)
Mn+Cl2→MnCl2 , (200oC) Mn+S→ MnS (до1580oC)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
Мn (порошок) + 2Н+ = Мn2+ + Н2↑
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Мn + 2Н2SO4(конц.) = МnSO4 + SO2↑+ 2Н2O
3Мn + 8HNO3(разб.) = 3Мn(NO3)2 + 2NO↑ + 4Н2O
Получение марганца
МnO2 + С (кокс) = Мn + СO2 (600 °С)
3(МnII MnIII)O4 + 8Аl = 9Мn + 4А12O3(700-900 °С)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
2MnSO4+2H2O→2Mn↓+O2↑+2H2SO4 (40oC, эликтролиз)
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) М nO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4МnO2 = 2Мn2O3 + O2 (530-585 °С)
2МnO2 + 2Н2SO4(конц.) = МnSO4 + O2↑ + 2Н2O (кипячение)
МnO2 + 4НС1(конц.) = МnС12 + С12↑ + 2Н2O
МnO2 + 2Н2SO4 + 2FeSO4 = МnSO4 + Fе2(SO4)3 + 2Н2O
МnO2 + 2КОН + КNO3 = К2MnO4 + KNO2 + Н2O (350-450 °С)
ЗМnO2 + ЗК2CO3 + КС1O3 = ЗК2MnO4+ КС1 + ЗCO2 (400 °С)
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO42-. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
3K2MnO4(конц) +2H2O→(t) 2KMnO4+MnO2↓+4KOH
3K2MnO4(разб)+4HCl=2KMnO4+MnO2↓+2H2O+4KCl
K2 MnO4 +8HCl(конц)=MnCl2+2Cl2↑+4H2O+2KCl
3K2MnO4+2H2O+4CO2(г)=2KMnO4+MnO2↓+4KHCO3
2K2 MnO4+Cl2(насыщ)=2KMnO4+2KCl
2K2MnO4+2H2O→ H2↑+2KMnO4+KOH (эликтролиз)
Получение: сплавление МnO2 с сильными окислителями (KNO
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до МnII , в нейтральной среде – до Mn IV в сильнощелочной среде — до МnVI
Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)
4КМnO4 + 2Н2O→МnO2↓+ 3O2↑ + 4КОН (t)
2КМnO4(т) + 16НСl(конц.) = 2МnС12 + 5С12↑ + 8Н2O + 2КС1 (80°С)
2КМnO4(т) + 2Н2SO4(96%) = 2КНSO4 + Мn2O7 + Н2O (на холоду)
4КМnO4(насыщ.) + 4КОН (15%) = 4К2МnO4+ O2↑ + 2Н2O (100 °С)
2КМnO4 + 2(NН3• Н2O)= 2МnO2↓ + N2↑ + 4Н2O+ 2КОН (50 °С)
2МnO4— + 16Н+ +10I— = 5I2+2Мn2+ + 8Н2O
2МnO4— + 6Н+ + 5Н2O2
2МnO4— + 6Н+ + 5SO32- =2Мn2+ + 5SO42- + ЗН2O
МnO4— + 8Н+ + 5Fе2+ = Мn2+ + 5Fе3+ + 4Н2O
2МnO4— + 6Н+ + 5NO2— = 2Мn2+ + 5NО3— + 3Н2O
2МnO4— + 3Н2S (насыщ.) = 2МnO2↓ + 3S↓ + 2Н2O + 2OН—
2МnO4— + Н2O + 3SO32- = 2МnO2↓ + 3SO42-+ 2OH—
2МnO4— + 2Н2O + ЗМn2+ = 5МnO2↓ + 4Н+ (50-80 °С)
2МnO4— + 2OH—(конц.)
+ SO32- = 2МnO42-+ SO42- + Н2OПолучение — электролиз раствора К2MnO4
himege.ru
№ элемента | Химический знак | Название элемента | Электронная формула |
1 | H | водород | 1s1 |
2 | He | гелий | 1s2 |
II период | |||
3 | Li | литий | 1s22s1 |
4 | Be | бериллий | 1s22s2 |
5 | бор | 1s22s22p1 | |
6 | C | углерод | 1s22s22p2 |
7 | N | азот | 1s22s22p3 |
8 | O | кислород | 1s22s22p4 |
9 | F | фтор | 1s22s22p5 |
10 | Ne | неон | 1s22s22p6 |
III период | |||
11 | Na | натрий | 1s22s22p63s1 |
12 | Mg | магний | 1s22s22p63s2 |
13 | Al | алюминий | 1s22s22p63s23p1 |
14 | Si | кремний | 1s22s22p63s23p2 |
15 | P | фосфор | 1s22s22p63s23p3 |
16 | S | сера | 1s22s22p63s23p4 |
17 | Cl | хлор | 1s22s22p63s23p5 |
18 | Ar | аргон | 1s22s22p63s23p6 |
IV период | |||
19 | K | калий | 1s22s22p63s23p64s1 |
20 | Ca | кальций | 1s22s22p63s23p64s2 |
21 | Sc | скандий | 1s22s22p63s23p64s23d1 |
22 | Ti | титан | 1s22s22p63s23p64s23d2 |
23 | V | ванадий | 1s22s22p63s23p64s23d3 |
24 | Cr | хром | 1s22s22p63s23p64s13d5 |
25 | Mn | марганец | 1s22s22p63s23p64s23d5 |
26 | Fe | железо | 1s22s22p63s23p64s23d6 |
27 | Co | кобальт | 1s22s22p63s23p64s23d7 |
28 | Ni | никель | 1s22s22p63s23p64s23d8 |
29 | Cu | медь | 1s22s22p63s23p64s13d10 |
30 | Zn | цинк | 1s22s22p63s23p64s23d10 |
31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 |
32 | Ge | германий | 1s22s22p63s23p64s23d104p2 |
33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 |
34 | Se | селен | 1s22s22p63s23p64s23d104p4 |
35 | Br | бром | 1s22s22p63s23p64s23d104p5 |
36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
V период | |||
37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 |
38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 |
39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 |
40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 |
41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 |
42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 |
43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 |
44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 |
45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 |
46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p65s04d10 |
47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 |
48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 |
49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
VI период | |||
55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
VII период | |||
87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
s-элементы | p-элементы | d-элементы | f-элементы |
infotables.ru
Марганец
«МАТИ-РГТУ им. К.Э.Циолковского»
РЕФЕРАТ
По дисциплине : Химия
Тема:Строение и Свойства Марганеца
Выполнил:
Студент 1 курса
дневного отделения
группы № 2АВС-1ДБ-270
Бессонов Илья Игоревич
Научный руководитель:
Евдокимов Сергей Васильевич
МОСКВА 2013
Содержание:
1)Электронная формула атома Марганца
2)Физический смысл всех индексов у атома Марганца в таб.Менделеева
3)Электронная конфигурация атома Марганца
4)Распределение валентных электронов Марганца по энергетическим ячейкам
5)Наборы квантовых чисел валентных электронов
6)Принадлежность Марганца к классу веществ
7)Степени окисления Марганца
8)Прогнозирование типа гибридизации валентных атомных орбиталей при образовании бинарных соединений
1)
Mn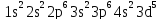
2)
Атомный номер Mn — 25. Он показывает заряд ядра атома, кол-во протонов в ядре, кол-во электронов в атоме.
А=Z+N
Mn располагается в IV периоде. Период показывает кол-во энергетических уровней.
Mn располагается в VII группе. Номер группы совпадает с числом валентных электронов, способных участвовать в образовании химических связей
3)
Mn — d-элемент. Его валентные подуровни : 4s^2,3d^5.
4)
3d
4s
3p
3s
2p
2s
1S
5)
Электроны | 4s^2 | 3d^5 | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
Квантовые числа | n | 4 | 4 | 3 | 3 | 3 | 3 | 3 |
l | 0 | 0 | 2 | 2 | 2 | 2 | 2 | |
ml | 0 | 0 | -2 | -1 | 0 | 1 | 2 | |
ms | — 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | |
6)
Марганец принадлежит к металлам.
7)
Марганец способен проявлять степени окисления : 0, +2, +3, +4, +6, +7 .
8)
Т.к в соединении MnCl2 участвуют две p-орбитали(от атомов Cl) и одна d-орбиталь(от атома Mn), то предполагаемая гибридизация в молекуле MnCl2 — pd2.
studfile.net
Валентность марганца (Mn), формулы и примеры
Общие сведения о валентности марганца
Марганец – серебристо-белый металл. Плотность – 7,44 г/см3. Температуры плавления и кипения равны 1245oС и 2080oС, соответственно. Известны четыре кристаллические модификации марганца, каждая из которых устойчива в определенном интервале температур. Так, например, при температуре ниже 707oС устойчив α-марганец, имеющий сложную структуру – в его элементарную ячейку входят 58 атомов.
Валентность марганца в соединениях
Марганец находится в четвертом периоде в VIIB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 25. В ядре атома марганца содержится 25 протонов и 31 нейтрон (массовое число равно 56). В атоме марганца есть четыре энергетических уровня, на которых находятся 25 электронов (рис. 1).
Рис. 1. Строения атома марганца.
Электронная формула атома марганца в основном состоянии имеет следующий вид:
1s22s22p63s23p63d54s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие пяти неспаренных электронов свидетельствует о том, что марганец в своих соединениях может проявлять валентность V, однако эти вещества неустойчивы и быстро разлагаются.
Атом марганца способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 4p-подуровня:
Наличие семи неспаренных электронов свидетельствует о том, что марганец в своих соединениях также может проявлять валентность VII (высшая) (MnVII2O7, MnVIIO3F).
Известно, что для марганца также характерны валентности II (MnIIO, MnII(OH)2, MnIICl2, MnIIS, MnIICO3, MnII3(PO4)2), IV (MnIVO2) и VI(MnVIF6, MnVIOF4, MnVIO3).
Примеры решения задач
ru.solverbook.com
Марганец (химический элемент) — Мегаэнциклопедия Кирилла и Мефодия — статья
Радиус нейтрального атома марганца 0, 130 нм, радиус иона Mn2+ — 0, 080-0, 104 нм, иона Mn7+ — 0, 039-0, 060 нм. Энергии последовательной ионизации атома марганца 7, 435, 15, 64, 33, 7, 51, 2, 72, 4 эВ. По шкале Полинга электроотрицательность марганца 1, 55; марганец принадлежит к числу переходных металлов. Марганец в компактном виде — твердый серебристо-белый металл.
Один из основных материалов марганца — пиролюзит— был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).В земной коре содержание марганца составляет около 0, 1 % по массе. В свободном виде марганец не встречается. Из руд наиболее распространены пиролюзит MnO2(содержит 63, 2 % марганца), манганит MnO2·Mn(OH)2 (62, 5 % марганца), браунит Mn2O3 (69, 5 % марганца), родохрозит MnCo3 (47, 8 % марганца), псиломелан mMnO·MnO2·nH2O (45-60% марганца). Марганец содержат железо-марганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1, 0·10–8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе (см. ст. Железо) при восстановлении руд железа и марганца коксом. В ферромарганце содержание углерода составляет 6-8 % по массе. Чистый марганец получают электролизом водных растворов сульфата марганца MnSO4, который проводят в присутствии сульфата аммония (NH4)2SO4.Марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив альфа-Mn, параметр решетки а = 0, 89125 нм, плотность 7, 44 кг/дм3. В интервале температур 710-1090°C существует бета-Mn, параметр решетки а = 0, 6300 нм; при температурах 1090-1137°C — гамма-Mn, параметр решетки а = 0, 38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив дельта-Mn с параметром решетки а = 0, 30750 нм. Модификаци альфа, бета и дельта хрупкие, гамма-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO. Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7. Все они, кроме Mn2O7, представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5, 9°C, твердые кристаллические вещества. Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO3 = MnO + CO2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn2O3. Этот же оксид марганца образуется при нагревании MnO2 на воздухе при температуре примерно 600°C:
4MnO2 = 2Mn2O3 + O2
Оксид Mn2O3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO2. Если MnO2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn3O4:
3MnO2 = Mn3O4 + O2
Этот оксид можно представить как MnO·Mn2О3, и по свойствам Mn3О4 соответствует смеси этих оксидов. Диоксид марганца MnO2 — наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая бета-модификация MnO2 — это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, гамма-MnO2 также встречается в природе. Это — минерал рамсделит (другое название — полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, — основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO2 можно восстановить водородом до MnO. Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами:
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Mn2O7 — кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO4. При взаимодействии марганца с галогенами образуются дигалогениды MnHal2. В случае фтора возможно также образование фторидов состава MnF3 и MnF4, а в случае хлора — также трихлорида MnCl3. Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS2. Известна целая группа нитридов марганца: MnN6, Mn5N2, Mn4N, MnN, Mn6N5, Mn3N2.
С фосфором марганец образует фосфиды составов MnР, MnP3, Mn2P, Mn3P, Mn3P2 и Mn4P. Известно несколько карбидов и силицидов марганца. С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH)2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца(II):
Mn + 2HCl = MnCl2 + H2.
Из растворов солей Mn2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH)2:
Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4). Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH,
так и восстановителей
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца(+4) и марганца(+7):
3K2MnO4 + 3Н2О = 2KMnO4 + MnO2·Н2О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном. Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4. При давлении около 10 МПа безводный MnCl2 в присутствии металлоорганических соединений реагирует с оксидом углерода(II) CO с образованием биядерного карбонила Mn2(CO)10.
Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10. Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений.Марганец — микроэлемент, постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Содержание марганца в растениях составляет 10-4–10-2 %, в животных 10-3–10-5%, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на проветривание и минеральные обмен.Человек с пищей получает ежедневно 0, 4-10 мг марганца. Недостаток марганца в организме может привести к заболеванию человека. Для обеспечения нормального развития растений в почву вносят марганцевые микроудобрения (обычно в форме разбавленного раствора перманганата калия). Однако избыток марганца для человеческого организма вреден. При отравлении соединениями марганца происходит поражение нервной системы, развивается так называемый марганцевый паркинсонизм.ПДК в расчете на марганец для воздуха 0, 03 мг/м3. Токсическая доза (для крыс) — 10-20 мг.- Позин М.Е. Технология минеральных солей. Л., 1974.
- Неорганическая химия. Энциклопедия школьника. Главный редактор И. П. Алимарин. М., 1975.
megabook.ru
свойства, применение, обозначение, степень окисления, интересные факты
Одним из самых важных для металлургии металлов является марганец. Кроме того, он вообще достаточно необычный элемент, с которым связаны интересные факты. Важный для живых организмов, нужный при получении многих сплавов, химических веществ. Марганец — химический элемент, фото которого можно увидеть ниже. Именно его свойства и характеристики рассмотрим в данной статье.

Характеристика химического элемента
Если говорить о марганце как об элементе периодической системы, то в первую очередь следует охарактеризовать его положение в ней.
- Располагается в четвертом большом периоде, седьмой группе, побочной подгруппе.
- Порядковый номер — 25. Марганец — химический элемент, заряд ядер атомов которого равен +25. Количество электронов такое же, нейтронов — 30.
- Значение атомной массы — 54,938.
- Обозначение химического элемента марганца — Mn.
- Латинское название — manganese.
Располагается между хромом и железом, чем объясняется его сходство с ними в физических и химических характеристиках.
Марганец — химический элемент: переходный металл
Если рассмотреть электронную конфигурацию приведенного атома, то ее формула будет иметь вид: 1s22s22p63s23p64s23d5. Становится очевидно, что рассматриваемый нами элемент — это переходный металл из d-семейства. Пять электронов на 3d-подуровне говорят о стабильности атома, что и проявляется в его химических свойствах.
Как металл марганец является восстановителем, однако большая часть его соединений способна проявлять и достаточно сильные окислительные способности. Это связано с различными степенями окисления и валентностями, которыми обладает данный элемент. В этом заключается особенность всех металлов данного семейства.
Таким образом, марганец — химический элемент, располагающийся среди других атомов и имеющий свои особенные характеристики. Рассмотрим, какие это свойства, более подробно.

Марганец — химический элемент. Степень окисления
Мы уже привели электронную формулу атома. Согласно ей, данный элемент способен проявлять несколько положительных степеней окисления. Это:
Валентность атома равна IV. Самыми устойчивыми являются те соединения, в которых у марганца проявляются значения +2, +4, +6. Высшая степень окисления позволяет выступать соединениям в роли сильнейших окислителей. Например: KMnO4, Mn2O7.
Соединения с +2 являются восстановителями, гидроксид марганца (II) обладает амфотерными свойствами, с преобладанием основных. Промежуточные показатели степеней окисления образуют амфотерные соединения.
История открытия
Марганец — химический элемент, который был открыт не сразу, а постепенно и разными учеными. Однако его соединениями люди пользовались с древних времен. Оксид марганца (IV) применялся для выплавки стекла. Один итальянец констатировал тот факт, что добавка этого соединения при химическом производстве стекол окрашивает их цвет в фиолетовый. Наряду с этим, это же вещество помогает устранить мутность в цветных стеклах.
Позже в Австрии ученый Кайм сумел получил кусочек металлического марганца, воздействуя высокой температурой на пюролизит (оксид марганца (IV)), поташ и уголь. Однако данный образец имел много примесей, устранить которые ему не удалось, поэтому открытие не состоялось.
Еще позже другой ученый также синтезировал смесь, в которой значительная доля приходилась на чистый металл. Это был Бергман, до этого открывший элемент никель. Однако и ему довести дело до конца было не суждено.

Марганец — химический элемент, получить и выделить который в виде простого вещества впервые удалось Карлу Шееле в 1774 году. Однако сделал он это совместно с И. Ганом, который завершил процесс выплавки кусочка металла. Но даже им не удалось полностью избавить его от примесей и получить 100% выход продукта.
Тем не менее именно это время стало открытием данного атома. Эти же ученые предприняли попытку дать название, как первооткрыватели. Ими был выбран термин манганезиум. Однако после открытия магния началась путаница, и название марганца было изменено на современное (Х. Дэвид, 1908 год).
Так как марганец — химический элемент, свойства которого являются весьма ценными для многих металлургических процессов, со временем появилась необходимость все же найти способ получения его в максимально чистом виде. Данная проблема решалась учеными всего мира, но сумела разрешиться лишь в 1919 году благодаря работам Р. Агладзе — советского ученого-химика. Именно он нашел способ, которым можно из сульфатов и хлоридов марганца электролизным путем получить чистый металл с содержанием вещества 99,98%. Теперь этот метод применяется во всем мире.
Нахождение в природе
Марганец — химический элемент, фото простого вещества которого можно увидеть ниже. В природе существует масса изотопов этого атома, количество нейтронов в которых сильно колеблется. Так, массовые числа меняются в пределах от 44 до 69. Однако единственным стабильным изотопом является элемент со значением 55Mn, все остальные имеют либо ничтожно короткий период полураспада, либо существует в слишком малых количествах.

Так как марганец — химический элемент, степень окисления которого весьма различна, то и соединений в природе он образует также много. В чистом виде данный элемент вообще не встречается. В минералах и рудах постоянный сосед его — железо. Всего можно обозначить несколько самых главных горных пород, в состав которых входит марганец.
- Пиролюзит. Формула соединения: MnO2*nH2O.
- Псиломелан, молекула MnO2*mMnO*nh3O.
- Манганит, формула MnO*OH.
- Браунит встречается реже, чем остальные. Формула Mn2O3.
- Гаусманит, формула Mn*Mn2O4.
- Родонит Mn2(SiO3)2.
- Карбонатные руды марганца.
- Малиновый шпат или родохрозит — MnCO3.
- Пурпурит — Mn3PO4.
Помимо этого, можно обозначить еще несколько минералов, в состав которых также входит рассматриваемый элемент. Это:
- кальцит;
- сидерит;
- глинистые минералы;
- халцедон;
- опал;
- песчано-алевритовые соединения.
Помимо горных и осадочных пород, минералов, марганец — химический элемент, который входит в состав следующих объектов:
- Растительные организмы. Самыми крупными накопителями этого элемента являются: водяной орех, ряска, диатомовые водоросли.
- Ржавчинные грибы.
- Некоторые виды бактерий.
- Следующие животные: рыжие муравьи, ракообразные, моллюски.
- Люди — суточная потребность примерно 3-5 мг.
- Воды Мирового океана содержат 0,3% этого элемента.
- Общее содержание в земной коре 0,1% по массе.
В целом это 14 по распространенности элемент из всех на нашей планете. Среди тяжелых металлов он второй после железа.
Физические свойства
С точки зрения свойств марганца, как простого вещества, можно выделить несколько основных физических характеристик для него.
- В виде простого вещества представляет собой достаточно твердый металл (по шкале Мооса показатель равен 4). Цвет — серебристо-белый, на воздухе покрывается защитной оксидной пленкой, на разрезе блестит.
- Температура плавления составляет 12460С.
- Кипения — 20610С.
- Проводниковые свойства хорошие, является парамагнетиком.
- Плотность металла составляет 7,44 г/см3.
- Существует в виде четырех полиморфных модификаций (α, β, γ, σ), различающихся строением и формой кристаллической решетки и плотностью упаковки атомов. Также отличается их температура плавления.
В металлургии применяются три основные формы марганца: β, γ, σ. Альфа реже, так как она слишком хрупкая по своим свойствам.

Химические свойства
С точки зрения химии, марганец — химический элемент, заряд иона которого сильно колеблется от +2 до +7. Это накладывает свой отпечаток и на его активность. В свободном виде на воздухе марганец очень слабо реагирует с водой, растворяется в разбавленных кислотах. Однако стоит лишь увеличить температуру, как активность металла резко возрастает.
Так, он способен взаимодействовать с:
- азотом;
- углеродом;
- галогенами;
- кремнием;
- фосфором;
- серой и прочими неметаллами.
При нагревании без доступа воздуха металл легко переходит в парообразное состояние. В зависимости от степени окисления, которую проявляет марганец, его соединения могут быть как восстановителями, так и окислителями. Некоторые проявляют амфотерные свойства. Так, основные характерны для соединений, в которых он +2. Амфотерные — +4, а кислотные и сильные окислительные в высшем значении +7.
Несмотря на то что марганец — это переходный металл, комплексные соединения для него немногочисленны. Это связано с устойчивой электронной конфигурацией атома, ведь 3d-подуровень его содержит 5 электронов.
Способы получения
Существует три основных способа, которыми в промышленности получают марганец (химический элемент). Как читается на латыни название, мы уже обозначали — manganum. Если перевести его на русский, то это будет «да, действительно проясняю, обесцвечиваю». Таким своим названием марганец обязан проявляемым свойствам, известным с самой древности.
Однако, несмотря на известность, получить его в чистом виде для применения сумели лишь в 1919 году. Делается это следующими методами.
- Электролизный, выход продукта составляет 99,98%. Таким способом получают марганец в химической промышленности.
- Силикотермический, или восстановление при помощи кремния. При данном методе происходит сплавление кремния и оксида марганца (IV), в результате чего формируется чистый металл. Выход составляет около 68%, так как побочно идет соединение марганца с кремнием в силицид. Данный способ применяют в металлургической промышленности.
- Алюминотермический метод — восстановление при помощи алюминия. Также не дает слишком высокого выхода продукта, марганец образуется загрязненный примесями.
Производство данного металла имеет важное значение для многих процессов, осуществляемых в металлургии. Даже небольшая добавка марганца способна сильно повлиять на свойства сплавов. Доказано, что в нем растворяются многие металлы, заполняя собой его кристаллическую решетку.

По добыче и производству данного элемента Россия занимает первое место в мире. Также этот процесс осуществляется в таких странах, как:
- Китай.
- ЮАР.
- Казахстан.
- Грузия.
- Украина.
Использование в промышленности
Марганец — химический элемент, применение которого важно не только в металлургии. но и в других областях. Помимо металла в чистом виде, большое значение имеют и различные соединения данного атома. Обозначим основные из них.
- Существует несколько видов сплавов, которые, благодаря марганцу, имеют уникальные свойства. Так, например, сталь Гадфильда настолько прочная и износостойкая, что ее используют для выплавки деталей экскаваторов, камнеперерабатывающих машин, дробилок, шаровых мельниц, броневых деталей.
- Диоксид марганца — обязательный окислительный элемент гальваники, его используют при создании деполяризаторов.
- Многие соединения марганца нужны для осуществления органических синтезов различных веществ.
- Перманганат калия (или марганцовка) применяется в медицине в качестве сильного обеззараживающего средства.
- Данный элемент входит в состав бронзы, латуни, образует собственный сплав с медью, который служит для изготовления турбин самолетов, лопастей и прочих деталей.
Биологическая роль
Суточная потребность в марганце для человека составляет 3-5 мг. Дефицит данного элемента приводит к угнетению нервной системы, нарушению сна и беспокойству, головокружению. Роль его до конца еще не изучена, однако ясно, что, прежде всего, он оказывает влияние на:
- рост;
- деятельность половых желез;
- работу гормонов;
- образование крови.
Данный элемент присутствует во всех растениях, животных, человеке, что доказывает его немаловажную биологическую роль.

Интересные сведения об элементе
Марганец — химический элемент, интересные факты о котором могут произвести впечатление на любого человека, а также заставить понять, насколько он важен. Приведем самые основные из них, которые нашли свой отпечаток в истории данного металла.
- В тяжелые времена гражданской войны в СССР одним из первых экспортных продуктов была руда, содержащая большое количество марганца.
- Если диоксид марганца сплавить с гидроксидом калия и селитрой, а затем продукт растворить в воде, то начнутся удивительные превращения. Сначала раствор окрасится в зеленый цвет, затем окраска сменится на синий, после — фиолетовый. Наконец, станет малиновой и постепенно выпадет бурый осадок. Если же смесь встряхнуть, то снова восстановится зеленый цвет и все произойдет заново. Именно за это марганцовка и получила свое название, которое переводится, как «минеральный хамелеон».
- Если в землю вносить удобрения, содержащие марганец, то у растений повысится производительность и возрастет скорость фотосинтеза. Озимая пшеница будет лучше формировать зерна.
- Самая большая глыба минерала марганца родонита весила 47 тонн и была найдена на Урале.
- Существует тройной сплав, который называется манганин. Он состоит из таких элементов, как медь, марганец и никель. Его уникальность в том, что он обладает большим электрическим сопротивлением, которое не зависит от температуры, но находится под влиянием давления.
Конечно, это не все, что можно сказать об этом металле. Марганец — химический элемент, интересные факты о котором достаточно разнообразны. Особенно если говорить о тех свойствах, которыми он наделяет различные сплавы.
fb.ru
Химический элемент марганец: свойства, применение, валентность

 Этот элемент в виде пиролюзита (диоксид марганца, MnO 2) использовался доисторическими пещерными художниками пещеры Ласко, во Франции, ещё около 30 000 лет назад. В более поздние времена в древнем Египте производители стекла использовали минералы, содержащие этот металл для удаления бледно-зеленоватого оттенка натурального стекла.
Этот элемент в виде пиролюзита (диоксид марганца, MnO 2) использовался доисторическими пещерными художниками пещеры Ласко, во Франции, ещё около 30 000 лет назад. В более поздние времена в древнем Египте производители стекла использовали минералы, содержащие этот металл для удаления бледно-зеленоватого оттенка натурального стекла.…
Вконтакте
Google+
Мой мир
Отличные руды были найдены в регионе Магнезия, что в северной Греции, к югу от Македонии, и именно тогда началась путаница с названием. Различные руды из региона, которые включали как магний, так и марганец просто назывались магнезией. В XVII веке термин магнезия альба или белая магнезия была принята для магниевых минералов, в то время как название чёрная магнезия использовалась для более тёмных оксидов марганца.
Это интересно: нуклеотид это что такое? Его строение, масса, длина и последовательность.
Кстати, знаменитые магнитные минералы, обнаруженные в этом регионе, были названы камнем магнезии, который, в конце концов, стал сегодняшним магнитом. Путаница продолжалась ещё некоторое время пока в конце XVIII века группа шведских химиков пришла к выводу, что марганец является отдельным элементом. В 1774 году, член группы, представил эти выводы в Стокгольмскую академию, а в том же году Юхан Готлиб Ган, стал первым человеком, который получил чистый марганец и доказал, что это отдельный элемент.
Марганец — химический элемент, характеристики марганца

 Это тяжёлый, серебристо-белый металл, который на открытом воздухе медленно темнеет. Твёрдый, и более хрупкий, чем железо, он имеет удельный вес 7,21 и температуру плавления 1244 °C. Химический символ Mn, атомный вес 54,938, атомный номер 25. В составе формул читается как марганец, например, KMnO 4 — калий марганец о четыре. Это очень распространённый элемент в горных породах, его количество оценивается как 0,085% от массы земной коры.
Это тяжёлый, серебристо-белый металл, который на открытом воздухе медленно темнеет. Твёрдый, и более хрупкий, чем железо, он имеет удельный вес 7,21 и температуру плавления 1244 °C. Химический символ Mn, атомный вес 54,938, атомный номер 25. В составе формул читается как марганец, например, KMnO 4 — калий марганец о четыре. Это очень распространённый элемент в горных породах, его количество оценивается как 0,085% от массы земной коры.Существует более 300 различных минералов, содержащих этот элемент. Крупные земные месторождения находятся в Австралии, Габоне, Южной Африке, Бразилии и России. Но ещё больше находиться на океанском дне в основном на глубине от 4 до 6 километров, поэтому его добыча там не является коммерчески жизнеспособной.
Минералы окисленного железа (гематит, магнетит, лимонит и сидерит) содержат 30% этого элемента. Другим потенциальным источником являются глина и красные грязевые отложения, в которых есть узелки с содержанием до 25%. Наиболее чистый марганец получают путём электролиза водных растворов.
Это интересно: типы кристаллических решёток, таблица.
Марганец и хлор находятся в VII группе периодической таблицы, но хлор — в главной подгруппе, а марганец — в побочной, к которой относятся ещё технеций Тс и рений Ке — полные электронные аналоги. Марганец Мп, технеций Тс и рений Ке — полные электронные аналоги с конфигурацией валентных электронов.
Этот элемент присутствует в небольших количествах и в сельскохозяйственных почвах. Во многих сплавах меди, алюминия, магния, никеля различное его процентное содержание, даёт им конкретные физические и технологические свойства:
- устойчивость к износу;
- теплоустойчивость;
- устойчивость к коррозии;
- плавкость;
- электрическое сопротивление и т. д.
Валентности марганца
Степени окисления марганца от 0 до +7. В двухвалентной степени окисления марганец имеет отчётливо металлический характер и высокую склонность к образованию сложных связей. При четырехвалентном окислении преобладает промежуточный характер между металлическими и неметаллическими свойствами, в то время как шестивалентный и семивалентный обладают неметаллическими свойствами.
Это интересно: ковалентная неполярная связь, примеры из химии.
Оксиды:
Формула. Цвет

 (II) MnO зелёный;
(II) MnO зелёный;- (II, III) Mn 3O4, коричневый;
- (II, IV) Mn 5O8;
- (III) Mn 2O3, тёмно-коричневый;
- (IV) MnO 2, бурый;
- (VI) MnO 3;
- (VII) MnO 7, тёмно-зелёный.
Биохимия и фармакология
Марганец является элементом, широко распространённым в природе, он присутствует в большинстве тканей растений и животных. Самые высокие концентрации находятся:
- в апельсиновой корке;
- в винограде;
- в ягодах;
- в спарже;
- в ракообразных;
- в брюхоногих;
- в двустворчатых.
Одни из наиболее важных реакций в биологии, фотосинтезе, полностью зависят от этого элемента. Это звёздный игрок в реакционном центре фотосистемы II, где молекулы воды превращаются в кислород. Без него невозможен фотосинтез.
Он является важным элементом во всех известных живых организмах. Например, фермент, ответственный за превращение молекул воды в кислород во время фотосинтеза, содержит четыре атома марганца.
Средний человеческий организм содержит около 12 миллиграммов этого металла. Мы получаем около 4 миллиграммов каждый день из таких продуктов, как орехи, отруби, злаки, чай и петрушка. Этот элемент делает кости скелета более прочными. Он также важен для усвоения витамина B1.
Польза и вредные свойства

 Этот микроэлемент, имеет большое биологическое значение: он действует в качестве катализатора в биосинтезе порфиринов, а затем гемоглобина у животных и хлорофилла в зелёных растениях. Его присутствие также является необходимым условием для активности различных митохондриальных ферментных систем, некоторых ферментов метаболизма липидов и окислительных процессов фосфорилирования.
Этот микроэлемент, имеет большое биологическое значение: он действует в качестве катализатора в биосинтезе порфиринов, а затем гемоглобина у животных и хлорофилла в зелёных растениях. Его присутствие также является необходимым условием для активности различных митохондриальных ферментных систем, некоторых ферментов метаболизма липидов и окислительных процессов фосфорилирования.Пары или питьевая вода, загрязнённая солями этого металла, приводит к ирритативным изменениям дыхательных путей, хронической интоксикации с прогрессирующей и необратимой тенденцией, характеризующейся поражением базальных ганглиев центральной нервной системы, а затем нарушению экстрапирамидного типа аналогичного болезни Паркинсона.
Такое отравление часто имеет профессиональный характер. Ему подвержены рабочих занятые на обработке этого металла и его производных, а также работники химической и металлургической промышленности. В медицине, его используют в форме перманганата калия как вяжущее, местное антисептическое средство, а также в качестве антидота ядов природы алкалоидов (морфин, кодеин, атропин и т. д.).
Некоторые почвы имеют низкий уровень этого элемента, поэтому его добавляют к удобрениям и дают в качестве пищевой добавки для пасущихся животных.
Марганец: применение

 В виде чистого металла, за исключением ограниченного использования в области электротехники, этот элемент не имеет других практических применений, в то же время широко используется для приготовления сплавов, производства стали и пр.
В виде чистого металла, за исключением ограниченного использования в области электротехники, этот элемент не имеет других практических применений, в то же время широко используется для приготовления сплавов, производства стали и пр.Когда Генри Бессемер изобрёл процесс производства стали в 1856 году, его сталь разрушалась из-за горячей прокатки. Проблема была решена в том же году, когда было обнаружено, что добавление небольших количеств этого элемента к расплавленному железу решает эту проблему. Сегодня фактически около 90% всего марганца используется для производства стали.
obrazovanie.guru
