Сила реакции опоры: определение и формула
Статика — один из разделов современной физики, который изучает условия нахождения тел и систем в механическом равновесии. Для решения задач на равновесие важно знать, что такое сила реакции опоры. Данная статья посвящена подробному рассмотрению этого вопроса.
Второй и третий законы Ньютона
Прежде чем рассматривать определение силы реакции опоры, следует вспомнить о том, что вызывает движение тел.
Причиной нарушения механического равновесия является действие на тела внешних или внутренних сил. В результате этого действия тело приобретает определенное ускорение, которое вычисляется с помощью следующего равенства:
F = m*a
Эта запись известна как второй закон Ньютона. Здесь сила F является результирующей всех действующих на тело сил.
Если одно тело воздействует с некоторой силой F1¯ на второе тело, то второе оказывает действие на первое с точно такой же по абсолютной величине силой F2¯, но она направлена в противоположном направлении, чем F1¯. То есть справедливо равенство:
F1¯ = -F2¯
Эта запись является математическим выражением для третьего ньютоновского закона.
При решении задач с использованием этого закона школьники часто допускают ошибку, сравнивая эти силы. Например, лошадь везет телегу, при этом лошадь на телегу и телега на лошадь оказывают одинаковые по модулю силы. Почему же тогда вся система движется? Ответ на этот вопрос можно правильно дать, если вспомнить, что обе названные силы приложены к разным телам, поэтому они друг друга не уравновешивают.
Сила реакции опоры
Сначала дадим физическое определение этой силы, а затем поясним на примере, как она действует. Итак, силой нормальной реакции опоры называется сила, которая действует на тело со стороны поверхности. Например, мы поставили стакан с водой на стол. Чтобы стакан не двигался с ускорением свободного падения вниз, стол воздействует на него с силой, которая уравновешивает силу тяжести. Это и есть реакция опоры. Ее обычно обозначают буквой N.
Сила N — это контактная величина. Если имеется контакт между телами, то она появляется всегда. В примере выше значение величины N равно по модулю весу тела. Тем не менее это равенство является лишь частным случаем. Реакция опоры и вес тела — это совершенно разные силы, имеющие различную природу. Равенство между ними нарушается всегда, когда изменяется угол наклона плоскости, появляются дополнительные действующие силы, или когда система движется ускоренно.
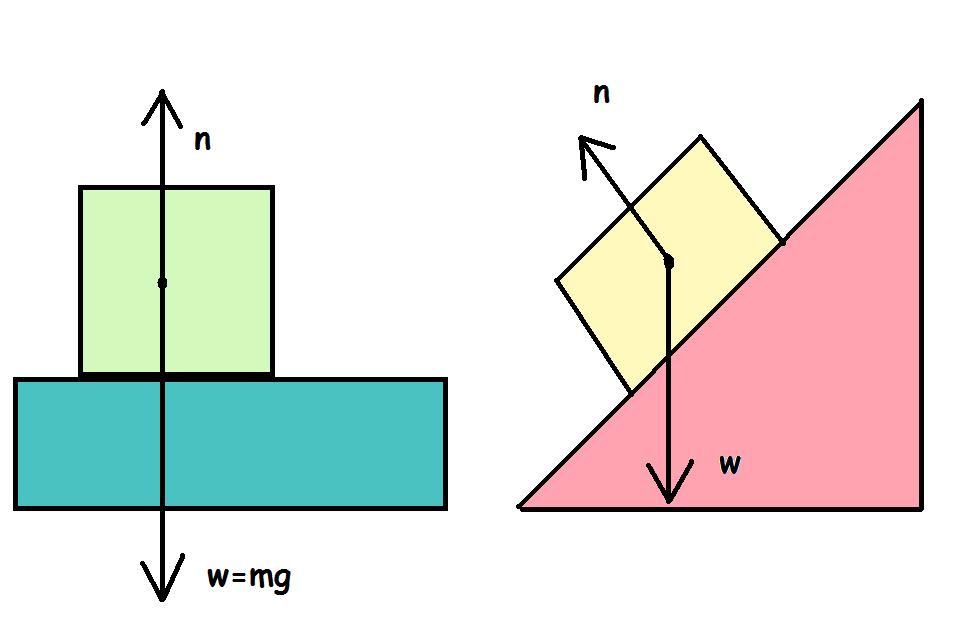
Сила N называется нормальной потому, что она всегда направлена перпендикулярно плоскости поверхности.
Если говорить о третьем законе Ньютона, то в примере выше со стаканом воды на столе вес тела и нормальная сила N не являются действием и противодействием, поскольку обе они приложены к одному телу (стакану с водой).
Физическая причина появления силы N
Как было выяснено выше, сила реакции опоры препятствует проникновению одних твердых тел в другие. Почему появляется эта сила? Причина заключается в деформации. Любые твердые тела под воздействием нагрузки деформируются сначала упруго. Сила упругости стремится восстановить прежнюю форму тела, поэтому она оказывает выталкивающее воздействие, что проявляется в виде реакции опоры.
Если рассматривать вопрос на атомном уровне, то появление величины N — это результат действия принципа Паули. При небольшом сближении атомов их электронные оболочки начинают перекрываться, что приводит к появлению силы отталкивания.
Многим может показаться странным, что стакан с водой способен деформировать стол, но это так. Деформация настолько мала, что невооруженным глазом ее невозможно наблюдать.
Как вычислять силу N?
Сразу следует сказать, что какой-то определенной формулы силы реакции опоры не существует. Тем не менее имеется методика, применяя которую, можно определить N для совершенно любой системы взаимодействующих тел.
Методика определения величины N заключается в следующем:
- сначала записывают второй закон Ньютона для данной системы, учитывая все действующие в ней силы;
- находят результирующую проекцию всех сил на направление действия реакции опоры;
- решение полученного уравнения Ньютона на отмеченное направление приведет к искомому значению N.
При составлении динамического уравнения следует внимательно и правильно расставлять знаки действующих сил.
Найти реакцию опоры можно также, если пользоваться не понятием сил, а понятием их моментов. Привлечение моментов сил справедливо и является удобным для систем, которые имеют точки или оси вращения.
Далее приведем два примера решения задач, в которых покажем, как пользоваться вторым ньютоновским законом и понятием момента силы для нахождения величины N.
Задача со стаканом на столе
Выше уже был приведен этот пример. Предположим, что пластиковый стакан объемом 250 мл наполнен водой. Его поставили на стол, а сверху на стакан положили книгу массой 300 грамм. Чему равна сила реакции опоры стола?
Запишем динамическое уравнение. Имеем:
m*a = P1 + P2 — N
Здесь P1 и P2 — вес стакана с водой и книги соответственно. Поскольку система находится в равновесии, то a=0. Учитывая, что вес тела равен силе тяжести, а также пренебрегая массой пластикового стакана, получаем:
m1*g + m2*g — N = 0 =>
N = (m1 + m2)*g
Учитывая, что плотность воды равна 1 г/см3, и 1 мл равен 1 см3, получаем согласно выведенной формуле, что сила N равна 5,4 ньютона.
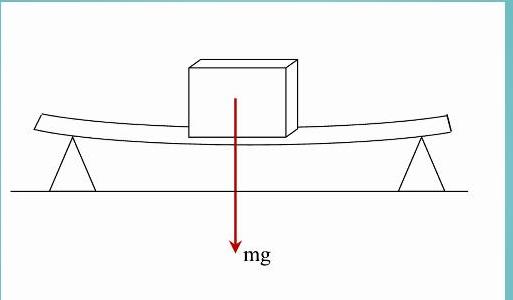
Задача с доской, двумя опорами и грузом

Доска, массой которой можно пренебречь, лежит на двух твердых опорах. Длина доски равна 2 метра. Чему будет равна сила реакции каждой опоры, если на эту доску посередине положить груз массой 3 кг?
Прежде чем переходить к решению задачи, следует ввести понятие момента силы. В физике этой величине соответствует произведение силы на длину рычага (расстояние от точки приложения силы до оси вращения). Система, имеющая ось вращения, будет находиться в равновесии, если суммарный момент сил равен нулю.
Возвращаясь к нашей задаче, вычислим суммарный момент сил относительно одной из опор (правой). Обозначим длину доски буквой L. Тогда момент силы тяжести груза будет равен:
M1 = -m*g*L/2
Здесь L/2 — рычаг действия силы тяжести. Знак минус появился потому, что момент M1 осуществляет вращение против часовой стрелки.
Момент силы реакции опоры будет равен:
M2 = N*L
Поскольку система находится в равновесии, то сумма моментов должна быть равной нулю. Получаем:
M1 + M2 = 0 =>
N*L + (-m*g*L/2) = 0 =>
N = m*g/2 = 3*9,81/2 = 14,7 Н
Заметим, что от длины доски сила N не зависит.
Учитывая симметричность расположения груза на доске относительно опор, сила реакции левой опоры также будет равна 14,7 Н.
fb.ru
Реакция соединения: примеры и формула
Реакция обмена, замещения, соединения, разложения рассматриваются в курсе школьной программы. Проанализируем особенности каждого типа, приведем примеры взаимодействий.
Определение термина
Что собой представляет реакция соединения, примеры которой в общеобразовательных учреждениях рассматривают на первой ступени обучения? Для начала отметим, что сам термин «химическая реакция» в химии считается вторым по значимости.
В нашем мире каждую минуту протекает реакция соединения, уравнения которой знакомы нам, но мы о них даже не задумываемся.
Например, получение газированных напитков, сгорание дров — типичные примеры реакций соединения.
Данный процесс предполагает получение продуктов с определенным качественным и количественным составом из исходных химических веществ.
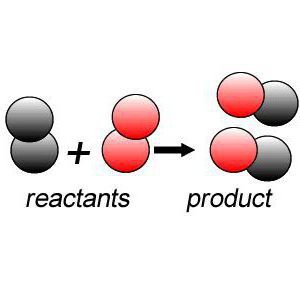
Признаки химических реакций
Любой процесс, в том числе и химическая реакция соединения, сопровождается определенными признаками:
- выделение света или тепла;
- изменение окраски раствора;
- выделение газообразного вещества;
- появление специфического запаха;
- растворение либо выпадение осадка.
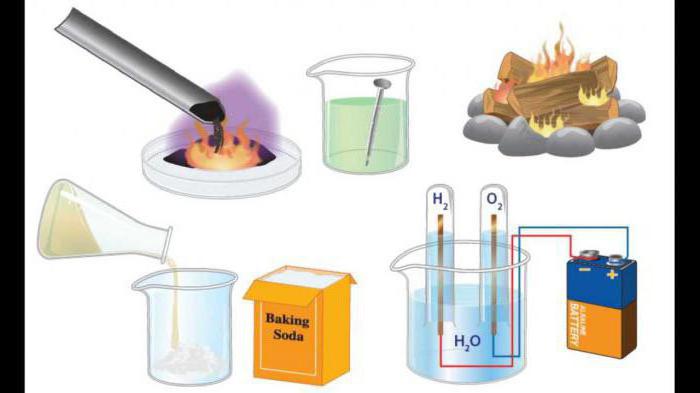
Условия проведения реакций
В зависимости от особенностей качественного и количественного состава, химическая реакция соединения может протекать при разных условиях.
Например, взаимодействие вида 2Са + О2 = 2СаО (гашение извести) протекает без предварительного нагревания, сопровождается выделением существенного количества тепловой энергии.
Как правильно составляется реакция соединения? Уравнения подобных процессов предполагают написание в левой части исходных веществ, а в правой части составляется продукт реакции.
4Na + O2 = 2Na2O
Подобные процессы присущи органическим веществам. Так, качественной реакцией на непредельность (присутствие кратной связи) является реакция окисления исходного вещества перманганатом калия.

Сгорание дров
Данный процесс протекает по уравнению:
С + О2 = СО2
Это типичная реакция соединения, примеры которых уже были приведены выше. Какова суть данного процесса? При взаимодействии дров с кислородом, содержащимся в воздухе, происходит образование молекул углекислого газа. Процесс сопровождается образованием новой молекулы сложного соединения связи, является экзотермической реакцией.
Возможна ли между сложными веществами реакция соединения? Примеры взаимодействия с простыми веществами были рассмотрены выше, но данный тип характерен и для сложных веществ. Типичным вариантом подобного взаимодействия можно считать реакцию гашения извести.
СаО + Н2О = Са(ОН)2
Данный процесс также сопровождается выделением значительного количества тепловой энергии. Среди специфических особенностей этого процесса отметим его самопроизвольность.
Классификация
По составу исходных веществ и продуктов реакции выделяется реакция соединения, разложения, замещения, обмена. Рассмотрим их примеры, а также приведем определения таких процессов.
Замещение — это замена атомами простого вещества части сложного соединения.
Присоединение — это процесс объединения нескольких простых либо сложных веществ в одно более сложное. Примеры подобных процессов можно привести из неорганической и органической химии.
2H2 + О2 = 2H2 O
Этот процесс происходит с выделением существенного количества тепла, поэтому возможен взрыв.
C2 H4 + H2 = C2 H6
При пропускании водорода через этилен, происходит разрыв двойной связи, образование предельного (насыщенного) углеводорода.
Разложение — это те химические реакции, в результате которых из одного сложного соединения образуется нескольких веществ, имеющих более простой качественный и количественный состав.
Реакции ионного обмена — это процессы, происходящие между сложными веществами, в результате которых происходит обмен составными частями.
Существует три условия протекания такого процесса: выделение газа, выпадение осадка, образование малодиссоциируемого вещества.
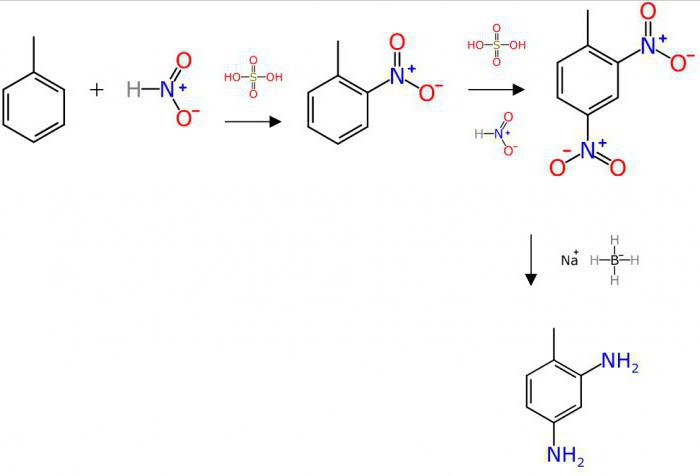
Данное взаимодействие называют этерификацией, так как конечный продукт взаимодействия является сложным эфиром. Условием протекания процесса в прямом направлении является введение в реакционную смесь концентрированной серной кислоты.
Деление по агрегатному состоянию взаимодействующих веществ
Все химические процессы классифицируют по данному признаку на гомогенные и гетерогенные взаимодействия. В первом случае исходные вещества и продукты взаимодействия находятся в одном агрегатном состоянии, а для гетерогенных видов допускается различное состояние.
Например, гомогенным процессом будет являться следующее взаимодействие:
H2(газ) + Cl2(газ) = 2HCl(газ)
В качестве гетерогенной реакции можно рассмотреть следующий вариант:
CaO(тв) + H2O(ж) = Ca(OH)2 (р-р)

По изменению степени окисления
Реакция соединения, формула которой была приведена выше (образование воды из простых веществ), является окислительно-восстановительным процессом. Суть процесса состоит в том, что происходит принятие и отдача электронов.
Среди реакций соединения есть и такие процессы, которые не сопровождаются изменением степеней окисления, то есть не являются ОВР:
СаО + Н2О = Са(ОН)2
По характеру протекания
В зависимости от того, может ли процесс протекать только в прямом направлении либо реакция происходит и в обратную сторону, в химии выделяют необратимые и обратимые взаимодействия.
Например, качественная реакция на органические соединения является необратимой, так как приводит к образованию нерастворимого либо газообразного вещества. Примером такого качественного взаимодействия будет реакция «серебряного зеркала», являющаяся качественным способом определения в смеси альдегидов.
Среди типичных вариантов обратимых реакций, которые способны протекать в двух взаимно обратных направлениях, отметим реакцию этерификации:
CO2 + H2O = H2CO3
По использованию катализатора
В некоторых случаях необходимо применять ускоритель (катализатор) для того, чтобы пошел химический процесс. Примером каталитического взаимодействия является процесс разложения перекиси водорода.

Особенности разбора ОВР
Среди тех вопросов, которые чаще всего вызывают затруднения у школьников, является расстановка коэффициентов в реакции с помощью метода электронного баланса. Начнем с того, что существуют определенные правила, согласно которым в каждом веществе можно определить степени окисления у отдельных элементов.
Независимо от того, простое или сложное вещество будет рассматриваться, сумма их должна быть равна нулю.
Следующим этапом будет выбор тех веществ или отдельных химических элементов, у которых поменялось значение степени окисления. Их выписывают отдельно, показывая знаками «плюс» либо «минус» количество принятых либо отданных электронов.
Между этими цифрами находят наименьшее число, при делении на которое числа принятых и отданных электронов будут получаться целые числа.
Полученные числа являются стереохимическими коэффициентами, расставляемыми в уравнении предложенного процесса. Важным этапом разбора окислительно-восстановительных реакций является определение окислителя и восстановителя, а также запись происходящих процессов. В качестве восстановителя выбирают те атомы или ионы, которые в ходе взаимодействия повысили свою степень окисления, для окислителя, напротив, характерно понижение этого показателя.
Предполагает ли в этом алгоритме какие-то изменения органическая химия? Реакция соединения, замещения, разложения, протекания с изменением степеней окисления, рассматривается по аналогичному алгоритму.
Есть определенные особенности в расстановке степеней окисления в органических соединениях, но их сумма также должна быть равна нулю.
В зависимости от того, как именно происходит изменение степеней окисления, выделяют несколько видов химических взаимодействий:
- диспропорционирование — связано с изменением степеней окисления у одного и того же элемента в большую и меньшую сторону;
- контрпропорционирование — предполагает взаимодействие восстановителя и окислителя, в составе которых один и тот же элемент, но в разных степенях окисления.
Заключение
В качестве небольшого итога отметим, что при взаимодействии веществ друг с другом происходят их изменения, превращения. Химические реакции являются превращениями одного либо нескольких реагентов в продукты, имеющие иной качественный и количественный состав.
Если в ядерных превращениях наблюдается изменение состава ядер атомов, то в случае химических реакций этого нет, происходит лишь перераспределение ядер и электронов, приводящее к появлению новых соединений.
Происходящие процессы могут сопровождаться выделением света, тепла, появлением запаха, выпадением осадка, образованием газообразных веществ.
Существует множество вариантов классификации органических и неорганических взаимодействий по разным признакам. Среди самых распространенных вариантов можно упомянуть изменение степеней окисления, агрегатное состояние, обратимость протекания, механизм проведения процесса, применение катализатора (ингибитора).
Химические реакции являются базой не только промышленного производства, но и основой жизни. Без обменных процессов, которые проходят в живых организмах, существование было бы невозможно.
fb.ru
Химические формулы и уравнения химических реакций
При написании уравнений химических реакций часто указывают физическое состояние каждого компонента, помещая справа от формулы в скобках символы г — газообразное ж — жидкое, т — твердое, водн. — растворенное состояние. Например [c.21]Уравнением химической реакции называется изображение химической реакции при помощи химических формул, соединенных знаком плюс и знаком равенства. Химическое уравнение выражает не только качественную, но и количественную [c.18]
Химический элемент, простое вещество, сложное вещество. Знаки химических элементов и хгшические формулы. Уравнения химических реакций. [c.122]
В уравнениях химических реакций белый фосфор обычно записывают формулой Р4, которая соответствует составу его молекул. Красная и черная модификации фосфора обычно записываются символом Р. Этот же символ используют, если модификация неизвестна или может быть любой.
Предложить два различных метода определения МпОг в пиролюзите. Записать уравнения химических реакций, расчетные формулы. [c.124]
Осторожно нагрейте пробирку на газовой горелке наблюдайте изменение цвета и характера осадка за счет восстановления дигид-роксида меди Си(ОН)з до металлической меди. Какое соединение получилось в результате окисления формальдегида Напишите структурные формулы формальдегида и полученной в опыте муравьиной кислоты. Составьте уравнение химической реакции окисления муравьиного альдегида дигидроксидом меди. [c.242]
В уравнении химической реакции каждая формула изображает один моль соответствующего вещества. Поэтому, зная мольные массы участвующих в реакции веществ, молуравнению реакции найти соотношение между массами веществ, вступающих в реакцию н образующихся в результате ее протекания. Если в реакции участвуют вещества в газообразном состоянии, то уравнение реакции позволяет найти их объемные отношения. [c.25]
Вот это утверждение уже представляет собой уравнение химической реакции меди с кислородом, приводящей к получению оксида меди(1). Числа, 2 и 4, помещенные перед символами или формулами, называются стехиомет-рическими коэффициентами. Для проверки подсчитаем атомы каждого элемента в обеих частях уравнения [c.107]
В обеих частях (левой и правой) уравнения химической реакции должно находиться одинаковое число символов каждого элемента (закон сохранения элементов). Для этого перед формулами исходных и конечных веществ ставятся соответствующие числовые коэффициенты (определяющие число молей вступающих в реакцию и получающихся в результате реакции веществ), например [c.364]
Химические уравнения используют для выполнения различных расчетов, связанных с реакциями. Напомним, что каждая формула в уравнении химической реакции изображает один моль соответствующего вещества. Поэтому, зная молярные массы веществ — участников реакции и коэффициенты в уравнении, можно найти количественные соотношения между веществами, вступающими в реакцию и образующимися в результате ее протекания. Например, уравнение
При осуществлении химических диктантов, которые используют при написании формул и символов элементов, уравнений химических реакций. Запись текста на магнитофон может быть осуществлена в двух вариантах (женский и мужской голос). Учитель наблюдает за работой учащихся. Такая форма звукозаписей имеет значение для контроля знаний учащихся. [c.101]
Любую химическую реакцию можно представить в виде химического уравнения, которое состоит из двух частей, соединенных знаком равенства. В левой части уравнения записываются формулы веществ, вступающих в реакцию, а в правой— веществ, полученных в результате реакции. [c.18]
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании главы и выясняются ее трудные места. При повторном изучении темы усваиваются сущность вопроса, теоретические положения, их приложения, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивает прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом способствует сосредоточенности внимания, помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный студентами на основе изучения учебника, передает не только содержание книги, но и отношение читающего к изучаемому материалу. Прежде чем записать мысль, необходимо обдумать ее формулировку и выразить ее своими словами. Однако наиболее важные положения и определения целесообразно приводить в виде выписок и цитат. Необходимо заносить в конспекты основные законы и понятия химии, формулы и уравнения реакций, математические зависимости, незнакомые термины и названия. Облегчает усвоение материала, составление графиков, схем и таблиц на основе прочитанного раздела книги.
При изучении химии мы постоянно пользуемся уравнениями химических реакций, которые представляют собой запись происшедших при реакции превращений веществ. Таким образом, при составлении уравнения реакции мы должны знать, что образовалось в результате взаимодействия, и записать это при помощи химических формул. Например, водород реагирует с кислородом, давая воду [c.167]
Составляется химическая формула или уравнение реакции, на основе которых будет решаться данная задача (если о них говорится в условии задачи). [c.231]
Научной основой курса химии средней школы является учение о периодичности свойств и строении атомов элементов. На первоначальном этапе обучения в средней школе и ПТУ, техникумах и на подготовительных курсах много внимания уделяется атомно-молекулярной теории и основным законам химии. Поэтому указанный материал намеренно не рассматривается в пособии отдельно. Его можно повторить, используя школьный учебник и тренируясь в решении задач и упражнений (
www.chem21.info
Скорость химических реакций
Скорость химической реакции
Изучение скоростей протекания реакций, получение данных о факторах, влияющих на скорость химической реакции, а также изучение механизмов химических реакций осуществляют экспериментально.
Скорость гомогенной и гетерогенной реакций определяются различно.
Определение меры скорости химической реакции можно записать в математической форме. Пусть – скорость химической реакции в гомогенной системе, nB – число моле какого-либо из получающихся при реакции веществ, V – объем системы, – время. Тогда в пределе:
= dnB / (Vd)
Это уравнение можно упростить – отношение количества вещества к объему представляет собой молярную концентрацию вещества nB /V = cB, откуда dnB / V = dcB и окончательно:
= dcB/d
На практике измеряют концентрации одного или нескольких веществ в определенные промежутки времени. Концентрации исходных веществ со временем уменьшаются, а концентрации продуктов – увеличиваются (рис. 1).
Рис. 1. Изменение концентрации исходного вещества (а) и продукта реакции (б) со временем
Факторы, влияющие на скорость химической реакции
Факторами, оказывающими влияние на скорость химической реакции, являются: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов, давление и объем (в газовой фазе).
С влиянием концентрации на скорость химической реакции связан основной закон химической кинетики – закон действующих масс (ЗДМ): скорость химической реакции прямопропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. ЗДМ не учитывает концентрацию веществ в твердой фазе в гетерогенных системах.
Для реакции mA +nB = pC +qD математическое выражение ЗДМ будет записываться:
= k × CAm × CBn
= k × [A]m × [B]n ,
где k – константа скорости химической реакции, представляющая собой скорость химической реакции при концентрации реагирующих веществ 1моль/л. В отличие от скорости химической реакции, k не зависит от концентрации реагирующих веществ. Чем выше k, тем быстрее протекает реакция.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа. Правило Вант-Гоффа: при повышении температуры на каждые десять градусов скорость большинства химических реакций увеличивается примерно в 2 – 4 раза. Математическое выражение:
(T2) = (T1) × (T2-T1)/10 ,
где – температурный коэффициент Вант-Гоффа, показывающий во сколько раз увеличилась скорость реакции при повышении температуры на 10oС.
Молекулярность и порядок реакции
Молекулярность реакции определяется минимальным числом молекул, одновременно вступающих во взаимодействие (участвующих в элементарном акте). Различают:
— мономолекулярные реакции (примером могут служить реакции разложения)
N2O5 = 2NO2 + 1/2O2
= k × C, -dC/dt = kC
Однако, не все реакции, подчиняющиеся этому уравнению мономолекулярны.
— бимолекулярные
H2 + I2 = 2HI
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
= k × C1 × C2, -dC/dt = k × C1 × C2
— тримолекулярные (встречаются очень редко).
Молекулярность реакции определяется ее истинным механизмом. По записи уравнения реакции определить ее молекулярность нельзя.
Порядок реакции определяется по виду кинетического уравнения реакции. Он равен сумме показателей степеней концентрации в этом уравнении. Например:
CaCO3 = CaO + CO2
= k × C12 × C2 – третий порядок
Порядок реакции может быть дробным. В таком случае он определяется экспериментально. Если реакция протекает в одну стадию, то порядок реакции и ее молекулярность совпадают, если в несколько стадий, то порядок определяется самой медленной стадией и равен молекулярности этой реакции.
Примеры решения задач
ru.solverbook.com
формула реакции — это… Что такое формула реакции?
- формула реакции
Makarov: reaction formula
Универсальный русско-английский словарь. Академик.ру. 2011.
- формула расширения
- формула регрессии
Смотреть что такое «формула реакции» в других словарях:
Формула-1 в сезоне 2010 — 61 й Чемпионат мира Формулы 1 ◄ 2009 Сезон 2010 2011 ► … Википедия
формула брейта-вигнера — Теоретическая формула для зависимости сечения реакции от энергии в окрестности изолированного резонанса … Политехнический терминологический толковый словарь
Порог реакции — Порогом реакции называется минимальная кинетическая энергия, которую должна иметь элементарная частица в лабораторной системе отсчёта, чтобы было возможным протекание данной ядерной реакции. Формула для расчёта: или аналогично , если , то эту… … Википедия
ЛЕЙКОЦИТАРНАЯ ФОРМУЛА КРОВИ — ЛЕЙКОЦИТАРНАЯ ФОРМУЛА КРОВИ, процентное взаимоотношение отдельных пяти видов лейкоцитов: нейтрофилов, эозино филов, базофилов, лимфоцитов и моноцитов. Лейкоцитарная формула крови составляется на основании сосчитывания в окрашенном сухом мазке… … Большая медицинская энциклопедия
ВРЕМЯ ПСИХИЧЕСКОЙ РЕАКЦИИ — ВРЕМЯ ПСИХИЧЕСКОЙ РЕАКЦИИ, время от момента раздражения до момента реакции испытуемого субъекта на это раздражение. Оно слагается из ряда компонентов, по числу элементов рефлекторной дуги (по Vogelsang у, при В.п. р.в 0,239 сек.,на сенсорную… … Большая медицинская энциклопедия
Брейта-Вигнера формула — Брейта Вигнера формула, позволяет определить вероятность ядерной реакции в зависимости от энергии бомбардирующей частицы, вызывающей данную реакцию. Предложена американскими физиками Г. Брейтом (G. Breit) и Ю. Вигнером (Е. Wigner) в 1936.… … Большая советская энциклопедия
БРЕЙТА — ВИГНЕРА ФОРМУЛА — описывает зависимость эфф. сечения s ядерных реакций от энергии налетающих ч ц вблизи резонансного значения энергии. Предложена амер. физиками Г. Брейтом (G. Breit) и Ю. Вигнером (Е. Wigner) в 1936. Иногда называется также дисперсионной ф лой,… … Физическая энциклопедия
Экзотермические реакции — Экзотермическая реакция химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции. Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать … Википедия
Брейта — Вигнера формула — позволяет определить вероятность ядерной реакции в зависимости от энергии бомбардирующей частицы, вызывающей данную реакцию. Предложена американскими физиками Г. Брейтом (G. Breit) и Ю. Вигнером (Е. Wigner) в 1936. Подробнее см. Ядерные… … Большая советская энциклопедия
КЛЕЙНА — НИШЙНЫ ФОРМУЛА — выражение для дифференц. сечения ds рассеяния фотона на электроне (см. Комптона эффект). В лаб. системе координат где частоты падающего и рассеянного фотона, элемент телесного угла для рассеянного фотона, угол рассеяния, параметр r0 = e … Физическая энциклопедия
БРЕЙТА — ВИГНЕРА ФОРМУЛА — БРЕЙТА ВИГНЕРА ФОРМУЛА, описывает зависимость вероятности ядерной реакции от энергии «налетающей» частицы вблизи резонансной энергии. Предложена американскими физиками Г. Брейтом (G. Breit) и Ю. Вигнером (см. ВИГНЕР Юджин Пол) в 1936 … Энциклопедический словарь
universal_ru_en.academic.ru
формула реакции — это… Что такое формула реакции?
- формула реакции
формулаи реаксия (ҳамтабдилот). хим.
Краткий русско-таджикский терминологический словарь по точным, естественным и техническим наукам. Пирмаҳмад Нуров. 2013.
- формула размерностей
- формула Резерфорда
Смотреть что такое «формула реакции» в других словарях:
Формула-1 в сезоне 2010 — 61 й Чемпионат мира Формулы 1 ◄ 2009 Сезон 2010 2011 ► … Википедия
формула брейта-вигнера — Теоретическая формула для зависимости сечения реакции от энергии в окрестности изолированного резонанса … Политехнический терминологический толковый словарь
Порог реакции — Порогом реакции называется минимальная кинетическая энергия, которую должна иметь элементарная частица в лабораторной системе отсчёта, чтобы было возможным протекание данной ядерной реакции. Формула для расчёта: или аналогично , если , то эту… … Википедия
ЛЕЙКОЦИТАРНАЯ ФОРМУЛА КРОВИ — ЛЕЙКОЦИТАРНАЯ ФОРМУЛА КРОВИ, процентное взаимоотношение отдельных пяти видов лейкоцитов: нейтрофилов, эозино филов, базофилов, лимфоцитов и моноцитов. Лейкоцитарная формула крови составляется на основании сосчитывания в окрашенном сухом мазке… … Большая медицинская энциклопедия
ВРЕМЯ ПСИХИЧЕСКОЙ РЕАКЦИИ — ВРЕМЯ ПСИХИЧЕСКОЙ РЕАКЦИИ, время от момента раздражения до момента реакции испытуемого субъекта на это раздражение. Оно слагается из ряда компонентов, по числу элементов рефлекторной дуги (по Vogelsang у, при В.п. р.в 0,239 сек.,на сенсорную… … Большая медицинская энциклопедия
Брейта-Вигнера формула — Брейта Вигнера формула, позволяет определить вероятность ядерной реакции в зависимости от энергии бомбардирующей частицы, вызывающей данную реакцию. Предложена американскими физиками Г. Брейтом (G. Breit) и Ю. Вигнером (Е. Wigner) в 1936.… … Большая советская энциклопедия
БРЕЙТА — ВИГНЕРА ФОРМУЛА — описывает зависимость эфф. сечения s ядерных реакций от энергии налетающих ч ц вблизи резонансного значения энергии. Предложена амер. физиками Г. Брейтом (G. Breit) и Ю. Вигнером (Е. Wigner) в 1936. Иногда называется также дисперсионной ф лой,… … Физическая энциклопедия
Экзотермические реакции — Экзотермическая реакция химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции. Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать … Википедия
Брейта — Вигнера формула — позволяет определить вероятность ядерной реакции в зависимости от энергии бомбардирующей частицы, вызывающей данную реакцию. Предложена американскими физиками Г. Брейтом (G. Breit) и Ю. Вигнером (Е. Wigner) в 1936. Подробнее см. Ядерные… … Большая советская энциклопедия
КЛЕЙНА — НИШЙНЫ ФОРМУЛА — выражение для дифференц. сечения ds рассеяния фотона на электроне (см. Комптона эффект). В лаб. системе координат где частоты падающего и рассеянного фотона, элемент телесного угла для рассеянного фотона, угол рассеяния, параметр r0 = e … Физическая энциклопедия
БРЕЙТА — ВИГНЕРА ФОРМУЛА — БРЕЙТА ВИГНЕРА ФОРМУЛА, описывает зависимость вероятности ядерной реакции от энергии «налетающей» частицы вблизи резонансной энергии. Предложена американскими физиками Г. Брейтом (G. Breit) и Ю. Вигнером (см. ВИГНЕР Юджин Пол) в 1936 … Энциклопедический словарь
technik_rus_taj.academic.ru
формула+химической+реакции — с русского на английский
formula (pi. formulae, formulas)•Аналогичные формулы могут быть выписаны для… — Analogous formulas can be written down for…
• Будем руководствоваться формулой… — We are guided by the formula…
• В формулах (2) переменная к предполагается функцией от г. — In the formulas (2), к is assumed to be a function of r.• В этой формуле мы все еще не предположили, что… — In this formula we have not yet assumed that…
• Данная формула хорошо согласуется с экспериментом. — This formula is in good agreement with the experiment; This formula is in good agreement with with experimental results.
• Для F обычно дается следующая формула: … — The formula usually given for F is…• Другой способ вывода этих формул основан на… — Another way of deriving these formulas is based on…
• Затем задача заключается в выводе формулы для… — The problem is then to deduce a formula for…
• Здесь мы приводим некоторые формулы для… — Неге we give some formulae for…
• Используя подобные формулы, можно… — Using such formulae, it is possible to…
• Нашей задачей является нахождение общей формулы для… — The problem is to find a general formula for…
• Не существует общей формулы для… — There is no general formula for…
• Очевидным следствием соотношения (1) является формула… — An obvious deduction from (1) is the formula…
• Подобным способом могут быть выведены несколько иные дополнительные формулы. — Still other formulas can be obtained in a similar way.
• Результат, представленный формулой (9), очень полезен при выводе свойств (чего-л). — The result (9) is very useful for deducing properties of…
• Справедливость этой формулы зависит от… — The validity of this formula depends on…
• Теперь мы получим ту же самую формулу из других соображений. — We now obtain the same formula from another point of view.
• Физическим следствием формулы (1) является то, что… — The physical implication of (1) is that…
• Формула (4) может быть выражена в несколько отличной форме посредством… — The result (4) may be expressed in a slightly different form by means of…
• Часто использование альтернативной формулы (2) имеет свои преимущества. — It is often advantageous to use the alternative formula (2).
• Эта формула полезна когда бы ни… — This formula is useful whenever…
• Эта формула четко предсказывает… — This formula clearly predicts…
translate.academic.ru