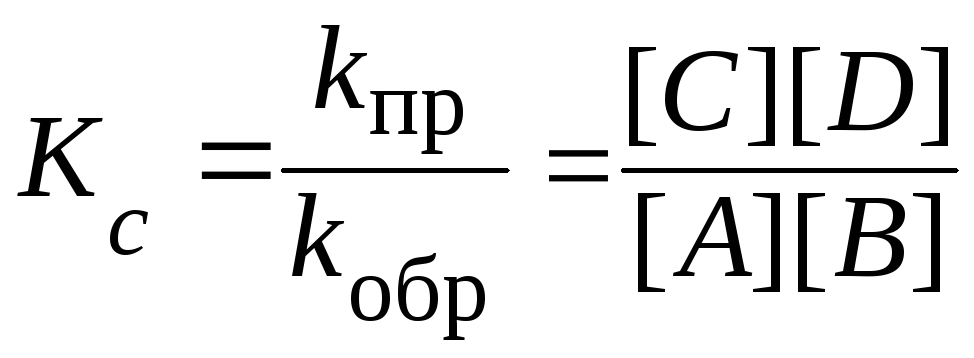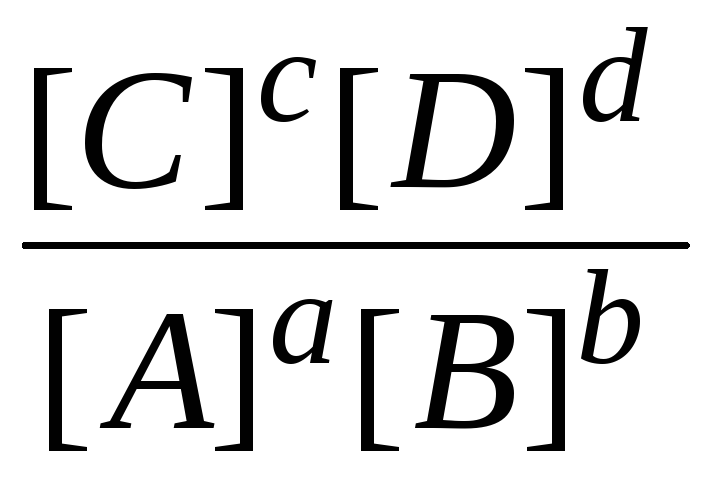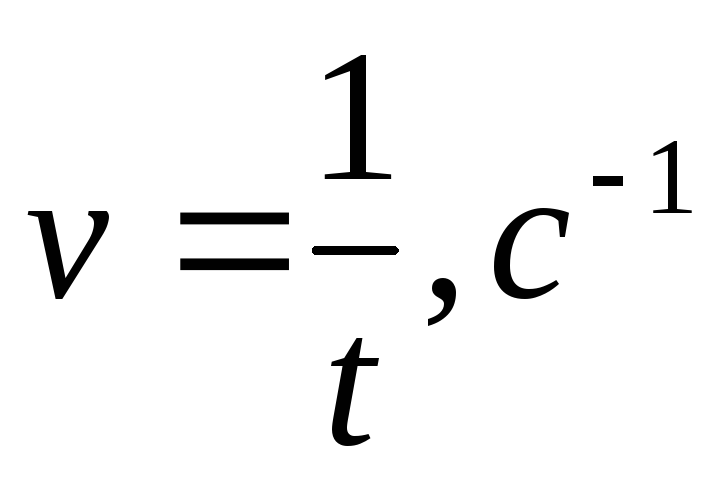Лекция по теме«Химическое равновесие»
Учебные вопросы
Состояние равновесия
Константа равновесия
Расчет равновесных концентраций
Смещение химического равновесия. Принцип Ле Шателье
Состояние равновесия
Реакции, протекающие при одних и тех же условиях одновременно в противоположных направлениях, называются обратимыми.
Рассмотрим обратимую реакцию, которая протекает в закрытой системе
A + B C + D
Скорость прямой реакции описывается уравнением:

 пр = k
пр = k
где  пр–
скорость прямой реакции;
пр–
скорость прямой реакции;
k пр– константа скорости прямой реакции.
С
течением времени концентрации реагентов А и В уменьшаются, скорость реакции падает
(рис.1, кривая  пр).
пр).
Реакция между А и В приводит к образованию веществ C и D, молекулы которых при столкновениях могут вновь дать вещества А и В.
Скорость обратной реакции описывается уравнением:
 обр = k обр [С] [D],
обр = k обр [С] [D],
где 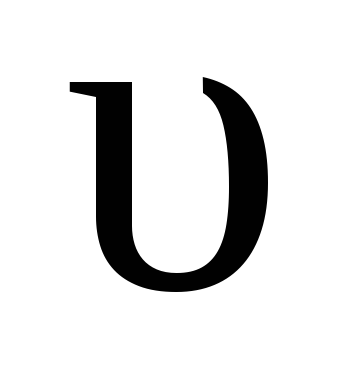
k обр – константа скорости обратной реакции.
По
мере того как концентрации веществ C и D возрастают, скорость обратной реакции
растет (рис.1, кривая 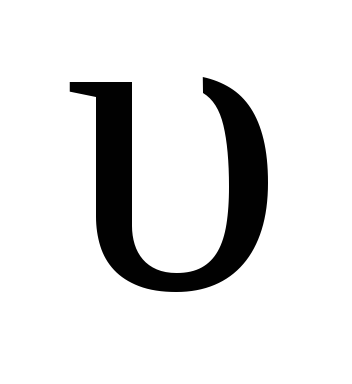 обр).
обр).
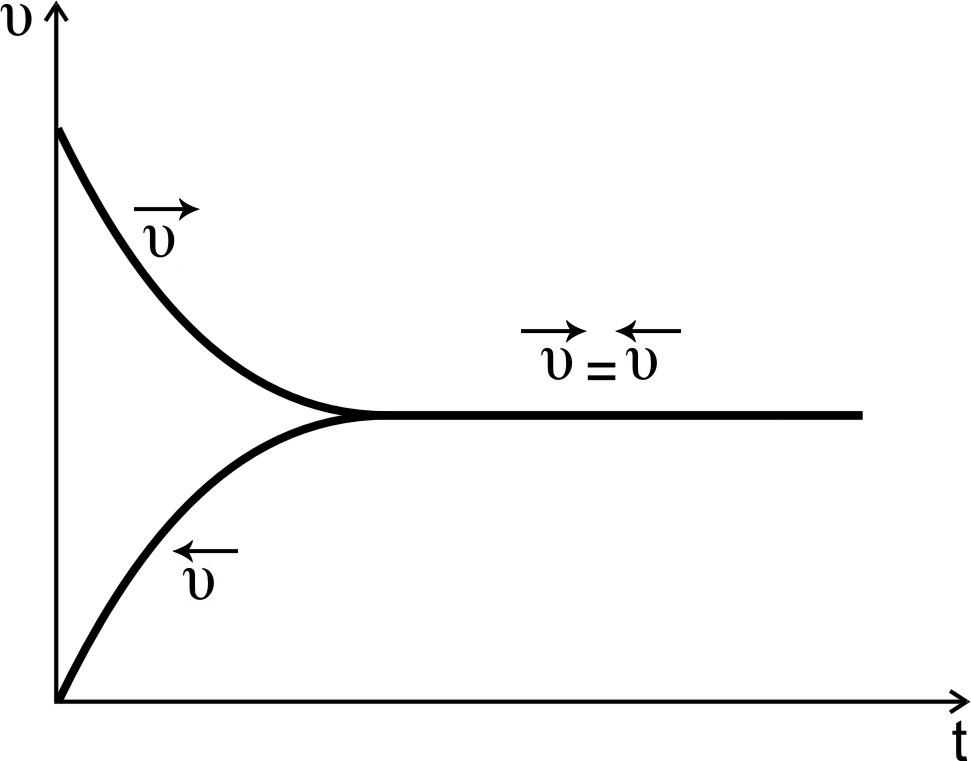
Рис.1. Изменение скоростей прямой и обратной реакций во времени
Через некоторое время скорости прямой и обратной реакций становятся равными:
 пр =
пр = 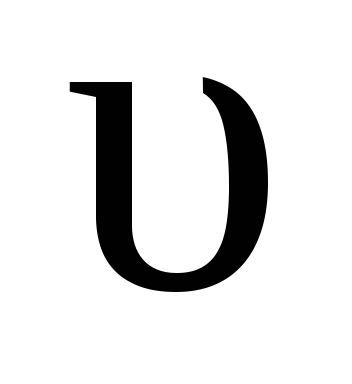
Такое состояние системы называется состоянием равновесия.
В состоянии равновесия концентрации всех его участников перестают меняться во времени. Такие концентрации называются равновесными.
Химическое равновесие – это динамическое равновесие. Неизменность концентраций веществ, присутствующих в закрытой системе, есть следствие непрерывно идущих химических процессов. Скорости прямой и обратной реакции не равны нулю, а нулю равна наблюдаемая скорость процесса.
Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия.
2. Константа равновесия
При равенстве скоростей прямой и обратной реакции
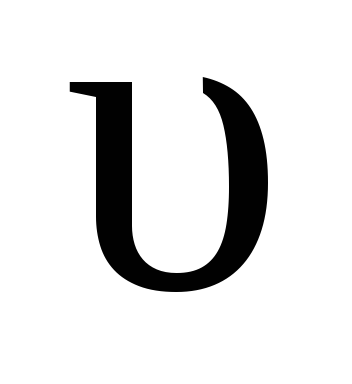 пр =
пр = 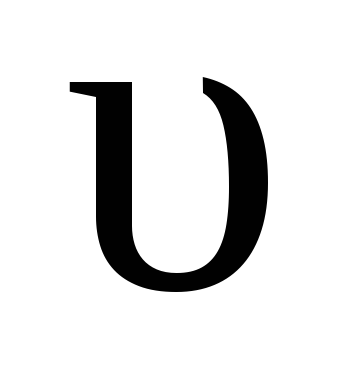
справедливо равенство
k пр[A] [B] = k обр[С] [D],
где [A], [B], [С], [D] – равновесные концентрации веществ.
Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:

Отношение констант скоростей прямой и обратной реакций ( kпр/kобр) называют константой химического равновесия:
|
Истинное химическое равновесие может устанавливаться только в том случае, если равновесны все элементарные стадии механизма реакции. Сколь бы сложны ни были механизмы прямой и обратной реакций, но в состоянии равновесия они должны обеспечить стехиометрический переход исходных веществ в продукты реакции и обратно. Это значит, что алгебраическая сумма всех стадий процесса равна стехиометрическому уравнению реакции, т.е. стехиометрические коэффициенты представляют собой сумму молекулярностей всех стадий механизма.
Для сложной реакции
aA + bB cC + dD
Кс = |
Для одной и той же температуры отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, представляет постоянную величину .
Это вторая формулировка закона действующих масс.
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Например, выражение для константы равновесия следующей реакции
СО2 (г) + С(тв) 2СО(г)
записывается так:
Кс =  .
.
Изменение концентрации любого из этих веществ влечет за собой изменения концентраций всех остальных веществ. В итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Величина константы равновесия зависит от природы реагирующих веществ и температуры.
Константа равновесия, выраженная через молярные концентрации реагирующих веществ (Кс) и константа равновесия, выраженная через равновесные парциальные давления (Кр) (см. «Основы химической термодинамики»), связаны между собой соотношениями:
К р = Кс RT , Kc = Кр / (RT) ,
где — изменение числа газообразных молей в реакции.
Стандартное изменение энергии Гиббса равно
GТ = — RT ln Kp,
а также
GТ = H – T S.
После приравнивания правых частей уравнений:
— RT ln Kp = H – T S
или
ln K р = — H / (RT) + S/R .
Уравнение не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ.
Константа равновесия не зависит от концентраций (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов
studfile.net
Скорость химической реакции. Энергия Гиббса
Говорить об осуществимости процесса можно по изменению энергии Гибсса системы. Но данная величина не отражает настоящую возможность протекания реакции, ее скорость и механизм.
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм. Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные.
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны. Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени. Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
υ = ± dn/dt·V
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
υ= ± dC/dt,
где C – концентрация, моль/л
Единица измерения скорости реакции моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой, которая имеет вид:
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:
| υ = — ΔC/Δt [моль/л·с] |
Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом: Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Если исследуемый процесс представить в виде:
а А + b В = продукты
то скорость химической реакции можно выразить кинетическим уравнением:
υ = k·[A]a·[B]b или
υ = k·CaA·CbB
Здесь [A] и [B] (CA и CB )- концентрации реагентов,
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины k — это скорость реакции при единичных концентрациях. То есть, если концентрации веществ А и В равны 1, то υ = k.
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
- Реакция активируется термично, т.е. энергией теплового движения молекул.
- Концентрация реагентов распределена равномерно.
- Свойства и условия среды в ходе процесса не меняются.
- Свойства среды не должны влиять на k.
К сложным процессам закон действия масс применить нельзя. Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которя называется лимитирующей.
Каждая реакция имеет свой порядок. Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок. Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
υ = k·[A]a·[B]b
a – порядок по реагенту А
b — порядок по реагенту В
Общий порядок a + b = n
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения. Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Определим факторы, влияющие на скорость химической реакции υ.
Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс: υ = k[A]a·[B]b
Очевидно, что с увеличением концентраций реагирующих веществ, υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами. Причем, важно учитывать порядок реакции: если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества. Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 22 = 4 раза, а увеличение концентрации в 3 раза ускорит реакцию в 32 = 9 раз.
Зависимость скорости реакции от давления
определяется уравнением Клапейрона – Менделеева, которое связывает концентрацию и давление:
pV = nRT, откуда
С = p/RT
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления. Эта зависимость актуальна в первую очередь для процессов, идущих с участием газов. Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит υ – она станет в 2 раза больше.
Зависимость скорости реакции от площади поверхности
касается гетерогенных реакций. Вещества реагируют быстрее, если площадь поверхности, на которой может происходить взаимодействие веществ больше. Растворяя вещество, мы уменьшаем его размеры до размеров молекулы, увеличивая тем самым площадь поверхности. Поэтому химические процессы между веществами, находящимися в растворенном, жидком или газообразном состоянии имеют большую скорость, чем взаимодействия между твердыми веществами.
Зависимость скорости реакции от природы вещества.
Имеет большое значение строение электронной оболочки атома, тип химической связи и ее прочность в молекулах, структура вещества, прочность его кристаллической решетки. Известно, что натрий будет активнее взаимодействовать с водой, чем, например, олово. Поэтому и скорость взаимодействия натрия с водой выше скорости взаимодействия олова с водой.
Зависимость скорости реакции от температуры
определяется правилом Вант-Гоффа и уравнением Аррениуса. Повышая температуру, мы сообщаем молекулам дополнительную энергию (увеличивая, тем самым, энергию активации), которая способствует протеканию реакции. Сванте Аррениус в 1889 году, изучая зависимость υ от температуры, установил, что большинство химических процессов подчиняются уравнению:
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.
Часто бывает, что известна константа скорости при одной температуре Т1, а требуется найти k при некой другой температуре Т2. Это легко сделать, если взять логарифм уравнения Аррениуса при Т1 и Т2:
ln k1 = lg A – Ea/2,3RT1 и
ln k2 = lg A – Ea/2,3RT2
Вычитая второе равенство из первого, получаем:
При определении скорости химической реакции, также можно использовать уравнение Аррениуса (в случае, если υ описывается степенным уравнением):
υ = k·[A]a·[B]b
Если принять, что концентрации веществ А и В постоянны и прологарифмировать данное выражение, то получим следующее:
ln υ = const – Ea/2,3RT
Также удобно пользоваться эмпирическим правилом, которое сформулировал Якоб Вант-Гофф: увеличение температуры на каждые 10 градусов, приводит к росту скорости реакции в 2 – 4 раза. Правило имеет математическое выражение:
где υT1 и υT2 – скорости реакции при температурах Т1 и Т2
γ — температурный коэффициент реакции, значения которого лежат в интервале от 2 до 4.
Приведем пример. Допустим, что γ = 3, а Т2 – Т1 = 20о, тогда
υT1/υT2 = 32 = 9. Это означает, что υ возросла в 9 раз.
Зависимость скорости реакции от присутствия катализатора
Катализ – это любое изменение скорости реакции под действием катализатора. Он может быть положительным и отрицательным. Суть катализа – генерирование активного субстрата или реагента с участием катализаторов.
Катализатор представляет собой вещество, которое селективно ускоряет химическую реакцию, вступая при этом в промежуточную стадию, но регенирируясь к ее концу (к моменту образования конечных продуктов). Например, в биохимической среде в качестве катализаторов выступают ферменты.
Если такое вещество замедляет химическую реакцию, то оно называется ингибитором.
Влияние катализатора на скорость реакции основывается на том, что он изменяет энергию активации Еа или А. Понижение энергии активации под действием катализатора схематично представлено на рисунке ниже:
влияние катализатора на энергию активации
Видно, что веществам А и В требуется большое количество энергии, чтобы образовать конечные продукты. Но в присутствии катализатора для получения конечных продуктов требуется гораздо меньше энергии, т.к. идет понижение полной энергии активации, и тем самым, увеличение скорости реакции. Обращаю ваше внимание на то, что энергии как начальных, так и конечных веществ остаются одинаковыми в обеих реакциях.
zadachi-po-khimii.ru
Скорость химической реакции, подготовка к ЕГЭ по химии
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.

Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.

Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо — железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.

Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет».
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждении, но вы не поддавайтесь и помните про постулат!

Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»

В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?

Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора — каталитическими.

Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.

©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Скорость химических реакций. Химическое равновесие
Цель работы: изучить влияние различных факторов на скорость химической реакции и смещение химического равновесия.
Теоретическая часть.
Скорость химической реакции измеряется изменением концентраций реагирующих веществ в единицу времени. Под концентрацией вещества понимают количество его в единице объема. Концентрацию обычно выражают числом молей вещества, содержащихся в одном литре.
Скорость реакции зависит от природы реагирующих веществ и от условий ее протекания. Главными факторами, влияющими на скорость реакции, являются концентрации реагирующих веществ и температура.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов. Эта зависимость носит название закона действия масс.
Например, для реакции синтеза аммиака, протекающей по уравнению:
N2 + 3Н2 2NH3 ΔНr = -92,6 кДж,
2NH3 ΔНr = -92,6 кДж,
зависимость скорости реакции от концентраций реагирующих веществ имеет следующий вид:
 ,
,
где к — константа скорости данной реакции
Закон действия масс строго применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют также твердые вещества, концентрация которых постоянна, то данная концентрация не включается в зависимость v = f(c).
Зависимость скорости реакции от температуры выражается экспериментальным правилом Вант — Гоффа, согласно которому с повышением температуры на каждые 10° скорость реакции увеличится в 2 — 4 раза:

где: V2 и Vt— скорости реакции соответственно при температурах Т2 и Т1
γ — температурный коэффициент реакции, γ = 2 … 4
С течением времени скорость реакции уменьшается, так как по мере взаимодействия веществ уменьшаются их концентрации. Но если реакция обратима и протекает в замкнутом пространстве, то одновременно с уменьшением скорости прямой реакции Vпр. увеличивается скорость обратной реакции Vобр. вследствие накопления продуктов прямой реакции. Когда обе скорости становятся одинаковыми, наступает состояние равновесия, и дальнейшее изменение концентраций всех участвующих в реакции веществ прекращается
Соотношение между концентрациями исходных веществ и продуктов в состоянии равновесия является постоянным для реакции. Так, для реакции синтеза аммиака выражение для константы равновесия имеет вид:

Состояние химического равновесия в основном зависит от 3-х факторов:
а) концентраций участников реакции,
б) температуры,
в) давления (если в реакции участвуют газообразные вещества).
При изменении хотя бы одной из указанных величин равновесие нарушается, и концентрации всех участвующих в реакции веществ начинают изменяться до тех пор, пока при измененных условиях скорости прямой и обратной реакций снова не сравняются. Этот процесс называется смещением или сдвигом равновесия.
Направление, в котором смещается равновесие, определяется принципом Ле Шателье:
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие смещается в направлении, противодействующему данному воздействию.
Так, равновесие процесса синтеза аммиака можно сдвинуть в прямом направлении (вправо), если:
а) увеличить концентрации N2 или Н2 или уменьшить концентрацию NH3;
б) уменьшить температуру;
в) увеличить давление в системе.
Практическая часть
Опыт № 1. Влияние концентраций реагирующих веществ на скорость реакции
В пронумерованные пробирки налить тиосульфат натрия Nа2S2O3 и воду в соответствии с заданием (табл. 3.2). Затем в 1 -ю пробирку добавить указанное в задании количество капель серной кислоты H2SO4 и отметить время, прошедшее с момента прикапывания H2SO4 до появления первых признаков выпадающей в осадок серы (помутнение реакционной смеси):
Na2S2O3 + H2SO4 = S + SO2 + Na2SO4 + Н2О
Для того, чтобы не пропустить момент появления мути, необходимо рядом с пробиркой, в которой находится реакционная смесь, поместить контрольную пробирку с дистиллированной водой
Таблица 3.1. Параметры для определения скорости реакции.
№ пробирки | Кол-во капель Na2S2O3 , п1 | Кол-во капель Н2О, п2 | Кол-во капель H2SO4, п3 | Относительная концентрация | Время помутнения , t,c | Относительная скорость реакции |
1 2 3 4 |
Аналогично провести опыты с растворами в остальных пробирках. Полученные данные записать в таблицу 3.1.
По данным таблицы построить график зависимости реакции V от концентрации С и сделать вывод о характере данной зависимости.
Памятка для построения графиков
При построении графиков на оси абсцисс откладывается независимая переменная (аргумент), а по оси ординат — зависимая (функция). Оси координат разбиваются на равные промежутки согласно выбранному масштабу. Масштаб выбирается таким образом, чтобы максимальному значению откладываемой величины соответствовал отрезок в 10 см на координатной оси. Экспериментальные точки ставятся на пересечении перпендикуляров, восстановленных из точек на координатных осях, соответствующих параметрам данного опыта. Графиком зависимости является плавная (без изломов) линия, объединяющая по возможности все экспериментальные точки.
Таблица 3.2. Список заданий к опыту №1 (количества реактивов даны в каплях)
Название реактива
№ про-
бирки
Номера заданий
1
2
3
4
5
6
7
8
Na2S2O3
1
2
3
4
4
8
12
16
2
5
10
15
2
4
8
12
4
9
15
21
3
6
9
12
3
6
12
18
5
10
15
20
6
12
18
24
Н2О
1
2
3
4
12
8
4
0
13
10
5
0
10
8
4
0
17
12
6
0
9
6
3
0
15
12
6
0
15
10
5
0
18
12
6
0
h2so4
1
2
3
4
1
1
1
1
1
1
1
1
1
1
1
1
2
2
2
2
1
1
1
1
2
2
2
2
2
2
2
2
2
2
2
2
Опыт № 2. Влияние температуры на скорость реакции.
Подготовить 3 одинаковые пробирки, в каждую из которых налить Na2S2О3 и Н2О в количествах, соответствующих пробирке №1 в 1-м опыте. Подготовленные пробирки поместить на водяную баню, заполненную горячей водой (см. рис.3.1)
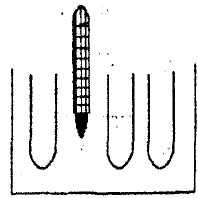
Рис.3.1 Установка для изучения влияния температуры на скорость
В эту же баню поместить термометр. Подождать 2 -3 мин, чтобы температура содержимого пробирок сравнялась с температурой воды в бане. Отметить температуру опыта, капнуть в 1-ю пробирку H2SO4, и измерить время от момента прикапывания H2SO4 до появления мути. Подождать, пока температура воды в бане уменьшится на 5° -10° и повторить опыт для 2-й пробирки и т.д. Результаты опытов записать в таблицу 3.3.. Сюда же (в таблицу 3.3.), измерив комнатную температуру, вписать время помутнения для первой пробирки из опыта №1.
Таблица 3.3. Параметры для определения скорости реакции
№ пробирки | Температура опыта, Т, 0C | Время помутнения, t,c | Относительная скорость, |
1 2 3 |
По данным таблицы построить график зависимости скорости реакции от температуры и сделать вывод о характере данной зависимости.
Опыт №3. Влияние площади поверхности на скорость реакции в гетерогенной системе.
Налить в две пробирки по 2 — 3 мл 2н раствора соляной кислоты; Взять два одинаковых кусочка мела и один из них растереть в ступке. Высыпать в одну пробирку порошок, а в другую поместить кусочек мела. В какой пробирке реакция идет быстрее? Напишите уравнение реакции взаимодействия мела с соляной кислотой.
Опыт №4. Влияние катализатора на скорость химических реакций.
К 2 мл пероксида водорода Н2О2 прибавить немного порошка МnО2, и наблюдать энергичное разложение перекиси водорода с выделением кислорода. Написать уравнение протекающей реакции и сделать вывод.
Опыт №5. Смещение химического равновесия при изменении концентрации реагирующих веществ.
В
пробирку налить 20 — 25 капель воды и 1 —
2 капли растворов хлорида железа (III)
и роданида аммония:
FeCI3 + 3NH4CNS  Fe(CNS)3 + 3NH4C1
Fe(CNS)3 + 3NH4C1
Окрашенный раствор (красная окраска обусловлена образованием роданида трехвалентного железа) разлить поровну в 4 пробирки. В одну пробирку добавить 2-3 капли FeCI3, а в другую — NH4CNS. В третью пробирку всыпать немного сухого хлорида аммония NH4C1 и сильно взболтать. Что наблюдается? Сравнить цвета растворов с окраской четвертой (контрольной) пробирки. Дать объяснение изменениям окраски.
Лабораторная работа №4.
studfile.net
Примеры решения задач:
Задачи с использованием закона действия масс
Пример 1
Во сколько раз изменится скорость прямой химической реакции, протекающей в гомогенной системе: 2NO + Br2 = 2NOBr2
при: а) увеличении концентрации NO в два раза
б) уменьшении концентрации Br2 в три раза
Решение
Т. к. сказано, что система гомогенная, то все вещества находятся в газовой фазе и их концентрации входят в формулу закона действия масс. Запишем выражение закона для этой реакции: 1 = k[NO]2[Br2]
а) При увеличении концентрации NO в три раза формула закона действия масс будет выглядеть следующим образом: 2 = k[2NO]2[Br2]=4k[NO]2[Br2](вынесли 2 из-под знака концентрации и возвели её в квадрат). Таким образом 2/1 = 4k[NO]2[Br2]/ k[NO]2[Br2] =4. Следовательно скорость прямой реакции увеличится в 4 раз.
б)
При уменьшении
концентрации Br2 в три раза формула закона действия масс
будет выглядеть следующим образом: 2 = k[NO]2[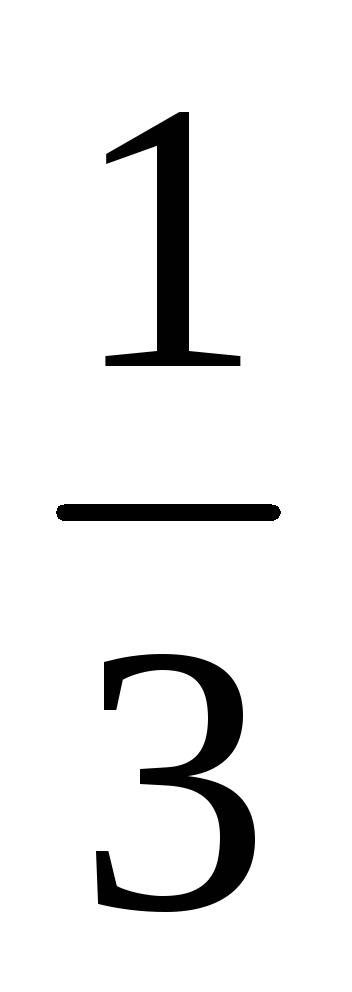 Br2]
=
Br2]
=  k[NO]2[Br2].
Таким образом 2/1 =
k[NO]2[Br2].
Таким образом 2/1 = 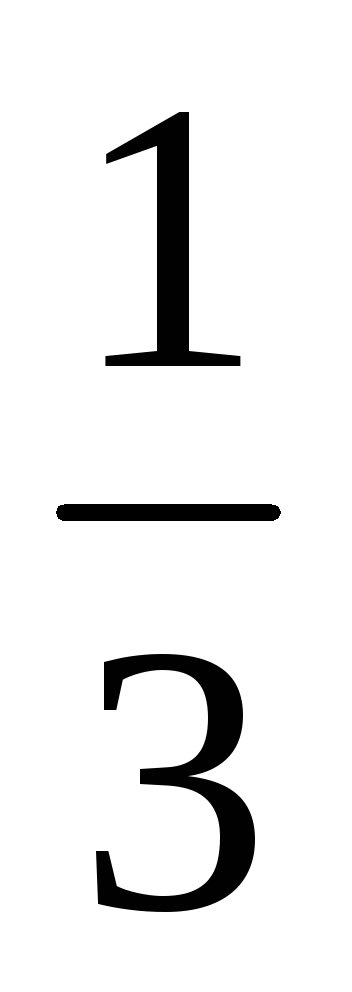 k[NO]2[Br2]/
k[NO]2[Br2]=
k[NO]2[Br2]/
k[NO]2[Br2]= 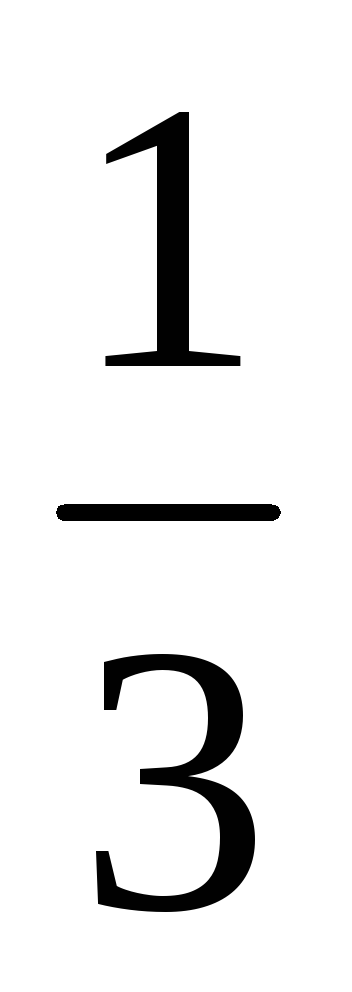 .
Следовательно скоростьпрямой
реакции
уменьшится в 3 раза.
.
Следовательно скоростьпрямой
реакции
уменьшится в 3 раза.
Пример 2
Во сколько раз изменится скорость прямой химической реакции, протекающей в системе: 3А(г) + В(г) =2С(г)
при: а) увеличении объёма в пять раз
б) увеличении давления в два раза
Решение
Т. к. все вещества находятся в газообразном состоянии, то их концентрации входят в формулу закона действия масс.
Запишем выражение закона для этой реакции: 1 = k[А]3[B]
а)
При увеличении объёма (или при уменьшении
давления ) в n-е
количество раз концентрации реагирующих
газообразных веществ уменьшаются в
такое же количество раз, т. е. при
увеличении объёма в пять раз концентрации А и В уменьшаются в пять раз. Отсюда 2 = k[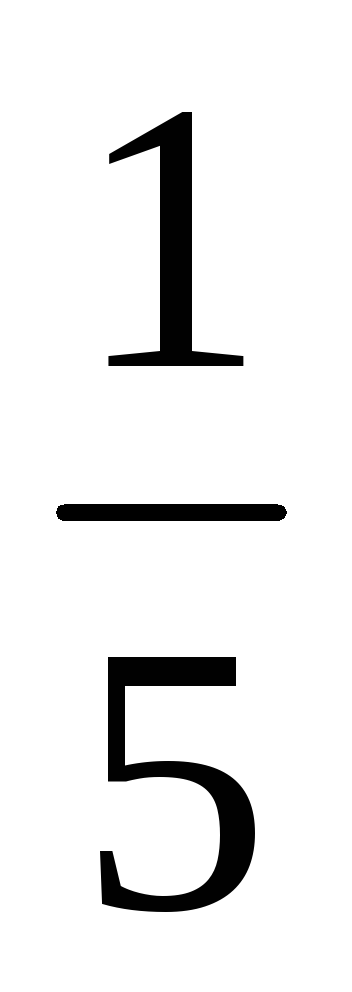 А]3[
А]3[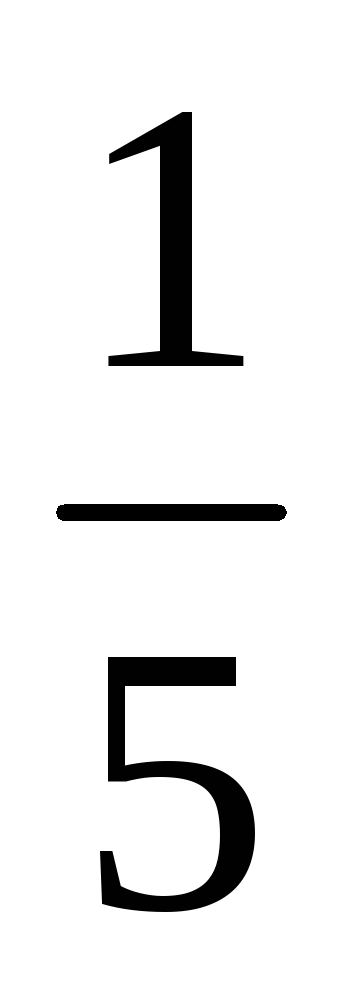 B]
=
k[А]3[B
] (вынесли
B]
=
k[А]3[B
] (вынесли  из-под знака концентрации, возвели её
в куб и умножили на
из-под знака концентрации, возвели её
в куб и умножили на 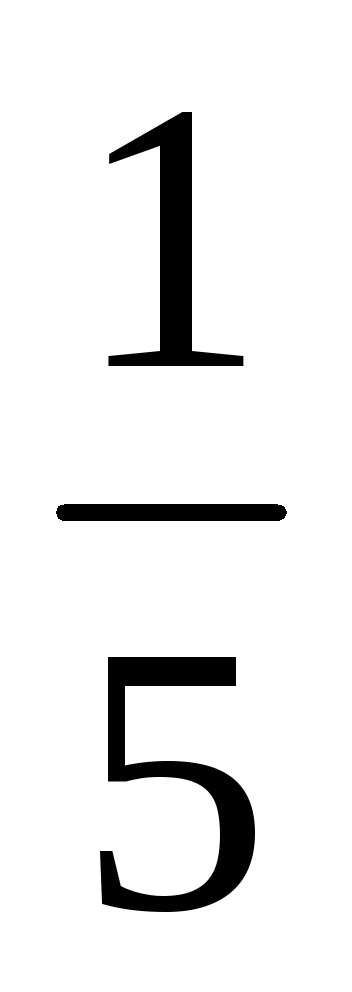 ). Таким образом2/1 =
=
). Таким образом2/1 =
= k[А]3[B
]/ k[А]3[B
] =
k[А]3[B
]/ k[А]3[B
] = .
Следовательно скоростьпрямой
реакции
уменьшится в 625 раз.
.
Следовательно скоростьпрямой
реакции
уменьшится в 625 раз.
б) При увеличении давления ( или уменьшении объёма ) в n-е количество раз концентрации реагирующих газообразных веществ увеличиваются в такое же количество раз, т. е. при увеличении давления в два раза концентрации А и В увеличиваются в два раза. Отсюда 2 = k[2А]3[2B] = 16k[А]3[B ]. Таким образом 2/1 = =16k[А]3[B ]/ k[А]3[B ] =16. Следовательно скорость прямой реакции увеличится в 16 раз.
Пример 3
Как скажется уменьшение объёма в четыре раза на скорости следующих реакций:
а) 2С(к) + О2(г) = 2СО(г)
б) 2КМ(к) = 2К(к) + М(г)
Решение
а) Так в данной системе одно из веществ ( С ) находится в кристаллическом состоянии, то его концентрация не будет входить в формулу закона действия масс. Следовательно 1 = k [О2]. При уменьшении объёма в четыре раза концентрация О2 увеличивается в четыре раза и 2 = k[4О2] = 4 k[О2]. Отсюда 2/1 = =4k[О2]./ k[О2].= 4 и скорость прямой реакции увеличится в 4 раза.
б) Поскольку среди исходных веществ имеется только одно вещество, причём в кристаллическом состоянии, то изменение объёма не будет влиять на скорость прямой реакции и она не изменится. __________________________________________________________________________
СОВЕТ: обращайте внимание на то, в каком агрегатном состоянии находится вещество в реакции и помните, что концентрации веществ в кристаллическом состоянии не учитываются.
studfile.net
Изменение скорости реакции | Дистанционные уроки
08-Янв-2014 | комментария 3 | Лолита Окольнова
Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.

Тема большая, зачастую в ней присутствуют формулы для расчета скорости, но в этой статье мы разберем все вопросы в формате подготовки к ЕГЭ.
Факторы, влияющие на
- концентрация;
- площадь поверхности реагентов;
- катализатор реакции;
- давление;
- температура
Теперь разберем каждый фактор отдельно.
1. Влияние концентрации на изменение скорости реакции:
По указанному определению можно записать формулу скорости:

ν — скорость реакции
ΔС — изменение концентрации
Δt — время реакции
Если Δt — примем как постоянную, не меняющуюся величину, то изменение скорости реакции напрямую зависит от изменения концентрации
| Изменение скорости реакции прямопропорционально изменению концентрации |
Эта зависимость определяется не только уравнением. Есть простая логика — чем больше вещества, тем больше взаимодействие между частицами — тем быстрее идет реакция.
2. Влияние площади поверхности на изменение скорости реакции.
Есть гетерогенные реакции — реакции, в которых есть больше чем одна фаза:
— твердое вещество \ жидкость: Zn + 2HCl = ZnCl2 + H2
— твердое вещество \ газ: C + O2= CO2
| Изменение скорости реакции прямопропорционально площади поверхности |
Давайте представим, что кусочек цинка бросили в кислоту. Что будет происходить? Слой за слоем металл будет растворяться.
А что будет если мы внесем в кислоту цинк в виде порошка? Конечно, реакция пройдет намного быстрее.
Есть, конечно, определенные нюансы, но в школьном курсе они не рассматриваются…
3. Влияние температуры на изменение скорости реакции.
Как и в случае концентрации, увеличение температуры увеличивает количество активных столкновений между частицами, что, естественно, увеличивает скорость реакции.
Изменение скорости реакции при повышении температуры соответствует правилу (приблизительному, для точных определений существует ряд формул) —
|
4. Влияние катализатора на изменение скорости реакции.
Здесь все очень просто. Определение катализа и катализатора говорит само за себя:
катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются в конце реакции.
5. Влияние давления на изменение скорости реакции.
А вот на этот пункт стоит обратить внимание.
Давление влияет на изменение скорости реакции именно в газовой среде.
Любой газ занимает весь предоставленный объем — молекулы разлетаются, и число их столкновений уменьшается. Если повысить давление, число активных соударений возрастает, соответственно, скорость реакции увеличивается.
Изменение скорости реакции в газовой фазе прямопропорционально изменению давления |
- в ЕГЭ это вопрос А20 — Скорость реакции, ее зависимость от различных факторов
Еще на эту тему:
Обсуждение: «Изменение скорости реакции»
(Правила комментирования)distant-lessons.ru
Задачи к разделу Химическая кинетика и равновесие химической реакции
Задачи к разделу Химическая кинетика и равновесие химической реакции.
Задача 1. Дайте определение понятию скорость химической реакции. Опишите количественно (где это можно), как влияют на скорость реакции внешние условия (концентрация, температура, давление). Рассчитайте, во сколько раз изменится скорость реакции Н2+С12 = 2НС1 при увеличении давления в 2 раза;
Показать решение »
Решение.
Скоростью химической реакции u называют число элементарных актов взаимодействия, в единицу времени, в единице объема для гомогенных реакций или на единице поверхности раздела фаз для гетерогенных реакций. Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t. Концентрацию выражают в моль/л, а время в минутах, секундах или часах.
υ = ± dC/dt,
где C – концентрация, моль/л
Единица измерения скорости реакции моль/л·с
Если в некоторые моменты времени t1 и t2 концентрации одного из исходных веществ равна с1 и с2, то за промежуток времени Δt = t2 – t1 , Δc = c2 – c1
| ῡ = — ΔC/Δt [моль/л·с] |
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, присутствия катализаторов, давления (с участием газов), среды (в растворах), интенсивности света (фотохимические реакции).
Зависимость скорости реакции от природы реагирующих веществ. Каждому химическому процессу присуще определенное значение энергии активации Еа. Причем, скорость реакции. тем больше, чем меньше энергия активации.
Скорость зависит от прочности химических связей в исходных веществах. Если эти связи прочные, то Еа велика, например N2 + 3H2 = 2NH3, то скорость взаимодействия мала. Если Еа равна нулю, то реакция протекает практически мгновенно, например:
HCl (раствор) + NaOH (раствор) = NaCl (раствор) + H2O.
Закон действующих масс. Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции аА + bB = cC + dD
υ = k·[A]a·[B]b,
где [A] и [B] – концентрации веществ А и В в моль/л,
k – константа скорости реакции.
Концентрации твердых веществ, в случае гетерогенной реакции в кинетическое уравнение не включают.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс:
υ = k·[A]a·[B]b
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции увеличивается, т.к. увеличивается число соударений между участвующими в реакции веществами. Причем, важно учитывать порядок реакции: если реакция имеет первый порядок по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества. Если реакция имеет второй порядок по какому-либо реагенту, то удвоение его концентрации приведет к росту скорости реакции в 22 = 4 раза, а увеличение концентрации в 3 раза ускорит реакцию в 32 = 9 раз.
Зависимость скорости от температуры. Правило Вант-Гоффа: Скорость большинства химических реакций при повышении температуры на 10° увеличивается от 2 до 4 раз.
υТ2 – скорость реакции при температуре t2, υТ1 – скорость реакции при температуре t1, γ — температурный коэффициент (γ = 2¸4).
Влияние катализаторов. Катализаторы увеличивают скорость реакции (положительный катализ). Скорость реакции растет, так как уменьшается энергия активации реакции в присутствии катализатора. Уменьшение энергии активации обусловлено тем, что в присутствии катализатора реакция протекает в несколько стадий с образованием промежуточных продуктов, и эти стадии характеризуются малыми значениями энергии активации.
Ингибиторы замедляют скорость реакции (отрицательный катализ).
В реакции:
H2 + Cl2 = 2HCl
υпрям = k×[H2] ×[Cl2];
υобр = k×[HCl]2
При увеличении давления в 2 раза концентрация веществ увеличится тоже в 2 раза и скорость реакции станет равна:
υпрям2= k×[2H2] ×[2Cl2]
υпрям2/ υпрям1= k×[2H2] ×[2Cl2]/k×[H2] ×[Cl2] = 4,
υпрям возрастает в 4 раза.
Задача 2. При установлении равновесия Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г) концентрация [CO] = 1 моль/л и [CO2] = 2 моль/л. Вычислите исходную концентрацию [CO]исх, если начальная концентрация CO2 равна нулю.
Показать решение »
Решение.
Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г)
3 моля СО2 образуется, если в реакцию вступают 3 моля СО,
2 молей СО2 — х
х = 2 моль, ⇒ исходная концентрация [CO]исх = [CO]pавн + 2 моль = 1 + 2 = 3 моль.
Задача 3.Температурный коэффициент реакции равен 2,5. Как изменится ее скорость при охлаждении реакционной смеси от изменения температуры от 50 °С до 30 °С?
Показать решение »
Решение.
Воспользуемся правилом Вант-Гоффа
Скорость реакции уменьшится в 6,25 раз
Задача 4. Рассчитайте скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют соответственно 0,2 и 0,3 моль/л, а k=1,5∙10-3л∙моль-1∙с-1
Показать решение »
Решение.
AgNO3 + KCl = AgCl↓ + K NO3
Скорость прямой реакции равна:
v = k·[AgNO3]·[KCl]
v = 1,5∙10-3 · 0,2 · 0,3 = 9·10-5 моль/л·с
Таким образом скорость реакции равна v = 9·10-5 моль/л·с
Задача 5. Как следует изменить концентрацию кислорода, чтобы скорость гомогенной элементарной реакции: 2 NО(г) +O2(г) → 2 NО2(г) не изменилась при уменьшении концентрации оксида азота (II) в 2 раза?
Показать решение »
Решение.
2 NО(г) +O2(г) → 2 NО2(г)
Скорость прямой реакции равна:
υ1 = k·[NO]2·[O2]
При уменьшении концентрации NО в 2 раза скорость прямой реакции станет равной:
υ2 = k·[1/2NO]2·[O2] = 1/4·k·[NO]2·[O2]
т.е. скорость реакции уменьшится в 4 раза:
υ2 /υ1= 1/4·k·[NO]2·[O2] / k·[NO]2·[O2] = 4
Чтобы скорость реакции не изменилась концентрацию кислорода надо увеличить в 4 раза.
При условии, что υ1= υ2
1/4·k·[NO]2 ·х[O2] = k·[NO]2·[O2]
х = 4
Задача 6. При увеличении температуры с 30 до 45оС скорость гомогенной реакции повысилась в 20 раз. Чему равна энергия активации реакции?
Решение.
Применяя уравнение Аррениуса, получим:
ln 20 = Ea/8,31 · (1/303 – 1/318),
отсюда
Ea = 160250 Дж = 160,25 кДж
Задача 7. Константа скорости реакции омыления уксусноэтилового эфира: СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р) равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
Показать решение »
Решение.
СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р)
Скорость прямой реакции равна:
υнач = k·[СН3СООС2Н5]·[КОН]
υнач = 0,1·0,01·0,05 = 5·10-5 моль/л·мин
В тот момент, когда концентрация эфира станет равной 0,008 моль/л, его расход составит
[СН3СООС2Н5]расход = 0,01 – 0,008 = 0,002 моль/лЗначит, в этот момент щелочи также израсходовалось [КОН]расход = 0,002 моль/л и ее концентрация станет равной
[КОН]кон = 0,05 – 0,002 = 0,048 моль/лВычислим скорость реакции в тот момент, когда концентрация эфира станет равной 0,008 моль/л, а щелочи 0,048 моль/л
υкон = 0,1·0,008·0,048 = 3,84·10-5 моль/л·мин
Задача 8. Как следует изменить объем реакционной смеси системы:
8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г), чтобы скорость реакции уменьшилась в 60 раз?
Показать решение »
Решение.
Чтобы уменьшить скорость реакции необходимо увеличить объем системы, т.е. уменьшить давление и, тем самым, уменьшить концентрацию газообразного компонента — NH3. Концентрация Br2 при этом останется постоянной.
Начальная скорость прямой реакции была равна:
υ1= k·[NH3]8·[Br2]
при увеличении концентрации аммиака скорость прямой реакции стала равной:
υ2= k·[x·NH3]8·[Br2] = k·x8·[NH3]8·[Br2]
υ2/ υ1 = k·x8·[NH3]8·[Br2]/k·[NH3]8·[Br2] = 60
После сокращения всех постоянных, получаем
x8 = 60
x = 1,66
Таким образом, чтобы уменьшить скорость реакции в 60 раз, надо увеличить объем в 1,66 раз.
Задача 9. Как повлияет на выход хлора в системе:
4HCl(г) +O2(г) ↔2Cl2(г) + 2H2О(ж); ΔНо298 =−202,4кДж
а) повышение температуры; b) уменьшение общего объема смеси; c) уменьшение концентрации кислорода; d) введение катализатора?
Показать решение »
Решение.
4HCl(г) +O2(г) ↔2Cl2(г) + 2H2О(ж); ΔНо298 =−202,4кДж
- ΔНо298 ˂ 0, следовательно, реакция экзотермическая, поэтому, согласно принципу Ле-Шателье, при повышении температуры равновесие сместится в сторону образования исходных веществ (влево), т.е. выход хлора уменьшится.
- При уменьшении давления, равновесие смещается в сторону реакции, идущей с увеличением числа молекул газообразных веществ. В данном случае в равновесие смещается сторону образования исходных веществ (влево), т.е. выход хлора также уменьшится.
- Уменьшение концентрации кислорода также будет способствовать смещению равновесия влево и уменьшению выхода хлора.
- Внесение катализатора в систему приводит к увеличению скорости как прямой, так и обратной реакций. При этом, изменяется скорость достижения состояния равновесия, но при этом константа равновесия не меняется и смещения равновесия не происходит. Выход хлора останется неизменным.
Задача 10. В системе: PCl5 ↔ PCl3 + Cl2
равновесие при 500 оС установилось, когда исходная концентрация PCl5, равная 1 моль/л, уменьшилась до 0,46 моль/л. Найдите значение константы равновесия при указанной температуре.
Показать решение »
Решение.
PCl5 ↔ PCl3 + Cl2
Запишем выражение для константы равновесия:
К = [PCl3]·[Cl2] ̸ [PCl5]
Найдем количество PCl5, которое расходуется на образование PCl3 и Cl2 и их равновесные концентрации.
[PCl5]расход = 1 – 0,46 = 0,54 моль/лИз уравнения реакции:
Из 1 моль PCl5 образуется 1 моль PCl3
Из 0,54 моль PCl5 образуется x моль PCl3
x = 0,54 моль
Аналогично, из 1 моль PCl5 образуется 1 моль Cl2
из 0,54 моль PCl5 образуется у моль Cl2
у = 0,54 моль
К = 0,54·0,54/0,46 = 0,63.
Задача 11. Константа равновесия реакции: СОСl2(г) ↔ СО(г)+С12(г) равна 0,02. Исходная концентрация СОCl2 составила 1,3 моль/л. Рассчитайте равновесную концентрацию Сl2. Какую исходную концентрацию СОCl2 следует взять, чтобы увеличить выход хлора в 3 раза?
Показать решение »
Решение.
СОСl2(г) ↔ СО(г)+С12(г)
Запишем выражение для константы равновесия:
К = [СО]·[Cl2] ̸ [СОСl2]
Пусть [СО]равн = [Cl2]равн = х, тогда
[СОСl2]равн = 1,3 – хПодставим значения в выражение для константы равновесия
0,02 = х·х/(1,3 — х)
Преобразим выражение в квадратное уравнение
х2 + 0,02х – 0,026 = 0
Решая уравнение, находим
х = 0,15
Значит, [СО]равн = [Cl2]равн = 0,15 моль/л
Увеличив выход хлора в 3 раза получим:
[Cl2]равн = 3·0,15 = 0,45 моль/лИсходная концентрация [СОСl2]исх2 при этом значении Cl2 равна:
[СОСl2]равн2 = 0,45·0,45/0,02 = 10,125 моль/л
[СОСl2]исх2 = 10,125 + 0,45 = 10,575 моль/л
Таким образом, чтобы увеличить выход хлора в 3 раза, исходная концентрация СОCl2 должна быть равна [СОСl2]исх2 = 10,575 моль/л
Задача 12. Равновесие в системе H2(г)+ I2(г)↔ 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01 моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08 моль/л?
Показать решение »
Решение.
H2(г)+ I2(г)↔ 2HI(г)
Найдем значение константы равновесия данной реакции:
К = [HI]2 ̸ [H2] ·[I2]
К = 0,05 2 ̸ 0,01 · 0,01 = 25
При увеличении концентрации HI до 0,08 моль/л, равновесие сместится в сторону образования исходных веществ.
Из уравнения реакции видно, что образуется 2 моль HI, 1 моль H2 и 1 моль I2.
Обозначим новые равновесные концентрации через неизвестную х.
[HI]равн2 = 0,08 — 2х [H2]равн2 = [I2]равн2 = 0,01 + хНайдем х с помощью выражения для константы равновесия:
К = (0,08 — 2х) 2 ̸ [(0,01 + х) · (0,01 + х)] = 25
Решая уравнения находим:
х = 0,004
[H2]равн2 = [I2]равн2 = 0,01 + 0,004 = 0,0014 моль/лЗадача 13. Для реакции: FeO(к) + CO(г)↔Fe(к) + CO2(г) константа равновесия при 1000оС равна 0,5. Начальные концентрации СО и СО2 были соответственно равны 0,05 и 0,01 моль/л. Найдите их равновесные концентрации.
Показать решение »
Решение.
FeO(к) + CO(г)↔Fe(к) + CO2(г)
Запишем выражение для константы равновесия:
К = [СО2] ̸ [СО]
Пусть равновесные концентрации равны:
[СО]равн = (0,05 – х) моль/л [СО2]равн = (0,01 + х) моль/лПодставим значения в выражение для константы равновесия:
К = (0,01 + х)/(0,05 – х) = 0,5
Решая уравнение, найдем х:
х = 0,01
[СО]равн = 0,05 – 0,01 = 0,04 моль/л [СО2]равн = 0,01 + 0,01 = 0,02 моль/лzadachi-po-khimii.ru