Сульфат серебра — Википедия
Материал из Википедии — свободной энциклопедии
Растворимость сульфата серебра в воде при разных температурахСульфа́т серебра́ (сульфат серебра (I)) — неорганическое вещество с формулой Ag2SO4, соль серебра в степени окисления +1 и серной кислоты.
Бесцветные кристаллы со временем темнеющие от воздействия света. Плохо растворим в воде.
Применяется в качестве стандартного вещества для тепловой калибровки калориметров и иногда для бактерицидной обработки воды.
При нормальных условиях сульфат серебра — белое кристаллическое вещество, малорастворимое в воде (0,79 г/100 г H2O при 20 °C; 1,30 г/100 г H2O при 80 °C), нерастворимое в этаноле. При осаждении из водных растворов не образует кристаллогидратов.
Существует в двух кристаллических модификациях: с ромбической и гексагональной сингонией кристаллической решётки. Температура фазового перехода из ромбической формы в гексагональную — 427 °C.
При 660 °C плавится без разложения.
Окислительно-восстановительные реакции[править | править код]
При температуре 750−1100 °C сульфат серебра разлагается с выделением металлического серебра:
- Ag2SO4⟶2 Ag+ SO2+O2.{\displaystyle {\mathsf {Ag_{2}SO_{4}\longrightarrow 2\ Ag+\ SO_{2}+O_{2}}}.}
Также металлическое серебро восстанавливается из сульфата при нагревании последнего в токе водорода выше 200 °C:
- Ag2SO4+ h3⟶2 Ag+ h3SO4,{\displaystyle {\mathsf {Ag_{2}SO_{4}+\ H_{2}\longrightarrow 2\ Ag+\ H_{2}SO_{4}}},}
или при нагревании с сульфидом серебра выше 300 °C:
- Ag2SO4+ Ag2S⟶4 Ag+2 SO2.{\displaystyle {\mathsf {Ag_{2}SO_{4}+\ Ag_{2}S\longrightarrow 4\ Ag+2\ SO_{2}}}.}
Обменные реакции[править | править код]
Сульфат серебра растворяется в концентрированном водном растворе аммиака с образованием комплекса:
- Ag2SO4+4 (Nh4⋅h3O)⟶[Ag(Nh4)2]2SO4+4 h3O.{\displaystyle {\mathsf {Ag_{2}SO_{4}+4\ (NH_{3}\cdot H_{2}O)\longrightarrow [Ag(NH_{3})_{2}]_{2}SO_{4}+4\ H_{2}O}}.}
При небольшом (до 50 °C) нагревании сульфат серебра растворяется в концентрированной серной кислоте с образованием гидросульфата серебра:
- Ag2SO4+ h3SO4⟶2 AgHSO4.{\displaystyle {\mathsf {Ag_{2}SO_{4}+\ H_{2}SO_{4}\longrightarrow 2\ AgHSO_{4}}}.}
При взаимодействии с концентрированной соляной кислотой выпадает осадок хлорида серебра:
- Ag2SO4+2 HCl⟶2 AgCl↓+ h3SO4.{\displaystyle {\mathsf {Ag_{2}SO_{4}+2\ HCl\longrightarrow 2\ AgCl\downarrow +\ H_{2}SO_{4}}}.}
При взаимодействии с концентрированной щёлочью выпадает осадок оксида серебра (I):
- Ag2SO4+2 KOH⟶K2SO4+Ag2O↓+ h3O.{\displaystyle {\mathsf {Ag_{2}SO_{4}+2\ KOH\longrightarrow K_{2}SO_{4}+Ag_{2}O\downarrow +\ H_{2}O}}.}
Сульфат серебра может быть получен нагреванием металлического серебра с диоксидом серы и кислородом выше 450 °C:
- 2Ag+ SO2+ O2⟶Ag2SO4.{\displaystyle {\mathsf {2Ag+\ SO_{2}+\ O_{2}\longrightarrow Ag_{2}SO_{4}}}.}
- 2Ag+2 h3SO4⟶Ag2SO4↓+ SO2↑+2 h3O.{\displaystyle {\mathsf {2Ag+2\ H_{2}SO_{4}\longrightarrow Ag_{2}SO_{4}\downarrow +\ SO_{2}\uparrow +2\ H_{2}O}}.}
Осаждением из растворов в реакциях ионного обмена, например:
- 2AgNO3+ Na2SO4⟶Ag2SO4↓+2 NaNO3.{\displaystyle {\mathsf {2AgNO_{3}+\ Na_{2}SO_{4}\longrightarrow Ag_{2}SO_{4}\downarrow +2\ NaNO_{3}}}.}
Вытеснением концентрированной серной кислотой летучих соединений водорода из солей:
- 2 AgX+ h3SO4⟶Ag2SO4↓+2 HX↑{\displaystyle {\mathsf {2\ AgX+\ H_{2}SO_{4}\longrightarrow Ag_{2}SO_{4}\downarrow +2\ HX\uparrow }}}, где X= F,Br,I,CN.{\displaystyle {\mathsf {X=\ F,Br,I,CN}}.}
Применяется для бактерицидной обработки воды.
Калориметрия[править | править код]
Сульфат серебра используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Сульфат серебра оказывает сильное раздражающее действие на глаза. При длительном контакте с кожей может вызывать аргирию.
LD50 5000 мг/кг.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник. — М: Дрофа, 2006.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник. — М: Дрофа, 2007.
- Merck Safety Data Sheet − Silver sulfate (pdf)
Пиросерная кислота — Википедия
Материал из Википедии — свободной энциклопедии
| Пиросерная кислота | |
|---|---|
| Систематическое наименование | Пиросерная кислота |
| Традиционные названия | Дисерная кислота |
| Хим. формула | H2S2O7 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 178,14 г/моль |
| Плотность | 1,9 г/см³ |
| Температура | |
| • плавления | 35 °C |
| Рег. номер CAS | 7783-05-3 |
| PubChem | 62682 |
| Рег. номер EINECS | 231-976-8 |
| SMILES | |
| InChI | |
| ChEBI | 29211 |
| ChemSpider | 56433 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пиросерная кислота — неорганическое соединение, двухосновная кислота с формулой H2S2O7, бесцветные кристаллы, разлагается в воде. На воздухе она дымит, так как разлагается на серную кислоту, выделяя летучий серный ангидрид, а потому называется дымящей серной кислотой.
В Энциклопедическом словаре Брокгауза и Эфрона описывается в составе нордгаузенской серной кислоты следующим образом:
О присутствии в нордгаузенской серной кислоте, по крайней мере, при низких температурах и отчасти при обыкновенной гидрата H2S2O7 надо заключить из того, что при охлаждении до 0° — 5° этот гидрат можно выделить из нее в кристаллическом виде. С другой стороны, пиросерная кислота непрочна, кристаллы ее, плавясь при 35°С, уже разлагаются при этом на H2SO4 и SO3. В растворе в серной кислоте такое разложение, несомненно, наступает еще ранее, уже при обыкновенной температуре и сопровождается выделением паров легколетучего серного ангидрида, который, встречаясь с влагой воздуха и соединяясь с ней в труднолетучий гидрат H2SO4, и обусловливает появление тяжелого белого дыма, испускаемого нордгаузенской кислотой.[1].
- В 100% серной кислоте содержится 0,04% пиросерной кислоты.
- В серной кислоте, насыщенной триоксидом серы (олеум), имеет место равновесие
- SO3+h3SO4 ⇄h3S2O7{\displaystyle {\mathsf {SO_{3}+H_{2}SO_{4}\ \rightleftarrows H_{2}S_{2}O_{7}}}}
Пиросерная кислота образует бесцветные кристаллы моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 1,2955 нм, b = 1,3705 нм, c = 1,3164 нм, β = 109,2°, Z = 16 [3].
Реагирует с водой и этанолом.
- Разлагается водой:
- h3S2O7+h3O → 2h3SO4{\displaystyle {\mathsf {H_{2}S_{2}O_{7}+H_{2}O\ {\xrightarrow {}}\ 2H_{2}SO_{4}}}}
- Образует соли — дисульфаты или пиросульфаты, которые получаются нагреванием гидросульфатов, например дисульфат калия:
- 2KHSO4 →T K2S2O7+h3O{\displaystyle {\mathsf {2KHSO_{4}\ {\xrightarrow {T}}\ K_{2}S_{2}O_{7}+H_{2}O}}}
Применяется в производстве органических красителей, фармацевтических препаратов, очистки нефтепродуктов.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-85270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
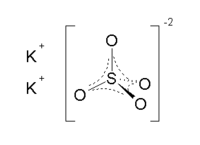
Сульфат калия — Википедия
| Сульфат калия | |||
|---|---|---|---|
 ( {{{картинка}}}) | |||
| |||
| Систематическое наименование | сульфат калия | ||
| Традиционные названия | сернокислый калий | ||
| Хим. формула | K2SO4 | ||
| Состояние | белое кристаллическое вещество | ||
| Молярная масса | 174.259 г/моль | ||
| Плотность | 2.66 г/см³ | ||
| Температура | |||
| • плавления | 1069 °C | ||
| • кипения | 1689 °C | ||
| • вспышки | негорюч °C | ||
| Мол. теплоёмк. | 131,4 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −1437,7 кДж/моль | ||
| Растворимость | |||
| • в воде | (20 °C) 11.1 г/100мл (25 °C) 12 г/100мл (100 °C) 24 г/100 мл | ||
| • в остальных веществах | слабо растворим в глицерине, нерастворим в ацетоне, спирте, CS2 | ||
| Кристаллическая структура | ромбическая | ||
| Рег. номер CAS | 7778-80-5 | ||
| PubChem | 24507 | ||
| Рег. номер EINECS | 231-915-5 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E515(i) | ||
| RTECS | TT5900000 | ||
| ChEBI | 32036 | ||
| ChemSpider | 22915 | ||
| ЛД50 | 6600 мг/кг | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Сульфат калия — неорганическое соединение. Химическая формула K2SO4.
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Бесцветные кристаллы, ромбическая сингония (a = 0,742 нм, b = 1,001 нм, c = 0,573 нм, Z = 4, пространственная группа Pnam). При температуре выше 584 °C переходит в гексагональную модификацию (a = 0,5947 нм, c = 0,8375 нм, Z = 2, пространственная группа P63/mmc).
Хорошо растворим в воде, не подвергается гидролизу. Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Вкус горько-солёный[1].
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит (англ. Arcanite) состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии (США).
Есть много минералов, содержащих соли калия:
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате сульфат калия, как правило, сильно загрязнён побочными продуктами:
- 2KCl+2MgSO4⇄K2SO4⋅MgSO4+MgCl2{\displaystyle {\mathsf {2KCl+2MgSO_{4}\rightleftarrows K_{2}SO_{4}\cdot MgSO_{4}+MgCl_{2}}}}
- K2SO4⋅MgSO4+2KCl⇄2K2SO4+MgCl2{\displaystyle {\mathsf {K_{2}SO_{4}\cdot MgSO_{4}+2KCl\rightleftarrows 2K_{2}SO_{4}+MgCl_{2}}}}
- 2KCl+Na2SO4⇄K2SO4+2NaCl{\displaystyle {\mathsf {2KCl+Na_{2}SO_{4}\rightleftarrows K_{2}SO_{4}+2NaCl}}}
- 2KCl+CaSO4⋅2h3O⇄K2SO4+CaCl2+2h3O{\displaystyle {\mathsf {2KCl+CaSO_{4}\cdot 2H_{2}O\rightleftarrows K_{2}SO_{4}+CaCl_{2}+2H_{2}O}}}
- 2KCl+FeSO4⇄K2SO4+FeCl2{\displaystyle {\mathsf {2KCl+FeSO_{4}\rightleftarrows K_{2}SO_{4}+FeCl_{2}}}}
Наиболее чистый продукт получают, обрабатывая твёрдый хлорид калия концентрированной серной кислотой:
- 2KCl+h3SO4→>100oCK2SO4+2HCl↑{\displaystyle {\mathsf {2KCl+H_{2}SO_{4}{\xrightarrow {>100^{o}C}}K_{2}SO_{4}+2HCl\uparrow }}}
Прокаливанием с углём минерала лангбейнита:
- K2SO4⋅2MgSO4+2C→>TK2SO4+2Mg↓+2CO2↑+2SO2↑{\displaystyle {\mathsf {K_{2}SO_{4}\cdot 2MgSO_{4}+2C{\xrightarrow {>T}}K_{2}SO_{4}+2Mg\downarrow +2CO_{2}\uparrow +2SO_{2}\uparrow }}}
В лабораторной практике применяют следующие методы:
- K2O+h3SO4→K2SO4+h3O{\displaystyle {\mathsf {K_{2}O+H_{2}SO_{4}{\xrightarrow {}}K_{2}SO_{4}+H_{2}O}}}
- вытеснением из слабых или неустойчивых кислот:
- K2CO3+h3SO4→K2SO4+CO2↑+h3O{\displaystyle {\mathsf {K_{2}CO_{3}+H_{2}SO_{4}{\xrightarrow {}}K_{2}SO_{4}+CO_{2}\uparrow +H_{2}O}}}
- из щёлочи и разбавленной кислоты:
- 2KOH+h3SO4→K2SO4+2h3O{\displaystyle {\mathsf {2KOH+H_{2}SO_{4}{\xrightarrow {}}K_{2}SO_{4}+2H_{2}O}}}
- 2KHSO4→240oCK2SO4+h3SO4{\displaystyle {\mathsf {2KHSO_{4}{\xrightarrow {240^{o}C}}K_{2}SO_{4}+H_{2}SO_{4}}}}
- KHSO4+KOH→K2SO4+h3O{\displaystyle {\mathsf {KHSO_{4}+KOH{\xrightarrow {}}K_{2}SO_{4}+H_{2}O}}}
- 2KHSO4+KCl→500oCK2SO4+HCl↑{\displaystyle {\mathsf {2KHSO_{4}+KCl{\xrightarrow {500^{o}C}}K_{2}SO_{4}+HCl\uparrow }}}
- K2S+2O2→>500oCK2SO4{\displaystyle {\mathsf {K_{2}S+2O_{2}{\xrightarrow {>500^{o}C}}K_{2}SO_{4}}}}
- 2KO2+S→140oCK2SO4{\displaystyle {\mathsf {2KO_{2}+S{\xrightarrow {140^{o}C}}K_{2}SO_{4}}}}
- 2KO2+SO2→100oCK2SO4+O2{\displaystyle {\mathsf {2KO_{2}+SO_{2}{\xrightarrow {100^{o}C}}K_{2}SO_{4}+O_{2}}}}
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
- 4K2SO3→600oCK2S+3K2SO4{\displaystyle {\mathsf {4K_{2}SO_{3}{\xrightarrow {600^{o}C}}K_{2}S+3K_{2}SO_{4}}}}
Окисление серы бихроматом калия:
- K2Cr2O7+S→800−1000oC Cr2O3+K2SO4{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+S{\xrightarrow {800-1000^{o}C}}\ Cr_{2}O_{3}+K_{2}SO_{4}}}}
Взаимодействием сульфата аммония и гидроксид калия:
- (Nh5)2SO4+2KOH→K2SO4+2Nh4↑+2h3O{\displaystyle {\mathsf {(NH_{4})_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2NH_{3}\uparrow +2H_{2}O}}}
Как соль двухосновной кислоты образует кислые соли:
- K2SO4+h3SO4⇄2KHSO4{\displaystyle {\mathsf {K_{2}SO_{4}+H_{2}SO_{4}\rightleftarrows 2KHSO_{4}}}}
Как все сульфаты взаимодействует с растворимыми соединениями бария:
- K2SO4+BaCl2→2KCl+BaSO4↓{\displaystyle {\mathsf {K_{2}SO_{4}+BaCl_{2}{\xrightarrow {}}2KCl+BaSO_{4}\downarrow }}}
Восстанавливается до сульфида:
- K2SO4+4h3→600oC,Fe2O3K2S+4h3O{\displaystyle {\mathsf {K_{2}SO_{4}+4H_{2}{\xrightarrow {600^{o}C,Fe_{2}O_{3}}}K_{2}S+4H_{2}O}}}
- K2SO4+4C→900oCK2S+4CO{\displaystyle {\mathsf {K_{2}SO_{4}+4C{\xrightarrow {900^{o}C}}K_{2}S+4CO}}}
С оксидом серы образует пиросульфат:
- K2SO4+SO3→K2S2O7{\displaystyle {\mathsf {K_{2}SO_{4}+SO_{3}{\xrightarrow {}}K_{2}S_{2}O_{7}}}}
Основной потребитель сульфата калия — сельское хозяйство. Сульфат калия является ценным бесхлорным удобрением. Эффективность сульфата калия лучше проявляется на бедных калием дерново-подзолистых почвах гранулометрического состава и торфяных почвах. На черноземных почвах он применяется обычно под культуры, которые усваивают много калия и натрия (сахарная свёкла, подсолнечники, плодовые, для корнеплодов, овощей). На каштановых и серозёмных почвах используют в зависимости от вида культуры, технологии выращивания и содержания калия в почве. Сульфат калия намного эффективнее влияет на величину урожая и его качество, если его применять в комплексе с азотными и фосфорными удобрениями. На кислых почвах действие сульфата калия повышается на фоне использования извести.
Калий повышает содержание сахаров и витаминов в выращиваемой продукции, а подкормки в конце августа-сентября способствуют лучшему зимованию плодово-ягодным и декоративным деревьям и кустарникам. Используется на различных почвах, под все культуры, а также для комнатного и балконного цветоводства. Сульфат калия пригоден для всех способов внесения: основного (при перекопке почвы весной или осенью) и для подкормки в течение вегетационного периода.[2]
Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Наличие в удобрении сульфат-иона положительно влияет на урожай растений семейства крестоцветных (капуста, брюква, турнепс и др.) и бобовых, потребляющих много серы.
Также сульфат калия используется в производстве стекла, различных квасцов и других соединений калия, как флюс в металлургии.[3] В Европейском союзе допущен в качестве использования как пищевая добавка E515.
Следующие действия сульфатом калия на части тела могут вызвать:
- Глаза: попадание пыли может вызвать механическое раздражение,
- Кожа: попадание на кожу может вызвать раздражение,
- Проглатывание: употребление в пищу больших количеств может вызвать раздражение желудочно-кишечного тракта,
- Вдыхание: при вдыхании может вызвать раздражение дыхательных путей,
- При хроническом употреблении сульфата калия: отравления могут возникать в редких случаях длительного воздействия.
Пероксодисерная кислота — Википедия
Материал из Википедии — свободной энциклопедии
| Пероксодисерная кислота | |
|---|---|
| ( {{{картинка}}}) | |
| Систематическое наименование | Пероксодисерная кислота |
| Традиционные названия | Надсерная кислота |
| Хим. формула | H2S2O8 |
| Рац. формула | H2S2O6(O2) |
| Состояние | твёрдое вещество |
| Молярная масса | 194,14 г/моль |
| Температура | |
| • плавления | с разл. 65 °C |
| Рег. номер CAS | 13445-49-3 |
| PubChem | 24413 |
| SMILES | |
| InChI | |
| ChEBI | 29268 |
| ChemSpider | 22822 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пероксодисерная кислота — неорганическое соединение, двухосновная кислота с формулой H2S2O8 (по номенклатуре ИЮПАК H2S2O6(O2)), белое, очень гигроскопичное вещество, устойчиво в концентрированном водном растворе, разлагается в разбавленном.
- 2h3SO4 →e−,0oC h3S2O8+h3↑{\displaystyle {\mathsf {2H_{2}SO_{4}\ {\xrightarrow {e^{-},0^{o}C}}\ H_{2}S_{2}O_{8}+H_{2}\uparrow }}}
- h3SO5+HSO3Cl → h3S2O8+HCl{\displaystyle {\mathsf {H_{2}SO_{5}+HSO_{3}Cl\ {\xrightarrow {}}\ H_{2}S_{2}O_{8}+HCl}}}
- K2S2O8+2h3SO4 →0oC h3S2O8+2KHSO4{\displaystyle {\mathsf {K_{2}S_{2}O_{8}+2H_{2}SO_{4}\ {\xrightarrow {0^{o}C}}\ H_{2}S_{2}O_{8}+2KHSO_{4}}}}
Пероксодисерная кислота — белое, очень гигроскопичное вещество, устойчиво в концентрированном водном растворе, разлагается в разбавленном.
Растворимо в этаноле, диэтиловом эфире, серной кислоте.
- Разлагается при нагревании выше температуры плавления:
- 2h3S2O8 →65oC 2h3SO4+2SO3+O2{\displaystyle {\mathsf {2H_{2}S_{2}O_{8}\ {\xrightarrow {65^{o}C}}\ 2H_{2}SO_{4}+2SO_{3}+O_{2}}}}
- В разбавленных водных растворах разлагается:
- h3S2O8+h3O →0oC h3SO5+h3SO4{\displaystyle {\mathsf {H_{2}S_{2}O_{8}+H_{2}O\ {\xrightarrow {0^{o}C}}\ H_{2}SO_{5}+H_{2}SO_{4}}}}
- h3S2O8+2h3O →20−25oC 2h3SO4+h3O2{\displaystyle {\mathsf {H_{2}S_{2}O_{8}+2H_{2}O\ {\xrightarrow {20-25^{o}C}}\ 2H_{2}SO_{4}+H_{2}O_{2}}}}
- 2h3S2O8+4NaOH →0oC Na2S2O8+NaHSO5+NaHSO4+3h3O{\displaystyle {\mathsf {2H_{2}S_{2}O_{8}+4NaOH\ {\xrightarrow {0^{o}C}}\ Na_{2}S_{2}O_{8}+NaHSO_{5}+NaHSO_{4}+3H_{2}O}}}
- 2h3S2O8+8NaOH →80oC 4Na2SO4+O2↑+6h3O{\displaystyle {\mathsf {2H_{2}S_{2}O_{8}+8NaOH\ {\xrightarrow {80^{o}C}}\ 4Na_{2}SO_{4}+O_{2}\uparrow +6H_{2}O}}}
- Является сильным окислителем, медленно окисляет аммиак:
- 3h3S2O8+14Nh4 → 6(Nh5)2SO4+N2↑{\displaystyle {\mathsf {3H_{2}S_{2}O_{8}+14NH_{3}\ {\xrightarrow {}}\ 6(NH_{4})_{2}SO_{4}+N_{2}\uparrow }}}
- Окисляет серебро до трёхвалентного состояния:
- h3S2O8+2AgNO3+2h3O → AgIAgIIIO2↓+2h3SO4+2HNO3{\displaystyle {\mathsf {H_{2}S_{2}O_{8}+2AgNO_{3}+2H_{2}O\ {\xrightarrow {}}\ Ag^{I}Ag^{III}O_{2}\downarrow +2H_{2}SO_{4}+2HNO_{3}}}}
Пероксосульфаты — Википедия
Материал из Википедии — свободной энциклопедии
Пероксосульфаты (персульфаты) — неорганические соединения, соли пероксосерных кислот.
- По номенклатуре IUPAC кислоты, содержащие пероксидную группу -O-O- получили название пероксокислоты. Примеры названий:
По IUPAC суммирование пероксидного и оксидного атомов кислорода, то есть использование кратких формул H2S2O8, не рекомендуется.
- По систематической номенклатуре названия солей строится по принципу номенклатуры комплексных соединений, например, K2S2O7 — гептаоксодисульфат(VI) калия. Однако, для солей, имеющих традиционные названия, рекомендуется использовать их.
- Традиционные названия содержат приставку пероксо-:
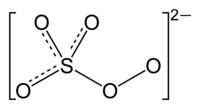 Структура пероксосульфат-иона
Структура пероксосульфат-иона 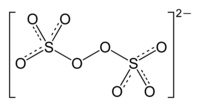 Структура пероксодисульфат-иона
Структура пероксодисульфат-иона- Пероксодисульфаты получают электролизом кислых сульфатов:
- KHSO4 →e− K2S2O8+h3↑{\displaystyle {\mathsf {KHSO_{4}\ {\xrightarrow {e^{-}}}\ K_{2}S_{2}O_{8}+H_{2}\uparrow }}}
- Пероксосульфаты получают из пероксосерной кислоты (Кислота Каро):
- h3SO5+NaOH → NaHSO5+h3O{\displaystyle {\mathsf {H_{2}SO_{5}+NaOH\ {\xrightarrow {}}\ NaHSO_{5}+H_{2}O}}}
- так как кислота одноосновная, то она образует только «кислые» соли (но в некоторых литературных источниках упоминаются «средние» соли).
- 5K2S2O8+2MnSO4+8h3O →Ag+ 2KMnO4+8h3SO4+4K2SO4{\displaystyle {\mathsf {5K_{2}S_{2}O_{8}+2MnSO_{4}+8H_{2}O\ {\xrightarrow {Ag^{+}}}\ 2KMnO_{4}+8H_{2}SO_{4}+4K_{2}SO_{4}}}}
- Отбеливатели
- Дезинфицирующее средство
- Инициаторы полимеризации
- Неорганическая химия / Под ред. Третьякова Ю. Д. — М.: Изд. центр «Академия», 2004. — Т. 2. — 368 с. — ISBN 5-7695-1436-1.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р. А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9.
Тиосерная кислота — Википедия
| Тиосерная кислота | |
|---|---|
| ( {{{картинка}}}) | |
| Общие | |
| Систематическое наименование | Тиосерная кислота |
| Хим. формула | H2SO3S |
| Физические свойства | |
| Состояние | бесцветная вязкая жидкость |
| Молярная масса | 114,15 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | разл. -78 °C |
| Классификация | |
| Рег. номер CAS | 13686-28-7 |
| PubChem | 24478 |
| SMILES | O=S(=S)(O)O |
| InChI | 1S/h3O3S2/c1-5(2,3)4/h(h3,1,2,3,4)DHCDFWKWKRSZHF-UHFFFAOYSA-N |
| ChEBI | 29279 и 5587 |
| ChemSpider | 22886 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Тиосерная кислота — неорганическое соединение, двухосновная сильная кислота с формулой H2SO3S. Бесцветная вязкая жидкость, реагирует с водой. Образует соли — неорганические тиосульфаты. Тиосерная кислота содержит два атома серы, один из которых имеет степень окисления +4, а второй — электронейтрален.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Литература
- Реакция сероводорода и триоксида серы в этиловом эфире при низких температурах:
- h3S+SO3 →<−5oC h3SO3S{\displaystyle {\mathsf {H_{2}S+SO_{3}\ {\xrightarrow {<-5^{o}C}}\ H_{2}SO_{3}S}}}
- Действие газообразного хлористого водорода на тиосульфат натрия:
- Na2SO3S+2HCl →<−80oC h3SO3S+2NaCl{\displaystyle {\mathsf {Na_{2}SO_{3}S+2HCl\ {\xrightarrow {<-80^{o}C}}\ H_{2}SO_{3}S+2NaCl}}}
Тиосерная кислота образует бесцветную вязкую жидкость, не замерзающую даже при очень низкой температуре. Термически неустойчива — разлагается уже при комнатной температуре.
Быстро, но не мгновенно, разлагается в водных растворах. В присутствии серной кислоты разлагается мгновенно.
- Термически очень неустойчива:
- 2h3S2O3 →>−78oC h3S3O6+h3S{\displaystyle {\mathsf {2H_{2}S_{2}O_{3}\ {\xrightarrow {>-78^{o}C}}\ H_{2}S_{3}O_{6}+H_{2}S}}}
- В присутствии серной кислоты разлагается:
- h3SO3S →H+ SO2+S↓+h3O{\displaystyle {\mathsf {H_{2}SO_{3}S\ {\xrightarrow {H^{+}}}\ SO_{2}+S\downarrow +H_{2}O}}}
- Реагирует со щелочами:
- h3SO3S+2NaOH → Na2S2O3+2h3O{\displaystyle {\mathsf {H_{2}SO_{3}S+2NaOH\ {\xrightarrow {}}\ Na_{2}S_{2}O_{3}+2H_{2}O}}}
- Реагирует с галогенами:
- h3SO3S+4Br2+5h3O → 2h3SO4+8HBr{\displaystyle {\mathsf {H_{2}SO_{3}S+4Br_{2}+5H_{2}O\ {\xrightarrow {}}\ 2H_{2}SO_{4}+8HBr}}}
Образует сложные эфиры — органические тиосульфаты.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Химические свойства неорганических веществ: Учеб. пособие для вузов — 3-е изд., испр — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0https://wikidata.org/wiki/Track:Q52153739″>https://wikidata.org/wiki/Track:Q52153731″>https://wikidata.org/wiki/Track:Q52153729″>https://wikidata.org/wiki/Track:Q52153728″>https://wikidata.org/wiki/Track:Q52153736″>
§ 15. Вычисления по химическим формулам. Массовая доля в соединении
1. Вычислите относительную молекулярную массу сульфата меди CuSO4.
Mr (CuSO4) = Ar (Cu) + Ar (S) + 4 * Ar (O) = 63,5 + 32 + 4 * 16 = 159,5 а. е. м.
2. Вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
m (H) : m (C) : m (O) = 2 * Ar (H) : Ar (C) : 3 * Ar (O) = 2 : 12 : 48 = 1 : 6 : 24
3. Вычислите массовые доли элементов в процентах по формулам соединений: а) CuSO4 — сульфат меди; б) Fe2O3 — оксид железа; в) HNO3 — азотная кислота.
Массовую долю элемента в соединении находят по формуле:
w (Э) = (Ar (Э) / Mr вещ-ва) * 100%
а) CuSO4 — сульфат меди
Mr (CuSO4) = Ar (Cu) + Ar (S) + 4 * Ar (O) = 64 + 32 + 4 * 16 = 160 а. е. м.
w (Cu) = Ar (Cu) / Mr (CuSO4) = 64 / 160 = 0,4 = 40%
w (S) = Ar (S) / Mr (CuSO4) = 32 / 160 = 0,2 = 20%
w (O) = 4 * Ar (O) / Mr (CuSO4) = 4 * 16 / 160 = 0,4 = 40%
Хотя массовую долю последнего элемента всегда можно найти вычитанием из 100% массовых долей всех других элементов:
w (O) = 100 — w (Cu) — w (S) = 100 — 40 — 20 = 40 (%)
б) Fe2O3 — оксид железа
Mr (Fe2O3) = 2 * Ar (Fe) + 3 * Ar (O) = 2 * 56 + 3 * 16 = 112 + 48 = 160 а. е. м.
w (Fe) = 2 * Ar (Fe) / Mr (Fe2O3) = 2 * 56 / 160 = 112 / 160 = 0,7 = 70%
w (O) = 3 * Ar (O) / Mr (Fe2O3) = 3 * 16 / 160 = 48 / 160 = 0,3 = 30%
в) HNO3 — азотная кислота
Mr (HNO3) = Ar (H) + Ar (N) + 3 * Ar (O) = 1 + 14 + 3 * 16 = 63 а. е. м.
w (H) = Ar (H) / Mr (HNO3) = 1 / 63 = 0,016 = 1,6%
w (N) = Ar (N) / Mr (HNO3) = 14 / 63 = 0,222 = 22,2%
w (O) = 3 * Ar (O) / Mr (HNO3) = 3 * 16 / 63 = 0,762 = 76,2%
4. Во сколько раз массовая доля химического элемента серы в оксиде серы SO3 меньше, чем в оксиде серы SO2?
Чтобы ответить на поставленный вопрос, нам придется найти массовую долю серы в обоих оксидах.
а) W (S) = Ar (S) / Mr (SO3) = 32 / (32 + 3 * 16) = 32 / 80 = 0,4 = 40%
б) W (S) = Ar (S) / Mr (SO2) = 32 / (32 + 2 * 16) = 32 / 64 = 0,5 = 50%
Теперь мы можем ответить на вопрос: w1 (S) / w2 (S) = 0,4 / 0,5 = 0,8 (раз)
5. Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Отношение масс элементов в соединении равно отношению их относительных атомных масс: m (H) : m (S) = x * Ar (H) : y * Ar (S), где x и y — некоторые коэффициенты, показывающие соотношение количества атомов элементов в соединении.
x * Ar (H) : y * Ar (S) = x * Ar (1) : y * Ar (32) = x : 32y
m (H) : m (S) = 1 : 16
1 : 16 = x : 32y
Разумеется, y не может быть меньше единицы (относительная атомная масса S = 32 а. е. м.). Значит, x = 2, y = 1. А формула сероводорода H2S.
6. Применяя сведения об относительных атомных массах химических элементов, составьте химическую формулу сульфата меди, если массовые отношения в нем меди, серы и кислорода соответственно равны 2 : 1 : 2.
Задача аналогична предыдущей, но с тремя элементами.
m (Cu) : m (S) : m (O) = x * Ar (Cu) : y * Ar (S) * z Ar (O) = 2 : 1 : 2
Ar (Cu) = 64 а. е. м.; Ar (S) = 32 а. е. м.; Ar (O) = 16 а. е. м.
64x : 32y : 16z = 2 : 1 : 2
Или,
64x : 32 : 16z = 2 : 1 : 2
Или,
2x : 1 : 0,5z = 2 : 1 : 2
Откуда: x = 1, y = 1, z = 4.
Формула сульфата меди CuSO4
7. Выведите простейшую формулу соединения, в котором массовая доля натрия равна 32,4%, серы — 22,5%, кислорода — 45,1%.
Из условия задачи следует, что в 100 г вещества будет содержаться 32,4 г натрия, 22,5 г серы и 45,1 г кислорода. Если каждое из этих чисел разделить на относительные атомные массы соответствующих элементов, то получим число атомов каждого элемента в 100 молекулах вещества.
32,4 : 23 = 1,4 атома натрия
22,5 : 32 = 0,7 атома серы
45,1 : 16 = 2,8 атома кислорода
Таким образом, соотношение атомов элементов в веществе будет:
x : y : z = 1,4 : 0,7 : 2,8 = 2 : 1 : 4
Формула соединения Na2SO4 — сульфат натрия.
8. Смешали 14 г порошкообразного железа с 14 г порошкообразной серы. Смесь нагрели. Найдите массу сульфида железа, если известно, что Fe и S в данном случае соединяются в массовых отношениях 7 : 4.
Здесь, нужно вспомнить, что сера и железо соединяются друг с другом в разных пропорциях. Поэтому мы не знаем заранее формулу сульфида. Для начала определим ее:
m (Fe) / m (S) = x * Ar (Fe) / y * Ar (S), где x и y — числовые коэффициенты, показывающие соотношение атомов в молекуле.
По условиям задачи, m (Fe) / m (S) = 7 : 4
Теперь подставим значения относительной атомной массы в правую часть уравнения:
7 : 4 = x * 56 : y * 32
7 : 4 = 7x : 4y
Значит, x = y = 1 и формула сульфида FeS. Т.е. в молекуле сульфида на 1 атом железа приходится 1 атом серы.
Теперь составим пропорцию. 7 массовых частей железа вступают в реакцию с 4 массовыми частями серы, а 14 грамм железа вступают в реакцию с z грамм серы:
7 м.ч. (Fe) — 4 м.ч. (S)
14 г (Fe) — z г (S)
Откуда z = 8 г — масса серы, вступившей в реакцию.
Тогда, масса сульфида железа будет равна массе железа + масса серы, вступившей в реакцию: 14 + 8 = 22 г
Последний этап задачи можно было решить с помощью такого понятия как количество вещества, через моли. Но т.к. в учебнике эта тема еще не освещалась, говорить о ней преждевременно.
Тестовые задания
1.Установите соответствие между химической формулой и массовым соотношением химических элементов, входящих в состав этой формулы.
| 1) MgO | А. 3 : 2 |
| 2) H2SO4 | Б. 7 : 3 |
| 3) Fe2O3 | В. 2 : 1 : 2 |
| 4) CuSO4 | Г. 1 : 16 : 32 |
Боюсь, схитрить тут особо не получится и придется браться за калькулятор.
MgO: Ar (Mg) : Ar (O) = 24 : 16 = 1,5 : 1 = 3 : 2 (вариант А)
Логично будет предположить, что второе отношение двух чисел (вариант Б) 7 : 3 относится ко второму бинарному соединению Fe2O3. Но чтобы не получить нагоняй от учителя и закрепить материал, проделаем все нужные действия:
Fe2O3: 2*Ar (Fe) : 3*Ar (O) = 2*56 : 3*16 = 112 : 48 = 1 : 2,33 = 3 : 7 (вариант Б)
H2SO4: 2*Ar (H) : Ar (S) : 4*Ar (O) = 2 : 32 : 64 = 1 : 16 : 32 (вариант Г)
CuSO4: Ar (Cu) : Ar (S) : 4*Ar (O) = 64 : 32 : 64 = 2 : 1 : 2 (вариант В)
Ответы: 1 — А, 2 — Г, 3 — Б, 4 — В.
2. Массовая доля химического элемента углерода в молекуле этанола C2H6O составляет:
1) 10%: 2) 23,6%: 3) 41,0%; 4) 52,2%.
w(C) = 2*Ar (C) / Mr (C2H6O)
Mr (C2H6O) = 2*Ar (C) + 6*Ar (H) + Ar (O) = 2*12 + 6*1 + 16 = 24 + 6 + 16 = 46 а. е. м.
w(C) = 2*12 / 46 = 0,522 = 52,2%
Ответ: 4) 52,2%
 (
(