Оксиды азота. Азотная кислота | АЛХИМИК
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Солеобразующие оксиды: N2O3, NO2, N2O4, N2O5
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
2N2O = 2N2 + O2
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2 + O2 = 2NO
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
4NH3 + 5O2 = 4NO + 6H2O
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):
2NO + O2 = 2NO2
 Оксид азота (IV)
Оксид азота (IV)Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO 3. Поэтому взаимодействие с водой происходит по уравнению:
2NO2 + H2O = HNO2 + HNO3
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
4NO2 + O2 + 2H2O ⇄ 4HNO3
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
В избытке кислорода образуется только нитрат натрия:
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Ниже 22 0С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:
 Оксид азота (III)
Оксид азота (III)N2O3 + H2O = 2HNO2
Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
4HNO3 ⇄ 2H2O + 4NO2↑ + O2↑
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
 Азотная кислота
Азотная кислотаКислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
HNO3
Как и все кислоты, она реагирует:
а) с оксидами металлов:
MgO + 2HNO3 = Mg(NO3)2 + H2O
б) с основаниями:
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
в) с солями более слабых кислот:
K2CO3 + HNO3 = KNO3 + CO2↑ + H2O
Окислительно – восстановительные свойства
Азотная кислота является одним из сильнейших окислителей. Ее окислительно-восстановительные свойства обусловлены присутствием в молекуле HNO3 атома азота в высшей степени окисления N+5 в составе кислотного остатка NO3—. Окислительные свойства кислотного остатка NO3— значительно сильнее, чем ионов водорода Н+, поэтому азотная кислота взаимодействует практически со всеми металлами, кроме золота и платины, находящимися в конце ряда напряжений. Так как окислителем в HNO 3 являются ионы NO3—, а не ионы Н+, то при взаимодействии HNO3 с металлами практически никогда не выделяется водород. Нитрат-ионы NO3— при взаимодействии HNO3 с металлами восстанавливаются тем полнее, чем более разбавлена кислота и чем более активен металл. На следующей схеме показано, какие продукты могут образоваться при восстановлении HNO3:

 Общая схема взаимодействия азотной кислоты с металлами
Общая схема взаимодействия азотной кислоты с металламиКонцентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
10HNO3 + 4Ca = 4Ca(NO3)
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
4HNO3 + Ni = Ni(NO3)2 + 2NO2↑ + 2H2O
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
5HNO3 + P = HPO3 + 5NO2↑ + 2H2O
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
3Al + 12HNO3 = Al(NO3)3 + Al2O3 + 9NO2↑ + 6H2O
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH 4NO3:
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:
2HNO3 + S = H2SO4 + 2NO↑
 Взаимодействие азотной кислоты с медью
Взаимодействие азотной кислоты с медьюПолучение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
В промышленности получение азотной кислоты идет в три стадии:
- Окисление аммиака до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
- Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 = 2NO2
- Растворение оксида азота (IV) в воде и избытком кислорода:
4NO2 + 2H2O + O2 = 4HNO3
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:

Примеры:
2NaNO3 = 2NaNO2 + O2↑
2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2↑ + O2↑
*на изображении записи кристаллы нитрата меди (II)
Похожее
al-himik.ru
свойства, получение и применение :: SYL.ru
Введение
 Вы увлекаетесь цветоводством и пришли в магазин, чтобы купить удобрения для своих цветов. Пересматривая различные названия и составы, вы заметили бутыль с надписью «Азотное удобрение». Читаем его состав: «Фосфор, кальций, то-се… Азотная кислота? А это еще что за зверь?!». Обычно с азотной кислотой знакомятся именно в такой обстановке. И многим тогда же захочется узнать о ней побольше. Сегодня я постараюсь удовлетворить ваше любопытство.
Вы увлекаетесь цветоводством и пришли в магазин, чтобы купить удобрения для своих цветов. Пересматривая различные названия и составы, вы заметили бутыль с надписью «Азотное удобрение». Читаем его состав: «Фосфор, кальций, то-се… Азотная кислота? А это еще что за зверь?!». Обычно с азотной кислотой знакомятся именно в такой обстановке. И многим тогда же захочется узнать о ней побольше. Сегодня я постараюсь удовлетворить ваше любопытство.Определение
Азотная кислота (формула HNO3) является сильной одноосновной кислотой. В неокисленном состоянии она выглядит так, как на фото 1. В обычных условиях это жидкость, но ее можно перевести в твердое агрегатное состояние. И в нем она напоминает кристаллы, имеющие моноклинную или ромбическую решетку.
Химические свойства азотной кислоты
 Имеет способность хорошо смешиваться с водой, где происходит почти полная диссоциация этой кислоты на ионы. Концентрированная азотная кислота имеет бурый цвет (фото). Его обеспечивает разложение на диоксид азота, воду и кислород, происходящее из-за солнечного света, который падает на нее. Если ее нагреть, произойдет такое же разложение. С ней реагируют все металлы, за исключением тантала, золота и платиноидов (рутения, родия, палладия, иридия, осмия и платины). Однако ее соединение с соляной кислотой может даже растворять некоторые из них (это так называемая «царская водка»). Азотная кислота, имеющая любую концентрацию, может проявляться в качестве окислителя. Многие органические вещества при взаимодействии с ней могут самовоспламеняться. А некоторые металлы в этой кислоте будут пассивироваться. При действии на них (а также при реакции с оксидами, карбонатами и гидроксидами) азотная кислота образует свои соли, носящие название нитратов. Последние хорошо растворяются в воде. Но нитрат-ионы в ней не гидролизуются. Если нагреть соли данной кислоты, то произойдет их необратимое разложение.
Имеет способность хорошо смешиваться с водой, где происходит почти полная диссоциация этой кислоты на ионы. Концентрированная азотная кислота имеет бурый цвет (фото). Его обеспечивает разложение на диоксид азота, воду и кислород, происходящее из-за солнечного света, который падает на нее. Если ее нагреть, произойдет такое же разложение. С ней реагируют все металлы, за исключением тантала, золота и платиноидов (рутения, родия, палладия, иридия, осмия и платины). Однако ее соединение с соляной кислотой может даже растворять некоторые из них (это так называемая «царская водка»). Азотная кислота, имеющая любую концентрацию, может проявляться в качестве окислителя. Многие органические вещества при взаимодействии с ней могут самовоспламеняться. А некоторые металлы в этой кислоте будут пассивироваться. При действии на них (а также при реакции с оксидами, карбонатами и гидроксидами) азотная кислота образует свои соли, носящие название нитратов. Последние хорошо растворяются в воде. Но нитрат-ионы в ней не гидролизуются. Если нагреть соли данной кислоты, то произойдет их необратимое разложение.Получение
Для получения азотной кислоты синтетический аммиак окисляют с помощью платино-родиевых катализаторов до появления смеси нитрозных газов, которые в дальнейшем поглощаются водой. Также она образуется, когда смешивают и нагревают калиевую селитру и железный купорос.

Применение
С помощью азотной кислоты производят минеральные удобрения, взрывчатые и некоторые отравляющие вещества. Ею травят печатные формы (офортные доски, магниевые клише и т.д.), а еще подкисляют тонирующие растворы для фото. Из азотной кислоты производят красители и лекарства, а также с ее помощью определяют наличие золота в золотых сплавах.
Физиологическое воздействие
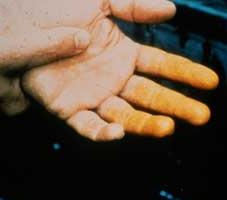
Учитывая степень влияния азотной кислоты на организм, ее относят к 3-му классу опасности (умеренно опасная). Вдыхание ее паров приводит к раздражению дыхательных путей. При попадании на кожу азотная кислота оставляет множество долго заживающих язв. Участки кожи, куда она попала, становятся характерного желтого цвета (фото). Говоря научным языком, происходит ксантопротеиновая реакция. Диоксид азота, который получается при нагревании азотной кислоты или ее разложении на свету, очень токсичен и может вызвать отек легких.
Заключение
Азотная кислота приносит пользу человеку как в разбавленном, так и в чистом состоянии. Но чаще всего она встречается в составе веществ, многие из которых вам наверняка знакомы (например, нитроглицерин).
www.syl.ru
Азотная кислота — Википедия. Что такое Азотная кислота
| Азотная кислота | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | азотная кислота |
| Хим. формула | HNO3 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 63.012 г/моль |
| Плотность | 1,513 г/см³ |
| Энергия ионизации | 11,95 ± 0,01 эВ[2] |
| Термические свойства | |
| Т. плав. | -41,59 °C |
| Т. кип. | 82,6 °C |
| Мол. теплоёмк. | 109,9 Дж/(моль·К) |
| Энтальпия образования | -174,1 кДж/моль |
| Энтальпия плавления | 10,47 кДж/моль |
| Энтальпия кипения | 39,1 кДж/моль |
| Энтальпия растворения | -33,68 кДж/моль |
| Давление пара | 56 гПА |
| Химические свойства | |
| pKa | -1,64 [1] |
| Растворимость в воде | смешивается |
| Оптические свойства | |
| Показатель преломления | 1.397 |
| Структура | |
| Дипольный момент | 2.17 ± 0.02 Д |
| Классификация | |
| Рег. номер CAS | 7697-37-2 |
| PubChem | 944 |
| Рег. номер EINECS | 231-714-2 |
| SMILES | |
| InChI | |
| Рег. номер EC | 231-714-2 |
| RTECS | QU5775000 |
| ChEBI | 48107 |
| Номер ООН | 2031 |
| ChemSpider | 919 |
| Безопасность | |
| ЛД50 | 430 мг/кг |
| Токсичность | 
 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Кислота ядовита.
Физические и физико-химические свойства
Плотность азотной кислоты в зависимости от концентрации. Фазовая диаграмма водного раствора азотной кислоты.
Фазовая диаграмма водного раствора азотной кислоты.Азот в азотной кислоте четырёхвалентен[3], степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C)
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
- моногидрат HNO3·H2O, Tпл = −37,62 °C
- тригидрат HNO3·3H2O, Tпл = −18,47 °C
Твёрдая азотная кислота образует две кристаллические модификации:
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, a = 0,631 нм, b = 0,869 нм, c = 0,544, Z = 4;
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
- d(c)=0,9952+0,564c+0,3005c2−0,359c3{\displaystyle {\mathsf {d(c)=0,9952+0,564c+0,3005c^{2}-0,359c^{3}}}}
где d — плотность в г/см³, с — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
- 4HNO3⟶4NO2↑+2h3O+O2↑{\displaystyle {\mathsf {4HNO_{3}\longrightarrow 4NO_{2}\uparrow +2H_{2}O+O_{2}\uparrow }}}
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
- CuO+2HNO3⟶Cu(NO3)2+h3O{\displaystyle {\mathsf {CuO+2HNO_{3}\longrightarrow Cu(NO_{3})_{2}+H_{2}O}}}
- ZnO+2HNO3⟶Zn(NO3)2+h3O{\displaystyle {\mathsf {ZnO+2HNO_{3}\longrightarrow Zn(NO_{3})_{2}+H_{2}O}}}
б) с основаниями:
- KOH+HNO3⟶KNO3+h3O{\displaystyle {\mathsf {KOH+HNO_{3}\longrightarrow KNO_{3}+H_{2}O}}}
в) вытесняет слабые кислоты из их солей:
- CaCO3+2HNO3⟶Ca(NO3)2+h3O+CO2↑{\displaystyle {\mathsf {CaCO_{3}+2HNO_{3}\longrightarrow Ca(NO_{3})_{2}+H_{2}O+CO_{2}\uparrow }}}
При кипении или под действием света азотная кислота частично разлагается:
- 4HNO3⟶4NO2↑+O2↑+2h3O{\displaystyle {\mathsf {4HNO_{3}\longrightarrow 4NO_{2}\uparrow +O_{2}\uparrow +2H_{2}O}}}
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
- Cu+4HNO3(60%)⟶Cu(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)\longrightarrow Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
Разбавленная HNO3
- 3Cu+8HNO3(30%)⟶3Cu(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)\longrightarrow 3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
б) с металлами, стоящими в ряду напряжений левее водорода:
- Zn+4HNO3(60%)⟶Zn(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Zn+4HNO_{3}(60\%)\longrightarrow Zn(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
- 3Zn+8HNO3(30%)⟶3Zn(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Zn+8HNO_{3}(30\%)\longrightarrow 3Zn(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
- 4Zn+10HNO3(20%)⟶4Zn(NO3)2+N2O↑+5h3O{\displaystyle {\mathsf {4Zn+10HNO_{3}(20\%)\longrightarrow 4Zn(NO_{3})_{2}+N_{2}O\uparrow +5H_{2}O}}}
- 5Zn+12HNO3(10%)⟶5Zn(NO3)2+N2↑+6h3O{\displaystyle {\mathsf {5Zn+12HNO_{3}(10\%)\longrightarrow 5Zn(NO_{3})_{2}+N_{2}\uparrow +6H_{2}O}}}
- 4Zn+10HNO3(3%)⟶4Zn(NO3)2+Nh5NO3+3h3O{\displaystyle {\mathsf {4Zn+10HNO_{3}(3\%)\longrightarrow 4Zn(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
- увеличение концентрации кислоты ⇐NO2,NO,N2O,N2,Nh5NO3⇒{\displaystyle {\mathsf {\Leftarrow NO_{2},NO,N_{2}O,N_{2},NH_{4}NO_{3}\Rightarrow }}} увеличение активности металла
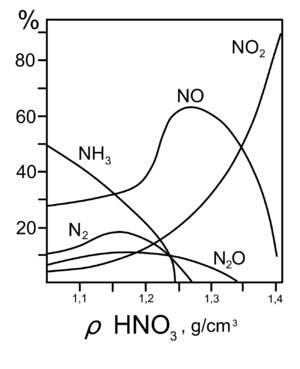 Продукты, полученные при взаимодействии железа с HNO3, разной концентрации
Продукты, полученные при взаимодействии железа с HNO3, разной концентрацииС золотом и платиной азотная кислота, даже концентрированная, не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
- Fe+4HNO3(25%)⟶Fe(NO3)3+NO↑+2h3O{\displaystyle {\mathsf {Fe+4HNO_{3}(25\%)\longrightarrow Fe(NO_{3})_{3}+NO\uparrow +2H_{2}O}}}
- 4Fe+10HNO3(2%)⟶4Fe(NO3)2+Nh5NO3+3h3O{\displaystyle {\mathsf {4Fe+10HNO_{3}(2\%)\longrightarrow 4Fe(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
- S+6HNO3(60%)⟶h3SO4+6NO2↑+2h3O{\displaystyle {\mathsf {S+6HNO_{3}(60\%)\longrightarrow H_{2}SO_{4}+6NO_{2}\uparrow +2H_{2}O}}}
- S+2HNO3(40%)⟶h3SO4+2NO↑{\displaystyle {\mathsf {S+2HNO_{3}(40\%)\longrightarrow H_{2}SO_{4}+2NO\uparrow }}}
- P+5HNO3(60%)⟶h4PO4+5NO2↑+h3O{\displaystyle {\mathsf {P+5HNO_{3}(60\%)\longrightarrow H_{3}PO_{4}+5NO_{2}\uparrow +H_{2}O}}}
- 3P+5HNO3(30%)+2h3O⟶3h4PO4+5NO↑{\displaystyle {\mathsf {3P+5HNO_{3}(30\%)+2H_{2}O\longrightarrow 3H_{3}PO_{4}+5NO\uparrow }}}
и сложные вещества, например:
- FeS+4HNO3(30%)⟶Fe(NO3)3+S+NO+2h3O{\displaystyle {\mathsf {FeS+4HNO_{3}(30\%)\longrightarrow Fe(NO_{3})_{3}+S+NO+2H_{2}O}}}
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
- 3HCl+HNO3⟶NOCl+2[Cl]↑+2h3O{\displaystyle {\mathsf {3HCl+HNO_{3}\longrightarrow NOCl+2[Cl]\uparrow +2H_{2}O}}}
- Au+HNO3+4HCl⟶H[AuCl4]+NO↑+2h3O{\displaystyle {\mathsf {Au+HNO_{3}+4HCl\longrightarrow H[AuCl_{4}]+NO\uparrow +2H_{2}O}}}
- 3Pt+4HNO3+18HCl⟶3h3[PtCl6]+4NO↑+8h3O{\displaystyle {\mathsf {3Pt+4HNO_{3}+18HCl\longrightarrow 3H_{2}[PtCl_{6}]+4NO\uparrow +8H_{2}O}}}
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы и некоторые соединения неметаллов, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния (исключая литий):
- 2KNO3→2KNO2+O2{\displaystyle {\mathsf {2KNO_{3}\rightarrow 2KNO_{2}+O_{2}}}}
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью (а также литий):
- 4Al(NO3)3→2Al2O3+12NO2+3O2{\displaystyle {\mathsf {4Al(NO_{3})_{3}\rightarrow 2Al_{2}O_{3}+12NO_{2}+3O_{2}}}}
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
- 2AgNO3→2Ag+2NO2+O2{\displaystyle {\mathsf {2AgNO_{3}\rightarrow 2Ag+2NO_{2}+O_{2}}}}
г) нитрат аммония:
- Nh5NO3→N2O+2h3O{\displaystyle {\mathsf {NH_{4}NO_{3}\rightarrow N_{2}O+2H_{2}O}}}
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
- Fe+3KNO3+2KOH→K2FeO4+3KNO2+h3O{\displaystyle {\mathsf {Fe+3KNO_{3}+2KOH\rightarrow K_{2}FeO_{4}+3KNO_{2}+H_{2}O}}}
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
- 3KNO3+8Al+5KOH+18h3O→3Nh4↑+8K[Al(OH)4]{\displaystyle {\mathsf {3KNO_{3}+8Al+5KOH+18H_{2}O\rightarrow 3NH_{3}\uparrow +8K[Al(OH)_{4}]}}}
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Исторические сведения
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
Во времена М. В. Ломоносова азотную кислоту называли крепкой водкой.
Промышленное производство, применение и действие на организм
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
- 4Nh4+5O2→Pt4NO+6h3O{\displaystyle {\mathsf {4NH_{3}+5O_{2}{\xrightarrow[{}]{Pt}}4NO+6H_{2}O}}}
- 2NO+O2→2NO2{\displaystyle {\mathsf {2NO+O_{2}\rightarrow 2NO_{2}}}}
- 4NO2+O2+2h3O→4HNO3{\displaystyle {\mathsf {4NO_{2}+O_{2}+2H_{2}O\rightarrow 4HNO_{3}}}}
Все три реакции — экзотермические, первая — необратимая, остальные — обратимые[4]. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется[5].
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
- 4KNO3+2FeSO4⋅7h3O→otFe2O3+2K2SO4+2HNO3↑+2NO2↑+6h3O{\displaystyle {\mathsf {4KNO_{3}+2FeSO_{4}\cdot 7H_{2}O{\xrightarrow[{}]{^{o}t}}Fe_{2}O_{3}+2K_{2}SO_{4}+2HNO_{3}\uparrow +2NO_{2}\uparrow +6H_{2}O}}}
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
- KNO3+h3SO4→otKHSO4+HNO3↑{\displaystyle {\mathsf {KNO_{3}+H_{2}SO_{4}{\xrightarrow[{}]{^{o}t}}KHSO_{4}+HNO_{3}\uparrow }}}
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Применение
Действие на организм


Азотная кислота ядовита. По степени воздействия на организм относится к веществам 3-го класса опасности. Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3[7]. Рейтинг NFPA 704 для концентрированной азотной кислоты: опасность для здоровья: 4, огнеопасность: 0, нестабильность: 0, специальное: Ox[8]
Юникод
В Юникоде есть алхимический символ азотной кислоты (лат. Aqua fortis).
| Графема | Unicode | HTML | |||
|---|---|---|---|---|---|
| Код | Название | Шестнадцатеричное | Десятичное | Мнемоника | |
wiki.sc
Кислоты азота — Справочник химика 21
Н. Шифрин рекомендует при сжигании в бомбе пользоваться в качестве катализатора каплей дымящей азотной кислоты, нанесенной на внешнюю стенку платиновой чашки с навеской продукта, так как есть указания, что содержащийся в кислоте азот способствует более полному окислению серы, находящейся в топливе, при сжигании последнего. [c.402]Этерификации Органические кислоты Сложные эфиры — 300 Качественный анализ кислот Азот, аргон гелий [c.177]
Во время приготовления смесей солей окислителей (соли кислородсодержащих кислот азота, хлора, перманганаты, дихроматы, пероксиды и др.) с мелкодисперсными веществами не растирайте их в ступке, а осторожно смешивайте стеклянной палочкой или шпателем на листке чистой гладкой бумаги. [c.9]
В составе органических оснований азот входит в структуры важнейших компонентов клеточного вещества — нуклеиновых кислот. Азот также является составной частью многих других биологически важных веществ растительного и животного мира — ферментов, гормонов, витаминов. [c.88]
Совершенно аналогично проявляются основные свойства аминов. При действии кислот азот аминогруппы присоединяет ион водорода и амины образуют соли замещенного аммония. Последние иногда изображают в виде молекулярных соединений амина и кислоты. Например [c.272]
При растворении меди в разбавленной азотной кислоте азот восстанавливается до моноксида азота, а медь окисляется до нитрата меди [c.107]
Опыты по исследованию эффективности пар дифференциальной аэрации проводятся при непрерывной подаче в ячейку газов кислорода и азота или только одного азота. Газы поступают из баллонов через редуктор в буферную емкость (стеклянную бутыль на 20 л), реометр для контроля скорости потока и систему поглотителей. Для очистки кислорода применяются растворы едкого бария и концентрированная сбр-ная кислота. Азот очищается раствором пирогаллола. [c.266]
На рис. 159 приведена энергетика образования кислот азота, фосфора в сопоставлении с оцененными величинами для его гомологов. [c.294]
Участвует ли в образовании азотной кислоты азот, содержащийся в топливе, достаточной ясности нет. Одно несомненно, что количество образующейся в бомбе азотной кислоты не зависит от содержания азота в сжигаемой навеске, [c.204]
Назовите кислородные кислоты азота. Охарактеризуйте их окислительно-восстановительные свойства. [c.227]
Адипиновая кислота Азот [c.120]
Органические производные кислот азота, в том числе содержащие другие главные группы могут быть названы с использованием префиксов, представленных в табл. 30. [c.182]
После введения навески и растворителя связывают верхний край шлифа сосуда минимальным количеством смазки она не должна попадать в отверстия крана. Соединяют реакционный сосуд с прибором. Через систему в течение 5 мии пропускают азот, высушенный концентрированной серной кислотой. Азот подводит через кран 5, находящийся в положении 5а (см. рис. 8.1), поддерживая уро-ис иь ртути в газовой бюретке возможно ближе к крану. Азот выходит через крап 2, установленный в положение 2а. По мере пропускания азота медленно понижают уровень ртути до начала шкалы и на кончик отводной трубки реакционного сосуда надевают пробку 3. Поворачивают кран 2 в положение 26 а кран 5 — в положение 56 и прекращают поток азота. [c.373]
Осветление Кислота азот- [c.266]
Большое значение в химии и технологии имеют кислородсодержащие кислоты азота — азотистая HN02 н азотная HNOз и нх соли. [c.407]
Азот. Анализ азота осуществляют чаще всего методом Кьельдаля [32], который состоит в превращении с помощью концентрированной серной кислоты азота в пробе угля в сульфат аммония и в последующем определении его по количеству образующегося аммиака. Существенные трудности этого анализа заключаются в способе озоления. Добавление тщательно подобранного катализатора к углю позволяет уменьшить продолжительность анализа и сделать реакцию более полной. Этот метод является стандартным во многих странах [18, 33]. Часто для ускорения анализа используют полумикрометоД Къельдаля, являющийся тоже стандартным [33], который позволяет обрабатывать навеску угля порядка 0,1 г. [c.49]
Производство сжиженного кислорода является важным направлением в перерабатывающей промышленности. В настоящее время в США его производится порядка 13 млн. т в год, из которых 70% идет на нужды сталелитейной промышленности, а еще 10% — на другие металлоплавильные производства. В 1982 г. по объему производства сжиженный кислород занимал четвертое место после серной кислоты, азота и аммиака [Ма1ра5,1984]. Основное количество сжиженного кислорода производится на тех же предприятиях, где он и потребляется. Некоторые сталелитейные производства потребляют до 1000 т сжиженного кислорода в день. С установок по сжижению жидкий кислород может транспортироваться по трубопроводам. Одна из английских установок, где получают сжиженный кислород, имеет разветвленную сеть трубопроводов с общей [c.443]
Азотная кислота (уд. вес 1.42). — Концентрированная азотная кислота (НМОз). Для удаления окислов азота пробарбатировать через кислоту азот до тех пор, пока раствор не обесцветится полностью. [c.31]
Азотная кислота — один из сильнейших окислителей, окисляет многие металлы и относительно легко — многие неметаллы например, серу — до Н2304 (при кипячении), фосфор — до Н3РО4, углерод — до СО2 и т, д. Иногда окислительно-аосста-новительный процесс экзотермичен и настолько бурно протекает, что происходит вспышка (скипидар в дымящей азотной кислоте). Азот в составе ЫОг может в зависимости от условий [c.130]
В азотной кислоте азот четырехвалешен, а степень окисления его равна (5+) — см, 6, гл. Ill, [c.302]
Даже М (II), Са (II), 5г (II) образуют с комплексонами хелатные комплексы высокой устойчивости Ве (II) — исключение. Координация комплексона осуществляется только через кислород, как с обычной карбоновой кислотой. Азот не координируется, поэтому вклад хелатного эффекта в химическую связь отсутствует и комплекс оказывается непрочным, легко гидролизуется, превращаясь в полимерный малорастворимый гидроксокомплексонат. Прич
www.chem21.info
Азотистая кислота. Химические и физические свойства
Азотистая кислота — это одноосновная слабая кислота, которая может существовать только в разбавленных водных растворах голубого цвета и в газовой форме. Соли данной кислоты называют азотистокислым или нитритами. Они токсичны и более устойчивы, чем сама кислота. Химическая формула данного вещества выглядит так: HNO2.
Физические свойства:
1. Молярная масса равна 47 г/моль.
2. Относительная молекулярная масса равна 27 а.е.м.
3. Плотность составляет 1,6.
4. Температура плавления равна 42 градусам.
5. Температура кипения равна 158 градусам.
Химические свойства азотистой кислоты
1. Если раствор с азотистой кислотой нагреть, то произойдет следующая химическая реакция:
3HNO2 (азотистая кислота) = HNO3 (кислота азотная) + 2NO (оксид азота, выделяется в виде газа)+ h3O (вода)
2. В водных растворах диссоциирует и легко вытесняется из солей более сильными кислотами:
h3SO4 (серная кислота) + 2NaNO2 (нитрит натрия) = Na2SO4 (сульфат натрия) + 2HNO2 (азотистая кислота)
3. Рассматриваемое нами вещество может проявлять как окислительные, так и восстановительные свойства. При воздействии на него более сильных окислителей (например: хлор, пероксид водорода h3O2, перманганат калия) окисляется до азотной кислоты (в некоторых случаях происходит образование соли азотной кислоты):
Восстановительные свойства:
HNO2 (азотистая кислота) + h3O2 (пероксид водорода) = HNO3 (азотная кислота) + h3O (вода)
HNO2 + Cl2 (хлор) + h3O (вода) = HNO3 (кислота азотная) + 2HCl (соляная кислота)
5HNO2 (азотистая кислота)+ 2HMnO4 = 2Mn(NO3)2 (нитрат марганца, соль азотной кислоты) + HNO3 (кислота азотная) + 3h3O (вода)
Окислительные свойства:
2HNO2 (азотистая кислота)+ 2HI = 2NO (оксид кислорода, в виде газа) + I2 (йод) + 2h3O (вода)
Получение азотистой кислоты
Данное вещество можно получить несколькими способами:
1. При растворении азота оксида (III) в воде:
N2O3 (оксид азота) + h3O (вода) = 2HNO3 (азотистая кислота)
2. При растворении азота оксида (IV) в воде:
2NO3 (оксид азота) + h3O (вода) = HNO3 (азотная кислота) + HNO2 (азотистая кислота)
Применение азотистой кислоты:
— диазотирование ароматических первичных аминов;
— производство солей диазония;
— в синтезе органических веществ (например, для производства органических красителей).
Воздействие азотистой кислоты на организм
Данное вещество токсично, обладает ярким мутагенным эффектом, так как по сути своей является деаминирующим агентом.
Что такое нитриты
Нитриты — это различные соли азотистой кислоты. К воздействию температур они менее устойчивы, чем нитраты. Необходимы при производстве некоторых красителей. Применяются в медицине.
Особенное значение приобрел для человека нитрит натрия. Это вещество имеет формулу NaNO2. Используется в качестве консерванта в пищевой промышленности при производстве изделий из рыбы и мяса. Представляет собой порошок чистого белого или слегка желтоватого цвета. Нитрит натрия гигроскопичен (исключение составляет очищенный нитрит натрия) и хорошо растворяется в h3O (воде). На воздухе способен постепенно окислиться до нитрата натрия, имеет сильные восстановительные свойства.
Натрия нитрит применяется в:
— химическом синтезе: для получения диазо-аминных соединений, для дезактивирования избытка натрия азида, для получения кислорода, натрия оксида и натрия азота, для поглощения углекислого газа;
— в производстве пищевых продуктов (пищевая добавка Е250): в качестве антиокислителя и антибактериального агента;
— в строительстве: в качестве противоморозной добавки к бетону в изготовлении конструкций и строительных изделий, в синтезе органических веществ, в роли ингибитора коррозии атмосферной, в производстве каучуков, попперсов, раствора добавки для взрывчатых веществ; при обработке металла для снятия слоя олова и при фосфатировании;
— в фотографии: как антиокислитель и реагент;
— в биологии и медицине: сосудорасширяющее, спазмолитическое, слабительное, бронхолитическое; как антидот при отравлении животного или человека цианидами.
В настоящее время также используются и другие соли азотистой кислоты (например, нитрит калия).
fb.ru

