Закон сохранения массы. Движение. Теплота
Читайте также
Глава 10 ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА
Глава 10 ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА § 1. Третий закон Ньютона§ 2. Закон сохранения импульса§3. Импульс все-таки сохраняется§ 4. Импульс и энергия§ 5. Релятивистский импульс§ 1. Третий закон НьютонаВторой закон Ньютона, который связывает ускорение любого тела с действующей на
Сохранение массы
Сохранение массы При рассмотрении импульса мы имели дело с тремя величинами: скоростью, массой и их произведением, т. е. самим импульсом.С точки зрения сохранения мы рассмотрели две из них: импульс, который сохраняется, и скорость, которая не сохраняется. А что происходит
Несохранение массы
Несохранение массы
Новое представление о строении атома укрепило уверенность физиков в том, что законы сохранения применимы не только к окружающему нас повседневному миру, но и к тому огромному миру, который изучают астрономы.
Закон сохранения массы и энергии
Закон сохранения массы и энергии В ядерных реакциях изменения энергии столь значительны, что эквивалентностью массы и энергии уже нельзя пренебречь. Если следить за изменением одной только массы, кажется, что закон сохранения нарушается.Чтобы убедиться в этом,
ИСТОРИЯ ПРИНЦИПОВ СОХРАНЕНИЯ
ИСТОРИЯ ПРИНЦИПОВ СОХРАНЕНИЯ Современный историк механики не случайно начинает свою общую характеристику развития механики в XVII в. со следующего положения: «От ожерелья, надетого на наклонную плоскость, до первой подлинно математической физики мировой системы, через
2.1. Поиск общей причины неудач с ppm. «Закон сохранения силы»
2.1. Поиск общей причины неудач с ppm. «Закон сохранения силы»
Последние два века описанного в гл. 1 периода истории ppm (XVII и XVIII вв.) характерны тем, что многие даже достаточно серьезные ученые верили, в то, что вечный двигатель можно создать. Даже постоянные неудачи
«Закон сохранения силы»
Последние два века описанного в гл. 1 периода истории ppm (XVII и XVIII вв.) характерны тем, что многие даже достаточно серьезные ученые верили, в то, что вечный двигатель можно создать. Даже постоянные неудачиIII. Закон взаимосвязи массы и энергии
III. Закон взаимосвязи массы и энергии 1. Формула Эйнштейна.Мы знаем, что существует закон сохранения массы: «Ничто в природе не пропадает бесследно и не создается из ничего, все превращается». С другой стороны, известно, что есть закон сохранения энергии. Энергия
Законы сохранения в СТО
Законы сохранения в СТО Как выводились законы сохранения и строились сохраняющиеся величины в дорелятивистской механике и электродинамике до появления СТО? Преобразованиями в уравнениях движения частиц, механических систем, уравнений поля выделялись специальные
СОХРАНЕНИЕ МАССЫ И ЭНЕРГИИ
СОХРАНЕНИЕ МАССЫ И ЭНЕРГИИ
1. 2. Существуют два принципа, ставшие краеугольными камнями здания современной науки. Первый принцип материя не создается и не уничтожается и лишь переходит из одного вида в другой был высказан в XVIII веке и знаком каждому изучающему химию; он
2. Существуют два принципа, ставшие краеугольными камнями здания современной науки. Первый принцип материя не создается и не уничтожается и лишь переходит из одного вида в другой был высказан в XVIII веке и знаком каждому изучающему химию; он
ЭКВИВАЛЕНТНОСТЬ МАССЫ И ЭНЕРГИИ
ЭКВИВАЛЕНТНОСТЬ МАССЫ И ЭНЕРГИИ 1.4. Один из выводов, полученных на довольно ранней стадии развития теории относительности, состоял в том, что инертная масса движущегося тела увеличивается с возрастанием его скорости. Это означало эквивалентность изменения энергии
IV. Законы сохранения
IV. Законы сохранения Отдача Даже тот, кто не был на войне, знает, что при выстреле из орудия его ствол резко отходит назад. При стрельбе из ружья происходит отдача в плечо. Но и не прибегая к огнестрельному оружию, можно ознакомиться с явлением отдачи. Налейте в пробирку
Налейте в пробиркуЗакон сохранения импульса
Закон сохранения импульса Произведение массы тела на его скорость называется импульсом тела (другое название – количество движения). Так как скорость – вектор, то и импульс является векторной величиной. Разумеется, направление импульса совпадает с направлением
Закон сохранения механической энергии
Закон сохранения механической энергии Мы убедились на только что рассмотренных примерах, как полезно знать величину, не изменяющую свое численное значение (сохраняющуюся) при движении.Пока мы знаем такую величину лишь для одного тела. А если в поле тяжести движется
Закон сохранения вращательного момента
Закон сохранения вращательного момента
Если связать два камня веревкой и с силой бросить один из них, то второй камень полетит вдогонку за первым на натянутой веревке. Один камень будет обгонять второй, перемещение вперед будет сопровождаться вращением.Забудем про поле
Один камень будет обгонять второй, перемещение вперед будет сопровождаться вращением.Забудем про поле
3.9. Массы и плотности астероидов
3.9. Массы и плотности астероидов Поскольку энергия, выделяющаяся при столкновении тела с Землей, пропорциональна массе тела, получение оценки массы является необходимым элементом оценивания угрозы со стороны каждого потенциально опасного тела.Масса m, объем v и средняя
Эпилог Конструкция массы
Эпилог Конструкция массы Из чего сделан мир?В середине 1930-х мы могли бы сказать, что вся материальная субстанция в мире состоит из химических элементов, а каждый элемент состоит из атомов. Каждый атом, в свою очередь, состоит из ядра, а ядро – из разного числа положительно
Материалы урока по теме «Закон сохранения массы веществ» 8 класс.

Тема урока: «Закон сохранения массы веществ. Уравнения химических реакций»
Класс: 8
Тип урока: изучение нового материала.
Цели урока:
Обучающие: ознакомить учащихся с формулировкой закона сохранения массы веществ при химических реакциях и на основе этого закона сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ, сформировать умение составлять уравнения химических реакций, расставлять коэффициенты в УХР.
Развивающие: развитие памяти, внимания учащихся, умения сравнивать и анализировать.
Воспитательные: воспитание коммуникативных способностей учащихся, трудолюбия, умения слушать и слышать.
Оборудование: интерактивная доска, компьютер; раствор хлорида меди (II), 10 % раствор гидроксида натрия, весы, разновесы, круглый подъемный столик.
.
Ресурсы: видеофрагмент «Закон сохранения массы веществ при химических реакциях» (модель М.В. Ломоносова).
Интернет-ресурсы: http://school-collection.edu.ru/
Литература:
Новошинский И.И., Новошинская Н.С. Химия. 8 класс: учеб. для общеобразоват. учреждений. – 4-е изд., перераб.– М: ООО «ТИД «Русское слово – РС», 2009. – 224 с.: ил.
Новошинский И.И., Новошинская Н.С. Текущий и итоговый контроль по курсу «Химия. 8класс» / И.И. Новошинский, Н.С. Новошинская.– М: ООО «Русское слово – учебник», 2013. – 136 с.
Ход урока
Организационный момент.
Приветствие учащихся. Акцентируется внимание о том, что продолжается изучение раздела «Химические реакции», по окончании изучения которого будет проверочная работа.
Проверка домашнего задания
А) Письменная работа у доски (один уч-ся у доски выполняет задачу № 4 В. 16. Р.II.).
16. Р.II.).
Б) Устный опрос
— Дома, вы должны были привести примеры химических реакций с которыми вы сталкивались в быту и по каким признакам вы определили, что произошла химическая реакция? (скисание молока, гниение яичного белка, горение метана в газовых плитах, старение вин, выведение цветных пятен с помощью отбеливателей).
В) Самопроверка по эталону (слайд 2.)
Задание № 1,2 с. 99.
Вопрос в ходе выполнения задания №2:
— Что такое химические свойства вещества? (способность вещества превращаться в другое вещество, эти свойства проявляются в химических реакциях).
Оцените свою работу дома, на полях поставьте отметку (критерии помним: все задание выполнено самостоятельно и правильно – 5, одна ошибка -4, две ошибки -3).
— кто поставил — 5? -4? -3? А есть кто допустил более двух ошибок?
Актуализация знаний учащихся.
 Целеполагание.
Целеполагание.
Фронтальный опрос:
Какие изменения могут происходить с веществами?
Объясните суть физического явления?
Назовите признаки по которым ХР можно отличить от физического явления?
Что будет являться условием возникновения реакции горения? А условием протекания? (постоянный приток воздуха, если приток воздуха прекратить, то горение тоже прекратится, т.к. вещество перестанет соприкасаться с кислородом). А если, н.р., химическая реакция идет с поглощением теплоты, то условием протекания реакции будет являться постоянный приток тепла (энергии), т.е. необходимо нагревание на протяжении всей реакции).
Какие условия течения химических реакций вам еще известны?
Чем отличаются изменения, происходящие с веществами при химических реакциях от изменений, происходящие при физических явлениях (вещества распадаются на атомы в химических реакциях).

Как мы обозначаем состав вещества? (ХФ выражает качественный и количественный состав вещесва).
Индекс? (число атомов в формульной единице вещества). Коэффициент? (число молекул).
А реакцию можно обозначить? (химическую реакцию мы научимся выражать с помощью уравнений).
— Сегодня на уроке мы узнаем, что происходит с атомами в химических реакциях, познакомимся с законом сохранения массы веществ, научимся на основе данного закона составлять УХР (т.е. графически обозначать реакцию).
Тему урока уч-ся записывают в тетрадь, учитель на доске. (слайд 3.)
План нашей работы следующий (слайд 4.):
Ознакомиться с формулировкой закона сохранения массы веществ при химических реакциях.
На основе этого закона сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ.

Научиться составлять уравнения химических реакций.
Изучение нового материала.
А) Беседа.
— Мы с Вами живем в нашей стране по Основному Закону – Конституции. Слышим о законах по телевизору, радио, сетуем, что не все законы выполняются, некоторые нарушаются. Но закон о котором пойдет речь сегодня на уроке нельзя нарушить. Этот закон имеет исключительное значение для химии, он является следствием всеобщего естественного закона сохранения материи и энергии.
Б) Демонстрационный эксперимент: «Взаимодействие раствора хлорида меди (II) с раствором гидроксида натрия». Следует соблюдать правила обращения со стеклянной посудой.
В течении многих лет люди верили в то, что вещество может исчезнуть бесследно, а также возникнуть из ничего. Нам сейчас предстоит опровергнуть или доказать это житейское утверждение.
Чтобы ответить на вопрос, выполним задание, следуя инструкции (слайд 5.).
Инструкция:
Взять стаканчик с раствором хлорида меди (II)и стаканчикс раствором гидроксида натрия, взвесить их на весах (охарактеризовать внешний вид веществ). Записать массу на доске. После этого смешать растворы. Что при этом наблюдаем? (отметить как протекает химическая реакция, охарактеризовать внешний вид образовавшихся продуктов).
Вопросы для учащихся:
— Какие признаки химической реакции вы наблюдаете?
— Что происходит с веществами, которые вступают в реакцию? (состав вещества изменяется — вещества распадаются на атомы, из которых образуются новые вещества).
Снова всё взвесить.
В ходе опыта уч-ся — помощники заполняют на интерактивной доске:
Масса вступивших в реакцию веществ =
Масса образовавшихся веществ =
Какой можно сделать вывод?
Равна ли масса образовавшихся веществ массе веществ, вступивших в реакцию?
Вывод: масса вступивших в реакцию веществ равна массе, образовавшихся веществ, так звучит современная формулировка закона сохранения массы веществ.
В) Слово учителя: в истории развития науки к такому выводу пришли не сразу. Первоначально мысль о сохранении вещества и энергии была высказана древнегреческими материалистами – Демокритом (460- 370 лет до н.э.). Согласно Демокриту материя состоит из бесчисленного множества мельчайших неделимых частиц («неделимые» по-гречески «атом»), которые соединяясь и разъединяясь, образуют все бесчисленное разнообразие вещей в природе. Затем почти на 20 веков об этом забыли.
Лишь в 1748 году русский ученый М.В. Ломоносов сформулировал закон, который мы с вами озвучили. Экспериментально доказал его в 1756 г.
— Найдите в тексте параграфа на с. 100 формулировку закона, как она звучала 250 лет назад.
Вопрос уч-ся:
— Не противоречит ли закону сохранения массы веществ уменьшение свечи при ее горении?
— Как можно поставить опыт с горящей свечой для подтверждения закона?
Уч-ся высказывают свои точки зрения. Подтвердить правильность версии поможет просмотр видеофрагмента «Закон сохранения массы веществ при химических реакциях» (модель М.В. Ломоносова) (слайд 6.).
Подтвердить правильность версии поможет просмотр видеофрагмента «Закон сохранения массы веществ при химических реакциях» (модель М.В. Ломоносова) (слайд 6.).
— Мы с вами раскрыли ошибку, допущенную англ.химиком Р.Бойлем (сдайд 7.), который прокаливал в открытой реторте (стеклянный сосуд) различные металлы и взвешивал их до и после нагревания. Он обнаружил, что масса металлов увеличивается. Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в результате химической реакции изменяется. Р.Бойль утверждал, что существует какая-то «огненная материя» (флогистон), которая в случае нагревания металла соединяется с металлом, увеличивая массу. Лишь спустя 100 лет Ломоносов скажет «Мнение славного Роберта Бойля ложно». Он проводил те же опыты по прокаливанию металлов, лишь с одним отличием, каким?
Аналогичные выводы на основе экспериментов по прокаливанию металлов сделал в 1777 г. и Антуан Лавуазье, который после открытия в 1774 г Д. Пристли кислорода, знал качественный и количественный состав воздуха.
и Антуан Лавуазье, который после открытия в 1774 г Д. Пристли кислорода, знал качественный и количественный состав воздуха.
Подведем итог нашей беседы: (слайд 8.)
Атомы в химических реакциях не исчезают бесследно и не возникают из ничего.
Сущность химической реакции заключается в перегруппировке атомов.
На основе закона составляют УХР и производят расчеты по ним.
ФИЗКУЛЬТМИНИТКА.
Г) Работа с рисунком (слайд 9.)
— Что происходит с веществами в химических реакциях?
— Образовавшиеся вещества (их называют продуктами реакции) состоят из тех же атомов, что и исходные вещества (их называют реагентами)? (в химических реакциях атомы не исчезают и не возникают, общее число атомов не изменяется, а происходит лишь их перегруппировка).
— Каждый атом имеет строго определенную массу?
— Масса исходных веществ будет равна продуктов реакции?
— Соблюдается закон сохранения массы веществ?
На основе закона составляются уравнения химических реакций, сегодня мы научимся выражать химическую реакцию с помощью уравнения (слайд 10.).
Уравнения химических реакций (УХР) составляются на основании следствия из закона сохранения массы веществ: число атомов каждого химического элемента в левой части должно быть равно числу атомов тех же элементов в правой части. Для этого перед ХФ веществ в УХР ставят коэффициенты.
Учитель на интерактивной доске дописывает коэффициенты:
Итог работы:
Сущность закона сохранения массы веществ (масса вступивших веществ в реакцию равна массе веществ образованных).
Уравнение реакции отражает материальный баланс вступивших в реакцию веществ (реагентов) и образовавшихся продуктов. Как составить материальный баланс химических реакций на основе закона сохранения массы мы будем изучать через два урока.
Как составить материальный баланс химических реакций на основе закона сохранения массы мы будем изучать через два урока.
Д) Слово учителя:
Процесс составления УХР состоит из двух этапов (слайд 11.):
Составление схемы реакции. Схема реакции показывает какие вещества вступили в реакцию и какие образовались в результате. Обратить внимание, что молекулы простых газообразных веществ почти всегда состоят из двух атомов (О2).
Подбор коэффициентов к формулам веществ. Число атомов каждого химического элемента в левой части должно быть равно числу атомов тех же элементов в правой части.
Задание (слайд 12.): Составьте уравнение химической реакции (УХР), протекающей при взаимодействии алюминия с кислородом (учитель работает у интерактивной доски).
Решение:
Составим схему реакции.
 Для этого в левой части запишем формулы исходных веществ ( Al и О2), соединим их знаком плюс, а затем поставим стрелку (→):
Для этого в левой части запишем формулы исходных веществ ( Al и О2), соединим их знаком плюс, а затем поставим стрелку (→):
Al + О2 →
В правой части (после стрелки) запишем формулу продукта реакции:
Al + О2 → Al2О3
реагенты продукты
Подберем коэффициенты к формулам веществ. Число атомов кислорода в правой части схемы нечетное, а в левой – четное, поэтому перед формулой оксида алюминия ставим коэффициент 2: Al + О2 → 2 Al2О3
В правой части схемы стало четыре атома алюминия, а в левой- только один. Следовательно, чтобы уравнять число атомов алюминия, надо перед его формулой в левой части поставить коэффициент 4: 4 Al + О2 → 2 Al2О3
Теперь число атомов алюминия в обеих частях схемы одинаково. Но в правой части схемы шесть атомов кислорода, а в левой – только два. Для уравнивания числа атомов кислорода нужно в левой части перед формулой кислорода поставить коэффициент 3:
Но в правой части схемы шесть атомов кислорода, а в левой – только два. Для уравнивания числа атомов кислорода нужно в левой части перед формулой кислорода поставить коэффициент 3:
4 Al + 3 О2 → 2 Al2О3
Число атомов каждого химического элемента в левой части стало равно числу атомов в правой части, значит, стрелку в схеме заменяем знаком равенства:
4 Al + 3 О2 = 2 Al2О3
Это УХР, из которого следует, что при взаимодействии четырех атомов алюминия и трех молекул кислорода О2, образуется две молекулы оксида алюминия Al2О3.
Первичное закрепление.
А) — Составим уравнение химической реакции, которую мы проводили в ходе демонстрационного эксперимента «Взаимодействие раствора хлорида меди (II) с раствором гидроксида натрия» (слайд 13. ):
):
хлорид меди (II) + гидроксид натрия → гидроксид меди (II) + хлорид натрия
У доски работает сильный учащийся.
Учитель помогает: составляем схему уравнения с помощью ХФ. Обратить внимание
на вещество Cu(ОН)2, найти его в таблице растворимости – оно не растворимо, т.е. выпадает в осадок, в УХР справа от формулы осадка ставят стрелку, направленную вниз (↓), если же образуется газ, то справа от формулы газа ставят стрелку, направленную вверх (↑). Подбираем коэффициенты начиная с наиболее сложного по составу вещества — CuСl2. В составе этого вещества два атома меди, а в составе NаСl — один атом. Следовательно, перед формулой NаСl надо поставить коэффициент – 2:
CuСl2 + NаOН → Cu(ОН)2 ↓ + 2 NаСl
Затем уравниваем число атомов натрия, перед формулой NаОН ставим коэффициент – 2:. CuСl2 + 2 NаOН → Cu(ОН)2 ↓ + 2 NаСl
Сравнив число атомов водорода и кислорода в левой и правой частях схемы, устанавливаем, что оно одинаково, поэтому заменяем стрелку в схеме заменяем знаком равенства: CuСl2 + 2 NаOН = Cu(ОН)2 ↓ + 2 NаСl
Б) Сравните две записи, найдите отличия (слайд 14. ):
):
2 H2 + O2 = 2 H2O 2) H2 + O2 → H2O
УХР – выражает качественную Схема реакции – выражает только
и количественную сторону реакции качественную сторону реакции
— Какая запись не соответствует закону сохранения массы веществ? Будьте внимательны, такой вопрос в домашнем задании.
В) Самостоятельная работа (слайд 15.):
1. Расставьте коэффициенты в схемах химических реакций:
Са + O2 → СаО
Fe + Cl2 → FeCl3
Na2O + НCl → NaCl + Н2O
NО2 → NО + O2
2. Составьте УХР по следующей схеме:
Гидроксил железа (II) + соляная кислота → хлорид железа (II) + вода
Взаимопроверка по образцу (Слайд 16.).
Оцените работу соседа по парте, поставьте отметку (критерии помним: все задание выполнено самостоятельно и правильно – 5, одна ошибка -4, две ошибки -3).
— кто поставил — 5? -4? -3? А есть кто допустил более двух ошибок?
Итог урока. Рефлексия.
А) Пояснение к домашнему заданию:
§ 29 изучить, з. 1,2. (Слайд 17.)
Б) Итог урока (слайд 18).
1.) Кто сформулировал и экспериментально доказал закон сохранения массы веществ:
А) М.В. Ломоносов Б) Р. Бойль В) А. Лавуазье
2) Установите правильную последовательность.
Закон сохранения массы веществ:
— массе веществ,
масса веществ
в результате ее
вступивших в реакцию,
образовавшихся
— равна
масса вступивших в реакцию веществ равна массе, образовавшихся веществ
3). Условная запись химической реакции это-
Условная запись химической реакции это-
А. химическая формула
Б. коэффициент
В. химическое уравнение
Г. индекс
— Что было самым сложным?
— Оцените свое состояние, используя следующую анкету (слайд 19.):
1. На уроке я работал активно / пассивно
2. Своей работой на уроке я доволен / не доволен
3. Урок для меня показался коротким / длинным
4. За урок я не устал /устал
5. Мое настроение стало лучше / стало хуже
6. Материал урока мне был понятен / не понятен
полезен / бесполезен
интересен / скучен
7. Домашнее задание мне кажется легким / трудным
интересным / не интересным
— Кто был самым активным сегодня на уроке?
— Спасибо всем за плодотворную работу на уроке. Отметки за урок.
Отметки за урок.
Закон сохранения массы
ЗАКОН СОХРАНЕНИЯ МАССЫ. Принцип классической механики, устанавливающий, что масса не может создаваться или исчезать, а может только переноситься из одного объема в другой. В метеорологии выражением 3. С. М. является уравнение неразрывности.[ …]
Закон сохранения массы: сумма массы вещества системы и массы эквивалентной энергии, полученной или отданной той же системой, постоянна. Первоначальная формулировка этого закона — масса (вес) веществ до химической реакции равна массе (весу) веществ после химической реакции, а более расширительно — масса поступающего в систему вещества минус масса выходящего из системы вещества равна массе накапливаемого в системе вещества. Если накопления или убывания вещества в системе не наблюдается, она находится в устойчивом, гомеостатическом состоянии. Близкий к этому закон сохранения энергии, или первый принцип (закон, начало) термодинамики, гласит: любые изменения в изолированной системе оставляют ее общую энергию постоянной; или: при всех макроскопических процессах энергия не создается и не исчезает, а лишь переходит из одной формы в другую. [ …]
[ …]
Действие закона внутреннего динамического равновесия совершенно четко связано с законом однонаправленности потока энергии. Именно ограниченность этого потока и специфические свойства формируют всю массу связей в экосистеме в их разнообразии. Поэтому и соблюдается экологический аналог законов сохранения массы и энергии (разд.[ …]
В соответствии с законом сохранения массы (вещества) при любом физическом или химическом изменении вещество не возникает и не исчезает, но лишь изменяет свое физическое или химическое состояние. За длительное время установились, причем в очень узких диапазонах, значения параметров окружающей среды, при которых существует жизнь. Мы привыкли говорить о потреблении или расходовании ресурсов. Но мы не потребляем вещество, а только временно пользуемся какими-то видами ресурсов Земли, перемещая их, превращая в продукты или полезные товары. Все, что выброшено, остается с нами.[ …]
Данный принцип гармонирует с законом сохранения массы. Так как атомы не возникают, не исчезают и не превращаются один в другой, они могут использоваться бесконечно в самых различных химических соединениях, и запас их практически неограничен. Именно это и происходит в природных экосистемах.[ …]
Именно это и происходит в природных экосистемах.[ …]
Уравнение неразрывности, как известно, выражает закон сохранения массы. В нем представлена связь распределения удельного количества движения и изменения плотности жидкости. Получим его применительно к поставленной ранее задаче.[ …]
Действительно, уже 200 лет назад был сформулирован закон сохранения массы, но человек и по сей день действует так, будто масса непрерывно возникает в одном месте и бесследно исчезает в другом.[ …]
Смысл первого принципа очевиден, а смысл второго, выражающего по существу законы сохранения массы и энергии, заключается в том, что необходимо анализировать результаты наших предполагаемых конкретных действий до того, как с их помощью достигнуты желаемые цели. В третьем принципе содержится напоминание о том, насколько взаимосвязаны наша экономическая и социальная деятельность и состояние окружающей среды как элементы одной системы.[ …]
При рассмотрении вопроса с количественной точки зрения исследователи опираются прежде всего на известные законы сохранения массы, количества движения, энергии. Для замыкания системы уравнений используются определенные гипотезы и упрощения. Существующие количественные методы прогноза можно представить в виде табл. 9.1.[ …]
Для замыкания системы уравнений используются определенные гипотезы и упрощения. Существующие количественные методы прогноза можно представить в виде табл. 9.1.[ …]
Очевидно, что при любых изменениях состояния потоков в элементе ХТС, ее подсистеме или ХТС в целом должны соблюдаться законы сохранения массы и энергии.[ …]
Принципиальная позиция автора состоит в том, что инженерная и санитарная охрана окружающей среды основаны на фундаментальном законе экологии — законе лимитирующего фактора, значимость которого сопоставима со значимостью таких фундаментальных законов физики, как закон сохранения массы и второе начало термодинамики.[ …]
Закономерности процессов преобразования веществ в пищевых целях в водной, воздушной средах подчиняются фундаментальным законам физики1 — закону сохранения массы и второму началу термодинамики (сохранение энергии).[ …]
Неотложной является задача объединения теплофизического и гидромеханического подходов. Таким образом в модели будут использоваться три закона сохранения: массы, количества движения и энергии. Один из вариантов такого подхода рассматривается далее в разд. 9.2.[ …]
Один из вариантов такого подхода рассматривается далее в разд. 9.2.[ …]
Балансовые уравнения в экологии, описывающие движение потоков биомассы и энергии между основными компонентами наземных систем, опираются на законы сохранения массы и энергии. Схематично потоки массы и энергии изображены на рис. 4.[ …]
В общем случае этот блок модели представляет собой полную систему нестационарных уравнений Навье — Стокса распределения газа в поле силы тяжести, которые отражают закон сохранения массы, импульса и энергии. Приведем общий вид этой системы без комментариев.[ …]
В заключение этого раздела отметим, что справедливость равенств (5.3.5) обеспечивается справедливостью равенств (5.2.5) и (5.3.1). Последнее равенство является прямым следствием уравнения неразрывности (2.5.14) из дискретной модели (см. гл. 2). Этим самым выполнение законов сохранения для дискретных моделей экосистем является следствием требований, сформулированных в виде равенств (5.2.5), и согласованности дискретных моделей экосистем с дискретными моделями гидротермодинамики, для котоых имеет место дискретный аналог закона сохранения массы воды. [ …]
[ …]
Вопреки всем данным науки некоторые люди свято верят в «безотходное» производство, полагая, что именно так работают экосистемы. То, что это не так, хорошо известно и наглядно иллюстрируется накоплением биогенных геологических пород. Собственно, вся стратисфера планеты пронизана «отходами» биотических процессов. Последние лишь полузамкнуты, иногда в высокой, но не в абсолютной степени. В случае же хозяйственной деятельности существует мало осознаваемый закон неустранимости отходов и ¡или побочных воздействий производства (хозяйства): в любом хозяйственном цикле образующиеся отходы и возникающие побочные эффекты неустранимы, они могут быть лишь переведены из одной физикохимической формы в другую или перемещены в пространстве. Если бы была реальная возможность избавиться от отходов, это было бы нарушением законов сохранения массы и энергии (разд. 3.2.3.). Суммарное количество отходов в виде вещества, энергии и побочных эффектов (изменения динамических качеств природных систем — их устойчивости, надежности и т. п.) фактически постоянно: в производственных циклах меняется лишь место их возникновения, время образования и физико-химическая или биологическая форма. Поэтому закон неустранимости отходов может быть дополнен законом постоянства количества отходов в технологических цепях.[ …]
п.) фактически постоянно: в производственных циклах меняется лишь место их возникновения, время образования и физико-химическая или биологическая форма. Поэтому закон неустранимости отходов может быть дополнен законом постоянства количества отходов в технологических цепях.[ …]
Не боясь повториться, отметим, что моделирование экосистем больших стратифицированных озер требует применения трехмерных моделей ввиду огромного разнообразия гидрофизических условий в водоеме, связанного именно с большими размерами водоема. Эти модели должны воспроизводить процессы трансформации органического вещества и биогенов, перенос, седиментацию и турбулентную диффузию субстанций. Важным свойством моделей экосистем является выполнение для них закона сохранения веществ при отсутствии источников и стоков или законов изменения, если есть обмен веществом на границах водоема. Выполнение законов сохранения обеспечивается, с одной стороны, согласованностью моделей экосистем с моделями гидродинамики водоема, для которых выполняется закон сохранения массы воды, с другой — соответствующей требованию консервативности конструкцией операторов, описывающих трансформацию органического вещества и биогенов. [ …]
[ …]
Анализ аварийных и поставарийных ситуаций, связанных с загрязнением окружающей среды (ОС), в значтельной мере опирается на математическое моделирование переноса поллютантов (загрязнителей) в разных естественных средах. Для прогноза поведения поллютантов в ОС в настоящее время привлекают разнообразные модели переноса поллютантов (модели поллютантности). В последние годы все более широкое использование находят аэро- и гидродинамические модели поллютантности, основанные на фундаментальных законах сохранения массы, количества движения и энергии [1-3]. В то же время нельзя не отметить, что подобные модели требуют большого объема исходной информации, значительных затрат машинного времени при проведении расчетов по этим моделям на ЭВМ, однако они не гарантируют высокой точности прогноза.[ …]
Закон сохранения импульса — опредление, формулы, формулировка
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат
(в правом нижнем углу экрана).
Импульс: что это такое
Как-то раз Рене Декарт (это который придумал ту самую декартову систему координат) решил, что каждый раз считать силу, чтобы описать процессы — как-то лень и сложно.
Для этого нужно ускорение, а оно не всегда очевидно. Тогда он придумал такую величину, как импульс. Импульс можно охарактеризовать, как количество движения — это произведение массы на скорость.
Импульс тела p — импульс тела [кг · м/с] m — масса тела [кг] v — скорость [м/с] |
Закон сохранения импульса
В физике и правда ничего не исчезает и не появляется из ниоткуда. Импульс — не исключение. В замкнутой изолированной системе (это та, в которой тела взаимодействуют только друг с другом) закон сохранения импульса звучит так:
Закон сохранения импульса
|
А выглядит — вот так:
Закон сохранения импульса
|
Простая задачка
Мальчик массой m = 45 кг плыл на лодке массой M = 270 кг в озере и решил искупаться. Остановил лодку (совсем остановил, чтобы она не двигалась) и спрыгнул с нее с горизонтально направленной скоростью 3 м/с. С какой скоростью станет двигаться лодка?
Остановил лодку (совсем остановил, чтобы она не двигалась) и спрыгнул с нее с горизонтально направленной скоростью 3 м/с. С какой скоростью станет двигаться лодка?
Решение:
Запишем закон сохранения импульса для данного процесса.
— это импульс системы мальчик + лодка до того, как мальчик спрыгнул,
— это импульс мальчика после прыжка,
— это импульс лодки после прыжка.
Изобразим на рисунке, что происходило до и после прыжка.
Если мы спроецируем импульсы на ось х, то закон сохранения импульса примет вид
Подставим формулу импульса.
, где:
— масса мальчика [кг]
— скорость мальчика после прыжка [м/с]
— масса лодки [кг]
— скорость лодки после прыжка [м/с]
Выразим скорость лодки :
Подставим значения:
м/с
Ответ: скорость лодки после прыжка равна 0,5 м/с
Задачка посложнее
Тело массы m1 = 800 г движется со скоростью v1 = 3 м/с по гладкой горизонтальной поверхности. Навстречу ему движется тело массы m2 = 200 г со скоростью v2 = 13 м/с. Происходит абсолютно неупругий удар (тела слипаются). Найти скорость тел после удара.
Навстречу ему движется тело массы m2 = 200 г со скоростью v2 = 13 м/с. Происходит абсолютно неупругий удар (тела слипаются). Найти скорость тел после удара.
Решение: Для данной системы выполняется закон сохранения импульса:
Импульс системы до удара — это сумма импульсов тел, а после удара — импульс «получившегося» в результате удара тела.
Спроецируем импульсы на ось х:
После неупругого удара получилось одно тело массы , которое движется с искомой скоростью:
Отсюда находим скорость тела, образовавшегося после удара:
Переводим массу в килограммы и подставляем значения:
м/с
В результате мы получили отрицательное значение скорости. Это значит, что в самом начале на рисунке мы направили скорость после удара неправильно.
Знак минус указывает на то, что слипшиеся тела двигаются в сторону, противоположную оси X. Это никак не влияет на получившееся значение.
Это никак не влияет на получившееся значение.
Ответ: скорость системы тел после соударения равна v = 0,2 м/с.
Второй закон Ньютона в импульсной форме
Второй закон Ньютона в импульсной форме можно получить следующим образом. Пусть для определенности векторы скоростей тела и вектор силы направлены вдоль одной прямой линии, т. е. движение прямолинейное.
Запишем второй закон Ньютона, спроецированный на ось х, сонаправленную с направлением движения и ускорением:
Применим выражение для ускорения
В этих уравнениях слева находится величина a. Так как левые части уравнений равны, можно приравнять правые их части
Полученное выражение является пропорцией. Применив основное свойство пропорции, получим такое выражение:
В правой части находится — это разница между конечной и начальной скоростью.
Преобразуем правую часть
Раскрыв скобки, получим
Заменим произведение массы и скорости на импульс:
Подставляем:
Или, сокращенно:
То есть, вектор – это вектор изменения импульса .
Тогда второй закон Ньютона в импульсной форме запишем так
Вернемся к векторной форме, чтобы данное выражение было справедливо для любого направления вектора ускорения.
Задачка про белку отлично описывает смысл второго закона Ньютона в импульсной форме Белка с полными лапками орехов сидит на гладком горизонтальном столе. И вот кто-то бесцеремонно толкает ее к краю стола. Белка понимает законы Ньютона и предотвращает падение. Но как? |
Решение:
Чтобы к белке приложить силу, которая будет толкать белку в обратном направлении от края стола, нужно создать соответствующий импульс (вот и второй закон Ньютона в импульсной форме подъехал).
Ну, а чтобы создать импульс, белка может выкинуть орехи в сторону направления движения — тогда по закону сохранения импульса ее собственный импульс будет направлен против направления скорости орехов.
Реактивное движение
В основе движения ракет, салютов и некоторых живых существ: кальмаров, осьминогов, каракатиц и медуз — лежит закон сохранения импульса. В этих случаях движение тела возникает из-за отделения какой-либо его части. Такое движение называется реактивным.
Яркий пример реактивного движения в технике — движение ракеты, когда из нее истекает струя горючего газа, которая образуется при сгорании топлива.
Сила, с которой ракета действует на газы, равна по модулю и противоположна по направлению силе, с которой газы отталкивают от себя ракету:
Сила называется реактивной. Это та сила, которая возникает в процессе отделения части тела. Особенностью реактивной силы является то, что она возникает без взаимодействия с внешними телами.
Закон сохранения импульса позволяет оценить скорость ракеты.
mг · vг = mр · vр,
где mг — это масса горючего,
vг — скорость горючего,
mр — масса ракеты,
vр — скорость ракеты.
Отсюда можно выразить скорость ракеты:
vр = mг · vг / mр
Скорость ракеты при реактивном движении vр = mг · vг / mр vг — скорость горючего [м/с] mр — масса ракеты [кг] vр — скорость ракеты [м/с] |
Эта формула справедлива для случая мгновенного сгорания топлива. Мгновенное сгорание — это теоретическая модель. В реальной жизни топливо сгорает постепенно, так как мгновенное сгорание приводит к взрыву.
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
Закон сохранения массы (закон Ломоносова)
Экспериментальное доказательство закона сохранения массы при химических взаимодействиях явилось первым примером количественного химического анализа. Гениальный русский ученый М. В. Ломоносов (1711— 1765), впервые применивший весы и взвешивание для количественного контроля химических превращений и открывший закон сохранения массы, является основоположником количественного анализа. [c.7]
Гениальный русский ученый М. В. Ломоносов (1711— 1765), впервые применивший весы и взвешивание для количественного контроля химических превращений и открывший закон сохранения массы, является основоположником количественного анализа. [c.7]
Закон сохранения массы и энергии. В 1760 г. Ломоносов, по существу, сформулировал единый закон сохранения массы и энергии «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Сей всеобщий естест венный закон распространяется и в самые правила движения, ибо тело, движущее своею силою другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает». Однако до начала XX в. эти законы обычно рассматривались независимо друг от друга. Химия в основном имела дело с законом сохранения массы вещества, а физика — с законом сохранения энергии.
 В 1905 г. основоположник современной физики А.Эйнштейн показал, что между массой и энергией существует взаимосвязь, выражаемая уравнением [c.8]
В 1905 г. основоположник современной физики А.Эйнштейн показал, что между массой и энергией существует взаимосвязь, выражаемая уравнением [c.8]М. Б. Ломоносов (1711 — 1765) впервые стал систематически применять весы при изучении химических реакций. Б 1756 г. он экспериментально установил один из основных законов природы — закон сохранения массы вещества, составивший основу количественного анализа и имеющий огромное значение для всей науки. М. В. Ломоносов разработал многие приемы химического анализа и исследования, не потерявшие значения до наших дней [c.8]
Химия как точная наука зародилась еще в эпоху полного господства теории флогистона Более определенным временем ее возникновения можно условно считать середину XVIII в., когда М. В. Ломоносов (1711 — 1765) сформулировал закон сохранения массы вещества в химических процессах и доказал его экспериментально. Он же первый высказал мысль, что при нагревании металл соединяется, как он говорил, с частичками воздуха. Заслуга полного и окончательного ниспровержения флогистонной теории принадлежит великому французскому химику А. Лавуазье (1743—1794), который, изучая горение и обжиг металлов, не только выяснил и сделал очевидной для других роль кислорода в этих явлениях, разрушив тем самым теорию флогистона, но также внес ясность в понятия химического элемента, простого и сложного вещества и независимо от Ломоносова экспериментально установил закон сохранения массы в химических реакциях. Начиная с Лавуазье химия заговорила на современном нам языке. Именно его трудами завершился процесс превращения химии в науку. Если Бойль начал этот процесс, то Лавуазье довел его до конца. [c.22]
Заслуга полного и окончательного ниспровержения флогистонной теории принадлежит великому французскому химику А. Лавуазье (1743—1794), который, изучая горение и обжиг металлов, не только выяснил и сделал очевидной для других роль кислорода в этих явлениях, разрушив тем самым теорию флогистона, но также внес ясность в понятия химического элемента, простого и сложного вещества и независимо от Ломоносова экспериментально установил закон сохранения массы в химических реакциях. Начиная с Лавуазье химия заговорила на современном нам языке. Именно его трудами завершился процесс превращения химии в науку. Если Бойль начал этот процесс, то Лавуазье довел его до конца. [c.22]
Закон сохранения массы. На основании молекулярно-атомистических представлений М. В. Ломоносов сделал вывод Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте . Позднее, применяя точные методы исследования, ученые подтвердили опытным путем, что при химических превращениях общая масса веществ остается неизменной. Этот закон — закон сохранения массы — в настоящее время формулируется так [c.10]
Позднее, применяя точные методы исследования, ученые подтвердили опытным путем, что при химических превращениях общая масса веществ остается неизменной. Этот закон — закон сохранения массы — в настоящее время формулируется так [c.10]
В связи со сказанным необходимо реабилитировать гения русской науки — Михаила Васильевича Ломоносова. До сих пор приходится встречаться с ложным утверждением о том, что закон сохранения энергии открыт Ломоносовым. Это утверждение основывается не на каких-либо работах Ломоносова, а на одной фразе в его письме Эйлеру 5 июля 1748 года Так, сколько материи прибавляется какому-либо телу, столько же теряется у другого… Так как это всеобщий закон природы, то он распространяется и на правила движения тело, которое своим толчком возбуждает другое к движению, столько же теряет от своего движения, сколько сообщает другому, им двинутому . Слова очень содержательные. Но, во-первых, они касаются не энергии, а движения — понятия неопределенного, и, во-вторых, сходные мысли были высказаны еще в XVH веке Декартом, утверждавшим, что во Вселенной в.
 сегда сохраняется одно и то же количество движения. Закона сохранения энергии здесь нет, да и невозможно было открыть его до наступления века пара и электричества. Ломоносов, открывший закон сохранения массы, обосновавший кинетическую теорию тепла, так много сделавший в науке и искусстве, не нуждается в том, чтобы ему приписывали мнимые открытия. [c.16]
сегда сохраняется одно и то же количество движения. Закона сохранения энергии здесь нет, да и невозможно было открыть его до наступления века пара и электричества. Ломоносов, открывший закон сохранения массы, обосновавший кинетическую теорию тепла, так много сделавший в науке и искусстве, не нуждается в том, чтобы ему приписывали мнимые открытия. [c.16]Закон сохранения массы и э н е р г и и. Несмотря на то что еще в 1760 г. Ломоносов, по существу, сформулировал единый закон сохранения массы и энергии , до начала XX в. эти законы обычно рассматривались независимо друг от друга. Химия в основном имела дело с законом сохранения массы вещества, а физика — с законом сохранения энергии. В 1905 г. основоположник современной физики А. Эйнштейн показал, что между массой и энергией существует взаимосвязь, количественно выражаемая уравнением [c.9]
На основе достижений современной атомной физики и теории относительности было установлено, что закон сохранения массы тесно связан с законом сохранения энергии (Ломоносов, 1748 г. , Мейер, 1842 г.). Соотношение между массой и энергией было установлено Эйнштейном, который показал, что изменение энергии системы прямо пропорционально изменению массы [c.11]
, Мейер, 1842 г.). Соотношение между массой и энергией было установлено Эйнштейном, который показал, что изменение энергии системы прямо пропорционально изменению массы [c.11]
Закон сохранения массы вещества. Впервые его высказал М. В. Ломоносов в письме к Эйлеру от 5 июня 1748 г., опубликованном на русском языке в 1760 г. Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому… Это определение, за исключением архаичности языка, не устарело. [c.13]
Закон сохранения массы при химических реакциях. В 1756 г. Ломоносов, применяя количественные методы при исследовании химических процессов, установил, что при химических превращениях масса веществ остается неизменной. Это открытие Ломоносова стало одним из основных законов химии, который в настоящее время формулируется следующим образом масса веществ, вступивших в реакцию, всегда равна массе вешаете, образовавшихся в результате реакции. [c.8]
[c.8]
Творческая деятельность Ломоносова отличается исключительной широтой интересов и глубиной проникновения в тайны природы. Его исследования относятся к области физики, химии, астрономии и др. Результаты этих работ заложили основы современного естествознания. Ломоносов указал (1765) на основополагающее значение закона сохранения массы вещества в химических реакциях изложил (1741 —1750) основы корпускулярного (атомно-молекулярного) учения выдвинул (1744—1748) кинетическую теорию теплоты. Был зачинателем применения математических и физических методов исследования в химии и первым начал читать в Петербургской АН самостоятельный Курс истинно физической химии , заложил основы русского химического языка. [c.9]
Закон сохранения массы вещества. Применяя количественные методы исследования химических реакций, М. В. Ломоносов установил, что при химических превращениях общий вес вещества остается неизменным. На основании своих опытов он сформулировал закон сохранения массы веш,еств [c.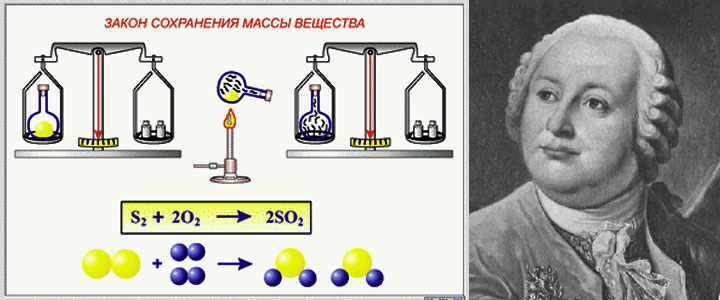 25]
25]
Ломоносов первый из отечественных ученых начал применять физические методы исследований в химии. Закон сохранения массы вещества и энергии был одним из важнейших открытий Ломоносова в области физической химии. Ломоносовым установлено, что понижение температуры замерзания раствора зависит от его концентрации, и эта температура бывает всегда ниже температуры замерзания чистого растворителя. Им сделан и ряд других открытий и исследований. [c.6]
Из этой формулировки видно, что М. В. Ломоносов закон сохранения массы веществ рассматривал в единстве с законом сохранения энергии и понимал его как всеобщий закон природы. [c.56]
Закон сохранения массы. Исключительное значение для химии имело установление закона сохранения массы, являющегося следствием всеобщего естественного закона сохранения материи и движения, сформулированного М. В. Ломоносовым (1711 —1765 гг.) как всеобщий естественный закон в 1748 г. в письме к Д. Эйлеру Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупится к другому, ежели где убудет несколько материи, то умножится в другом месте. .. Сей всеобщий закон простирается и в самые правила движения ибо тело, движущее своей силой другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает (Ломоносов М. В. Труды по физике и химии,— М.. 1951.— Т. II.— С. 183). [c.14]
.. Сей всеобщий закон простирается и в самые правила движения ибо тело, движущее своей силой другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает (Ломоносов М. В. Труды по физике и химии,— М.. 1951.— Т. II.— С. 183). [c.14]
В 1749 г, по чертежам и указаниям Ломоносова была построена первая в России химическая научная и учебная лаборатория на Васильевском острове в Петербурге. В лаборатории Ломоносов экспериментально обосновывает закон сохранения массы веществ, сформулированный нм еще в 1748 г. [c.8]
М. В. Ломоносов сначала высказал теоретически (1748), а затем экспериментально обосновал (1756 ) закон сохранения массы веществ. В настоящее время он формулируется так [c.15]
М. В. Ломоносов связывал закон сохранения массы веществ с законом сохранения энергии (количества движения) и рассматривал их в единстве как всеобщий закон природы. Этот закон он сформулировал в 1748 г. следующим образом Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте. Сей всеобщий естественный закон простирается и в самые правила движения ибо тело, движущее [c.15]
Этот закон он сформулировал в 1748 г. следующим образом Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте. Сей всеобщий естественный закон простирается и в самые правила движения ибо тело, движущее [c.15]
М. В. Ломоносов сначала теоретически, а затем опытным путем открыл и обосновал закон сохранения массы веществ, который лежит в основе всех химических реакций. В настоящее время он формулируется следующим образом масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. [c.18]
М. В. Ломоносов связывал закон сохранения массы веществ с законом сохранения энергии (количества движения) и рассматривал их в единстве как всеобщий закон природы. Этот закон он сформулировал в 1748 г. следующим образом [c.18]
В 1748 г. М. В. Ломоносов сформулировал положение, которое в дальнейшем сыграло большую роль в развитии химии и получило название закона сохранения массы веш,еств масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. [c.21]
В. Ломоносов сформулировал положение, которое в дальнейшем сыграло большую роль в развитии химии и получило название закона сохранения массы веш,еств масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. [c.21]
Впоследствии М. В. Ломоносов экспериментально подтвердил правильность своих выводов. Независимо от М. В. Ломоносова закон сохранения массы веществ был сформулирован позднее французским химиком Лавуазье. [c.21]
Одним из первых химических явлений, с которым человечество познакомилось на заре своего существования, было горение. Вна-ч-але оно использовалось для варки пищи и обогрева жилища. Лишь через многие тысячелетия человек научился использовать его для превращения химической анергии горючих веществ в механическую, электрическую и другие формы энергии. Представления об этом явлении менялись у человека по мере накопления им все новых и новых фактов. Впервые правильное представление о процессе горения высказал гениальный русский ученый Михаил Васильевич Ломоносов (1711—1765 гг. ), заложивший основы отечественной науки и установивший ряд важнейших законов современной химии и физики. Он провел большое количество опытов с прокаливанием свинца и олова в открытых и запаянных сосудах. Во всех опытах М. В. Ломоносов производил взвешивание вещества до прокаливания и после него. Он убедился, что металлы при прокаливании увеличиваются в весе за счет соединения их с воздухом (в то время кислород был неизвестен). В этих опытах он впервые установил основной закон химии — закон сохранения массы вещества. [c.5]
), заложивший основы отечественной науки и установивший ряд важнейших законов современной химии и физики. Он провел большое количество опытов с прокаливанием свинца и олова в открытых и запаянных сосудах. Во всех опытах М. В. Ломоносов производил взвешивание вещества до прокаливания и после него. Он убедился, что металлы при прокаливании увеличиваются в весе за счет соединения их с воздухом (в то время кислород был неизвестен). В этих опытах он впервые установил основной закон химии — закон сохранения массы вещества. [c.5]
М. В. Ломоносов первым из ученых (в 1748 г.) сформулировал закон сохранения массы вещества при химической реакции. Q писал … все перСхМены, в., натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимается, столько присовокупится к другому . Этот закон в современной формулировке гласит Масса веществ, вступивших в реакцию, всегда равна массе веществ, образовавшихся в результате реакции. [c.3]
Химическая промышленность в период домонополистического капитализма. Во второй половине ХУП1 в. возникает одновременно с химией химическая технология. Большое значение для обеих наук имеет закон сохранения массы, открытый М. В. Ломоносовым. В применении к химическим производствам этот закон позволяет вычислять максимально возможные (стехиометрические) выходы продуктов и составлять материальные балансы, а это является первым шагом при проектировании технологического процесса. М. В. Ломоносов уделял много внимания и непосредственно химической технологии. Своими трудами он содействовал развитию в России металлургии, стекловарения, производства фарфора. [c.11]
Во второй половине ХУП1 в. возникает одновременно с химией химическая технология. Большое значение для обеих наук имеет закон сохранения массы, открытый М. В. Ломоносовым. В применении к химическим производствам этот закон позволяет вычислять максимально возможные (стехиометрические) выходы продуктов и составлять материальные балансы, а это является первым шагом при проектировании технологического процесса. М. В. Ломоносов уделял много внимания и непосредственно химической технологии. Своими трудами он содействовал развитию в России металлургии, стекловарения, производства фарфора. [c.11]
Закон сохранения массы. Ломоносов создал при Академии наук химическую лабораторию. В ней он изучал протекаиие химических реакций, взвешивая исходные вещества и продукты реакции. При этом он установил закон сохранения массы (веса) [c.18]
Закон сохранения массы при химических реакциях. Применяя количественные методы при исследовании химических процессов, Ломоносов в 1756 г. установил, что ири химических превращениях общая масса веществ остается неизменной. Это открытие Ломоносова ста ю одним из основных закогюв химии, который в настоя-огсе время формулируется следующим образом [c.12]
установил, что ири химических превращениях общая масса веществ остается неизменной. Это открытие Ломоносова ста ю одним из основных закогюв химии, который в настоя-огсе время формулируется следующим образом [c.12]
Возникновение физической хнмии как самостоятельной науки относится к середине XVIII в. Первый в мире курс физической химии был создан М. В. Ломоносовым (1752—1754). На основе своих физико-химических исследований М. В. Ломоносов пришел к принципиально новому определению химии как науки о свойствах тел, исходя из того, что все изменения в природе связаны с движением материи. Он первым обосновал основной закон сохранения массы вещества и пришел к определению принципа сохранения материи и движения, получившего признание как всеобщий закон природы. [c.6]
Михаил Васильевич Ломоносов — великий русский ученый — одни из основоположников новой химии. Он открыл основной закон химии — закон сохранения массы веществ. Разработал теорию атомно-молекуляриого строения веществ, являющуюся основой физики и химии. Ввел в химию количественные методы исследования. Объединил химию с физикой, создал новую науку — физическую химию. Большим вкладом в науку являются его работы по исследованию растворов. С имеием Ломоносова связано развитие в России различных иаук. Историк, ритор, механик, химик, минералог, художник и сти.хотворец — он все испытал и все проник , — писал о нем А. С. Пушкин. [c.4]
Ввел в химию количественные методы исследования. Объединил химию с физикой, создал новую науку — физическую химию. Большим вкладом в науку являются его работы по исследованию растворов. С имеием Ломоносова связано развитие в России различных иаук. Историк, ритор, механик, химик, минералог, художник и сти.хотворец — он все испытал и все проник , — писал о нем А. С. Пушкин. [c.4]
Ломоносов первый из отечественных ученых начал применять физические методы исследований в химии. Закон сохранения массы вещества и энергии был одним из важнейших открытий Ломо- [c.6]
Атомно-молекулярная теория. Создатель атомно-молекулярного учения и первооткрыватель закона сохранения массы веществ М.В.Ломоно-сов по праву считается основателем научной химии. Ломоносов четко различал две ступени в строении вещества элементы (в нашем понимании — атомы) и корпускулы (молекулы). Согласно Ломоносову, молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ — из разных атомов. Всеобщее признание атомно-молекулярная теория получила в начале XIX в. после утверждения в химии атомистики Дальтона. С тех пор главным объектом иссле- [c.7]
Всеобщее признание атомно-молекулярная теория получила в начале XIX в. после утверждения в химии атомистики Дальтона. С тех пор главным объектом иссле- [c.7]
Систематическое изучение количественных соотношений между составом веществ и физическими свойствами началось в XVIII в. Основополагающими в этой области являются труды М. В. Ломоносова и А. Лавуазье. М. В. Ломоносов в 1748 г. сформулировал закон сохранения массы и энергии. Он же первый сформулировал основную задачу физико-химического анализа как установление зависимости свойств от состава системы для выяснения природы составляющих ее частей . К сожалению, труды М. Е5. Ломоносова оставались долгое время неизвестными и были опубликованы Б. Н. Меншуткиным лишь в 1904 г. [c.265]
Закон сохранения массы. Химические уравнения. и расчеты по ним. Закон сохранения массы веи еств масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции (М. В. Ломоносов, 1848). С точки зрения атомно-молекулярного учения при химич еских реакциях атомы не образуются из ничего и не исчезают, поэтому число атомов всех видов в ходе химической реакции остается неизменным. А так. hMi маестгданного атома постоянна, [c.17]
С точки зрения атомно-молекулярного учения при химич еских реакциях атомы не образуются из ничего и не исчезают, поэтому число атомов всех видов в ходе химической реакции остается неизменным. А так. hMi маестгданного атома постоянна, [c.17]
И только в начале XIX столетия английский ученый Джон Дальтон возвращается к атомам как наименьшим частицам материи и вводит в науку этот термин. Этому предшествовали работы таких замечательных ученых, как Р. Бойль (в книге Химик-скептик он нанес сокрушительный удар по представлениям алхимиков), Дж. Пристли и К. В. Шееле (открытие кислорода), Г. Кавендиш (открытие водорода), А. Л. Лавуазье (попытка составить первую таблицу простых веществ), М. В. Ломоносов (основные положения атомно-молекулярного учения, закон сохранения массы), Ж. Л. Ируст (закон постоянства состава) и многие другие. [c.3]
Химические уравнения. Закон сохранения массы веществ
Цели урока:
1. Образовательные: систематизировать
знания учащихся о классификации веществ, научить
учащихся составлять уравнения химических
реакций согласно Закону сохранения массы
веществ.
Образовательные: систематизировать
знания учащихся о классификации веществ, научить
учащихся составлять уравнения химических
реакций согласно Закону сохранения массы
веществ.
2. Развивающие: совершенствовать умения учащихся при составлении химических уравнений, развивать у них умения сравнивать и обобщать, устойчивое внимание; развивать аналитическое мышление; осуществлять межпредметную связь.
3. Воспитательные: формировать информационную и коммуникативную культуру.
Оборудование и реактивы: весы, пробирки, колбы, HCL, CuSO4, CaCO3, H2 SO4, Cu(OH)2.
Тип урока: комбинированный.
План урока:
- Организационный момент.
- Актуализация знаний. (Решение кроссворда, диктант).
- Изучение нового материала:
а) историческая справка;
б) демонстрация опытов;
в) формулировка закона;
г) химические уравнения.
- Закрепление (Выполнение упражнений).
- Итоги урока.
- Домашнее задание.
- Песенка.
Ход урока
1. Орг.момент.
Приветствие.
Девиз урока: “ О, сколько нам открытий чудных
Готовит просвещения дух…”
Сегодня на уроке мы будем говорить об открытиях, узнаем много нового, мы повторим пройденный материал, вспомним, как пишутся формулы веществ, познакомимся с законом сохранения массы веществ, научимся писать уравнения. А для достижения наших целей мы будем работать по следующему плану: (на экране появляется план).
2. Актуализация знаний
– Вспомните, какие явления существуют в природе.
– Чем физические явления отличаются от химических?
– Чем сопровождаются химические реакции?
– Как обозначают вещества в химии?
– Кто предложил такое обозначение?
А теперь, обратите внимание на экран. Вы видите
кроссворд, разгадав который вы не только
повторите то, что всем известно, но и узнаете тему
нашего сегодняшнего урока.
Вы видите
кроссворд, разгадав который вы не только
повторите то, что всем известно, но и узнаете тему
нашего сегодняшнего урока.
Обратите внимание, заголовок написан, а ключевое слово выделено красным цветом и зашифровано. После решения верные ответы появляются на экране.
Молодцы! Таким образом, тема нашего урока: “Химические уравнения.
Закон сохранения массы веществ”
Открываем тетради, пишем число, тему урока.
Сейчас мы с вами напишем диктант.
Я буду называть вещества, а вы будете записывать формулы.
Диктант.
Ba(N O3), BaCL2,HCL, Cu SO4, CaC O3,H2O, NaOH, H2 SO4, HN O3,AL2O3,
Zn (N O3)2, Mg CL2.
На экране появляются верные формулы. Учащиеся сверяют свои записи.
3.
 Изучение нового материала.
Изучение нового материала.
Теперь, когда мы вспомнили знаки, формулы, приступим к изучению нового материала.
Историческая справка
З.С.М.В. был открыт великим русским ученым Ломоносовым в 1748 году, позднее подтвердил этот закон в 1789 году французский химик Лавуазье. Какова же история открытия?
Пытливый ум Ломоносова занимала мысль о том, что происходит с веществами, вступающими в химическую реакцию.
Изменяется ли их состав и масса?
Он проводил опыты.
Сначала он брал для опытов сосуды с открытыми отверстиями. Масса изменялась.
Затем он провел опыты в запаянных стеклянных ретортах– масса оставалась неизменной.
Тогда он объяснил закон тем, что при химических реакциях атомы не исчезают и не возникают, а происходит только их перегруппировка.
Сейчас мы с вами проведем опыты, подтверждающие
открытия Ломоносова.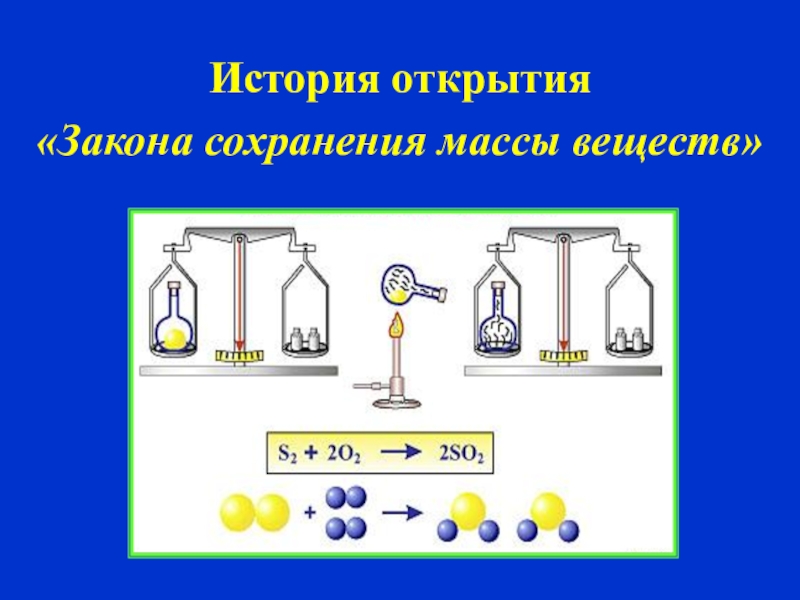
Демонстрация опытов:
Какой вывод мы можем сделать, как изменилась масса веществ ?
Какой закон физики имеет подобное смысловое значение? (закон сохранения энергии).
Как он формулируется?
Во всех явлениях, происходящих в природе, энергия не возникает и не исчезает. Она только превращается из одного вида в другой, при этом её значение сохраняется.
– Теперь, когда вы вспомнили закон сохранения энергии и узнали суть закона сохранения массы веществ. попробуйте сформулировать сам Закон сохранения массы веществ.(на экране появляется закон)
– Запишите в тетради.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
– Вещества вступают в реакцию, образуются новые вещества.
Мы обо всем этом говорим. А как это можно записать?
А записывают эти процессы с помощью уравнений.
Как в русском языке вы из букв составляете
слова, а из слов предложения, так и в химии из
знаков – формулы, из формул – уравнения.
Для записи уравнений в химии используются следующие знаки:
Записывая уравнения, нужно придерживаться следующего алгоритма действий (на экране).
N2+H2. —> NH3
N2+3 H2 —> 2NH3
– Ребята, кто сможет предположить что такое химическое уравнение?
(Формулировка появляется на экране)
– Химическое уравнение – это условная запись химической реакции посредством химических формул.
Вещества, принимающие участие в реакции называются реагентами.
Вещества, образующиеся в результате реакции – продуктами реакции.
Учащиеся записывают в тетради.
– А теперь составим уравнение реакции, которые мы провели.
2HCL+ CuSO4—>CuCL2+ H2.SO4
2HCL+ CaCO3—>Ca CL2 + H2 CO3
Cu(OH)2+ H2 SO4 —> Cu SO4 + H2О
4.
 Упражнения для закрепления
Упражнения для закрепления – Ребята, у кого есть вопросы?
– А сейчас мы выполним несколько упражнений для закрепления:
1. Какой коэффициент стоит в уравнении реакции перед формулой соляной кислоты
| Na+ HCL—> NaCL+H2 | (2 Na+2 HCL—> 2NaCL+H2) |
2. Продолжите уравнения реакции, расставьте коэффициенты :
AL + O2 —>…(AL2 O3)
3. Запишите уравнения реакции и расставьте коэффициенты : сульфат натрия соединяется с нитратом бария с образованием сульфата бария и нитрата натрия
(Na2SO4 +Ba (N O3)2—> Ba S O4v+ 2NaN O3)
3. Найдите ошибки:
| Mg+HBr —> MgBr2 +H2 | (Mg+2HBr —> MgBr2 +H2) |
| BaO+ H2 SO4 —> Ba2 SO4 + H2O | (BaO+ H2 SO4—> BaSO4 + H2O) |
| ZnO + HNO3 —> ZnNO3 + H2O | (ZnO + HNO3—> ZnNO3 + H2O) |
5. Закончите уравнения:
Закончите уравнения:
6. Выполните ряд превращений, запишите уравнения реакции:
Ca —> CaO —> (CaOH)2
– Закончили, хорошо. Обратите внимание на экран. Возьмите друг у друга тетради и проверьте себя. Поменяйтесь обратно. У кого все верно? Хорошо.
5. Итоги урока
.– Какие выводы мы можем сделать?
– Что мы проходим на уроке?
– Как уравниваются уравнения?
– Кто открыл Закон сохранения массы веществ?
– Что называется уравнением?
– Как называются вещества, вступившие в реакцию?
– Как называются получившиеся вещества?
Сегодня славно потрудились
Могу я подвести итог.
Вы все старались, не ленились
И каждый сделал сколько мог!
Выставление оценок.
– А теперь, запишите в дневниках:
Дом.задание.
П. 31, упр.2,3.стр.110, для любознательных упр. 2,3,4.
– Хорошо!
– А урок мы закончим песенкой про Закон на мотив песни “Улыбка”.
Ломоносов сей закон открыл
Подтвердил французский химик Лавуазье
Массы всех веществ в реакцию вступивших
Равна массе получившихся веществ
Каждый атом не дурак
Поступает ровно так:
Не возникнет, не исчезнет
Не изменитсяНу, а масса как всегда
Этих атомов одна
И в исходных веществах она не сменится. – 2 разаЛомоносова закон тогда
В химии стал главной панацеей
Все реакции теперь всегда
Составляются системой уравнений.Каждый атом не дурак
Поступает ровно так:
Не возникнет, не исчезнет
Не изменитсяНу, а масса как всегда
Этих атомов одна
И в исходных веществах она не сменится.— 2 раза
№1 Вместо знака ? напишите формулу соответствующих веществ и составьте уравнения реакции: 1. HCL + ? —> ZnCL2 + H2 2. O2 + ? —> CuO |
№2 Вместо знака ? напишите формулу соответствующих веществ и составьте уравнения реакции: 1. CL + ? —> ALCL3 2.. HCL + ? —> MgCL2 + H2 |
№3 Вместо знака ? напишите формулу соответствующих веществ и составьте уравнения реакции: 1. H2 + ? —> N H3 2. O2 + ? —> CaO |
Диктант. Ba(N O3), BaCL2,HCL, Cu SO4, CaC O3,H2O, NaOH, H2 SO4, HN O3,AL2O3, Zn (N O3)2, Mg CL2. |
| Выполните ряд превращений, запишите
уравнения реакции: Ca —> CaO —> (CaOH)2 |
Закон сохранения массы в химии. Закон сохранения массы. Закон сохранения массы и энергии
Системы. В отличие от классической модели, сохраняется масса только изолированной физической системы , то есть при отсутствии энергообмена с внешней средой. Не сохраняется сумма масс компонентов системы (масса неаддитивна). Например, при радиоактивном распаде в изолированной системе, состоящей из вещества и радиации, совокупная масса вещества уменьшается, но масса системы сохраняется, несмотря на то что масса радиации может быть нулевая.
Исторический очерк
Закон сохранения массы исторически понимался как одна из формулировок закона сохранения материи . Одним из первых его сформулировал древнегреческий философ Эмпедокл (V век до н. э.) :
Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться.
Ранее Эмпедокла «принцип сохранения» применялся представителями Милетской школы для формулировки теоретических представлений о первовеществе, основе всего сущего . Позже аналогичный тезис высказывали Демокрит , Аристотель и Эпикур (в пересказе Лукреция Кара).
Средневековые учёные также не высказывали никаких сомнений в истинности этого закона. Фрэнсис Бэкон в 1620 году провозгласил: «Сумма материи остается всегда постоянной и не может быть увеличена или уменьшена… ни одна мельчайшая её часть не может быть ни одолена всей массой мира, ни разрушена совокупной силой всех агентов, ни вообще как-нибудь уничтожена» .
Вес настолько тесно привязан к веществу элементов, что, превращаясь из одного в другой, они всегда сохраняют тот же самый вес.
Оригинальный текст (фр.)
La pesanteur est si étroitement jointe à la première matière des éléments que, se changeant de l»un en l»autre, ils gardent toujours le même poids.
Все встречающиеся в природе изменения происходят так, что если к чему-либо нечто прибавилось, то это отнимается у чего-то другого. Так, сколько материи прибавляется к какому-либо телу, столько же теряется у другого, сколько часов я затрачиваю на сон, столько же отнимаю от бодрствования и т. д.
В СССР на основании этой фразы М. В. Ломоносова объявили автором закона сохранения массы, хотя он никогда не претендовал на такой приоритет и в своём «Обзоре важнейших открытий» данный закон не упоминает. Современные историки подобные претензии считают безосновательными . Ошибочно мнение, что закон сохранения массы был Ломоносовым доказан опытным путём ;
Всеобщий закон сформулирован Ломоносовым на основе общефилософских материалистических соображений, никогда не подвергался им сомнению или проверке, а напротив, служил ему твёрдой исходной позицией во всех исследованиях на всём протяжении его жизни.
В дальнейшем, вплоть до создания физики микромира, закон сохранения массы считался истинным и очевидным. Иммануил Кант объявил этот закон постулатом естествознания (1786). Лавуазье в «Начальном учебнике химии» (1789) привёл точную количественную формулировку закона сохранения массы вещества, однако не объявил его каким-то новым и важным законом, а просто упомянул мимоходом как давно известный и достоверно установленный факт. Для химических реакций Лавуазье сформулировал закон в следующих выражениях :
Ничто не творится ни в искусственных процессах, ни в природных, и можно выставить положение, что во всякой операции [химической реакции] имеется одинаковое количество материи до и после, что качество и количество начал остались теми же самыми, произошли лишь перемещения, перегруппировки. На этом положении основано всё искусство делать опыты в химии.
Другими словами, сохраняется масса закрытой физической системы , в которой происходит химическая реакция, а сумма масс всех веществ, вступивших в эту реакцию, равна сумме масс всех продуктов реакции (то есть тоже сохраняется). {-12}}
.
{-12}}
.
(M2 ) Масса не является аддитивной величиной: масса системы не равна сумме масс её составляющих. Примеры неаддитивности:
- Электрон и позитрон , каждый из которых обладает массой, могут аннигилировать в фотоны , не имеющие массы поодиночке, а обладающие ею только как система.
- Масса дейтрона , состоящего из одного протона и одного нейтрона , не равна сумме масс своих составляющих, поскольку следует учесть энергию взаимодействия частиц.
- При термоядерных реакциях, происходящих внутри Солнца, масса водорода не равна массе получившегося из него гелия.
- Особенно яркий пример: масса протона (≈938 МэВ) в несколько десятков раз больше массы составляющих его кварков (около 11 МэВ).
Таким образом, при физических процессах, которые сопровождаются распадом или синтезом физических структур, не сохраняется сумма масс составляющих (компонентов) системы, но сохраняется общая масса этой (изолированной) системы:
- Масса системы получившихся при аннигиляции фотонов равна массе системы, состоящей из аннигилирующих электрона и позитрона.

- Масса системы, состоящей из дейтрона (с учётом энергии связи), равна массе системы, состоящей из одного протона и одного нейтрона отдельно.
- Масса системы, состоящей из получившегося при термоядерных реакциях гелия, с учётом выделенной энергии, равна массе водорода.
Сказанное означает, что в современной физике закон сохранения массы тесно связан с законом сохранения энергии и выполняется с таким же ограничением — надо учитывать обмен системы энергией с внешней средой.
Дорелятивистская физика знала два фундаментальных закона сохранения, а именно:закон сохранения энергии и закон сохранения массы; оба эти фундаментальных закона считались совершенно независимыми друг от друга. Теория относительности слила их в один .
Более детально
Чтобы более детально пояснить, почему масса в современной физике оказывается неаддитивной (масса системы не равна — вообще говоря — сумме масс компонент), следует вначале заметить, что под термином масса в современной физике понимается лоренц-инвариантная величина :
m = E 2 / c 4 − p 2 / c 2 , {\displaystyle m={\sqrt {E^{2}/c^{4}-p^{2}/c^{2}}},}где
E
{\displaystyle E} — энергия ,
p
→
{\displaystyle {\vec {p}}}
— импульс ,
c
{\displaystyle c} — скорость света . И сразу заметим, что это выражение одинаково легко применимо к точечной бесструктурной («элементарной») частице, так и к любой физической системе, причём в последнем случае энергия и импульс системы вычисляются просто суммированием энергий и импульсов компонент системы (энергия и импульс — аддитивны).
И сразу заметим, что это выражение одинаково легко применимо к точечной бесструктурной («элементарной») частице, так и к любой физической системе, причём в последнем случае энергия и импульс системы вычисляются просто суммированием энергий и импульсов компонент системы (энергия и импульс — аддитивны).
- Можно попутно заметить также, что вектор импульса-энергии системы — это 4-вектор , то есть его компоненты преобразуются при переходе к другой системе отсчета в соответствии с преобразованиями Лоренца , поскольку так преобразуются его слагаемые — 4-векторы энергии-импульса составляющих систему частиц. А поскольку масса, определённая выше, есть длина этого вектора в Лоренцевой метрике , то она оказывается инвариантной (лоренц-инвариантной), то есть не зависит от системы отсчёта, в которой её измеряют или рассчитывают.
Кроме того, заметим, что c {\displaystyle c} — универсальная константа, то есть просто число, которое не меняется никогда, поэтому в принципе можно выбрать такую систему единиц измерения, чтобы выполнялось c = 1 {\displaystyle c=1} , и тогда упомянутая формула будет менее загромождена:
m = E 2 − p 2 , {\displaystyle m={\sqrt {E^{2}-p^{2}}},}как и остальные связанные с нею формулы (и мы ниже будем для краткости использовать именно такую систему единиц). {2}-0}}=E\neq 0,}
{2}-0}}=E\neq 0,}
(импульсы уничтожились, а энергии сложились — они не могут быть разного знака).
В общем случае всё происходит аналогично этому, наиболее отчётливому и простому примеру. Вообще говоря, частицы, образующие систему, не обязательно должны иметь нулевые массы, достаточно, чтобы массы были малы или хотя бы сравнимы с энергиями или импульсами , и эффект будет большим или заметным. Также видно, что точной аддитивности массы нет практически никогда, за исключением лишь достаточно специальных случаев.
Масса и инертность
Отсутствие аддитивности массы, казалось бы, вносит затруднения. Однако они искупаются не только тем, что определённая так (а не иначе, например, не как энергия деленная на квадрат скорости света) масса оказывается лоренц-инвариантной, удобной и формально красивой величиной, но и имеет физический смысл, точно соответствующий обычному классическому пониманию массы как меры инертности.
А именно для системы отсчёта покоя физической системы (то есть той системы отсчета, в которой импульс физической системы ноль) или систем отсчёта, в которых система покоя медленно (по сравнению со скоростью света) движется, упомянутое выше определение массы
m = E 2 / c 4 − p 2 / c 2 {\displaystyle m={\sqrt {E^{2}/c^{4}-p^{2}/c^{2}}}}Полностью соответствует классической ньютоновской массе (входит во второй закон Ньютона). {2}/2}
(если
v
), что означает, что ящик ведет себя как классическое тело массы
m
{\displaystyle m} . Тот же результат можно (и даже легче) получить для отражения (отскока) от стенок быстрых релятивистских дискретных частиц (для нерелятивистских тоже, но в этом случае масса просто окажется
{2}/2}
(если
v
), что означает, что ящик ведет себя как классическое тело массы
m
{\displaystyle m} . Тот же результат можно (и даже легче) получить для отражения (отскока) от стенок быстрых релятивистских дискретных частиц (для нерелятивистских тоже, но в этом случае масса просто окажется
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. На основании этого закона химические реакции можно отобразить с помощью химических уравнений, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ.
Например, реакция горения метана записывается следующим образом:
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса
всех веществ, вступивших в химическую
реакцию, равна массе всех продуктов
реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
В
начале 20 века формулировка закона
сохранения массы подверглась
пересмотру в связи с появлением теории
относительности (А.Эйнштейн, 1905 г.),
согласно которой масса тела зависит от
его скорости и, следовательно, характеризует
не только количество материи, но и ее
движение. Полученная телом
энергия E связана с увеличением
его массы mсоотношением E = m c 2 ,
где с — скорость света. Это соотношение
не используется в химических реакциях,
т.к. 1 кДж энергии соответствует изменению
массы на ~10 -11 г
и mпрактически не может быть
измерено. В ядерных реакциях, где Е
в ~10 6 раз
больше, чем в химических реакциях, m следует
учитывать.
В ядерных реакциях, где Е
в ~10 6 раз
больше, чем в химических реакциях, m следует
учитывать.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава
Материал из Википедии — свободной энциклопедии
Закон постоянства состава (Ж.Л. Пруст , 1801 —1808гг .) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов , причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это один из основных законов химии .
Закон
постоянства состава не выполняется
для бертоллидов (соединений
переменного состава). Однако условно
для простоты состав многих бертоллидов
записывают как постоянный. Например,
состав оксида
железа(II) записывают
в виде FeO (вместо более точной формулы
Fe 1-x O).
ЗАКОН ПОСТОЯНСТВА СОСТАВА |
Согласно закону постоянства состава, всякое чистое вещество имеет постоянный состав независимо от способа его получения. Так, оксид кальция можно получить следующими способами: Независимо от того, каким способом получено вещество СаО, оно имеет постоянный состав: один атом кальция и один атом кислорода образуют молекулу оксида кальция СаО. Определяем молярную массу СаО: Определяем массовую долю Са по формуле: Вывод: В химически чистом оксиде массовая доля кальция всегда составляет 71,4% и кислорода 28,6%. |
Закон кратных отношений
Закон
кратных отношений —
один из стехиометрических законов химии :
если два вещества (простых или сложных )
образуют друг с другом более одного
соединения, то массы одного вещества,
приходящиеся на одну и ту же массу
другого вещества, относятся как целые
числа ,
обычно небольшие.
· Упругость · Пластичность · Закон Гука · Реология · Вязкоупругость
Закон сохранения массы — закон физики , согласно которому масса физической системы сохраняется при всех природных и искусственных процессах.
Ничто не может произойти из ничего, и никак не может то, что есть, уничтожиться.
Ранее Эмпедокла «принцип сохранения» применялся представителями Милетской школы для формулировки теоретических представлений о первовеществе, основе всего сущего.
Позже аналогичный тезис высказывали Демокрит , Аристотель и Эпикур (в пересказе Лукреция Кара). Средневековые учёные также не высказывали никаких сомнений в истинности этого закона. В 1630 году Жан Рэ (Jean Rey, 1583-1645), доктор из Перигора, писал Мерсенну :
Вес настолько тесно привязан к веществу элементов, что, превращаясь из одного в другой, они всегда сохраняют тот же самый вес.
Все встречающиеся в природе изменения происходят так, что если к чему-либо нечто прибавилось, то это отнимается у чего-то другого.
Так, сколько материи прибавляется к какому-либо телу, столько же теряется у другого, сколько часов я затрачиваю на сон, столько же отнимаю от бодрствования и т. д.
В дальнейшем, вплоть до создания физики микромира, закон сохранения массы считался истинным и очевидным. Иммануил Кант объявил этот закон постулатом естествознания (1786). Лавуазье в «Начальном учебнике химии» (), приводит точную количественную формулировку закона сохранения массы вещества, однако не объявляет его каким-то новым и важным законом, а просто упоминает мимоходом как о хорошо известном и давно установленном факте. Для химических реакций Лавуазье сформулировал закон так :
Ничто не творится ни в искусственных процессах, ни в природных, и можно выставить положение, что во всякой операции [химической реакции] имеется одинаковое количество материи до и после, что качество и количество начал остались теми же самыми, произошли лишь перемещения, перегруппировки. На этом положении основано всё искусство делать опыты в химии.
Другими словами, сохраняется масса закрытой физической системы , в которой происходит химическая реакция, а сумма масс всех веществ, вступивших в эту реакцию, равна сумме масс всех продуктов реакции (то есть тоже сохраняется). Масса считается аддитивной.
Современное состояние
В XX веке обнаружились два новых свойства массы.
(M1 ) Масса физического объекта зависит от его внутренней энергии (см. Эквивалентность массы и энергии). При поглощении внешней энергии масса растёт, при потере — уменьшается. Отсюда следует, что масса сохраняется только в изолированной системе , то есть при отсутствии обмена энергией с внешней средой. Особенно ощутимо изменение массы при ядерных реакциях . Но даже при химических реакциях, которые сопровождаются выделением (или поглощением) тепла, масса не сохраняется, хотя в этом случае дефект массы ничтожен. Академик Л. Б. Окунь пишет:
Чтобы подчеркнуть, что масса тела меняется всегда, когда меняется его внутренняя энергия, рассмотрим два обыденных примера:
1) при нагревании железного утюга на 200° его масса возрастает на величину ;
2) при полном превращении некоторого количества льда в воду .
(M2 ) Масса не является аддитивной величиной: масса системы не равна сумме масс её составляющих. Примеры неаддитивности:
- Электрон и позитрон , каждый из которых обладает массой, могут аннигилировать в фотоны , не имеющие массы поодиночке, а обладающие ею только как система.
- Масса дейтрона , состоящего из одного протона и одного нейтрона , не равна сумме масс своих составляющих, поскольку следует учесть энергию взаимодействия частиц.
- При термоядерных реакциях, происходящих внутри Солнца, масса водорода не равна массе получившегося из него гелия.
- Особенно яркий пример: масса протона (≈938 МэВ) в несколько десятков раз больше массы составляющих его кварков (около 11 МэВ).
Таким образом, при физических процессах, которые сопровождаются распадом или синтезом физических структур, не сохраняется сумма масс составляющих (компонентов) системы, но сохраняется общая масса этой (изолированной) системы:
- Масса системы получившихся при аннигиляции фотонов равна массе системы, состоящей из аннигилирующих электрона и позитрона.

- Масса системы, состоящей из дейтрона (с учётом энергии связи), равна массе системы, состоящей из одного протона и одного нейтрона отдельно.
- Масса системы, состоящей из получившегося при термоядерных реакциях гелия, с учётом выделенной энергии, равна массе водорода.
Сказанное означает, что в современной физике закон сохранения массы тесно связан с законом сохранения энергии и выполняется с таким же ограничением — надо учитывать обмен системы энергией с внешней средой.
Более детально
Чтобы более детально пояснить, почему масса в современной физике оказывается неаддитивной (масса системы не равна — вообще говоря — сумме масс компонент), следует вначале заметить, что под термином масса в современной физике понимается лоренц-инвариантная величина :
где — энергия , — импульс , — скорость света . И сразу заметим, что это выражение одинаково легко применимо к точечной бесструктурной («элементарной») частице, так и к любой физической системе, причём в последнем случае энергия и импульс системы вычисляются просто суммированием энергий и импульсов компонент системы (энергия и импульс — аддитивны).
- Можно попутно заметить также, что вектор импульса-энергии системы — это 4-вектор , то есть его компоненты преобразуются при переходе к другой системе отсчета в соответствии с преобразованиями Лоренца , поскольку так преобразуются его слагаемые — 4-векторы энергии-импульса составляющих систему частиц. А поскольку масса, определённая выше, есть длина этого вектора в Лоренцевой метрике, то она оказывается инвариантной (лоренц-инвариантной), то есть не зависит от системы отччета, в которой ее измеряют или рассчитывают.
Кроме того, заметим, что — универсальная константа, то есть просто число, которое не меняется никогда, поэтому в принципе можно выбрать такую систему единиц измерения, чтобы выполнялось , и тогда упомянутая формула будет менее загромождена:
как и остальные связанные с нею формулы (и мы ниже будем для краткости использовать именно такую систему единиц).
Рассмотрев уже самый парадоксальный на вид случай нарушения аддитивности массы — случай, когда система нескольких (для простоты ограничимся двумя) безмассовых частиц (например фотонов) может иметь ненулевую массу, легко увидеть механизм, порождающий неаддитивность массы.
Пусть есть два фотона 1 b 2 с противоположными импульсами: . Масса каждого фотона, как известно, равна нулю, следовательно можно записать:
то есть энергия каждого фотона равна модулю его импульса. Заметим попутно, что масса равна нулю за счет вычитания под знаком корня ненулевых величин друг из друга.
Рассмотрим теперь систему этих двух фотонов как целое, посчитав ее импульс и энергию. Как видим, импульс этой системы равен нулю (импульсы фотонов, сложившись, уничтожились, так как эти фотоны летят в противоположных направлениях) :
.Энергия же нашей физической системы будет просто суммой энергий первого и второго фотона:
Ну и отсюда масса системы:
(импульсы уничтожились, а энергии сложились — они не могут быть разного знака).
В общем случае всё происходит аналогично этому, наиболее отчётливому и простому примеру. Вообще говоря, частицы, образующие систему, не обязательно должны иметь нулевые массы, достаточно, чтобы массы были малы или хотя бы сравнимы с энергиями или импульсами , и эффект будет большим или заметным. Также видно, что точной аддитивности массы нет практически никогда, за исключением лишь достаточно специальных случаев.
Также видно, что точной аддитивности массы нет практически никогда, за исключением лишь достаточно специальных случаев.
Масса и инертность
Отсутствие аддитивности массы, казалось бы, вносит затруднения. Однако они искупаются не только тем, что определённая так (а не иначе, например, не как энергия деленная на квадрат скорости света) масса оказывается лоренц-инвариантной, удобной и формально красивой величиной, но и имеет физический смысл, точно соответствующий обычному классическому пониманию массы как меры инертности.
А именно для системы отстчета покоя физической системы (то есть той системы отсчета, в которой импульс физической системы ноль) или систем отсчета, в которых система покоя медленно (по сравнению со скоростью света) движется, упомянутое выше определение массы
Полностью соответствует классической ньютоновской массе (входит во второй закон Ньютона).
Это можно конкретно проиллюстрировать, рассмотрев систему, снаружи (для внешних взаимодействий) являющейся обычным твердым телом, а внутри содержащую быстро движущиеся частицы. Например, рассмотрев зеркальный ящик с идеально отражающими стенками, внутри которого — фотоны (электромагнитные волны).
Например, рассмотрев зеркальный ящик с идеально отражающими стенками, внутри которого — фотоны (электромагнитные волны).
Пусть для простоты и большей четкости эффекта сам ящик (почти) невесом. Тогда, если, как в рассмотренном в параграфе выше примере, суммарный импульс фотонов внутри ящика ноль, то ящик будет в целом неподвижен. При этом он должен под действием внешних сил (например если мы станем его толкать), вести себя как тело с массой, равной суммарной энергии фотонов внутри, деленной на .
Рассмотрим это качественно. Пусть мы толкаем ящик, и он приобрел из-за этого некоторую скорость вправо. Будем для простоты сейчас говорить только об электромагнитных волнах, бегущих строго вправо и влево. Электромагнитная волна, отражающаяся от левой стенки, повысит свою частоту (вследствие эффекта Допплера) и энергию. Волна, отражающаяся от правой стенки, напротив, уменьшит при отражении свои частоту и энергию, однако суммарная энергия увеличится, так как полной компенсации не будет. В итоге тело приобретет кинетическую энергию , равную (если ), что означает, что ящик ведет себя как классическое тело массы . Тот же результат можно (и даже легче) получить для отражения (отскока) от стенок быстрых релятивистских дискретных частиц (для нерелятивистских тоже, но в этом случае масса просто окажется суммой масс частиц, находящихся в ящике).
В итоге тело приобретет кинетическую энергию , равную (если ), что означает, что ящик ведет себя как классическое тело массы . Тот же результат можно (и даже легче) получить для отражения (отскока) от стенок быстрых релятивистских дискретных частиц (для нерелятивистских тоже, но в этом случае масса просто окажется суммой масс частиц, находящихся в ящике).
Примечания
Литература
- Джеммер М. Понятие массы в классической и современной физике . — М.: Прогресс, 1967. (Переиздание: Едиториал УРСС, 2003, ISBN 5-354-00363-6)
- Окунь Л. Б. Понятие массы (Масса, энергия, относительность). Успехи физических наук, № 158 (1989).
- Спасский Б. И. История физики . — М
.: Высшая школа, 1977.
- Том 1: часть 1-я часть 2-я
- Том 2: часть 1-я часть 2-я
Wikimedia Foundation . 2010 .
Смотреть что такое «Закон сохранения массы» в других словарях:
ЗАКОН СОХРАНЕНИЯ МАССЫ — фундаментальный закон нерелятивистской ньютоновской механики, согласно которому масса вещества, поступающего в замкнутую систему, либо накапливается в ней, либо покидает ее, т. е. масса поступающего в систему вещества минус масса выходящего из… … Экологический словарь
е. масса поступающего в систему вещества минус масса выходящего из… … Экологический словарь
Из данного урока вы узнаете, в чем заключается сущность химической реакции с позиции атомно-молекулярной теории. Урок посвящен изучению одного из важнейших законов химии — закона сохранения массы веществ.
Тема: Первоначальные химические представления
Урок: Сущность химической реакции. Закон сохранения массы веществ
Вопрос о сущности химического превращения долгое время оставался загадкой для естествоиспытателей. Только с развитием атомно-молекулярной теории стало возможным предположить, как на уровне атомов и молекул происходят химические реакции.
В соответствие с атомно-молекулярной теорией, вещества состоят из молекул, а молекулы – из атомов. В ходе химической реакции атомы, входящие в состав исходных веществ, не исчезают и не появляются новые атомы.
Тогда, мы можем предположить, что в результате химической реакции продукты реакции образуются из атомов, которые ранее входили в состав исходных веществ. Вот модель химической реакции:
Вот модель химической реакции:
Рис. 1. Модель химической реакции с позиции АМТ
Проанализировав данную модель, мы можем выдвинуть гипотезу (научно обоснованное предположение):
Суммарная масса продуктов реакции должна быть равна суммарной массе исходных веществ.
Еще Леонардо да Винчи сказал: «Знания, не проверенные опытом, матерью всякой достоверности, бесплодны и полны ошибок». Значит, гипотеза никогда не станет законом, если ее не подтвердить экспериментально.
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в ходе химических реакций изменяется.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается неизменной и что при прокаливании к металлу присоединяется воздух (кислород в то время не был еще открыт). Но Ломоносов не опубликовал результаты своих исследований.
Он доказал, что масса веществ до и после реакции остается неизменной и что при прокаливании к металлу присоединяется воздух (кислород в то время не был еще открыт). Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов. Но он сделал новое, очень важное, наблюдение, а именно, что только часть воздуха запаянной реторты соединилась с металлом и что увеличение веса металла, перешедшего в окалину, равно уменьшению веса воздуха в реторте. Вместе с тем часть металла осталась в свободном виде.
Таким образом, независимо друг от друга, М.В. Ломоносов и А. Лавуазье подтвердили справедливость предположения о сохранении массы веществ в результате химической реакции.
Это предположение стало законом лишь после десятилетнего исследования немецкого химика Г. Ландольта в начале 20 века. Сегодня закон сохранения массы веществ формулируется так:
Масса веществ, участвующих в реакции, равна массе продуктов реакции .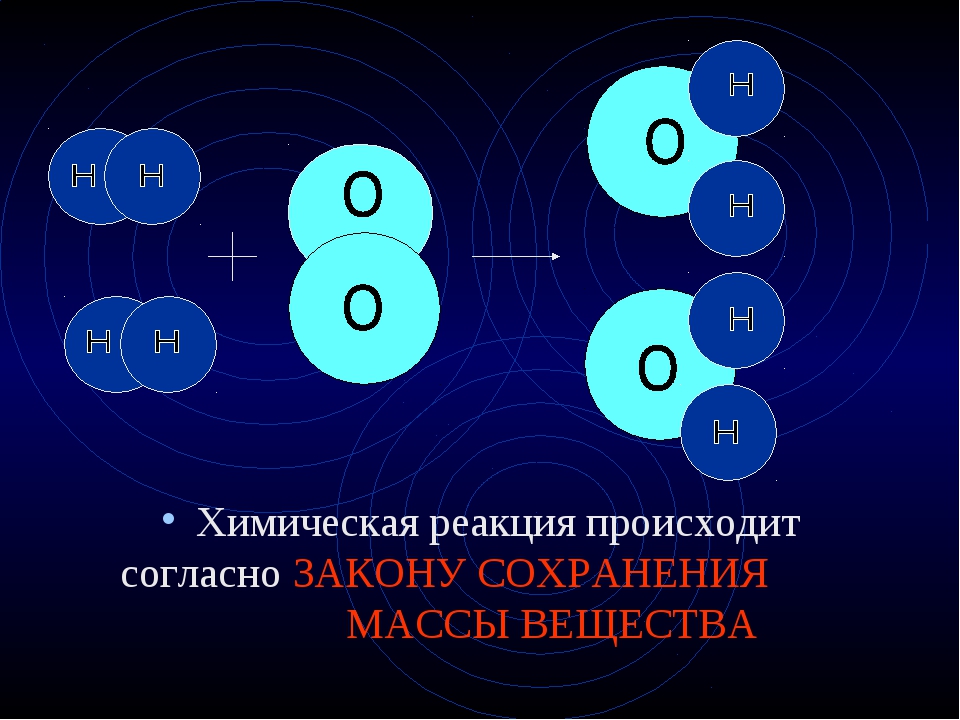
Подтвердить правильность закона сохранения массы веществ можно с помощью следующего опыта. В первом сосуде Ландольта подготовим растворы йодида калия и нитрата свинца. Во втором сосуде – пройдет реакция хлорида железа с роданидом калия. Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось (Рис. 2). Масса исходных веществ всегда равна массе продуктов реакции.
Рис. 2. Эксперимент, подтверждающий правильность закона сохранения массы веществ
Приведем пример еще одного опыта, доказывающего правильность закона сохранения массы веществ в химических реакциях. Внутри колбы при закрытой пробке будет гореть свеча. Уравновесим весы. Подожжем свечу и опустим ее в колбу. Плотно закроем колбу пробкой. Горение свечи – это химический процесс. Израсходовав находящийся в колбе кислород, свеча гаснет, химическая реакция завершается. Но равновесие весов не нарушается: масса продуктов реакции остается такой же, какой была масса исходных веществ (Рис. 3).
Горение свечи – это химический процесс. Израсходовав находящийся в колбе кислород, свеча гаснет, химическая реакция завершается. Но равновесие весов не нарушается: масса продуктов реакции остается такой же, какой была масса исходных веществ (Рис. 3).
Рис. 3. Эксперимент с горящей свечой в колбе
Открытие закона сохранения массы веществ имело огромное значение для дальнейшего развития химии. На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.15-16)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§6)
учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§6)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с. 16 №№ 3,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Открытие молекул и атомов явилось важнейшим событием в развитии атомно-молекулярной теории. Ещё в 1748 году великий русский учёный Михаил Васильевич Ломоносов сформулировал закон сохранения массы как философскую концепцию. Он впоследствии сам же подвёл под её доказательство мощную практико-теоретическую базу, и произошло это в 1756 году. Параллельно с российским учёным над этой проблемой работал химик-француз А.Л.Лавуазье. Свой вариант доказательства он предложил в 1789 году.
Он впоследствии сам же подвёл под её доказательство мощную практико-теоретическую базу, и произошло это в 1756 году. Параллельно с российским учёным над этой проблемой работал химик-француз А.Л.Лавуазье. Свой вариант доказательства он предложил в 1789 году.
Закон сохранения массы вещества гласит, что сумма масс всех веществ, которые вступают в химическую реакцию, численно равна массе веществ, являющихся продуктами реакции. Первоначальные способы практически доказать тогда ещё предположение о сохранении масс не увенчались успехом. Дело в том, что опыты, которые проводились ещё до Ломоносова, основывались на сжигании веществ. Результаты взвешивания до и после реакции никак не согласовывались с очевидной, но не подтверждённой на практике теорией. Нагревание на воздухе ртути в результате давало красную окалину, и масса её была больше чем масса вступающего в реакцию металла. С золой, появляющейся после сгорания древесины, результат был противоположный, масса продукта всегда оказывалась меньше массы вещества до осуществления реакции.
Заключается в том, что он, чтобы доказать закон сохранения массы, впервые проводил опыт с замкнутыми системами. Простота опыта в очередной раз доказала гениальность российского учёного. Прокаливаемые металлы Ломоносов помещал в запаянный стеклянный сосуд. После успешно проведенной реакции вес сосуда оставался неизменным. И только когда сосуд разбивали, и вовнутрь устремлялся воздух, наблюдалось увеличение массы сосуда.
Теоретическое объяснение проведённого эксперимента было дано присоединительным характером реакции горения металла. Увеличение массы происходило за счёт присоединения атомов кислорода в продукт окисления. Доказав закон сохранения массы, Ломоносов осуществил весомый вклад в развитие атомно-молекулярной теории. Практически он ещё раз доказал, что атомы химически неделимы. Конструкции молекул в ходе реакций меняются, они обмениваются между собой атомами, но суммарное их количество (атомов) в замкнутой системе остаётся неизменным. Соответственно и общая масса вещества является величиной постоянной.
Закон сохранения массы стал первым вкладом в познании более глобальной природной закономерности. Дальнейшие исследования в этом направлении позволили выявить, что в замкнутых системах происходит не только сохранение масс. Энергия изолированной системы тоже является величиной постоянной. Любой процесс, происходящий в не производит и не уничтожает ни массу, ни энергию. А выявленная закономерность впоследствии получила название: закон сохранения массы и энергии. стали лишь доказательством частного случая величайшего закона природы.
Но на этом познание окружающего нас мира не заканчивается. Труды Эйнштейна продвинули науку ещё дальше, в своей теории он не только доказал взаимосвязь энергии и массы, но и сделал смелое предположение о возможности их преобразования. То, что сейчас кажется понятным обыкновенному школьнику, формировалось в ходе практических опытов и теоретических исследований на протяжении трех последних столетий. Учёные в самых различных областях естествознания по крупицам собирали мощную платформу для доказательства закономерностей и осознания понятий «энергия» и «масса».
Не только физика и химия, но и множество других наук активно используют взаимосвязь и принцип сохранения массы и энергии. Биология, география, астрономия находят применение закону сохранения массы и энергии. Даже философия под влиянием этого закона сформировала современное представление человека о бытии.
Закон сохранения массы — определение, формула, уравнение, примеры
Кто такой Михаил Васильевич Ломоносов?- Михаил Васильевич Ломоносов (10 ноября 1711 — 15 апреля 1765) — русский ученый, эрудит и писатель, широко известный своим вкладом в химию открытием закона сохранения массы.
- Кроме того, он также известен своим вкладом в астрономию, поскольку он был связан с открытием атмосферы Венеры.
- Еще в химии Ломоносов открыл точку замерзания ртути и провел с ней различные опыты.
Закон сохранения массы гласит, что в химической реакции общая масса участвующих реагентов всегда равна общей массе образующихся продуктов, так что общая масса системы остается постоянной.
- Другими словами, масса внутри замкнутой системы остается неизменной, поскольку количество материи не увеличивается и не уменьшается.
- Закон эквивалентен закону сохранения энергии, поскольку энергия и масса являются обратимыми величинами.
- Закон сохранения массы определяет математическую зависимость между массами реагентов и массами продуктов.
- Первое понимание сохранения массы возникло после открытия французским химиком Лавуазье в 1774 году того, что масса не может быть ни создана, ни уничтожена.
- Закон позже выдвинул русский ученый Михаил Васильевич Ломоносов.Поэтому он также известен как закон Ломоносова-Лавуазье.
- Закон согласуется с атомной теорией Дальтона, поскольку он утверждал, что общее число атомов химических веществ, участвующих в химической реакции, сохраняется.
Закон сохранения массы можно выразить математической формулой, используя уравнение неразрывности. Формула имеет дифференциальную форму и часто используется в гидромеханике и механике сплошных сред.
Формула имеет дифференциальную форму и часто используется в гидромеханике и механике сплошных сред.
Формулу закона сохранения массы можно записать так:
∂ρ/∂t + ∇ (ρv) = 0где,
∂ρ — разница в плотности химических частиц
∂t разница во времени
ρ – плотность (масса на единицу объема)
v скорость или скорость реакции
∇ это расхождение
Закон сохранения уравнения массыЗакон сохранения массы можно выразить в виде уравнения, если мы рассмотрим химическую реакцию:
А + В → С + D
Если X граммов A соединяется с Y граммами B в химической реакции с образованием P граммов C и Q граммов D, закон сохранения массы можно выразить как;
Х + Y = Р + Q
Таким образом, общая масса реагентов = общая масса продуктов.
Закон сохранения массовых примеров Закон сохранения массы можно наблюдать в различных замкнутых системах, как химических, так и природных. Некоторые из примеров закона:
Некоторые из примеров закона:
- Одним из наиболее легко наблюдаемых примеров закона сохранения массы является процесс горения.
- Реагентами, участвующими в процессе горения, являются древесина и кислород, а продуктами являются углекислый газ, водяной пар и пепел.
- В ходе этого процесса масса реагентов равна массе продуктов по закону сохранения массы.
- Реакция между AgNO 3 и NaCl используется как средство экспериментальной проверки закона сохранения массы.
- Во время процесса AgNO 3 и NaCl берут два конца Н-образной трубки. Трубка утяжелена химическими веществами.
- Затем два раствора смешивают, встряхивая пробирку, и дают возможность протекать реакции.
- Продукт реакции представляет собой творожистый белый осадок AgCl.
 Затем трубку снова взвешивают для определения общей массы продуктов.
Затем трубку снова взвешивают для определения общей массы продуктов. - В ходе процесса не наблюдается изменения веса после химической реакции.
AgNO 3 + NaCl → AgCl + NaNO 3
Исключения из закона сохранения массы- Несмотря на то, что многие химические реакции следуют закону сохранения массы, из этого закона есть некоторые исключения.
- Закон имеет свои недостатки, так как в некоторых случаях масса системы не является постоянной из-за преобразования массы в энергию.
- Согласно соотношению массы и энергии Эйнштейна, он заявил, что масса и энергия взаимопревращаемы друг в друга и, таким образом, в некоторых химических реакциях некоторая масса может быть преобразована в энергию.
- Одним из примеров таких исключений является ядерная реакция. В ядерной реакции масса реагентов не равна массе продуктов, так как часть массы превращается в энергию.

- Таким образом, в современной химии был переопределен закон сохранения массы, так как полная масса и энергия в ходе химической реакции всегда остаются постоянными.
Ссылки и источники
- Gautum SD, Pant M и Adhikari NR (2016). Всесторонняя химия, часть 2. Шестое издание. Издатели и дистрибьюторы Heritage, Pvt. ООО
- 8% — https://courses.lumenlearning.com/introchem/chapter/the-law-of-conservation-of-mass/
- 7% – https://study.com/academy/lesson/the-law-of-conservation-of-mass-definition-equation-examples.html
- 2% – https://en.wikipedia.
 org/wiki/Mass_conservation
org/wiki/Mass_conservation - 2% – http://panchbhaya.weebly.com/uploads/1/3/7/0/13701351/conservation_of_mass_lab_exemplar.pdf
- 1% – https://www.youtube.com/watch?v=2S6e11NBwiw
- 1% – https://scienceforum.ru/2020/article/2018018706
- 1% — https://qsstudy.com/физика/масс-энергия-отношение
- 1% – https://madelineisn.weebly.com/conservation-of-mass-lab.html
- 1% – https://flexbooks.ck12.org/cbook/ck-12-middle-school-physical-science-flexbook-2.0/section/5.13/primary/lesson/reactants-and-products-ms-ps
- 1% – https://byjus.com/physics/law-of-conservation-of-mass/
- 1% – http://www.sfu.ca/~mbahrami/ENSC%20283/Solution%20manual/Chapter1_SM.pdf
- <1% – https://www.britannica.com/science/combustion
Закон сохранения массы
Физика известна как наука, изучающая структуру материи и взаимодействия между фундаментальными составляющими Вселенной, которая развивается вокруг нас и даже за ее пределами. Другими словами, физика занимается всеми аспектами природы, рассматривая как макроскопический, так и субмикроскопический уровни. Это естественная наука, основанная на экспериментах, измерениях и математическом анализе любой материи или ее составляющих.
Другими словами, физика занимается всеми аспектами природы, рассматривая как макроскопический, так и субмикроскопический уровни. Это естественная наука, основанная на экспериментах, измерениях и математическом анализе любой материи или ее составляющих.
Физика помогает нам организовать всю вселенную в простую концепцию, которая позволяет нам легко понять, как все работает вокруг нас. Он имеет дело с основами и помогает нам увидеть связи между простой материей и другими явлениями. Физика дает нам мощные инструменты и знания, которые помогают нам выражать наше творчество внутри нас, видеть мир всеми возможными способами, а затем дает нам возможность изменить весь задействованный процесс.Физика пригодится тому, кто выживет на этой планете.
Определение
Как в физике, так и в химии закон сохранения массы или принцип сохранения массы утверждает, что для любой системы, закрытой для любого переноса вещества и энергии, масса конкретной системы должна оставаться постоянной во времени, поскольку массу системы нельзя часто менять, поэтому понятно, что количество нельзя ни добавить, ни убрать.
Различные этапы закона сохранения массы
Закон сохранения массы соблюдается либо в сбалансированном химическом уравнении, то есть в формулировке, показывающей, что вся масса сохраняется на протяжении всего процесса реакции.Химические уравнения, которые не подчиняются этому обычному закону сохранения массы, известны как несбалансированные уравнения или скелетные уравнения.
Лучший пример для понимания закона сохранения массы
Закон сохранения массы гласит, что любой объект или конкретная материя не могут быть созданы или уничтожены в результате химической реакции.
Например, когда горит кусок дерева, масса дыма, пепла и газов равна первоначальной массе всего древесного угля и кислорода, когда он вступает в реакцию.Таким образом, это означает, что общая масса любого продукта равна общей массе полученного реагента.
Закон сохранения материи | Утверждение и примеры
Закон сохранения материи в специальной теории относительности
В начале ХХ века понятие массы подверглось радикальному пересмотру.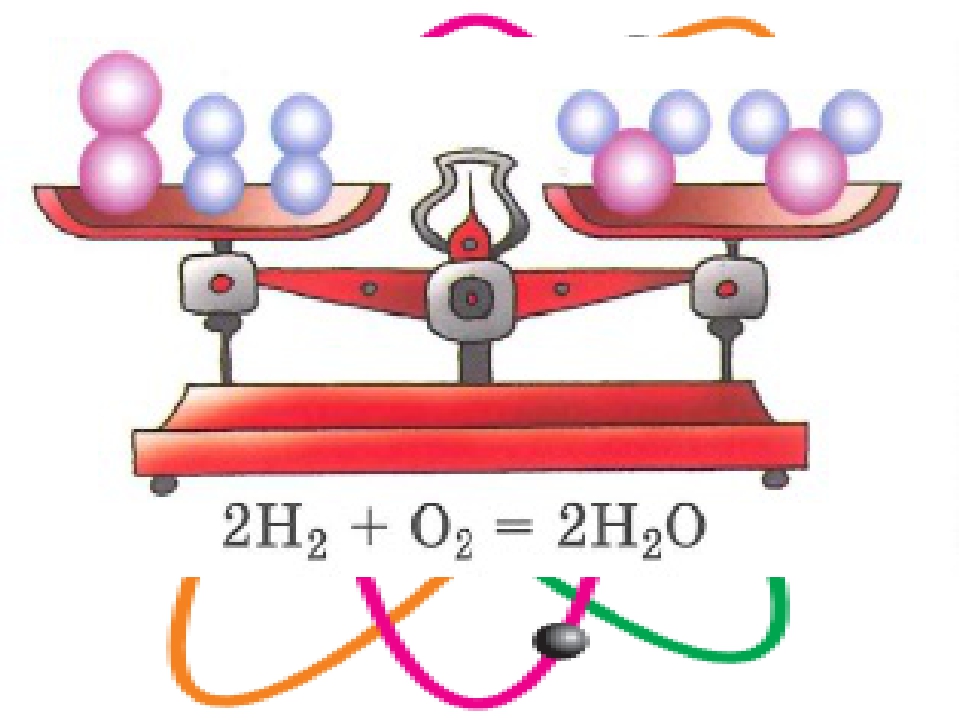 Масса потеряла свою абсолютность . Одним из поразительных результатов теории относительности Эйнштейна является то, что масса и энергия эквивалентны и могут быть преобразованы друг в друга. Эквивалентность массы и энергии описывается знаменитой формулой Эйнштейна E = mc 2 . Другими словами, энергии равно массе , умноженной на скорости света в квадрате . Поскольку скорость света очень велика, формула подразумевает, что любое небольшое количество материи содержит очень большое количество энергии. Масса объекта считалась эквивалентной энергии, взаимопревращаемой с энергией и значительно увеличивающейся на чрезвычайно высоких скоростях, близких к скорости света.Полная энергия включала его массу покоя и его увеличение массы , вызванное увеличением кинетической энергии .
Масса потеряла свою абсолютность . Одним из поразительных результатов теории относительности Эйнштейна является то, что масса и энергия эквивалентны и могут быть преобразованы друг в друга. Эквивалентность массы и энергии описывается знаменитой формулой Эйнштейна E = mc 2 . Другими словами, энергии равно массе , умноженной на скорости света в квадрате . Поскольку скорость света очень велика, формула подразумевает, что любое небольшое количество материи содержит очень большое количество энергии. Масса объекта считалась эквивалентной энергии, взаимопревращаемой с энергией и значительно увеличивающейся на чрезвычайно высоких скоростях, близких к скорости света.Полная энергия включала его массу покоя и его увеличение массы , вызванное увеличением кинетической энергии .
В специальной теории относительности определенные типы материи могут быть созданы или уничтожены . Тем не менее, масса и энергия, связанные с таким веществом , остаются неизменными в количестве во всех этих процессах. Было обнаружено, что масса покоя атомного ядра значительно меньше суммы масс покоя составляющих его протонов, нейтронов и электронов .Масса больше не считалась неизменной в замкнутой системе. Разница является мерой энергии связи ядра, которая удерживает ядро вместе. Согласно соотношению Эйнштейна ( E = mc 2 ), эта энергия связи пропорциональна этой разности масс, известной как дефект массы .
«Пример:
Рассчитайте дефект массы ядра 63 Cu , если фактическая масса 63 Cu в основном ядерном состоянии равна 62.91367 у. 63 Ядро Cu имеет 29 протонов, а также (63 – 29) 34 нейтрона.
Масса протона 1,00728 ед., и нейтрона 1,00867 ед. .
Комбинированная масса: 29 протонов х (1.00728 U / протон) + 34 нейтроны x (1.00867 U / Neutrons) = 63.50590 U
Массовый дефект — 62,91367 u = 0.59223 U = 0.59223
Преобразование дефекта массы в энергию (энергию ядерной связи).
(0.59223 U / NUCLEUS) x (1.6606 x 10 -27 9.8346 x 10 -28 кг / ядро
ΔE = ΔMC 2
ΔE = ( 9,8346 x 10 -28 кг/ядро) x (2,9979 x 10 8 м/с) 2 = 8,8387 x 10 -11 Дж/ядро
энергия связи ядра . Однако энергия связи ядра может быть выражена в кДж/моль (для лучшего понимания).Рассчитайте энергию связи ядер 1 моля 63 Cu:
(8,8387 x 10 -11 Дж/ядро) x (1 кДж/1000 Дж) x (6,022 x 10 23 ядер/моль) = 5,3227 х 10 10 кДж/моль ядер.
Один моль 63 Cu (~63 грамма) связан энергией связи ядра (5,3227 x 10 10 кДж/моль), что эквивалентно:
- 14,8 миллиона киловатт-часов (≈ 15 ГВт·ч)
- 336 100 галлонов США автомобильного бензина
«Пример:
Рассчитайте дефект массы 3000 МВт активной зоны одного года эксплуатации одного годаСредняя восстанавливаемая энергия на одно деление составляет около 200 МэВ , что представляет собой полную энергию за вычетом энергии излучаемых антинейтрино.
Скорость реакции на всю 3000 МВт й активной зоны реактора составляет около 9,33×10 19 делений в секунду .
Суммарное энерговыделение в джоулях: 1 ) х 31.5 × 10 6 (секунды в год) = 9. 4 × 10 16 J / год
4 × 10 16 J / год
Массовый дефект рассчитывается как:
Δm = ΔE / C 2
ΔM = 9,4 × × × × × 10 16 / (2,9979 x 10 8 ) 2 = 1,046 кг
Обратите внимание, что типичная годовая загрузка урана для активной зоны реактора мощностью 3000 МВтт составляет около 20 тонн из обогащенного урана (т.е., о 22,7 т UO 2 ). Вся активная зона реактора может содержать около 80 тонн обогащенного урана.
Дефект массы непосредственно из E=mc
2Дефект массы можно рассчитать непосредственно из соотношения Эйнштейна ( E = mc 2 ) как:
Δm = ΔE/c 2 2 2224 2 2 = 3000×10 6 (W = Дж/с) x 31,5×10 6 (секунд в году) / (2,9979 x 10 8 ) 2 = 1.051 кг
Кривая энергии связи ядер.
Источник: гиперфизика. Таким образом, эта масса удаляется из общей массы исходных частиц, и масса отсутствует в образовавшемся ядре. Энергии связи ядер огромны, и они в миллион раз превышают энергии связи электронов атомов.
Как правило, в обеих химических и ядерных реакциях происходит некоторое преобразование между массой покоя и энергией, так что продукты обычно имеют меньшую или большую массу, чем реагенты. Поэтому новым принципом сохранения является сохранение массовой энергии .
См. также: Выделение энергии при делении.
”
Материя – Антиматерия творение происходит естественным образом в высокоэнергетических процессах с участием космических лучей, а также в высокоэнергетических экспериментах на ускорителях на Земле.Высокоэнергетические космические лучи, сталкиваясь с земной атмосферой (или любым другим веществом в Солнечной системе), производят мельчайшие количества античастиц в образующихся струях частиц, которые немедленно аннигилируют при контакте с ближайшим веществом. Присутствие образовавшейся антивещества можно обнаружить по двум гамма-лучам (с энергией 511 кэВ), возникающим каждый раз, когда позитроны аннигилируют с соседним веществом.
Присутствие образовавшейся антивещества можно обнаружить по двум гамма-лучам (с энергией 511 кэВ), возникающим каждый раз, когда позитроны аннигилируют с соседним веществом.Создание антивещества также очень распространено в ядерном распаде многих изотопов.Предположим, произошел распад калия-40 . Природный калий состоит из трех изотопов, из которых 40 K является радиоактивным . Следы 40 К обнаружены во всем калии, и это наиболее распространенный радиоизотоп в человеческом организме . 40 K представляет собой радиоактивный изотоп калия с очень длительным периодом полураспада 1,251×10 9 лет и подвергается обоим типам бета-распада .
- Около 89,28% времени (10.72% приходится на электронный захват), он распадается до кальция-40 ( 40 Ca) с испусканием бета-частиц (β − , электрон) с максимальной энергией 1,33 МэВ и антинейтрино , которая является античастицей нейтрино.

- Очень редко (0,001% времени) он распадается на 40 Ar, испуская позитрон (β+) и нейтрино.
Еще одним очень интересным источником антиматерии является ядерный реактор .Ядерные реакторы – основной источник антинейтрино, созданных человеком. Это связано с тем, что антинейтрино образуются при отрицательном бета-распаде. В ядерном реакторе происходит особенно распад β − , потому что общей чертой осколков деления является избыток нейтронов. Обратите внимание, что миллиардов солнечных нейтрино в секунду проходят (в основном без взаимодействия) через каждый квадратный сантиметр (~6×10 10 ) на поверхности Земли, и антинейтринное излучение ни в коем случае не опасно.
Наконец, дело в том, что антиматерия гораздо более распространена, чем может показаться.
В январе 2011 года исследования Американского астрономического общества обнаружили антивещества (позитронов) , возникающих над грозовыми облаками . Предполагается, что эти позитроны образуются в земных гамма-вспышках (TGF). Эти положения создаются вспышками гамма-излучения, создаваемыми электронами, ускоряемыми сильными электрическими полями в облаках. TGF — это короткие вспышки, возникающие во время грозы и связанные с молнией.Потоки позитронов и электронов сталкиваются выше в атмосфере, генерируя больше гамма-лучей. Ежедневно в мире может происходить около 500 TGF, но в большинстве случаев они остаются незамеченными.
Предполагается, что эти позитроны образуются в земных гамма-вспышках (TGF). Эти положения создаются вспышками гамма-излучения, создаваемыми электронами, ускоряемыми сильными электрическими полями в облаках. TGF — это короткие вспышки, возникающие во время грозы и связанные с молнией.Потоки позитронов и электронов сталкиваются выше в атмосфере, генерируя больше гамма-лучей. Ежедневно в мире может происходить около 500 TGF, но в большинстве случаев они остаются незамеченными.
См. также: Производство электронно-позитронных пар.
См. также: Реактор как источник антинейтрино
Материя — Аннигиляция антиматерии
Когда позитрон (частица антиматерии) останавливается, он взаимодействует с электроном, что приводит к аннигиляции обеих частиц и полному преобразованию их массы покоя в чистую энергию в виде двух противоположно направленных 0.Фотоны с энергией 511 МэВ. Как было написано, частица и ее античастица имеют одинаковую массу, но противоположный электрический заряд и другие различия в квантовых числах. Это означает, что протон имеет положительный заряд, а антипротон — отрицательный, и поэтому они притягиваются друг к другу. Известно, что столкновение любой частицы с ее партнером-античастицей приводит к их взаимной аннигиляции. Поскольку материя и антиматерия несут огромное количество энергии (из-за E = mc 2 ), их взаимная аннигиляция связана с образованием интенсивных фотонов (гамма-лучей), нейтрино, а иногда и менее массивных частиц-античастиц. пары.
Это означает, что протон имеет положительный заряд, а антипротон — отрицательный, и поэтому они притягиваются друг к другу. Известно, что столкновение любой частицы с ее партнером-античастицей приводит к их взаимной аннигиляции. Поскольку материя и антиматерия несут огромное количество энергии (из-за E = mc 2 ), их взаимная аннигиляция связана с образованием интенсивных фотонов (гамма-лучей), нейтрино, а иногда и менее массивных частиц-античастиц. пары.
Одним из самых известных процессов является электрон-позитронная аннигиляция . Электрон-позитронная аннигиляция происходит при столкновении отрицательно заряженного электрона и положительно заряженного позитрона. Когда низкоэнергетический электрон аннигилирует низкоэнергетический позитрон (античастица электрона), он может произвести только два или более фотона (гамма-лучи). Производство только одного фотона запрещено из-за сохранения линейного импульса и полной энергии. Производство другой частицы также запрещено, потому что обе частицы (электрон-позитрон) вместе не несут достаточно массовой энергии для производства более тяжелых частиц.Когда электрон и позитрон сталкиваются, они аннигилируют, что приводит к полному превращению их массы покоя в чистую энергию (согласно формуле E=mc 2 ) в виде двух противоположно направленных гамма-лучей (фотонов) с энергией 0,511 МэВ.
Производство другой частицы также запрещено, потому что обе частицы (электрон-позитрон) вместе не несут достаточно массовой энергии для производства более тяжелых частиц.Когда электрон и позитрон сталкиваются, они аннигилируют, что приводит к полному превращению их массы покоя в чистую энергию (согласно формуле E=mc 2 ) в виде двух противоположно направленных гамма-лучей (фотонов) с энергией 0,511 МэВ.
e − + e + → γ + γ (2x 0,511 МэВ)
Этот процесс должен удовлетворять многим законам сохранения, включая:
- Сохранение электрического заряда. Чистый заряд до и после равен нулю.
- Сохранение импульса и полной энергии. T
- Сохранение момента импульса.
Закон сохранения материи в гидродинамике
Масса не может быть ни создана, ни уничтожена.
Уравнение непрерывности – Определение Этот принцип широко известен как принцип сохранения материи . В нем говорится, что масса объекта или набора объектов никогда не меняется с течением времени, независимо от того, как перестраиваются составные части.Этот принцип можно использовать при анализе протекающих жидкостей . Сохранение массы в гидродинамике утверждает, что все массовых расходов в контрольном объеме равны всем массовым расходам из контрольного объема плюс скорость изменения массы в контрольном объеме. Этот принцип математически выражается следующим уравнением: контрольный объем в единицу времениПример скорости потока в реакторе.Это иллюстративный пример, и данные не представляют какой-либо конструкции реактора.
В нем говорится, что масса объекта или набора объектов никогда не меняется с течением времени, независимо от того, как перестраиваются составные части.Этот принцип можно использовать при анализе протекающих жидкостей . Сохранение массы в гидродинамике утверждает, что все массовых расходов в контрольном объеме равны всем массовым расходам из контрольного объема плюс скорость изменения массы в контрольном объеме. Этот принцип математически выражается следующим уравнением: контрольный объем в единицу времениПример скорости потока в реакторе.Это иллюстративный пример, и данные не представляют какой-либо конструкции реактора.
Это уравнение описывает нестационарный поток . Нестационарный поток относится к состоянию, при котором свойства жидкости в любой точке системы могут изменяться с течением времени. Установившийся поток относится к состоянию, при котором свойства жидкости ( температура, давление и скорость ) в любой точке системы не изменяются с течением времени . Но одним из наиболее важных постоянных свойств в системе с установившимся потоком является массовый расход системы.Это означает, что не происходит накопления массы ни в одном компоненте системы.
Но одним из наиболее важных постоянных свойств в системе с установившимся потоком является массовый расход системы.Это означает, что не происходит накопления массы ни в одном компоненте системы.
См. также: Уравнение неразрывности
Уравнение неразрывности
Уравнение неразрывности является просто математическим выражением принципа сохранения массы. Для контрольного объема с одним входом и одним выходом принцип сохранения массы гласит, что для стационарного потока массовый расход в объеме должен равняться массовому расходу на выходе.
ṁ in = ṁ out
Масса на входе в единицу времени = масса на выходе в единицу времени
Это уравнение называется уравнением неразрывности для установившегося одномерного потока. Чистый массовый расход должен быть равен нулю для установившегося потока через контрольный объем с множеством входов и выходов, где отрицательные притоки и оттоки положительны.
Этот принцип можно применить к трубке потока , такой как показанная выше. Жидкость не течет через границу, образованную линиями тока , , поэтому масса входит и выходит только через два конца этой секции трубки потока.
Когда жидкость находится в движении, она должна двигаться таким образом, чтобы сохранялась масса. Чтобы увидеть, как закон сохранения массы накладывает ограничения на поле скоростей, рассмотрим стационарный поток жидкости через воздуховод (то есть входной и выходной потоки не меняются со временем).
Дифференциальная форма уравнения неразрывности
Общее уравнение неразрывности также может быть записано в дифференциальной форме :
∂⍴ ⁄ ∂t + ∇ . (⍴ ͞v) = σ
, где
- ∇ .— дивергенция,
- ρ — плотность количества q,
- ⍴ ͞v — поток количества q,
- σ — генерация q в единице объема в единицу времени. Термины, которые генерируют (σ > 0) или удаляют (σ < 0) q, называются «источниками» и «стоками» соответственно.
 Если q — сохраняющаяся величина (например, энергия), σ равно 0.
Если q — сохраняющаяся величина (например, энергия), σ равно 0.
Закон сохранения массы: определение, уравнение и примеры — видео и расшифровка урока
Важность
Открытие закона сохранения массы помогло превратить химию в респектабельную науку, которой она является сегодня.Химия имеет свои основы в алхимии, прото-науке, которая вложила много сил в магию и мистицизм. С появлением закона сохранения массы химики взяли тайну и иллюзию алхимии и привнесли предсказуемость и надежность в химическую науку.
Закон сохранения массы очень важен для изучения и производства химических реакций. Если ученые знают количество и состав реагентов для конкретной реакции, они могут предсказать количество продуктов, которые будут получены.Производители химических веществ могут повысить эффективность, применяя закон сохранения массы к своей лабораторной практике.
Примеры
Представьте, что вы зажигаете свой газовый гриль для первого летнего барбекю. Пропан из вашего тяжелого бензобака вступает в реакцию с кислородом воздуха, образуя горячее голубое пламя. Продуктами этой реакции являются водяной пар и углекислый газ.
Пропан из вашего тяжелого бензобака вступает в реакцию с кислородом воздуха, образуя горячее голубое пламя. Продуктами этой реакции являются водяной пар и углекислый газ.
Если бы вы собирали весь водяной пар и углекислый газ, образующиеся при приготовлении пищи на гриле, общая масса равнялась бы массе пропана и кислорода, которые пошли в реакцию.Если используется 100 граммов пропана и кислорода, то образуется 100 граммов водяного пара и углекислого газа.
В другом сценарии вы позволили 10-граммовому кубику льда растаять в закрытом контейнере в жаркий день. Хотя кубик льда будет постепенно менять форму, превращаясь из жидкости в пар, масса контейнера никогда не изменится. Даже после полного испарения масса воды в системе составит 10 грамм.
Уравнения
Закон сохранения массы соблюдается в сбалансированном химическом уравнении , которое показывает, что вся масса сохраняется на протяжении всей реакции. В сбалансированном химическом уравнении количество и типы атомов в каждой части уравнения должны быть равными.
В сбалансированном химическом уравнении количество и типы атомов в каждой части уравнения должны быть равными.
Химические уравнения, не подчиняющиеся закону сохранения массы, известны как несбалансированных уравнений или скелетных уравнений . Это химическое уравнение не подчиняется закону сохранения массы:
Мы знаем, что это уравнение несбалансировано, потому что количество и виды атомов неодинаковы по обе стороны уравнения.Например, на стороне реагентов три атома углерода, а на стороне продуктов только один. На стороне реагентов восемь атомов водорода, а на стороне продуктов только два.
Для сравнения, уравнение ниже действительно подчиняется закону сохранения массы.
Обратите внимание, что в приведенном выше уравнении перед каждым химическим веществом добавлены коэффициенты. Эти коэффициенты такие же, как и в математике; число коэффициента изменяет количество атомов или молекул каждого типа, присутствующих для того, чтобы произошла реакция. Мы знаем, что это уравнение уравновешено, потому что количество и виды атомов одинаковы с обеих сторон. С каждой стороны по три атома углерода, восемь атомов водорода и десять атомов кислорода.
Мы знаем, что это уравнение уравновешено, потому что количество и виды атомов одинаковы с обеих сторон. С каждой стороны по три атома углерода, восемь атомов водорода и десять атомов кислорода.
Резюме урока
Закон сохранения массы гласит, что в замкнутой системе масса системы не может меняться со временем. Мы можем вспомнить закон сохранения массы с помощью этого простого утверждения:
- Масса реагентов должна равняться массе продуктов.
Закон сохранения массы соблюдается в сбалансированном химическом уравнении , которое показывает, что вся масса сохраняется на протяжении всей реакции. Химические уравнения, которые не подчиняются закону сохранения массы, известны как несбалансированных уравнения или скелетных уравнения .
Сохранение массовой лексики и определений
- Закон сохранения массы : Этот закон гласит, что масса системы не может изменяться со временем в замкнутой системе.

- Сбалансированное химическое уравнение : Когда масса подвергается химической реакции, это химическое уравнение показывает, что вся масса сохраняется.
- Несбалансированное уравнение/уравнения скелета : Эти химические уравнения появляются, когда химическая реакция на массу не подчиняется закону сохранения массы.
Результаты обучения
После завершения этого урока учащиеся должны уметь:
- Давать определение закону сохранения массы
- Объясните сбалансированные химические уравнения и несбалансированные уравнения
4.2: Закон сохранения материи
В науке закон — это общее утверждение, объясняющее большое количество наблюдений. Прежде чем быть принятым, закон должен быть многократно проверен при многих условиях. Поэтому законы считаются высшей формой научного знания и обычно считаются неприкосновенными. Научные законы составляют ядро научного знания. Одним из научных законов, лежащих в основе понимания химии, является закон сохранения материи. В нем говорится, что в любой данной системе, закрытой для переноса материи (входящей и исходящей), количество материи в системе остается постоянным. Краткий способ выразить этот закон состоит в том, чтобы сказать, что количество материи в системе равно 90 813 сохраненных 90 814 .
В нем говорится, что в любой данной системе, закрытой для переноса материи (входящей и исходящей), количество материи в системе остается постоянным. Краткий способ выразить этот закон состоит в том, чтобы сказать, что количество материи в системе равно 90 813 сохраненных 90 814 .
С развитием более точных представлений об элементах, соединениях и смесях ученые начали исследовать, как и почему вещества реагируют. Французский химик А. Лавуазье положил начало научному изучению вещества, указав, что вещества реагируют по определенным законам.{\text{Кислород}}}_{\text{7,4 г}} \]
Другой способ выразить это так: «В химической реакции материя не создается и не разрушается». Закон сохранения массы также известен как «закон неразрушимости материи».
Пример \(\PageIndex{1}\)
Если при нагревании 10 граммов \(\ce{CaCO3}\) образуется 4,4 г \(\ce{CO2}\) и 5,6 г \(\ce{CaO}\), покажите, что эти наблюдения согласуются с закон сохранения массы.
Образец карбоната кальция (CaCO 3 ). (Общественное достояние; Уокерма).
(Общественное достояние; Уокерма).
Раствор
- Масса реагентов, \(\ce{CaCO3}\) : \(10 \,г\)
- Массы продуктов, \(\ce{CO2}\) и \(\ce{CaO}\): \(4,4 \,г+ 5,6\, г = 10\, г\).
Поскольку масса реагентов = масса продуктов, наблюдения согласуются с законом сохранения массы.
Что это значит для химии? При любом химическом изменении одно или несколько исходных веществ превращаются в другое вещество или вещества.И начальная, и конечная субстанции состоят из атомов, потому что вся материя состоит из атомов. Согласно закону сохранения материи, материя не создается и не разрушается, поэтому после химического изменения мы должны иметь того же числа и вида атомов , что и до химического изменения.
Может показаться, что горение уничтожает материю, но после костра остается то же количество или масса материи, что и раньше. На рис. 5.1.1 показано, что при горении древесина соединяется с кислородом и превращается не только в пепел, но и в углекислый газ и водяной пар. Газы улетучиваются в воздух, оставляя только пепел. Предположим, мы измерили массу дров до того, как они сгорели, и массу пепла после того, как они сгорели. Предположим также, что мы смогли измерить количество кислорода, используемого при пожаре, и газов, образующихся при пожаре. Что бы мы нашли? Общая масса материи после пожара будет такой же, как и общая масса материи до пожара.
Газы улетучиваются в воздух, оставляя только пепел. Предположим, мы измерили массу дров до того, как они сгорели, и массу пепла после того, как они сгорели. Предположим также, что мы смогли измерить количество кислорода, используемого при пожаре, и газов, образующихся при пожаре. Что бы мы нашли? Общая масса материи после пожара будет такой же, как и общая масса материи до пожара.
Упражнение \(\PageIndex{1}\)
- Что такое закон сохранения материи?
- Как закон сохранения материи применим к химии?
- Ответ а:
Закон сохранения материи гласит, что в любой данной системе, закрытой для переноса материи, количество материи в системе остается постоянным
- Ответ б:
Закон сохранения вещества гласит, что в химических реакциях общая масса продуктов должна равняться общей массе реагентов.

сохранения массы — Студенты | Britannica Kids
Введение
Британская энциклопедия, Inc.Закон сохранения массы является фундаментальным принципом физики. Согласно этому закону материя не может быть ни создана, ни уничтожена. Другими словами, масса объекта или совокупности объектов никогда не меняется, как бы ни переставлялись части. В обычной химической реакции сумма масс реагирующих веществ (веществ, претерпевающих превращение) равна сумме масс продуктов (веществ, образующихся в результате реакции).Например, масса древесины и кислорода, исчезающих при сгорании, равна массе водяного пара, углекислого газа, дыма и золы, образующихся в результате реакции.
Сохранение массы в химических и физических системах
Масса сохраняется в химических реакциях, потому что в реагентах присутствуют те же самые атомы, что и в продуктах, хотя они комбинируются по-разному. Например, кальций (Ca) может реагировать с кислородом (O 2 ) с образованием соединения оксида кальция (CaO):
2 Ca + O 2 → 2 CaO
Обратите внимание, что реагенты состоят из 2 атомов кальция и 1 молекула кислорода, которая содержит 2 атома кислорода. Продукт представляет собой 2 молекулы оксида кальция, каждая из которых состоит из 1 атома кальция и 1 атома кислорода. Количество и типы атомов до реакции — 2 атома кальция и 2 атома кислорода — равны количеству и типам атомов в продукте — 2 атома кальция и 2 атома кислорода. Атомы в продукте расположены иначе, чем в реагентах, но до и после реакции присутствует одинаковое количество и тип массы.
Продукт представляет собой 2 молекулы оксида кальция, каждая из которых состоит из 1 атома кальция и 1 атома кислорода. Количество и типы атомов до реакции — 2 атома кальция и 2 атома кислорода — равны количеству и типам атомов в продукте — 2 атома кальция и 2 атома кислорода. Атомы в продукте расположены иначе, чем в реагентах, но до и после реакции присутствует одинаковое количество и тип массы.
Масса также сохраняется, когда материя претерпевает физические изменения, например изменения состояния.Например, вода состоит из атомов водорода и кислорода и имеет химическую формулу H 2 O. Вода может существовать в трех состояниях: твердом (лед), жидком и газообразном (водяной пар или пар). Масса образца воды останется неизменной независимо от изменения состояния. Если растопить 1 грамм кубиков льда, получится 1 грамм жидкой воды и, при повышении температуры, 1 грамм водяного пара:
1 г H 2 O льда = 1 г H 2 O воды = 1 г H 2 O пар
Кроме того, количество атомов водорода и кислорода во льду будет равно количеству атомов водорода и кислорода в жидкой воде и водяном паре.
Сохранение массы в живых системах
Encyclopædia Britannica, Inc.Закон сохранения массы применим и к движению материи в живых системах. По мере того, как питательные вещества перемещаются через биосферу, элементы непрерывно переносятся между организмами и окружающей их средой посредством биогеохимических циклов, таких как круговорот азота и круговорот фосфора.
Движение углерода в углеродном цикле является хорошим примером сохранения массы в живых системах.Источником углерода в живой материи является углекислый газ, находящийся в воздухе или растворенный в воде. В земной среде растения используют углекислый газ из воздуха для производства углеводов посредством фотосинтеза. Эти соединения переходят к травоядным — организмам, поедающим растения, — а затем к организмам, поедающим травоядных. Чтобы получить энергию, организмы расщепляют углеводы посредством клеточного дыхания, высвобождая углекислый газ обратно в атмосферу. Углерод в животных отходах и в тканях мертвых организмов выделяется в окружающую среду в результате разложения. Часть углерода возвращается в атмосферу в виде углекислого газа. Однако некоторая часть углерода хранится под землей. Углерод в ископаемом топливе, таком как уголь и нефть, происходит из разложившихся тканей растений и животных, отложившихся миллионы лет назад. Этот углерод возвращается в атмосферу в результате сгорания при сжигании этих видов топлива. Горение также объясняет выделение углекислого газа при сжигании растительности и при извержении вулканов.
Часть углерода возвращается в атмосферу в виде углекислого газа. Однако некоторая часть углерода хранится под землей. Углерод в ископаемом топливе, таком как уголь и нефть, происходит из разложившихся тканей растений и животных, отложившихся миллионы лет назад. Этот углерод возвращается в атмосферу в результате сгорания при сжигании этих видов топлива. Горение также объясняет выделение углекислого газа при сжигании растительности и при извержении вулканов.
Углерод также перемещается в водных экосистемах, где растворенный в воде углекислый газ поглощается водорослями и фитопланктоном для фотосинтеза и возвращается в воду посредством клеточного дыхания.Углерод, отложившийся в донных отложениях из разложившихся останков организмов, способствует образованию минеральных соединений, которые некоторые водные животные, например устрицы, включают в свои раковины.
Круговорот углерода показывает, что одни и те же атомы углерода могут — в течение тысячелетий — неоднократно перемещаться между организмами, атмосферой, почвой и океанами. Углерод, выделяемый животным в виде двуокиси углерода, может оставаться в атмосфере в течение 5 или 10 лет, прежде чем будет поглощен другим организмом, или же углерод может почти сразу возвращаться в соседнее растение и использоваться в процессе фотосинтеза.Даже когда организмы умирают, углерод в их тканях не разрушается, хотя он может менять форму по мере того, как циркулирует в окружающей среде.
Углерод, выделяемый животным в виде двуокиси углерода, может оставаться в атмосфере в течение 5 или 10 лет, прежде чем будет поглощен другим организмом, или же углерод может почти сразу возвращаться в соседнее растение и использоваться в процессе фотосинтеза.Даже когда организмы умирают, углерод в их тканях не разрушается, хотя он может менять форму по мере того, как циркулирует в окружающей среде.
Закон сохранения массы-энергии
Однако закон сохранения массы не всегда верен. Специальная теория относительности Альберта Эйнштейна, представленная в 1905 году, показала, что масса и энергия эквивалентны, поэтому массу можно преобразовать в энергию и наоборот. Некоторое преобразование между массой и энергией происходит как в химических, так и в ядерных реакциях, так что продукты обычно имеют меньшую или большую массу, чем реагенты.Разница в массе для обычных химических реакций настолько незначительна, что закон сохранения массы все еще считается верным. Однако в ядерных реакциях превращение массы в энергию достаточно существенно, чтобы сделать закон недействительным. В свете этого открытия закон сохранения массы был объединен с законом сохранения энергии, чтобы создать закон сохранения массы-энергии.
В свете этого открытия закон сохранения массы был объединен с законом сохранения энергии, чтобы создать закон сохранения массы-энергии.
Закон сохранения массы | История, Формула, Пример
Определение закона сохранения массы
Закон сохранения массы гласит, что «масса в изолированной системе не может быть ни создана, ни уничтожена, но может быть преобразована из одной формы в другую».
По закону сохранения массы масса реагентов должна быть равна массе продуктов для низкоэнергетического термодинамического процесса.
Допущения закона сохранения массы
- Считается, что есть несколько допущений классической механики, определяющих сохранение массы.
- Позже закон сохранения массы был изменен с помощью квантовой механики и специальной теории относительности, что энергия и масса являются одной сохраняющейся величиной.
- В 1789 году Антуан Лоран Лавуазье открыл закон сохранения массы. Закон сохранения массы или принцип сохранения массы гласит, что для любой системы замкнуты все переносы вещества и энергии.
 Масса системы должна оставаться постоянной во времени. Поскольку масса системы не может измениться, количество нельзя ни добавить, ни убрать. Следовательно, количество массы сохраняется во времени.
Масса системы должна оставаться постоянной во времени. Поскольку масса системы не может измениться, количество нельзя ни добавить, ни убрать. Следовательно, количество массы сохраняется во времени. - Закон подразумевает, что масса не может быть ни создана, ни уничтожена.Хотя он может быть переставлен в пространстве, или связанные с ним сущности могут быть изменены по форме.
Закон сохранения массы-энергии
Этот закон позже был изменен Эйнштейном в законе сохранения массы-энергии. Что описывает тот факт, что полная масса и энергия в системе остаются постоянными. Эта поправка включает тот факт, что масса и энергия могут быть преобразованы друг в друга.
Однако закон сохранения массы остается полезным понятием в химии.Поскольку энергия, производимая или потребляемая в типичной химической реакции, составляет незначительное количество массы.
Следовательно, мы можем представить себе химические реакции как перегруппировку атомов и связей. При этом количество атомов, участвующих в реакции, остается неизменным.
Это предположение позволяет нам представить химическую реакцию в виде сбалансированного уравнения, в котором количество молей любого участвующего элемента одинаково в обеих частях уравнения.
Еще одним полезным применением этого закона является определение масс газообразных реагентов и продуктов.Если суммы твердых или жидких реагентов и продуктов известны, любую оставшуюся массу можно отнести к газу.
История
Важной идеей древнегреческой философии было то, что «Ничто не происходит из ничего». Так что то, что существует сейчас, существовало всегда: никакая новая материя не может возникнуть там, где ее раньше не было.
Явное утверждение этого, наряду с дальнейшим принципом, что ничто не может перейти в ничто, мы находим у Эмпедокла. «Ибо невозможно, чтобы что-то произошло из того, чего нет, и нельзя произвести или услышать о том, что должно быть совершенно уничтожено.
Еще один принцип сохранения был сформулирован Эпикуром около 3 века до н. э., который, описывая природу Вселенной, писал, что «совокупность вещей всегда была такой, какая она есть сейчас, и всегда будет». Джайнская философия, некреационистская философия, основанная на учении Махавиры (6 век до н.э.), утверждает, что Вселенная и ее составляющие, такие как материя, не могут быть разрушены или созданы.
э., который, описывая природу Вселенной, писал, что «совокупность вещей всегда была такой, какая она есть сейчас, и всегда будет». Джайнская философия, некреационистская философия, основанная на учении Махавиры (6 век до н.э.), утверждает, что Вселенная и ее составляющие, такие как материя, не могут быть разрушены или созданы.
Джайнский текст Таттвартасутра (2 век н.э.) утверждает, что субстанция постоянна, но ее формы характеризуются созиданием и разрушением.
Насир ад-Дин ат-Туси (около 13 века нашей эры) также сформулировал принцип сохранения материи.
Он писал: «Тело материи не может полностью исчезнуть. Она лишь меняет свою форму, состояние, состав, цвет и другие свойства и превращается в другую сложную или элементарную материю».
Открытие закона сохранения массы в химии
- К 18 веку широко использовался принцип сохранения массы при химических реакциях.Это было важным предположением во время экспериментов, даже до того, как определение было официально установлено, как это можно увидеть в работах Джозефа Блэка, Генри Кавендиша и Джин Рея.

- Первым, кто изложил этот принцип, был Михаил Ломоносов в 1756 году. Возможно, он продемонстрировал его экспериментально и определенно обсуждал этот принцип в 1748 году в переписке с Леонардом Эйлером, хотя его утверждение по этому вопросу иногда оспаривается. По словам советского физика Яакова Дорфмана:
- Ломоносов сформулировал универсальный закон, исходя из общефилософских материалистических соображений.Это никогда не подвергалось сомнению или проверке им, а наоборот. Это послужило ему надежной отправной точкой во всех исследованиях на протяжении всей его жизни.
- Позже Антуан Лавуазье провел более совершенную серию экспериментов. Который высказал свой вывод в 1773 г. и популяризировал сохранение массы. Демонстрация принципа опровергла популярную в то время теорию флогистона, согласно которой масса может увеличиваться или уменьшаться в процессах горения и нагревания.
- Сохранение массы на протяжении тысячелетий оставалось неясным из-за выталкивающего эффекта земной атмосферы на вес газов.
 Например, кусок дерева после сжигания весит меньше; казалось, это предполагает, что часть его массы исчезает, трансформируется или теряется. Это не было опровергнуто до тех пор, пока не были проведены тщательные эксперименты, в которых химические реакции, такие как ржавление, могли происходить в запаянных стеклянных ампулах; было установлено, что химическая реакция не изменила вес запечатанного контейнера и его содержимого. Взвешивание газов с помощью весов было невозможно до изобретения вакуумного насоса в 17 веке.
Например, кусок дерева после сжигания весит меньше; казалось, это предполагает, что часть его массы исчезает, трансформируется или теряется. Это не было опровергнуто до тех пор, пока не были проведены тщательные эксперименты, в которых химические реакции, такие как ржавление, могли происходить в запаянных стеклянных ампулах; было установлено, что химическая реакция не изменила вес запечатанного контейнера и его содержимого. Взвешивание газов с помощью весов было невозможно до изобретения вакуумного насоса в 17 веке.
Важность закона сохранения массы
- Открытие закона сохранения массы помогло превратить химию в респектабельную науку, которой она является сегодня. Химия имеет свои основы в алхимии, прото-науке, которая вложила много сил в магию и мистицизм. С появлением закона сохранения массы химики взяли тайну и иллюзию алхимии и привнесли в химию предсказуемость и надежность.
- Закон сохранения массы лежит в основе изучения и производства химических реакций.
 Если ученые знают количество и состав реагентов для конкретной реакции. Затем они могут предсказать количество произведенной продукции. Производители химических веществ могут повысить эффективность, применяя закон сохранения массы к своей лабораторной практике.
Если ученые знают количество и состав реагентов для конкретной реакции. Затем они могут предсказать количество произведенной продукции. Производители химических веществ могут повысить эффективность, применяя закон сохранения массы к своей лабораторной практике.
Формула закона сохранения массы
Закон сохранения массы может быть выражен в дифференциальной форме с использованием уравнения неразрывности в гидромеханике и механике сплошной среды как:
∂ρ / ∂t+▽(ρv) = 0
где,
- ρ — плотность.
- т это время.
- v — скорость.
- ▽ – дивергенция.
Примеры
Процесс сжигания
Сжигание древесины — это сохранение массы, поскольку при сжигании древесины используются кислород, углекислый газ, водяной пар и зола.
Химические реакции:
Для получения одной молекулы H 2 O (воды) с молекулярной массой 10 к водороду с молекулярной массой 2 добавляют кислород с молекулярной массой 8, тем самым сохраняя массу.
- Аналогичным законом сохранения массы является пример изображения горящей свечи. Для этого примера представьте обычную свечу с воском и фитилем. Однако, как только свеча полностью сгорит, вы увидите, что воска стало намного меньше, чем было до того, как вы ее зажгли. Это означает, что часть воска (не весь, как вы, вероятно, заметили по зажженным свечам в реальной жизни!) превратилась в газы, а именно в водяной пар и углекислый газ. Как показал предыдущий пример с костром, никакая материя (и, следовательно, никакая масса) не теряется в процессе горения.
Вопросы по закону сохранения массы
Вот несколько вопросов, основанных на законе сохранения массы
Вопрос-1
грамм карбоната кальция (CaCO 3 ) дает 3,8 грамма диоксида углерода (CO 2 ) и 6,2 грамма оксида кальция (CaO). Представьте эту реакцию в терминах закона сохранения массы.
Решение:
По закону сохранения массы:
Масса реагентов = Масса продуктов
∴ 10 грамм CaCO 3 = 3.
 Целеполагание.
Целеполагание.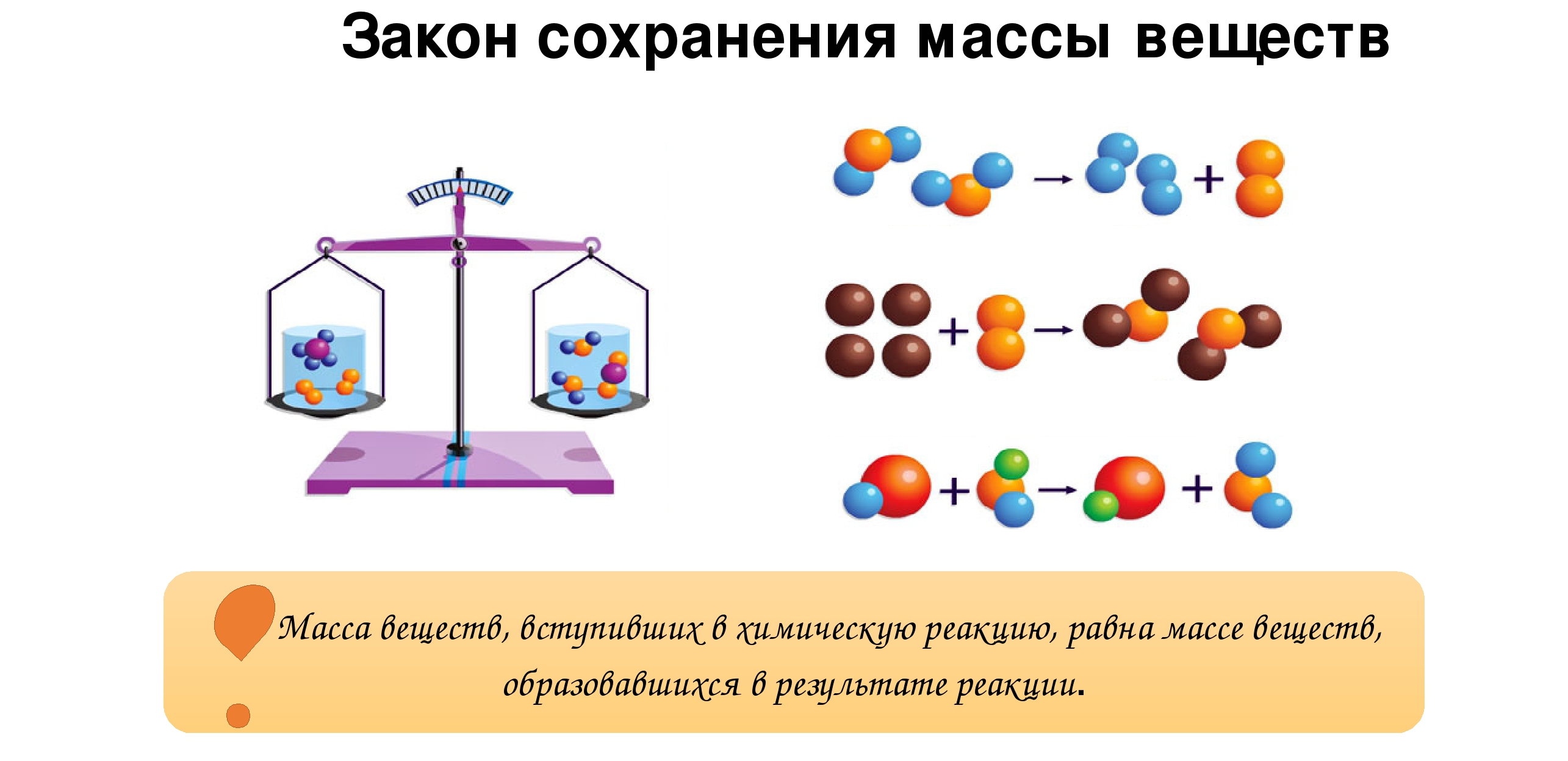

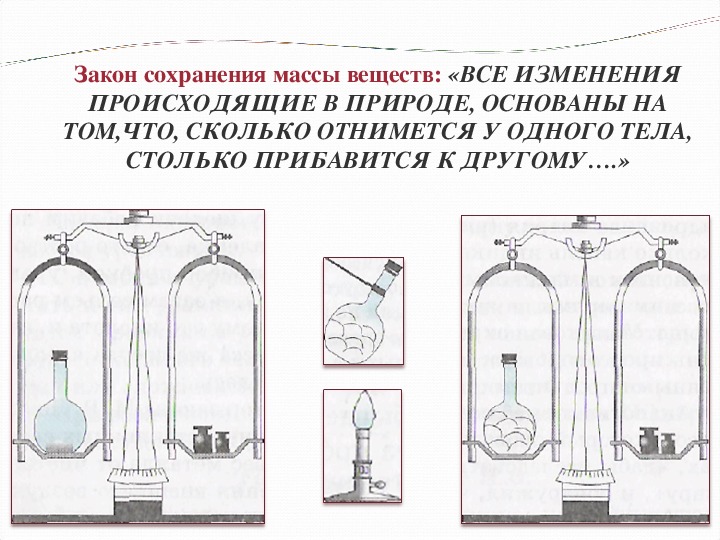 Для этого в левой части запишем формулы исходных веществ ( Al и О2), соединим их знаком плюс, а затем поставим стрелку (→):
Для этого в левой части запишем формулы исходных веществ ( Al и О2), соединим их знаком плюс, а затем поставим стрелку (→):
 — 2 раза
— 2 раза



 Так, сколько материи прибавляется к какому-либо телу, столько же теряется у другого, сколько часов я затрачиваю на сон, столько же отнимаю от бодрствования и т. д.
Так, сколько материи прибавляется к какому-либо телу, столько же теряется у другого, сколько часов я затрачиваю на сон, столько же отнимаю от бодрствования и т. д.


 Затем трубку снова взвешивают для определения общей массы продуктов.
Затем трубку снова взвешивают для определения общей массы продуктов.
 org/wiki/Mass_conservation
org/wiki/Mass_conservation
 Если q — сохраняющаяся величина (например, энергия), σ равно 0.
Если q — сохраняющаяся величина (например, энергия), σ равно 0.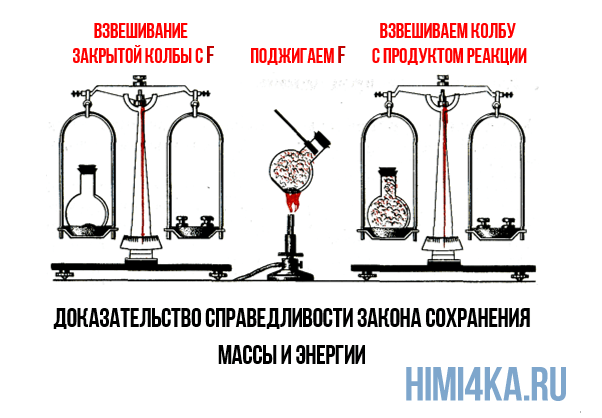

 Масса системы должна оставаться постоянной во времени. Поскольку масса системы не может измениться, количество нельзя ни добавить, ни убрать. Следовательно, количество массы сохраняется во времени.
Масса системы должна оставаться постоянной во времени. Поскольку масса системы не может измениться, количество нельзя ни добавить, ни убрать. Следовательно, количество массы сохраняется во времени.
 Например, кусок дерева после сжигания весит меньше; казалось, это предполагает, что часть его массы исчезает, трансформируется или теряется. Это не было опровергнуто до тех пор, пока не были проведены тщательные эксперименты, в которых химические реакции, такие как ржавление, могли происходить в запаянных стеклянных ампулах; было установлено, что химическая реакция не изменила вес запечатанного контейнера и его содержимого. Взвешивание газов с помощью весов было невозможно до изобретения вакуумного насоса в 17 веке.
Например, кусок дерева после сжигания весит меньше; казалось, это предполагает, что часть его массы исчезает, трансформируется или теряется. Это не было опровергнуто до тех пор, пока не были проведены тщательные эксперименты, в которых химические реакции, такие как ржавление, могли происходить в запаянных стеклянных ампулах; было установлено, что химическая реакция не изменила вес запечатанного контейнера и его содержимого. Взвешивание газов с помощью весов было невозможно до изобретения вакуумного насоса в 17 веке. Если ученые знают количество и состав реагентов для конкретной реакции. Затем они могут предсказать количество произведенной продукции. Производители химических веществ могут повысить эффективность, применяя закон сохранения массы к своей лабораторной практике.
Если ученые знают количество и состав реагентов для конкретной реакции. Затем они могут предсказать количество произведенной продукции. Производители химических веществ могут повысить эффективность, применяя закон сохранения массы к своей лабораторной практике.