Структурные формулы изомеров, гомологов, органических соединений
Вещества в органической химии принято записывать в виде структурных формул, именно они позволяют понимать, как именно связаны между собой атомы, сколько связей образует тот или иной атом. Уметь правильно записывать органические вещества, а так же давать им названия – это важный навык, который приобретается на курсе по органической химии в 9-10 классах на начальных этапах обучения.
Молекулярная формула органического вещества показывает качественный и количественный состав (С2Н6), то есть число атомов каждого элемента в молекуле, то структурная формула показывает последовательность соединения атомов в молекуле, дает представление о взаимном расположении атомов в молекуле друг относительно друга, дает понимание химического строения вещества.
Для правильного составления структурных формул нужно знать валентности атомов в молекуле, рассмотрим основные из них:
1. атом углерода (С) в органической химии всегда четырехвалентен, это означает, что он образует 4 связи с другими атомами:
2. атом кислорода (О) имеет валентность равную двум, значит, образует 2 связи с другими атомами:
атом кислорода (О) имеет валентность равную двум, значит, образует 2 связи с другими атомами:
3. атом водорода одновалентен, образует одну связь с другими атомами
4. азот – трехвалентен, три связи с другими атомами
Рассмотрим одни из главных базовых понятий в органической химии – это правило гомологических рядов, приведем примеры гомологов и изомеров, опираясь на теорию химического строения веществ. Гомологи – это вещества, имеющие сходные химические свойства и строение, которые относятся к одному классу веществ, отличаются они друг от друга по составу только на гомологическую разность, то есть на одну или несколько групп (-CH2-).
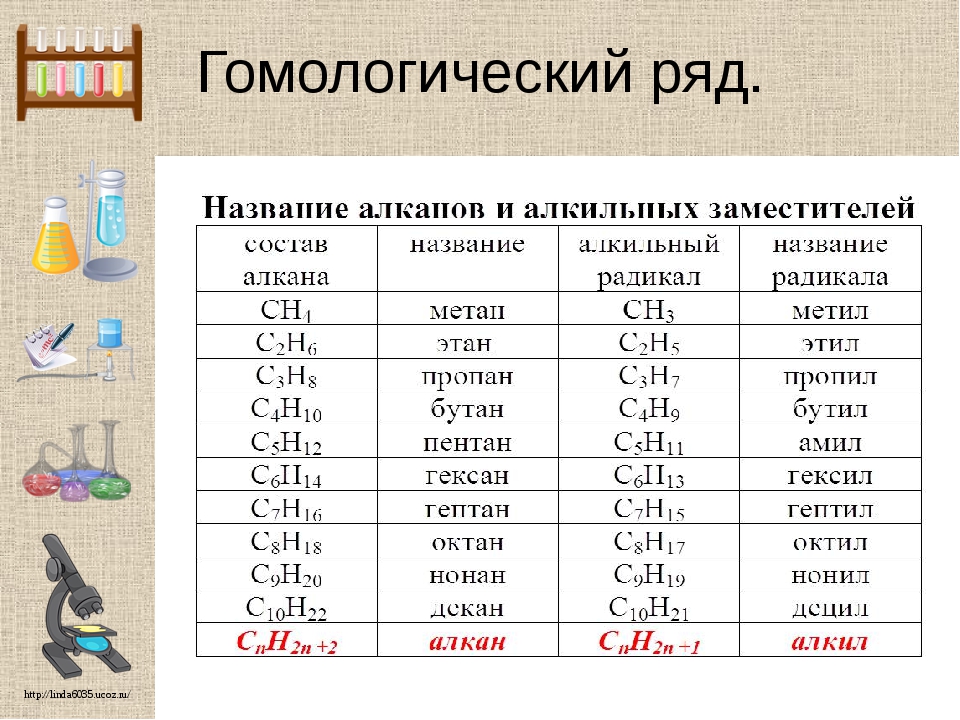
На начальных этапах изучения органической химии важно не только понимать кто такие гомологи, но и запомнить гомологический ряд алканов (предельных углеводородов), так как именно знание этих веществ дает возможность легко называть вещества из других классов. При запоминании алканов, обратите внимание на то, какой корень в названии соответствует какому количеству углерода в молекуле.
Для более точного понимания определений гомологи и гомологический ряд рассмотрим структурные формулы предельных углеводородов (помним, что атом углерода в органической химии четырехвалентен, а зачет образует 4 химических связи с другими атомами):
В данном гомологическом ряду все молекулы отличаются друг от друга на гомологическую разность, которая выделена жирным цветом. Записывая вещества в молекулярном виде, мы так же можем заметить, что в формулы отличаются на (СН2). Прибавляя каждый раз к формуле вещества, например, пропана гомологическую разность мы получаем формулу следующего представителя этого гомологического ряда, в данном случае ряда метана (алканов, предельных углеводородов). Гомологом пропана (C
Изомеры – это вещества, которые имеют одинаковый качественный и количественный состав, но имеющие разное строение и свойства. Другими словами, вещества имеют те же самые атомы в том же количестве, но соединены друг с другом они по-разному.
Например, бутан, имеющий линейное строение, то есть n-бутан (нормальный бутан) и i-бутан (изобутан). Часто в названиях веществ линейного строения опускают слово «нормальный». Качественный и количественный состав у них одинаковый, но атомы соединены по-разному, следовательно, это два совершенно разных вещества, которые по отношению друг к другу являются структурными изомерами.
Предельные углеводороды гомология — Справочник химика 21
Напишите молекулярные формулы предельных углеводородов, содержащих шесть, десять, двенадцать и пятнадцать атомов углерода. Составьте структурные формулы ближайшего гомолога октана, имеющего в молекуле два третичных атома углерода. [c.9] Вещества, сходные по своим свойствам и строению и отличающиеся по составу одно от другого на одну и ту же группу СНг, называются гомологами. Все предельные углеводороды составляют гомологический ряд. В органической химии известно много других гомологических рядов. [c.9]
[c.9]
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти. Крекингом называют нроцесс расщепления углеводородов с длинными цепями на молекулы меньшей длины, происходящий в присутствии катализаторов (каталитический крекинг) или при нагревании предельных углеводородов до 500—700 С под
Таким образом, усложнение изомерии непредельных углеводородов обусловлено тем, что, наряду с изомерией углеродной цепи, для них еще характерна изомерия положения двойной связи. Для высших гомологов этиленовых углеводородов различие в числе изомеров по сравнению с предельными углеводородами с тем же числом углеродных атомов еще больше. [c.65]
Первые четыре члена гомологического ряда предельных углеводородов (алканов) имеют тривиальные названия (метан, этан, пропан, бутан). Названия последующих гомологов производятся от греческих числительных с добавлением суффикса -ан [c. 55]
55]
ГТри галогенировании предельных углеводородов замещение водорода легче всего происходит при третичном углеродном атоме и труднее всего при первичном. Ниже приведены относительные скорости хлорирования гомологов метана в газовой фазе при 100 °С. [c.150]
Более тяжелые предельные углеводороды (гомологи метана) характеризуются тем, что все атомы углерода соединены между собой простой связью С—С, остальные валентности атомов углерода заполнены связью с атомами водорода. [c.5]
Предельные углеводороды образуют гомологический ряд. Физические и химические свойства в гомологическом ряду обычно изменяются от одного члена к другому постепенно и равномерно, так что знание свойств отдельных членов ряда позволяет судить и о свойствах низших и высших его гомологов. [c.26]
С увеличением числа органических соединений, полученных синтетическим путем, все больше стала ощущаться острая потребность в новой номенклатуре, которая учитывала бы структуру соединения. Так возникла рациональная номенклатура . В ней все изомеры и гомологи рассматриваются как производные родоначальника конкретного класса углеводородов (например, в случае предельных углеводородов — метан, а непредельных — этилен и ацетилен). При этом учитываются названия функциональной группы и радикалов, связанных с ней. Например
Так возникла рациональная номенклатура . В ней все изомеры и гомологи рассматриваются как производные родоначальника конкретного класса углеводородов (например, в случае предельных углеводородов — метан, а непредельных — этилен и ацетилен). При этом учитываются названия функциональной группы и радикалов, связанных с ней. Например
Из термохимических данных следует, что теплота образования этана из атомов равна приблизительно 673 ккал. Вычитая из этой величины энергию шести связей С—И, т. е. 99-6я= 594 ккал, найдем, что энергия связи С—С составляет около 80 ккал. Предположение об аддитивности энергий связи в соединениях ряда предельных углеводородов подтверждается хорошим совпадением вычисленных значений с величинами, найденными из опыта для высших гомологов, например пропана (СзНе). Данные об энергиях связи (некоторые из них приведены в табл. 1.1) позволяют производить различные оценки, в частности вычисления теплот реакций, которые равны разности между энергиями разрываемых связей и вновь образующихся.
В этих условиях идет также крекинг углеводородов. В результате образуется смесь изомерных нитросоединений различных гомологов предельных углеводородов. [c.153]
Открытие гомологии сыграло большую роль в развитии органической химии. Оно позволило выделить из огромного количества органических соединений определенные ряды веществ, что значительно облегчило изучение их свойств. Исчерпывающее объяснение гомологии оказалось возможным только на основании теории химического строения, согласно которой гомология является следствием способности углеродных атомов образовывать цепи различной длины. Развитие представлений о гомологии позволило предсказать и открыть многие ранее неизвестные члены гомологических рядов. Изучением гомологии, особенно в области предельных углеводородов, подробно занимался известный немецкий химик-органик К- Шорлеммер (1834—1892).
В то же время органические жидкости с асимметричными молекулами (алифатические кислоты, спирты, амины, кетоны) при содержании в цепи более трех атомов углерода имеют одинаковое поверхностное натяжение, равное таковому для предельных углеводородов даже при большой разнице в длине цепи и значениях 11. В этом случае о перестает быть функцией полярности и кривая зависимости о —И идет параллельно оси абсцисс для гомологов с разной длиной цепи (рис. 19.3,2). Отсутствие влияния длины цепи на о является следствием ориентации молекул полярными группами в жидкость, неполярными — в газовую фазу. [c.306]
Названия гомологов этана (ацетилена) по систематической номенклатуре образуют по тем же правилам, как в случае предельных углеводородов [c.198]
Гомология, изомерия и номенклатура предельных углеводородов [c.37]
Соединения с близкими химическими свойствами, отличающиеся по строению друг от друга на одну или несколько групп СНз, составляют так называемый гомологический ряд, а отдельные члены этого ряда называются гомологами. Ряд углеводородов, который мы рассматриваем (метан, этан, пропан и т. д.), является гомологическим рядом предельных углеводородов. Поэтому можно сказать, что гексан является гомологом этана или метана, пентан — гомологом метана или бу тана и т. д. [c.25]
Ряд углеводородов, который мы рассматриваем (метан, этан, пропан и т. д.), является гомологическим рядом предельных углеводородов. Поэтому можно сказать, что гексан является гомологом этана или метана, пентан — гомологом метана или бу тана и т. д. [c.25]
Номенклатура этиленовых углеводородов. Названия отдельных гомологов этиленовых углеводородов производят от названий предельных углеводородов с тем же числом углеродных атомов путем замены родового окончания -ан на окончание -плен. Например, этан—этилен, пропан — пропилен, изобутан — изобутилен и т, д. Только углеводороды С Ню, как исключение, называют амиленами. Чтобы различить изомеры, пользуются принципами рациональной, а в последнее время — преимущественно женевской номенклатуры.
Номенклатура и изомерия. У производных бензола один или несколько атомов водорода бензольного кольца замещены на какие-либо другие атомы нли радикалы. В гомологах бензола заместителем является радикал предельного углеводорода (алкил) с открытой цепью углеродных атомов. Он носит название боковой цепи. [c.247]
Он носит название боковой цепи. [c.247]
Предельные кислоты являются производными предельных углеводородов. Высшие гомологи этих кислот впервые были выделены из природных жиров, поэтому их, а затем и все другие кислоты с открытой цепью углеродных атомов назвали жирными кислотами. [c.152]
Число реально полученных изомеров несравненно меньше, чем число теоретически возможных. Все изомеры получены только для первых членов ряда. Как видно из таблицы 2, в ряду предельных углеводородов все изомеры получены для членов ряда С1—Сд, а для высших гомологов — лишь небольшая доля теоретически возможного числа. [c.51]
В промышленных условиях зтилен и его гомологи выделяют из газов крекинга нефти. Весьма важный способ их получения — дегидрирование соответствующих предельных углеводородов над никелевым катализатором [c.346]
Из приведенных реакций видно, что при сгорании одного объема метана образуется один объем двуокиси углерода, а при сгорании одного объема гомологов метана — этана, пропана и бутана —образуются соответственно два, три и четыре объема двуокиси углерода. Следовательно, числом углеродных атомов в молекуле предельного углеводорода определяется количество образующихся молекул СО а- [c.31]
Следовательно, числом углеродных атомов в молекуле предельного углеводорода определяется количество образующихся молекул СО а- [c.31]
В молекулах этих соединений все связи между атомами угле рода простые (ординарные), атомы углерода максимально, д предела насыщены водородом. Состав любого из гомологов от вечает общей формуле С Н2я+2 (где п —число атомов углерода) эта закономерность дает возможность написать формулу состав для предельного углеводорода с любым числом С-атомов, напри мер, С]8Нз8 (октадекан), С оНгог (гектан). [c.468]
В заключение можно сказать, что как парафиновые, так и нафтеновые углеводороды при нормальной температуре слабо подвергаются действию концентрированной серной кислоты. Это воздействие равно нулю для низших гомологов и увеличивается с повышением молекулярного ве са. С дымящей же кислотой и при нагревании все предельные углеводороды образуют моно- и дисульфопроизводные. [c.178]
Хотя отдельные углеводороды и содержатся в некоторых нефтях в почти неограниченных количествах, все же получение их в чистом виде, за исключением, пожалуй, первых членов ряда, почти полностью основано на применении препаративных методов. Зависит это главным образом от того, что разделение смеси углеводородов на отдельные компоненты представляет собой весьма трудную задачу, которая может быть в известной степени разрешена лишь при наличии очень больших количеств исходных веществ и со значительными потерями. Физические и химические свойства соседних членов ряда предельных углеводородов настолько сходны между собой, что даже после многократного разделения с помошью перегонки, кристаллизации и т. п. часто получаются еще смеси близких друг другу изо.меров и гомологов. [c.30]
Зависит это главным образом от того, что разделение смеси углеводородов на отдельные компоненты представляет собой весьма трудную задачу, которая может быть в известной степени разрешена лишь при наличии очень больших количеств исходных веществ и со значительными потерями. Физические и химические свойства соседних членов ряда предельных углеводородов настолько сходны между собой, что даже после многократного разделения с помошью перегонки, кристаллизации и т. п. часто получаются еще смеси близких друг другу изо.меров и гомологов. [c.30]
Температуры кипения предельных углеводородов повышаются с увеличением молекулярного веса. Однако разности между температурами кипения двух следующих один за другим члейдБ ряда становятся все меньше по мере приближения к высшим гомологам, Это явление зависит от того, что вступление новой СНа-группы тем меньше отражается (в процентном отношении) на составе углеводорода, чем выше он стоит в гомологическом ряду.
 …… [c.34]
…… [c.34]Как и в других гомологических рядах, в ряду метана проявляется всеобщий закон природы — закон перехода количественных изменений в качественные. Изменение состава молекулы на группу СН2 каждый раз приводит к новому веществу, которое хотя и имеет много общего с соседними членами ряда, но вместе с тем по некоторым свойствам отличается от них. Различие гомологов ясно проявляется в их физических свойствах. Низшие члены ряда предельных углеводородов (от СН4 до С4Н10) — газы средние члены (от С5Н12 до 16h44) при температуре до 20 °С — жидкости, остальные при обычных условиях находятся в твердом состоянии. Во всех случаях температуры кипения и затвердевания тем выще, чем больше молекулярная масса углеводорода. [c.562]
Ароматизацией (дигидроциклизацией) 5 г предельного углеводорода получили 4,6 г гомолога бензола. Определите молекулярную формулу гомолога бензола. [c.92]
В табл. 4 сопоставлены свойства гомологов метана с нормальной цепью. Из приведенных данных видно, что метан, этан, пропан и бутан при обычных условиях представляют собой газы они почти не имеют запаха. Пентан и следующие за ним углеводороды (вплоть до С16Н34) — жидкости с характерным бензиновым запахом и различной, постепенно снижающейся летучестью. Высшие предельные углеводороды — твердые нелетучие вещества, не имеющие запаха. Эта закономерность в изменении свойств по мере усложнения количественного состава в гомологических рядах углеводородов была открыта К- Шорлеммером. Ф. Энгельс отметил ее как один из наиболее ярких примеров проявления закона диалектики о переходе количественных изменений в качественные. [c.50]
Из приведенных данных видно, что метан, этан, пропан и бутан при обычных условиях представляют собой газы они почти не имеют запаха. Пентан и следующие за ним углеводороды (вплоть до С16Н34) — жидкости с характерным бензиновым запахом и различной, постепенно снижающейся летучестью. Высшие предельные углеводороды — твердые нелетучие вещества, не имеющие запаха. Эта закономерность в изменении свойств по мере усложнения количественного состава в гомологических рядах углеводородов была открыта К- Шорлеммером. Ф. Энгельс отметил ее как один из наиболее ярких примеров проявления закона диалектики о переходе количественных изменений в качественные. [c.50]
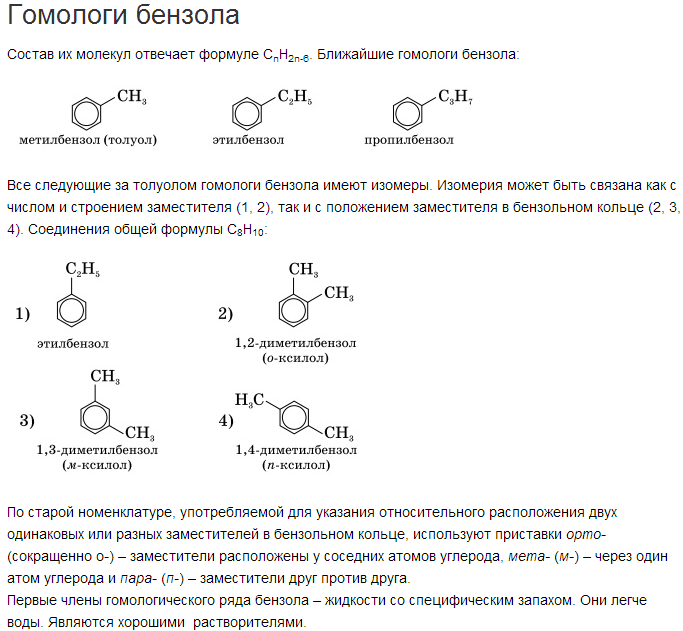
Изомерия этиленовых углеводородов. Как и в предельном ряду, у непредельных углеводородов, начиная с гомологов, содержащих четыре углеродных атома, проявляется изомерия. Однако этиленовые углеводороды имеют больше изомеров, чем предельные с тем же числом углеродных атомов. Так, мы видели (стр. 41—42), что существует только два изомерных предельных углеводорода состава С4Ню- Непредельных же углеводородов состава С4Н8 существует три. Строение их может быть выведено исходя из пропилена путем последовательной замены в его молекуле атомов водорода прп различных углеродных атомах на метил (аналогично тому, как мы поступали, выводя изомерные бутаны из пропана, см. стр. 41). Но и в этом случае изомеры удобнее выводить по способу, описанному на стр. 44 и сл. [c.64]
Строение их может быть выведено исходя из пропилена путем последовательной замены в его молекуле атомов водорода прп различных углеродных атомах на метил (аналогично тому, как мы поступали, выводя изомерные бутаны из пропана, см. стр. 41). Но и в этом случае изомеры удобнее выводить по способу, описанному на стр. 44 и сл. [c.64]
Действие окислителей. Бензол еще более стоек к действию окислителей, чем предельные углеводороды. Он не окисляется разбавленной азотной кислотой раствором марганцовокислого калия и т. п. Гомологи бензола окисляются значительно легче. Но и в них бензольное ядро относительно более устойчиво к действию окислителей, чем соединенные с ним углеводородные радикалы. Обычно в первую очередь окисляются боковые цепи, а бензольное ядро не изменяется. Как бы ни была сложна боковая цепь, она при действии сильных окислителей разрушается, и лишь углерод, непосредственно связанный с ядром, не отрывается от него и превращается в карбоксильную группу —СООН. Таким образом, любой гомолог бензола с одной боковой цепью окисляется в одноосновную ароматическую (бензойную) кислоту [c.337]
Таким образом, любой гомолог бензола с одной боковой цепью окисляется в одноосновную ароматическую (бензойную) кислоту [c.337]
Примером гомологического ряда может служить ряд предельных углеводородов (алканов). Простейший его представитель — метан СН . Гомологами метана являются этан СаН,, пропан СаН,, бутан С Н и, пентан СьНг , гексан СвНх , гептан С,Н1в и т. д. Формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности. [c.276]
Гомологические ряды непредельных углеводородов. Соединения гомологического ряда этилена изображаются общей формулой СпНап. Названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончания -ан на -илен. Например этан СаН,— этилен С2Н4, пропан СзН, — пропилен СаН, и т. д. [c.288]
Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор КМПО4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителен. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом [c.301]
В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор КМПО4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителен. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом [c.301]
Основной частью природного газа является метан, в среднем его содержится по объему 80—98%. В попутном нефтяном газе содержится значительно меньле метана (30—50%), но больше его ближайших гомологов этана, пропана, бутана, пентана (до 20% каждого) и других предельных углеводородов. [c.518]
Гомологи метана » storinka.click
Материал параграфа поможет вам:
выяснить, что такое гомологический ряд соединений и какие углеводороды являются гомологами метана;
называть гомологи метана и составлять их формулы;
узнать о физических свойствах метана и его гомологов.
Формулы соединений. В предыдущем параграфе речь шла о простейшем насыщенном углеводороде — метане СН4. Выведем формулы насыщенных углеводородов, в молекулах которых имеется два и три атома Карбона. Сначала соединим атомы Карбона черточками (простыми ковалентными связями):
В предыдущем параграфе речь шла о простейшем насыщенном углеводороде — метане СН4. Выведем формулы насыщенных углеводородов, в молекулах которых имеется два и три атома Карбона. Сначала соединим атомы Карбона черточками (простыми ковалентными связями):
Затем от каждого атома Карбона проведем столько дополнительных черточек, чтобы их у него было четыре (атом Карбона четырехвалентный):
После этого допишем к каждой черточке атом Гидрогена и получим формулы соответствующих углеводородов:
Так можно вывести структурные формулы молекул линейного строения других углеводородов с простыми ковалентными связями.
Составленные структурные формулы молекул часто записывают в сокращенном виде, с черточками только между атомами Карбона:
Углеводороды СН4, С2Н6, С3Н8 принадлежат к гомологическому ряду метана.
Гомологическим рядом называют ряд органических соединений, молекулы которых имеют подобное строение и различаются по составу на одну или несколько групп атомов СН2.
Название группы атомов СН2 — гомологическая разность. Соединения С2Н6, С3Н8 и многие другие являются гомологами метана.
Для того чтобы составить химическую формулу гомолога метана с четырьмя атомами Карбона в молекуле, достаточно добавить к формуле С3Н8 группу атомов СН2. Получаем: С3Н8СН2 => С4Н10. Эту формулу можно также вывести из формулы метана: СН4(СН2)3 => С4Н10.
Если углеводород гомологического ряда метана содержит п атомов Карбона в молекуле,
то его формула — CH4(CH2)n_i, или СЛН2п+2. Вторая формула является общей для углеводородов этого типа.
Воспользовавшись формулой СлН2л+2, составьте химические формулы гомологов метана, в молекулах которых содержится 5, 6 и 7 атомов Карбона.
Названия. Четыре простейших по составу углеводорода гомологического ряда метана имеют названия метан, этан, пропан, бутан. Названия остальных соединений этого типа происходят от иноязычных числительных (с. 21), соответствующих количеству атомов Карбона в молекулах углеводородов (табл. 2). В названиях метана и его гомологов имеется суффикс -ан.
Углеводороды гомологического ряда метана СцНгл+г
Таблица 2
Гомологи метана
Строение молекул. Вам известно, что молекула метана СН4 имеет форму тетраэдра. Выясним пространственное строение молекул других углеводородов гомологического ряда метана.
Молекула этана С2Н6 состоит из двух соединенных групп атомов СН3, каждая из которых является частью молекулы метана. Легко прийти к выводу, что все атомы в молекуле этана размещены не на плоскости, а в трехмерном пространстве (рис. 48).
В молекулах пропана, бутана (рис. 49) и других гомологов метана центры атомов Карбона находятся на ломаной, зигзагообразной, линии. Поэтому сокращенные структурные формулы молекул пропана и бутана следует изображать так:
Поэтому сокращенные структурные формулы молекул пропана и бутана следует изображать так:
Рис. 49.
Зигзагообразная форма карбоновой цепи в молекулах: а — пропана; б — бутана
В школьном курсе химии для упрощения используют не зигзагообразные, а линейные структурные формулы молекул углеводородов.
Физические свойства. Метан — газ, не имеющий запаха. Он легче воздуха. При охлаждении до температуры -162 ° С (при нормальном давлении) этот газ превращается в жидкость. Этан,
пропан и бутан в обычных условиях также являются газами, следующие двенадцать гомологов метана — жидкости (они имеют характерный «бензиновый» запах), а остальные — твердые вещества. Температуры плавления и кипения гомологов метана с увеличением числа атомов Карбона в молекулах возрастают.
Поскольку молекулы метана и его гомологов неполярны, эти соединения нерастворимы в воде (рис. 50), но хорошо растворяются (во многих случаях — неограниченно) в органических растворителях и друг в друге.
Физиологическое действие метана и его гомологов. Метан при длительном вдыхании вызывает отравление, которое может привести к летальному исходу. С целью обнаружения его утечки из плиты, негерметичного или поврежденного трубопровода в газовую магистраль добавляют небольшое количество веществ с очень неприятным запахом (их название — меркаптаны). Пользуясь газом в быту, необходимо чаще проветривать помещение.
Газообразные и жидкие гомологи метана негативно воздействуют на центральную нервную систему. Твердые насыщенные углеводороды нетоксичны (парафин1 используют в лечебных целях).
Это интересно
Формула
простейшего
меркаптана
1 Парафин — смесь насыщенных углеводородов с количеством атомов Карбона в молекулах от 18 до 35.
Выводы
Ряд органических соединений, молекулы которых имеют подобное строение и различаются по составу на одну или несколько групп атомов СН2, называют гомологическим рядом.
Общая формула метана и его гомологов — СпН2п+2. Названия большинства этих соединений происходят от иноязычных числительных; название каждого соединения содержит суффикс -ан.
Молекулы пропана и последующих гомологов метана имеют зигзагообразную карбоновую цепь.
Метан, этан, пропан и бутан — газы, остальные гомологи метана — жидкости или твердые вещества. Все эти соединения не растворяются в воде.
Метан, а также его газообразные и жидкие гомологи негативно влияют на организм.
152. Что такое гомологический ряд? Какие соединения называют гомологами?
153. Укажите среди приведенных формул те, которые принадлежат соединениям гомологического ряда метана: С3Н6, С5Н12, С6Н12, C7Hi6.
154. Установите последовательность углеводородов по уменьшению количества атомов Карбона в их молекулах:
а) гептан; г) пентан;
б) бутан; д) пропан.
в) гексан;
155. Изобразите электронную формулу молекулы: а) этана; б) пропана.
156. Укажите правильное окончание предложения «Отношение количества атомов Гидрогена к количеству атомов Карбона в молекулах гомологов метана с возрастанием молярной массы соединений…»:
а) уменьшается;
б) увеличивается;
в) изменяется хаотически.
157. Какова относительная молекулярная масса гомолога метана, в молекуле которого имеется 5 атомов Карбона? (Устно.)
158. В каком соединении массовая доля Карбона наибольшая — в этане, пропане или бутане? Попробуйте дать ответ, не проводя расчетов.
159. Определите количество вещества (устно):
а) в 15 г этана;
б) в 4,48 л бутана (н. у.).
160. Заполните таблицу:
161. Запишите формулу гомолога метана, в молекуле которого вдвое больше атомов Гидрогена, чем в молекуле бутана.
162. Какой углеводород имееттакую же плотность, что и углекислый газ?
г
ДЛЯ ЛЮБОЗНАТЕЛЬНЫХ
Два бутана, три пентана. ..
..
Для молекулы С4Н10 можно предложить не только «линейную» карбоновую цепь
но и разветвленную:
Соответствующие структурные формулы и их сокращенные варианты имеют такой вид:
Каждая формула отвечает определенной молекуле. Поэтому должны существовать два соединения с одинаковыми химическими формулами С4Н10, но с молекулами разного строения — нераз-ветвленного и разветвленного. Эти углеводороды известны и хорошо изучены.
Соединения, молекулы которых имеют одинаковый состав, но разное строение, называют изомерами.
С увеличением числа атомов Карбона в молекулах углеводородов количество изомеров резко возрастает. Одну и ту же формулу
С4Н10 имеют два углеводорода, С5Н12 — три, С6Н14 — пять, С7Н16 — девять и т. д.
Существование изомеров — одна из причин разнообразия и многочисленности органических соединений.
Если молекула углеводорода имеет неразветвленное («нормальное») строение, то перед его названием записывают букву н и дефис. Например, соединение с формулой СНз-СН2-СН2-СНз называют н-бутаном. Изомер с формулой
получил название «изобутан».
Это материал учебника Химия 9 класс Попель, Крикля
Откуда берутся и зачем нужны гомологические формулы
Гомологические (или общие) формулы описывают в общем виде состав органических веществ, относящихся к одному классу.
Давайте разберемся, откуда они берутся, и начнем с того, что выведем общую формулу ряда алканов – углеводородов, содержащих только одинарные углерод-углеродные связи.
Для того, чтобы вывести гомологические формулы оставшихся классов веществ, нужно определить, какие изменения происходят в составе. Рассуждать можно примерно таким образом:
чтобы получить двойную связь, нужно убрать по одному атому водорода от каждого углерода, образующего эту связь.
 Водорода становится на два меньше, чем в алкане, поэтому общая формула алкенов – Cnh3n.
Водорода становится на два меньше, чем в алкане, поэтому общая формула алкенов – Cnh3n.чтобы замкнуть углеродную цепочку в цикл, нужно убрать по одному водороду от каждого из концевых атомов углерода. Водорода становится на два меньше, чем в алкане, поэтому общая формула циклоалканов – Cnh3n.
для образования тройной связи нужно суммарно убрать четыре атома водорода из соответствующего алкана, поэтому общая формула алкинов – Cnh3n-2.
в спиртах атом кислорода просто встраивается по связи С-Н, количество атомов водорода при этом не изменяется по сравнению с алканом. Общая формула спиртов – Cnh3n+2О.
Решим несколько задач на составление гомологических формул.
1) Приведите общую формулу нециклических углеводородов, имеющих в молекуле три двойные и две тройные связи.
Решение:
Для образования одной двойной связи нужно убрать из алкана 2 атома водорода, для образования тройной связи – 4 атома водорода. Таким образом, общая формула таких углеводородов имеет вид Сnh3n+2˗3·2-2·4 = Cnh3n-12.
Таким образом, общая формула таких углеводородов имеет вид Сnh3n+2˗3·2-2·4 = Cnh3n-12.
2) Приведите общую формулу нециклических альдегидов, имеющих в молекуле три тройных и одну двойную связи.
Решение:
Для образования тройной связи нужно убрать из соответствующего алкана 4 атома водорода, для образования двойной связи – 2 атома водорода. При введении карбонильной группы в молекуле появляется атом кислорода, а число атомов водорода уменьшается на два. Общая формула таких альдегидов будет иметь вид Сnh3n+2˗3·4-1·2-2O = Cnh3n-14О.
3) Приведите общую формулу карбоновых кислот, содержащих одну гидроксильную группу и тройную связь.
Решение:
При добавлении гидроксильной группы количество атомов водорода относительно соответствующего алкана не изменяется, но добавляется один кислород. Карбоксильную группу можно условно разбить на составляющие С=О и -ОН, поэтому, учитывая прошлые рассуждения, нужно убрать два атома водорода и добавить два кислорода. Для образования тройной связи необходимо убрать 4 атома водорода из соответствующего алкана. Поэтому общая формула таких карбоновых кислот имеет вид Сnh3n-2-4O3 = Cnh3n-4O3.
Для образования тройной связи необходимо убрать 4 атома водорода из соответствующего алкана. Поэтому общая формула таких карбоновых кислот имеет вид Сnh3n-2-4O3 = Cnh3n-4O3.
Для чего может пригодиться знание гомологических формул? Во-первых, для уравнивания органических реакций. Это звучит странно, но самую распространенную ошибку в органических цепочках формата ЕГЭ допускают в реакциях с участием аренов. Например, такую:
Ошибка такого рода возникает из-за того, что по структурным формулам, приведенным выше, сложно отследить количество водорода. Чтобы ее избежать, нужно проверять состав веществ по гомологическим формулам.
Во-вторых, умение оперировать гомологическими формулами позволяет легко решать задачи на вывод молекулярной формулы органических соединений. В последние годы на ЕГЭ по химии предлагают задачи, в которых неизвестен класс вещества и нет дополнительных данных, которые позволяют определить молярную массу искомого соединения. Поэтому после проведения стандартных расчетов часто возникает вопрос, нужно ли удваивать индексы в простейшей формуле или можно оставить ее как есть.
Давайте представим, что мы вывели простейшие формулы нескольких веществ. Определим, существуют ли органические соединения с получившимся составом: C3H5Cl3, C2h5Br, Ch4O.
Галогены в органических веществах одновалентны, и можно условно говорить, что они эквивалентны атомам водорода. В первом соединении сумма водородов и хлоров равна 8, то есть C3H5Cl3 ~ C3H8. Вещество с формулой С3Н8 существует и относится к ряду алканов, поэтому С3Н5Cl3 — существующий трихлоралкан. Во втором соединении общее количество атомов водорода и брома равно 5 (нечетное), что невозможно для соединений, не содержащих азот. Поэтому вещества с формулой C2h5Br не существует. В органических веществах вида CxHyOz должно быть четное число атомов водорода, поэтому третья формула Ch4O не соответствует никакому соединению.
Будьте бдительны, учите химию и помните:
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Закон гомологических рядов наследственной изменчивости Н. И. Вавилова
Николай Иванович Вавилов имел научные интересы в широких сферах, но более всего он известен как ботаник-селекционер и генетик. Исследуя параллелизм в наследственной изменчивости, в 1920 году он открыл и обосновал закон гомологических рядов, который звучит так:
«Виды и роды, генетически близкие, характеризуются сходными рядами наследственной изменчивости с такой правильностью, что, зная ряд форм в пределах одного вида, можно предвидеть нахождение параллельных форм у других видов и родов. Чем ближе генетически расположены в общей системе роды и виды, тем полнее сходство в рядах их изменчивости.
Чем ближе генетически расположены в общей системе роды и виды, тем полнее сходство в рядах их изменчивости.
Целые семейства растений в общем характеризуются определенным циклом изменчивости, проходящей через все роды и виды, составляющие семейства».
Для наглядной иллюстрации действия закона удобно взять растения семейства мятликовых. Например, зерновка черной окраски имеется у пшеницы, ячменя, ржи, кукурузы и ряда других представителей семейства. А вот удлиненная форма зерновки наблюдается у всех видов семейства, изученных на сегодняшний день.
С помощью этого закона Н. И. Вавилов обнаружил ряд форм ржи, еще не известных в то время: с остистыми и безостными колосьями, с черной, белой, фиолетовой и красной зерновкой, с зерном мучнистым и стекловидным и проч. Исследователь опирался на наличие данных признаков у пшеницы.
Знак «+» указывает на наличие наследственных форм, которые обладают названным признаком.
Николай Вавилов не зря был назван «Менделеевым от биологии». Он выявил базовые закономерности в биологии, сходные с теми строгими закономерностями, которые Менделеев обнаружил для химических элементов. Закон гомологических рядов наследственной изменчивости можно применять как для растений, так и для животных.
1. Например, короткопалость встречается и у человека, и у птиц, собак, крупного рогатого скота.
2. Альбинизм бывает у представителей разных групп млекопитающих, а также у птиц и прочих животных.
3. Перья могут отсутствовать у птиц, чешуя у рыб, волосистый покров у млекопитающих, и всё это производные кератина.
Закон, открытый Вавиловым, очень важен в селекции. Он дает возможность предугадать появление форм, доселе не обнаруженных у конкретного вида, однако имеющихся у близкородственных видов. Данную форму можно «вдруг» обнаружить в дикой природе, но можно и получить с помощью искусственного мутагенеза.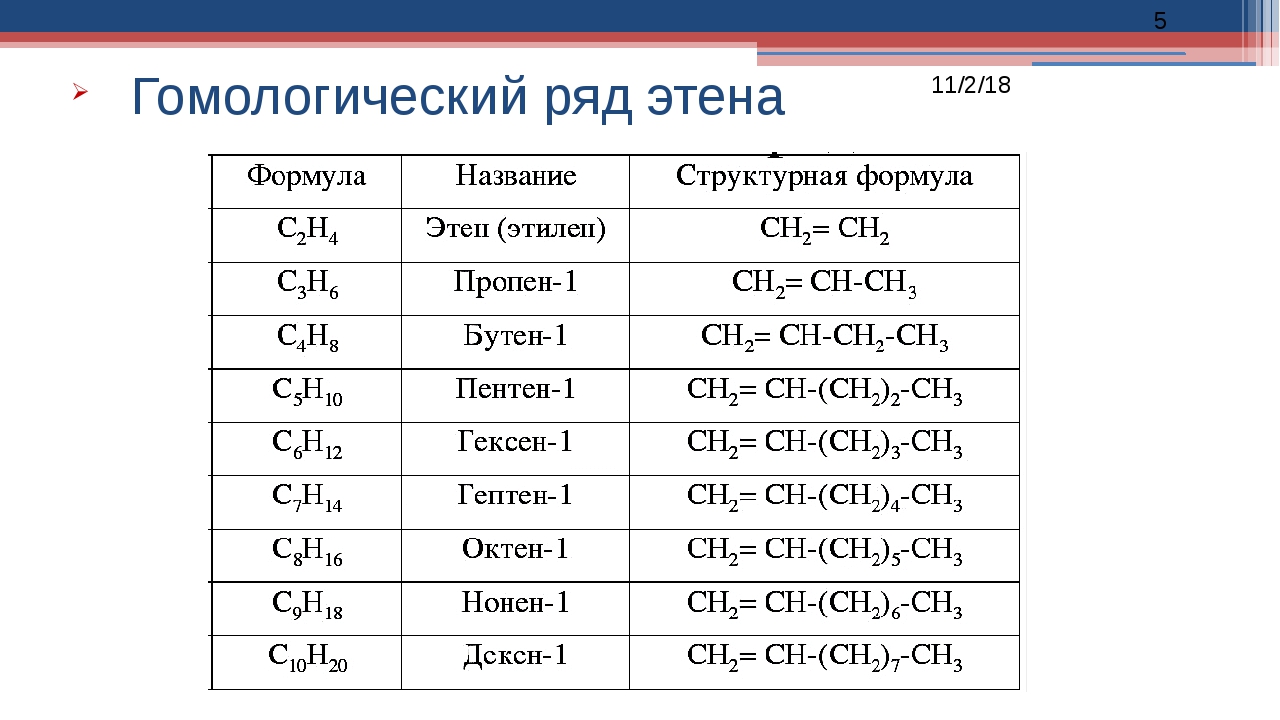
Алкены: молекулярные и структурные формулы
Алкены: молекулярные и структурные формулы
Алкены включают в себя ряд соединений, состоящих из атомов углерода и водорода с по крайней мере одной двойной связью в углеродной цепи. Эта группа соединений включает гомологический ряд с общей молекулярной формулой C n H 2 n , где n равно любому целому числу больше единицы.
Простейший алкен, этен, имеет два атома углерода и молекулярную формулу C 2 H 4 . Структурная формула этилена:
.
В более длинных алкеновых цепях дополнительные атомы углерода связаны друг с другом одинарными ковалентными связями. Каждый атом углерода также присоединен к достаточному количеству атомов водорода, чтобы образовать вокруг себя в общей сложности четыре одинарных ковалентных связи. В цепочках с четырьмя и более атомами углерода двойная связь может располагаться в разных положениях, что приводит к образованию структурных изомеров. Например, алкен молекулярной формулы C 4 H 8 имеет два изомера.
Стереоизомеры. Помимо структурных изомеров, алкены также образуют стереоизомеры . Поскольку вращение вокруг кратной связи ограничено, группы, присоединенные к двойным атомам углерода, всегда остаются в одних и тех же относительных положениях. Эти «заблокированные» положения позволяют химикам идентифицировать различные изомеры по расположению заместителей. Например, один структурный изомер C 5 H 10 имеет следующие стереоизомеры.
Изомер слева, в котором два заместителя (метильная и этильная группы) находятся на одной и той же стороне двойной связи, называется цис-изомером , а изомер справа, с двумя неводородные заместители на противоположных сторонах двойной связи, называется транс-изомером .
Если к атомам углерода двойной связи присоединено более двух заместителей, нельзя использовать систему цис и транс .Для таких химических веществ используется обозначение E-Z . В системе E-Z молекула сначала делится пополам вертикально через двойную связь. Во-вторых, два атома или группы на каждом атоме углерода ранжируются по атомному весу. Приоритет отдается более высокому атомному весу. Например, на рисунке атомы углерода и хлора слева от биссектрисы ранжированы. Хлор имеет приоритет, потому что он тяжелее. С правой стороны бром опережает углерод. В-третьих, определяются положения двух атомов более высокого ранга. Если два атома находятся в положении цис , расположение будет Z (по-немецки zusammen , что означает «вместе»). Если атомы или группы находятся в положении транс , расположение будет E (для немецкого entgegen , что означает «напротив»).
Если два атома находятся в положении цис , расположение будет Z (по-немецки zusammen , что означает «вместе»). Если атомы или группы находятся в положении транс , расположение будет E (для немецкого entgegen , что означает «напротив»).
Название химического вещества на рисунке: ( E )-2-бром-3-хлор-2-бутен.
Учебное пособие по химии гомологичных серий
Ключевые понятия
- В органической химии (химия углерода) гомологический ряд относится к семейству соединений, которые:
(i) имеют ту же функциональную группу
(ii) отличаются на постоянную единицу при переходе от одного элемента к другому
- Гомологический ряд можно описать общей формулой.
Некоторые названия гомологических рядов и соответствующие им общие формулы Гомологический ряд алканы алкены алкины алканолы алканалы алканоны алкановая кислота Общая
формулаС Н Н 2н+2 С Н Н 2 Н C n H 2n−2 С Н Н 2н+2 О С Н Н 2 Н О С Н Н 2 Н О C n H 2n O 2 - Каждое соединение в гомологическом ряду (член) называется гомологом (иногда пишется как гомолог).

- Гомологи в гомологическом ряду вступают в сходные химические реакции, потому что они имеют одну и ту же функциональную группу.
- Существует градация физических свойств гомологов ряда из-за увеличения длины углеродной цепи.
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Гомологическая серия алканов
Гомологический ряд алканов содержит соединения, которые:
- состоят ТОЛЬКО из атомов углерода (C) и водорода (H)
- имеют одинарные ковалентные связи между всеми атомами углерода (С-С)
- не содержат функциональной группы
Поскольку один углерод образует в общей сложности 4 ковалентные связи, первый член (гомолог) гомологического ряда алканов должен состоять из 1 атома углерода, связанного с 4 атомами водорода, как показано ниже:
| Н | | ||
| Н- | С | -Н |
| | Х |
с молекулярной формулой CH 4 .
Следующий гомолог в гомологическом ряду алканов будет содержать 2 атома углерода с одинарной ковалентной связью между ними, каждый атом углерода будет составлять свою квоту из 4 ковалентных связей, связываясь с 3 атомами водорода, как показано ниже:
| Н | | Н | | |||
| Н- | С | − | С | -Н |
| | Х | | Х |
, и эта молекула имеет молекулярную формулу C 2 H 6 .
Следующий гомолог в ряду будет иметь 3 атома углерода и 8 атомов водорода (C 3 H 8 ), за которыми следуют 4 атома углерода и 10 атомов водорода (C 4 H 10 ), и так далее. и так далее…
| Некоторые гомологи гомологического ряда алканов | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| молекулярная структура | молекулярная формула | молярная масса (г моль -1 ) | |||||||||||||||||||||||||||||||||
| СН 4 | 16 | |||||||||||||||||||||||||||||||||
| С 2 Н 6 | 30 | |||||||||||||||||||||||||||||||||
| С 3 Н 8 | 44 | |||||||||||||||||||||||||||||||||
| С 4 Н 10 | 58 | |||||||||||||||||||||||||||||||||
| С 5 Н 12 | 72 | |||||||||||||||||||||||||||||||||
Заметили закономерность? Для каждого последующего гомолога мы добавляем в цепь CH 2 .
Начать с CH 4 (первый гомолог)
, затем добавьте CH 2 , чтобы получить C 2 H 6 (следующий гомолог в ряду)
, затем добавьте CH 2 , чтобы получить C 3 H 8 (следующий гомолог в ряду)
, затем добавьте CH 2 , чтобы получить C 4 H 10 (следующий гомолог в ряду)
, затем добавьте CH 2 , чтобы получить C 5 H 12 (следующий гомолог в ряду)
Это означает, что разница в молярной массе между соседними гомологами в ряду составляет 14 г моль -1 :
C имеет молярную массу 12 г моль -1
H имеет молярную массу 1 г моль -1
Следовательно CH 2 имеет молярную массу 12 + (2 × 1) = 12 + 2 = 14 г моль -1
Итак, каждый член ряда алканов, каждый гомолог, содержит цепь длиной n атомов углерода, C n .
Каждый гомолог также будет содержать 2 × n атомов водорода (от каждой единицы CH 2 ), плюс на каждом конце цепи есть дополнительный атом водорода, то есть 2 дополнительных атома H, поэтому общее число атомов водорода в цепи 2 n +2, H 2 n +2 .
Сводя все вместе, мы можем написать общую формулу гомологического ряда алканов: C n H 2 n +2
Для первого члена ряда алканов (первый гомолог), n = 1, поэтому молекулярная формула будет C 1 H 2×1+2 , что равно CH 4
Для второго члена ряда алканов (второй гомолог) n = 2, поэтому молекулярная формула будет C 2 H 2×2+2 , что равно C 2 H 6
Нажмите, чтобы исследовать свойства алканов.
Гомологичный ряд алкенов
Гомологический ряд алкенов содержит соединения, которые:
- состоят ТОЛЬКО из атомов углерода (C) и водорода (H)
- имеют двойную связь между двумя атомами углерода (C=C)
- не содержат другой функциональной группы
Первый член, первый гомолог, гомологического ряда алкенов должен содержать 2 атома углерода, которые соединены двойной связью, и, поскольку каждый атом углерода должен образовывать в общей сложности 4 связи, каждый из атомов углерода должен быть связан с 2 атома водорода, как показано ниже:
| Н | Х | |||||
| \ | / | |||||
| С | = | С | ||||
| / | \ | |||||
| Н | Х | |||||
| C 2 H 4 (M = 28 г моль -1 ) | ||||||
Для следующего гомолога мы добавляем еще 1 атом C, и в общей сложности он должен будет образовать 4 связи, как показано в структуре ниже:
| Н | Х | Х | |||||
| \ | | | | | |||||
| С | = | С | − | С | -Н | ||
| / | | | ||||||
| Н | Х | ||||||
| C 3 H 6 (M = 42 г моль -1 ) | |||||||
Для следующего гомолога мы добавляем еще 1 атом C, и в общей сложности он должен будет образовать 4 связи, как показано в структуре ниже:
| Н | Х | Х | Х | ||||||
| \ | | | | | | | ||||||
| С | = | С | − | С | − | С | -Н | ||
| / | | | | | |||||||
| Н | Х | Х | |||||||
| C 4 H 8 (M = 56 г моль -1 ) | |||||||||
Для следующего гомолога мы добавляем еще 1 атом C, и в общей сложности он должен будет образовать 4 связи, как показано в структуре ниже:
| Н | Х | Х | Х | Х | |||||||
| \ | | | | | | | | | |||||||
| С | = | С | − | С | − | С | − | С | -Н | ||
| / | | | | | | | ||||||||
| Н | Х | Х | Х | ||||||||
| C 5 H 10 (M = 70 г моль -1 ) | |||||||||||
Таким образом, мы видим, что мы добавляем единицу CH 2 к одному гомологу, чтобы сделать следующий в серии.
Поскольку каждая единица CH 2 имеет молярную массу 14 г моль -1 , разница в молярной массе между соседними гомологами составляет 14 г моль -1 .
И мы можем описать гомологический ряд алкенов общей формулой C n H 2n .
Для первого члена ряда (первого гомолога) n=2, поэтому молекулярная формула этого соединения будет C 2 H 2×2 , что равно C 2 H 4
Для второго члена ряда (второго гомолога) n=3, поэтому молекулярная формула этого соединения будет C 3 H 2×3 , что равно C 3 H 6
Нажмите, чтобы исследовать свойства алкенов.
Гомологичный ряд алкинов
Гомологический ряд алкиновсодержит соединения, которые:
- состоят ТОЛЬКО из атомов углерода (C) и водорода (H)
- имеют тройную связь между двумя атомами углерода (C≡C)
- не содержат другой функциональной группы
Первый член, первый гомолог, гомологического ряда алкинов должен содержать 2 атома углерода, которые соединены тройной связью, и, поскольку каждый атом углерода должен образовывать в общей сложности 4 связи, каждый из атомов углерода должен быть связан с 1 атом водорода, как показано ниже:
| Н- | С≡С | -Н | ||
| C 2 H 2 (M = 26 г моль -1 ) | ||||
Следующий член ряда, следующий гомолог, должен содержать 3 атома углерода, и каждый атом C должен образовывать в сумме 4 связи:
| Н | | ||||
| Н- | С≡С | − | С | -Н |
| | Х | ||||
| C 3 H 4 (M = 40 г моль -1 ) | ||||
За которым следует следующий гомолог с 4 атомами углерода:
| Н | | Н | | |||||
| Н- | С≡С | − | С | − | С | -Н |
| | Х | | Х | |||||
| C 4 H 6 (M = 54 г моль -1 ) | ||||||
Итак, мы снова видим, что мы добавляем единицу CH 2 к одному гомологу, чтобы сделать следующий в серии.
Поскольку каждая единица CH 2 имеет молярную массу 14 г моль -1 , разница в молярной массе между соседними гомологами составляет 14 г моль -1 .
И мы можем описать гомологический ряд алкинов общей формулой C n H 2n−2 .
Для первого члена ряда (первого гомолога) n=2, поэтому молекулярная формула этого соединения будет C 2 H 2×2−2 , что равно C 2 H 2
Для второго члена ряда (второго гомолога) n=3, поэтому молекулярная формула этого соединения будет C 3 H 2×3−2 , что равно C 3 H 4
Алканол Гомологичный ряд
Гомологический ряд алканоловсодержит соединения, которые:
- состоят ТОЛЬКО из атомов углерода (C), водорода (H) и кислорода (O)
- имеют только одинарные связи между атомами углерода (С-С)
- содержат гидроксильную функциональную группу (ОН)
Первый член гомологического ряда алканолов содержит всего 1 атом углерода, который должен образовать в общей сложности 4 связи, одна из этих связей должна быть связана с функциональной группой OH , поэтому остальные 3 связи должны быть связаны с атомами водорода (H ), как показано ниже:
| Н | | ||
| ОХ − | С | -Н |
| | Х | ||
| CH 4 O (M = 32 г моль -1 ) | ||
Следующий гомолог содержит 2 атома углерода, каждый атом углерода должен образовывать в общей сложности 4 связи, одна из этих связей связана с функциональной группой OH :
| Н | | Н | | |||
| ОХ − | С | − | С | -Н |
| | Х | | Х | |||
| C 2 H 6 O (M = 46 г моль -1 ) | ||||
Следующий член гомологического ряда алканолов имеет 3 атома углерода, каждый из которых должен образовывать 4 связи, и одна из этих связей должна быть связана с функциональной группой OH :
| Н | | Н | | Н | | ||||
| ОХ − | С | − | С | − | С | -Н |
| | Х | | Х | | Х | ||||
| C 3 H 8 O (M = 60 г моль -1 ) | ||||||
Разница между молекулярными формулами соседних гомологов составляет -CH 2 , который имеет молярную массу 14 г моль -1 , поэтому разница в молярной массе соседних гомологов составляет 14 г моль -1 .
Общая формула членов гомологического ряда алканолов: C n H 2n+2 O
Первый член гомологического ряда алканолов имеет n=1, поэтому молекулярная формула первого гомолога C 1 H 2×1+2 O, то есть CH 4 O
Второй член гомологического ряда алканолов имеет n=2, поэтому молекулярная формула второго гомолога C 2 H 2×2+2 O, то есть C 2 H 6 O
Нажмите, чтобы исследовать свойства алканолов.
Алканальные гомологичные серии
Гомологический ряд алканалов содержит соединения, которые:
- состоят ТОЛЬКО из атомов углерода (C), водорода (H) и кислорода (O)
- имеют только одинарные связи между атомами углерода (С-С)
- содержат карбонильную функциональную группу (C=O) на концевом атоме углерода цепи (конец углеродной цепи или первый атом углерода цепи)
Первый член (гомолог) алканального гомологического ряда содержит только 1 атом углерода, который должен образовывать в общей сложности 4 связи, и 2 из этих связей относятся к атому кислорода, как показано ниже:
| Н | | ||||
| О= | С | -Н | ||
| CH 2 O (M = 30 г моль -1 ) | ||||
Второй член (гомолог) алканального гомологического ряда содержит 2 атома углерода, каждый из которых должен образовывать в сумме 4 связи, а концевой атом углерода должен образовывать 2 связи с атомом кислорода, как показано ниже:
| Н | | Н | | |||
| О= | С | − | С | -Н |
| | Х | ||||
| C 2 H 4 O (M = 44 г моль -1 ) | ||||
Третий член (гомолог) алканального гомологического ряда содержит 3 атома углерода, каждый из которых должен образовывать в сумме 4 связи, а концевой атом углерода должен образовывать 2 связи с атомом кислорода, как показано ниже:
| Н | | Н | | Н | | ||||
| О= | С | − | С | − | С | -Н |
| | Х | | Х | |||||
| C 3 H 6 O (M = 58 г моль -1 ) | ||||||
Разница между молекулярными формулами соседних гомологов составляет -CH 2 , который имеет молярную массу 14 г моль -1 , поэтому разница в молярной массе соседних гомологов составляет 14 г моль -1 .
Общая формула для представителей гомологического ряда алканолов: C n H 2n O
Первый член гомологического ряда алканалей имеет n=1, поэтому молекулярная формула первого гомолога C 1 H 2×1 O, то есть CH 2 O
Второй член гомологического ряда алканалей имеет n=2, поэтому молекулярная формула второго гомолога C 2 H 2×2 O, то есть C 2 H 4 O
Нажмите, чтобы исследовать свойства алканалов.
Гомологичный ряд алканонов
Гомологический ряд алканонов содержит соединения, которые:
- состоят ТОЛЬКО из атомов углерода (C), водорода (H) и кислорода (O)
- имеют только одинарные связи между атомами углерода (С-С)
- содержат карбонильную функциональную группу (C=O) на неконцевом атоме углерода цепи (не на конце углеродной цепи или не на первом атоме углерода цепи)
Первый член (гомолог) гомологического ряда алканонов содержит 3 атома углерода, каждый из которых должен образовывать в сумме 4 связи, а атом углерода в середине цепи должен образовывать 2 связи с атомом кислорода, как показано ниже :
| Н | | О || | Н | | ||||
| Н- | С | − | С | − | С | -Н |
| | Х | | Х | |||||
| C 3 H 6 O (M = 58 г моль -1 ) | ||||||
Следующий гомолог содержит 4 атома углерода, каждый из которых должен в сумме образовывать 4 связи, а атом углерода в середине цепи должен образовывать 2 связи с атомом кислорода, как показано ниже:
| Н | | О || | Н | | Н | | |||||
| Н- | С | − | С | − | С | − | С | -Н |
| | Х | | Х | | Х | ||||||
| C 4 H 8 O (M = 72 г моль -1 ) | ||||||||
Следующий гомолог содержит 5 атомов углерода, каждый из которых должен в сумме образовывать 4 связи, а атом углерода в середине цепи должен образовывать 2 связи с атомом кислорода, как показано ниже:
| Н | | О || | Н | | Н | | Н | | ||||||
| Н- | С | − | С | − | С | − | С | − | С | -Н |
| | Х | | Х | | Х | | Х | |||||||
| C 5 H 10 O (M = 86 г моль -1 ) | ||||||||||
Разница между молекулярными формулами соседних гомологов составляет -CH 2 , который имеет молярную массу 14 г моль -1 , поэтому разница в молярной массе соседних гомологов составляет 14 г моль -1 .
Общая формула членов гомологического ряда алканонов: C n H 2n O
Первый член гомологического ряда алканонов имеет n=3, поэтому молекулярная формула первого гомолога C 3 H 2×3 O, то есть C 3 H 6 O
Второй член гомологического ряда алканонов имеет n=4, поэтому молекулярная формула второго гомолога C 4 H 2×4 O, то есть C 4 H 8 O
Нажмите, чтобы исследовать свойства алканонов.
Алкановые кислоты, гомологичный ряд
Гомологический ряд алкановой кислоты содержит соединения, которые:
- состоят ТОЛЬКО из атомов углерода (C), водорода (H) и кислорода (O)
- имеют только одинарные связи между атомами углерода (С-С)
- содержат карбоксильную функциональную группу (COOH) на концевом атоме углерода цепи (на конце углеродной цепи или на первом атоме углерода цепи)
Первый член (гомолог) гомологического ряда алкановой кислоты содержит только 1 атом углерода, который в сумме должен образовывать 4 связи, из которых 2 связи связаны с атомом кислорода, одна из этих связей связана с группой ОН, как показано ниже:
| О || | ||||
| НО- | С | -Н | ||
| CH 2 O 2 (M = 46 г моль -1 ) | ||||
Второй член (гомолог) гомологического ряда алкановой кислоты содержит 2 атома углерода, которые в сумме должны образовывать 4 связи, первый атом углерода должен иметь 2 из этих связей с атомом кислорода и 1 из этих связей с ОН-группой , как показано ниже:
| О || | Н | | |||
| HO- | С | − | С | -Н |
| | Х | ||||
| C 2 H 4 O 2 (M = 60 г моль -1 ) | ||||
Третий член (гомолог) гомологического ряда алкановой кислоты содержит 3 атома углерода, которые в сумме должны образовывать 4 связи, первый атом углерода должен иметь 2 из этих связей с атомом кислорода и 1 из этих связей с группой ОН , как показано ниже:
| О || | Н | | Н | | ||||
| HO- | С | − | С | − | С | -Н |
| | Х | | Х | |||||
| C 3 H 6 O 2 (M = 74 г моль -1 ) | ||||||
Разница между молекулярными формулами соседних гомологов составляет -CH 2 , который имеет молярную массу 14 г моль -1 , поэтому разница в молярной массе соседних гомологов составляет 14 г моль -1 .
Общая формула членов гомологического ряда алкановой кислоты: C n H 2n O 2
Первый член гомологического ряда алкановой кислоты имеет n=1, поэтому молекулярная формула первого гомолога C 1 H 2×1 O 2 , то есть CH 2 O 2
Второй член гомологического ряда алкановой кислоты имеет n=2, поэтому молекулярная формула второго гомолога C 2 H 2×2 O 2 , то есть C 2 H 4 О 2
Нажмите, чтобы исследовать свойства алкановых кислот.
Все о Гомологе и Изомере! – ChemSimplified
Наряду со знанием основных функциональных групп, присутствующих в органических соединениях, высока вероятность того, что вы столкнетесь с этими двумя понятиями: гомологический ряд и изомерия. Гомологический ряд (для краткости гомолог) подобен семье, состоящей из братьев и сестер, обладающих одинаковыми/похожими признаками. Например, самый основной гомологический ряд состоит из неразветвленного алкана. Проверьте список первых 10 братьев и сестер ниже.
Например, самый основной гомологический ряд состоит из неразветвленного алкана. Проверьте список первых 10 братьев и сестер ниже.
Обратите внимание, что их структура выглядит примерно одинаково? Единственная разница между одним из братьев и сестер заключается в дополнительном CH 2 . Это одна из характеристик, определяющих гомолог. Кроме того, гомологи имеют одну и ту же функциональную группу и общую формулу (C n H 2n+2 в нашем случае неразветвленного алкана).
Поскольку их структура настолько похожа, что способствует тому, что они имеют довольно схожие физические свойства, такие как температура кипения, точка плавления, физические состояния, плотность и т. д.Проверьте их температуру кипения и физическое состояние:
Очень похожи, не так ли? Можно с уверенностью сказать, что температура кипения обычно повышается примерно на 20-30°C для каждого дополнительного углерода в гомологическом ряду. Вы сможете наблюдать какую-то тенденцию, когда дело доходит до физических свойств гомологов. Вы как будто замечаете, что у всех братьев и сестер в семье кудрявые волосы, и с возрастом их волосы становятся длиннее. Таким образом, у младшего брата самые короткие вьющиеся волосы, а у старшего брата самые длинные вьющиеся волосы. (Не стреляйте в меня, если у вас есть знания в области генетики. Я просто пытаюсь придумать аналогию, чтобы помочь понять.) [Если у вас есть лучшая аналогия, я весь в глаза, напишите это в комментариях ниже. ;-)]
Вы как будто замечаете, что у всех братьев и сестер в семье кудрявые волосы, и с возрастом их волосы становятся длиннее. Таким образом, у младшего брата самые короткие вьющиеся волосы, а у старшего брата самые длинные вьющиеся волосы. (Не стреляйте в меня, если у вас есть знания в области генетики. Я просто пытаюсь придумать аналогию, чтобы помочь понять.) [Если у вас есть лучшая аналогия, я весь в глаза, напишите это в комментариях ниже. ;-)]
Гомологи также имеют схожие химические свойства. Например, алканы сгорают с кислородом с образованием углекислого газа и воды. Однако по мере увеличения размера алкана горение становится труднее. Тем не менее, наблюдается тенденция к их химической реакции с кислородом.Другой пример – поскольку алканы являются неполярными молекулами, они обычно не реагируют с ионными соединениями. Это как сказать, что братья и сестры обычно не любят есть сладкое, поэтому большинство из них держатся подальше от конфет, печенья, пирожных или чего-либо сладкого. Младший может съесть конфету раз в голубую луну, а старший и близко не подойдёт к сладкому. Сумасшедший, верно? Кто не любит сладкое? Я отвлекся, во всяком случае, вы понимаете, о чем я.
Младший может съесть конфету раз в голубую луну, а старший и близко не подойдёт к сладкому. Сумасшедший, верно? Кто не любит сладкое? Я отвлекся, во всяком случае, вы понимаете, о чем я.
Все эти разговоры о гомологах и их характеристиках суммированы здесь:
Хорошо, если вы записали гомолог.Тогда как насчет изомера? Я могу обобщить их в двух пунктах:
Конечно, на этом уровне (основной химии) изомеры, о которых мы говорим, относятся к конституционным изомерам. Не беспокойтесь об этом, если вы никогда не слышали о них. Но, если вам интересно, вы можете больше узнать о том, как можно классифицировать изомеры и где вписывается конституционный изомер. Чтобы обнаружить изомеры, вам нужно будет подсчитать количество атомов, присутствующих для каждого элемента в соединении. а также иметь возможность видеть, связаны ли они по-разному.Если вам нужно освежить знания о подсчете атомов, вы можете прочитать все об этом здесь.
Если вам хочется посмотреть, как я пройдусь по каждому из пунктов, определяющих гомолог и изомер, вы можете посмотреть это здесь:
youtube.com/embed/VUcjTa1Bxpc?rel=0″ src=»data:image/gif;base64,R0lGODlhAQABAAAAACH5BAEKAAEALAAAAAABAAEAAAICTAEAOw==»/>
В любом случае, что, если вам нужно классифицировать данный набор соединений как гомолог или изомер , или если они являются одним и тем же соединением или нет? Не волнуйся, я тебя прикрою. Просто используйте эту простую блок-схему, и вы сможете классифицировать как босс!
Посмотрите, как я прохожу блок-схему здесь:
Готовы проверить свои навыки? Каждая практика сосредоточена на 1 наборе соединений и состоит из 5 вопросов.Нажмите прочь!
Какова молекулярная формула i Четвертый высший гомолог 12 класса химии CBSE
Подсказка: Здесь мы должны найти случайный член гомологического ряда спиртов.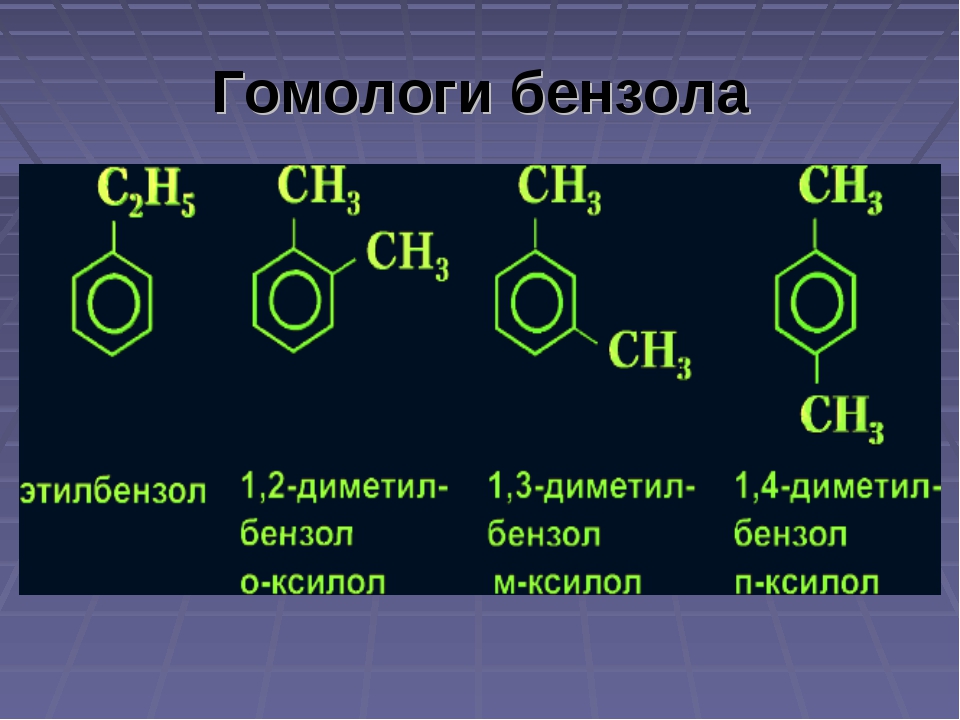 Гомологический ряд представляет собой непрерывный ряд углеводородов. Мы напишем общую молекулярную формулу спирта, а затем найдем соответствующие члены спиртов. Каждый последующий член гомологического ряда отличается на $ — C{H_2} $ группу.
Гомологический ряд представляет собой непрерывный ряд углеводородов. Мы напишем общую молекулярную формулу спирта, а затем найдем соответствующие члены спиртов. Каждый последующий член гомологического ряда отличается на $ — C{H_2} $ группу. Полный ответ:
Гомологический ряд – это ряд соединений, обладающих сходными физическими и химическими свойствами, но различающихся только группой $-C{H_2}$.Они содержат одну и ту же функциональную группу. Каждый член этого ряда называется гомологичным, а сам ряд также известен как гомология. Таким образом, мы можем сказать, что каждый последовательный член гомологического ряда отличается молекулярной массой $ 16 {\ text { }} г $, что является массой группы $ — C {H_2} $. В случае спиртов каждый член гомологического ряда содержит гидроксильные группы $ \left( { — OH} \right) $ . Каждый последующий член ряда будет отличаться на $ — C{H_2} $ группу. Также мы знаем общую формулу для спирта: $ {C_n}{H_{2n + 1}} — OH $ .Здесь n — целое положительное значение, и оно не может быть равно нулю. Поэтому первым членом ряда будет $C{H_3}-OH$, метиловый спирт.
Поэтому первым членом ряда будет $C{H_3}-OH$, метиловый спирт.
$ (i){\text{ }} $ Когда мы запрашиваем четвертый высший гомолог этилового спирта, это означает, что мы должны добавить четыре $ — C{H_2} $ к этиловому спирту. Мы знаем формулу этилового спирта: $C{H_3} — C{H_2} — OH$. Теперь мы добавим четыре группы $ — C{H_2} $, чтобы получить четвертый старший член ряда. Таким образом, мы получаем,
$ C{H_3} — C{H_2} — {\left( {C{H_2}} \right)_4} — OH $ , что является гексанолом.
$ (ii){\text{ }} $ Когда мы запрашиваем второй нижний член бутилового спирта, это означает, что мы должны вычесть два $ — C{H_2} $ из бутилового спирта. Мы знаем, что бутиловый спирт можно записать как $C{H_3} — C{H_2} — C{H_2} — C{H_2} — OH $ . Теперь вычтем две группы $-C{H_2}$, чтобы получить второй низший гомолог бутилового спирта. Таким образом, мы получаем,
$ C{H_3} — C{H_2} — OH $
Примечание:
Каждый член гомологического ряда отличается только группой $ — C{H_2} $. Для нахождения более высокого члена это означает, что мы должны увеличить группу $-C{H_2}$, а для нахождения более низкого гомолога мы должны вычесть $-C{H_2}$. Также молекулярная масса каждого последующего члена отличается только на массу группы $ — C{H_2} $.
Для нахождения более высокого члена это означает, что мы должны увеличить группу $-C{H_2}$, а для нахождения более низкого гомолога мы должны вычесть $-C{H_2}$. Также молекулярная масса каждого последующего члена отличается только на массу группы $ — C{H_2} $.
Извлечение рядов нецелевых гомологов из данных масс-спектрометрии высокого разрешения, разделенных дефисом | Journal of Cheminformatics
Основываясь на определении серий сигналов LC-HRMS, которые могут быть вызваны гомологичными соединениями, обнаружение серий происходит в два этапа.Первый этап извлекает набор S 3 допустимых 3-кортежей (троек) пиков, а второй этап пошагово рекомбинирует их в более крупные наборы n > 3.
Определение серии
Серия A k длиной n ≥ n мин определяется как кортеж S н,к = ( p 1 ,к, …, стр. н,к ) выбранных пиков сигнала LC-HRMS p = { m/z, RT, интенсивность }, упорядоченных по возрастанию m/z серий пиков. С п обозначает набор всех таких кортежей серий, имеющих длину n . Предполагается, что пики, расположенные рядом в кортеже, отличаются только повторяющейся и, возможно, неизвестной химической единицей или функциональной группой, например, CH 2 или OH. В результате изменения разностей масс Δ m/z между любыми двумя соседними сериями пиков p й,к и р j +1 ,k должно оставаться в пределах погрешности [−4 ε; 4 ε ]. ε здесь обозначает максимальную ± m/z ошибку измерения и может зависеть от m/z или пиковой интенсивности [36].
н,к ) выбранных пиков сигнала LC-HRMS p = { m/z, RT, интенсивность }, упорядоченных по возрастанию m/z серий пиков. С п обозначает набор всех таких кортежей серий, имеющих длину n . Предполагается, что пики, расположенные рядом в кортеже, отличаются только повторяющейся и, возможно, неизвестной химической единицей или функциональной группой, например, CH 2 или OH. В результате изменения разностей масс Δ m/z между любыми двумя соседними сериями пиков p й,к и р j +1 ,k должно оставаться в пределах погрешности [−4 ε; 4 ε ]. ε здесь обозначает максимальную ± m/z ошибку измерения и может зависеть от m/z или пиковой интенсивности [36]. Δ m/z всех рядов в наборе данных LC-HRMS находится в пределах нижней и верхней границ Δ m/z мин и Δ м/з макс. , априори установленный как рассматриваемый диапазон масс химических единиц при заданных зарядах z .
Δ m/z всех рядов в наборе данных LC-HRMS находится в пределах нижней и верхней границ Δ m/z мин и Δ м/з макс. , априори установленный как рассматриваемый диапазон масс химических единиц при заданных зарядах z .
Кроме того, Δ m/z сдерживает возможные различия в дефекте массы пиков соседних серий, обозначенных Δ m . Дефект массы здесь относится к отклонению между точным значением m/z иона и его ближайшим целым числом [37]. Для любой моноизотопной химической единицы, которая может составлять разность масс Δ m/z , границы γ мин и γ макс. для минимальной и максимальной разницы в Δ м между пиками серии p й,к и еще пик р j +1 ,k можно определить по массовым дефектам изотопов с наименьшей массой для каждого из элементов, содержащихся в единице. Например, хотя и не зная точного состава химической единицы, но предполагая, что присутствуют только C, H, N, O, S, Cl и Br, мы можем ожидать значение Δ m между любыми двумя пиками серии отличаясь на Δ m/z , чтобы лежать в пределах [-0,0010 Δ m/z ; 0,0078 Δ m/z ]. Первый множитель γ мин определяется отношением дефекта массы к атомной массе 79 Br, второй множитель γ макс. по соотношению для 1 Н.Коэффициенты для всех остальных элементов находятся между этими границами. γ должны быть рассчитаны для всех химических элементов, если нельзя сделать никаких предположений относительно задействованных элементов. Математическое определение γ мин и γ макс.
Например, хотя и не зная точного состава химической единицы, но предполагая, что присутствуют только C, H, N, O, S, Cl и Br, мы можем ожидать значение Δ m между любыми двумя пиками серии отличаясь на Δ m/z , чтобы лежать в пределах [-0,0010 Δ m/z ; 0,0078 Δ m/z ]. Первый множитель γ мин определяется отношением дефекта массы к атомной массе 79 Br, второй множитель γ макс. по соотношению для 1 Н.Коэффициенты для всех остальных элементов находятся между этими границами. γ должны быть рассчитаны для всех химических элементов, если нельзя сделать никаких предположений относительно задействованных элементов. Математическое определение γ мин и γ макс. приведен в дополнительном файле 1. Кроме того, необходимо учитывать округление, связанное с расчетом дефекта массы: любое Δ m в ряду, приводящее к значениям дефекта массы выше 0.5 последовательно сворачивают их в Δm — 1, тогда как значения ниже -0,5 преобразуются в Δ м + 1. Таким образом, различия на Δ м должны быть адаптированы соответствующим образом.
приведен в дополнительном файле 1. Кроме того, необходимо учитывать округление, связанное с расчетом дефекта массы: любое Δ m в ряду, приводящее к значениям дефекта массы выше 0.5 последовательно сворачивают их в Δm — 1, тогда как значения ниже -0,5 преобразуются в Δ м + 1. Таким образом, различия на Δ м должны быть адаптированы соответствующим образом.
Подобно границам для Δ m/z и Δ m , отклонения во времени удерживания RT между пиками соседних серий также должны быть ограничены, чтобы отражать разумные хроматографические характеристики, вызванные повторным введением химических единиц [29]. , 30]. С одной стороны Δ RT мин и Δ РТ макс. , следовательно, определить минимальные и максимальные границы различий в RT от одного пика p й,к до следующего пика кортежа p j +1 ,k соответственно. С другой стороны, можно ожидать, что изменения Δ RT в ряду будут носить систематический характер [29, 30]. Во-первых, такие изменения Δ RT от одной пары соседних пиков в наборе ( p й,к , р j +1 ,k ) к следующему ( p j +1 ,k , р j +2 ,k ) должно быть меньше предопределенного значения, обозначаемого как ΔΔ RT .Во-вторых, кубические сглаживающие сплайны подгоняются к модели RT как функция m/z в каждом наборе серий [38]. Вкратце, соответствие модели каждой серии определяется коэффициентом детерминации ( R 2 ) должно быть выше определенного порога, используя заданный параметр сглаживания λ ≥ 0.
С другой стороны, можно ожидать, что изменения Δ RT в ряду будут носить систематический характер [29, 30]. Во-первых, такие изменения Δ RT от одной пары соседних пиков в наборе ( p й,к , р j +1 ,k ) к следующему ( p j +1 ,k , р j +2 ,k ) должно быть меньше предопределенного значения, обозначаемого как ΔΔ RT .Во-вторых, кубические сглаживающие сплайны подгоняются к модели RT как функция m/z в каждом наборе серий [38]. Вкратце, соответствие модели каждой серии определяется коэффициентом детерминации ( R 2 ) должно быть выше определенного порога, используя заданный параметр сглаживания λ ≥ 0. , первый этап обнаружения серии использует k -мерных ( k -d) деревьев [39] в качестве метрической структуры данных, чтобы обеспечить вычислительно быстрое извлечение 3-кортежей пиков, которые могут быть возможными подкортежами больших серий. кортежи.{4}\)
, первый этап обнаружения серии использует k -мерных ( k -d) деревьев [39] в качестве метрической структуры данных, чтобы обеспечить вычислительно быстрое извлечение 3-кортежей пиков, которые могут быть возможными подкортежами больших серий. кортежи.{4}\)
$$a_{x} = \left( {m/z_{x} , \, \Delta m_{x} — \, \gamma_{min} m/z_{x} , \, \Delta m_{x } — \, \gamma_{max} m/z_{x} , \, RT_{x} } \right)$$
(1)
Геометрическое изображение элементов и х показано синими линиями на рис. 1. Второй и третий элементы \(a_{{x_{2} }}\) и \(a_{{x_{3} }}\) преобразуют минимальное и максимальное изменение в дефекте массы с изменением массы пика до метрической шкалы, которую можно представить в виде дерева k -d.В последнем каждый узел дерева (псевдоним пика) разбивает пространство и содержащиеся в нем пики на два раздела, используя пик со средним значением для одного из элементов в и х . {3}\)).Начиная с первой записи и х для корневого узла и рекурсивный цикл по записям и х до тех пор, пока не будут достигнуты разделы с одним пиком (т. е. конечные узлы), дерево k -d поддерживает быстрые запросы диапазона. Эти запросы выполняются для извлечения всех пиков из двух подпространств типов L и H с более низкими и более высокими m/z , повторно центрированными на каждом пике LC-HRMS.Извлеченные пики затем последовательно рекомбинируются для выявления всех уникальных комбинаций пиков, которые могут образовывать тройки в соответствии с приведенным выше определением серии и которые включают текущий центральный пик в качестве второго элемента триплета (см. зеленые и синие точки на рис. . 1). Пики, запрошенные с помощью этих подпространств, обычно представляют собой незначительную часть всех измеренных пиков ЖХ-МСВР, и рекомбинация в возможные триплеты, таким образом, значительно улучшается по сравнению с проверкой, использующей все пики.
{3}\)).Начиная с первой записи и х для корневого узла и рекурсивный цикл по записям и х до тех пор, пока не будут достигнуты разделы с одним пиком (т. е. конечные узлы), дерево k -d поддерживает быстрые запросы диапазона. Эти запросы выполняются для извлечения всех пиков из двух подпространств типов L и H с более низкими и более высокими m/z , повторно центрированными на каждом пике LC-HRMS.Извлеченные пики затем последовательно рекомбинируются для выявления всех уникальных комбинаций пиков, которые могут образовывать тройки в соответствии с приведенным выше определением серии и которые включают текущий центральный пик в качестве второго элемента триплета (см. зеленые и синие точки на рис. . 1). Пики, запрошенные с помощью этих подпространств, обычно представляют собой незначительную часть всех измеренных пиков ЖХ-МСВР, и рекомбинация в возможные триплеты, таким образом, значительно улучшается по сравнению с проверкой, использующей все пики. Упомянутые типы подпространств L и H являются результатом объединения интервалов
Упомянутые типы подпространств L и H являются результатом объединения интервалов
$$I_{1} = [a_{{x_{1} }} + \Delta m/z_{min} ; a_{{x_{1} }} + \Delta m/z_{max} ]$$
(2)
$$I_{2} = [a_{{x_{2} }} — 2\varepsilon ;\infty ]$$
(3)
$$I_{3} = [ — \infty ;a_{{x_{3} }} + 2\varepsilon ]$$
(4)
$$I_{4} = \left[ {a_{{x_{4} }} + RT_{min} ;a_{{x_{4} }} + RT_{max} } \right]$$
(5)
$$I_{5} = [a_{{x_{1} }} — \Delta m/z_{max} ;a_{{x_{1} }} — \Delta m/z_{min} ]$$
(6)
$$I_{6} = [ — \infty ;a_{{x_{2} }} + 2\varepsilon ]$$
(7)
$$I_{7} = \left[ {a_{{x_{3} }} — 2\varepsilon ;\infty } \right]$$
(8)
$$I_{8} = [a_{{x_{4} }} — RT_{max} ;a_{{x_{4} }} — RT_{min} ]$$
(9)
через их декартовы произведения в запрашиваемые подпространства
$$H = I_{1} \times I_{2} \times I_{3} \times I_{4}$$
(10)
$$L = I_{5} \times I_{6} \times I_{7} \times I_{8}$$
(11)
Рис. 1
1 Пример запроса подпространства ( черных полигонов ) для обнаружения трех кортежей с центром в одном пике ( синяя точка ) с одним обнаруженным трехкортежным примером в зеленых . Пересечения синих линий с осями указывают значения четырех элементов и . х для этого пика. Кроме того, пунктирных линий отмечают интервал m/z , определенный в уравнении.(6). В свою очередь, пунктирных линий на верхней панели отмечают интервал RT уравнения. (9), в то время как пунктирных линий на нижней панели указывают верхнюю и нижнюю границу интервалов, связанных с различиями дефекта массы из уравнений. (7) и (8), соответственно
Интервалы I 1 – I 4 определить границы в каждом из четырех измерений a х для подпространства H , следующего за запрошенным центральным пиком. Напротив, интервалы I 5 – I 8 определяет подпространство L , предшествующее запрошенному пику, как показано черными линиями и многоугольниками на рис. 1. Дополнительные сведения о том, как учесть упомянутую проблему округления Δ м и ускорить вычислительный поиск подпространств представлены в дополнительном файле 2.
Напротив, интервалы I 5 – I 8 определяет подпространство L , предшествующее запрошенному пику, как показано черными линиями и многоугольниками на рис. 1. Дополнительные сведения о том, как учесть упомянутую проблему округления Δ м и ускорить вычислительный поиск подпространств представлены в дополнительном файле 2.
Рекомбинация кортежей
На втором этапе извлеченные 3-кортежи последовательно объединяются в более крупные кортежи.Для этого все попарные комбинации кортежей x и y из набора S п , которые отличаются только первым и последним пиковыми элементами, т.е.
$$\left( {p_{1,x} , \ldots , \, p_{n — 1,x} } \right) = \left( {p_{2,y}, \ldots, \, p_{n,y} } \right)$$
(12)
или
$$\left( {p_{2,x} , \ldots , \, p_{n,x} } \right) = \left( {p_{1,y} , \ldots , \, p_{n — 1,y} } \right)$$
(13)
и соответствуют приведенным выше определениям серии, касающимся ε , изменения в ΔRT и λ объединяются в новый (n + 1 ) -кортеж в S n +1 . Сформировав все комбинации из S п , результирующие кортежи в S n +1 , в свою очередь, рекомбинируются в более крупные кортежи в следующем наборе S n +2 . Это повторяется до тех пор, пока не будет достигнуто пустое множество, в котором каждый n -кортеж может быть объединен в несколько различных ( n + 1)-кортежей.Поэтому вершина не может быть включена более одного раза в один кортеж, а несколько раз в несколько разных кортежей. В каждой рекурсии n -кортежей, которые можно объединить хотя бы в один новый ( n + 1)-кортеж из S n +1 удалены из S п ; в противном случае они остаются в S п или отбрасываются, если длина меньше минимальной, определяемой пользователем n мин .
Сформировав все комбинации из S п , результирующие кортежи в S n +1 , в свою очередь, рекомбинируются в более крупные кортежи в следующем наборе S n +2 . Это повторяется до тех пор, пока не будет достигнуто пустое множество, в котором каждый n -кортеж может быть объединен в несколько различных ( n + 1)-кортежей.Поэтому вершина не может быть включена более одного раза в один кортеж, а несколько раз в несколько разных кортежей. В каждой рекурсии n -кортежей, которые можно объединить хотя бы в один новый ( n + 1)-кортеж из S n +1 удалены из S п ; в противном случае они остаются в S п или отбрасываются, если длина меньше минимальной, определяемой пользователем n мин . Кроме того, избыточные подкортежи, которые образуются путем регулярного исключения пиков в больших n -наборах наборов S n ≥5 необходимо фильтровать при каждой рекурсии.
Кроме того, избыточные подкортежи, которые образуются путем регулярного исключения пиков в больших n -наборах наборов S n ≥5 необходимо фильтровать при каждой рекурсии.
Спаривание рядов
Как уже упоминалось, пик может быть членом более чем одного ряда, так как он, содержащий 3 кортежа, мог быть включен в несколько разных более крупных кортежей, а не в один. Для выяснения причин, лежащих в основе такой неоднозначности, были извлечены все уникальные пары серий, которые пересекаются по крайней мере в одном пике образца ЖХ-МСВР, и их свойства охарактеризованы двояко.
С одной стороны, угол пересечения θ использовался для аппроксимации того, насколько два ряда x и y такой пары пересекаются в плоскости RT и m/z . θ определяется как
$$\cos \theta = \frac{{u_{x} \cdot u_{y}}}}{{\parallel u_{x}\parallel \parallel u_{y}\parallel} }$$
(14)
В этом уравнении числитель и знаменатель задают скалярное произведение и произведение евклидовой нормы векторов с масштабированными средними значениями
$$u_{x} = \left( {\frac{{\overline{{\Delta RT_{ x} }} }}{{c_{\Delta RT}}},\frac{{\overline{{\Delta m/z_{x}}}}}}{{c_{\Delta m/z}}}} \справа)$$
(15)
каждой серии соответственно. Здесь \(c_{\Delta RT}\) и \(c_{\Delta m/z}\) — диапазоны \(\overline{\Delta RT}\) и \(\overline{\Delta m/ z}\) по всей серии. Чем меньше значение θ , тем больше две парные серии перекрывают друг друга в плоскости RT против m/z . При θ = 0 π они полностью пересекаются.
Здесь \(c_{\Delta RT}\) и \(c_{\Delta m/z}\) — диапазоны \(\overline{\Delta RT}\) и \(\overline{\Delta m/ z}\) по всей серии. Чем меньше значение θ , тем больше две парные серии перекрывают друг друга в плоскости RT против m/z . При θ = 0 π они полностью пересекаются.
С другой стороны, самоорганизующаяся карта (SOM) использовалась для визуализации и кластеризации общих свойств среди парных рядов, чтобы объяснить различия в θ [40, 41].Будучи неконтролируемой стратегией обучения, SOM позволяют отображать большой набор из m многомерных входных векторов v = ( v 1 ,…,v и ,…,v м ) свойств пары серий на меньшую двумерную сетку узлов SOM. Затем SOM можно выборочно отображать для сопоставленных свойств; подобные свойства здесь сопоставлены с близкими областями в SOM, в то время как разные свойства довольно разделены. В данном случае каждый входной вектор свойств пары рядов
В данном случае каждый входной вектор свойств пары рядов
$$v_{j} = \left( {\frac{{\overline{{\Delta RT_{x} }}}}{{\hat{c} _{\Delta RT}}},\frac{{\overline{{\Delta m/z_{x}}}}}{{\hat{c}_{\Delta m/z}}},\frac{ {\overline{{\Delta RT_{y}}}}}{{\шляпа{c}_{\Delta RT}}},\frac{{\overline{{\Delta m/z_{y}}}}} }{{\шляпа{c}_{\Delta m/z} }}} \right)$$
(16)
содержит средние значения m/z и RT разностей, присутствующих в парных рядах x и y , упорядоченных по \(\overline{{\Delta m/z_{x} }} \ge \ надчеркивание {{\Delta m/z_{y}}}\) и \(\hat{c}_{\Delta RT}\) и \(\hat{c}_{\Delta m/z}\), представляющие средние ожидаемые погрешности измерения Δ RT и Δ m/z соответственно.На основании этих свойств можно рассчитать угол пересечения θ для каждого узла SOM по уравнению. (14) для оценки суперявности отображаемых на него рядов. Дополнительная информация об обучении и качестве SOM представлена в дополнительном файле 3. Расчеты SOM проводились с помощью пакета R kohonen , параметризованного, как указано в дополнительном файле 4: таблица S1 [42].
Расчеты SOM проводились с помощью пакета R kohonen , параметризованного, как указано в дополнительном файле 4: таблица S1 [42].
Отбор проб и анализ
Оценка проводилась на 24-часовых пропорциональных расходу пробах, взятых из сточных вод десяти швейцарских очистных сооружений в феврале 2010 г., как это использовалось и подробно описано в Schymanski et al.[16]. Короче говоря, каждый образец объемом 0,25 л был скорректирован по pH, отфильтрован, дополнен 103 изотопно-мечеными стандартами и обогащен с помощью твердофазной экстракции в смешанном слое. После щелочной/кислотной экстракции, дальнейшего обогащения в потоке газообразного азота, восстановления водой ВЭЖХ до 1 мл и второго этапа фильтрации конечную аликвоту объемом 20 мкл л анализировали с помощью ВЭЖХ-ESI-HRMS. Стадия хроматографии включала колонки Waters XBridge C18 (Milford, USA) и градиент вода/метанол при скорости потока 200 μ л/мин, создаваемый смесительным насосом низкого давления Rheos 2200 (Flux tools, Basel, Швейцария). Q-Exactive (Thermo Fisher Scientific, Сан-Хосе, США) использовали для полносканирующего масс-спектрометрического анализа с разрешением 140 000 при m/z = 200 после ионизации электрораспылением в каждом положительном и отрицательном режимах (напряжение распыления + 4 и -3 кВ соответственно; капиллярная температура 350 °C). Контрольное измерение проводили перед каждым блоком положительных и отрицательных аликвот образцов соответственно. Файлы данных находятся в открытом доступе через репозиторий MassIVE [43].
Q-Exactive (Thermo Fisher Scientific, Сан-Хосе, США) использовали для полносканирующего масс-спектрометрического анализа с разрешением 140 000 при m/z = 200 после ионизации электрораспылением в каждом положительном и отрицательном режимах (напряжение распыления + 4 и -3 кВ соответственно; капиллярная температура 350 °C). Контрольное измерение проводили перед каждым блоком положительных и отрицательных аликвот образцов соответственно. Файлы данных находятся в открытом доступе через репозиторий MassIVE [43].
Обработка данных
Данные полного сканирования LC-HRMS были центроидированы и преобразованы в открытые файлы формата mzXML с помощью ProteoWizard (версия 3.0,7162) [44, 45]. Затем весь последующий анализ выполнялся в статистической среде R [46]. Используя пакет R enviPick (версия 1.2) [47], ионные хроматограммы были извлечены в каждый файл, и каждая извлеченная хроматограмма была проверена на пики сигнала с параметрами, перечисленными в дополнительном файле 5: Таблица S2. После выбора пиков серии были обнаружены с помощью описанного выше алгоритма, как указано в дополнительном файле 6: таблица S3. Для каждого пика, являющегося частью серии, выполняли как вычитание холостого опыта, так и деизотопирование с помощью enviMass v3.1 [48] и пакеты nontarget v1.9 [49] соответственно (параметры см. в таблицах S4 и S5 в дополнительных файлах 7 и 8). В первом случае было проверено пик-центрированное окно RT и m/z для каждого пика образца, чтобы не содержать необработанных пустых данных, превышающих максимальную интенсивность пика образца более чем в 0,1 раза, чтобы подтвердить его присутствие в сточных водах. Правило большинства, т. е. доля ≥0,5 пиков на серию, использовалось для окончательного присвоения серии нулевого происхождения.Для деизотопирования сравнение с квантованными данными моделирования позволило сгруппировать пики изотополога неизвестного соединения в пределах заданных погрешностей измерения. Затем пики в отдельных группах изотопологов каждой серии пиков ранжировали по возрастанию m/z .
После выбора пиков серии были обнаружены с помощью описанного выше алгоритма, как указано в дополнительном файле 6: таблица S3. Для каждого пика, являющегося частью серии, выполняли как вычитание холостого опыта, так и деизотопирование с помощью enviMass v3.1 [48] и пакеты nontarget v1.9 [49] соответственно (параметры см. в таблицах S4 и S5 в дополнительных файлах 7 и 8). В первом случае было проверено пик-центрированное окно RT и m/z для каждого пика образца, чтобы не содержать необработанных пустых данных, превышающих максимальную интенсивность пика образца более чем в 0,1 раза, чтобы подтвердить его присутствие в сточных водах. Правило большинства, т. е. доля ≥0,5 пиков на серию, использовалось для окончательного присвоения серии нулевого происхождения.Для деизотопирования сравнение с квантованными данными моделирования позволило сгруппировать пики изотополога неизвестного соединения в пределах заданных погрешностей измерения. Затем пики в отдельных группах изотопологов каждой серии пиков ранжировали по возрастанию m/z .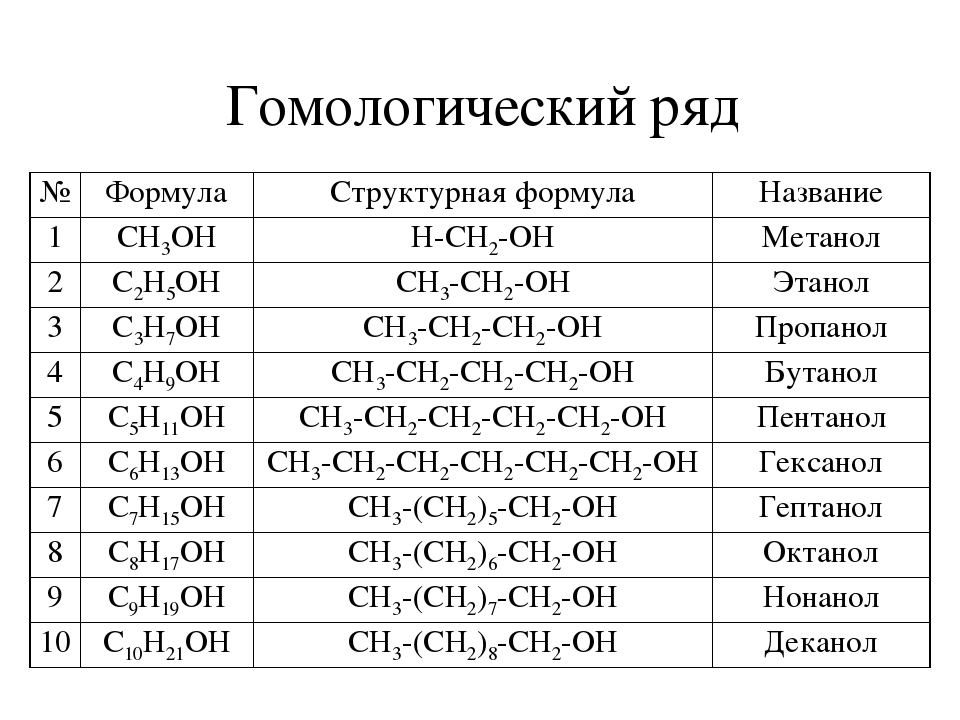 Ряд считался моноизотопным, если наиболее частый ранг среди всех пиков в ряду равнялся 1.
Ряд считался моноизотопным, если наиболее частый ранг среди всех пиков в ряду равнялся 1.
Вариация числа хромосом
Изменение числа хромосом может происходить за счет добавления всей или части хромосомы. ( анеуплоидия ), потеря всего набора хромосом ( моноплоидия ) или приобретение одной или нескольких полные наборы хромосом ( эуплоидий ).Каждое из этих состояний является вариацией нормального диплоидное число хромосом. Как и следовало ожидать, каждый из них может оказать сильное влияние на фенотипическое выражение.Анеуплоидия — в аномальном состоянии были одна или несколько хромосом нормального набора хромосомы отсутствуют или присутствуют в большем, чем обычно, количестве копий
Моноплоидия — потеря всего набора хромосом
Эуплоидия — весь набор хромосом удваивается один или несколько раз
Различные состояния анеуплоидии:
- Нуллисомия — потеря обеих пар гомологичных хромосом; люди называются нуллисомики и их хромосомный состав 2N-2
- Моносомия — потеря одной хромосомы; особи называются моносомиками, а их хромосомный состав 2N-1
- Трисомия — приобретение лишней копии хромосомы; людей называют трисомиками и их хромосомный состав 2N+1
- Тетрасомный — приобретение лишней пары гомологичных хромосом; люди называются тетрасомики и их хромосомный состав 2N+2
 вовлеченный.Например, у двойной моносомии отсутствует одна хромосома из каждой из двух пар.
гомологичной хромосомы (обозначенной 2N-1-1 ), а двойная тетрасомная хромосома содержит дополнительную пару
из двух пар гомологичных хромосом ( 2N+2+2 ).
вовлеченный.Например, у двойной моносомии отсутствует одна хромосома из каждой из двух пар.
гомологичной хромосомы (обозначенной 2N-1-1 ), а двойная тетрасомная хромосома содержит дополнительную пару
из двух пар гомологичных хромосом ( 2N+2+2 ). В дополнение к вариациям целых чисел хромосом были обнаружены генетические запасы.
развиты, особенно у растений, у которых сохраняются части хромосом.
Одним из примеров являются телоцентрики , которые представляют собой хромосомы с терминальной центромерой.Эти
структуры представляют собой хромосомы, в которых отсутствует генетический материал за пределами этой центромеры.
(Стаки, содержащие эти типы хромосом, называются monotelosomics или monotelos для
короче.) Другим типом структуры является изохромосома , которая представляет собой хромосому, содержащую
одинаковый генетический материал на обеих руках. (Генетические запасы, содержащие эти хромосомы, называются monoisosomics или monoisos для краткости. )
)
Авторские права © 1997.Phillip McClean
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.

- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
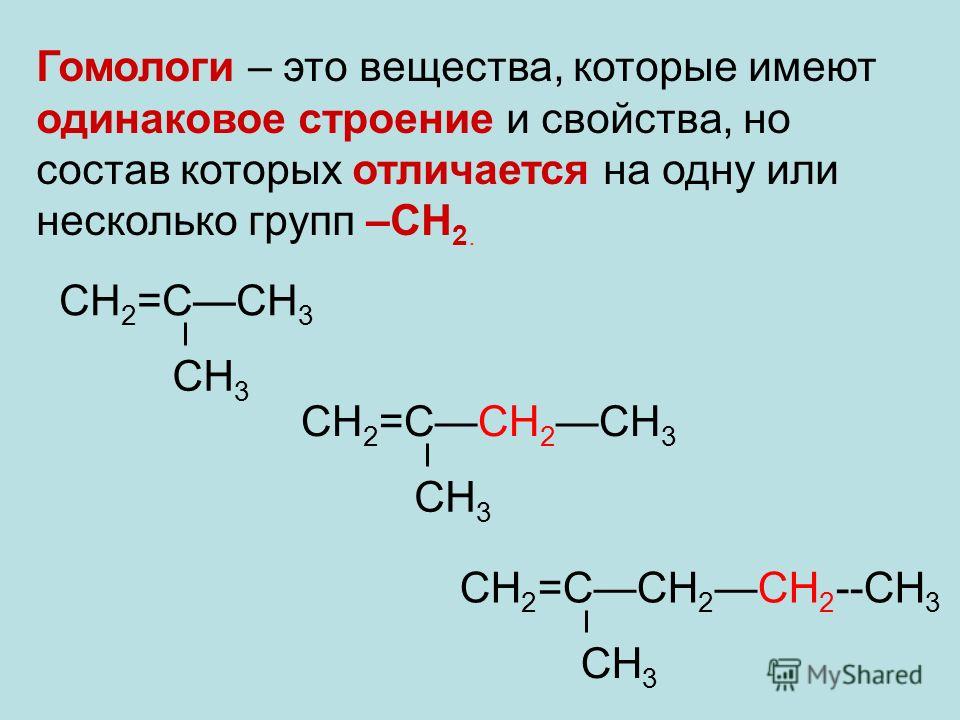 Водорода становится на два меньше, чем в алкане, поэтому общая формула алкенов – Cnh3n.
Водорода становится на два меньше, чем в алкане, поэтому общая формула алкенов – Cnh3n.