Урок алгебры по теме «Двойной радикал». 8-й класс
Цели урока:
Учебная:
- Углубить знания учащихся по теме квадратные корни и обобщить учебный материал.
- Познакомить учащихся с понятием двойного радикала.
- Научить преобразовывать двойные радикалы выделением полного квадрата подкоренного выражения.
- Научить учащихся использовать формулу двойного радикала.
- Развивать умения и навыки работы с иррациональными выражениями.
Развивающая:
- Развитие внимания учащихся.
- Развитие умения добиваться результатов труда.
- Развитие интереса к изучению алгебры и навыков самостоятельной работы.
Воспитывающая:
- Воспитание чувства коллективизма.
- Формирование чувства ответственности за результат работы.
- Формирование у учащихся адекватной самооценки при выборе отметки за работу на уроке.

Оборудование: компьютер, проектор.
Ход урока1 этап работы. Организационный момент.2 этап работы. Мотивация и выход на постановку проблемыДо восьмого класса мы осуществляли над числами пять арифметических действий: сложение, вычитание, умножение, деление и возведение в степень, причем при вычислениях, мы активно использовали различные свойства этих операций.
В курсе алгебры восьмого класса была введена новая операция – извлечение квадратного корня из неотрицательного числа. Выражения, содержащие операцию извлечения квадратного корня, называются иррациональными.
В большом толковом словаре можно найти следующее определение иррациональности:
С философской точки зрения иррациональность – недоступность разуму, то, что не может быть постигнуто разумом, что явно не подчиняется законам логики, и не может быть выражено в логических понятиях, что оценивается как «сверхразумное».
Действительно ли понятие иррациональности – это что-то «уму не постижимое, несоизмеримое, немыслимое»?
На этот вопрос мы постараемся сегодня найти ответ.
3 этап работы. Повторение ранее изученного материала1) Свойства квадратного корня
Чтобы успешно выполнять преобразования выражений, содержащих операцию извлечения квадратного корня, нужно знать свойства этой операции.
Вспомним эти свойства:
1) Квадратный корень из произведения двух неотрицательных чисел равен произведению квадратных корней из этих чисел.
2) Если a≥0, b>0, то справедливо равенство
3) Если a≥0 и n – натуральное число, то
4) При любом a справедливо тождество
Если хорошо знать приёмы преобразования рациональных выражений, приёмы преобразования алгебраических дробей, усвоить определение понятия корня и свойства квадратного корня, уметь вносить множитель под знак квадратного корня, выносить множитель из – под знака квадратного корня, то можно выполнить преобразование любого выражения, содержащего операцию извлечения квадратного корня.
2) Способы преобразования радикалов
Кроме перечисленных теорем при преобразовании радикалов применяются некоторые специальные приёмы, тоже вытекающие из этих теорем, но требующие некоторого навыка.
Первый называется уничтожением иррациональности в знаменателе дроби. Если в знаменателе дроби имеется корень или несколько корней, то обращаться с такой дробью не совсем удобно. Смысл этого приёма заключается в том, что надо подобрать такой множитель, чтобы его произведение на знаменатель не содержало корней.
Второе интересное преобразование радикалов называется преобразованием двойного радикала .
4 этап работы. Ввести понятие двойного радикала и доказатьформулу сложного радикала.Выражения вида и называют двойными радикалами или сложными радикалами. Преобразовать двойной радикалэто значит избавиться от внешнего радикала.
Справедливы тождества
=
При каждое подкоренное выражение неотрицательно.
Докажем эти равенства(доказывает ученик):
Для этого возведём в квадрат обе части данных выражений, воспользовавшись при этом формулой квадрата суммы (разности) двух чисел и формулой разности квадратов.
Возведем в квадрат левую часть:
=
Возведем в квадрат правую часть:
= ∙ = = = = = = =
Заметим, что доказанное тождество позволяет существенно облегчить вычисления и преобразования, если выражение представляет полный квадрат.
5 этап работы. Рассмотрим способы преобразования двойного радикала.1 способ:
Можно выполнить алгебраические действия в некотором выражении, содержащем двойные радикалы.
Примеры:
= = = = = =
= = = = = =
= = = = =
=
2 способ
Можно привести подкоренное выражение к полному квадрату.
Примеры:
- = = = = = = =
- = = = = =
- = = = = =
Таким образом, если подкоренное выражение представить в виде полного квадрата, то можно легко освободиться от внешнего радикала.
Попробуем решить
НЕ УДАЕТСЯ!!!
3 способ
В тех случаях, когда подкоренное выражение нелегко представить в виде полного квадрата, то можно использовать готовую формулу сложного радикала
=
Примеры:
- = = = = = = =
- = = = = = =
- = = = = = =
 Закрепление изученного материала.
Закрепление изученного материала.Преобразуйте выражения, содержащие двойные радикалы:
Преобразовать двойные радикалы можно следующим образом:
- выполняя в выражении, содержащем двойные радикалы, алгебраические действия, применив свойства квадратных корней;
- приводя подкоренное выражение к полному квадрату;
- используя формулы сложного радикала.
Дома вы преобразуете двойные радикалы разными способами (раздать листы с заданиями).
Урок окончен. Спасибо за урок!
«Сложные эфиры»
«Сложные эфиры»
Автор: edu2
Методическая копилка — Химия
Автор: учитель химии первой квалификационной категории Коваленко Марина Витальевна, стаж педагогической деятельности 17 лет
МКОУ «Никольская СОШ»Солнцевского района Курской области
Предмет химия.
Методическая разработка урока с использованием информационно-коммуникационных технологий.
Класс 10
Тема:«Кислородосодержащие органические соединения и их нахождение в природе»
Тема урока: «Сложные эфиры»
Описание разработки.
Слайды презентации, выполненные в Power Point, обосновывается актуальностью данной темы и её связью с жизнью, так как изучение химических свойств сложных эфиров, реакций этерификации и гидролиза эфиров принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике.
Тип урока: Урок – вводный, объяснение нового материала сочетние фронтального, парного и индивидуального вида работы учащихся.
Тема урока сформулирована в соответствии с программой О.С. Габриеляна «Химии 10 класса» (базовый уровень),
Тема рассчитана на один урок.
Ожидаемые результаты обучения:
В результате изучения данной темы учащиеся должны уметь:
— классифицировать сложные эфиры, разбираться в механизме реакций этерификации и гидролиза эфиров, знать практическое значение эфиров
-знать понятия «Сложные эфиры и жиры. Сложные эфиры как продукты взаимодействия кислот со спиртами. Значение сложных эфиров в природе и жизни человека.
Сложные эфиры как продукты взаимодействия кислот со спиртами. Значение сложных эфиров в природе и жизни человека.
Цели урока:
1.Образовательные: Помочь сформировать знания обучающихся о строении сложных эфиров.
Содействовать пробуждению интереса учащихся к познанию мира, его химических закономерностей.
Актуализировать понятия «реакции этерификации» и «гидролиз эфиров», «изомерия сложных эфиров», «номенклатура эфиров»
Помочь в определение понятий «получении сложных эфиров»,
«полиэфиры на примере лавсана», «гидролиз сложных эфиров как важнейшее химическое свойство», сложные эфиры в природе и промышленности»
Направить усилия обучающихся формировании взаимосвязи строения физических, химических свойств сложных эфиров.
2. Развивающие: (формирование и развитие образовательных компетенций):
а) учебно-познавательных: умение самостоятельно и мотивированно организовывать свою познавательную деятельность (от постановки цели до получения оценки результата). Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей. Определение сущностных характеристик изучаемого объекта; самостоятельный выбор критериев для сравнения, сопоставления, оценки и классификации объектов
Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей. Определение сущностных характеристик изучаемого объекта; самостоятельный выбор критериев для сравнения, сопоставления, оценки и классификации объектов
Участие в проектной деятельности, в организации и проведении учебно- исследовательской работы: выдвижение гипотез, осуществление- их проверки, владение приемами исследовательской деятельное , элементарными умениями прогноза. Самостоятельное создание алгоритмов познавательной деятельности .Формулирование полученных результатов.
б) информационно-коммуникативных: Поиск нужной информации по заданной теме в источниках различного типа. Извлечение необходимой информации из источников,
в различных знаковых системах (текст, таблица, график, диаграмма, аудиовизуальный ряд и др.), отделение основной информации от второстепенной, критическое оценивание достоверности полученной информации, передача содержания информации адекватно поставленной цели (сжато, полно, выборочно).
Умение развернуто обосновывать суждения, давать определения, приводить доказательства.Объяснение изученных положений на самостоятельно подобранных конкретных примерах.
Владение основными видами публичных выступлений (высказывание, монолог, дискуссия, полемика)
в)рефлексивных : Понимание ценности образования как средства развития культуры личности. Объективное оценивание своих учебных достижений, поведения, черт своей личности; учет мнения других людей при определении собственной позиции и самооценке. Владение навыками организации и участия в коллективной деятельности: постановка общей цели и определение средств ее достижения, конструктивное восприятие иных мнений и идей, учет индивидуальности партнеров по деятельности, объективное определение своего вклада в общий результат.
Оценивание и корректировка своего поведения в окружающей среде, выполнение в практической деятельности и в повседневной жизни экологических требований.
Осуществлений осознанного выбора путей продолжения образования или будущей профессиональной деятельности.
2.Воспитывающие:Воспитывать сознательное отношение к учебному труду, чувство ответственности, развивать интерес к знаниям. Воспитывать бережное отношение к своему здоровью.
4. Здоровьесберегающие: закрепить навыки безопасного обращения с реактивами.
Планируемые результаты обучения
В результате изучения данного материала учащиеся должны:
Знать:
а) определение понятий – сложные эфиры и жиры. Сложные эфиры как продукты взаимодействия кислот со спиртами. Значение сложных эфиров в природе и жизни человека.
б) знать механизм реакций этерификации и гидролиза сложных эфиров.
Уметь: (владеть способами познавательной деятельности):
Объяснять механизм этерификации. Различать группы сложных эфиров, уметь давать названия сложным эфирам. Прогнозировать по строению веществ принадлежности к классу химических соединений.
Тип урока: вводный.
Вид урока: урок- с применением ИКТ.
Оборудование и реактивы:
1.Персональный компьютер, медиапроектор.
2.Компьютерная презентация по теме «Сложные эфиры»
3.Дифференцированный раздаточный материал для групповой работы.
4.Учебник О.С. Габриеляна «Химии 10 класса»9базовый уровень), учебные тексты и схемы по теме.
5.Реактивы:(этиловый спирт, уксусная, концентрированная серная кислота, штативы для пробирок, пробирки с пробками, спиртовки, пробиркодержатели).
Дополнительная выставка парфюмерной продукции: мыло разных видов, духи и одеколоны, лосьоны, лаки, элексиры, живые цветы (герань, гвоздика, роза, фиалки), свежие фрукты: лимон, апельсин, мандарин, пихтовое и эфкалиптовое масла.
Хронокарта урока:
Организационный момент -1мин.
Актуализация знаний – 4 мин.
Новый материал-30 мин.
Первичное закрепление знаний-7 мин.
Домашнее задание, подведение итогов работы-2 мин.
Рефлексия- 1мин.
Автор: учитель химии первой квалификационной категории Коваленко Марина Витальевна, стаж педагогической деятельности 17 лет
МКОУ «Никольская СОШ»Солнцевского района Курской области
Предмет химия.
Методическая разработка урока с использованием информационно-коммуникационных технологий.
Класс 10
Тема:«Кислородосодержащие органические соединения и их нахождение в природе»
Тема урока: «Сложные эфиры»
Описание разработки.
Слайды презентации, выполненные в Power Point, обосновывается актуальностью данной темы и её связью с жизнью, так как изучение химических свойств сложных эфиров, реакций этерификации и гидролиза эфиров принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике.
Тип урока: Урок – вводный, объяснение нового материала сочетние фронтального, парного и индивидуального вида работы учащихся.
Тема урока сформулирована в соответствии с программой О.С. Габриеляна «Химии 10 класса» (базовый уровень),
Тема рассчитана на один урок.
Ожидаемые результаты обучения:
В результате изучения данной темы учащиеся должны уметь:
— классифицировать сложные эфиры, разбираться в механизме реакций этерификации и гидролиза эфиров, знать практическое значение эфиров
-знать понятия «Сложные эфиры и жиры. Сложные эфиры как продукты взаимодействия кислот со спиртами. Значение сложных эфиров в природе и жизни человека.
Цели урока:
1.Образовательные: Помочь сформировать знания обучающихся о строении сложных эфиров.
Содействовать пробуждению интереса учащихся к познанию мира, его химических закономерностей.
Актуализировать понятия «реакции этерификации» и «гидролиз эфиров», «изомерия сложных эфиров», «номенклатура эфиров»
Помочь в определение понятий «получении сложных эфиров»,
«полиэфиры на примере лавсана», «гидролиз сложных эфиров как важнейшее химическое свойство», сложные эфиры в природе и промышленности»
Направить усилия обучающихся формировании взаимосвязи строения физических, химических свойств сложных эфиров.
2. Развивающие: (формирование и развитие образовательных компетенций):
а) учебно-познавательных: умение самостоятельно и мотивированно организовывать свою познавательную деятельность (от постановки цели до получения оценки результата). Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей. Определение сущностных характеристик изучаемого объекта; самостоятельный выбор критериев для сравнения, сопоставления, оценки и классификации объектов
Участие в проектной деятельности, в организации и проведении учебно- исследовательской работы: выдвижение гипотез, осуществление- их проверки, владение приемами исследовательской деятельное , элементарными умениями прогноза. Самостоятельное создание алгоритмов познавательной деятельности .Формулирование полученных результатов.
б) информационно-коммуникативных: Поиск нужной информации по заданной теме в источниках различного типа. Извлечение необходимой информации из источников,
Извлечение необходимой информации из источников,
в различных знаковых системах (текст, таблица, график, диаграмма, аудиовизуальный ряд и др.), отделение основной информации от второстепенной, критическое оценивание достоверности полученной информации, передача содержания информации адекватно поставленной цели (сжато, полно, выборочно).
Умение развернуто обосновывать суждения, давать определения, приводить доказательства.Объяснение изученных положений на самостоятельно подобранных конкретных примерах.
Владение основными видами публичных выступлений (высказывание, монолог, дискуссия, полемика)
в)рефлексивных : Понимание ценности образования как средства развития культуры личности. Объективное оценивание своих учебных достижений, поведения, черт своей личности; учет мнения других людей при определении собственной позиции и самооценке. Владение навыками организации и участия в коллективной деятельности: постановка общей цели и определение средств ее достижения, конструктивное восприятие иных мнений и идей, учет индивидуальности партнеров по деятельности, объективное определение своего вклада в общий результат.
Оценивание и корректировка своего поведения в окружающей среде, выполнение в практической деятельности и в повседневной жизни экологических требований.
Осуществлений осознанного выбора путей продолжения образования или будущей профессиональной деятельности.
2.Воспитывающие:Воспитывать сознательное отношение к учебному труду, чувство ответственности, развивать интерес к знаниям. Воспитывать бережное отношение к своему здоровью.
4. Здоровьесберегающие: закрепить навыки безопасного обращения с реактивами.
Планируемые результаты обучения
В результате изучения данного материала учащиеся должны:
Знать:
а) определение понятий – сложные эфиры и жиры. Сложные эфиры как продукты взаимодействия кислот со спиртами. Значение сложных эфиров в природе и жизни человека.
б) знать механизм реакций этерификации и гидролиза сложных эфиров.
Уметь: (владеть способами познавательной деятельности):
Объяснять механизм этерификации. Различать группы сложных эфиров, уметь давать названия сложным эфирам. Прогнозировать по строению веществ принадлежности к классу химических соединений.
Тип урока: вводный.
Вид урока: урок- с применением ИКТ.
Оборудование и реактивы:
1.Персональный компьютер, медиапроектор.
2.Компьютерная презентация по теме «Сложные эфиры»
3.Дифференцированный раздаточный материал для групповой работы.
4.Учебник О.С. Габриеляна «Химии 10 класса»9базовый уровень), учебные тексты и схемы по теме.
5.Реактивы:(этиловый спирт, уксусная, концентрированная серная кислота, штативы для пробирок, пробирки с пробками, спиртовки, пробиркодержатели).
Дополнительная выставка парфюмерной продукции: мыло разных видов, духи и одеколоны, лосьоны, лаки, элексиры, живые цветы (герань, гвоздика, роза, фиалки), свежие фрукты: лимон, апельсин, мандарин, пихтовое и эфкалиптовое масла.
Хронокарта урока:
Организационный момент -1мин.
Актуализация знаний – 4 мин.
Новый материал-30 мин.
Первичное закрепление знаний-7 мин.
Домашнее задание, подведение итогов работы-2 мин.
Рефлексия- 1мин.
“Мыслящий ум не чувствует себе счастливым, пока ему не удастся связать воедино разрозненные факты, им наблюдаемые”.
I. Организационный момент.
II. Актуализация знаний.
— Какие вещества относятся к одноатомным спиртам?
Названия пяти первых представителей гомологического ряда спиртов: (метанол, этанол, пропанол, бутанол, пентанол).
Одновременно на слайде высвечиваются формулы данных спиртов.
— Какова общая формула спиртов? СnН2n+1ОН или R – ОН.
— Какие вещества относятся к классу “Карбоновые кислоты”?
Названия первых пяти представителей гомологического ряда кислот: (метановая, этановая или уксусная, пропановая, бутановая или масляная, пентановая или валериановая).
СH3-COOH
CH3-COOH
CH3-CH2-COOH
CH3-CH2-CH2-COOH
Какова общая формула кислот? СnН2n+1COОН или R – COОН.
Ароматические вещества в пробирках.
Тема урока?
III.Новый материал
Сложные эфиры – продукт совместной дегидратации молекулы спирта и молекулы кислоты .
Эфир- в греческой мифологии верхний, лучезарный слой воздуха.
Сложным эфирам можно дать и другое определение.
Сложные эфиры – функциональные производные карбоновых кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR)
Общая формула реакции этерификации (от латинского слова aether – эфир.
На карбоновую кислоту действовали спиртом, который вместо обычного атома кислорода содержал тяжёлый изотоп.
После проведения реакции тяжёлый изотоп кислорода был обнаружен в сложном эфире. Значит, что при реакции этерификации от молекулы спирта отделяется не гидроксильная группа, а только атом водорода, гидроксильная группа отделяется от молекулы кислоты.
Появляется общая формула сложных эфиров:
RCOOR. Систематическое название эфирам даётся по названию радикала R и кислотного остатка – алкилалканат.
Работа по группам.
1 группа. Номенклатура сложных эфиров.
Самое длинное название также состоит из четырех слов. Самые короткие (в одно слово) предполагают называть сложные эфиры аналогично солям карбоновых кислот. У нас уже есть формула вещества. Давайте попробуем дать все названия: принцип построения названий сложных эфиров:
СН3СООСH3
1. по названию спирта + тривиальное (историческое название кислоты) –метиловый эфир уксусной кислоты;
2. название углеводородного радикала спирта + название аниона кислоты + окончание -ат (все пишется слитно) – метилацетат;
3. тривиальное название кислоты + название радикала от спирта + слово эфир – уксуснометиловый эфир;
тривиальное название кислоты + название радикала от спирта + слово эфир – уксуснометиловый эфир;
4. название радикала по спирту + систематическое (IUPAK) название кислоты + окончание –оат — метилэтаноат
Составить формулу и название сложного эфира, образованного следующими веществами в результате реакции этерификации.
Алгоритм:
1.Записать уравнение реакции между данными веществами;
2. Определить спирт и кислоту.
3. Дать название полученному эфиру по любой из классификаций (не менее 2х)
4.Составьте формулы и названия сложных эфиров, образованных следующими веществами (по вашему выбору )
Ответ обучающихся:
2 группа. История открытия эфиров.
В 1759 г. де Лаурагваис перегнал «крепкую уксусную кислоту с винным спиртом» и получил некоторое количество житкости, запах которой отличался от запаха исходных веществ. Это был уксусноэтиловый эфир, класс сложных эфиров:
CH3-COOH+C2H5OH↔CH3COOC2H5+H2 О
Термин «эфир»впервые применил к синтезированному веществу в 1782 г. Карл Шееле.
Карл Шееле.
На рисунке – портрет Бертло в королевской короне, рядом прибор, в котором проводится большинство органических синтезов, в том числе синтез сложных эфиров. Прибор состоит из круглодонной колбы (для равномерного подогрева) с боковым отводом (это колба Вюрца, в ней протекает синтез), водяного холодильника Либиха, где конденсируются продукты реакции, и аллонжа, направляющего конденсат в колбу-приемник. Великому химику Бертло был дан еще редкий дар – дар большой любви. Бертло очень любил свою жену, испытывал потребность видеть ее постоянно. В его лаборатории была отгорожена стеклом кабинка, где мадам Бертло читала, вязала, пока ее муж занимался синтезами. Он всегда мог подойти к ней, поговорить, подержать за руку, и это общение вдохновляло «короля органического синтеза» на новые подвиги во благо науки.
Судьба супругов Бертло соответствует словам Александра Грина: «Они жили счастливо и умерли в один день». Действительно, Бертло не смог пережить утраты жены: она умерла утром, он – вечером. Похоронили их в одной могиле в соборе Парижской богоматери, где хоронят самых выдающихся граждан Франции.
Похоронили их в одной могиле в соборе Парижской богоматери, где хоронят самых выдающихся граждан Франции.
Одним из величайших достижений химика Бертло был синтез жиров – веществ, характерных для живых организмов, т.е. органических веществ в прямом смысле этого слова. Синтезировав жиры, Бертло нанес сокрушительный удар по теории витализма – божественного происхождения органических веществ.
3 группа. Синтез эфиров.
Вашей группе предстоит синтезировать этиловый эфир уксусной кислоты. Один из обучающихся (или двое) собирают прибор, как показано на рисунке.
Другой обучающийся составляет уравнение реакции образования сложного эфира с указанием условий смещения химического равновесия в сторону прямой реакции (Т кипения эфира 770 С)
Расскажите ребятам в классе, как вы выполняли практическое задание, соблюдая технику безопасности. Осторожно! Эфир легковоспламеняемая (ЛВЖ) жидкость.
Опишите миниопыт синтеза сложного эфира. Чтобы получить сложные эфиры в малых количествах, используем простой прибор. В широкую пробирку вставим узкую пробирку таким образом, чтобы одна треть широкой пробирки в её нижней части оставалась незаполненной. Укрепим узкую пробирку с помощью кусочков резины, вырезанной из резиновой трубки и оставим зазор, чтобы исключить избыточное давление при нагревании. Теперь нальём в широкую пробирку 2 мл этанола и приблизительно столько же уксусной кислоты, тщательно охлаждённой в проточной воде, 5-10 капель концентрированной кислоты и несколько крупинок поваренной соли. Вставим внутреннюю пробирку с кусочками льда или снегом. Закрепим прибор в штативе и поставим подальше от себя. На самом малом огне будем кипятить смесь 10-15 минут (добавить «кипелки»!). Чем дольше нагревание, тем лучше выход. Внутренняя пробирка, заполненная водой, служит обратным холодильником. Уже до завершения опыта мы часто можем почувствовать приятный запах полученного сложного эфира, на который всё же накладывается едкий запах хлористого водорода.
Чтобы получить сложные эфиры в малых количествах, используем простой прибор. В широкую пробирку вставим узкую пробирку таким образом, чтобы одна треть широкой пробирки в её нижней части оставалась незаполненной. Укрепим узкую пробирку с помощью кусочков резины, вырезанной из резиновой трубки и оставим зазор, чтобы исключить избыточное давление при нагревании. Теперь нальём в широкую пробирку 2 мл этанола и приблизительно столько же уксусной кислоты, тщательно охлаждённой в проточной воде, 5-10 капель концентрированной кислоты и несколько крупинок поваренной соли. Вставим внутреннюю пробирку с кусочками льда или снегом. Закрепим прибор в штативе и поставим подальше от себя. На самом малом огне будем кипятить смесь 10-15 минут (добавить «кипелки»!). Чем дольше нагревание, тем лучше выход. Внутренняя пробирка, заполненная водой, служит обратным холодильником. Уже до завершения опыта мы часто можем почувствовать приятный запах полученного сложного эфира, на который всё же накладывается едкий запах хлористого водорода. После охлаждения реакционную смесь нейтрализуем разбавленным раствором соды и тогда мы можем обнаружить запах чистого эфира, а также заметить множество маленьких маслянистых капелек сложного эфира, которые плавают на поверхности водного раствора, в то время как непрореагировавшие исходные вещества большей частью содержатся в растворе или образуют кристаллический осадок.
После охлаждения реакционную смесь нейтрализуем разбавленным раствором соды и тогда мы можем обнаружить запах чистого эфира, а также заметить множество маленьких маслянистых капелек сложного эфира, которые плавают на поверхности водного раствора, в то время как непрореагировавшие исходные вещества большей частью содержатся в растворе или образуют кристаллический осадок.
4 группа. Физические свойства. Изомерия.
Какие виды изомерии характерны для сложных эфиров?
Изомерия углеродной цепи по кислотному остатку (начиная с бутановой кислоты) и по спиртовому остатку, начиная с пропанола. Пример. Этилбутирату изомерен этилизобутират, пропилацетату изомерен изопропилацетат.
Межклассовая изомерия. Например: метилацетату изомерна пропановая кислота.
Слайд
Физические свойства сложных эфиров:
Летучие, бесцветные жидкости
Плохо растворимы в воде
Чаще с приятным запахом
Легче воды
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов.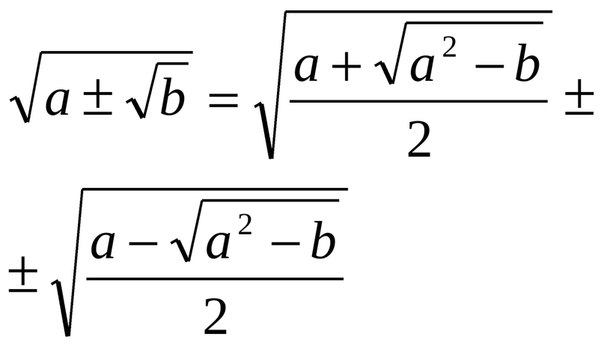 Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлены летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот.
Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлены летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот.
|
Аромат. Структурная формула. |
Название сложного эфира |
|
Яблоко
O ║ CH3 –CH2 – CH – C – O – C2H5 │ CH3 |
Этиловый эфир 2-метилбутановой кислоты
|
|
Вишня O ║ H – C – O – C5H11
|
Амиловый эфир муравьиной кислоты
|
|
Груша
|
Изоамиловый эфир уксусной кислоты
|
|
Ананас |
Этиловый эфир масляной кислоты (этилбутират) |
|
Банан
|
Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
|
Жасмин
O ║ CH3– C – O – СН2 – C6H5
|
Бензиловый эфир уксусной (бензилацетат)
|
5 группа. Химические свойства.
Химические свойства.
Химические свойства сложных эфиров.
Это достаточно химически инертные вещества.
1.Они хорошо горят, образуя углекислый газ и воду.
Составьте уравнение реакции горения метилформиата.
НСООСН3 + 2 О2 → 2 СО2 + 2 Н2О
2. Подвергаются гидролизу.
Гидролиз – реакция, обратная этерификации, в нейтральной среде он протекает медленно и заметно ускоряется в присутствии кислот или оснований, т.к. ионы Н+и ОН–катализируют этот процесс.
СН3COOC2H5 + H2O → СН3COOH + HOC2H5
СН3COOC2H5 + NaOH → СН3COONa+ HOC2H5
Гидролиз в присутствии щелочей называется омылением. Название связано с тем, что высшие карбоновые кислоты (С15–19) в виде солей щелочных металлов представляют собой мыло.
Составьте в тетрадях уравнения гидролиза:
пентилформиата – водой,
этилбутирата – водой,
пропилформиата – гидроксидом калия,
метилбутирата – гидроксидом лития,
изопропилацетата – гидроксидом натрия.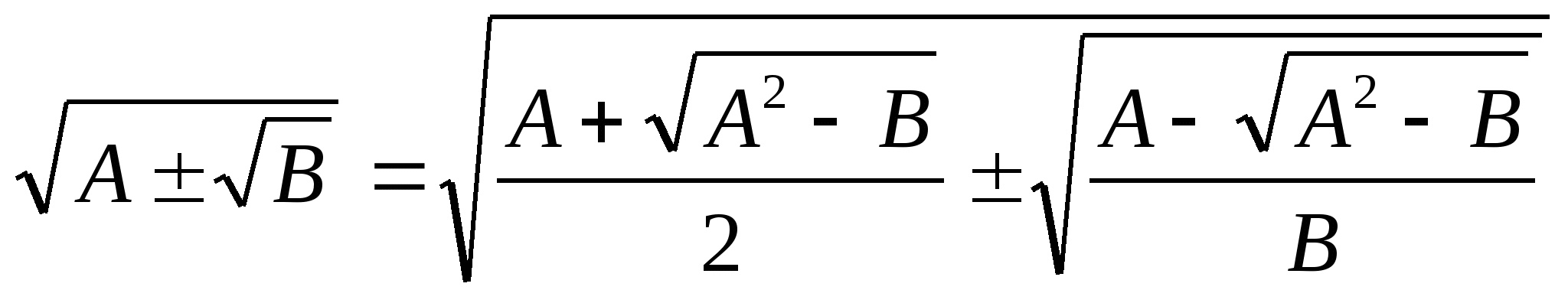
Сложные эфиры карбоновых кислот можно разделить на группы.
1.Когда число атомов С в исходной карбоновой кислоте и спирте не превышает 6–8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости – эфирные масла, чаще всего с фруктовым запахом. (Слайд).
2.Если в образовании сложного эфира участвует ароматический спирт (содержащий бензольное кольцо), то такие соединения обладают, как правило, не фруктовым, а цветочным запахом. Все соединения этой группы практически нерастворимы в воде, но легко растворимы в большинстве органических растворителей. Интересны эти соединения широким спектром приятных ароматов (табл. 1, Слайд 9), некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
|
Табл. 1. НЕКОТОРЫЕ СЛОЖНЫЕ ЭФИРЫ, обладающие фруктовым или цветочным ароматом (фрагменты исходных спиртов в формуле соединения и в названии выделены жирным шрифтом) |
||
|
Формула сложного эфира |
Название |
Аромат |
|
СН3СООС4Н9 |
Бутилацетат |
грушевый |
|
С3Н7СООСН3 |
Метиловый эфир масляной кислоты |
яблочный |
|
С3Н7СООС2Н5 |
Этиловый эфир масляной кислоты |
ананасовый |
|
С4Н9СООС2Н5 |
Этиловый эфир изовалериановой кислоты |
малиновый |
|
С4Н9СООС5Н11 |
Изоамиловый эфир изовалериановой кислоты |
банановый |
|
СН3СООСН2С6Н5 |
Бензилацетат |
жасминовый |
|
С6Н5СООСН2С6Н5 |
Бензилбензоат |
цветочный |
3. При увеличении размеров органических групп, входящих в состав сложных эфиров, до С15–30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками. Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.4. Третья группа – жиры.
При увеличении размеров органических групп, входящих в состав сложных эфиров, до С15–30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками. Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.4. Третья группа – жиры.
Опережающее обучение.
1.Способность различать запахи называют обонянием. В носу у человека около 50 млн. рецепторов обонятельного эпителия (у собаки – свыше 200млн), представляющих собой оголенные нервные окончания. Это свидетельствует о том, что обоняние – это одно из самых древних и примитивных чувств. Ощущение запаха возникает только при вдохе (надо нюхать). Ученые предполагают, что молекула пахнущего вещества приближается к рецептору и “укладывается” в особую шель, которая имеет форму, соответствующую форме данной молекулы (принцип ключа и замка), т.е. молекулы веществ, имеющих запах одного типа, должны иметь сходное пространственное строение.
На основе этой теории предложена классификация запахов: гнилостный, острый, эфирный, мятный, цветочный, мускусный, камфорный. Молярная масса душистых веществ, как правило, не превышает 300г/моль. Запах более выражен у тех веществ, молекулы которых имеют разветвленный углеродный скелет. Приятный запах присущ соединениям, молекулы которых содержат более 6 атомов углерода в цепи. На силу и характер запахов влияют различные виды изомерии. Иногда запах зависит от концентрации вещества.
2. Значение и влияние запахов для человека.
Наш организм не безразличен к запахам. Если воздух загрязнен дымом, плохо пахнет, мозг подает сигнал тревоги, носовая щель сужается, и в легкие поступает меньше воздуха. Аромат цветов, леса, моря вдыхать приятно, мы чувствуем, как легко дышится, когда воздух приятно пахнет.
Неприятный запах испорченной пищи предупреждает нас: “Не бери в рот! Опасно!” О пожаре предупреждает запах дыма.
Одежда впитывает запахи табачного дыма, пищи, духов; часто по запаху одежды можно определить профессию человека.
У курящих острота обоняния ниже, чем у некурящих. Огорчение и волнение притупляет обоняние. Во влажном воздухе запах ощущается
К запахам можно привыкнуть. Неумеренные дозы и слишком продолжительное воздействие неприятных запахов могут безвозвратно лишить человека обоняния.
Химическое соединение, запах которого человек может обнаружить, при наименьшей концентрации вещества в воздухе — ванилин. Достаточно 2.10-11 г ванилина на 1 л воздуха, чтобы мы почувствовали его присутствие.
Люди способны выделять не только притягивающие ароматические вещества (антрактанты), но и отталкивающие (репелленты).
Антрактанты чаще выделяются тогда, когда человек находится в хорошем состоянии, репелленты – во время депрессии, стрессов, ссор, когда человек ощущает страх и дискомфорт. По-видимому, существует запах страха, об этом писал А. Вознесенский :
Когда человек боится, выделяется адреналин,
Это знают собаки и с лаем бегут за ним.
Науку о лечении запахами называют ароматерапией. замечено, что запахи мирта, лимона, мяты оказывают тонизирующее действие на нервную систему, ароматы розы, жасмина, лаванды – успокаивающее. Запахи пиридина и толуола повышают остроту ночного зрения, а запахи бензола и гераниола – остроту слуха.
3.Значение запахов для животных.
Животные используют обоняние для поисков пищи, запах для них – средство коммуникации, взаимодействия полов.
Акула способна за 1 км почуять в воде запах капли крови. Лосось находит место своего рождения по запаху за сотни километров.
Собака-ищейка различает до 500 тыс. запахов, может обнаружить масляную кислоту в воздухе при ее содержании 10-18 г/см3.
Моль чует запах за 10-11 км. комаров привлекает запах молочной кислоты, содержащейся в поте человека.
Сильный запах сложных эфиров очень мудро используют пчелы. Ужалив жертву, они вместе с ядом впрыскивают в ранку смесь сложных эфиров, характерный запах которой и побуждает других пчел устремиться к месту укуса.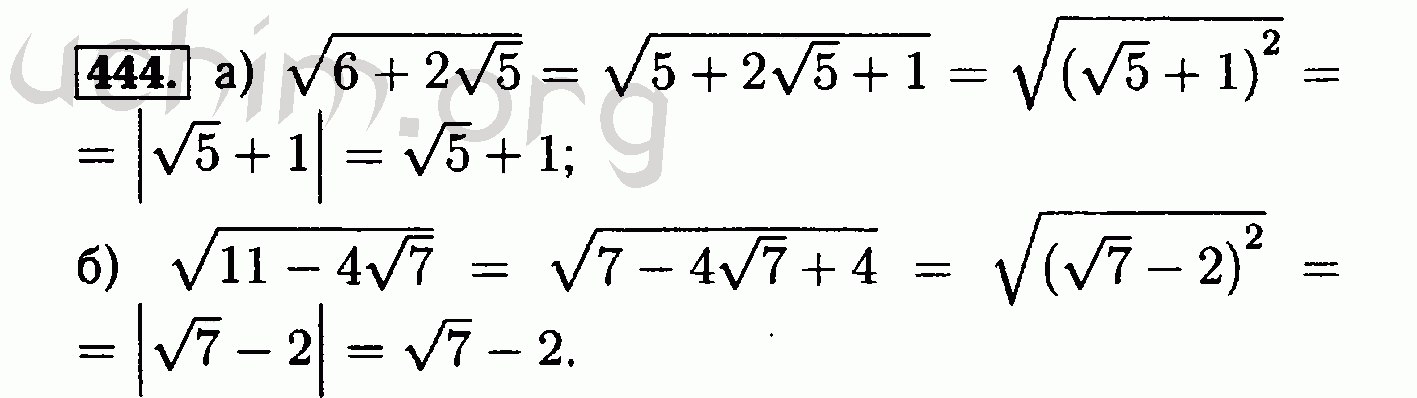
Некоторые виды клопов и муравьев для предупреждения соплеменников об опасности выделяют гексаналь.
Самки обезьян для привлечения самцов выделяют уксусную и пропионовую кислоты.
В Бразилии обитают бабочки, которые издают сильный и приятный запах, поэтому их специально держат дома для ароматизации воздуха.
4.Свойства полиэтилентерефталата.
Термопластичный полимер. Из него в промышленности получают синтетическое волокно «Лавсан».
Образец ткани полиэфирного волокна.
Лавсановую ткань сочетают с хлопком, льном, шерстью. Такие ткани почти не выгорают, стойки к истиранию, их почти не нужно гладить. Но их нельзя гладить горячим утюгом. Полиэтилентерефталат термически не устойчив.
Пластиковые бутылки так же изготовляют из полиэтилентерефталата. маркировка ПЭТ (РЭТ).
Вспомните реакцию гидролиза. Можно ли в пластиковых бутылках хранить щёлочь, вещества щелочной среды? НЕТ
Аспирин. Ацетилсалициловая кислота.
Ацетилсалициловая кислота.
Эфир салициловой кислоты с уксусным ангидридом.
Синтез органического стекла. Метиловый эфир метакриловой кислоты легко полимеризуется с образованием ценного полимера- органического стекла, из которого изготовляют колпаки реактивных самолётов и пуленепробиваемое стекло «триплекс». «Триплекс» состоит из нескольких пластин органического стекла, склеенных слоями прозрачной пластмассы. Он выдерживает удары пуль даже на малых расстояниях
VI.Первичное закрепление знаний.
Дифференцированные задания:
Работа оп парам.
Вещество С3Н6О2 – бесцветная жидкость, не взаимодействующая с натрием. Составьте его структурную формулу. Как изменится ответ, если в условии будет сказано, что вещество способно взаимодействовать с натрием? (2-3 минуты на обсуждение задания в парах, потом проверяем у доски)
Предполагаемый ответ обучающихся: Это вещество — сложный эфир.
Возможные структурные формулы: НСООС2Н5 или СН3СООСН3.
Изомерны сложным веществам — карбоновые кислоты. Они, в отличие от эфиров, взаимодействуют с активными металлами.
Вещество с формулой С3Н6О2, взаимодействующее с натрием — это пропионовая кислота: С2Н5СООН
Решение расчётной задачи.
Вычислите максимально возможный выход этил-ацетата, если для реакции было взято 40г.кислоты и 20г.спирта.
Ответ: 38г.
Выполнение тестового задания.
1.Сложные эфиры образуются в результате реакции:
1 – гидратации
2 – гидролиза
3 – этерификации
2.Реакция этерификации – это реакция
1 – гидролиза
2 – дегидратации
3 – присоединения
3.При гидролизе метилпропионата образуется:
1 – метанол и пропановая кислота
2 – пропанол и метановая кислота
3 – метанол и уксусная кислота
4. Продукт взаимодействия этанола с уксусной кислотой относится к:
Продукт взаимодействия этанола с уксусной кислотой относится к:
1 – эфирам фруктовым
2 – воскам
3 – жирам
5.Вещества, каких классов могут быть изомерны между собой:
1 – спирты и альдегиды
2 – кислоты и соли
3 – сложные эфиры и кислоты
Сегодня на уроке мы познакомились с ещё одним классом кислородсодержащих соединений – сложными эфирами. Сложными эфирами называют соединения, в которых присутствует сложно – эфирная групп и общая формула эфиров.
Сложными эфирами также называют продукты взаимодействия одноатомных и многоатомных спиртов с сильными минеральными кислотами.
Основным методом получения сложных эфиров является реакция спирта с карбоновой или раствором сильной минеральной кислоты. Рассмотрели взаимное влияние атомов в молекулах спирта и кислоты и возможность протекания данной реакции.
Основным химическим свойством сложных эфиров является их гидролиз. Гидролиз может катализироваться кислотой или основанием.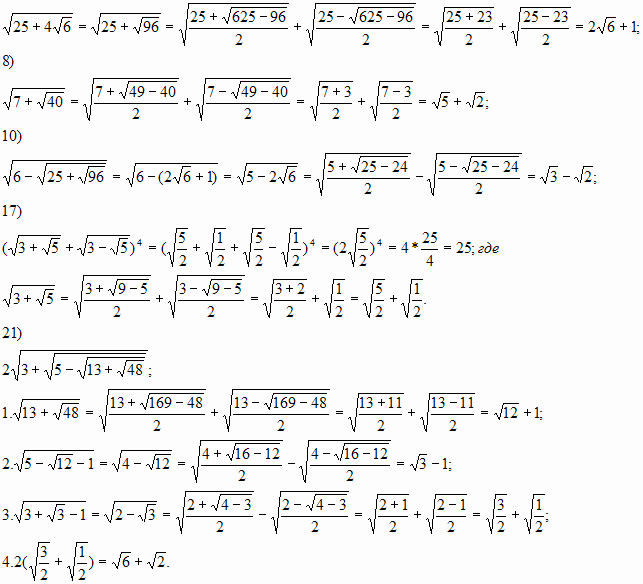
Сложные эфиры имеют широкое применение в промышленности. Из них производят пластмассы и искусственные волокна, растворители для различных красок и лаков, основы для клея, синтетические моющие средства. В пищевой промышленности их используют в качестве ароматизаторов, и, конечно, в парфюмерии.
VII.Домашнее задание
VIII. Рефлексия: Ответить на вопросы.
Управляют целым миром.
В барбариске и ириске,
В мармеладке, в шоколадке,
В лепестках сирени майской –
Всюду их незримый след.
Ароматами жасмина,
“Пепси-колы”, апельсина,
Несравненной розы алой
Они пленяют белый свет.
Чашка кофе по утрам и
И от насморка бальзам,
Сливки с капельками жира –
Это сложные эфиры.
Если спирт и кислота
Участвуют в реакции –
Получаются эфиры
Путем этерификации.
Муравьиная радикал — Справочник химика 21
Префиксом группы —СНО является формил- , который в то же время служит и названием ацильного радикала муравьиной кислоты. [c.140]
[c.140] Путь, по которому авторы провели подобное доказательство предложенной ими схемы окисления пропилена, был следующий. Обработкой экспериментальных данных при помощи схемы была установлена истинная кинетика образования промежуточных продуктов — формальдегида и ацетальдегида,— т. е. кинетика пх образования, не искаженная дальнейшим окислением. Разность между рассчитанными из схемы такими истинно образовавшимися количествами альдегидов и аналитически найденными давала количество альдегидов, подвергшихся окислению. По принятым в схеме суммарным уравнениям окисления альдегидов рассчитывалась далее сумма количеств СО и СОа, получающихся этим путем. Кроме того, количество СО, получающейся по реакции 6, определялось как разность между количествами формальдегида, полученного распадом радикала СН2(00)СН0, и аналитически определенным количеством муравьиной кислоты. Таким образом, пользуясь своей схемой, авторы смогли рассчитать все количество СО СО2, которое должно образоваться к каждому моменту реакции. Эти данные затем сравнивались с аналитически определенными количествами СО -I- СО2. [c.392]
Эти данные затем сравнивались с аналитически определенными количествами СО -I- СО2. [c.392]
Образующийся гидрат альдегида представляет собой не что иное, как двухатомный спирт с двумя гидроксилами при одном углероде. Но мы уже знаем, что такие спирты неустойчивы образуясь при реакциях, они выделяют воду и превращаются в соединения с карбонильной группой (стр. 120). Поэтому гидраты альдегидов существуют, за редким исключением, лишь в водном растворе. Приведенная реакция обратима, причем в зависимости от характера связанного с альдегидной группой радикала равновесие смещено в ту или иную сторону. Например, для раствора муравьиного альдегида оно почти полностью смещено вправо. Раствор уксусного альдегида тоже содержит значительное количество гидрата, а в случае высших альдегидов равновесие сильно смещено влево . [c.140]
В то же время способность карбоновых кислот к диссоциации зависит и от влияния связанного с карбоксилом углеводородного радикала. В табл. 13 приведены константы диссоциации карбоновых кислот самой сильной одноосновной карбоновой кислотой является муравьиная, в которой карбоксил не связан с радикалом. Кислоты, содержащие в соединении с карбоксилом предельные углеводородные радикалы, значительно слабее муравьиной кислоты. [c.156]
В табл. 13 приведены константы диссоциации карбоновых кислот самой сильной одноосновной карбоновой кислотой является муравьиная, в которой карбоксил не связан с радикалом. Кислоты, содержащие в соединении с карбоксилом предельные углеводородные радикалы, значительно слабее муравьиной кислоты. [c.156]
Степень диссоциации органических кислот зависит от развития цепи и сложности строения радикала. В ряду метана самой сильной кислотой является муравьиная кислота Н—СООН, затем уксусная, а более высокомолекулярные являются весьма слабыми электролитами. Значительно увеличивает степень диссоциации введение атомов галогенов в состав радикала (см. с. 449). Влияние строения радикала и наличия замещенных атомов на константы диссоциации органических кислот показано в табл. 14.2. [c.461]
Общая формула сложных эфиров н с—О—R, где К и К —углеводородные радикалы. Сложные эфиры можно рассматривать как производные кислот, у которых водород в гидроксиле замещен на радикал. Однако в сложных эфирах муравьиной кислоты вместо радикала К стоит атом водорода. [c.329]
Однако в сложных эфирах муравьиной кислоты вместо радикала К стоит атом водорода. [c.329]
Кислотный радикал муравьиной кислоты Н—СО— называется формилом-, радикал уксусной кислоты СНа—СО— ацетилом-, радикал пропионовой кислоты —СО— пропионилом-, радикал масляной кислоты С3Н,—СО— бутирилом и т. д. [c.269]
Правила ЮПАК, помимо заместительных, используют еще ряд названий, из которых надо отметить очень распространенные радикально-функциональные названия, образуемые из названия радикала и функционального класса или характеристической группы. Например СаНа— он этиловый спирт, СаН,—ЫНа пропиламин и т. д. Правила ЮПАК приводят также перечень целого ряда тривиальных названий, допускаемых к применению даже предпочтительнее соответствующих систематических названий. По рекомендации ЮПАК предпочтительнее называть не метановая кислота, а муравьиная, не этано-вая, а уксусная, не бутановая, а масляная и т. д. [c.37]
Мы видим, что наличие трех атомов хлора в молекуле хлоралгидрата значительно понижает прочность связи между радикалом и карбонильной группой.
 Так, при действии едкой щелочи на гидрат хлорала или, точнее, на хлорал, щелочь уже при обычной температуре отрывает карбонильную группу от галогензамещенного радикала. При этом образуется натриевая соль муравьиной кислоты и хлороформ (галогензамещенный углеводород—трихлорметан). Сравните эту реакцию с получением метана из уксуснокислого натрия (оп. 7). Ход реакции [c.43]
Так, при действии едкой щелочи на гидрат хлорала или, точнее, на хлорал, щелочь уже при обычной температуре отрывает карбонильную группу от галогензамещенного радикала. При этом образуется натриевая соль муравьиной кислоты и хлороформ (галогензамещенный углеводород—трихлорметан). Сравните эту реакцию с получением метана из уксуснокислого натрия (оп. 7). Ход реакции [c.43]Эти димеры разрушаются только при сильном разбавлении в растворах или при повышенных температурах. Кислоты могут образовывать водородные связи также и с растворителями, например с водой. Поэтому муравьиная, уксусная, пропионовая и я-масляная кислоты смешиваются с водой во всех отношениях. С возрастанием молекулярной массы растворимость кислот в воде падает, так как гидрофобные свойства углеводородного радикала начинают преобладать над гидрофильными свойствами карбоксильной группы. [c.390]
Скорость этерификации карбоновой кислоты тем выше, чем больше положительный заряд карбонильного углерода. Величина o-f-на углероде карбоксильной группы зависит от характера радикала кислоты. Электронодонорные группы, связанные с карбоксилом, понижают дробный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем препятствуют взаимодействию кислоты с нуклеофилом электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной. Поэтому кислоты типа трихлоруксусной, щавелевой, муравьиной быстро реагируют со спиртами даже без добавок минеральной кислоты-катализатора, а ароматические кислоты, особенно те, которые в ароматическом ядре содержат электронодонорные заместители, взаимодействуют со спиртом значительно труднее и требуют больших количеств катализатора. [c.207]
Величина o-f-на углероде карбоксильной группы зависит от характера радикала кислоты. Электронодонорные группы, связанные с карбоксилом, понижают дробный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем препятствуют взаимодействию кислоты с нуклеофилом электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной. Поэтому кислоты типа трихлоруксусной, щавелевой, муравьиной быстро реагируют со спиртами даже без добавок минеральной кислоты-катализатора, а ароматические кислоты, особенно те, которые в ароматическом ядре содержат электронодонорные заместители, взаимодействуют со спиртом значительно труднее и требуют больших количеств катализатора. [c.207]
При реакциях, ведущих к разложению изонитрилов, радикал остается связанным с азотом, между тем как атом углерода образует муравьиную кислоту или продукты ее превращения. [c.67]
Вследствие этого первые члены ряда карбоновых кислот димерны не только в жидком состоянии, но и в парах вблизи температуры кипения. По мере увеличения углеводородного радикала прочность димеров уменьшается. Как и в любых кислотах, негидроксильный (карбонильный) кислород в карбоксильной группе оттягивает на себя электронную плотность, увеличивая полярность связи О—и способствуя диссоциации (см. разд. 14.3), тем не менее за исключением муравьиной кислоты (К = 2,1 Ю ), которая считается электролитом средней силы, карбоновые кислоты относятся к слабым электролитам. [c.421]
По мере увеличения углеводородного радикала прочность димеров уменьшается. Как и в любых кислотах, негидроксильный (карбонильный) кислород в карбоксильной группе оттягивает на себя электронную плотность, увеличивая полярность связи О—и способствуя диссоциации (см. разд. 14.3), тем не менее за исключением муравьиной кислоты (К = 2,1 Ю ), которая считается электролитом средней силы, карбоновые кислоты относятся к слабым электролитам. [c.421]
При этом предполагается, что муравьиная кислота, двуокись углерода, вода и большая часть окиси углерода получаются в процессе окисления из радикала НСО. [c.262]
Сила кислот во многом определяется характером радикала, связанного с группой —СООН. Электроноакцепторные радикалы (такие, как ССЦ), оттягивающие электронную плотность от карбоксильной группы, увеличивают силу кислоты. Напротив, электроно-донорные радикалы (такие, как СНд), увеличивающие электронную плотность на карбоксильной группе, уменьшают силу кислоты. Муравьиная кислота НСООН — наименее слабая из предельных карбоновых кислот. [c.357]
Муравьиная кислота НСООН — наименее слабая из предельных карбоновых кислот. [c.357]
Препаративное значение имеют реакции между магний-органическими соединениями и ортоугольным, а также орто-муравьиным эфиром, протекающие с заменой алкоксигруппы на радикал магнийорганического соединения . [c.26]
Карбоновые кислоты алкилируются олефинами тем легче, чем более электроотрицательным является радикал, связанный с карбоксильной группой. В ряду жирных одноосновных кислот наиболее легко алкилируются олефинами муравьиная и уксусная кислоты, затем следует про- [c.315]
По приведенному механизму образования кислот из каждого гидропе-рекисного радикала образуется три молекулы кислоты, одна из которых муравьиная, уксусная или СОг. [c.174]
В этом случае активным окисляющим агентом является нейтральный радикал О—Н. Это процесс с короткими цепями. Окисляемое вещество сперва превращается в радикал, способный реагировать с молекулярной перекисью водорода. К этому типу относится окисление муравьиной кислоты, которое может быть изображено схемой [c.273]
К этому типу относится окисление муравьиной кислоты, которое может быть изображено схемой [c.273]
Карбоновые кислоты алкилируются олефинами тем легче, чем более электроотрицательным является радикал, связанный с кар- боксильной группой. В ряду жирных одноосновных кислот наи- более легко алкилируются олефинами муравьиная и уксусная-кислоты, затем следует иропионовая, масляная и изовалериапо-вая кислоты (рис. 2). Следовательно, способность карбоновых кислот присоединяться но месту двойной связи олефинов понижается с увеличением углеводородного остатка, связанного с карбоксильной группой. Двухосновные насыщенные жирные кислоты химически менее активны и труднее алкилируются, чем соответствующие им одноосновные кислоты, причем алкилирование их протекает тем труднее, чем большее число углеродных атомов разделяет две карбоксильные группы активность в их ряду понижается от щавелевой к янтарной кислоте. [c.16]
Все органические кислоты—слабыа электролиты.
 В ряду производных метана самая сильная метановая, или муравьиная, кислота НСООН. С увеличением числа атомов углерода степень диссоциации кислот уменьшается. Свойства кислэт зависят также от алкильного радикала и от взаимного влияния друг на друга карбоксильной группы и алкильного радикала. Рассмотрим наиболее характерные для карбоновых кислот реакции. Подобно минеральным кислотам, органические кислоты взаимодействуют с металлами, оксидами и гидроксидами металлов, образуя соли карбоновых кислот, например [c.264]
В ряду производных метана самая сильная метановая, или муравьиная, кислота НСООН. С увеличением числа атомов углерода степень диссоциации кислот уменьшается. Свойства кислэт зависят также от алкильного радикала и от взаимного влияния друг на друга карбоксильной группы и алкильного радикала. Рассмотрим наиболее характерные для карбоновых кислот реакции. Подобно минеральным кислотам, органические кислоты взаимодействуют с металлами, оксидами и гидроксидами металлов, образуя соли карбоновых кислот, например [c.264] По женевской номенклатуре названия альдегидов производят от женевских названий соответствующих по углеродному скелету углеводородов (стр. 48), добавляя к этим названиям окончание -ал-, если требуется, после него ставят цифру, указывающую номер углеродного атома цепи, входящего в состав альдегидной группы. При выборе в формуле самой длинной углеродной цепи в последнюю должен быть включен и альдегидный углерод. Нумерацию начинают с того конца, к которому ближе простейший боковой радикал. В соответствии с этим по женевской номенклатуре название муравьиного альдегида — метанал, уксусного — этанал, н-валерианового (I) — пентанал, изовалерианового (И) — 2-метилбутанал-4, а его изомера по положению альдегидной группы (П1) — 2-метилбутанал-1. [c.136]
В соответствии с этим по женевской номенклатуре название муравьиного альдегида — метанал, уксусного — этанал, н-валерианового (I) — пентанал, изовалерианового (И) — 2-метилбутанал-4, а его изомера по положению альдегидной группы (П1) — 2-метилбутанал-1. [c.136]
Женевская номенклатура. По женевской номенклатуре кислоты называют, образуя прилагательное из женевского названия, соответствующего по числу углеродных атомов и по строению углеводорода. Так, женевское название муравьиной кислоты— метановая кислота, уксусной — этановая кислота, пропионовой — пропановая кислота, масляной — бутановая кислота, изомасля-ной — 2-метилпропаноеая кислота и т. д. В названиях кислот, изомерных по положению карбоксильной группы, после окончания -овая ставится (через дефис) цифра — номер углеродного атома цепи, образующего карбоксильную группу. Нумерацию цепи начинают с того конца, к которому ближе боковой радикал. Например, две изомерные валериановые кислоты изостроения имеют следующие названия по женевской номенклатуре [c. 154]
154]
Как уже указано, муравьиная кислота в отличие от других кислот содержит в соединении с карбоксилом не углеводородньн радикал, а водород, и из ее формулы видно, что в ней имеется как [c.163]
Хлорамфеникол является оптически активным нейтральным соединением в его молекуле содержатся два неионогенных атома хлора, две гидроксильные группы, ацетилируемые уксусным ангидридом в присутствии пиридина, и ароматическая нитрогруппа, восстановление которой приводит к амину, способному диазотироваться и затем сочетаться с аминами и фенолами. При кислотном гидролизе образуется дихлоруксусная кислота и оптически активное основание gHi204Na, которое при нагревании с дихлор-уксуснонатриевой солью превращается в хлорамфеникол. Упомянутое основание реагирует с двумя молекулами перйодата калия, образуя п-нитро-бензальдегид, формальдегид, аммиак, а также муравьиную кислоту. Из этого следует, что основание gHj204N2 содержит и-нитрофенильный радикал и трехуглеродную цепь нормального строения, в которой аминогруппа может находиться только при среднем углеродном атоме, так как иначе и сам хлорамфеникол мог бы реагировать с йодной кислотой, [c. 700]
700]
Едкая щелочь при действии на иодал отщепляет карбонильную группу от радикаЛа (см. оп. 12), образуя с ней натриевую соль муравьиной кислоты, а атом водорода с галогензамещенным радикалом образует йодоформ [c.45]
Многое из выщеизложенного может стать понятным, если признать возможность образования метильного радикала при разложении г/зег-бутоксильного радикала. При проведении пиролиза ди-грег-бутилперекиси в присутствии кислорода многие из выделенных продуктов реакции — метанол, формальдегид, муравьиная кислота, окись и двуокись углерода — очевидно являются продуктами вторичных. реакций метильного радикала СНз. + Oj —у СНз-0-0. [c.262]
Префиксом группы —СНО является формил-, который в то же время служит и названием адильного радикала муравьиной кислоты. Когда альдегидная группа не является главной группой, то она назьшается в префиксе, как фуппа 0= -оксо, например —СН2СН2СН2СН=0 4-оксобутил (см. соединение (16), с. 368). [c.412]
368). [c.412]
Исследование состава продуктов жидкофазного окисления бутана хроматографическими методами показало, что наряду с основными продуктами реакции — уксусной кислотой, ме-тилэтилкетоном и этилацета-том — в реакционной смеси в небольших количествах присутствуют также ацетон, ацетальдегид, диацетил, бутилаце-тат, метилацетат, метиловый, этиловый и вторичный бутиловый спирты, муравьиная кислота и перекиси [26]. Кинетические кривые накопления продуктов окисления бутана в жидкой фазе приведены на рис. 13. Механизм образования этих продуктов определяется двумя направлениями реакции продолжения цепи. По реакции (2) образуются гидроперекись и продукты ее превраш,ения — метилэтилкетон, вторичный бутиловый спирт, диацетил, этилацетат и уксусная кислота. Продукты, содержавшие в своей молекуле меньше четырех атомов углерода, образуются по реакции (2 ) путем изомеризации и распада радикала ВОг- При этом для радикала СНзСНСНгСИз [c.388]
Интересно отметить, что при совместном проведении паров какого-либо спирта и сложного эфира вторичного спирта над окисью алюминия Происходит частичное замещение опиртоюго радикала эфира с образО ванием см-еси сложных эфиров 1 . Пары метило вого эфира муравьиной кислоты и изобутилового оп ирта [c.429]
Пары метило вого эфира муравьиной кислоты и изобутилового оп ирта [c.429]
«Преобразования двойных радикалов» (8 класс)
Цели урока:
Учебная:
1) Познакомить учащихся с понятием двойного радикала.
2) Научить преобразовывать двойные радикалы выделением полного квадрата подкоренного выражения и по формулам двойного радикала.
3) Развивать умения и навыки работы с квадратными корнями, выявить закономерности и обобщить учебный материал.
Развивающая:
1) Развитие внимания учащихся.
2) Развитие умения слушать товарища, доводить начатое дело до конца.
3) Развитие интереса к изучению алгебры и навыки самостоятельной и исследовательской работы.
Воспитывающая:
1) Воспитание чувства коллективизма.
2) Продолжить формирование чувства ответственности за результат работы.
Ход урока:
1 этап работы. Организационный момент.
2 этап работы. Устный счёт.
а) Найти два последовательных натуральных числа, между которыми заключено число:
б) Имеет ли смысл выражение:
в) Упростите выражение:
г) Выполни умножение:
Вводим понятие двойного радикала:
Выражения вида и называют двойными радикалами или сложными радикалами.
Преобразовать двойной радикал – это значит избавиться от внешнего радикала.
Обратим внимание, что во время устного счёта мы с вами уже преобразовывали двойные радикалы. Преобразование двойных радикалов произошло во время алгебраических действий с квадратными корнями.
Преобразовать выражение в тетради:
1)
На этом примере мы убедились, что мы уже умеем преобразовывать двойные радикалы в процессе выполнения алгебраических действий.
2) Вместо “?” поставить числа так, чтобы получилось верное равенство:
Преобразовать следующие выражения, используя формулы полного квадрата:
Вывод: Если подкоренное выражение представить в виде полного квадрата, то можно легко освободиться от внешнего радикала.
Работаем в тетрадях примерам 1;2;3;5 с листа контрольных заданий.
Последний пример пытаются выполнить и не получается.
В тех случаях, когда подкоренное выражение нелегко представить в виде полного квадрата, можно использовать готовые формулы:
При данных условиях каждое подкоренное выражение не отрицательно. Докажем справедливость одной из формул.
Возведём обе части первого равенства в квадрат. Имеем:(доказывает ученик):
Применяя данные формулы решить примеры 7;8;10;17; 21 с листа контрольных заданий.
7)
Вывод урока: преобразовать двойные радикалы можно
1) при вып-ии алгебраич-х действий в некот выражении, содержащем двойные радикалы.
2) приводя подкоренное выражение к полному квадрату;
3) по формулам сложного радикала.
Дома вы преобразуете двойные радикалы с контрольного листа разными способами.
Контрольные задания к уроку.
О теореме Абеля-Руффини без групп и теории Галуа / Хабр
Историческая справка
Поиск решения алгебраических уравнений оказал колоссальное влияние на развитие математики. Формула решения общего кубического уравнения впервые была получена итальянскими математиками 16-го века. Это событие ставшее первопричиной рассмотрения комплексных чисел, считается одним из поворотных моментов в истории математики. Судьбы Джероламо Кардано, Никколо Тартальи, Сципиона дель Ферро и их поисков решения кубического уравнения заслуживают отдельного романа со своими интригами, скандалами и расследованиями. Столь яркие истории достаточно редки в математике.
Формула решения общего кубического уравнения впервые была получена итальянскими математиками 16-го века. Это событие ставшее первопричиной рассмотрения комплексных чисел, считается одним из поворотных моментов в истории математики. Судьбы Джероламо Кардано, Никколо Тартальи, Сципиона дель Ферро и их поисков решения кубического уравнения заслуживают отдельного романа со своими интригами, скандалами и расследованиями. Столь яркие истории достаточно редки в математике.
Начиная с 19-го века поиск формул для решения уравнений произвольных степеней положил начало теории групп и абстрактной алгебре, которые преобразили практически все разделы современной математики. Думаю, многие, кто интересовался историей и развитием алгебры, знают, что формулы для решения общего алгебраического уравнения степени выше четвертой не существует. Как сообщается, первое доказательство этого факта было дано итальянским математиком Паоло Руффини в самом конце восемнадцатого века, оно составляло около 500 страниц и все же содержало некоторые пробелы. Хотя отдельные математики, как Огюстен Коши, и признавали данное доказательство, но ввиду столь большого объема и сложности изложения, оно так и не было принято математическим сообществом. Считается, что первое полное доказательство дано норвежским математиком Нильсом Абелем и содержалось в двух работах, изданных в 1824 и 1826 годах. С тех пор оно носит название теоремы Абеля или теоремы Абеля-Руффини.
Хотя отдельные математики, как Огюстен Коши, и признавали данное доказательство, но ввиду столь большого объема и сложности изложения, оно так и не было принято математическим сообществом. Считается, что первое полное доказательство дано норвежским математиком Нильсом Абелем и содержалось в двух работах, изданных в 1824 и 1826 годах. С тех пор оно носит название теоремы Абеля или теоремы Абеля-Руффини.
Если вы попытаетесь изучить это доказательство в его современном изложении, то окажется, что оно практически полность опирается на Теорию Галуа. Эварист Галуа был французским математиком 19-го века и современником Нильса Абеля. Помимо занятий математикой он вел активную политическую жизнь из-за чего несколько раз попадал в тюрьму. В возрасте всего двадцати лет был застрелен на дуэли, поводом для которой послужила любовная интрига, хотя есть предположения, что дуэль была подстроена его политическими противниками. Об этой истории написано достаточно много, кроме того, имеется перевод на русский язык его мемуаров и писем. Последнее письмо его другу Огюсту Шевалье было написано в ночь накануне дуэли, в нем он наспех излагает свои последние идеи. Несмотря на столь короткую жизнь, Эварист Галуа считается одним из родоначальников современной алгебры. Хотел бы заметить, что в популярном изложении создается некий романтический образ Галуа, как подростка-гения, который в одиночку, с нуля создал теорию групп и преобразил всю алгебру. Несомненно его идеи сыграли огромную роль, но если почитать его сочинения, то мы увидим, что он хорошо знал и опирался на знаменитые работы Лагранжа, Эйлера, Гаусса, Абеля, Якоби. Зачатки теории групп и перестановок появляются еще в работах Жозефа Луи Лагранжа по теории алгебраических уравнений, а также Карла Фридриха Гаусса в его знаменитых «Арифметических исследованиях». К тому же, теория Галуа в современном изложении была оформлена многими последующими математиками — Дедекиндом, Кронекером, Гильбертом, Артином и другими.
Последнее письмо его другу Огюсту Шевалье было написано в ночь накануне дуэли, в нем он наспех излагает свои последние идеи. Несмотря на столь короткую жизнь, Эварист Галуа считается одним из родоначальников современной алгебры. Хотел бы заметить, что в популярном изложении создается некий романтический образ Галуа, как подростка-гения, который в одиночку, с нуля создал теорию групп и преобразил всю алгебру. Несомненно его идеи сыграли огромную роль, но если почитать его сочинения, то мы увидим, что он хорошо знал и опирался на знаменитые работы Лагранжа, Эйлера, Гаусса, Абеля, Якоби. Зачатки теории групп и перестановок появляются еще в работах Жозефа Луи Лагранжа по теории алгебраических уравнений, а также Карла Фридриха Гаусса в его знаменитых «Арифметических исследованиях». К тому же, теория Галуа в современном изложении была оформлена многими последующими математиками — Дедекиндом, Кронекером, Гильбертом, Артином и другими.
Мотивация данной статьи
Чуть менее года назад меня сильно увлекла статья об истории решения кубического уравнения и последующих безуспешных поисков формулы уравнения 5-й степени, длившихся почти триста лет. Сразу хочу отметить, что специального математического образования у меня нет и поэтому, попробовав прочесть современную версию доказательства теоремы Абеля-Руффини, я естественно ничего не понял. В моем сознании термины группа, кольцо и поле никак не ассоциировались с алгебраическими структурами. Но желание разобраться было столь велико, что я принялся за изучение курса высшей алгебры.
Сразу хочу отметить, что специального математического образования у меня нет и поэтому, попробовав прочесть современную версию доказательства теоремы Абеля-Руффини, я естественно ничего не понял. В моем сознании термины группа, кольцо и поле никак не ассоциировались с алгебраическими структурами. Но желание разобраться было столь велико, что я принялся за изучение курса высшей алгебры.
На первых этапах абстрактная алгебра была наверное самым сложным из того, что мне приходилось изучать ранее. Объем новых терминов и определений просто зашкаливал: группы, факторгруппы, моноиды, поля, кольца, тела, модули, идеалы, ядра, векторные пространства, биекции, сюръекции, инъекции, изоморфизмы, автоморфизмы, гомоморфизмы, эндоморфизмы и тд. Спустя несколько месяцев упорных занятий, я начал понимать формальную часть, но, к сожалению, интуитивного понимания, которое и являлось моей изначальной целью, я так и не достиг.
Дело в том, что практически все современные доказательства неразрешимости уравнений 5-й степени в радикалах сводятся к следующему. Рассматривается некоторое неприводимое уравнение, например x5-10x+2, после чего методами мат анализа определяется, что оно имеет три действительных и два комплексно-сопряженных корня. После чего заключается, что группой Галуа данного уравнения есть группа S5, которая не является разрешимой, и следовательно данное уравнение неразрешимо в радикалах. Доказательство теоремы Абеля-Руффини о неразрешимости общего уравнения также сводится к неразрешимости группы Sn. Для меня данные доказательства были слишком абстрактными и оторванными от конкретных уравнений. Когда я пытался представить их в терминах элементарных алгебраических операций, чтобы понять в чем заключается главная причина неразрешимости уравнений, у меня ничего не получалось. Возможно для тех, кто занимается этим достаточно долго, эти вещи могут казаться интуитивно понятными.
Рассматривается некоторое неприводимое уравнение, например x5-10x+2, после чего методами мат анализа определяется, что оно имеет три действительных и два комплексно-сопряженных корня. После чего заключается, что группой Галуа данного уравнения есть группа S5, которая не является разрешимой, и следовательно данное уравнение неразрешимо в радикалах. Доказательство теоремы Абеля-Руффини о неразрешимости общего уравнения также сводится к неразрешимости группы Sn. Для меня данные доказательства были слишком абстрактными и оторванными от конкретных уравнений. Когда я пытался представить их в терминах элементарных алгебраических операций, чтобы понять в чем заключается главная причина неразрешимости уравнений, у меня ничего не получалось. Возможно для тех, кто занимается этим достаточно долго, эти вещи могут казаться интуитивно понятными.
Немного иной подход описан в книге Алексеева «Теорема Абеля в задачах и решениях», основанной на лекциях Владимира Арнольда, но в изложенном там доказательстве помимо теории групп используются элементы комплексного анализа и Римановых поверхностей. Я также находил похожие статьи, использующие топологические аргументы в виде комбинаций петель и коммутаторов, но мне хотелось найти что-то чисто алгебраическое.
Я также находил похожие статьи, использующие топологические аргументы в виде комбинаций петель и коммутаторов, но мне хотелось найти что-то чисто алгебраическое.
Параллельно изучая историю математики и понимая, что современная формулировка и доказательство сильно отличаются от того, как излагали свои идеи Лагранж, Руффини, Абель и Галуа, я решил прочесть первоисточники. К сожалению, на русский или английский по этой теме переведены лишь сочинения Галуа и одна из работ Абеля.
После некоторых поисков я наткнулся на статью 1845 года французского математика Пьера Лорана Ванцеля, в которой он переработал и сильно упростил доказательство Абеля-Руффини, о чем он пишет во введении. В этой работе, он так же упоминает мемуары Галуа и отмечает, что они будут опубликованы в скором времени. Для заметки — работы Галуа были опубликованы лишь в 1846 году Жозефом Лиувиллем, спустя почти 15 лет после смерти Галуа. Кстати, Пьер Лоран Ванцель, также был первым, кто доказал неразрешимость трисекции угла и удвоения куба с помощью циркуля и линейки — знаменитых задач стоявших еще со времен античности. Доказательства Ванцеля были изложены без использования абстрактной алгебры и теории Галуа, поскольку на тот момент они еще не были разработаны. Хотя работа и была доступна лишь на французском, которого я до этого практически не знал, но ввиду специфической темы, небольшого размера (всего 7 страниц) и наличия гугл переводчика, я справился достаточно быстро. По моему субъективному мнению, его доказательство теоремы Абеля-Руффини является наиболее простым для понимания.
Доказательства Ванцеля были изложены без использования абстрактной алгебры и теории Галуа, поскольку на тот момент они еще не были разработаны. Хотя работа и была доступна лишь на французском, которого я до этого практически не знал, но ввиду специфической темы, небольшого размера (всего 7 страниц) и наличия гугл переводчика, я справился достаточно быстро. По моему субъективному мнению, его доказательство теоремы Абеля-Руффини является наиболее простым для понимания.
Уже позже я нашел пример подобного доказательства основанного на работе Руффини в книге Чеботарёва “Основы Теории Галуа”. Далее я постараюсь кратко изложить принцип решения уравнений в радикалах и идею доказательства неразрешимости уравнения 5-й степени.
Решения уравнений в радикалах
Для дальнейшего понимания, потребуются минимальные пререквизиты:
Формулы Виета — напомню, что коэффициенты произвольного уравнения являются элементарными симметрическими функциями от его корней, то есть функциями, которые не меняют своего значения при любых перестановках корней.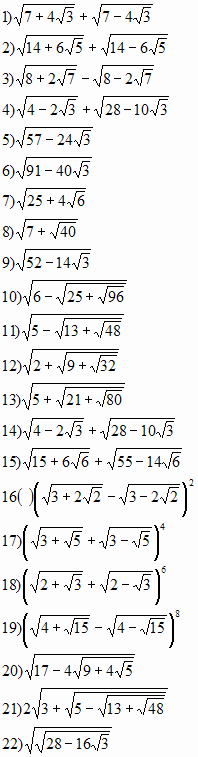 Примеры: x1 + x2 + x3, x1x2x3, x1x2 + x1x3 + x2x3.
Примеры: x1 + x2 + x3, x1x2x3, x1x2 + x1x3 + x2x3.
Теорема о симметрических многочленах — каждую симметрическую функцию от корней, можно выразить с помощью элементарных симметрических функций (коэффициентов уравнения).
Первообразные корни n-й степени из единицы — комплексные величины не равные единице, но n-я степень которых, равна единице. Примеры: (-1)2 = 1, (-1/2 + sqrt(-3)/2)3 = 1, i4 = 1 соответственно квадратный, кубический и биквадратный корни из единицы.
Основная теорема алгебры — гласит о том, что уравнение n-й степени с комплексными коэффициентами имеет ровно n комплексных корней с учетом кратности (корни могут быть одинаковые).
Первоначальная идея восходит к работе Жозефа Луи Лагранжа “Размышления о решении уравнений” 1770-1771 годов. Это достаточно объемное сочинение и я не нашел его перевода на русский или английский язык. Как указывается в разных источниках, в попытке найти формулу для уравнения 5-й степени, Лагранж проанализировал все имеющиеся к тому времени способы решения уравнений и выделил общий принцип, позволяющий решить уравнения 4-й и низших степеней. В этой же работе, изучая перестановки корней, он пришел к теореме, которая сейчас носит его имя. Принцип, открытый Лагранжем, заключался в том, чтобы найти выражения от корней заданного уравнения n-й степени, которые при всех возможных перестановках этих корней принимали n-1 значений, но в тоже время через них выражались первоначальные корни. На эти значения, можно составить уравнение n-1 степени и повторить операцию, тем самым сводя изначальное уравнение к цепочке уравнений меньших степеней, решив которые, можно получить корни первоначального уравнения. Рассмотрим один из примеров:
Это достаточно объемное сочинение и я не нашел его перевода на русский или английский язык. Как указывается в разных источниках, в попытке найти формулу для уравнения 5-й степени, Лагранж проанализировал все имеющиеся к тому времени способы решения уравнений и выделил общий принцип, позволяющий решить уравнения 4-й и низших степеней. В этой же работе, изучая перестановки корней, он пришел к теореме, которая сейчас носит его имя. Принцип, открытый Лагранжем, заключался в том, чтобы найти выражения от корней заданного уравнения n-й степени, которые при всех возможных перестановках этих корней принимали n-1 значений, но в тоже время через них выражались первоначальные корни. На эти значения, можно составить уравнение n-1 степени и повторить операцию, тем самым сводя изначальное уравнение к цепочке уравнений меньших степеней, решив которые, можно получить корни первоначального уравнения. Рассмотрим один из примеров:
Пусть f(x) = x4 + ax3 + bx2 + cx + d общее уравнение 4-й степени с произвольными коэффициентами a, b, c, d и x1, x2, x3, x4 его корни.
Напомним, что его коэффициенты — это элементарные симметрические функции от корней, в чем можно убедиться просто раскрыв скобки в выражении (x — x1)(x -x2)(x — x3)(x — x4):
x1 + x2 + x3 + x4 = -a
x1x2 + x1x3 + x1x4 + x2x3 + x2x4 + x3x4 = b
x1x2x3 + x1x2x4 + x1x3x4 + x2x3x4 = -c
x1x2x3x4 = d
Так как корни являются произвольными, то существует 4! = 24 различных вариантов их расположения, но можно составить выражение x1x2 + x3x4, которое принимает всего три разных значения при всех 24-х перестановках корней:
x1x2 + x3x4 = y1
x1x3 + x2x4 = y2
x1x4 + x2x3 = y3
На эти три значения мы можем составить уже кубическое уравнение, корнями которого они и будут являться. Таким образом, мы сводим решение уравнения 4-й степени к уравнению 3-й степени. Для решения кубического уравнения мы можем воспользоваться резольвентой Лагранжа (y1 + wy2 + w2y3)3, где w — это кубический корень из единицы. Данное выражение принимает всего два разных значения при всех возможных 3! = 6 перестановках. Оно будет сохранять значение при циклических перестановках и менять знак при любой транспозиции. Получим:
Таким образом, мы сводим решение уравнения 4-й степени к уравнению 3-й степени. Для решения кубического уравнения мы можем воспользоваться резольвентой Лагранжа (y1 + wy2 + w2y3)3, где w — это кубический корень из единицы. Данное выражение принимает всего два разных значения при всех возможных 3! = 6 перестановках. Оно будет сохранять значение при циклических перестановках и менять знак при любой транспозиции. Получим:
(y1 + wy2 + w2y3)3 = z1
(y1 + w2y2 + wy3)3 = z2
Теперь составим квадратное уравнение на z1 и z2:
(t — z1)(t — z2) = t2 — t(z1+z2) + z1z2
z1+z2 и z1z2 — будут симметрическими функциями от корней нашего изначального уравнения f(x), следовательно, по теореме о симметрических многочленах, напрямую выражаться через коэффициенты a, b, c, d. Решив квадратное уравнение мы получим значения z1, z2. После чего, извлекая кубические корни из z1, z2, и складывая с коэффициентом b, сможем выразить y1. Далее, c помощью y1 и коэффициентов a, b, d, решив два квадратных уравнения, мы доберемся до корней x1, x2, x3, x4 изначального уравнения.
Решив квадратное уравнение мы получим значения z1, z2. После чего, извлекая кубические корни из z1, z2, и складывая с коэффициентом b, сможем выразить y1. Далее, c помощью y1 и коэффициентов a, b, d, решив два квадратных уравнения, мы доберемся до корней x1, x2, x3, x4 изначального уравнения.
Данный пример показывает, что произвольное уравнение 4-й степени решается путем составления вспомогательных кубического и квадратных уравнений. Далее я приведу рассуждение, почему подобный прием невозможен для общего уравнения 5-й степени.
Неразрешимость уравнения 5-й степени
Итак, мы хотим показать, что ни один корень общего уравнения 5-й степени не может быть выражен через его коэффициенты путем решения цепочки вспомогательных двучленных уравнений низших степеней.
Пусть f(x) = x5 + ax4 + bx3 + cx2 + xd + e общее уравнение 5-й степени с произвольными коэффициентами a, b, c, d, e и x1, x2, x3, x4, x5 его корни. Обозначим за y1 первый радикал входящий в значение x1 в порядке вычисления. Пусть y1n = p, где p будет какой-то симметрической функцией от корней и, следовательно, напрямую выражаться через коэффициенты a, b, c, d, e. Заметим, что y1 уже не будет симметрической, а лишь рациональной функцией g от корней — g(x1, x2, x3, x4, x5). Следовательно, g должно менять значение при перестановке любых двух корней. Тогда эти значения будут являться корнями уравнения y1n = p, которые имеют вид g, zg, z2g, z3g … zn-1g, где z — первообразный корень n-й степени из единицы (zn=1). Рассмотрим произвольную транспозицию, например (x1, x2), тогда
Обозначим за y1 первый радикал входящий в значение x1 в порядке вычисления. Пусть y1n = p, где p будет какой-то симметрической функцией от корней и, следовательно, напрямую выражаться через коэффициенты a, b, c, d, e. Заметим, что y1 уже не будет симметрической, а лишь рациональной функцией g от корней — g(x1, x2, x3, x4, x5). Следовательно, g должно менять значение при перестановке любых двух корней. Тогда эти значения будут являться корнями уравнения y1n = p, которые имеют вид g, zg, z2g, z3g … zn-1g, где z — первообразный корень n-й степени из единицы (zn=1). Рассмотрим произвольную транспозицию, например (x1, x2), тогда
g(x2, x1, x3, x4, x5) = zg(x1, x2, x3, x4, x5)
если мы применим ее еще раз, то получим:
g(x1, x2, x3, x4, x5) = zg(x2, x1, x3, x4, x5)
что равносильно g(x1, x2, x3, x4, x5) = z2g(x1, x2, x3, x4, x5)
Из этого следует, что z2 = 1, то есть z должен быть квадратным корнем из единицы (z = -1) и соответственно первый радикал y1 будет квадратным. Поясним: так как корни являются произвольными, то g должно сохранять значение при любых четных перестановках корней и менять знак при нечетных. Теперь покажем, что значение функции g не будет меняться при циклической перестановке трех корней (x1, x2, x3). Здесь стоит пояснить, что циклическая перестановка (x1, x2, x3) четная и может быть представлена, как произведение транспозиций (x1, x2)(x2, x3). То есть, функция g не поменяет своего значения при данной перестановке. Еще заметим, что функция g не изменится при циклической перестановке пяти корней, так как она так же раскладывается в произведение четного количества транспозиций. Присоединяя радикал y1 к выражениям от коэффициентов с помощью базовых арифметических операций, мы будем получать симметрические функции относительно всех циклов на трех и пяти корнях и вообще любых четных перестановок, но при перестановке содержащей нечетное количество транспозиций, y1 будет менять знак.
Поясним: так как корни являются произвольными, то g должно сохранять значение при любых четных перестановках корней и менять знак при нечетных. Теперь покажем, что значение функции g не будет меняться при циклической перестановке трех корней (x1, x2, x3). Здесь стоит пояснить, что циклическая перестановка (x1, x2, x3) четная и может быть представлена, как произведение транспозиций (x1, x2)(x2, x3). То есть, функция g не поменяет своего значения при данной перестановке. Еще заметим, что функция g не изменится при циклической перестановке пяти корней, так как она так же раскладывается в произведение четного количества транспозиций. Присоединяя радикал y1 к выражениям от коэффициентов с помощью базовых арифметических операций, мы будем получать симметрические функции относительно всех циклов на трех и пяти корнях и вообще любых четных перестановок, но при перестановке содержащей нечетное количество транспозиций, y1 будет менять знак. Дальнейшее присоединение квадратных радикалов не даст нам ничего нового. Теперь предположим, что мы пришли к радикалу, который меняет свое значение лишь при тройных циклах. Обозначим его y2, тогда y2n = q, где q — это рациональная функция от коэффициентов a, b, c, d, e и радикала y1.
Дальнейшее присоединение квадратных радикалов не даст нам ничего нового. Теперь предположим, что мы пришли к радикалу, который меняет свое значение лишь при тройных циклах. Обозначим его y2, тогда y2n = q, где q — это рациональная функция от коэффициентов a, b, c, d, e и радикала y1.
g(x2, x3, x1, x4, x5) = zg(x1, x2, x3, x4, x5)
g(x3, x1, x2, x4, x5) = zg(x2, x3, x1, x4, x5)
g(x1, x2, x3, x4, x5) = zg(x3, x1, x2, x4, x5)
что равносильно g(x1, x2, x3, x4, x5) = z3g(x1, x2, x3, x4, x5)
В данном случае z3 = 1, то есть z здесь будет кубическим корнем из единицы.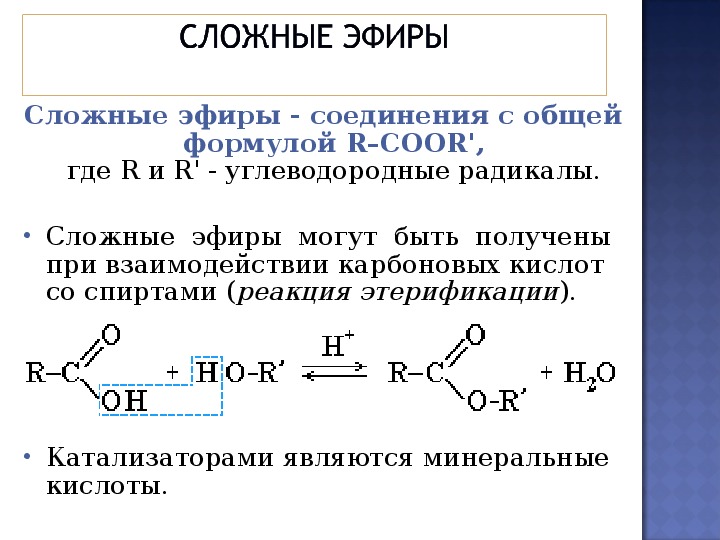
Теперь произведем циклическую перестановку 5-и корней
g(x2, x3, x4, x5, x1) = zg(x1, x2, x3, x4, x5)
g(x3, x4, x5, x1, x2) = zg(x2, x3, x4, x5, x1)
g(x4, x5, x1, x2, x3) = zg(x3, x4, x5, x1, x2)
g(x5, x1, x2, x3, x4) = zg(x4, x5, x1, x2, x3)
g(x1, x2, x3, x4, x5) = zg(x5, x1, x2, x3, x4)
Так как z должен быть кубическим корнем из единицы, как мы выяснили ранее, то единственным вариантом будет z = 1 и g должна быть инвариантна при любой из этих циклических перестановок.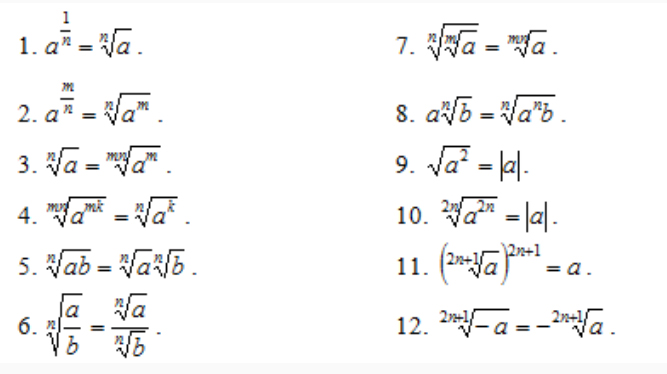 Но тогда она должна быть инвариантна и при циклической перестановке x3,x2,x5,x1,x4 -> x2,x5,x1,x4,x3. Отсюда, одной транспозицией мы можем получить, что
Но тогда она должна быть инвариантна и при циклической перестановке x3,x2,x5,x1,x4 -> x2,x5,x1,x4,x3. Отсюда, одной транспозицией мы можем получить, что
g(x3, x4, x5, x1, x2) = g(x2, x3, x1, x4, x5)
но, выше мы уже видели, что
g(x1, x2, x3, x4, x5) = g(x3, x4, x5, x1, x2)
а из этого следует
g(x1, x2, x3, x4, x5) = g(x2, x3, x1, x4, x5)
что приводит нас к противоречию, так как мы предполагали, что g меняет значение при циклической перестановке трех корней (x1, x2, x3).
Еще одним вариантом, было бы показать что все четные перестановки на пяти корнях порождаются тройными циклами, то есть, если есть тройные циклы, то никаких выражений от корней, которые бы сохраняли набор значений при всех четных перестановках, не существует. Если теперь перевести это на теоретико-групповой язык, то получается, что группа общего уравнения пятой степени есть симметрическая группа S5, в которой существует 5! = 120 различных перестановок пяти корней. Далее, путем присоединения квадратного корня из дискриминанта, мы можем понизить ее до знакопеременной группы четных перестановок A5, которая содержит 120/2 = 60 перестановок. Но A5 является простой группой, в которой нет никаких нетривиальных нормальных подгрупп, которым бы соответствовали выражения от корней сохраняющие значения при определенных перестановках, из чего следует, что присоединение любых дополнительных радикалов не приблизит нас к решению.
Заключение
Поводом для написания данной статьи послужило желание структурировать свои мысли по этой теме и представить идеи о неразрешимости уравнений в радикалах без привлечения абстрактной алгебры и теории Галуа. По моему мнению, в подавляющем большинстве современных изложений теряется связь между областью, в которой происходит доказательство и конкретными уравнениями. Если у кого-то есть замечания, дополнения или ссылки на подобные элементарные изложения, буду рад услышать.
По моему мнению, в подавляющем большинстве современных изложений теряется связь между областью, в которой происходит доказательство и конкретными уравнениями. Если у кого-то есть замечания, дополнения или ссылки на подобные элементарные изложения, буду рад услышать.
| 1. |
Формула кислоты
Сложность: лёгкое |
1 |
2.
|
Окраска индикатора
Сложность: лёгкое |
1 |
| 3. |
Физические свойства карбоновых кислот
Сложность: среднее |
1 |
4.
|
Применение карбоновых кислот
Сложность: среднее |
1 |
| 5. |
Общие формулы карбоновых кислот
Сложность: среднее |
1 |
6.
|
С чем реагирует кислота
Сложность: среднее |
1 |
| 7. |
Продукты реакций
Сложность: среднее |
2 |
8.
|
Как определить вещества
Сложность: сложное |
3 |
| 9. |
Вычисли массу углерода в кислоте
Сложность: сложное |
3 |
Иррациональные числа.
 Формула сложного радикала — Математика — Каталог статей
Формула сложного радикала — Математика — Каталог статейРациональные
числа. Иррациональные числа.
Примеры иррациональных чисел.
Формула
сложного радикала.
Иррациональные числа в отличие от рациональных (см. “Рациональные числа”) не могут быть представлены в виде обыкновенной несократимой дроби вида: m / n, где m и n – целые числа. Это числа нового типа, которые могут быть вычислены с любой точностью, но не могут быть заменены рациональным числом. Они могут появиться как результат геометрических измерений, например:
— отношение длины диагонали квадрата к длине его стороны равно ,
— отношение длины окружности к длине её диаметра равно иррациональному числу
Примеры других иррациональных чисел:
Докажем, что
является иррациональным числом. Предположим противное:
— рациональное число, тогда согласно определению рационального числа можно
записать:
= m
/ n , отсюда: 2 = m2 / n2,
или m2 =
2 n2,
то есть m2 делится на 2, следовательно, m
делится на 2, откуда m = 2 k,
тогда m2 = 4 k2 или 4 k2 = 2 n2,
то есть n2 = 2 k2,
то есть n2 делится на 2, а значит, n
делится на 2, следовательно, m
и n имеют общий множитель 2, что противоречит
определению рационального числа (см. выше). Таким образом, доказано, что
является иррациональным числом.
выше). Таким образом, доказано, что
является иррациональным числом.
При алгебраических преобразованиях иррациональных выражений и уравнений, содержащих квадратные корни, может быть полезна следующая формула сложного радикала:
(все подкоренные выражения неотрицательны). Для доказательства этой формулы достаточно возвести в квадрат обе ее части.
3.1: Типы химических соединений и их формулы
Цели обучения
- Чтобы понять разницу между ковалентной и ионной связью.
Атомы всех веществ, содержащих несколько атомов, удерживаются вместе за счет электростатических взаимодействий — взаимодействий между электрически заряженными частицами, такими как протоны и электроны. Электростатическое притяжение между противоположно заряженными частицами (положительным и отрицательным) приводит к возникновению силы, которая заставляет их двигаться навстречу друг другу, подобно притяжению между противоположными полюсами двух магнитов. Напротив, электростатическое отталкивание между двумя видами с одинаковым зарядом (как положительным, так и отрицательным) приводит к силе, которая заставляет их отталкивать друг друга, как это делают одинаковые полюса двух магнитов. Атомы образуют химические соединения, когда электростатические взаимодействия притяжения между ними сильнее, чем взаимодействия отталкивания. В совокупности притягивающие взаимодействия между атомами называются химическими связями.
Напротив, электростатическое отталкивание между двумя видами с одинаковым зарядом (как положительным, так и отрицательным) приводит к силе, которая заставляет их отталкивать друг друга, как это делают одинаковые полюса двух магнитов. Атомы образуют химические соединения, когда электростатические взаимодействия притяжения между ними сильнее, чем взаимодействия отталкивания. В совокупности притягивающие взаимодействия между атомами называются химическими связями.
Химические связи обычно делятся на два принципиально разных типа: ионные и ковалентные.В действительности, однако, связи в большинстве веществ не являются ни чисто ионными, ни чисто ковалентными, а лежат в спектре между этими крайностями. Хотя чисто ионные и чисто ковалентные связи представляют собой крайние случаи, редко встречающиеся в каких-либо, кроме очень простых веществ, краткое обсуждение этих двух крайностей помогает объяснить, почему вещества с различными видами химических связей обладают очень разными свойствами. Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения обычно состоят из молекул, представляющих собой группы атомов, в которых одна или несколько пар электронов являются общими для связанных атомов.В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Это обсуждение структур и формул начинается с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны ниже.
Ионные соединения состоят из положительно и отрицательно заряженных ионов, удерживаемых вместе сильными электростатическими силами, тогда как ковалентные соединения обычно состоят из молекул, представляющих собой группы атомов, в которых одна или несколько пар электронов являются общими для связанных атомов.В ковалентной связи атомы удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, которые они разделяют. Это обсуждение структур и формул начинается с описания ковалентных соединений. Энергетические факторы, участвующие в образовании связи, более подробно описаны ниже.
Примечание
Ионные соединения состоят из ионов с противоположными зарядами, удерживаемых вместе сильными электростатическими силами, тогда как пары электронов являются общими для связанных атомов в ковалентных соединениях.
Ковалентные молекулы и соединения
Точно так же, как атом является простейшей единицей, обладающей фундаментальными химическими свойствами элемента, молекула является простейшей единицей, обладающей фундаментальными химическими свойствами ковалентного соединения. Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («два атома») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , и I 2 (часть (a) на рисунке \(\PageIndex{1}\)).Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые встречаются как P 4 и S 8 (часть (b) на рисунке \(\PageIndex{1} \)).
Некоторые чистые элементы существуют в виде ковалентных молекул. Водород, азот, кислород и галогены встречаются в природе в виде двухатомных («два атома») молекул H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , и I 2 (часть (a) на рисунке \(\PageIndex{1}\)).Точно так же несколько чистых элементов существуют в виде многоатомных («многоатомных») молекул, таких как элементарный фосфор и сера, которые встречаются как P 4 и S 8 (часть (b) на рисунке \(\PageIndex{1} \)).
Каждое ковалентное соединение представлено молекулярной формулой, которая дает атомный символ для каждого составляющего элемента в установленном порядке, сопровождаемый нижним индексом, указывающим количество атомов этого элемента в молекуле. Нижний индекс записывается только в том случае, если число атомов больше 1.Например, вода с двумя атомами водорода и одним атомом кислорода на молекулу записывается как \(H_2O\). Точно так же углекислый газ, который содержит один атом углерода и два атома кислорода в каждой молекуле, записывается как \(CO_2\).
Точно так же углекислый газ, который содержит один атом углерода и два атома кислорода в каждой молекуле, записывается как \(CO_2\).
Ковалентные соединения, содержащие преимущественно углерод и водород, называются органическими соединениями. При представлении формул органических соединений сначала пишут углерод, затем водород, а затем любые другие элементы в алфавитном порядке (например,г. , CH 4 O – метиловый спирт, горючее). Соединения, которые состоят в основном из элементов, отличных от углерода и водорода, называются неорганическими соединениями; они включают как ковалентные, так и ионные соединения. В неорганических соединениях составные элементы перечислены, начиная с самого левого в периодической таблице, как в CO 2 или SF 6 . Те, кто находится в одной группе, перечислены, начиная с нижнего элемента и вверх, как в ClF. Однако по соглашению, когда неорганическое соединение содержит как водород, так и элемент из групп 13–15, водород обычно указывается в формуле последним.Примерами являются аммиак (NH 3 ) и силан (SiH 4 ). Такие соединения, как вода, состав которых был установлен задолго до того, как была принята эта конвенция, всегда пишутся сначала водородом: вода всегда пишется как H 2 O, а не OH 2 . Условные обозначения для неорганических кислот, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), описаны в другом месте.
, CH 4 O – метиловый спирт, горючее). Соединения, которые состоят в основном из элементов, отличных от углерода и водорода, называются неорганическими соединениями; они включают как ковалентные, так и ионные соединения. В неорганических соединениях составные элементы перечислены, начиная с самого левого в периодической таблице, как в CO 2 или SF 6 . Те, кто находится в одной группе, перечислены, начиная с нижнего элемента и вверх, как в ClF. Однако по соглашению, когда неорганическое соединение содержит как водород, так и элемент из групп 13–15, водород обычно указывается в формуле последним.Примерами являются аммиак (NH 3 ) и силан (SiH 4 ). Такие соединения, как вода, состав которых был установлен задолго до того, как была принята эта конвенция, всегда пишутся сначала водородом: вода всегда пишется как H 2 O, а не OH 2 . Условные обозначения для неорганических кислот, таких как соляная кислота (HCl) и серная кислота (H 2 SO 4 ), описаны в другом месте.
Примечание
Для органических соединений: сначала напишите C, затем H, а затем остальные элементы в алфавитном порядке.Для молекулярных неорганических соединений: начните с крайне левого элемента периодической таблицы; перечислите элементы в той же группе, начиная с нижнего элемента и работая вверх.
Пример \(\PageIndex{1}\)
Напишите молекулярную формулу каждого соединения.
- Соединение фосфора и серы, ответственное за воспламенение так называемых зажигательных спичек, содержит 4 атома фосфора и 3 атома серы на молекулу.
- Этиловый спирт, спирт алкогольных напитков, имеет 1 атом кислорода, 2 атома углерода и 6 атомов водорода на молекулу. Фреон-11
- , когда-то широко использовавшийся в автомобильных кондиционерах и причастный к повреждению озонового слоя, имеет 1 атом углерода, 3 атома хлора и 1 атом фтора на молекулу.
Дано : идентичность присутствующих элементов и количество атомов каждого
Запрашиваемый : молекулярная формула
Стратегия :
A Определите символ для каждого элемента в молекуле. Затем идентифицируйте вещество как органическое или неорганическое соединение.
Затем идентифицируйте вещество как органическое или неорганическое соединение.
B Если вещество представляет собой органическое соединение, расположите элементы в порядке, начиная с углерода и водорода, а затем перечислите остальные элементы в алфавитном порядке. Если это неорганическое соединение, перечислите элементы, начиная с самого левого в периодической таблице. Перечислите элементы в одной группе, начиная с нижнего элемента и вверх.
C Из предоставленной информации добавьте индекс для каждого типа атома, чтобы написать молекулярную формулу.
Решение :
а.
- A В молекуле 4 атома фосфора и 3 атома серы. Поскольку соединение не содержит в основном углерод и водород, оно является неорганическим.
- B Фосфор находится в группе 15, а сера в группе 16. Поскольку фосфор находится слева от серы, он пишется первым.
- C Запись количества атомов каждого вида в правом нижнем индексе дает P 4 S 3 в виде молекулярной формулы.

б.
- A Этиловый спирт содержит преимущественно углерод и водород, поэтому он является органическим соединением.
- B Формула органического соединения записывается так, чтобы сначала число атомов углерода, затем число атомов водорода и остальные атомы в алфавитном порядке: CHO.
- C Добавление нижних индексов дает молекулярную формулу \(\ce{C2H6O}\).
в.
- A Фреон-11 содержит углерод, хлор и фтор.Его можно рассматривать либо как неорганическое соединение, либо как органическое соединение (в котором фтор заменил водород). Таким образом, формула для фреона-11 может быть записана с использованием любого из двух соглашений.
- B Согласно соглашению для неорганических соединений, углерод пишется первым, потому что он находится дальше слева в таблице Менделеева. Фтор и хлор находятся в одной группе, поэтому они перечислены, начиная с низшего элемента и вверх: CClF.
 Добавление нижних индексов дает молекулярную формулу CCl 3 F.
Добавление нижних индексов дает молекулярную формулу CCl 3 F. - C Такую же формулу получаем для фреона-11, используя условное обозначение для органических соединений. Сначала записывается число атомов углерода, затем количество атомов водорода (ноль), а затем остальные элементы в алфавитном порядке, что также дает CCl 3 F.
Упражнение \(\PageIndex{1}\)
Напишите молекулярную формулу каждого соединения.
- Закись азота, также называемая «веселящим газом», имеет 2 атома азота и 1 атом кислорода на молекулу.Закись азота используется в качестве мягкого анестетика при небольших хирургических вмешательствах и в качестве пропеллента в банках со взбитыми сливками.
- Сахароза, также известная как тростниковый сахар, имеет 12 атомов углерода, 11 атомов кислорода и 22 атома водорода.
- Гексафторид серы, газ, используемый для повышения давления «не находящихся под давлением» теннисных мячей и в качестве охлаждающей жидкости в ядерных реакторах, содержит 6 атомов фтора и 1 атом серы на молекулу.

Ответ :
- Н 2 О
- С 12 Н 22 О 11
- СФ 6
Представления молекулярных структур
Молекулярные формулы дают только элементный состав молекул.Напротив, структурные формулы показывают, какие атомы связаны друг с другом, а в некоторых случаях и приблизительное расположение атомов в пространстве. Знание структурной формулы соединения позволяет химикам создать трехмерную модель, которая предоставляет информацию о том, как это соединение будет вести себя физически и химически.
Рисунок \(\PageIndex{2}\): Молекулы, содержащие одинарные, двойные и тройные связи. Водород (H 2 ) имеет одинарную связь между атомами. Кислород (O 2 ) имеет двойную связь между атомами, обозначенную двумя линиями (=).Азот (N 2 ) имеет тройную связь между атомами, обозначенную тремя линиями (≡). Каждая связь представляет собой электронную пару.
Структурная формула для H 2 может быть представлена как H–H, а для I 2 – как I–I, где линия указывает на одну пару общих электронов, одинарную связь. Две пары электронов являются общими в двойной связи, что обозначено двумя линиями, например, O 2 означает O=O. Три пары электронов являются общими в тройной связи, что обозначено тремя линиями — например, N 2 — это N≡N (рисунок \(\PageIndex{2}\)).Углерод уникален тем, что он образует одинарные, двойные и тройные связи с самим собой и другими элементами. Количество связей, образуемых атомом в его ковалентных соединениях, не является произвольным. Водород, кислород, азот и углерод имеют очень сильную склонность к образованию веществ, в которых они имеют соответственно одну, две, три и четыре связи с другими атомами (таблица \(\PageIndex{1}\)).
| Атом | Количество облигаций |
|---|---|
| H (группа 1) | 1 |
| О (группа 16) | 2 |
| Н (группа 15) | 3 |
| С (группа 14) | 4 |
Структурная формула воды может быть представлена следующим образом:
Поскольку последний аппроксимирует экспериментально определенную форму молекулы воды, он более информативен. Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записывают в виде плоских молекул:
Точно так же аммиак (NH 3 ) и метан (CH 4 ) часто записывают в виде плоских молекул:
Однако, как показано на рисунке \(\PageIndex{3}\), фактическая трехмерная структура NH 3 выглядит как пирамида с треугольным основанием из трех атомов водорода. Структура CH 4 с четырьмя атомами водорода, расположенными вокруг центрального атома углерода, как показано на рисунке \(\PageIndex{3}\), является тетраэдрической: атомы водорода расположены в каждой второй вершине куба.Многие соединения, в частности соединения углерода, имеют четыре связанных атома, расположенных вокруг центрального атома, образуя тетраэдр.
Рисунок \(\PageIndex{3}\): Трехмерные структуры воды, аммиака и метана. а) Вода представляет собой молекулу V-образной формы, в которой все три атома лежат в одной плоскости. (b) Напротив, аммиак имеет пирамидальную структуру, в которой три атома водорода образуют основание пирамиды, а атом азота находится в вершине. в) четыре атома водорода метана образуют тетраэдр; атом углерода находится в центре.
Рисунки \(\PageIndex{3}\)-\(\PageIndex{3}\) иллюстрируют различные способы представления структуры молекул. Должно быть ясно, что не существует единственного «наилучшего» способа изобразить структуру молекулы; используемый метод зависит от того, какой аспект структуры следует подчеркнуть и сколько времени и усилий требуется. На рисунке \(\PageIndex{4}\) показаны различные способы изображения структуры несколько более сложной молекулы: метанола. Эти представления сильно различаются по своей информативности.Например, молекулярная формула метанола (часть (а) на рисунке \(\PageIndex{4}\)) дает только количество атомов каждого вида; запись метанола как CH 4 O ничего не говорит о его структуре. Напротив, структурная формула (часть (b) на рисунке \(\PageIndex{4}\)) показывает, как связаны атомы, но метанол выглядит плоским (что на самом деле не так). И шаростержневая модель (часть (c) на рисунке \(\PageIndex{4}\)) и перспективный рисунок (часть (d) на рисунке \(\PageIndex{4}\)) показывают три- объемная структура молекулы. Последнее (также называемое клино-штриховым представлением) — самый простой способ зарисовать структуру молекулы в трех измерениях. Он показывает, какие атомы находятся выше и ниже плоскости бумаги, используя клинья и штрихи соответственно; центральный атом всегда предполагается находящимся в плоскости бумаги. Модель заполнения пространства (часть (e) на рисунке \(\PageIndex{4}\)) иллюстрирует приблизительные относительные размеры атомов в молекуле, но не показывает связи между атомами. Кроме того, в модели заполнения пространства атомы «впереди» молекулы могут заслонять атомы «сзади».
Последнее (также называемое клино-штриховым представлением) — самый простой способ зарисовать структуру молекулы в трех измерениях. Он показывает, какие атомы находятся выше и ниже плоскости бумаги, используя клинья и штрихи соответственно; центральный атом всегда предполагается находящимся в плоскости бумаги. Модель заполнения пространства (часть (e) на рисунке \(\PageIndex{4}\)) иллюстрирует приблизительные относительные размеры атомов в молекуле, но не показывает связи между атомами. Кроме того, в модели заполнения пространства атомы «впереди» молекулы могут заслонять атомы «сзади».
 (e) Модель заполнения пространства показывает атомы в молекуле, но не связи.(f) Сокращенная структурная формула — это, безусловно, самый простой и распространенный способ представления молекулы.
(e) Модель заполнения пространства показывает атомы в молекуле, но не связи.(f) Сокращенная структурная формула — это, безусловно, самый простой и распространенный способ представления молекулы. Хотя структурная формула, шарико-стержневая модель, чертеж в перспективе и заполняющая пространство модель предоставляют значительный объем информации о структуре молекулы, каждая из них требует времени и усилий. Следовательно, химики часто используют сокращенную структурную формулу (часть (f) на рисунке \(\PageIndex{4}\)), в которой опущены линии, представляющие связи между атомами, и просто перечислены атомы, связанные с данным атомом рядом с ним.Несколько групп, присоединенных к одному и тому же атому, показаны в круглых скобках, за которыми следует нижний индекс, указывающий количество таких групп. Например, сокращенная структурная формула метанола — CH 3 OH, что указывает на то, что молекула содержит звено CH 3 , похожее на фрагмент метана (CH 4 ). Таким образом, метанол можно рассматривать либо как молекулу метана, в которой один атом водорода заменен группой –ОН, либо как молекулу воды, в которой один атом водорода заменен фрагментом –СН 3 . Из-за простоты использования и информативности мы используем сокращенные структурные формулы для молекул в этом тексте. Шарико-стержневые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а заполняющие пространство модели используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Из-за простоты использования и информативности мы используем сокращенные структурные формулы для молекул в этом тексте. Шарико-стержневые модели используются, когда необходимо проиллюстрировать трехмерную структуру молекул, а заполняющие пространство модели используются только тогда, когда необходимо визуализировать относительные размеры атомов или молекул, чтобы понять важный момент.
Пример \(\PageIndex{2}\)
Напишите молекулярную формулу каждого соединения. Приведена сокращенная структурная формула.
- Монохлорид серы (также называемый дихлоридом серы) представляет собой коррозионно-желтую жидкость с неприятным запахом, используемую в производстве синтетического каучука. Его сокращенная структурная формула ClSSCl.
- Этиленгликоль является основным компонентом антифриза. Его сокращенная структурная формула: HOCH 2 CH 2 OH.
- Триметиламин – одно из веществ, ответственных за запах испорченной рыбы.
 Его сокращенная структурная формула (CH 3 ) 3 N.
Его сокращенная структурная формула (CH 3 ) 3 N.
Дано : сокращенная структурная формула
Запрашиваемый : молекулярная формула
Стратегия :
- Определите каждый элемент в сокращенной структурной формуле, а затем определите, является ли соединение органическим или неорганическим.
- При необходимости используйте органические или неорганические обозначения для перечисления элементов. Затем добавьте соответствующие нижние индексы, чтобы указать количество атомов каждого элемента, присутствующего в молекулярной формуле.
Решение :
Молекулярная формула содержит список элементов в молекуле и число атомов каждого из них.
- A Каждая молекула монохлорида серы содержит два атома серы и два атома хлора. Поскольку он не содержит в основном углерод и водород, это неорганическое соединение.
 B Сера находится слева от хлора в таблице Менделеева, поэтому в формуле она написана первой. Добавление нижних индексов дает молекулярную формулу S 2 Cl 2 .
B Сера находится слева от хлора в таблице Менделеева, поэтому в формуле она написана первой. Добавление нижних индексов дает молекулярную формулу S 2 Cl 2 . - A Подсчитав количество атомов в этиленгликоле, мы получаем шесть атомов водорода, два атома углерода и два атома кислорода на молекулу. Соединение состоит в основном из атомов углерода и водорода, поэтому оно является органическим. B Как и во всех органических соединениях, C и H пишутся первыми в молекулярной формуле. Добавление соответствующих индексов дает молекулярную формулу C 2 H 6 O 2 .
- A Сокращенная структурная формула показывает, что триметиламин содержит три звена CH 3 , поэтому у нас есть один атом азота, три атома углерода и девять атомов водорода на молекулу.Поскольку триметиламин содержит в основном углерод и водород, это органическое соединение.
 B Согласно соглашению об органических соединениях C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
B Согласно соглашению об органических соединениях C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
Упражнение \(\PageIndex{2}\)
Напишите молекулярную формулу каждой молекулы.
- Хлороформ, который был одним из первых анестетиков и до недавнего времени использовался во многих сиропах от кашля, содержит один атом углерода, один атом водорода и три атома хлора.Его сокращенная структурная формула: CHCl 3 .
- Гидразин используется в качестве топлива в реактивных двигателях космического корабля «Шаттл». Его сокращенная структурная формула H 2 NNH 2 .
- Путресцин — это соединение с резким запахом, впервые выделенное из экстрактов гниющего мяса. Его сокращенная структурная формула: H 2 NCH 2 CH 2 CH 2 CH 2 NH 2 . Его часто записывают как H 2 N(CH 2 ) 4 NH 2 , чтобы указать, что имеется четыре фрагмента CH 2 , связанных вместе.

- Ответить на
CHCl 3
- Ответ б
Н 2 Н 4
- Ответ c
С 4 Н 12 С 2
Ионные соединения
Вещества, описанные в предыдущем обсуждении, состоят из электрически нейтральных молекул; то есть количество положительно заряженных протонов в ядре равно количеству отрицательно заряженных электронов.Напротив, ионы представляют собой атомы или группы атомов, которые имеют общий электрический заряд. Ионы, содержащие меньше электронов, чем протоны, имеют суммарный положительный заряд и называются катионами. И наоборот, ионы, содержащие больше электронов, чем протонов, имеют суммарный отрицательный заряд и называются анионами. Ионные соединения содержат как катионы, так и анионы в соотношении, которое приводит к отсутствию общего электрического заряда.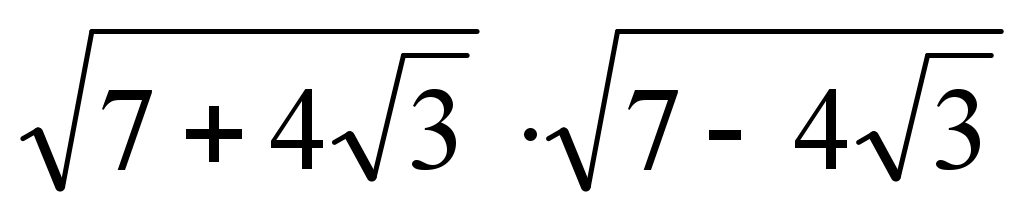
Примечание
Ионные соединения содержат как катионы, так и анионы в соотношении, которое приводит к нулевому электрическому заряду .
Рисунок \(\PageIndex{5}\): Ковалентная и ионная связи. (а) В молекулярном водороде (H 2 ) два атома водорода делят два электрона, образуя ковалентную связь. (б) Ионное соединение NaCl образуется при переносе электронов от атомов натрия к атомам хлора. Образовавшиеся ионы Na + и Cl — образуют трехмерное твердое тело, которое удерживается вместе притягивающими электростатическими взаимодействиями. В ковалентных соединениях электроны распределяются между связанными атомами и одновременно притягиваются более чем к одному ядру.Напротив, ионные соединения содержат катионы и анионы, а не дискретные нейтральные молекулы. Ионные соединения удерживаются вместе благодаря притягивающим электростатическим взаимодействиям между катионами и анионами. В ионном соединении катионы и анионы расположены в пространстве, образуя расширенный трехмерный массив, который максимизирует количество электростатических взаимодействий притяжения и минимизирует количество электростатических взаимодействий отталкивания (рис. \(\PageIndex{5}\)). Как показано в уравнении 3.1.1, электростатическая энергия взаимодействия между двумя заряженными частицами пропорциональна произведению зарядов частиц и обратно пропорциональна расстоянию между ними:
\(\PageIndex{5}\)). Как показано в уравнении 3.1.1, электростатическая энергия взаимодействия между двумя заряженными частицами пропорциональна произведению зарядов частиц и обратно пропорциональна расстоянию между ними:
\[ \text {электростатическая энергия} \propto {Q_1Q_2 \over r} \label{3.1.1}\]
где
- \(Q_1\) и \(Q_2\) — электрические заряды частиц 1 и 2, а
- \(r\) — расстояние между ними.
Когда \(Q_1\) и \(Q_2\) оба положительны, что соответствует зарядам катионов, катионы отталкиваются друг от друга и электростатическая энергия положительна. Когда \(Q_1\) и \(Q_2\) оба отрицательны, что соответствует зарядам анионов, анионы отталкиваются друг от друга, и электростатическая энергия снова положительна.Электростатическая энергия отрицательна только тогда, когда заряды имеют противоположные знаки; то есть положительно заряженные виды притягиваются к отрицательно заряженным видам и наоборот. Как показано на рисунке \(\PageIndex{6}\), сила взаимодействия пропорциональна величине зарядов и уменьшается по мере увеличения расстояния между частицами.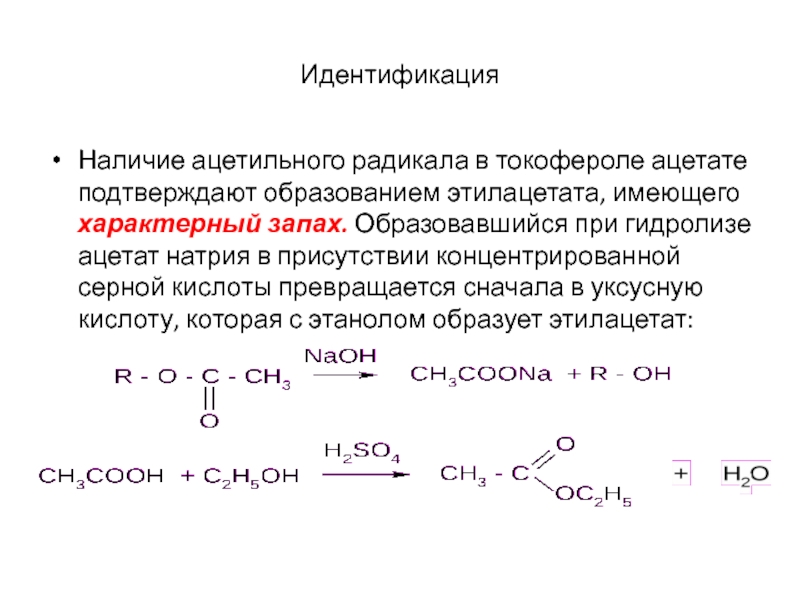 Эти энергетические факторы обсуждаются более подробно позже.
Эти энергетические факторы обсуждаются более подробно позже.
Примечание
Если электростатическая энергия положительна, частицы отталкиваются друг от друга; если электростатическая энергия отрицательна, частицы притягиваются друг к другу.
Одним из примеров ионного соединения является хлорид натрия (NaCl), образованный из натрия и хлора.При образовании химических соединений многие элементы имеют тенденцию приобретать или терять достаточно электронов, чтобы получить такое же количество электронов, как у ближайшего к ним инертного газа в периодической таблице. Когда натрий и хлор вступают в контакт, каждый атом натрия отдает электрон, чтобы стать ионом Na + с 11 протонами в ядре, но только 10 электронами (как у неона), и каждый атом хлора получает электрон, чтобы стать ионом Cl. Ион − с 17 протонами в ядре и 18 электронами (как у аргона), как показано в части (b) на рисунке \(\PageIndex{5}\).Твердый хлорид натрия содержит равное количество катионов (Na + ) и анионов (Cl — ), таким образом сохраняя электрическую нейтральность. Каждый ион Na + окружен 6 ионами Cl — , а каждый ион Cl — окружен 6 ионами Na + . Из-за большого количества взаимодействий притяжения Na + Cl — общая электростатическая энергия притяжения в NaCl велика.
Ион − с 17 протонами в ядре и 18 электронами (как у аргона), как показано в части (b) на рисунке \(\PageIndex{5}\).Твердый хлорид натрия содержит равное количество катионов (Na + ) и анионов (Cl — ), таким образом сохраняя электрическую нейтральность. Каждый ион Na + окружен 6 ионами Cl — , а каждый ион Cl — окружен 6 ионами Na + . Из-за большого количества взаимодействий притяжения Na + Cl — общая электростатическая энергия притяжения в NaCl велика.
В соответствии с тенденцией иметь то же количество электронов, что и ближайший благородный газ, при образовании ионов элементы в группах 1, 2 и 3 имеют тенденцию терять один, два и три электрона соответственно с образованием катионов, таких как Na + и Mg 2 + .Тогда у них такое же количество электронов, как у ближайшего инертного газа: неона. Точно так же K + , Ca 2 + и Sc 3 + имеют по 18 электронов, как и ближайший благородный газ: аргон. Кроме того, элементы группы 13 теряют три электрона с образованием катионов, таких как Al 3 + , снова достигая того же количества электронов, что и ближайший к ним инертный газ в периодической таблице. Поскольку лантаниды и актиниды формально принадлежат к группе 3, наиболее распространенным ионом, образованным этими элементами, является M 3 + , где M представляет собой металл.И наоборот, элементы в группах 17, 16 и 15 часто реагируют, чтобы получить один, два и три электрона, соответственно, с образованием таких ионов, как Cl — , S 2 — и P 3 — . Такие ионы, которые содержат только один атом, называются одноатомными ионами. Заряды большинства одноатомных ионов, полученных из элементов основной группы, можно предсказать, просто взглянув на периодическую таблицу и подсчитав, сколько столбцов элемента находится с крайнего левого или правого края. Например, барий (в группе 2) образует Ba 2 + , чтобы иметь то же количество электронов, что и его ближайший благородный газ, ксенон; кислород (в группе 16) образует O 2− , чтобы иметь то же количество электронов, что и неон; а цезий (в группе 1) образует Cs + , который имеет такое же количество электронов, как ксенон.
Кроме того, элементы группы 13 теряют три электрона с образованием катионов, таких как Al 3 + , снова достигая того же количества электронов, что и ближайший к ним инертный газ в периодической таблице. Поскольку лантаниды и актиниды формально принадлежат к группе 3, наиболее распространенным ионом, образованным этими элементами, является M 3 + , где M представляет собой металл.И наоборот, элементы в группах 17, 16 и 15 часто реагируют, чтобы получить один, два и три электрона, соответственно, с образованием таких ионов, как Cl — , S 2 — и P 3 — . Такие ионы, которые содержат только один атом, называются одноатомными ионами. Заряды большинства одноатомных ионов, полученных из элементов основной группы, можно предсказать, просто взглянув на периодическую таблицу и подсчитав, сколько столбцов элемента находится с крайнего левого или правого края. Например, барий (в группе 2) образует Ba 2 + , чтобы иметь то же количество электронов, что и его ближайший благородный газ, ксенон; кислород (в группе 16) образует O 2− , чтобы иметь то же количество электронов, что и неон; а цезий (в группе 1) образует Cs + , который имеет такое же количество электронов, как ксенон. Обратите внимание, что этот метод неэффективен для большинства переходных металлов, как обсуждалось в разделе 2.3. Некоторые распространенные одноатомные ионы перечислены в таблице \(\PageIndex{2}\).
Обратите внимание, что этот метод неэффективен для большинства переходных металлов, как обсуждалось в разделе 2.3. Некоторые распространенные одноатомные ионы перечислены в таблице \(\PageIndex{2}\).
Примечание
Элементы групп 1, 2 и 3 склонны образовывать ионы 1+, 2+ и 3+ соответственно; элементы в группах 15, 16 и 17 имеют тенденцию образовывать ионы 3-, 2- и 1- соответственно.
| Группа 1 | Группа 2 | Группа 3 | Группа 13 | Группа 15 | Группа 16 | Группа 17 |
|---|---|---|---|---|---|---|
Ли + литий | Be 2 + бериллий | Н 3− нитрид (азид) | О 2− оксид | Ф − фторид | ||
На + натрий | мг 2 + магний | Ал 3 + алюминий | Р 3- фосфид | С 2− сульфид | Кл − хлорид | |
К + калий | Ca 2 + кальций | Sc 3 + скандий | Ga 3 + галлий | Как 3 − арсенид | Se 2 − селенид | Бр − бромид |
руб. рубидий | Ср 2 + стронций | Д 3 + иттрий | В 3 + индий | Те 2 − теллурид | I − йодид | |
Cs + цезий | Ва 2 + барий | Ла 3 + лантан |
Пример \(\PageIndex{3}\)
Предсказать заряд наиболее распространенного одноатомного иона, образованного каждым элементом.
- алюминий, используемый в квантовых логических часах, самых точных часах в мире
- селен, используемый для производства стекла рубинового цвета
- иттрий, используемый для изготовления высокоэффективных свечей зажигания
Дано : элемент
По запросу : ионный заряд
Стратегия :
A Определите группу в периодической таблице, к которой принадлежит элемент. Основываясь на его положении в периодической таблице, решите, является ли элемент металлом, который имеет тенденцию терять электроны; неметалл, который имеет тенденцию приобретать электроны; или полуметалл, который может сделать и то, и другое.
B Найдя ближайший к элементу благородный газ, определите, какое количество электронов элемент должен получить или потерять, чтобы иметь такое же количество электронов, как у ближайшего благородного газа.
Решение :
- A Алюминий — металл 13 группы; следовательно, он будет иметь тенденцию терять электроны. B Ближайший благородный газ к алюминию – неон. Алюминий потеряет три электрона, чтобы сформировать ион Al 3 + , который имеет такое же количество электронов, как и неон.
- A Селен является неметаллом 16-й группы, поэтому он склонен приобретать электроны. B Ближайшим благородным газом является криптон, поэтому мы предсказываем, что селен получит два электрона, чтобы сформировать ион Se 2 − , который имеет такое же количество электронов, как и криптон.
- A Иттрий относится к группе 3, и элементы этой группы представляют собой металлы, склонные терять электроны. B Ближайшим благородным газом к иттрию является криптон, поэтому, по прогнозам, иттрий потеряет три электрона с образованием Y 3 + , который имеет то же количество электронов, что и криптон.

Упражнение \(\PageIndex{3}\)
Предсказать заряд наиболее распространенного одноатомного иона, образованного каждым элементом.
- кальций, используемый для профилактики остеопороза
- йод, необходимый для синтеза гормонов щитовидной железы
- цирконий, широко используемый в ядерных реакторах
Ответ :
- Ca 2 +
- I −
- Zr 4 +
Молекулярные и ионные соединения: https://youtu.be/zJejgCll1bw
Физические свойства ионных и ковалентных соединений
В общем, ионные и ковалентные соединения имеют разные физические свойства. Ионные соединения образуют твердые кристаллические вещества, плавящиеся при высоких температурах и устойчивые к испарению. Эти свойства обусловлены характерной внутренней структурой ионного твердого тела, схематически показанной в части (a) на рисунке \(\PageIndex{8}\), на котором показан трехмерный массив чередующихся положительных и отрицательных ионов, удерживаемых вместе сильным электростатическим притяжением.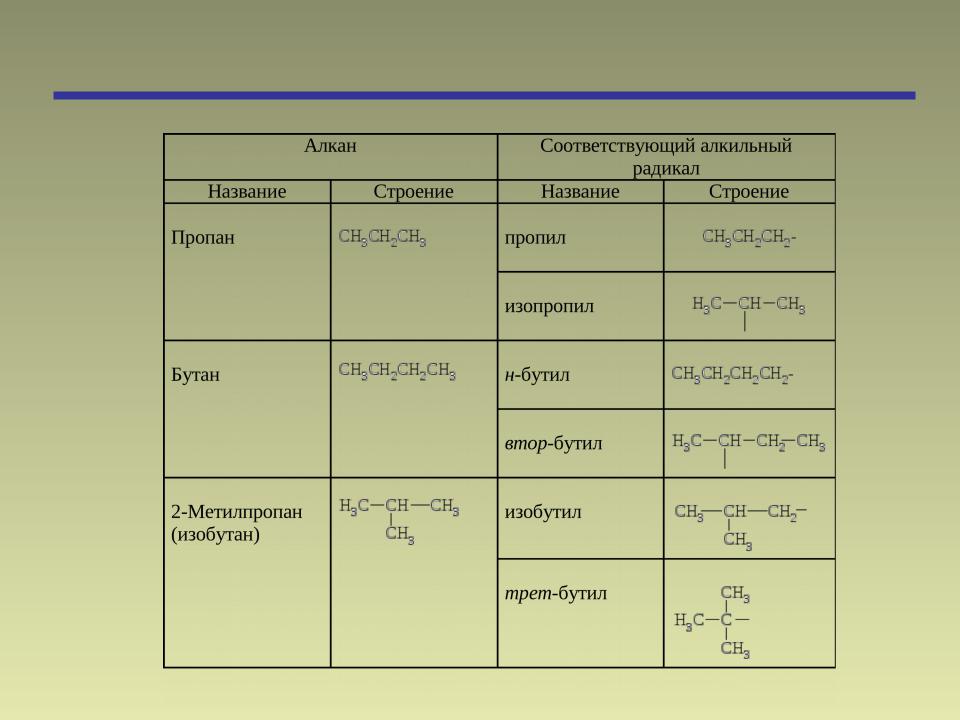 .Напротив, как показано в части (b) на рисунке \(\PageIndex{8}\), большинство ковалентных соединений состоят из отдельных молекул, удерживаемых вместе сравнительно слабыми межмолекулярными силами (силами между молекулами), даже если атомы внутри каждой молекулы удерживаются прочными внутримолекулярными ковалентными связями (силами внутри молекулы). Ковалентные вещества могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении, в зависимости от силы межмолекулярных взаимодействий. Ковалентные молекулярные твердые вещества имеют тенденцию образовывать мягкие кристаллы, которые плавятся при низких температурах и легко испаряются.Однако некоторые ковалентные вещества не являются молекулярными, а состоят из бесконечных трехмерных массивов ковалентно связанных атомов и включают некоторые из самых твердых известных материалов, таких как алмаз. Эта тема будет затронута в другом месте. Ковалентные связи, которые удерживают атомы вместе в молекулах, не изменяются, когда ковалентные вещества плавятся или испаряются, поэтому образуется жидкость или пар из независимых молекул.
.Напротив, как показано в части (b) на рисунке \(\PageIndex{8}\), большинство ковалентных соединений состоят из отдельных молекул, удерживаемых вместе сравнительно слабыми межмолекулярными силами (силами между молекулами), даже если атомы внутри каждой молекулы удерживаются прочными внутримолекулярными ковалентными связями (силами внутри молекулы). Ковалентные вещества могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении, в зависимости от силы межмолекулярных взаимодействий. Ковалентные молекулярные твердые вещества имеют тенденцию образовывать мягкие кристаллы, которые плавятся при низких температурах и легко испаряются.Однако некоторые ковалентные вещества не являются молекулярными, а состоят из бесконечных трехмерных массивов ковалентно связанных атомов и включают некоторые из самых твердых известных материалов, таких как алмаз. Эта тема будет затронута в другом месте. Ковалентные связи, которые удерживают атомы вместе в молекулах, не изменяются, когда ковалентные вещества плавятся или испаряются, поэтому образуется жидкость или пар из независимых молекул. Например, при комнатной температуре метан, основной компонент природного газа, представляет собой газ, состоящий из дискретных молекул CH 4 .Сравнение различных физических свойств ионных соединений и ковалентных молекулярных веществ приведено в таблице \(\PageIndex{3}\).
Например, при комнатной температуре метан, основной компонент природного газа, представляет собой газ, состоящий из дискретных молекул CH 4 .Сравнение различных физических свойств ионных соединений и ковалентных молекулярных веществ приведено в таблице \(\PageIndex{3}\).
| Ионные соединения | Ковалентные молекулярные вещества |
|---|---|
| твердые вещества | газы, жидкости или мягкие твердые вещества |
| высокие температуры плавления | низкая температура плавления |
| энергонезависимый | летучий |
Рисунок \(\PageIndex{8}\): Взаимодействие в ионных и ковалентных твердых телах.
 (а) Положительно и отрицательно заряженные ионы в ионном твердом веществе, таком как хлорид натрия (NaCl), удерживаются вместе за счет сильных электростатических взаимодействий. (b) В этом представлении упаковки молекул метана (Ch5) в твердом метане, прототипе молекулярного твердого тела, молекулы метана удерживаются вместе в твердом теле только относительно слабыми межмолекулярными силами, даже если атомы внутри каждой молекулы метана удерживаются. вместе прочными ковалентными связями.
(а) Положительно и отрицательно заряженные ионы в ионном твердом веществе, таком как хлорид натрия (NaCl), удерживаются вместе за счет сильных электростатических взаимодействий. (b) В этом представлении упаковки молекул метана (Ch5) в твердом метане, прототипе молекулярного твердого тела, молекулы метана удерживаются вместе в твердом теле только относительно слабыми межмолекулярными силами, даже если атомы внутри каждой молекулы метана удерживаются. вместе прочными ковалентными связями. Когда химики синтезируют новое соединение, они могут еще не знать его молекулярную или структурную формулу.В таких случаях обычно начинают с определения его эмпирической формулы, относительных чисел атомов элементов в соединении, приведенных к наименьшим целым числам. Поскольку эмпирическая формула основана на экспериментальных измерениях количества атомов в образце соединения, она показывает только отношения количества присутствующих элементов. Разницу между эмпирическими и молекулярными формулами можно проиллюстрировать на примере бутана, ковалентного соединения, используемого в качестве топлива в одноразовых зажигалках. Молекулярная формула бутана C 4 H 10 . Отношение атомов углерода к атомам водорода в бутане составляет 4:10, что может быть уменьшено до 2:5. Таким образом, эмпирическая формула бутана C 2 H 5 . Формульная единица — это абсолютная группировка атомов или ионов, представленная эмпирической формулой соединения, ионного или ковалентного. Бутан имеет эмпирическую формулу C 2 H 5 , но он содержит две формульные единицы C 2 H 5 , что дает молекулярную формулу C 4 H 10 .
Молекулярная формула бутана C 4 H 10 . Отношение атомов углерода к атомам водорода в бутане составляет 4:10, что может быть уменьшено до 2:5. Таким образом, эмпирическая формула бутана C 2 H 5 . Формульная единица — это абсолютная группировка атомов или ионов, представленная эмпирической формулой соединения, ионного или ковалентного. Бутан имеет эмпирическую формулу C 2 H 5 , но он содержит две формульные единицы C 2 H 5 , что дает молекулярную формулу C 4 H 10 .
Поскольку ионные соединения не содержат дискретных молекул, для обозначения их состава используются эмпирические формулы. Все соединения, будь то ионные или ковалентные, должны быть электрически нейтральными. Следовательно, положительные и отрицательные заряды в формульной единице должны точно компенсировать друг друга. Если катион и анион имеют заряды одинаковой величины, например Na + и Cl — , то в соединении должно быть соотношение катионов к анионам 1:1, а эмпирическая формула должна быть NaCl. Если заряды не одинаковой величины, то для получения нейтрального соединения необходимо соотношение катион: анион, отличное от 1:1. Например, в случае Mg 2 + и Cl — два иона Cl — необходимы для уравновешивания двух положительных зарядов на каждом ионе Mg 2 + , что дает эмпирическую формулу MgCl 2 . Точно так же формула ионного соединения, содержащего ионы Na + и O 2– , имеет вид Na 2 O.
Если заряды не одинаковой величины, то для получения нейтрального соединения необходимо соотношение катион: анион, отличное от 1:1. Например, в случае Mg 2 + и Cl — два иона Cl — необходимы для уравновешивания двух положительных зарядов на каждом ионе Mg 2 + , что дает эмпирическую формулу MgCl 2 . Точно так же формула ионного соединения, содержащего ионы Na + и O 2– , имеет вид Na 2 O.
Примечание
Ионные соединения не содержат дискретных молекул, поэтому для обозначения их состава используются эмпирические формулы.
Бинарные ионные соединения
Ионное соединение, содержащее только два элемента, один в виде катиона, а другой в виде аниона, называется бинарным ионным соединением. Одним из примеров является MgCl 2 , коагулянт, используемый при приготовлении тофу из соевых бобов. Для бинарных ионных соединений нижние индексы в эмпирической формуле также можно получить путем пересечения зарядов: используйте абсолютное значение заряда одного иона в качестве нижнего индекса для другого иона. Этот метод схематично показан следующим образом:
Этот метод схематично показан следующим образом:
Плата за проезд . Одним из методов получения индексов в эмпирической формуле является скрещивание зарядов .
При пересечении зарядов иногда необходимо привести индексы к их простейшему соотношению, чтобы записать эмпирическую формулу. Рассмотрим, например, соединение, образованное Mg 2 + и O 2− . Использование абсолютных значений зарядов ионов в качестве нижних индексов дает формулу Mg 2 O 2 :
Это упрощает его правильную эмпирическую формулу MgO.Эмпирическая формула имеет один ион Mg 2 + и один ион O 2− .
Пример \(\PageIndex{4}\)
Напишите эмпирическую формулу простейшего бинарного ионного соединения, образованного каждым ионом или парой элементов.
- Ga 3 + и As 3 −
- Eu 3 + и O 2−
- кальций и хлор
Дано : ионы или элементы
Запрошено : эмпирическая формула для бинарного ионного соединения
Стратегия :
A Если не указано, определите заряды ионов на основе положения элементов в периодической таблице.
B Используйте абсолютное значение заряда каждого иона в качестве нижнего индекса для другого иона. Уменьшите индексы до наименьших чисел
, чтобы написать эмпирическую формулу. Убедитесь, что эмпирическая формула электрически нейтральна.
Раствор
а. B Использование абсолютных значений зарядов ионов в качестве нижних индексов дает Ga3As3:
Сокращение индексов до наименьших целых чисел дает эмпирическую формулу GaAs, электрически нейтральную [+3 + (-3) = 0].В качестве альтернативы мы могли бы признать, что Ga 3 + и As 3 — имеют заряды одинаковой величины, но разных знаков. Один ион Ga 3 + уравновешивает заряд одного иона As 3 — , и соединение 1:1 не будет иметь суммарного заряда. Поскольку мы пишем индексы только в том случае, если число больше 1, эмпирическая формула — GaAs. GaAs — это арсенид галлия, который широко используется в электронной промышленности в транзисторах и других устройствах.
б. B Поскольку Eu 3 + имеет заряд +3, а O 2− имеет заряд -2, соединение 1:1 будет иметь суммарный заряд +1. Поэтому мы должны найти кратные суммы зарядов, которые сокращаются. Перекрестим заряды, используя абсолютное значение заряда одного иона в качестве нижнего индекса для другого иона:
.Нижний индекс для Eu 3 + равен 2 (от O 2– ), а нижний индекс для O 2– равен 3 (от Eu 3 + ), что дает Eu2 0 3 ; индексы не могут быть сокращены дальше.Эмпирическая формула содержит положительный заряд 2 (+3) = +6 и отрицательный заряд 3 (-2) = -6, при общем заряде 0. Соединение Eu 2 O 3 является нейтральным. Оксид европия отвечает за красный цвет на экранах телевизоров и компьютеров.
в. A Поскольку заряды ионов не указаны, мы должны сначала определить заряды, ожидаемые для наиболее распространенных ионов, полученных из кальция и хлора. Кальций находится во 2-й группе, поэтому он должен потерять два электрона, чтобы образовать Ca 2 + .Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
Кальций находится во 2-й группе, поэтому он должен потерять два электрона, чтобы образовать Ca 2 + .Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
B Два иона Cl − необходимы для балансировки заряда одного иона Ca 2 + , что приводит к эмпирической формуле CaCl 2 . Мы также могли бы перекрестить заряды, используя абсолютное значение заряда Ca 2 + в качестве нижнего индекса для Cl и абсолютное значение заряда Cl − в качестве нижнего индекса для Ca:
.Нижние индексы в CaCl 2 не могут быть дополнительно сокращены.Эмпирическая формула электрически нейтральна [+2 + 2(-1) = 0]. Это соединение представляет собой хлорид кальция, одно из веществ, используемых в качестве «соли» для таяния льда на дорогах и тротуарах зимой.
Упражнение \(\PageIndex{4}\)
Напишите эмпирическую формулу простейшего бинарного ионного соединения, образованного каждым ионом или парой элементов.
- Li + и N 3−
- Al 3 + и O 2−
- литий и кислород
Ответ :
- Ли 3 Н
- Ал 2 О 3
- Ли 2 О
Многоатомные ионы
Многоатомные ионы представляют собой группы атомов, которые несут суммарный электрический заряд, хотя атомы в многоатомном ионе удерживаются вместе теми же ковалентными связями, что и атомы в молекулах.Точно так же, как видов молекул намного больше, чем простых элементов, многоатомных ионов гораздо больше, чем одноатомных. Двумя примерами многоатомных катионов являются ионы аммония (NH 4 + ) и метиламмония (CH 3 NH 3 + ). Многоатомных анионов гораздо больше, чем многоатомных катионов; некоторые распространенные примеры приведены в таблице \(\PageIndex{4}\).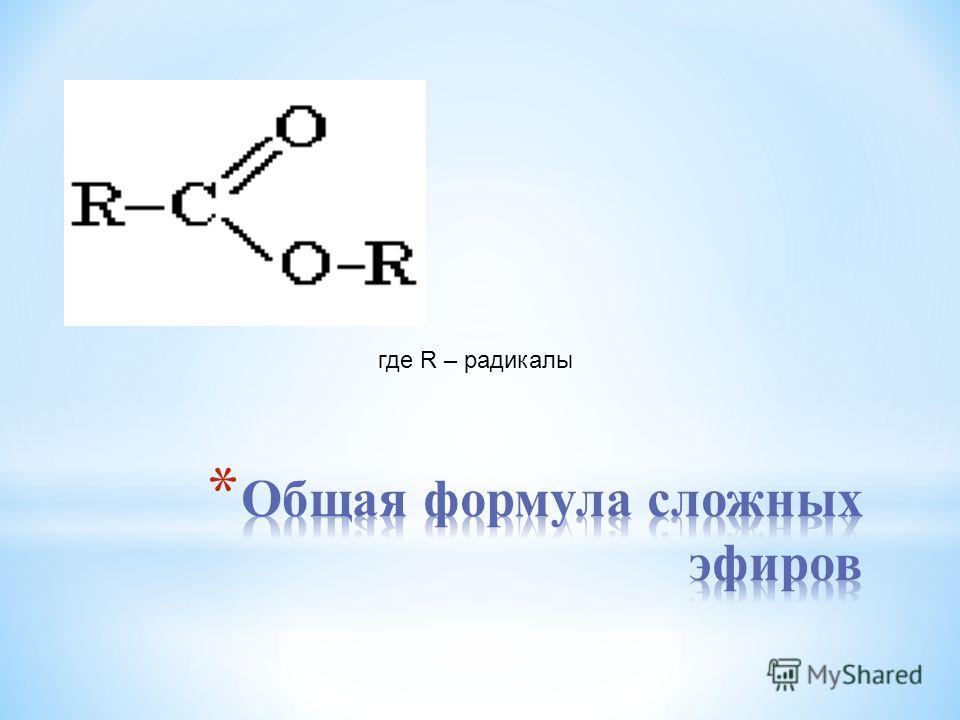
| Формула | Имя Иона |
|---|---|
| NH 4 + | аммоний |
| CH 3 NH 3 + | метиламмоний |
| ОХ − | гидроксид |
| О 2 2 − | перекись |
| CN − | цианид |
| SCN − | тиоцианат |
| НЕТ 2 − | нитрит |
| НЕТ 3 − | нитрат |
| СО 3 2 − | карбонат |
| ОХС 3 − | гидрокарбонат или бикарбонат |
| СО 3 2 − | сульфит |
| СО 4 2 − | сульфат |
| ХСО 4 − | гидросульфат или бисульфат |
| Заказ на поставку 4 3 − | фосфат |
| ГПО 4 2 − | гидрофосфат |
| H 2 Заказ на покупку 4 − | дигидрофосфат |
| ClO − | гипохлорит |
| ClO 2 − | хлорит |
| ClO 3 − | хлорат |
| ClO 4 − | перхлорат |
| MnO 4 − | перманганат |
| CrO4 2 − | хромат |
| Cr 2 O 7 2 − | дихромат |
| С 2 О 4 2 − | оксалат |
| ОХС 2 − | формиат |
| CH 3 CO 2 − | ацетат |
| C 6 H 5 CO 2 − | бензоат |
Метод, используемый для предсказания эмпирических формул для ионных соединений, содержащих одноатомные ионы, также можно использовать для соединений, содержащих многоатомные ионы. Общий заряд катионов должен уравновешивать общий заряд анионов в формульной единице. Таким образом, ионы K + и NO 3 − объединяются в соотношении 1: 1 с образованием KNO 3 (нитрат калия или селитра), основного ингредиента черного пороха. Точно так же Ca 2 + и SO 4 2 — образуют CaSO 4 (сульфат кальция), который соединяется с различным количеством воды с образованием гипса и гипса.Многоатомные ионы NH 4 + и NO 3 − образуют NH 4 NO 3 (аммиачная селитра), широко используемое удобрение и, в чужих руках, взрывчатое вещество. Одним из примеров соединения, в котором ионы имеют заряды разной величины, является фосфат кальция, который состоит из ионов Ca 2 + и PO 4 3 — ; это основной компонент костей. Соединение электрически нейтрально, потому что ионы объединяются в соотношении три иона Ca 2 + [3(+2) = +6] на каждые два иона [2(-3) = -6], что дает эмпирическое формула Ca 3 (PO 4 ) 2 ; скобки вокруг PO 4 в эмпирической формуле указывают на то, что это многоатомный ион.
Общий заряд катионов должен уравновешивать общий заряд анионов в формульной единице. Таким образом, ионы K + и NO 3 − объединяются в соотношении 1: 1 с образованием KNO 3 (нитрат калия или селитра), основного ингредиента черного пороха. Точно так же Ca 2 + и SO 4 2 — образуют CaSO 4 (сульфат кальция), который соединяется с различным количеством воды с образованием гипса и гипса.Многоатомные ионы NH 4 + и NO 3 − образуют NH 4 NO 3 (аммиачная селитра), широко используемое удобрение и, в чужих руках, взрывчатое вещество. Одним из примеров соединения, в котором ионы имеют заряды разной величины, является фосфат кальция, который состоит из ионов Ca 2 + и PO 4 3 — ; это основной компонент костей. Соединение электрически нейтрально, потому что ионы объединяются в соотношении три иона Ca 2 + [3(+2) = +6] на каждые два иона [2(-3) = -6], что дает эмпирическое формула Ca 3 (PO 4 ) 2 ; скобки вокруг PO 4 в эмпирической формуле указывают на то, что это многоатомный ион. Запись формулы фосфата кальция в виде Ca 3 P 2 O 8 дает правильный номер каждого атома в формульной единице, но затемняет тот факт, что соединение содержит легко идентифицируемый PO 4 3 − ионов.
Запись формулы фосфата кальция в виде Ca 3 P 2 O 8 дает правильный номер каждого атома в формульной единице, но затемняет тот факт, что соединение содержит легко идентифицируемый PO 4 3 − ионов.
Пример \(\PageIndex{5}\)
Напишите эмпирическую формулу соединения, образованного каждой парой ионов.
- Na + и HPO 4 2 −
- катион калия и анион цианида
- катион кальция и анион гипохлорита
Дано : ионы
Запрошено : эмпирическая формула для ионного соединения
Стратегия :
A Если он не указан, определите заряд одноатомного иона по его местоположению в периодической таблице.Используйте таблицу \(\PageIndex{4}\) «Общие многоатомные ионы и их названия», чтобы найти заряд многоатомного иона.
B Используйте абсолютное значение заряда каждого иона в качестве нижнего индекса для другого иона. При написании эмпирической формулы сократите индексы до наименьших целых чисел.
Решение :
а. B Поскольку HPO 4 2 − имеет заряд −2, а Na + имеет заряд +1, эмпирическая формула требует двух ионов Na + , чтобы сбалансировать заряд многоатомного иона. , давая Na 2 HPO 4 .Нижние индексы уменьшены до наименьших чисел, поэтому эмпирическая формула Na 2 HPO 4 . Это соединение представляет собой гидрофосфат натрия, который используется для придания текстуры плавленым сырам, пудингам и завтракам быстрого приготовления.
б. A Катион калия K + , анион цианида CN − . B Поскольку величина заряда каждого иона одинакова, эмпирическая формула — KCN. Цианистый калий очень токсичен, и одно время его использовали в качестве крысиного яда.Однако это использование было прекращено, потому что слишком много людей отравились случайно.
Цианистый калий очень токсичен, и одно время его использовали в качестве крысиного яда.Однако это использование было прекращено, потому что слишком много людей отравились случайно.
в. A Катион кальция Ca 2 + , анион гипохлорита ClO − . B Два иона ClO − необходимы для балансировки заряда одного иона Ca 2 + , что дает Ca(ClO) 2 . Нижние индексы не могут быть сокращены дальше, поэтому эмпирическая формула Ca(ClO) 2 . Это гипохлорит кальция, «хлор», используемый для очистки воды в плавательных бассейнах.
Упражнение \(\PageIndex{5}\)
Напишите эмпирическую формулу соединения, образованного каждой парой ионов.
- Ca 2 + и H 2 PO 4 −
- катион натрия и анион бикарбоната
- катион аммония и сульфат-анион
Ответ :
- Ca(H 2 PO 4 ) 2 : дигидрофосфат кальция является одним из ингредиентов разрыхлителя.

- NaHCO 3 : бикарбонат натрия содержится в антацидах и разрыхлителях; в чистом виде он продается как пищевая сода.
- (NH 4 ) 2 SO 4 : сульфат аммония является распространенным источником азота в удобрениях.
Резюме
- Существует два принципиально разных типа химических связей (ковалентная и ионная), которые придают веществам очень разные свойства.
- Состав соединения представлен эмпирической или молекулярной формулой, каждая из которых состоит как минимум из одной формульной единицы.Авторы
Атомы в химических соединениях удерживаются вместе притягивающими электростатическими взаимодействиями, известными как химические связи. Ионные соединения содержат положительно и отрицательно заряженные ионы в соотношении, при котором общий заряд равен нулю. Ионы удерживаются вместе в регулярном пространственном расположении электростатическими силами. Большинство ковалентных соединений состоят из молекул, групп атомов, в которых одна или несколько пар электронов являются общими по крайней мере для двух атомов, образуя ковалентную связь. Атомы в молекулах удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, общими для ядер. Молекулярная формула ковалентного соединения указывает типы и количество присутствующих атомов. Соединения, которые содержат преимущественно углерод и водород, называются органическими соединениями, тогда как соединения, которые состоят в основном из элементов, отличных от углерода и водорода, являются неорганическими соединениями. Двухатомные молекулы содержат два атома, а многоатомные молекулы содержат более двух.Структурная формула указывает состав и приблизительную структуру и форму молекулы. Одинарные связи, двойные связи и тройные связи представляют собой ковалентные связи, в которых одна, две и три пары электронов соответственно являются общими для двух связанных атомов. Атомы или группы атомов, обладающие суммарным электрическим зарядом, называются ионами; они могут иметь как положительный заряд (катионы), так и отрицательный заряд (анионы).
Атомы в молекулах удерживаются вместе за счет электростатического притяжения между положительно заряженными ядрами связанных атомов и отрицательно заряженными электронами, общими для ядер. Молекулярная формула ковалентного соединения указывает типы и количество присутствующих атомов. Соединения, которые содержат преимущественно углерод и водород, называются органическими соединениями, тогда как соединения, которые состоят в основном из элементов, отличных от углерода и водорода, являются неорганическими соединениями. Двухатомные молекулы содержат два атома, а многоатомные молекулы содержат более двух.Структурная формула указывает состав и приблизительную структуру и форму молекулы. Одинарные связи, двойные связи и тройные связи представляют собой ковалентные связи, в которых одна, две и три пары электронов соответственно являются общими для двух связанных атомов. Атомы или группы атомов, обладающие суммарным электрическим зарядом, называются ионами; они могут иметь как положительный заряд (катионы), так и отрицательный заряд (анионы). Ионы могут состоять из одного атома (одноатомные ионы) или нескольких (многоатомные ионы). Заряды одноатомных ионов большинства элементов основной группы можно предсказать по положению элемента в периодической таблице.Ионные соединения обычно образуют твердые кристаллические вещества с высокими температурами плавления. Ковалентные молекулярные соединения, напротив, состоят из отдельных молекул, удерживаемых вместе слабыми межмолекулярными силами, и могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении.
Ионы могут состоять из одного атома (одноатомные ионы) или нескольких (многоатомные ионы). Заряды одноатомных ионов большинства элементов основной группы можно предсказать по положению элемента в периодической таблице.Ионные соединения обычно образуют твердые кристаллические вещества с высокими температурами плавления. Ковалентные молекулярные соединения, напротив, состоят из отдельных молекул, удерживаемых вместе слабыми межмолекулярными силами, и могут быть газами, жидкостями или твердыми телами при комнатной температуре и давлении.
Эмпирическая формула дает относительные числа атомов элементов в соединении, приведенные к наименьшим целым числам. Формульная единица — это абсолютная группировка, представленная эмпирической формулой соединения, ионного или ковалентного.Эмпирические формулы особенно полезны для описания состава ионных соединений, не содержащих легко идентифицируемых молекул. Некоторые ионные соединения встречаются в виде гидратов, которые содержат определенное соотношение слабо связанных молекул воды, называемых гидратными водами.
Квантово-химические расчеты для более чем 200 000 видов органических радикалов и 40 000 связанных молекул с замкнутой оболочкой
Cheng, G.J., Zhang, X., Chung, L.W., Xu, L. & Wu, Y.D. Вычислительная органическая химия: соединение теории и эксперимента в установлении механизмов химических реакций. Дж. Ам. хим. соц. 137 , 1706–1725 (2015).
КАС Статья Google ученый
Мессерли, Р. А. и др. . К количественному прогнозированию чувствительности времени задержки воспламенения к коэффициенту эквивалентности топлива и воздуха. Сгорел. Пламя 214 , 103–115 (2020).
КАС Статья Google ученый
Ким С. и др. . Экспериментальное и теоретическое понимание склонности изомеров метилциклогексена к образованию сажи. Проц. Сгорел. Инст. 37 , 1083–1090 (2019).
Проц. Сгорел. Инст. 37 , 1083–1090 (2019).
КАС Статья Google ученый
Аткинсон Р. и Арей Дж. Газофазная тропосферная химия биогенных летучих органических соединений: обзор. Атмос. Окружающая среда. 37 , 197–219 (2003).
ОБЪЯВЛЕНИЕ Статья Google ученый
Houmam, A. Реакции, инициированные переносом электрона: образование связи и диссоциация связи. Хим. Ред. 108 , 2180–2237 (2008 г.).
КАС Статья Google ученый
Coote, M.L. In Encyclo pedia o f Pol ymer Science and Technology 3rd edn (ed.Kroschwitz, J.I.) Comp utational Qu antum Chemistry for Free-Radical Polymerization (JohnWiley and Sons, 2004).
Ким С. и др. . Вычислительное исследование энтальпий диссоциации связи для большого диапазона нативных и модифицированных лигнинов. J. Phys. хим. лат. 2 , 2846–2852 (2011).
КАС Статья Google ученый
Конарчик, Й.Л., Гринвуд, Дж. В., Алегре-Рекена, Дж. В., Патон, Р. С. и МакНалли, А. Реакция кросс-сочетания пиридин-пиридин через деароматизированные радикальные промежуточные соединения. Анжю. Хеми — Междунар. Эд 58 , 14882–14886 (2019).
КАС Статья Google ученый
Гилмер Дж., Шенхольц С.С., Райли П.Ф., Виньялс О. и Даль Г.Э. Передача нейронных сообщений для квантовой химии. архив: 1704.01212 (2017).
Фабер, Ф. А. и др. . Ошибки прогнозирования моделей молекулярного машинного обучения ниже, чем ошибка гибридного ДПФ. J. Chem. Теория вычисл. 13 , 5255–5264 (2017).
J. Chem. Теория вычисл. 13 , 5255–5264 (2017).
КАС Статья Google ученый
Шютт К.Т., Арбабзадах Ф., Чмиела С., Мюллер К.Р. и Ткатченко А. Квантово-химические выводы из глубоких тензорных нейронных сетей. Нац. коммун. 8 , 13890–13898 (2017).
ОБЪЯВЛЕНИЕ Статья Google ученый
Батталья, П. В. и др. . Относительные индуктивные смещения, глубокое обучение и графовые сети. arXiv:1806.01261 cs.LG (2018).
Кирнс, С., Макклоски, К., Берндл, М., Панде, В. и Райли, П. Молекулярные свертки графа: выход за рамки отпечатков пальцев. Дж. Вычисл. Помощь. Мол. Дес. 30 , 595–608 (2016).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Смит, Дж. С., Исаев, О. и Ройтберг, А. Е. АНИ-1: потенциал расширяемой нейронной сети с точностью ТПФ при затратах на вычисление силового поля. Хим. науч. 8 , 3192–3203 (2017).
КАС Статья Google ученый
Синицкий А. В. и Панде В. С. Глубокая нейронная сеть вычисляет плотность и энергию электронов большого набора органических молекул быстрее, чем теория функционала плотности (DFT). архив: 1809.02723 (2018).
Сент-Джон, П. К., Гуан, Ю., Ким, Ю., Ким, С. и Патон, Р. С. Прогнозирование энтальпий диссоциации гомолитической органической связи с почти химической точностью и вычислительными затратами менее секунды. Нац. коммун. 11 , 1–12 (2020).
ОБЪЯВЛЕНИЕ Google ученый
Грэмбоу, К. А., Ли, Ю.-П. и Грин, У. Х. Точная термохимия с небольшими наборами данных: подход к исправлению аддитивности связи и переносу обучения. J. Phys. хим. А 123 , 5826–5835 (2019).
J. Phys. хим. А 123 , 5826–5835 (2019).
КАС Статья Google ученый
Альварес-Морено, М. и др. . Управление проблемой больших данных вычислительной химии: платформа ioChem-BD. J. Chem. Инф. Модель. 55 , 95–103 (2015).
Артикул Google ученый
Рамакришнан Р., Драл П.О., Рупп М. и фон Лилиенфельд О.А. Структуры и свойства квантовой химии 134-килограммовых молекул. наук. Данные 1 , 191–197 (2014).
Артикул Google ученый
Смит, Дж. С., Исаев, О. и Ройтберг, А. Э. Дескриптор данных: ANI-1, набор данных из 20 миллионов рассчитанных неравновесных конформаций для органических молекул. наук. Данные 4 , 1–8 (2017).
Артикул Google ученый
Грэмбоу, К., Паттанаик Л. и Грин У. Х. Реагенты, продукты и переходные состояния элементарных химических реакций на основе квантовой химии. ChemRxiv. Препринт , https://doi.org/10.26434/chemrxiv.11400240.v2 (2019)
Рупп М., Ткатченко А., Мюллер К.-Р. и фон Лилиенфельд, О. А. Быстрое и точное моделирование энергий молекулярного распыления с помощью машинного обучения. Физ. Преподобный Летт. 108 , 058301 (2012).
ОБЪЯВЛЕНИЕ Статья Google ученый
Смит, Дж.С., Небген Б., Любберс Н., Исаев О. и Ройтберг А. Э. Меньше значит больше: выборка химического пространства с активным обучением. J. Chem. Физ . 148 (2018).
Смит, Дж. С. и др. . Приближение к точности связанных кластеров с потенциалом нейронной сети общего назначения посредством трансферного обучения. Нац. коммун.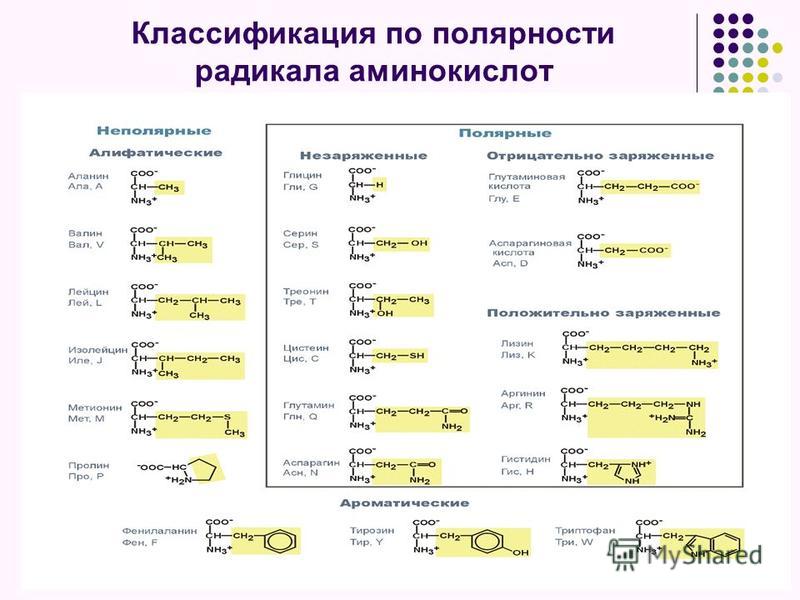 10 , 2903 (2019).
10 , 2903 (2019).
ОБЪЯВЛЕНИЕ Статья Google ученый
Ким С. и др. . Обновление PubChem 2019: улучшен доступ к химическим данным. Рез. нуклеиновых кислот. 47 , Д1102–Д1109 (2018).
Артикул Google ученый
Zhao, Y. & Truhlar, DG Набор функционалов плотности M06 для термохимии основных групп, термохимической кинетики, нековалентных взаимодействий, возбужденных состояний и переходных элементов: два новых функционала и систематическое тестирование четырех функционалов класса M06 и 12 другая функция. Теор. хим. Акк. 120 , 215–241 (2007).
Артикул Google ученый
Frisch, M.J. и др. . Гауссиан 16 Ред. C.01. Гауссов 16 (2016).
Джон, П. С. и др. . BDE-db: набор из 290 664 гомолитических энтальпий диссоциации связи для малых органических молекул. figshare https://doi.org/10.6084/m9.figshare.10248932.v1 (2019).
С. и др. . BDE-db: набор из 290 664 гомолитических энтальпий диссоциации связи для малых органических молекул. figshare https://doi.org/10.6084/m9.figshare.10248932.v1 (2019).
Ландрам, Г. А. RDKit: хемоинформатика с открытым исходным кодом, http://www.rdkit.org (2020).
Халгрен, Т. А. Мерк Молекулярное силовое поле. I. Основа, форма, объем, параметризация и производительность MMFF94. Дж. Вычисл. хим. 17 , 490–519 (1996).
КАС Статья Google ученый
Риникер, С. и Ландрам, Г. А. Более информированная дистанционная геометрия: использование того, что мы знаем, для улучшения генерации конформации. J. Chem. Инф. Модель. 55 , 2562–2574 (2015).
КАС Статья Google ученый
O’Boyle, N.M. и др. . Open Babel: открытый химический набор инструментов. Ж. Хеминформ. 3 , 33 (2011).
. Open Babel: открытый химический набор инструментов. Ж. Хеминформ. 3 , 33 (2011).
Артикул Google ученый
О’Бойл, Н. М., Тендерхолт, А. Л. и Лангнер, К. М. cclib: библиотека для независимых от пакетов алгоритмов вычислительной химии. Дж. Вычисл. хим. 29 , 839–845 (2008).
Артикул Google ученый
St John, PC и др. . Квантово-химические расчеты для более чем 200 000 видов органических радикалов и 40 000 связанных с ними молекул с замкнутой оболочкой. figshare https://doi.org/10.6084/m9.figshare.c.45 (2020).
Кордеро, Б. и др. . Еще раз о ковалентных радиусах. далт.Транс . 2832–2838 (2008 г.).
От стабильных Sb- и Bi-центрированных радикалов к соединению с двойной связью Ga=Sb
Общие методы
Манипуляции проводили в сухой бескислородной атмосфере аргона с реагентами, растворенными или суспендированными в апротонных растворителях и комбинированные или изолированные с использованием методов канюли и перчаточного ящика. 1 – 4 синтезированы реакциями LGa с Cp*SbCl 2 или Cp*BiI 2 в различных мольных соотношениях, а 5 эквимолярной реакцией 1 0 20 9 9 0 соответственно , в растворе толуола и выделяют низкотемпературной кристаллизацией. 1 – 5 охарактеризованы методами элементного анализа, многоядерного ЯМР (диамагнитные соединения 2 , 3 , 5 ) и ЭПР-спектроскопии (парамагнитные соединения 1 ,6 ). Спектры ЭПР с разверткой поля X и Q были измерены как для твердых веществ в атмосфере N 2 , так и для замороженных растворов в гексане ( 1 ) и толуоле ( 4 ). Магнитные моменты для 1 и 4 определяли методом Эванса (фаза растворения) и с помощью СКВИД-сусцептометра ( 4 , твердотельный) с полем 1.0 T в диапазоне температур 2–300 K. DFT, реализованный в программном пакете ab initio для квантовой химии ORCA, использовался для расчета геометрии молекул, орбитальных энергий и составов.
1 – 4 синтезированы реакциями LGa с Cp*SbCl 2 или Cp*BiI 2 в различных мольных соотношениях, а 5 эквимолярной реакцией 1 0 20 9 9 0 соответственно , в растворе толуола и выделяют низкотемпературной кристаллизацией. 1 – 5 охарактеризованы методами элементного анализа, многоядерного ЯМР (диамагнитные соединения 2 , 3 , 5 ) и ЭПР-спектроскопии (парамагнитные соединения 1 ,6 ). Спектры ЭПР с разверткой поля X и Q были измерены как для твердых веществ в атмосфере N 2 , так и для замороженных растворов в гексане ( 1 ) и толуоле ( 4 ). Магнитные моменты для 1 и 4 определяли методом Эванса (фаза растворения) и с помощью СКВИД-сусцептометра ( 4 , твердотельный) с полем 1.0 T в диапазоне температур 2–300 K. DFT, реализованный в программном пакете ab initio для квантовой химии ORCA, использовался для расчета геометрии молекул, орбитальных энергий и составов.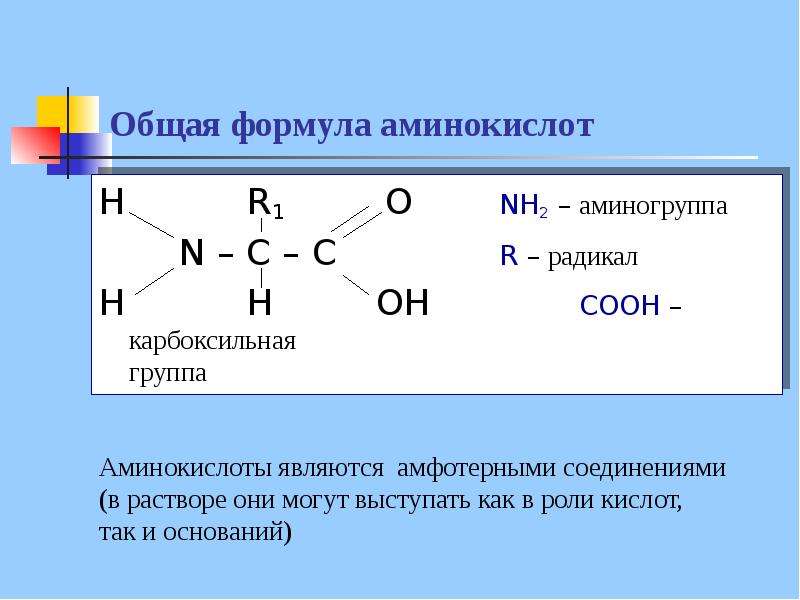 Дополнительная информация о синтетических, спектроскопических, кристаллографических и вычислительных методах приведена в дополнительных методах.
Дополнительная информация о синтетических, спектроскопических, кристаллографических и вычислительных методах приведена в дополнительных методах.
Синтез [L(Cl)Ga]
2 Sb· 1 и L(Cl)GaSb(H)Cp* 2 Смесь LGa (0,297 г, 0,610 ммоль) и Cp*SbCl 2 ( 0,1 г, 0.305 ммоль) в 2 мл бензола перемешивали при комнатной температуре в течение 7 дней. Растворители удаляли при пониженном давлении, а остаток растворяли в 2 мл гексана. Темно-красный раствор выдерживали при комнатной температуре в течение 3 дней с получением темно-красных и крошечных желтых кристаллов. Красные кристаллы собирали вручную под микроскопом и фракционно кристаллизовали в 2 мл гексана. Фракционную кристаллизацию повторили дважды, получив аналитически чистую форму 1 . Выход: 181 мг (0,155 ммоль, 51%).М.п. 241 °С. Анальный. Расч. для C 58 H 82 N 4 Cl 2 Ga 2 Sb: C 59,67; Н, 7,08; Н, 4,80. Найдено: С 59,55; Н, 7,09; Н, 4,89%. ИК (чистый): ν 2957, 2926, 2865, 1521, 1436, 1380, 1313, 1258, 1178, 1098, 1019, 939, 865, 798, 755, 706, 638, 614, 528, 706, 638, 614, 528, 448 4 см 19048 4 см .
ИК (чистый): ν 2957, 2926, 2865, 1521, 1436, 1380, 1313, 1258, 1178, 1098, 1019, 939, 865, 798, 755, 706, 638, 614, 528, 706, 638, 614, 528, 448 4 см 19048 4 см .
Соединение 2 было выделено в виде бесцветных кристаллов (20 мг) при кристаллизации вышеуказанной реакционной смеси после перемешивания при комнатной температуре в течение 1 дня в 2 мл толуола при 8 °C.М.п. 135 °С (разл.). Анальный. Расч. для C 39 H 57 N 2 ClGaSb: C 59,99; Н, 7,36; Н, 3,59. Найдено: С 60,20; Н, 7,54; Н, 3,54%. ИК (в чистом виде): ν 2966, 2919, 2866, 1855, 1552, 1522, 1441, 1382, 1312, 1248, 1184, 1102, 1020, 933, 862, 798, 763, 635, 524 см −495, 4904 1 . 1 H ЯМР (C 6 D 6 , 300,1 МГц): Δ 7.23-7.02 (M, 6 H, C 6 H 3 ( I PR) 2 ), 4,95 (с, 1 H, γ -C H ), 3.92 ( 3 J HH HH = 6,6 Гц, 1 ч, -C H (CH 3 ) 2 ), 3. 81 ( 3 J HH = 6,9 Гц, 1 час, -C H (CH 3 ) 2 ), 3.28 ( 3 ), 3.28 ( 3 J HH = 6,6 Гц, 1 ч, -C H (CH 3 ) 2 ), 3.14 ( г. 3 J HH HH = 6,9 Гц, 1 ч, -C H (CH 3 ) 2 ), 2.73 (с, 1 H, Sb H ), 1,69 (с, 15 H, Cp * ), 1,65, 1,63 (м, 9 H, ArNCC H 9 3 , -СН(С Н 3 ) 2 ), 1,56 (г, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,34 (дд, 3 J HH = 6,6 Гц, 6 H, −CH(C H 3 ) 2 ), 1.23 (г, 3 J HH = 6.9 Гц, 3 H, −CH(C H 3 ) 2 ), 1,21 (г, 3 J HH = 6,9 Гц, 3 H, −CH(C H 3 ) 2 ), 1,00 (г, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 0,99 (д, 3 J HH = 6.
81 ( 3 J HH = 6,9 Гц, 1 час, -C H (CH 3 ) 2 ), 3.28 ( 3 ), 3.28 ( 3 J HH = 6,6 Гц, 1 ч, -C H (CH 3 ) 2 ), 3.14 ( г. 3 J HH HH = 6,9 Гц, 1 ч, -C H (CH 3 ) 2 ), 2.73 (с, 1 H, Sb H ), 1,69 (с, 15 H, Cp * ), 1,65, 1,63 (м, 9 H, ArNCC H 9 3 , -СН(С Н 3 ) 2 ), 1,56 (г, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,34 (дд, 3 J HH = 6,6 Гц, 6 H, −CH(C H 3 ) 2 ), 1.23 (г, 3 J HH = 6.9 Гц, 3 H, −CH(C H 3 ) 2 ), 1,21 (г, 3 J HH = 6,9 Гц, 3 H, −CH(C H 3 ) 2 ), 1,00 (г, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 0,99 (д, 3 J HH = 6. 6 Гц, 3 H, −CH(C H 3 ) 2 ). 13 С НМР (C 6 D 6 , 75,5 МГц): δ 168,85, 168,81 (ARN C CH 3 ), 146.62, 146.26, 142.84, 142.65, 141.45, 141.41, 125.76, 125.47, 124.12 ( C 6 H 3 ), 123.98 ( C 5 ME 5 ), 97.76 ( γ — C H), 30.06, 29.87, 28.19, 28.10 (- С Н(СН 3 ) 2 ), 26.95, 26.70, 25.02, 24.87, 24.81, 24.72, 24.31, 24.13 (-CH ( C H 3 ) 2 ), 23.94, 23.76 (ARNC C H 3 ), 13.64 (C 5 Me 5 ).
6 Гц, 3 H, −CH(C H 3 ) 2 ). 13 С НМР (C 6 D 6 , 75,5 МГц): δ 168,85, 168,81 (ARN C CH 3 ), 146.62, 146.26, 142.84, 142.65, 141.45, 141.41, 125.76, 125.47, 124.12 ( C 6 H 3 ), 123.98 ( C 5 ME 5 ), 97.76 ( γ — C H), 30.06, 29.87, 28.19, 28.10 (- С Н(СН 3 ) 2 ), 26.95, 26.70, 25.02, 24.87, 24.81, 24.72, 24.31, 24.13 (-CH ( C H 3 ) 2 ), 23.94, 23.76 (ARNC C H 3 ), 13.64 (C 5 Me 5 ).
Синтез L(Cl)GaSb(Cl)Cp* 3
Смесь LGa (0,1 г, 0,205 ммоль) и Cp*SbCl 2 (0,067 г, 0,205 ммоль) в 1 мл бензола перемешивали при комнатной температуре в течение 1 часа. Растворители удаляли при пониженном давлении, а остаток растворяли в 2 мл гексана.Раствор хранили при комнатной температуре в течение 3 часов с получением желтых кристаллов 3 . Выход: 0,11 г (0,135 ммоль, 66%). М.п. 130 °С (разл.). Анальный. Расч. для C 39 H 56 N 2 Cl 2 GaSb: C 57,46; Н, 6,92; Н, 3,44. Найдено: С 57,50; Н, 6,98; Н, 3,39%. ИК (чистый): ν 2960, 2913, 2855, 1546, 1528, 1435, 1388, 1312, 1260, 1179, 1097, 1016, 934, 864, 794, 759, 642, 583, 525 см, 443, 4104 1 . 1 H ЯМР (C 6 D 6 , 300.1 МГц): δ 7.26-7.02 (M, 6 H, C 6 H 3 ( I PR) 2 ), 4.86 (S, 1 ч, γ -C h ), 3.86 ( 3 J J HH = 6,9 Гц, 1 ч, -C H (CH 3 ) 2 ), 3.54 ( 3 J HH = 6,6 Гц, 1 H, -C H (CH 3 ) 2 ), 3.45 ( г. 3 J HH = 6,9 Гц, 1 ч, -C H СН 3 ) 2 ), 3.25 ( г. 3 J HH HH = 6,9 Гц, 1 ч, -C H (CH 3 ) 2 ), 1.
Выход: 0,11 г (0,135 ммоль, 66%). М.п. 130 °С (разл.). Анальный. Расч. для C 39 H 56 N 2 Cl 2 GaSb: C 57,46; Н, 6,92; Н, 3,44. Найдено: С 57,50; Н, 6,98; Н, 3,39%. ИК (чистый): ν 2960, 2913, 2855, 1546, 1528, 1435, 1388, 1312, 1260, 1179, 1097, 1016, 934, 864, 794, 759, 642, 583, 525 см, 443, 4104 1 . 1 H ЯМР (C 6 D 6 , 300.1 МГц): δ 7.26-7.02 (M, 6 H, C 6 H 3 ( I PR) 2 ), 4.86 (S, 1 ч, γ -C h ), 3.86 ( 3 J J HH = 6,9 Гц, 1 ч, -C H (CH 3 ) 2 ), 3.54 ( 3 J HH = 6,6 Гц, 1 H, -C H (CH 3 ) 2 ), 3.45 ( г. 3 J HH = 6,9 Гц, 1 ч, -C H СН 3 ) 2 ), 3.25 ( г. 3 J HH HH = 6,9 Гц, 1 ч, -C H (CH 3 ) 2 ), 1.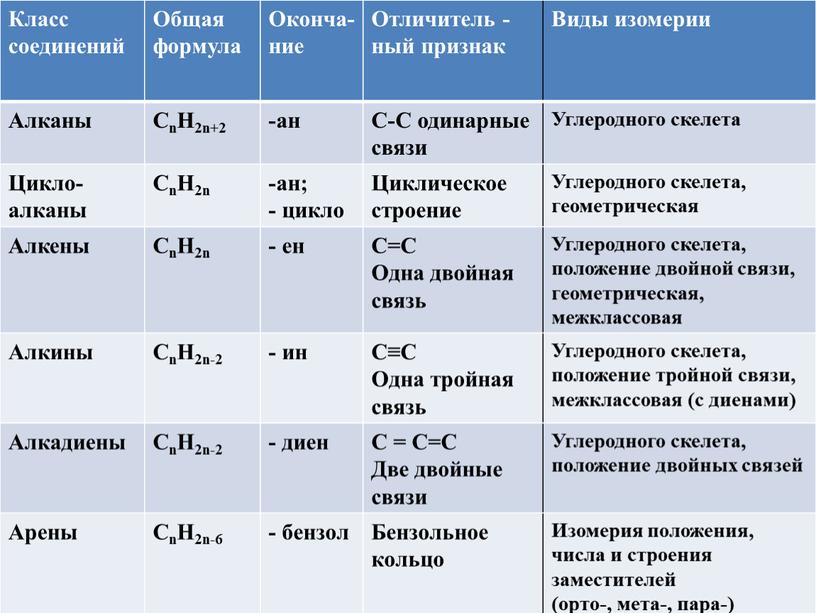 76 (D, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,73 (с, 15 H, Cp * ), 1,57 (с, 3 H, ArNCC H 3 ), 1,53 (с, 3 H, ArNCC H 3 ), 1.53 (г, 3 J HH = 6.6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,38 (г, 3 J HH = 6,9 Гц, 3 H, −CH(C H 3 ) 2 ), 1,27 (дд, 3 J HH = 6,6 Гц, 6 H, −CH(C H 3 ) 2 ), 1,19 (д, 3 J HH = 6.6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,03 (г, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 0,94 (г, 3 J HH = 6,9 Гц, 3 H, −CH(C H 3 ) 2 ). 13 C ЯМР (C 6 D 6 , 75,5 МГц): δ 169,96, 168,87 (ArN C CH 3 ), 146.77, 145.68, 142.45, 142,68, 142.45, 142.17, 141.98, 126.35, 125.98, 126.35, 125.79, 124.38 ( C 6 H 3 ), 122.92 ( C 5 ME 5 ), 97.71 ( γ — C H), 30.89, 29.99, 28.32, 27.95 (- C H (CH 3 ) 2 ), 26.38, 26.28, 25.31, 24.91, 24.73, 24.40, 24.23 (-Ch ( C H 3 ) 2 ), 23,86, 23,58 (ArNC C H 3 ), 11,88 (C 5 Me 5 ).
76 (D, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,73 (с, 15 H, Cp * ), 1,57 (с, 3 H, ArNCC H 3 ), 1,53 (с, 3 H, ArNCC H 3 ), 1.53 (г, 3 J HH = 6.6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,38 (г, 3 J HH = 6,9 Гц, 3 H, −CH(C H 3 ) 2 ), 1,27 (дд, 3 J HH = 6,6 Гц, 6 H, −CH(C H 3 ) 2 ), 1,19 (д, 3 J HH = 6.6 Гц, 3 H, −CH(C H 3 ) 2 ), 1,03 (г, 3 J HH = 6,6 Гц, 3 H, −CH(C H 3 ) 2 ), 0,94 (г, 3 J HH = 6,9 Гц, 3 H, −CH(C H 3 ) 2 ). 13 C ЯМР (C 6 D 6 , 75,5 МГц): δ 169,96, 168,87 (ArN C CH 3 ), 146.77, 145.68, 142.45, 142,68, 142.45, 142.17, 141.98, 126.35, 125.98, 126.35, 125.79, 124.38 ( C 6 H 3 ), 122.92 ( C 5 ME 5 ), 97.71 ( γ — C H), 30.89, 29.99, 28.32, 27.95 (- C H (CH 3 ) 2 ), 26.38, 26.28, 25.31, 24.91, 24.73, 24.40, 24.23 (-Ch ( C H 3 ) 2 ), 23,86, 23,58 (ArNC C H 3 ), 11,88 (C 5 Me 5 ).
Синтез [L(I)Ga]
2 Bi· 4К смеси LGa (0,30 г, 0,62 ммоль) и Cp*BiI 2 (0,184 г, 0,31 ммоль) при –40 °С. Темно-красную суспензию медленно нагревали до комнатной температуры в течение 4 часов с получением прозрачного красного раствора. Все летучие вещества удаляли при пониженном давлении и остаток трижды промывали 5 мл н -гексана с получением 4 в виде красного микрокристаллического порошка. Выход: 316 мг (0.22 ммоль, 71%). М.п. 100 °С (разл.). Анальный. Расч. для C 65 H 90 BiGa 2 I 2 N 4 ( 4 ·толуол): C 51,04; Н, 5,93; Н, 3,67. Найдено: С 51,8; Н, 5,99; Н, 3,84%. ИК (чистый): ν 3060, 3021, 2961, 2922, 2864, 1523, 1437, 1380, 1314, 1258, 1174, 1099, 1018, 935, 859, 796, 757, 727, 693, 635, 4 325, 438 см −1 .
Синтез LGaSbGa(Cl)L 5
Смесь 1 (0,120 г, 0,102 ммоль) и KC 8 (0.014 г, 0,102 ммоль) в 1 мл бензола перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали и осадок промывали 1 мл бензола. Растворитель из объединенных фильтратов удаляли при пониженном давлении, а остаток растворяли в 1 мл гексана. Темно-красный раствор выдерживали при комнатной температуре в течение 2 дней с получением красных кристаллов 5 . Выход: 70 мг (0,062 ммоль, 60%). М.п. 226 °С. Анальный. Расч. для C 58 H 82 N 4 ClGa 2 Sb: C, 61.54; Ч, 7,30; Н, 4,95. Найдено: С 61,65; Н, 7,22; Н, 4,91%. ИК (чистый): ν 2957, 2925, 2863, 1523, 1436, 1380, 1311, 1255, 1174, 1106, 1019, 938, 856, 794, 757, 632, 526, 495, 445 см –1 . 1 H ЯМР (Толуол- D 8 , 500 МГц): δ 7.16-7.06 (M, 6 H, C 6 H 3 ( I PR) 2 ), 4,87 (с, 1 H, γ -C H ), 3,15 (септ, 4 H, -C H (CH 3 ) 2 ), 1,51 (с, 6 HC 9H, 3 ), 1.24 (г, 12 H, 3 J HH = 7.0 Гц, -CH(C H 3 ) 2 ), 1,10 (г, 12 H, 3 J HH = 6,5 Гц, −CH(C H 3 5 ) 2 ). 13 C ЯМР (Толуол- D 8 , 150 МГц): δ 168.09 (ARN C CH 3 ), 143.71, 141.60, 127.27, 124.31 ( C 6 H 3 ), 98.28 ( γ — C H), 29.01 (- C H (CH 3 ) 2 ), 26,32 (-CH ( C H 3 ) 2 ), 24.40 ( -CH( C H 3 ) 2 ), 24,30 (ArNC C H 3 ).
Синтез LGaClF
Смесь 1 (28 мг, 0,024 ммоль) и NOBF 4 (5,6 мг, 0,048 ммоль) в 0,5 мл бензола при комнатной температуре обрабатывали ультразвуком. Растворители удаляли при пониженном давлении и полученный остаток экстрагировали н -гексаном (2 ×5 мл).Раствор экстракта концентрировали до 1 мл и выдерживали при комнатной температуре в течение 1 дня, чтобы получить бесцветные кристаллы LGaClF. Выход: 15,4 мг (0,028 ммоль, 59 %). Анальный. Расч. для C 29 H 41 N 2 ClFGa: C 64,29; Н, 7,63; Н, 5.17. Найдено: С 64,22; Н, 7,59; Н, 5,21%. ИК (чистый): v 3058, 2959, 2926, 2867, 1552, 1524, 1460, 1442, 1383, 1317, 1259, 1179, 1105, 1055, 1022, 946, 935, 878, 806, 796, 76 727, 716, 636, 608, 533, 443, 403 см -1 . 1 H ЯМР (C 6 D 6 , 300 МГц): δ 7.18–7.05 (м, 6 H, C 6 H 3 ( i Pr) 2 ), 4.80 (с, 1 H, γ γ с с с , 3 J HH HH = 6,9 Гц, 2 ч, -C H (CH 3 ) 2 ), 3.19 ( 3 1 J HH = 6,9 Гц, 2 H, −C H (CH 3 ) 2 ), 1,52 (с, 6 H, ArNCC H 3 ), 1,46 (д, 3 J HH = 6.6 Гц, 6 H, −CH(C H 3 ) 2 ), 1,41 (г, 3 J HH = 6,6 Гц, 6 H, −CH(C H 3 ) 2 ), 1,15 (г, 3 J HH = 6,9 Гц, 6 H, −CH(C H 3 ) 2 ), 1,09 (д, 3 J HH = 6,6 Гц, 6 H, −CH(C H 3 ) 2 ). 13 C ЯМР (C 6 D 6 , 75,5 МГц): δ 171.91 (ARN C CH 3 ), 145.21, 143.77, 138.43, 128.91, 125.09, 124,48 ( C 6 H 3 ), 96.60 ( γ — C H), 29,00 (- C H (CH 3 ) 2 ), 28.33 (- C H (CH 3 ) 2 ), 25,45 (-СН( С Н 3 ) 2 ), 24,78 (-СН( С Н 3 ) 2 ), 24.78.56 (-CH( C H 3 ) 2 ), 24,44 (-CH( C H 3 ) 2 ), 23,43 (ArNC 3 701 H 9 ). 19 F ЯМР (C 6 D 6 , 282 МГц): δ -177,67.
Доступность данных
Кристаллографические данные были депонированы в Кембриджском центре кристаллографических данных в виде дополнительных публикаций №. CCDC-1575886 ( 1 ), CCDC-1575134 ( 2 ), CCDC-1575887 ( 3 ), CCDC-1575135 ( 4 · 2C 7 H 8 ), CCDC-1575885 ( 5 ) и CCDC-1580689 ( LGaClF ).Копии данных можно получить бесплатно по заявлению в CCDC, 12 Union Road, Cambridge, CB21EZ (факс: (+ 44) 1223/336033; электронная почта: [email protected]). Авторы заявляют, что все другие данные, подтверждающие результаты этого исследования, доступны в статье [и ее дополнительных информационных файлах].
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
%PDF-1.4 % 5 0 объект > эндообъект 8 0 объект (Абстрактный) эндообъект 9 0 объект > эндообъект 12 0 объект (Введение) эндообъект 13 0 объект > эндообъект 16 0 объект (Обзор современной литературы) эндообъект 17 0 объект > эндообъект 20 0 объект (скорости реакции NO3-BVOC и химические механизмы) эндообъект 21 0 объект > эндообъект 24 0 объект (Скорость реакции) эндообъект 25 0 объект > эндообъект 28 0 объект (Механизмы) эндообъект 29 0 объект > эндообъект 32 0 объект (Выход органических аэрозолей, состав и химия фазы частиц) эндообъект 33 0 объект > эндообъект 36 0 объект (гетерогенные и водофазные процессы NO3) эндообъект 37 0 объект > эндообъект 40 0 объект (Гетерогенные процессы) эндообъект 41 0 объект > эндообъект 44 0 объект (воднофазные реакции) эндообъект 45 0 объект > эндообъект 48 0 объект (Инструментальные методы) эндообъект 49 0 объект > эндообъект 52 0 объект (измерения нитратных радикалов) эндообъект 53 0 объект > эндообъект 56 0 объект (Измерения органических нитратов в газовой фазе) эндообъект 57 0 объект > эндообъект 60 0 объект (Онлайн-анализ твердых частиц) эндообъект 61 0 объект > эндообъект 64 0 объект (Автономный анализ твердых частиц) эндообъект 65 0 объект > эндообъект 68 0 объект (Полевые наблюдения) эндообъект 69 0 объект > эндообъект 72 0 объект (Нитратные радикалы и БЛОС) эндообъект 73 0 объект > эндообъект 76 0 объект (Аэрозоли органических нитратов) эндообъект 77 0 объект > эндообъект 80 0 объект (Модели химии NO3-BVOC) эндообъект 81 0 объект > эндообъект 84 0 объект (Химические механизмы) эндообъект 85 0 объект > эндообъект 88 0 объект (Влияние на органический аэрозоль) эндообъект 89 0 объект > эндообъект 92 0 объект (Влияние на реактивный азот и озон) эндообъект 93 0 объект > эндообъект 96 0 объект (Сравнение полевых данных с моделями качества воздуха) эндообъект 97 0 объект > эндообъект 100 0 объект (Перспективы и мировоззрение) эндообъект 101 0 объект > эндообъект 104 0 объект (Оптические и физические свойства аэрозоля) эндообъект 105 0 объект > эндообъект 108 0 объект (воздействие на здоровье) эндообъект 109 0 объект > эндообъект 112 0 объект (Тенденции выбросов NOx и органических аэрозолей — последствия для стратегий контроля качества воздуха) эндообъект 113 0 объект > эндообъект 116 0 объект (стандарты органических нитратов) эндообъект 117 0 объект > эндообъект 120 0 объект (Критические потребности для моделей) эндообъект 121 0 объект > эндообъект 124 0 объект (Надежное и эффективное представление химии газовой фазы) эндообъект 125 0 объект > эндообъект 128 0 объект (Улучшенные методы и протоколы для оценки сложных и восстановленных газофазных механизмов) эндообъект 129 0 объект > эндообъект 132 0 объект (Уменьшение неопределенностей в процессах подсетевого масштаба) эндообъект 133 0 объект > эндообъект 136 0 объект (Полевые исследования в развивающихся странах и малоизученных областях) эндообъект 137 0 объект > эндообъект 140 0 объект (Будущие потребности в камерных исследованиях) эндообъект 141 0 объект > эндообъект 144 0 объект (Воздействие химического состава NO3-BVOC на качество воздуха) эндообъект 145 0 объект > эндообъект 148 0 объект (Приложение) эндообъект 149 0 объект > эндообъект 152 0 объект (Конкурирующие интересы) эндообъект 153 0 объект > эндообъект 156 0 объект (Благодарности) эндообъект 157 0 объект > эндообъект 160 0 объект (Использованная литература) эндообъект 161 0 объект > эндообъект 208 0 объект > поток x[r:}WQh;&/c;s’3E)i
Полимеры
Полимеры
1.Введение
До начала 1920-х годов химики сомневались в существовании молекул с молекулярной массой более нескольких тысяч. Это ограниченное представление было оспорено Германом Штаудингером, немецким химиком, имевшим опыт изучения природных соединений, таких как каучук и целлюлоза. В отличие от преобладающего представления об этих веществах как о агрегатах малых молекул, Штаудингер предположил, что они состоят из 91 796 макромолекул, 91 797 из 10 000 или более атомов.Он сформулировал полимерную структуру для каучука на основе повторяющегося звена изопрена (называемого мономером). За свой вклад в химию Штаудингер получил Нобелевскую премию 1953 года. Термины полимер и мономер произошли от греческих корней поли (много), моно (один) и мерос (часть).
За признанием того, что полимерные макромолекулы составляют многие важные природные материалы, последовало создание синтетических аналогов, обладающих разнообразными свойствами.Действительно, применение этих материалов в качестве волокон, гибких пленок, клеев, стойких красок и прочных, но легких твердых материалов изменило современное общество. Некоторые важные примеры этих веществ обсуждаются в следующих разделах.
2. Написание формул для полимерных макромолекул
Повторяющаяся структурная единица большинства простых полимеров не только отражает мономер(ы), из которых построены полимеры, но также обеспечивает краткие средства для рисования структур, представляющих эти макромолекулы.Для полиэтилена, возможно, самого простого полимера, это демонстрируется следующим уравнением. Здесь этилен (этен) является мономером, а соответствующий линейный полимер называется полиэтиленом высокой плотности (ПЭВП). ПЭВП состоит из макромолекул, в которых n находится в диапазоне от 10 000 до 100 000 (молекулярная масса от 2*10 5 до 3*10 6 ).
Если Y и Z представляют собой моли мономера и полимера соответственно, Z приблизительно равно 10 -5 Y. Этот полимер называется полиэтиленом, а не полиметиленом, (-CH 2 -) n , потому что этилен является стабильным соединением. (метилен не является), и он также служит синтетическим предшественником полимера.Две открытые связи, остающиеся на концах длинной цепи углеродов (окрашены пурпурным цветом), обычно не указываются, потому что атомы или группы, находящиеся там, зависят от химического процесса, используемого для полимеризации. Методы синтеза, использованные для получения этого и других полимеров, будут описаны далее в этой главе.
В отличие от более простых чистых соединений, большинство полимеров не состоят из идентичных молекул. Молекулы ПЭВП, например, состоят из длинных углеродных цепей, но их длина может варьироваться в пределах тысяч мономерных звеньев.Из-за этого молекулярные массы полимеров обычно приводятся как средние значения. Два экспериментально определенных значения являются общими: M n , среднечисловая молекулярная масса, рассчитывается из распределения мольных долей молекул разного размера в образце, а M w , средневесовая молекулярная масса, равна рассчитывают из распределения массовых долей молекул разного размера. Они определены ниже. Поскольку более крупные молекулы в образце весят больше, чем более мелкие молекулы, средневзвешенное значение M w обязательно смещено в сторону более высоких значений и всегда больше, чем M n .По мере сужения массовой дисперсии молекул в образце М w приближается к M n , а в маловероятном случае, когда все молекулы полимера имеют одинаковую массу (чистый монодисперсный образец), соотношение M w / M n становится единицей.
Влияние различных массовых распределений на M n и M w можно изучить с помощью простого калькулятора массы. |
|---|
Известно множество полимерных материалов, имеющих цепочечную структуру, аналогичную полиэтилену. Полимеры, образованные прямым соединением мономерных звеньев без потери или прибавления материала, называются аддитивными полимерами или полимерами с ростом цепи . Список некоторых важных аддитивных полимеров и их предшественников мономеров представлен в следующей таблице.
Имя | Формула | |||
|---|---|---|---|---|
| Полиэтилен Низкая плотность (LDPE) | — (CH 2 CH 2 ) N — | этилен ч 2 = CH 2 = CH 2 = CH 2 8 | Soft, Waxy Tool | пленочная пленка, пластиковые пакеты |
| полиэтилен высокая плотность (HDPE) | — (CH 2 -CH 2 -CH 2 ) N — | этилен CH 2 = CH 2 = CH 2 8 | , 3 8 | RegiD, полупрозрачные изоляции бутылки, игрушки 9028 |
| Polypropylene (PP) разные марки | –[CH 2 -CH(CH 3 )] n – | пропилен CH 2 2 =CHCH 0 3 8 Atactic : Мягкие, эластичные твердые | , похоже на LDPE ковер, обивка | |
| Poly (винилхлорид) (PVC) | — (CH 2 — CHCl) N — | винилхлорид CH 2 = CHCL | Сильные жесткие твердые твердые | Трубы, сайдинг, настил |
| поли (винилиденхлорид) (Саран а) | — (CH 2 -CCL 2 ) N — | Vinylidene Хлорид CCC 2 = CCL 2 = CCL 2 | Плотные, высокое плавление твердого вещества | Чехлы на сиденье, пленки |
| полистирол ( PS) | — [CH 2 -CH (C 6 H 5 )] N — | стирол CH 2 = CHC 6 H 5 | Жесткий, жесткий, прозрачное твердое вещество , растворимое в органических растворителях 9 0228 | Игрушки, Шкафы Упаковка (вспененные) |
| Polyacryлонитрил (Pan, Orlon, Acrilan) | — (CH 2 -CHCN) N — | акрилонитрил CH 2 = CHCN | High-Telling Solid Растворимый в органических растворителях | Коврики, Одеяла Одежда |
| (PTFE, Teflon) | — (CF 2 -CF 2 ) N — | тетрафторэтилен CF 2 = CF 2 = CF 2 = CF 2 | Устойчивые, гладкие твердые вещества Электрические изоляции Электрические изоляция | |
| Poly (метилметакрилат) (PMMA, Lucite, Plexiglas) | — [ CH 2 -C (CH 3 ) CO 2 CH 3 ] N — | метилметакрилат CH 2 = C (CH 3 ) CO 2 CH 3 | жесткий, прозрачный прочный | Освещение крышек, знаки Skylights |
| поли (винилацетат) (PVAC) | винил Acetate CH 2 = Chococh 3 | Мягкий, липкий твердый | Латексные краски, клеевые | |
| CIS-полиизопрен Натуральный резина — [CH 2 -CH = C (CH 3 ) -CH 2 ] 2 ] N — 8 | ISoprene CH 2 = CH-C (CH 3 ) = CH 2 8 | Мягкий, липкий прочный | требует вулканизации для практического использования | |
| полихлоропрен (CIS + TRANS) (неопрен) | — [CH 2 -CH = CCL-CH 2 ] N — | Chloroprene CH 2 = CH-CCL =CH 2 | прочная резиноподобная основа d | синтетический каучук маслостойкий |
3.Свойства макромолекул
Поучительно сравнение свойств полиэтилена (как LDPE, так и HDPE) с природными полимерами каучуком и целлюлозой. Как отмечалось выше, синтетические макромолекулы ПЭВП имеют массы от 10 5 до 10 6 а.е.м. (молекулы ПЭНП более чем в сто раз меньше). Молекулы каучука и целлюлозы имеют одинаковые диапазоны массы, но меньше мономерных звеньев из-за большего размера мономера. Физические свойства этих трех полимерных веществ отличаются друг от друга и, конечно же, от их мономеров.
• ПЭВП представляет собой жесткое полупрозрачное твердое вещество, которое размягчается при нагревании выше 100º C, и из него можно формовать различные формы, включая пленки. Он не так легко растягивается и деформируется, как ПВД. ПЭВП нерастворим в воде и большинстве органических растворителей, хотя при погружении в последние может произойти некоторое набухание. HDPE является отличным электрическим изолятором.
• LDPE представляет собой мягкое полупрозрачное твердое вещество, которое плохо деформируется при температуре выше 75º C. Пленки, изготовленные из LDPE, легко растягиваются и обычно используются для обертывания.LDPE нерастворим в воде, но размягчается и набухает при воздействии углеводородных растворителей. И LDPE, и HDPE становятся хрупкими при очень низких температурах (ниже -80ºC). Этилен, обычный мономер для этих полимеров, представляет собой газ с низкой температурой кипения (-104ºC).
• Натуральный (латексный) каучук представляет собой непрозрачное, мягкое, легко деформируемое твердое вещество, которое становится липким при нагревании (выше 60°С) и становится хрупким при охлаждении ниже -50°С. растворители, такие как толуол, со временем растворяются, но непроницаемы для воды.Мономер C 5 H 8 изопрен представляет собой летучую жидкость (точка кипения 34ºC).
• Чистая целлюлоза в виде хлопка представляет собой мягкое гибкое волокно, практически не изменяющееся при изменении температуры в диапазоне от -70 до 80°C. Хлопок легко впитывает воду, но не подвергается воздействию толуола или большинства других органических растворителей. . Целлюлозные волокна могут изгибаться и скручиваться, но не сильно растягиваются, прежде чем порвутся. Мономером целлюлозы является C 6 H 12 O 6 альдогексоза D-глюкоза.Глюкоза представляет собой водорастворимое твердое вещество, плавящееся при температуре ниже 150ºC.
Чтобы объяснить отмеченные здесь различия, нам необходимо рассмотреть природу совокупной макромолекулярной структуры или морфологию каждого вещества. Поскольку полимерные молекулы очень велики, они обычно упаковываются неравномерно, с упорядоченными или кристаллоподобными областями, смешанными с неупорядоченными или аморфными областями. В некоторых случаях все твердое тело может быть аморфным, полностью состоящим из спиральных и запутанных макромолекулярных цепей.Кристалличность возникает, когда линейные полимерные цепи структурно ориентированы в однородной трехмерной матрице. На диаграмме справа кристаллические домены окрашены в синий цвет.
Повышенная кристалличность связана с увеличением жесткости, прочности на разрыв и непрозрачности (из-за светорассеяния). Аморфные полимеры обычно менее жесткие, более слабые и легче деформируются. Часто они прозрачные.
На степень кристалличности влияют три фактора:
i) Длина цепи
ii) Разветвление цепи
iii) 9
Важность первых двух факторов хорошо иллюстрируется различиями между LDPE и HDPE.Как отмечалось ранее, ПЭВП состоит из очень длинных неразветвленных углеводородных цепей. Они легко объединяются в кристаллические домены, которые чередуются с аморфными сегментами, и полученный материал, хотя и относительно прочный и жесткий, сохраняет некоторую гибкость. Напротив, ПЭНП состоит из меньших по размеру и более разветвленных цепей, которым нелегко принять кристаллическую структуру. Таким образом, этот материал мягче, слабее, менее плотный и легче деформируется, чем HDPE. Как правило, механические свойства, такие как пластичность, прочность на растяжение и твердость, повышаются и в конечном итоге выравниваются с увеличением длины цепи.
Природа целлюлозы подтверждает приведенный выше анализ и демонстрирует важность третьего фактора (iii). Начнем с того, что цепи целлюлозы легко принимают стабильную палочковидную конформацию. Эти молекулы выстраиваются бок о бок в волокна, которые стабилизируются межцепочечной водородной связью между тремя гидроксильными группами на каждом мономерном звене. Следовательно, кристалличность высокая, и молекулы целлюлозы не перемещаются и не скользят друг относительно друга. Высокая концентрация гидроксильных групп также объясняет легкое поглощение воды, характерное для хлопка.
Натуральный каучук представляет собой полностью аморфный полимер. К сожалению, потенциально полезные свойства необработанного латексного каучука ограничены температурной зависимостью; однако эти свойства могут быть изменены путем химического изменения. Цис-двойные связи в углеводородной цепи образуют плоские сегменты, которые делают цепь более жесткой, но не выпрямляют ее. Если эти жесткие сегменты полностью удалить гидрированием (катализатор H 2 и Pt), цепи теряют все ограничения, и продукт представляет собой легкоплавкое парафиноподобное полутвердое вещество, имеющее небольшую ценность.Если вместо этого цепи молекул каучука слегка сшиты атомами серы, процесс, называемый вулканизацией , который был открыт Чарльзом Гудиером в 1839 году, желаемые эластомерные свойства каучука существенно улучшаются. При степени сшивания от 2 до 3% получается полезная мягкая резина, которая больше не страдает от проблем с липкостью и хрупкостью при нагревании и охлаждении. При степени сшивки от 25 до 35% образуется жесткий твердый каучуковый продукт. На следующем рисунке показан сшитый участок аморфного каучука.Щелкнув по диаграмме, она изменится на отображение соответствующего растянутого участка. Цепи с более высоким порядком в растянутой конформации энтропийно нестабильны и возвращаются в исходное свернутое состояние, когда им позволяют расслабиться (щелчок второй раз).
При нагревании или охлаждении большинство полимеров претерпевают тепловые переходы, которые позволяют понять их морфологию. Они определяются как переход расплава , T m и переход в стеклообразное состояние , T g .
T m – температура, при которой кристаллические домены теряют свою структуру или плавятся. По мере увеличения кристалличности увеличивается и T m . |
T г часто зависит от истории образца, особенно от предшествующей термообработки, механических манипуляций и отжига.Иногда ее интерпретируют как температуру, выше которой значительные части полимерных цепей способны скользить относительно друг друга в ответ на приложенную силу. Введение относительно больших и жестких заместителей (таких как бензольные кольца) будет препятствовать этому движению цепи, таким образом увеличивая T g (обратите внимание на полистирол ниже). Введение низкомолекулярных соединений, называемых пластификаторами, в полимерную матрицу увеличивает расстояние между цепями, что позволяет цепям двигаться при более низких температурах.с последующим уменьшением Т г . Дегазация пластификаторов, используемых для модификации пластиковых деталей салона автомобиля, производит привычный нам «запах нового автомобиля».
Ниже перечислены значенияT m и T g для некоторых распространенных аддитивных полимеров. Обратите внимание, что целлюлоза не имеет ни T m , ни T g .
Полимер | ПВД | ПЭВП | ПП | ПВХ | PS | ПАН | ПТФЭ | ПММА | Резина |
|---|---|---|---|---|---|---|---|---|---|
T м (ºC) | 110 | 130 | 175 | 7 2 280 280> 200 | 330 | 180 | 180 | 30 | |
T г (ºC) | _ 110 | _ 100 | _ 10 | 80 | 90 | 95 | _ 110 | 105 | _ 70228 70251 |
относится к важной группе полимеров, называемых эластомерами .Эластомеры представляют собой аморфные полимеры, обладающие способностью растягиваться, а затем возвращаться в исходную форму при температурах выше Т g . Это свойство важно для таких применений, как прокладки и уплотнительные кольца, поэтому разработка синтетических эластомеров, способных работать в суровых или сложных условиях, остается практической задачей. При температурах ниже T g эластомеры становятся жесткими стеклообразными твердыми телами и теряют всякую эластичность. Трагическим примером этого стала катастрофа космического корабля «Челленджер».Термостойкие и химически стойкие уплотнительные кольца, используемые для герметизации секций твердотопливных ракет-носителей, имели, к сожалению, высокую T g около 0 ºC. Неожиданно низкие температуры в утро запуска были ниже этого T g , что позволило горячим ракетным газам выйти из уплотнений.
4. Регио- и стереоизомеризация в макромолекулах
Симметричные мономеры, такие как этилен и тетрафторэтилен, могут соединяться друг с другом только одним способом. С другой стороны, монозамещенные мономеры могут соединяться вместе двумя организованными способами, описанными на следующей диаграмме, или третьим случайным образом.Большинство мономеров этого типа, включая пропилен, винилхлорид, стирол, акрилонитрил и сложные эфиры акриловой кислоты, предпочитают соединяться «голова к хвосту» с некоторой случайностью, возникающей время от времени. Причины такой региоселективности будут обсуждаться в разделе синтетических методов.
Если полимерная цепь вычерчена зигзагообразно, как показано выше, каждая из замещающих групп (Z) обязательно будет расположена выше или ниже плоскости, определяемой углеродной цепью.Следовательно, мы можем идентифицировать три конфигурационных изомера таких полимеров. Если все заместители лежат на одной стороне цепи, конфигурация называется изотактической . Если заместители регулярно чередуются с одной стороны на другую, конфигурация называется синдиотактической . Наконец, случайное расположение замещающих групп обозначается как атактическое . Примеры таких конфигураций показаны здесь.
Многие распространенные и полезные полимеры, такие как полистирол, полиакрилонитрил и поли(винилхлорид), являются атактическими при обычном получении.Были разработаны специальные катализаторы, которые осуществляют стереорегулярную полимеризацию полипропилена и некоторых других мономеров, а улучшенные свойства, связанные с повышенной кристалличностью этих продуктов, сделали эту область важной областью исследований. Сообщалось о следующих значениях T g .
| Полимер | Т г | атактическихТ г | изотактическогоТ г | синдиотактических|||
|---|---|---|---|---|---|---|
| ПП | -20 ºC | 9021 0 ºC | -8 ºC | |||
PMMA | 100 ºC | 130 ºC | 120 ºC | 120 ºC | 120 ºC | 120 ºC |
Свойства данного полимера значительно варьируются со своей величинойТаким образом, атактический полипропилен непригоден в качестве твердого конструкционного материала и используется в основном как компонент клеев или как мягкая матрица для композиционных материалов. Напротив, изотактический полипропилен представляет собой твердое вещество с высокой температурой плавления (около 170 ºC), из которого можно формовать или подвергать механической обработке структурные компоненты.
Синтез аддитивных полимеров
Все мономеры, из которых состоят аддитивные полимеры, представляют собой алкены или функционально замещенные алкены. Наиболее распространенными и термодинамически предпочтительными химическими превращениями алкенов являются реакции присоединения.Известно, что многие из этих реакций присоединения протекают ступенчато с участием реакционноспособных промежуточных соединений, и именно этому механизму следует большинство полимеризаций. Здесь представлена общая диаграмма, иллюстрирующая эту сборку линейных макромолекул, которая поддерживает название полимеров для роста цепи . Поскольку пи-связь в мономере превращается в сигма-связь в полимере, реакция полимеризации обычно экзотермична на 8-20 ккал/моль. Действительно, сообщалось о случаях взрывной неконтролируемой полимеризации.
Полезно различать четыре процедуры полимеризации, соответствующие этому общему описанию.
• Радикальная полимеризация Инициатором является радикал, а местом распространения реакционной способности (*) является углеродный радикал.
• Катионная полимеризация Инициатором является кислота, а центром распространения реакционной способности (*) является карбокатион.
• Анионная полимеризация Инициатором является нуклеофил, а местом распространения реакционной способности (*) является карбанион.
• Координационная каталитическая полимеризация Инициатором является комплекс переходного металла, а местом распространения реакционной способности (*) является конечный каталитический комплекс.
1. Радикальная полимеризация с ростом цепи
Практически все описанные выше мономеры подвержены радикальной полимеризации. Поскольку это может быть инициировано следами кислорода или других незначительных примесей, чистые образцы этих соединений часто «стабилизируют» небольшими количествами ингибиторов радикалов, чтобы избежать нежелательной реакции.Когда желательна радикальная полимеризация, ее нужно начинать с использования радикального инициатора , такого как пероксид или определенные азосоединения. Формулы некоторых распространенных инициаторов и уравнения, показывающие образование радикальных частиц из этих инициаторов, представлены ниже.
Используя небольшие количества инициаторов, можно полимеризовать широкий спектр мономеров. Одним из примеров такой радикальной полимеризации является превращение стирола в полистирол, показанное на следующей диаграмме.Первые два уравнения иллюстрируют процесс инициирования , а последние два уравнения являются примерами распространения цепи . Каждое мономерное звено добавляется к растущей цепи таким образом, что образуется наиболее стабильный радикал. Поскольку углеродные радикалы стабилизируются заместителями многих видов, предпочтение региоселективности «голова к хвосту» в большинстве аддитивных полимеризаций понятно. Поскольку радикалы устойчивы ко многим функциональным группам и растворителям (включая воду), радикальные полимеризации широко используются в химической промышленности.
Посмотреть анимированную модель радикальной полимеризации винилхлорида с ростом цепи
В принципе, можно ожидать, что однажды начавшись, радикальная полимеризация будет продолжаться беспрепятственно, производя несколько чрезвычайно длинноцепочечных полимеров. На практике образуется большее количество цепей среднего размера, что указывает на то, что должны иметь место реакции обрыва цепи. Наиболее распространенными процессами прерывания являются радикальная комбинация и диспропорционирование .Эти реакции иллюстрируются следующими уравнениями. Растущие полимерные цепи окрашены в синий и красный цвет, а атом водорода, перенесенный в результате диспропорционирования, окрашен в зеленый цвет. Обратите внимание, что в обоих типах терминации два реакционноспособных радикальных сайта удаляются путем одновременного превращения в стабильный продукт (продукты). Поскольку концентрация радикалов в реакции полимеризации невелика по сравнению с другими реагентами (например, мономерами, растворителями и обрывами цепей), скорость, с которой происходят эти радикально-радикальные реакции обрыва, очень мала, и большинство растущих цепей достигают умеренной длины перед обрывом. .
Относительная важность этих обрывов варьируется в зависимости от природы мономера, подвергающегося полимеризации. Комбинация акрилонитрила и стирола является основным процессом. Однако метилметакрилат и винилацетат обрываются главным образом диспропорционированием.
Другая реакция, которая отклоняет радикальную полимеризацию с ростом цепи от образования линейных макромолекул, называется передачей цепи . Как следует из названия, эта реакция перемещает углеродный радикал из одного места в другое за счет межмолекулярного или внутримолекулярного переноса атома водорода (окрашен зеленым).Эти возможности демонстрируются следующими уравнениями
Реакции передачи цепи особенно распространены при радикальной полимеризации этилена под высоким давлением, которая является методом, используемым для производства LDPE (полиэтилена низкой плотности). 1º-радикал в конце растущей цепи превращается в более стабильный 2º-радикал за счет переноса атома водорода. Дальнейшая полимеризация в новом месте радикала приводит к образованию радикала боковой цепи, что, в свою очередь, может привести к образованию других боковых цепей в результате реакций переноса цепи.В результате морфология ПЭНП представляет собой аморфную сеть сильно разветвленных макромолекул.
2. Катионная полимеризация с ростом цепи
Полимеризация изобутилена (2-метилпропена) следами сильных кислот является примером катионной полимеризации. Полиизобутиленовый продукт представляет собой мягкое каучукоподобное твердое вещество, T г = _ 70ºC, которое используется для внутренних трубок. Этот процесс подобен радикальной полимеризации, что демонстрируют следующие уравнения.Рост цепи прекращается, когда концевой карбокатион соединяется с нуклеофилом или теряет протон, давая концевой алкен (как показано здесь).
Мономеры, содержащие стабилизирующие катион группы, такие как алкильные, фенильные или виниловые, могут быть полимеризованы с помощью катионных процессов. Обычно их инициируют при низкой температуре в растворе хлористого метилена. Сильные кислоты, такие как HClO 4 , или кислоты Льюиса, содержащие следы воды (как показано выше), служат инициирующими реагентами. При низких температурах реакции передачи цепи в таких полимеризациях происходят редко, поэтому получаемые полимеры являются чисто линейными (неразветвленными).
3. Анионная полимеризация с ростом цепи
Обработка холодного раствора стирола в ТГФ 0,001 эквивалента н-бутиллития вызывает немедленную полимеризацию. Это пример анионной полимеризации, ход которой описывается следующими уравнениями. Рост цепи может быть остановлен водой или углекислым газом, и передача цепи происходит редко. Только мономеры, имеющие заместители, стабилизирующие анион, такие как фенил, циано или карбонил, являются хорошими субстратами для этого метода полимеризации.Многие из полученных полимеров в значительной степени изотактичны по конфигурации и имеют высокую степень кристалличности.
Вещества, которые использовались для инициирования анионной полимеризации, включают щелочные металлы, амиды щелочных металлов, алкиллитий и различные источники электронов. Практическое применение анионной полимеризации происходит при использовании суперклея. Этот материал представляет собой метил-2-цианоакрилат, CH 2 =C(CN)CO 2 CH 3 . При воздействии воды, аминов или других нуклеофилов происходит быстрая полимеризация этого мономера.
4. Каталитическая полимеризация Циглера-Натта
Эффективная и стереоспецифическая процедура каталитической полимеризации была разработана Карлом Зиглером (Германия) и Джулио Натта (Италия) в 1950-х годах. Их результаты позволили впервые осуществить синтез неразветвленного полиэтилена высокой молекулярной массы (ПЭВП), лабораторный синтез натурального каучука из изопрена и контроль конфигурации полимеров из концевых алкенов, таких как пропен (например, чистые изотактические и синдиотактические полимеры).В случае этилена быстрая полимеризация происходила при атмосферном давлении и температуре от умеренной до низкой, что давало более прочный (более кристаллический) продукт (ПЭВП), чем продукт радикальной полимеризации (ПЭНП). За это важное открытие эти химики получили Нобелевскую премию по химии 1963 года.
Катализаторы Циглера-Натта получают реакцией некоторых галогенидов переходных металлов с металлоорганическими реагентами, такими как алкилалюминий, литий и цинк. Катализатор, образованный реакцией триэтилалюминия с тетрахлоридом титана, широко изучался, но другие металлы (например,грамм. V и Zr) также доказали свою эффективность. На следующей диаграмме представлен один механизм этой полезной реакции. Были предложены другие, с изменениями, чтобы приспособиться к гетерогенности или гомогенности катализатора. Полимеризация пропилена под действием титанового катализатора дает изотактический продукт; тогда как катализатор на основе ванадия дает синдиотактический продукт.
Сополимеры
Синтез макромолекул, состоящих из более чем одного мономерного повторяющегося звена, изучался как средство управления свойствами получаемого материала.В этом отношении полезно различать несколько способов включения различных мономерных звеньев в полимерную молекулу. Следующие примеры относятся к двухкомпонентной системе, в которой один мономер обозначен А , а другой В .
Статистические сополимеры | Также называются статистическими сополимерами. Здесь мономерные звенья распределены в полимерной цепи хаотично, а иногда и неравномерно: ~ ABBAAABAABBBABAABA ~. |
|---|---|
Чередующиеся сополимеры | Здесь мономерные звенья распределены регулярно чередующимся образом с почти эквимолярными количествами каждого в цепи: ~ ABABABABABABABAB ~. |
Блок-сополимеры | Вместо смешанного распределения мономерных звеньев длинная последовательность или блок одного мономера присоединены к блоку второго мономера: . |
Привитые сополимеры | Как следует из названия, боковые цепи данного мономера присоединены к основной цепи второго мономера: |
1. Добавочная сополимеризация
Большинство прямых сополимеризаций эквимолярных смесей различных мономеров дают статистические сополимеры или, если один мономер намного более реакционноспособен, почти гомополимер этого мономера.Сополимеризация стирола с метилметакрилатом, например, протекает по-разному в зависимости от механизма. Радикальная полимеризация дает статистический сополимер. Однако продуктом катионной полимеризации в основном является полистирол, а анионная полимеризация способствует образованию поли(метилметакрилата). В тех случаях, когда относительные реакционные способности различны, состав сополимера иногда можно контролировать, непрерывно вводя в реакцию смещенную смесь мономеров.
Образование чередующихся сополимеров предпочтительно, когда мономеры имеют разные полярные заместители (например, один электроноакцепторный и другой электронодонорный), и оба имеют одинаковую реакционную способность по отношению к радикалам. Например, стирол и акрилонитрил сополимеризуются в значительной степени чередующимся образом.
мономер | Мономер B | сополимер | использует | ||
|---|---|---|---|---|---|
| HCL 2 C = CHCL 8 | H 2 C = CCL 2 | SARAN | Фильмы и волокна | H 2 C = CHC 6 H 5 H 5 8 | H 2 C = C-CH 2 C = C-CH = CH 2 | SBR STRELE BUTADIENE RUB | шины |
| H 2 C = CHCN 8 | H 2 C = C-CH = CH 2 | 2 NITRILE RUB HOSES | |||
H 2 C = C (CH 3 ) 2 | H | H 2 C = C-CH = CH 2 | 2 Butly Rubbre | внутренние трубки | 8 | |
| F 2 C = CF (CF 3 ) 2 C=CHF | Viton | прокладки |
Терполимер акрилонитрила, бутадиена и стирола, называемый АБС-каучуком, используется для изготовления ударопрочных контейнеров, труб и прокладок.
2. Блок-сополимеризация
Было разработано несколько различных методов получения блок-сополимеров, многие из которых используют реакции конденсации (следующий раздел). На этом этапе наше обсуждение будет ограничено применением анионной полимеризации. При анионной полимеризации стирола, описанной выше, реакционноспособный центр остается на конце цепи до тех пор, пока он не будет погашен. Негашеный полимер был назван живым полимером , и если добавить дополнительный стирол или другой подходящий мономер, образуется блок-полимер.Это показано для метилметакрилата на следующей диаграмме.
Конденсационные полимеры
Большое количество важных и полезных полимерных материалов не образуются в результате процессов роста цепи с участием реакционноспособных частиц, таких как радикалы, а вместо этого происходят в результате обычных превращений функциональных групп полифункциональных реагентов. Эти полимеризации часто (но не всегда) происходят с потерей небольшого побочного продукта, такого как вода, и обычно (но не всегда) объединяют два разных компонента в чередующуюся структуру.Полиэфир дакрон и полиамид нейлон 66, показанные здесь, являются двумя примерами синтетических конденсационных полимеров, также известных как полимеры ступенчатого роста . В отличие от полимеров с цепным ростом, большинство из которых растет за счет образования связи углерод-углерод, полимеры со ступенчатым ростом обычно растут за счет образования связи углерод-гетероатом (CO и CN в дакроне и нейлоне соответственно). Хотя полимеры такого типа можно рассматривать как чередующиеся сополимеры, повторяющееся мономерное звено обычно определяют как комбинированный фрагмент.
Примерами встречающихся в природе конденсационных полимеров являются целлюлоза, полипептидные цепи белков и поли(β-гидроксимасляная кислота), сложный полиэфир, синтезируемый в больших количествах некоторыми почвенными и водными бактериями. Формулы для них будут отображаться ниже, если щелкнуть по диаграмме.
1. Характеристики конденсационных полимеров
Конденсационные полимеры образуются медленнее, чем аддитивные полимеры, часто требуют нагревания и обычно имеют более низкую молекулярную массу.Концевые функциональные группы в цепи остаются активными, так что группы более коротких цепей объединяются в более длинные цепи на поздних стадиях полимеризации. Присутствие полярных функциональных групп в цепях часто увеличивает притяжение цепей друг к другу, особенно если они связаны с водородными связями, и, таким образом, кристалличность и прочность на растяжение. Следующие примеры конденсационных полимеров являются иллюстративными.
Обратите внимание, что для коммерческого синтеза компоненты карбоновой кислоты могут фактически использоваться в форме производных, таких как простые эфиры.Кроме того, реакции полимеризации нейлона 6 и спандекса не протекают за счет удаления воды или других малых молекул. Тем не менее, очевидно, что полимер образуется в результате ступенчатого процесса роста.
Разница в T g и T m между первым полиэфиром (полностью алифатическим) и двумя найлоновыми полиамидами (5-я и 6-я позиции) показывает влияние внутрицепочечной водородной связи на кристалличность. Замена гибких алкилиденовых звеньев жесткими бензольными кольцами также делает полимерную цепь более жесткой, что приводит к повышению кристалличности, как это продемонстрировано для сложных полиэфиров (опыты 1, 2 и 3) и полиамидов (опыты 5, 6, 7 и 8).Высокие значения T g и T m для аморфного полимера Lexan согласуются с его блестящей прозрачностью и стеклоподобной жесткостью. Кевлар и номекс — чрезвычайно прочные и стойкие материалы, которые находят применение в пуленепробиваемых жилетах и огнеупорной одежде.
Многие полимеры, как аддитивные, так и конденсационные, используются в качестве волокон. Основными методами формования синтетических полимеров в волокна являются расплавы или вязкие растворы. Сложные полиэфиры, полиамиды и полиолефины обычно получают из расплавов при условии, что T m не слишком высока.Полиакрилаты подвержены термическому разложению, поэтому их получают из растворов в летучем растворителе. Холодное волочение является важной физической обработкой, улучшающей прочность и внешний вид этих полимерных волокон. При температурах выше T g более толстое волокно может быть принудительно растянуто во много раз по сравнению с его длиной; и при этом полимерные цепи распутываются и имеют тенденцию выстраиваться параллельно. Эта процедура холодного волочения организует произвольно ориентированные кристаллические домены, а также выравнивает аморфные домены, чтобы они стали более кристаллическими.В этих случаях физически ориентированная морфология стабилизируется и сохраняется в конечном продукте. Это контрастирует с эластомерными полимерами, для которых растянутая или выровненная морфология нестабильна по сравнению с морфологией аморфного случайного клубка.
Если щелкнуть следующую диаграмму, карикатура этих изменений переключится с одной крайности на другую. Эту обработку холодным волочением можно также использовать для обработки полимерных пленок (например, Mylar и Saran), а также волокон.
Ступенчатая полимеризация также используется для получения класса клеев и аморфных твердых веществ, называемых эпоксидными смолами.Здесь ковалентная связь происходит в результате реакции S N 2 между нуклеофилом, обычно амином, и концевым эпоксидом. В следующем примере тот же промежуточный продукт бисфенола А, который используется в качестве мономера для лексана, служит бифункциональным каркасом, к которому присоединены эпоксидные кольца. Бисфенол А получают катализируемой кислотой конденсацией ацетона с фенолом.
2. Термореактивные и термопластичные полимеры
Большинство полимеров, описанных выше, классифицируются как термопласты .Это отражает тот факт, что выше T g они могут формоваться или прессоваться в формы, формоваться или отливаться из расплава или растворяться в подходящих растворителях для последующего формования. Из-за их высокой температуры плавления и плохой растворимости в большинстве растворителей кевлар и номекс оказались проблемой, но в конечном итоге эта проблема была решена.
Другая группа полимеров, характеризующаяся высокой степенью сшивания, сопротивляется деформации и растворению после достижения их окончательной морфологии. Такие полимеры обычно готовят в формах, которые позволяют получить желаемый объект.Поскольку эти полимеры после образования не могут быть изменены при нагревании, их называют термореактивными полимерами . Частичные формулы для четырех из них будут показаны ниже, если щелкнуть соответствующую кнопку. Первоначальная экспозиция представляет собой бакелит, один из первых полностью синтетических пластиков, который начал использоваться в коммерческих целях (около 1910 г.).
Природный смолистый полимер, называемый лигнином, имеет сшитую структуру, похожую на бакелит. Лигнин представляет собой аморфную матрицу, в которой ориентированы целлюлозные волокна древесины.Древесина — природный композитный материал, природный эквивалент композитов из стекловолокна и углеродного волокна. Здесь показана частичная структура лигнина
Эпоха пластмасс
Исторически многие эпохи характеризовались материалами, которые были тогда важны для человеческого общества (например, каменный век, бронзовый век и железный век). Двадцатый век получил несколько таких ярлыков, в том числе ядерный век и нефтяной век ; тем не менее, лучшее название, вероятно, пластический век .В течение этого периода никакие технологические достижения, кроме подачи электроэнергии в каждый дом, не повлияли на нашу жизнь больше, чем широкое использование синтетических пластмасс в нашей одежде, посуде, строительных материалах, автомобилях, упаковке и игрушках, и это лишь некоторые из них. . Разработка материалов, которые мы сейчас называем пластиками, началась с вискозы в 1891 году, продолжилась бакелитом в 1907 году, полиэтиленом в 1933 году, нейлоном и тефлоном в 1938 году, полипропиленом в 1954 году, кевларом в 1965 году и продолжается до сих пор.
Многие типы полимеров, которые мы смешиваем вместе как пластмассы, как правило, недороги, легки, прочны, долговечны и, при желании, гибки. Пластмассы могут обрабатываться экструзией, литьем под давлением, вакуумным формованием и прессованием, образуя волокна, тонкие листы или объекты определенной формы. Они могут быть окрашены по желанию и армированы стеклянными или углеродными волокнами, а некоторые из них могут быть расширены до пены низкой плотности. Многие современные клеи предполагают образование пластичного связующего вещества.Пластмассы заменили все большее количество природных материалов. При производстве клавиш пианино и бильярдных шаров пластик заменил слоновую кость, помогая слону выжить. Примечательно, что предприятие по производству синтетического волокна занимает гораздо меньшую площадь земли, чем потребовалось бы для производства такого же количества натуральных волокон, таких как хлопок, шерсть или шелк. При всех этих преимуществах неудивительно, что многое из того, что вы видите вокруг себя, сделано из пластика. Действительно, низкая стоимость, малый вес, прочность и конструктивная адаптируемость пластиков для решения различных задач привели к значительному росту их производства и использования из года в год, который, вероятно, продолжится.Действительно, многие пластмассы используются в одноразовых продуктах, предназначенных только для одноразового использования.
Закон непреднамеренных последствий
Успешные решения технологических проектов часто достигаются путем сосредоточения внимания на ограниченном наборе переменных, которые напрямую связаны с желаемым результатом. Однако у природы часто есть способ вознаградить такой успех, выявив неожиданные проблемы, возникающие «вне коробки» определенного проекта. В случае с пластмассами их благоприятная долговечность и относительная низкая стоимость привели к серьезному загрязнению окружающей среды, поскольку использованные предметы и упаковка небрежно выбрасываются и заменяются в бесконечном цикле.Мы видим это каждый день на улицах и полях наших кварталов, но проблема гораздо серьезнее. Чарльз Мур, американский океанограф, в 1997 году обнаружил огромное скопление мусора, вес которого оценивается почти в 100 миллионов тонн, плавающее в Тихом океане между Сан-Франциско и Гавайями. Названное «Большим тихоокеанским мусорным пятном», это месиво из мусора состоит в основном (80%) из кусочков пластика, которые перевешивают планктон в соотношении 6:1, в районе, вдвое превышающем размер Техаса. Хотя часть этих обломков происходит от судов в море, не менее 80% приходится на наземный мусор.Представленная здесь информация и иллюстрация слева взяты из статьи Сьюзан Кейси в
BestLife
Циркуляция течений по часовой стрелке, движимая глобальной системой ветра и ограниченная окружающими континентами, образует вихрь или круговорот, сравнимый с большим водоворотом. Каждый крупный океанический бассейн имеет большой круговорот в субтропическом регионе с центром около 30º северной и южной широты. Североатлантический субтропический круговорот известен как Саргассово море. Более крупный субтропический круговорот в северной части Тихого океана, называемый депрессией, представляет собой зону конвергенции, где пластик и другие отходы смешиваются вместе.Подобные области есть в южной части Тихого океана, в Северной и Южной Атлантике и в Индийском океане.
Помимо отвратительного эстетического вида, мусорное пятно представляет собой серьезную проблему для окружающей среды и здоровья. Никто не знает, сколько времени потребуется для того, чтобы некоторые из этих пластиков разложились или вернулись к составляющим их молекулам. Устойчивые объекты, такие как кольца из шести упаковок и выброшенные сети, ловят морских животных. Морские птицы принимают мелкие пластиковые отходы за пищу; и часто обнаруживаются непереваренными в кишечнике мертвых птиц.Гранулы пластика размером с чечевицу, в изобилии встречающиеся там, где производятся и распространяются пластмассы, разносятся ветром по всей биосфере. Они достаточно легкие, чтобы развеваться, как пыль, и смываться в гавани, ливневые стоки и ручьи. Сбежавшие гранулы и другой пластиковый мусор мигрируют в океан по круговороту в основном с суши. В таких отдаленных местах, как Раротонга на островах Кука, они обычно встречаются в смеси с пляжным песком. Оказавшись в океане, гранулы могут поглощать в миллион раз больше любых органических загрязнителей, обнаруженных в окружающих водах.Пустышки в море легко принимают за рыбью икру существа, которые очень хотели бы такой закуской. Оказавшись внутри тела большеглазого тунца или королевского лосося, они становятся частью нашей пищевой цепи.
Переработка и утилизация
Большинство пластиков рассыпаются на все более мелкие фрагменты под воздействием солнечного света и непогоды. За исключением небольшого количества, которое было сожжено — а это очень небольшое количество — каждый кусочек когда-либо произведенного пластика все еще существует, если только молекулярная структура материала не предназначена для биоразложения.К сожалению, очистка участка мусора не является реалистичным вариантом, и если мы не изменим наши привычки утилизации и переработки, он, несомненно, станет больше. Одним из разумных решений было бы требование к производителям по возможности использовать натуральные биоразлагаемые упаковочные материалы, а потребителям — добросовестно утилизировать свои пластиковые отходы. Таким образом, вместо того, чтобы выбрасывать весь пластиковый мусор на свалку, часть его может давать энергию путем прямого сжигания, а часть перерабатываться для повторного использования в качестве заменителя первичного пластика.Последнее особенно привлекательно, поскольку большая часть пластмасс производится из нефти, сокращающегося ресурса с неустойчивой ценой.
Энергетический потенциал пластиковых отходов относительно значителен и составляет от 10,2 до 30,7 МДж/кг, что позволяет предположить их применение в качестве источника энергии и стабилизатора температуры на муниципальных мусоросжигательных заводах, теплоэлектростанциях и цементных печах. Использование пластиковых отходов в качестве источника топлива могло бы стать эффективным средством сокращения потребности в мусорных свалках при восстановлении энергии.Это, однако, зависит от использования соответствующих материалов. Недостаточный контроль горения, особенно для пластмасс, содержащих хлор, фтор и бром, представляет собой риск выделения токсичных загрязняющих веществ.
Независимо от того, используются ли пластиковые отходы в качестве топлива или в качестве источника переработанного пластика, они должны быть разделены на разные категории. С этой целью в 1988 году Общество производителей пластмасс (SPI) разработало систему идентификационного кодирования, которая используется во всем мире. Этот код, показанный справа, представляет собой набор символов, нанесенных на пластмассу для идентификации типа полимера с целью обеспечения эффективного разделения различных типов полимеров для переработки.Сокращения кода объясняются в следующей таблице.
| 94 236 | |||
| ПИТИ | ПЭВП | V | ПВД |
|---|---|---|---|
| полиэтилен терефталат | высокой плотности полиэтилен | поливинилхлорид | низкой плотности полиэтилен |
| ПП | PS | ДРУГИЕ | |
| полипропилен | полистирол | полиэфиры, акрилы полиамиды, тефлон и т.д. | |
Несмотря на использование символа переработки в кодировке пластмасс, у потребителей возникает путаница в отношении того, какие пластмассы легко перерабатываются. В большинстве населенных пунктов по всей территории Соединенных Штатов PETE и HDPE являются единственными пластиками, собираемыми в рамках муниципальных программ утилизации. Тем не менее, некоторые регионы расширяют ассортимент собираемого пластика по мере появления рынков. (Например, в Лос-Анджелесе перерабатывается весь чистый пластик с номерами от 1 до 7). Теоретически, большинство пластиков пригодны для вторичной переработки, и некоторые типы можно использовать в сочетании с другими.Однако во многих случаях существует несовместимость между различными типами, что требует их эффективного разделения. Поскольку пластмассы, используемые в данном производственном секторе (например, в электронике, автомобилестроении и т. д.), как правило, ограничены несколькими типами, эффективная переработка часто лучше всего достигается с помощью целевых потоков отходов.
Пластиковый мусор из большинства домохозяйств, даже при некотором разделении пользователей, представляет собой смесь неопознанных кусочков. Утилизация таких смесей является сложной задачей.Процесс float/sink оказался полезным в качестве первого шага. При помещении в среду промежуточной плотности частицы разной плотности отделяются друг от друга: частицы с меньшей плотностью всплывают, а частицы с большей плотностью тонут. Использовались различные разделительные среды, включая воду или водные растворы известной плотности (спирт, NaCl, CaCl 2 или ZnCl 2 ). Как показано в следующей таблице, плотности обычных пластиков достаточно различаются, чтобы их можно было различать таким образом.Цилиндроконическое циклонное устройство, показанное справа, обеспечивает процедуру непрерывной подачи, при которой разделяемый материал закачивается в сосуд одновременно с разделяющей средой. Некоторые полимеры, такие как полистирол и полиуретан, обычно превращают в вспененные твердые вещества, которые имеют гораздо меньшую плотность, чем твердый материал.
| |||||||||||||||||
Одна из серьезных проблем при переработке отходов связана с наличием большого количества добавок.К ним относятся пигменты для окраски, твердые волокна в композитах, стабилизаторы и пластификаторы. В случае ПЭТФ (или ПЭТФ), который обычно используется для изготовления бутылок, некоторые отходы могут подвергаться механической и термической обработке для производства упаковочных материалов и волокон низкого качества. Для повышения ценности извлеченного ПЭТЭ его можно деполимеризовать перегретым метанолом в диметилтерефталат и этиленгликоль. Затем эти химические вещества очищают и используют для производства первичного ПЭТ. Углеводородные полимеры, такие как полиэтилен и полипропилен, могут быть расплавлены и экструдированы в гранулы для повторного использования.Однако наличие красителей или пигментов ограничивает ценность этого продукта.
Биоразлагаемые полимеры
Пластмассы, полученные из природных материалов, таких как целлюлоза, крахмал и гидроксикарбоновые кислоты, легче разлагаются под воздействием кислорода, воды, почвенных организмов и солнечного света, чем большинство полимеров на основе нефти. Гликозидные связи в полисахаридах и сложноэфирные группы в полиэфирах представляют собой точки атаки ферментов микроорганизмов, которые облегчают их разложение.Такие биоразлагаемые материалы можно компостировать, разлагать и возвращать в землю в качестве полезных питательных веществ. Тем не менее, важно признать, что правильное компостирование необходимо. Размещение таких материалов на свалке приводит к более медленному анаэробному разложению, в результате которого образуется метан, парниковый газ.
Производные целлюлозы, такие как ацетат целлюлозы, уже давно используются для производства пленок и волокон. Наиболее полезным ацетатным материалом является диацетат, в котором две трети гидроксильных групп целлюлозы этерифицированы.Ацетатные волокна теряют прочность при намокании, поэтому одежду из ацетата необходимо сдавать в химчистку. Другой основной полисахарид, крахмал, менее прочен, чем целлюлоза, но в гранулированной форме он в настоящее время заменяет полистирол в качестве упаковочного материала.
Двумя природными полиэфирами, которые находят все более широкое применение в качестве заменителей пластмасс на нефтяной основе, являются полилактид (PLA) и полигидроксиалканоаты (PHA), последние чаще всего представляют собой сополимеры с полигидроксибутиратом (PHB). Структуры этих полимеров и их мономерных предшественников показаны ниже.
PLA на самом деле является полимером молочной кислоты, но димерный лактид используется в качестве прекурсора, чтобы избежать образования воды при прямой полиэтерификации. Бактериальная ферментация используется для получения молочной кислоты из кукурузного крахмала или тростникового сахара. После димеризации до лактида проводят полимеризацию очищенного лактида с раскрытием цикла с использованием соединений двухвалентного олова в качестве катализаторов. PLA можно перерабатывать, как и большинство термопластов, в волокна и пленки.В ситуациях, требующих высокого уровня ударной вязкости, прочности PLA в первозданном виде часто бывает недостаточно. Смеси PLA с полимерами, такими как ABS, обладают хорошей стабильностью формы и визуальной прозрачностью, что делает их полезными для недорогих упаковочных приложений. Материалы PLA в настоящее время используются в ряде биомедицинских приложений, таких как швы, стенты, диализные среды и устройства для доставки лекарств. Однако одним из недостатков полилактидов для биомедицинских применений является их хрупкость.
Молочная кислота имеет хиральный центр, причем (S)(+)-энантиомер представляет собой широко распространенную природную форму (L-молочная кислота). Из-за хиральной природы молочной кислоты существует несколько различных форм полилактида. Поли-L-лактид (PLLA) представляет собой продукт полимеризации (S,S)-лактида. PLLA имеет кристалличность около 37%, температуру стеклования 50-80 ºC и температуру плавления 173-178 ºC. Температура плавления PLLA может быть увеличена на 40-50 ºC, а температура его тепловой деформации может быть увеличена примерно с 60 ºC до 190 ºC путем физического смешивания полимера с PDLA (поли-D-лактидом).PDLA и PLLA образуют высокорегулярный стереокомплекс с повышенной кристалличностью.
PHA (полигидроксиалканоаты) синтезируются микроорганизмами, такими как Alcaligenes eutrophus , выращенными в подходящей среде и питаемыми соответствующими питательными веществами, так что они быстро размножаются. Как только популяция увеличивается, состав питательных веществ меняется, заставляя микроорганизмы синтезировать ПГА. Собранное количество PHA из организма может достигать 80% от сухого веса организма.Простейшей и наиболее часто встречающейся формой ПГА является поли(R-3-гидроксибутират), ПОБ или П(3ГБ)). Чистый ПОБ, состоящий из 1000-30000 единиц оксикислоты, является относительно хрупким и жестким. В зависимости от микроорганизма, многие из которых созданы для этой цели с помощью генной инженерии, и условий культивирования могут образовываться гомо- или сополиэфиры с различными гидроксиалкановыми кислотами. Такие сополимеры могут иметь улучшенные физические свойства по сравнению с гомо-P(3HB). В настоящее время эти ПГА стоят примерно в два раза дороже, чем пластмассы на нефтяной основе.Также был создан искусственный просо, в листьях и стеблях которого растет ПГА, что дает возможность избежать некоторых затрат, связанных с крупномасштабной бактериальной ферментацией.
В отличие от P(3HB), полимер 4-гидроксибутирата, P(4HB), является эластичным и гибким с более высокой прочностью на растяжение. Сополимеры P(3HB) и P(4HB) синтезированы Comamonas acidovarans . Молекулярная масса остается примерно такой же (400 000–700 000 Да), но термические свойства коррелируют с соотношением этих мономерных звеньев.Т.пл. уменьшается со 179 до 130 (или ниже) с увеличением 4HB, а при увеличении 4HB с 0% до 100% Tg уменьшается с 4 до -46. 4-Гидроксибутират (4HB) производится из 1,4-бутандиола микроорганизмами, такими как Aeromonas hydrophila , Escherichia coli или Pseudomonas putida . Затем ферментационный бульон, содержащий 4ГБ, использовали для производства гомополимера П(4ГБ), а также сополимеров с П(3ГБ), [П(3ГБ-4ГБ)]. В следующей таблице перечислены некоторые свойства этих гомополимеров и сополимеров.
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3HV = 3-гидроксивалерат, 3HD = 3-гидроксидеканоат |

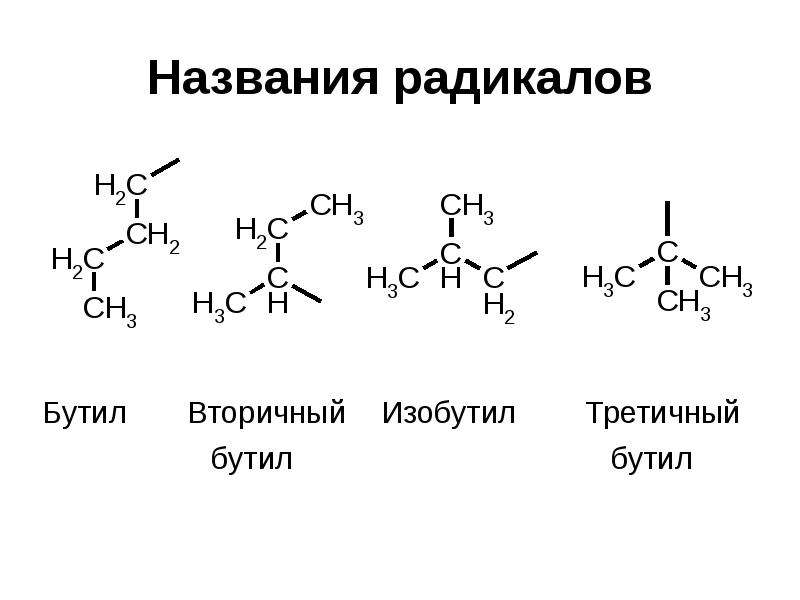
 Добавление нижних индексов дает молекулярную формулу CCl 3 F.
Добавление нижних индексов дает молекулярную формулу CCl 3 F.
 Его сокращенная структурная формула (CH 3 ) 3 N.
Его сокращенная структурная формула (CH 3 ) 3 N. B Сера находится слева от хлора в таблице Менделеева, поэтому в формуле она написана первой. Добавление нижних индексов дает молекулярную формулу S 2 Cl 2 .
B Сера находится слева от хлора в таблице Менделеева, поэтому в формуле она написана первой. Добавление нижних индексов дает молекулярную формулу S 2 Cl 2 . B Согласно соглашению об органических соединениях C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.
B Согласно соглашению об органических соединениях C и H пишутся первыми, что дает молекулярную формулу C 3 H 9 N.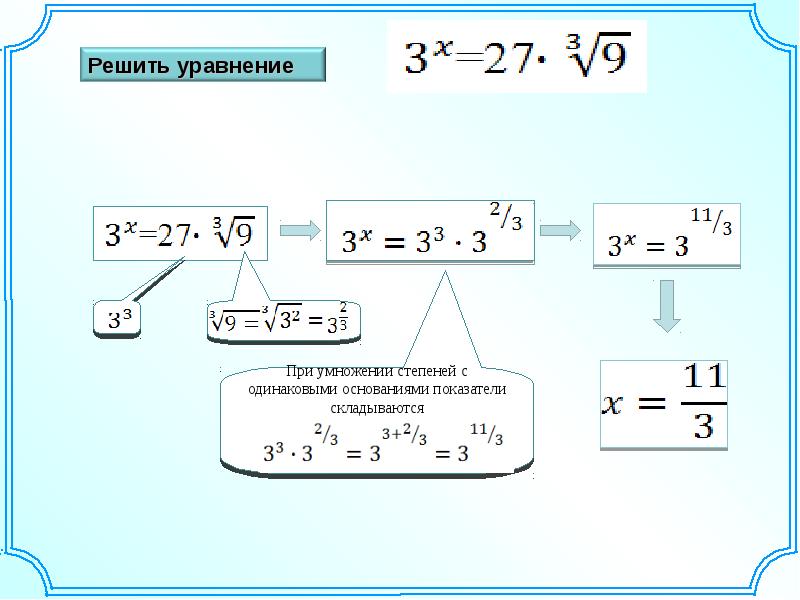
 +
+ 
