Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
Среди многоэлементных соединений важную группу составляют гидроксиды. Некоторые из них проявляют свойства оснований (основные гидроксиды) – NaOH, Ba(OH)2 и т.п.; другие проявляют свойства кислот (кислотные гидроксиды) – HNO3, H3PO4 и другие. Существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как свойства оснований, так и свойства кислот – Zn(OH)2, Al(OH) 3 и т.п.
ОСНОВАНИЯ
Основания — это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула:
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Формула | Название | Формула | Название |
LiOH | гидроксид лития | Ca(OH)2 | гидроксид кальция |
NaOH | гидроксид натрия | Cu(OH)2 | гидроксид меди(II) |
KOH | гидроксид калия | Fe(OH)3 | гидроксид железа(III) |
Классификация оснований
Щёлочи – это основания
растворимые в воде. К щелочам относят
гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH,
Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные — нерастворимые.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при
взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
Классификация оснований по числу групп ОН:
n=1 однокислотное
n=2 двухкислотное
n=3 трехкислотное
См. «Классификация оснований»
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
ЩЁЛОЧЕЙ
1. Металл + H2O = ЩЁЛОЧЬ + Н2↑
2Na + 2H2O = 2NaOH + H2
2. ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
Na2O + H2O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na,
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
МехАу+ Ме*(OH)n = Me(OH)у↓+Ме*хАn
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
Видео «Получение нерастворимых оснований»
ВЫПОЛНИТЕ ЗАДАНИЯ:
LiOH , NO , Al2O3, Zn(OH)2, CaO , SiO2, CrO , NaOH , Mn2O7, Fe(OH2,
Cr2O3
| Основный оксид | Кислотный оксид | Амфотерный оксид | Безразличный оксид | Щёлочь | Нерастворимое основание |
№2.
 Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их :MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2, K2O, ZnO, KOH, CrO3№3. Приведите по два уравнения реакций получения следующих оснований:
Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их :MnO, P2O5, Ca(OH)2, CO, Al(OH)3, BeO, Mg(OH)2, K2O, ZnO, KOH, CrO3№3. Приведите по два уравнения реакций получения следующих оснований:1) Гидроксид калия
2) Гидроксид кальция
в) Гидроксид железа (III)
ТРЕНАЖЁРЫ
Тренажёр №1. Классификация оснований по растворимости в воде
Тренажёр №2. «Оказание первой помощи при попадании щелочей на кожу»
Тренажёр №3. Правила техники безопасности при работе со щелочами
Тренажёр №4. Составление названия основания по формуле
Тренажёр №5. Составление формул оснований
Тренажёр №6. Установление соответствия: основание — оксид металла
Физические свойства оснований — урок. Химия, 8–9 класс.
При обычных условиях основания (гидроксиды металлов) являются твёрдыми кристаллическими веществами. Они нелетучи и не имеют запаха.
Растворимость оснований в воде
По растворимости в воде эти соединения делят на две группы: щёлочи и практически нерастворимые основания. В свою очередь щёлочи делят на хорошо растворимые в воде и малорастворимые основания.
Общеустановленных чётких границ между хорошо-, малорастворимыми и практически нерастворимыми в воде веществами не существует, поэтому справочные данные, взятые из разных источников, могут несколько отличаться друг от друга. Приведём сведения о растворимости щелочей, которых мы будем придерживаться.
Классификация щелочей по их растворимости в воде:
LiOH — гидроксид лития, NaOH — гидроксид натрия, KOH — гидроксид калия, RbOH — гидроксид рубидия, CsOH — гидроксид цезия, FrOH — гидроксид франция, Ba(OH)2 — гидроксид бария, Ra(OH)2 — гидроксид радия. | Ca(OH)2 — гидроксид кальция, Sr(OH)2 — гидроксид стронция.
|
Обрати внимание!
Почти все остальные основания (гидроксиды металлов) являются практически нерастворимыми.
Окраска оснований
Большинство оснований — вещества белого цвета. Но существуют гидроксиды металлов, которые имеют отличающуюся окраску.
Цвет основания | Примеры |
Белый
| LiOH — гидроксид лития, Mg(OH)2 — гидроксид магния, Ca(OH)2 — гидроксид кальция |
| Жёлтый | CuOH — гидроксид меди(\(I\)) |
Светло-розовый (при соприкосновении с кислородом воздуха окраска становится коричневой) | Mn(OH)2 — гидроксид марганца(\(II\)) |
| Красно-коричневый | Fe(OH)3 — гидроксид железа(\(III\)) |
Белый с зеленоватым оттенком (при соприкосновении с кислородом воздуха окраска становится темнее) | Fe(OH)2 — гидроксид железа(\(II\)) |
| Светло-зелёный | Ni(OH)2 — гидроксид никеля(\(II\)) |
| Синий | Cu(OH)2 — гидроксид меди(\(II\)) |
Свойства оснований
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп. Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости
в воде основания делят на щелочи
(растворимые в воде основания) и нерастворимые в воде основания.
Щелочи образуют щелочные и щелочно-земельные металлы, а также
некоторые другие элементы-металлы. По кислотности (числу ионов
ОН–,
образующихся при полной диссоциации, или количеству ступеней
диссоциации) основания подразделяют на
однокислотные (при полной диссоциации получается один ион
ОН–;
одна ступень диссоциации) и многокислотные
(при полной диссоциации получается больше одного иона
ОН–; более одной ступени
диссоциации). Среди многокислотных оснований различают
двухкислотные (например,
Sn(OH)2),
трехкислотные
По кислотности (числу ионов
ОН–,
образующихся при полной диссоциации, или количеству ступеней
диссоциации) основания подразделяют на
однокислотные (при полной диссоциации получается один ион
ОН–;
одна ступень диссоциации) и многокислотные
(при полной диссоциации получается больше одного иона
ОН–; более одной ступени
диссоциации). Среди многокислотных оснований различают
двухкислотные (например,
Sn(OH)2),
трехкислотные
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
|
Амфотерный гидроксид (основная и кислотная форма) |
Комплексный ион |
|
|
Zn(OH)2 / H2ZnO2 |
ZnO2 (II) |
[Zn(OH)4]2– |
|
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
|
Be(OH)2 / H2BeO2 |
BeO2 (II) |
[Be(OH)4]2– |
|
Sn(OH)2 / H2SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
|
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
|
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
|
Cr(OH)3 / HCrO 2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания —
твердые вещества различных цветов и различной растворимости в воде.
Основания —
твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация: КОН + nН2О К+×mН2О + ОН–×dН2О или сокращенно: КОН К+ + ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в
основном диссоциация протекает по первой ступени). Например,
двухкислотное основание Fe(OH)
Fe(OH)2FeOH+ + OH– (1 ступень);
FeOH+Fe2+ + OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор + ОН– (щелочь) окрашенное соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
Таблица 2 — Температуры разложения некоторых гидроксидов металлов
| Гидроксид | tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH)3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
| Sr(OH)2 | 535 | Zn(OH)2 | 125 | Bi(OH)3 | 100 |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
2Al + 2OH–+
6H2О
®
2[Al(OH)4]– + 3H2.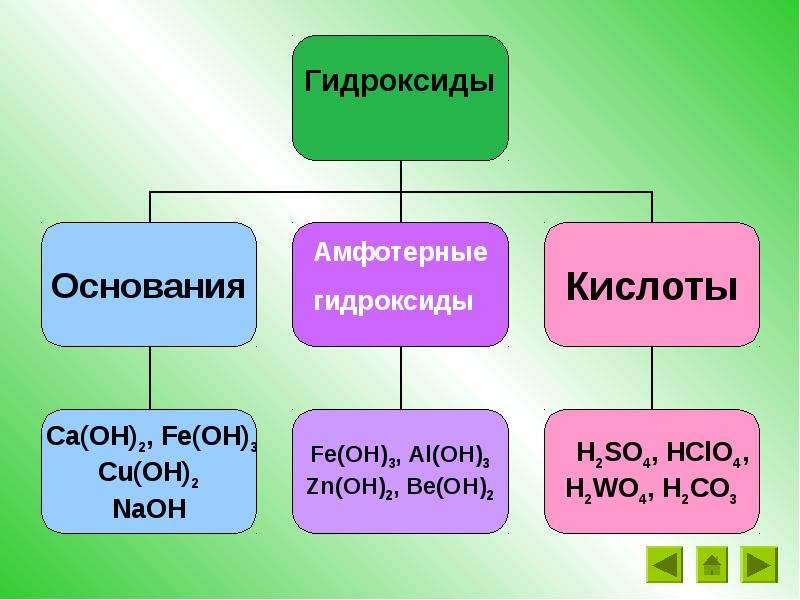
При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2® Na2CO3 + H2O 2OH–+ CO2 ® CO32– + H2O.
В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH–+ ZnO + H2О ® [Zn(OH)4]2–.
При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
таблицу 1):
В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2++ 2OH– ® Cu(OH)2¯.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2++ 2OH– ® Zn(OH)2¯.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O
®
2NaOH + H2
Ca + 2H2O
®
Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2+ Na2CO3® 2NaOH + BaCO3¯ Ba2+ + CO32– ® BaCO3¯.
Л.А. Яковишин
Тема: Гидроксиды | План-конспект урока по химии (8 класс) по теме:
Гидроксиды. Основания.
Гидроксиды – это сложные вещества, в состав которых входит группа –OH.
Гидроксиды
Основные (ОСНОВАНИЯ) | Амфотерные | Кислотные (КИСЛОТЫ) |
Все гидроксиды одновалентных металлов и большинства двухвалентных металлов. | Большинство гидроксидов металлов с валентностью III и IV. | Гидроксиды неметаллов и гидроксиды металлов с валентностью V, VI и VII. |
NaOH, KOH, Ba(OH)2, Fe(OH)2, Mg(OH)2, Cu(OH)2, Ca(OH)2 | Be(OH)2, Al2(OH)3, Cr2(OH)3, Zn(OH)2, Fe(OH)3 | h3CO3, h3SO4, HMnO4, K2CrO4 |
Растворимые (ЩЕЛОЧИ) | Нерастворимые |
NaOH, KOH, Ba(OH)2, Ca(OH)2 | Mg(OH)2, Cu(OH)2, Fe(OH)2 |
ОСНОВАНИЯ
Основания – это сложные вещества, в молекуле которых атомы металла связаны с одной или несколькими гидроксидными группами –OH (Ме ОН).
Щелочи – это растворимые в воде основания. Некоторые растворимые в воде основания называют едкими щелочами: NaOH – едкий натр, KOH – едкий кали.
Все основания – твёрдые вещества (кроме гидроксида аммония Nh5OH), имеющие разные цвета: Cu(OH)2 – голубой, Fe(OH)2 – бледно-зелёный, Ca(OH)2 – белый, Co(OH)2 – розовый.
Графические формулы.
Показывают порядок связей и их количество (по валентности). В гидроксидах атомы кислорода связаны только с атомами других элементов и не связаны между собой.
Ca(OH)2 | HO – Ca – OH |
NaOH | Na – O – H |
Получение оснований
- Растворимых оснований:
- Взаимодействием щелочных и щелочноземельных металлов с водой
2Na + 2HOH → 2NaOH + h3↑
Ca + 2HOH → Ca(OH)2 + h3↑
- Взаимодействием оксидов щелочных и щелочноземельных металлов с водой
Na2O + h3O → 2NaOH (Na2O·h3O)
BaO + h3O → Ba(OH)2 (BaO·h3O)
- Нерастворимых оснований:
- Взаимодействием щелочей с растворимыми солями металлов
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
2KOH + ZnCl2 → Zn(OH)2↓ + 2KCl
Химические свойства
Общие свойства оснований объясняются наличием в их растворах анионов OH-, которые образуются в результате электролитической диссоциации молекул оснований:
Me(OH)y ↔ Mey+ + yOH-
- Водные растворы щелочей изменяют окраску индикаторов
Индикатор | Цвет индикатора в среде | ||
Щелочной (pH > 7) | Нейтральной (pH = 7) | Кислой (pH | |
Универсальная индикаторная бумага | Синий | Желтый | Красный |
Лакмус | Синий | Фиолетовый | Красный |
Фенолфталеин | Малиновый | Бесцветный | Бесцветный |
Метиловый оранжевый | Желтый | Оранжевый | Розовый |
- Взаимодействуют с кислотами с образованием соли и воды
NaOH + HCl → NaCl + HOH
Cu(OH)2 + h3SO4 → CuSO4 + 2HOH
- Взаимодействуют с кислотными оксидами с образованием соли и воды
2NaOH + SO2 → Na2SO3 + h3O
Ca(OH)2 + CO2 → CaCO3 + h3O
- Растворы щелочей взаимодействуют с растворами солей при образовании нерастворимого основания или нерастворимой соли
2NaOH + CuSO4→ Cu(OH)2↓ + h3O
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH
- Нерастворимые основания при нагревании разлагаются на основной оксид и воду
to
Cu(OH)2 → CuO + h3O
- Растворы щелочей взаимодействуют металлами, которые образуют амфотерные оксиды и гидроксиды:
Zn + 2NaOH → Na2ZnO2 + h3↑
цинкат натрия
2Al + 2KOH + 6h3O → 2K[Al(OH)4] + 3h3↑
тетрагидроксоалюминат калия
- Растворы щелочей взаимодействуют амфотерными оксидами:
ZnO + 2NaOH → Na2ZnO2 + h3O
цинкат натрия
Al2O3 + 2KOH → 2KAlO2 + h3O
алюминат калия
- Щелочи взаимодействуют амфотерными гидроксидами:
- в расплаве
Al(OH)3 + KOH → KAlO2 + 2h3O
алюминат калия
- в растворе
Al(OH)3 + KOH → K[Al(OH)4]
- Щелочи взаимодействуют с неметаллами:
2NaOH + Cl20 → NaCl-1 + NaCl+1O + h3O
Ме +O2 Основной оксид +h3O (-h3O) Основание | амфМе +O2 Амфотерный оксид
+h3O Амфотерное основание | неМе +O2 Кислотный оксид +h3O Кислота |
Соли | ||
ОСНОВАНИЕ | НЕМЕТАЛЛ | НЕМЕТАЛЛ |
ТИПИЧНЫЙ МЕТАЛЛ «АМФОТЕРНЫЙ» МЕТАЛЛ» | МЕТАЛЛ | |
ОСНОВНОЙ ОКСИД АМФОТЕРНЫЙ ОКСИД КИСЛОТНЫЙ ОКСИД | ОКСИД | |
ОСНОВНОЙ (ОСНОВАНИЕ) АМФОТЕРНЫЙ ГИДРОКСИД КИСЛОТНЫЙ (КИСЛОТА) | ГИДРОКСИД | |
СОЛЬ | СОЛЬ |
Гидроксиды.
 Основания: способы получения — презентация онлайн
Основания: способы получения — презентация онлайн1. Гидроксиды. Основания: способы получения.
2. Цель урока:
Углубить знания о важнейших классах веществнеорганической химии
3. Формулы только оксидов приведены в ряду:
1.2.
3.
4.
h3SO3, BeO, CuCl2
Na2CO3, Na2O, Cl2O7
CO2, Li2O, CrO3
KOH, K2O, BaO
4. Не характеризует свойство основных оксидов:
1.2.
3.
4.
CaO + h3O → Ca(OH)2
SO3 + Na2O → Na2SO4
K2O + 2HCl → 2KCl + h3O
Zn(OH)2 → ZnO + h3O
5. Назовите вещества:
CONa2O
6. Гидроксиды. Основания: способы получения.
План урока:Гидроксиды. Основания: способы
получения
Что надо узнать:
Состав и
названия
Физические
свойства
Способы
получения
Определение
Классификаци
я
Роль в жизни
человека
8. K2O + h3O → 2KOH
9. K2O + h3O → 2KOH
Гидроксиды – это сложные вещества в составкоторых входят атомы металлов и
гидроксогруппы ОН.
!!! Число гидроксогрупп в формуле
гидроксида соответствует валентности металла
10. Гидроксиды. Основания: способы получения.
Основания — это гидроксиды металлов IА иIIА (кроме Be), а также металлов в
минимальной степени окисления (если она
имеет переменное значение)
• Например: NaOH, LiOH, Mg(OH)2, Ca(OH)2,
Cr(OH)2, Mn(OH)2.
12. Работа с учебником:
Стр 137 «Классификация гидроксидов»Стр 139 «Физические свойства оснований»
? На какие группы можно классифицировать
основания?
? Физические свойства оснований?
Гидроксиды
КОН
Zn(ОН)2
NaOH
Fe(OH)3
Mg(OH)2
Be(OH)2
Гидроксиды
Основания
Амфотерные
гидроксиды
КОН
Zn(ОН)2
NaOH
Fe(OH)3
Ca(OH)2
Be(OH)2
Основания
Растворимые
в воде
Нерастворимые
в воде
Щелочи
Fe(OH)2
КОН
LiOH
NaOH
Ca(ОН)2
Cu(OH)2
Mg(ОН)2
17.
 NaOH – гидроксид натрия, едкий натр, каустическая сода NaOH – гидроксид натрия, едкий
NaOH – гидроксид натрия, едкий натр, каустическая сода NaOH – гидроксид натрия, едкийкаустическая сода
натр,
18. Получение оснований
ЩелочиАктивный металл + вода
2Na + 2h3O 2NaOH + h3
Основной оксид + вода
K2O + h3O 2KOH
Нерастворимые в воде основания
Косвенный
способ
FeCl2 +Ba(OH)2 BaCl2 + Fe(OH)2
CuSO4 +2NaOH Na2SO4 + Cu(OH)2
Zn(NO3)2 +2KOH 2KNO3 + Zn(OH)2
Реакция обмена:
соль + щелочь → соль + нерастворимое основание
План урока:
Гидроксиды. Основания: способы
получения
Что надо узнать:
Состав и
названия
Определение
Физические
свойства
Способы
получения
Классификация
Роль в жизни
человека
21. Домашнее задание:
• §41• По задачнику
23. Химические свойства оснований
Щелочи изменяют окраску индикаторовЛакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
Фенолфталеиновый
в щелочах
малиновый
Индикатор фиксирует наличие
ионов ОН- в растворе щелочи
рН = 7
рН
рН > 7
Основания реагируют с кислотами
щелочи
нерастворимые
Нейтрализация
NaOH + HNO3 NaNO3 + h3O
Cu(OH)2 + 2HNO3 Cu(NO3)2 + 2h3O
основание
соль
кислота
вода
Индикатор
Изменение
рН среды
NaOH + HCl NaCl + h3O
Щелочи реагируют с кислотными
оксидами
Кислотный
оксид
Соответствующая
кислота
SO2
h3SO3
SO3
h3SO4
P2O5
h4PO4
Кислотный
остаток в соли
MeSO3 (II)
сульфит
MeSO4 (II)
сульфат
MePO4 (III)
фосфат
N2O5
HNO3
MeNO3 (I) нитрат
CO2
h3CO3
SiO2
h3SiO3
MeCO3 (II)
карбонат
MeSiO3 (II)
силикат
6NaOH + P2O5 2Na3PO4 + 3h3O
Щелочь
+
Кислотный
оксид
Соль
Н3 PO4
+
Вода
2KOH + CO2 K2CO3 + h3O
Н2 CO3
Нейтрализация
Нерастворимые основания
при нагревании разлагаются
2Fe(OH)3 Fe2O3 + 3h3O
Cu(OH)2 CuO + h3O
Гидроксид
Оксид
металла
+
Вода
––
Cu(OH)2 –t° CuO + h3O
33.
 Определение оснований Ме(ОН)n
Определение оснований Ме(ОН)nКОН
Гидроксиды
Ca(ОН)2 Al(ОН)3
Ba(ОН)2
KOH K+1 + OH-1
Ba(ОН)2 Ba+2 + 2 OH-1
Основания – вещества, в растворах которых
содержатся гидроксильные ионы
34. Сильные и слабые основания
Сильные основанияNaOH гидроксид
натрия (едкий натр)
KOH гидроксид калия
(едкое кали)
LiOH гидроксид
лития
Ba(OH)2 гидроксид
бария
Ca(OH)2 гидроксид
кальция
Слабые основания
Mg(OH)2 гидроксид
магния
Fe(OH)2 гидроксид
железа (II)
Zn(OH)2 гидроксид
цинка
Nh5OH гидроксид
аммония
Fe(OH)3 гидроксид
железа (III)
Основания. — Химия — Подготовка к ЕГЭ
Конспект занятия «Основания.»Основания – это электролиты, образующие в результате электролитической диссоциации в качестве анионов только анионы ОН– (гидроксид-ионы). Число гидроксид-ионов, приходящихся на один катион металла, называется кислотностью основания. Соответственно, бывают однокислотные (NaOH, KOH) и многокислотные (Ca(OH)2, Fe(OH)2) основания.
Основания делятся на сильные (щелочи) и слабые. Заметные концентрации гидроксид-ионов в растворе могут создать только сильные основания – щелочи. Щелочами являются гидроксиды щелочных и щелочноземельных металлов. Наиболее часто использующиеся на практике щелочи – NaOH, KOH, Ca(OH)2, Ba(OH)2. Все остальные основания являются слабыми. Гидроксиды бериллия и магния не являются щелочами. Причем Ве(OH)2 – амфотерный гидроксид, Mg(OH)2 – слабое основание.
Все щелочи – сильные электролиты, диссоциируют полностью и необратимо:
Ва(ОН)2 Ва2+ + 2ОН–.
Диссоциация протекает по двум ступеням практически полностью.
Рассмотрим химические свойства оснований.
Общие химические свойства щелочей обусловлены наличием в их растворах гидроксид-ионов. Щелочи изменяют окраску индикаторов (фенолфталеин – малиновый; лакмус – синий; метилоранж – желтый).
В ионных уравнениях формулы щелочей следует записывать в диссоциированном виде.
Химические свойства щелочей
Взаимодействие с кислотами (реакция нейтрализации):
NaOH + HCl = NaCl + H2O
H+ + OH– = H2O.
Взаимодействие с кислотными и амфотерными оксидами:
2NaOH + SiO2 = Na2SiO3 + H2O
2OH– + SiO2 = SiO32– + H2O;
2NaOH + ZnO Na2ZnO2 + Н2О.
Взаимодействие с амфотерными гидроксидами:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Al(OH)3 + 3OH– = [Al(OH)6]3–.
Взаимодействие с солями (реакция обмена):
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Fe3+ + 3OH– = Fe(OH)3.
Некоторые щелочи при нагревании разлагаются:
Ca(OH)2 CaO + H2O;
Ba(OH)2 BaO + H2O;
2LiOH Li2O + H2O.
Гидроксиды натрия и калия не разлагаются при нагревании. При температурах 323 0С и 405 0С соответственно NaOH и KOH плавятся без разложения.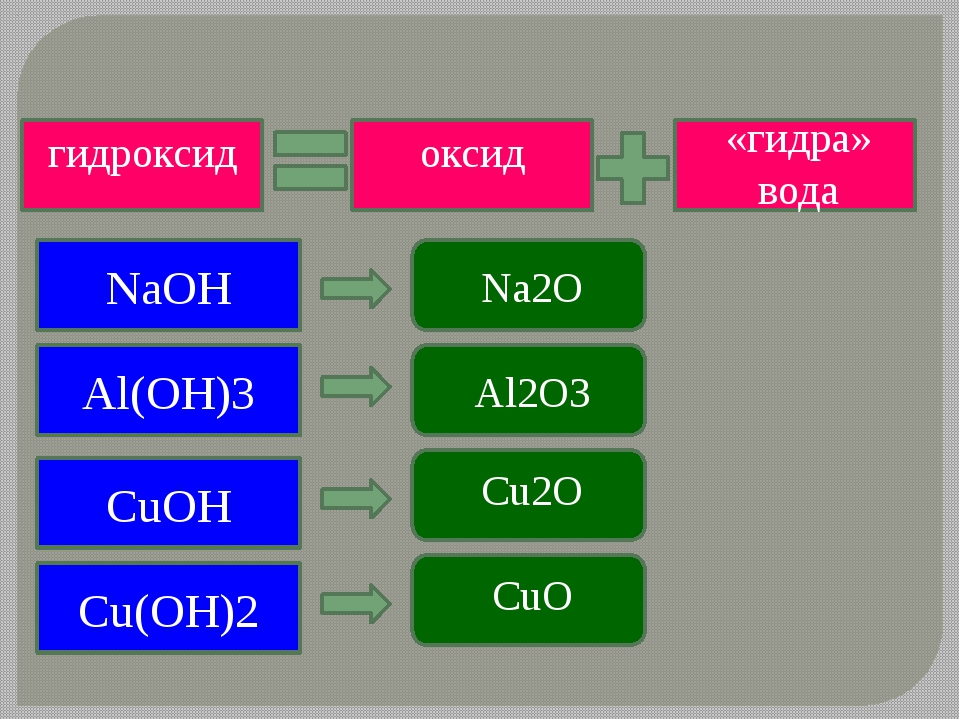
Слабые основания обладают очень малой растворимостью и не могут создать заметной концентрации ионов ОН–, поэтому ряд свойств, присущих щелочам для них нехарактерен. В ионных уравнениях формулы нерастворимых оснований следует записывать в недиссоциированном виде. Все это относится и к амфотерным гидроксидам.
Нерастворимые основания и амфотерные гидроксиды взаимодействуют с растворами кислот:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O;
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2H+ = Zn2+ + 2H2O;
Амфотерные гидроксиды взаимодействуют с растворами щелочей:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Al(OH)3 + 3OH– = [Al(OH)6]3–.
Кроме этого, нерастворимые основания и амфотерные гидроксиды при нагревании разлагаются на соответствующий оксид и воду:
Cu(OH)2 CuO + H2O;
Zn(OH)2 ZnO + H2O.
Гидроксиды, щелочи и основания — Справочник химика 21
Кислотам противостоит группа веществ, называемых основани ями. (Сильные основания получили название щелочей.) Эти вещества имеют горький вкус, химически активны, меняют цвета-красителей, но на противоположные по сравнению с кислотами и т. д. Растворы кислот нейтрализуют растворы оснований. Другими словами, смесь кислоты и основания, взятых в определенной соотношении, не проявляет свойств ни кислоты, ни основания. Эта смесь представляет собой раствор соли, которая обычно химически значительно менее активна, чем кислота или основание. Таким образом, при смешении соответствующих количеств раство- ров сильной и едкой кислоты (соляной кислоты) с сильной и едкой щелочью (гидроксидом натрия) получается раствор хлорида натрия, т. е. обыкновенной поваренной соли. [c.53]
Таким образом, при смешении соответствующих количеств раство- ров сильной и едкой кислоты (соляной кислоты) с сильной и едкой щелочью (гидроксидом натрия) получается раствор хлорида натрия, т. е. обыкновенной поваренной соли. [c.53]Свойства гидроксида церия (IV). К 1 мл раствора сульфата церия (IV) прилейте разбавленный раствор щелочи до получения желеобразного желтого осадка гидроксида церия (IV). Часть осадка перенесите в другую пробирку. В одну из них добавьте разбавленную серную кислоту, а в другую — концентрированный раствор гидроксида натрия или калия. На основании проведенных опытов сделайте вывод об амфотерных свойствах Се (ОН) 4. Какие свойства у Се (ОН) 4 преобладают кислотные или основные Напишите уравнения соответствующих реакций. Можно ли вместо серной кислоты использовать соляную, если редокс-потен-циал пары Се +/Се + равен -f-1,61 В Что произойдет, если к осадку Се (ОН) 4 прибавить концентрированную соляную кислоту [c.243]
Гидроксиды щелочных металлов МеОН — кристаллические вещества, растворимые в воде и спиртах. Их водные растворы — едкие щелочи — самые сильные основания. Гидроксиды получают электролизом водных растворов хлоридов . При этом в катодном пространстве выделяется водород и образуется гидроксид щелочного металла. Побочными продуктами производства являются водород и хлор (на аноде). При нейтрализации растворов гидроксидов щелоч- [c.116]
Наиболее простой механизм МФК в присутствии сильных щелочей (например, механизмы Н/В-обмена и изомеризации), по всей видимости, включают экстракцию гидроксида. Многие другие механизмы глубоко не изучены. В случае МФК механизмы могут сильно изменяться в зависимости от характера субстрата и условий реакции. Так, например, р-элиминирование может проходить межфазно, если катализатор облегчает стадию депротонирования. В то же время, если в органической фазе присутствуют малые количества ионов гидроксида четвертичного аммония, то и депротонирование будет осуществляться в этой же фазе. Однако известен еще и третий механизм. Он наблюдается в отсутствие оснований при повышенных температурах. В неполярных средах относительно несольватированные ионы галогенидов ведут себя как основания (см. гл. 1) на-лример, пентахлорэтан дегидрохлорируется галогенидами аммония в условиях запатентованного промышленного процесса [c.64]
Однако известен еще и третий механизм. Он наблюдается в отсутствие оснований при повышенных температурах. В неполярных средах относительно несольватированные ионы галогенидов ведут себя как основания (см. гл. 1) на-лример, пентахлорэтан дегидрохлорируется галогенидами аммония в условиях запатентованного промышленного процесса [c.64]
Обсудим вначале возможную роль размеров молекулы основания в приведенном выше случае-гидроксид-аниона. При рассмотрении элиминирования по Зайцеву было показано, что с увеличением объема молекулы основания увеличивается выход а-алкена и что наименьший выход последнего получают при использовании спиртовых растворов щелочей (основание-гидроксид-анион). При распаде четвертичных аммониевых оснований роль основания играет гидроксид-анион, но несмотря на это, главным продуктом реакции является а-алкен. Следовательно, объем молекулы основания не играет решающей роли в обсуждаемом превращении. [c.422]
Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действующих масс можно сместить это равновесие в ту или иную сторону за счет введения в раствор кислоты или основания. Этим часто пользуются для усиления или подавления процесса гидролиза, в частности, с целью поддержания постоянной концентрации ионов водорода в растворе. Прибавление кислоты вызывает усиление гидролиза по аниону (смещение равновесия вправо в результате связывания ионов в воду) гидролиз по катнсну усиливается в присутствии щелочи. Таи, если к раствору буры N32840, добавить кислоту, т. е. связать гидроксид-ионы, то гидролиз [c.214]
Гидроксиды, щелочи и основания [c.174]
Гидроксид магния Mg(0H)2 получается в виде малорастворимого белого осадка при действии щелочей на растворимые соли магния. В отличие от гидроксида бериллия гидроксид магния обладает только основными свойствами, представляя собой основание средней силы. [c. 391]
391]
Примеры сильных оснований гидроксиды щелочных металлов (LiOH, NaOH, КОН и др.). Их называют также щелочами. Гидроксиды щелочноземельных металлов (Са(ОН) , Ba(OH) и др.) тоже можно считать сильными основаниями. Их растворимость меньше, чем растворимость гидроксидов щелочных металлов, но намного больше растворимости гидроксидов остальных металлов. [c.126]
Гидроксиды — соединения, содержащие одну или несколько гидроксогрупп ОН. Гидроксиды щелочных и щелочно-земельных металлов имеют явно выраженный оснбвный характер, их называют щелочами. Гидроксиды других металлов являются слабыми основаниями или амфотерными соединениями. Основания при электролитической диссоциации в качестве анионов образуют только гидроксид-ионы. [c.26]
Гидроксиды элементов подгруппы ИА Э (ОН) 2 более слабые основания, чем гидроксиды щелочных металлов. Основные свой-, ства гидроксидов увеличиваются от Ве(0Н)2 к Ва(ОН)г Ве(0Н)2 и Mg(0H)2 — слабые основания, Ва(0Н)5 — щелочь. Усиление основных свойств от Ве(0Н)2 к,Ва(0Н)2 проявляется и в том, что для реакции [c.315]
Как основание гидроксид натрия сильнее, чем гидроксид кальция. Однако равновесие реакции сдвинуто вправо из-за образования нерастворимого карбоната кальция. Щелочи идут на приготовление электролитов щелочных аккумуляторов, на производство мыла, красок, целлюлозы. [c.145]
К амфотерным гидроксидам относят те гидроксиды, которые взаимодействуют и с растворами щелочей, и с растворами кислот с образованием соли и воды, т. е. проявляют свойства, характерные как для кислот, так и для оснований. [c.157]
На кривой титрования слабой кислоты сильным основанием,, например уксусной кйслоты гидроксидом калия (см. рис. 6.3),. иижняя ветвь кривой располагается в области высоких значений pH. По мере прибавления раствора КОН pH титруемого раствора сначала возрастает медленно, и только после того как будет исчерпана буферная емкость раствора, дальнейшее прибавление раствора щелочи вызывает быстрое увеличение pH. Интервал медленного возрастания pH отвечает состоянию системы, при котором концентрации свободной слабой кислоты и образовав шейся в результате нейтрализации соли примерно одинаковы [c.322]
Интервал медленного возрастания pH отвечает состоянию системы, при котором концентрации свободной слабой кислоты и образовав шейся в результате нейтрализации соли примерно одинаковы [c.322]
В то время как гидроксид бериллия Ве(0Н)2 — типичное амфо-терное соединение, Mg(0H)2 — слабое основание, Са(0И)2, 5г(ОН)2, Ва(ОН)2 — щелочи. [c.264]
Гидроксиды ЭОН неустойчивы, являются слабыми основаниями. Аммиачные же комплексы типа Э1 (ЫНз)21 (ОН) значительно устойчивее и по силе приближаются к щелочам. [c.415]
Сегодня большинство людей покупают коммерческие мыла и чистяшие средства. А в XIX в. часто делали мыло сами — из щелочи (гидроксида натрия NaOH) и животного жира. Глицерилтрипальмитат реагирует со щелочью (основанием) и образует мыло — пальмитат натрия. Поэтому такое мыло содержит непрореагировавшую щелочь, которая может повредить коже. [c.467]
ЦИКлогёксай Превращается в трихлорбензол. Главным продуктом реакции является 1,2,4-трихлорбензол (выход 75—95 %), изомеры 1,2,3-трихлорбензол и 1,3,5-трихлорбензол получаются с выходом соответственно 3—20% и О— 7,6%. На различной скорости реакции изомеров гексахлорциклогексана с щелочами основан кинетический метод определения — зомера в смеси. Аналогичная реакция с отщеплением НС1 происходит при взаимодействии с гидроксидом кальция, аммиаком, органическими аминами и другими основаниями, а также при повышенной температуре (250—350 °С) в присутствии инициирующих веществ (хлор, железо, алюминий, их соли и др.). При использовании в качестве инициатора хлора часть трихлорбензо-ла хлорируется, поэтому, кроме трихлорбензЬла, получаются продукты его хлорирования. При избытке хлора с хорошим выходом образуется гексахлорбензол. Эту реакцию используют в промышленности для получения из нетоксичных изомеров гексахлорциклогексана три-, тетра- и гексахлорбензолов. [c.58]
Калий и натрий, относятся к I группе системы элементов Д. И,Менделеева, их гидроксиды — сильные основания (щелочи). НН4 близок по свойствам к катиону К и образует несколько аиа/югичных малорастворимых солей. Очень важно, что соли аммония в отличие от солей 120 [c.120]
И,Менделеева, их гидроксиды — сильные основания (щелочи). НН4 близок по свойствам к катиону К и образует несколько аиа/югичных малорастворимых солей. Очень важно, что соли аммония в отличие от солей 120 [c.120]
Основания классифицируют по их растворимости в воде и по их силе. По растворимости основания делятся на растворимые, или щелочи, и на нерастворимые. Важнейшие щелочи — это гидроксид натрия NaOH, гидроксид калия КОН м гидроксид кальция Са(0Н)2. По силе основания делятся на сильные и слабые ( 84). К сильным основаниям относятся все и1,елочи, кроме гидроксида аммония. Согласно международной поменклатуре, соединения, содержащие в своем составе гидроксогруппы, па.зывают г ид роке идам и. В случае металлов переменной валентности в скобках указывают валентность металла в данном основании. Так, Са(ОН)2—гидроксид кальция, Ре(ОН)2—гидроксид железа(П), Ре(ОН)з— гидроксид железа(III), [c.41]
С водой Са и 1п не реагируют. Т1 медленно взаимодействует с ней, при этом образуется Т10Н и выделяется водород. Гидроксиды Оа(ОН)з, 1п(0Н)з, Т1(0Н)з получают, действуя щелочами на растворы солей Э+ . Гидроксиды Оа, 1п, Т1 — не растворимые в воде, слабые основания. Оа (ОН) з и 1п(0Н)з амфотерны, основная и кислотная диссоциация 0а(0Н)з происходят почти в одинаковой степени, у 1п(0Н)з преобладают основные свойства. соответствии со значениями Л0° для реакций [c.346]
Гидроксид Мп(0Н)2 выпадает в виде белого осадка при действии щелочей на растворы солей Мп +. Это основание средней силы, немного растворимое в воде (ПР 10 ). Поэтому реакция Мп » + 2ЫН40Н Мп(ОН)2 + 2МН [c.547]
При действии щелочей на растворы солей Си+ осаждается еиний гидроксид Си (ОН) 2. Это слабое основание, обладающее в небольшой степени амфотерными свойствами — оно растворяется в концентрированных растворах щелочей с образованием ярко-синих растворов гидроксокупратов М2[Си(ОН)4]. Гидроксид меди(П) легко разлагается при нагревании [c. 586]
586]
Гидроксиды лантаноидов Э(ОН)з практически неамфотерны, их основные свойства медленно уменьшаются при переходе от Се(ОН)з к Ьи(ОН)з (в связи с уменьшением г,). Гидроксид Се (ОН) 4 значительно более слабое основание, чем Се(ОН)з, и он слабо амфотерен цераты получают сплавлением СеОа со щелочами [c.605]
В пять пробирок налейте по 0,5—1 мл растворов солей АЬ(804)3, Сг2( 04)з, 2п804, РЬ(ЫОз)г, ЗЬСЦ. К каждому раствору прибавьте по каплям, при перемешивании, разбавленный раствор гидроксида натрия до получения обильного осадка гидроксида. Разделите содержимое каждой пробирки на две части. К одной прибавьте разбавленной серной или азотной кислоты, а ко второй — раствор щелочи до полного растворения осадков. На основании проделанных опытов, наблюдений запишите уравнения реакций. [c.59]
Запись данных опыта. На основании результатов опыта сделать вывод о свойствах гидроксида свинца. Написать уравнения реакций получения гидроксида свинца, его диссоциации и растворения в кислоте и в щелочи, учитывая образование в щелочной среде комплексного аниона РЬ[(ОН)в] —гексагидроксоплюм-бата (И). Почему в данном опыте следует пользоваться азотной кислотой, а не хлороводородной или серной [c.177]
Гидроксиды содержат атом элемента и связанные с ним гидроксильные группы ОН. Гидроксильная группа ОН одновалентна. Гидроксиды металлов называют основаниями. Растворимые в воде основания называют щелочами. Чем ярче выражены металлические свойства элемента, тем выше основные свойства его гидроксида. Чем ярче выражены неметаллические свойства элемента, тем сильнее выражены кислотные свойства его гидроксида. [c.14]
Сложные вещества, при диссоциации которых в водных растворах отщепляются в качестве анионов только гидроксид-ионы, назыеаю гся основаниями. Хорошо растворимые в воде основания (щелочи) являются сильными основаниями, а плохо растворимые -слабыми, [c.129]
Оксид серебра(I) незначительно растворяется в воде (0,017 г/л). Получающийся раствор имеет щелочную реакцию и, подобно щелочам, осаждает гидроксиды некоторых металлов из растворов их солей. Очевидно, в растворе содержится гидроксид серебра AgOH, представляющий собой довольно сильное основание. Последнее подтверждается тем, что соли серебра не гидролизуются. [c.538]
Получающийся раствор имеет щелочную реакцию и, подобно щелочам, осаждает гидроксиды некоторых металлов из растворов их солей. Очевидно, в растворе содержится гидроксид серебра AgOH, представляющий собой довольно сильное основание. Последнее подтверждается тем, что соли серебра не гидролизуются. [c.538]
Гидроксиды. Соединения щелочных металлов МОН — твердые бесцветные, очень гигроскопичные вещества, хорошо растворяются в воде, при этом выделяется большое количество теплоты. Растворимость гидроксидов в ряду LiOH— sOH повышается. В водных растворах они диссоциируют почти нацело, являются самыми сильными основаниями и носят название едких щелочей. По подгруппе щелочных металлов сверху вниз основные свойства щелочей увеличиваются. [c.255]
Образование малорастворимого гидроксида меди. Растворы едких щелочен осаждают из pa i ворон солей меди (II) голубой осадок основания Си (ОН) 2, легко растворимый в кислотах и обладающий весьма слабо выраженными кислотными свойствами. В сильно концентрированных растворах щелочей свежеосажденный гидроксид меди заметно растворим, образуя темно-синие растворы, [c.291]
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы главной подгруппы I группы периодической системы элементов Д. И. Менделеева 11, Ыа, К1 Р1), Сз и радиоактианый элемент Рг. Гидроксиды Щ. м.— сильные основания (щелочи). Щ. м.— химически активные элементы — активность их возрастает от кРг. [c.288]
В растворах сильных кислот и оснований типа НС1, HNO3, КОН или NaOH мольная концентрация ионов водорода и (или) гидроксид-ионов совпадает с мольной концентрацией кислоты или щелочи. Поэтому, например, в 0,01 М растворе НС1 концентрация ионов водорода равна [Н+]=0,01 моль/л и рН = = —Ig 1 10-2, а также [ОН-] = 1 lO- Vl 10-2= 1 10->2 и рОН = = —Ig Ы0- 2=12 или рОН = 14 —рН=14—2=12. [c.160]
Определите pH 0,1 М растворов НС1, HNO3, КОН и NaOH. Можно ли на основании проведенных экспериментов сделать вывод, что концентрация ионов водорода или гидроксид-ионов совпадает с концентрацией сильных кислот или оснований (щелочей), т. е. [c.165]
е. [c.165]
С аодой галлий и индий не реагируют таллий медленно взаимодействует с ней, при этом образуется гидроксид таллия Т10П и выделяется водород. Гидроксиды Са(011)з, 1п(011)з, Т1(0Н)) получают, действуя щелочами на растворы солей Э . Гидроксиды Са(ОН)з, 1л(011)з, и Т1(011)з-не растворимые в воде, слабые основания Са(ОП)з и 1п(011)] амфотерны, основная и кислотная диссоциация Ga(OH)j происходят почти в одинаковой степени, у 1п(0П)з преобладают основные свойства. В соответствии со значениями Дс реакций [c.358]
Гидроксиды лантаноидо Э(ОН)з практически неамфотерны, их основные свойстаа постепенно ослабевают при переходе от Се(ОН)з к и (ОН)з (в связи с уменьшением ионного радиуса>. Гидроксид Се(0Н)4 — более слабое основание, чем Се(ОН)), и он слабо амфотерен цераты М СеО] получают сплавлением СеОг со щелочами [c.572]
Вторая группа. Для всех элементов этой группы характерна степень окисления — -2. Атомы элементов главной подгруппы (Ве, Mg, Са, 5г, Ва и На) имеют на внешнем слое два з-электрона. По восстановительной способности элементы этой подгруппы уступают щелочным металлам (атомы последних имеют б6льц1ие размеры), хотя в связи с возрастанием атомных радиусов Са, 8г, Ва и Ка являются сильными восстановителями. Ионы Ве2+, Са +, Зг — , Ва — и Ка — , будучи аналогами ионов подгруппы лития, имеют конфигурацию атомов благородных газов, но отличаются от зарядом и меньшими радиусами. Поэтому их гидроксиды слабее гидроксидов щелочных металлов. Рост радиусов ионов в ряду Ве +—Ка + приводит к тому, что если Ве(ОН)г — амфотерное соединение, а Mg(0H)2 — слабое основание, то Са(ОН)2 — сильное основание, а Ва(0Н)г — очень сильное основание, хорошо растворимое в воде это щелочь, что нашло отражение и в его названии (едкий барит). [c.90]
Определения кислот и оснований и роль воды
Определения
кислот и оснований
и роль воды
Свойства кислот и Основания согласно Boyle
В 1661 году Роберт Бойль резюмировал свойства кислот следующим образом:
следует.
1. Кислоты имеют кислый вкус.
2. Кислоты едкие.
3. Кислоты изменяют цвет некоторых растительных красителей, например лакмус, от синего до красного.
4. Кислоты теряют кислотность при сочетании с щелочи.
Название «кислота» происходит от латинского acidus , что означает «кислый» и относится к резкому запаху и кисловатый вкус многих кислот.
Примеры: уксус кислый на вкус, потому что это разбавленный раствор. уксусной кислоты в воде. Лимонный сок кислый на вкус, потому что он содержит лимонную кислоту. Молоко скисает, когда портится, потому что образуется молочная кислота, и неприятный кисловатый запах гнилого мясо или масло можно отнести к таким соединениям, как масляная кислоты, образующиеся при порче жира.
В 1661 году Бойль резюмировал свойства щелочей следующим образом: следует.
- Щелочи кажутся скользкими.
- Щелочи меняют цвет лакмусовой бумажки с красного на синий.
- Щелочи становятся менее щелочными в сочетании с кислоты.
По сути, Бойль определил щелочи как вещества, которые потребляют, или нейтрализовать кислоты. Кислоты теряют свойственный кислый вкус и способность растворять металлы при их смешивании со щелочами.Щелочи даже обращают вспять изменение цвета, которое происходит, когда лакмусовая контактирует с кислотой. Со временем стали известны щелочи. как базы , потому что они служат «базой» для делая определенные соли.
Аррениус Определение кислот и оснований
В 1884 году Сванте Аррениус предположил, что соли, такие как NaCl диссоциируют, когда они растворяются в воде, давая частицы, которые он называется ионов .
| H 2 O | ||
| NaCl ( с ) | Na + ( водн. ) + Cl — ( водн. ) ) + Cl — ( водн. ) |
Три года спустя Аррениус расширил эту теорию, предложив что кислоты — нейтральные соединения, которые ионизируют , когда они растворяются в воде с образованием ионов H + и соответствующего отрицательный ион.Согласно его теории, хлористый водород — это кислоты, потому что она ионизируется, когда растворяется в воде, чтобы дать ионы водорода (H + ) и хлорида (Cl — ) как показано на рисунке ниже.
| H 2 O | ||
| HCl ( г ) | H + ( водн. ) + Cl — ( водн. ) |
Аррениус утверждал, что основания — это нейтральные соединения, которые либо диссоциируют или ионизируют в воде с образованием ионов OH — и положительный ион.NaOH является основанием Аррениуса, потому что он диссоциирует в вода с образованием гидроксида (OH — ) и натрия (Na + ) ионы.
| H 2 O | ||
| NaOH ( с ) | Na + ( водн ) + OH — ( водн ) |
Аррениусовая кислота — это любое вещество, которое ионизируется при растворении в воде с образованием H + , или водород, ион.
Основание Аррениуса — это любое вещество, которое дает ОН — , или гидроксид, ион, когда он растворяется в воде.
Кислоты Аррениуса включают такие соединения, как HCl, HCN и H 2 SO 4 которые ионизируются в воде с образованием иона H + . Аррениус
основания включают ионные соединения, которые содержат OH — ион, такой как NaOH, KOH и Ca (OH) 2 .
Эта теория объясняет, почему кислоты обладают схожими свойствами: характерные свойства кислот возникают из-за присутствия ион H + , образующийся при растворении кислоты в воде.Это также объясняет, почему кислоты нейтрализуют основания и наоборот. Кислоты предоставить ион H + ; базы обеспечивают OH — ион; и эти ионы объединяются, образуя воду.
H + ( водн. ) + OH — ( водн. ) H 2 O ( л )
Теория Аррениуса имеет несколько недостатков.
- Может применяться только к реакциям, протекающим в воде. потому что он определяет кислоты и основания с точки зрения того, что происходит, когда соединения растворяются в воде.
- Это не объясняет, почему некоторые соединения, в которых водород имеет степень окисления +1 (например, HCl) растворяется в вода для получения кислых растворов, тогда как другие (например, CH 4 ) нет.
- Только соединения, содержащие ион ОН — можно отнести к базам Аррениуса. Аррениус теория не может объяснить, почему другие соединения (например, Na 2 CO 3 ) обладают характерными свойствами оснований.
Роль H + и ОН — Ионы в химии водных растворов
Кислород Becuase ( EN = 3,44) намного электроотрицательнее
чем водород ( EN = 2,20), электроны в HO
связи в воде не разделяются поровну между водородом и кислородом.
атомы.Эти электроны притягиваются к атому кислорода в
центре молекулы и от атомов водорода на любом
конец. В результате молекула воды полярная . Кислород
атом несет частичный отрицательный заряд (-),
а атомы водорода несут частичный положительный заряд (+).
В результате молекула воды полярная . Кислород
атом несет частичный отрицательный заряд (-),
а атомы водорода несут частичный положительный заряд (+).
Когда они диссоциируют с образованием ионов, молекулы воды образуют положительно заряженный ион H + и отрицательно заряженный ион OH — .
Возможна и обратная реакция. Ионы H + могут объединяться с ионами OH — с образованием нейтральные молекулы воды.
Тот факт, что молекулы воды диссоциируют с образованием H + и ионы OH — , которые затем могут рекомбинировать с образованием воды молекул, указывается следующим уравнением.
В какой степени Вода диссоциирует с образованием ионов?
При 25 ° C плотность воды составляет 0,9971 г / см 3 , или 0,9971 г / мл. Следовательно, концентрация воды составляет 55,35 моль.
Концентрация ионов H + и OH — образованных диссоциацией нейтральных молекул H 2 O при эта температура всего 1.0 x 10 -7 моль / л. Соотношение концентрации иона H + (или OH — ) концентрации нейтральных молекул H 2 O составляет поэтому 1,8 x 10 -9 .
Другими словами, только около 2 частей на миллиард (ppb)
молекулы воды диссоциируют на ионы при комнатной температуре. В
На рисунке ниже показана модель из 20 молекул воды, одна из которых
диссоциировал с образованием пары H + и OH — ионы.Если бы эта иллюстрация была фотографией с очень высоким разрешением
структуры воды мы бы встретили пару H + и
OH — ионов в среднем только один раз на каждые 25
миллион таких фотографий.
В
На рисунке ниже показана модель из 20 молекул воды, одна из которых
диссоциировал с образованием пары H + и OH — ионы.Если бы эта иллюстрация была фотографией с очень высоким разрешением
структуры воды мы бы встретили пару H + и
OH — ионов в среднем только один раз на каждые 25
миллион таких фотографий.
Оперативный Определение кислот и оснований
Тот факт, что вода диссоциирует с образованием H + и OH — ионов в обратимой реакции — основа для оперативного определение кислот и оснований более мощное, чем определения, предложенные Аррениусом.С практической точки зрения, кислота любое вещество, повышающее концентрацию H + ион при растворении в воде. База — любое вещество что увеличивает концентрацию иона OH — , когда растворяется в воде.
Эти определения связывают теорию кислот и оснований с простой лабораторный тест на кислоты и щелочи. Чтобы решить, будет ли соединение представляет собой кислоту или основание, мы растворяем его в воде и тестируем решение, чтобы узнать, H + или OH — концентрация ионов увеличилась.
Типичные кислоты и Базы
Свойства кислот и оснований являются результатом различий между химией металлов и неметаллов, как видно из химии этих классов соединений: водород, оксиды и гидроксиды.
Соединения, содержащие водород, связанный с неметаллом, называются Гидриды неметаллов . Поскольку они содержат водород в +1 степень окисления, эти соединения могут действовать как источник H + ион в воде.
Гидриды металлов , напротив, содержат водород
привязан к металлу. Поскольку эти соединения содержат водород в
-1 степень окисления, они диссоциируют в воде с образованием H — (или гидридный) ион.
Ион H — с его парой валентных электронов может абстрагировать ион H + из молекулы воды.
Поскольку удаление ионов H + из молекул воды является одним способ увеличения концентрации ионов OH — в раствор, гидриды металлов являются основаниями.
Похожая картина наблюдается в химии оксидов. образованный металлами и неметаллами. Оксиды неметаллов растворяются в воде с образованием кислот. CO 2 растворяется в воде с образованием угольная кислота, SO 3 дает серную кислоту, а P 4 O 10 реагирует с водой с образованием фосфорной кислоты.
Оксиды металлов , с другой стороны, являются основаниями.Металл оксиды формально содержат ион O 2-, который реагирует с вода с образованием пары ионов OH — .
Следовательно, оксиды металлов соответствуют рабочему определению база.
Мы видим такую же закономерность в химии соединений, которые содержат ОН, или гидроксид, группа. Гидроксиды металлов , такие как LiOH, NaOH, KOH и Ca (OH) 2 , являются основаниями.
Гидроксиды неметаллов , такие как хлорноватистая кислота (HOCl), кислоты.
В таблице ниже обобщены тенденции, наблюдаемые в этих трех
категории соединений. Гидриды металлов, оксиды металлов и металл
гидроксиды — основания. Гидриды неметаллов, оксиды неметаллов и
гидроксиды неметаллов — кислоты.
Гидриды металлов, оксиды металлов и металл
гидроксиды — основания. Гидриды неметаллов, оксиды неметаллов и
гидроксиды неметаллов — кислоты.
Типичные кислоты и основания
| Кислоты | Основания |
| Неметаллические гидриды HF, HCl, HBr, HCN, HSCN, H 2 S | Гидриды металлов HI, LiH, NaH, KH, MgH 2 , CaH 2 |
| Неметаллические оксиды CO 2 , SO 2 , SO 3 , НЕТ 2 , П 4 O 10 | Оксиды металлов Li 2 O, Na 2 O, K 2 O, MgO, CaO |
| Неметаллические гидроксиды HOCl, HONO 2 , O 2 S (OH) 2 , OP (OH) 3 | Гидроксиды металлов LiOH, NaOH, KOH, Ca (OH) 2 , Ba (OH) 2 |
Кислые атомы водорода в гидроксидах неметаллов в приведенной выше таблице не связаны с азотом, серой или атомы фосфора.В каждом из этих соединений кислый водород присоединен к атому кислорода. Таким образом, все эти соединения примеры оксикислот.
Структуры скелета для восьми оксикислот представлены на рисунке. ниже. Как правило, кислоты, содержащие кислород, имеют скелет. структуры, в которых кислые водороды присоединены к кислороду атомы.
Почему металл Гидроксидные основы и неметаллические гидроксиды кислоты?
Чтобы понять, почему гидроксиды неметаллов являются кислотами и металлами.
гидроксиды являются основаниями, мы должны смотреть на электроотрицательность
атомов в этих соединениях. Начнем с типичного металла
гидроксид: гидроксид натрия
Начнем с типичного металла
гидроксид: гидроксид натрия
Разница между электроотрицательностями натрия и кислород очень большой ( EN = 2,5). В результате электроны в NaO облигации не делятся поровну электроны тянутся к более электроотрицательному атому кислорода. Таким образом, NaOH диссоциирует с образованием Na + и OH —. ионы при растворении в воде.
Мы получаем совсем другой узор, когда применяем тот же процедура для хлорноватистой кислоты, HOCl, типичного неметалла гидроксид.
Здесь разница электроотрицательностей атомы хлора и кислорода небольшие ( EN = 0,28). В результате электроны в ClO связь распределяется между двумя атомами более или менее поровну. ОН связь, с другой стороны, является полярной ( EN = 1,24) электроны в этой связи тянутся к более электроотрицательным атом кислорода. Когда эта молекула ионизируется, электроны в OH связь остается с атомом кислорода, а OCl — и H + образуются ионы.
Нет резкого перехода от металла к неметаллу в ряду или вниз по столбцу периодической таблицы. Поэтому мы должны ожидайте найти соединения, которые лежат между крайностями металла и оксиды неметаллов, или гидроксиды металлов и неметаллов. Эти соединения, такие как Al 2 O 3 и Al (OH) 3 , называются амфотерными (буквально «либо, либо оба «), потому что они могут действовать как кислоты или основания.Al (OH) 3 , например, действует как кислота, когда реагирует с основанием.
И наоборот, он действует как основание, когда реагирует с кислотой.
Br nsted Определение кислот и оснований
Модель Брнстеда или Брнстеда-Лоури основана на простом
предположение: Кислоты отдают ионы H + другой ион или молекула, которая действует как основание . В
диссоциация воды, например, включает перенос H + ион от одной молекулы воды к другой с образованием H 3 O + и OH — ионов.
В
диссоциация воды, например, включает перенос H + ион от одной молекулы воды к другой с образованием H 3 O + и OH — ионов.
Согласно этой модели, HCl не диссоциирует в воде до образуют ионы H + и Cl + . Вместо этого H + ион передается от HCl к молекуле воды с образованием H 3 O + и ионов Cl — , как показано на рисунке ниже.
Поскольку это протон, ион H + составляет несколько порядков величины меньше самого маленького атома. В результате заряд изолированного иона H + распределяется по таким небольшое пространство, которое привлекает этот ион H + к любому источнику отрицательного заряда, который существует в растворе. Таким образом, момент, когда ион H + создается в водный раствор, он связывается с молекулой воды.Брнстед модель, в которой ионы H + переносятся от одного иона или молекулы к другому, поэтому имеет больше смысла, чем Теория Аррениуса, которая предполагает, что ионы H + существуют в водный раствор.
Даже модель Брнстеда наивна. Каждый ион H + , который Кислота, отданная воде, на самом деле связана с четырьмя соседними молекулы воды, как показано на рисунке ниже.
Более реалистичная формула вещества, производимого при кислота теряет ион H + , следовательно, H (H 2 O) 4 + , или H 9 O 4 + .Для всех практических однако это вещество может быть представлено как H 3 O + ион.
Реакция между HCl и водой является основой для
понимание определений кислоты Бренстеда и кислоты Бренстеда
база. Согласно этой теории, ион H + является
передается от молекулы HCl к молекуле воды, когда HCl
диссоциирует в воде.
Согласно этой теории, ион H + является
передается от молекулы HCl к молекуле воды, когда HCl
диссоциирует в воде.
HCl действует как донор ионов H + в этой реакции, а H 2 O действует как акцептор ионов H + .Кислота Брнстеда является поэтому любое вещество (такое как HCl), которое может отдавать H + ион к основанию. База Брнстеда — это любое вещество (например, H 2 O), который может принимать ион H + из кислота.
Существует два способа присвоения имени H + ion. Некоторый химики называют это ионом водорода; другие называют это протоном. Как В результате кислоты Бренстеда известны как ионно-водородные . доноров или доноров протонов .Основания Бренстеда — водород-ионных акцепторы или акцепторы протонов .
С точки зрения модели Брнстеда, реакции между кислоты и основания всегда подразумевают перенос H + ион от донора протона до акцептора протона. Кислоты могут быть нейтральные молекулы.
Они также могут быть положительными ионами
или отрицательные ионы.
Таким образом, теория Брнстеда расширяет число потенциальных кислоты.Это также позволяет нам решить, какие соединения являются кислотами из их химические формулы. Любое соединение, содержащее водород с степень окисления +1 может быть кислотой. Кислоты Бренстеда включают HCl, H 2 S, H 2 CO 3 , H 2 PtF 6 , NH 4 + , HSO 4 — и HMnO 4 .
Базы Брнстеда могут быть идентифицированы по их структурам Льюиса.
Согласно модели Брнстеда, основанием является любой ион или молекула
который может принимать протон. Чтобы понять последствия этого
определения, посмотрите, как прототипная база, OH — ион, принимает протон.
Чтобы понять последствия этого
определения, посмотрите, как прототипная база, OH — ион, принимает протон.
Единственный способ принять ион H + — это сформировать ковалентная связь с ним. Для образования ковалентной связи с H + иона, не имеющего валентных электронов, база должна обеспечивать оба электроны, необходимые для образования связи.Таким образом, только соединения, которые имеют пары несвязывающих валентных электронов, могут действовать как H + -ион акцепторы или базы Бренстеда.
Все следующие соединения, например, могут действовать как Brnsted оснований, потому что все они содержат несвязывающие пары электронов.
Модель Брнстеда расширяет список потенциальных баз до включают любой ион или молекулу, которые содержат одну или несколько пар несвязывающие валентные электроны.Брнстедское определение базы применяется к такому количеству ионов и молекул, что почти легче подсчитывать вещества, такие как следующие, которые нельзя Бренстед основания, потому что у них нет пар несвязывающей валентности электроны.
Роль воды в Теория Брнстеда
Теория Брнстеда объясняет роль воды в кислотно-щелочном реакции.
- Вода диссоциирует с образованием ионов за счет переноса H + ион от одной молекулы, действующий как кислота к другой молекула, выступающая в качестве основы.
| H 2 O ( л ) | + | H 2 O ( л ) | H 3 O + ( водн. ) ) | + ОН — ( водн. ) | |
| кислота | основание |
- Кислоты реагируют с водой, отдавая ион H + к нейтральной молекуле воды с образованием H 3 O + ион.
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + класс — ( водн. ) | ||
| кислота | основание |
- Основания реагируют с водой, принимая ион H + из молекулы воды с образованием иона OH —.
| NH 3 ( водн. ) | + | H 2 O ( л ) | NH 4 + ( водн. ) | + ОН — ( водн. ) | |
| основание | кислота |
- Молекулы воды могут действовать как промежуточные соединения в кислотно-щелочном реакции с получением ионов H + из кислоты
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) ) | + класс — ( водн. ) |
, а затем теряет эти ионы H + на основание.
| NH 3 ( водн. ) | + | H 3 O + ( водн. ) | NH 4 + ( водн. ) | + H 2 O ( л ) |
Модель Брнстеда может быть расширена на кислотно-основные реакции в другие растворители.Например, в жидкости наблюдается небольшая тенденция аммиак для переноса иона H + из одного NH 3 молекулы к другой с образованием NH 4 + и NH 2 — ионы.
| 2 NH 3 | NH 4 + | + NH 2 — |
По аналогии с химией водных растворов делаем вывод что кислоты в жидком аммиаке включают любой источник NH 4 + ион, и эти основания включают любой источник NH 2 — ион.
Модель Брнстеда может быть расширена даже на реакции, которые
не встречаются в растворе. Классический пример газовой фазы
кислотно-щелочная реакция встречается, когда открытые емкости с
затем проводится концентрированная соляная кислота и водный раствор аммиака.
друг другу. Вскоре образуется белое облако хлорида аммония,
газообразный HCl, выходящий из одного раствора, вступает в реакцию с NH 3 газ от другого.
| HCl ( г ) | + NH 3 ( г ) | NH 4 Cl ( с ) |
Эта реакция включает перенос иона H + от HCl до NH 3 и, следовательно, является кислотно-основным реакция, даже если она происходит в газовой фазе.
Список сильных оснований (Базы Аррениуса)
Сильные основания — это основания, которые полностью диссоциируют в воде на катион и OH — (гидроксид-ион). Гидроксиды металлов группы I (щелочные металлы) и металлов группы II (щелочноземельные) обычно считаются сильными основаниями. Это классические основания Аррениуса. Вот список наиболее распространенных сильных оснований.
- LiOH — гидроксид лития
- NaOH — гидроксид натрия
- KOH — гидроксид калия
- RbOH — гидроксид рубидия
- CsOH — гидроксид цезия
- * Ca (OH) 2 — гидроксид кальция
- * Sr (OH) 2 — гидроксид стронция
- * Ba (OH) 2 — гидроксид бария
* Эти основания полностью диссоциируют в растворах 0.01 М или меньше. Другие основания образуют 1,0 М растворы и при этой концентрации диссоциируют на 100%. Есть и другие сильные основания, чем перечисленные, но они встречаются не часто.
Свойства сильных оснований
Сильные основания являются отличными акцепторами протонов (ионов водорода) и донорами электронов. Сильные основания могут депротонировать слабые кислоты. Водные растворы сильных оснований скользкие и мыльные. Однако никогда не стоит прикасаться к раствору, чтобы проверить его, потому что эти основания имеют тенденцию быть едкими.Концентрированные растворы могут вызвать химические ожоги.
Супербазы
Помимо сильных оснований Аррениуса, есть еще и супербазы. Супероснования — это основания Льюиса, которые представляют собой соли карбанионов группы 1, такие как гидриды и амиды. Основания Льюиса имеют тенденцию быть даже сильнее, чем сильные основания Аррениуса, потому что их сопряженные кислоты настолько слабы. В то время как основания Аррениуса используются в виде водных растворов, супероснования депротонируют воду, полностью вступая с ней в реакцию. В воде исходный анион сверхоснования не остается в растворе.Супероснования чаще всего используются в органической химии в качестве реагентов.
Основания Льюиса имеют тенденцию быть даже сильнее, чем сильные основания Аррениуса, потому что их сопряженные кислоты настолько слабы. В то время как основания Аррениуса используются в виде водных растворов, супероснования депротонируют воду, полностью вступая с ней в реакцию. В воде исходный анион сверхоснования не остается в растворе.Супероснования чаще всего используются в органической химии в качестве реагентов.
Примеры супербазов:
- Этоксид-ион
- Бутиллитий (n-BuLi)
- Диизопропиламид лития (LDA) (C 6 H 14 LiN)
- Диэтиламид лития (LDEA)
- Амид натрия (NaNH 2 )
- Гидрид натрия (NaH)
- Бис (триметилсилил) амид лития, ((CH 3 ) 3 Si) 2 NLi
4.Сильная и слабая базы
На этой странице объясняются термины «сильная» и «слабая» применительно к базам. В рамках этого он определяет и объясняет K b и pK b . Обычный способ сравнения силы оснований — посмотреть, насколько легко они производят гидроксид-ионы в растворе. Это может быть связано с тем, что они уже содержат ионы гидроксида, или потому, что они отбирают ионы водорода из молекул воды для образования ионов гидроксида.
Прочные основания
Сильное основание — это полностью ионный гидроксид натрия или гидроксид калия.Вы можете думать о соединении как о 100% расщеплении на ионы металлов и гидроксид-ионы в растворе.
Каждый моль гидроксида натрия растворяется с образованием одного моля гидроксид-ионов в растворе.
Некоторые сильные основания, такие как гидроксид кальция, плохо растворяются в воде. Это не имеет значения — то, что растворяется, по-прежнему на 100% ионизировано на ионы кальция и ионы гидроксида. Гидроксид кальция по-прежнему считается сильным основанием из-за 100% ионизации.
Определение pH сильного основания
Помните, что:
\ [pH = — \ log_ {10} [H ^ +] \]
Поскольку pH является мерой концентрации ионов водорода, как раствор, содержащий ионы гидроксида, может иметь pH? Чтобы понять это, нужно знать об ионном продукте для воды. -_ {(водный)} \]
-_ {(водный)} \]
В присутствии дополнительных гидроксид-ионов, скажем, из гидроксида натрия, равновесие все еще существует, но положение равновесия было сдвинуто влево согласно принципу Ле Шателье. Ионов водорода будет гораздо меньше, чем в чистой воде, но ионы водорода все равно будут. PH является мерой их концентрации.
Схема метода определения pH сильного основания
- Определите концентрацию гидроксид-ионов.
- Используйте K w для определения концентрации ионов водорода.
- Преобразование концентрации ионов водорода в pH.
Пример 1
Что такое pH 0,500 моль дм -3 раствора гидроксида натрия 😕
Решение
Поскольку гидроксид натрия полностью ионный, каждый его моль дает такое же количество молей гидроксид-ионов в растворе.
[OH — ] = 0,500 моль дм -3
Теперь вы используете значение K w для температуры вашего раствора.Обычно вы принимаете это как 1,00 x 10 -14 моль 2 дм -6 .
[H + ] [OH — ] = 1,00 x 10 -14
Это верно независимо от того, чистая вода или нет. В этом случае у нас есть значение для концентрации гидроксид-иона. Подставляя, получаем:
[H + ] x 0,500 = 1,00 x 10 -14
Если вы решите это для [H + ], а затем преобразуете его в pH, вы получите pH 13.-_ {(водный)} \]
Однако реакция обратима, и в любой момент около 99% аммиака все еще присутствует в виде молекул аммиака. Только около 1% фактически произвел ионы гидроксида. Слабое основание — это основание, которое не полностью превращается в ионы гидроксида в растворе. Когда слабое основание реагирует с водой, положение равновесия меняется от основания к основанию. Чем левее, тем слабее основание.
Вы можете измерить положение равновесия, написав константу равновесия для реакции. -]} {[B:]} \]
-]} {[B:]} \]
Связь между K b и pK b точно такая же, как и между всеми другими терминами «p» в этой теме:
\ [pK_b = — \ log_ {10} K_b \]
В таблице показаны некоторые значения для \ (K_b \) и \ (pK_b \) для некоторых слабых оснований.
| основание | K b (моль-дм -3 ) | pK б |
|---|---|---|
| C 6 H 5 NH 2 | 4.17 х 10 -10 | 9,38 |
| NH 3 | 1,78 x 10 -5 | 4,75 |
| CH 3 NH 2 | 4,37 x 10 -4 | 3,36 |
| Канал 3 Канал 2 NH 2 | 5,37 x 10 -4 | 3,27 |
По мере продвижения по таблице значение K b увеличивается.Значит, укрепляются базы. По мере того, как K b становится больше, pK b становится меньше. Чем ниже значение pK b , тем сильнее база. Это в точности соответствует соответствующему термину для кислот, pK a — чем меньше значение, тем сильнее кислота.
Авторы и ссылки
Base (химия) — Energy Education
Рис. 1. Отбеливатель имеет pH около 12-13.Основание или щелочное — это любое вещество, которое будет реагировать с водой с образованием OH — [1] Обычно растворы оснований в воде имеют pH более 7.
В воде всегда присутствует некоторое количество ионов H + и OH — в растворе из-за самоионизации воды. В базовых решениях OH — будет больше, чем H + . Более концентрированные основания будут иметь больше OH — в растворе. Согласно шкале pH, более щелочной раствор — раствор с большим количеством OH – — будет иметь на более высокое значение pH . Кислоты могут реагировать с основаниями в реакции нейтрализации, где H + из кислоты реагирует с OH — основания с образованием раствора с более низкой концентрацией OH — — и более низким pH — чем исходный базовый раствор.
Кислоты могут реагировать с основаниями в реакции нейтрализации, где H + из кислоты реагирует с OH — основания с образованием раствора с более низкой концентрацией OH — — и более низким pH — чем исходный базовый раствор.
Наиболее распространенными неорганическими основаниями являются гидроксиды (содержащие в своем составе OH — ), такие как гидроксид натрия, NaOH или гидроксид кальция, Ca (OH) 2 . Однако существуют некоторые органические основания, такие как молекулы на основе аммиака, такие как амины, которые не содержат непосредственно OH — : любой OH — в растворе этих молекул образуется в результате реакции с водой. [2]
использует
Способность оснований нейтрализовать кислоты очень полезна, так как многие реакции и промышленные процессы имеют кислотные отходы.Некоторые примеры использования оснований для нейтрализации нежелательных кислот:
- Кислотные дожди можно нейтрализовать основными минералами, такими как известняк. (Известняк состоит в основном из карбоната кальция. [3] )
- В скрубберах, используемых на электростанциях, используются основания (например, гидроксид кальция), чтобы уменьшить выбросы оксидов серы (типа кислотного загрязнителя), производимых станцией.
- Антациды содержат основания (чаще всего карбонат кальция), которые вступают в реакцию с кислотой желудка, чтобы лечить изжогу и расстройство желудка. [4]
Помимо нейтрализации, основания также используются в химических реакциях:
- Гидроксид натрия и гидроксид калия используются для изготовления мыла. [5]
- Гипохлорит натрия (NaOCl) является основным ингредиентом отбеливателя для стирки. [6]
- Бикарбонат натрия (пищевая сода) используется для образования газов для закваски хлеба и выпечки, а также в некоторых огнетушителях. [7]
 2.Различные кислоты и основания по шкале pH. [8]
2.Различные кислоты и основания по шкале pH. [8] Чтобы узнать больше о кислотах и основаниях, см. Chemistry LibreText.
Моделирование Фета
Университет Колорадо любезно разрешил нам использовать следующую симуляцию Фета. Изучите эту симуляцию, чтобы увидеть, как работает pH кислот и оснований.
Для дальнейшего чтения
Чтобы узнать больше о кислотах и основаниях, см. Chemistry LibreText.
Список литературы
- ↑ Chemistry LibreTexts.(11 июля 2018 г.). Обзор кислот и оснований [онлайн], доступно: https: //chem.libretexts.org/Textbook_Maps/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_ (Physical_and_Theoretical_Chemistry) / Acids_and_Bases_Aid / Overview
- ↑ Chemistry LibreTexts. (11 июля 2018 г.). Organic Acids and Organic Bases [онлайн], доступно: https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry/Map%3A_Organic_Chemistry_(McMurry)/chapter_02%3A_Polar_Covalent_Bonds%3B_Acids/10_Organic_Acids_and_Organic_Bases # Ammonia_as_a_weak_base
- ↑ Geology.com. (11 июля 2018 г.). Известняк [онлайн], Доступно: https://geology.com/rocks/limestone.shtml
- ↑ Chemistry Libretexts. (11 июля 2018 г.). Изжога [онлайн], Доступно: https://chem.libretexts.org/Textbook_Maps/General_Chemistry/Map%3A_A_Molecular_Approach_(Tro)/16%3A_Acids_and_Bases/16.01%3A_Heartburn
- ↑ Ogden Publications Inc. (11 июля 2018 г.). Жизнь Матери-Земли: Рецепт мыла с медом и пчелиным воском [онлайн], Доступно: https: // www.motherearthliving.com/health-and-wellness/beauty-recipes/honey-and-beeswax-soap-recipe-ze0z1506zdeb
- ↑ Хлорокс. (11 июля 2018 г.). Что такое отбеливатель? [онлайн], доступно: https://www.clorox.com/how-to/laundry-basics/bleach-101/bleach/
- ↑ Piper Fire Protection Inc. (11 июля 2018 г.). Виды огнетушителей и их назначение . [онлайн]. Доступно: http://www.
 piperfire.com/types-of-fire-extinguishers-and-what-they-do/
piperfire.com/types-of-fire-extinguishers-and-what-they-do/ - ↑ По материалам «Энергия: его использование и окружающая среда» — Р.А. Хинрихс и М. Кляйнбах, «Кислотный дождь», в Энергия: его использование и окружающая среда, , 5-е изд. Торонто, Онтарио. Канада: Брукс / Коул, 2006, глава 8, раздел C, стр 252-256
Гидроксид | химическое соединение | Britannica
Hydroxide , любое химическое соединение, содержащее одну или несколько групп, каждая из которых содержит по одному атому кислорода и водорода, связанных вместе и функционирующая как отрицательно заряженный ион OH —. Положительно заряженная часть соединения обычно представляет собой ион металла ( эл.g., натрия, магния или алюминия), хотя это может быть органическая группа (, например, гуанидиния или тетраметиламмония). Предпочтительно характеризовать присутствие неионизированной ковалентно связанной гидроксильной группы OH с помощью приставки гидрокси, как в органическом соединении гидроксиуксусной кислоты, CH 2 OHCOOH, или суффиксом ol, как в метаноле, CH 3 OH, а в координационных соединениях с приставкой hydroxo, как в тетрагидроксоаурате калия, KAu (OH) 4 .
Гидроксиды включают щелочи, известные в лабораторных и промышленных процессах. Гидроксиды щелочных металлов, лития, натрия, калия, рубидия и цезия, являются самыми сильными основаниями, наиболее стабильными и наиболее растворимыми из гидроксидов. Гидроксид натрия, NaOH, также известный как каустическая сода или щелочь, имеет большое промышленное значение. Кальций, барий и стронций — все щелочноземельные металлы — образуют растворимые гидроксиды, которые являются сильными основаниями, но менее стабильны, чем гидроксиды щелочных металлов.Из них гидроксид кальция Ca (OH) 2 , широко известный как гашеная известь, является наиболее распространенным. За исключением гидроксида таллия (TlOH), гидроксиды других металлов, таких как магний, железо, висмут, никель, кобальт и медь, плохо растворяются в воде, но нейтрализуют кислоты. Гидроксиды бериллия, свинца, цинка, алюминия, хрома (трехвалентный), олова (двухвалентный), золота (трехвалентный) и некоторых других металлов проявляют как кислотные, так и основные свойства; то есть они растворяются в водных растворах оснований или кислот.Гидроксиды и другие вещества, такие как оксиды и сульфиды, с этими двойными свойствами, называются амфотерными.
Гидроксиды бериллия, свинца, цинка, алюминия, хрома (трехвалентный), олова (двухвалентный), золота (трехвалентный) и некоторых других металлов проявляют как кислотные, так и основные свойства; то есть они растворяются в водных растворах оснований или кислот.Гидроксиды и другие вещества, такие как оксиды и сульфиды, с этими двойными свойствами, называются амфотерными.
Кислоты и основания
Кислоты, основания и шкала pHТермины кислота и основание описывают химические характеристики многих веществ, которые мы используем ежедневно. Кислые вещи кислые на вкус. Обычные или щелочные вещества имеют мыльный вкус. Сильные кислоты вызывают коррозию, а сильные основания — едкие; оба могут вызвать серьезное повреждение кожи, которое похоже на ожог.Однако слабые кислоты и основания обычны и относительно безвредны для нас. Что делает вещество кислым или основным? Следующее уравнение — хорошее место для начала:
2 H 2 O & Равновесие; 1 H 3 O + + 1 OH —Начнем с двух молекул воды и переместим несколько атомов водорода. Одна молекула воды приобретает водород и, следовательно, приобретает положительный заряд, в то время как другая молекула воды теряет атом водорода и, следовательно, становится отрицательно заряженной.H 3 O + называется ионом гидроксония, и он делает вещи кислыми. OH — называется гидроксил-ионом, и он делает вещи основными. Однако в воде существует баланс между гидроксониями и гидроксилами, поэтому они нейтрализуют заряды друг друга. Чистая вода не является ни кислой, ни щелочной; он нейтрален.
Так как же что-то становится кислым или щелочным? Это происходит, когда гидроксоний и гидроксил не сбалансированы. Если положительно заряженных гидроксониев больше, чем отрицательно заряженных гидроксилов, то вещество кислое.Если отрицательно заряженных гидроксилов больше, чем положительно заряженных гидроксониев, то вещество становится основным. pH фактически означает «потенциал (или мощность) водорода».
Примечание : Иногда люди пишут H + как сокращение от H 3 O + , и это может вызвать путаницу, потому что иногда, когда люди пишут H + , они действительно имеют в виду только H + и не H 3 O + . Следите за этим и попросите разъяснений!
Когда мы растворяем кислоты в воде, мы создаем избыток гидроксония.Когда мы растворяем основания в воде, мы создаем избыток гидроксилов. Вот два примера. Уксус, слабая кислота, имеет химическую формулу CH 3 COOH. При растворении в воде он превращается в CH 3 COO — и H + . Ионы H + соединяются с молекулами воды с образованием H 3 O + , поэтому раствор становится кислым. Теперь давайте посмотрим на щелок, сильное основание с химической формулой NaOH (гидроксид натрия). Если мы добавим NaOH в воду, он диссоциирует на Na + и OH — .Натрий не делает ничего важного, но гидроксилы делают раствор более щелочным.
Последний вопрос: почему сильные кислоты и сильные основания такие противные? Это потому, что они не сбалансированы. У них либо слишком много положительных зарядов, и они ищут отрицательные, чтобы восстановить баланс, либо у них слишком много отрицательных зарядов, и они ищут положительные, чтобы восстановить баланс. Это заставляет их очень быстро реагировать на все, с чем они контактируют. Когда положительные и отрицательные стороны равны, они нейтрализуют друг друга.
Что такое pH ?: pH — это шкала, по которой мы измеряем силу кислот и оснований. pH обозначает потенциал водорода и является примерно отрицательным из десятичного логарифма молярной концентрации ионов водорода, поэтому pH = -log 10 [H + ]
Шкала pH — это показатель кислотности по 14-балльной шкале, где 7 — нейтральная средняя точка. pH — это логарифмическая шкала (как шкала Рихтера для землетрясений), поэтому pH 4 в 10 раз более кислый, чем pH 5, и в 100 раз более кислый, чем pH 6.Вы можете купить электронные pH-метры или индикаторную бумагу pH в любой биологической или лабораторной компании, которая может быть использована для точного измерения кислотного или основного качества веществ, которые вы хотите проверить. Попробуйте это моделирование, чтобы определить pH некоторых распространенных веществ.
Дополнительный мини-эксперимент : Сделайте свой собственный индикатор pH, используя сок красной капусты. Смешайте 2 стакана нарезанных листьев красной капусты и 1 стакан воды в кухонном комбайне или электрическом блендере, пока кусочки не станут крошечными и однородными.Процедите твердые частицы и оставьте жидкость. Если у вас нет блендера, вы также можете крупно нарезать капусту и варить ее в воде около 5 минут, пока жидкость не станет темно-фиолетовой. Эта фиолетовая жидкость изменит цвет в зависимости от кислотности или щелочности веществ, которые вы хотите проверить. Добавьте около 10 капустного сока примерно к 1 столовой ложке исследуемого вещества. Какого цвета капустный сок превращается в кислоту, такую как белый уксус? Какого цвета капустный сок превращается в основу, такую как пищевая сода и водный раствор?
Проверьте pH различных веществ и создайте соответствующую цветовую шкалу pH.Сравните свои результаты с диаграммой здесь.
Вы также можете сделать индикаторную бумагу, окунув полоски белого бумажного полотенца, кофейные фильтры или белую плотную бумагу в капустный сок, пока они не станут фиолетовыми. Когда фиолетовые полоски высохнут, используйте зубочистку, соломинку для соды или пипетку, чтобы нанести на полоски каплю тестового раствора. Как результаты соотносятся с вашей диаграммой pH?
Chem4Kids.com: Реакции: кислоты и основания II
Давайте теперь посмотрим на картину в целом.Как и все остальное, есть шкала для кислот и оснований. Вот несколько определений, которые вам следует знать:
Кислота: Раствор с избытком ионов H + . Оно происходит от латинского слова acidus, что означает «острый» или «кислый».
Основание: Раствор с избытком ионов OH — . Другое название основания — щелочь.
Водный: Раствор, в основном состоящий из воды. Подумайте о слове «аквариум». AQUA означает воду.
Strong Acid: Кислота с очень низким pH (0-4).
Strong Base: Основание с очень высоким pH (10-14).
Слабая кислота: Кислота, которая только частично ионизируется в водном растворе . Это означает, что не каждая молекула распадается. Слабые кислоты обычно имеют pH, близкий к 7 (3-6).
Слабое основание: Основание, которое только частично ионизируется в водном растворе. Это означает, что не каждая молекула распадается. Слабые основания обычно имеют pH, близкий к 7 (8-10).
Нейтральный: Раствор с pH 7.Он не является ни кислотным, ни основным.
Химик по имени Льюис предложил третий способ взглянуть на кислоты и основания.Вместо того чтобы смотреть на ионы водорода, он смотрел на пары электронов (помните наши рисунки с точечной структурой в «Атомах и элементах»?). По мнению Льюиса, кислоты принимают пару электронов, и основания отдают пары электронов. Мы знаем, что оба этих описания кислот и оснований используют совершенно противоположные термины, но идея одна и та же. Ионы водорода по-прежнему хотят принять два электрона для образования связи. Базы хотят от них отказаться. В целом определение Льюиса позволило отнести еще больше соединений к кислотам или основаниям.
Что на самом деле происходит в этих решениях? Здесь становится немного сложно. Давайте еще раз посмотрим на распад молекул в водных растворах (на водной основе). Кислоты — это соединения, которые диссоциируют (распадаются) на ионы водорода (H +) и другое соединение при помещении в водный раствор. Помните тот пример с уксусной кислотой? Основания — это соединения, которые распадаются на ионы гидроксида (OH — ) и другое соединение при помещении в водный раствор. О пищевой соде мы поговорим в нескольких абзацах.
Давайте немного изменим формулировку. Если у вас есть ионное / электровалентное соединение, и вы поместите его в воду, оно распадется на два иона. Если один из этих ионов H + , раствор кислый. Одним из примеров является сильнокислый хлористый водород (HCl). Если один из ионов — OH — , раствор является основным. Пример сильного основания — гидроксид натрия (NaOH). Есть и другие ионы, которые образуют кислые и основные растворы, но мы не будем о них здесь говорить.
Та шкала pH , о которой мы говорили, на самом деле является мерой количества ионов H + в растворе.Если много ионов H + , pH очень низкий. Если имеется много ионов OH — по сравнению с числом ионов H + , pH высокий.
Задумайтесь на секунду об этой идее: почему жидкость с высоким содержанием NaOH может быть очень простой, но в то же время опасной? Связь Na-OH разрывается в растворе, и у вас есть ионы натрия (положительные) и ионы гидроксида (отрицательные). Ионы натрия не представляют опасности в растворе, но в растворе содержится огромное количество гидроксид-ионов по сравнению с ионами водорода, которые могут плавать вокруг в виде H 3 O + (ион гидроксония).Все эти избыточные ионы OH — делают pH сверхвысоким, и раствор легко вступает в реакцию со многими соединениями. То же самое происходит в менее опасном масштабе, когда вы добавляете в воду пищевую соду. Во время диссоциации в раствор выделяются ионы OH — и угольная кислота. Количество ионов OH — больше, чем количество ионов H 3 O + (H + и H 2 O), и pH увеличивается. Просто разница не такая сильная, как в гидроксиде натрия.Вот и все. (Ха-ха! Понял?)
Дополнительная информация в первой части.
Разжигание огня в воде (видео Science @ NASA)
Полезные ссылки
Британская энциклопедия: КислотыБританская энциклопедия: Базы
Википедия: Кислоты
Википедия: Базы
Encyclopedia.com: Кислоты
com: Базы
.

 piperfire.com/types-of-fire-extinguishers-and-what-they-do/
piperfire.com/types-of-fire-extinguishers-and-what-they-do/