Растворение. Растворимость веществ в воде
Автор — Севостьянова Людмила Николаевна, учитель химии высшей квалификационной категории муниципального автономного общеобразовательного учреждения средней школы №3 р.п. Ильиногорск, Володарского муниципального района Нижегородской областиОбозначение предметного содержания проекта. Учащиеся получают представление о растворении, как о физико-химическом процессе, понятии гидратах и кристаллогидратах, растворимости, кривых растворимости, как модели зависимости растворения от температуры, насыщенных, перенасыщенных и ненасыщенных растворах. Делают выводы о значении растворов для природы и сельского хозяйства.
Методическая разработка составлена на основе, программы основного общего образования по химии, учебно-методического комплекса О.С.. Габриеляна «Химия. 8-11 классы (Рабочие программы. Химия8-11 классы: учебно-методическое пособие/сост. Г.М. Пальдяева. – 2 изд., стереотип. М.: Дрофа, 2013). Данный концентрический курс соответствует Федеральному государственному образовательному стандарту основного общего образования, одобрен РАО и РАН, имеет гриф «Рекомендовано» и включен в Федеральный перечень учебников.
Согласно действующему Базисному учебному плану, рабочая программа для 8-го класса предусматривает обучение химии в объеме 2 часа в неделю.
Раздел. Растворение. Растворы. Свойства электролитов.
Тема. Растворимость. Растворимость веществ в воде.
Обоснование целесообразности данного предметного содержания для организации проектной/исследовательской деятельности обучающихся. Через организацию исследовательской деятельности сформировать представление о растворении, как о физико-химическом процессе. На основе знаний и умений, добытых в ходе активного поиска и самостоятельного решения проблемы, учащиеся учатся устанавливать межпредметные и причинно-следственные связи
Также данный проект, направленный на сформирование представления о физико-химическом процессе растворения, изучении растворимости различных веществ от различных условий обеспечивает развитие устойчивого интереса к химии.
Название проекта: «Растворы. Растворимость веществ в воде».
Описание проблемной ситуации, определение проблемы и цели проектного модуля. Учитель организует действия учащихся по выявлению и формулировке проблемы, предлагая учащимся провести мини-исследование «Приготовление водных растворов перманганата калия и серной кислоты». Учащиеся во время проведения опытов отмечают, что в процессе растворения веществ наблюдаются как признаки физического, так и признаки химического явления.
Учащиеся совместно с учителем формулируют противоречие.
Противоречие: В процессе растворения можно наблюдать с одной стороны признаки физических явлений, с другой — химических явлений.
Проблема: Процесс «растворение» — это процесс химический или физический? Можно ли влиять на этот процесс?
Описание проектного продукта/результата с критериями оценки.
Цель проектного модуля: доказать сущность процесса растворения и объяснить зависимость растворимости от различных факторов через создание ментальной карты «Растворимость веществ в воде».
Проектный продукт: ментальная карта «Растворимость веществ в воде».
Ментальная карта представляет собой систематизированный и представленный в наглядной форме материал. В центре записывается тема проекта «Растворимость веществ». Учащимся предлагается на основе проведенных мини-исследований сформулировать выводы и творчески оформить их в несколько блоков:
1 блок: «Модель процесса растворения»
2 блок: «Зависимость процесса растворения от различных факторов»
3 блок: «Классификация растворов»
4 блок: «Значение и применение растворов»
Каждый отдельный проектный продукт пары оценивается по следующим критериям.
- Достоверность найденной информации.
- Эстетичность оформления
- Структурность оформления
- Логичность оформления
- Наглядность
За каждый критерий от 0 до 3 баллов:
- 3 балла — критерий полностью представлен
- 2 балла – не достаточно представлен
- 1 балл – представлен частично
- 0 баллов – критерий отсутствует
Оценка «5» — 15-14 баллов
Оценка «4» — 13-11 баллов
Оценка «3»- 10-7 баллов
Оценка «2» -менее 7 баллов
Определение общего объема урочных часов, необходимых для реализации проекта, и его распределение по этапам проектной деятельности обучающихся с указанием действий педагога и обучающихся.
Проектный модуль включает 3 урока (3 часа проектного модуля реализуются за счет 1 часа, который отводится на изучение темы «Растворы. Растворимость веществ» и 2 часа за счет резервного времени):
Фазы ПД |
Этапы ПД |
Поурочное планирование |
Проектирование |
Актуализация |
1 урок + домашнее задание |
Проблематизация |
||
Целеполагание |
||
Планирование |
||
Концептуализация Моделирование |
||
Реализация |
Разработка критериальной базы |
2 урок + домашнее задание |
Реализация проектного продукта |
||
Представление проектного продукта Оценка Рефлексия |
Представление |
3 урок + домашнее задание |
Защита проекта |
||
Оценка |
||
Рефлексия |
||
Диагностика уровня сформированности проектных действий |
Поэтапное описание проектного модуля, действий обучающихся, действий педагога.
Этапы проектной деятельности |
Деятельность учителя |
Деятельность учащихся |
Средства |
Результат |
||||||||
1-й урок (подготовительный и проектировочный этапы): актуализация – проблематизация – целеполагания — планирование действий-концептуализация. |
||||||||||||
Актуализация имеющейся системы: предметных знаний и способов деятельности, метапредметных способов деятельности, ценностей и смыслов, связанных с содержанием модуля и самим процессом познания. |
Организует повторение правил техники безопасности и поведения в кабинете химии.
Организует фронтальное выполнение заданий, направленных на усвоение темы «Физические и химические явления» Задает вопрос учащимся: «Как отличить химические явления от физических?», «Каковы признаки химических реакций?» |
Отвечают на вопросы. Просмотр в режиме «без звука» флеш — ролика «Признаки химических реакций». Указывают признаки химических реакций, комментируют свой ответ. Рассуждают и делают вывод том, что химические явление характеризуются образованием новых веществ, с новыми признаками. Признаками химических реакций могут быть: появление запаха (выделение газа), образование осадка, изменение цвета.
|
Мультимедийный комплекс и интерактивной доской. Материал Единой коллекции ЦОР |
Выявлена граница «знания-незнания» |
||||||||
Проблематизация – определение проблемы проекта и причин, приводящий к появлению проблемы. |
Организует действия учащихся по выявлению и формулировке противоречия и проблемы. Проведение мини-исследования : «Приготовление водных растворов перманганата калия и серной кислоты»
|
Учащиеся, соблюдая правила техники безопасности выполняют мини-исследование №1: , описывают свои наблюдения , заполняют таблицу. Растворение
Проблема: К каким же явлениям относится процесс растворения, физическим или химическим, как можно описать процесс растворения веществ? |
Алгоритм выполнения мини-исследования №1 Приложение №1 Оборудование и реактивы:: KМnО4, Н2SО4(конц.), безводный СuSО4, вода, пробирки, штатив.
|
Сформулирована проблема |
||||||||
Целеполагание – определение цели и задач проекта. |
На основе сформулированной проблемы создает условия для формулировки цели и определения будущего проектного продукта |
Формулируют цель проекта с помощью учителя: описать модель процесса растворения, определить факторы, влияющие на процесс растворения, провести классификацию растворов, указать значение и применение растворов. С помощью учителя определяют блоки ментальной карты: 1 блок: «Модель процесса растворения» 2 блок: «Зависимость процесса растворения от различных факторов» 3 блок: «Классификация растворов» 4 блок: «Значение и применение растворов» |
|
Сформулирована цель общего проектного продукта. |
||||||||
Планирование действий |
Создает условия для формирования проектных групп и распределение обязанностей внутри групп по выполнению проектных заданий
|
Класс делится на 5 групп по 4-5 человек. Каждая группа выбирает руководителя. Совместно с учителем проговаривают совместный план действий.
|
|
Сформированы группы учащихся для выполнения проекта. Разработан план дальнейшей работы |
||||||||
Организует действия учащихся для работы в группах. Оказывает помощь в распределении обязанностей внутри группы Предлагает работу в группах по единым заданиям: прочитать текст учебника с.186-188, оформить схему-модель процесса растворения. Направляет группы на выполнение практического мини-исследования №2 «Наблюдение влияния природы растворенного вещества на процесс растворения» Направляет группы на выполнение практического мини-исследования №3 «Наблюдение влияния природы растворителя на процесс растворения веществ» Направляет группы на выполнение практического мини-исследования №4 «Наблюдение влияния температуры на растворимость веществ.». |
Составляют схему-модель «Растворение как физико-химический процесс». Каждый учащийся внутри группы самостоятельно читает текст. 1 ученик: рассматривает историю изучения данного вопроса. 2 ученик: выделяет сторонников физической теории растворов 3 ученик: выделяет сторонников химической теории растворов 4 ученик: описывают современные представления, составляют схему-модель РАСТВОР= Н2О + Р.В. + ГИДРАТЫ (продукты взаимодействия Н2О растворёнными веществами). 5 ученик планирует и оформляет блок 1 ментальной карты. Учащиеся, соблюдая правила техники безопасности, выполняют мини-исследование №2 «Наблюдение влияния природы растворенного вещества на процесс растворения» по предложенному алгоритму, формулируют вывод. Формулируют выводы : Природа растворяемого вещества влияет на процесс растворения. Растворимость вещества зависит от природы самого вещества. Учащиеся, соблюдая правила техники безопасности, выполняют мини-исследование №3 «Наблюдение влияния природы растворителя на процесс растворения веществ» по предложенному алгоритму, формулируют вывод. Формулируют выводы: Природа растворителя влияет на процесс растворителя. Растворимость вещества зависит от природы самого вещества. Учащиеся, соблюдая правила техники безопасности, выполняют мини-исследование №4 «Наблюдение влияния температуры на растворимость веществ.».по предложенному алгоритму, формулируют вывод. Формулируют выводы: С увеличением температуры растворимость вещества увеличивается. Возможно построение модели растворимости в зависимости от температуры. |
Проектные задания
«Мозговой штурм»
Алгоритм мини-исследования №2 Приложение 2 Оборудование и реактивы: пронумерованные пробирки с веществами: №1 Хлорид кальция №2 гидроксид кальция №3 карбонат кальция, вода. Алгоритм мини-исследования №3 Приложение 3 Оборудование и реактивы: Две пронуме-рованные пробирки №1 и №2 с несколькими кристаллами йода, спирт, вода. Алгоритм мини-исследования №4 Приложение 4
|
Созданы промежуточные продукты: схема – модель процесса растворения.
Сформулированы факторы, влияющие на растворимость веществ:
|
|||||||||
Концептуализация и моделирование – создание образа объекта проектирования.
|
Организует действия учащихся по созданию образа проектного продукта. Консультирует учащихся по созданию проектного продукта. |
Учащиеся в группах обсуждают, каким будет итоговой модуль, аргументируют свою точку зрения, выслушивают учеников своей группы, участвуют в обсуждении макета. . |
Мозговой штурм |
Создан образ (модель) проектного продукта – ментальной карты «Растворимость веществ» |
||||||||
Организует работу по распределению блоков внутри группы, организует работу по заполнению табеля учета работы над проектом |
Выбирают блок для заполнения, договариваются друг с другом, предлагают взаимопомощь в распределении и оформлении блоков. Оценивают свою собственную работу и работу одноклассников |
Табель учета работы над проектом |
Распределены все блоки внутри каждой группы, оценена работа за урок. |
|||||||||
Д/з: изучить параграф 34, выполнить задания в рабочей тетради. Подобрать иллюстрации для блоков к ментальной карте, иллюстрирующих классификацию и применение растворов. |
||||||||||||
2-й урок (этап реализации): решение конкретно-практических задач. Создание проектного продукта. |
||||||||||||
Разработка критериальной базы |
Организует работу по созданию критериев проекта |
Предлагают варианты критериев оценки проектного продукта:
За каждый критерий от 0 до 3 баллов:
Оценка «5» — 15-14 баллов Оценка «4» — 13-11 баллов Оценка «3»- 10-7 баллов Оценка «2» -менее 7 баллов |
Прием «Дерево мнений» |
Разработаны критерии оценки проекта |
||||||||
Решение конкретно-практических задач и создание образовательных продуктов (создание проектного продукта) |
Создает условия для реализации проектного продукта. Организуется выполнение проектного задания, рассматривается требования к составлению ментальной карты, требования к структурированию найденной информации Каждая группа получает проектное задание и алгоритм его выполнения, Осуществляет консультационную помощь в создании проектного продукта.
|
Учащиеся в соответствии с распределенными обязанностями определяют образ конкретно-практической задачи. Это будет ментальная карта, на которой будет структурирована информация по теме «Растворимость веществ. Растворы». В центре будет обозначена тема. Вокруг расположены 4 блока. Информация должна быть представлена в виде схем, рисунков, ассоциаций. Учащиеся распределяют обязанности в группе: 1 ученик: ответственный за блок №1, командир группы 2 ученик: ответственный за блок №2, отслеживание время; 3 ученик: ответственный за блок №3, 4 ученик: ответственный за блок №4 5 ученик: общее оформление работы, ответственный за оценивание выполненной работы. Выполнение заданий совместно, но под контролем ответственного:
|
Бумага, фломастеры, ножницы, принтер |
Выполнены проектные задания.
Создан проектный полупродукт. |
||||||||
Д/з: повторить параграф 34. Доработать созданный проектный полупродукт, подготовить выступление от группы. |
||||||||||||
3-й урок «Презентация полученного проектного продукта. Оценка качества продукта и рефлексия действий в проекте его создателей. |
||||||||||||
Презентация полученного проектного продукта. |
Создает условия для презентации проектного продукта
|
Презентуют созданные проектные продукты — ментальную карту, собранную из 4-х блоков.
|
|
Демонстрация карты «Раствори-мость. Растворенные вещества». |
||||||||
Оценка качества проектного продукта и рефлексия действий в проекте его создателей. |
Организует обобщение знаний и выполненных действий. Предлагает соотнести задачи и результаты создания проекта, оценить правильность выбора метода проекта. Обобщает полученные знания, выполненные действия. Использует критерии для оценки результатов. Оценивает полученные знания и освоенные действия в соответствии с критериями. Осуществляет контроль знаний по теме «Растворение. Растворимость веществ». |
Группы выходят защищать свой продукт. Оценивают свою работу в группе по реализации проектной деятельности, работу одноклассников; а также оценивают проекты. Оспаривают или соглашаются с оценкой своих работ. Анализируют допущенные недочеты. Вносят предложения в алгоритм выполнения однотипных заданий. Оценивают проектную деятельность в соответствии с критериями оценочного листа.
|
Оценочный лист проектной деятельности. Приложение №5 Оценочный лист проектного продукта Приложение №6 Задание «Вставь пропущенное слово» по вариантам. |
Выставлены оценки. Указаны ошибки. Проведена рефлексия. Контроль знаний. |
||||||||
Д/з: выполнить задания учебника с.192. Подготовить сообщения про растворы, используемые в медицине – 1 ряд, в с/х – 2 ряд, в быту – 3 ряд. |
||||||||||||
Описание промежуточных проектных продуктов и описание используемых урочных домашних заданий (дидактическое обеспечение проектного модуля).
На первом уроке учитель проверяет уровень усвоения ранее изученной темы, предлагает устно выполнить задание на актуализацию знаний — Просмотр в режиме «без звука» флеш — ролика «Признаки химических реакций», Материал Единой коллекции ЦОР
По итогам работы на первом уроке учащиеся получают промежуточные продукты: отчеты по мини-исследованиям№1«Наблюдение процессов растворения перманганата калия, концентрированной серной кислоты и безводного сульфата меди»», №2 Наблюдение влияния природы растворенного вещества на процесс растворения», №3 «Наблюдение влияния природы растворителя на процесс растворения», №4 «Наблюдение влияния температуры на процесс растворения»
На дом учащиеся получают следующее задание: изучить параграф 34, выполнить задание в рабочей тетради часть I тема 34 с помощью интернет — источника подобрать иллюстрации по темам «Значение и применение растворов», «Классификация растворов».
На втором уроке учащиеся разрабатывают проектный продукт в соответствии с проектными заданиями. К концу урока каждая группа оформляет ментальную карту. После второго урока учащиеся получают домашнее задание: доработать проектный полупродукт и подготовить по нему мини-выступление, включая подготовку к проекту и его реализацию.
После третьего урока учащиеся получают домашнее задание: подготовить сообщение про применение растворов в быту, с/х или медицине.
rosuchebnik.ru
Растворимость различных веществ в воде
Способность данного вещества растворяться в данном растворителе называется растворимостью.
С количественной стороны растворимость твердого вещества характеризует коэффициент растворимости или просто растворимость — это максимальное количество вещества, которое способно раствориться в 100 г или 1000 г воды при данных условиях с образованием насыщенного раствора.
Так как большинство твердых веществ при растворении в воде поглощают энергию, то в соответствии с принципом Ле-Шателье, растворимость многих твердых веществ увеличивается с повышением температуры.
Растворимость газов в жидкости характеризует коэффициент абсорбции — максимальный объем газа, который может раствориться при н.у. в одном объеме растворителя. При растворении газов выделяется тепло, поэтому с повышением температуры растворимость их понижается (например, растворимость NH3 при 0°С равна 1100 дм3/1 дм3 воды, а при 25°С — 700 дм3/1 дм3 воды). Зависимость растворимости газов от давления подчиняется закону Генри: масса растворенного газа при неизменной температуре прямо пропорциональна давлению.
Выражение количественного состава растворов
Наряду с температурой и давлением основным параметром состояния раствора является концентрация в нем растворенного вещества.
Концентрацией раствора называется содержание растворенного вещества в определенной массе или в определенном объеме раствора или растворителя. Концентрацию раствора можно выражать по-разному. В химической практике наиболее употребительны следующие способы выражения концентраций:
а) массовая доля растворенного вещества показывает число граммов (единиц массы) растворенного вещества, содержащееся в 100 г (единиц массы) раствора (ω, %)
ω
(%) = 
б) мольно-объемная концентрация, или молярность, показывает число молей (количество) растворенного вещества, содержащихся в 1 дм3 раствора (с или М, моль/дм3)
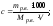
в) эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 дм3 раствора (сэ или н, моль/дм3)

г) мольно-массовая концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя (сm, моль / 1000 г)
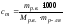 ;
;
д) титром раствора называется число граммов растворенного вещества в 1 см3 раствора (Т, г/см3)
T = mр.в./V.
Кроме того состав раствора выражается через безразмерные относительные величины -доли. Объемная доля — отношение объема растворенного вещества к объему раствора; массовая доля — отношение массы растворенного вещества к объему раствора; мольная доля отношение количества растворенного вещества (число молей) к суммарному количеству всех компонентов раствора. Наиболее употребительной величиной является мольная доля (N) – отношение количества растворенного вещества (ν1) к суммарному количеству всех компонентов раствора, то есть ν1 + ν2 (где ν2 –количество растворителя)
Nр.в. = ν1/( ν1 + ν2) = mр.в./Мр.в./( mр.в./Мр.в + mр-ля./Мр-ля).
Разбавленные растворы неэлектролитов и их свойства
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора, так называемому идеальному раствору. Раствор, образование которого не связано с изменением объема и тепловым эффектом, называют идеальным раствором. Однако, большинство растворов не обладает в полной мере свойствами идеальности и общие закономерности могут быть описаны на примерах так называемых разбавленных растворов, то есть растворов, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя и взаимодействием молекул растворенного вещества с растворителем можно пренебречь. Растворы обладают коллигативными свойствами — это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
осмотическое давление;
давление насыщенного пара. Закон Рауля;
повышение температуры кипения;
понижениетемпературы замерзания.
Осмос. Осмотическое давление.
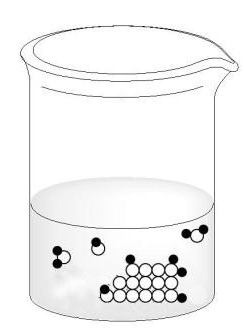
Пусть имеется сосуд, разделенный полупроницаемой перегородкой (пунктир на рисунке) на две части, заполненные до одинакового уровня О-О. В левой части помещается растворитель, в правой — раствор
0
I
IIII
0I

растворитель раствор
К понятию явления осмоса
Вследствие различия концентраций растворителя по обе стороны перегородки растворитель самопроизвольно (в соответствии с принципом Ле-Шателье) проникает через полупроницаемую перегородку в раствор, разбавляя его. Движущей силой преимущественной диффузии растворителя в раствор является разность свободных энергий чистого растворителя и растворителя в растворе. При разбавлении раствора за счет самопроизвольной диффузии растворителя объем раствора увеличивается и уровень перемещается из положения О в положение II. Односторонняя диффузия определенного сорта частиц в растворе через полупроницаемую перегородку называется осмосом.
Количественно охарактеризовать осмотические свойства раствора (по отношению к чистому растворителю) можно, введя понятие об осмотическом давлении. Последнее представляет собой меру стремления растворителя к переходу сквозь полупроницаемую перегородку в данный раствор. Оно равно тому дополнительному давлению, которое необходимо приложить к раствору, чтобы осмос прекратился (действие давления сводится к увеличению выхода молекул растворителя из раствора).
Растворы, характеризующиеся одинаковым осмотическим давлением, называются изотоническими. В биологии растворы с осмотическим давлением, большим, чем у внутриклеточного содержимого, называются гипертоническими, с меньшим – гипотоническими. Один и тот же раствор для одного типа клеток гипертонический, для другого – изотонический, для третьего – гипотонический.
Свойствами полупроницаемости обладает большинство тканей организмов. Поэтому осмотические явления имеют громадное значение для жизнедеятельности животных и растительных организмов. Процессы усвоения пищи, обмена веществ и т.д. тесно связаны с различной проницаемостью тканей для воды и тех или иных растворенных веществ. Явления осмоса объясняют некоторые вопросы, связанные с отношением организма к среде. Например, ими обусловлено то, что пресноводные рыбы не могут жить в морской воде, а морские в речной.
Вант-Гофф показал, что осмотическое давление в растворе неэлектролита пропорционально молярной концентрации растворенного вещества
Росм= сRТ,
где Росм — осмотическое давление, кПа; с — молярная концентрация, моль/дм3; R — газовая постоянная, равная 8,314 Дж/моль∙К; Т — температура, К.
Это выражение по форме аналогично уравнению Менделеева-Клапейрона для идеальных газов, однако эти уравнения описывают разные процессы. Осмотическое давление возникает в растворе при проникновении в него дополнительного количества растворителя через полупроницаемую перегородку. Это давление — сила, препятствующая дальнейшему выравниванию концентраций.
Вант-Гофф сформулировал закон осмотического давления: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, который занимает раствор, при той же температуре.
Давление насыщенного пара. Закон Рауля.
Рассмотрим разбавленный раствор нелетучего (твердого) вещества А в летучем жидком растворителе В. При этом общее давление насыщенного пара над раствором определяется парциальным давлением пара растворителя, поскольку давлением пара растворенного вещества можно пренебречь.
Рауль показал, что давление насыщенного пара растворителя над раствором Р меньше, чем над чистым растворителем Р°. Разность Р° — Р = Р называется абсолютным понижением давления пара над раствором. Эта величина, отнесенная к давлению пара чистого растворителя, то есть (Р°-Р)/Р° =Р/Р°, называется относительным понижением давления пара.
Согласно закону Рауля, относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного нелетучего вещества
(Р°-Р)/Р° = N = ν1/( ν1 + ν2) = mр.в./Мр.в./( mр.в./Мр.в + mр-ля./Мр-ля) = XA
где XA — мольная доля растворенного вещества. А так как ν1= mр.в./Мр.в, то используя этот закон можно определить мольную массу растворенного вещества.
Следствие закона Рауля. Понижение давления пара над раствором нелетучего вещества, например в воде, можно пояснить с привлечением принципа смещения равновесия Ле-Шателье. Действительно, при увеличении концентрации нелетучего компонента в растворе равновесие в системе вода — насыщенный пар сдвигается в сторону конденсации части пара (реакция системы на уменьшение концентрации воды при растворении вещества), что и вызывает уменьшение давления пара.
Понижение давления пара над раствором по сравнению с чистым растворителем вызывает повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем (t). Эти величины пропорциональны моляльной концентрации растворенного вещества — неэлектролита, то есть:
t = К∙ст = К∙т∙1000/М∙а,
где сm— моляльная концентрация раствора; а — масса растворителя. Коэффициент пропорциональности К, в случае повышения температуры кипения, называется эбуллиоскопической константой для данного растворителя (Е), а для понижения температуры замерзания — криоскопической константой (К). Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль нелетучего неэлектролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и моляльным понижением температуры замерзания раствора.
Крископическая и эбуллиоскопическая постоянные не зависят от концентрации и природы растворенного вещества, а зависят лишь от природы растворителя и характеризуются размерностью кг∙град/моль.
studfile.net
Растворение. Растворимость веществ в воде
Растворы играют ключевую роль в природе, науке и технике. Вода – основа жизни, всегда содержит растворенные вещества. Пресная вода рек и озер содержит мало растворенных веществ, в то время как морская вода содержит около 3,5% растворенных солей.
Первичный океан (во время зарождения жизни на Земле), по предположениям, содержал всего 1% растворенных солей.
 «Именно в этой среде впервые развивались живые организмы, из этого раствора они черпали ионы и молекулы, которые необходимы для их дальнейшего роста и развития… Со временем живые организмы развивались и преображались, поэтому они смогли оставить водную среду и перебраться на сушу и затем подняться в воздух. Они получили эти способности, сохранив в своих организмах водный раствор в виде жидкостей, которые содержат жизненно важный запас ионов и молекул» – именно такими словами описывает роль растворов в природе знаменитый американский химик, лауреат Нобелевской премии Лайнус Полинг. Внутри каждого из нас, в каждой клетке нашего организма – содержатся воспоминания о первичном океане, месте в котором зародилась жизнь, — водном растворе, обеспечивающем саму жизнь.
«Именно в этой среде впервые развивались живые организмы, из этого раствора они черпали ионы и молекулы, которые необходимы для их дальнейшего роста и развития… Со временем живые организмы развивались и преображались, поэтому они смогли оставить водную среду и перебраться на сушу и затем подняться в воздух. Они получили эти способности, сохранив в своих организмах водный раствор в виде жидкостей, которые содержат жизненно важный запас ионов и молекул» – именно такими словами описывает роль растворов в природе знаменитый американский химик, лауреат Нобелевской премии Лайнус Полинг. Внутри каждого из нас, в каждой клетке нашего организма – содержатся воспоминания о первичном океане, месте в котором зародилась жизнь, — водном растворе, обеспечивающем саму жизнь.
В любом живом организме постоянно течет по сосудам – артериям, венам и капиллярам – необычный раствор, который составляет основу крови, массовая доля солей в нем такая же, как в первичном океане, – 0,9%. Сложные физико-химические процессы, протекающие в организме человека и животного, также взаимодействуют в растворах. Процесс усвоения пищи связан с переводом высокопитательных веществ в раствор. Природные водные растворы напрямую связаны с процессами почвообразования, снабжением растений питательными веществами. Такие технологические процессы в химической и многих других отраслях промышленности, например производство удобрений, металлов, кислот, бумаги, происходят в растворах. Современная наука занимается изучением свойств растворов. Давайте выясним, что же такое раствор?
 Растворы отличаются от других смесей тем, что частицы составных частей располагаются в них равномерно, и в любом микрообъеме подобной смеси состав будет одинаков.
Растворы отличаются от других смесей тем, что частицы составных частей располагаются в них равномерно, и в любом микрообъеме подобной смеси состав будет одинаков.
Именно поэтому под растворами понимали однородные смеси, которые состоят из двух или более однородных частей. Такое представление исходило из физической теории растворов.
Приверженцы физической теории растворов, которой занимались Вант-Гофф, Аррениус и Оствальд, считали, что процесс растворения является результатом диффузии.
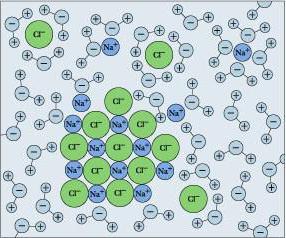
Д. И. Менделеев и сторонники химической теории считали, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды. Таким образом, будет точнее определить раствор как однородную систему, которая состоит из частиц растворенного вещества, растворителя, а также продуктов их взаимодействия.
Вследствие химического взаимодействия растворенного вещества с водой образуются соединения – гидраты. Химическое взаимодействие обычно сопровождается тепловыми явлениями. К примеру, растворение серной кислоты в воде проходит с выделением такого колоссального количества тепла, что раствор может закипеть, именно поэтому кислоту льют в воду, а не наоборот. Растворение таких веществ как хлорид натрия, нитрат аммония, сопровождается поглощением тепла.
М. В. Ломоносов доказал, что растворы превращаются в лед при более низкой температуре, чем растворитель.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Растворимость | CHEMEGE.RU
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
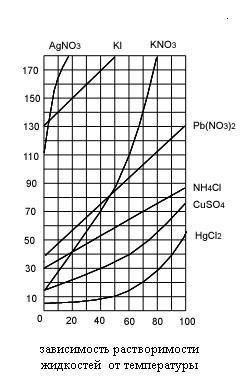
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблтце приведена растворимость некоторых веществ в воде при 20oС:
Вещество | Растворимость, г на 100 г H2O | Вещество | Растворимость, г на 100 г H2O |
NH4NO3 | 177 | H3BO3 | 6 |
NaCl | 36 | CaCO3 | 0,0006 |
NaHCO3 | 10 | AgI | 0,0000002 |
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пернебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Растворимость твердых веществ в жидкостях зависит от структуры твердого вещества (от типа кристаллической решетки твердого вещества). Например, вещества с металлическими кристаллическими решетками (железо, медь и др.) очень мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде.
Есть замечательное правило: “подобное хорошо растворяется в подобном”. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например, соли хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20oС растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например, растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
* Материалы портала onx.distant.ru
chemege.ru
таблица. Растворимость веществ в воде
В повседневной жизни люди редко сталкиваются с чистыми веществами. Большинство предметов представляют собой смеси веществ.
Раствор — это однородная смесь, в которой компоненты равномерно смешались. Есть несколько их видов по размеру частиц: грубодисперсные системы, молекулярные растворы и коллоидные системы, которые часто называют золи. В этой статье речь идет о молекулярных (или истинных) растворах. Растворимость веществ в воде — одно из главных условий, влияющих на образование соединений.
Растворимость веществ: что это и зачем нужно
Чтобы разобраться в этой теме, нужно знать, что такое растворы и растворимость веществ. Простым языком, это способность вещества соединяться с другим и образовывать однородную смесь. Если подходить с научной точки зрения, можно рассмотреть более сложное определение. Растворимость веществ — это их способность образовывать с одним или более веществами гомогенные (или гетерогенные) составы с дисперсным распределением компонентов. Существует несколько классов веществ и соединений:
- растворимые;
- малорастворимые;
- нерастворимые.

О чем говорит мера растворимости вещества
Содержание вещества в насыщенной смеси — это мера его растворимости. Как сказано выше, у всех веществ она разная. Растворимые — это те, которые могут развести более 10 г себя на 100 г воды. Вторая категория — менее 1 г при тех же условиях. Практически нерастворимые — это те, в смесь которых переходит менее 0,01 г компонента. В этом случае вещество не может передавать воде свои молекулы.
Что такое коэффициент растворимости
Коэффициент растворимости (k) — это показатель, максимальной массы вещества (г), которая может развестись в 100 г воды или другого вещества.
Растворители
В данном процессе участвуют растворитель и растворенное вещество. Первый отличается тем, что изначально он пребывает в таком же агрегатном состоянии, что и конечная смесь. Как правило, он взят в большем количестве.
Однако многие знают, что в химии вода занимает особое место. Для нее существуют отдельные правила. Раствор, в котором присутствует H2O называется водным. Когда говорится о них, жидкость является экстрагентом и тогда, когда она в меньшем количестве. В пример можно привести 80%-ный раствор азотной кислоты в воде. Пропорции здесь не равны Хоть доля воды меньше, чем кислоты, вещество называть 20%-ным раствором воды в азотной кислоте некорректно.
Существуют смеси, в которых отсутствует H2O. Они будут носить имя неводная. Подобные растворы электролита представляют собой ионные проводники. Они содержащие один или смеси экстрагентов. В их состав входят ионы и молекулы. Они используются в таких отраслях, как медицина, производство бытовой химии, косметики и в другие направления. Они могут сочетать в себе несколько нужных веществ с различной растворимостью. Компоненты многих средств, которые применяются наружно, являются гидрофобными. Иными словами, они плохо взаимодействуют с водой. В таких смесях растворители могут быть летучими, нелетучими и комбинированными. Органические вещества в первом случае хорошо растворяют жиры. К летучим относятся спирты, углеводороды, альдегиды и другие. Они часто входят в состав бытовой химии. Нелетучие чаще всего применяются для изготовления мазей. Это жирные масла, жидкий парафин, глицерин и прочие. Комбинированные — это смесь летучих и нелетучих, например, этанол с глицерином, глицерин с димексидом. Также они могут содержать воду.
Виды растворов по степени насыщенности
Насыщенный раствор — это смесь химических веществ, содержащая максимальную концентрацию одного вещества в растворителе при определенной температуре. Дальше оно разводиться не будет. В препарате твёрдого вещества заметно выпадение осадка, который находится в динамическом равновесии с ним. Под этим понятием подразумевается состояние, сохраняющееся во времени вследствие его протекания одновременно в двух противоположных направлениях (прямая и обратная реакции) с одинаковой скоростью.
Если вещество при постоянной температуре все еще может разлагаться, то этот раствор — ненасыщенный. Они устойчивы. Но если в них продолжать добавлять вещество, то оно будет разводиться в воде (или другой жидкости), пока не достигнет максимальной концентрации.
Еще один вид — перенасыщенный. В нем содержится больше растворенного вещества, чем может быть при постоянной температуре. Из-за того, что они находятся в неустойчивом равновесии, при физическом воздействии на них происходит кристаллизация.
Как отличить насыщенный раствор от ненасыщенного?
Это сделать достаточно просто. Если вещество — твердое, то в насыщенном растворе можно увидеть осадок. При этом экстрагент может загустевать, как, например, в насыщенном составе вода, в которую добавили сахар.
Но если изменить условия, повысить температуру, то он перестанет считаться насыщенным, так как при более высокой температуре максимальная концентрация этого вещества будет другой.
Теории взаимодействия компонентов растворов
Существует три теории относительно взаимодействия элементов в смеси: физическая, химическая и современная. Авторы первой — Сванте Август Аррениус и Вильгельм Фридрих Оствальд. Они предположили, что вследствие диффузии частицы растворителя и растворённого вещества равномерно распределились по всему объему смеси, но взаимодействия между ними нет. Химическая теория, которую выдвинул Дмитрий Иванович Менделеев, ей противоположна. Согласно ей, в результате химического взаимодействия между ними формируются неустойчивые соединения постоянного или переменного состава, которые называются сольваты.
В настоящее время используется объединенная теория Владимира Александровича Кистяковского и Ивана Алексеевича Каблукова. Она совмещает физическую и химическую. Современная теория гласит, что в растворе существуют как не взаимодействующие частицы веществ, так и продукты их взаимодействия — сольваты, существование которых доказывал Менделеев. В случае, когда экстрагент — вода, их называют гидратами. Явление, при котором образуются сольваты (гидраты) носит имя сольватация (гидратация). Она воздействует на все физико-химические процессы и меняет свойства молекул в смеси. Сольватация происходит благодаря тому, что сольватная оболочка, состоящая из тесно связанных с ней молекул экстрагента, окружает молекулу растворенного вещества.
Факторы, влияющие на растворимость веществ
Химический состав веществ. Правило «подобное притягивает подобное» распространяется и на реагенты. Схожие по физическим и химическим свойствам вещества могут взаимно растворяться быстрее. Например, неполярные соединения хорошо взаимодействуют с неполярными. Вещества с полярными молекулами или ионным строением разводятся в полярных, например, в воде. В ней разлагаются соли, щёлочи и другие компоненты, а неполярные — наоборот. Можно привести простой пример. Для приготовления насыщенного раствора сахара в воде потребуется большее количество вещества, чем в случае с солью. Как это понимать? Проще говоря, вы можете развести гораздо больше сахара в воде, чем соли.
Температура. Чтобы увеличить растворимость твердых веществ в жидкостях, нужно увеличить температуру экстрагента (работает в большинстве случаев). Можно продемонстрировать такой пример. Если положить щепотку хлорида натрия (соль) в холодную воду, то данный процесс займет много времени. Если проделать то же самое с горячей средой, то растворение будет проходить гораздо быстрее. Это объясняется тем, что вследствие повышения температуры возрастает кинетическая энергия, значительное количество которой часто тратится на разрушение связей между молекулами и ионами твёрдого вещества. Однако, когда повышается температура в случае с солями лития, магния, алюминия и щелочами, их растворимость понижается.
Давление. Этот фактор влияет только на газы. Их растворимость увеличивается при повышении давления. Ведь объём газов сокращается.
Изменение скорости растворения
Не стоит путать этот показатель с растворимостью. Ведь на изменение этих двух показателей влияют разные факторы.
Степень раздробленности растворяемого вещества. Этот фактор влияет на растворимость твердых веществ в жидкостях. В цельном (кусковом) состоянии состав разводится дольше, чем тот, который разбит на мелкие куски. Приведем пример. Цельный кусок соли будет растворяться в воде намного дольше, чем соль в виде песка.
Скорость помешивания. Как известно, этот процесс можно катализировать с помощью помешивания. Его скорость также важна, потому что чем она больше, тем быстрее растворится вещество в жидкости.
Для чего нужно знать растворимость твердых веществ в воде?
Прежде всего, подобные схемы нужны, чтобы правильно решать химические уравнения. В таблице растворимости есть заряды всех веществ. Их необходимо знать для правильной записи реагентов и составления уравнения химической реакции. Растворимость в воде показывает, может ли соль или основание диссоциировать. Водные соединения, которые проводят ток, имеют в своем составе сильные электролиты. Есть и другой тип. Те, которые плохо проводят ток, считаются слабыми электролитами. В первом случае компоненты представляют собой вещества, полностью ионизованные в воде. Тогда как слабые электролиты проявляют этот показатель лишь в небольшой степени.
Уравнения химической реакции
Есть несколько видов уравнений: молекулярный, полный ионный и краткий ионный. По сути последний вариант — сокращённая форма молекулярного. Это окончательный ответ. В полном уравнении записаны реагенты и продукты реакции. Теперь наступает очередь таблицы растворимости веществ. Для начала надо проверить, является ли реакция осуществимой, то есть выполняется ли одно из условий проведения реакции. Их всего 3: образование воды, выделение газа, выпадение осадка. Если два первых условия не соблюдаются, нужно проверить последнее. Для этого нужно посмотреть в таблицу растворимости и выяснить, есть ли в продуктах реакции нерастворимая соль или основание. Если оно есть, то это и будет осадок. Далее таблица потребуется для записи ионного уравнения. Так как все растворимые соли и основания — сильные электролиты, то они будут распадаться на катионы и анионы. Далее сокращаются несвязанные ионы, и уравнение записывается в кратком виде. Пример:
- K2SO4+BaCl2=BaSO4↓+2HCl,
- 2K+2SO4+Ba+2Cl=BaSO4↓+2K+2Cl,
- Ba+SO4=BaSO4↓.
Таким образом, таблица растворимости веществ — одно из ключевых условий решения ионных уравнений.
Подробная таблица помогает узнать, сколько компонента нужно взять для приготовления насыщенной смеси.
Таблица растворимости
Так выглядит привычная неполная таблица. Важно, что здесь указывается температура воды, так как она является одним из факторов, о которых мы уже говорили выше.
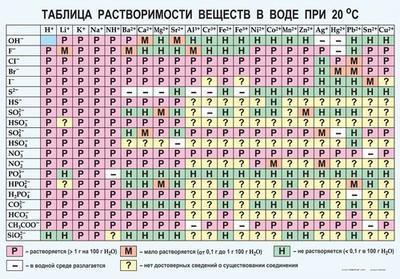
Как пользоваться таблицей растворимости веществ?
Таблица растворимости веществ в воде — один из главных помощников химика. Она показывает, как различные вещества и соединения взаимодействуют с водой. Растворимость твердых веществ в жидкости — это показатель, без которого многие химические манипуляции невозможны.
Таблица очень проста в использовании. В первой строке написаны катионы (положительно заряженные частицы), во второй — анионы (отрицательно заряженные частицы). Большую часть таблицы занимает сетка с определенными символами в каждой ячейке. Это буквы «Р», «М», «Н» и знаки «-» и «?».
- «Р» — соединение растворяется;
- «М» — мало растворяется;
- «Н» — не растворяется;
- «-» — соединения не существует;
- «?» — сведения о существовании соединения отсутствуют.
В этой таблице есть одна пустая ячейка — это вода.
Простой пример
Теперь о том, как работать с таким материалом. Допустим, нужно узнать растворима ли в воде соль — MgSo4 (сульфат магния). Для этого необходимо найти столбик Mg2+ и спускаться по нему до строки SO42-. На их пересечении стоит буква Р, значит соединение растворимо.
Заключение
Итак, мы изучили вопрос растворимости веществ в воде и не только. Без сомнений, эти знания пригодятся при дальнейшем изучении химии. Ведь растворимость веществ играет там важную роль. Она пригодится при решении и химических уравнений, и разнообразных задач.
fb.ru
Растворимость
Существует несколько трактований термина растворимость.
Растворимость — это способность вещества растворяться в воде или другом растворителе.
Растворимость – это способность веществ растворяться друг в друге, количественно характеризуется коэффициентом растворимости (к или р) — это масса растворённого вещества, приходящаяся на 100 или 1000г растворителя, в насыщенном растворе — при определённой температуре.
Растворимость вещества зависит от различных факторов: природы вещества и растворителя, от агрегатного состояния, от температуры и давления (для газов).
Существует утверждение “Подобное растворяется в подобном”. Это означает, что молекулярные и ионные соединения с полярной связью хорошо растворяются в полярных растворителях, а вещества с неполярной связью – в неполярных .
Главным растворителем является вода. Но не все вещества, особенно органические, растворяются в воде. Для растворения используют различные растворители, такие как ацетон, спирт, бензол, эфир, хлороформ, метанол и т.д. Применяются также смеси растворителей, например, смеси спирта с водой.
Чтобы растворить твердое вещество, его следует очень мелко измельчить (истереть вступке или помолоть в мельнице). Это делается для того, чтобы увеличить поверхность соприкосновения растворяемого вещества и растворителя. При перемешивании или взбалтывании ускоряется процесс получения раствора. Часто на емкость, в которой готовится раствор, надевают обратный холодильник. Его используют в основном для приготовления растворов путем кипячения. Этим уменьшают потери растворителя. Образующиеся при нагреваниипары смеси осаждаются в холодильнике и стекают обратно. Особенно это важно для горючих растворителей, пары которых из открытого сосуда могли бы загореться от соприкосновения с нагревающим элементом.
Растворимость веществ бывает:
- неограниченная
(Примеры: вода и спирт; калия хлорид и калия бромид; калий и рубидий) – эти вещества смешиваются в любых соотношениях.
- ограниченная (Пример: вода и соль поваренная) – определенное количество растворенного вещества
По степени растворимости все вещества делятся:
- Хорошо растворимые (растворимость при 200С более 1 г)
- Малорастворимые (растворимость при 200С от 0,01до 1,0 г)
- Нерастворимые (растворимость при 200С не более 0,01 г)
Хорошо растворимым считается вещество, если более 10 г его хорошо растворяется в 100 г воды.
Малорастворимым называют вещество, если в 100 г воды его растворяется менее 1 г.
И нерастворимые – это такие вещества, менее 0,01 г которых переходит в раствор.
Совсем нерастворимых веществ не бывает. Даже когда воду наливают в стеклянный сосуд, то незначительная часть молекул стекла переходит в раствор.
Что дает нам знание о растворимости веществ в производстве косметики? Существует множество вариантов композиций косметических продуктов. Чтобы предотвратить потенциальную несовместимость компонентов в них, для этого и необходимы знания о растворимости веществ. Зная, как и в чем растворяются вещества, подбирают правильный, последовательный ввод в реактор всех необходимых компонентов при изготовлении косметических средств. Понятие «растворимость» широко используется и в фармакологии. По определению растворимости судят о чистоте субстанции и вспомогательных веществ.
При изготовлении лекарственных средств, биологически активных добавок (БАД) зная о растворимости, применяют специальные технологические приемы:
- Изменяют последовательность растворения (смешивания) ингредиентов.
- Используют приемы раздельного растворения компонентов.
- Смешивают части лекарственных веществ, различные основы и затем объединяют эти части в единое целое
Зная о растворимости веществ, подбирают различные сорастворители, солюбилизаторы и стабилизаторы для создания прочных лекарственных форм.
растворимости веществ в разных растворителях обычно приводятся в частных статьях на субстанции или вспомогательные вещества.
Под растворимостью веществ в фармакопее подразумевают условные термины, которые приведены в таблице № 1(1):
Таблица №1:
| Термины | Объем (мл.) растворителя для растворения 1г вещества |
| растворим очень легко | менее 1 |
| растворим легко | 1 — 10 |
| растворим | 10 — 30 |
| растворим умеренно | 30 — 100 |
| растворим мало | 100 — 1000 |
| растворим очень мало | 1000 — 10 000 |
| практически не растворим | более 10 000 |
Очень важны для приема лекарственных средств и БАД знания о растворимости препарата. Лекарственное средство легче проникает в растворенном виде в желудочно – кишечный тракт, таким образом, принося более быстрый эффект облегчения больному, в отличие от мало растворимых или трудно растворимых лекарственных форм.
Как определяется растворимость веществ?
Берется навеска исследуемого вещества, помещается в отмеренное количество растворителя, раствор встряхивается в течение 10 мин.
Все определения проводят при температуре (18-22)0С.
Для медленно растворимых веществ (время растворения которых более 20 минут) возможно прогревание на водяной бане до 300С.
После энергичного встряхивания в течение двух минут и охлаждения раствора до (18-22)0С визуально фиксируют результат.
Для медленно растворимых веществ условия растворимости указываются в частных статьях.
Вещество считается растворившимся, если при рассмотрении раствора в проходящем свете в нем не обнаруживаются частицы.
Если неизвестна растворимость вещества, то методика испытания следующая:
Берут 1 г вещества, прибавляют 1 мл растворителя и проводят испытание, как описано выше. Если вещество полностью растворилось, оно считается растворимым очень легко.
Если растворение произошло не полностью, то берут 100 мг растертого вещества, добавляют 1 мл растворителя и снова растворяют. Навеска растворилась полностью — делают вывод, что вещество легко растворимо.
В случае, если растворение произошло не полностью, в этот раствор добавляют 2 мл растворителя и продолжают испытание. Навеска растворилась – считается, что вещество растворимо.
Если растворение прошло не полностью, то в раствор добавляют еще 7 мл растворителя и снова проводят растворение, как описано выше. Если при наблюдении в проходящем свете визуально не наблюдаются частицы, значит растворение прошло. Такое вещество считается умеренно растворимым.
В случае обнаружения нерастворенных частиц навески испытания проводят с 10 мг растертого вещества, добавляя к нему 10 мл растворителя. В том случае, если оно растворилось полностью –вещество считается мало растворимым.
Если растворение прошло не полностью, берут 10 мг растертого вещества, прибавляют к нему 100 мл растворителя и снова проводят испытание, как описано в методике. Вещество полностью растворилось – оно очень мало растворимо.
Если не растворилось — считается, что вещество практически нерастворимо в этом растворителе.
Для веществ с известной растворимостью, проводят испытания по вышеизложенной методике, но только для крайних значений указанного термина растворимости. Например, если вещество растворимо, то 100 мг его не должно раствориться в 1 мл, но полностью растворяется в 3 мл растворителя.Литература.
Государственная Фармакопея Российской Федерации. ХII издание. Часть 1, Москва, 2007 г, с.92-93.
www.korolevpharm.ru
Растворимость различных веществ в воде
Способность данного вещества растворяться в данном растворителе называется растворимостью.
С количественной стороны растворимость твердого вещества характеризует коэффициент растворимости или просто растворимость — это максимальное количество вещества, которое способно раствориться в 100 г или 1000 г воды при данных условиях с образованием насыщенного раствора.
Так как большинство твердых веществ при растворении в воде поглощают энергию, то в соответствии с принципом Ле-Шателье, растворимость многих твердых веществ увеличивается с повышением температуры.
Растворимость газов в жидкости характеризует коэффициент абсорбции — максимальный объем газа, который может раствориться при н.у. в одном объеме растворителя. При растворении газов выделяется тепло, поэтому с повышением температуры растворимость их понижается (например, растворимость NH3 при 0°С равна 1100 дм3/1 дм3 воды, а при 25°С — 700 дм3/1 дм3 воды). Зависимость растворимости газов от давления подчиняется закону Генри: масса растворенного газа при неизменной температуре прямо пропорциональна давлению.
Выражение количественного состава растворов
Наряду с температурой и давлением основным параметром состояния раствора является концентрация в нем растворенного вещества.
Концентрацией раствора называется содержание растворенного вещества в определенной массе или в определенном объеме раствора или растворителя. Концентрацию раствора можно выражать по-разному. В химической практике наиболее употребительны следующие способы выражения концентраций:
а) массовая доля растворенного вещества показывает число граммов (единиц массы) растворенного вещества, содержащееся в 100 г (единиц массы) раствора (ω, %)
ω
(%) = 
б) мольно-объемная концентрация, или молярность, показывает число молей (количество) растворенного вещества, содержащихся в 1 дм3 раствора (с или М, моль/дм3)
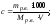
в) эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 дм3 раствора (сэ или н, моль/дм3)

г) мольно-массовая концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя (сm, моль / 1000 г)
 ;
;
д) титром раствора называется число граммов растворенного вещества в 1 см3 раствора (Т, г/см3)
T = mр.в./V.
Кроме того состав раствора выражается через безразмерные относительные величины -доли. Объемная доля — отношение объема растворенного вещества к объему раствора; массовая доля — отношение массы растворенного вещества к объему раствора; мольная доля отношение количества растворенного вещества (число молей) к суммарному количеству всех компонентов раствора. Наиболее употребительной величиной является мольная доля (N) – отношение количества растворенного вещества (ν1) к суммарному количеству всех компонентов раствора, то есть ν1 + ν2 (где ν2 –количество растворителя)
Nр.в. = ν1/( ν1 + ν2) = mр.в./Мр.в./( mр.в./Мр.в + mр-ля./Мр-ля).
Разбавленные растворы неэлектролитов и их свойства
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора, так называемому идеальному раствору. Раствор, образование которого не связано с изменением объема и тепловым эффектом, называют идеальным раствором. Однако, большинство растворов не обладает в полной мере свойствами идеальности и общие закономерности могут быть описаны на примерах так называемых разбавленных растворов, то есть растворов, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя и взаимодействием молекул растворенного вещества с растворителем можно пренебречь. Растворы обладают коллигативными свойствами — это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
осмотическое давление;
давление насыщенного пара. Закон Рауля;
повышение температуры кипения;
понижение температуры замерзания.
Осмос. Осмотическое давление.
Пусть имеется сосуд, разделенный полупроницаемой перегородкой (пунктир на рисунке) на две части, заполненные до одинакового уровня О-О. В левой части помещается растворитель, в правой — раствор
0
I
IIII
0I
растворитель раствор
К понятию явления осмоса
Вследствие различия концентраций растворителя по обе стороны перегородки растворитель самопроизвольно (в соответствии с принципом Ле-Шателье) проникает через полупроницаемую перегородку в раствор, разбавляя его. Движущей силой преимущественной диффузии растворителя в раствор является разность свободных энергий чистого растворителя и растворителя в растворе. При разбавлении раствора за счет самопроизвольной диффузии растворителя объем раствора увеличивается и уровень перемещается из положения О в положение II. Односторонняя диффузия определенного сорта частиц в растворе через полупроницаемую перегородку называется осмосом.
Количественно охарактеризовать осмотические свойства раствора (по отношению к чистому растворителю) можно, введя понятие об осмотическом давлении. Последнее представляет собой меру стремления растворителя к переходу сквозь полупроницаемую перегородку в данный раствор. Оно равно тому дополнительному давлению, которое необходимо приложить к раствору, чтобы осмос прекратился (действие давления сводится к увеличению выхода молекул растворителя из раствора).
Растворы, характеризующиеся одинаковым осмотическим давлением, называются изотоническими. В биологии растворы с осмотическим давлением, большим, чем у внутриклеточного содержимого, называются гипертоническими, с меньшим – гипотоническими. Один и тот же раствор для одного типа клеток гипертонический, для другого – изотонический, для третьего – гипотонический.
Свойствами полупроницаемости обладает большинство тканей организмов. Поэтому осмотические явления имеют громадное значение для жизнедеятельности животных и растительных организмов. Процессы усвоения пищи, обмена веществ и т.д. тесно связаны с различной проницаемостью тканей для воды и тех или иных растворенных веществ. Явления осмоса объясняют некоторые вопросы, связанные с отношением организма к среде. Например, ими обусловлено то, что пресноводные рыбы не могут жить в морской воде, а морские в речной.
Вант-Гофф показал, что осмотическое давление в растворе неэлектролита пропорционально молярной концентрации растворенного вещества
Росм= сRТ,
где Росм — осмотическое давление, кПа; с — молярная концентрация, моль/дм3; R — газовая постоянная, равная 8,314 Дж/моль∙К; Т — температура, К.
Это выражение по форме аналогично уравнению Менделеева-Клапейрона для идеальных газов, однако эти уравнения описывают разные процессы. Осмотическое давление возникает в растворе при проникновении в него дополнительного количества растворителя через полупроницаемую перегородку. Это давление — сила, препятствующая дальнейшему выравниванию концентраций.
Вант-Гофф сформулировал закон осмотического давления: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, который занимает раствор, при той же температуре.
Давление насыщенного пара. Закон Рауля.
Рассмотрим разбавленный раствор нелетучего (твердого) вещества А в летучем жидком растворителе В. При этом общее давление насыщенного пара над раствором определяется парциальным давлением пара растворителя, поскольку давлением пара растворенного вещества можно пренебречь.
Рауль показал, что давление насыщенного пара растворителя над раствором Р меньше, чем над чистым растворителем Р°. Разность Р° — Р = Р называется абсолютным понижением давления пара над раствором. Эта величина, отнесенная к давлению пара чистого растворителя, то есть (Р°-Р)/Р° =Р/Р°, называется относительным понижением давления пара.
Согласно закону Рауля, относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного нелетучего вещества
(Р°-Р)/Р° = N = ν1/( ν1 + ν2) = mр.в./Мр.в./( mр.в./Мр.в + mр-ля./Мр-ля) = XA
где XA — мольная доля растворенного вещества. А так как ν1= mр.в./Мр.в, то используя этот закон можно определить мольную массу растворенного вещества.
Следствие закона Рауля. Понижение давления пара над раствором нелетучего вещества, например в воде, можно пояснить с привлечением принципа смещения равновесия Ле-Шателье. Действительно, при увеличении концентрации нелетучего компонента в растворе равновесие в системе вода — насыщенный пар сдвигается в сторону конденсации части пара (реакция системы на уменьшение концентрации воды при растворении вещества), что и вызывает уменьшение давления пара.
Понижение давления пара над раствором по сравнению с чистым растворителем вызывает повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем (t). Эти величины пропорциональны моляльной концентрации растворенного вещества — неэлектролита, то есть:
t = К∙ст = К∙т∙1000/М∙а,
где сm— моляльная концентрация раствора; а — масса растворителя. Коэффициент пропорциональности К, в случае повышения температуры кипения, называется эбуллиоскопической константой для данного растворителя (Е), а для понижения температуры замерзания — криоскопической константой (К). Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль нелетучего неэлектролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и моляльным понижением температуры замерзания раствора.
Крископическая и эбуллиоскопическая постоянные не зависят от концентрации и природы растворенного вещества, а зависят лишь от природы растворителя и характеризуются размерностью кг∙град/моль.
studfile.net