Плотность и концентрация растворов соляной кислоты (15°С) / Кустарь
Плотность и концентрация растворов соляной кислоты (15°С)
| Плотность г/см3 | Содержание HCl | |
|---|---|---|
| % | г/л | |
| 1,000 | 0,16 | 1,6 |
| 1,005 | 1,15 | 12 |
| 1,010 | 2,14 | 22 |
| 1,015 | 3,12 | 32 |
| 1,020 | 4,13 | 42 |
| 1,025 | 5,15 | 53 |
| 1,030 | 6,15 | 63 |
| 1,035 | 7,15 | 74 |
| 1,040 | 8,16 | 85 |
| 1,045 | 9,16 | 96 |
| 1,050 | 10,17 | 107 |
| 1,055 | 11,18 | 118 |
| 1,060 | 12,19 | 129 |
| 1,065 | 13,19 | 140 |
| 1,070 | 14,17 | 152 |
| 1,075 | 15,16 | 163 |
| 1,080 | 16,15 | 174 |
| 1,085 | 17,13 | 186 |
| 1,090 | 18,11 | 197 |
| 1,095 | 19,06 | 209 |
| 1,100 | 20,01 | 220 |
| 1,105 | 20,97 | 232 |
| 1,110 | 21,92 | 243 |
| 1,115 | 22,86 | 255 |
| 1,120 | 23,82 | 267 |
| 1,125 | 24,78 | 279 |
| 1,130 | 25,75 | 291 |
| 1,135 | 26,70 | 302 |
| 1,140 | 27,66 | 315 |
| 1,142 | 28,14 | 321 |
| 1,145 | 28,61 | 328 |
| 1,150 | 29,57 | 340 |
| 1,152 | 29,95 | 345 |
| 1,155 | 30,55 | 353 |
| 1,160 | 31,52 | 366 |
| 1,163 | 32,10 | 373 |
| 1,165 | 32,49 | 379 |
| 1,170 | 33,46 | 391 |
| 1,171 | 33,65 | 394 |
| 1,175 | 34,42 | 404 |
| 1,180 | 35,39 | 418 |
| 1,185 | 36,31 | 430 |
| 1,190 | 443 | |
| 1,195 | 38,16 | 456 |
| 1,200 | 39,11 | 469 |
www.sdelaysam.info
Хлороводород — это… Что такое Хлороводород?
Хло́роводоро́д[1], хло́ристый водоро́д[2] (HCl) — бесцветный, термически устойчивый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При −85,1 °C конденсируется в бесцветную, подвижную жидкость. При −114,22 °C HCl переходит в твёрдое состояние. В твёрдом состоянии хлороводород существует в виде двух кристаллических модификаций: ромбической, устойчивой ниже −174,75 °C, и кубической.
Свойства
Водный раствор хлористого водорода называется соляной кислотой. При растворении в воде протекают следующие процессы:
- HClг + H2Oж⇌ H3O+ж + Cl−ж
Процесс растворения сильно экзотермичен. С водой HCl образует азеотропную смесь, содержащую 20,24 % HCl.
Соляная кислота является сильной одноосновной кислотой, она энергично взаимодействует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями, образуя соли — хлориды:
- Mg + 2 HCl → MgCl2 + H2↑
- FeO + 2 HCl → FeCl2 + H2O
Хлориды чрезвычайно распространены и имеют широчайшее применение (галит, сильвин). Большинство из них хорошо растворяется в воде и полностью диссоциирует на ионы. Слаборастворимыми являются хлорид свинца (PbCl2), хлорид серебра (AgCl), хлорид ртути(I) (Hg2Cl2, каломель) и хлорид меди(I) (CuCl).
При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:
- MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2O
При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
- 4 HCl + O2 → 2 H2O +2 Cl2↑
Однако, концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
- 2 Cu + 4 HCl → 2 H[CuCl2] + H2↑
Смесь 3 объемных частей концентрированной соляной и 1 объемной доли концентрированной азотной кислот называется «царской водкой». Царская водка способна растворять даже золото и платину. Высокая окислительная активность царской водки обусловлена присутствием в ней хлористого нитрозила и хлора, находящихся в равновесии с исходными веществами:
- 4 H3O+ + 3 Cl− + NO3−⇌ NOCl + Cl2 + 6 H2O
Благодаря высокой концентрации хлорид-ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению:
- 3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2O[3]
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
- R-CH=CH2 + HCl → R-CHCl-CH3
- R-C≡CH + 2 HCl → R-CCl2-CH3
Присоединяется к серному ангидриду, образуя хлорсульфоновую кислоту HSO3Cl:
- SO3 + HCl → HSO3Cl
Получение
В лабораторных условиях хлороводород получают, воздействуя концентрированной серной кислотой на хлорид натрия (поваренную соль) при слабом нагревании:
- NaCl(тверд.) + H2SO4(конц.) = NaHSO4 + HCl↑
HCl↑ также можно получить гидролизом ковалентных галогенидов, таких, как хлористый фосфорил, тионилхлорид (SOCl
- PCl5 + H2O → POCl3 + 2HCl↑
- R-COCl + H-OH → R-COOH + HCl↑
- H2O + O=SCl2 → SO2 + 2HCl↑
В промышленности хлороводород ранее получали в основном сульфатным методом (методом Леблана), основанном на взаимодействии хлорида натрия с концентрированной серной кислотой. В настоящее время для получения хлороводорода обычно используют прямой синтез из простых веществ:
- H2 + Cl2⇌ 2HCl↑
В производственных условиях синтез осуществляется в специальных установках, в которых водород непрерывно сгорает ровным пламенем в токе хлора, смешиваясь с ним непосредственно в факеле горелке. Тем самым достигается спокойное (без взрыва) протекание реакции. Водород подается в избытке (5 — 10 %), что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту.
Соляную кислоту получают растворением газообразного хлороводорода в воде.
Применение
Водный раствор широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамината натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Безопасность
Вдыхание хлороводорода может привести к кашлю, удушью, воспалению носа, горла и верхних дыхательных путей, а в тяжёлых случаях, отёк легких, нарушение работы кровеносной системы, и даже смерть. Контактируя с кожей может вызывать покраснение, боль и серьёзные ожоги. Хлористый водород может вызвать серьёзные ожоги глаз и их необратимое повреждение.
Использовался как отравляющее средство во время войн.[источник не указан 186 дней]
Примечания
Литература
- Левинский М.И, Мазанко А. Ф., Новиков И. Н. «Хлористый водород и соляная кислота» М.:Химия 1985
Ссылки
dic.academic.ru
Плотность при 200 С г/см3 | Концентрация HCl | Плотность при 200 С г/см3 | Концентрация HCl | ||
% по массе | моль/л | % по массе | моль/л | ||
1,000 1,005 1,010 1,015 1,020 1,025 1,030 1,035 1,040 1,045 1,050 1,055 1,060 1,065 1,070 1,075 1,080 1,085 1,090 1,095 1,100 | 0,3600 1,360 2,364 3,374 4,388 5,408 6,433 7,464 8,490 9,510 10,52 11,52 12,51 13,50 14,49 15,48 16,47 17,45 18,43 19,41 20,39 | 0,09872 0,3748 0,6547 0,9391 1,227 1,520 1,817 2,118 2,421 2,725 3,029 3,333 3,638 3,944 4,253 4,565 4,878 5,192 5,509 5,829 6,150 | 1,105 1,110 1,115 1,120 1,125 1,130 1,135 1,140 1,145 1,150 1,155 1,160 1,165 1,170 1,175 1,180 1,185 1,190 1,195 1,198 | 21,36 22,33 23,29 24,25 25,22 26,20 27,18 28,18 29,17 30,14 31,14 32,14 33,16 34,18 35,20 36,23 37,27 38,32 39,37 40,00 | 6,472 6,796 7,122 7,449 7,782 8,118 8,459 8,809 9,159 9,505 9,863 10,22 10,59 10,97 11,34 11,73 12,11 12,50 12,90 13,14 |
Плотность при 200 С г/см3 | Концентрация КОН | Плотность при 200 С г/см3 | Концентрация КОH | ||
% по массе | моль/л | % по массе | моль/л | ||
1,000 1,005 1,010 1,015 1,020 1,025 1,030 1,035 1,040 1,045 1,050 1,055 1,060 1,065 1,070 1,075 1,080 1,085 1,090 1,095 1,100 1,105 1,110 1,115 1,120 1,125 1,130 | 0,197 0,743 1,29 1,84 2,38 2,93 3,48 4,03 4,58 5,12 5,66 6,20 6,74 7,28 7,82 8,36 8,89 9,43 9,96 10,49 11,03 11,56 12,08 12,61 13,14 13,66 14,19 | 0,0351 0,133 0,233 0,333 0,433 0,536 0,639 0,744 0,848 0,954 1,06 1,17 1,27 1,38 1,49 1,60 1,71 1,82 1,94 2,05 2,16 2,28 2,39 2,51 2,62 2,74 2,86 | 1,270 1,275 1,280 1,285 1,290 1,295 1,300 1,305 1,310 1,315 1,320 1,325 1,330 1,335 1,340 1,345 1,350 1,355 1,360 1,365 1,370 1,375 1,380 1,385 1,390 1,395 1,400 | 28,29 28,77 29,25 29,73 30,21 30,68 31,15 31,62 32,09 32,56 33,03 33,50 33,97 34,43 24,90 35,36 35,82 36,28 36,73 37,19 37,65 38,10 38,56 39,01 39,46 39,92 40,37 | 6,40 6,54 6,67 6,81 6,95 7,08 7,22 7,36 7,49 7,63 7,77 7,91 8,05 8,19 8,33 8,48 8,62 8,76 8,90 9,05 9,19 9,34 9,48 9,63 9,78 9,93 10,07 |
Плотность при 200 С г/см3 | Концентрация КОН | Плотность при 200 С г/см3 | Концентрация КОH | ||
% по массе | моль/л | % по массе | моль/л | ||
1,135 1,140 1,145 1,150 1,155 1,160 1,165 1,170 1,175 1,180 1,185 1,190 1,195 1,200 1,205 1,210 1,215 1,220 1,225 1,230 1,235 1,240 1,245 1,250 1,255 1,260 1,265 | 14,70 15,22 15,74 16,26 16,78 17,29 17,81 18,32 18,84 19,35 19,86 20,37 20,88 21,38 21,88 22,38 22,88 23,38 23,87 24,37 24,86 25,36 25,85 26,34 26,83 27,32 27,80 | 2,97 3,09 3,21 3,33 3,45 3,58 3,70 3,82 3,94 4,07 4,19 4,32 4,45 4,57 4,70 4,83 4,95 5,08 5,21 5,34 5,47 5,60 5,74 5,87 6,00 6,13 6,27 | 1,405 1,410 1,415 1,420 1,425 1,430 1,435 1,440 1,445 1,450 1,455 1,460 1,465 1,470 1,475 1,480 1,485 1,490 1,495 1,500 1,505 1,510 1,515 1,520 1,525 1,530 1,535 | 40,82 41,26 41,71 42,15 42,60 43,04 43,48 43,92 44,36 44,79 45,23 45,66 46,09 46,53 46,96 47,39 47,82 48,25 48,67 49,10 49,53 49,95 50,38 50,80 51,22 51,64 52,05 | 10,22 10,37 10,52 10,67 10,82 10,97 11,12 11,28 11,42 11,58 11,73 11,88 12,04 12,19 12,35 12,50 12,66 12,82 12,97 13,13 13,29 13,45 13,60 13,76 13,92 14,08 14,24 |
studfile.net
Соляная кислота, плотность концентрация — Справочник химика 21
Плотность соляной кислоты различной концентрации при 20° С пр]шедена в табл. 21. [c.51]
Плотность соляной кислоты различной концентрации при 15 °С приведена в табл. 9-11. [c.474]
Для приготовления 0,1 н. раствора соляной кислоты берут обычно концентрированную кислоту. Поскольку соляная кислота плотности 1,19 г см дымит , то лучше для приготовления раствора брать соляную кислоту меньшей концентрации, примерно 20% (1 2). Определяют плотность ее ареометром, затем узнают процентную концентрацию соляной кислоты и рассчитывают, сколько этой кислоты следует взять, чтобы получить 500 мл 0,1 н. рас- [c.333]
Плотность соляной кислоты различной концентрации при 15°С [c.135]
Пример 5. Какова молярная концентрация (молярность) 16%-ного раствора соляной кислоты (плотность — 1,080 г/жл) [c.57]
Одинакова ли плотность растворов соляной кислоты различных концентраций [c.12]
Задача 33. (ММА, фарм. ф-т, 1994). Имеется 20%-ная соляная кислота (плотность 1,1 г/мл). Какова молярная концентрация хлороводорода в этом растворе [c.477]
К 100 мл 15%-ного раствора соляной кислоты (плотность 1,1) добавили равный объем раствора аммиака той же концентрации (плотность 0,9). Определите реакцию среды полученного раствора. [c.32]
К раствору, содержащему 3,88 г смеси бромида калия и иодида натрия, добавили 78мл 10%-ного раствора нитрата серебра (плотность 1,09 г/мл). Выпавший осадок отфильтровали. Фильтрат может прореагировать с 13,3 мл соляной кислоты с концентрацией [c.175]
На 10 г сульфида двухвалентного железа подействовали 16,6 мл 20% ного раствора соляной кислоты (плотность 1,1). Выделившийся газ пропустили через 0,5 л 0,1 н. раствора едкого натра. Каковы состав и молярная концентрация полученного вещества в растворе [c.29]
Концентрированная соляная кислота (максимальная концентрация 39 /о, плотность 1,19 г/см ) на воздухе дымит вследствие выделения хлористого водорода — газа с едким запахом, который соединяется с влагой воздуха. Большинство опытов мы сможем провести с разбавленной (10%-ной) соляной кислотой, работать с которой намного приятнее. Мы либо приобретем разбавленную кислоту наряду с концентрированной, либо приготовим ее в результате разбавления последней. При этом, как всегда, будем лить кислоту в воду, а не наоборот. [c.317]
Первые конкретные указания на возможность и целесообразность рефрактометрического анализа некоторых растворов и технических продуктов были сделаны еще в начале XIX в. Было, в частности, отмечено, что преломляющая сила пустотелых линз, заполненных соляной кислотой различной концентрации, зависит от плотности кислоты, и предлагалось использовать измерение фокусного расстояния таких линз для определения крепости и плотности кислоты при ее производстве. Однако широкое практическое применение рефрактометрические методы получили лишь после создания простых, точных и удобных в обращении приборов для измерения коэффициентов преломления. Поэтому важным событием в истории рефрактометрического анализа было появление известного рефрактометра Аббе (1869 г.) и последующий выпуск этой и других удачных моделей фирмой Цейсс. Применение рефрактометров в промышленных лабораториях началось в 80-х годах прошлого века (анализ растворов глицерина, а затем сахарозы). С этого времени значение рефрактометрических методов анализа стало быстро возрастать, и они заняли видное место не только в практике исследовательских лабораторий, но и в произ- [c.31]
А г а%-ного раствора соляной кислоты (плотность di) смешали с Б гее 6%-ного раствора (плотность da). Определите молярную и нормальную концентрации полученного раствора (плотность d-л). Какие данные могут быть исключены из условия задачи [c.22]
Концентрированная соляная кислота (максимальная концентрация 39%, плотность 1,19 м ) на воздухе дымит вследствие выделения хлористого водорода — газа с едким запахом, который соединяется с влагой воздуха. Большинство опытов мы сможем [c.371]
В продажу поступает соляная кислота различных концентраций. Реактивная соляная кислота имеет плотность 1190 кг/м и содержит около 37% хлороводорода техническую соляную кислоту выпускают с содержанием не менее 31% НС1 (синтетическая, полученная прямым синтезом из хлора и водорода). Соляную кислоту транспортируют в стеклянных бутылях или гуммированных (покрытых внутри слоем резины) металлических емкостях. [c.262]
В химической лаборатории в одном сосуде находилось 150 мл 10%-ного раствора соляной кислоты плотностью 1,047 г/мл, а в другом — 250 мл 2 н. раствора сола ной кислоты. На занятиях кружка один из учащихся сл » чайно смешал эти растворы. Далее в процессе работы по определению процентного состава смеси железа и цинка возникла необходимость использовать
www.chem21.info
|
|
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Внешний вид:
бесцветн. газ
Кристаллические модификации, цвет растворов и паров:
В жидком виде — бесцветная легко подвижная жидкость. Кристаллизуется в кубической решетке, ниже -174,15 С существует ромбическая модификация.Брутто-формула (система Хилла): HClМолекулярная масса (в а.е.м.): 36,46Температура плавления (в °C): -114,2Температура кипения (в °C): -85,08Температура разложения (в °C): 1500Температурные константы смесей:108,584 °C (температура кипения азеотропа, давление 1 атм) вода 79,778% хлороводород 20,222% -74,7 °C (температура плавления эвтектической смеси) вода 77% хлороводород 23% Растворимость (в г/100 г или характеристика):бензол: растворим 1,9 (20°C)вода: 96 (-18,3°C) вода: 93,31 (-15°C) вода: 89,79 (-10°C) вода: 82,3 (0°C) вода: 78,7 (10°C) вода: 72,47 (20°C) вода: 67,3 (30°C) вода: 63,3 (40°C) вода: 59,6 (50°C) вода: 56,1 (60°C) диэтиловый эфир: растворим 33,2 (20°C) метанол: 88,7 (20°C) серная кислота концентрированная: 0,4015 (25°C) этанол: растворим этанол абсолютный: 69,5 (20°C)
Вкус, запах, гигроскопичность:
запах: резкийПлотность:0,0016391 (0°C, г/см3)1,187 (-85,1°C, г/см3) 1,045 (-155°C, г/см3) 1,469 (-166°C, г/см3) 1,48 (-154,79°C, г/см3) Показатель преломления (для D-линии натрия):1,0004456 (0°C)1,256 (-85,1°C) Плотность растворов (г/см3):1,01 (2.36%, 20°C, растворитель — вода)1,03 (6.43%, 20°C, растворитель — вода) 1,05 (10.52%, 20°C, растворитель — вода) 1,06 (12.51%, 20°C, растворитель — вода) 1,07 (14.49%, 20°C, растворитель — вода) 1,08 (16.47%, 20°C, растворитель — вода) 1,1 (20.39%, 20°C, растворитель — вода) 1,155 (31.14%, 20°C, растворитель — вода) 1,198 (40%, 20°C, растворитель — вода) Показатель диссоциации:pKa (1) = -7 (25 C, вода)Диэлектрическая проницаемость:1,0046 (25°C)14,2 (-114,02°C) Стандартная энтальпия образования ΔH (298 К, кДж/моль):-91,8 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):-94,79 (г)Стандартная энтропия образования S (298 К, Дж/моль·K):186,8 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):29,13 (г)Энтальпия плавления ΔHпл (кДж/моль):1,99Энтальпия кипения ΔHкип (кДж/моль):16,15Симптомы острого отравления:Животные. При высоких концентрациях — некроз слизистых, главным образом носа и подлежащих тканей, помутнение роговицы. Дыхание иногда замедлено. Общее состояние тяжелое. Поздними следствиями могут быть воспалительные заболевания легких. При смертельном исходе иа вскрытии — отек и гиперемия легких, иногда кровоизлияния в желудке. Вдыхание 6,40 мг/л в течение 30 мин вызывает у кроликов и морских свинок быструю смерть (спазм и отек гортани, отек легкого). Вдыхание 5,0 мг/л в течение 1,5 ч приводит кроликов и морских свинок к смерти через 2-6 дней. При невысоких концентрациях — раздражение слизистой носа, слюнотечение; 0,45 мг/л при воздействии в течение 6 ч вызывают катар дыхательных путей, легкое поражение роговицы. У кошек и кроликов вдыхание 0,15-0,21 мг/л по 6 ч в день в течение 50 дней вызывает лишь беспокойство, раздражение, небольшое уменьшение содержания гемоглобина в крови. 12 экспозиций по 6 ч при 0,05 мг/л не вызывают видимого заболевания у обезьян и других животных (Machle et al.). Интратрахеальное введение 2 или 3 мл/кг 0,1 н. HCl вызывает нарушение дыхания и сердцебиения, гибель собак (Greenfield et al.). Человек. При высоких концентрациях — раздражение слизистых, в особенности носа; конъюнктивит; помутнение роговицы. Охриплость, чувство удушья, покалывание в груди, насморк, кашель, иногда кровь в мокроте. Концентрации 0,05-0,075 мг/л переносятся с трудом, хотя «привычные» люди выносят в течение нескольких минут даже концентрации 1-2 мг/л. Хроническое отравление вызывает катары дыхательных путей; разрушение зубов; изъязвления слизистой носа и даже прободение носовой перегородки; желудочно-кишечные расстройства; возможны воспалительные заболевания кожи. Описай случай тяжелого отравления: сильное исхудание, слабость; горячая, сухая, землистая кожа; кашель, учащенное дыхание, мелкопузырчатые хрипы; мокрота отхаркивается о большим трудом; сердечная деятельность нормальная, но по нескольку раз в день сильные сердцебиения. Пульс — 70-80. Острые боли в области желудка, рвота желтоватой слизью. По весьма совпадающим данным разных авторов, предельная безвредная при постоянной работе концентрация — 0,015 мг/л. Наблюдается якобы привыкание к хлороводороду, причина которого пока неясна. Действие на кожу. Туман соляной кислоты, образующийся при нагревании растворов для травления, вызывает резкую болезненность кожи лица. Ожоги в большинстве случаев не столь тяжелы, как при действии серной и азотной кислот. Обычно возникает чисто серозное воспаление с пузырями. Изъязвления развиваются лишь при более длительном воздействии (если, например, после попадания на кожу кислота сразу не отмыта). Тем не менее у травильщиков на руках иногда наблюдаются значительные изъязвления. Лечение отравлений:Немедленно вынести пострадавшего на свежий воздух, освободить от стесняющей дыхание одежды. Ингаляция кислорода. Промывание глаз, носа, полоскание 2% раствором соды. При затруднении дыхания через нос — 2-3% раствор эфедрина 3-4 раза в день по 4-5 капель, подкожно атропин (1 мл 0,1% раствора). Тепло на область шеи. При кашле — кодеин, дионин, тепловлажные ингаляции 2-3% раствора соды (2-3 раза в день по 10 мин). В дальнейшем — отхаркивающие средства, горчичники на область трахеи, теплое молоко с боржомом или содой, маслом или медом. В более тяжелых случаях для профилактики и лечения пневмонии — ингаляции аэрозолей антибиотиков, курс лечения антибиотиками и сульфаниламидами. При поражении глаз после промывания впустить в глаза по 1 капле 2% раствора новокаина или 0,5% раствора дикаина с адреналином (1:1000) с последующей инсталляцией стерильного вазелинового или персикового масла в конъюнктивальный мешок. Очки-консервы. В дальнейшем — 30% раствор альбуцида, гидрокортизоновая мазь. При попадании кислоты в глаза промывать их водой, а не нейтрализующими (щелочными) растворами. При попадании крепкой кислоты на кожу — немедленное обмывание ее водой, лучше под давлением (например, из гидранта в течение 5-10 мин. В здравпункте наложить на обожженную поверхность кашицу из соды. Критическая температура (в °C):51,4Критическое давление (в МПа):8,26Критическая плотность (в г/см3):0,42Применение:Водный раствор используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамината натрия, соды, хлора и других продуктов. Дополнительная информация:Химия безводного хлороводорода и его водного раствора различны. Безводный хлороводород сильно дымит во влажном воздухе. Безводный хлороводород химически пассивен: не реагирует с серой, фосфором, углем, многими металлами. С нитридами, карбидами, боридами и сульфидами реагирует выше 650 С, с гидридами кремния, германия и бора — в присутствии хлорида алюминия, с оксидами переходных металлов — при 300 С и выше. Окисляется кислородом и азотной кислотой до хлора, с триоксидом серы дает хлорсульфоновую кислоту. Водный раствор называется соляная кислота. Это бесцветная жидкость с резким запахом, сильная кислота, химически активна. Растворяет с выделением водорода все металлы имеющие отрицательный нормальный потенциал, со многими оксидами и гидроксидами дает хлориды, вытесняет более слабые кислоты (фосфорную, борную и т.д.) из их солей. Производство 31%-ной соляной кислоты в СССР составляло 1 520 000 т. (1986).
Источники информации:Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я |
www.xumuk.ru
Удельный вес кислот. Вес кислоты в 1 мл и в 1 м3.

Кислоты – одни из наиболее востребованных в жизни человека химических соединений. Пребывая в различных агрегатных состояниях, они встречаются в нашей жизни повсеместно:
- в производстве удобрений, лекарственных препаратов,
- при очистке нефтепродуктов,
- в пищевой промышленности,
- при создании взрывчатых, красящих и моющих веществ,
- в процессах осушения и чистки,
- при производстве аккумуляторных батарей и др.
В естественных процессах живых организмов кислоты также играют немаловажную роль. Рассмотрим подробнее кислоты, часто встречающиеся в нашей повседневности.
Соляная кислота
HCl или хлороводородная кислота, или проще соляная кислота – не имеющая цвета, прозрачная едкая жидкость, растворенный в воде хлороводород. При попадании концентрированного вещества на воздух, начинает «дымиться».
HCl широко используется в металлургии и гальванопластике. Встречается она и в продуктах питания как добавка Е507 – регулятор кислотности. В желудочном соке содержится в концентрации от 0,3 до 0,5%, и как медицинский препарат назначается совместно с пепсином для нормализации пониженной кислотности.
Насыщенная кислота способна вызывать сильный химожог. Для его нейтрализации применяется раствор пищевой соды. Вступает в реакции с сильными окислителями с образованием токсичного хлора. Удельный вес соляной кислоты (плотность) – 1,19 г/см3.
Серная кислота
Н2SО4 – более сильная кислота, нежели соляная. Концентрированное вещество разъедает и обугливает большинство органических соединений и активно поглощает воду. При естественных условиях это бесцветная маслянистая жидкость с кислым вкусом, которая не имеет цвета и запаха. Удельный вес серной кислоты – 1,84 г/см3.
Сфера применения довольно велика. Это и металлургия, и добыча минералов, производство удобрений, аккумуляторных батарей, создание взрывчатых веществ, использование в текстильной, кожевенной, нефтяной промышленности и пр.
По статистике, из 200 млн тонн годового производства серной кислоты в мире наибольшая доля уходит на создание минеральных удобрений. Сама по себе серная кислота – едкое и опасное для здоровья человека и окружающей среды вещество. Воздействие в течение 1 часа концентрации в 0,18 мг/л является смертельной дозой для живых организмов.
Азотная кислота
HNO3 смешивается с водой в любых пропорциях, и только в разбавленном виде используется в быту и промышленности (производство удобрений, взрывчатых и отравляющих веществ, красителей, лекарственных препаратов, органический синтез, ювелирное дело и пр.). Удельный вес азотной кислоты – 1,51 г/см3.
Относится к 3-му классу опасности. Это крайне токсичное вещество, вызывающее сильные поражения органических тканей.
Ортофосфорная кислота
Н3РО4 относится к неорганическим кислотам средней силы. В естественных условиях это твердое кристаллическое бесцветное вещество. Хорошо растворяется в воде. 85%-й раствор в виде сиропа в быту обычно называют ортофосфорной или фосфорной кислотой. Может растворяться в этаноле и прочих растворителях. В жидком состоянии удельный вес ортофосфорной кислоты – 1,685 г/см3.
Применяется в металлургии (пайка, антикоррозионная обработка), в пищевой промышленности (регулятор кислотности Е338), для понижения кислотности и профилактики мочекаменной болезни в животноводстве, в стоматологии в качестве протравителя эмали перед установкой пломб и в некоторых отбеливающих зубы составах.
| Название вещества | Химическая формула | Плотность (г/см3) | Удельный вес (кг/м3) | Сколько грамм в 1 мл |
| соляная кислота | HCl | 1,19 | 1190 | 1,19 |
| серная кислота | Н2SО4 | 1,84 | 1840 | 1,84 |
| азотная кислота | HNO3 | 1,51 | 1510 | 1,51 |
| ортофосфорная кислота | Н3РО4 | 1,68 | 1680 | 1,68 |
naruservice.com
Плотность растворов соляной кислоты
Стр 1 из 3Следующая ⇒| Плотность, г/мл | Массовое содержание, % | Плотность, г/мл | Массовое содержание, % |
| 1,003 | 1,088 | ||
| 1,008 | 1,098 | ||
| 1,018 | 1,108 | ||
| 1,028 | 1,118 | ||
| 1,038 | 1,129 | ||
| 1,048 | 1,139 | ||
| 1,057 | 1,149 | ||
| 1,067 | 1,174 |
4. Если в таблице нет цифры, соответствующей найденной плотности, то последнюю вычисляют методом интерполяции по двум ближайшим величинам.
Например, плотность раствора HСl равна 1,032 г/мл.
Берут значения плотности больше и меньше измеренной, и соответствующие им концентрации. Находят разности:
1,028 – 6%
1,038 – 8%
0,01 – 2%
При увеличении плотности на 0,01 процентное содержание соляной кислоты увеличивается на 2%. Найденная плотность меньше наибольшего значения на 1,038 — 1,032 = 0,006. Находят процентное содержание, соответствующее плотности 0,006:
0,01 – 2%
0,006 — Х%
Х = (2 · 0,006) : 0,01 = 1,2 (%).
Вычитая эту величину из наибольшего значения, получают искомую величину:
8% — 1,2% = 6,8%.
5. Зная процентное содержание HCl, вычисляют объем концентрированного (исходного) раствора, который необходимо взять для приготовления 0,1N раствора HCl. Объем исходного раствора рассчитывают по формуле:

где
V – объем концентрированного (исходного) раствора HCl, мл;
См – молярная концентрация раствора (См = СN ·f), моль/л;
Vк – объем мерной колбы, мл;
М – молекулярная масса вещества, г/моль;
ρ — плотность исходного раствора, г/мл;
ω – процентная концентрация исходного раствора, %.
Например, необходимо приготовить 200 мл 0,1N раствора HCl, тогда

Следовательно, для приготовления 200мл 0,1N (См = 0,1N·1, т.к. f=1) раствора HCl нужно взять 10,4 мл соляной кислоты плотностью 1,032 г/мл.
5. Мерной пипеткой с точностью до десятых долей мл отмеривают рассчитанный исходный концентрированный раствор HCl, переносят в мерную колбу нужного объема и доводят до метки дистиллированной водой так, чтобы нижний край мениска касался метки.


6. Закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз. Полученный таким образом раствор является приблизительно 0,1N. Точная нормальность такого раствора устанавливается с помощью титриметрических анализов.
7. Оформляют работу. Формулируют выводы.
Работа 2. Определение нормальности рабочего раствора HCl
По 0,1N раствору NaOH
Задача работы:ознакомление с методикой титриметрического анализа, т.е. определением концентрации рабочего раствора по титрованному раствору.
Оборудование, реактивы: рабочий раствор HCl, титрованный раствор NaOH, фенолфталеин, коническая колба на 250 мл (или иного объема на усмотрение преподавателя), мерные пипетки, бюретка, груша.
Выполнение работы:
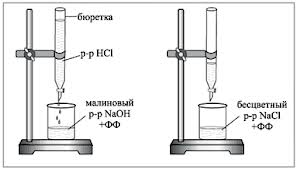 1. Бюретку заполняют исследуемым рабочим раствором HCl. В титровальную колбу отбирают пипеткой 5 мл 0,1N раствора NaOH, добавляют 1-2 капли фенолфталеина и титруют по каплям раствором кислоты до исчезновения малиновой окраски. При титровании содержимое колбы перемешивают вращательными движениями или магнитной мешалкой.
1. Бюретку заполняют исследуемым рабочим раствором HCl. В титровальную колбу отбирают пипеткой 5 мл 0,1N раствора NaOH, добавляют 1-2 капли фенолфталеина и титруют по каплям раствором кислоты до исчезновения малиновой окраски. При титровании содержимое колбы перемешивают вращательными движениями или магнитной мешалкой.
 2. По шкале бюретки фиксируют расход раствора HCl (VHCl, мл) пошедший на титрование 5 мл NaOH. Титрование повторяют 2-3 раза, каждое повторное титрование начинают с нулевого отсчета бюретки.
2. По шкале бюретки фиксируют расход раствора HCl (VHCl, мл) пошедший на титрование 5 мл NaOH. Титрование повторяют 2-3 раза, каждое повторное титрование начинают с нулевого отсчета бюретки.
По среднему объему кислоты, пошедшему на титрование щелочи рассчитывают ее нормальность по формуле:

3. Оформляют работу. Формулируют выводы.
Работа 3. Древовидные образования
Задача работы:ознакомление с понятием осмоса и осмотического давления. Изучить сущность явления гемолиза.
 Оборудование, реактивы: штатив с пробирками, раствор силикатного клея, Кристаллы солей: железа, меди, марганца, никеля, кобальта и др. (хлориды, бромиды, нитраты).
Оборудование, реактивы: штатив с пробирками, раствор силикатного клея, Кристаллы солей: железа, меди, марганца, никеля, кобальта и др. (хлориды, бромиды, нитраты).
Выполнение работы:
1. Ряд пробирок наполняют раствором силикатного клея и опускают в пробирки кристаллики солей. Через некоторое время из кристаллов вырастают древовидные образования.
2. Дают объяснение наблюдаемому явлению.
infopedia.su