1. Химические соединения и элементы / КонсультантПлюс
1. Химические соединения и элементы
1.1. Азота неорганические соединения (аммиак, азотная
кислота, оксиды азота и другие)
1.2. Альдегиды алифатические (предельные и непредельные) и
ароматические формальдегиды, ацетальдегид, акролеин,
бензальдегид, фталевый альдегид и др.)
1.3. Альдегидов и кетонов галогенопроизводные
(хлорбензальдегид, фторацетон, хлорацетофенон и др.)
1.4. Амины, амиды органических кислот, анилиды и др.
производные (диметилформамид, диметилацетамид,
капролактам и др.)
1.5. Бериллий и его соединения
1.6. Бор и его соединения (бора карбид, нитрид и др.)
1.6.1. Бороводороды
1.7. Галогены
1.7.1. Хлор, бром, йод, соединения с водородом, оксиды
1.
1.7.3. Фосгены
1.8. Гидразин и его производные (фенилгидразин и др.)
1.9. Кадмий и его соединения
1.10. Карбонилы металлов: никеля, кобальта, железа и др.
1.11. Кетоны алифатические и ароматические (ацетон,
метилэтилкетон, ацетофенон и др.)
1.12. Кислоты органические (муравьиная, уксусная, пропионовая,
масляная, валериановая, капроновая, щавелевая,
адипиновая, акриловая, нафтеновая, фталевая и др.)
Органических кислот галогенопроизводные (хлоруксусная,
трихлоруксусная, перфтормасляная, трихлорпропионовая и
др.), органических кислот ангидриды
1.12.1. Фталевая кислота
1.13. Кобальт
1.13.1. Ванадий, молибден, вольфрам, ниобий, тантал и их
соединения
1.14. Органические соединения кремния (силаны)
1. 15. Марганец и его соединения
15. Марганец и его соединения
1.16. Медь и ее соединения.
Серебро, золото и их соединения
1.17. Металлы щелочные и их соединения (натрий, калий,
рубидий, цезий, гидроокись натрия, калия). Металлы
щелочно-земельные (кальций, стронций, барий).
Металлы редкоземельные (лантан, иттрий, скандий, церий)
и их соединения
1.17.1. Литий
1.18. Мышьяк и его неорганические и органические соединения
1.19. Никель и его соединения
1.20. Озон
1.21. Органические окиси и перекиси (окись этилена, окись
пропилена, эпихлоргидрин, гидроперекиси и др.).
Неорганические перекиси (пергидроль)
1.22. Олово и его соединения
1.23. Платиновые металлы и их соединения (рутений, родий,
палладий, осмий, иридий, платина)
1.24. Ртуть и ее соединения
1. 25. Свинец и его соединения
25. Свинец и его соединения
1.25.1. Свинец и его неорганические соединения
1.25.2. Органические соединения свинца (тетраэтилсвинец)
1.26. Селен, теллур и их соединения
1.27.1. Оксиды, кислоты
1.27.2. Сероводород
1.27.3. Сероуглерод
1.27.4. Тетраметилтиурамдисульфид (тиурам)
1.28. Спирты алифатические (одноатомные и многоатомные) и
ароматические, их производные (этиловый, пропиловый,
бутиловый, алилловый, бензиловый, этиленгликоль,
пропиленгликоль, этилцеллюлозоль и др.)
1.28.1. Спирт метиловый
1.29. Сурьма и ее соединения
1.30. Таллий, индий, галлий и их соединения
1.31. Титан, цирконий, гафний, германий и их соединения
1.32. Углерода моноксид
1.33. Углеводороды ароматические: бензол
1.33.1. Углеводородов ароматических амино- и нитросоединения и
их производные анилин, м-п-толуидин, нитроаминобензолы,
нитрохлорбензолы, нитроаминофенолы, тринитротолуол,
фенилендиамины, ксилитины, анизидины, ниазон и др.
1.33.1.1. Изоцианаты (толоуленди- изоцианат и др.)
1.33.1.2. о-толуидин, бензидин, бета-нафтиламин
1.33.2. Углеводородов ароматических галогенпроизводные (галоген
в бензольном кольце): хлорбензол, хлортолуол, бромбензол
и др.
1.33.3. Углеводородов ароматических галогенпроизводные (галоген
в боковой цепи): бензил хлористый, бензилиден хлористый,
бензитрихлорид, бензотрифторил и др.
1.34. Углеводороды ароматические полициклические и их
производные (нафталин, нафталы, бенз(а)пирен, антрацен,
бензантрон, бензантрацен, фенантрен и др.
1.35. Углеводороды гетероциклические (фуран, фурфурол, пиридин
и его соединения, пиразол, пиперидин, морфолин, альтакс,
каптакс и др.)
1.36. Углеводороды предельные и непредельные: алифатические,
алициклические (метан, пропан, парафин, этилен,
пропилен, ацетилен, циклогексан и др.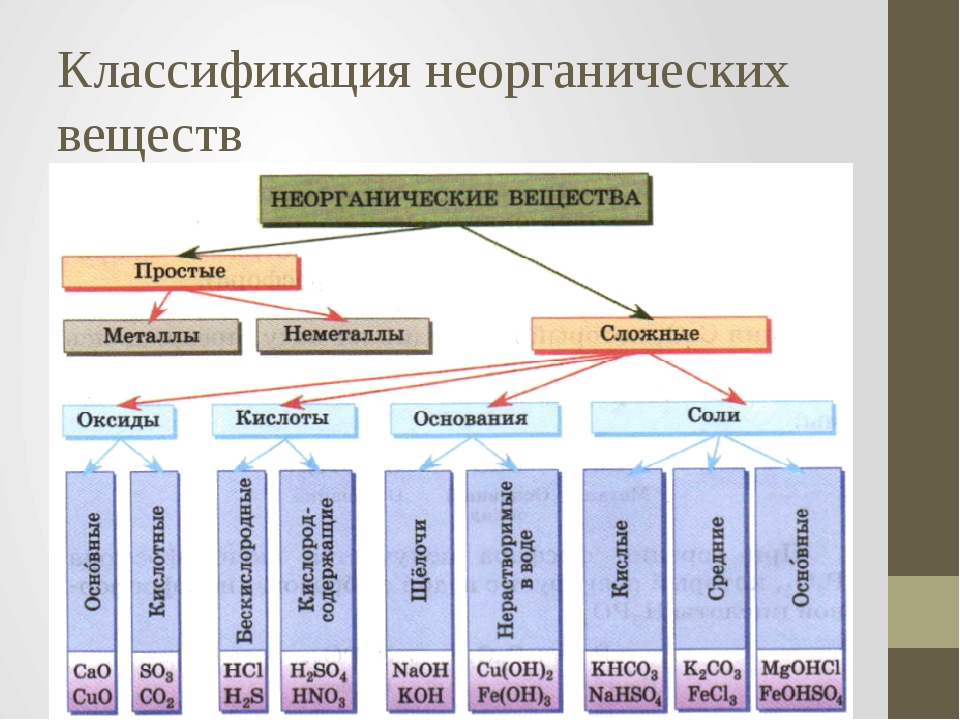 )
)
Камфара, скипидар
1.36.1. Углеводородов алифатических галогенпроизводные
(дихлорэтан, четырехлористый углерод, хлористый метилен,
хлористый метил, хлороформ, бромэтил, трихлорэтилен,
хлоропрен, перфторизобутилен и др.)
Винилхлорид
1.36.2. Углеводородов алифатических амино- и нитросоединения и
их производные (метиламин, этиленимин,
гексаметилендиамин, циклогексиламин и др.)
1.37. Фенол и его производные (хлорфенол, крезолы и др.)
1.38. Фосфор и его соединения
1.38.1. Фосфор и его неорганические соединения (белый фосфор,
фосфин, фосфиды металлов, галогениды фосфора и др.)
Красный фосфор
1.38.2. Органические соединения фосфора: трикрезилфосфат и др.
1.39. Хиноны и их производные (нафтохиноны, бензахиноны,
гидрохинон, антрохинон и др. )
)
1.40. Хром, хромовая кислота, их соединения и сплавы (хроматы,
бихроматы)
1.41. Цианистые соединения: цианисто-водородная кислота, ее
соли, галоген- и другие производные (цианистый калий,
хлорциан, цианамид и др.). Нитриды органических кислот,
ацетонитрил, бензонитрил и др.)
Акрилнитрил
1.42. Цинк и его соединения
1.43. Эфиры сложные (этилацетат, бутилацетат и др.)
1.43.1. Эфиры сложные акриловой кислоты: метилакрилат,
бутилакрилат, метилметакрилат и др.
1.43.2. Эфиры сложные фталевой кислоты: дибутилфталат,
диметилтерифталат и др.
Формулы химические неорганических соединений — Справочник химика 21
Наименование неорганических соединений химические формулы и номенклатура [c.307] Я. Берцелиус первым стал рассматривать (по аналогии с неорганическими соединениями) органические кислоты, спирты и эфи-)ы как окислы сложных радикалов.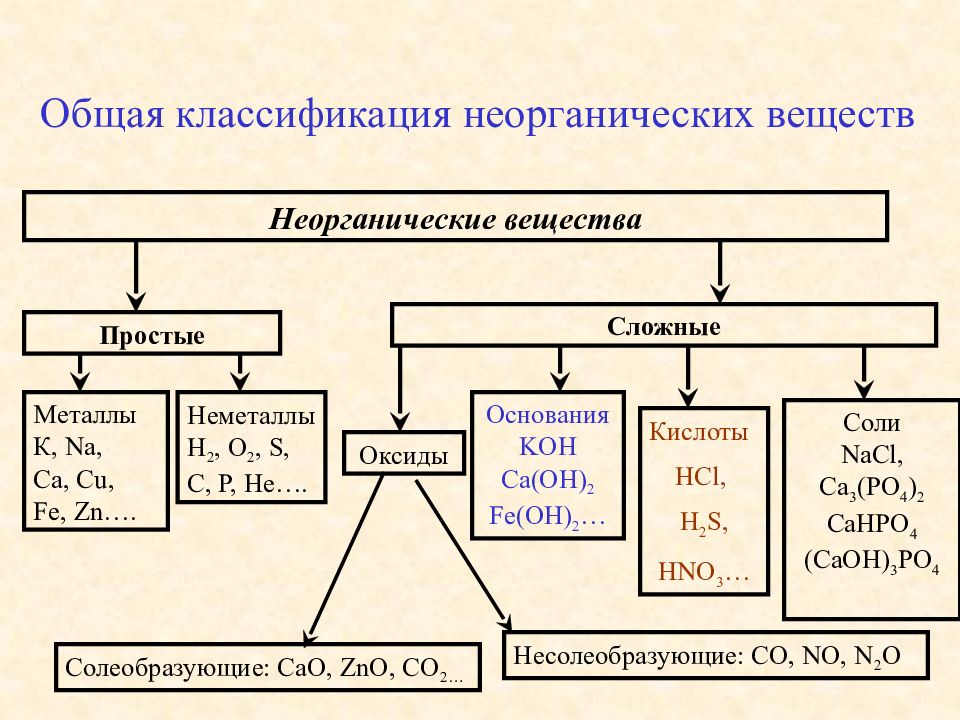
В этом разделе практикума учащиеся должны закрепить теоретические знания о свойствах оксидов, оснований, кислот и солей. В комплексной работе по взаимному превращению неорганических соединений различных классов особое внимание следует обратить на выполнение расчетов по формулам химических веществ и уравнениям химических реакций.

Названия органических и неорганических соединений даны в соответствии с правилами номенклатуры ИЮПАК или в той номенклатуре, по которой данное соединение называется наиболее часто в отечественной химической литературе. Названия минералов на русском языке даны в соответствии с традициями отечественной химической литературы. Для индивидуальных соединений приведена молекулярная или структурная формула в зависимости от сложности строения соединения. [c.5]
В настояш ее время для изображения структурных формул применяют валентные штрихи как символ химической связи, обусловленной электронными парами (см. гл. 5). Для обозначения числа электронных пар, которыми данный атом обладает вместе с другими атомами, применяют выражение число связей . В органических соединениях число связей в атоме большей частью равно его стехиометрической валентности. В неорганических соединениях это не всегда имеет место таких примеров известно много.
[c.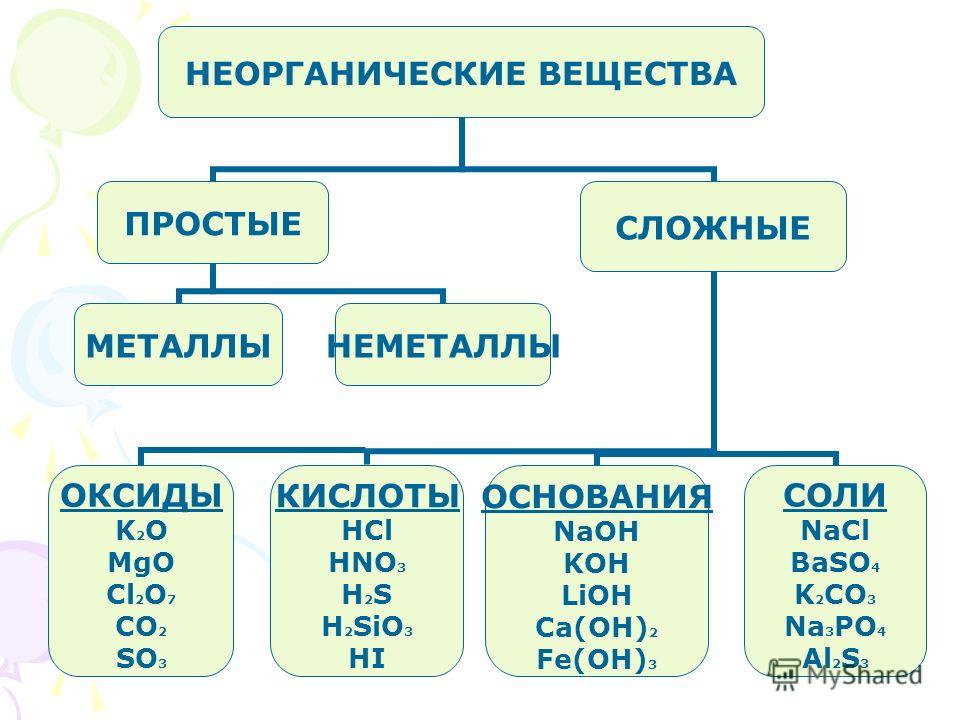 29]
29]В настоящей работе рассмотрены методы оценки физико-химических свойств жидкостей, которые как по своей достоверности, так и по исходным данным наилучшим образом пригодны для молекулярных неорганических соединений. Наряду с наиболее точными методами приводятся корреляции, сочетающие удовлетворительную точность с минимальным числом легкодоступных исходных данных. Последнее имеет особую практическую важность для малоизученных веществ, к которым в первую очередь приходится применять приближенные методы. За характеристику точности приближенного метода принята среднеквадратичная погрешность, вычисленная по формуле [c.25]
За время обучения химии — науки о химических превращениях веществ — учащиеся не получают ответ на главный вопрос почему протекают химические реакции Практически не обсуждается строение и вытекающие отсюда свойства кристаллических веществ, наиболее распространенных среди неорганических соединений. Отсутствие стройной системы изучения фундаментальных основ теории строения и учения о химическом процессе не позволяет раскрыть причинно-следственные связи, и поэтому учащиеся за химическими формулами и уравнениями часто не видят конкретного вещества с присущей ему совокупностью свойств и не видят сущности химического превращения.
ФОРМУЛЫ ХИМИЧЕСКОГО СТРОЕНИЯ ПРОСТЫХ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ [c.224]
До 1860-х годов химики долго и упорно изучали состав веществ, занимались их классификацией, установлением эмпирических и рациональных формул многочисленных органических и неорганических соединений. С накоплением сведений о веществе все яснее становилось понимание того, что определение свойств химических соединений и их состава — это не предел химического знания, есть более важная задача науки — она состоит в отыскании зависимости свойств веществ от их состава и строения. [c.188]
Экстракция раствором сульфита натрия дает элементную серу, но может содержать небольшое количество координационно связанной серы, как в тиура-ме. Экстракция ацетоном дает элементную серу и серу, содержащуюся в растворимых органических соединениях. Говоря о свободной сере, необходимо указать, каким растворителем проводилась экстракция. Сера общая — вся содержащаяся в резине сера, независимо от ее химической формулы, и включает элементную, связанную серу органических и неорганических соединений. [c.46]
[c.46]
Кристаллохимическое строение — порядок расположения и природа связи атомов в пределах элементарной ячейки, их взаимное влияние друг на друга, а также распределение электронной плотности, величины эффективных зарядов. Как видно из этого определения, понятие кристаллохимического строения представляет собой превращенную форму химического строения молекул применительно к немолекулярным структурам. Вот почему теория химического строения Бутлерова — общехимическая теория, в одинаковой степени приложимая как к органическим, так и к неорганическим объектам. На рис. 6, а приведена кубическая структура стехиометрического соединения АВ. Она показывает только порядок размещения атомов в элементарной ячейке и не отображает природу межатомных связей, а также их взаимное влияние. Вообще кристаллическая структура в той мере отражает кристаллохимическое строение вещества, в какой структурная формула — химическое строение молекулы.
 В действительности химическое и кристаллохимическое строение — понятие динамическое, а не статическое. [c.20]
В действительности химическое и кристаллохимическое строение — понятие динамическое, а не статическое. [c.20]Перед каждой таблицей приводятся названия и химические формулы веществ, образующих данную систему. В связи с том, что в настоящее время употребительны различные системы номенклатуры неорганических соединений, в Справочнике приняты наиболее распространенные наименования соединений. [c.5]
Основное направление научных работ — анализ неорганических соединений. Изучал (совместно с Бунзеном) химические реакции, протекающие под действием света, в частности взаимодействие хлора с водородом. Установил (1862, также совместно с Бунзеном), что количество продукта фотохимической реакции определяется общим количеством энергии излучения, падающего на реакционную систему (закон Бунзена — Роско). Показал (1865), что ванадиевый ангидрид имеет формулу УгОб, а не УОз, как полагал /7. Я. Берцелиус. Действием водорода на хлористый ванадий при нагревании получил (1865) металлический ванадий. Написал ряд книг, выдержавших по нескольку изданий как в Англии, так и за рубежом, в частности Уроки элементарной хи- [c.438]
Написал ряд книг, выдержавших по нескольку изданий как в Англии, так и за рубежом, в частности Уроки элементарной хи- [c.438]
Степени окисления элементов. Классы неорганических соединений. Номенклатура. Составление эмпирических формул и образование названий химических соединений основано на знании и правильном использовании степеней окисления элементов. Если допустить, что химические соединения состоят из ионов, то степень окисления показывает заряд иона, входящего в соединение. На самом деле чисто ионные соединения практически не существуют, поэтому степень окисления пред ставляет собой величину условную, формальную. При определении степени окисления исходят из того, что водород в соединениях имеет, как правило, степень окисления 1- -, а кислород — 2 —. Исключением являются [c.21]
Термохимические расчеты основаны на применении термохимических уравнений, которые представляют собой обычные уравнения химических реакций, когда в них, наряду с формулами веществ, участвующих в реакции, указываются и тепловые эффекты процесса. С термохимическими уравнениями можно производить те же алгебраические действия, что и с алгебраическими уравнениями. Расчеты производит следующим путем определяют, какие алгебраические действия нужно произвести, чтобы из приведенных для решения задачи уравнений получить искомое уравнение совершая аналогичные операции с соответствующими данным реакциям тепловыми эффектами, получают искомую величину. При расчетах различных тепловых эс ектов химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов теплоты образования для неорганических соединений и теплоты горения для органических соединений. [c.86]
С термохимическими уравнениями можно производить те же алгебраические действия, что и с алгебраическими уравнениями. Расчеты производит следующим путем определяют, какие алгебраические действия нужно произвести, чтобы из приведенных для решения задачи уравнений получить искомое уравнение совершая аналогичные операции с соответствующими данным реакциям тепловыми эффектами, получают искомую величину. При расчетах различных тепловых эс ектов химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов теплоты образования для неорганических соединений и теплоты горения для органических соединений. [c.86]
Для установления формул химического строения простейших неорганических соединений необходимо было такое же последовательное проведение принципов классической теории химического строения, какое имело место в органической химии. Но как раз эта последовательность в применении к более сложным неорганическим соединениям, известным тогда под названием молекулярных, а позднее комплексных, оказалась несостоятельной. Как мы уже говорили в первом разделе, для объяснения существования веществ, не возможных с точки зрения учения о постоянной атомности, Кекуле выдвинул гипотезу, что они представляют собой относительно лабильные соприлегания настоящих химических молекул. Однако вскоре обнаружилось, что эти соединения по всем своим физическим и химическим признакам подобны атомным соединениям , хотя и отличаются иногда некоторым своеобразием. Именно для молекулярных соединений известны были многочисленные случаи изомерии, которые требовали своего объяснения, как это было раньше в органической химии. Молекулярные соединения часто обладают настолько прочнылш связями, что на них, так же как на органические соединения, можно было распространить принцип наименьшего изменения строения во время реакций. Это делало возможным изучение их методами, вырабо-таннылш в органической химии. [c.226]
Как мы уже говорили в первом разделе, для объяснения существования веществ, не возможных с точки зрения учения о постоянной атомности, Кекуле выдвинул гипотезу, что они представляют собой относительно лабильные соприлегания настоящих химических молекул. Однако вскоре обнаружилось, что эти соединения по всем своим физическим и химическим признакам подобны атомным соединениям , хотя и отличаются иногда некоторым своеобразием. Именно для молекулярных соединений известны были многочисленные случаи изомерии, которые требовали своего объяснения, как это было раньше в органической химии. Молекулярные соединения часто обладают настолько прочнылш связями, что на них, так же как на органические соединения, можно было распространить принцип наименьшего изменения строения во время реакций. Это делало возможным изучение их методами, вырабо-таннылш в органической химии. [c.226]
Исходя из своей молекулярной теории, проверенной в ходе многочисленных исследований в области органической химии, Жерар предложил удвоить значения эмпирически установленных атомных весов у ряда элементов, где вместо истинных атомных были приняты эквивалентные веса.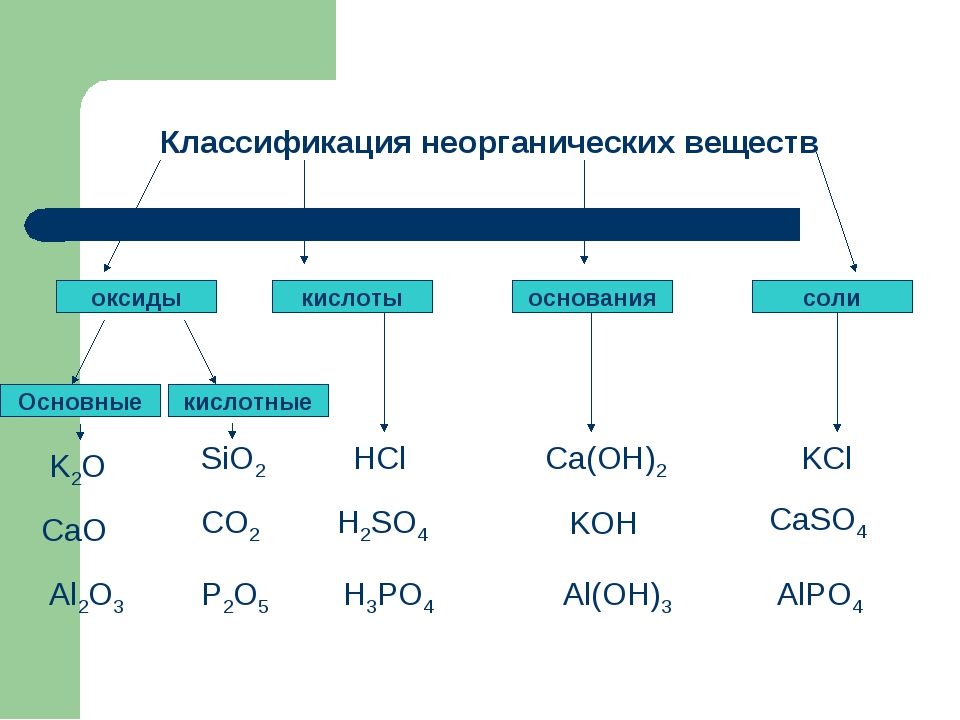 Отсюда как следствие вытекала необходимость соответственным образом изменить химические формулы тех органических, а затем уже и неорганических соединений, куда входили элементы с измененными (удвоенными, по предложению Жерара) атомными весами. [c.164]
Отсюда как следствие вытекала необходимость соответственным образом изменить химические формулы тех органических, а затем уже и неорганических соединений, куда входили элементы с измененными (удвоенными, по предложению Жерара) атомными весами. [c.164]
Химическая номенклатура состоит из формул и названий при этом название должно адекватно описывать формулу (т. е. состав). В части, посвященной номенклатуре неорганических веществ (глава 2), авторы книги уделяют основное внимание изложению и иллюстрированию правил построения названий соединений, но почти не рассматривают правил построения формул. По нашему глубокому убеждению написание формул должно подчиняться таким же строгим правилам, как и построение их систематических названий. Тогда переход от формулы к названию неорганического соединения окажется весьма простым и будет заключаться в чтении формулы справа налево с заменой химических символов элементов (или групп симво-« [c.10]
В соответствии с традицией, существующей в русском химическом языке, названия большинства неорганических соединений состоят из двух слов, причем на первом месте стоит название электроотрицательной части (или частей) формулы соединения, а на втором — название ее электроположительной части (или частей), например, KNaS04 — сульфат натрия-калия, Bi( l)0 — оксид-хлорид висмута. [c.11]
[c.11]
Простые вещества и неорганические соединения расположены в таблице в алфаоитиом пврядке химических символов. Органические соединения расположены по суммарным формулам 1 порядке возрастания числа атомов углерода в молекуле, а при одинаковом числе атомол углерода — в порядке возрастания числа атомов водорода. [c.585]
Применяемые названия неорганических соединений могут быть подразделены на две группы — условные и систематические. Условные названия или вовсе не вытекают нз формул ( бертоллетова соль , аммиак и т. п.), или имеют с ними лишь некоторую одностороннюю связь ( серная кислота , едким натр и т. п.). Логический переход от таких названий к формулам (или обратно), вообще немыслим и соответствие между теми и другими приходится в каждом отдельном случае только запоминать. Существующие систематические названия (например, хлорид, сульфат, фосфат и т. п. — натрия, кальция, алюминия и т. п.) точного представления о составе соединений, как правило, также не дают и для перехода от них к формулам требуется активное использование некоторой дополнительной информации. Между тем рациональные названия должны непосредственно давать однозначное словесное описание химических формул соответствующих веществ. Следовательно, номенклатуру нужно строить в плане именно рациональных названий и она должна быть по своим основам достаточно универсальна. [c.532]
Между тем рациональные названия должны непосредственно давать однозначное словесное описание химических формул соответствующих веществ. Следовательно, номенклатуру нужно строить в плане именно рациональных названий и она должна быть по своим основам достаточно универсальна. [c.532]
Степени окисления элементов. Классы неорганических соединений. Номенклатура. Составление эмпирических формул и образование названий химических соединений основано на знании и правильном использовании степеней окисления элементов . Если допустить, что химические соединения состоят из ионов, то степень окисления показывает заряд иона, входящего в соединение. На самом деле чисто ионные соединения практически не существуют, поэтому степень окисления представляет собой величину условную, формальную. При определении степени окисления исходят из того, что в соединениях, как правило, степень окисления водорода +1, а кислорода —2.
 Исключением являются гидриды активных металлов (ЫаН или СаНг), в которых водород имеет степень окисления —1, пероксид водорода и его производные (Н2О2 или Ва02), где кислород имеет степень окисления —1, а также фторид кислорода ОРг, степень окисления кислорода в котором равна +2. [c.25]
Исключением являются гидриды активных металлов (ЫаН или СаНг), в которых водород имеет степень окисления —1, пероксид водорода и его производные (Н2О2 или Ва02), где кислород имеет степень окисления —1, а также фторид кислорода ОРг, степень окисления кислорода в котором равна +2. [c.25]В этом указателе перечислены все препараты. Принятая в указателе-система та же, что н в hemi al Abstra ts. Основные принципы ее состоят в следующем 1) все обозначения химических элементоп в формулах расположены в алфавитном порядке, за исключением того, что в органических соединениях на первом месте всегда стоят С, а непосредственно за ним И, если соединение содерл[c.623]
Из схемы (см. стр. 279) известно, что тройные неорганические соединения делятся на две грзгапы АВХ и AXY. В первой группе два металлических элемента образуют соединение с одним неметаллическим, во второй — один металлический элемент с двумя неметаллическими. В структурном отношении эти группы также существенно отличаются.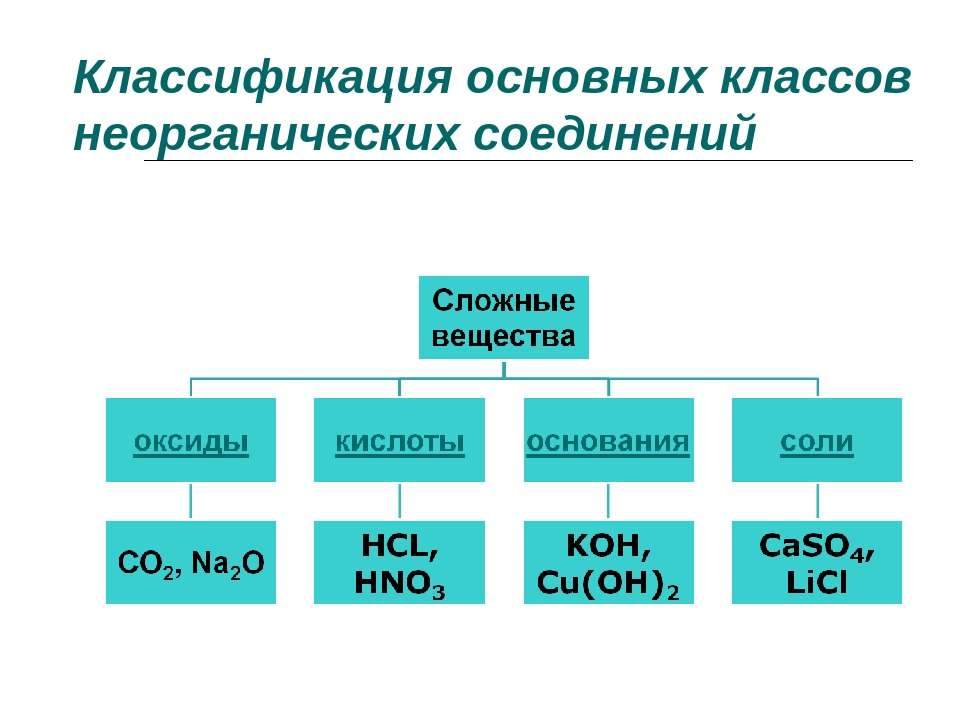 Пример первой из них мы уже знаем — это перовскит aTiOs. Для структур этой группы характерно то, что координационные числа катионов обычно больше числа анионов в химической формуле и поэтому никаких особых групп атомов (комплексов) и структуре нет. Так, в структуре перовскита Са имеет координационное число 12, а Ti — 6, в то время как число атомов кислорода, приходящееся на каждый из металлических атомов, равно трем. [c.319]
Пример первой из них мы уже знаем — это перовскит aTiOs. Для структур этой группы характерно то, что координационные числа катионов обычно больше числа анионов в химической формуле и поэтому никаких особых групп атомов (комплексов) и структуре нет. Так, в структуре перовскита Са имеет координационное число 12, а Ti — 6, в то время как число атомов кислорода, приходящееся на каждый из металлических атомов, равно трем. [c.319]
Действительно, для большинства неорганических соединений, как известно, важнейшей характеристикой служит состав, выражаемый молекулярной формулой, например H l, h3SO4. В то же время для органических веществ состав и соответственно молекулярная формула не являются однозначными характеристиками, так как одному. и тому же составу может соответствовать значительное количество реально существующих соединений. Это явление было открыто более 150 лет назад и названо изомерией, а различные вещества с одинаковым составом — изомерами. В соответствии со взглядами А. М. Бутлерова различие между изомерами заключается в их различном химическом строении. [c.52]
М. Бутлерова различие между изомерами заключается в их различном химическом строении. [c.52]
Научные исследования охватывают все главные проблемы общей химии первой половины XIX в. Экспериментально провери-л и доказал (1810—1816) достоверность законов постоянства состава и кратных отношений применительно к неорганическим оксидам и органическим соединениям. Определил (1807—1818) атомные массы 45 химических элементов. Ввел современное обозначение химических элементов (1814) и первые формулы химических соединений (1817— 1830), С 1811 занимался систематическим определением элементного состава органических соединений, Опираясь на законы изоморфизма, создал новую систему атомных весов и исправил формулы многих соединений. От-крыл химические элементы церий (1803, совместно со шведским химиком В, Г. Гизингером то же сделал независимо от них [c.56]
Если бы Берцелиус ограничился изложением такой электрохимической теории, он только в какой-то степени дополнил бы npefline TBOBaBniyi теорию Дэви. Поскольку тогда не были известны вытекающие из закона Фарадея количественные отношения между током и электролитическим разложением, теория имела бы ограниченное значение, тем более что она давала поводы для возражений. Но цель Берцелиуса состояла в том, чтобы объяснить на основе одной, более общей концепции состав различных соединений, главным образом неорганических, которые тогда были лучше всего изучены иными словами, эта цель состояла в том, чтобы найти отправной пункт для суждения о конституции соединений. Попытка установить рациональные формулы химических соединений привела Берцелиуса к созданию так называемой дуалистической системы и в то же время к усовершенствованию химической номенклатуры, разработанной французской школой. Уже ранее (1814) он видоизменил символы и формулы для изображения элементов и соединений и добавил индексы, которые позволили представлять химические реакции посредством уравнений но эта формальная сторона его проницательной идеи не приобрела бы большого значения, если бы не были известны рациональные формулы соединений [c.
Поскольку тогда не были известны вытекающие из закона Фарадея количественные отношения между током и электролитическим разложением, теория имела бы ограниченное значение, тем более что она давала поводы для возражений. Но цель Берцелиуса состояла в том, чтобы объяснить на основе одной, более общей концепции состав различных соединений, главным образом неорганических, которые тогда были лучше всего изучены иными словами, эта цель состояла в том, чтобы найти отправной пункт для суждения о конституции соединений. Попытка установить рациональные формулы химических соединений привела Берцелиуса к созданию так называемой дуалистической системы и в то же время к усовершенствованию химической номенклатуры, разработанной французской школой. Уже ранее (1814) он видоизменил символы и формулы для изображения элементов и соединений и добавил индексы, которые позволили представлять химические реакции посредством уравнений но эта формальная сторона его проницательной идеи не приобрела бы большого значения, если бы не были известны рациональные формулы соединений [c.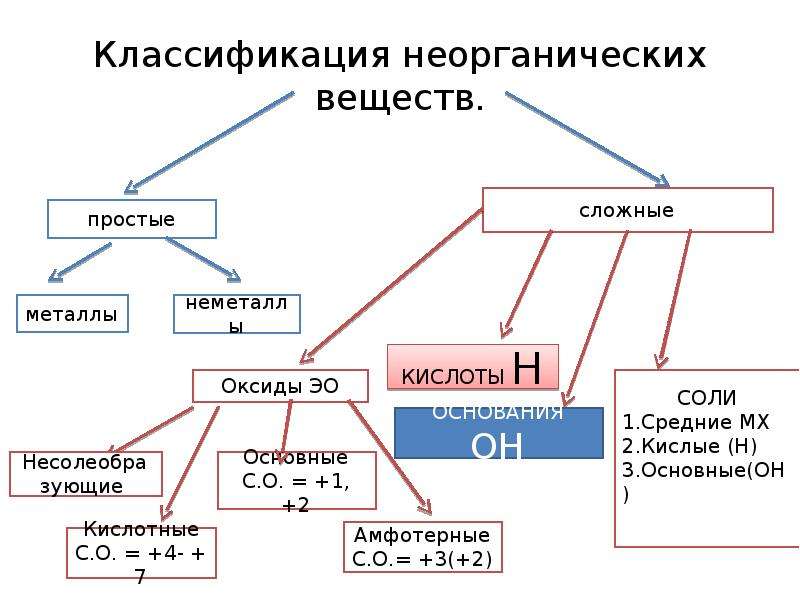 207]
207]
Химическая аналогия между азотом, фосфором, мышьяком и сурьмой, которая обваруживается при изучении неорганических соединений, сохраняется также в их органических производных. Чтобы показать существование такой аналогии, достаточно привести следующие формулы азобензола и аналогичных соединений других элементов [c.365]
Основные вопросы, которые ставили авторы обобщенных в настоящей монографии работ, и, несомненно, возникающие у читателей, это следующие являются ли гидриды переходных металлов истинными химическими соединениями и как понимать дробные показатели содержания водорода в формулах, которыми обычно выражается состав гидридов (например, Т1Н1,,6, ТЬНз,24, VHo,7 и др.), какое место занимают гидриды переходных металлов в общей систематике гидридов и, более широко, среди всех других классов неорганических соединений, и, наконец, какова их химическая природа. [c.159]
Во второй четверти XIX в. химики пользовались двумя видами формул химических соединений — двухобъемными и четырехобъемными . И те и другие выражают молекулярный вес вещества, определенный в паро- или газообразном состоянии по отношению к плотности водорода Он, Этот метод определения молекулярного веса предложен Авогадро (1811 г,), принимавшим, что молекула водорода состоит из двух атомов. Поэтому, если атомный вес водорода принять за единицу, молекулярный вес данного вещества X будет Л/х=2 >н. В 1814 г, появилась статья Ампера, утверждавшего, что молекулы простых газов, в том числе водорода, состоят из четырех -атомов. Тогда молекулярный вес того же вещества X будет Д/х =40н, Четырехобъемные формулы в широкое употребление ввел Дюма в 1826 г,, руководствуясь не только работой Ампера, но и некоторыми другими соображениями. Основная путаница в химии возникла потому, что химики, начиная с Дюма, стали применять оба вида формул (на причине этого мы здесь не можем останавливаться и отсылаем к монографии [Фаерштейн М. Г. История учения о молекуле в химии (до 1860 г,). М, Изд-во АН СССР, 1961, 368 с.]). В неорганической химии применялись главным [c.
И те и другие выражают молекулярный вес вещества, определенный в паро- или газообразном состоянии по отношению к плотности водорода Он, Этот метод определения молекулярного веса предложен Авогадро (1811 г,), принимавшим, что молекула водорода состоит из двух атомов. Поэтому, если атомный вес водорода принять за единицу, молекулярный вес данного вещества X будет Л/х=2 >н. В 1814 г, появилась статья Ампера, утверждавшего, что молекулы простых газов, в том числе водорода, состоят из четырех -атомов. Тогда молекулярный вес того же вещества X будет Д/х =40н, Четырехобъемные формулы в широкое употребление ввел Дюма в 1826 г,, руководствуясь не только работой Ампера, но и некоторыми другими соображениями. Основная путаница в химии возникла потому, что химики, начиная с Дюма, стали применять оба вида формул (на причине этого мы здесь не можем останавливаться и отсылаем к монографии [Фаерштейн М. Г. История учения о молекуле в химии (до 1860 г,). М, Изд-во АН СССР, 1961, 368 с.]). В неорганической химии применялись главным [c. 219]
219]
Если при определении химических формул неорганических соединений Берцелиус в основном исходил из соображений, соответ твующих химическим данным, пользуясь электрохимическими идеями только для подтверждения и расшифровки этих данных, то в случае органических соединений Берцелиус отошел от этого принципа. В 1818 г. из-за отсутствия достаточных эмпирических данных об органических веществах он вообще воздержался от распространения своей электрохимической теории на органические соединения. Но все же, следуя принципу химической аналогии неорганических и органических кислот, он пришел к гипотетическим формулам этих шслот путем отнятия окисла металла от формулы их соли [24, стр. 161]. В 30-х годах, когда накопился достаточный опытный материал, Берцелиус, развивая идеи Лавуазье и исходя из того же принципа химической аналогии, навязал органическим соединениям электрохимическую схему, выросшую на основе изучения неорганических веществ. Он отверг все попытки других химиков исходить из дуалистических соображений вообще при решении вопроса о строении органических соединений.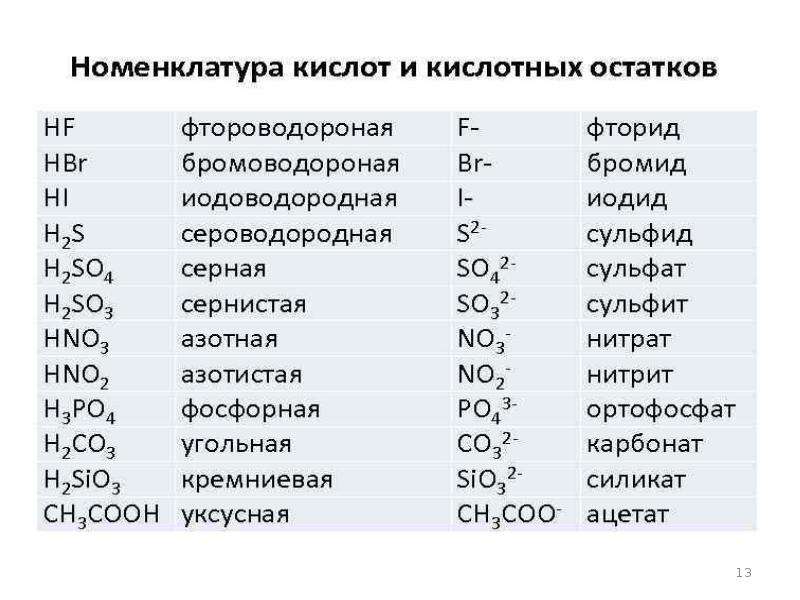 Берцелиус признавал не дуализм вообще, а только такой, который подчинен электрохимической теории. [c.171]
Берцелиус признавал не дуализм вообще, а только такой, который подчинен электрохимической теории. [c.171]
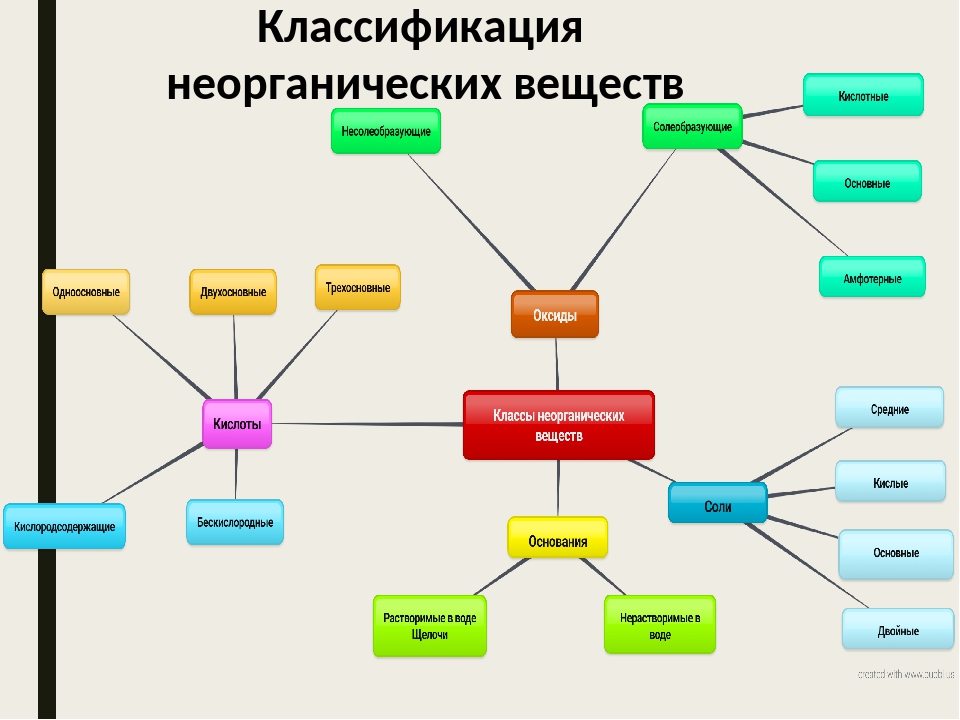
Классификация неорганических веществ — Химия для Степы
Сложные вещества обычно делят на классы: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Данная классификация несовершенна, т. к. в ней нет места для аммиака, соединений металлов с фосфором, азотом, углеродом и т. д.
Оксиды могут быть солеобразующими и несолеобразующими. Солеобразующим оксидам соответствуют гидроксиды и соли с элементом в той же степени окисления, что и в оксиде. Несолеобразующие оксиды не имеют соответствующих гидроксидов и солей. Таких оксидов немного: N2O, NO, SiO, CO.
Солеобразующие оксиды в зависимости от кислотно-основного характера делятся на кислотные, амфотерные и основные.
Основные оксиды образованы металлами с небольшими степенями окисления +1, +2. Амфотерные оксиды образованы переходными металлами со степенями окисления +3, +4, а также Be, Zn, Sn, Pb. Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
Кислотные оксиды образованы неметаллами, а также металлами со степенью окисления больше, чем +4. Рис. 3.
______________________________________________
Гидроксиды
______________________________________________
Основания
ОСНОВАНИЯ – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Основания – это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-анионов. В основу классификации оснований могут быть положены разные признаки. Например, их отношение к воде. По данному признаку основания делят на растворимые в воде (щелочи) и нерастворимые в воде.
______________________________________________
Амфотерные гидроксиды
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
Zn(OH)2 = h3ZnO2
форма основания форма кислоты
______________________________________________
Кислоты
КИСЛОТЫ
– это сложные вещества, состоящие из ионов водорода и
кислотных остатков.
Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металлы, и кислотных остатков. Кислоты можно разделить на группы по содержанию кислорода: кислородосодержащие (например, HNO3, h3SO4, h4PO4) и бескислородные (HI, h3S).
______________________________________________
Соли
СОЛИ – это сложные вещества, состоящие из ионов металла и кислотных остатков.
Средние соли состоят из катионов металла (или аммония) и анионов кислотных остатков. Кислые соли, кроме катионов металла, содержат катионы водорода и анион кислотного остатка. Основные соли в своем составе содержат гидроксид-анионы.
Если соль образована двумя видами катионов металлов и одним анионом, то ее называют двойной. Например, сульфат алюминия-калия KAl(SO4)2.
Соли с двумя разными анионами и одним катионом называют смешанными. Например, Са(OCl)Cl – хлорид-гипохлорит кальция.
В комплексных солях содержится сложный ион, который принято заключать в квадратные скобки.
______________________________________________
По материалам сайтов
http://interneturok.ru/ru/school/chemistry/11-klass/undefined/klassifikatsiya-i-nomenklatura-neorganicheskih-veschestv
Неорганическая химия – обзор
2.1 Введение
Если органическая химия определяется как химия углеводородных соединений и их производных, то неорганическая химия может быть описана в очень общем виде как химия неуглеродных соединений или как химия всего остального . Сюда входят все остальные элементы периодической таблицы (рис. 2.1 и 2.2) и некоторые соединения углерода (например, монооксид углерода (CO) и диоксид углерода (CO 2 )), который играет главную роль во многих неорганических соединениях. .Таким образом, неорганическая химия — это подкатегория химии, связанная со свойствами и реакциями неорганических соединений, которая включает все химические соединения без цепей или колец атомов углерода, которые попадают в подкатегорию органических соединений.
Рис. 2.1. Периодическая таблица элементов.
Рис. 2.2. Периодическая таблица элементов, показывающая группы и периоды, включая лантаноидные элементы и актинидные элементы.
Общее различие, помогающее различать неорганические соединения и органические соединения, заключается в том, что неорганические соединения являются либо результатом естественных процессов, не связанных с какой-либо формой жизни, либо результатом экспериментов человека в лаборатории, тогда как органические соединения возникают в результате деятельности живых существ. .Однако при использовании такого определения рекомендуется соблюдать осторожность, поскольку органические соединения могут быть созданы искусственно в лаборатории. Другое определение относится к солеобразующей способности неорганических соединений, которая отсутствует в органических соединениях, но даже в этом случае это определение также не совсем правильно, поскольку органические кислоты (RCO 2 H) священные также могут образовывать соли. Существует также аргумент, что неорганические соединения не имеют углерод-водородных связей — характеристика органических соединений, — но это также не совсем верно, поскольку перфторуглероды (углеродно-фтористые соединения, в которых все атомы водорода заменены атомами фтора). ) не имеют углерод-водородных связей, но все же являются органическими соединениями.Еще одно часто цитируемое различие заключается в том, что неорганические соединения содержат атомы металлов, а органические — нет. Опять же, это неверно, поскольку металлоорганические соединения содержат атомы металлов. Таким образом, рекомендуется проявлять осторожность при принятии любого определения, которое направлено на определение различий между неорганическими соединениями и органическими соединениями.
Существует также аргумент, что неорганические соединения не имеют углерод-водородных связей — характеристика органических соединений, — но это также не совсем верно, поскольку перфторуглероды (углеродно-фтористые соединения, в которых все атомы водорода заменены атомами фтора). ) не имеют углерод-водородных связей, но все же являются органическими соединениями.Еще одно часто цитируемое различие заключается в том, что неорганические соединения содержат атомы металлов, а органические — нет. Опять же, это неверно, поскольку металлоорганические соединения содержат атомы металлов. Таким образом, рекомендуется проявлять осторожность при принятии любого определения, которое направлено на определение различий между неорганическими соединениями и органическими соединениями.
Металлоорганическая химия , очень большая и быстро развивающаяся область, объединяет обе области, рассматривая соединения, содержащие прямые связи металл-углерод, и включает катализ многих химических реакций.![]() Металлоорганические соединения содержат по крайней мере одну связь между атомом металла и атомом углерода. Их называют координационными соединениями, используя систему аддитивной номенклатуры. Название органического лиганда, связывающегося через один атом углерода, может быть получено либо путем обращения с лигандом как с анионом, либо как с нейтральной замещающей группой. Кроме того, бионеорганическая химия связывает биохимию и неорганическую химию, а поскольку химия окружающей среды включает изучение как неорганических, так и органических соединений, исследования этих различных подразделений химии являются важными областями знаний.Как можно себе представить, область неорганической химии чрезвычайно широка и предоставляет практически безграничные области для исследований.
Металлоорганические соединения содержат по крайней мере одну связь между атомом металла и атомом углерода. Их называют координационными соединениями, используя систему аддитивной номенклатуры. Название органического лиганда, связывающегося через один атом углерода, может быть получено либо путем обращения с лигандом как с анионом, либо как с нейтральной замещающей группой. Кроме того, бионеорганическая химия связывает биохимию и неорганическую химию, а поскольку химия окружающей среды включает изучение как неорганических, так и органических соединений, исследования этих различных подразделений химии являются важными областями знаний.Как можно себе представить, область неорганической химии чрезвычайно широка и предоставляет практически безграничные области для исследований.
В самом широком (или общем) смысле неорганические химические вещества и соединения определяются тем, чем они не являются: (i) они не являются органическими по своей природе и (ii) ничем, кроме биологических, углеводородных и других подобных химических веществ на основе углерода можно отнести к неорганическим. В более практическом смысле неорганические химические вещества — это вещества минерального происхождения, которые не содержат углерода в своей молекулярной структуре и обычно основаны на наиболее распространенных химических веществах на Земле: кислороде, кремнии, алюминии, железе, кальции, натрии, калии и магнии. .Исключением являются CO и CO 2 , а также минеральные производные карбоната (CO 3 ) и производные бикарбоната (HCO 3 ).
В более практическом смысле неорганические химические вещества — это вещества минерального происхождения, которые не содержат углерода в своей молекулярной структуре и обычно основаны на наиболее распространенных химических веществах на Земле: кислороде, кремнии, алюминии, железе, кальции, натрии, калии и магнии. .Исключением являются CO и CO 2 , а также минеральные производные карбоната (CO 3 ) и производные бикарбоната (HCO 3 ).
Что касается экологических проблем, связанных с разливами или удалением неорганических химикатов, то уже много известно о влиянии молекулярной структуры на токсичность химических веществ для человека, и гораздо меньше известно о влиянии молекулярной структуры на окружающую среду. стойкость хим. Для экосистем, в которых существуют виды флоры и фауны, стойкость любых химических веществ (неорганических и органических) является чрезвычайно важным критерием для прогнозирования потенциального вреда, поскольку неизбежно существуют некоторые виды, чувствительные к любому химическому веществу и любому стойкому химическому веществу. Хотя некоторые химические вещества могут быть безвредными для ограниченного числа организмов, в конечном итоге они будут доставлены в ходе биогеохимических циклов к чувствительным видам в экосистеме. Таким образом, высокотоксичные, легко поддающиеся биологическому разложению вещества могут представлять гораздо меньшую проблему для окружающей среды, чем относительно безвредные стойкие химические вещества, которые могут нанести серьезный ущерб критически важным видам флоры или фауны.
Хотя некоторые химические вещества могут быть безвредными для ограниченного числа организмов, в конечном итоге они будут доставлены в ходе биогеохимических циклов к чувствительным видам в экосистеме. Таким образом, высокотоксичные, легко поддающиеся биологическому разложению вещества могут представлять гораздо меньшую проблему для окружающей среды, чем относительно безвредные стойкие химические вещества, которые могут нанести серьезный ущерб критически важным видам флоры или фауны.
Таким образом, изучение химических эффектов в окружающей среде можно разделить на две области исследования: (i) изучение уровней вещества, накапливающегося в воздухе, воде, почвах, включая отложения и биоту, и (ii) изучение воздействие химических веществ при достижении порогового уровня действия, в частности, воздействие на биоту, представляющее собой значительную неблагоприятную реакцию (т.е., кривая доза-реакция окружающей среды). Чтобы предсказать тенденции в уровнях химического вещества, требуется гораздо больше информации о скорости закачки; течение и разделение между воздухом, водой, почвой и биотой; и потери в результате деградации, что порождает концепцию экологического баланса экосистемы. Эти динамические явления определяются физическими свойствами и химическими свойствами молекулярного загрязнителя.
Эти динамические явления определяются физическими свойствами и химическими свойствами молекулярного загрязнителя.
Гидромеханика и метеорология могут в будущем предоставить концептуальные и технические инструменты для создания прогностических моделей таких систем.Большая часть знаний о воздействии получена из острых токсикологических и медицинских исследований различных (но не всех) организмов (включая людей), но, поскольку воздействие окружающей среды обычно связано с хроническим воздействием, все чаще проводятся исследования длительного непрерывного воздействия мельчайших количества хим. Хорошо известная трудность распознавания таких эффектов, когда они происходят в экосистеме, усугубляется тем фактом, что многие из эффектов неспецифичны и часто могут быть замаскированы аналогичными эффектами, возникающими в результате воздействия природных явлений, таких как голод, засухи и любые другие явления. (или более) нескольких метеорологических или катастрофических явлений.Даже когда распознан подлинный эффект, необходимо найти и сопоставить с ним возможную причину. Этот процесс должен сопровождаться экспериментальными исследованиями (лабораторными исследованиями и/или полевыми работами), которые без разумных сомнений связывают причинное неорганическое химическое(ые) вещество(я) и любое неблагоприятное воздействие(я) на растительную и/или фаунистическую экосистему. Этого можно достичь только усердным сбором и усвоением технических знаний по неорганической химии в том, что касается свойств и поведения неорганических химических веществ.
Этот процесс должен сопровождаться экспериментальными исследованиями (лабораторными исследованиями и/или полевыми работами), которые без разумных сомнений связывают причинное неорганическое химическое(ые) вещество(я) и любое неблагоприятное воздействие(я) на растительную и/или фаунистическую экосистему. Этого можно достичь только усердным сбором и усвоением технических знаний по неорганической химии в том, что касается свойств и поведения неорганических химических веществ.
Однако не ожидалось, что инженер будет накапливать столько же химических знаний, сколько профессиональный химик-неорганик — так же, как химик может стать брезгливым из-за необходимости быть опытным в одной или нескольких инженерных дисциплинах. Но накопление достаточных знаний для (i) понимания поведения неорганических химических веществ в окружающей среде с последующим (ii) способностью делать разумные прогнозы (на основе свойств) поведения неорганических химических веществ в окружающей среде.Неспособность признать взаимодействующие роли химика и инженера будет препятствовать и разрушать разработку единой политики управления окружающей средой, которая будет применяться к устойчивости любой экосистемы или широкой области окружающей среды (глава 1).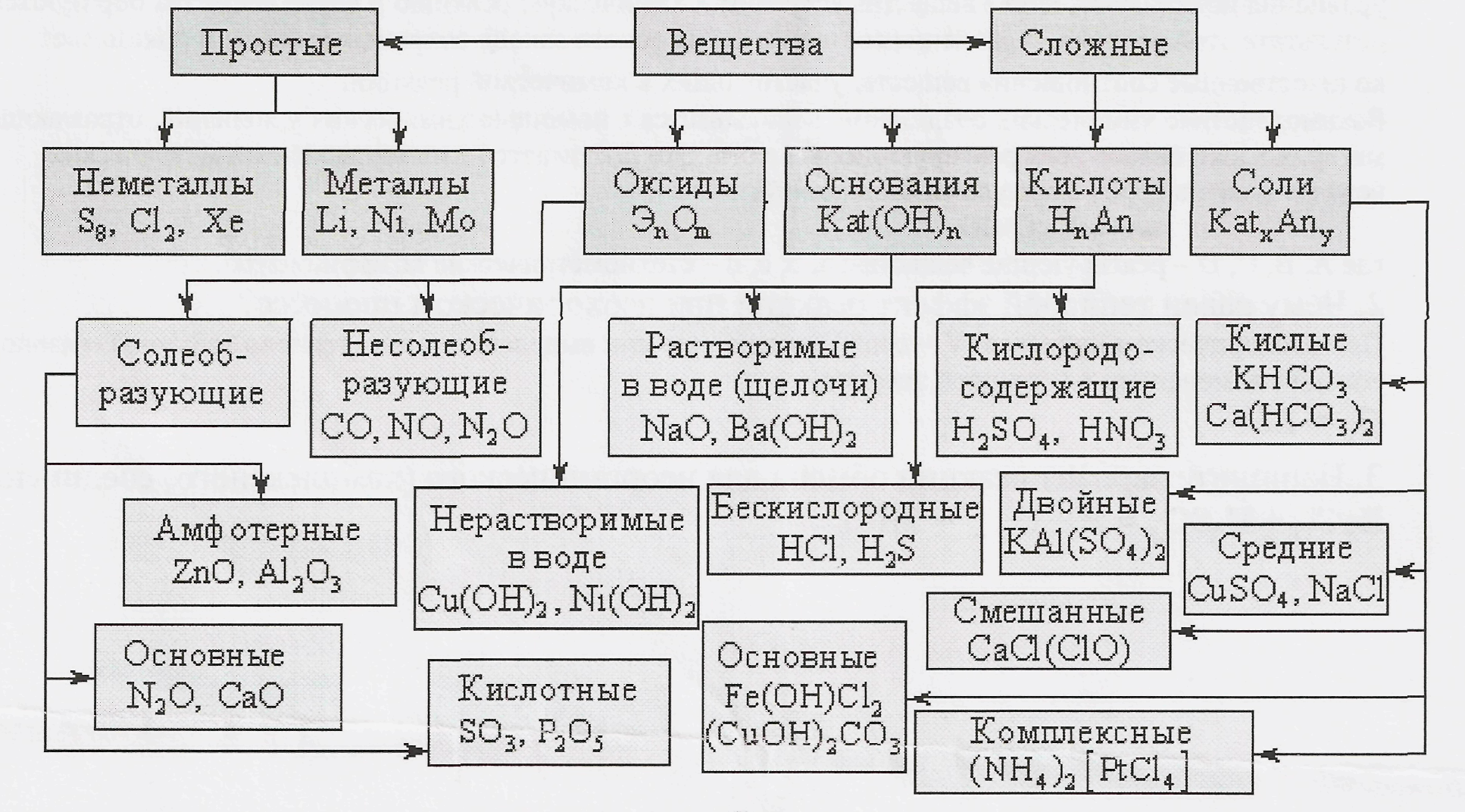
Таким образом, неорганические химикаты находят применение во всех аспектах химической промышленности, включая катализаторы, пигменты, поверхностно-активные вещества, покрытия, медицину, топливо и сельское хозяйство. Продукты неорганических химических процессов используются в качестве (i) основных химических веществ для промышленных процессов, которые включают кислоты, основания, соли, окислители, газы и галогены; (ii) химические добавки, включающие пигменты, щелочные металлы и красители; и (iii) готовая продукция, включающая удобрения, стекло и строительные материалы.
С точки зрения промышленности существует два основных класса неорганических химических веществ: (i) щелочные химические вещества, включая кальцинированную соду, которая представляет собой преимущественно карбонат натрия (NaCO 3 ), едкий натр (NaOH) и жидкий хлор (Cl 2 ) и (ii) основные неорганические соединения, такие как фторид алюминия (AlF 3 ), карбид кальция (CaC 2 ), хлорат калия (KClO 3 ) и диоксид титана (TiO 2 ). Кроме того, хлорно-щелочное производство является важным компонентом мировой химической экономики.Основной реакцией в промышленности является реакция, при которой соленая вода (рассол — вода, содержащая хлорид натрия, NaCl) разлагается в процессе электролиза с образованием NaOH (гидроксида натрия, NaOH), газообразного хлора (Cl 2 ) и водорода. (H 2 ) газ:
Кроме того, хлорно-щелочное производство является важным компонентом мировой химической экономики.Основной реакцией в промышленности является реакция, при которой соленая вода (рассол — вода, содержащая хлорид натрия, NaCl) разлагается в процессе электролиза с образованием NaOH (гидроксида натрия, NaOH), газообразного хлора (Cl 2 ) и водорода. (H 2 ) газ:
2NaCl+2h3O→Cl2+h3+2NaOH
Хлор образуется на положительном электроде (аноде), а водород (H 2 ) и гидроксид натрия образуются на отрицательном электроде ( катод). Эти три материала являются сырьем для производства отбеливателя (гипохлорита натрия, NaOCl) и множества других продуктов, включая кальцинированную соду (Na 2 CO 3 ).
Наконец, неорганическая химия — это предмет, к которому не следует подходить с какой-либо тревогой или нерешительностью, поскольку этот предмет становится легче по мере того, как отдельный исследователь углубляется в него. Темы, затронутые в этой книге, являются основными темами, которые служат для того, чтобы познакомить читателя не только с неорганической химией, но и с пониманием влияния неорганических химических веществ на различные экосистемы. Кроме того, понимание механизма, посредством которого происходит реакция, особенно важно, и по необходимости книга предлагает логический и упрощенный подход к реакциям различных неорганических функциональных групп.Это, в свою очередь, превращает список явно не связанных между собой фактов в осмысленную и связную тему. Эта глава будет служить введением в природу и производство неорганических химических веществ и структуру неорганических химических веществ, которая будет служить введением и производством неорганических химических веществ (глава 3), а следующая глава (глава 4) представляет собой введение в химические свойства и физические свойства неорганических химических веществ (глава 4), из которых можно оценить понимание воздействия неорганических химических веществ на растительную и животную среду.
Кроме того, понимание механизма, посредством которого происходит реакция, особенно важно, и по необходимости книга предлагает логический и упрощенный подход к реакциям различных неорганических функциональных групп.Это, в свою очередь, превращает список явно не связанных между собой фактов в осмысленную и связную тему. Эта глава будет служить введением в природу и производство неорганических химических веществ и структуру неорганических химических веществ, которая будет служить введением и производством неорганических химических веществ (глава 3), а следующая глава (глава 4) представляет собой введение в химические свойства и физические свойства неорганических химических веществ (глава 4), из которых можно оценить понимание воздействия неорганических химических веществ на растительную и животную среду.
Неорганические соединения углерода: определение и примеры
Что такое неорганическое соединение углерода?
Основываясь на том, что вы только что узнали, что такое неорганическое соединение углерода ? Ну, это неорганическое соединение (у него нигде нет связи С-Н), но, тем не менее, оно содержит углерод.
При старых способах различения (не)органических соединений это не имело бы смысла. Углерод либо есть, либо его нет! Но то, как эти два понятия могут быть определены сегодня, означает, что соединение может иметь углерод, но оставаться неорганическим.
Примеры
Некоторые примеры неорганических соединений углерода можно найти среди карбонатов , соединений, содержащих ион CO3 2-. Один из них известен как кальцинированная сода или карбонат натрия, который пишется как Na 2 CO 3 и используется для изготовления всего, от стекла до моющих средств.
Другой пример неорганических соединений углерода можно найти среди цианидов , соединений, содержащих цианид, или CN. Одним из них является цианистый водород, обозначаемый как HCN.Это соединение чрезвычайно опасно и ядовито. Это мешает вашему телу использовать кислород и в результате может очень быстро убить. Он используется в качестве боевого отравляющего вещества и в коммерческих целях, таких как добыча полезных ископаемых.
Хорошие примеры неорганических соединений углерода также можно найти среди карбидов , соединения, которое содержит углерод наряду с менее электроотрицательным элементом. Одним из таких соединений является карбид кальция, или CaC2, который используется для получения другого химического соединения, называемого ацетиленом.
Наконец, по крайней мере для этого урока, еще один замечательный пример неорганического соединения углерода приходит к нам из оксидов. Оксид представляет собой химическое соединение, включающее атом кислорода, связанный с другим атомом. Возможно, самым известным из них является углекислый газ или CO2. Вы, вероятно, лучше всего знаете это как газ, который мы выдыхаем из наших легких! Другим известным примером оксида углерода является не что иное, как угарный газ, или CO, который является смертельным газом.
Резюме урока
- Органическое соединение — это соединение, имеющее хотя бы одну связь C-H (углерод-водородная связь)
- Неорганическое соединение представляет собой соединение без по крайней мере одной связи C-H.

Исходя из этого, неорганическое углеродное соединение содержит углерод, но НЕ содержит связи C-H.
Примеры неорганических соединений углерода включают:
- Карбонат натрия или Na2CO3. Карбонат содержит ион CO3 2-.
- HCN или цианистый водород. Цианид содержит CN.
- Карбид кальция или CaC2. Карбид содержит углерод наряду с менее электроотрицательным элементом.
- Двуокись углерода или CO2.Это разновидность оксида углерода. Оксид представляет собой химическое соединение, включающее атом кислорода, связанный с другим атомом.
Неорганические химикаты | Глоссарий | Марквард и Бахлс
Химические вещества — это все химические соединения, полученные химическими процессами в лаборатории или в промышленности. Это могут быть чистые вещества или смеси веществ. Химические вещества подразделяются на органические и неорганические химические вещества . Органическая химия охватывает практически все углеродсодержащие соединения, а неорганическая химия (неорганические вещества) относится к другим элементам таблицы Менделеева и их соединениям.Таким образом, неорганическая химия имеет дело со структурой и свойствами безуглеродных соединений, за исключением нескольких простых углеродных соединений, которые построены как типичные неорганические вещества или которые по историческим причинам отнесены к неорганической химии. Неорганические химические вещества включают кислоты и основания (наиболее важными являются серная кислота, соляная кислота, азотная кислота, фосфорная кислота, едкий натр и аммиак), металлы, соли и минералы. Различные неорганические превращения также связаны с образованием газов.Элементарный углерод (графит, алмаз) и некоторые соединения углерода, такие как двуокись углерода, окись углерода, угольная кислота и карбиды, также относятся к неорганической химии.
Органическая химия охватывает практически все углеродсодержащие соединения, а неорганическая химия (неорганические вещества) относится к другим элементам таблицы Менделеева и их соединениям.Таким образом, неорганическая химия имеет дело со структурой и свойствами безуглеродных соединений, за исключением нескольких простых углеродных соединений, которые построены как типичные неорганические вещества или которые по историческим причинам отнесены к неорганической химии. Неорганические химические вещества включают кислоты и основания (наиболее важными являются серная кислота, соляная кислота, азотная кислота, фосфорная кислота, едкий натр и аммиак), металлы, соли и минералы. Различные неорганические превращения также связаны с образованием газов.Элементарный углерод (графит, алмаз) и некоторые соединения углерода, такие как двуокись углерода, окись углерода, угольная кислота и карбиды, также относятся к неорганической химии.
Наименование неорганических соединений регулируется правилами Международного союза теоретической и прикладной химии (IUPAC) и занесено в его «Красную книгу» (органические соединения занесены в «Синюю книгу»).
В то время как в прошлом неорганическая химия имела дело с материалами, которые не производятся органической жизнью, разделение между неорганической и органической химией было изменчивым с тех пор, как Фридриху Вёлеру впервые удалось синтезировать мочевину в 1828 году.Он создал химическую мочевину из неорганического материала. Сегодня современные химические лаборатории могут производить практически любое органическое вещество (полный синтез). Однако различие все же полезно, потому что механизмы реакции и структуры материалов различаются в неорганической и органической химии.
Когда различные неорганические вещества вступают в химическую реакцию друг с другом, они образуют вещества с новыми свойствами, например, соли. Типичными реакциями между неорганическими материалами являются окислительно-восстановительные реакции (перенос электронов) или кислотно-щелочные реакции (перенос протонов).Особенно при более высоких температурах неорганические соединения могут распадаться за счет выделяющихся газов, например, при обжиге извести (кальцинировании), когда углекислый газ выделяется из карбоната кальция, оставляя оксид кальция в виде остатка.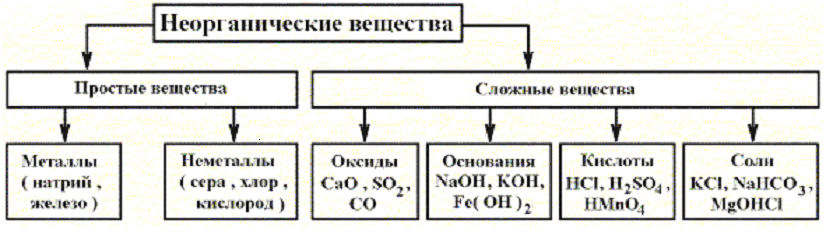
В то время как органическая химия идентифицировала около 19 миллионов известных соединений углерода, неорганическая химия включает только около 500 000 известных соединений. Тем не менее неорганические соединения приносят большие экономические выгоды. Производство металлов, керамики, цемента и извести имеет давние традиции.В последние десятилетия, например, большое значение приобрели соединения кремния. Они составляют основу современной полупроводниковой промышленности. Неорганическая химия также имеет большое значение для многих других отраслей промышленности. Например, в химической промышленности важными основными химическими веществами являются хлор, каустическая сода, серная кислота и аммиак.
В зависимости от свойств веществ или химических веществ они должны быть соответствующим образом классифицированы, маркированы и упакованы. Точно так же химическая совместимость, т.е.как различные химические вещества будут реагировать друг с другом – необходимо учитывать при их хранении; см. подробные комментарии в разделе Химические вещества.
подробные комментарии в разделе Химические вещества.
Неорганический | Химия
Неорганическая
Неорганическая химия занимается изучением свойств и поведения неорганических соединений. Эта область охватывает все химические соединения, кроме множества органических соединений (соединений на основе углерода, обычно содержащих связи C-H), которые являются предметом органической химии. Различие между двумя дисциплинами далеко не абсолютное, и существует много совпадений, особенно в подразделе металлоорганической химии.Исследования в области неорганической химии в отделе охватывают континуум от низкомолекулярных систем до металлопротеинов, от изучения реакционных свойств синтетических комплексов до использования реагентов на основе металлов для исследования взаимодействий белок-ДНК.
Основной факультет
Джон КарадоннаОбласть:Бионеорганическая химия Caradonna Group интересуется биологической химией негемового железа. | |
Линда ДёррерРаздел:Фторированные лиганды для катализа Doerrer Group проявляет большой интерес к химии комплексов переходных металлов с фторированными лигандами-донорами O, включая арилоксиды, а также монодентатные и бидентатные алкоксиды.Эти лиганды облегчают окислительную стабилизацию металлов для катализа, совсем недавно при создании реакционноспособных фрагментов {CunOm}n+ для функционализации C-H. Новые соединения тщательно исследуются на предмет их электронной структуры, что показало, что эти фторированные лиганды обладают электронным эффектом фторида без его обширного мостикового или гидролитического чувствительности. Мы также синтезируем новые соединения, которые потенциально могут быть одномерными (1D) электронными проводниками. | |
Шон ЭллиоттОбласть: Бионеорганическая химия и металлобиохимия The Elliott Group использует белково-пленочную вольтамперометрию (PFV) для изучения путей переноса электронов и окислительно-восстановительной каталитической химии сложных металлопротеинов, таких как сульфитредуктаза и мультимедные оксидазы.Они также разрабатывают протеомные инструменты, позволяющие исследовать «металлом» — полное считывание компонентов связывания металлов биологических путей. Эти эксперименты дают представление о роли ионов металлов в биологической химии. |
Справочник по неорганическим соединениям — 2-е издание — Дейл Л. Перри
Описание книги
Это обновленное издание Справочника по неорганическим соединениям является идеальным справочником для всех, кому нужны данные о свойствах соединений, номера CASRN для компьютерного или другого поиска, согласованная таблица молекулярных масс для синтеза неорганических материалов в лабораторных масштабах или данные связанные с физическими и химическими свойствами.Полностью переработанное второе издание включает новые данные о неорганических оптических материалах, неорганических веществах для обнаружения излучения, термохромных соединениях, пьезохромных соединениях, катализаторах, сверхпроводниках и люминесцентных (флуоресцентных и фосфоресцирующих) неорганических веществах.
Этот справочник, составленный для химиков, инженеров-химиков, материаловедов и других ученых, содержит:
- Базовые, важные данные о свойствах соединений, которые они хотят использовать в своих компиляциях баз данных, исследованиях и прикладных работах
- Американское химическое общество (ACS) Chemical Abstract Регистрационные номера ( RN или CAS ) для компьютерного и другого поиска.
 Были предприняты попытки включить номера CAS как для гидратированных химических соединений, так и для их исходных безводных соединений .
Были предприняты попытки включить номера CAS как для гидратированных химических соединений, так и для их исходных безводных соединений . - Таблица молекулярных масс для расчетов. В этом справочнике молекулярная масса во всех случаях рассчитана с точностью до трех знаков после запятой 90–108.
- Учебники и справочники по неорганической химии
Справочник по неорганическим соединениям : второе издание содержит данные для 3326 выбранных газообразных, жидких и твердых соединений, включая репрезентативные соединения нескольких различных классов соединений.Выбор соединений основывался на таких критериях, как включение соединений в различные справочники по лабораторным химикатам, обсуждение в недавних исследовательских публикациях, соединения, важные для химии неорганических материалов, и комментарии Консультативного комитета, руководившие выпуском первого издания справочника.
Содержание
Данные о неорганических соединениях
Указатель регистрационных номеров CAS
Указатель молекулярных формул
Указатель имен/синонимов
Избранные справочники по неорганической химии
Автор(ы)
Биография
Дейл Л. Перри получил докторскую степень по неорганической химии в Хьюстонском университете, Хьюстон, Техас. Он был валлийским постдокторантом и национальным научным сотрудником в Университете Райса. Он был научным сотрудником Миллера по химии в Калифорнийском университете в Беркли, Калифорния. Он работал научным сотрудником в области химии в Национальной лаборатории Лоуренса Беркли Калифорнийского университета и был назначен старшим научным сотрудником в области химии в том же учреждении. Он отредактировал и написал несколько книг, в том числе Инструментальный анализ Анализ поверхности геологических материалов , Применение аналитических методов к характеристике материалов и Применение методов синхротронного излучения в материаловедении .
Перри получил докторскую степень по неорганической химии в Хьюстонском университете, Хьюстон, Техас. Он был валлийским постдокторантом и национальным научным сотрудником в Университете Райса. Он был научным сотрудником Миллера по химии в Калифорнийском университете в Беркли, Калифорния. Он работал научным сотрудником в области химии в Национальной лаборатории Лоуренса Беркли Калифорнийского университета и был назначен старшим научным сотрудником в области химии в том же учреждении. Он отредактировал и написал несколько книг, в том числе Инструментальный анализ Анализ поверхности геологических материалов , Применение аналитических методов к характеристике материалов и Применение методов синхротронного излучения в материаловедении .
Помимо исследований, он был советником и членом нескольких специальных групп в области приборов, связанных с тяжелыми металлами, их химией и материаловедением для нескольких правительственных учреждений США. Он является организатором симпозиумов и семинаров по исследованиям неорганических веществ и материалов, включая синтез и определение характеристик неорганических материалов и применение различных типов спектроскопии к этим материалам
Он является организатором симпозиумов и семинаров по исследованиям неорганических веществ и материалов, включая синтез и определение характеристик неорганических материалов и применение различных типов спектроскопии к этим материалам
отзывов
Это обновленное издание Справочника по неорганическим соединениям является идеальным справочником для всех, кому нужны данные о свойствах соединений, номера CASRN для компьютерного или другого поиска, согласованная таблица молекулярных масс для синтеза неорганических материалов в лабораторных масштабах или данные связанные с физическими и химическими свойствами.
Полностью переработанное второе издание включает новые данные о неорганических оптических материалах, неорганических веществах для обнаружения излучения, термохромных соединениях, пьезохромных соединениях, катализаторах, сверхпроводниках и люминесцентных (флуоресцентных и фосфоресцирующих) неорганических веществах.
Справочник содержит данные для 3326 выбранных газообразных, жидких и твердых соединений, включая репрезентативные соединения нескольких различных классов соединений. Выбор соединений основывался на таких критериях, как включение соединений в различные справочники по лабораторным химикатам, обсуждение в недавних исследовательских публикациях, соединения, важные для химии неорганических материалов, и комментарии Консультативного комитета, руководившие выпуском первого издания справочника.
— Противораковые исследования, 32: 715-720 (2012)
2.4 Неорганические соединения, необходимые для функционирования человека — Колледж Дугласа, анатомия и физиология человека, I (1-е изд.
 )
)Цели обучения
К концу этого раздела вы сможете:
- Различать органические и неорганические молекулы
- Укажите химические и физические свойства воды
- Объясните биологическую важность воды
Понятия, которые вы уже изучили в этой главе, управляют всеми формами материи и могут служить основой как для геологии, так и для биологии.Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения являются либо неорганическими, либо органическими.
- Неорганическое соединение представляет собой вещество, которое не содержит ни углерода, ни водорода. Многие неорганические соединения содержат атомы водорода, например, вода (H 2 O) и соляная кислота (HCl), вырабатываемая желудком. Напротив, только несколько неорганических соединений содержат атомы углерода.Углекислый газ (CO 2 ) является одним из немногих примеров.

- Таким образом, органическое соединение представляет собой молекулу, которая содержит как углерод, так и водород. Многие органические соединения могут быть синтезированы с помощью ковалентных связей в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в пище, которую вы едите, в соединениях, из которых состоит структура вашего тела, и в химических веществах, питающих ваше функционирование.
В следующем разделе рассматриваются три группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
До 70 процентов массы тела взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько ее функций делают воду незаменимой для жизнедеятельности человека.
Вода в качестве смазки и подушки
Вода является основным компонентом многих смазочных жидкостей организма.Подобно тому, как масло смазывает дверные петли, вода в синовиальной жидкости смазывает движения суставов тела, а вода в плевральной жидкости помогает легким расширяться и сжиматься при дыхании. Водянистые жидкости способствуют прохождению пищи по пищеварительному тракту и обеспечивают движение соседних органов брюшной полости без трения.
Вода также защищает клетки и органы от физических травм, например, амортизирует мозг внутри черепа и защищает нежную нервную ткань глаз.Вода смягчает развивающийся плод и в утробе матери.
Вода как теплоотвод
Радиатор — это вещество или объект, который поглощает и рассеивает тепло, но не испытывает соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое химическими реакциями, без значительного повышения температуры. Более того, когда температура окружающей среды резко повышается, вода, запасенная в организме, помогает ему охлаждаться. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам прямо под кожей и передается в окружающую среду в виде лучистого тепла.В то же время потовые железы выделяют теплую воду вместе с потом. Чтобы произошло испарение этой воды, водородные связи между молекулами воды должны быть разорваны, что требует относительно большого количества энергии, которая частично включает тепло. Это удаление тепла путем испарения приводит к охлаждению крови на периферии тела, вблизи поверхности кожи, которая затем циркулирует обратно к ядру тела и охлаждает тело.
Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам прямо под кожей и передается в окружающую среду в виде лучистого тепла.В то же время потовые железы выделяют теплую воду вместе с потом. Чтобы произошло испарение этой воды, водородные связи между молекулами воды должны быть разорваны, что требует относительно большого количества энергии, которая частично включает тепло. Это удаление тепла путем испарения приводит к охлаждению крови на периферии тела, вблизи поверхности кожи, которая затем циркулирует обратно к ядру тела и охлаждает тело.
Вода как компонент жидких смесей
Смесь представляет собой комбинацию двух или более веществ, каждое из которых сохраняет свою химическую идентичность.Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если подумать о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются, образуя новое соединение. Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента.Это растворы, коллоиды и суспензии.
Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента.Это растворы, коллоиды и суспензии.
Чтобы клетки в организме выжили, их необходимо поддерживать во влажном состоянии в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределены по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды.Отношение сахара к воде в левой части стакана будет таким же, как отношение сахара к воде в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара и воды изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем» и считается, что жизнь не может существовать без воды из-за этого. Вода, безусловно, самый распространенный растворитель в организме; практически все химические реакции в организме происходят между соединениями, растворенными в воде.Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называются гидрофильными или «водолюбивыми». Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, плохо растворяющиеся в воде, называются гидрофобными или «водобоязненными».
Роль воды в химических реакциях
Рисунок 1.Дегидратационный синтез и гидролиз. Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера). (а) При дегидратационном синтезе два мономера ковалентно связываются в результате реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды высвобождается как побочный продукт при реакциях дегидратации. (б) При гидролизе ковалентная связь между двумя мономерами расщепляется за счет присоединения атома водорода к одному и гидроксильной группы к другому, что требует вклада одной молекулы воды.
(а) При дегидратационном синтезе два мономера ковалентно связываются в результате реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды высвобождается как побочный продукт при реакциях дегидратации. (б) При гидролизе ковалентная связь между двумя мономерами расщепляется за счет присоединения атома водорода к одному и гидроксильной группы к другому, что требует вклада одной молекулы воды.Два типа химических реакций связаны с созданием или потреблением воды: синтез дегидратации и гидролиз.
- В синтезе дегидратации один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 1). Это также иногда называют реакцией конденсации.
- При гидролизе молекула воды разрушает соединение, разрывая его связи.Вода сама расщепляется на Н и ОН. Затем одна часть разорванного соединения связывается с атомом водорода, а другая часть связывается с гидроксильной группой.

Эти реакции являются обратимыми и играют важную роль в химии органических соединений (которая будет обсуждаться в ближайшее время).
Посмотрите это видео о сестрах-амебах, чтобы узнать больше о свойствах воды! Посмотрите это видео CrashCourse, чтобы узнать больше о важности воды и ее химических свойствах.Рисунок 2. Диссоциация хлорида натрия в воде. Обратите внимание, что кристаллы хлорида натрия диссоциируют не на молекулы NaCl, а на катионы Na+ и анионы Cl–, каждый из которых полностью окружен молекулами воды. Вспомните, что соли образуются, когда ионы образуют ионные связи. В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH – .Этот факт важен для отличия солей от кислот и оснований, о чем пойдет речь далее.
Типичная соль NaCl полностью диссоциирует в воде (рис. 2). Положительные и отрицательные участки молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга. Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе.Это свойство имеет решающее значение для функции ионов в передаче нервных импульсов и стимулировании сокращения мышц.
Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Неорганические соединения | Encyclopedia.com
Существует два основных класса химических соединений: органические и неорганические. Органические соединения основаны на углероде (содержащем углерод в качестве структурной основы) и встречаются в живых существах.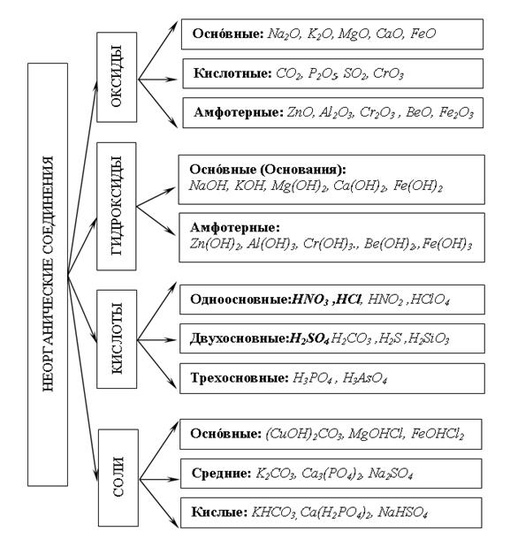 Неорганические соединения основаны на других элементах. Это различие является обобщением. Некоторые важные неорганические соединения, такие как карбонат кальция или известь, содержат углерод. Соединения на основе углерода не обязательно должны исходить от живых существ; синтетические волокна , такие как нейлон и полиэстер, основаны на углероде, но не встречаются в растениях или животных. С точки зрения судебно-медицинской экспертизы , в предметах вещественных доказательств обнаружены как органические, так и неорганические соединения. Методы, используемые для определения химического состава таких доказательств, часто зависят от того, являются ли составляющие соединения органическими (полученными из живой ткани или материала) или неорганическими.
Неорганические соединения основаны на других элементах. Это различие является обобщением. Некоторые важные неорганические соединения, такие как карбонат кальция или известь, содержат углерод. Соединения на основе углерода не обязательно должны исходить от живых существ; синтетические волокна , такие как нейлон и полиэстер, основаны на углероде, но не встречаются в растениях или животных. С точки зрения судебно-медицинской экспертизы , в предметах вещественных доказательств обнаружены как органические, так и неорганические соединения. Методы, используемые для определения химического состава таких доказательств, часто зависят от того, являются ли составляющие соединения органическими (полученными из живой ткани или материала) или неорганическими.
Стекло и краска, вероятно, являются наиболее важными доказательствами, содержащими неорганические соединения. Стекло состоит из кремнезема, соды, извести и примесей, которые обычно представляют собой минеральные соли. Химический состав стекла часто определяют с помощью сканирующего электронного микроскопа (СЭМ) в сочетании с энергодисперсионным рентгеновским анализом (EDX). Микроскоп обеспечивает увеличение образца в десять тысяч и более раз, используя электроны, а не свет. Предмет под микроскопом будет излучать излучение, характерное для элементов, из которых он сделан.Наличие и пропорции этих элементов можно определить, а затем сравнить с эталонными типами стекла. Это позволяет не только определить тип стекла, обнаруженного на месте преступления, но и провести сравнение с осколками стекла, обнаруженными у подозреваемого.
Химический состав стекла часто определяют с помощью сканирующего электронного микроскопа (СЭМ) в сочетании с энергодисперсионным рентгеновским анализом (EDX). Микроскоп обеспечивает увеличение образца в десять тысяч и более раз, используя электроны, а не свет. Предмет под микроскопом будет излучать излучение, характерное для элементов, из которых он сделан.Наличие и пропорции этих элементов можно определить, а затем сравнить с эталонными типами стекла. Это позволяет не только определить тип стекла, обнаруженного на месте преступления, но и провести сравнение с осколками стекла, обнаруженными у подозреваемого.
Краска — это еще один вид улик, который содержит неорганические соединения в виде пигментов или наполнителей. Красные, желтые и белые пигменты краски имеют неорганическую природу. Как и в случае со стеклом, XRD (рентгеновская дифракция) и EDX вместе используются для изучения
неорганическое содержимое чешуек или пятен краски.Они сравниваются с эталонными красками или сравнительными образцами.

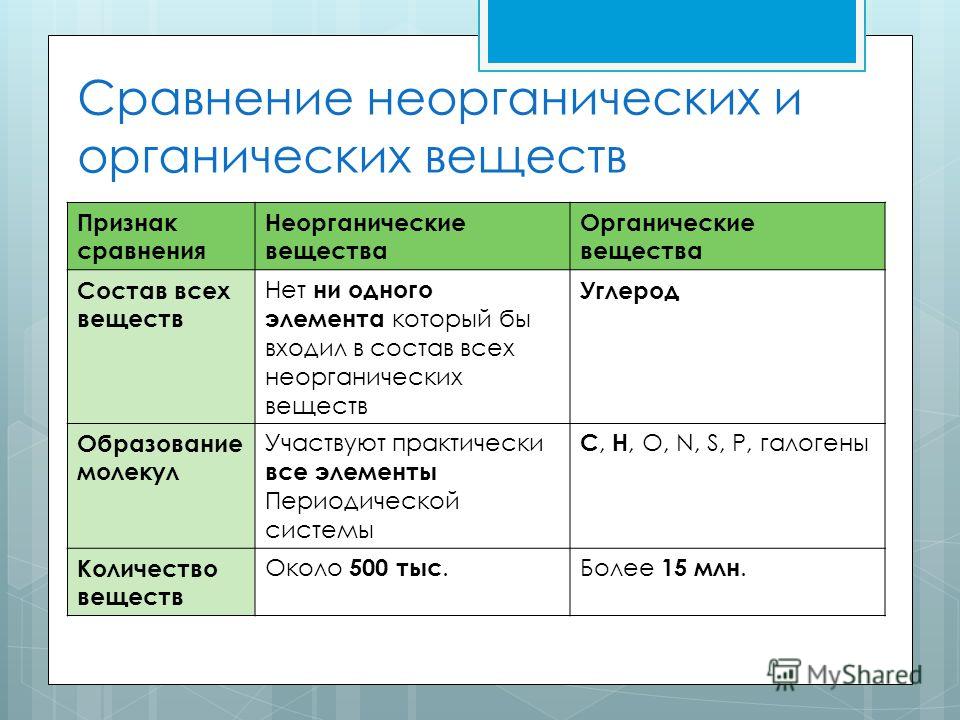 Подходы включают исследование синтетических моделей реактивности, биофизические и механистические исследования природных металлоферментов и рациональный дизайн металлопротеинов. Группа Caradonna исследует химию фенилаланингидроксилазы (ПАУ), негемовой железо-птерин-зависимой монооксигеназы, которая катализирует превращение фенилаланина в тирозин. Дефекты ЛАГ, вызывающие классическую фенилкетонурию (ФКУ), повышают концентрацию фенилаланина в сыворотке крови и приводят к аномальному накоплению продуктов метаболизма на основе фенилаланина.Эти продукты вызывают нарушение миелинизации центральной нервной системы и приводят к послеродовому повреждению головного мозга и тяжелой умственной отсталости. ФКУ является наиболее распространенной врожденной аномалией метаболизма аминокислот, имеющей клиническое значение (1 из 50 человек является носителем признака болезни, при средней частоте 1 на 10 000 для представителей европеоидной расы). Негемовый железо-активный центр ПАУ представляет дополнительный интерес, поскольку он выполняет тот же спектр химических превращений, что и цитохром Р450, без использования простетической группы гема.
Подходы включают исследование синтетических моделей реактивности, биофизические и механистические исследования природных металлоферментов и рациональный дизайн металлопротеинов. Группа Caradonna исследует химию фенилаланингидроксилазы (ПАУ), негемовой железо-птерин-зависимой монооксигеназы, которая катализирует превращение фенилаланина в тирозин. Дефекты ЛАГ, вызывающие классическую фенилкетонурию (ФКУ), повышают концентрацию фенилаланина в сыворотке крови и приводят к аномальному накоплению продуктов метаболизма на основе фенилаланина.Эти продукты вызывают нарушение миелинизации центральной нервной системы и приводят к послеродовому повреждению головного мозга и тяжелой умственной отсталости. ФКУ является наиболее распространенной врожденной аномалией метаболизма аминокислот, имеющей клиническое значение (1 из 50 человек является носителем признака болезни, при средней частоте 1 на 10 000 для представителей европеоидной расы). Негемовый железо-активный центр ПАУ представляет дополнительный интерес, поскольку он выполняет тот же спектр химических превращений, что и цитохром Р450, без использования простетической группы гема. Группа использует различные ферментативные механистические, молекулярно-биологические и биофизические методы для исследования механизма как фермента дикого типа, так и отдельных мутантов, вызывающих ФКУ у людей.
Группа использует различные ферментативные механистические, молекулярно-биологические и биофизические методы для исследования механизма как фермента дикого типа, так и отдельных мутантов, вызывающих ФКУ у людей. Их цель состоит в том, чтобы использовать строительные блоки на основе переходных металлов для сборки анизотропных систем, сочетание которых приведет к получению стабильных, перерабатываемых материалов со значительным переносом заряда.Эти материалы представляют большой интерес для ответа на фундаментальные вопросы об одномерном переносе заряда и обладают огромным потенциалом в наноэлектронике в виде нанопроводов.
Их цель состоит в том, чтобы использовать строительные блоки на основе переходных металлов для сборки анизотропных систем, сочетание которых приведет к получению стабильных, перерабатываемых материалов со значительным переносом заряда.Эти материалы представляют большой интерес для ответа на фундаментальные вопросы об одномерном переносе заряда и обладают огромным потенциалом в наноэлектронике в виде нанопроводов.
 Были предприняты попытки включить номера CAS как для гидратированных химических соединений, так и для их исходных безводных соединений
Были предприняты попытки включить номера CAS как для гидратированных химических соединений, так и для их исходных безводных соединений Полностью переработанное второе издание включает новые данные о неорганических оптических материалах, неорганических веществах для обнаружения излучения, термохромных соединениях, пьезохромных соединениях, катализаторах, сверхпроводниках и люминесцентных (флуоресцентных и фосфоресцирующих) неорганических веществах.
Полностью переработанное второе издание включает новые данные о неорганических оптических материалах, неорганических веществах для обнаружения излучения, термохромных соединениях, пьезохромных соединениях, катализаторах, сверхпроводниках и люминесцентных (флуоресцентных и фосфоресцирующих) неорганических веществах.
