Кремниевая кислота и её соли — урок. Химия, 8–9 класс.
Кремниевая кислота h3SiO3 — очень слабая, нерастворимая в воде кислота. Её получают в виде студенистого осадка при действии сильных кислот на растворы силикатов:
Na2SiO3+2HCl=h3SiO3↓+2NaCl.
Кремниевая кислота настолько слабая, что её можно вытеснить из солей даже угольной кислотой:
Na2SiO3+h3O+CO2=h3SiO3↓+Na2CO3.
Силикат натрия + соляная кислота
Гелеобразный осадок кремниевой кислоты через некоторое время загустевает и заполняет весь объём сосуда.
Загустевший осадок кремниевой кислоты
Особенности свойств кремниевой кислоты объясняются её строением. Кремниевая кислота не имеет постоянного состава, поэтому вместо формулы h3SiO3 иногда используют запись SiO2⋅nh3O. Кислота имеет полимерное строение:
Кремниевая кислота неустойчивая и при длительном хранении или повышенной температуре разлагается на воду и оксид кремния(\(IV\)):
h3SiO3=h3O+SiO2.
Oксид кремния(\(IV\)) образуется в виде пористого твёрдого вещества — силикагеля.
Кремниевая кислота не растворяется в воде, не диссоциирует, не изменяет окраску индикаторов. Как все кислоты, она реагирует с основными и амфотерными оксидами и гидроксидами. В результате реакций образуются соли силикаты (Na2SiO3, CaSiO3).
Из силикатов растворимы только соли щелочных металлов, и их называют растворимым или жидким стеклом. Силикаты натрия и калия входят в состав силикатного клея.
Концентрированные растворы этих солей используются для пропитки деревянных изделий и тканей с целью придания им огнеупорных свойств. При высыхании силикаты образуют стеклоподобный слой, который не пропускает воду, поэтому применяются и в качестве водоотталкивающих покрытий.
При высыхании силикаты образуют стеклоподобный слой, который не пропускает воду, поэтому применяются и в качестве водоотталкивающих покрытий.
В природе встречаются силикаты и алюмосиликаты. К ним относятся гранит, слюда, асбест, глина. Это доступное сырьё давно освоено человеком и широко используется в строительстве.
Глина легко формуется, при спекании становится твёрдой, поэтому она нашла применение для изготовления керамических изделий.
Глиняная посуда
Фарфоровая посуда
Кирпич керамический
При нагревании глины с известняком получают важнейший строительный материал — цемент.
Цемент
Кремниевая кислота: получение и свойства
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 4KOH → K2SiO3 + 4H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты
— это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
помогите пожалуйста написать нахождение в природе, физические и химические свойства,
Ответ:
Кремний может образовывать несколько кислот, но все они называются кремниевыми кислотами. Они могут иметь разное расположение атомов в молекуле и разные химические формулы: h3Si2F2, h5SiO4 и др. Чаще всего состав кремниевой кислоты обозначается формулой h3SiO3.
Получение.
Так как диоксид кремния с водой не взаимодействует, то кремниевая кислота получается косвенным путем — взаимодействием растворимых силикатов щелочных металлов с кислотами:
Na2SiO3 + 2 HCl => 2NaCl + h3SiO3
Физические свойства.
В момент получения это прозрачное студневидное вещество, практически нерастворимое в воде. Такой студень имеет и другое название — гель.
Химические свойства.
Кремниевая кислота — самая слабая из минеральных кислот, она почти не диссоциирует в растворах, не окрашивает индикаторов.
1. При нагревании она разлагается на диоксид и воду:
h3SiO3 => h3O + SiO2
2. Взаимодействует с растворами щелочей, образуя соли-силикаты:
h3SiO3 + 2NaOH => Na2SiO3 + 2h3O
Применение.
Гель кремниевой кислоты можно высушить, он при этом приобретает пористое строение с большой внутренней поверхностью, способной поглощать (адсорбировать) пары воды и многих органических веществ. Поэтому силикагель используется для осушения газов, разделения смесей. Он может быть и носителем мелко раздробленных катализаторов — это считается одним из важнейших его качеств. Кроме того, и сам силикагель может быть катализатором. Выпускаются и силикагели специального назначения: индикаторы влажности, гели для холодильников и др.
Он может быть и носителем мелко раздробленных катализаторов — это считается одним из важнейших его качеств. Кроме того, и сам силикагель может быть катализатором. Выпускаются и силикагели специального назначения: индикаторы влажности, гели для холодильников и др.
Кремниевую кислоту легко получить в домашних условиях. Для этого в пробирку нужно налить вдвое разбавленный силикатный клей — раствор силиката натрия или калия, а потом добавить к нему при перемешивании раствор соляной или серной кислоты. Жидкость на глазах начнет превращаться в прозрачный густой студень. Если перевернуть пробирку, то из него выльется жидкость — раствор полученной соли, а сама кремниевая кислота останется в пробирке, и ее можно будет внимательно рассмотреть.
Это интересно!
Ряд лекарственных растений, например хвощ полевой и подорожник ланцетный, берут кремниевую кислоту из почвы, перерабатывают и накапливают ее в своих клетках и клеточных мембранах. Кремниевая кислота — неотъемлемая составляющая человеческого организма, особенно важная для соединительных тканей, кожи, связок, сухожилий, волос и ногтей. Растения, богатые кремниевой кислотой, применяются особенно в тех случаях, когда организм испытывает острую нехватку кремниевой кислоты из-за недостаточного поступления ее с пищей, снижения усвоения ее организмом в связи с нарушением обмена веществ или при процессах износа и стирания тканей по причине болезни, преклонного возраста или усиленных занятий спортом. Кремниевая кислота полезна также людям, страдающим природной конституционной слабостью соединительных тканей, что является одной из причин варикозного расширения вен и целлюлита.
Растения, богатые кремниевой кислотой, применяются особенно в тех случаях, когда организм испытывает острую нехватку кремниевой кислоты из-за недостаточного поступления ее с пищей, снижения усвоения ее организмом в связи с нарушением обмена веществ или при процессах износа и стирания тканей по причине болезни, преклонного возраста или усиленных занятий спортом. Кремниевая кислота полезна также людям, страдающим природной конституционной слабостью соединительных тканей, что является одной из причин варикозного расширения вен и целлюлита.
Объяснение:
Кислоты Получение и свойства
Давая определение понятию «кислота»,
стремятся подчеркнуть самое важное в
свойствах молекул этого класса
соединений. Более старое
определение было таким: «Кислота —
это такое сложное вещество, атомы
водорода в котором способны
замещаться на металл, давая соль». На
основе теории электролетической
диссоциации кислоту можно
определить как сложное вещество,
молекулы которого в растворе
диссоциируют на ионы водорода и
анионы кислотного остатка.
На
основе теории электролетической
диссоциации кислоту можно
определить как сложное вещество,
молекулы которого в растворе
диссоциируют на ионы водорода и
анионы кислотного остатка.
Кислоты подразделяют на бескислородные (HBr, h3S) и кислородосодержащие (HNO3, h3O2). Еще кислоты делят на одно-, двух-, трехосновные, по числу атомов водорода, способных замещаться на металл. Номенклатура кислот будет рассматриваться при изучении химии конкретных элементов.
Получение
1. Растворением некоторых активных неметаллов в воде:
Cl2 + h3O = HCl + HOCl .
2. Синтезом из простых веществ:
h3 + Cl2 = 2HCl, h3 + S = h3S.
3. Растворением кислотных оксидов в воде:
P2O5 + 3h3O = 2h4PO4.
4. Окислением кислот:
2HNO2 + O2 = 2 HNO3.
5. Реакцией обмена — кислота + соль:
Ba(NO3)2 + h3SO4 = BaSO4 + 2HNO3, Na2SiO3 + 2HCl = 2 NaCl + h3SiO3,
KNO3 + h3SO4
KHSO4 + HNO3.
Свойства
1. Диссоциируют на ионы растворенной в воде части кислот:
h3SiO3 = HSiO3- + H+ = SiO32- + 2H+.
2. Взаимодействуют с металлами и металло-неметаллами:
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2+ 2h3O,
2Al + 6HCl = 2AlCl3 + 3h3.
3. Вступают в реакцию нейтрализации:
HBr + KOH = KBr + h3O,
3HNO3 + Cr(OH)3 = Cr(NO3)3 + 3h3O.
4. Вытесняют более слабые или более летучие кислоты из солей:
Na2CO3 + 2HCl = 2NaCl + CO2 + h3O,
NaCl + h3SO4(конц) =NaHSO4 + HCl.
5. Реагируют с кислыми и основными солями:
Mg(OH)Cl + HCl = MgCl2 + h3O,
NaHCO3 + h3SO4 = NaHSO4 + CO2 + h3O.
6. Подвергаются разложению при нагревании:
h3SiO3 = SiO2 + h3O.
Характерные химические свойства углерода и кремния
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметалламиПри обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 оС:
С бромом – 620-700 оС:
С йодом – 750-810 оС:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Реакция сопровождается выделением водорода:
Разработка урока по химии в 9 классе «Кремний и его соединения»
Разработка урока по химии в 9 классе
Тема: Кремний и его соединения
Тип урока: лекция (включает элементы беседы и лабораторный опыт)
Цели урока:
— дать общую характеристику кремния;
— рассмотреть природные соединения кремния;
— провести сравнительный анализ с соединениями углерода;
— изучить свойства кремния и его соединений: Sih5, SiO2, h3SiO3.
Оборудование: презентация к уроку, реактивы: раствор соляной кислоты, раствор карбоната натрия, раствор силикатного клея; штативы с пробирками; образцы природных соединений кремния ( гранит, горный хрусталь, кварц и др.), образцы изделий из стекла, фаянса, фарфора, керамики.
Ход урока:
1. Вводная часть (слайды 1,2,3)
— Сегодня мы познакомимся с ещё одним неметаллом, значимость которого очень велика, т. к. по распространенности на Земле он второй после кислорода, — это кремний.
к. по распространенности на Земле он второй после кислорода, — это кремний.
2. Открытие кремния (слайд 4)
(материал по этому вопросу может быть подготовлен и освещён учащимися)
— Уже в глубокой древности люди широко использовали в своём быту соединения кремния. Вспомните древних людей. Из чего были изготовлены их орудия труда? Но сам кремний впервые был получен в 1824 г. Шведским химиком И.Я. Берцелиусом. Однако, за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями.
Латинское название «силициум» берёт своё начало от латинского «силекс» — камень. С греческого языка «кремнос» — утёс, скала.
3. нахождение в природе (слайды 5,6,7,8,9)
(материал по этому вопросу может быть подготовлен и освещён учащимися)
(слайд 5)
— Земная кора на одну четверть состоит из соединений кремния. Наиболее распространённым является оксид кремния (IV) – кремнезём. В природе он образует минерал кварц и многие другие разновидности:горный хрусталь, аметист, агат, опал, яшма, халцедон, сердолик (полудрагоценные камни), а также обычный кварцевый песок (слайд 6).
Именно кремень положил начало каменному веку. Причин этому две: доступность и распространённость, а также способность образовывать на сколе острые режущие края.
Второй тип природных соединений кремния – силикаты. Самые распространённые алюмосиликаты: гранит, различные виды глин, слюды (слайд 7)
Не содержащий алюминия силикат – асбест ( из него изготавливают огнестойкие ткани)
Оксид кремния (IV) необходим и растениям, и животным. Он придаёт прочность стеблям растений и покровам животных ( камыши твёрдо стоят, осока режет, как лезвие, чешуя рыб, панцири насекомых, крылья бабочек, перья птиц, шерсть животных содержат оксид кремния (IV). ( слайд 8)
Кремний придаёт гладкость и прочность костям человека, входит в состав низших живых организмов – диатомовых водорослей и радиолярий (образует их скелеты) ( слайд 9)
4. Строение и свойства атомов (слайд 10)
(в сравнении с углеродом)
1 ученик у доски: характеристика положения кремния в таблице химических элементов
Д. И. Менделеева, возможные степени окисления, построение электронной формулы атома кремния.
И. Менделеева, возможные степени окисления, построение электронной формулы атома кремния.
2 ученик: характеристика положения углерода в таблице химических элементов
Д.И. Менделеева, возможные степени окисления, построение электронной формулы атома углерода.
(слайд 11)
3 ученик делает обобщение:
-У кремния электроны расположены на трёх энергетических уровнях, а у углерода – на двух, следовательно, окислительные (неметаллические) свойства у кремния выражены слабее, а восстановительные (металлические) – сильнее.
— 4e—
Si Si + O2 (CI,C) Si+4
восстановитель
+4e—
Si Si + металл Si -4
окислитель
5. Физические свойства (слайд 12)
(материал по этому вопросу может быть подготовлен и освещён учащимися)
— Вы обратили внимание, что когда мы говорим о содержании в природных условиях элемента кремния, то упоминаем только его соединения, но не простое вещество.
Кремний в свободном виде в природе не встречается в отличие от углерода (алмаз,
графит, аморфный С и т. Кристаллический кремний – серовато-стального цвета с металлическим блеском, твёрдый (7 баллов по шкале Мооса), но хрупкий, малореакционноспособный; полупроводник, (с повышением температуры электропроводность повышается), и с нарушением правильности структуры.
Кристаллический кремний – серовато-стального цвета с металлическим блеском, твёрдый (7 баллов по шкале Мооса), но хрупкий, малореакционноспособный; полупроводник, (с повышением температуры электропроводность повышается), и с нарушением правильности структуры.
Такие свойства обусловлены строением кристаллов, аналогичным структуре алмаза.
Физические константы: g = 2,33 г/см3; t пл.= 1415 0С; t кип.= 3500 0С
Аморфный кремний представляет собой белый порошок.
6. получение кремния (слайд 13)
— Способы получения кремния основаны в основном на восстановлении оксида кремния (IV) сильными восстановителями – активными металлами (Mg, Al) и углеродом.
Лабораторный способ: SiO2 + 2Mg = 2MgO + Si
Промышленный способ:
1900oC
SiO2 + 2C 2CO + Si
SiCi4 + 2Zn = 2ZnCi2 + Si
7. Химические свойства (слайд 14)
а) кремний — восстановитель
Все реакции протекают при нагревании!
Si + O2 = SiO2 (оксид кремния (IV))
Si0 – 4e- Si+4 восстановитель
O2 + 4e- 2O-2 окислитель
Si + 2Cl2 = SiCl4 (хлорид кремния)
Si + 2S = SiS2 (сульфид кремния)
20000C
Si + C Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу)
Si + 2h3O(пар) = SiO2 + h3
Si + 2NaOH(конц. ) + h3O = Na2SiO3 + 2h3
) + h3O = Na2SiO3 + 2h3
б) кремний – окислитель
Si + 2Ca = Ca2Si (силицид кальция)
Вывод: свойства кремния и углерода похожи. Оба неметалла взаимодействуют с кислородом, галогенами, серой, металлами. Но в отличие от углерода кремний напрямую не соединяется с водородом.
8. Соединения кремния
Свойства кремнезёма (слайд15,16)
Учитель подробно рассматривает свойства оксида кремния (IV) и проводит сравнительный анализ двух оксидов – SiO2 и CO2. результаты обсуждения в виде таблицы выводятся на экран.
Обратите внимание на одно важное свойство оксида кремния:
SiO2 + 4HF = 2h3O + SiF4
Оксид кремния входит в состав стекла, поэтому плавиковую кислоту нельзя хранить в стеклянной посуде.
Вывод: физические свойства оксидов резко отличаются, т.к. они образуют разные кристаллические решётки – молекулярную (CO2) и атомную (SiO2), но химические свойства схожи. Отличие состоит в различном отношении к воде.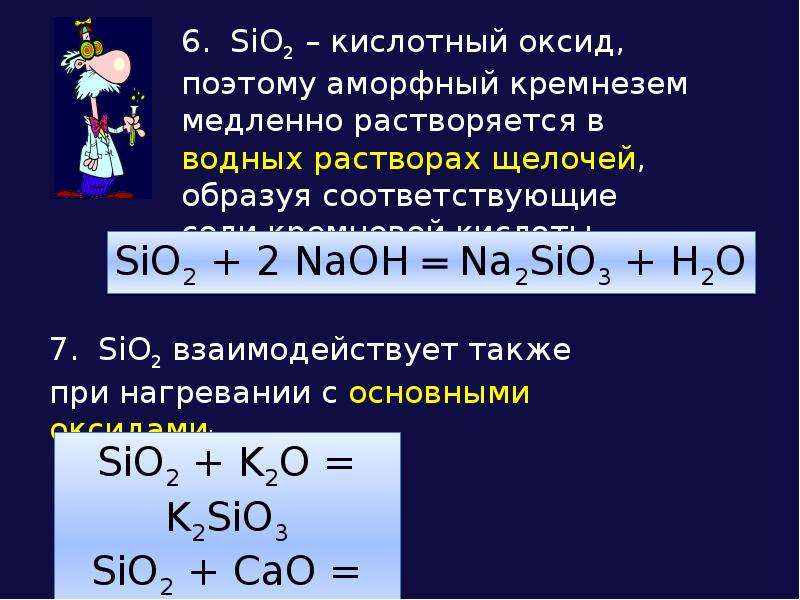 Кремниевая кислота и её соли (слайд 18)
Кремниевая кислота и её соли (слайд 18)
-кремниевая кислота H2SiO3 —единственная нерастворимая неорганическая кислота, — двухосновная,
— слабая h3SiO3 h3O +SiO2
При высыхании образует силикагель, используемый в качестве адсорбента.
Получить кремниевую кислоту можно только из её солей.
Проведение лабораторного опыта и составление уравнения реакции получения кремниевой кислоты (самостоятельно, на доске)
Na2SiO3 + 2HCl = 2NaCl + h3SiO3
SiO32- + 2Н+ = h3SiO3
Соли кремниевой кислоты называют силикатами (слайд 19).
Их можно получить сплавлением оксида кремния с оксидами металлов или карбонатами:
SiO2 + CaO = CaSiO3
SiO2 + CaCO3 = CaSiO3 + CO2
9. Применение соединений кремния в народном хозяйстве (слайды 20,21,22)
10. Заключительные выводы (слайд 23)
Кремний | Презентация к уроку по химии (9 класс) на тему:
Подписи к слайдам:
Кремень –камень1824г. Я. Берцелиус
Я. Берцелиус
Учитель химии Галяутдинова Д.А.МОБУ СОШ с. Ермекеево
Расположение в системе и строение атома
Si — элемент №14, 3 период, IV А группа, Ar(Si)=28.1s22s22p63s23p23d0 – стационарное состояние1s22s22p63s13p33d0 – возбуждённое состояние
3s
3p
3d
3s
3p
3d
Возможные степени окисления: -4; 0; +2; +4
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фторид кремния SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень).
Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др.-греч. κρημνός — «утес, гора».
Отделочные камни
Яшма
Агат
Физические свойства
Кристаллический кремнийТёмно-серого цвета, имеет металлический блеск, полупроводниковые свойстваХимически инертен. Плотность 2,33 г/см3Температура плавления = 1415⁰С
Аморфный кремнийБурый порошокБолее активен, чем кристаллическийАлмазоподобная структураПлотность 2 г/см3
Кремний
Химические свойства
Si + 2F2 → SiF4 (фторид кремния)Si + 2Cl2 → SiCl4 (хлорид кремния)
Типичный неметалл, инертен. Реагирует с сильными окислителями или восстановителями при очень высокой температуре.
Si + O2 → SiO2 (оксид кремния)
Кремний сгорает в кислороде
Кремний взаимодействует с азотом и углеродом
Si + C → SiС (карборунд)
3Si + 2N2 → Si3N4 (нитрид кремния)
Кремний растворяется в щелочах при нагревании
Si + 2NaOH + h3O → Na2SiO3 + 2h3↑
Как восстановитель
С водородом не взаимодействует
Si + h3 →
Взаимодействует с галогенами
∆
∆
∆
∆
∆
Применение кремния
ఁ」ӆҲ␆У”Ђǻї䄄섅ĿƿǀࠀNj㆜ǿ̿쎀쎁οmotherb_1Рисунок 10motherb_1.jpg开敲獬ⸯ敲獬콬櫁ッ،ﯠ瑠鑟僮裆寓힡㻒놀쒕똬撌柭橺軇䤿괧⍦죑싙僁ᳶ鹢尭윯ྷ娰ᙌꑮᡰ彟㎆꺭邶넮榨噊䬋儓䋽槉藇魲ⱌ헉쩖얌⿹ğ牟汥⽳爮汥偳ŋⴂ᐀ࠀ℀嬀범윹ༀ܀搀獲搯睯牮癥砮汭䭐·˻%ٔრ,န$܀䐄ఁ」H␇ఀѓ0ƁࠀƃࠀƓ龎‹Ɣ뷞hƿǿ̄̿
Оксид кремния (IV)
SiO2
Химическая связь
ковалентная полярная
Кристаллическая решетка
атомная
Оксид кремния (IV) – кварц Кварц — один из самых распространённых минералов в земной коре12% земной коры состоит из кварца
Разновидности кварца: бесцветный, розовый, «волоса-тик», сердолик, агат, «тигровый глаз».
Химические свойства оксида кремния (IV)
Оксид кремния (IV) является оксидом:
кислотным
Оксид кремния (IV), как типичный оксид, способен реагировать с:
кислотный
1. основными оксидами.
2. щелочами.
Составьте уравнения реакций оксида кремния (IV) с оксидом кальция, гидроксидом натрия:
SiO2 + CaO = CaSiO3
SiO2 + 2NaOH = Na2SiO3 + h3O
SiO2 + 2Na2CO3 = Na2SiO3 + CO2
Оксид кремния (IV) сплавляется с карбонатами щелочных металлов,также образуя силикаты:
Оксид кремния (IV) взаимодействует с плавиковой кислотой
SIO2 + 6HF = h3[SiF6] + 2h3O
Применение оксида кремния (IV)
Оксид кремния (IV) применяют:
для получения кремния
как наполнитель в производстве резин
в производстве стекла, керамики, абразивов,
при производстве кремнезёмистых огнеупоров
в хроматографии
Кристаллы кварца используются:
в радиотехнике,
ультразвуковых установках,
в зажигалках.
Аморфный непористый оксид кремния (IV) применяется: в пищевой промышленности в качестве вспомогательного вещества E551,препятствующего слёживанию и комкованию,
парафармацевтике (зубные пасты),
в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство фармакопей),
пищевой добавки или лекарственного препарата в качестве энтеросорбента.
Искусственно полученные плёнки оксид кремния (IV) используются в качествеизолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей используется чистый плавленый оксид кремния (IV) с добавкой в него некоторых специальных ингредиентов
1
2
3
4
5
6
7
8
9
стекло
керамика
абразивы
Ультрозвуковые установки
Радиотехника
Зажигалки
Е551
Зубная паста
Кремниевая кислота. Силикаты
nSiO2 ∙ mh3O поликремниевые кислоты
N = 1, m = 1 SiO2 ∙ h3O или h3SiO3 – кремниевая кислота. Слабая, непрочная, в воде малорастворима (образует коллоидный раствор), нет кислого вкуса.
При нагревании разлагается h3SiO3 → h3O + SiO2Со щелочамиh3SiO3 +2NaOH → 2h3O + Na2SiO3
Na2SiO3 и K2SiO3 – жидкое стекло
Получение: Na2SiO3 + 2HCl → 2NaCl + h3SiO3
Студенистый осадок
Свойства:
Лабораторный опыт
Испытание раствора силиката натрия индикатором
Добавьте к выданному раствору силиката натрия одну каплю фенол-фталиина. О чем свидетельствует появление окраски?Какую среду имеет раствор? Чем это вызвано?Напишите уравнение полного гидролиза.
Na2SiO3 → 2Na+ + SiO32–
SiO32– + h3O ↔ HSiO3– + OH–
Na2SiO3+ h3O ↔ NaHSiO3 + NaOH
1 ступень
HSiO3– + h3O = ↓h3SiO3 + OH–
SiO32– + 2Na+ + h3O ↔ Na+ + HSiO3– + Na+ +OH–
HSiO3– + Na+ + h3O = ↓h3SiO3– + Na+ +OH–
NaSiO3 + h3O = ↓h3SiO3 + NaOH
2 ступень
Силикатная промышленность
Соединения кремния служат основой для производства керамики, стекла, цемента, фарфора, силикатного кирпича, т.е. всех тех материалов, которые составляют основу силикатной промышленности
Керамика
Керамика (др.-греч.κέραμος — глина) — изделия из неорганических, неметаллических материалов (например, глины) и их смесей с минеральными добавками, изготовляемые под воздействием высокойтемпературы с последующим охлаждением. В узком смысле слово керамика обозначает глину прошедшую обжиг. Самая ранняя керамика использовалась как посуда из глины или из смесей её с другими материалами. В настоящее время керамика применяется как индустриальный материал (машиностроение, приборостроение, авиационная промышленность и др.), как строительный, художественный, как материал, широко используемый в медицине.
Фарфо́р (тур. farfur, fagfur, от перс. фегфур) — вид керамики, непроницаемый для воды и газа. В тонком слое просвечивающийся.Фарфор обладает высокой механической прочностью, химической и термической стойкостью, электроизоляционными свойствами и применяется для изготовления высококачественной посуды, художественно-декоративных и санитарно-технических изделий, электро- и радиотехнических деталей, коррозионностойких аппаратов химической технологии, низкочастотных изоляторов и т. д. Фарфор обычно получают высокотемпературным обжигом тонкодисперсной смеси каолина, полевого шпата, кварца и пластичной глины.
Основные виды тонкой керамики – фарфор, полуфарфор, фаянс, майолика
Фаянс (фр. faience, от названия итальянского города Фаэнца, где производился фаянс), керамические изделия (облицовочные плитки, архитектурные детали, посуда, умывальники и др.), имеющие плотный мелкопористый черепок (обычно белый), покрытые прозрачной или глухой (непрозрачной) глазурью. Для изготовления фаянса применяются те же материалы, что и для производства фарфора (меняется лишь соотношение компонентов), и сходная технология (различия в режиме обжига)
Майолика (от итал. Maiolica — Мальорка) — разновидность керамики, изготавливаемой из обожжённой глины с использованием расписной глазури. В технике майолики изготовляются как декоративные панно, наличники, изразцы и т. п., так и посуда и даже монументальные скульптурные изображения.
Силикатный кирпич (белый) — кирпич, состоящий из кварцевого песка и извести.
Цветной силикатный кирпич
Цветной силикатный камень используют для облицовки зданий
Кремниевая кислота (h3SiO3), кальциевая соль (1: 1)
Кремниевая кислота (h3SiO3), кальциевая соль (1: 1) Свойства
- Точка плавления:
- 1540 ° С
- Плотность
- 2,905
- форма
- Порошок
- Удельный вес
- 2.905
- цвет
- Белый
- Растворимость в воде
- Не растворим в воде.
- Мерк
- 14,1702
- Константа произведения растворимости (Ksp)
- упаковок: 7,6
- Ссылка на базу данных CAS
- 10101-39-0
- Добавки косвенного действия, используемые в веществах, контактирующих с пищевыми продуктами
- МЕТАСИЛИКАТ КАЛЬЦИЯ
- Система регистрации веществ EPA
- Метасиликат кальция (10101-39-0)
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
Кремниевая кислота (h3SiO3), кальциевая соль (1: 1) цена Подробнее (8)
| Производитель | Номер товара | Описание продукта | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | 372668 | силикат кальция 200 меш, 99% | 10101-39-0 | 50 г | 86 долларов.7 | 2020-08-18 | Купить |
| Сигма-Олдрич | 372668 | силикат кальция 200 меш, 99% | 10101-39-0 | 250 г | 299 долл. США | 2020-08-18 | Купить |
| Альфа Эзар | 035843 | Силикат кальция, мета, 99% (мет. Прим.) | 10101-39-0 | 100 г | 37 долларов.8 | 2020-06-24 | Купить |
| Альфа Эзар | 035843 | Силикат кальция, мета, 99% (мет. Прим.) | 10101-39-0 | 25 г | 43,2 долл. США | 2020-06-24 | Купить |
| Альфа Эзар | 035843 | Силикат кальция, мета, 99% (мет. Прим.) | 10101-39-0 | 500 г | 66 долларов.1 | 2020-06-24 | Купить |
Кремниевая кислота (h3SiO3), кальциевая соль (1: 1) Поставщики
Глобальные (23) Поставщики Китай 12 Германия 1 Швейцария 1 Великобритания 1 США 8 В мире 23
10101-39-0 (Кремниевая кислота (h3SiO3), кальциевая соль (1: 1)) Поиск по теме:
- КРЕМНИЕВАЯ КИСЛОТА КАЛЬЦИЕВАЯ СОЛЬ
- Ванфре Ил-2
- VANSIL W-20
- VANSIL W30
- VANSIL (R) G
- VANSIL (R) W10
- VANSIL W-10
- СИЛИКАТ КАЛЬЦИЯ, МЕТА
- КАЛЬЦИЯ СИЛИКАТ, ORTHO
- CALFLO E
- КАЛЬЦИЙ-М-СИЛИКАТ
- бейсикалк
- бета-силикат кальция
- г.i.77230
- г.i.pigmentwhite28
- кальций-кремнийоксид
- cs (цементный компонент)
- Флорит
- Кремний оксид кальция
- Силикат кальция 99%
- силикат кальция, мета, химическая чистота
- Силикат кальция, мета, 99% (мет. Прим.)
- метасиликат кальция, оксид кальция и кремния, кремний оксид кальция
- kemolitasb8k
- пигмент белый 28
- кремниевая кислота (h3sio3), кальциевая соль (1: 1)
- Кремниевая кислота, кальциевая соль (1: 1)
- КАЛЮЦИЙ СИЛИКАТНЫЙ ПОРОШОК
- НАНОПОРОШОК СИЛИКАТ КАЛЬЦИЯ 99.0%
- СИЛИКАТ КАЛЬЦИЯ, -200 MESH, 99%
- Кремниевая кислота (h3SiO3), кальциевая соль (1: 1) ISO 9001 : 2015 REACH
- 10101-39-0
- Неорганические соли
- Синтетические реагенты
- Неорганические вещества
кремниевая кислота (h3SiO3), литиевая соль алюминия (2: 1: 1), 12068-40-5
кремниевая кислота (h3SiO3), литиевая соль алюминия (2: 1: 1), 12068-40-5Спонсоры поставщиков
Категория: пищевые добавки непрямого действия: клеи и компоненты покрытий США / ЕС / FDA / JECFA / FEMA / FLAVIS / Ученый / Патентная информация: Физические свойства:
Органолептические свойства:
Косметическая информация: Поставщиков: Информация по безопасности:
Информация о безопасности использования:
Ссылки по безопасности:
Артикулы: Другая информация: Примечание о потенциальных блендерах и основных компонентахВозможное использование: Возникновение (природа, еда, прочее): примечание.Синонимов:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Статей:
Не найдено
Система реестров | Агентство по охране окружающей среды США
Для получения дополнительной информации о веществе вы можете щелкнуть одну из ссылок ниже, чтобы перейти в соответствующий раздел:
Программа и нормативная информация
Устав / РегламентНиже приведены приложения / системы EPA, законодательные акты / правила или другие источники, которые отслеживают или регулируют это вещество.В этой таблице показано, как каждый список относится к веществу. Чтобы просмотреть дополнительные метаданные о конкретном синониме, щелкните синоним.
Синонимов этого типа нет.Приложения / системы Агентства по охране окружающей среды
Ниже приведены приложения / системы EPA, законодательные акты / правила или другие источники, которые отслеживают или регулируют это вещество. В этой таблице показано, как каждый список относится к веществу. Чтобы просмотреть дополнительные метаданные о конкретном синониме, щелкните синоним.
Синонимов этого типа нет.Другие источники
Ниже приведены приложения / системы EPA, законодательные акты / правила или другие источники, которые отслеживают или регулируют это вещество. В этой таблице показано, как каждый список относится к веществу. Чтобы просмотреть дополнительные метаданные о конкретном синониме, щелкните синоним.
Синонимов этого типа нет. Специальный список
Синонимов этого типа нет.
Дополнительные синонимы
Синонимов этого типа нет.
Начало страницы
Родственные вещества
Это вещество не относится к другим веществам.
Начало страницы
Медицинская и другая научная информация
Следующий список содержит ссылки, относящиеся к выбранному веществу. Некоторые из следующих ссылок выходят с сайта EPA Выход.
Связанные ссылки на это вещество отсутствуют.
Начало страницы
404 Ошибка
Химикат не найден!
Искомое химическое вещество (кремниевая кислота% a0acid% a0% 28h3sio3% 29% 2c% a0disodium% a0salt% 2c% a0pentahydrate) не найдено в нашей базе данных. Воспользуйтесь нашим химическим каталогом, чтобы узнать, не указали ли мы его под немного другим написанием.
| /yogi/chemicals/cn/silicic%25a0acid%25a0%2528h3sio3%2529%252c%25a0disodium%25a0salt%252c%25a0pentahydrate.html |
| кремниевая кислота% a0acid% a0% 28h3sio3% 29% 2c% a0disodium% a0salt% 2c% a0pentahydrate |
Связанные ресурсы
- Таблица 49 CFR 172 USDOT по опасным материалам.101
Онлайн-версия списка опасных материалов USDOT из 49CFR 172.101. Эта таблица может быть отсортирована по надлежащему отгрузочному наименованию, идентификатору UN / NA и / или по классу / подразделению основной опасности.
- 2008 ERG (Руководство по реагированию на чрезвычайные ситуации)
Вы когда-нибудь задумывались, что означают эти четырехзначные числа на табличках на бортах грузовиков и железнодорожных вагонов? Наш онлайн-справочник 2008 ERG даст вам ответ. Это онлайн-версия руководства, разработанная Министерством транспорта США для оказания первой помощи на начальном этапе инцидента с опасными грузами / опасными веществами.Данные ERG последний раз проверены / обновлены 2 октября 2011 г.
- Табло для перевозки опасных материалов DOT США
Таблички с опасными материалами (DOT) необходимы при транспортировке опасных материалов в США, Канаде и Мексике. На этих страницах приведены определения Министерства транспорта США для каждого табло об опасности.
- Руководство по обращению с бытовой химией
Что вы можете сделать, чтобы сделать свой дом более безопасным.
- Молярность, моляльность и нормальность
Вводит стехиометрию и объясняет различия между молярностью, молярностью и нормальностью.
- Расчеты молярной массы и калькулятор Javascript
Расчеты молярной массы объяснены, и для помощи в расчетах имеется калькулятор JavaScript.
- Периодическая таблица элементов
Предоставляет исчерпывающие данные для каждого элемента периодической таблицы элементов, включая до 40 свойств, названия на 10 языках и общие химические соединения. Также предоставлена информация о 3600 нуклидах и 4400 модах распада нуклидов.
Примечание редактора: Некоторые химические вещества в этой базе данных содержат больше информации, чем другие, из-за первоначальной причины, по которой эта информация была собрана, и того, как составлялась компиляция.
Работая с паспортами безопасности материалов (MSDS), я обнаружил, что производители иногда используют неясные названия составляющих химикатов, и я не всегда имел хорошее представление о том, с чем имею дело. Чтобы решить эту проблему, на протяжении многих лет я скомпилировал химические названия и идентификаторы в личную базу данных, по возможности ссылаясь на нормативную информацию и информацию о безопасности для здоровья. Коллеги и друзья в конечном итоге начали предлагать мне разместить свои данные на этом веб-сайте, чтобы другие могли извлечь выгоду из моих усилий — что я, наконец, сделал в 2004 году.Чем более распространенным, регулируемым и / или опасным является химическое вещество, тем больше информации о нем я, скорее всего, смогу собрать.
Товарные знаки
Если вам известны какие-либо синонимы, перечисленные выше, которые являются зарегистрированными товарными знаками, свяжитесь с нами и предоставьте соответствующую информацию, чтобы можно было надлежащим образом отметить товарные знаки.
Примечания к смесям
Некоторые химические вещества, перечисленные в этой базе данных, или не чистые химические соединения, скорее, это смеси / растворы химикатов. Нередко широкий диапазон молярных соотношений смеси объединяется как «синонимы» одного и того же «химического вещества».В некоторых случаях химические вещества, которые очень похожи с точки зрения здоровья и безопасности и / или нормативных требований, также могут быть объединены в одну группу.
Справочные источники
Данные для этой базы данных были собраны из: сотен паспортов безопасности материалов (MSDS) общепромышленных и бытовых товаров; Таблицу опасных материалов из «Свода федеральных правил» США, заголовок 49, раздел 172.101; Карманный справочник по химическим опасностям Национального института охраны труда и здоровья; Руководства по реагированию на чрезвычайные ситуации DOT США 1996, 2000 и 2004 гг .; U.S. Национальная медицинская библиотека и многие другие ресурсы по теме.
Заявление об ограничении ответственности
ПРЕДУПРЕЖДЕНИЕ. Эти страницы предназначены только для общих справочных и образовательных целей и НЕ ДОЛЖНЫ использоваться в качестве единственного источника для определения соответствия нормативным требованиям или по вопросам жизни и здоровья. Этот сайт и автор не гарантируют и не гарантируют точность или достаточность предоставленной информации и не несут никакой ответственности за ее использование.
Чтобы обеспечить соответствие нормативным требованиям при транспортировке опасных материалов или опасных грузов, необходимо пройти соответствующее обучение и сертификацию у квалифицированного инструктора и ознакомиться с Кодексом федеральных нормативных актов текущего года, раздел 49 (49CFR) или правилами перевозки грузов вашей страны.По вопросам безопасности на рабочем месте обращайтесь к действующим правилам OSHA (29CFR) и руководствам NIOSH или правилам охраны труда и техники безопасности вашей страны. Никто не должен попадать в опасную среду без надлежащей подготовки квалифицированных инструкторов.
| 0 7699-41-4 Информация по безопасности
Global (48) Поставщики Все поставщики Китай (32) Индия (5) США (4) Италия (2) Великобритания (2) Финляндия (1) Япония (1) Люксембург (1)
|
Кремниевая кислота (h3SiO3), кадмиевая соль (1: 1)
Откуда эти опасности?
Опасности для здоровья и окружающей среды, перечисленные на этой странице, были связаны с этим веществом либо научным органом, таким как Агентство по охране окружающей среды США, либо токсикологом, использующим метод GreenScreen для более безопасной химии.
Все вещества имеют строку «Все опасности», в которой отображается информация об опасности, собранная HBN’s Pharos из научных списков опасностей. Уровни опасности определяются переводчиком списков GreenScreen для большинства списков и HBN для остальных. Если существует несколько списков для одной конечной точки, отображаемый уровень опасности является наивысшим для наиболее авторитетной категории списков. Пустая ячейка не обязательно означает отсутствие опасности, только то, что в настоящее время нет списка для этого химического вещества для этой конечной точки.См. Наш Обзор метода GreenScreen и описание системы Pharos Chemical and Material Library для получения дополнительной информации.
Что делает опасность высокой или низкой степенью достоверности и как это обозначается?
Уровню опасности для каждой конечной точки часто дается оценка достоверности.
Для списка опасностей:
- Жирный шрифт означает высокую степень достоверности Авторитетный список A
- Курсив означает список с более низким уровнем достоверности — авторитетный список B, список проверки A или список проверки B.
- Неформатированный текст означает, что список отсутствует в переводчике списков GreenScreen, поэтому ему не присвоен уровень достоверности
- Жирный шрифт означает высокую степень достоверности, либо из списка высокой достоверности, либо данных высокого качества для химического вещества или сильного аналога.
- Курсив означает, что уровень опасности для конечной точки основан на исследованиях с более низкой степенью достоверности, данных от слабого аналога, оценочных данных от подходящего аналога или списках с более низким уровнем достоверности.
Что такое оценка GreenScreen?
GreenScreen® для более безопасных химикатов — это метод оценки химической опасности, предназначенный для выявления наиболее опасных химикатов и более безопасных альтернатив. Если для этого вещества была опубликована оценка GreenScreen, она будет отображаться первой в сводной таблице опасностей. Уровни опасности для каждой конечной точки здоровья человека или окружающей среды назначаются токсикологом с использованием протокола GreenScreen. Когда доступна оценка GreenScreen, список опасностей не отображается, пока вы не нажмете «Показать сводку опасностей в списке» или не нажмете «Списки опасностей».Обратите внимание, что этот список опасностей может охватывать некоторые конечные точки, не учитываемые оценкой GreenScreen, такие как истощение озонового слоя и глобальное потепление.
Как просмотреть все списки опасностей, в которые входит данное химическое вещество?
Щелкните «Списки опасностей», чтобы просмотреть все списки опасностей, которые в настоящее время включают это вещество, составленные Pharos. Первоначально в этой таблице отображается только список с наивысшим уровнем опасности из наиболее авторитетного типа списка для каждой конечной точки.Если для конечной точки существует несколько списков опасностей, под «Еще» появится стрелка, чтобы отобразить их все.
Что означают звездочки в таблице списка опасностей?
Они указывают на то, что опасность присвоена, потому что химическое вещество является членом группы. В списках научной опасности иногда указывается химическая группа (например, соединения триметилолова) без CASRN. Для них Pharos создает список CASRN, соответствующих критериям группы. Наведите курсор на звездочку имени группы и щелкните звездочку, чтобы увидеть группу и ее определение.См. Проект «Население химического класса» для получения дополнительной информации о том, как определяются эти группы.
Как я могу узнать больше о списках опасности?
См. Описание системы библиотеки химических веществ и материалов. Кроме того, подписчики на библиотеку химикатов и материалов Pharos (20 долларов в месяц) могут перейти по ссылке Pharos на вкладке «Внешние ресурсы», чтобы более подробно ознакомиться со списками. Для подмножества химических веществ Pharos также предоставляет подписчикам информацию о том, что типы строительных материалов, в которых используется химикат, и возможные остатки.
(PDF) Селективное отделение шеелита от кальцита путем самосборки полимера h3SiO3 с использованием Al3 + во флотации Pb-BHA
Minerals 2019,9, 43 14 из 15
и Центр совместных инноваций для чистого и эффективного использования стратегического металла Минеральные ресурсы,
Ключевая лаборатория провинции Хунань по чистому и эффективному использованию стратегических кальцийсодержащих минералов
Ресурсы (№ 2018TP1002).
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Ссылки
1.
Li, C .; Лю, Ю. Селективная флотация шеелита из минералов кальция с олеатом натрия в качестве коллектора и
фосфатов в качестве модификаторов. II. Механизм взаимодействия фосфатных модификаторов с минералами.
Внутр. Дж. Майнер. Процесс. 1983,10, 219–235.
2.
Gao, Y .; Gao, Z .; Sun, W .; Ху, Ю. Селективная флотация шеелита из кальцита: новая схема реагентов. Int. J.
Шахтер. Процесс. 2016,154, 10–15.[CrossRef]
3.
Gao, Y .; Gao, Z .; Sun, W .; Инь, З .; Wang, J .; Hu, Y. Адсорбция новой схемы реагентов на шеелите и кальците
, вызывая эффективное флотационное разделение. J. Colloid Interface Sci.
2018
, 512, 39–46. [CrossRef] [PubMed]
4.
Han, H.S .; Hu, Y.H .; Sun, W .; Li, X.D .; Cao, C.G .; Liu, R.Q .; Юэ, Т .; Meng, X.S .; Guo, Y.Z .; Wang, J.J .; и другие.
Флотация жирных кислот в сравнении с флотацией минералов вольфрама в КНБК и их эффективность в практике флотации.
Внутр. Дж. Майнер. Процесс. 2017, 159, 22–29. [CrossRef]
5.
Li, C .; Гао, З. Влияние мелющих тел на свойства поверхности и флотирование частиц шеелита.
Порошок Technol. 2017, 322, 386–392. [CrossRef]
6.
Gao, Z .; Fan, R .; Ralston, J .; Sun, W .; Hu, Y. Поверхностные разорванные связи: эффективный способ оценки поведения поверхности фторита. Шахтер. Англ. 2019, 130, 15–23. [CrossRef]
7.
Фенг, Б.; Луо, X .; Wang, J .; Ван П. Флотационное отделение шеелита от кальцита с использованием подкисленного силиката натрия
в качестве депрессора. Шахтер. Англ. 2015,80, 45–49.
8.
Dong, L .; Jiao, F .; Цинь, Вт .; Zhu, H .; Jia, W. Влияние подкисленного жидкого стекла на флотационное отделение шеелита
от кальцита с использованием смешанных катионных / анионных коллекторов. Прил. Серфинг. Sci.
2018
, 444, 747–756. [CrossRef]
9.
Gao, Z .; Bai, D .; Солнце, W.; Cao, X .; Hu, Y. Селективное всплывание шеелита из кальцита и флюорита с использованием коллекторной смеси
. Шахтер. Англ. 2015,72, 23–26. [CrossRef]
10.
Oliveira, J.F .; Сампайо, Дж. Исследования разработки для извлечения бразильских шеелитовых шлаков путем вспенивания.
Производство и обработка мелких частиц; Plumpton, A.J., Ed .; Пергамон: Амстердам, Нидерланды,
1988; С. 209–217.
11.
Liu, C .; Feng, Q .; Чжан, Г.; Chen, W .; Чен, Ю. Влияние депрессантов на селективную флотацию шеелита
и кальцита с использованием окисленного парафинового мыла в качестве коллектора. Int. Дж. Майнер. Процесс. 2016, 157, 210–215. [CrossRef]
12.
Mercade, V. Влияние гидрозолей поливалентных силикатов металлов на флотацию кальцита. Пер. МСП / AIME
1981
,
268, 1842–1846.
13.
Yang, Y .; Xu, L .; Tian, J .; Liu, Y .; Han, Y. Селективная флотация ильменита из оливина с использованием подкисленной воды
стекла в качестве депрессора.Int. Дж. Майнер. Процесс. 2016, 157, 73–79. [CrossRef]
14.
Feng, B .; Guo, W .; Xu, H .; Peng, J .; Луо, X .; Чжу, X. Совместное действие иона свинца и силиката натрия в флотационном отделении шеелита от кальцита
–. Сен. Technol. 2016,52, 567–573. [CrossRef]
15.
Tohry, A .; Дехгани, А. Влияние силиката натрия на обратную анионную флотацию кремнисто-фосфорной железной руды. Сентябрь Purif. Technol. 2016, 164, 28–33.[CrossRef]
16.
Deng, R .; Ян, X .; Hu, Y .; Ku, J .; Zuo, W .; Ма, Ю. Влияние Fe (II) в качестве помощника депрессанта на отделение флотации
шеелита от кальцита. Шахтер. Англ. 2018, 118, 133–140. [CrossRef]
17.
Han, H.S .; Hu, Y.H .; Sun, W .; Li, X.D .; Chen, K.F .; Zhu, Y.G .; Nguyen, A.V .; Tian, M.J .; Wang, L .; Юэ, Т .;
и др. Новые механизмы катализа адсорбции бензогидроксамовой кислоты ионами свинца и изменения
поверхности частиц шеелита.Шахтер. Англ. 2018,119, 11–22. [CrossRef]
18.
Han, H.S .; Liu, W.L .; Hu, Y.H .; Sun, W .; Ли, X.D. Новая схема флотации: селективная флотация минералов вольфрама
из минералов кальция с использованием комплексов Pb-BHA в Шичжуюань. Редкий Met.