Оксид калия | справочник Пестициды.ru
Информация
Традиционно содержание Калия в удобрениях выражают содержанием Оксида калия. Все свойства Калия, как питательного элемента описаны в статье Калий.
Подробнее »
Химические и физические свойства
Оксид калия – твердое кристаллическое вещество, образующее бесцветные кристаллы. Имеет две устойчивые кристаллические модификации: кубическую (до 372°С) и гексагональную (выше 372°С).
- Температура плавления – 740°С.
- Плотность – 2,32 г/см3.
Оксид калия на воздухе расплавляется и, поглощая CO2, дает K2CO3. Бурно взаимодействует с водой с образованием КОН. Реагирует с эфиром и спиртом.
При температуре 250°С вступает в реакцию с H2. При этом образуются КОН. При этой же температуре взаимодействует с NH3, образуя КОН и KNH2.
Трехмерная модель молекулы
Энергично вступает в реакции взаимодействия с галогенами, расплавленной серой, различными кислотами. При нагревании с оксидами бора, алюминия, кремния образует соответственно бораты, алюминаты и полисиликаты.
При нагревании с NO2 образуется смесь KNO3 и KNO2.
Оксид калия получают:
- Нагреванием К с твердыми КОН, K2O2, KNO2. Например, 2KNO2+ 6К → 4К2O+ N2.
- При нагревании смеси KN3 и KNO2. 3KN3 + KNO2 → 2K2O + 5N2
- Окислением K, растворенного в жидком аммиаке, кислородом. 2K + O2 → 2K2O[3]
Содержание оксида калия в почве и удобрениях
Доступность калия для растений зависит от формы доступности калия в почве. Катионы ППК и водорастворимые соединения калия являются основными источниками калийного питания растений. В этой связи степень обеспеченности почвы калием для нужд питания растений выражают содержанием в подвижной форме и через оксид калия K2O. Эта величина обозначает суммарное количество обменного и водорастворимого кальция в мг/кг почвы.[1]
Катионы ППК и водорастворимые соединения калия являются основными источниками калийного питания растений. В этой связи степень обеспеченности почвы калием для нужд питания растений выражают содержанием в подвижной форме и через оксид калия K2O. Эта величина обозначает суммарное количество обменного и водорастворимого кальция в мг/кг почвы.[1]
Удобрения содержат различное количество оксида калия. Например, хлористый калий включает в себя 57–60 % калия в пересчете на K2O. Фиксированный почвой калий из удобрений доступен для растений. При этом степень его доступности тем выше, чем больше его фиксировано почвой.[2]
Калийные удобрения отличаются высокой растворимостью в воде. При внесении в почву они быстро растворяются и на основании обменных реакций вступают во взаимодействие с ППК. Часть калия удобрений переходит в необменные фиксированные почвенные соединения.[2]
Формула оксида калия (K2O), свойства, риски и использование / химия | Thpanorama
оксид калия, также называется оксидом калия, ионная кислородно-калиевая соль, формула которой K2О. Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
К2Или это самый простой оксид калия, это очень реактивное и редко встречающееся соединение. Некоторые коммерческие материалы, такие как удобрения и цементы, испытывают, предполагая процентное содержание состава, которое будет эквивалентно смеси химических соединений K2О.
Оксид калия получают из гидроксида калия (едкого кали) и металлического калия при 450 ° C с образованием молекулярного водорода (ОКСИД КАЛИЯ K2O, S.F.) в соответствии с уравнением:
2K + 2KOH ⇌ 2K2O + H2 (450 ° С).
Его также получают путем восстановления пероксида калия в соответствии с реакцией:
2K2О2 → К2O + O2 (530 ° С).
Другим способом получения оксида калия является нагревание карбоната калия при высокой температуре, как показано следующей реакцией:
К2Колорадо3 ⇌ К2O + CO2 (Т> 1200 ° С).
Однако основным способом получения оксида калия является нагревание нитрата калия для получения молекулярного азота, как показано следующей реакцией:
2KNO3 + 10K → 6K2O + N2
индекс
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 использования
- 4 Ссылки
Оксид калия — это желтоватые тетраэдрические кристаллы без характерного аромата (Национальный центр биотехнологической информации, 2017). Его внешний вид показан на рисунке 2 (американские элементы, С.Ф.).
Соединение имеет молекулярную массу 94,2 г / моль и плотность 2,13 г / мл при 24 ° С. Он имеет температуру плавления 740 ° C, хотя начинает разлагаться при 300 ° C (Royal Society of Chemistry, 2015).
Соединение устойчиво к нагреванию и растворим в этаноле и эфире. К2Или он кристаллизуется в структуре антифторита. По этой причине положения анионов и катионов меняются местами относительно их положений в CaF. 2, с ионами калия, координированными до 4 оксидных ионов, и ионами оксида, скоординированными с 8 калиями.
2, с ионами калия, координированными до 4 оксидных ионов, и ионами оксида, скоординированными с 8 калиями.
К2Или это основной оксид и бурно реагирует с водой с образованием едкого гидроксида калия. Он распух и поглощает воду из атмосферы, инициируя эту энергичную реакцию.
Оксид калия обратимо окисляется до пероксида калия при 350 ° С, бурно реагирует с кислотами, такими как соляная кислота, с образованием солей калия в соответствии с реакцией:
К2O + 2HCl → 2KCl + H2О.
Соединение реагирует с диоксидом азота с образованием нитрата и нитрита калия при температуре от 150 до 200 ° C:
К2O + 2NO2 = КНО2 + KNO3
Оксид калия реагирует при низких температурах с аммиаком с образованием амидов и гидроксида калия в соответствии с реакцией:
К2O + NH3 (l) → KNH2↓ + KOH (-50 ° C).
Реактивность и опасностиОксид калия является нестабильным веществом. Он легко окисляется до других оксидов калия, пероксида или до окиси калия (KHO). Соединение не является горючим, но активно и экзотермически реагирует с водой с образованием гидроксида калия (KOH).
Он легко окисляется до других оксидов калия, пероксида или до окиси калия (KHO). Соединение не является горючим, но активно и экзотермически реагирует с водой с образованием гидроксида калия (KOH).
Раствор оксида калия в воде является сильным основанием, бурно реагирует с кислотой и вызывает коррозию. Бурно реагирует с водой, образующей гидроксид калия. Атакует многие металлы в присутствии воды (Национальный институт безопасности и гигиены труда, 2014).
Вещество разъедает глаза, кожу и дыхательные пути, а также при попадании в организм. Вдыхание аэрозоля может вызвать отек легких. Симптомы отека легких часто проявляются лишь через несколько часов и усиливаются при физической нагрузке..
В случае попадания в глаза вам следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза должны быть промыты проточной водой в течение не менее 15 минут с открытыми веками. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста.
Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
В случае проглатывания не вызывать рвоту. Ослабьте тесную одежду, такую как воротники рубашки, ремни или галстуки. Если пострадавший не дышит, проведите реанимацию из уст в уста. Во всех случаях следует немедленно обратиться за медицинской помощью (IPCS, S.F.).
приложенийХимическая формула К2O (или просто «K») используется в нескольких промышленных контекстах: числа N-P-K для удобрений, в формулах цемента и в формулах стекла.
Оксид калия часто не используется непосредственно в этих продуктах, но количество калия указывается в терминах K-эквивалентов.2Или для любого типа используемых соединений калия, таких как карбонат калия.
Оксид калия составляет около 83% калия по весу, а хлорид калия — только 52%. Хлорид калия обеспечивает меньше калия, чем равное количество оксида калия.
Поэтому, если удобрением является хлорид калия в количестве 30% по весу, его стандартный индекс калия, основанный на оксиде калия, будет составлять только 18,8%.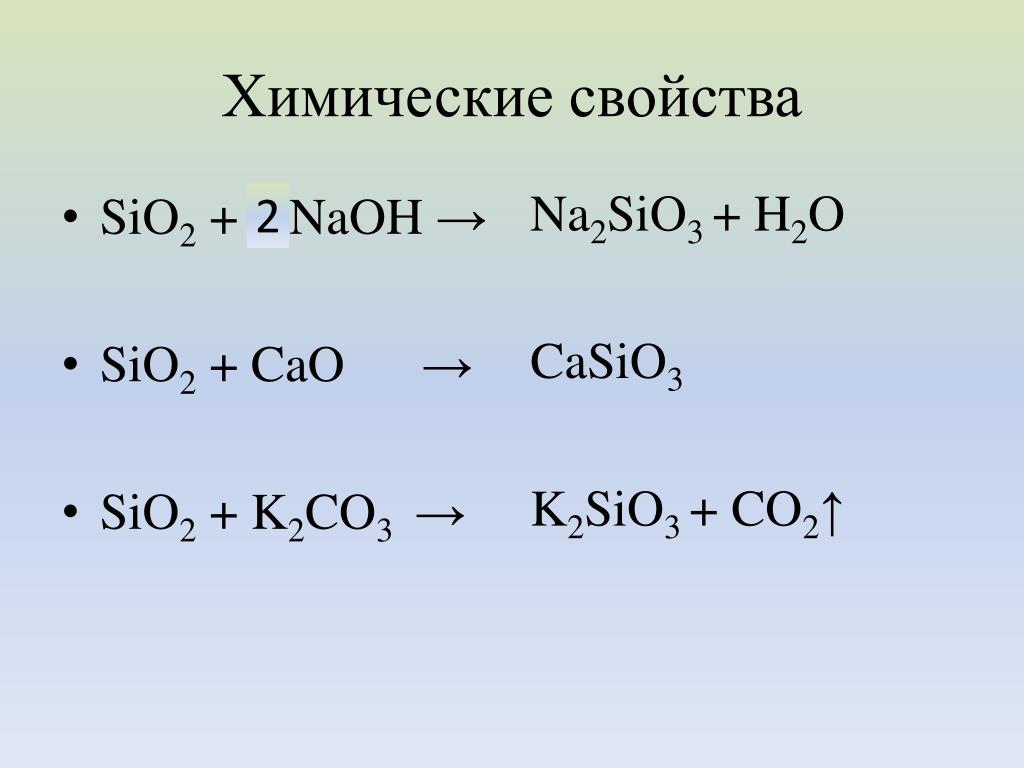 Он производится и / или импортируется от 10 до 100 тонн в год этого вещества в Европейском экономическом пространстве.
Он производится и / или импортируется от 10 до 100 тонн в год этого вещества в Европейском экономическом пространстве.
Это вещество используется в лабораторных химикатах, удобрениях, полимерах и фитосанитарных продуктах. К2Или это имеет промышленное использование, которое приводит к производству другого вещества (использование промежуточных продуктов).
Оксид калия используется в областях приготовления смесей и / или переупаковки, а также в сельском хозяйстве, лесном хозяйстве и рыболовстве. Это вещество используется для производства химических продуктов, пластмассовых изделий и минеральных продуктов (например, гипса, цемента)..
Выброс в окружающую среду оксида калия, вероятно, произойдет для промышленного использования: в качестве промежуточного этапа при производстве другого вещества (использование промежуточных продуктов), составления смесей, в качестве вспомогательного средства для обработки и промышленной обработки на истирание с низкой скоростью. выпуска, резки, механической обработки или полировки металла).
Возможно, что другое высвобождение в окружающую среду этого вещества путем его использования во внутренних помещениях, например, моющих жидкостей / моющих средств, автомобильных средств по уходу, краски и покрытия или клеи, ароматизаторы и освежители воздуха..
Также для использования внутри помещений в закрытых системах с минимальным выбросом, таких как охлаждающие жидкости в холодильниках, электрические нагреватели на масляной основе.
Оксид калия используется на открытом воздухе в долговременных материалах с низкой скоростью высвобождения, например, в строительных материалах и конструкциях из металла, дерева и пластика..
В помещении он используется в долговечных материалах с низкой скоростью высвобождения, таких как мебель, игрушки, строительные материалы, занавески, обувь, кожгалантерея, бумажные и картонные изделия, электронное оборудование..
Это вещество можно найти в изделиях из камня, гипса, цемента, стекла или керамики (например, посуду, кастрюли / сковородки, контейнеры для хранения продуктов питания, строительные и изоляционные материалы) (Европейское химическое агентство, 2017).
Оксид калия является термостойким, крайне нерастворимым источником калия, подходящим для стекла, оптики и керамики. Оксидные соединения не приводят к электричеству.
Однако некоторые структурированные оксиды перовскита являются электронными проводниками, которые находят применение в катоде твердооксидных топливных элементов и системах генерации кислорода..
Они представляют собой соединения, которые содержат, по меньшей мере, один кислородный анион и один катион металла. Они чрезвычайно стабильны, что делает их полезными для изготовления керамических конструкций, таких как глиняные миски или для продвинутой электроники.
Он также используется в легких конструкционных компонентах в аэрокосмической и электрохимической промышленности, таких как топливные элементы, в которых они проявляют ионную проводимость..
Металлооксидные соединения являются основными ангидридами и поэтому могут вступать в реакцию с кислотами и сильными восстановителями в окислительно-восстановительных реакциях. .
.
- Американские элементы. (S.F.). Оксид калия. Восстановленный от americanelements.com.
- EMBL-EBI. (2016, 19 сентября). оксид калия. Взято из ЧЕБИ: ebi.ac.uk.
- Европейское химическое агентство. (2017, 12 января). Двуокись оксида. Получено с echa.europa.eu.
- (S.F.). ОКСИД КАЛИЯ . Восстановлено с inchem.org.
- Национальный центр биотехнологической информации … (2017, 29 апреля). База данных PubChem Compound; CID = 9989219. Получено из pubchem.ncbi.nlm.nih.gov.
- Национальный институт охраны труда и здоровья. (2014, 1 июля). ОКСИД КАЛИЯ. Восстановлено из cdc.gov.
- КАЛИЯ ОКСИД K2O. (S.F.). Получено с allreactions.com.
- Королевское химическое общество. (2015). Калий окись калия. .
ICSC 0769 — ОКСИД КАЛИЯ
ICSC 0769 — ОКСИД КАЛИЯ| ОКСИД КАЛИЯ | ICSC: 0769 (Октябрь 2006) |
| CAS #: 12136-45-7 |
| UN #: 2033 |
| EINECS #: 235-227-6 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. |
Использовать порошок, двуокись углерода. НЕ использовать водные агенты. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боли в горле. Кашель. Ощущения жжения. Затрудненное дыхание. Сбивчивое дыхание. | Применять местную вытяжку. Применять средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Может потребоваться искусственное дыхание. Немедленно обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. Промыть кожу большим количеством воды или принять душ. Обратиться за медицинской помощью. |
|
| Глаза | Покраснение. Боль. Ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений). Немедленно обратиться за медицинской помощью. |
| Проглатывание | Боль в горле. Ощущение жжения в горле и груди. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: костюм химической защиты, включая автономный дыхательный аппарат. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. Сухие пластиковыеСмести просыпанное вещество в закрытые контейнеры. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН ОПАСНО Вызывает серьезные ожоги кожи и повреждения глазТранспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных кислот и пищевых продуктов и кормов. Хранить сухим. | |
| УПАКОВКА | |
| Герметичная. Не перевозить с продуктами питания и кормами для животных. |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ОКСИД КАЛИЯ | ICSC: 0769 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: K2O |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Сильные локальные эффекты при всех путях воздействия. Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Бурно реагирует с такими средствами пожаротушения, как вода. Симптомы отека легких часто не проявляются, пока не пройдет несколько часов, и они усугубляются физическими усилиями. Поэтому крайне важны отдых и медицинское наблюдение. Следует рассмотреть возможность немедленного проведения соответствующей ингаляционной терапии врачом или уполномоченным на это лицом. См. карту ICSC 0357. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Оксиды: состав, классификация, получение, химические свойства и применение.

Запитання 1
Дайте верное определение:
варіанти відповідей
Оксиды — это сложные вещества, состоящие из двух элементов, одним из которых является оксиген, а другим — металл или неметалл
Оксиды — это вещества, состоящие из кислорода и кислотного остатка
Оксиды — это сложные вещества, состоящие из оксигена
Оксиды — это вещества, образовавшиеся при разложении кислот
Запитання 2
Оксиды классифицируются
варіанти відповідей
на кислотные, основные и амфотерные
на кислотные и основные
на простые и сложные
на щелочные, основные, кислотные и амфотерные
Запитання 3
Какие вещества относятся к оксидам?
варіанти відповідей
h3SO4, BaCl2, NaOH, Fe, Zn
CaO, Al2O3, Cr2O3, SO3, P2O5
Запитання 4
Установите соответствие:
1. SO3 А. Нитроген (IV) оксид
2. ZnO Б. Натрий оксид
ZnO Б. Натрий оксид
3. NO2 В. Сульфур (VI) оксид
4. SO2 Г. Цинк оксид
5. Na2O Д. Сульфур (IV) оксид
варіанти відповідей
1-г, 2-д, 3-а, 4-в, 5-б
1-в, 2-г, 3-а, 4-д, 5-б
1-б, 2-а, 3-г, 4-д, 5-в
1-а, 2-д, 3-в, 4-б, 5-д
Запитання 5
Установите соответствие:
1. P2O5 А. Карбон (IV) оксид
2. Al2O3 Б. Феррум (III) оксид
3. NO В. Фосфор (V) оксид
4. CO2 Г. Нитроген (II) оксид
5. Fe2O3 Д. Алюминий (III) оксид
варіанти відповідей
1-д, 2-а, 3-г, 4-в, 5-б
1-б, 2-а, 3-д, 4-г, 5-в
1-в, 2-д, 3-г, 4-а, 5-б
1-а, 2-в, 3-г, 4-б, 5-д
Запитання 6
Основные оксиды реагируют
варіанти відповідей
с кислотными оксидами
Запитання 7
Кислотные оксиды реагируют с
варіанти відповідей
основными оксидами
Запитання 8
Как теоретически доказать, что оксид является кислотным?
варіанти відповідей
в состав оксида входит амфотерный металл
в состав оксида входит щелочной металл
в состав оксида входит атом неметалла
Запитання 9
Как экспериментально доказать, что оксид является основным?
варіанти відповідей
растворить в воде, добавить метилоранж, при добавлении которого не будет изменения окрашивания раствора
растворить в воде, затем добавить фенолфталеин до появления малинового окрашивания
растворить в h3O, при этом лакмус не изменит своего окрашивания
Запитання 10
Укажите кислотные оксиды:
варіанти відповідей
Запитання 11
Укажите основные оксиды:
варіанти відповідей
Запитання 12
Выберите амфотерные оксиды:
варіанти відповідей
Запитання 13
Выберите основные методы получения оксидов:
варіанти відповідей
реакция двух растворимых солей с образованием соли
разложение нерастворимых оснований
термическое разложение некоторых солей и большинства кислот
взаимодействие металлов с неметаллами
взаимодействие простых веществ с кислородом
взаимодействие растворимых солей с кислотами
Запитання 14
Что такое амфотерные оксиды?
варіанти відповідей
оксиды, которым соответствуют основания
оксиды, которым соответствуют кислоты
оксиды, которые могут проявлять свойства как кислотных, так и основных оксидов
оксиды с высшей степенью окисления
Запитання 15
Укажите несолеобразующие оксиды:
варіанти відповідей
Запитання 16
В каком агрегатном состоянии находятся большинство основных оксидов?
варіанти відповідей
жидкое состояние
газообразное состояние
все основные оксиды меняют свое состояние в зависимости от условий среды
твёрдое состояние
Запитання 17
Кислотному оксиду P2O5 соответствует кислота —
варіанти відповідей
Запитання 18
Группа веществ, которая взаимодействует с водой, образуя щёлочи:
варіанти відповідей
Запитання 19
Группа веществ, взаимодействующая с водой, которая образует кислоты:
варіанти відповідей
Запитання 20
Какие вещества относятся к оксидам?
варіанти відповідей
h3SO4, BaCl2, NaOH, Fe, Zn
CaO, Al2O3, Cr2O3, SO3, P2O5
Cr2(SO4)3, KOH, SO2, Cl2, Fe(NO3)3
Запитання 21
Составьте формулу оксида, если атомы Co и O имеют одинаковую валентность:
варіанти відповідей
Запитання 22
Перечислите пары оксидов, которые взаимодействуют между собой:
варіанти відповідей
Запитання 23
Реакция взаимодействия ZnO с HCl — это реакция
варіанти відповідей
нейтрализации
Запитання 24
Реакция взаимодействия BaO и CO2 — реакция
варіанти відповідей
нейтрализации
Запитання 25
Реакция взаимодействия Al2O3 c h3SO4 — реакция
варіанти відповідей
нейтрализации
Запитання 26
Выберите лишний оксид:
варіанти відповідей
Запитання 27
Fe2O3 не взаимодействует с
варіанти відповідей
Запитання 28
С Rb2O будут взаимодействовать:
варіанти відповідей
Запитання 29
С какими веществами будет взаимодействует Al2O3?
варіанти відповідей
Запитання 30
C CuO реагируют следующие вещества:
варіанти відповідей
Запитання 31
С SO3 реагируют следующие вещества —
варіанти відповідей
Запитання 32
C P2O5 реагируют следующие вещества —
варіанти відповідей
Запитання 33
C CO2 реагируют следующие вещества —
варіанти відповідей
Запитання 34
FeO взаимодействует со следующими веществами
варіанти відповідей
Запитання 35
C MgO взаимодействуют
варіанти відповідей
Запитання 36
Выберите вещества, которые образуются в результате взаимодействия основного оксида и кислоты или кислотного оксида со щёлочью:
варіанти відповідей
соль и водород
Запитання 37
Выберите вещества, которые образуются в результате взаимодействия кислотного оксида с водой:
варіанти відповідей
соль и водород
Запитання 38
Определите класс веществ, которые образуются во время взаимодействие водой с оксидами активных металов?
варіанти відповідей
кислотные оксиды
Запитання 39
Во время какой реакции можно получить калий цинкат?
варіанти відповідей
взаимодействие оксида цинка с натрий гидроксидом
сплавление Zn(OH)2 с KOH
взаимодействие цинка с раствором калий гидроксида
Запитання 40
Выберите истинное утверждение:
варіанти відповідей
все кислотные оксиды реагируют с водой
при действии водных растворов щелочей на амфотерные оксиды всегда образуются те же продукты, что и при сплавлении данных оксидов с твердыми щелочами
в ходе реакции основного оксида с кислотным оксидом может быть получено соединение, не содержащее ни одного неметалла, кроме кислорода
СО, N2O и NO при взаимодействии с водой образуют кислоты
Запитання 41
НЕ происходит химическая реакция между:
варіанти відповідей
водным раствором КОН и оксидом марганца (VII)
оксидом ртути (II) и водой
оксидом серы (IV) и озоном
йодоводородной кислотой и BeO
Запитання 42
Происходит химическая реакция между реагентами —
варіанти відповідей
Запитання 43
Al2O3 не реагирует с
варіанти відповідей
Запитання 44
Не взаимодействуют между собой:
варіанти відповідей
Запитання 45
Закончите схему реакции: NiO + HNO3 = Определите сумму коэффициентов в уравнении:
варіанти відповідей
Запитання 46
Закончите схему реакции: Li2O + HCl = Определите сумму коэффициентов в уравнении:
варіанти відповідей
Запитання 47
Закончите схему реакции: Na2O + P2O5 =
Определите сумму коэффициентов в уравнении:
варіанти відповідей
Запитання 48
Закончите уравнение MgO + SO3 =, а также определите сумму коэффициентов в данном уравнении:
варіанти відповідей
Запитання 49
Закончите схему реакции NaOH(изб) + h3S =, а также определите сумму коэффициентов в данном уравнении:
варіанти відповідей
Запитання 50
Выберите правильные суждения об CuO:
А. Данный оксид получается при термическом разложении Cu(OH)2
Данный оксид получается при термическом разложении Cu(OH)2
Б. В результате взаимодействия с водой этот оксид образует гидроксид
В. СuO — амфотерный оксид
Г. СuO можно получить при прокаливании медной проволки в пламени
Д. Цвет CuO — чёрный
варіанти відповідей
Запитання 51
Выберите правильные суждения относительно оксида Cr2O3:
А. Данный оксид имеет зелёный цвет
Б. Этот оксид является амфотерным
В. Термическое разложение Cr(OH)3 способствует получению Сr2O3
варіанти відповідей
Запитання 52
Основные оксиды образуют:
варіанти відповідей
только металлы с валентностью больше IV
неметаллы с валентностью больше IV
только неметаллы
металлы с валентностью I, II
Запитання 53
Кислотные оксиды образуют:
варіанти відповідей
только неметаллы
неметаллы и металлы с валентностью больше IV
только металлы с валентностью больше IV
металлы с валентностью I, II
Запитання 54
Выберите правильные суждения относительно оксида BaO:
А. Является амфотерным оксидом
Является амфотерным оксидом
Б. Является основным оксидом
В. При растворении в воде образует щёлочь
Г. Взаимодействует с кислотами
варіанти відповідей
Запитання 55
Какие оксиды возможно получить термическим разложением соответствующих гидроксидов?
варіанти відповідей
Запитання 56
Какие оксиды невозможно получить разложением соответствующих гидроксидов?
варіанти відповідей
Запитання 57
Кислотные оксиды представляют собой в основном:
варіанти відповідей
газообразные вещества
Запитання 58
Закончите схему реакции: ZnO + h3SO4 =
Рассчитайте сумму коэффициентов в уравнении
варіанти відповідей
Запитання 59
Закончите схему реакции: CuO + HNO3 =
Определите сумму коэффициентов:
варіанти відповідей
Запитання 60
Закончите схему реакции: h3O + SO3 =
Определите сумму коэффициентов:
варіанти відповідей
Запитання 61
Закончите схему реакции: NaOH(изб) + SO2 =
Определите сумму коэффициентов:
варіанти відповідей
Запитання 62
Закончите схему реакции: Ba(OH)2(изб. ) + CO2 =
) + CO2 =
Определите сумму коэффициентов:
варіанти відповідей
Запитання 63
Закончите схему реакции: Sr(OH)2(изб.) + P2O5 =
Определите сумму коэффициентов:
варіанти відповідей
Запитання 64
Между какими веществами веществами происходит химическая реакция?
варіанти відповідей
Запитання 65
Между какими веществами невозможна химическая реакция?
варіанти відповідей
Запитання 66
Выберите правильные суждения относительно K2O:
А. Основный оксид
Б. Реагирует с основаниями
В. Реагирует с кислотами
Г. Реагирует с основными оксидами
Д. Реагирует с кислотными оксидами
варіанти відповідей
Запитання 67
Формулы оксидов
1) P2O5 и SO3
2) ZnO и SO2
3) CO2 и CO
4) СаО и FеО
Характер свойств оксидов
А) кислотный и кислотный
Б) основный и основный
В) амфотерный и кислотный
Г) амфотерный и основный
Д) солеобразующий и несолеобразующий.
варіанти відповідей
Запитання 68
Установите соответствие между исходными веществами и продуктами реакций
Исходные вещества
1) Na2O + h3O
2) Na2O + CO2
3) Na2O + HCl
4) Na2O + h4PO4
Продукты реакций
А) NaCl + h3O
Б) NaOH
В) Na3PO4 + h3O
Г) Na2CO3
варіанти відповідей
Запитання 69
Оксид кремния при соответствующих условиях реагирует с
А) серной кислотой
Б) гидроксидом калия
В) водой
Г) карбонатом калия
Д) оксидом кальция
Е) магнием
варіанти відповідей
Запитання 70
Применение CO2:
варіанти відповідей
в производстве строительных материалов
в огнетушителях
изготовление стекла
в газированных напитках
Запитання 71
Применение SiO2 —
варіанти відповідей
изготовление стекла
руда для получения стали и чугуна
приготовление строительных материалов
основная часть белой краски
Запитання 72
Применение Cr2O3 —
варіанти відповідей
основная часть зелёной краски
основная часть белой краски
газированные напитки
хороший восстановитель в металлургическом производстве
Запитання 73
Какая масса соли образовалась при взаимодействии CaO массой 70 г и HCl массой 36,5 г?
варіанти відповідей
Запитання 74
Какой объём SO3 необходимо пропустить через избыток NaOH чтобы получить соль Na2SO4 массой 124 г?
варіанти відповідей
Запитання 75
Какая масса Rb3PO4 образуется при взаимодействии избытка 136 г h4PO4 и 62 г Rb2O?
варіанти відповідей
Запитання 76
Какая масса P2O5 необходима для получения 80 г K3PO4 взаимодействием оксида данного состава с щёлочью?
варіанти відповідей
Запитання 77
Какой объём CO2 необходимо пропустить через 60 г NaOH, чтобы получить 42 г Na2CO3?
варіанти відповідей
Запитання 78
Какая масса KCl образуется при взаимодействии K2O массой 80 г и HCl массой 120 г?
варіанти відповідей
Запитання 79
Какая масса Cr2O3 образуется при прокаливании 200 г Cr(OH)3?
варіанти відповідей
Запитання 80
Какую массу Cu(OH)2 подвергли термическому разложению, если образовалось 120 г CuO?
варіанти відповідей
Створюйте онлайн-тести
для контролю знань і залучення учнів
до активної роботи у класі та вдома
Натисніть «Подобається», щоб слідкувати за оновленнями на Facebook
Амфотерность — презентация онлайн
1.
 Амфотерность
Амфотерность2. СПЛАВЫ (без воды)
2KOH(тв.) + h3ZnO2(тв.) (t,сплавление)→ K2ZnO2 +2h3O
Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→
2h3O + Na2BeO2 (метабериллат натрия, или
бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→
2h3O + Na2PbO2 (метаплюмбат натрия, или
плюмбат)
h4AlO3 – h3O → HAlO2 + h3O
Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→
2h3O + KAlO2(метаалюминат калия)
Cr(OH)3 → h4CrO3 → HCrO2
Cr(OH)3(тв.) + KOH(тв.) (t,сплавление)→
2h3O + KCrO2(метахромат калия).
Степень
окисления
+2
+4
Формула
гидроксида
Sn(OH)2
Pb(OH)2
Sn(OH)4
Pb(OH)4
Формула
гидроксида в виде
кислоты
h3SnO2
h3PbO2
h3SnO3
h3PbO3
Соль(калиевая)
K2SnO2
K2PbO2
K2SnO3
K2PbO3
Название соли
станнИТ
блюмбИТ
метастаннА
Т
метаблюм
бАТ
6. СПЛАВЛЕНИЕ!!!
1. Амфотерного оксида с сильноосновным оксидом:ZnO(тв.
 ) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия/цинкат калия)
) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия/цинкат калия)2. Амфотерного оксида со щелочью:
ZnO(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + h3O↑
3. Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
ZnO(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
4. Амфотерного гидроксида с сильноосновным оксидом:
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + h3O↑
5. Амфотерного гидроксида со щелочью:
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2h3O↑
6. Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
Zn(OH)2(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + h3O↑
7. Соли слабой кислоты и металла, образующего амфотерные соединение с
сильноосновным оксидом:
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
8. Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + h3O↑
9. Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой
кислоты и металла, образующего щелочь:
ZnCO3(тв.
 ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑7. РАСТВОРЫ!!
Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4]Al2O3 + 6NaOH + 3h3O → 2Na3[Al(OH)6]
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑
2Al + 6NaOH + 6h3O → 2Na3[Al(OH)6] + 3h3↑
8. Основные гидроксиды
ОксидГидроксид
Гидроксид
в виде
кислоты
Кислотный
остаток
Соль
Название
соли
BeO
Be(OH)2
h3BeO2
BeO22-
K2BeO2
Метаберил
лат
(бериллат)
ZnO
Zn(OH)2
h3ZnO2
ZnO22-
K2ZnO2
Метацинкат
(цинкат)
Al2O3
Al(OH)3
HAlO2
AlO2—
KAlO2
Метаалюми
нат
(алюминат)
Fe2O3
Fe(OH)3
HFeO2
FeO2—
KFeO2
Метаферра
т
SnO
Sn(OH)2
h3SnO2
SnO22-
K2SnO2
СтаннИТ
9. Основные гидроксиды
ОксидГидроксид
Гидроксид
в виде
кислоты
Кислотный
остаток
Соль
Название
соли
PbO
Pb(OH)2
h3PbO2
PbO22-
K2PbO2
БлюмбИТ
SnO2
Sn(OH)4
h3SnO3
SnO32-
K2SnO3
МетастаннА
Т (станнат)
PbO2
Pb(OH)4
h3PbO3
PbO32-
K2PbO3
Метаблюмб
АТ
(плюмбат)
Cr2O3
Cr(OH)3
HCrO2
CrO2—
KCrO2
Метахрома
т
1.
 Na[Al(OH)4] — Тетрагидроксоалюминат
Na[Al(OH)4] — Тетрагидроксоалюминатнатрия
Al(OH)3 + NaOH → Na[Al(OH)4]
Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4]
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑
2. Na3[Al(OH)6] -Гексагидроксоалюминат
натрия
Al(OH)3 + 3NaOH → Na3[Al(OH)6]
Al2O3 + 6NaOH + 3h3O → 2Na3[Al(OH)6]
2Al + 6NaOH + 6h3O → 2Na3[Al(OH)6] + 3h3↑
3. K2[Zn(OH)4] -тетрагидроксоцинкат натрия
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4]
ZnO + 2NaOH + h3O → Na2[Zn(OH)4]
Zn + 2NaOH + 2h3O → Na2[Zn(OH)4]+ h3↑
4. K4[Zn(OH)6] -гексагидроксоцинкат натрия
Zn(OH)2 + 4NaOH → Na4[Zn(OH)6]
ZnO + 4NaOH + h3O → Na4[Zn(OH)6]
Zn + 4NaOH + 2h3O → Na4[Zn(OH)6]+ h3↑
5. Li2[Be(OH)4] -тетрагидроксобериллат лития
Be(OH)2 + 2LiOH → Li2[Be(OH)4]
BeO + 2LiOH + h3O → Li2[Be(OH)4]
Be + 2LiOH + 2h3O → Li2[Be(OH)4]+ h3↑
6. Li4[Be(OH)6] -гексагидроксобериллат лития
Be(OH)2 + 4LiOH → Li4[Be(OH)6]
BeO + 4LiOH + h3O → Li4[Be(OH)6]
Be + 4LiOH + 2h3O → Li4[Be(OH)6]+ h3↑
7.
 Na[Cr(OH)4] -тетрагидроксохромат натрия
Na[Cr(OH)4] -тетрагидроксохромат натрияCr(OH)3 + NaOH → Na[Cr(OH)4]
Cr2O3 + 2NaOH + 3h3O → 2Na[Cr(OH)4]
8. Na3[Cr(OH)6] — гексагидроксохромат натрия
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
Cr2O3 + 6NaOH + 3h3O → 2Na3[Cr(OH)6]
9. Na[Fe(OH)4] — тетрагидроксоферрат натрия
Fe(OH)3 + NaOH → Na[Fe(OH)4]
Fe2O3 + 2NaOH + 3h3O → 2Na[Fe(OH)4]
10. Na3[Fe(OH)6] -гексагидроксоферрат натрия
Fe(OH)3 + 3NaOH → Na3[Fe(OH)6]
Fe2O3 + 6NaOH + 3h3O → 2Na3[Fe(OH)6]
Полученные в этих взаимодействиях соли
реагируют с кислотами, образуя две
другие соли (соли данной кислоты и двух
металлов):
2Na3[Al(OH)6] + 6h3SO4 → 3Na2SO4 + Al2(SO4)3 +
12h3O
. Фрикционные наполнители на основе титанатов калия для полимерных композитов
Титанаты калия с общей химической формулой K2O∙nTiO2, представляющие собой новый вид функциональных материалов, структура и, соответственно, свойства которых существенно зависят от соотношения оксидов K2O и TiO2 в составе молекулы и температуры получения. Титанаты калия, синтезированные при температурах менее 500°С, как правило, обладают слоистой структурой, высокой интеркаляционной и каталитической активностью, низкой энергией межслоевого сдвига и могут быть использованы в качестве катализаторов, ионообменных материалов и антифрикционных наполнителей. Титанаты калия, имеющих n=4 и полученные при температурах порядка 900-1100°С имеют волокнистую структуру, что позволяют использовать их в качестве микроармирующих наполнителей композиционных материалов. Для создания композиционных материалов зарубежными исследователями применяются исключительно кристаллические волокнистые титанаты калия (вискеры) с соотношением K2O и TiO2 более 4, ориентируясь на эффект микро и наноармирования композитов. При этом незатронутым остается крайне перспективное направление слоистых полититанатов (СПТК), которые не только существенно дешевле, но и обладают комплексом ценных свойств. Наиболее перспективным применением СПТК являются антифрикционные материалы, так как в этой области СПК представляет собой аналог широко применяемого дисульфида молибдена.
Титанаты калия, синтезированные при температурах менее 500°С, как правило, обладают слоистой структурой, высокой интеркаляционной и каталитической активностью, низкой энергией межслоевого сдвига и могут быть использованы в качестве катализаторов, ионообменных материалов и антифрикционных наполнителей. Титанаты калия, имеющих n=4 и полученные при температурах порядка 900-1100°С имеют волокнистую структуру, что позволяют использовать их в качестве микроармирующих наполнителей композиционных материалов. Для создания композиционных материалов зарубежными исследователями применяются исключительно кристаллические волокнистые титанаты калия (вискеры) с соотношением K2O и TiO2 более 4, ориентируясь на эффект микро и наноармирования композитов. При этом незатронутым остается крайне перспективное направление слоистых полититанатов (СПТК), которые не только существенно дешевле, но и обладают комплексом ценных свойств. Наиболее перспективным применением СПТК являются антифрикционные материалы, так как в этой области СПК представляет собой аналог широко применяемого дисульфида молибдена.
Как показали последние исследования, при введении малых количеств СПТК можно достичь существенного повышения прочностных свойств (20-40% при введении 0,1 – 1% СПТК), а также снижения коэффициентов трения и износа (снижение износ по массе при трении на 15 – 50% при введении 0,1 – 1% СПТК). Как показывает практика создания полимерных композитов, наиболее перспективным путем введения наполнителей являются такие технологические приемы как применение суперконцентратов и полимеризационное наполнение. Создание таких суперконцентратов слоистых микро- и нанодисперсных наполнителей подробно исследовано на примере слоистых силикатов, при этом показаны очень хорошие результаты по повышению как трибологических, так и механических свойств материалов.
Урок 16. свойства, получение, применение оксидов — Химия — 8 класс
Конспект
Свойства, получение, применение оксидов
Для дальнейшего знакомства с оксидами отправимся в небольшое путешествие. Сначала побываем в мастерской художника и посмотрим на краски глазами химика: охра – оксиды железа, цинковые белила – оксид цинка, хромовая зелень – оксид хрома (III). Переместимся в аптеку. Многие оксиды используются в качестве лекарственных препара-тов: антациды – MgO, мази против опрелостей – ZnO, солнцезащитные средства – TiO2, в стоматологии – As2O3. Теперь отправимся на стройку. Главный строительный материал – это цемент, в состав которого входят оксид кремния SiO2, оксид кальция CaO, оксид алюминия Al2О3, оксид железа (III) Fe2O3. Оксид кремния есть не только в цементе, отпра-вимся на стекольный завод. Основа любого стекла – это оксид кремния. Для придания стеклу особых свойств в его состав вводят другие соединения: Na2O, CaO, PbO, K2O, B2O3, Co2O3, Cr2O3.
Сначала побываем в мастерской художника и посмотрим на краски глазами химика: охра – оксиды железа, цинковые белила – оксид цинка, хромовая зелень – оксид хрома (III). Переместимся в аптеку. Многие оксиды используются в качестве лекарственных препара-тов: антациды – MgO, мази против опрелостей – ZnO, солнцезащитные средства – TiO2, в стоматологии – As2O3. Теперь отправимся на стройку. Главный строительный материал – это цемент, в состав которого входят оксид кремния SiO2, оксид кальция CaO, оксид алюминия Al2О3, оксид железа (III) Fe2O3. Оксид кремния есть не только в цементе, отпра-вимся на стекольный завод. Основа любого стекла – это оксид кремния. Для придания стеклу особых свойств в его состав вводят другие соединения: Na2O, CaO, PbO, K2O, B2O3, Co2O3, Cr2O3.
Оксиды – очень нужные вещества. Существует два основных способа получения оксидов:
— разложение веществ (под влияние температуры): Cu(OH)2 = CuO + h3O
— взаимодействие простых веществ: С+ O2 = CO2
Химические свойства оксидов
Оксиды могут взаимодействовать с водой с образованием гидроксидов:
оксид + вода = гидроксид РАСТВОРИМЫЙ
Если в реакцию вступит кислотный оксид, то гидроксидом будет кислота:
кислотный оксид + вода = кислота РАСТВОРИМАЯ
Такая реакция лежит в основе образования кислотных дождей.
С водой могут взаимодействовать оснОвные оксиды с образованием гидроксида – основания:
основный оксид + вода = основание РАСТВОРИМОЕ
Чтобы определить кислоту или основание используют индикатор. Индикаторы – вещества, изменяющие свою окраску под действием других веществ.
Основные и кислотные оксиды взаимодействуют друг с другом:
основный оксид + кислотный оксид = соль
Справочные материалы
Физические свойства и применение некоторых оксидов
Оксид углерода (IV), углекислый газ CO2. Бесцветный газ без запаха,
тяжелее воздуха, относительно хорошо растворяется в воде. Производство газированных
напитков.
Оксид серы (IV), сернистый газ SO2. Бесцветный газ c резким запа-хом, тяжелее воздуха, хорошо растворяется в воде. Отбеливание шёлка и шерсти.
Оксид железа (III) Fe2O3. Твёрдое вещество красно-коричневого цвета. Минеральный пигмент, один из компонентов керамики.
Оксид кальция CaO. Твёрдое вещество белого цвета. Производство гашеной извести.
Оксид водорода h3O. Жидкость без вкуса, без цвета, без запаха. Вода – основа жизни на Земле.
Оксид кремния (IV) SiO2. Твёрдое бесцветное кристалли-ческое вещество. Изготовление силикатного кирпича.
Формула оксида калия
Оксид калия, также известный как оксид калия, калия или оксид калия, представляет собой неорганическое соединение, используемое в качестве добавки при производстве стекла, керамики и других материалов.
Формула и структура: Молекулярная формула оксида калия — K2O. Молярная масса 94,196 г / моль. Эта молекула образована двумя катионами калия K +2 и одним анионом кислорода O -2 . Два катиона связаны с анионом ионными связями.Молекула имеет антифтористую кристаллическую структуру, в которой один катион связан с 4 анионами, а каждый анион связан с 8 катионами. Его химическая структура может быть записана, как показано ниже, в общих представлениях, используемых для органических молекул.
Происхождение: Оксид калия не встречается в природе. Он подготовлен по одной из методологий, описанных ниже.
Препарат: Оксид калия получают в результате различных реакций. Самый простой метод — с элементарным калием, в котором пропускают поток газообразного кислорода:
2К + О 2 → К 2 О
Другой метод — реакция пероксида калия с элементарным калием или просто нагревание пероксида калия для ускорения разложения:
2К + 1/2 К 2 О 2 → К 2 О
К 2 О 2 → К 2 О + 1/2 О 2
Физические свойства: Оксид калия — твердое вещество желтого цвета без запаха.Плотность этого оксида составляет 2,32 г / л. Его температура плавления составляет 740 ° C, и выше этой температуры он разлагается. Растворим в некоторых органических растворителях.
Химические свойства: известно, что оксид калия реагирует в воде с образованием КОН посредством экзотермической реакции, которая в некоторых случаях может быть бурной:
К 2 O + H 2 O → 2 КОН
Этой реакции также может способствовать влажность окружающей среды, поэтому соединение следует хранить в надлежащих условиях.
Применение: Оксид калия используется как удобрение и как компонент других смесей, предназначенных для использования в сельском хозяйстве.Он также используется при производстве цемента, стекла и керамики.
Воздействие на здоровье / опасность для здоровья: Оксид калия вызывает раздражение глаз и кожи. Он вызывает коррозию и может бурно реагировать с водой.
Оксид калия — Введение, структура, применение, выводы и ответы на часто задаваемые вопросы
Оксид калия состоит из калия и кислорода, соединенных ионными связями. Калий имеет степень окисления +1. Так что он легко может потерять один электрон. Калий относится к группе щелочных металлов.Он имеет высокую тенденцию к объединению с любым другим противоионом для достижения своей валентности. Таким образом, в свободной форме он очень реактивен. Он легко реагирует с кислородом с образованием гидроксида калия. Он имеет бледно-желтый цвет и широко используется в качестве удобрения. При растворении в воде это сильно коррозионная щелочь. Здесь мы изучим формулу, структуру, физические и химические свойства оксида калия и его использование. Оксид калия — сильно коррозионная щелочь при растворении в воде.
Здесь мы изучим формулу, структуру, физические и химические свойства оксида калия и его использование. Оксид калия — сильно коррозионная щелочь при растворении в воде.
Структура
Формула оксида калия содержит два атома калия и один атом кислорода.Эти атомы соединены связями. Калий находится в степени окисления +1. Кислород имеет степень окисления -2. Чтобы сбалансировать валентность, два атома калия соединяются с одним атомом кислорода. Итак, формула оксида калия: K2O
[Изображение будет загружено в ближайшее время]
Физические свойства
Он твердый, бледно-желтого цвета.
Молекулярная масса 94,2 г / моль.
Плотность K2O составляет 2,35 г / см3.
Температура плавления оксида калия составляет 740 ℃.

Растворим в эфире и этаноле.
Химические свойства
4K + O2 → 2K2O
K2O + h3O → KOH
K2O + HCl → KCl + h3O
2K + 2h3O → 2KOH + h3
Применение и использование
Это используется в качестве удобрения в сельском хозяйстве.
Не растворяется в воде и очень стабилен. Это делает его полезным в керамической промышленности. Он используется для изготовления легких чаш и конструкционных смесей в аэрокосмической отрасли.
Используется для приготовления мыла и стекла. Он широко известен как чистый калий.
Он используется для лечения грибковых инфекций, таких как зигомицеты.

Он также используется при лечении болезней животных.
Заключение
В этой статье мы узнали об оксиде калия, формуле оксида калия, его химических и физических свойствах, а также о его применении. Это ионное соединение.При обработке кислотой образует соль и воду. Он также используется в качестве удобрения в сельском хозяйстве. Он может быть токсичным при вдыхании и проглатывании. Он используется в керамической, стекольной и оптической промышленности.
Знаете ли вы?
Следует отметить, что оксид калия имеет химическую формулу K2O. В то время как супероксид калия — это неорганическое соединение с химической формулой KO2. Это парамагнитное твердое вещество желтого цвета, которое разлагается во влажном воздухе. Степень окисления кислорода в супероксиде калия рассчитывается как -1.Эти два соединения полностью отличаются друг от друга по химическим и физическим свойствам.
Формула оксида калия: определение, получение, свойства, применение
Оксид калия Формула: Оксид калия — это неорганическое соединение с химической формулой \ ({{\ rm {K}} _ 2} {\ rm {O}} \). Это оксид щелочного металла. Это простейший оксид калия, обладающий высокой реакционной способностью. Это ионное соединение, состоящее из атомов калия и кислорода. Оксид калия — это оксид металла, который имеет основную природу.В этой статье мы обсудим более подробно оксид калия.
УДАЛИТЬ КОНЦЕПТУАЛЬНЫЕ СОМНЕНИЯ ПО ОКСИДУ КАЛИЯ
Химическая формула оксида калияХимическая формула оксида калия: \ ({{\ rm {K}} _ 2} {\ rm {O}} \).
Он содержит атомы калия и кислорода. Между атомами калия и кислорода существует ионная связь. Следовательно, это ионное соединение. Ионное соединение образуется путем переноса электронов между составляющими атомами.
Изучите концепции 10-го экзамена CBSE
Образование оксида калия Атомный номер калия \ (19 \). Он имеет один электрон во внешней оболочке. Следовательно, он может отдать этот электрон, чтобы получить стабильную электронную конфигурацию. Точно так же атомный номер кислорода равен \ (8 \). На внешней оболочке у него шесть электронов. Для завершения своего октета требуется еще два электрона. Следовательно, во время образования оксида калия два атома калия переносят два (по одному электрону от одного атома калия) электрона на атом кислорода, образуя между собой ионную связь.Его можно представить как,
Он имеет один электрон во внешней оболочке. Следовательно, он может отдать этот электрон, чтобы получить стабильную электронную конфигурацию. Точно так же атомный номер кислорода равен \ (8 \). На внешней оболочке у него шесть электронов. Для завершения своего октета требуется еще два электрона. Следовательно, во время образования оксида калия два атома калия переносят два (по одному электрону от одного атома калия) электрона на атом кислорода, образуя между собой ионную связь.Его можно представить как,
Молярная масса оксида калия равна \ (94.196 \; {\ rm {g}} / {\ rm {mol}} \).
Кристаллическую структуру оксида калия можно представить как,
Практика 10-го экзамена CBSE Вопросы
Получение химической формулы оксида калияХимическая формула оксида калия может быть получена с помощью метода Крест-накрест .
В методе крест-накрест, если мы знаем валентность каждого элемента соединения, мы можем легко написать его формулу. {2 -}}} \ right) \) ионы. Валентность иона калия равна единице, а иона оксида — двум. Путем пересечения этих чисел валентности получается химическая формула оксида калия \ ({{\ rm {K}} _ 2} {\ rm {O}} \). То есть
{2 -}}} \ right) \) ионы. Валентность иона калия равна единице, а иона оксида — двум. Путем пересечения этих чисел валентности получается химическая формула оксида калия \ ({{\ rm {K}} _ 2} {\ rm {O}} \). То есть
Оксид калия можно получить следующими способами:
1. Оксид калия образуется при взаимодействии калия с кислородом. Химическое уравнение реакции может быть представлено как,
\ (4 \; {\ rm {K}} + {{\ rm {O}} _ 2} \ to 2 \; {{\ rm {K}} _ 2} {\ rm {O}} \)
Во время этой реакции также образуется пероксид калия, который при обработке калием дает оксид калия.\ circ {\ rm {C}} \). То есть пероксид калия разлагается с образованием оксида калия и кислорода. Химическое уравнение реакции может быть представлено как,
\ (2 \; {{\ rm {K}} _ 2} {{\ rm {O}} _ 2} \ to 2 \; {{\ rm {K}} _ 2} {\ rm {O}} + { {\ rm {O}} _ 2} \ uparrow \)
4. Оксид калия образуется при взаимодействии гидроксида калия с расплавленным металлическим калием. Химическое уравнение реакции может быть представлено как,
Химическое уравнение реакции может быть представлено как,
Попытка пробных тестов 10-го экзамена CBSE
Свойства оксида калияОбсудим физические и химические свойства оксида калия \ (\ left ({{{\ rm {K}} _ 2} {\ rm {O}}} \ right) \).
Физические свойства оксида калия 1. Оксид калия представляет собой твердое вещество бледно-желтого цвета.
2. Оксид калия — соединение без запаха.
3. Оксид калия хорошо растворяется в диэтиловом эфире.
4. Температура плавления оксида калия примерно равна \ (1010 \; {\ rm {K}} \).
5. Оксид калия обладает свойством расплывания (это свойство вещества поглощать воду из воздуха, растворяться и образовывать водный раствор) по своей природе.
Исследование формулы гидроксида калия
Химические свойства оксида калия 1. Оксид калия — это оксид металла. Оксиды металлов обычно имеют щелочную или щелочную природу. Таким образом, оксид калия имеет щелочную природу и также очень агрессивен.
Таким образом, оксид калия имеет щелочную природу и также очень агрессивен.
2. Оксид калия — растворяющееся вещество. Следовательно, он интенсивно впитывает влагу из воздуха.
Реакция оксида калия с водой дает гидроксид калия.\ circ {\ rm {C}} \), разлагается с образованием пероксида калия и калия. Химическое уравнение реакции может быть представлено как,
4. Реакции оксида калия с кислотами:
Реакция оксида калия с различными кислотами может быть представлена как,
Реакция оксида калия с серной кислотой Оксид калия реагирует с серной кислотой с образованием сульфата калия и воды. Химическое уравнение реакции можно представить в виде
\ ({{\ rm {K}} _ 2} {\ rm {O}} + {{\ rm {H}} _ 2} {\ rm {S}} { {\ rm {O}} _ 4} \ to {{\ rm {K}} _ 2} {\ rm {S}} {{\ rm {O}} _ 4} + {{\ rm {H}} _ 2} { \ rm {O}} \)
Оксид калия реагирует с соляной кислотой с образованием хлорида калия и воды. Химическое уравнение реакции можно представить в виде
Химическое уравнение реакции можно представить в виде
\ ({{\ rm {K}} _ 2} {\ rm {O}} + 2 {\ rm {HCl}} \ to 2 {\ rm {KCl}} + {{\ rm {H}} _ 2} {\ rm {O}} \)
Оксид калия реагирует с азотной кислотой с образованием нитрата калия и воды. Химическое уравнение реакции можно представить в виде
\ ({{\ rm {K}} _ 2} {\ rm {O}} + 2 {\ rm {HN}} {{\ rm {O}} _ 3} \ to 2 {\ rm {KN}} {{\ rm {O}} _ 3} + {{\ rm {H}} _ 2} {\ rm {O}} \)
Оксид калия является основным по своей природе.Поэтому реакция оксида калия с разными кислотами является примером реакции нейтрализации.
Оксид калия имеет множество применений. В их числе:
- Оксид калия в основном используется в удобрениях, рецептурах цемента и в составах для стекловарения.
- Оксид калия подходит для оптики и керамики.
- Используется как реагент для производства других химикатов.
 \ circ {\ rm {C}} \). В этой статье мы подробно объяснили формулу, другие методы приготовления, физические и химические свойства, а также их основные применения.
\ circ {\ rm {C}} \). В этой статье мы подробно объяснили формулу, другие методы приготовления, физические и химические свойства, а также их основные применения.ПРАКТИЧЕСКИЕ ВОПРОСЫ, КАСАЮЩИЕСЯ ОКСИДА КАЛИЯ
Часто задаваемые вопросы по оксиду калияQ.1. Какая формула оксида калия?
Ответ: Оксид калия — это неорганическое соединение с химической формулой \ ({{\ rm {K}} _ 2} {\ rm {O}} \). Это ионное соединение.Q.2. Для чего используется оксид калия?
Ответ: Оксид калия имеет множество применений. Он в основном используется в удобрениях, формулах цемента и формулах для производства стекла. Оксид калия подходит для оптики и керамики. Он используется как реагент для производства других химикатов, он используется для лечения некоторых грибковых инфекций у зигомицетов и т. Д.Q.3. Оксид калия кислый?
Ответ: Нет, оксид калия является основным. Это оксид металла. Обычно оксиды металлов имеют основную природу.
Это оксид металла. Обычно оксиды металлов имеют основную природу.Q.4. \ ({{\ Rm {K}} _ 2} {\ rm {O}} \) ионный или ковалентный?
Ответ: \ ({{\ rm {K}} _ 2} {\ rm {O}} \) ионный. Во время образования оксида калия два атома калия переносят два (по одному электрону от одного атома калия) электрона на атом кислорода, образуя между собой ионную связь.Q.5. Что происходит, когда оксид калия вступает в реакцию с водой?
Ответ: Реакция оксида калия с водой дает гидроксид калия.Химическое уравнение реакции можно представить в виде
\ ({{\ rm {K}} _ 2} {\ rm {O}} + {{\ rm {H}} _ 2} {\ rm {O}} \ to 2 {\ rm {KOH}} \)
Вышеуказанная реакция является бурной.Мы надеемся, что эта статья «Формула оксида калия» помогла вам. Если у вас есть какие-либо вопросы, оставьте комментарий ниже, и мы свяжемся с вами.
82 Просмотры
Оксид калия — обзор
В таблице 25 перечислены всего шесть препаратов ферроцена, хотя их гораздо больше, и неудивительно, что такое стабильное соединение часто встречается, когда железо или его соединения и циклопентадиен или циклопентадиенильные соединения собраны вместе.
 Второй и третий приведенные методы, вероятно, являются наиболее удобными, хотя использование гидратированного хлорида железа (II) более выгодно, чем использование безводного соединения. Ферроцен стоил всего 0,15 доллара за г −1 в 1981 году, и сейчас мало кто решает синтезировать его.
Второй и третий приведенные методы, вероятно, являются наиболее удобными, хотя использование гидратированного хлорида железа (II) более выгодно, чем использование безводного соединения. Ферроцен стоил всего 0,15 доллара за г −1 в 1981 году, и сейчас мало кто решает синтезировать его.Таблица 25. Некоторые примечания и ссылки по ферроцену
1. М. Розенблюм, в «Химии металлоценов группы железа», Wiley, New York, 1965.
2. G. Wilkinson, Org. Synth. , 1956, 36, , 31; W.L. Jolly, Неорг. Synth. , 1968, 11 , 120.
3. Д. Э. Бублиц и К. Л. Райнхарт, мл., Org. Реагировать. , 1969, 17 , 1.
4. П. Л. Тиммс и Т. У. Терни, Adv. Органомет. Chem. , 1977, 15 , 53.
5. A. Haaland, Acc. Chem. Res. , 1979, 12 , 415.
6. C. Clec’h, G. Calvarin, J. F. Bérar and R. Kahn, C. R. Hebd. Сеансы акад. Sci.
 , 1978, 286 , 315.
, 1978, 286 , 315.7. П. Зайлер, Дж. Д. Дуниц, Acta Crystallogr. , 1979, B35 , 1068 и 2020.
8. Ф. Такусагава и Т. Ф. Кетцле, Acta Crystallogr. , 1979, B35 , 1074.
9. E. Hough и D. G. Nicholson, J. Chem. Soc., Dalton Trans. , 1978, 15.
10. П. Дж. Уитли, в «Перспективы структурной химии», изд. Дж. Д. Дуниц и Дж. А. Иберс, Wiley, Нью-Йорк, 1967, с. 000.
11. К. Крюгер, Б.Л. Барнетт и Д. Брауэр, в «Органической химии железа», изд. Э. А. Кернер фон Густорф, Ф.-В. Гревелс и И. Фишлер, Academic, Нью-Йорк, 1978, т. 1, стр. 1.
12. С. Эванс, М. Л. Х. Грин, Б. Джевитт, Г. Х. Кинг и А. Ф. Орчард, J. Chem. Soc., Faraday Trans. 2 , 1974, 70 , 356.
13. J. W. Lauher и R. Hoffmann, J. Am. Chem. Soc. , 1976, 98 , 1729.
14. Д. Р. Армстронг, Р. Форчун и П. Г. Перкинс, J.Органомет. Chem. , 1976, 111 , 197.

15. P. S. Bagus, U. I. Wahlgren и J. Almlöf, J. Chem. Phys. , 1976, 64 , 2324.
16. M. C. Zerner, G. H. Loew, R. F. Kirchner и U. T. Mueller-Westerhoff, J. Am. Chem. Soc. , 1980, 102 , 589.
17. J. W. Rabalais, L.O. Werme, T. Bergmark, L. Karlsson, M. Hussain and K. Siegbahn, J. Chem. Phys. , 1972, 57 , 1185 и 4508.
18.Ю. С. Сон, Д. К. Хендриксон и Г. Б. Грей, J. Am. Chem. Soc. , 1971, 93 , 3603.
19. B. E. Mann, Adv. Органомет. Chem. , 1974, 12 , 135.
20. M. H. Chisholm, S. Godleski, Prog. Неорг. Chem. , 1976, 20, , 299.
21. П. К. Лаутербур и Р. Б. Кинг, J. Am. Chem. Soc. , 1965, 87 , 3266.
22. Т. Дж. Маркс, в «Органической химии железа», изд. Э.А. Кернер фон Густорф, Ф.-В. Гревелс и И. Фишлер, Academic, Нью-Йорк, 1978, т. 1, стр.
 113.
113.23. Дж. У. Фаллер, Х. Х. Мюррей и М. Сандерс, J. Am. Chem. Soc. , 1980, 102 , 2306.
24. R. L. Collins, J. Chem. Phys. , 1965, 42 , 1072.
25. Х. Г. Дрикамер, Р. В. Воган и А. Р. Чэмпион, Acc. Chem. Res. , 1969, 2 , 40.
26. M. L. Good, J. Buttone and D. Foyt, Ann.N.Y. Acad. Sci. , 1974, 239 , 193.
27. T. C. Gibb, J. Chem. Soc., Dalton Trans. , 1976, 1237.
28. Пэриш Р. В., в «Органической химии железа», изд. Э. А. Кернер фон Густорф, Ф.-В. Гревелс и И. Фишлер, Academic, Нью-Йорк, 1978; т. 1, стр. 175.
29. M. Cais and M. S. Lupine, Adv. Органомет. Chem. , 1970, 8 , 211.
30. Дж. Мюллер, в «Органической химии железа», изд. Э.А.Кернер фон Густорф, Ф.-W. Гревелс и И. Фишлер, Academic, Нью-Йорк, 1978, т. 1, стр. 145.
31. S. M. Schildcrout, J. Am. Chem. Soc. , 1973, 95 , 3846.

32. A. J. Campbell, C. A. Fyfe, D. Harold-Smith and K. R. Jeffrey, Mol. Cryst. Liq. Cryst. , 1976, 36, , 1 и ссылки в нем.
33. С. Картер и Дж. Н. Муррелл, J. Organomet. Chem. , 1980, 192 , 399.
34. S. Sorriso, J. Organomet. Chem., 1979, 179 , 205.
35. Г. Церичелли, Г. Иллюминати, Г. Ортаджи и А. М. Джулиани, J. Organomet. Chem. , 1977, 127 , 357.
36. T. E. Bitterwolf и A. C. Ling, J. Organomet. Chem. , 1977, 141 , 355.
37. M. S. Foster and J. L. Beauchamp, J. Am. Chem. Soc. , 1975, 97 , 4814.
38. Т. Р. Кромптон, в «Химическом анализе металлоорганических соединений», Academic, New York, 1977, vol.5.
39. Дж. Р. Чипперфилд, Дж. К. Р. Снейд и Д. Э. Вебстер, J. Organomet. Chem. , 1979, 178 , 177.
40. Несмеянов А.Н., Кочеткова Н.
 С., Россия. Chem. Rev. ( англ. Пер. ), 1974, 43 , 710; Кочеткова Н.С., Кочеткова Ю. К. Крынкина, Россия. Chem. Rev. ( Engl. Transl. ), 1978, 47 , 486.
С., Россия. Chem. Rev. ( англ. Пер. ), 1974, 43 , 710; Кочеткова Н.С., Кочеткова Ю. К. Крынкина, Россия. Chem. Rev. ( Engl. Transl. ), 1978, 47 , 486.41. C. U. Pittman, Jr., в «Organometallic Reactions», ed. Беккер Э.Цуцуи, Вили, Нью-Йорк, 1977, т. 6, стр. 1.
42. Б. В. Локшин, В. Т. Алексанян, Э. Б. Русач, J. Organomet. Chem. , 1975, 86, , 253 и ссылки в них.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.
 Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Оксид калия: формула, свойства, риски и применение
He Оксид калия , также называемый оксидом калия, представляет собой ионную соль кислорода и калия, формула которой K 2 O.
 Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
Его структура представлена на рисунке 1 (EMBL-EBI, 2016).K 2 O — простейший оксид калия, это соединение с высокой реакционной способностью, которое встречается редко. Некоторые коммерческие материалы, такие как удобрения и цементы, тестируются, принимая процентное содержание состава, которое было бы эквивалентно смеси химических соединений K 2 OR.
Рисунок 1: структура оксида калия.
Оксид калия получают из гидроксида калия (едкого калия) и металлического калия при 450 ° C с образованием молекулярного водорода (оксид калия K2O, S.F.) в соответствии с уравнением:
2K + 2KOH ⇌ 2K 2 O + H 2 (450 ° C).
Его также получают восстановлением пероксида калия по реакции:
2K 2 OR 2 → K 2 O + O 2 (530 ° C).
Другой способ получения оксида калия заключается в нагревании карбоната калия при высокой температуре, на что указывает следующая реакция:
K 2 CO 3 ⇌ K 2 O + CO 2 (T> 1200 ° C).

Однако основным способом получения оксида калия является нагревание нитрата калия для получения молекулярного азота, как показано следующей реакцией:
2КНО 3 + 10К → 6К 2 О + Н 2
Физико-химические свойства оксида калияОксид калия — тетраэдрические кристаллы желтоватого цвета без характерного аромата (Национальный центр биотехнологической информации, 2017).Их внешний вид показан на рисунке 2 (американские элементы, С.Ф.).
Рисунок 2: внешний вид оксида калия.
Соединение имеет молекулярную массу 94,2 г / моль и плотность 2,13 г / мл при 24 ° C. Оно имеет точку плавления 740 ° C, но начинает разлагаться при 300 ° C (Royal Society of Chemistry, 2015). .
Состав термостойкий, растворим в этаноле и эфире. K 2 O кристаллизуется в структуре антифторита. По этой причине положения анионов и катионов меняются местами относительно их положений в CaF 2 , причем ионы калия координируются с 4 ионами оксида, а ионы оксида координируются с 8 ионами калия.

K 2 O представляет собой основной оксид, который бурно реагирует с водой с образованием гидроксида каустика. Он расплывается и поглощает воду из атмосферы, инициируя эту бурную реакцию.
Оксид калия обратимо окисляется до пероксида калия при 350 ° C, бурно реагирует с кислотами, такими как соляная кислота, с образованием солей калия в соответствии с реакцией:
К 2 + 2HCl → 2KCl + H 2 ИЛИ.
Соединение реагирует с диоксидом азота с образованием нитрата и нитрита калия При температуре от 150 до 200 ° C:
K 2 O + 2NO 2 = KNO 2 + KNO 3
Оксид калия реагирует при низких температурах с аммиаком с образованием амидов и гидроксида калия в соответствии с реакцией:
K 2 O + NH 3 (L) → KNH 2 ↓ + KOH (-50 ° C).
Реакционная способность и опасностиОксид калия — вещество нестабильное.
 Он легко окисляется до других оксидов калия, перекиси или кислого оксида калия (KHO). Соединение не горючее, но активно и экзотермически реагирует с водой с образованием гидроксида калия (КОН).
Он легко окисляется до других оксидов калия, перекиси или кислого оксида калия (KHO). Соединение не горючее, но активно и экзотермически реагирует с водой с образованием гидроксида калия (КОН).Раствор оксида калия в воде является сильным основанием, бурно реагирует с кислотой и вызывает коррозию. Реагирует бурно с водой с образованием гидроксида калия.Он атакует многие металлы в присутствии воды (Национальный институт безопасности и гигиены труда, 2014).
Вещество оказывает разъедающее действие на глаза, кожу и дыхательные пути, а также при проглатывании. Вдыхание аэрозоля может вызвать отек легких. Симптомы отека легких часто не проявляются в течение нескольких часов и усугубляются физическими нагрузками.
В случае попадания в глаза проверьте наличие контактных линз и немедленно снимите их. Глаза следует промывать проточной водой не менее 15 минут с открытыми веками.Можно использовать холодную воду. Мазь для глаз использовать не следует.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело.
 Поместите пострадавшего под защитный душ.
Поместите пострадавшего под защитный душ.Если химическое вещество накапливается на открытой коже жертвы, например, на руках, осторожно и тщательно промойте загрязненную кожу проточной водой с неабразивным мылом. Можно использовать холодную воду. Если раздражение не проходит, обратиться к врачу. Перед повторным использованием вымойте загрязненную одежду.
При сильном контакте с кожей ее следует промыть дезинфицирующим мылом и покрыть загрязненную кожу антибактериальным кремом.
В случае вдыхания пострадавшего следует оставить в хорошо проветриваемом помещении. При сильном вдыхании пострадавшего следует как можно скорее эвакуировать в безопасное место.
Ослабьте тесную одежду, например воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует ввести кислород.Если пострадавший не дышит, проводится реанимация «рот в рот».
Всегда учитывать, что реанимация «рот в рот» может быть опасна для лица, оказывающего помощь, если вдыхаемый материал токсичен, заразен или вызывает коррозию.

При проглатывании не вызывать рвоту. Ослабьте тесную одежду, например воротники рубашки, ремни или галстуки. Если пострадавший не дышит, выполните реанимацию «рот в рот». Во всех случаях немедленно обратитесь за медицинской помощью (IPCS, S.F.).
ПриложенияХимическая формула K 2 O (или просто «K») используется в различных промышленных контекстах: числа N-P-K для удобрений, формул цемента и формул стекла.
Оксид калия часто не используется напрямую в этих продуктах, но количество калия указывается в эквивалентах K 2 Или для любого типа используемых соединений калия, таких как карбонат калия.
Оксид калия составляет около 83% по весу, а хлорид калия — только 52%.Хлорид калия обеспечивает меньше калия, чем такое же количество оксида калия.
Следовательно, если удобрение содержит 30 мас.% Хлорида калия, его стандартный индекс оксида калия на основе калия будет только 18,8%.
 S And производит и / или импортирует от 10 до 100 тонн этого вещества в год в Европейскую экономическую зону.
S And производит и / или импортирует от 10 до 100 тонн этого вещества в год в Европейскую экономическую зону.Это вещество используется в лабораторных химикатах, удобрениях, полимерах и фитосанитарных продуктах. K 2 Или он используется в промышленности, что приводит к производству другого вещества (использование промежуточных продуктов).
Оксид калия используется в областях приготовления смесей и / или переупаковки, а также в сельском, лесном и рыбном хозяйстве. Это вещество используется для производства химикатов, пластмассовых изделий и минеральных продуктов (например, гипса, цемента).
Высвобождение оксида калия в окружающую среду, вероятно, произойдет при промышленном использовании: в качестве промежуточного этапа при производстве другого вещества (использование промежуточных продуктов), в составлении смесей, в качестве технологической добавки и при промышленной обработке абразивного материала с низкой скоростью Высвобождение текстиля , резка, обработка или полировка металла).

Дальнейшее выделение этого вещества в окружающую среду может быть связано с его использованием в помещениях, например, в жидкостях / моющих средствах для машинной стирки, средствах для ухода за автомобилем, красках и покрытиях или клеях, ароматизаторах и освежителях воздуха.
Также для использования внутри помещений в закрытых системах с минимальным выбросом, таких как охлаждающие жидкости в холодильниках, электронагреватели на масляной основе.
Оксид калия предназначен для наружного применения в материалах с длительным сроком службы с низкой скоростью выделения, например, в строительных материалах и конструкциях из металла, дерева и пластика.
В интерьере он используется в материалах с длительным сроком службы с низкой скоростью высвобождения, таких как, например, мебель, игрушки, строительные материалы, шторы, обувь, кожаные изделия, бумажные изделия и картон, электронное оборудование.
Это вещество можно найти в изделиях из камня, гипса, цемента, стекла или керамики (например, тарелки, кастрюли / сковороды, контейнеры для хранения пищевых продуктов, строительные материалы и изоляция) (Европейское химическое агентство, 2017).

Оксид калия — это термически стабильный, очень нерастворимый источник калия, подходящий для стекла, оптики и керамики.Оксидные соединения не вызывают электричество.
Однако некоторые оксиды со структурой перовскита обладают электронной проводимостью, что находит применение в катоде твердооксидных топливных элементов и систем генерации кислорода.
Это соединения, содержащие по крайней мере один анион кислорода и один катион металла. Они чрезвычайно стабильны, что делает их полезными при производстве керамических конструкций, таких как глиняные чаши, или для продвинутой электроники.
Он также используется в легких конструктивных элементах в аэрокосмической и электрохимической промышленности, таких как топливные элементы, в которых они обладают ионной проводимостью.
Соединения оксидов металлов представляют собой основные ангидриды и поэтому могут реагировать с кислотами и сильными восстановителями в окислительно-восстановительных реакциях.
Список литературы
- Американские элементы. (С.Ф.). Оксид калия . Получено с сайта americanelements.com.
- EMBL-EBI. (2016, 19 сентября). Оксид калия . Получено с ChEBI: ebi.ac.uk.
- Европейское химическое агентство. (2017, 12 января). Оксид калия . Получено с echa.europa.eu.
- (С.Ф.). ОКСИД КАЛИЯ . Получено с inchem.org.
- Национальный центр биотехнологической информации. . (2017, 29 апреля). База данных PubChem Compound; CID = 9989219 . Получено с pubchem.ncbi.nlm.nih.gov.
- Национальный институт охраны труда. (2014, 1 июля). ОКСИД КАЛИЯ . Получено с cdc.gov.
- ОКСИД КАЛИЯ K2O .(С.Ф.). Получено с allreactions.com.
- Королевское химическое общество. (2015). Калий оксидокалий . Получено с сайта chemspider.com.
ОКИСЬ КАЛИЯ | CAMEO Chemicals
Химический лист данных
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названияХимические идентификаторы
В Поля химического идентификатора включать общие идентификационные номера, NFPA алмаз U. S. Знаки опасности Министерства транспорта и общие
описание химического вещества. Информация в CAMEO Chemicals поступает
из множества
источники данных.
S. Знаки опасности Министерства транспорта и общие
описание химического вещества. Информация в CAMEO Chemicals поступает
из множества
источники данных.Номер CAS Номер ООН / NA Знак опасности DOT USCG CHRIS Код никто Карманный справочник NIOSH Международная карта химической безопасности никто NFPA 704
данные недоступны
Общее описание
Кристаллическое твердое вещество белого цвета.
 Плотнее воды. Контакт может вызвать сильное раздражение кожи, глаз и слизистых оболочек. Может быть токсичным при проглатывании, вдыхании и абсорбции через кожу. Используется для производства других химикатов.
Плотнее воды. Контакт может вызвать сильное раздражение кожи, глаз и слизистых оболочек. Может быть токсичным при проглатывании, вдыхании и абсорбции через кожу. Используется для производства других химикатов.Опасности
Оповещения о реактивности
Реакции воздуха и воды
Растворим в воде. Оксиды калия активно реагируют с водой и выделяют достаточно тепла, чтобы вызвать кипение и разбрызгивание горячего щелочного раствора, [Паспорта химической безопасности SD-9, SD-10.1947]. Реагирует с теплой водой с сильным взрывом [Thorpe and Tlitton J. Chem. Soc. 59: 1019: 1891].
Пожарная опасность
Выдержка из руководства ERG 154 [Вещества — токсичные и / или коррозионные (негорючие)]:Негорючее, само по себе вещество не горит, но может разлагаться при нагревании с образованием коррозионных и / или токсичных паров. Некоторые из них являются окислителями и могут воспламенить горючие вещества (дерево, бумага, масло, одежда и т.
 Д.). При контакте с металлами может выделяться горючий газообразный водород. Емкости могут взорваться при нагревании.Для электромобилей или оборудования следует также обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ERG, 2016)
Д.). При контакте с металлами может выделяться горючий газообразный водород. Емкости могут взорваться при нагревании.Для электромобилей или оборудования следует также обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ERG, 2016)Опасность для здоровья
Выдержка из руководства ERG 154 [Вещества — токсичные и / или коррозионные (негорючие)]:TOXIC; Вдыхание, проглатывание или контакт материала с кожей может привести к серьезным травмам или смерти. Контакт с расплавленным веществом может вызвать серьезные ожоги кожи и глаз. Избегайте контакта с кожей. Эффекты контакта или вдыхания могут быть отсроченными.При пожаре могут выделяться раздражающие, едкие и / или токсичные газы. Сток из воды для пожаротушения или разбавления воды может быть коррозионным и / или токсичным и вызывать загрязнение. (ERG, 2016)
Профиль реактивности
Высшие оксиды калия, образующиеся в воздухе, взрывоопасно реагируют с чистым калием, натрием, сплавами натрий-калий и органическими веществами [Mellor 2, Supp.
 3: 1559. 1963].
3: 1559. 1963].Принадлежит к следующей реактивной группе (группам)
Потенциально несовместимые абсорбенты
Будьте осторожны: жидкости с этой классификацией реактивной группы известно, что он реагирует с абсорбенты перечислено ниже.Дополнительная информация о абсорбентах, включая ситуации, на которые следует обращать внимание …
- Абсорбенты на основе целлюлозы
- Абсорбенты на минеральной и глиняной основе
Ответные рекомендации
В Поля рекомендаций ответа включать расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, противопожарное реагирование, защитная одежда и первая помощь. В информация в CAMEO Chemicals поступает из различных источники данных.Изоляция и эвакуация
Выдержка из руководства ERG 154 [Вещества — токсичные и / или коррозионные (негорючие)]:В качестве немедленной меры предосторожности изолируйте зону разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров (75 футов) для твердых тел.

РАЗЛИВ: при необходимости увеличьте в направлении ветра изоляционное расстояние, указанное выше.
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна вовлечены в пожар, ИЗОЛИРУЙТЕСЬ на 800 метров (1/2 мили) во всех направлениях; также рассмотрите возможность начальной эвакуации на 800 метров (1/2 мили) во всех направлениях.(ERG, 2016)
Пожарная
Выдержка из руководства ERG 154 [Вещества — токсичные и / или коррозионные (негорючие)]:МАЛЫЙ ПОЖАР: Сухие химические вещества, CO2 или водяная струя.
БОЛЬШОЙ ПОЖАР: Сухие химикаты, CO2, спиртоустойчивая пена или водяная струя. Уберите контейнеры из зоны пожара, если это можно сделать без риска. Сделайте плотину противопожарной воды для последующей утилизации; не рассыпать материал.
ПОЖАР В ЦИСТЕРНАХ ИЛИ АВТОМОБИЛЬНЫХ / ПРИЦЕПНЫХ НАГРУЗКАХ: тушите пожар с максимального расстояния или используйте необслуживаемые держатели шлангов или контрольные насадки.Не допускайте попадания воды внутрь контейнеров.
 После того, как огонь потухнет, охладите емкости затопленным количеством воды. Немедленно удалите воду в случае появления шума из вентиляционных устройств безопасности или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ERG, 2016)
После того, как огонь потухнет, охладите емкости затопленным количеством воды. Немедленно удалите воду в случае появления шума из вентиляционных устройств безопасности или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ERG, 2016)Без огня
Выдержка из руководства ERG 154 [Вещества — токсичные и / или коррозионные (негорючие)]:УСТРАНИТЬ все источники воспламенения (запретить курение, факелы, искры или пламя в непосредственной близости). Не прикасайтесь к поврежденным контейнерам или пролитому материалу, если не носите соответствующую защитную одежду.Остановите утечку, если вы можете сделать это без риска. Не допускайте попадания в водные пути, канализацию, подвалы или закрытые пространства. Собрать или накрыть сухой землей, песком или другим негорючим материалом и переложить в контейнеры. НЕ ПОЛУЧАЙТЕ ВОДУ В КОНТЕЙНЕРЫ. (ERG, 2016)
Защитная одежда
Выдержка из руководства ERG 154 [Вещества — токсичные и / или коррозионные (негорючие)]:Надеть автономный дыхательный аппарат с положительным давлением (SCBA).
 Носите химическую защитную одежду, специально рекомендованную производителем.Он может обеспечивать небольшую тепловую защиту или не обеспечивать ее вовсе. Структурная защитная одежда пожарных обеспечивает ограниченную защиту ТОЛЬКО в пожарных ситуациях; он не эффективен в ситуациях разлива, когда возможен прямой контакт с веществом. (ERG, 2016)
Носите химическую защитную одежду, специально рекомендованную производителем.Он может обеспечивать небольшую тепловую защиту или не обеспечивать ее вовсе. Структурная защитная одежда пожарных обеспечивает ограниченную защиту ТОЛЬКО в пожарных ситуациях; он не эффективен в ситуациях разлива, когда возможен прямой контакт с веществом. (ERG, 2016)Ткани для костюмов DuPont Tychem®
Нет доступной информации.
Первая помощь
Выдержка из руководства ERG 154 [Вещества — токсичные и / или коррозионные (негорючие)]:Убедитесь, что медицинский персонал осведомлен о задействованном материале (материалах) и принимает меры предосторожности, чтобы защитить себя.Переместите пострадавшего на свежий воздух. Позвоните в службу 911 или в скорую медицинскую помощь. Сделайте искусственное дыхание, если пострадавший не дышит. Не используйте метод «рот в рот», если пострадавший проглотил или вдохнул вещество; сделайте искусственное дыхание с помощью карманной маски с односторонним клапаном или другого подходящего респираторного медицинского устройства.
 При затрудненном дыхании подайте кислород. Снимите и изолируйте загрязненную одежду и обувь. В случае контакта с веществом немедленно промыть кожу или глаза проточной водой в течение не менее 20 минут.При незначительном контакте с кожей избегайте попадания материала на здоровую кожу. Держите жертву в тепле и спокойствии. Эффекты воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут быть отсроченными. (ERG, 2016)
При затрудненном дыхании подайте кислород. Снимите и изолируйте загрязненную одежду и обувь. В случае контакта с веществом немедленно промыть кожу или глаза проточной водой в течение не менее 20 минут.При незначительном контакте с кожей избегайте попадания материала на здоровую кожу. Держите жертву в тепле и спокойствии. Эффекты воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут быть отсроченными. (ERG, 2016)Физические свойства
Точка воспламенения: данные недоступны
Нижний предел взрываемости (НПВ): данные недоступны
Верхний предел взрываемости (ВПВ): данные недоступны
Температура самовоспламенения: данные недоступны
Точка плавления: данные недоступны
Давление пара: данные недоступны
Плотность пара (относительно воздуха): данные отсутствуют
Удельный вес: данные недоступны
Точка кипения: данные недоступны
Молекулярный вес: данные недоступны
Растворимость в воде: данные отсутствуют
Потенциал ионизации: данные недоступны
IDLH: данные недоступны
AEGL (рекомендуемые уровни острого воздействия)
Нет доступной информации AEGL.
ERPGs (Руководство по планированию действий в чрезвычайных ситуациях)
Нет доступной информации по ERPG.PAC (Критерии защитного действия)
Химическая промышленность PAC-1 PAC-2 PAC-3 Оксид калия (12136-45-7) 0,18 мг / м3 2 мг / м3 54 мг / м3 (DOE, 2016)
Нормативная информация
В Поля нормативной информации включать информацию из U.S. Сводный список раздела III Агентства по охране окружающей среды. Списки, химический объект Министерства внутренней безопасности США Стандарты борьбы с терроризмом, и Управления по охране труда и здоровья США Стандартный список управления производственной безопасностью особо опасных химических веществ (см. подробнее об этих
источники данных).
подробнее об этих
источники данных).Сводный список списков Агентства по охране окружающей среды
Нет нормативной информации.Стандарты по борьбе с терроризмом для химических объектов DHS (CFATS)
Нет нормативной информации.Список стандартов OSHA Process Safety Management (PSM)
Нет нормативной информации.Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества, включая торговые наименования и синонимы.
- ОКИСЬ ДИПОТАЦИЯ
- ОКСИД ДИПОТАЦИЯ
- КАЛИЙНЫЙ
- ОКСИД КАЛИЯ
- ОКСИД КАЛИЯ

- В вашем браузере отключены файлы cookie.

 2
2


 \ circ {\ rm {C}} \). В этой статье мы подробно объяснили формулу, другие методы приготовления, физические и химические свойства, а также их основные применения.
\ circ {\ rm {C}} \). В этой статье мы подробно объяснили формулу, другие методы приготовления, физические и химические свойства, а также их основные применения. Это оксид металла. Обычно оксиды металлов имеют основную природу.
Это оксид металла. Обычно оксиды металлов имеют основную природу. Второй и третий приведенные методы, вероятно, являются наиболее удобными, хотя использование гидратированного хлорида железа (II) более выгодно, чем использование безводного соединения. Ферроцен стоил всего 0,15 доллара за г −1 в 1981 году, и сейчас мало кто решает синтезировать его.
Второй и третий приведенные методы, вероятно, являются наиболее удобными, хотя использование гидратированного хлорида железа (II) более выгодно, чем использование безводного соединения. Ферроцен стоил всего 0,15 доллара за г −1 в 1981 году, и сейчас мало кто решает синтезировать его. , 1978, 286 , 315.
, 1978, 286 , 315.
 113.
113.
 С., Россия. Chem. Rev. ( англ. Пер. ), 1974, 43 , 710; Кочеткова Н.С., Кочеткова Ю. К. Крынкина, Россия. Chem. Rev. ( Engl. Transl. ), 1978, 47 , 486.
С., Россия. Chem. Rev. ( англ. Пер. ), 1974, 43 , 710; Кочеткова Н.С., Кочеткова Ю. К. Крынкина, Россия. Chem. Rev. ( Engl. Transl. ), 1978, 47 , 486. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
Его структура представлена на рисунке 1 (EMBL-EBI, 2016).

 Он легко окисляется до других оксидов калия, перекиси или кислого оксида калия (KHO). Соединение не горючее, но активно и экзотермически реагирует с водой с образованием гидроксида калия (КОН).
Он легко окисляется до других оксидов калия, перекиси или кислого оксида калия (KHO). Соединение не горючее, но активно и экзотермически реагирует с водой с образованием гидроксида калия (КОН). Поместите пострадавшего под защитный душ.
Поместите пострадавшего под защитный душ.
 S And производит и / или импортирует от 10 до 100 тонн этого вещества в год в Европейскую экономическую зону.
S And производит и / или импортирует от 10 до 100 тонн этого вещества в год в Европейскую экономическую зону.


 S. Знаки опасности Министерства транспорта и общие
описание химического вещества. Информация в CAMEO Chemicals поступает
из множества
источники данных.
S. Знаки опасности Министерства транспорта и общие
описание химического вещества. Информация в CAMEO Chemicals поступает
из множества
источники данных. Плотнее воды. Контакт может вызвать сильное раздражение кожи, глаз и слизистых оболочек. Может быть токсичным при проглатывании, вдыхании и абсорбции через кожу. Используется для производства других химикатов.
Плотнее воды. Контакт может вызвать сильное раздражение кожи, глаз и слизистых оболочек. Может быть токсичным при проглатывании, вдыхании и абсорбции через кожу. Используется для производства других химикатов. Д.). При контакте с металлами может выделяться горючий газообразный водород. Емкости могут взорваться при нагревании.Для электромобилей или оборудования следует также обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ERG, 2016)
Д.). При контакте с металлами может выделяться горючий газообразный водород. Емкости могут взорваться при нагревании.Для электромобилей или оборудования следует также обращаться к ERG Guide 147 (литий-ионные батареи) или ERG Guide 138 (натриевые батареи). (ERG, 2016) 3: 1559. 1963].
3: 1559. 1963].
 После того, как огонь потухнет, охладите емкости затопленным количеством воды. Немедленно удалите воду в случае появления шума из вентиляционных устройств безопасности или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ERG, 2016)
После того, как огонь потухнет, охладите емкости затопленным количеством воды. Немедленно удалите воду в случае появления шума из вентиляционных устройств безопасности или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ERG, 2016) Носите химическую защитную одежду, специально рекомендованную производителем.Он может обеспечивать небольшую тепловую защиту или не обеспечивать ее вовсе. Структурная защитная одежда пожарных обеспечивает ограниченную защиту ТОЛЬКО в пожарных ситуациях; он не эффективен в ситуациях разлива, когда возможен прямой контакт с веществом. (ERG, 2016)
Носите химическую защитную одежду, специально рекомендованную производителем.Он может обеспечивать небольшую тепловую защиту или не обеспечивать ее вовсе. Структурная защитная одежда пожарных обеспечивает ограниченную защиту ТОЛЬКО в пожарных ситуациях; он не эффективен в ситуациях разлива, когда возможен прямой контакт с веществом. (ERG, 2016) При затрудненном дыхании подайте кислород. Снимите и изолируйте загрязненную одежду и обувь. В случае контакта с веществом немедленно промыть кожу или глаза проточной водой в течение не менее 20 минут.При незначительном контакте с кожей избегайте попадания материала на здоровую кожу. Держите жертву в тепле и спокойствии. Эффекты воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут быть отсроченными. (ERG, 2016)
При затрудненном дыхании подайте кислород. Снимите и изолируйте загрязненную одежду и обувь. В случае контакта с веществом немедленно промыть кожу или глаза проточной водой в течение не менее 20 минут.При незначительном контакте с кожей избегайте попадания материала на здоровую кожу. Держите жертву в тепле и спокойствии. Эффекты воздействия (вдыхание, проглатывание или контакт с кожей) вещества могут быть отсроченными. (ERG, 2016)
 подробнее об этих
источники данных).
подробнее об этих
источники данных).