Типичные реакции кислот, оснований, оксидов, солей (условия их проведения)
Типичные реакции кислот, оснований, оксидов, солей (условия их проведения)
Типичные реакции кислот
1. Кислота + основание → соль + вода
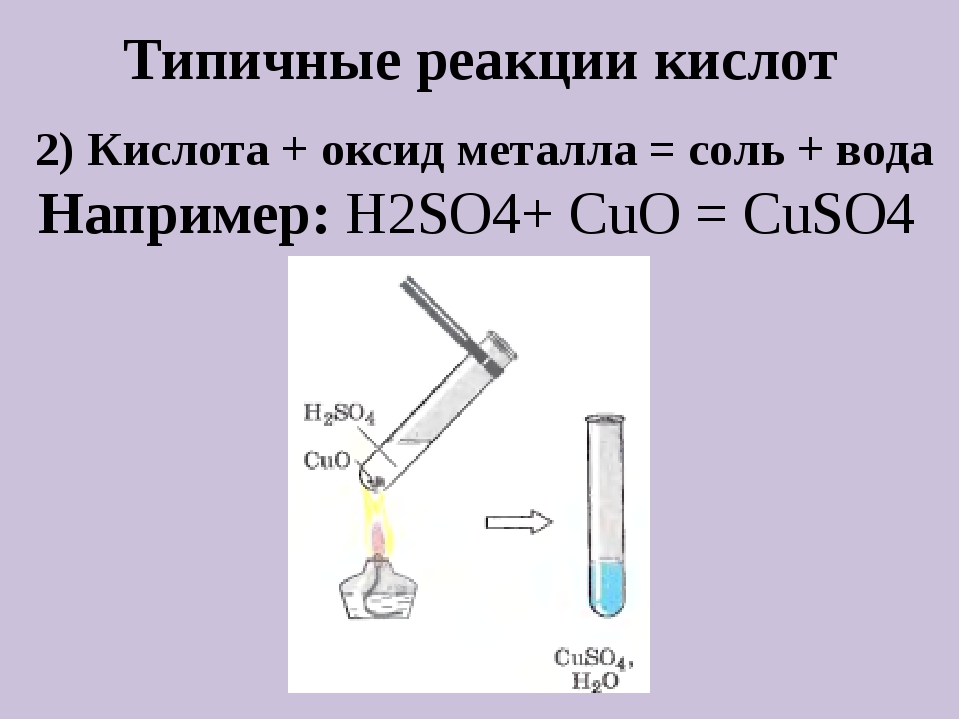
2. Кислота + оксид металла → соль + вода
3. Кислота + металл → соль + водород (условия: а) металл должен находиться в электрохимическом ряду напряжений левее водорода; б) должна получиться растворимая соль; в) нерастворимая кислота – кремниевая не реагирует с металлами; г) концентрированные серная и азотная кислоты реагируют иначе с металлами, водород не выделяется)
4. Кислота + соль → новая кислота + новая соль. (условие: реакция идёт в том случае, если образуется осадок или газ)
Типичные реакции оснований
1.
2. Основание + оксид неметалла → соль + вода (условие: оксид неметалла – кислотный оксид)
3. Щёлочь + соль → новое основание + новая соль (условие: образуется осадок или газ)
Типичные реакции основных оксидов
1. Основный оксид + кислота → соль + вода
2. Основный оксид + кислотный оксид → соль
3. Основный оксид + вода → щёлочь (условие: образуется растворимое основание-щёлочь)
Типичные реакции кислотных оксидов
1. Кислотный оксид + основание → соль + вода
2. Кислотный оксид + основный оксид → соль
3. Кислотный оксид + вода → кислота (условие: кислота должна быть растворимой)
Типичные реакции солей
1. Соль + кислота → другая соль + другая кислота (условие: если образуется осадок или газ)
Соль + кислота → другая соль + другая кислота (условие: если образуется осадок или газ)
2. Соль + щёлочь → другая соль + другое основание (условие: если образуется осадок или газ)
3. Соль1 + соль2 → соль3 + соль 4 (условие: образуется осадок)
4. Соль + металл → другая соль + другой металл (условие: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений; при этом обе соли должны быть растворимыми)
Оксиды. Классификация и химические свойства. 8 класс
1. Тема: «Оксиды. Классификация и химические свойства».
8 класс2. Оксиды-это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Общая формула оксидов:ЭnOm
5. Несолебразующими называют такие оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами и не образуют солей.
 Примеры несолеобразующих
Примеры несолеобразующихоксидов: NO; N2O; CO; SiO.
Солеобразующими
называются оксиды,
которые взаимодействуют с
кислотами или с щелочами
с образованием соли и
7. Солеобразующие оксиды:
8. Кислотные оксиды-это такие оксиды, которым соответствуют кислоты (оксиды неМе или металлов с валентностью 3-7) CO2 — h3CO3
SO2-h3SO3Mn2O7-HMnO4
Нерастворимый в воде
кислотный оксид
SiO2
10. Типичные реакции кислотных оксидов
Кислотный оксид +щёлочь→соль + вода (реакция
обмена).
SO3+2KOH→K2SO4+h3O
CO2+Ca(OH)2→CaCO3+h3O
Кислотный оксид +
вода→кислота
(реакция соединения)
11. Основные оксиды-это такие оксиды, которым соответствуют основания (Ме с валентностью- 1 и 2)
K2O – KOHLi2O-LiOH
Sr(OH)2
BaO- Ba(OH)2
SrO-
12. Типичные реакции основных оксидов
• Основный оксид + кислота→соль +вода
(реакция обмена)
CuO + h3SO4→CuSO4 + h3O
K2O +2HCl→2KCl + h3O
Основный оксид +
вода→щёлочь
(реакция соединения)
13.
 Общие свойства оксидов: Основный оксид + кислотный
Общие свойства оксидов: Основный оксид + кислотныйоксид→ соль
(реакция соединения)
Li2O + CO2 → Li2CO3
SO2 + MgO → MgSO3
14. Задания для закрепления изученной темы:
1).Какие из перечисленных веществявляются оксидами?
КОН; SiO2; h3SO4; CaO; NaCl; N2O3;
Fe2O3; Zn(OH)2; Al2O3.
2)Какие из перечисленных веществ
являются основными и
кислотными оксидами? Дать им
названия.
Li2O; SO3; FeO; Mn2O7;CO2; BaO; SiO2
15. Задание 3:Осуществить следующие превращение:
алюминий→оксид алюминия→гидроксид
алюминия→бромид
алюминия→алюминий.
Напишите уравнения реакций.
16. Выводы:
1)повторили определение«оксидов»,
2)рассмотрели классификацию
оксидов по агрегатному
состоянию и способности
образовывать соли,
3)изучили свойства основных и
кислотных оксидов, а также их
общие свойства.
17. Домашнее задание:
Учить параграф №30, упр.1,3,5стр.
 92
9218. Используемые интернет-ресурсы:
ru.wikipedia.org›Оксиды
festival.1september.ru
metod-kopilka.ru
infourok.ru
900igr.net›kartinki/khimija…svojstva
…Oksidy.html
Оксиды, классификация и химические свойства
Цель:
- систематизировать и углубить знания учащихся о составе оксидов, их классификации и свойствах основных и кислотных оксидов;
- продолжить развитие умений учащихся составлять уравнения химических реакций по схемам;
- продолжить работу над развитием умений обобщать и сравнивать;
- способствовать воспитанию уважения и толерантности к окружающим.
Оборудование:
- ПСХЭ, таблица «Растворимость солей, кислот и оснований», компьютер, мультимедийный проектор, презентация урока, раздаточный материал.
- Презентация.

Ход урока
| Этап урока | №, название и содержание слайда | Деятельность учителя и ученика |
| Организационный момент | ||
| Повторение изученного материала | №1 «Тема и цель урока» | Учитель сообщает тему и цель урока, |
| №2 «Определение оксидов» | Ученики дают определение оксидов, отличие от других классов соединений. | |
| №3 «Классификация оксидов по агрегатному состоянию» | Ученики приводят конкретные примеры. |
|
| №4 «Фото» | Перед вами фотография самого удивительного вещества на Земле. | |
| №5 «Фото» | Это вещество выделяют при дыхании все живые организмы и только растения способны в присутствии данного газа образовывать органические вещества. | |
| №6 «Оксид кремния» | Найдите в средствах информации материал о значении данного оксида. | |
| Изучение нового материала | №7 «Классификация оксидов по способности к солеобразованию» | Объяснение материала учителем. |
| №8 «Несолеобразующие оксиды» | Объяснение материала учителем | |
| №9 «Солеобразующие оксиды» | Объяснение материала учителем | |
| №10 «Основные оксиды» | Ученики приводят примеры по ПСХЭ | |
| №11 «Кислотные оксиды» | Ученики приводят примеры по ПСХЭ | |
| №12 «Типичные реакции основных оксидов» | Работа у доски. |
|
| №13 «Типичные реакции кислотных оксидов» | Работа у доски | |
| №14 «Общее свойство оксидов» | Работа у доски | |
| №15 «Исключения реакций с водой» | Объяснение материала учителем. Учитель проводит физкультминутку для глаз под музыку. |
|
| Работа в группах | Учитель объясняет правила работы в группах с консультантами, раздаёт карточки-тренажёры1и 2, учащиеся работают в группах. После определённого времени консультанты покидают свои группы и выполняют дополнительные задания. | |
| Самостоятельная работа | Ученики выполняют самостоятельную
работу, подтверждая работу консультантов. |
|
| Заключительная часть урока | №16 «Выводы» | Ученики делают выводы с помощью учителя |
| №17 «Домашнее задание» | Консультация учителя | |
| №18 «Дополнительное задание» | Если останется время. |
Тренажёр.
1. Выпиши формулы:
А) основных оксидов
Б) кислотных оксидов.
NO2 CaSO4 BaSO4 SO2 Mg(OH)2 HNO3 NaCl Fe2(SO4)3 CaO
KNO2 MgO Fe2O3 Na2SO4 Ca3(PO4)2 CuO H2CO3 Na2CO3 KOH H2SO4 Fe(OH)3
2. Реши уравнения реакций:
Реши уравнения реакций:
SO3 + H2O->
P2O5 + H2O->
SO2 + H2O->
CO2+ H2O->
N2O3+ H2O->
N2O5+H2O->
SiO2+H2O->
CaO + HCl->
CaO + H2SO4->
CaO + HNO3 ->
Консультант________________________________________
| Ученик (ф. и.) | Оценка консультанта | Оценка учителя | Итоговая оценка |
Тренажёр.
Даны следующие вещества: оксид бария, оксид
натрия, оксид водорода, угарный газ, углекислый
газ, оксид кремния.
Какие из них будут взаимодействовать с серной кислотой. Напишите возможные уравнения реакций.
Проверочная работа.
1 вариант.
1. Выпиши формулы:
А) основных оксидов
Б) кислотных оксидов
Al2 (SO4)3 K3PO4 H2SO3 Na2CO3 BaO CO2 Cr(OH)3 Ca(OH)2 Zn(OH)2 SO3 HCl K2SO4 H3PO4 NaOH K2O Fe(OH)2 NaNO3 N2O5 HJ
2.Реши уравнения реакций:
MgO + HCl->
MgO + H2SO4->
MgO + HNO3->
SO3 + H2O->
Проверочная работа
2 вариант.
1. Выпиши формулы:
А) основных оксидов
Б) кислотных оксидов
H2SO4 Na2O SO2 CuO HPO3 P2O3 Zn(OH)2
KOH Ca(NO3)2 KCl MgCl2 Cu(OH)2 BaO
HBr Cl2O7 FeCl3 NaOH HCl Zn(NO3)2
2. Реши уравнения реакций:
Реши уравнения реакций:
BaO + HCl->
BaO + H2SO4->
BaO + HNO3->
SO2 + H2O->
Взаимодействие кислотных и основных оксидов
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Оксиды. Химические свойства и способы получения. Классификация, получение и свойства оксидов Оксиды химические свойства оксидов получение
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N 2 O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов : большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O 2 → 2Al 2 O 3
Не взаимодействуют с кислородом золото, платина, палладий .
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na 2 O 2 ,
2Na + O 2 → 2Na 2 O 2
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO 2:
K + O 2 → KO 2
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O 2 → 2Fe 2 O 3
4Cr + 3O 2 → 2Cr 2 O 3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O 2 → Fe 3 O 4
1.2. Окисление простых веществ-неметаллов .
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O 2(изб. ) → 2P 2 O 5
) → 2P 2 O 5
4P + 3O 2(нед.) → 2P 2 O 3
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
S + O 2 → SO 2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO 2 + O 2 = 2SO 3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
N 2 + O 2 = 2NO
Не окисляется кислородом фтор F 2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl 2 , бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS 2 образуются оксид железа (III) и оксид серы (IV):
4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H 2 S + 3O 2(изб.) → 2H 2 O + 2SO 2
2H 2 S + O 2(нед.) → 2H 2 O + 2S
А вот аммиак горит с образованием простого вещества N 2 , т.к. азот реагирует с кислородом только в жестких условиях:
4NH 3 + 3O 2 →2N 2 + 6H 2 O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH 3 + 5O 2 → 4NO + 6H 2 O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H 2 CO 3 → H 2 O + CO 2
H 2 SO 3 → H 2 O + SO 2
NH 4 OH → NH 3 + h3O
2AgOH → Ag 2 O + H 2 O
2CuOH → Cu 2 O + H 2 O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др. :
:
H 2 SiO 3 → H 2 O + SiO 2
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li 2 CO 3 → H 2 O + Li 2 O
CaCO 3 → CaO + CO 2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO 3) 2 → 2ZnO + 4NO 2 + O 2
Более подробно про разложение нитратов можно прочитать в статье .
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
2. Классификация, получение и свойства оксидов
Из бинарных соединений наиболее известны оксиды. Оксидами
называются соединения, состоящие из двух элементов, одним из которых является
кислород, имеющий степень окисления -2. По функциональным признакам
оксиды подразделяются на солеобразующие и несолеобразующие (безразличные) .
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и
амфотерные.
По функциональным признакам
оксиды подразделяются на солеобразующие и несолеобразующие (безразличные) .
Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и
амфотерные.
Названия оксидов образуются с применением слова «оксид» и русского названия элемента в родительном падеже с указанием римскими цифрами валентности элемента, например: SO 2 — оксид серы (IV ), SO 3 — оксид серы (VI ), CrO — оксид хрома (II ), Cr 2 O 3 — оксид хрома (III ).
2.1. Основные оксиды
Основными называются оксиды, взаимодействующие с кислотами (или с кислотными оксидами) с образованием солей.
К основным оксидам относятся оксиды типичных металлов , им соответствуют гидроксиды, обладающие свойствами оснований (основные гидроксиды), причем степень окисления элемента не изменяется при переходе от оксида к гидроксиду, например,
Получение основных оксидов
1. Окисление металлов при нагревании в атмосфере кислорода:
2Mg + O 2 = 2MgO,
2Cu
+ O 2 = 2CuO.
Этот метод неприменим для щелочных металлов, которые при окислении обычно дают пероксиды и супероксиды, и только литий, сгорая, образует оксид Li 2 O .
2. Обжиг сульфидов:
2 CuS + 3 O 2 = 2 CuO + 2 SO 2 ,
4 FeS 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 .
Метод неприменим для сульфидов активных металлов , окисляющихся до сульфатов.
3. Разложение гидроксидов (при высокой температуре):
С u (OH ) 2 = CuO + H 2 O .
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот (при высокой температуре):
ВаСО 3 = ВаО + СО 2 ,
2Pb(NO 3) 2 = 2PbO + 4NO 2 + O 2 ,
4 FeSO 4 = 2 Fe 2 O 3 + 4 SO 2 + O 2 .
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
(ZnOH) 2 CO 3 = 2ZnO +CO 2 + H 2 O.
Свойства основных оксидов
Большинство основных
оксидов представляет собой твердые кристаллические вещества ионного характера,
в узлах кристаллической решетки расположены ионы металлов, достаточно прочно
связанные с оксид-ионами О —2 , поэтому оксиды типичных металлов
обладают высокими температурами плавления и кипения.
1. Большинство основных оксидов не распадаются при нагревании, исключение составляют оксиды ртути и благородных металлов:
2HgO = 2Hg + O 2 ,
2Ag 2 O = 4Ag + O 2 .
2. Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами:
BaO + SiO 2 = BaSiO 3 ,
MgO + Al 2 O 3 = Mg(AlO 2) 2 ,
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O.
3. Присоединяя (непосредственно или косвенно) воду, основные оксиды образуют основания (основные гидроксиды). Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Li 2 O + H 2 O = 2 LiOH ,
CaO + H 2 O = Ca (OH ) 2 .
Исключение составляет оксид магния MgO . Из него нельзя получить гидроксид магния Mg (OH ) 2 при взаимодействии с водой.
4. Как и все другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
Fe 2 O 3 + 2Al = Al 2 O 3 + 2Fe,
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O,
4
FeO
+
O
2
= 2
Fe
2
O
3
.
М.В. Андрюxoва, Л.Н. Бopoдина
1 группа — несолеобразующие — N 2 O, NO, CO, SiO.
2 группа — солеобразующие:
- Основные — это такие оксиды, которым соответствуют основания. Оксиды металлов , степень окисления которых +1, +2: Na 2 O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
- Основный оксид + кислота → соль + вода (реакция обмена).
- Основный оксид + кислотный оксид → соль (реакция соединения)
- Основный оксид + вода → щелочь (реакция соединения).
- Кислотные — — это такие оксиды, которым соответствуют кислоты. Оксиды неметаллов. Оксиды металлов , степень окисления которых > +5: SO 2 , SO 3
, P 2 O 5 , CrO 3 , Mn 2 O 7
.
 Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов: - Кислотный оксид + основание → соль + вода (реакция обмена).
- Кислотный оксид + основный оксид → соль (реакция соединения).
- Кислотный оксид + вода → кислота (реакция соединения)
- Амфотерные — это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Оксиды металлов , степень окисления которых +2, +3, +4: BeO, ZnO, Al 2 O 3 , Cr 2 O 3 , MnO 2 . Взаимодействуют как с кислотами так и с основаниями. Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов:
- Амфотерный оксид + кислота → соль + вода (реакция обмена).
- Амфотерный оксид + основание → соль + вода или комплексное соединение.
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Взаимодействие с кислородом
При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О 2 = 2СО 2 .
Взаимодействие с водородом : СО + Н 2 = С + Н 2 О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl 2 = COCl 2 (фосген). и серой СО + S = COS (карбонилсульфид).
Восстановительные свойства
СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C +2 O + CuO = Сu + C +4 O 2 .
Взаимодействие с переходными металлами
С переходными металлами образует карбонилы:
- Ni + 4CO = Ni(CO) 4 ;
- Fe + 5CO = Fe(CO) 5 .
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO 2 , бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО 2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO 2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
- Na 2 O + CO 2 = Na 2 CO 3 ,
- 2NaOH + CO2 = Na 2 CO 3 + H 2 O,
- NaOH + CO 2 = NaHCO 3 .
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды.
Взаимодействие оксидов с водой
| Правило | Комментарий |
|---|---|
| Основный оксид + H 2 O → Щелочь | Реакция идет, если образуется растворимое основание, а также Ca(OH) 2: CaO + H 2 O → Ca(OH) 2 MgO + H 2 O → Реакция не идет, ак как Mg(OH) 2 нерастворим* |
| Амфотерный оксид | Амфотерные оксиды, также как и амфотерные гидроксиды, с водой не взаимодействуют |
| Кислотный оксид + H 2 O → Кислота | Все реакции идут за исключением SiO 2 (кварц, песок): SiO 2 + H 2 O → реакция не идет |
* Источник: «Я сдам ЕГЭ. Курс самоподготовки», стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na 2 O + CaO → реакция не идет
CO 2 + SO 3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO 2 , SO 2 , о них подробнее ниже):
Na 2 O + SO 3 → Na 2 SO 4
CaO + CO 2 → CaCO 3
Na 2 O + ZnO → Na 2 ZnO 2
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Na 2 O + HNO 3 → NaNO 3 + H 2 O
ZnO + 2HCl → ZnCl 2 + H 2 O
Al 2 O 3 + 3H 2 SO 4 → Al 2 (SO 4) 3 + 3H 2 O
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H 2 SiO 3 . Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H 2 SiO 3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
SO 2 + 2H 2 S → 3S + 2H 2 O
SO 3 + H 2 S → SO 2 — + H 2 O
SiO 2 + 4HF(нед.) → SiF 4 + 2H 2 O
С кислотами-окислителями (только если оксид можно окислить):
SO 2 + HNO 3 + H 2 O → H 2 SO 4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
CO 2 + 2NaOH → Na 2 CO 3 + H 2 O
CO 2 + NaOH → NaHCO 3 (если CO 2 в избытке)
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H 2 O → Na 2 (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H 2 O → Na 2 (тетрагидроксобериллат натрия)
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O (цинкат натрия)
(кислота: H 2 ZnO 2)
BeO + 2NaOH → Na 2 BeO 2 + H 2 O (бериллат натрия)
(кислота: H 2 BeO 2)
Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O (алюминат натрия)
(кислота: HAlO 2)
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
SiO 2 + CaCO 3 → CaSiO 3 + CO 2 —
P 2 O 5 + 3CaCO 3 → Ca 3 (PO 4) 2 + 3CO 2 —
Al 2 O 3 + Na 2 CO 3 → 2NaAlO 2 + CO 2
Cr 2 O 3 + Na 2 CO 3 → 2NaCrO 2 + CO 2
ZnO + 2KHCO 3 → K 2 ZnO 2 + 2CO 2 + H 2 O
SiO 2 + K 2 SO 3 → K 2 SiO 3 + SO 2 —
ZnO + Na 2 SO 3 → Na 2 ZnO 2 + SO 2 —
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K 2 CO 3 + SO 2 → K 2 SO 3 + CO 2 — (H 2 CO 3 слабее и менее устойчива, чем H 2 SO 3)
2. Растворенный в воде CO 2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO 2 + H 2 O + CaCO 3 → Ca(HCO 3) 2
CO 2 + H 2 O + MgCO 3 → Mg(HCO 3) 2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO 3 + CO 2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H 2:
CuO + C → Cu + CO-
CuO + CO → Cu + CO 2
CuO + H 2 → Cu + H 2 O-
ZnO + C → Zn + CO-
ZnO + CO → Zn + CO 2
ZnO + H 2 → Zn + H 2 O-
PbO + C → Pb + CO
PbO + CО → Pb + CO 2 —
PbO + H 2 → Pb + H 2 O
FeO + C → Fe + CO
FeO + CО → Fe + CO 2 —
FeO + H 2 → Fe + H 2 O
Fe 2 O 3 + 3C → 2Fe + 3CO
Fe 2 O 3 + 3CО → 2Fe + 3CO 2
Fe 2 O 3 + 3H 2 → 2Fe + 3H 2 O-
WO 3 + 3H 2 → W + 3H 2 O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
CaO + 3C → CaC 2 + 3CO
2Al 2 O 3 + 9C → Al 4 C 3 + 6CO
3. Восстановление более активным металлом:
3FeO + 2Al → 3Fe + Al 2 O 3
Cr 2 O 3 + 2Al → 2Cr + Al 2 O 3 .
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
2P 2 O 5 + 5C → 4P + 5CO 2
SO 2 + C → S + CO 2
2NO + C → N 2 + CO 2
2N 2 O + C → 2N 2 + CO 2
SiO 2 + 2C → Si + 2CO
Только оксиды азота и углерода реагируют с водородом:
2NO + 2H 2 → N 2 + 2H 2 O
N 2 O + H 2 → N 2 + H 2 O
SiO 2 + H 2 → реакция не идет.
В случае углерода восстановления до простого вещества не происходит:
CO + 2H 2 CH 3 OH (t, p, kt)
Особенности свойств оксидов CO 2 и SO 2
1. Не реагируют с амфотерными гидроксидами:
CO 2 + Al(OH) 3 → реакция не идет
2. Реагируют с углеродом:
CO 2 + C → 2CO-
SO 2 + C → S + CO 2 —
3. С сильными восстановителями SO 2 проявляет свойства окислителя:
SO 2 + 2H 2 S → 3S + 2H 2 O
SO 2 + 4HI → S + 2I 2 + 2H 2 O
SO 2 + 2C → S + CO 2
SO 2 + 2CO → S + 2CO 2 (Al 2 O 3 , 500°C)
4. Сильные окислители окисляют SO 2:
SO 2 + Cl 2 SO 2 Cl 2
SO 2 + Br 2 SO 2 Br 2
SO 2 + NO 2 → SO 3 + NO
SO 2 + H 2 O 2 → H 2 SO 4
5SO 2 + 2KMnO 4 +2H 2 O → 2MnSO 4 + K 2 SO 4 + 2H 2 SO 4
SO 2 + 2KMnO 4 + 4KOH → 2K 2 MnO 4 +K 2 SO 4 + 2H 2 O
SO 2 + HNO 3 + H 2 O → H 2 SO 4 + NO
6. Оксид углерода (IV) CO 2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
Оксид углерода (IV) CO 2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO 2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N 2 O 5 , NO 2 , NO, N 2 O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H 2 , HI и йодиды, H 2 S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2NO 2 + 4CO  → N 2 + 4CO 2
2NO 2 + 2S → N 2 + 2SO 2
2NO 2 + 4Cu → N 2 + 4CuO
N 2 O 5 + 5Cu → N 2 + 5CuO
2N 2 O 5 + 2KI → I 2 + 2NO 2 + 2KNO 3
N 2 O 5 + H 2 S → 2NO 2 + S + H 2 O
2NO + 2H 2 → N 2 + 2H 2 O
2NO + C → N 2 + CO 2
2NO + Cu → N 2 + 2Cu 2 O
2NO + Zn → N 2 + ZnO
2NO + 2H 2 S → N 2 + 2S + 2H 2 O
N 2 O + H 2 → N 2 + H 2 O
2N 2 O + C → 2N 2 + CO 2
N 2 O + Mg → N 2 + MgO
2. Могут окисляться сильными окислителями (кроме N 2 O 5 , так как степень окисления уже максимальная):
Могут окисляться сильными окислителями (кроме N 2 O 5 , так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO 3 + 3KCl + H 2 O
8NO + 3HClO 4 + 4H 2 O → 8HNO 3 + 3HCl
14NO + 6HBrO 4 + 4H 2 O → 14HNO 3 + 3Br 2
NO + KMnO 4 + H 2 SO 4 → HNO 3 + K 2 SO 4 + MnSO 4 + H 2 O
5N 2 O + 2KMnO 4 + 3H 2 SO 4 → 10NO + 2MnSO 4 + K 2 SO 4 + 3H 2 O.
3. Несолеобразующие оксиды N 2 O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2CO + O 2 → 2CO 2
CO + 2H 2 CH 3 OH (t, p, kt)
CO + Cl 2 COCl 2 (фосген)
2. Реагирует с некоторыми сложными соединениями:
CO + KOH → HCOOK
CO + Na 2 O 2 → Na 2 CO 3
CO + Mg → MgO + C (t)
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
CO + CuO → Cu + CO 2
3CO + Fe 2 O 3 → 2Fe + 3CO 2
3CO + Cr 2 O 3 → 2Cr + 3CO 2
2CO + SO 2 → S + 2CO 2 — (Al 2 O 3 , 500°C)
5CO + I 2 O 5 → I 2 + 5CO 2 —
4CO + 2NO 2 → N 2 + 4CO 2
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO 2
1. Взаимодействует с активными металлами:
SiO 2 + 2Mg → 2MgO + Si
SiO 2 + 2Ca → 2CaO + Si
SiO 2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
SiO 2 + 2C → Si + 2CO
(Согласно пособию «Курс самоподготовки» Каверина, SiO 2 + CO → реакция не идет)
3 С водородом SiO 2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO 2 + 2NaOH → Na 2 SiO 3 +H 2 O
SiO 2 + CaO → CaSiO 3
SiO 2 + BaO → BaSiO 3
SiO 2 + Na 2 CO 3 → Na 2 SiO 3 + CO 2
SiO 2 + CaCO 3 → CaSiO 3 + CO 2
SiO 2 + Cu(OH) 2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO 2 взаимодействует только с плавиковой кислотой:
SiO 2 + 4HF → SiF 4 + 2H 2 O.
Свойства оксида P 2 O 5 как сильного водоотнимающего средства
HCOOH + P 2 O 5 → CO + H 3 PO 4
2HNO 3 + P 2 O 5 → N 2 O 5 + 2HPO 3
2HClO 4 + P 2 O 5 → Cl 2 O 7 + 2HPO 3 .
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu 2 O + O 2 (t)
2HgO → 2Hg + O 2 (t)
Кислотные:
2SO 3 → 2SO 2 + O 2 (t)
2N 2 O → 2N 2 + O 2 (t)
2N 2 O 5 → 4NO 2 + O 2 (t)
Амфотерные:
4MnO 2 → 2Mn 2 O 3 + O 2 (t)
6Fe 2 O 3 → 4Fe 3 O 4 + O 2 (t).
Особенности оксидов NO 2 , ClO 2 и Fe 3 O 4
1. Диспропорционирование: оксидам NO 2 и ClO 2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO 2 и хлорат и хлорит в случае ClO 2:
2N +4 O 2 + 2NaOH → NaN +3 O 2 + NaN +5 O 3 + H 2 O
4NO 2 + 2Ba(OH) 2 → Ba(NO 2) 2 + Ba(NO 3) 2 + 2H 2 O
2NO 2 + Na 2 CO 3 → NaNO 3 + NaNO 2 + CO 2
В аналогичных реакциях с кислородом образуются только соединения с N +5 , так как он окисляет нитрит до нитрата:
4NO 2 + O 2 + 4NaOH → 4NaNO 3 + 2H 2 O
4NO 2 + O 2 + 2H 2 O → 4HNO 3 (растворение в избытке кислорода)
2Cl +4 O 2 + H 2 O → HCl +3 O 2 + HCl +5 O 3
2ClO2
+ 2NaOH → NaClO 2 + NaClO 3 + H 2 O
2. Оксид железа (II,III) Fe 3 O 4 (FeO·Fe 2 O 3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Оксид железа (II,III) Fe 3 O 4 (FeO·Fe 2 O 3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Fe 3 O 4 + 8HCl → FeCl 2 + 2FeCl 3 4H 2 O.
Оксиды — сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2 .
По способности образовывать соли оксиды делят на солеобразующие и несолеобразующие (СО,SiO,NO,N 2 О). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные .
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li 2 О, Na 2 О, К 2 О, Cs 2 О, Rb 2 О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu 2 O, CuO, Ag 2 O, СrO, FeO, MnO, СоO, NiO).
Кислотные оксиды образуют как элементы-неметаллы (СО 2 , SO 2 , NO 2 ,Р 2 O 5 , Cl 2 O 7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V 2 O 5 , СrO 3 , Mn 2 O 7 , MnO 3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI 2 O 3 , Fe 2 O 3 , BeO, Cr 2 O 3 , PbO, SnO, MnO 2).
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO 3 ,Сl 2 O7,Mn 2 O7), газообразными (CO 2 , SO 2 , NO 2) и твердыми (P 2 O 5 , SiO 2). Некоторые имеют запах (NO 2 , SO 2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый газ NO 2 , вишнево-красный CrO 3 , черные CuO и Ag 2 O, красные Cu 2 O и HgO, коричневый Fe 2 O 3 , белые SiO 2 , Аl 2 O 3 и ZnO, другие — бесцветные (H 2 O, CO 2 , SO 2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют , для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Большинство кислотных оксидов вещества (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Al 2 O 3 +6KOH+3H 2 O=2K 3 — гексагидроксоалюминат калия;
ZnO+2NaOH+H 2 O=Na 2 — тетрагидроксоцинкат натрия;
ДЗ Оксиды в свете ТЭД 22 04
ДЗ
Оксиды в свете ТЭД 22. 04. 2017
Разнообразие оксидов Аметист Кварц Вода Бурый газ Песок
Классификация оксидов
Определения Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами и не образуют солей Солеобразующие оксиды – это оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду Основные оксиды – это оксиды, которым соответствуют основания Кислотные оксиды – это оксиды, которым соответствуют кислоты
Основные оксиды Основный оксид – это оксид металла со СО +1, +2 Основные оксиды – это в основном оксиды металлов I и II группы, главной подгруппы, Hg. O, Mn. O, Cu. O Мех. Оу Все основные оксиды – твердые вещества
O, Mn. O, Cu. O Мех. Оу Все основные оксиды – твердые вещества
Типичные реакции основных оксидов Кислота Основный оксид Соль Реакция обмена Пример: Вода
Типичные реакции основных оксидов Кислотный оксид Основный оксид Соль Реакция соединения Пример: Смотрим на соответствие оксидов солям
Типичные реакции основных оксидов Основный оксид Вода Реакция соединения Пример: Щелочь
Кислотные оксиды А также оксиды металлов с высокой степенью окисления Кислотные оксиды – оксиды неметаллов Не. Мех. Оу Могут быть в разном агрегатном состоянии
Типичные реакции кислотных оксидов Щелочь Кислотный оксид Соль Реакция обмена Пример: Вода
Типичные реакции основных оксидов Кислотный оксид Основный оксид Соль Реакция соединения Пример: Смотрим на соответствие оксидов солям
Типичные реакции кислотных оксидов Растворимая Кислотный оксид Вода Реакция соединения Пример: Смотрим на соответствие оксидов кислотам Кислота
ДЗ
2.
 4 Характерные химические свойства оксидов: основных, амфотерных, кислотных
4 Характерные химические свойства оксидов: основных, амфотерных, кислотныхВидеоурок 1: Свойства оксидов
Видеоурок 2: Химические свойства основных оксидов
Лекция: Характерные химические свойства оксидов: основных, амфотерных, кислотных
Оксиды — бинарные соединения (сложные вещества), состоящие из кислорода со степенью окисления -2 и другого элемента.
По своим химическим способностям образовывать соли все оксиды подразделены на две группы:
- солеобразующие,
- несолеобразующие.
Солеообразующие в свою очередь подразделены на три группы: основные, ксилотные, амфотерные. К несолеобразующим относятся оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
Основные оксиды — это оксиды, проявляющие основные свойства, образованные щелочными и щелочноземельными металлами в степенях окисления +1,+2, а также переходными металлами в низших степенях окисления.
Данной группе оксидов соответствуют основания: К2О – КОН; ВаО – Ва(ОН)2; La2O3 – La(OH)3.
Кислотные оксиды — это оксиды, проявляющие кислотные свойства, образованные типичными неметаллами, а также некоторыми переходными металлами в степенях окисления от +4 до +7.
Данной группе оксидов соответствуют кислоты: SO3 –H2SO4; CO2 – H2CO3; SO2 – H2SO3 и т.д.
Амфотерные оксиды — это оксиды, проявляющие основные и кислотные свойства, образованные переходными металлами в степенях окисления +3,+4. Искл.: ZnO, BeO, SnO, PbO.
Данной группе оксидов соответствуют амфотерные основания: ZnO – Zn(OH)2; Al2O3 – Al(OH)3.
Рассмотрим химические свойства оксидов:
Реагент | Основные оксиды | Амфотерные оксиды | Кислотные оксиды |
| Вода | Реагируют. Пример: Пример:CaO + H2O → Ca(OH)2 | Не реагируют | Реагируют. Пример: SO3 + H2O → H2SO4 |
| Кислота | Реагируют. Пример: Fe2O3 + 6HCl → 2FeCl3 + 3H2O | Реагируют. Пример: ZnO + 2HCl → ZnCl2 + H2O | Не реагируют |
| Основание | Не реагируют | Реагируют. Пример: ZnO + 2NaOH + H2O → Na2[Zn(OH)4] | Реагируют. Пример: 2NaOH + SiO2 → Na2SiO3 + H2O |
| Основный оксид | Не реагируют | Реагируют. Пример: ZnO + CaO → CaZnO2 | Реагируют. Пример: SiO2 + CaO → CaSiO3 |
| Кислотный оксид | Реагируют. Пример: CaO + CO2 → CaCO3 | Реагируют. Пример: Пример:ZnO + SiO2 → ZnSiO3 | Не реагируют |
| Амфотерный оксид | Реагируют. Пример: Li2O + Al2O3 → 2LiAlO | Реагируют | Реагируют. Пример: Al2O3 + 3SO3 → Al2(SO4)3 |
Из приведенной таблицы можно резюмировать следующее:
Основные оксиды наиболее активных металлов взаимодействуют с водой, образуя сильные основания – щелочи. Основные оксиды менее активных металлов, при обычных условиях с водой не реагируют. С кислотами реагируют всегда и все оксиды данной группы, образуя соли и воду. А с основаниями не реагируют.
Кислотные оксиды в большинстве своем реагируют с водой. Но не все реагируют в обычных условиях. С основаниями реагирует все оксиды данной группы, образуя соли и воду. С кислотами не реагируют.
Основные и кислотные оксиды способны реагировать между собой, с последующим образованием соли.

Амфотерные оксиды обладают основными и кислотными свойствами. Поэтому они реагируют и с кислотами, и с основаниями, образуя соли и воду. Амфотерные оксиды реагируют с кислотными и основными оксидами. Так же взаимодействуют и между собой. Чаще всего, данные химические реакции протекают при нагревании с образованием солей.
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
класс 7А
Марка 7Б
Класс 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 8А
Марка 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
Оценка 9 (комбинированные A и B)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 4А
класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (комбинированные A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 6А
Марка 6Б
Класс 6 (вместе A и B)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать ксерокопии, распечатывать и распространять их сколь угодно часто. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать ксерокопии, распечатывать и распространять их сколь угодно часто. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими организациями, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендовые версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, изменять или дополнять их любым способом, с единственным требованием — указать Сиявула надлежащим образом. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Серная кислота — обзор
3.3.15 Серная кислота
Серная кислота (H 2 SO 4 ) (историческое название масло купороса ) представляет собой неорганическое химическое вещество, которое представляет собой сильно коррозионную сильную минеральную кислоту, которая является едко-эфирной, от бесцветной до слегка желтой. вязкая жидкость, растворимая в воде при любых концентрациях. Иногда кислота может продаваться в виде темно-коричневой жидкости (краситель добавляется во время производства), чтобы предупредить покупателей об опасностях обращения с этой кислотой.
Серная кислота производится в больших количествах в мировом масштабе, причем производство химического вещества часто связано со стадией развития страны из-за большого количества процессов преобразования, в которых она используется.Серная кислота (H 2 SO 4 ) является основным сырьем, используемым в широком спектре промышленных процессов и производственных операций. Большая часть производимой серной кислоты используется в производстве фосфорных удобрений, а также для других целей, включая выщелачивание меди, производство неорганических пигментов, нефтепереработку, производство бумаги и промышленное производство органических химикатов.
Большая часть производимой серной кислоты используется в производстве фосфорных удобрений, а также для других целей, включая выщелачивание меди, производство неорганических пигментов, нефтепереработку, производство бумаги и промышленное производство органических химикатов.
Серная кислота производится из элементарной серы в трехстадийном процессе:
S + O2 → SO2
2SO2 + O2 → 2SO3
SO3 + h3O → h3SO4
Поскольку реакция серы с сухим воздухом является экзотермической, диоксид серы необходимо охладить, чтобы удалить избыточное тепло и избежать обращения реакции вспять.
Сжигание элементарной серы является основным источником диоксида серы, используемого для производства серной кислоты. Сжигание сероводорода из отходящих газов, термическое разложение отработанной серной кислоты или других серосодержащих материалов и обжиг пирита также используются в качестве источников диоксида серы. Серная кислота может производиться в промышленных масштабах либо по процессу со свинцовой камерой , либо по контактному процессу с современным подходом к контактному процессу.
В контактном процессе технологические установки обычно характеризуются в зависимости от загружаемого в них сырья: (1) сжигание элементарной серы, (2) сжигание отработанной серной кислоты и сероводорода и (3) сжигание сульфида металла. сжигание руд и плавильных газов. Более конкретно, контактный процесс включает три основных операции, каждая из которых соответствует отдельной химической реакции. Сначала сера в исходном сырье окисляется (сжигается) до диоксида серы:
S + O2 → SO2
Полученный диоксид серы подается в технологическую установку (часто называемую преобразователем ), где он подвергается каталитическому окислению. в триоксид серы:
2SO + 2O2 → 2SO3
Наконец, триоксид серы абсорбируется в растворе сильной серной кислоты (98%):
SO3 + h3O → h3SO4
В процессе Фраша элементарная сера плавится, фильтруют для удаления золы и распыляют под давлением в камеру сгорания, где сера сжигается в чистом воздухе, высушенном путем промывки серной кислотой 93–99% (об. / об.).Газы из камеры сгорания охлаждаются, проходя через котел-утилизатор, а затем поступают в нейтрализатор катализатора (пятиокись ванадия, V 2 O 5 ). Обычно 95% -98% (об. / Об.) Диоксида серы из камеры сгорания превращается в триоксид серы с сопутствующим большим выделением тепла. После охлаждения, опять же за счет генерации пара, газ, выходящий из конвертера, поступает в абсорбционную башню. Абсорбционная башня представляет собой насадочную колонну, в которой кислота распыляется сверху, а триоксид серы поступает снизу.Триоксид серы абсорбируется серной кислотой 98–99% (об. / Об.), Где триоксид серы соединяется с водой в кислоте и образует больше серной кислоты. Если образуется олеум (раствор несвязанного триоксида серы, растворенного в серной кислоте), триоксид серы из конвертера сначала направляют в олеумную башню, в которую подается 98% (об. / Об.) Кислоты из абсорбционной системы. Затем газы из олеумной башни перекачиваются в абсорбционную колонну, где удаляется остаточный триоксид серы.
/ об.).Газы из камеры сгорания охлаждаются, проходя через котел-утилизатор, а затем поступают в нейтрализатор катализатора (пятиокись ванадия, V 2 O 5 ). Обычно 95% -98% (об. / Об.) Диоксида серы из камеры сгорания превращается в триоксид серы с сопутствующим большим выделением тепла. После охлаждения, опять же за счет генерации пара, газ, выходящий из конвертера, поступает в абсорбционную башню. Абсорбционная башня представляет собой насадочную колонну, в которой кислота распыляется сверху, а триоксид серы поступает снизу.Триоксид серы абсорбируется серной кислотой 98–99% (об. / Об.), Где триоксид серы соединяется с водой в кислоте и образует больше серной кислоты. Если образуется олеум (раствор несвязанного триоксида серы, растворенного в серной кислоте), триоксид серы из конвертера сначала направляют в олеумную башню, в которую подается 98% (об. / Об.) Кислоты из абсорбционной системы. Затем газы из олеумной башни перекачиваются в абсорбционную колонну, где удаляется остаточный триоксид серы. В процессе однократной абсорбции используется только один абсорбер, как следует из названия, но на многих предприятиях установлен этап двойной абсорбции.
В процессе однократной абсорбции используется только один абсорбер, как следует из названия, но на многих предприятиях установлен этап двойной абсорбции.
На стадии двойной абсорбции газообразный триоксид серы, образующийся на ступенях первичного конвертера, направляется в промежуточный абсорбер, где большая часть триоксида серы удаляется с образованием серной кислоты. Оставшийся непрореагировавший диоксид серы направляется на заключительные ступени конвертера для удаления большей части оставшегося диоксида серы путем окисления до триоксида серы, откуда он направляется в конечный абсорбер для удаления оставшегося триоксида серы.
Если образуется олеум (дымящая серная кислота, просто представленная как H 2 SO 4 · SO 3 ) (смесь избыточного триоксида серы и серной кислоты), триоксид серы из конвертера переходит в олеум колонна, в которую подается 98% (об. / об.) кислоты из абсорберов.Затем газы из этой колонны перекачиваются в абсорбционную колонну, где удаляется триоксид серы. Могут быть получены олеум различной концентрации. Общие включают 20% олеума (20%, об. / Об. Триоксида серы в 80%, об. / Об. Серной кислоты, без воды), 40% олеума и 60% олеума.
Могут быть получены олеум различной концентрации. Общие включают 20% олеума (20%, об. / Об. Триоксида серы в 80%, об. / Об. Серной кислоты, без воды), 40% олеума и 60% олеума.
Диоксид серы является основным выбросом при производстве серной кислоты и обнаруживается в основном в отходящих дымовых газах. Превращение диоксида серы в триоксид серы также является неполным во время процесса, что приводит к выбросам.Двойная абсорбция считается наилучшей доступной технологией контроля (BACT), отвечающей требованиям NSPS для диоксида серы. Помимо дымовых газов, небольшие количества диоксида серы выбрасываются из хранилищ и вентиляционных отверстий автоцистерн во время погрузки, из концентраторов серной кислоты и из протекающего технологического оборудования.
Кислотный туман может также выделяться из дымовых газов абсорбера при производстве серной кислоты. Очень стабильный кислотный туман образуется, когда триоксид серы реагирует с водяным паром ниже точки росы триоксида серы.Типичные устройства управления включают вертикальную трубку, вертикальную панель и горизонтальные туманоуловители с двумя подушками.
При производстве серной кислоты осадок образуется в установке удаления диоксида углерода, используемой для абсорбции газа-растворителя. В установке используется углеводородный растворитель, который во время процесса распадается на углеводородный шлам. Этот шлам обычно сжигается на другой части процесса. При производстве серной кислоты также образуются твердые отходы, содержащие тяжелый металл ванадий, когда катализатор конвертера регенерируют или просеивают.Эти отходы отправляются стороннему поставщику для переработки. Дополнительные твердые отходы производства серной кислоты могут содержать как ванадий, так и мышьяк, в зависимости от используемого сырья, и необходимо принять меры для их правильной утилизации на свалках.
Кислотные реакции этановой кислоты | Эксперимент
Это практическое занятие студенты могут выполнить примерно за 30 минут или за 40 минут, если включено дополнительное расширение.
Здесь задействовано много бесцветных растворов, поэтому учеников придется организовывать. Может быть полезно выпускать этикетки, чтобы на пробирках можно было пометить их содержимое.
Может быть полезно выпускать этикетки, чтобы на пробирках можно было пометить их содержимое.
Удлинение карбонатом меди — красочная дополнительная реакция, или ее можно было бы использовать как альтернативу карбонату натрия.
Студентов можно попросить написать уравнения для возникающих реакций. Самая сложная область — это формулы солей двухвалентных ионов с этаноатом.
Проиллюстрированные эксперименты представляют собой четыре классических теста на кислотность (pH, действие со щелочами, карбонатами и химически активными металлами).Потребность в воде, чтобы кислоты могли проявлять кислотность, рассматривается в разделе Что делает вещество кислым? который мог бы следовать за этим экспериментом.
Еще одно расширение — получение солей, например сульфата меди, как в реакции оксида меди (II) с серной кислотой.
Оборудование
Аппарат
- Защита глаз
- Штатив для пробирок
- Пробирки x6
- Стаканы, 100 см 3 , 2 шт.

- Стеклянный стержень
- Пипетки для капель x2
- Доступ к пламени для проверки водорода (но держаться подальше от магния)
- Доступ к универсальной цветной диаграмме pH индикатора (pH 1–14)
Для расширения:
- Шпатель
- Фильтровальная бумага
- Пробирки x2
Химические вещества
- Магниевая лента, две полоски по 1 см
- Раствор этановой кислоты, 0.05 M, 15 см 3
- Раствор соляной кислоты, 0,05 М, 15 см 3
- Раствор гидроксида натрия, 0,4 M (РАЗДРАЖАЮЩИЙ), 5 см 3
- Раствор карбоната натрия, 0,4 М, 5 см 3
- Универсальный индикаторный раствор (полный диапазон, pH 1–14) (легковоспламеняющийся), несколько капель
Для расширения:
- Карбонат меди (ВРЕДНЫЙ), 0,5 г
Примечания по безопасности, охране труда и технике
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности.

- Пользоваться защитными очками.
- Магниевая лента, Mg (s) — см. CLEAPSS Hazcard HC059A. Магний следует соскрести шпателем или натереть наждачной бумагой, чтобы удалить оксидный налет. Магниевая лента привлекательна для студентов, которые могут попытаться вынуть ее из лаборатории и зажечь. Любые последующие возгорания будут очень горячими, и их будет трудно потушить. Поэтому рекомендуется держать это под контролем учителя. Стричь лучше всего ножницами, так как попытки оторвать кожу пальцами могут привести к порезам.
- Раствор этановой кислоты, CH 3 COOH (водн.) — см. CLEAPSS Hazcard HC038a и книгу рецептов CLEAPSS RB039.
- Раствор соляной кислоты, HCl (водный) — см. CLEAPSS Hazcard HC047a и CLEAPSS Recipe Book RB043.
- Раствор гидроксида натрия, NaOH (водн.), (РАЗДРАЖАЮЩИЙ при используемой концентрации) — см. CLEAPSS Hazcard HC091a и CLEAPSS Recipe Book RB085.
- Раствор карбоната натрия, Na 2 CO 3 (водн.
 ) — см. CLEAPSS Hazcard HC095A и CLEAPSS Recipe Book RB080.
) — см. CLEAPSS Hazcard HC095A и CLEAPSS Recipe Book RB080. - Универсальный индикаторный раствор (ЛЕГКО ВОСПЛАМЕНЯЮЩИЙСЯ) — см. CLEAPSS Hazcard HC032 и CLEAPSS Recipe Book RB000.
Для добавочного номера:
- Карбонат меди, CuCO 3 .Cu (OH) 2 (s), (ВРЕДНО) — см. CLEAPSS Hazcard HC026.
Процедура
- Установите штатив для пробирок, содержащий шесть пробирок.
- В три пробирки поместите раствор этановой кислоты (0,05 М) на глубину 2 см.
- В остальные три пробирки поместите соляную кислоту (0,05 M) на глубину 2 см.
- Добавьте три капли универсального индикаторного раствора полного диапазона в одну из пробирок с этановой кислотой и запишите pH.
- Добавьте три капли универсального индикаторного раствора полного диапазона в одну из пробирок с соляной кислотой и запишите pH.
- Налейте раствор карбоната натрия (0,4 M) глубиной примерно 0,5 см в небольшой химический стакан.

- С помощью пипетки-капельницы добавьте одну каплю раствора карбоната натрия в пробирку с этановой кислотой, в которой находится индикатор.Перемешайте трубку стеклянной палочкой и отметьте все наблюдения. Продолжайте добавлять капли, пока pH не станет нейтральным. Подсчитайте количество использованных капель.
- Повторите процедуру шага 7, но добавив карбонат натрия в пробирку, содержащую соляную кислоту и индикатор.
- Добавить раствор гидроксида натрия (0,4 М) к этановой и соляной кислотам. Сделайте это, следуя процедуре шагов 5, 6, 7 и 8, но используя гидроксид натрия вместо карбоната натрия.
- Добавьте небольшой кусочек магниевой ленты в оставшуюся трубку с соляной кислотой.Попытайтесь определить выделяемый газ.
- Повторите шаг 10, используя третью пробирку с этановой кислотой. Сравните скорость реакции со скоростью соляной кислоты.
Продление или вместо раствора карбоната натрия:
- Возьмите небольшое количество (четверть лопатки) твердого карбоната меди на фильтровальной бумаге.

- Налейте соляную и этановую кислоты на глубину 1 см в еще две пробирки.
- Добавьте карбонат меди в каждую пробирку в очень малых количествах, перемешивая стеклянной палочкой, пока ничего не произойдет.Запишите свои наблюдения.
Учебные заметки
Соляная кислота покажет pH = 1, а этановая кислота покажет pH = 3.
Для нейтрализации кислот потребуется всего несколько капель раствора карбоната натрия и гидроксида натрия, поскольку щелочные растворы в восемь раз более концентрированы, чем кислоты. Соляная кислота будет сильно шипеть с раствором карбоната натрия, тогда как для этановой кислоты шипение будет заметным, но менее сильным.
Соляная кислота будет шипеть вместе с магнием. Выделяется водород. (Соберите в трубку, перевернутую над реакционной трубкой, и быстро перенесите открытый конец в пламя — должен быть слышен писк.) Водород выделяется медленнее с этановой кислотой.
Обе кислоты будут шипеть с карбонатом меди, но реакция с соляной кислотой будет более интенсивной.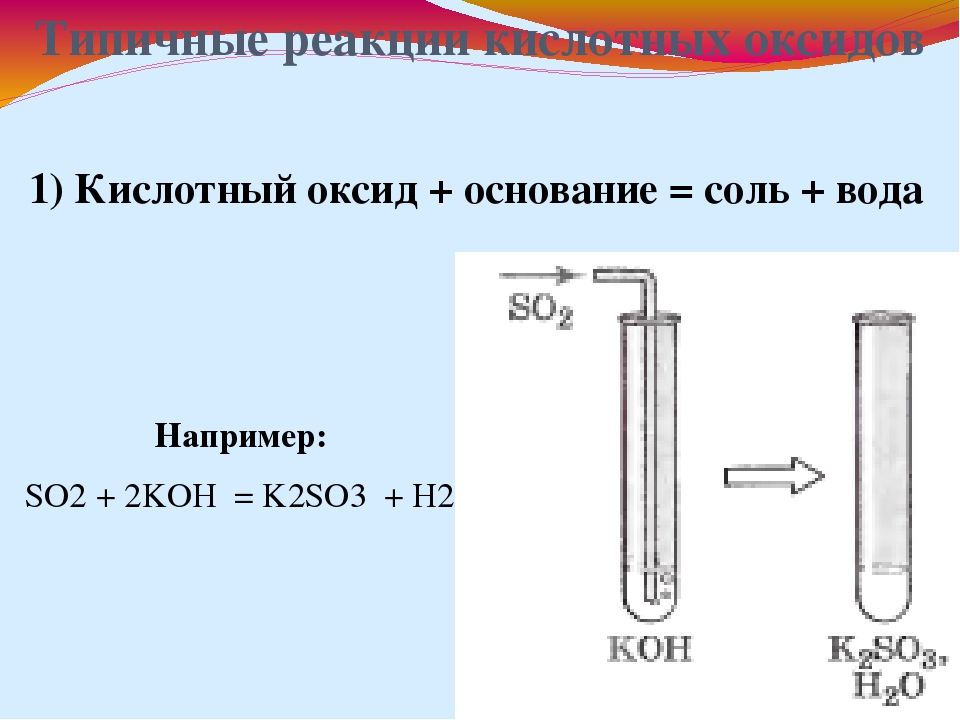 Когда избыток карбоната меди осядет, будут видны цвета хлорида меди (зеленый) и этаноата меди (синий).
Когда избыток карбоната меди осядет, будут видны цвета хлорида меди (зеленый) и этаноата меди (синий).
Обсуждение слабых и сильных кислот, вероятно, больше подходит для студентов продвинутого уровня, а не для студентов среднего уровня.
Этановая кислота — слабая кислота, что означает, что она не полностью диссоциирует на ионы в воде.
CH 3 COOH ⇌ H + + CH 3 COO —
Соляная кислота — сильная кислота, полностью диссоциирующая.
HCl → H + + Cl —
Это означает, что концентрация ионов H + в 0.4 M HCl выше, чем в 0,4 M этановой кислоте, поэтому ее pH ниже, а кислотные реакции проходят быстрее. Однако при добавлении щелочей положение равновесия этановой кислоты смещается вправо, поэтому в конечном итоге вся кислота вступает в реакцию, как показано в уравнениях ниже:
NaOH + HCl → NaCl + H 2 O
NaOH + CH 3 COOH → CH 3 COONa + H 2 O
Na 2 CO 3 + 2HCl → 2NaCl + CO 2 + H 2 O
Na 2 CO 3 + 2CH 3 COOH → 2CH 3 COONa + CO + H 2 O
Mg + 2HCl → MgCl 2 + H 2
Mg + 2CH 3 COOH → (CH 3 COO) 2 Mg + H 2
CuCO 3 + 2HCl → CuCl 2 + CO 2 + H 2 O
CuCO 3 + 2CH 3 COOH → (CH 3 COO) 2 Cu + CO 2 + H 2 O
Что такое кислотный дождь? | US EPA
Кислотный дождь или кислотное осаждение — это широкий термин, который включает любую форму осадков с кислотными компонентами, такими как серная или азотная кислота, которые выпадают на землю из атмосферы во влажной или сухой форме. Это может быть дождь, снег, туман, град или даже кислая пыль.
Это может быть дождь, снег, туман, град или даже кислая пыль.
Кислотный дождь возникает, когда диоксид серы (SO 2 ) и оксиды азота (NO X ) выбрасываются в атмосферу и переносятся ветром и воздушными потоками. SO 2 и NO X реагируют с водой, кислородом и другими химическими веществами с образованием серной и азотной кислот. Затем они смешиваются с водой и другими материалами, прежде чем упасть на землю.
Хотя небольшая часть SO 2 и NO X , вызывающих кислотные дожди, поступает из природных источников, таких как вулканы, большая их часть происходит от сжигания ископаемого топлива.Основными источниками SO 2 и NO X в атмосфере являются:
- Сжигание ископаемого топлива для производства электроэнергии. Две трети SO 2 и одна четверть NO X в атмосфере поступают от генераторов электроэнергии.
- Транспортные средства и тяжелая техника.

- Обрабатывающая, нефтеперерабатывающая и другие отрасли промышленности.
Ветры могут дуть SO 2 и NO X на большие расстояния и через границы, делая кислотные дожди проблемой для всех, а не только для тех, кто живет рядом с этими источниками.
Формы кислотного осаждения
Влажное осаждение
Влажное осаждение — это то, что мы чаще всего называем кислотным дождем . Образовавшиеся в атмосфере серная и азотная кислоты падают на землю в смеси с дождем, снегом, туманом или градом.
Сухое осаждение
Кислые частицы и газы могут также осаждаться из атмосферы в отсутствие влаги как сухое осаждение . Кислые частицы и газы могут быстро осаждаться на поверхности (водоемы, растительность, здания) или могут реагировать во время атмосферного переноса с образованием более крупных частиц, которые могут быть вредными для здоровья человека. Когда накопленные кислоты смываются с поверхности следующим дождем, эта кислая вода течет по земле и через нее и может нанести вред растениям и животным, таким как насекомые и рыбы.
Когда накопленные кислоты смываются с поверхности следующим дождем, эта кислая вода течет по земле и через нее и может нанести вред растениям и животным, таким как насекомые и рыбы.
Количество кислотности в атмосфере, которая откладывается на земле в результате сухого осаждения, зависит от количества осадков, выпадающих на данную территорию. Например, в пустынных районах соотношение сухих и влажных отложений выше, чем в районах, где ежегодно выпадает несколько дюймов дождя.
Измерение кислотных дождей
Кислотность и щелочность измеряются с помощью шкалы pH, равной 7.0 нейтрален. Чем ниже pH вещества (менее 7), тем оно более кислое; чем выше pH вещества (более 7), тем оно более щелочное. Нормальный дождь имеет pH около 5,6; он слабокислый, потому что в нем растворяется углекислый газ (CO 2 ), образуя слабую угольную кислоту. Кислотный дождь обычно имеет pH от 4,2 до 4,4. Политики, ученые-исследователи, экологи и разработчики моделей полагаются на Национальную сеть тенденций (NTN) Национальной программы атмосферных отложений (NADP) для измерений влажных отложений. NADP / NTN собирает кислотные дожди более чем на 250 объектах мониторинга в США, Канаде, Аляске, Гавайях и Виргинских островах США. В отличие от влажного осаждения измерение сухого осаждения сложно и дорого. Оценки сухого осаждения загрязняющих веществ, содержащих азот и серу, предоставлены Сетью по состоянию и тенденциям в области чистого воздуха (CASTNET). CASTNET измеряет концентрации в воздухе более чем в 90 точках.
NADP / NTN собирает кислотные дожди более чем на 250 объектах мониторинга в США, Канаде, Аляске, Гавайях и Виргинских островах США. В отличие от влажного осаждения измерение сухого осаждения сложно и дорого. Оценки сухого осаждения загрязняющих веществ, содержащих азот и серу, предоставлены Сетью по состоянию и тенденциям в области чистого воздуха (CASTNET). CASTNET измеряет концентрации в воздухе более чем в 90 точках.
Когда кислотные отложения смываются в озера и ручьи, некоторые из них могут стать кислыми.Сеть долгосрочного мониторинга (LTM) измеряет и отслеживает химический состав поверхностных вод более чем на 280 участках, чтобы предоставить ценную информацию о здоровье водных экосистем и о том, как водные объекты реагируют на изменения в выбросах, вызывающих кислоту, и кислотных осаждениях.
Затем узнайте о влиянии кислотного дождя.
Или узнать больше о:
Азотная кислота — Энциклопедия Нового Света
| Азотная кислота | |
|---|---|
| Общие | |
| Систематическое название | Азотная кислота |
| Другие названия | Aqua fortis Spirit of селитра Salpetre acid |
| Молекулярная формула | HNO 3 |
| УЛЫБКИ | [N +] (= O) (OH) [O-] |
| Концентрация кислотных ионов | pH = -2 (1 Н) |
| Молярная масса | 63. 01 г / моль 01 г / моль |
| Внешний вид | Прозрачная бесцветная жидкость |
| Номер CAS | 7697-37-2 |
| Недвижимость | |
| Плотность и фаза | 1,51 г / см³ |
| Растворимость в воде | смешиваемый |
| Температура плавления | -42 ° С (231 К) |
| Температура кипения | 83 ° С (356 К) |
| Кислотность (p K a ) | -2 |
| Вязкость | ? cP при? ° C |
| Структура | |
| Молекулярная форма | тригонально планарный |
| Дипольный момент | ? D |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Классификация ЕС | Окислитель ( O ) Коррозионный ( C ) |
| NFPA 704 (≤40%) | 0 3 0 OX |
| NFPA 704 (> 40%) | 0 4 0 OX |
| NFPA 704 (дымящий) | 0 4 1 OX |
| R-фразы | R8, R35 |
| S-фразы | S1 / 2, S23, S26, S36, S45 |
| Температура вспышки | не применимо |
| Номер RTECS | QU5775000 |
| Страница дополнительных данных | |
| Структура и свойства | n , ε r и т. Д. Д. |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газовое |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Родственные соединения | Азотистая кислота Пятиокись азота |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа) | |
Азотная кислота (химическая формула HNO 3 ) — одна из важнейших неорганических кислот.Алхимики восьмого века назвали его aqua fortis (сильная вода), aqua valens (сильная вода) или духом селитры. Это очень едкая и токсичная кислота, которая может вызвать серьезные ожоги. Бесцветные в чистом виде, более старые образцы имеют тенденцию приобретать желтый оттенок из-за накопления оксидов азота. Азотная кислота смешивается с водой во всех пропорциях, образуя гидраты при низкой температуре.
Азотная кислота смешивается с водой во всех пропорциях, образуя гидраты при низкой температуре.
Эта кислота является обычным лабораторным реактивом и важным промышленным товаром.Он в основном используется для производства нитрата аммония (NH 4 NO 3 ) для удобрений. Он также используется для производства взрывчатых веществ (таких как нитроглицерин), нитрохлопка или пушечного хлопка, пластмасс и красителей.
История
Самое раннее известное письменное описание метода синтеза азотной кислоты приписывают алхимику Джабиру ибн Хайяну (Геберу). Он говорит:
Возьмите фунт кипрского купороса, полтора фунта солянки и четверть фунта квасцов.Отправьте все на перегонку, чтобы получить раствор, обладающий сильным растворяющим действием. Растворяющая способность кислоты значительно возрастает, если ее смешать с некоторым количеством нашатырного спирта, поскольку тогда она растворяет золото, серебро и серу. [1]
Позднее голландский химик Иоганн Рудольф Глаубер первым получил азотную кислоту путем перегонки селитры с серной кислотой, или купоросного масла, как он это называл. Продукт (декагидрат сульфата натрия) назван «глауберова соль» в память о нем.
Продукт (декагидрат сульфата натрия) назван «глауберова соль» в память о нем.
Царская водка (латинское слово «королевская вода») — одно из химикатов, придуманных древними учеными. Это очень едкий дымящийся раствор желтого или красного цвета. Смесь образуется путем смешивания концентрированной азотной и соляной кислоты, обычно в объемном соотношении один к трем. Это один из немногих реагентов, способных растворять золото и платину, так называемые королевские или благородные металлы — отсюда и название «королевская вода». Эффективность царской водки частично объясняется наличием как хлора, так и нитрозилхлорида.Царская водка используется при травлении и некоторых аналитических процессах, а также в лабораториях для очистки стеклянной посуды от органических и металлических соединений.
Физические свойства
Лабораторный реагент азотная кислота содержит только 68 процентов HNO по весу. Эта концентрация соответствует постоянно кипящей смеси HNO 3 с водой, которая имеет атмосферное давление 68,4 процента по весу и кипит при 121,9 ° C. Чистая безводная азотная кислота (100 процентов) представляет собой бесцветную жидкость с плотностью 1522 кг / м 3 при 25 ° C, которая затвердевает при -41.6 ° C с образованием белых кристаллов и кипит при 86 ° C. При кипячении на свету даже при комнатной температуре происходит частичное разложение с образованием диоксида азота по реакции:
Чистая безводная азотная кислота (100 процентов) представляет собой бесцветную жидкость с плотностью 1522 кг / м 3 при 25 ° C, которая затвердевает при -41.6 ° C с образованием белых кристаллов и кипит при 86 ° C. При кипячении на свету даже при комнатной температуре происходит частичное разложение с образованием диоксида азота по реакции:
- 4HNO 3 → 2H 2 O + 4NO 2 + O 2 (72 ° C)
, что означает, что безводную азотную кислоту следует хранить при температуре ниже 0 ° C во избежание разложения. Двуокись азота (NO 2 ) остается растворенной в азотной кислоте, окрашивая ее в желтый или красный цвет при более высоких температурах.В то время как чистая кислота имеет тенденцию выделять белые пары при контакте с воздухом, кислота с растворенным диоксидом азота выделяет красновато-коричневые пары, что дает общее название «красная дымящая кислота» или «дымящая азотная кислота».
- Азотная кислота смешивается с водой во всех пропорциях, и перегонка дает азеотроп с концентрацией 68 процентов HNO 3 и температурой кипения 120,5 ° C при 1 атм.
 Известны два твердых гидрата: моногидрат (HNO 3 .H 2 O) и тригидрат (HNO 3 .3H 2 O).
Известны два твердых гидрата: моногидрат (HNO 3 .H 2 O) и тригидрат (HNO 3 .3H 2 O).
- Оксиды азота (NO x ) растворимы в азотной кислоте, и это свойство влияет более или менее на все физические характеристики в зависимости от концентрации оксидов. В основном это давление пара над жидкостью и температура кипения, а также цвет, упомянутый выше.
- Азотная кислота подвержена термическому или легкому разложению с увеличением концентрации, и это может вызвать некоторые существенные изменения давления пара над жидкостью, поскольку образующиеся оксиды азота частично или полностью растворяются в кислоте.
Химические свойства
Азотная кислота образуется при реакции пятиокиси азота (N 2 O 3 ) и двуокиси азота (NO 2 ) с водой. Если раствор содержит более 86 процентов азотной кислоты, он обозначается как дымящаяся азотная кислота . Дымящаяся азотная кислота характеризуется как белая дымящая азотная кислота и красная дымящая азотная кислота, в зависимости от количества присутствующего диоксида азота.
Азотная кислота — это сильная одноосновная кислота, мощный окислитель, который также нитрирует многие органические соединения, и одноосновная кислота, потому что диссоциация только одна.
Кислотные свойства
Азотная кислота, как типичная кислота, реагирует со щелочами, основными оксидами и карбонатами с образованием солей, наиболее важной из которых является нитрат аммония. Из-за своей окислительной природы азотная кислота (за некоторыми исключениями) не выделяет водород при реакции с металлами, и образующиеся соли обычно находятся в более высоком окисленном состоянии. По этой причине можно ожидать сильной коррозии, и ее следует защищать с помощью соответствующего использования коррозионно-стойких металлов или сплавов.
Азотная кислота — сильная кислота с константой кислотной диссоциации (pK a ) -2: в водном растворе она полностью ионизируется в нитрат-ион NO 3 — и гидратированный протон, известный как гидроний. ион, H 3 O + .
- HNO 3 + H 2 O → H 3 O + + NO 3 —
Окислительные свойства
Азотная кислота — сильный окислитель, о чем свидетельствуют большие положительные значения E ◦ .
- NO 3 — (водн.) + 2H + (водн.) E — → NO 2 (г) + H 2 O (l) E ◦ = 0,79 V
- NO 3 — (водн.) + 4H + + 3e — → NO (г) 2H 2 (l) E ◦ = 0,96 V
Являясь мощным окислителем, азотная кислота бурно реагирует со многими неметаллическими соединениями, и реакции могут быть взрывоопасными. Конечные продукты могут варьироваться в зависимости от концентрации кислоты, температуры и используемого восстановителя.Реакция протекает со всеми металлами, кроме ряда драгоценных металлов и некоторых сплавов. Как правило, окислительные реакции происходят в основном с концентрированной кислотой, что способствует образованию диоксида азота (NO 2 ).
Реакции с металлами
Азотная кислота растворяет большинство металлов, включая железо, медь и серебро, с высвобождением низших оксидов азота, а не водорода. Он также может растворять благородные металлы с добавлением соляной кислоты.
- Cu + 4HNO 3 → Cu (NO 3 ) 2 + 2NO 2 + 2H 2 O
Кислотные свойства имеют тенденцию преобладать с разбавленной кислотой в сочетании с преимущественным образованием азота оксид (NO).
- 3Cu + 8HNO 3 → 3Cu (NO 3 ) 2 + 2NO + 4H 2 O
Поскольку азотная кислота является окислителем, водород (H) образуется редко. Только магний (Mg) и кальций (Ca) реагируют с холодной, разбавленной азотной кислотой с образованием водорода:
- Mg (s) + 2HNO 3 (водн.) → Mg (NO 3 ) 2 (водн.) + H 2 (г)
Реакции с неметаллами
Реакция с неметаллическими элементами, за исключением кремния и галогена, обычно окисляет их до высшей степени окисления в виде кислот с образованием диоксида азота для концентрированной кислоты и оксида азота для разбавленной кислоты.
- C + 4HNO 3 → CO 2 + 4NO 2 + 2H 2 O
или
- 3C + 4HNO 3 → 3CO 2 + 4NO + 2H 2 O
Пассивация
Хотя хром (Cr), железо (Fe) и алюминий (Al) легко растворяются в разбавленной азотной кислоте, концентрированная кислота образует слой оксида металла, который защищает металл от дальнейшего окисления, что называется пассивацией.
Синтез и производство
Азотная кислота производится путем смешивания диоксида азота (NO 2 ) с водой в присутствии кислорода или воздуха для окисления азотистой кислоты, также образующейся в результате реакции.Разбавленная азотная кислота может быть сконцентрирована перегонкой до 68% кислоты, которая представляет собой азеотропную смесь с 32% воды. Дальнейшее концентрирование включает перегонку с серной кислотой, которая действует как дегидратирующий агент. В лабораторных условиях такая перегонка должна проводиться во всех стеклянных аппаратах при пониженном давлении, чтобы предотвратить разложение кислоты. Также следует избегать использования резиновых и пробковых фитингов, поскольку азотная кислота разъедает эти материалы. Растворы азотной кислоты товарного качества обычно содержат от 52 до 68 процентов азотной кислоты.Промышленное производство азотной кислоты осуществляется по технологии Оствальда, названной в честь Вильгельма Оствальда.
Также следует избегать использования резиновых и пробковых фитингов, поскольку азотная кислота разъедает эти материалы. Растворы азотной кислоты товарного качества обычно содержат от 52 до 68 процентов азотной кислоты.Промышленное производство азотной кислоты осуществляется по технологии Оствальда, названной в честь Вильгельма Оствальда.
Первый процесс представляет собой каталитическую реакцию в газовой фазе — первичный процесс окисления аммиака до азотной кислоты при температуре около 900 ° C на платино-родиевом катализаторе.
- 4 NH 3 (г) + 5O 2 (г) → 4NO (г) + 6H 2 O (г)
Второй этап — быстрое окисление оксида азота до диоксида азота. Это относительно медленная реакция, т.е.е., этап, определяющий скорость в последовательности реакций.
- 2NO (г) + O, 2 (г) → 2NO 2 (г)
Наконец, диспропорционирование NO 2 в воде дает одну молекулу оксида азота на каждые две молекулы азотной кислоты.
- 3NO 2 (г) + H 2 O (л) → 2HNO 3 (вод.) + NO (г)
Для получения чистой азотной кислоты, которая бесцветна и кипит, требуется дальнейшее удаление воды. при 83 ° С.
В лаборатории азотная кислота может быть получена из нитрата меди (II) или путем реакции примерно равных масс нитрата калия (KNO 3 ) с 96-процентной серной кислотой (H 2 SO 4 ) и перегонкой. эту смесь при температуре кипения азотной кислоты 83 ° C до тех пор, пока в реакционном сосуде не останется только белая кристаллическая масса, гидросульфат калия (KHSO 4 ). Полученная красная дымящаяся азотная кислота может быть преобразована в белую азотную кислоту. Обратите внимание, что в лабораторных условиях необходимо использовать цельностеклянное оборудование, в идеале цельную реторту, поскольку безводная азотная кислота разрушает пробку, резину и кожу, а протечки могут быть чрезвычайно опасными.
- H 2 SO 4 + KNO 3 → KHSO 4 + HNO 3
Растворенный NO x легко удаляется при пониженном давлении при комнатной температуре (10-30 мин. 200 мм рт. Ст. Или 27 кПа). Полученная белая дымящаяся азотная кислота имеет плотность 1,51 г / см³. Эту процедуру также можно выполнить при пониженном давлении и температуре за один этап, чтобы получить меньше газообразного диоксида азота.
200 мм рт. Ст. Или 27 кПа). Полученная белая дымящаяся азотная кислота имеет плотность 1,51 г / см³. Эту процедуру также можно выполнить при пониженном давлении и температуре за один этап, чтобы получить меньше газообразного диоксида азота.
Кислота также может быть синтезирована путем окисления аммиака, но продукт разбавляется водой, также образующейся в ходе реакции.Однако этот метод важен при производстве нитрата аммония из аммиака, полученного в процессе Габера, поскольку конечный продукт может быть получен из азота, водорода и кислорода в качестве единственного сырья.
Белая дымящаяся азотная кислота, также называемая 100-процентной азотной кислотой или WFNA, очень близка к безводной азотной кислоте. Одна из спецификаций дымящейся азотной кислоты заключается в том, что она содержит максимум 2 процента воды и максимум 0,5 растворенного NO 2 . Красная дымящая азотная кислота, или RFNA, содержит значительные количества растворенного диоксида азота (NO 2 ), в результате чего раствор приобретает красновато-коричневый цвет. В одной формулировке RFNA указано как минимум 17 процентов NO 2 , в другой — 13 процентов NO 2 . В любом случае, ингибированная дымящая азотная кислота (IWFNA или IRFNA) может быть получена путем добавления от 0,6 до 0,7 процента фтороводорода HF. Этот фторид добавляют для защиты от коррозии в металлических резервуарах (фторид создает слой фторида металла, который защищает металл).
В одной формулировке RFNA указано как минимум 17 процентов NO 2 , в другой — 13 процентов NO 2 . В любом случае, ингибированная дымящая азотная кислота (IWFNA или IRFNA) может быть получена путем добавления от 0,6 до 0,7 процента фтороводорода HF. Этот фторид добавляют для защиты от коррозии в металлических резервуарах (фторид создает слой фторида металла, который защищает металл).
использует
Обычно используется в качестве лабораторного реагента, азотная кислота используется при производстве взрывчатых веществ, включая нитроглицерин, тринитротолуол (TNT) и циклотриметилентринитрамин (RDX), а также удобрения, такие как нитрат аммония.
Также в методах ICP-MS и ICP-AES азотная кислота (с концентрацией от 0,5 до 2,0%) используется в качестве матричного соединения для определения следов металлов в растворах. Для такого определения требуется сверхчистая кислота, поскольку небольшие количества ионов металлов могут повлиять на результат анализа.
Он находит дополнительное применение в металлургии и рафинировании, поскольку вступает в реакцию с большинством металлов, а также в органическом синтезе. В сочетании с соляной кислотой он образует царскую водку, один из немногих реагентов, способных растворять золото и платину.
Азотная кислота — компонент кислотных дождей.
Азотная кислота — мощный окислитель, и реакции азотной кислоты с такими соединениями, как цианиды, карбиды и металлические порошки, могут быть взрывоопасными. Реакции азотной кислоты со многими органическими соединениями, такими как скипидар, являются бурными и гиперголичными (т. Е. Самовоспламеняющимися).
Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с протеиновым кератином. Эти желтые пятна при нейтрализации становятся оранжевыми.
Одно из применений IWFNA — окислитель в ракетах на жидком топливе.
Азотная кислота используется в колориметрическом тесте для различения героина и морфина.
Азотная кислота также используется в школьных лабораториях для проведения экспериментов по проверке хлоридов. В образец добавляют раствор нитрата серебра и азотную кислоту, чтобы увидеть, остался ли белый осадок хлорида серебра.
Техника безопасности
Азотная кислота — опасное химическое вещество, с которым следует обращаться с учетом ее коррозионных и окислительных свойств.Избегайте контакта с кислотой и используйте средства защиты, особенно средства защиты глаз. При попадании на кожу он может вызвать изменение цвета на желтый, а большие количества или концентрации могут вызвать смертельные ожоги. Не вдыхайте пары, выделяющиеся при смешивании с металлами или органическими соединениями — эффект может быть отсроченным, но все же фатальным. Держитесь подальше от красно-коричневых паров! Азотная кислота сама по себе не горит, но окисляет органические вещества и делает их легко воспламеняемыми.
Связанные темы
Банкноты
- ↑ Томас Х.
 Чилтон, Strong Water; Азотная кислота: источники, методы производства и использование (Кембридж, Массачусетс: M.I.T. Press, 1968). OCLC 237255.
Чилтон, Strong Water; Азотная кислота: источники, методы производства и использование (Кембридж, Массачусетс: M.I.T. Press, 1968). OCLC 237255.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чилтон, Томас Х. 1968. Сильная вода; Азотная кислота: источники, методы производства и использование. Кембридж, Массачусетс: M.I.T. Нажмите. OCLC 237255.
- Корвин, К. Х. 2001. Введение в химические концепции и связи. 3-е изд.Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. ISBN 0130874701.
- Федерманн, Р. 1964. Королевское искусство алхимии. Пер. Р. Х. Вебер. Нью-Йорк: Книга Чилтона. ASIN B000J3UZJ4.
- Джолли, В. Л. 1966. Химия неметаллов. Основы серии современной химии. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ASIN B0006BNQ1I.
- Макмерри Дж. И Фэй Р. С. 2004. Chemistry. 4-е изд. Река Аппер Сэдл, штат Нью-Джерси: Prentice Hall. ISBN 0131402080.

Внешние ссылки
Все ссылки получены 5 декабря 2018 г.
Кредиты
Энциклопедия Нового Света писателя и редактора переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Зеленый синтез оксида графена по шкале времени в секундах, водное электролитическое окисление
Синтез и характеристика листов GO методом ЕС
Синтез GO включает два последовательных процесса EC при комнатной температуре с коммерческой гибкой графитовой бумагой (FGP) в качестве сырья (Рис. .1а и дополнительные рис. 1, 2). Коммерческий FGP имеет аналогичную структуру с графитом, высокую прочность на разрыв (от 4 до 5 МПа), отличную электропроводность, сравнимую с ВОПГ, и хорошую гибкость (рис. 1b, дополнительное примечание 1 и дополнительные рис. 3, 4). Обычно он имеет толщину от микрометров до миллиметров, ширину до метров и длину до километров. Сначала FGP подвергают интеркаляции ЭК в концентрированном H 2 SO 4 с образованием бумаги с интеркаляцией графита на стадии I 36 (GICP, рис.1c и дополнительный фильм 1). Затем GICP используют в качестве анода для реакции ЕС в разбавленном H 2 SO 4 (50 мас. %). Очень удивительно, что GICP синего цвета, погруженный в разбавленный H 2 SO 4 , быстро окисляется до оксида графита желтого цвета 24 в течение нескольких секунд вместе с отшелушиванием (рис. 1d, дополнительные видеоролики 2, 3 и Дополнительный рис. 5). После вакуумной фильтрации и очистки водой осадок на фильтре расслаивается в воде ультразвуком с образованием электрохимически синтезированной дисперсии GO (EGO) (рис.1д).
%). Очень удивительно, что GICP синего цвета, погруженный в разбавленный H 2 SO 4 , быстро окисляется до оксида графита желтого цвета 24 в течение нескольких секунд вместе с отшелушиванием (рис. 1d, дополнительные видеоролики 2, 3 и Дополнительный рис. 5). После вакуумной фильтрации и очистки водой осадок на фильтре расслаивается в воде ультразвуком с образованием электрохимически синтезированной дисперсии GO (EGO) (рис.1д).
Синтез ЭГО электролитическим окислением воды. a , Схематическое изображение процесса синтеза EGO электролитическим окислением в воде. b — e , Фотографии сырья и продуктов, полученных на каждом этапе. б , ФГП. c , GICP (синяя область), полученный после EC интеркаляции FGP в 98 мас.% H 2 SO 4 при 1,6 В в течение 20 мин. d , Оксид графита (желтая область), полученный водным электролитическим окислением GICP в 50 мас. % H 2 SO 4 при 5 В в течение 30 с. и , хорошо диспергированный водный раствор EGO (5 мг · мл -1 ), полученный обработкой ультразвуком оксида графита в воде в течение 5 мин. Масштабные линейки в bd : 1 мм
% H 2 SO 4 при 5 В в течение 30 с. и , хорошо диспергированный водный раствор EGO (5 мг · мл -1 ), полученный обработкой ультразвуком оксида графита в воде в течение 5 мин. Масштабные линейки в bd : 1 мм
Стоит отметить, что общее количество воды, используемой для очистки оксида графита в нашем методе (массовое отношение к сырому FGP, около 150, дополнительное примечание 2 и дополнительный рисунок 6) значительно ниже, чем те, которые используются в методах Хаммерса (обычно около 1000).Подобно ГО, синтезированному традиционным методом Хаммерса (HGO) 5 , наш EGO показывает очень стабильную растворимость в воде. Он сохраняет гомогенную дисперсию без каких-либо осадков и изменения цвета после хранения в течение 6 месяцев при концентрации 1 мг · мл -1 в воде (рис. 2а). После сушки вымораживанием выход EGO оценивается примерно в 96 мас.% От сырого FGP. Кроме того, этот метод очень легко масштабировать. EGO может производиться непрерывно путем непрерывного введения среза GICP в разбавленный раствор H 2 SO 4 с определенной скоростью (дополнительный фильм 2). Например, используя два стакана объемом 250 мл в качестве реакторов и ПБР толщиной 0,5 мм и шириной 40 мм в качестве сырья, EGO непрерывно производился с производительностью около 12 г · ч -1 , что свидетельствует о большом потенциале этого способ массового производства ГО листов. Необходимо отметить, что FGP является идеальным сырьем для непрерывного производства листов GO нашим методом из-за его совокупных превосходных свойств, упомянутых выше, и хорошей устойчивости к объемному расширению, вызванному интеркалированием, показанным ниже, хотя это относительно сложно. окислен традиционным методом Хаммерса по сравнению с чешуйками природного графита (дополнительное примечание 1 и дополнительная таблица 4).Графитовые порошки не могут быть использованы непосредственно в нашем методе из-за очень малого размера и должны быть изготовлены в виде макроскопических электродов, чтобы обеспечить подачу напряжения. Графитовые стержни также не подходят для нашего метода, поскольку они легко ломаются на мелкие кусочки даже после кратковременного интеркалирования и не могут использоваться для дальнейшего окисления.
Например, используя два стакана объемом 250 мл в качестве реакторов и ПБР толщиной 0,5 мм и шириной 40 мм в качестве сырья, EGO непрерывно производился с производительностью около 12 г · ч -1 , что свидетельствует о большом потенциале этого способ массового производства ГО листов. Необходимо отметить, что FGP является идеальным сырьем для непрерывного производства листов GO нашим методом из-за его совокупных превосходных свойств, упомянутых выше, и хорошей устойчивости к объемному расширению, вызванному интеркалированием, показанным ниже, хотя это относительно сложно. окислен традиционным методом Хаммерса по сравнению с чешуйками природного графита (дополнительное примечание 1 и дополнительная таблица 4).Графитовые порошки не могут быть использованы непосредственно в нашем методе из-за очень малого размера и должны быть изготовлены в виде макроскопических электродов, чтобы обеспечить подачу напряжения. Графитовые стержни также не подходят для нашего метода, поскольку они легко ломаются на мелкие кусочки даже после кратковременного интеркалирования и не могут использоваться для дальнейшего окисления.
Характеристика EGO. ad , Сравнение EGO с HGO: водный раствор ( a , 1 мг · мл -1 ), XPS-спектры C1s ( b ), FTIR-спектры ( c ), спектры комбинационного рассеяния ( d ) ).HGO был синтезирован модифицированным методом Хаммерса 7 с использованием хлопьев графита (80 меш) в качестве сырья. e – h , Типичные изображения листов EGO с помощью АСМ ( e ), SEM ( f ), TEM ( g ) и HRTEM ( h ). i , j , боковой размер ( i ) и количество слоев ( j ), распределение листов EGO, полученных ультразвуковой обработкой для 5 (черные столбцы), 15 (красные столбцы) и 30 мин (синие столбцы). столбцы). k , Массовый водный раствор EGO (5 мг · мл -1 ).Масштабные линейки: и , 2 мкм; f , 10 мкм; г , 1 мкм; h , 5 нм
Химический состав непрерывно производимого EGO был проанализирован с помощью элементного анализатора горения (EA), рентгеновского фотоэлектронного спектрометра (XPS), инфракрасного спектрометра с преобразованием Фурье (FTIR) и атомно-эмиссионного спектрометра с индуктивно связанной плазмой. (ICP-AES). Анализ EA показывает, что EGO имеет типичный состав (ат.%): C (50,2), O (29,2), H (19,7) и S (0,9). Это дает атомное отношение C / O около 1.7, что ниже типичного значения для HGO (около 2,0) 7, 24, 26 , что указывает на более высокую степень окисления EGO. Спектры XPS C1s показывают сильный пик C = C (284,6 эВ), заметный пик эпокси / гидроксила (C – O, 287,0 эВ) и слабый карбонильный (C = O, 288,0 эВ) и карбоксильный (O – C = O, 289,2 эВ). ) пики (рис. 2б). Спектры FTIR показывают валентное колебание O – H (в диапазоне от 3000 до 3700 см −1 ), колебание C = O (1740 см −1 ), колебание C = C от sp 2 связей (1645 см −1 ) и колебания C – O (1402, 1087 и 1042 см −1 ) (рис.2в). Эти характеристики XPS и FTIR аналогичны характеристикам HGO, что позволяет предположить, что EGO имеет те же кислородсодержащие функциональные группы, что и HGO. Обилие функциональных групп обеспечивает EGO высокий дзета-потенциал -56,8 мВ (pH = 6,8), что приводит к отличной растворимости в воде, как показано на рис.
(ICP-AES). Анализ EA показывает, что EGO имеет типичный состав (ат.%): C (50,2), O (29,2), H (19,7) и S (0,9). Это дает атомное отношение C / O около 1.7, что ниже типичного значения для HGO (около 2,0) 7, 24, 26 , что указывает на более высокую степень окисления EGO. Спектры XPS C1s показывают сильный пик C = C (284,6 эВ), заметный пик эпокси / гидроксила (C – O, 287,0 эВ) и слабый карбонильный (C = O, 288,0 эВ) и карбоксильный (O – C = O, 289,2 эВ). ) пики (рис. 2б). Спектры FTIR показывают валентное колебание O – H (в диапазоне от 3000 до 3700 см −1 ), колебание C = O (1740 см −1 ), колебание C = C от sp 2 связей (1645 см −1 ) и колебания C – O (1402, 1087 и 1042 см −1 ) (рис.2в). Эти характеристики XPS и FTIR аналогичны характеристикам HGO, что позволяет предположить, что EGO имеет те же кислородсодержащие функциональные группы, что и HGO. Обилие функциональных групп обеспечивает EGO высокий дзета-потенциал -56,8 мВ (pH = 6,8), что приводит к отличной растворимости в воде, как показано на рис. 2а. В соответствии с тем фактом, что металлсодержащие химические вещества не используются, измерения ICP-AES подтверждают отсутствие (менее 50 частей на миллиард) типичных металлических примесей (Fe, Co, Ni, Mn, Cu, Zn) в EGO.
2а. В соответствии с тем фактом, что металлсодержащие химические вещества не используются, измерения ICP-AES подтверждают отсутствие (менее 50 частей на миллиард) типичных металлических примесей (Fe, Co, Ni, Mn, Cu, Zn) в EGO.
Хорошо известно, что GO имеет структуру небольших sp 2 C – C доменов, изолированных внутри sp 3 C – O матрицы 1,2,3 .Рамановская спектроскопия предоставляет мощный инструмент для получения подробной структурной информации о материалах на основе графена. Пик G приписывается растяжению связей sp 2 пар углерода, а пик D приписывается режиму дыхания sp 2 углеродных колец и активирован дефектами 37 . Как показано на рис. 2d, как EGO, так и HGO демонстрируют заметный пик D (1323 см, −1 ) и пик G (1580 см, −1 ), а также очень слабый 2D-пик (2650 см, −1 ) и D + G пик (2903 см −1 ).Стоит отметить, что отношение интенсивностей пика D к пику G в EGO выше, чем в HGO, что позволяет предположить, что домены sp 2 в EGO меньше, чем в HGO. Это согласуется с более высокой степенью окисления EGO, показанной выше.
Это согласуется с более высокой степенью окисления EGO, показанной выше.
Затем мы использовали атомно-силовой микроскоп (AFM), растровый электронный микроскоп (SEM), просвечивающий электронный микроскоп высокого разрешения (HRTEM), чтобы охарактеризовать количество слоев и поперечный размер EGO (рис. 2e – j). Подобно HGO, однослойные листы EGO имеют толщину около 1.0 нм (рис. 2д) из-за наличия функциональных групп и адсорбированной воды. Измерения AFM и SEM показывают, что поперечный размер листов EGO в основном находится в диапазоне от 1 мкм до 10 мкм (около 61%), причем около 7% больше 10 мкм и около 32% меньше 1 мкм (рис. 2i). . Изображения согнутых краев, полученные с помощью ПЭМВР, прямо указывают на количество слоев (рис. 2h). Обширные наблюдения с помощью HRTEM на 150 листах EGO показывают, что около 46% из них являются монослойными, а около 86% — не более чем трехслойными (рис.2j), которые согласуются с результатами измерений АСМ (дополнительный рис. 7). На рис. 2k показан серийно выпускаемый водный раствор EGO (5 мг · мл -1 ). Обратите внимание, что в образцах GO также присутствуют несколько мультислоев, отслоившихся от оксида графита, полученного методом Хаммерса без центрифугирования 25, 38 . В нашем методе увеличение времени обработки ультразвуком значительно снижает процент мультислоев и поперечный размер листов EGO (рис. 2i, j и дополнительный рис. 7). Например, образцы, полученные 30-минутной обработкой ультразвуком, содержат около 95% монослоев и около 5% бислоев, а поперечный размер в основном меньше 1 мкм.
Обратите внимание, что в образцах GO также присутствуют несколько мультислоев, отслоившихся от оксида графита, полученного методом Хаммерса без центрифугирования 25, 38 . В нашем методе увеличение времени обработки ультразвуком значительно снижает процент мультислоев и поперечный размер листов EGO (рис. 2i, j и дополнительный рис. 7). Например, образцы, полученные 30-минутной обработкой ультразвуком, содержат около 95% монослоев и около 5% бислоев, а поперечный размер в основном меньше 1 мкм.
Механизм синтеза и контролируемый синтез листов GO методом ЕС
Чтобы понять механизм синтеза EGO, мы использовали спектроскопию комбинационного рассеяния in-situ (рис. 3a, e), рентгеновскую дифрактограмму ex-situ (рис. 3b, f) и XPS (рис. 3c, g) и оптическая микроскопия (рис. 3d), чтобы контролировать изменения структуры и химического состава среза FGP в зависимости от времени реакции в двухэтапном процессе ЭК. Как показано на фиг. 1b, 3a и 3b, после 20 мин реакции в концентрированной H 2 SO 4 , срез FGP меняет цвет с блестящего серого на синий, пик Рамана G сдвигается с 1580 до 1631 см −1 и XRD (002) пик сдвигается с 26. От 5 ° до 23,2 °, что ясно свидетельствует об интеркаляции I стадии графита 36, 39 . Следует отметить, что в полученном GICP отсутствуют дефекты или содержащие окисление функциональные группы (рис. 3a, c, дополнительное примечание 3 и дополнительное рис. 8). Более того, GICP остается почти такой же силой разрушения и гибкостью, что и FGP, а поверхностное сопротивление значительно снижается из-за легирования серной кислотой (дополнительная таблица 5). Хотя после длительного времени реакции (2 часа) в концентрированном H 2 SO 4 не происходит окисления, GICP страдает сильным набуханием (примерно в 7 раз увеличение толщины по сравнению с FGP, дополнительная таблица 5), что приводит к резкому снижение механической прочности и проводимости, поэтому его нельзя использовать в следующем процессе ЕС.
От 5 ° до 23,2 °, что ясно свидетельствует об интеркаляции I стадии графита 36, 39 . Следует отметить, что в полученном GICP отсутствуют дефекты или содержащие окисление функциональные группы (рис. 3a, c, дополнительное примечание 3 и дополнительное рис. 8). Более того, GICP остается почти такой же силой разрушения и гибкостью, что и FGP, а поверхностное сопротивление значительно снижается из-за легирования серной кислотой (дополнительная таблица 5). Хотя после длительного времени реакции (2 часа) в концентрированном H 2 SO 4 не происходит окисления, GICP страдает сильным набуханием (примерно в 7 раз увеличение толщины по сравнению с FGP, дополнительная таблица 5), что приводит к резкому снижение механической прочности и проводимости, поэтому его нельзя использовать в следующем процессе ЕС.
Исследование процесса ЭЦ-синтеза ЭГО. a-c , Шаг I: интеркаляция EC. Спектры комбинационного рассеяния ( a ), картины XRD ( b ) и XPS-спектры C1s ( c ) после интеркаляции в течение разного времени. Снизу вверх в ( a ) время реакции составляет 0, 1, 4, 10, 16, 17, 18, 20, 60 и 120 минут последовательно. d-g , стадия II: ЕС-окисление. d , Морфология и изменение цвета среза GICP в зависимости от времени реакции.Спектры комбинационного рассеяния ( e ), картины XRD ( f ) и XPS-спектры C1s ( g ) после реакции в течение разного времени. Рамановские спектры и дифрактограммы, обозначенные цифрами 0, 1, 2 и 3 минуты в ( e ) и ( f ), были взяты из синтезированных образцов GICP и EGO после 1, 2 и 3 минут реакции. соответственно, без очистки и сушки, и те, которые обозначены как 3 минуты, сухие были взяты из образцов, полученных после 3-минутной реакции, с последующей очисткой и сушкой.Можно обнаружить, что содержащаяся вода и H 2 SO 4 оказывают значительное влияние на спектры комбинационного рассеяния света и картины XRD (также см. Дополнительное примечание 4 и дополнительный рисунок 9). Спектры XPS C1s в ( г ) были сняты для образцов после очистки и сушки.
Снизу вверх в ( a ) время реакции составляет 0, 1, 4, 10, 16, 17, 18, 20, 60 и 120 минут последовательно. d-g , стадия II: ЕС-окисление. d , Морфология и изменение цвета среза GICP в зависимости от времени реакции.Спектры комбинационного рассеяния ( e ), картины XRD ( f ) и XPS-спектры C1s ( g ) после реакции в течение разного времени. Рамановские спектры и дифрактограммы, обозначенные цифрами 0, 1, 2 и 3 минуты в ( e ) и ( f ), были взяты из синтезированных образцов GICP и EGO после 1, 2 и 3 минут реакции. соответственно, без очистки и сушки, и те, которые обозначены как 3 минуты, сухие были взяты из образцов, полученных после 3-минутной реакции, с последующей очисткой и сушкой.Можно обнаружить, что содержащаяся вода и H 2 SO 4 оказывают значительное влияние на спектры комбинационного рассеяния света и картины XRD (также см. Дополнительное примечание 4 и дополнительный рисунок 9). Спектры XPS C1s в ( г ) были сняты для образцов после очистки и сушки. ч , атомное соотношение C / O расслоенного продукта и соответствующая скорость расслоения GICP в растворах H 2 SO 4 с различными концентрациями. Шкала ошибок показывает диапазон атомного отношения C / O, измеренный для пяти образцов в каждой партии продукта. i , Сравнение содержания 18 O в образцах EGO, синтезированных четырьмя различными комбинациями нормального и 18 O-содержащих реагентов, включая H 2 SO 4 для интеркаляции EC (нормальный Acid-Int / 18 O Acid-Int) и вода (нормальный Aq-OX / 18 O Aq-OX) и H 2 SO 4 (нормальный Acid-OX / 18 O Acid-OX), используемые в Процесс окисления ЕС. Нормальный: EGO синтезируется с нормальным Acid-Int, Aq-OX и Acid-OX; 18 O Aq-OX: EGO, синтезированный с нормальным Acid-Int, 18 O Aq-OX и нормальным Acid-OX; 18 O Acid-Int: EGO, синтезированный с 18 O Acid-Int, нормальным Aq-OX и нормальным Acid-OX; 18 O Acid-OX: EGO, синтезированный с нормальным Acid-Int, нормальным Aq-OX и 18 O Acid-OX.
ч , атомное соотношение C / O расслоенного продукта и соответствующая скорость расслоения GICP в растворах H 2 SO 4 с различными концентрациями. Шкала ошибок показывает диапазон атомного отношения C / O, измеренный для пяти образцов в каждой партии продукта. i , Сравнение содержания 18 O в образцах EGO, синтезированных четырьмя различными комбинациями нормального и 18 O-содержащих реагентов, включая H 2 SO 4 для интеркаляции EC (нормальный Acid-Int / 18 O Acid-Int) и вода (нормальный Aq-OX / 18 O Aq-OX) и H 2 SO 4 (нормальный Acid-OX / 18 O Acid-OX), используемые в Процесс окисления ЕС. Нормальный: EGO синтезируется с нормальным Acid-Int, Aq-OX и Acid-OX; 18 O Aq-OX: EGO, синтезированный с нормальным Acid-Int, 18 O Aq-OX и нормальным Acid-OX; 18 O Acid-Int: EGO, синтезированный с 18 O Acid-Int, нормальным Aq-OX и нормальным Acid-OX; 18 O Acid-OX: EGO, синтезированный с нормальным Acid-Int, нормальным Aq-OX и 18 O Acid-OX. ( j ), атомное соотношение C / O в расслоенном продукте и соответствующая скорость расслоения FGP в растворах H 2 SO 4 с разными концентрациями
( j ), атомное соотношение C / O в расслоенном продукте и соответствующая скорость расслоения FGP в растворах H 2 SO 4 с разными концентрациями
Чтобы четко показать изменение структуры и состава GICP во время второго В процессе ЭК мы зафиксировали срез GICP в электролите (начальная длина погружения: 1 см) без движения. Во время процесса EC, как только графит окислился, он стал изолирующим, и, следовательно, его реакция окисления EC немедленно прекратилась, хотя он все еще оставался в электролите.Очень удивительно, как показано на рис. 3d, дополнительный ролик 3 и дополнительный рис. 5, только через несколько секунд некоторые области поверхности GICP меняют цвет с синего на желтый, что свидетельствует об окислении графита 24 . При увеличении времени реакции желтые участки быстро расширяются, и примерно через 60 с вся поверхность становится желтой. Затем цвет становится темнее и темнее по мере окисления внутренней части, и через 3 мин цвет уже не меняется. Эволюция спектров комбинационного рассеяния света, рентгенограммы и XPS-спектров C1s подтверждает полное окисление GICP с поверхности во внутреннюю часть (рис.3д – ж). Во время непрерывного процесса производства EGO срез GICP непрерывно вводился в электролит со скоростью около 5 мм · мин -1 , но GICP, погруженный в электролит, оставался почти постоянной длиной около 1 мм, как показано на Дополнительный фильм 2. Все эти результаты показывают, что ЕС-окисление решетки графита завершается в течение нескольких секунд. Дж. М. Тур и его сотрудники изучили механизм образования оксида графена с помощью модифицированного метода Хаммерса с использованием одной чешуйки графита и обнаружили, что преобразование соединения интеркаляции графита в оксид графита, ключевой этап в образовании GO, занимает несколько секунд. часов четные дни 40 .Следовательно, скорость окисления ЭК в нашем методе более чем в 100 раз выше, чем скорость окисления в методах Хаммерса.
Эволюция спектров комбинационного рассеяния света, рентгенограммы и XPS-спектров C1s подтверждает полное окисление GICP с поверхности во внутреннюю часть (рис.3д – ж). Во время непрерывного процесса производства EGO срез GICP непрерывно вводился в электролит со скоростью около 5 мм · мин -1 , но GICP, погруженный в электролит, оставался почти постоянной длиной около 1 мм, как показано на Дополнительный фильм 2. Все эти результаты показывают, что ЕС-окисление решетки графита завершается в течение нескольких секунд. Дж. М. Тур и его сотрудники изучили механизм образования оксида графена с помощью модифицированного метода Хаммерса с использованием одной чешуйки графита и обнаружили, что преобразование соединения интеркаляции графита в оксид графита, ключевой этап в образовании GO, занимает несколько секунд. часов четные дни 40 .Следовательно, скорость окисления ЭК в нашем методе более чем в 100 раз выше, чем скорость окисления в методах Хаммерса.
Другой очень важной особенностью нашего метода является то, что степень окисления полученного оксида графита может быть легко отрегулирована простым изменением концентрации H 2 SO 4 в электролите, как показано на рис. 3h (см. Также дополнительные Примечание 5, дополнительный рисунок 10 и дополнительная таблица 6). Сильно окисленный GO (C / O <2) достигается только тогда, когда концентрация H 2 SO 4 находится в диапазоне 40 мас.% до 60 мас.%, а наивысшая степень окисления при атомном соотношении C / O 1,5–1,8 достигается при концентрации H 2 SO 4 50 мас.%. Ниже и выше этого диапазона концентраций получаются только частично окисленные продукты (C / O> 2). Кроме того, масс-спектрометрический анализ газообразных продуктов процесса ЕС-окисления не показывает серосодержащих побочных продуктов (дополнительное примечание 6, дополнительный рисунок 11a – d и дополнительная таблица 7), что указывает на то, что H 2 SO 4 не является разложился.Эти результаты позволяют предположить, что вода в электролите играет ключевую роль в синтезе оксида графита методом ЭК. Дальнейшие эксперименты по изотропному отслеживанию 18 O ясно показывают, что кислородные функциональные группы в EGO в основном происходят из воды (рис.
3h (см. Также дополнительные Примечание 5, дополнительный рисунок 10 и дополнительная таблица 6). Сильно окисленный GO (C / O <2) достигается только тогда, когда концентрация H 2 SO 4 находится в диапазоне 40 мас.% до 60 мас.%, а наивысшая степень окисления при атомном соотношении C / O 1,5–1,8 достигается при концентрации H 2 SO 4 50 мас.%. Ниже и выше этого диапазона концентраций получаются только частично окисленные продукты (C / O> 2). Кроме того, масс-спектрометрический анализ газообразных продуктов процесса ЕС-окисления не показывает серосодержащих побочных продуктов (дополнительное примечание 6, дополнительный рисунок 11a – d и дополнительная таблица 7), что указывает на то, что H 2 SO 4 не является разложился.Эти результаты позволяют предположить, что вода в электролите играет ключевую роль в синтезе оксида графита методом ЭК. Дальнейшие эксперименты по изотропному отслеживанию 18 O ясно показывают, что кислородные функциональные группы в EGO в основном происходят из воды (рис. 3i, дополнительное примечание 7 и дополнительный рис. 12).
3i, дополнительное примечание 7 и дополнительный рис. 12).
Мы также изучали ЕС-реакцию FGP непосредственно в разбавленном водном растворе H 2 SO 4 . Однако были получены только слабоокисленные листы графена с атомным соотношением C / O более 7 или тонкие чешуйки графита (рис.3j, дополнительный рисунок 10 и дополнительная таблица 6). Это похоже на описанные методы ЕС 27, 28, 34 , которые напрямую используют нетронутые графитовые материалы для реакции ЕС в кислотном или солевом водном растворе и могут производить только нетронутые или слабо окисленные графеновые листы с атомным соотношением C / O, в основном большим. чем 3,0 даже после очень длительного времени реакции 48 ч (дополнительные таблицы 2 и 3). Таким образом, предварительная интеркаляция графита H 2 SO 4 играет ключевую роль в сверхбыстром синтезе ЭК высокоокисленных листов GO в нашем методе.- $
(4)
Где * означает активный центр на поверхности электрода, * OH, * O и * OOH представляют радикальные промежуточные соединения, адсорбированные на активном центре, а E относится к управляющему напряжению. В случае графитового анода адсорбированные реакционноспособные * OH, * O и * OOH могут реагировать с углеродной решеткой, которая сильно заряжена положительно, с образованием ковалентно связанных кислородсодержащих функциональных групп 34, 42 . Однако быстрое образование большого количества газа O 2 усилит расслоение графитового анода, что приведет к неэффективной подаче тока или разрыву цепи и, как следствие, остановке реакции электрохимического окисления 27, 28 .
В случае графитового анода адсорбированные реакционноспособные * OH, * O и * OOH могут реагировать с углеродной решеткой, которая сильно заряжена положительно, с образованием ковалентно связанных кислородсодержащих функциональных групп 34, 42 . Однако быстрое образование большого количества газа O 2 усилит расслоение графитового анода, что приведет к неэффективной подаче тока или разрыву цепи и, как следствие, остановке реакции электрохимического окисления 27, 28 .
Затем мы изучили газообразные продукты реакций ЭК с GICP, FGP или Pt в качестве анода и Pt в качестве катода в 50 мас.% Водном растворе H 2 SO 4 при 5 В (дополнительное примечание 6 и дополнительный рис. . 11e). Было обнаружено, что молярное отношение O 2 к H 2 составляет всего 1: 8,36 для GICP в качестве анода, что значительно меньше, чем при водном электролизе с Pt в качестве анода и катода (1: 2,05). Напротив, мольное отношение O 2 к H 2 составляет примерно 1: 3. 4 для ПБР в качестве анода. В результате скорость отшелушивания GICP примерно на порядок ниже, чем у FGP (рис. 3h, j и дополнительные видеоролики 3, 4). Эти результаты показывают, что использование GICP эффективно ингибирует образование O 2 при высоком напряжении. Адсорбированные реакционноспособные * OH, * O и * OOH в достаточном количестве вместе с высоким напряжением обеспечивают сверхбыстрый синтез полностью окисленного оксида графита и GO (рис. 3d – g). Для FGP в качестве анода из-за отсутствия достаточного количества реакционноспособных * OH, * O и * OOH и разрыва цепи, вызванной расслоением, получаются только листы графена или чешуйки графита с низкой степенью окисления (рис.3j). Сообщалось, что 2,2,6,6-тетраметилпиперидин-1-оксил (ТЕМПО) может эффективно подавлять образование кислородных радикалов при электролизе воды 28 . При добавлении 4 ‰ и 10 TEMPO в 50 мас.% Водного раствора H 2 SO 4 во время оптимизированного процесса ЕС-окисления GICP соотношение C / O продуктов увеличивается с 1,8 до 2,2 и 2,6 соответственно.
4 для ПБР в качестве анода. В результате скорость отшелушивания GICP примерно на порядок ниже, чем у FGP (рис. 3h, j и дополнительные видеоролики 3, 4). Эти результаты показывают, что использование GICP эффективно ингибирует образование O 2 при высоком напряжении. Адсорбированные реакционноспособные * OH, * O и * OOH в достаточном количестве вместе с высоким напряжением обеспечивают сверхбыстрый синтез полностью окисленного оксида графита и GO (рис. 3d – g). Для FGP в качестве анода из-за отсутствия достаточного количества реакционноспособных * OH, * O и * OOH и разрыва цепи, вызванной расслоением, получаются только листы графена или чешуйки графита с низкой степенью окисления (рис.3j). Сообщалось, что 2,2,6,6-тетраметилпиперидин-1-оксил (ТЕМПО) может эффективно подавлять образование кислородных радикалов при электролизе воды 28 . При добавлении 4 ‰ и 10 TEMPO в 50 мас.% Водного раствора H 2 SO 4 во время оптимизированного процесса ЕС-окисления GICP соотношение C / O продуктов увеличивается с 1,8 до 2,2 и 2,6 соответственно. (Дополнительное примечание 8, дополнительный рисунок 13 и дополнительная таблица 8). Это свидетельствует о существовании кислородных радикалов и их ключевой роли в синтезе ГО во время процесса окисления ЭК.
(Дополнительное примечание 8, дополнительный рисунок 13 и дополнительная таблица 8). Это свидетельствует о существовании кислородных радикалов и их ключевой роли в синтезе ГО во время процесса окисления ЭК.
Титрование
Лаборатории, медицинские или промышленные, часто просят определить точную концентрацию определенного вещества в растворе. Например, какова концентрация уксусной кислоты в образце уксуса? Каковы концентрации ионов железа, кальция и магния в пробе жесткой воды? Такие определения могут быть выполнены с использованием метода, известного как титрование.
При титровании известный объем раствора неизвестной концентрации реагирует с известным объемом раствора неизвестной концентрации или титруется им. Зная объемы титрования и молярное соотношение, в котором реагируют растворенные вещества, можно рассчитать концентрацию второго раствора. Используемый метод аналогичен используемому в примерах 11. 8 и 11.9. Раствор неизвестной концентрации может содержать кислоту (например, желудочную кислоту), основание (например, аммиак), ион (например, йодид-ион) или любое другое вещество, концентрацию которого необходимо определить.
8 и 11.9. Раствор неизвестной концентрации может содержать кислоту (например, желудочную кислоту), основание (например, аммиак), ион (например, йодид-ион) или любое другое вещество, концентрацию которого необходимо определить.
К аналитическому титрованию предъявляются несколько требований:
- Уравнение реакции должно быть известно, чтобы можно было использовать стехиометрическое соотношение в расчетах.
- Реакция должна быть быстрой и полной.
- Когда реагенты точно соединились, должно быть явное изменение некоторых измеримых свойств реакционной смеси. Возникновение этого изменения называется конечной точкой реакции.
- Должен быть способ точного измерения количества каждого реагента, независимо от того, находится ли этот реагент изначально в растворе или в твердом состоянии, которое необходимо растворить.
Давайте обсудим эти требования применительно к конкретному титрованию раствора серной кислоты известной концентрации с раствором гидроксида натрия неизвестной концентрации. Сбалансированное уравнение этой кислотно-основной реакции:
Сбалансированное уравнение этой кислотно-основной реакции:
2 NaOH + H 2 SO 4 Na 2 SO 4 + 2H 2 O
Гидроксид натрия ионизируется в воде с образованием ионов натрия и гидроксид-ионов; серная кислота ионизируется с образованием ионов водорода и сульфат-ионов.Реакция между гидроксид-ионами и ионами водорода протекает быстро и полностью; Таким образом, второе требование к аналитическому титрованию выполнено.
Какое явное изменение свойств произойдет, когда реакция завершится? Предположим, раствор гидроксида натрия медленно добавляется к раствору кислоты. При добавлении каждого гидроксид-иона он реагирует с ионом водорода с образованием воды. молекула. Пока непрореагировавшие ионы водорода остаются в растворе, раствор кислая.Когда количество добавленных гидроксид-ионов точно равно исходному количества ионов водорода раствор становится нейтральным. Если есть лишний гидроксид ионы добавляются, раствор становится щелочным. Как экспериментатор узнает, когда решение становится основным? В разделе 5.7D вы узнали об органических соединениях, называемых индикаторами, у которых есть один цвет в кислых растворах и другой в щелочных растворах. Если такой показатель присутствует при кислотно-основном титровании, меняет цвет при изменении раствора от кислого до основного.Фенолфталеин — бесцветный кислотно-щелочной индикатор. в кислых растворах и розовый в основных растворах. Если добавлен фенолфталеин по сравнению с исходным образцом серной кислоты раствор бесцветный и будет остаются таковыми, пока ионы водорода находятся в избытке. После достаточного количества раствора гидроксида натрия был добавлен для реакции со всеми ионами водорода, следующая капля основания обеспечит небольшой избыток гидроксид-ионов, и раствор станет розовым. Таким образом, будет видимая и четкая индикация возникновения конечная точка.В таблице 11.4 перечислены три индикатора, которые можно использовать в кислотно-щелочном титрования.
| Показатель | Цвет в кислоте | Цвет в базе |
|---|---|---|
| фенолфталеин | бесцветный | розовый |
| метиловый оранжевый | красный | желтый |
| синий бромтимол | желтый | синий |
Требование точного измерения объемов используемых растворов удовлетворяется за счет использования мерной посуды, в частности бюреток, для измерения объемов растворов.Напомним из раздела 2.2, что точность бюретки составляет одну тысячную долю. На рисунке 11.4 показана типичная установка для титрования.
| РИСУНОК 11.4 Типичное кислотно-основное титрование: (a) Точный объем раствора кислоты известной концентрации отмеряется в колбу. А добавлено несколько капель индикатора фенолфталеина. (б) Раствор, содержащий гидроксид натрия в неизвестной концентрации добавляется до бледно-розового цвета цвет виден в течение нескольких секунд. |
Данные и расчеты для типичного кислотно-основного титрования показаны в таблице 11.5. Обратите внимание, что было проведено три испытания — стандартная процедура для проверки точности титрования.
Реакции титрования не всегда являются кислотно-щелочными. Это могут быть окислительно-восстановительные реакции, реакторы осаждения или комбинированные реакции. Конечная точка может быть определена по изменению цвета добавленного индикатора или по изменению цвета раствора после завершения реакции.В других титрованиях конечная точка может быть отмечена изменением электропроводности реакционной смеси, образованием осадка или множеством других способов.
| ||||||||||||||||||||
| Данные Молярность H 2 SO 4 : 0.108 M = 0,108 ммоль / мл | ||||||||||||||||||||
| ||||||||||||||||||||
| ||||||||||||||||||||
| ||||||||||||||||||||
| * Первые три фактора в уравнении дают миллимоли H 2 SO 4 использованных. Разделение на объем использованной кислоты дает молярность (моль / л). 1 в последнем множителе — безразмерное число. | ||||||||||||||||||||
Пример: три пробы 25,00 мл раствора серной кислоты неизвестной концентрации титровали до конечной точки фенолфталеина с 0.129 М гидроксид калия решение. Показания бюретки для каждого испытания были следующими:
Рассчитайте молярность раствора серной кислоты. Решение Решение этой проблемы оформить в виде таблицы 11.5. Уравнение 2 КОН + Н 2 СО 4 K 2 SO 4 + 2 H 2 O Данные Молярность KOH: 0.129 M (0,129 ммоль КОН / мл раствора)
(Эти данные получены путем вычитания показаний бюретки, приведенных в суть проблемы. |

 Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:  д.
д.


 ) — см. CLEAPSS Hazcard HC095A и CLEAPSS Recipe Book RB080.
) — см. CLEAPSS Hazcard HC095A и CLEAPSS Recipe Book RB080.


 Известны два твердых гидрата: моногидрат (HNO 3 .H 2 O) и тригидрат (HNO 3 .3H 2 O).
Известны два твердых гидрата: моногидрат (HNO 3 .H 2 O) и тригидрат (HNO 3 .3H 2 O). Чилтон, Strong Water; Азотная кислота: источники, методы производства и использование (Кембридж, Массачусетс: M.I.T. Press, 1968). OCLC 237255.
Чилтон, Strong Water; Азотная кислота: источники, методы производства и использование (Кембридж, Массачусетс: M.I.T. Press, 1968). OCLC 237255.