Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена… на Сёзнайке.ру
Соли. Химические свойства солей. Взаимодействие с кислотами, щелочами, металлами. Реакции обмена между солями. Практическое значение солей
(хлорида натрия, карбонатов натрия, калия и кальция).
ПЛАН ОТВЕТА:
- Определение
- Химические свойства:
a) Взаимодействие с кислотами,
b) Взаимодействие со щелочами,
c) Взаимодействие с металлами,
d) Взаимодействие с солями.
- Практическое значение:
a) Хлорида натрия,
b) Карбоната натрия,
c) Карбоната калия,
d) Карбоната кальция.
Соли – это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl ® Na+ + Cl— K2SO4 ® 2K+ + SO4
Общие химические свойства солей характеризуются их взаимодействием с кислотами, щелочами, металлами и солями.
- Соли взаимодействуют с кислотами, если образуется:
a) летучая кислота: CaCO3 + 2HCl = CaCl2 + H2O + CO2, CaCO3 + 2H+ = Ca2+ + H2O + CO2;
b) нерастворимая кислота: Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3?, SiO32- + 2H+ = H2SiO3;
c) соль, нерастворимая в воде и образующейся кислоте:
AgNO3 + HCl = AgCl? + HNO 3, Ag+ + Cl— = AgCl.
- Растворимые соли взаимодействуют со щелочами, если одно из образующихся веществ выпадает в осадок: CuSO4 + 2NaOH = Cu(OH)2? + Na2SO4 Cu2+ + 2OH— = Cu(OH)2,
Na2SO4 + Ba(OH)2 = BaSO4? + 2NaOH SO42- + Ba2+ = BaSO4
- Более активные металлы вытесняют менее активные металлы из растворов их солей, за исключением металлов, реагирующих с водой: CuSO4 + Zn = ZnSO4 + Cu
Cu + ZnSO4 = —————
!!! При взаимодействии растворов солей со щелочными металлами образуется новая соль, нерастворимое основание и водород, т.
Na + CuSO4 + H2О = …………………..
2Na + 2H2O = 2NaOH + H2
2NaOH + CuSO4 = Cu(OH)2? + Na2SO4
————————————————-
2Na + CuSO4 + 2H2O = H2 + Cu(OH)2? + Na2SO4
- Растворы солей реагируют между собой, если происходит связывание ионов.
Если связывания ионов не происходит, то говорят, что реакция идёт не до конца:
CuSO4 + BaCl2 = CuCl2 + BaSO4 SO42- + Ba2+ = BaSO4?
есть связывание ионов, реакция идёт до конца.
K2SO4 + 2NaCl = Na2SO4 + 2KCl
2K+ + SO42- + 2Na+ + 2Cl — = 2Na+ + SO42- + 2K+ + 2Cl—
нет связывания ионов, реакция идёт не до конца.
Многие соли имеют большое практическое значение. Например, хлорид натрия NaCl или поваренная соль, каменная соль, пищевая соль – ценнейшее химическое сырьё. Его используют при получении соды, хлороводорода. При электролизе водного раствора хлорида натрия получают гидроксид натрия, хлор и, попутно, водород, а при электролизе расплава хлорида натрия получают металлический натрий и хлор. Хлорид натрия применяют при первичной обработке кож, при подготовке тканей к крашению, как консервант в пищевой промышленности, как вкусовую добавку в пищу. В дорожном хозяйстве для предотвращения обледенения асфальта. Всего хлорид натрия используют более чем в 1500 производствах различных веществ и материалов.
Карбонат натрия Na2CO3 или кальцинированная сода, сода, стиральная сода. Его применяют при производстве стекла, мыла и моющих средств, при варке целлюлозы, как нейтрализующее вещество при обработке кислых растворов.
Карбонат калия, K2CO3 поташ применяют при варке оптического стекла, жидкого мыла, минеральных красок, получении многих соединений калия.
Карбонат кальция CaCO3 – распространённое в природе вещество: минерал кальцит, горная порода известняк и его разновидности – мел, мрамор, туф. Применяется для производства негашёной извести, цемента, стекла, минеральных удобрений, как наполнитель при изготовлении «мелованной» бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осаждённого порошка – для изготовления школьных мелков, зубных порошков и паст, в побелке помещений.
Химические свойства солей. 8-й класс
Цель: изучить некоторые химические свойства солей в процессе практической
деятельности.
Задачи: -формировать умения и навыки при работе с формулами, уравнениями, химическим оборудованием и реактивами;
-развивать память, речь, мышление;
-формировать умения сравнивать и анализировать, делать выводы;
-воспитывать самостоятельность, коммуникативность, вниматетельность,
трудолюбие, аккуратность.
Тип урока: комбинированный.
Методы и ФОПД: частично-поисковый; коллективная, групповая, парная и индивидуальная работы.
Оборудование: медиапроектор, ноутбук, экран, 6 ящиков с реактивами и химическим оборудованием /пробирки,спички,спиртовки, держатель, стеклянная палочка, лучинки/ карточки с формулами, таблица растворимости, ПСХЭ, инструкция к практикуму.
Реактивы: CuSO4 , CaCO3, HCl, NaOH, BaCl2, вода.
Ход урока:
1. Организационный момент
2. Повторение.
Учитель: Какие классы неорганических веществ вы знаете?
Какие соединения называют оксидами (кислотами, основаниями)?
/Учащиеся отвечают на поставленные вопросы/
Задание. Прочитать и назвать формулы веществ, спроецированных на экран через медиапроектор /устно/
Слайд 1*.
HBr, SO2, HNO 3, Al2O3, Fe(OH)3, K2O, P2O5, Zn(OH)2, H3BO3.
Учитель: Какие вещества называют солями? Какие бывают соли? /ответы учащихся/
Задание. Разделить предложенные формулы солей, согласно их классификации /работа в тетради/
На доске:
Слад 2. На экране спроецированы формулы. Учащиеся выходят по очереди( 4 человека), выписывают формулы на доску, дают названия.
Даны соли: NaCl, КNaSO4, Cu(OH)Cl, MgSO4, NaHCO3, NaLi 2PO4, Mg(OH)Br, NaHS.
Учитель: А теперь, в качестве итога нашего повторения, напишем небольшую проверочную работу.
3.Проверочная работа.
Слайд 3.
Задание. Составить формулы солей: хлорид алюминия, нитрат магния, сульфат калия, карбонат железа, ортофосфат кальция, сульфид калия
/ Один из учащихся выполняет данное задание на скрытой части доски,
остальные работают на листочках. После выполнения работы ребята
меняются листочками, проверяют задание и ставят оценки./
После выполнения работы ребята
меняются листочками, проверяют задание и ставят оценки./
Слайд 4. Критерии оценивания: «5»-0 ошибок.
«4»-1.
«3»-2.
«2»-3 и больше.
Учитель: А теперь приступим к изучению новой темы. Сначала вы внимательно изучите
инструкцию, затем мы разберем вместе вопросы, которые у вас возникнут и
затем будите выполнять работу.
Повторим правила ТБ по картинкам на экране. (Слайд 5)
4. Изучение новой темы / групповая работа/
Группам раздаются инструкции, на их изучение дается 3 минуты,
затем выполняется практическая часть./15 мин./
/см. инструкцию/
5. Домашнее задание
: параграф 33, № 6(п) стр.98. /комментарии учителя/
6. Подведение итогов.
/Учитель сообщает учащимся оценки, подводит итог урока. /
/
1. 1 пробирка: CuSO4.
2 –3 пробирки: CaCO3
1 часть. Рассмотрите выданные вам образцы солей. Какого они агрегатного состояния,
какого цвета?
Проверьте соли на растворимость в воде. Для этого, в пробирки с солями
прилейте по 4-5 мл. воды /кроме 3 пробирки/ и размешайте стеклянной палочкой.
Что вы наблюдаете? Сделайте вывод.
2 часть. Изучение химических свойств солей.
1.Разделите полученный раствор соли CuSO4 на 3 пробирки.
2.В первую пробирку добавьте 1-2 мл. раствора кислоты HCl,
что вы наблюдаете?
4.В третью- раствор соли BaCl2, что наблюдаете?
5. Третью пробирку с солью СаСО3 закрепите в пробиркодержателе и осторожно нагрейте, соблюдая все правила техники безопасности.
 Что вы наблюдаете?
Что вы наблюдаете?Зажгите лучину о спиртовку и проверьте наличие газа в пробирке с солью.
Какой газ выделяется в результате данной реакции? Проверьте по таблице растворимости, является ли данная соль растворимой.
6. Составьте уравнения всех реакции и запишите наблюдения в тетрадь.
/правильность составления уравнений проверяется на доске/
3 часть. 1. Понятие о кристаллогидратах. /сообщение /
/За неделю до данного урока одному из учеников было дано задание вырастить
дома кристаллы солей (хлорида натрия, дихромата калия) и сделать небольшое
сообщение./
2. Сделайте выводы о химических свойствах солей.
/Учащиеся делают выводы о химических свойствах/
Выводы. Соли реагируют с кислотами, основаниями, солями;
нерастворимые соли разлагаются при нагревании; образуют кристаллогидраты.
* Презентацию можно получить у автора статьи
Химические свойства солей — Учебник по Химии.
 8 класс. Григорович
8 класс. ГригоровичУчебник по Химии. 8 класс. Григорович — Новая программа
Вспомните:
• как определить, растворяется ли неорганическое вещество (соль, кислота или основание) в воде;
• условия протекания реакций обмена (§ 33).
Взаимодействие солей с основаниями
Из § 33 вы уже узнали о взаимодействии щелочей с кислотами. Реакции между солями и основаниями являются реакциями обмена.
Обратите внимание:
• чтобы взаимодействие между солью и основанием соответствовало условиям протекания реакций обмена, один из продуктов должен выпадать в осадок;
• поскольку нерастворимые вещества не могут быть одновременно среди реагентов и продуктов, то в такие реакции могут вступать только растворимые соли со щелочами.
Следовательно:
Такие реакции используют для получения нерастворимых оснований.
Например, при взаимодействии растворов купрум(II) хлорида и натрий гидроксида выпадает осадок купрум(II) гидроксида с характерной окраской (рис. 38.1):
38.1):
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Рис. 38.1. О реакции купрум(II) хлорида и щелочи свидетельствует образование синего осадка купрум(II) гидроксида
Если прилить раствор соли к нерастворимому основанию, например феррум(II) гидроксиду, то такая реакция не происходит:
Fe(OH)2+ СuСl2 ≠ Cu(OH)2 + FeCl2
Щелочи являются сильными основаниями, а нерастворимые гидроксиды — слабыми. Следовательно, реакция между солью и основанием происходит только в том случае, если более сильное основание (щелочь) вытесняет из соли более слабое (нерастворимое). Таким образом, соль со щелочью взаимодействовать может, а с нерастворимым основанием — нет.
Взаимодействие солей с кислотами
Из § 35 вы уже узнали о взаимодействии солей с кислотами. Такие реакции являются реакциями обмена, ведь в результате должны образоваться новые соль и кислота:
Как вы помните, реакции между солью и кислотой возможны при условии, что:
• выпадает осадок;
• выделяется неустойчивая или летучая кислота.
Например, при взаимодействии аргентум(І) нитрата с хлоридной кислотой реакция протекает с образованием белого творожистого осадка (рис. 38.2):
AgNO3 + НСl = AgCl↓ + ΗΝO3
Рис. 38.2. При сливании растворов аргентум(І) нитрата и хлоридной кислоты образуется осадок аргентум хлорида
Неустойчивые кислоты образуются в реакциях кислот с карбонатами или сульфитами. Например, при добавлении к барий сульфиту хлоридной кислоты наблюдается исчезновение нерастворимого барий сульфита, поскольку новая соль растворима в воде. Но образованная сульфитная кислота является неустойчивой, она медленно разлагается, о чем свидетельствует появление запаха сернистого газа (сульфур(ІV) оксида):
BaSO3↓ + 2НСl = ВаСl2 + SO2↑+ Н2O
Реакции между двумя солями
Две соли также могут вступать в реакцию друг с другом. Между ними может происходить реакция обмена. Конечно, если в реакцию вступают две соли, то и продуктами реакции также должны быть две соли.
Обратите внимание: взаимодействие двух солей возможно лишь в том случае, если обе исходные соли растворимы в воде и хотя бы один из продуктов реакции выпадает в осадок, т. е. среди продуктов реакции одна соль должна быть нерастворимой или малорастворимой в воде:
Например, получить малорастворимый кальций флуорид или нерастворимый плюмбум(II) йодид можно по таким уравнениям реакций (рис. 38.3 и 38.4):
СаСl2 + 2NaF = CaF2↓+ 2NaCl
Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3
Рис. 38.3. Образование осадка малорастворимого кальций флуорида при сливании растворов натрий флуорида с кальций хлоридом
Рис. 38.4. Взаимодействие калий йодида с плюмбум(II) нитратом с образованием желто-золотистого осадка плюмбум(II) йодида
Если при смешивании двух растворимых солей среди продуктов реакции нет нерастворимой соли, то такие реакции не происходят:
Na2SO4 + 2KNO3 ≠ 2NaNO3 + K2SO4
Иногда в реакцию могут вступать растворимая соль с нерастворимой. Это возможно в случае, если образуется соль, растворимость которой еще меньше. Значит, нужно знать численные показатели растворимости реагентов и продуктов реакции. Например, кальций сульфат — малорастворимая соль, а барий сульфат — нерастворимая, поэтому возможна реакция:
Это возможно в случае, если образуется соль, растворимость которой еще меньше. Значит, нужно знать численные показатели растворимости реагентов и продуктов реакции. Например, кальций сульфат — малорастворимая соль, а барий сульфат — нерастворимая, поэтому возможна реакция:
CaSO4 + ВаСl2 = BaSO4↓ + СаСl2
Аргентум хлорид и аргентум йодид — нерастворимые соли, но аргентум хлорида в 1 л воды растворяется 1,9 мг, а аргентум йодида — лишь 0,0024 мг. Таким образом, аргентум йодид менее растворим, чем аргентум хлорид, поэтому возможна реакция:
AgCl + NaI = AgI + NaCl
Аргентум хлорид имеет белую окраску, а аргентум йодид — желтоватую. О ходе реакции можно узнать по изменению цвета осадка, однако из-за того, что реагируют нерастворимые вещества, такие реакции протекают слишком медленно и происходящих изменений почти не видно.
• В конце XIX в. в Петербургской академии наук рассматривали предложение называть химические вещества по образцу русских фамилий. Так, гидроген хлорид HCI(хлороводород) предлагали называть «водород хлорович», а натрий сульфат Na2SO4 — «натрий серович четырехкислов».
Так, гидроген хлорид HCI(хлороводород) предлагали называть «водород хлорович», а натрий сульфат Na2SO4 — «натрий серович четырехкислов».
• Для золочения куполов, древесины, гипсовых изделий ранее иногда использовали так называемое муссивное золото. Однако оно не содержит ни грамма золота. Это станнум(IV) сульфид, из которого изготовляют краску, имитирующую позолоту.
• Кроме обычного сахара, химикам известен еще свинцовый сахар — плюмбум(II) ацетат Рb(СН3СОО)2. Внешне он очень похож на обычный сахар, сладкий и хорошо растворяется в воде, но чрезвычайно ядовит.
• Использование гипса для фиксации сломанных конечностей впервые в мировой медицине предложил наш соотечественник, уроженец Винницкой области (с. Вишня, ныне — с. Пирогово), основатель военно-полевой хирургии Николай Иванович Пирогов (1810-1881).
Ошибка 404. Страница не найдена!
В нашей гимназии открыта запись в объединения дополнительного образования на новый 2021-2022 учебный год. Подробнее>>
Подробнее>>
ИЗМЕНЕНИЯ ПОДАЧИ ЗАЯВЛЕНИЙ НА СДАЧУ ОГЭ В 2021
Дубненские выпускники 9-х классов смогут подать заявление на сдачу основного государственного экзамена (далее-ОГЭ) дистанционно. Подробнее>>
Уважаемые учащиеся и родители!
Уважаемые родители!
В соответствии с Приказом Министерства просвещения Российской Федерации от 02.09.2020 № 458 «Об утверждении Порядка приема на обучение по образовательным программам начального общего, основного общего и среднего общего образования» информируем Вас об изменении сроков приема заявлений в первый класс на 2021-2022 учебный год.
Уважаемые родители!
Информируем вас о том, что записаться на «Родительский контроль» — проект по оценке качества питания в школах — в Подмосковье теперь можно в режиме онлайн. Сделать это можно на Школьном портале региона. Регистрация проходит быстро — вся процедура займет не более трех минут.
Сделать это можно на Школьном портале региона. Регистрация проходит быстро — вся процедура займет не более трех минут.
— Нужно перейти во вкладку «Родительская»;
— Перейти в раздел «Школьное питание»;
— Выбрать желаемую дату и время;
— Нажать кнопку «Записаться».
Школа автоматически получит заявку и в назначенное время родителя будет ожидать классный руководитель или ответственный за питание.
Проект «Билет в будущее»
Билет в будущее» — это проект ранней профессиональной ориентации школьников 6−11 классов.
Кампания проекта проходит с июля по ноябрь 2020 года. Родителю и ребенку нужно пройти регистрацию на Платформе проекта по адресу https://bilet.worldskills.ru/, у каждого будет свой личный кабинет, в котором будут отражаться результаты участия.
Инструкция для регистрации .pdf
Подготовка к егэ
Приказ №164 от 29.05.2020г. «Об организации подготовки к ЕГЭ в режиме онлайн в 2020г». pdf
pdf
График консультаций ЕГЭ в режиме онлайн. pdf
Приказ №166 от 29.05.2020 «О внесении изменений в приказ №142 от 29.04.2020 «Об организации сотрудников гимназии №11 с 01.06.2020 по 14.06.2020г.» .pdf
внимание
Приказ №151а от 12.05.2020 «О внесении изменений в приказ №142 от 29.04.2020 «Об организации сотрудников гимназии №11 с 06.04.2020 по 31.05.2020» .pdf
Приказ №142 от 29.04.2020 «О внесении изменений в приказ №136 от 06.04.2020 «Об организации сотрудников гимназии №11 с 06.04.2020 по 30.04.2020» .pdf
Северное инспекторское отделение Центра ГИМС ГУ МЧС России по Московской области информирует
Сейчас на территории Подмосковья действует режим самоизоляции и покидать дома без острой необходимости запрещается, а прогулки у воды без присмотра взрослых могут стоить жизни. К сожалению, не все родители объясняют своим детям, что же означает этот режим, и к каким последствиям могут привести прогулки.
Самоизоляция – это комплекс ограничительных мер для населения, которые вводит правительство на определенный срок для борьбы с распространением опасного заболевания.
Граждан просят соблюдать режим: не выходить на улицу без острой необходимости, ограничить контакты с другими людьми и соблюдать все рекомендации по профилактике вирусных заболеваний, предложенные медицинским сообществом.
Уважаемые родители и дети просим Вас не пользоваться береговой зоной водоемов и не нарушать режим самоизоляции.
Берегите себя и своих близких!!!
Приказ №136 от 06.04.2020 «Об организации работы сотрудников гимназии №11 с 06.04.2020г. по 30.04.2020г » .pdf
Приказ №134 от 03.04.2020 «О переходе на обучение с использованием электронного обучения и дистанционных образовательных программ» .pdf
Регламент организации дистанционного обучения в Гимназии №11
Дорогие участники образовательного процесса, учащиеся, учителя, родители! Познакомьтесь с регламентом организации дистанционного обучения . pdf
pdf
Изменения в Постановлении Губернатора Московской области
Уважаемые родители и ученики! Согласно постановлению Губернатора Московской области №171-ПГ от 02.04.2020 образовательный процесс в Гимназии №11 с 06.04.2020 по 30.04.2020 будет осуществляться с использованием электронного обучения и дистанционных образовательных технологий .pdf
О режиме повышенной готовности в гимназии №11
20 марта на сайте гимназии опубликован приказ №122 » О введении режима повышенной готовности в гимназии №11″ .pdf
меры профилактики гриппа и ОРВИ
Уважаемые родители!
Ежегодно в конце зимы и начале весны увеличивается число заболевших гриппом и ОРВИ. Давайте отнесемся к здоровью наших детей в этот период с особым вниманием. Узнать более подробно о мерах профилактики данных заболеваний:
https://www.rospotrebnadzor.ru/about/info/news_time/news_details.php?ELEMENT_ID=13566
УВАЖАЕМЫЕ РОДИТЕЛИ! ПРИМИТЕ УЧАСТИЕ В ОПРОСЕ
Родителям будущих первоклассников!
График приема родителей: (приказ. pdf)
pdf)
1 февраля 2020г. — с 09.00 до 17.00 (обед 13.00-14.00)
2 февраля 2020г. — с 09.00 до 17.00 (обед 13.00-14.00)
с 03.02.2020 — 30.06.2020г. с с 09.00 до 18.00 (обед 13.00-14.00) с понедельника по пятницу
С 1 февраля 2020 года начинается прием заявлений от родителей (законных представителей) на зачисление детей в 1 класс 2020 – 2021 учебного года в электронном виде для граждан, проживающих на закрепленной территории, посредством Портала государственных и муниципальных услуг Московской области https://uslugi.mosreg.ru/.
Подробнее по ссылке>>
Учитель шахмат
Департамент государственной политики в сфере общего образования Министерства Просвещения РФ информирует о проведении конкурса «Учитель шахмат», организатором которого является Общероссийская общественная организация «Федерация шахмат России». Заявки на участие в конкурсе принимаются до 15 апреля 2019 года.
Форму заявки можно скачать по ссылке. Конкурсные материалы принимаются с 16 апреля до 30 июня 2019 года. Форму для прикрепления конкурсных материалов можно скачать здесь. Контактное лицо: руководитель проекта «Шахматный всеобуч России» Костьев Александр Николаевич, тел. 8(968)732-00-74, адрес электронной почты: [email protected].
Урок мужества
1 марта 2019 г. во всех классах школы пройдет Урок мужества. В этот день будет проходить торжественная церемония награждения детей-лауреатов Всероссийской общественной инициативы «Горячее сердце».
Показать/скрытьЦелью такого урока является формирование у школьников готовности к общественной полезной деятельности, преодолению сложных ситуаций в семье или ограничений здоровья.
Лауреатами «Горячего сердца» являются дети, которые спасли людей при пожарах, помогли оказавшимся в беде или в сложной ситуации, участвовали в борьбе с распространением наркотиков, а также добились успеха в различных видах деятельности, несмотря на ограничения здоровья.
Методические рекомендации
Ребята и их родители!
Приглашаем вас принять участие в увлекательных конкурсах! Зарегистрируйтесь на сайте https://www.prav-pit.ru/, если есть вопросы, обращайтесь за помощью к координатору конкурса в гимназии №11социальному педагогу Волковой Елене Ивановне.
01.11.2018 – 15.06.2019
Конкурс семейной фотографии. Участники конкурса должны подготовить семейный фотоплакат, демонстрирующий важность здорового образа жизни.
15.10.2018 – 30.08.2019
Фотоконкурс “Воспитываем здоровых и счастливых”. Участвуйте конкурсе и размещайте свои фотографии, рассказывающие о том, как в вашей семье воспитывают здоровых и счастливых!
Авторы фотографий, за которых проголосует больше всего посетителей сайта, получат главный приз — 3 дневную экскурсионную поездку в Москву.
ЕСИА Условия успешной авторизации на Школьном портале через ЕСИА (только для пользователей старше 14 лет)
1. Наличие Подтверждённой учётной записиЕСИА (подробно о том, как и где подтвердить учётную запись ЕСИА, рассказано здесь)
Наличие Подтверждённой учётной записиЕСИА (подробно о том, как и где подтвердить учётную запись ЕСИА, рассказано здесь)
2.Наличие учётной записи в системе «Школьный портал»
3.Совпадение ФИО и СНИЛС в учётных записях ЕСИА и системы «Школьный портал»
ВНИМАНИЕ! В случае отсутствия СНИЛС в учетной записи необходимо выполнить связывание своих учетных записей вручную. Как это сделать: https://helpschool.mosreg.ru/hc/ru/articles/360001467547
Уважаемые родители!Информацию о приеме в кружки и секции дополнительного образования на 2018/2019 уч.г. можно посмотреть в разделе Родителям
Уважаемые учащиеся!
Предлагаем вам ознакомиться с материалами и принять участие в VIII Всероссийском конкурсе социальной рекламы «Новый взгляд». Подробнее…Уважаемые учащиеся и родители!
Министерство здравоохранения Московской области в рамках подготовки к Всемирному Дню сердца предлагает ознакомиться с видео-роликом о первых признаках инсульта «УДАР», а также на сайте службы медицинской профилактики Московской области пройти анкетирование и ознакомиться с полезной информацией о факторах риска развития инсульта.
Свойства солей в свете ТЭД
Это вещество так необходимо человеческому роду, что даже
духовные удовольствия не могут быть лучше выражены,
как словом «…» — таково имя, данное всем проявлениям острого ума.
Плиний-Старший
В древней раздробленной Германии наличие соляных источников на той или иной территории считалось вполне достаточным и убедительным поводом для военного вторжения соседей.
Легионерам Древнего Рима часто платили жалование не деньгами, а солью. Слово «солдат» и английское слово “salary” (жалованье) родились благодаря такому «жалованью».
В
XIII в.,
по свидетельству Марко Поло, в Тибете монетой служила лепёшка из соли с
оттиснутым на ней изображением «великого хана», а по словам М. В.
Ломоносова, ещё и в его время за 4-5 плиток «Горной соли» в Абиссинии
можно было купить раба.
Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка. Соли – это твёрдые вещества, они отличаются между собой окраской и растворимость в воде.
Ещё в начале XIX в. шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте на металл. По этим признакам соли делят на средние, кислые и основные.
Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Именно эти соли вам уже известны. Например,
Na2CO3 – карбонат натрия
Al2(SO4)3 – сульфат алюминия
Ba(NO3)2 – нитрат бария
CaCl2 – хлорид кальция
K3PO4 – фосфат калия
Эти
соли диссоциируют на катионы металла и анионы кислотного остатка. Так, карбонат
натрия диссоциирует на катион натрия и карбонат-ион, сульфат алюминия
диссоциирует на катион алюминия и сульфат-ион, нитрат бария диссоциирует
на катион бария и нитрат-ион, хлорид кальция – на катион кальция и
хлорид-ион, а фосфат калия диссоциирует на катион калия и фосфат-ион.
Так, карбонат
натрия диссоциирует на катион натрия и карбонат-ион, сульфат алюминия
диссоциирует на катион алюминия и сульфат-ион, нитрат бария диссоциирует
на катион бария и нитрат-ион, хлорид кальция – на катион кальция и
хлорид-ион, а фосфат калия диссоциирует на катион калия и фосфат-ион.
Na2CO3 = 2Na+ + CO32-
Al2(SO4)3 = 2Al3+ + 3SO42-
Ba(NO3)2= Ba2+ +2 NO3—
CaCl2 = Ca2+ + 2Cl—
K3PO4 = 3K+ + PO43-
Кислые соли
– это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят такие соли как NaHSO4, KHCO3, CaHPO4. Название этих солей складывается из названий средних солей с прибавлением слова «гидро». Назовём наши соли:
NaHSO4 – гидросульфат натрия
KHCO3 – гидрокарбонат калия
CaHPO4 – гидрофосфат кальция
Эти соли диссоциируют ступенчато. На первой ступени образуется катион металла и анион кислотного остатка, содержащий ион водорода, а на второй ступени отщепляется ион водорода и кислотный остаток.
NaHSO4 = Na+ + HSO4—
HSO4— ↔ H + SO42-
Основные соли
– это продукты неполного замещения гидроксогрупп в основании на
кислотный остаток.
К таким солям относится малахит, формула которого (CuOH)2CO3. Как видите, это соль состоит из двух гидроксокатионов CuOH+ и двухзарядного аниона кислотного остатка СО32-. Если подсчитать сумму зарядов ионов, то получается, что эта соль электронейтральна. Названия основных солей складывается из названия средней соли с добавлением слова «гидроксо». Например, назовём соли: (CuOH)2CO3, Mg(OH)Cl.
(CuOH)2CO3 – гидроксокарбонат меди (II)
Mg(OH)Cl – гидроксохлорид магния
Эти соли также диссоциируют
ступенчато: сначала отщепляется катион металла, содержащий гидроксогруппу и
анион кислотного остатка, а затем отщепляется катион металла и гидроксогруппа.
Mg(OH)Cl = MgOH+ + Cl—
MgOH+ ↔ Mg2+ + OH—
Соли реагируют с кислотами, но только в том случае, если образуется осадок, или выделяется газ. Этот тип реакций относится к реакциям обмена. Проведём эксперимент. В одну пробирку нальем силиката натрия и серной кислоты, во вторую – карбонат натрия и азотную кислоту, а в третью нитрат натрия и серную кислоту. В результате у нас получается, что в первой пробирке выпал студенистый осадок, во второй пробирке мы можем наблюдать выделение газа, а в третьей изменений нет. Следовательно, химические реакции прошли только в двух пробирках.
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
NaNO3 + H2SO4 ≠
Соли
вступают в реакции обмена со щелочами, при этом образуется
новая соль и новое основание. Для этого нальём в первую пробирку раствор
сульфата железа (III)
и добавим гидроксида натрия, во вторую сульфата аммония и
гидроксида калия, слегка нагреем содержимое пробирки, а в третью нальём раствор
нитрата бария и добавим гидроксида калия. В первой пробирке мы наблюдаем
осадок бурого цвета, во второй пробирке образуется газ с резким запахом, в
третьей пробирке изменений не наблюдаем. Поэтому, можно говорить о том, что соли
реагируют с основаниями в том случае, если образуется слабое основание или
нерастворимое в воде основание.
Для этого нальём в первую пробирку раствор
сульфата железа (III)
и добавим гидроксида натрия, во вторую сульфата аммония и
гидроксида калия, слегка нагреем содержимое пробирки, а в третью нальём раствор
нитрата бария и добавим гидроксида калия. В первой пробирке мы наблюдаем
осадок бурого цвета, во второй пробирке образуется газ с резким запахом, в
третьей пробирке изменений не наблюдаем. Поэтому, можно говорить о том, что соли
реагируют с основаниями в том случае, если образуется слабое основание или
нерастворимое в воде основание.
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
Fe3+ + 3OH— = Fe(OH)3↓
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O
NH4+ + OH— = NH3↑ + H2O
Ba(NO3)2 + KOH ≠
Соли
могут реагировать между собой. Эти реакции относятся к
реакциям обмена. При этом образуется две новые соли, одна из них должна быть
нерастворимой. Например, если мы к раствору хлорида бария добавим
раствор сульфата натрия, то у нас образуется осадок белого цвета. Т.о. в
результате данной реакции образовалось две соли, причём одна выпадает в виде
осадка.
Эти реакции относятся к
реакциям обмена. При этом образуется две новые соли, одна из них должна быть
нерастворимой. Например, если мы к раствору хлорида бария добавим
раствор сульфата натрия, то у нас образуется осадок белого цвета. Т.о. в
результате данной реакции образовалось две соли, причём одна выпадает в виде
осадка.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + SO42- = BaSO4↓
Соли
могут вступать в реакции замещения с металлами.
При этом образуется другая соль и другой металл. Однако для прогнозирования
протекания этих реакций необходимо использовать ряд активности металлов.
Впервые этот ряд составил Н.Н. Бекетов, который расположил металлы и водород по
способности вытеснять друг друга из растворов солей. Этот ряд он назвал
вытеснительным рядом металлов. Вытеснительный ряд металлов называют ещё
электрохимическим рядом напряжений металлов. Более активные металлы находятся
вначале ряда, а неактивные – в конце. Поэтому, этот вытеснительный ряд
металлов используют для определения протекания реакций между солями и
металлами. Каждый металл вытесняет из раствора соли металлы, расположенные
правее его в ряду напряжений. При этом должны соблюдаться условия: обе
соли (и реагирующая, и образующаяся) должны быть растворимыми, металлы не
должны реагировать с водой (т.е. щелочные и щелочноземельные металлы,
которые реагируют с водой с образованием щелочей).
Этот ряд он назвал
вытеснительным рядом металлов. Вытеснительный ряд металлов называют ещё
электрохимическим рядом напряжений металлов. Более активные металлы находятся
вначале ряда, а неактивные – в конце. Поэтому, этот вытеснительный ряд
металлов используют для определения протекания реакций между солями и
металлами. Каждый металл вытесняет из раствора соли металлы, расположенные
правее его в ряду напряжений. При этом должны соблюдаться условия: обе
соли (и реагирующая, и образующаяся) должны быть растворимыми, металлы не
должны реагировать с водой (т.е. щелочные и щелочноземельные металлы,
которые реагируют с водой с образованием щелочей).
Для
подтверждения этих правил проведём опыт. Для этого в первую пробирку
поместим железный гвоздь, во вторую – свинцовую пластину, а в
третью – медную пластину. В первые две пробирки нальём раствора
сульфата меди (II),
а в третью – раствор сульфата железа (II). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а
во второй и третьей пробирке нет никаких изменений. Следовательно, в первой
пробирке находился более активный металл, который вытеснил медь из
раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат
свинца (II)) является
нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее
железа в ряду напряжений и не может вытеснить его из раствора соли.
Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а
во второй и третьей пробирке нет никаких изменений. Следовательно, в первой
пробирке находился более активный металл, который вытеснил медь из
раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат
свинца (II)) является
нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее
железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
Cu + FeSO4 ≠
Урок «Химические свойства солей»
УРОК ХИМИИ
8 класс
Тема: Химические свойства солей
Цель урока: расширить знания о солях при знакомстве с химическими свойствами этих соединений.
Задачи урока:
- Образовательная: успешное усвоение химических свойств солей, формирование навыков и умений написания уравнений химических реакций на примере химических свойств солей, продолжение формирование навыков работы с лабораторным оборудованием и химическими реактивами, осуществление контроля за усвоением нового материала.
- Развивающая: развивать познавательный интерес к уроку, развитие умений выделять, запоминать главное, обобщать результаты работы, наблюдать, прогнозировать химические свойства солей, объяснять взаимосвязь между строением и свойствами солей. Развитие способностей к само- и взаимоконтролю, самоорганизации.
- Воспитательная: воспитывать культуру общения через работу в паре, группе, воспитывать у учеников внимание, инициативу, воспитание культуры умственного труда
Оборудование и реактивы: презентация, ноутбуки, видеофрагменты, проектор, экран, растворы кислот, щелочей, солей, пробирки,
Методы и приемы : проблемный, частично- поисковый, наглядный, проектный (на подготовительном этапе).
Тип урока: Урок формирования новых знаний, умений и навыков.
Форма организации работы учащихся: групповая, индивидуальная, фронтальная.
Межпредметные связи: биология, экология, английский язык, валеология. Структура урока:
- Организационный момент.
- Проверка знаний. Поиск зашифрованного слова.
- Мотивация. Постановка проблемного вопроса
- Изучение нового материала, формирование навыков.
использование видеофрагмента, решение упражнений на первичное закрепление материала, формулировка основного правила для каждого свойства. Физкультминутка. Экологическая минутка.
- Практическое закрепление. Проведение и анализ опыта.
- Подведение итогов урока
решение проблемного вопроса, составление итоговой схемы, компьютерная тестовая проверка знаний, оценивание.
- Дифференцированное домашнее задание.
- Рефлексия.
ХОД УРОКА
I. Организационный момент.
Здравствуйте!
Открыли глаза, чтобы все увидеть!
Навострили ушки, чтобы все услышать!
Потерли ладошки, чтобы все сделать!
Включили мозги, чтобы все понять!
Слайд 2. Я хочу чтобы девизом нашего сегодняшнего урока стали слова Л.Н. Толстого «Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью»
Так что вперед за прочными знаниями.
Слайд 3.
II. Проверка знаний.
На прошлых урока, мы знакомились с разнообразием и номенклатурой солей. Чтобы проверить, как вы усвоили материал, я предлагаю выполнить следующее задание используя данные таблицы установите соответствие между названием и формулой вещества. Используя буквы на пересечении, составьте кодовое слово.
Используя буквы на пересечении, составьте кодовое слово.
Слайд 4. Какое слово у вас получилось (INSECTS) Как переводится это слово? (Насекомые). Вы наверное слышали слово инсектициды. Инсектицидами(от лат. Insectum — насекомое; caedo — уничтожать, убивать) принято называть вещества, предназначенные для уничтожения насекомых.
III. Мотивация.
Слайд 5. Соли очень разнообразны и занимают значительное место в жизни человека. Поэтому важно знать их основные свойства и оценить их реакционную способность. И так запишем тему нашего сегодняшнего урока: «Химические свойства солей»
Слайд 6. Изучая тему сегодняшнего урока мы постараемся найти ответ на вопрос «Почему соли часто называют классом веществ, связывающим между собой другие классы неорганических соединений.»
Слайд 7. Давайте вспомним какие классы неорганических соединений мы уже изучили (Оксиды, Основания, Кислоты) В конце урока мы вернемся к этому слайду и я верю найдем ответ на вопрос.
IV. Изучение нового материала
(поиск ответа на проблемный вопрос)
Слайд 8. Немного истории. Николай Николаевич Бекетов в 1865г изучил способность металлов вытеснять из растворов солей другие металлы. На основе своих исследований он составил вытеснительный ряд металлов
Слайд 9. ПРАВИЛА ВЫТЕСНИТЕЛЬНОГО РЯДА :
- МЕТАЛЛ ДОЛЖЕН НАХОДИТЬСЯ В РЯДУ НАПРЯЖЕНИЙ ДО МЕТАЛЛА СОЛИ;
- ОБЕ СОЛИ ДОЛЖНЫ БЫТЬ РАСТВОРИМЫМИ;
- НЕ РЕКОМЕНДУЕТСЯ ИСПОЛЬЗОВАТЬ АКТИВНЫЕ(ЩЕЛОЧНЫЕ) МЕТАЛЛЫ т.к ОНИ ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ.
(Видеофрагмент)
Слайд 10. Взаимодействие солей с металлами
Напишите уравнения продемонстрированных реакций.
Cu + AgNO3 =
Fe + CuSO4 =
Zn + Рb(NO3)2 =
(Ребята записывают уравнение в тетради,)
Слайд 11. Проверьте запись уравнений продемонстрированных реакций.
Cu + 2AgNO3 =2Ag +Cu (NO3)2
Fe + CuSO4 = Cu + FeSO4
Zn + Рb(NO3)2 = Рb+ Zn(NO3)2
Слайд 12. Взаимодействие с кислотами
Взаимодействие с кислотами
(проект «Своя виртуальная лаборатория» Ефимец Егор )
СаCO3 (ТВ.) + 2 HCl = СaCl2 + H2O + CO2↑
(Ребята записывают уравнение в тетради)
Соли взаимодействуют с кислотами, если образуются газ или осадок
Слайд 13. Проверим, как вы поняли характеристику данного свойства. Заполните пустые клетки в химическом кроссворде.
Слайд 14. Замечательно. Но мне кажется чего-то не хватает до полной картины.
Слайд 15. Вот теперь все на своих местах.
Как вы думаете, как будет взаимодействовать соль с щелочью?
Слайд 16. Взаимодействие со щелочами
(проект «Своя виртуальная лаборатория» Стороженко Роман )
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
(Ребята записывают уравнение в тетради)
Соли взаимодействуют с растворами щелочей, если образуется осадок нерастворимого основания.
Слайд 17. Решаем устно задачу.
Решаем устно задачу.
Какое количество вещества осадка образуется в результате взаимодействия 12 граммов натрий гидроксида с достаточным количеством феррум (ІІІ) хлорида?
3NaOH + FeCl3 = 3NaCl + Fe(OH)3
M(NaOH)=23+16+1= 40г/моль
υ(NaOH)=12/40 = 0,3 моль
υ(Fe(OH)3) = 0,3/3 =0,1 моль Ответ: 0,1 моль
Хорошо! А теперь давайте посмотрим, как будут реагировать соли друг с другом
Слайд 18. Взаимодействие соли с солью
(проект «Своя виртуальная лаборатория» Сенченко Марина )
BaCl2 + Na2SO4 = 2NaCl + BaSO4↓
(Ребята записывают уравнение в тетради)
Соли взаимодействуют друг с другом в растворах, при этом должен образовываться осадок или газ
Для того что бы закрепить знания выполним групповое задание «Ромашка для химика» Учащиеся объединяются в три рабочие группы и находят пары солей которые будут вступать в реакцию между собой.
Слайд 19. Валеологическая пауза
Слайд 20. Термическое разложение солей
2KNO3 = 2KNO2 + O2 ↑
Найдите и исправьте ошибки в расстановке коэффициентов
3KMnO4 = K2MnO4 + 2MnO2 + O2 ↑
CaCO3 = CaO + 2CO2 ↑
2AgNO3 = Ag + 2NO2↑ + O2↑
Слайд 21. Правильные уравнения
Правильные уравнения
2KMnO4 = K2MnO4 + MnO2 + O2 ↑
CaCO3 = CaO + CO2 ↑
2AgNO3 = 2Ag + 2NO2↑ + O2↑
Как вы думаете, все ли соли при нагревании разлагаются?
Слайд 22. Экологическая минутка
Экологическая минутка
Не идётся и не едется, потому что гололедица.
Но зато отлично падается!
Почему ж никто не радуется? В. Берестов
Какие же методы защиты используют дорожные службы Украины и Европы в борьбе с гололедицей?
Песчано-солевая смесь
- Раствор кальций хлорида — эффективен лишь при температурах до -10°C
- Кристаллический натрий хлорид — если температура воздуха и дорожного покрытия не опустилась до -18°C.
- Магний хлорид в твердой или жидкой форме – эффективен при температуре даже -35°C
Кроме того, 10%-ный раствор магний хлорида безопасен для окружающей среды!!!
V. Практическое закрепление
Слайд 23. Повторим правила безопасности при проведении лабораторного опыта
Инструктивная карточка
1. Перед вами две пробирки, ознакомьтесь с их содержимым.
Перед вами две пробирки, ознакомьтесь с их содержимым.
2. Осторожно перелейте содержимое одной пробирки в другую.
3. Пронаблюдайте и опишите признаки химической реакции.
4. Запишите уравнение реакции.
5. Укажите, какое свойство солей характеризует данная реакция?
VI. Подведение итогов урока
Слайд 24. Давайте еще раз повторим какими же химическими свойствами будут обладать соли.
С + кислоты = С + кислота
О + щелочи = О + основание
Л + соли = Л + соль
Ь + Ме = Ь + Ме
↓tº
ПРОДУКТЫ РАЗЛОЖЕНИЯ My Test
Слайд 25. И давайте вернемся к вопросы который я задала вам в начале урока «Почему соли часто называют классом веществ, связывающим между собой другие классы неорганических соединений?»
И давайте вернемся к вопросы который я задала вам в начале урока «Почему соли часто называют классом веществ, связывающим между собой другие классы неорганических соединений?»
Работа по составлению схемы.
VII. Дифференцированное домашнее задание.
Слайд 26.
- Если ты все запомнил — выучи §19, выполни №3 стр.93
- Если ты все понял — выучи §19, выполни №5 стр.93
- Если ты научился – закрепи по §19, получи индивидуальное задание на olhovka_oosh@mail.ru
VIII. Рефлексия.
Слайд 27. Заполнение таблички
Заполнение таблички
Вопрос | Результат |
ЧТО ЗАПОМНИЛИ? |
|
ЧТО ПОНЯЛИ? |
|
ЧЕМУ НАУЧИЛИСЬ? |
|
Завершающее слово учителя:
На следующем уроке мы с вами познакомимся уже с генетической связью между оксидами, основаниями ,кислотами и солями, и в продолжении темы хочу сказать, что знания химических свойств простых веществ и их соединений позволяют управлять превращением одних веществ в другие и тем самым получать необходимые для народного хозяйства химические продукты.
Урок №38. Физические и химические свойства солей
Физические свойства солей
Прочитайте и сделайте конспект в тетрадь ( запишите все уравнения реакций, посмотрите предложенные видеоопыты)
Соли — это кристаллические вещества разных цветов и разной растворимости в воде. Растворимость соли можно определить по таблице «Растворимость солей, кислот, оснований в воде»
Некоторые соли широко используются в быту и помимо научных имеют бытовые (тривиальные) названия. Хлорид натрия, или поваренная соль, незаменим в приготовлении пищи. Карбонат натрия больше известен как сода, а перманганат калия больше известен как марганцовка. В качестве удобрения используют калийную селитру — нитрат калия. Она же входит в состав пороха и других пиротехнических смесей. Соли применяют в промышленности для получения металлов, кислот, в производстве стекла. сельском хозяйстве они служат удобрениями и средствами борьбы с болезнями и вредителями растений Некоторые соли используют в качестве строительных материалов и лекарств. [1]
[1]Мел — карбонат кальция
Мрамор — карбонат кальция
Известняк — карбонат кальция
Малахит — гидроксокарбонат меди(II) (CuOH)2CO3 или CuCO3·Cu(ОН)2:
Дихромат аммония — (NH4)2Cr2O7:
Химические свойства
1) Разложение при нагревании. При нагревании некоторых солей они разлагаются на оксид металла и кислотный оксид:
СаСO3 → СаO + СО2.
соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl→Ag + Cl2.
Исключение. Соли щелочных металлов:
2KClO3 = 2 KCl + 3 O2
2КNO3 →2КNO2 + O2
Видео Разложение малахита при нагревании:
(CuOH)2CO3 = 2CuO+CO2+H2O
Разложение дихромата аммония при нагревании.
Видео «Вулкан»:
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
2) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
2HCl + Na2CO3 → 2NaCl + CO2↑+ H2O
СaCl2 + H2SO4→ CaSO4 ↓ + 2HCl
Видео «Взаимодействие с кислотами»
3) Взаимодействие со щелочами. Со щелочами реагируют соли, если при этом образуется нерастворимое основание.
CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4
4) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl → AgCl↓ + NaNO3
5) Взаимодействие с металлами.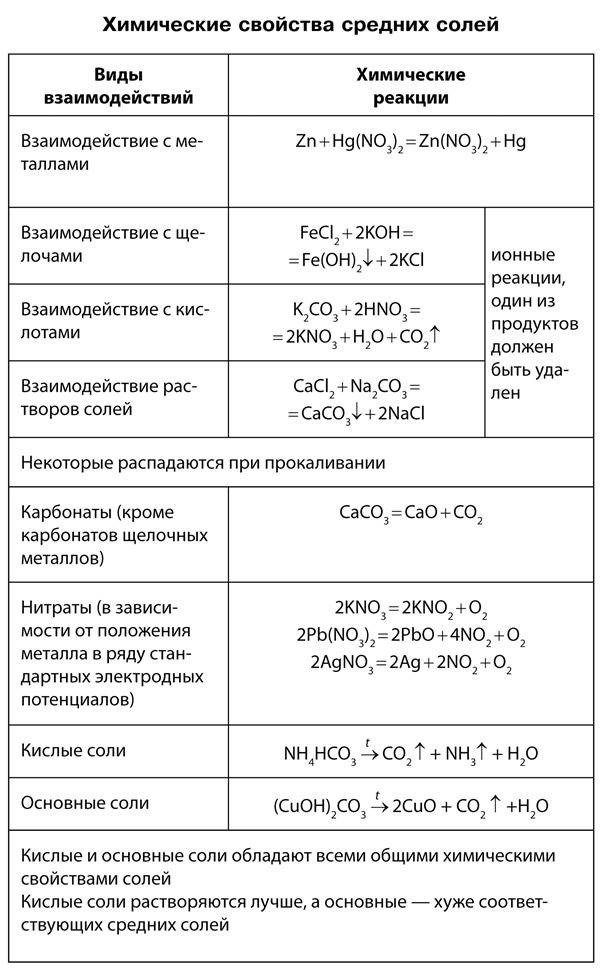 Каждый предыдущий металл в ряду
напряжений вытесняет последующий за ним из раствора его соли:
Каждый предыдущий металл в ряду
напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 → Cu + FeSO4
6) Взаимодействие с кислотными оксидами.
Na2CO3 + SiO2 → СО2 ↑+ Na2SiO3
Домашнее задание: прочитать параграф 47 стр.164 в 1, 2, 3, 5 письменно в тетради, высылать не нужно, проверю в школе.
Свойства соли и химическая формула | Что такое соль в химии? — Видео и стенограмма урока
| Соль | Молекулярная структура | использует |
|---|---|---|
| Дихромат калия | K2Cr2O7 | Он очень токсичен, легко воспламеняется и канцероген. Он используется в основном для приготовления сильнодействующих чистящих растворов. |
| Хлорид кальция | CaCl2 | Хороший водопоглощающий агент. Используется для таяния льда на дорогах в зимний период. Используется для таяния льда на дорогах в зимний период. |
| Сульфат меди | CuSO4 | Хороший водопоглощающий агент. Он используется в удобрениях и в переработанных пищевых продуктах. |
| Бисульфат натрия | NaHSO4 | Используется для понижения pH растворов. |
Соль — это соединение?
Соль — это соединение? Большинство солей состоит как минимум из двух элементов, что делает их соединениями.
Является ли соль ионным соединением? Соль состоит из ионов, которые представляют собой атомы или группы атомов, которые имеют положительный или отрицательный заряд. Причина, по которой ионные молекулы несут заряд, заключается в том, что они либо потеряли, либо приобрели один или несколько своих валентных электронов.
- Отрицательно заряженные ионы, то есть ионы, которые приобрели дополнительные электроны на своей внешней оболочке, называются анионами .
 — {/ eq} расходятся, молекулы воды окружают их.-_ (водн.) {/ eq}
— {/ eq} расходятся, молекулы воды окружают их.-_ (водн.) {/ eq}Катионы соли в окружении кислорода в воде
Хлорид-анионы, окруженные водородом в воде
Соли образуются в результате реакции кислоты и основания. Такие реакции называются реакциями нейтрализации . Причина этого названия связана с тем, что, когда кислоты и основа соединяются вместе, они нейтрализуют друг друга.Продукты их нейтрализации — соль и вода, оба нейтральные. Обратите внимание, что нейтральные соли образуются только тогда, когда сильная кислота реагирует с сильным основанием или когда слабая кислота реагирует со слабым основанием.
Образование хлорида натрия является продуктом нейтрализации сильной кислотой и основанием. Где соляная кислота {eq} HCl {/ eq} — сильная кислота, а гидроксид натрия {eq} NaOH {/ eq} — сильное основание:
{eq} HCl_ (водн.
 ) + NaOH_ (s) \ rightarrow NaCl_ (s ) + H_2O_ (l) {/ eq}
) + NaOH_ (s) \ rightarrow NaCl_ (s ) + H_2O_ (l) {/ eq}Уксусная кислота {eq} CH_3COOH {/ eq}, слабая кислота, реагирует с гидроксидом аммония {eq} NH_4OH {/ eq}, слабым основанием, с образованием следующего:
{eq} CH_3COOH_ (aq) + NH_4OH_ (aq) \ rightarrow CH_3COONH_4 + H_2O {/ eq}
Ацетат аммония {eq} CH_3COONH_4 {/ eq} представляет собой нейтральную соль.- {/ экв}. Однако он переформатирован как {eq} NaCl {/ eq}. Представленное изображение должно помочь в выводе молекулярной формулы солей. Кальций передает два электрона, но хлор может принять только один электрон (они достигают конфигурации благородного газа после принятия 1 электрона). В то время как он дает, он распределяет свои два электрона на два атома хлора.
Кальций переносит два электрона на два хлорида
Ниже приведены примеры других солей:
- Хлорид калия {eq} KCl {/ eq}
- Сульфат магния {eq} MgSO_4 {/ eq}
- Сульфат кальция {eq} CaSO_4 {/ eq}
- Карбонат натрия {eq} Na_2CO_3 {/ eq}
Примечание: анионы иногда могут быть соединением / группами атомов, такими как сульфат {eq} SO_4 ^ + 2 {/ eq}.

Соль: Таблица Менделеева
Как упоминалось ранее, соли состоят из катионов металлов и анионов неметаллов. Галогены — самые распространенные анионы в солях, они из 17 группы периодической таблицы. Им нужен только один электрон, чтобы достичь конфигурации благородного газа. Как гласит правило октетов , атомы имеют тенденцию делиться, отдавать или получать электроны, так что на их внешней оболочке присутствует только восемь электронов. Катионы обычно представляют собой щелочные элементы из групп 1, 2 и алюминий из группы 13.Переходные металлы от 3 до 12 группы также могут быть катионами в солях, они способны передавать электроны анионам, но количество электронов, которые они могут передавать, не всегда фиксировано. В таблице указаны фиксированные заряды элементов, образующих соли (за исключением переходных металлов).
Номер группы Катионный заряд Ионы 17 -1 Галогены 16 -2 S-2 и O-2 1 1+ Na +, К +.  ..
..2 2+ Ca + 2, Mg + 2 .. 13 3+ Al + 3 Периодическая таблица: катионы солей могут быть щелочными и переходными металлами, а анионы могут быть галогенами, кислородом и серой.
Свойства соли
Соль имеет кристаллическую структуру и часто бывает разного цвета.Например, кальций имеет белый цвет, сульфат меди — синий, хлорид натрия — от прозрачного до белого. Как правило, соли могут иметь разный цвет в зависимости от их чистоты и концентрации минералов. Точки плавления и кипения солей чрезвычайно высоки; для разрыва ионных связей соли требуется чрезмерное количество энергии. Соли полярны, что делает их водорастворимыми и прекрасными проводниками электричества. Это хорошие электролиты, потому что они полностью диссоциируют в воде, образуя ионы, плавающие в водном растворе.
 Соли на вкус, ну, соленые, без запаха.
Соли на вкус, ну, соленые, без запаха.Краткое содержание урока
Соли в химии — это ионные соединения , которые образуются в результате полного переноса электронов катионами на анионы . Соли состоят из катионов металлов и анионов неметаллов, связанных ионной связью. Чтобы записать молекулярную формулу любой соли, необходимо знать количество электронов, которые переносит катион и принимает анион.Например, магний (из группы 2) переносит два электрона, но хор (из группы 17) может принимать только один. Итак, магний связывается с двумя атомами хлора, передавая по одному электрону каждому. Всего имеется один атом магния и два атома хлора, поэтому молекулярная формула хлорида магния — {eq} MgCl_2 {/ eq}. Причина, по которой хлор может принимать только один электрон, заключается в том, что для достижения конфигурации благородного газа требуется только один электрон в соответствии с правилом октетов . Это означает, что атомы достигают оптимальной стабильности, когда у них есть 8 электронов во внешней оболочке.

Соли — полярные водорастворимые соединения, они также твердые и хрупкие. Они полностью диссоциируют в воде, что делает их хорошими электролитами и проводниками электричества. Соли являются продуктом кислотно-щелочной реакции нейтрализации , они имеют кристаллическую структуру и часто имеют разный цвет в зависимости от их чистоты. У них чрезвычайно высокие температуры кипения и плавления, потому что для разрыва их прочных ионных связей требуется больше энергии.
Общие свойства солей — A Plus Topper
Общие свойства солейНекоторые из характерных свойств солей:
- Точки плавления и кипения: Соли в основном твердые, которые плавятся, а также кипят. при высоких температурах.
- Растворимость в воде: Соли обычно растворимы в воде. Например, хлорид натрия, сульфат калия, нитрат алюминия, карбонат аммония и т. Д. Являются растворимыми солями, в то время как хлорид серебра, хлорид свинца, карбонат меди и т.
 Д. Нерастворимы в воде.
Д. Нерастворимы в воде. - Кристаллизационная вода: Обычно соли встречаются в виде кристаллов с присутствующими в них молекулами воды. Эта вода называется кристаллизационной водой, а такие соли называются гидратированными солями.
Например, кристалл сульфата меди содержит пять молекул воды на каждую молекулу сульфата меди. Это записывается как CuSO 4 .5H 2 O. Эта кристаллизационная вода придает кристаллу его форму. Он также придает цвет некоторым кристаллам. При нагревании гидратированные соли теряют кристаллизационную воду, в результате кристаллы теряют форму и цвет и превращаются в порошкообразное вещество.
Гидратированные соли, утратившие свою кристаллизационную воду, называются безводными солями .
При нагревании гидратированного сульфата меди выделяются молекулы воды с образованием белого порошкообразного безводного сульфата меди. При добавлении воды это вещество может снова превратиться в раствор гидратированного сульфата меди.
Люди также спрашивают
Общие свойства солей:
1. Реакция с кислотой: Когда соль реагирует с кислотой, образуется другая соль и кислота. Например, когда хлорид натрия нагревают с серной кислотой, образуется гидросульфат натрия (при низкой температуре), а затем сульфат натрия (при высокой температуре) и выделяется газообразный хлористый водород.
2. Реакция с основанием: Соль реагирует с основанием с образованием другой соли и основания.
(NH 4 ) 2 SO 4 + 2NaOH → Na 2 SO 4 + 2NH 4 OH
3. Взаимодействие с металлом: Иногда может реагировать солевой раствор. с металлом. Например, когда железный гвоздь погружается в водный раствор сульфата меди, медь откладывается на поверхности гвоздя, а образовавшийся сульфат железа остается в растворе.
CuSO 4 + Fe → FeSO 4 + Cu
Эта реакция показывает, что железо более реактивно, чем медь.

Таким образом, более химически активный металл может вытеснить менее химически активный металл из раствора своей соли.4. Поведение солей по отношению к воде:
Когда соль растворяется в воде, раствор может быть нейтральным, кислым или щелочным. Это зависит от природы используемой соли.(i) Обычная соль, полученная из сильной кислоты и сильного основания, дает нейтральный раствор.Например, водные растворы NaCl и K 2 SO 4 нейтральны по отношению к лакмусу.
(ii) Нормальная соль, полученная из слабой кислоты и сильного основания, дает щелочной раствор. Например, водные растворы карбоната натрия (Na 2 CO 3 ) и ацетата натрия (CH 3 COONa) являются щелочными.Na 2 CO 3 + 2H 2 O → 2NaOH + CO 2 + H 2 O
CH 3 COONa + H 2 O → CH 3 COOH + NaOH
(iii) Соль, полученная из сильной кислоты и слабого основания, дает кислый раствор.
 Например, как хлорид алюминия (AlCl 3 ), так и хлорид аммония (NH 4 Cl) образуют кислые водные растворы.
Например, как хлорид алюминия (AlCl 3 ), так и хлорид аммония (NH 4 Cl) образуют кислые водные растворы.AlCl 3 + 3H 2 O → Al (OH) 3 + 3HCl
NH 4 Cl + H 2 O → NH 4 OH + HCl
(iv) Растворы кислые соли являются кислыми до лакмусовой бумажки, т. е. эти растворы окрашивают синюю лакмусовую бумажку в красный цвет. Например, раствор гидросульфата натрия (NaHSO 4 ) окрашивает синюю лакмусовую бумажку в красный цвет.
Раствор гидрокарбоната натрия (NaHCO 3 ), однако, является слабощелочным.Разница между солью и натрием
Основное различие — соль против натрия
В химии соль — это любое соединение, которое образуется в результате реакции между кислотой и основанием. Соль состоит либо из иона металла, либо из любого другого катиона, связанного с анионом посредством ионной связи. Но в общем, соль — это белое кристаллическое вещество, которое используется в качестве пищевой добавки.
 Он в основном состоит из хлорида натрия. Натрий — химический элемент 1 группы периодической таблицы. Это металл. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом.
Он в основном состоит из хлорида натрия. Натрий — химический элемент 1 группы периодической таблицы. Это металл. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом. Основные области покрытия
1. Что такое соль
— Определение, химические свойства
2. Что такое натрий
— Определение, химические свойства
3.Какая связь между солью и натрием
4. В чем разница между солью и натрием
— Сравнение основных различийКлючевые термины: кислота, основание, катион, ионная связь, металл, соль, натрий, хлорид натрия
Что такое соль
В химии соль — это химическое соединение, образующееся в результате кислотно-щелочной реакции. Но обычно соль представляет собой белое кристаллическое вещество, которое придает морской воде характерный вкус и используется для приправы или консервирования пищи.
 Мы называем это соединение поваренной солью.
Мы называем это соединение поваренной солью.Соль может быть получена из руд каменной соли или морской воды путем испарения. Самый распространенный и традиционный метод производства соли — испарение морской воды под прямыми солнечными лучами. Здесь морская вода называется солевым раствором. Рассол представляет собой высококонцентрированную морскую воду. Соль — это хлорид натрия, который состоит из ионов натрия и хлорида. Следовательно, это ионное соединение.
Соль, полученная из морской воды, помимо хлорида натрия содержит некоторые другие соединения, но в следовых количествах.Кристаллы соли полупрозрачные. Они имеют кубическую форму. Кристаллы соли белые, но наличие примесей может изменить цвет. Температура плавления соли составляет около 801 ° C. Температура кипения составляет около 1465 ° C.
Рисунок 1: Столовая соль
Молярная масса соли считается молярной массой хлорида натрия. Это 58,44 г / моль. Соль очень хорошо растворяется в воде, образуя ионы натрия и хлора.

Что такое натрий
Натрий — это химический элемент, имеющий атомный номер 11 и химический символ «Na».Атомный вес натрия составляет около 22,98 а.е.м.
Натрий — это металл. Температура плавления составляет 97,79 ° C, а температура кипения составляет 882,8 ° C. При комнатной температуре и давлении натрий находится в твердой фазе. Несмотря на то, что он имеет металлический блеск, это мягкий металл, который можно легко разрезать ножом. Натрий находится в группе 1 периодической таблицы. Следовательно, это блочный элемент s. Элементы группы 1 известны как щелочные металлы. Это потому, что они могут образовывать основные (щелочные) соединения.
Натрий очень реактивный. Легко реагирует с кислородом и водой. Следовательно, металлическая форма натрия имеет меньше применений. Его нельзя использовать в качестве строительного материала, потому что он слишком мягкий и очень реактивный. При горении натрий дает желто-оранжевое пламя. Когда к воде добавляют крошечный кусочек натрия, происходит взрывоопасная реакция.

Рисунок 2: Реакция между натрием и водой
Натрий образует ряд соединений, которые очень полезны в лабораториях, а также в промышленности.Соли натрия щелочные. Некоторые важные примеры включают поваренную соль (NaCl), кальцинированную соду (Na 2 CO 3 ), едкий натр (NaOH), бура (Na 2 B 4 O 7 · 10H 2 O) и др.
Связь между солью и натрием
- Соль состоит в основном из хлорида натрия. Хлорид натрия — это галогенид натрия. Это ионное соединение, образованное натрием. Натрий — одновалентный катион. Следовательно, поваренная соль — это натриевая соль.
Разница между солью и натрием
Определение
Соль: Соль представляет собой белое кристаллическое вещество, придающее морской воде характерный вкус.
Натрий: Натрий — это химический элемент, имеющий атомный номер 11 и химический символ «Na».

Внешний вид
Соль: Соль — белые полупрозрачные кубические кристаллы.
Натрий: Натрий имеет металлический вид серебристо-белого цвета.
Природа
Соль: Кристаллы соли имеют твердую кубическую форму.
Натрий: Натрий — мягкий металл.
Реакция с водой
Соль: Соль хорошо растворяется в воде.
Натрий: Натрий проявляет взрывную реакцию с водой.
Точка плавления
Соль: Температура плавления соли составляет 801 ° C.
Натрий: Температура плавления натрия 97.79 ° С.
Температура кипения
Соль: Температура кипения соли 1465 ° C.
Натрий: Температура кипения натрия составляет 882,8 ° C.
Заключение
Соль, в основном, поваренная соль. Он в основном состоит из хлорида натрия с небольшими следами примесей.
 Хлорид натрия — это натриевая соль, что означает, что это ионное соединение, состоящее из катиона натрия, связанного с анионом. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом.
Хлорид натрия — это натриевая соль, что означает, что это ионное соединение, состоящее из катиона натрия, связанного с анионом. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом.Артикул:
1. «Соль». Википедия, Фонд Викимедиа, 6 декабря 2017 г., доступно здесь.
2. «Элемент натрия». Это элементаль. Доступно здесь.
3. «Как сделать натрий металлическим». WonderHowTo, 21 июля 2014 г., доступно здесь.Изображение предоставлено:
1. «Поваренная соль с солонкой V1» Автор Poyraz 72 — Собственная работа (CC BY-SA 4.0) через Commons Wikimedia
2. «Натрий и вода» Автор Naatriumi_reaktsioon_veega_purustab_klaasist_anuma.jpg: Превосходная производная работа: Тони Мах (CC BY-SA 3.0) через Commons WikimediaЗаметки о физических и химических свойствах солей
Соли — очень важные химические вещества в лаборатории, поскольку они используются в нескольких реакциях и процессах.
 Они также широко используются в различных отраслях промышленности.
Они также широко используются в различных отраслях промышленности.
Соли — это ионные соединения, образующиеся в результате нейтрализации кислоты и основания.
Ex: карбонат натрия, бикарбонат натрия, сульфат алюминия и калия, хлоргипохлорит кальция и хлорид аммония.
Они являются хорошими проводниками электричества в расплавленном состоянии или в водной форме.
Большинство солей растворимы в воде. Степень растворимости зависит от температуры.
Соли состоят как из катионов, так и из анионов.
Общая недвижимостьКристаллизационная вода
Количество молекул воды, химически объединенных в определенной молекулярной пропорции с солью в кристаллическом состоянии. Соли, которые содержат определенное количество молекул воды в виде кристаллизационной воды, называются гидратированными солями.
Пример: Гипс и стиральная сода.
И наоборот, соли, не содержащие кристаллизационной воды, называются безводными солями.
Пример: безводный сульфат меди.
Deliquescence
Способность некоторых солей поглощать влагу из атмосферы, растворяться и превращаться в жидкость.
Размножение соединений происходит из-за того, что давление пара конкретной соли ниже атмосферного давления пара. И его можно уменьшить, если хранить соль в сухих условиях.
Примеры:
Хлорид кальция, хлорид магния, хлорид цинка и карбонат калия.Гигроскопичные вещества
Некоторые соли гигроскопичны, т. Е. Обладают способностью поглощать влагу из атмосферы, не растворяясь. Пример:
Оксид кальция, силикагель и т. Д.
.Выцветание
Частичная или полная потеря кристаллизационной воды из гидратированной соли при воздействии атмосферы.
Светящиеся вещества, теряющие кристаллизационную воду, становятся порошкообразными.
Пример:
Пентагидрат сульфата меди или голубой камень и гептагидрат сульфата магния или соль эпсома.
CuSO 4 .5H 2 O → CuSO 4 + 5H 2 O
MgSO 4 .7H 2 O → MgSO 4 + 7H 2 O
Соли в повседневной жизниХлорид натрия (NaCl)
Он образуется при реакции гидроксида натрия с хлористым водородом.
Это белое кристаллическое твердое вещество с высокими температурами плавления и кипения.
Трудно растворим в воде /
Используется для консервирования солений, рыбы и мяса.
Он используется для таяния льда, образующегося на дорогах в странах с холодным климатом, и
Он используется в качестве сырья для производства других соединений.
Также используется для производства мыла.
Карбонат натрия (Na 2 CO 3 )
Карбонат натрия, стиральная сода или кальцинированная сода — это натриевая соль угольной кислоты.
Добавление воды к карбонату натрия и охлаждение смеси с образованием декагидратированного карбоната натрия.
Na 2 CO 3 + 10 H 2 O → Na 2 CO 3 .10H 2 O
В кристаллическом состоянии он содержит десять молекул кристаллизационной воды.
Его получают путем пропускания газообразного диоксида углерода в концентрированный раствор гидроксида натрия.
Это белое кристаллическое твердое вещество, обычная форма которого — декагидрат. При контакте с воздухом его кристаллы теряют воду, переходят в моногидратную форму и выглядят как белый непрозрачный порошок.
При нагревании на горелке Бунзена излучает золотисто-желтое пламя.
При нагревании декагидрат карбоната натрия приобретает безводную форму.
Растворяется в воде, выделяя тепло. Раствор карбоната натрия имеет щелочную природу.
Карбонат натрия используется для производства стекла, чистящих средств, мыла, стекла и бумаги, соединений натрия, таких как бура.Гидрокарбонат натрия (NaHCO 3 ):
Это белое кристаллическое твердое вещество без запаха.
Полностью растворим в воде и мало растворим в этаноле.
Его получают путем пропускания диоксида углерода через концентрированный раствор гидроксида натрия или карбоната натрия.
При нагревании теряет углекислый газ и воду с образованием карбоната натрия.При реакции с кислотами образует соль и воду и выделяет диоксид углерода.
Гидрокарбонат натрия обычно называют пищевой содой.
Гидрокарбонат натрия используется в хлебопекарной промышленности.
Используется для приготовления содовой кислоты.
Также используется в огнетушителях пенного типа.
Калийные квасцы (K 2 SO 4 Al 2 (SO 4 ) 3 .24H 2 O):
Это бесцветное кристаллическое вещество без запаха. Его кристаллы получают путем смешивания концентрированных растворов сульфата калия и сульфата алюминия.
Растворим в воде.
Плавится при 92 ° C и разбухает по мере удаления кристаллизационной воды при 200 ° C.
Его получают смешиванием концентрированных растворов K 2 SO 4 и Al 2 (SO 4 ) 3 в эквимолярной пропорции по весу.
K 2 SO 4 + Al 2 (SO 4 ) 3 + 24H 2 O → K 2 SO 4 .Al 2 (SO 4 4 ) 3 24ч 2 OОн разложится на компоненты при температуре 200 0 C.
K 2 SO 4 .Al 2 (SO 4 ) 3 24H 2 O → K 2 SO 4 + Al 2 (SO 4 ) 3 + 24H 2 O
Отбеливающий порошок (CaOCl 2 )
Обесцвечивающий порошок, химически известный как оксихлорид кальция.
Его получают, когда хлор реагирует с сухой гашеной известью при 40 ° C.
Это бледно-желтый порошок с сильным запахом хлора.
Он реагирует с разбавленными кислотами или углекислым газом с выделением хлора.
Используется для отбеливания хлопка, льняной ткани и древесной массы.
Растворим в воде. Где применяется для обеззараживания питьевой воды.Хлорид аммония или соль Наушадара (NH 4 Cl)
Его получают путем пропускания аммиака в соляную кислоту.
Это белое кристаллическое твердое вещество, растворимое в воде.
Не имеет запаха, ломкий, соленый на вкус, оказывает охлаждающее действие на язык.
При высокой температуре разлагается на аммиак и соляную кислоту. При охлаждении эти газы объединяются с образованием хлорида аммония.Гипс Парижский (CaSO 4 . ½ H 2 O)
Парижский гипс, химически называемый полугидратом сульфата кальция. С тех пор, как он был введен в обиход из Парижа, его называют «парижской штукатуркой».
Его получают нагреванием гипса до 373 К.

CaSO 4 .2H 2 O 373 K → CaSO 4 ½H 2 O + 1½H 2 O
Гипсовая штукатурка Paris WaterХимические свойства и защитное действие бамбуковой соли in vivo на желудок
- 1.
Шин Х.Й., Ли Э.Х., Ким С.Й., Шин Т.Й., Ким С.Д., Сонг Ю.С., Ли К.Н., Хонг Ш., Ким Х.М. Противовоспалительное действие корейской народной медицины пурпурной бамбуковой соли.Иммунофармакол. Иммунотоксикол. 25: 377–384 (2003)
Статья Google Scholar
- 2.
Shin HY, Na HJ, Moon PD, Seo SW, Shin TY, Hong SH, Lee KN. Биологическая активность бамбуковой соли. Food Ind. Nutr. 9: 36–45 (2004)
Google Scholar
- 3.
Hu C, Zhang Y, Kitts DD. Оценка антиоксидантной и прооксидантной активности бамбука Phyllostachys nigra var.Экстракт листьев хенониса in vitro. J. Agr. Food Chem. 48: 3170–3176 (2000)
CAS Статья Google Scholar
- 4.

Xin Z, Kim SY, Park KY. Соль бамбука имеет in vitro, противоопухолевую активность в клетках HCT-116 и оказывает антиметастатическое действие in vivo. J. Med. Еда. 16: 9–19 (2013)
Статья Google Scholar
- 5.
Ким Х.С., Кан С.И., Юнг К.К., Ким Т.Г., Хан Х.М., Рю Х.М., Мун А.Р.Характеристика и противоязвенная активность бамбуковой соли. J. Food Hyg. Безопасность 13: 252–257 (1998)
Google Scholar
- 6.
Szabo S, Trier JS, Brown A, Schnoor J. Раннее повреждение сосудов и повышенная проницаемость сосудов при повреждении слизистой оболочки желудка, вызванном этанолом у крысы. Гастроэнтерология 88: 228–236 (1985)
CAS Статья Google Scholar
- 7.
Medeiros JV, Gadelha GG, Lima SJ, Garcia JA, Soares PM, Santos AA, Brito GA, Ribeiro RA, Souza MH. Роль пути NO / cGMP / KATP в защитных эффектах силденафила против вызванного этанолом повреждения желудка у крыс.
 Брит. J. Pharmacol. 153: 721–727 (2008)
Брит. J. Pharmacol. 153: 721–727 (2008)CAS Статья Google Scholar
- 8.
Стефанссон А., Гуннарссон И., Жиру Н. Новые методы прямого определения растворенного неорганического, органического и общего углерода в природных водах с помощью безреагентной ионной хроматографии и атомно-эмиссионной спектрометрии с индуктивно связанной плазмой.Анальный. Chem. Acta 582: 69–74 (2007)
Статья Google Scholar
- 9.
Йошида Ю., Йошихара К., Нагаока Н., Ханабуса М., Мацумото Т., Момои Ю. Анализ дифракции рентгеновских лучей трехмерного самоусиливающегося мономера и его химического взаимодействия с зубом и гидроксиапатитом. Вмятина. Матер. J. 31: 697–702 (2012)
CAS Статья Google Scholar
- 10.
Гуастальди П.П., Ю Д., Марин К., Джимбо Р., Товар Н., Занетта-Барбоса Д., Коэльо П.Г.Плазменная обработка сохраняет поверхностную энергию поверхности имплантата и усиливает остеоинтеграцию.
 Int. J. Biomater. 2013: 354125 (2013)
Int. J. Biomater. 2013: 354125 (2013) - 11.
Барнард Т.В., Крокетт М.И., Ивальди Дж. К., Лундберг П.Л., Йейтс Д.А., Левин П.А., Зауэр Д.И. Твердотельный детектор для ИСП-ОЭС. Анальный. Chem. 65: 1231–1239 (1993)
CAS Статья Google Scholar
- 12.
Morgan AB, Gilman JW. Характеристика полимер-слоистых силикатных (глинистых) нанокомпозитов с помощью просвечивающей электронной микроскопии и дифракции рентгеновских лучей: сравнительное исследование.J. Appl. Полимер. Sci. 87: 1329–1338 (2003)
CAS Статья Google Scholar
- 13.
Рамирес РО, Роа СС. Гастропротекторный эффект дубильных веществ, экстрагированных из коры дюхата ( Syzygium cumini Skeels), на индуцированное HCl / этанолом повреждение слизистой оболочки желудка у крыс Sprague-Dawley. Clin. Гемореол. Микро. 29: 253–261 (2003)
CAS Google Scholar
- 14.

Ensikat HJ, Barthlott W.Замена жидкости: универсальная процедура подготовки образцов биологических материалов на сканирующем электронном микроскопе без сушки или нанесения покрытия. J. Microsc. 172: 195–203 (1993)
CAS Статья Google Scholar
- 15.
Weng XF. Приготовление хлорида натрия большого размера. J. Salt Chem. Инд. 38: 18–19 (2009)
CAS Google Scholar
- 16.
Сегнер В.П., Шмидт К.Ф., Больц Дж.К.Влияние хлорида натрия и pH на рост спор типа E Clostridium botulinum при оптимальных и субоптимальных температурах. Прил. Environ. Microbiol. 14: 49–54 (1966)
CAS Google Scholar
- 17.
Эллиотт С.Н., Уоллес Дж. Л., Макнайт В., Галл Д. Г., Хардин Дж. А., Олсон М., Бурет А. Бактериальная колонизация и заживление язв желудка: эффекты эпидермального фактора роста. Являюсь. J. Physiol.
 Гастроинтест. Liver Physiol.278: 105–112 (2000)
Гастроинтест. Liver Physiol.278: 105–112 (2000)Google Scholar
- 18.
Каземекайте М., Леонавичен Л., Брадунайте Р., Станюлит З., Палаима А., Разумас В. Противовоспалительная активность некоторых калиевых солей N, N-дизамещенных 4-аминоазобензолсульфоновых кислот при адъювантном артрите у крыс. Arch. Pharm. Res. 31: 736–741 (2008)
CAS Статья Google Scholar
- 19.
Critchlow J, Magee D, Ito S, Takeuchi K, Silen W.Требования к восстановлению поверхностного эпителия желудка лягушки после повреждения слизистой оболочки. Гастроэнтерология 88: 237–249 (1985)
CAS Статья Google Scholar
- 20.
Островски Дж., Песта Дж., Линник Д., Бутрук Э. Влияние антагонистов кальция (верапамил, нифедипин и MgCl2) на повреждение желудка крысы, вызванное этанолом in vivo и in vitro . J. Physiol.
 Pharmacol. 44: 273–281 (1993)
Pharmacol. 44: 273–281 (1993)Google Scholar
- 21.
Смит С.М., Гришем МБ, Манси Е.А., Грейнджер Д.Н., Квиетис ПР. Повреждение слизистой оболочки желудка у крысы. Роль железа и ксантиноксидазы. Гастроэнтерология 92: 950–956 (1987)
CAS Google Scholar
- 22.
Чжао Х, Юнг О.С., Парк, Кентукки. Щелочное и антиоксидантное действие бамбуковой соли. J. Korean Soc. Food Nutr. 41: 1301–1304 (2012)
CAS Статья Google Scholar
- 23.
Yalcin S, Mutlu IH. Структурная характеристика некоторых образцов поваренной соли методами XRD, ICP, FTIR и XRF. Acta Physica. Полоника. A 121: 50–52 (2012)
CAS Google Scholar
- 24.
га, JK, Park KY. Сравнение минерального состава и внешнего строения различных солей. J. Korean Soc. Food Sci. Nutr. 27: 413–418 (1998)
CAS Google Scholar
- 25.

Ghosal S, Shbeeb A, Hemminger JC. Поверхностная сегрегация брома в NaCl, легированном бромидом: последствия для сезонных колебаний арктического озона. Geophys. Res. Lett. 27: 1879–1882 (2000)
CAS Статья Google Scholar
- 26.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Руководство для промышленности, оценка максимальной безопасной начальной дозы в начальных клинических испытаниях терапевтических средств на взрослых здоровых добровольцах. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, Силвер-Спринг, Мэриленд, США (2005)
Google Scholar
- 27.
Kim HY, Lee ES, Jeong JY, Choi JH, Choi YS, Han DJ, Lee MA, Kim SY, Kim CJ. Влияние бамбуковой соли на физико-химические свойства мясных эмульсионных систем. Meat Sci. 86: 960–965 (2010)
CAS Статья Google Scholar
- 28.

Шин Х.Й., На ХДЖ, Мун П.Д., Шин Т.К., Шин ТИ, Ким Ш., Хун Ш., Ким Х.М. Подавление зависимых от тучных клеток реакций гиперчувствительности немедленного типа пурпурной бамбуковой солью. J. Ethnopharmacol. 91: 153–157 (2004)
Статья Google Scholar
- 29.
Лигумский М., Сестиери М., Окон Э., Гинзбург И. Антиоксиданты подавляют вызванное этанолом повреждение желудка у крыс: роль марганца, глицина и каротина. Сканд. J. Gastroentero. 30: 854–860 (1995)
CAS Статья Google Scholar
- 30.
Чжао Х, Джу Дж. Х., Ким Х. М., Парк, Кентукки. Антимутагенная активность и in vitro противораковые эффекты соли бамбука на клетки гепатомы человека HepG2. J. Environ. Патол. Toxicol. Онкол.32: 9–20 (2013)
Статья Google Scholar
- 31.
Nassini R, Andrè E, Gazzieri D, De Siena G, Zanasi A, Geppetti P, Materazzi S.
 Бикарбонатно-щелочная минеральная вода защищает от вызванных этанолом геморрагических поражений желудка у мышей. Биол. Pharm. Бык. 33: 1319–1323 (2010)
Бикарбонатно-щелочная минеральная вода защищает от вызванных этанолом геморрагических поражений желудка у мышей. Биол. Pharm. Бык. 33: 1319–1323 (2010)CAS Google Scholar
- 32.
Zhao X, Deng X, Park KY, Qiu L, Pang L. Пурпурная бамбуковая соль обладает противоопухолевой активностью в клетках TCA8113 in vitro и оказывает профилактическое действие на рак слизистой оболочки ротовой полости у мышей in vivo .Exp. Ther. Med. 5: 549–554 (2013)
Google Scholar
- 33.
Чжао X, Сонг JL, Kil JH, Парк KY. Соль бамбука ослабляет вызванное CCl4 повреждение печени у крыс Sprague-Dawley. Nutr. Res. Практик. 7: 273–280 (2013)
CAS Статья Google Scholar
- 34.
Ваананен П.М., Меддингс Дж. Б., Уоллес Дж. Л.. Роль свободных радикалов, полученных из кислорода, в повреждении желудка, вызванном индометацином.
 Являюсь. J. Physiol. Гастро. Л. 261: 470–475 (1991)
Являюсь. J. Physiol. Гастро. Л. 261: 470–475 (1991)Google Scholar
- Кристаллы или белый кристаллический порошок.
- Прозрачный и бесцветный в кристаллической форме, похожий на лед.
- Кристаллизуется в изометрической системе, обычно в форме кубов.
- Растворим в воде (35,6 г / 100 г при 0 ° C и 39,2 г / 100 г при 100 °).
- Слабо растворим в спирте, но не растворим в концентрированной соляной кислоте.
- Цвет: Серебристо-белый.

- Ковкость: способность деформироваться или сгибаться.
- Пластичность: Легко вытягивается или растягивается в тонкую проволоку.
- Глянец: Имеет блеск или сияние.
- Электропроводность: Хорошая передача тепла или электричества.
- Мягкость: достаточно мягкая, чтобы ее можно было разрезать ножом.
- Вода полярная.
- Вода — отличный растворитель.
- Вода обладает высокой теплоемкостью.
- Вода имеет высокую теплоту испарения.
- Вода обладает когезионными и адгезионными свойствами.
- Вода менее плотная в твердом виде, чем в жидкой.
- Он легко растворим в воде и частично растворим или не растворим в других жидкостях.

- Это белые кристаллы, не имеющие запаха, но обладающие вкусом.
- В водном состоянии NaCl действует как хороший проводник электричества из-за свободного движения ионов.
Каковы химические свойства соли? — Easierwithpractice.com
Каковы химические свойства соли?
Растворим в воде (35,6 г / 100 г при 0 ° C и 39,2 г / 100 г при 100 °). Слабо растворим в спирте, но не растворим в концентрированной соляной кислоте. Плавится при 801 ° C и начинает испаряться при температурах чуть выше этой точки кипения 1413 ° C.Твердость 2,5 по шкале твердости MOH.
Что такое соль в науке?
Соль, в химии, вещество, получаемое при реакции кислоты с основанием. Соль состоит из положительного иона (катиона) основания и отрицательного иона (аниона) кислоты. Термин «соль» также используется для обозначения поваренной поваренной соли или хлорида натрия.
Что такое соль и виды?
Соль — это ионное соединение, которое имеет катион, отличный от H +, и анион, отличный от OH–, и получается вместе с водой в реакции нейтрализации между кислотами и основаниями. Например: — NaCl, CuCl2 и т. Д. Хлорид натрия — одна из самых известных солей.
Например: — NaCl, CuCl2 и т. Д. Хлорид натрия — одна из самых известных солей.
Что такое соль и виды соли?
Щелочная или основная соль — Соль, которая образуется при частичной нейтрализации сильного основания слабой кислотой, называется основной солью. Эти соли гидролизуются с образованием основного раствора. Двойная соль — соли, содержащие более одного катиона или одного аниона, называются двойной солью.
Что подразумевается под солью?
Соль — это соединение, состоящее из двух ионов — положительно заряженного иона и отрицательно заряженного иона.Притяжение между двумя ионами образует прочные ионные связи, придавая солям твердую и хрупкую кристаллическую структуру.
Слабое или сильное Nh5Cl?
Хлорид аммония — сильный электролит, поскольку он полностью растворен в ионы или на 100% ионизирован в водном растворе. 1 Почему Nh5Cl действует как кислая соль?
Как KCl влияет на pH?
Однако pH — это мера активности H +, на которую влияет ионная сила. Добавление KCl в буфер увеличивает его ионную силу, что должно отражаться в снижении активности H + и, следовательно, в повышении pH.
Добавление KCl в буфер увеличивает его ионную силу, что должно отражаться в снижении активности H + и, следовательно, в повышении pH.
Изменяет ли KCl pH?
ДобавлениеKCl к образцам не приводит к значительному изменению pH.
Как узнать, что растворяется больше в кислоте или в воде?
При добавлении AgI H + образует HI, который является сильной кислотой; следовательно, AgI НЕ более растворим в кислоте, чем в воде. Для KClO4 добавление H + образует HClO4, но это сильная кислота, поэтому она НЕ более растворима в кислоте. При добавлении CuBr H + образует HBr, который является слабой кислотой; следовательно, CuBr более растворим в кислоте, чем в воде.
Какие соли будут более растворимы в кислоте?
На вопрос, какие соли будут более растворимы в кислом растворе, чем в чистой воде? Как показано выше, нерастворимые соли с анионами или слабые кислотно-щелочные соединения увеличивают растворимость в сильных кислотах, чем в чистой воде.
Что происходит, если кислота растворяется в воде?
при растворении кислоты в воде кислоты отдают ионы водорода (H +). Ионы водорода — это атомы водорода, которые потеряли электрон и теперь имеют только протон, что дает им положительный электрический заряд.Ионы H + в кислоте присоединяются и нейтрализуются ионами OH- основания с образованием h3O.
Ионы водорода — это атомы водорода, которые потеряли электрон и теперь имеют только протон, что дает им положительный электрический заряд.Ионы H + в кислоте присоединяются и нейтрализуются ионами OH- основания с образованием h3O.
Hi — сильная кислота?
Сила кислоты и прочность связи HCl, HBr и HI — все сильные кислоты, а HF — слабая кислота.
Как расположить кислоты от самой сильной к самой слабой?
При движении вниз по строке в Периодической таблице (см. Рисунок ниже) атомы становятся больше, поэтому прочность связей ослабевает, а это означает, что кислоты становятся сильнее. Для галогенсодержащих кислот, указанных выше, HF имеет самую прочную связь и является самой слабой кислотой.
Каковы два физических свойства соленой воды?
Каковы два физических свойства соленой воды?
Что такое температура и соленость и как они определяются? Физические свойства морской воды включают как «термодинамические свойства», такие как плотность и точка замерзания, так и «транспортные свойства», такие как электропроводность и вязкость.
Дистиллированная вода представляет собой смесь?
Нет, дистиллированная вода не является смесью. Дистиллированная вода считается чистыми веществами.Это соединение, состоящее из водорода и кислорода.
Каковы физические и химические свойства морской воды?
Морская вода представляет собой сложную смесь 96,5% воды, 2,5% солей и меньшего количества других веществ, включая растворенные неорганические и органические материалы, твердые частицы и несколько атмосферных газов.
Каковы свойства соли?
Свойства соли
Каковы 3 физических свойства натрия?
Физические свойства натрия следующие:
Каковы три свойства воды?
Уникальные свойства воды
Каковы физические и химические свойства поваренной соли?
Физические свойства: Хлорид натрия представляет собой белое кристаллическое твердое вещество с плотностью 2,16 г / мл и температурой плавления 801 ° C. Он также доступен в виде водных растворов различной концентрации, называемых солевыми растворами. Химические свойства: хлорид натрия легко растворяется в воде и других полярных растворителях.
Химические свойства: хлорид натрия легко растворяется в воде и других полярных растворителях.
Каковы химические свойства серебра?
Чистое серебро почти белое, блестящее, мягкое, очень пластичное, податливое, оно отлично проводит тепло и электричество.Это не химически активный металл, но он подвержен действию азотной кислоты (образуя нитрат) и горячей концентрированной серной кислоты.
Каковы физические свойства сахара?
Химические данные
| Химическая формула сахарозы | С12х32О11 |
|---|---|
| Молярная масса или молекулярный вес | 342,30 г / моль |
| Плотность | 1,587 г / см3 |
| Внешний вид | Белый, твердый кристалл |
| Точка плавления | Разлагается при 459 K |
Каковы свойства NaCl?
Свойства хлорида натрия
Является ли NaCl кислотным или основным?
Соль, полученная в результате реакции сильной кислоты с сильным основанием, образует раствор с pH 7. Примером является хлорид натрия, образованный в результате нейтрализации HCl с помощью NaOH…. Соли, образующие нейтральные растворы.
| Соль, образованная из: | Солевой раствор |
|---|---|
| Слабая кислота + сильное основание | Базовый |
Является ли NaCl хорошим проводником электричества?
NaCl является «хорошим проводником электричества» в расплавленном состоянии, но не в твердом состоянии.Пояснение: NaCl (хлорид натрия) в твердом состоянии не проводит электричество, так как ионы остаются в фиксированном положении в твердом состоянии, что не требует передачи или обмена электронами.
Воспламеняется ли NaCl?
Неорганические соли также обычно негорючие. Соли, содержащие органические группы, в принципе горючие, хотя могут с трудом гореть. Когда вы НАГРЕВАЕТЕ соль (NaCl), она плавится, а затем испаряется. Когда вы ВНЕСЕТЕ соль в ПЛАМЯ, вы видите ярко-желтую окраску пламени.
Горючий ли HOCh3Ch3OH?
Соединение HOCh3Ch3OH известно как этиленгликоль. Это соединение представляет собой вязкий дигидрокси спирт без цвета, запаха и запаха. Это соединение может воспламеняться при высоких температурах.
Почему соль реакционноспособна?
Соленая вода полна молекул хлорида натрия. не являются ядовитыми и реактивными, как металлический натрий и газообразный хлор, потому что они представляют собой электрически заряженные атомы, называемые «ионами». У атомов натрия отсутствует внешний электрон.
Легковоспламеняющаяся ли соль?
Поваренная соль (хлорид натрия) негорючая и не воспламеняется. Соль даже не растает, пока не достигнет температуры 1470 градусов по Фаренгейту (800 по Цельсию).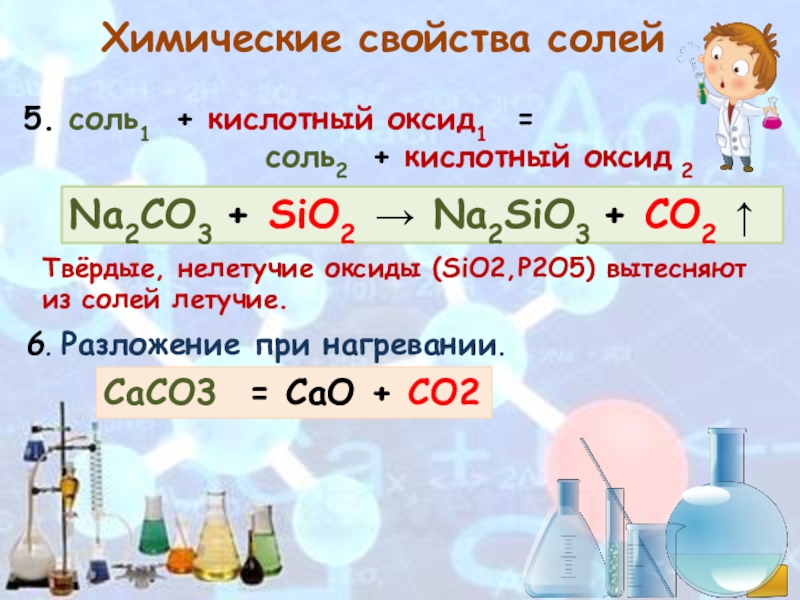
Соль состоит из двух ядов?
Минеральное название — галит. Поваренная соль представляет собой химически простую комбинацию двух компонентов, натрия и хлора. Натрий немедленно воспламеняется при контакте с водой, а хлор ядовит при проглатывании. Однако в сочетании эти два элемента образуют хлорид натрия, широко известный как соль.
Что будет, если сжечь соль?
Соль поваренная основная горит желтым. Пламя, исходящее от меди, имеет голубовато-зеленый цвет. Калий горит фиолетовым цветом.
Что произойдет, если поджечь соль?
Когда вы НАГРЕВАЕТЕ соль (NaCl), она плавится, а затем испаряется. Но эти физические изменения требуют очень высоких температур. Когда вы ВНЕСЕТЕ соль в ПЛАМЯ, вы видите ярко-желтую окраску пламени. Соль не горит в обычных условиях, когда дерево или бумага могут гореть.
Соль делает огонь сильнее?
Соль — хорошее средство для контроля / подавления пламени и возгораний, не оказывая охлаждающего воздействия на угли.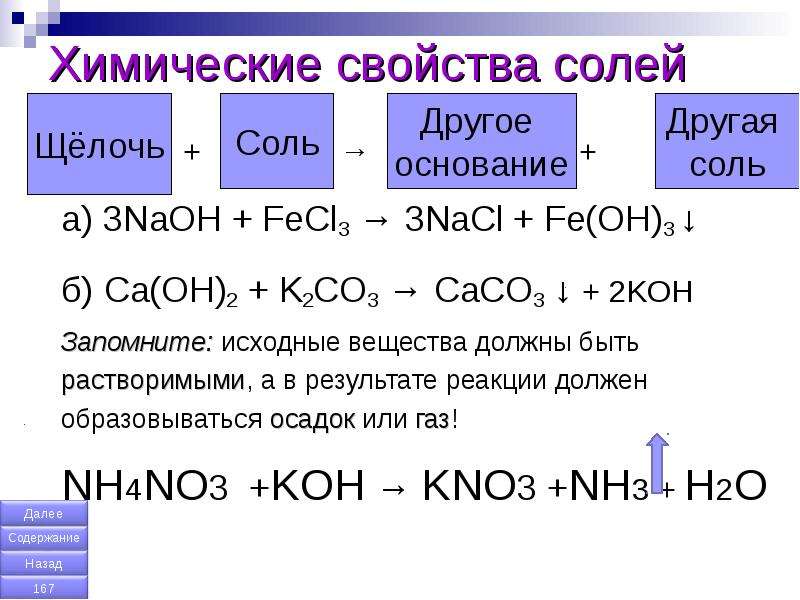 Соль на самом деле не горит (хотя, если вы можете заставить ее расплавиться, вы можете получить красивое оранжевое пламя от сгорания натрия), и если вы сразу положите ее в огонь, она может его задушить.
Соль на самом деле не горит (хотя, если вы можете заставить ее расплавиться, вы можете получить красивое оранжевое пламя от сгорания натрия), и если вы сразу положите ее в огонь, она может его задушить.
Что будет, если сжечь сахар?
Сахар состоит из атомов углерода, водорода и кислорода. При нагревании над свечой эти элементы реагируют с огнем, превращаясь в жидкость.Тепло заставляет атомы сахара соединяться с кислородом воздуха, образуя новые группы атомов. В этой химической реакции выделяется энергия в виде дыма и черной сажи.
Тушит ли мука огонь?
Нет. НИКОГДА не используйте муку для тушения пожара жира. Он мог воспламениться, что еще больше усугубило ситуацию. Разрыхлитель и пищевая сода — НЕ одно и то же, и, как и мука, усугубляют огонь.
Вода тушит огонь?
Вода одновременно охлаждает и тушит огонь.Он охлаждает его так сильно, что он больше не может гореть, и душит его, так что он не может больше взорвать кислород в воздухе.
 — {/ eq} расходятся, молекулы воды окружают их.-_ (водн.) {/ eq}
— {/ eq} расходятся, молекулы воды окружают их.-_ (водн.) {/ eq} ) + NaOH_ (s) \ rightarrow NaCl_ (s ) + H_2O_ (l) {/ eq}
) + NaOH_ (s) \ rightarrow NaCl_ (s ) + H_2O_ (l) {/ eq}
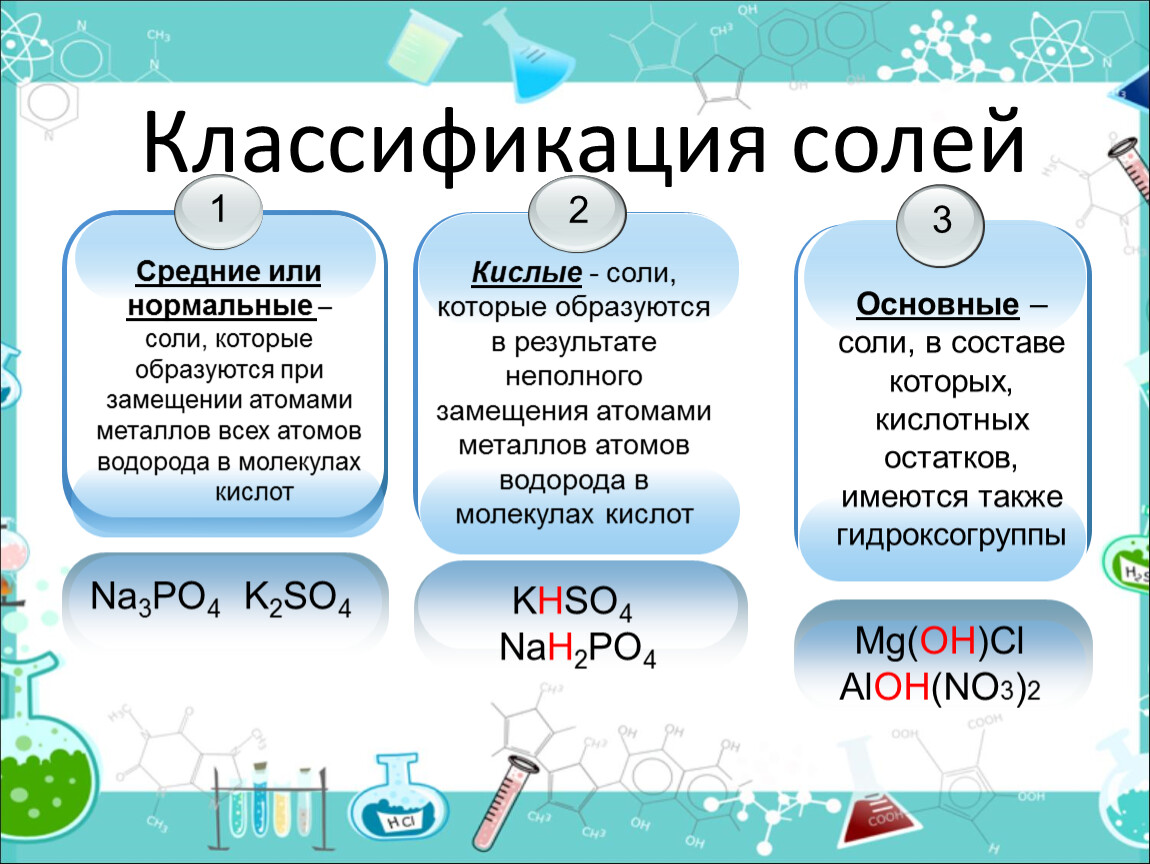 ..
.. Соли на вкус, ну, соленые, без запаха.
Соли на вкус, ну, соленые, без запаха.
 Д. Нерастворимы в воде.
Д. Нерастворимы в воде.

 Например, как хлорид алюминия (AlCl 3 ), так и хлорид аммония (NH 4 Cl) образуют кислые водные растворы.
Например, как хлорид алюминия (AlCl 3 ), так и хлорид аммония (NH 4 Cl) образуют кислые водные растворы. Он в основном состоит из хлорида натрия. Натрий — химический элемент 1 группы периодической таблицы. Это металл. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом.
Он в основном состоит из хлорида натрия. Натрий — химический элемент 1 группы периодической таблицы. Это металл. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом.  Мы называем это соединение поваренной солью.
Мы называем это соединение поваренной солью.


 Хлорид натрия — это натриевая соль, что означает, что это ионное соединение, состоящее из катиона натрия, связанного с анионом. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом.
Хлорид натрия — это натриевая соль, что означает, что это ионное соединение, состоящее из катиона натрия, связанного с анионом. Основное различие между солью и натрием состоит в том, что соль представляет собой белое кристаллическое соединение, состоящее из хлорида натрия, тогда как натрий является металлическим элементом. Они также широко используются в различных отраслях промышленности.
Они также широко используются в различных отраслях промышленности. 







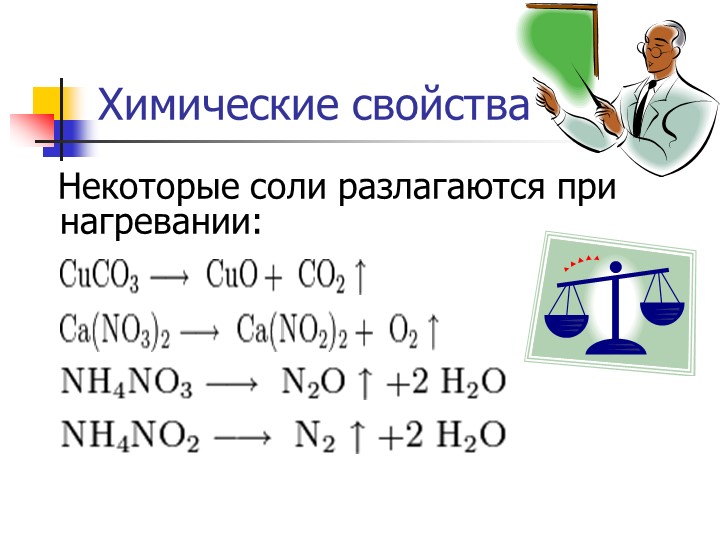 Брит. J. Pharmacol. 153: 721–727 (2008)
Брит. J. Pharmacol. 153: 721–727 (2008) Int. J. Biomater. 2013: 354125 (2013)
Int. J. Biomater. 2013: 354125 (2013)
 Гастроинтест. Liver Physiol.278: 105–112 (2000)
Гастроинтест. Liver Physiol.278: 105–112 (2000) Pharmacol. 44: 273–281 (1993)
Pharmacol. 44: 273–281 (1993)

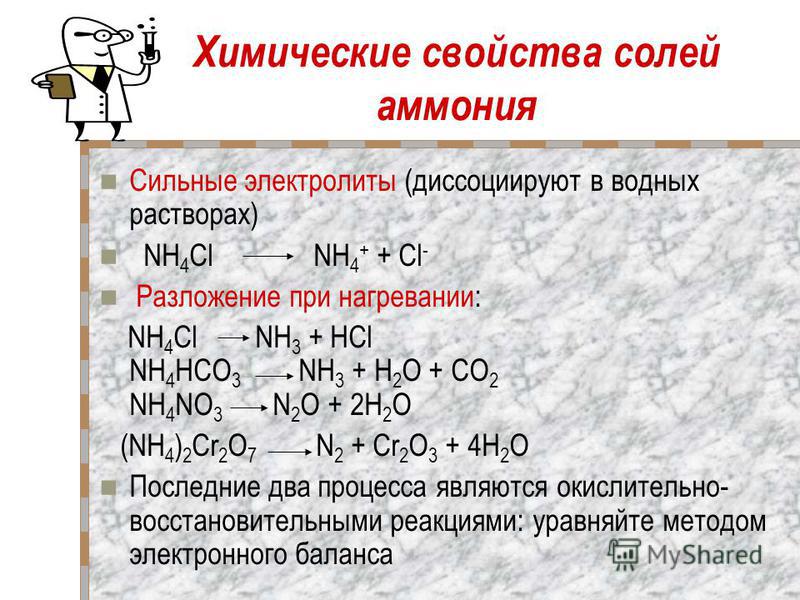 Бикарбонатно-щелочная минеральная вода защищает от вызванных этанолом геморрагических поражений желудка у мышей. Биол. Pharm. Бык. 33: 1319–1323 (2010)
Бикарбонатно-щелочная минеральная вода защищает от вызванных этанолом геморрагических поражений желудка у мышей. Биол. Pharm. Бык. 33: 1319–1323 (2010) Являюсь. J. Physiol. Гастро. Л. 261: 470–475 (1991)
Являюсь. J. Physiol. Гастро. Л. 261: 470–475 (1991)
