Гидроксид железа (II)
| Гидроксид железа (II) | |
|---|---|
| Систематическое название | Гидроксид железа (II) |
| Химическая формула | Fe(OH)2 |
| Внешний вид | белые или светло-зелёные кристаллы |
| Молярная масса | 89,86 г/моль |
| Температура разложения | 150—200 °C |
| Плотность | 3,4 г/см³ |
| Твёрдость по Моосу | 3,5—4 |
| Константа диссоциации pKb | 1,92 |
| Растворимость в воде | 5,2⋅10−5 г/100 мл |
| Произведение растворимости | 7,9⋅10−16 |
| Кристаллическая решётка | тригональная |
| Стандартная энтальпия образования | −574 кДж/моль |
| Стандартная молярная энтропия | +92 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −493 кДж/моль |
| Регистрационный номер CAS | 18624-44-7 |
Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Гидроксид железа (II) — неорганическое вещество с формулой Fe(OH)2, соединение железа. Амфотерный гидроксид с преобладанием основных свойств. Кристаллическое вещество белого (иногда с зеленоватым оттенком) цвета, на воздухе со временем темнеет. Является одним из промежуточных соединений при ржавлении железа.
Нахождение в природе
Гидроксид железа (II) встречается в природе в виде минерала амакинита. Данный минерал содержит примеси магния и марганца (эмпирическая формула Fe0,7Mg0,2Mn0,1(OH)2). Цвет минерала жёлто-зелёный или светло-зелёный, твёрдость по Моосу 3,5—4, плотность 2,925—2,98 г/см³.[1]
Физические свойства
Чистый гидроксид железа (II) — кристаллическое вещество белого цвета (на фото — коричневый цвет). Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде (растворимость 5,8⋅10−6 моль/л). При нагревании разлагается. Имеет тригональную сингонию кристаллической решётки.
При нагревании разлагается. Имеет тригональную сингонию кристаллической решётки.
Химические свойства
Гидроксид железа (II) вступает в следующие реакции.
Проявляет свойства основания — легко вступает в реакции нейтрализации с разбавленными кислотами, например с соляной (образуется раствор хлорида железа (II)):
- Fe(OH)2 + 2HCl ⟶ FeCl2 + 2H2O
В более жёстких условиях проявляет кислотные свойства, например с концентрированным (более 50 %) гидроксидом натрия при кипении в атмосфере азота образует осадок тетрагидроксоферрата (II) натрия:
- Fe(OH)2 + 2NaOH ⟶ Na2[Fe(OH)4]↓
Не реагирует с гидратом аммиака. При нагревании реагирует с концентрированными растворами солей аммония, например, хлорида аммония:
- Fe(OH)2 + 2NH4Cl ⟶ FeCl2 + 2NH3↑ + 2H2O
При нагревании разлагается с образованием оксида железа (II):
- Fe(OH)2 →150−200∘C FeO + H2O
- В этой реакции в качестве примесей образуются металлическое железо и оксид железа (III) — железа (II) (Fe3O4).

В виде суспензии, при кипячении в присутствии кислорода воздуха окисляется до метагидроксида железа. При нагревании с последним образует оксид железа (III)-железа (II):
- 4Fe(OH)2 + O2 ⟶ 4FeO(OH) + 2H2O
- Fe(OH)2 + 2FeO(OH) →600−1000∘C (FeIIFe2III)O4 + 2H2O
- Эти реакции также происходят (медленно) в процессе коррозии железа.
Получение
Гидроксид железа (II) может быть получен в виде осадка в обменных реакциях растворов солей железа (II) со щёлочью, например:
- FeSO4 + 2KOH ⟶ Fe(OH)2↓ + K2SO4
Образование гидроксида железа (II) является одной из стадий ржавления железа:
- 2Fe + 2H2O + O2 ⟶ 2Fe(OH)2
- Также гидроксид железа (II) может быть получен электролизом раствора солей щелочных металлов(например хлорида натрия) при перемешивании.
 Сначала образуется соль железа, которая при реакции с образовавшимся гидроксидом натрия даёт гидроксид железа. Чтобы получить двухвалентный гидроксид нужно вести электролиз при большой плотности тока. Реакция в общем виде:
Сначала образуется соль железа, которая при реакции с образовавшимся гидроксидом натрия даёт гидроксид железа. Чтобы получить двухвалентный гидроксид нужно вести электролиз при большой плотности тока. Реакция в общем виде: - Fe + 2H2O ⟶ Fe(OH)2↓ + H2
Применение
Гидроксид железа (II) находит применение при изготовлении активной массы железо-никелевых аккумуляторов.
|
Гидроксид железа(II), химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливомt°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип
=2403°C32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл
=2617°Ct°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Гидроксид железа 3
Неорганическое соединение гидроксид железа 3 имеет химическую формулу Fe(OH)2. Оно принадлежит к ряду амфотерных соединений железа, в которых преобладают свойства, характерные для оснований. На вид это вещество представляет собой кристаллы белого цвета, которые при длительном пребывании на открытом воздухе постепенно темнеют. Имеются варианты кристаллов зеленоватого оттенка. В повседневной жизни вещество может наблюдать каждый в виде зеленоватого налета на металлических поверхностях, что свидетельствует о начала процесса ржавления — гидроксид железа 3 выступает в качестве одной из промежуточных стадий этого процесса.
В природе соединение находят в виде амакинита. Этот кристаллический минерал, кроме собственно железа, содержит в себе еще примеси магния и марганца, все эти вещества придают амакиниту разные оттенки – от желто-зеленого до бледно- зеленого, в зависимости от процентного содержания того или иного элемента. Твердость минерала составляет 3,5-4 единицы по шкале Мооса, а плотность равна примерно 3 г/см³.
Твердость минерала составляет 3,5-4 единицы по шкале Мооса, а плотность равна примерно 3 г/см³.
К физическим свойствам вещества следует также отнести его крайне слабую растворимость. В том случае, когда гидроксид железа 3 подвергается нагреванию, он разлагается.
Это вещество очень активно и взаимодействует со многими другими веществами и соединениями. Так, например, обладая свойствами основания, оно вступает в реакции нейтрализации с различными кислотами. В частности, серная кислота, гидроксид железа 3 в ходе реакции ведут к получению сульфата железа (III). Так как эта реакция может происходить путем обычного прокаливания на открытом воздухе, такой недорогой способ производства сульфата используется как в лабораторных, так и в промышленных условиях.
В ходе реакции с соляной кислотой ее результатом является образование хлорида железа (II).
В некоторых случаях гидроксид железа 3 может проявлять и кислотные свойства. Так, например, при взаимодействии с сильно концентрированным (концентрация должна быть не менее 50%) раствором гидроксида натрия получается тетрагидроксоферрат (II) натрия, выпадающий в виде осадка. Правда, для течения такой реакции необходимо обеспечить довольно сложные условия: реакция должна происходить в условиях кипения раствора в азотной атмосферной среде.
Правда, для течения такой реакции необходимо обеспечить довольно сложные условия: реакция должна происходить в условиях кипения раствора в азотной атмосферной среде.
Как уже говорилось, при нагревании вещество разлагается. Результатом этого разложения выступает оксид железа (II), а, кроме того, в виде примесей получаются металлическое железо и его производные: оксид дижелеза (III), химическая формула которого Fe3O4.
Как произвести гидроксид железа 3, получение которого связано с его способностью вступать в реакции с кислотами? До того как приступить к проведению опыта, следует обязательно напомнить о правилах безопасности при проведении таких опытов. Эти правила применимы для всех случаев обращения с кислотно-щелочными растворами. Главное здесь – обеспечить надежную защиту и избегать попадания капель растворов на слизистые оболочки и кожу.
Итак, получить гидроксид можно в ходе проведения реакции, в которой взаимодействуют хлорид железа (III) и KOH – калия гидроксид. Данный метод — самый распространенный для образования нерастворимых оснований. При взаимодействии этих веществ протекает обычная реакция обмена, в результате которой получается осадок бурого цвета. Этот осадок и есть искомое вещество.
Данный метод — самый распространенный для образования нерастворимых оснований. При взаимодействии этих веществ протекает обычная реакция обмена, в результате которой получается осадок бурого цвета. Этот осадок и есть искомое вещество.
Применение гидроксида железа в промышленном производстве довольно широко. Наиболее распространенным является его использование в качестве активного вещества в аккумуляторах железо-никелевого типа. Кроме того, соединение используется в металлургии для получения различных металлосплавов, а также в гальваническом призводстве, авомобилестроении.
Конспект урока в 9 классе на тему «Соединения железа»
Конспект урока в 9 классе на тему «Соединения железа».
Цель урока: изучить свойства соединений железа (II) и (III).
Задачи:
Обучающие:
– сформулировать знания учащихся о свойствах гидроксидов железа (II) и (III), понимания различия этих свойств;
– добиться понимания взаимосвязи между соединениями железа со степенями окисления 2, 3;
– научить определять катионы Fe2+ и Fe3+ в растворе солей;
Развивающие:
– развивать наблюдательность, внимание, умение анализировать, обобщать, выделять главное и делать выводы;
— совершенствовать умение учащихся проводить химический эксперимент и делать выводы по выполненному исследованию.
– развить навыки самостоятельной работы с элементами исследования;
Воспитательные:
– воспитывать культуру учебного труда, соблюдение правил техники безопасности.
Оборудование.
Ход урока.
На прошлых уроках мы изучили строение и свойства железа – элемента побочной подгруппы.
На данном уроке наша цель заключается в изучении свойств соединений железа и осознании их биологического и практического значения.
– Вспомним, какие самые характерные степени окисления железа?
(ответы учащихся)
Разделите формулы веществ:Fe(NO3)2, Fe2O3, FeCl3, Fe(OH)2, FeS, Fe(OH)3, FeO, Fe2(SO4)3 — на две равные группы, каждую из которых назовите.
1-я группа:_____________________________________________________________
2-я группа:_____________________________________________________________
– Как вы думаете, данные соединения одинаковы или отличаются по характеру и свойствам?
– Давайте экспериментально исследуем, чем отличаются соединения железа со степенью окисления +2,+ 3.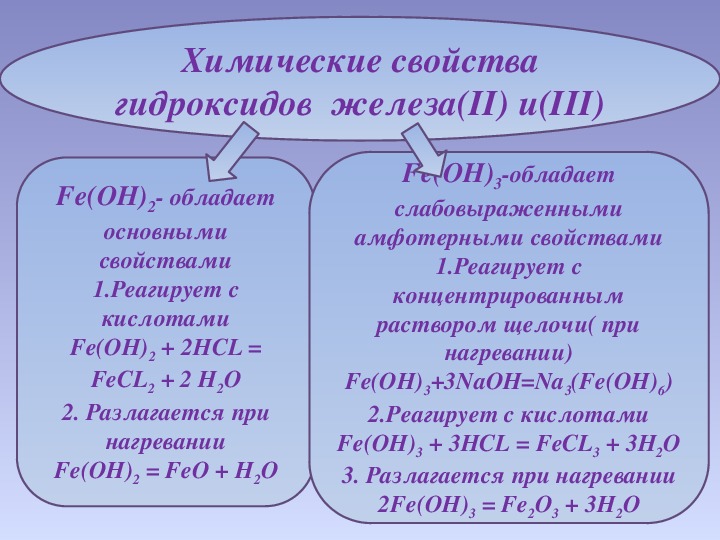
Для работы вам предлагается инструкция, которая поможет в исследовании.
Перед работой напомнить правила ТБ.
Получите гидроксид железа(II) и изучите его свойства.
Получите гидроксид железа (II) взаимодействием раствора сульфата железа (II) с раствором гидроксида натрия. Напишите уравнение реакции. Укажите цвет осадка.
Наблюдайте изменение цвета гидроксида железа (II) в местах соприкосновения его с воздухом. Опишите и объясните это явление. Напишите уравнение реакции.
Докажите экспериментально, что гидроксид железа(II) является основанием. Опишите и объясните наблюдения. Напишите уравнение реакции.
Сформулируйте вывод.
Получите гидроксид железа(III) и изучите его свойства.
Получите гидроксид железа (III) взаимодействием раствора хлорида железа (III) с раствором гидроксида натрия. Напишите уравнение реакции. Укажите цвет осадка.
Экспериментально подтвердите, что гидроксид железа(III) взаимодействует с кислотами. Объясните наблюдения. Напишите уравнение реакции.
Объясните наблюдения. Напишите уравнение реакции.
Исследуйте, взаимодействует ли гидроксид железа(III) с щелочами. Опишите наблюдения объясните их. Напишите уравнение реакции.
Сформулируйте вывод о свойствах гидроксида железа (III).
Качественные реакции на ионы Fe2+и Fe3+.
При добавлении к раствору хлорида железа(ІІІ) раствора желтой кровяной соли образуется темно-синий осадок (берлинская лазурь).
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl.
Это качественная реакция нa ионы Fe3+.
При взаимодействии раствора сульфата железа(ІІ) с раствором красной кровяной соли образуется темно-синий осадок(турнбулева синь):
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+ 3K2SO4.
Это качественная реакция на ионы Fe2+ .
Для обнаружения ионов Fe3+ используется также реакция с роданидом калия, при которой реакционная смесь приобретает красный цвет:
FeCl3+ 3KCNS = Fe(CNS)3 + 3KCl.
Выскажите обоснованные предположения, какие вещества, указанные в таблице, реагируют друг с другом. ( В соответствующие клетки таблицы поставьте знак «+»).
Формулы реагирующих веществ | Формулы реагирующих веществ | ||||
NaOH | HCl | h3O | O2, h3O | Cl2 | |
Fe2O3 Fe(OH)2 FeSO4 | |||||
Составьте план экспериментальной проверки высказанных предложений. Осуществите их.
Напишите уравнения реакций. Опишите наблюдаемые явления и объясните их сущность.
Рефлексия.
Сегодня я узнал ……………..
Теперь я умею ……………………
Я хотел бы ……………………
домашнее задание. Упр.4 стр. 82 (124)
Упр.4 стр. 82 (124)
Рабочая карта урока.
Учени____ 9 класса __________________________________________________________________
Тема урока. Соединения железа.
Разделите формулы веществ: Fe(NO3)2, Fe2O3, FeCl3, Fe(OH)2, FeS, Fe(OH)3, FeO, Fe2(SO4)3 — на две равные группы, каждую из которых назовите.
1-я группа:_____________________________________________________________
_______________________________________________________________________
2-я группа:_____________________________________________________________
______________________________________________________________________
Перед лабораторной работой вспомните правила техники безопасности.
Правила техники безопасности
• Не оставляйте открытые склянки с реактивами, закрывайте теми же пробками или крышками, какими они были закрыты.
• Бережно обращайтесь с посудой, веществами и лабораторным оборудованием.
• Проводите опыты лишь с теми веществами, которые указаны учителем. Не берите для опыта больше вещества, чем это необходимо.
• Нагревайте сначала всю пробирку, затем, не вынимая ее из пламени, ту часть, где находится вещество.
• Будьте аккуратнее – работаете с щелочью и кислотой!
С правилами техники безопасности ознакомлен: __________________________________
Получите гидроксид железа(II) и изучите его свойства.
Получите гидроксид железа (II) взаимодействием раствора сульфата железа (II) с раствором гидроксида натрия. Напишите уравнение реакции. Укажите цвет осадка.
_______________________________________________________________________
_______________________________________________________________________
Наблюдайте изменение цвета гидроксида железа (II) в местах соприкосновения его с воздухом. Опишите и объясните это явление. Напишите уравнение реакции.
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Докажите экспериментально, что гидроксид железа(II) является основанием. Опишите и объясните наблюдения. Напишите уравнение реакции.
Опишите и объясните наблюдения. Напишите уравнение реакции.
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Сформулируйте вывод.
________________________________________________________________________
________________________________________________________________________
Получите гидроксид железа(III) и изучите его свойства.
Получите гидроксид железа (III) взаимодействием раствора хлорида железа (III) с раствором гидроксида натрия. Напишите уравнение реакции. Укажите цвет осадка.
________________________________________________________________________
________________________________________________________________________
Экспериментально подтвердите, что гидроксид железа(III) взаимодействует с кислотами. Объясните наблюдения. Напишите уравнение реакции.
Объясните наблюдения. Напишите уравнение реакции.
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Исследуйте, взаимодействует ли гидроксид железа(III) с щелочами. Опишите наблюдения объясните их. Напишите уравнение реакции.
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Сформулируйте вывод о свойствах гидроксида железа (III).
________________________________________________________________________
________________________________________________________________________
Качественные реакции на ионы Fe2+и Fe3+.
При добавлении к раствору хлорида железа(ІІІ) раствора желтой кровяной соли образуется темно-синий осадок (берлинская лазурь).
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl.
Это качественная реакция нa ионы Fe3+.
При взаимодействии раствора сульфата железа(ІІ) с раствором красной кровяной соли образуется темно-синий осадок(турнбулева синь):
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+ 3K2SO4.
Это качественная реакция на ионы Fe2+ .
Для обнаружения ионов Fe3+ используется также реакция с роданидом калия, при которой реакционная смесь приобретает красный цвет:
FeCl3+ 3KCNS = Fe(CNS)3 + 3KCl.
Выскажите обоснованные предположения, какие вещества, указанные в таблице, реагируют друг с другом. ( В соответствующие клетки таблицы поставьте знак «+»).
Формулы реагирующих веществ | Формулы реагирующих веществ | ||||
NaOH | HCl | h3O | O2, h3O | Cl2 | |
Fe2O3 Fe(OH)2 FeCl2 | |||||
Составьте план экспериментальной проверки высказанных предложений. Осуществите их.
Осуществите их.
Напишите уравнения реакций. Опишите наблюдаемые явления и объясните их сущность.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
домашнее задание. Упр.4 стр. 82 (124)
Упр.4 стр. 82 (124)
Решенные лабы в методе — PDF, страница 9
Fe, Co, Ni в своих соединениях проявляют степениокисления +2 и +3, у железа и кобальта более устойчива степень окисления +3, у Ni — +2.В ряду Fe – Co – Ni химическая активность металлов понижается.Fe, Co, Ni растворяются в разбавленных соляной и серной кислотах с образованиемионов Э 2+ и выделением водорода, концентрированные серная кислота и азотная кислотаокисляют железо до Fe 3+:TFe + h3SO4 (разб) → FeSO4 + h3↑; 2Fe + h3SO4 (конц) Fe2(SO4)3 + 3SO2↑ + 6h3O;T3Fe + 4HNO3 (конц) 3Fe(NO3)3 + NO↑ + 2 h3OПри концентрации выше 70% серная кислота пассивирует железо, болееконцентрированная HNO3 на холоду пассивирует Fe и Co, образуя на их поверхностизащитные оксидные пленки типа ЭIIЭ2IIIO4. С растворами щелочей Fe, Co, Ni невзаимодействуют, с водой также не реагируют, но при температуре красного каления(Т > 5000C) железо взаимодействует с парами воды:T3Fe + 4h3O Fe3O4 + 4h3↑Оксиды и гидроксиды Э (II) проявляют основные свойства, нерастворимы в воде,гидроксиды железа (II) и кобальта (II) неустойчивы, окисляются в растворе кислородомвоздуха:4 Fe(OH)2 + O2 + 2h3O → 4 Fe(OH)3серо-зеленоватыйбуро-желтыйПри получении гидроксида Со (II) сначала образуется осадок малорастворимойосновной соли синего цвета, который затем переходит в розовый гидроксид Co(OH)2,медленно окисляющийся в коричневатый гидроксид кобальта (III):CoCl2 + NaOH CoOHCl↓ +NaCl;CoOHCl + NaOH Co(OH)2↓+ NaCl;4Co(OH)2 + O2 +2h3O 4Co(OH)3↓Гидроксид Ni(OH)2 устойчив, окисляется более сильными окислителями, например,свободными галогенами:2Ni(OH)2 + Cl2 + 2КОН ® 2КС1 + 2Ni(ОН)3Оксид Fе2О3 проявляет амфотерные свойства при высоких температурах:TFe2O3 +2NaOH 2NaFeO2 + Н2О. При реакции Fe2О3 с оксидом FeO образуется феррит железа, проявляющийферромагнитные свойства:TFeO + Fе2О3 Fe (FeO2)2 ® Fе3O4Железо в оксиде FеО3 проявляет высшую степень окисления +6, железная кислотаh3FeO4 не получена в свободном виде, получены в сильно окислительной среде приспекании соли — ферраты:T5Fe + 6NаNО3 + 4NaOH 5Na2FeO4 + 3N2↑ + 2Н2O4Дигалогениды – типичные солеобразные соединения с ионным характером химической связи.
При реакции Fe2О3 с оксидом FeO образуется феррит железа, проявляющийферромагнитные свойства:TFeO + Fе2О3 Fe (FeO2)2 ® Fе3O4Железо в оксиде FеО3 проявляет высшую степень окисления +6, железная кислотаh3FeO4 не получена в свободном виде, получены в сильно окислительной среде приспекании соли — ферраты:T5Fe + 6NаNО3 + 4NaOH 5Na2FeO4 + 3N2↑ + 2Н2O4Дигалогениды – типичные солеобразные соединения с ионным характером химической связи.
Дифториды мало растворимы в воде, остальные дигалогениды хорошо раствоFeCl2 +h3O ® FeOHCl + HCl.ряются в воде и подвергаются гидролизу:Хлорид железа FeCl2 обладает довольно сильными восстановительными2FeCl2 +Cl2 ® 2FeCl3.свойствами, окисляясь в трихлорид:Соли железа (III) весьма гигроскопичны и подвержены гидролизу в большейстепени, чем соли железа (II), поэтому имеют сильнокислую реакцию.
Добавлениесильных кислот подавляет гидролиз, а нагревание и добавление щелочей усиливаютгидролиз, доводя его до образования геля Fe(OH)3:Fe2(SO4)3 + 2h3O ® 2FeOHSO4 + h3SO4;TFeOHSO4 + 2h3O Fe(OH)3↓+ h3SO4. Ион Fe3+ является довольно сильным окислителем, восстанавливаясь до иона Fе2+:2Fe3+ + 2I- ® 2Fe2+ +I2;2Fe3+ + Cu ®2Fe2+ + Cu2+Железо, кобальт и никель являются типичными комплексообразователями, образуямногочисленные комплексы: анионные — [NiF6]3 -, [Fe(C2O4)3]4 -; катионные -[Co(Nh4)6] 3+,[Ni(h3O)6]2+; нейтральные — [Fe(CO)5], [Co2(CO)8].
Ион Fe3+ является довольно сильным окислителем, восстанавливаясь до иона Fе2+:2Fe3+ + 2I- ® 2Fe2+ +I2;2Fe3+ + Cu ®2Fe2+ + Cu2+Железо, кобальт и никель являются типичными комплексообразователями, образуямногочисленные комплексы: анионные — [NiF6]3 -, [Fe(C2O4)3]4 -; катионные -[Co(Nh4)6] 3+,[Ni(h3O)6]2+; нейтральные — [Fe(CO)5], [Co2(CO)8].
Реакции комплексообразованияиспользуются часто в аналитической практике для обнаружения элементов. Так,цианидные комплексы железа — гексацианоферрат (II) калия (или желтая кровяная соль)K4 [Fe(CN)6] и гексацианоферрат(III) калия (или красная кровяная соль) К3[Fе(СN)6] являются реактивами для обнаружения ионов Fe(II) и Fe(III):ЗFe2+ + 2[Fe(CN)6]3- ® Fe3[Fe(CN)6]2гексацианоферрат (III) железа (II) (турнбулева синь)4Fe + 3 [Fe(CN)6] ® Fe4[Fe(CN)6]33+4-гексацианоферрат (II) железа (III) (берлинская лазурь)Характерной реакцией на ион Fe3+ является реакция с тиоцианатом (роданидом)аммония Nh5SCN:Fe3+ +3SCN — ® Fe(SCN)3Тиоцианат железа (III) Fe(SCN)3 обладает интенсивной красной окраской. Устойчивость аммиачных комплексов [Э(Nh4)6]2+ растет от железа к никелю,гексааммин железа (II), полученный в безводных условиях, малоустойчив и разлагаетсяводой, гексааммин кобальта (II) устойчив в избытке аммиака, а гексааммин никеля (II)легко образуется в водном растворе:Ni(ОН)2 + 6Nh4∙Н2О ® [Ni(Nh4)6]2++ 2OH- + 6Н2ОПрактическая частьОпыт 1.
Устойчивость аммиачных комплексов [Э(Nh4)6]2+ растет от железа к никелю,гексааммин железа (II), полученный в безводных условиях, малоустойчив и разлагаетсяводой, гексааммин кобальта (II) устойчив в избытке аммиака, а гексааммин никеля (II)легко образуется в водном растворе:Ni(ОН)2 + 6Nh4∙Н2О ® [Ni(Nh4)6]2++ 2OH- + 6Н2ОПрактическая частьОпыт 1.
Получение и свойства гидроксида железа (II). В три ячейки капельногопланшета внесите 2-3 капли раствора соли железа (II), в каждую добавьте по одной капле4раствора NaOH до выпадения осадка Fe(OH)2. Отметьте цвет образующегося осадка.Далее, в первую ячейку добавьте 2 капли раствора HCl; во вторую – 2 капли раствораNaOH, третью оставьте на воздухе и проследите за изменением цвета осадка. Напишитеуравнения реакций, укажите химический характер и устойчивость гидроксида железа (II).Опыт 2. Получение и свойства гидроксида железа (III). В две ячейки капельногопланшета внесите 2-3 капли раствора железа (III), в каждую добавьте по 1 капле раствораNaOH до выпадения осадка Fe(OH)3.
Отметьте цвет образующегося осадка. В первуюячейку добавьте 2 капли раствора HCl, во вторую – 2 капли раствора NaOH. Происходитли растворение осадков? Напишите уравнения реакций и укажите химический характергидроксида железа (III).Опыт 3. Характерные реакции на ионы Fe2+ и Fe3+а) В ячейку капельного планшета внесите 2 капли раствора железа (II), добавьте 1 каплюраствора гексацианоферрата (Ш) калия (красной кровяной соли) K3[Fe(CN)6].
Отметьтецвет образовавшейся турнбулевой сини. Напишите уравнение реакции.б) В ячейку капельного планшета внесите 2 капли раствора железа (Ш), добавьте 1каплю раствора гексацианоферрата (II) калия (желтой кровяной соли) K4[Fe(CN)6].Отметьте цвет образовавшейся берлинской лазури.
Напишите уравнение реакции.в) В ячейку капельного планшета внесите 2 капли раствора железа (Ш), добавьте 1каплю раствора тиоцианата аммония Nh5SCN. Отметьте цвет осадка тиоцианата железа(III). Напишите уравнение реакции.Опыт 4. Окислительные свойства Fe3+. В ячейку капельного планшета внесите 2 каплираствора железа (Ш), добавьте 1 каплю раствора иодида калия KI и 1 каплю растворакрахмала или опустите крахмальную бумажку. Получившееся синее окрашиваниеуказывает на образование свободного иода. Напишите уравнение реакции.Опыт 5.
Получившееся синее окрашиваниеуказывает на образование свободного иода. Напишите уравнение реакции.Опыт 5.
Получение и свойства гидроксида кобальта (II). В три ячейки капельногопланшета внесите по 1-ой капле раствора соли кобальта (II), в каждую добавьте по однойкапле раствора NaOH до выпадения осадка основной соли кобальта (II). Отметьте цветобразующегося осадка. Добавьте еще по 1-2 капли NaOH до перехода основной соликобальта (II) в розовый гидроксид Co(OH)2 . Далее в первую ячейку добавьте 2 каплираствора HCl; во вторую – еще 2 капли раствора NaOH, в третью — 1 каплю растворапероксида водорода h3O2. Отметьте происходящие изменения.
Напишите уравненияреакций, укажите химический характер и устойчивость Co(OH)2 .Опыт 6. Получение и свойства гидроксида никеля (II). В три ячейки капельногопланшета внесите по 1-ой капле раствора соли никеля (II), в каждую добавьте по однойкапле раствора NaOH до выпадения осадка гидроксида Ni(OH)2. Отметьте цвет4образующегося осадка. Далее в первую ячейку добавьте 2 капли раствора HCl; во вторую–2 капли раствора NaOH, в третью — 2 капли раствора пероксида водорода h3O2.
В какихслучаях осадок растворяется? Какой окислитель может окислить Ni(OH)2? Напишитеуравнения реакций, укажите химический характер гидроксида никеля (II). Укажите,какой из ионов Fe 2+, Co 2+ или Ni 2+ является более энергичным восстановителем?Опыт 7. Получение аммиаката никеля.
В ячейку капельного планшета внесите 2 каплираствора соли никеля (II). Добавьте 2-3 капли раствора аммиака Nh5OH до образованиякомплексного иона [Ni(Nh4)6] 2+. Отметьте цвет раствора. Напишите уравнение реакции.Контрольные вопросы и задачи1. При каких взаимодействиях может образоваться гидроксид железа (III):a) Fe(OH)2 + O2 + h3O →; б) FeCl3 + KOH →;в) Fe2O3 + h3O →2. Вычислите, в какой железной руде содержание железа выше: Fe3O4, Fe2O3,FeS2. Какими тремя способами можно получить чистое железо? Приведитесоответствующие уравнения реакций.3.
В чем проявляется различное действие соляной и азотной кислот на железо,кобальт, никель? Ответ подтвердите уравнениями реакций.4. Объясните, почему при нагревании раствора FeCl3 его окраска темнеет, а придобавлении кислоты светлеет? Какие соли – двухвалентного или трехвалентного железа,– подвергаются гидролизу в меньшей степени и почему?5. Приведите уравнения химических реакций, с помощью которых можноосуществить следующие превращения:а) FeCl3 ← Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → KFeO2б) Ni(OH)2 → NiO → NiCl2 → NiSO4 → Ni2CO3Укажите условия их протекания.6. О каких свойствах двухвалентного железа (окислительных иливосстановительных) свидетельствуют нижеприведенные уравнения реакций? Закончитеуравнения:a) Fe(OH)2 + O2 + h3O → ;б) FeCl2 + Cl2 →;в) FeSO4 + O2 + h3O →7.
Приведите уравнения химических реакций, с помощью которых можноосуществить следующие превращения:а) FeCl3 ← Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → KFeO2б) Ni(OH)2 → NiO → NiCl2 → NiSO4 → Ni2CO3Укажите условия их протекания.6. О каких свойствах двухвалентного железа (окислительных иливосстановительных) свидетельствуют нижеприведенные уравнения реакций? Закончитеуравнения:a) Fe(OH)2 + O2 + h3O → ;б) FeCl2 + Cl2 →;в) FeSO4 + O2 + h3O →7.
Железо, содержащееся в 100 мл раствора FeSO4, окислено до железа (III) иосаждено в виде Fe(OH)3. После прокаливания масса осадка составила 4,132 г.Рассчитайте молярную концентрацию сульфата железа (II) в исходном растворе.8. Укажите, в чем различие действия избытков растворов аммиака и гидроксиданатрия на растворы хлоридов двухвалентных кобальта и никеля. Приведите возможныеуравнения реакций.49. Образец стали (сплав железа с углеродом) растворили в избытке разбавленнойсерной кислоты. При этом выделилось 1,96 л газа (н.у.). Определите массовую долю (в %)каждого компонента сплава. 10. Укажите, какой комплексный ион является более устойчивым и почему:а) Ni(Nh4)6 2+ , Кнест = 2 10 -9;б) Co(Nh4)6 3+ , Кнест = 6 10-36в) Co(СN)6 4 — , Кнест = 8 10 -20;г) [Fe(CN)6] 4 -,Кнест = 510-37Работа № 8.
10. Укажите, какой комплексный ион является более устойчивым и почему:а) Ni(Nh4)6 2+ , Кнест = 2 10 -9;б) Co(Nh4)6 3+ , Кнест = 6 10-36в) Co(СN)6 4 — , Кнест = 8 10 -20;г) [Fe(CN)6] 4 -,Кнест = 510-37Работа № 8.
ХИМИЧЕСКИЕ СВОЙСТВАр- ЭЛЕМЕНТОВ (В, Al, Sn, Pb)Цель работы – изучение свойств бора, алюминия, олова, свинца и их соединений.Теоретическая частьВ Ш А – VIII A группах периодической системы элементов Д.И. Менделееварасположены p – элементы. При заполненном s- подуровне внешнего энергетическогоуровня у них заполняется p — подуровень. В образовании химических связей участвуют sи р – электроны, поэтому эти элементы в своих соединениях проявляют переменныестепени окисления.Бор и алюминий находятся в ША группе.
Соли железа 3 цвет. Химические свойства железа и его соединений, их применение
Является одним из самых распространенных элементов в земной коре.
Физические свойства железа.
Железо — ковкий металл серебристо-белого цвета с высокой химической стойкостью. Оно хорошо переносит высокие температуры и влажности. Быстро тускнеет (ржавеет) на воздухе и в воде. Очень пластичный, хорошо поддается ковке и прокатке. Обладает хорошей тепло- и электропроводностью, отличный ферромагнетик.
Оно хорошо переносит высокие температуры и влажности. Быстро тускнеет (ржавеет) на воздухе и в воде. Очень пластичный, хорошо поддается ковке и прокатке. Обладает хорошей тепло- и электропроводностью, отличный ферромагнетик.
Химические свойства железа.
Железо переходный металл. Может иметь степень окисления +2 и +3. Реагирует с водяным паром:
3 Fe + 4 H 2 O = Fe 3 O 4 + 4 H 2 .
Но в присутствии влаги железо ржавеет:
4 Fe + 3 O 2 + 6 H 2 O = 4 Fe (OH ) 3 .
2 Fe + 3 Cl 2 = 2 FeCl 3 .
Fe + H 2 SO 4 = FeSO 4 + H 2 .
Концентрированные кислоты пассивируют железо на холоде, но растворяют при нагревании:
2Fe + 6H 2 SO 4 = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Гидроксид железа (II ) получается при действии щелочи на соли железа (II) без доступа кислорода :
F 2 SO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4 .
Выделяется осадок белого цвета, который на воздухе быстро окисляется:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 .
Данный гидроксид амфотерный, при нагреве растворяется в щелочах с образованием гексагидроферата:
Fe(OH) 3 + 3KOH = K 3 .
Железо образует две комплексные соли железа :
- Желтая кровяная соль K 4 [ Fe (CN ) 6 ];
- Красная кровяная соль K 3 [ Fe (CN ) 6 ].
Эти соединения являются качественными для определения ионов железа. Соединение берлинская лазурь :
K 4 + Fe 2+ = KFe III + 2K + .
Применение железа.
Железо является важнейшим компонентом процесса дыхания. Он входит в состав гемоглобина крови, участвует в переносе кислорода от легких к тканям. В природе железо встречается в составе руд и минералов.
В природе железо встречается в составе руд и минералов.
ОПРЕДЕЛЕНИЕ
Железо — элемент четвертого периода VIII группы побочной (B) подгруппы Периодической таблицы. Обозначение – Fe. В виде простого вещества железо — серебристо-белый металл.
Плотность равна 7,87 г/см 3 . Температура плавления 1539 o С, кипения 3200 o С. Железо имеет несколько модификаций. До 769 o С устойчиво α-железо с объемно центрированной кубической решеткой и ферромагнитными свойствами. При 769 o С осуществляется переход в β-железо (кристаллическая структура та же, парамагнетик). При 910 o С образуется γ-железо с гранецентрированной кристаллической решеткой. Парамагнитные свойства. При 1400 o С и до температуры плавления — δ- железо с объемно центрированной кубической решеткой.
Степень окисления железа в соединениях
Железо может существовать в виде простого вещества — металла, а степень окисления металлов в элементарном состоянии равна нулю , так как распределение электронной плотности в них равномерно.
Для железа характерны степени окисления (+2) и (+3) : Fe +2 O, Fe +3 2 O 3 , Fe +2 (OH) 2 , Fe +3 (OH) 3 , Fe +2 Cl 2 , Fe +3 Cl 3 , Fe +2 SO 4 , Fe +3 2 (SO 4) 3 .
Известны соединения железа со степенью окисления (+6) , они носят название «ферраты» (K 2 Fe +6 O 4).
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
Соединения железа (II)
Соединения железа со степень окисления железа +2 малоустойчивы и легко окисляются до производных железа (III).
Fe 2 O 3 + CO = 2FeO + CO 2 .
Гидроксид железа (II) Fe(OH) 2 в свежеосажденном виде имеет серовато-зеленую окраску, в воде не растворяется, при температуре выше 150 °С разлагается, быстро темнеет вследствие окисления:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 .
Проявляет слабовыраженные амфотерные свойства с преобладанием основных, легко реагирует с неокисляющими кислотами:
Fe(OH) 2 + 2HCl = FeCl 2 + 2H 2 O.
Взаимодействует с концентрированными растворами щелочей при нагревании с образованием тетрагидроксоферрата (II):
Fe(OH) 2 + 2NaOH = Na 2 .
Проявляет восстановительные свойства, при взаимодействии с азотной или концентрированной серной кислотой образуются соли железа (III):
2Fe(OH) 2 + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 6H 2 O.
Получается при взаимодействии солей железа (II) с раствором щелочи в отсутствии кислорода воздуха:
FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4 .
Соли железа (II). Железо (II) образует соли практически со всеми анионами. Обычно соли кристаллизуются в виде зеленых кристаллогидратов: Fe(NO 3) 2 · 6H 2 O, FeSO 4 · 7H 2 O, FeBr 2 · 6H 2 O, (NH 4) 2 Fe(SO 4) 2 · 6H 2 O (соль Мора) и др. Растворы солей имеют бледно-зеленую окраску и, вследствие гидролиза , кислую среду:
Fe 2+ + H 2 O = FeOH + + H + .
Проявляют все свойства солей.
При стоянии на воздухе медленно окисляются растворенным кислородом до солей железа (III):
4FeCl 2 + O 2 + 2H 2 O = 4FeOHCl 2 .
Качественная реакция на катион Fe 2+ — взаимодействие с гексацианоферратом (III) калия (красной кровяной солью) :
FeSO 4 + K 3 = KFe↓ + K 2 SO 4
Fe 2+ + K + + 3- = KFe↓
в результате реакции образуется осадок синего цвета — гексацианоферрат (II) железа (III) — калия.
Степень окисления +3 характерна для железа.
Оксид железа (III) Fe 2 O 3 — вещество бурого цвета, существует в трех полиморфных модификациях.
Проявляет слабовыраженные амфотерные свойства с преобладанием основных. Легко реагирует с кислотами:
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O.
С растворами щелочей не реагирует, но при сплавлении образует ферриты :
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O.
Проявляет окислительные и восстановительные свойства. При нагревании восстанавливается водородом или оксидом углерода (II), проявляя окислительные свойства:
Fe 2 O 3 + H 2 = 2FeO + H 2 O,
Fe 2 O 3 + CO = 2FeO + CO 2 .
В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
Fe 2 O 3 + 3KNO 3 + 4KOH = 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
При температуре выше 1400°С разлагается:
6Fe 2 O 3 = 4Fe 3 O 4 + O 2 .
Получается при термическом разложении гидроксида железа (III):
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
или окислением пирита:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 .
FeCl 3 + 3KCNS = Fe(CNS) 3 + 3KCl,
68. Соединения железа
Оксид железа (II) FeO – черное кристаллическое вещество, нерастворимое в воде и щелочах. FeO соответствует основание Fe(OH)2 .
Получение. Оксид железа (II) можно получить неполным восстановлением магнитного железняка оксидом углерода (II):
Химические свойства. Является основным оксидом. Реагируя с кислотами, образует соли:
Гидроксид железа (II) Fe(OH)2 – кристаллическое вещество белого цвета.
Получение. Гидроксид железа (II) получается из солей двухвалентного железапри действии растворов щелочей:
Химические свойства. Основный гидроксид. Вступает в реакции с кислотами:
На воздухе Fe(OH)2 окисляется до Fе(ОН)3:
Оксид железа(III) Fe2O3 – вещество бурого цвета, встречается в природе в виде красного железняка, нерастворим в воде.
Получение . При обжиге пирита:
Химические свойства. Проявляет слабые амфотерные свойства. При взаимодействии со щелочами образует соли:
Проявляет слабые амфотерные свойства. При взаимодействии со щелочами образует соли:
Гидроксид железа (III) Fe(OH)3 – вещество красно-бурого цвета, нерастворимое в воде и избытке щелочи.
Получение . Получают путем окисления оксида железа (III) и гидроксида железа (II).
Химические свойства. Является амфотерным соединением (с преобладанием основных свойств). Выпадает в осадок при действии щелочей на соли трехвалентного железа:
Соли двухвалентного железа получают взаимодействием металлического железа с соответствующими кислотами. Они сильно гидро-лизуются, потому их водные растворы – энергичные восстановители:
При нагревании выше 480 °C разлагается, образуя оксиды:
При действии щелочей на сульфат железа (II) образуется гидроксид железа (II):
Образует кристаллогидрат – FeSO4?7Н2О (железный купорос). Хлорид железа (III) FeCl3 – кристаллическое вещество темно-коричневого цвета.
Химические свойства. Растворим в воде. FeCl3 проявляет окислительные свойства.
Растворим в воде. FeCl3 проявляет окислительные свойства.
Восстановители – магний, цинк, сероводород, окисляются без нагревания.
Железо – химический элемент
1. Положение железа в периодической таблице химических элементов и строение его атома
Железо — это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar (Fe ) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Fe 0 -2 e — → Fe +2 , окисляется восстановитель
Fe 0 -3 e — → Fe +3 , окисляется восстановитель
Основные степени окисления: +2, +3
2. Распространённость железа
Железо – один из
самых распространенных элементов в природе . В земной коре его массовая доля составляет 5,1%,
по этому показателю оно уступает только
кислороду, кремнию и алюминию . Много железа находится и в небесных телах,
что установлено по данным спектрального анализа. В образцах лунного грунта,
которые доставила автоматическая станция “Луна”, обнаружено железо в
неокисленном состоянии.
Много железа находится и в небесных телах,
что установлено по данным спектрального анализа. В образцах лунного грунта,
которые доставила автоматическая станция “Луна”, обнаружено железо в
неокисленном состоянии.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются :
магнетит (магнитный железняк) – Fe 3 O 4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
| |
гематит (железный блеск, кровавик)– Fe 2 O 3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
лимонит (бурый железняк) – Fe 2 O 3* nH 2 O содержит до 60% железа, месторождения встречаются в Крыму:
пирит (серный колчедан, железный
колчедан, кошачье золото) – FeS 2 содержит примерно 47% железа, месторождения встречаются на Урале.
3. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO 2 .
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так
от одной и той же причины – наличия железа в соках и тканях – весело зеленеют
листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают
химически чистое и технически чистое железо. Технически чистое железо, по сути,
представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода,
а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо
содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый,
блестящий, по внешнему виду очень похожий на платину металл. Химически чистое
железо устойчиво к коррозиии хорошо
сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих
драгоценный свойств.
Однако ничтожные доли примесей лишают его этих
драгоценный свойств.
5. Получение железа
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
FeO + C = Fe + CO
Fe 2 O 3 + 3CO = 2Fe + 3CO 2
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
Опыт «Получение железа алюминотермией»
6. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3
2) Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II,III) — вещество чёрного цвета:
3Fe + 2O 2 = Fe 3 O 4
C кислородом во влажном воздухе образуется Fe 2 O 3 * nH 2 O
Опыт «Взаимодействие железа с кислородом»
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H 2 O t˚C → Fe 3 O 4 + 4H 2
4) Железо реагирует с неметаллами при нагревании:
Fe + S t˚C → FeS
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 (разб
. ) = FeSO 4
+ H 2
) = FeSO 4
+ H 2
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
2Fe + 6H 2 SO 4 (конц .) t˚C → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (конц
.) t˚C → Fe(NO 3) 3
+ 3NO 2 + 3H 2 O Железо (III)
7. Применение железа.
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Изделия из чугуна
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: М
Тренажёр №2 — Генетический ряд Fe 3+
Тренажёр №3 — Уравнения реакций железа с простыми и сложными веществами
Задания для закрепления
№1. Составьте
уравнения реакций получения железа из его оксидов Fe 2 O 3 и
Fe 3 O 4 , используя в качестве восстановителя:
Составьте
уравнения реакций получения железа из его оксидов Fe 2 O 3 и
Fe 3 O 4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите
превращения по схеме:
Fe 2 O 3 -> Fe — +h3O,
t -> X — +CO, t -> Y — +HCl ->Z
Назовите продукты X, Y, Z?
Формула гидроксида железа III — структура, свойства, использование и часто задаваемые вопросы
Гидроксид железа (III) — это химическое соединение, состоящее из водорода, железа и кислорода, имеющее химическую формулу Fe (OH) 3. В зависимости от гидратации, кристаллической структуры, размера и формы частиц гидроксиды железа III различаются по цвету от темно-коричневого до черного. Здесь мы изучим формулу гидроксида железа III, его свойства, химическую структуру и использование. Формула гидроксида железа также является Fe (OH) 3.
Свойства гидроксида железа III
Химическое название | Гидроксид железа III | |
Другие наименования | Формула железа или железа | |
гидроксида железа | Fe (OH) 3 | |
Температура плавления | 135 ° C | |
Молярная масса | 106. | |
Плотность | 4,25 г / см³ | |
Внешний вид | Яркие темно-оранжевые кристаллы | |
Растворимость в воде | Растворимость в воде |
Давайте посмотрим на другие свойства ниже.
Цвет оксигидроксида железа (III) варьируется от желтого до темно-коричневого до черного в зависимости от степени гидратации, формы и размера частиц, а также кристаллической структуры.
Структура
Кристаллическая структура β-FeOOH (также называемого акаганеитом) — это структура BaMn8O16 или голландита. Элементарная ячейка является тетрагональной, имеет a = 1,048 и c = 0,3023 нм и содержит 8 формульных единиц FeOOH. Его размеры до 500 × 50 × 50 нм. Часто в результате двойникования образуются частицы, имеющие форму шестиугольных звезд.
Химия
При нагревании гидроксида железа III β-FeOOH разлагается и перекристаллизовывается в α-Fe2O3 (который называется гематитом).
Естественные явления
Безводный гидроксид трехвалентного железа встречается в природе как чрезвычайно редкий минерал берналит, Fe (OH) 3 · nh3O (n = 0.0-0,25). Оксигидроксиды железа также называют FeOOH. Они более распространены и естественным образом встречаются в виде структурно различных минералов (или полиморфов) и обозначаются греческими буквами α, β, γ и δ.
Гетит с химической формулой — α-FeO (OH) использовался в качестве охристого пигмента с доисторических времен.
Фероксигит (δ) может образовываться в условиях высокого давления океана и морского дна, будучи термодинамически нестабильным по отношению к α-полиморфу (или гетиту) на поверхности.

Использует
Лимонит, который представляет собой смесь различных полиморфов и гидратов оксигидроксида железа, является одной из трех первичных железных руд, которые использовались, по крайней мере, с 2500 г. до н.э.
Желтый оксид железа, иначе называемый Pigment Yellow 42, одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для использования в косметике и может использоваться в некоторых чернилах для татуировок.
Кроме того, гидроксид железа можно использовать при очистке воды в аквариуме в качестве связующего фосфата.
Наночастицы оксида-гидроксида железа были изучены как возможные адсорбенты для удаления свинца из водных сред.

Усовершенствованные материалы Reade — гидроксид железа (III) / Fe (OH) 3
Физические свойства
Гранулы, порошок или суспензия
Химические свойства Fe (OH) 3
1) Гидроксид железа, суспензия — 13%
| % Железо: Мин .: 6,54 и макс. = 7,07 |
| Свободная кислота: 0,00% |
| pH (10% раствор): 5-9 |
| Вязкость по Брукфилду: от 5000 до 25000 сП |
| Внешний вид: Шоколадно-коричневый |
| Типичный анализ следов (все не более 0,1%): хлориды, нитраты, сульфаты, натрий, марганец, углерод и цинк |
Суспензия гидроксида железа не является складированным продуктом.Со временем продукт обесцветится. Для производства необходимо 2 — 3 недели.
Примечание: Продукт расслаивается (гидроксид железа не растворяется в воде), и его необходимо тщательно перемешать перед использованием.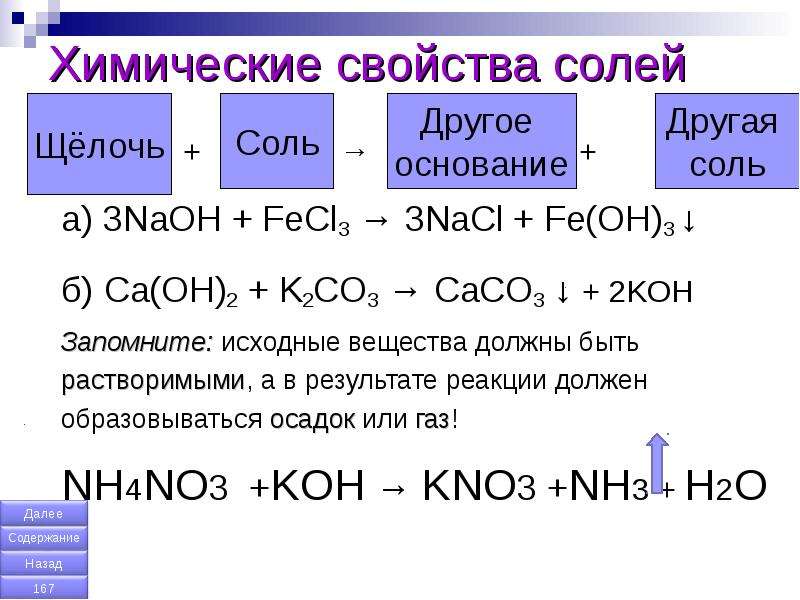
2) Гидроксид железа, гранулированный — ß-FeOOH и Fe (Oh4)
| Содержание сухих твердых веществ: 58% (± 10%) |
| Содержание железа по отношению к сухим веществам: 600 г / кг (± 10%) |
| Размер частиц: 0.2 — 2,0 мм 0,2 — 2,0 мм |
| Негабаритная фракция: |
| Общая доля негабаритных и меньших размеров: |
| Насыпная плотность с обратной промывкой: 1150 кг / м3 (± 10%) |
| Удельная поверхность (метод БЭТ): прибл. 300 м2 / г |
Типичные области применения гидроксида железа
Очистка воды, обработка мышьяка и других тяжелых металлов.
- Специальные приложения для очистки воды:
- Очистка сточных вод
- Очистка питьевой воды
- Производство минеральной и столовой воды
- Очистка природных вод
- Очистка кровельных и уличных стоков
- Производство пигментов
- Пигменты резиновые
- Катализатор
- Облучение ядерных отходов
Описание гидроксида железа
Обозначения: Гидроксид железа (III) (гранулированный, порошок или суспензия) часто используется в качестве адсорбента для удаления различных тяжелых металлов (т. е.е., мышьяк и хром) из загрязненной почвы и воды.
е.е., мышьяк и хром) из загрязненной почвы и воды.
Обозначения:
Химическое название: Гидроксид железа (III), гидроксид железа
Химическая формула: Fe (OH) 3
Упаковка
а) Банки, ведра, бочки, многослойные бумажные мешки, мешки для массовых грузов и контейнеры из ДВП.
b) За дополнительной информацией о вариантах упаковки обращайтесь в READE.
Синонимы этого химического вещества
гидроксид железа (III) железа, (Fe (OH) 3, CAS № 1309-37-1, CAS № 51274-00-1, (FeO (OH)), гидроксид железа, гранулированный гидроксид трехвалентного железа, суспензия гидроксида трехвалентного железа, жидкость железо, гранулированный гидроксид железа
Классификация
- TSCA (SARA Title III) Статус:
Для получения дополнительной информации, пожалуйста, свяжитесь с E.П.А. - Химический реферат Номер службы:
Гидроксид железа ß-FeOOH и Fe (Oh4) Гранулированный CAS # 51274-00-1
Суспензия гидроксида железа CAS # 1309-37-1 - Национальная медицинская библиотека США (NIH):
Список веществ.
- Паспорт безопасности:
Свяжитесь с ПРОЧИТАЕМ для получения последней SDS
Сопутствующие товары
Превращение Fe (OH) 2 в магнетит и его преобразование в маггемит …
Метан (Ch5) — чистый источник энергии, поэтому текущие крупномасштабные усилия направлены на получение этого углеводорода.Мало что известно о том, как поверхностная реакционная способность глин способствует производству Ch5 in situ. В этой статье сообщается о естественном образовании Ch5 после реакции четырех нонтронитов, богатых железом диоктаэдрических смектитов [Fe2O3ca. 30% и Al2O3 <12%], от бикарбоната в строгих условиях отсутствия кислорода при 25 ° C. Используемые аналитические методы включали рентгеновскую флуоресценцию, дифракцию рентгеновских лучей, элементный анализ, газовую хроматографию, сканирующую и просвечивающую электронную микроскопию высокого разрешения, а также рентгеновскую спектроскопию с дисперсией по энергии и нано-дифракцию.Производство Ch5 достигло 5700 частей на миллиард. Для сравнения, зарегистрированные концентрации Ch5 в водных дисперсиях нонтронита превзошли среднюю концентрацию Ch5 в атмосфере Земли (1,774 ppbv) и планетарный баланс Ch5 для поверхности Марса (10–250 ppbv). Рассчитаны фитинговые функции для производства Ch5. Наибольшее образование Ch5 зарегистрировано в дисперсиях, содержащих нонтрониты с меньшим содержанием Fe (% Fe). Накопленная продукция Ch5 (ΣCh5 через 60 дней) изменяется с% Fe согласно: y = −171.5 (x) + 7348, r² = 0,98 (n = 4). Повышение активности протонов способствовало образованию Ch5 вместо представления о том, что коррозия сильно восстановленных нанодоменов Fe, которые возникают в природе на нонтронитовых поверхностях, приводит к образованию протонов, которые гидрируют углеродные центры. Между тем, бикарбонат действовал не как анион-наблюдатель, а как источник углерода. С другой стороны, микроскопические наблюдения выявили наличие биосигнатур в нонтроните, обозначающих бесполое и половое размножение бактериальных окислителей железа, присущих литотрофной среде.
Для сравнения, зарегистрированные концентрации Ch5 в водных дисперсиях нонтронита превзошли среднюю концентрацию Ch5 в атмосфере Земли (1,774 ppbv) и планетарный баланс Ch5 для поверхности Марса (10–250 ppbv). Рассчитаны фитинговые функции для производства Ch5. Наибольшее образование Ch5 зарегистрировано в дисперсиях, содержащих нонтрониты с меньшим содержанием Fe (% Fe). Накопленная продукция Ch5 (ΣCh5 через 60 дней) изменяется с% Fe согласно: y = −171.5 (x) + 7348, r² = 0,98 (n = 4). Повышение активности протонов способствовало образованию Ch5 вместо представления о том, что коррозия сильно восстановленных нанодоменов Fe, которые возникают в природе на нонтронитовых поверхностях, приводит к образованию протонов, которые гидрируют углеродные центры. Между тем, бикарбонат действовал не как анион-наблюдатель, а как источник углерода. С другой стороны, микроскопические наблюдения выявили наличие биосигнатур в нонтроните, обозначающих бесполое и половое размножение бактериальных окислителей железа, присущих литотрофной среде. Таким образом, как образование Ch5, так и ассимиляция углерода лучше всего объяснялись тем, что восстановление карбоната лабильными высокореакционноспособными нанодоменами Fe, присутствующими в нонтроните в условиях окружающей среды.
Таким образом, как образование Ch5, так и ассимиляция углерода лучше всего объяснялись тем, что восстановление карбоната лабильными высокореакционноспособными нанодоменами Fe, присутствующими в нонтроните в условиях окружающей среды.
Утюг
УтюгУтюг, Fe 3+
Наиболее частое окисление государства : +2, +3
М.П. 1535 o
Б.П. 2750 или
Плотность 7.87 г / см 3
Характеристики : Серый, умеренно активный металл.
Характерные реакции Fe 2+ и Fe 3+ :
[Fe (H 2 O) 6 ] 3+ ион бесцветен (или бледно-розовый), но многие растворы, содержащие этот ион желтого или янтарного цвета из-за гидролиза. Железо в обоих степени окисления образует много сложных ионов.
Аммиак водный:
Водный раствор аммиака реагирует с Fe (II) ионы с образованием белого гелеобразного Fe (OH) 2 , который окисляется с образованием красно-коричневого Fe (OH) 3 :
Fe 2+ (водн. ) + 2NH 3 (водн.) + 3H 2 O (l) <==> Fe (OH) 2 (s)
+ 2NH 4 + (водн.)
) + 2NH 3 (водн.) + 3H 2 O (l) <==> Fe (OH) 2 (s)
+ 2NH 4 + (водн.)Водный раствор аммиака реагирует с Fe (III) ионы с образованием красно-коричневого Fe (OH) 3 :
Fe 3+ (водн.) + 3NH 3 (водн.) + 3H 2 O (l) <==> Fe (OH) 3 (т) + 3NH 4 + (водн.)Оба осадка не растворимы в избыток водного аммиака.Гидроксид железа (II) быстро окисляется до Fe (OH) 3 в присутствии воздуха или другого окислителя. агенты.
гидроксид натрия:
Гидроксид натрия также производит Fe (OH) 2 и Fe (OH) 3 из соответствующих степеней окисления железа в водной решение.
Fe 2+ (водн.) + 2OH — (водн.) <==> Fe (OH) 2 (т) Fe 3+ (водн.) + 3OH — (водн.) <==> Fe (OH) 3 (т) Ни одного гидроксида в осадке
растворяется в избытке гидроксида натрия.
Ферроцианид калия:
Ферроцианид калия будет реагировать с раствором Fe 3+ с образованием темно-синего осадка называется берлинской лазурью:
K + (водн.) + Fe 3+ (водн.) + [Fe (CN) 6 ] 4- (водн.) <==> KFe [Fe (CN) 6 ] (s)С Fe 2+ раствора, будет образовываться белый осадок, который будет преобразован в синий из-за окисления кислородом воздуха:
2Fe 2+ (водн.) + [Fe (CN) 6 ] 4- (водн.) <==> Fe 2 [Fe (CN) 6 ] (s)Примечание: многие ионы металлов образуют ферроцианид осаждается, поэтому ферроцианид калия не является хорошим реагент для разделения ионов металлов.Чаще используется как подтверждающий тест.
Феррицианид калия:
Феррицианид калия дает
коричневая окраска, но без осадка с Fe 3+ .
В случае Fe 2+ образуется темно-синий осадок.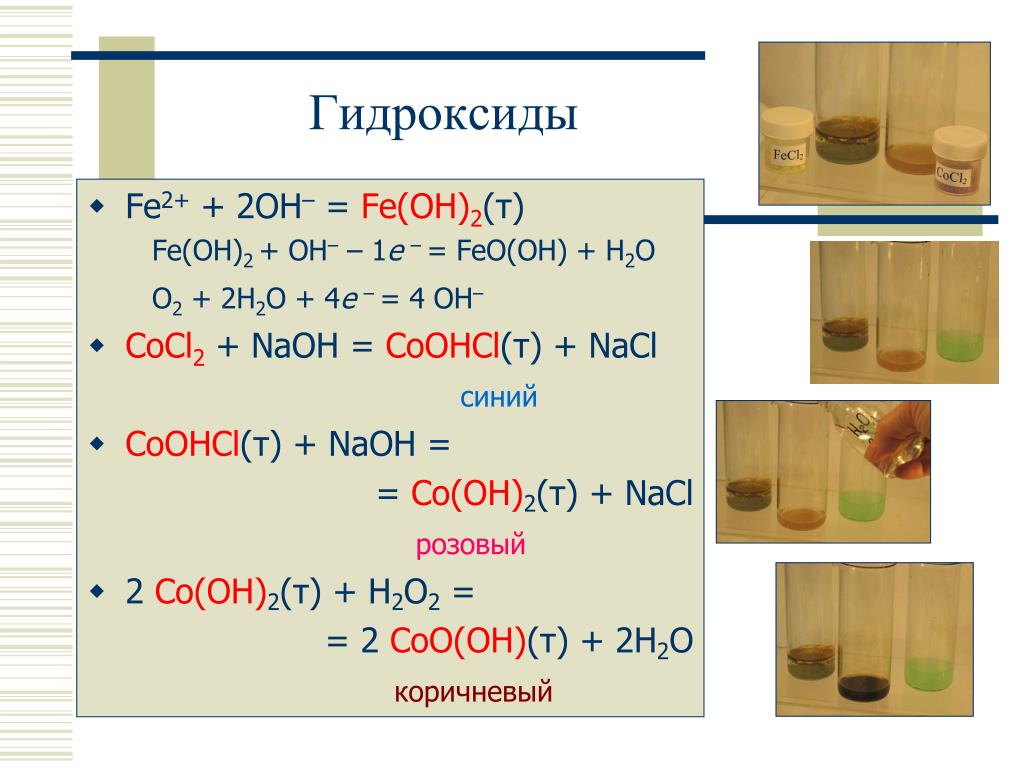 Несмотря на то что
этот осадок известен как синий цвет Тернбулла, он идентичен
Берлинская лазурь.
Несмотря на то что
этот осадок известен как синий цвет Тернбулла, он идентичен
Берлинская лазурь.
Калий Тиоцианат:
KSCN дает темно-красный цвет. к растворам, содержащим Fe 3+ :
Fe 3+ (водн.) + NCS — (водн.) <==> [FeNCS] 2+ (водн.)Нет реакции:
Класс —, SO 4 2-
Перейти катион меню
% PDF-1.4
%
524 0 объект>
эндобдж
xref
524 135
0000000016 00000 н.
0000003986 00000 н.
0000004189 00000 п.
0000004215 00000 н.
0000004263 00000 н.
0000004298 00000 н.
0000004705 00000 н.
0000004815 00000 н.
0000004925 00000 н.
0000005034 00000 н.
0000005144 00000 п.
0000005254 00000 н.
0000005363 00000 п.
0000005473 00000 н.
0000005582 00000 н. 0000005691 00000 п.
0000005799 00000 н.
0000005909 00000 н.
0000006019 00000 п.
0000006129 00000 н.
0000006238 00000 п.
0000006347 00000 н.
0000006490 00000 н.
0000006569 00000 н.
0000006648 00000 н.
0000006728 00000 н.
0000006807 00000 н.
0000006886 00000 н.
0000006964 00000 н.
0000007043 00000 п.
0000007121 00000 н.
0000007200 00000 н.
0000007278 00000 н.
0000007357 00000 н.
0000007437 00000 н.
0000007516 00000 н.
0000007595 00000 н.
0000007673 00000 н.
0000007752 00000 н.
0000007832 00000 н.
0000007911 00000 п.
0000007990 00000 н.
0000008069 00000 н.
0000008148 00000 н.
0000008226 00000 п.
0000008305 00000 н.
0000008383 00000 п.
0000008462 00000 п.
0000008540 00000 н.
0000008619 00000 п.
0000008697 00000 п.
0000008776 00000 п.
0000008854 00000 н.
0000008934 00000 н.
0000009012 00000 н.
0000009091 00000 н.
0000009169 00000 п.
0000009246 00000 н.
0000009324 00000 п.
0000009401 00000 п.
0000009479 00000 п.
0000009558 00000 п.
0000009635 00000 н.
0000005691 00000 п.
0000005799 00000 н.
0000005909 00000 н.
0000006019 00000 п.
0000006129 00000 н.
0000006238 00000 п.
0000006347 00000 н.
0000006490 00000 н.
0000006569 00000 н.
0000006648 00000 н.
0000006728 00000 н.
0000006807 00000 н.
0000006886 00000 н.
0000006964 00000 н.
0000007043 00000 п.
0000007121 00000 н.
0000007200 00000 н.
0000007278 00000 н.
0000007357 00000 н.
0000007437 00000 н.
0000007516 00000 н.
0000007595 00000 н.
0000007673 00000 н.
0000007752 00000 н.
0000007832 00000 н.
0000007911 00000 п.
0000007990 00000 н.
0000008069 00000 н.
0000008148 00000 н.
0000008226 00000 п.
0000008305 00000 н.
0000008383 00000 п.
0000008462 00000 п.
0000008540 00000 н.
0000008619 00000 п.
0000008697 00000 п.
0000008776 00000 п.
0000008854 00000 н.
0000008934 00000 н.
0000009012 00000 н.
0000009091 00000 н.
0000009169 00000 п.
0000009246 00000 н.
0000009324 00000 п.
0000009401 00000 п.
0000009479 00000 п.
0000009558 00000 п.
0000009635 00000 н. 0000009712 00000 н.
0000009788 00000 н.
0000009867 00000 н.
0000009946 00000 н.
0000010025 00000 п.
0000010104 00000 п.
0000010322 00000 п.
0000011031 00000 п.
0000011257 00000 п.
0000011713 00000 п.
0000012171 00000 п.
0000012409 00000 п.
0000016350 00000 п.
0000016729 00000 п.
0000017128 00000 п.
0000017394 00000 п.
0000017783 00000 п.
0000024686 00000 п.
0000025287 00000 п.
0000025688 00000 п.
0000026173 00000 п.
0000026250 00000 п.
0000026467 00000 н.
0000031995 00000 п.
0000032355 00000 п.
0000033176 00000 п.
0000034075 00000 п.
0000034768 00000 п.
0000035101 00000 п.
0000035232 00000 п.
0000036189 00000 п.
0000036454 00000 п.
0000037209 00000 п.
0000037742 00000 п.
0000038251 00000 п.
0000038668 00000 п.
0000038919 00000 п.
0000039223 00000 п.
0000039326 00000 п.
0000048614 00000 п.
0000048951 00000 п.
0000049351 00000 п.
0000049587 00000 п.
0000050479 00000 п.
0000051365 00000 п.
0000051759 00000 п.
0000052576 00000 п.
0000053492 00000 п.
0000009712 00000 н.
0000009788 00000 н.
0000009867 00000 н.
0000009946 00000 н.
0000010025 00000 п.
0000010104 00000 п.
0000010322 00000 п.
0000011031 00000 п.
0000011257 00000 п.
0000011713 00000 п.
0000012171 00000 п.
0000012409 00000 п.
0000016350 00000 п.
0000016729 00000 п.
0000017128 00000 п.
0000017394 00000 п.
0000017783 00000 п.
0000024686 00000 п.
0000025287 00000 п.
0000025688 00000 п.
0000026173 00000 п.
0000026250 00000 п.
0000026467 00000 н.
0000031995 00000 п.
0000032355 00000 п.
0000033176 00000 п.
0000034075 00000 п.
0000034768 00000 п.
0000035101 00000 п.
0000035232 00000 п.
0000036189 00000 п.
0000036454 00000 п.
0000037209 00000 п.
0000037742 00000 п.
0000038251 00000 п.
0000038668 00000 п.
0000038919 00000 п.
0000039223 00000 п.
0000039326 00000 п.
0000048614 00000 п.
0000048951 00000 п.
0000049351 00000 п.
0000049587 00000 п.
0000050479 00000 п.
0000051365 00000 п.
0000051759 00000 п.
0000052576 00000 п.
0000053492 00000 п.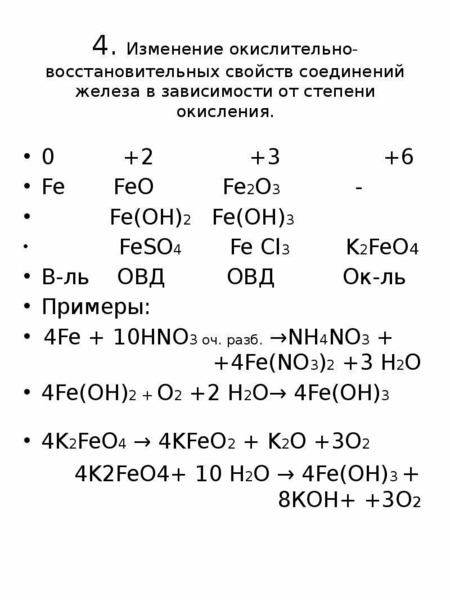 0000054380 00000 п.
0000054996 00000 п.
0000057322 00000 п.
0000076560 00000 п.
0000093748 00000 н.
0000096257 00000 п.
0000096569 00000 п.
0000096936 00000 п.
0000097127 00000 п.
0000097184 00000 п.
0000097419 00000 п.
0000097521 00000 п.
0000097622 00000 н.
0000097741 00000 п.
0000097855 00000 п.
0000098016 00000 п.
0000098115 00000 п.
0000098251 00000 п.
0000098399 00000 п.
0000098504 00000 п.
0000098606 00000 п.
0000098722 00000 п.
0000098848 00000 п.
0000002996 00000 н.
трейлер
] >>
startxref
0
%% EOF
658 0 obj> поток
x ڬ TILSQSVPEBET-AZҠ!? qcZZɁHB5WhvpDb \ Hԅ & `BL ~ 7m = sZ
0000054380 00000 п.
0000054996 00000 п.
0000057322 00000 п.
0000076560 00000 п.
0000093748 00000 н.
0000096257 00000 п.
0000096569 00000 п.
0000096936 00000 п.
0000097127 00000 п.
0000097184 00000 п.
0000097419 00000 п.
0000097521 00000 п.
0000097622 00000 н.
0000097741 00000 п.
0000097855 00000 п.
0000098016 00000 п.
0000098115 00000 п.
0000098251 00000 п.
0000098399 00000 п.
0000098504 00000 п.
0000098606 00000 п.
0000098722 00000 п.
0000098848 00000 п.
0000002996 00000 н.
трейлер
] >>
startxref
0
%% EOF
658 0 obj> поток
x ڬ TILSQSVPEBET-AZҠ!? qcZZɁHB5WhvpDb \ Hԅ & `BL ~ 7m = sZ
Оксид железа — wikidoc
- Эта страница посвящена оксиду железа красного цвета.Для использования в других целях, см красное железо.
Шаблон: Chembox new
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]
Обзор
Оксид железа (III) или Оксид железа представляет собой неорганическое соединение с формулой Fe 2 O 3 . Это один из трех основных оксидов железа, два других — оксид железа (II) (FeO), который встречается редко, и оксид железа (II, III) (Fe 3 O 4 ), который также встречается. естественно, как минерал магнетит.Минерал, известный как гематит, Fe 2 O 3 является основным источником железа для сталелитейной промышленности. Fe 2 O 3 является ферромагнитным, темно-красным и легко разрушается кислотами. Оксид железа (III) часто называют ржавчиной, и в некоторой степени этот ярлык полезен, поскольку ржавчина имеет несколько общих свойств и имеет схожий состав. Для химика ржавчина считается плохо определенным материалом, описываемым как гидратированный оксид железа .
Это один из трех основных оксидов железа, два других — оксид железа (II) (FeO), который встречается редко, и оксид железа (II, III) (Fe 3 O 4 ), который также встречается. естественно, как минерал магнетит.Минерал, известный как гематит, Fe 2 O 3 является основным источником железа для сталелитейной промышленности. Fe 2 O 3 является ферромагнитным, темно-красным и легко разрушается кислотами. Оксид железа (III) часто называют ржавчиной, и в некоторой степени этот ярлык полезен, поскольку ржавчина имеет несколько общих свойств и имеет схожий состав. Для химика ржавчина считается плохо определенным материалом, описываемым как гидратированный оксид железа .
Строение
Fe 2 O 3 может быть получен в различных полиморфных модификациях.В основных из них, α и γ, железо имеет октаэдрическую координационную геометрию. То есть каждый Fe-центр связан с шестью кислородными лигандами.
Альфа-фаза
α-Fe 2 O 3 имеет ромбоэдрическую корундовую (α-Al 2 O 3 ) структуру и является наиболее распространенной формой. Он встречается в природе в виде минерала гематита, который добывается как основная железная руда. Он является антиферромагнитным ниже ~ 260 К (температура перехода Морина) и проявляет слабый ферромагнетизм между 260 К и температурой Нееля 950 К. [1] Легко приготовить, используя как термическое разложение, так и осаждение в жидкой фазе. Его магнитные свойства зависят от многих факторов, например давление, размер частиц и напряженность магнитного поля.
Гамма-фаза
γ-Fe 2 O 3 имеет кубическую структуру. Он метастабилен и превращается из альфа-фазы при высоких температурах. Он встречается в природе в виде минерала маггемита. Он ферромагнитен и находит применение в записывающих лентах, [2] , хотя сверхмелкозернистые частицы размером менее 10 нанометров являются суперпарамагнитными. Его можно получить термической дегидратацией гамма-оксида-гидроксида железа (III), осторожным окислением оксида железа (II, III). Другой метод включает осторожное окисление Fe 3 O 4 . [2] Ультратонкие частицы могут быть получены термическим разложением оксалата железа (III).
Его можно получить термической дегидратацией гамма-оксида-гидроксида железа (III), осторожным окислением оксида железа (II, III). Другой метод включает осторожное окисление Fe 3 O 4 . [2] Ультратонкие частицы могут быть получены термическим разложением оксалата железа (III).
Остальные фазы
Было идентифицировано или заявлено несколько других фаз. Β-фаза является кубически объемноцентрированной (пространственная группа Ia3), метастабильной и при температурах выше 500 (930) превращается в альфа-фазу.Его можно получить восстановлением гематита углеродом, пиролизом раствора хлорида железа (III) или термическим разложением сульфата железа (III). Эпсилон-фаза является ромбической и показывает свойства, промежуточные между альфа- и гамма-характеристиками, и может иметь полезные магнитные свойства. Подготовка чистой эпсилон-фазы оказалась очень сложной задачей из-за загрязнения альфа- и гамма-фазами. Материал с высокой долей эпсилон-фазы может быть получен термическим преобразованием гамма-фазы. Эта фаза также является метастабильной, переходя в альфа-фазу между 500 ( Ошибка выражения: Неожиданный оператор округления. ). Также может быть получен окислением железа в электрической дуге или золь-гель осаждением из нитрата железа (III). [необходима ссылка ] Кроме того, при высоком давлении заявлена аморфная форма. [3] Недавнее исследование выявило эпсилон-оксид железа (III) в древней китайской керамической глазури Цзянь, что может дать представление о способах получения этой формы в лаборатории. [4]
Эта фаза также является метастабильной, переходя в альфа-фазу между 500 ( Ошибка выражения: Неожиданный оператор округления. ). Также может быть получен окислением железа в электрической дуге или золь-гель осаждением из нитрата железа (III). [необходима ссылка ] Кроме того, при высоком давлении заявлена аморфная форма. [3] Недавнее исследование выявило эпсилон-оксид железа (III) в древней китайской керамической глазури Цзянь, что может дать представление о способах получения этой формы в лаборатории. [4]
Гидратированные оксиды железа (III)
Существует несколько гидратов оксида железа (III).
При добавлении щелочи к растворам растворимых солей Fe (III) образуется желатиновый осадок красно-коричневого цвета. Это не Fe (OH) 3 , а Fe 2 O 3 · H 2 O (также обозначаемый как Fe (O) OH).
Также существует несколько форм гидратированного оксида Fe (III). Красный лепидокрокит , γ-Fe (O) OH, встречается снаружи рустиклеров, а оранжевый гетит , который встречается внутри рустиклеров. Когда Fe 2 O 3 · H 2 O нагревается, он теряет гидратную воду. Дальнейшее нагревание при 1670 K превращает Fe 2 O 3 в черный Fe 3 O 4 (Fe II Fe III 2 O 4 ), который известен как минерал магнетит. .
Fe (O) OH растворим в кислотах, давая [Fe (OH 2 ) 6 ] 3+ . В концентрированной водной щелочи Fe 2 O 3 дает [Fe (OH) 6 ] 3- . [2]
Когда Fe 2 O 3 · H 2 O нагревается, он теряет гидратную воду. Дальнейшее нагревание при 1670 K превращает Fe 2 O 3 в черный Fe 3 O 4 (Fe II Fe III 2 O 4 ), который известен как минерал магнетит. .
Fe (O) OH растворим в кислотах, давая [Fe (OH 2 ) 6 ] 3+ . В концентрированной водной щелочи Fe 2 O 3 дает [Fe (OH) 6 ] 3- . [2]
Реакция
Наиболее важной реакцией является его карботермическое восстановление, в результате которого получают железо, используемое в сталеплавильном производстве:
- Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2
Другой окислительно-восстановительной реакцией является чрезвычайно экзотермическая реакция термитов с алюминием. [5]
- 2 Al + Fe 2 O 3 → 2 Fe + Al 2 O 3
Этот процесс используется для сварки толстых металлов, таких как рельсы железнодорожных путей, с использованием керамического контейнера для воронки расплавленное железо между двумя секциями рельса. Термит также используется в оружии и создании небольших чугунных скульптур и инструментов.
Термит также используется в оружии и создании небольших чугунных скульптур и инструментов.
Частичное восстановление водородом при температуре около 400 ° C дает магнетит, черный магнитный материал, содержащий как Fe (III), так и Fe (II): [6]
- 3 Fe 2 O 3 + H 2 → 2 Fe 3 O 4 + H 2 O
Оксид железа (III) не растворяется в воде, но легко растворяется в сильной кислоте , например соляная и серная кислоты.Он также хорошо растворяется в растворах хелатирующих агентов, таких как ЭДТА и щавелевая кислота.
При нагревании оксидов железа (III) с оксидами или карбонатами других металлов получаются материалы, известные как ферраты: [6]
- ZnO + Fe 2 O 3 → Zn (FeO 2 ) 2
Препарат
Оксид железа (III) — продукт окисления железа. Его можно приготовить в лаборатории путем электролиза раствора бикарбоната натрия, инертного электролита, с железным анодом:
- 4 Fe + 3 O 2 + 2 H 2 O → 4 FeO (OH)
Полученный гидратированный оксид железа (III), обозначенный здесь как Fe (O) OH, дегидратируется при температуре около 200 ° C. [6] [7]
[6] [7]
- 2 FeO (OH) → Fe 2 O 3 + H 2 O
Его также можно получить термическим разложением гидроксида железа (III) при температуре выше 200 ° C.
- 2 Fe (OH) 3 → Fe 2 O 3 + 3H 2 O
Использует
Металлургическая промышленность
Оксид железа (III) в подавляющем большинстве случаев используется в качестве сырья для сталелитейной и черной металлургии, например.г. производство чугуна, стали и многих сплавов. [7]
Полировка
Очень тонкий порошок оксида железа, известный как «ювелирные румяна», «красные румяна» или просто румяна. Его используют для окончательной полировки металлических украшений и линз, а также исторически в качестве косметического средства. Rouge режет медленнее, чем некоторые современные полироли, такие как оксид церия (IV), но до сих пор используется в производстве оптики и ювелирами для достижения превосходного качества отделки. При полировке золота румяна слегка окрашивают золото, что способствует внешнему виду готового изделия.Румяна продается в виде порошка, пасты, насыпанной на ткань для полировки или твердого стержня (с восковым или жирным связующим). Другие полировальные составы также часто называют «румянами», даже если они не содержат оксида железа. Ювелиры удаляют остатки румян с ювелирных изделий с помощью ультразвуковой чистки. Продукты, продаваемые как «стреппинг», часто наносятся на кожаный ремешок, чтобы сделать лезвие бритвы острым на ножах, опасных бритвах или любом другом инструменте с острыми кромками.
При полировке золота румяна слегка окрашивают золото, что способствует внешнему виду готового изделия.Румяна продается в виде порошка, пасты, насыпанной на ткань для полировки или твердого стержня (с восковым или жирным связующим). Другие полировальные составы также часто называют «румянами», даже если они не содержат оксида железа. Ювелиры удаляют остатки румян с ювелирных изделий с помощью ультразвуковой чистки. Продукты, продаваемые как «стреппинг», часто наносятся на кожаный ремешок, чтобы сделать лезвие бритвы острым на ножах, опасных бритвах или любом другом инструменте с острыми кромками.
Пигмент
Два разных цвета в разной гидратной фазе (α = красный, β = желтый) гидрата оксида железа (III) [8] , и они полезны в качестве пигмента. Оксид железа (III) также используется в качестве пигмента под названиями «Коричневый пигмент 6», «Коричневый пигмент 7» и «Красный пигмент 101». [9] Некоторые из них, например Pigment Red 101 и Pigment Brown 6 одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для использования в косметике. Оксиды железа используются в качестве пигментов в стоматологических композитах наряду с оксидами титана. [10]
Оксиды железа используются в качестве пигментов в стоматологических композитах наряду с оксидами титана. [10]
Гематит является характерным компонентом шведской краски цвета Falu red.
Магнитная запись
Оксид железа (III) был наиболее распространенной магнитной частицей, используемой во всех типах магнитных запоминающих устройств и носителей записи, включая магнитные диски (для хранения данных) и магнитную ленту (используемую в аудио- и видеозаписи, а также для хранения данных).Однако современные магнитные носители информации — в частности, жесткие диски — используют более совершенную технологию тонких пленок, которая может состоять из стопки из 15 или более слоев. [11]
Фотокатализатор
α-Fe 2 O 3 изучается как фотоанод для реакции расщепления воды более 25 лет. [12]
Медицина
Смесь оксида цинка с примерно 0,5% оксида железа (III) называется каламином, который является активным ингредиентом лосьона каламина.
См. Также
Список литературы
- ↑ Гридон, Дж. Э. (1994). «Магнитные оксиды». У Кинга, Р. Брюса. Энциклопедия неорганической химии . Нью-Йорк: Джон Вили и сыновья. ISBN 0-471-93620-0.
- ↑ 2,0 2,1 2,2 . Housecroft, Catherine E .; Шарп, Алан Г. (2008). «Глава 22: d -блочная химия металлов: элементы первого ряда». Неорганическая химия, 3-е издание .Пирсон. п. 716. ISBN 978-0-13-175553-6.
- ↑ Вуйтек, Милан; Зборил, Радек; Кубинек, Роман; Машлан, Мирослав. «Ультратонкие частицы оксидов железа (III) с точки зрения АСМ — новый путь изучения полиморфизма в наномире» (PDF). http://atmilab.upol.cz . Чешский язык. Проверено 12 июля 2014.
- ↑ {{Уроки прошлого: Редкий ε-Fe2O3 в древних изделиях Цзянь (Тэнмоку) с черной глазурью Кэтрин Деджуа, Филипп Шау, Вейдун Ли, Лор Ноэ, Апурва Мехта, Кай Чен, Хунцзе Луо, Мартин Кунц, Нобумичи Тамура & Чжи Лю Научные отчеты 4, Номер статьи: 4941 doi: 10.
 1038 / srep04941 Получено 20 февраля 2014 г. Принято 15 апреля 2014 г. Опубликовано 13 мая 2014 г.}}
1038 / srep04941 Получено 20 февраля 2014 г. Принято 15 апреля 2014 г. Опубликовано 13 мая 2014 г.}} - ↑ Адлам; Прайс (1945 г.). Свидетельство о высшем образовании по неорганической химии . Лесли Слейтер Прайс.
- ↑ 6,0 6,1 6,2 Справочник препаративной неорганической химии, 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, NY. Vol. 1. п. 1661.
- ↑ 7,0 7,1 Greenwood, N. N .; Эрншоу, А. (1997). Химия элемента (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- ↑
- ↑ Краски и покрытия поверхностей: теория и практика . ISBN William Andrew Inc. 1-884207-73-1.
- ↑ Банерджи, Авиджит (2011). Пикард Руководство по оперативной стоматологии . США: Oxford University Press Inc., Нью-Йорк. п. 89. ISBN 978-0-19-957915-0.
- ↑ С. Piramanayagam, J. Appl.Phys.
 102, 011301 (2007).
102, 011301 (2007). - ↑ Кей, А., Сезар, И. и Гратцель, М., Журнал Американского химического общества 2006 , 128 , 15714-15721
Внешние ссылки
Шаблон: Соединения железа Шаблон: Оксиды
Восстановление и одновременное удаление 99Tc и Cr с помощью преобразования минералов Fe (OH) 2 (s).
Abstract Технеций (Tc) остается приоритетной задачей восстановления из-за постоянных проблем, включая мобилизацию из-за быстрого повторного окисления иммобилизованного Tc и конкурирующих смешанных загрязнителей, например.g., Cr (VI), которые ингибируют восстановление и включение Tc (VII) в стабильные минеральные фазы. Здесь Fe (OH) 2 (s) исследуется как комплексное решение для преодоления этих проблем, выступая как восстановитель (Fe (II)), так и иммобилизирующий агент для образования магнетита с включенным Tc (Fe 3 О 4 ). Анализ следов металлов предполагает, что удаление Tc (VII) и Cr (VI) из раствора происходит одновременно; однако полное удаление и восстановление Cr (VI) достигается раньше, чем удаление / восстановление смешанного Tc (VII). Объемный анализ степени окисления конечной твердой фазы магнетита с помощью XANES показывает, что большая часть Tc составляет Tc (IV), что подтверждается измерениями XPS. Кроме того, результаты EXAFS показывают успешное, хотя и частичное, включение Tc (IV) в октаэдрические позиции магнетита. Анализ Cr XPS показывает восстановление до Cr (III) и образование шпинели с включением Cr, фаз Cr 2 O 3 и Cr (OH) 3 . Шпинель (смоделированная как Fe 3 O 4 ), гетит (α-FeOOH) и фероксигит (δ-FeOOH) обнаруживаются во всех прореагировавших конечных образцах твердой фазы, проанализированных с помощью XRD.Включение Tc (IV) мало влияет на структуру решетки шпинели. Реакция Fe (OH) 2 (s) в присутствии Cr (III) приводит к образованию фазы шпинели, которая представляет собой твердый раствор между магнетитом (Fe 3 O 4 ) и хромитом (FeCr 2 О 4 ).
Объемный анализ степени окисления конечной твердой фазы магнетита с помощью XANES показывает, что большая часть Tc составляет Tc (IV), что подтверждается измерениями XPS. Кроме того, результаты EXAFS показывают успешное, хотя и частичное, включение Tc (IV) в октаэдрические позиции магнетита. Анализ Cr XPS показывает восстановление до Cr (III) и образование шпинели с включением Cr, фаз Cr 2 O 3 и Cr (OH) 3 . Шпинель (смоделированная как Fe 3 O 4 ), гетит (α-FeOOH) и фероксигит (δ-FeOOH) обнаруживаются во всех прореагировавших конечных образцах твердой фазы, проанализированных с помощью XRD.Включение Tc (IV) мало влияет на структуру решетки шпинели. Реакция Fe (OH) 2 (s) в присутствии Cr (III) приводит к образованию фазы шпинели, которая представляет собой твердый раствор между магнетитом (Fe 3 O 4 ) и хромитом (FeCr 2 О 4 ).
Загрузить PDF для просмотраПросмотреть больше
pdf?t=oyolpu» type=»application/pdf»/>Дополнительная информация Меньше информации
Закрывать
Введите пароль, чтобы открыть этот PDF-файл:
Отмена В ПОРЯДКЕ
Подготовка документа к печати…
Отмена
.

 Сначала образуется соль железа, которая при реакции с образовавшимся гидроксидом натрия даёт гидроксид железа. Чтобы получить двухвалентный гидроксид нужно вести электролиз при большой плотности тока. Реакция в общем виде:
Сначала образуется соль железа, которая при реакции с образовавшимся гидроксидом натрия даёт гидроксид железа. Чтобы получить двухвалентный гидроксид нужно вести электролиз при большой плотности тока. Реакция в общем виде:
 Также восстановительными свойствами обладают и соли железа (II).
Также восстановительными свойствами обладают и соли железа (II). Гидроксид железа (II) Fe(OH)2 — серо-зеленого цвета, гидроксид железа (III) Fe(OH)3 — бурый.
Гидроксид железа (II) Fe(OH)2 — серо-зеленого цвета, гидроксид железа (III) Fe(OH)3 — бурый.  867 г / моль
867 г / моль


 1038 / srep04941 Получено 20 февраля 2014 г. Принято 15 апреля 2014 г. Опубликовано 13 мая 2014 г.}}
1038 / srep04941 Получено 20 февраля 2014 г. Принято 15 апреля 2014 г. Опубликовано 13 мая 2014 г.}} 102, 011301 (2007).
102, 011301 (2007).