| 1. | Дополни предложения | 1 вид — рецептивный | лёгкое | 1 Б. | Требуется определить, является явление физическим или химическим. |
| 2. | Физические явления | 1 вид — рецептивный | лёгкое |
1 Б.
|
Требуется выбрать явления, которые относятся к физическим. |
| 3. | Явления, происходящие с веществами | 2 вид — интерпретация | среднее | 2 Б. | Требуется выбрать процесс, который не является химической реакцией. |
4.
|
Изменения веществ при физических и химических явлениях | 2 вид — интерпретация | среднее | 3 Б. | Надо выбрать неверное утверждение о физических и химических явлениях, а также определить по схеме, какое явление она отображает. |
| 5. | Соответствие: явление — характеристика | 3 вид — анализ | сложное |
3 Б.
|
Надо установить соответствие между типом явления и его характеристиками. |
| 6. | Схема химической реакции | 3 вид — анализ | сложное | 4 Б. | Требуется составить схему химической реакции по её описанию. |
04. Химические и физические явления
Изменения веществ, которые не ведут к образованию новых веществ (с иными свойствами), называют физическими явлениями.
1. Вода при нагревании может переходить в пар, а при охлаждении –
2. Длина медных проводов изменяется летом и зимой: увеличивается при нагревании и уменьшается при охлаждении.
3. Объем воздуха в шаре увеличивается в теплом помещении.
Изменения с веществами произошли, но при этом вода осталась водой, медь – медью, воздух – воздухом.
Новых веществ, несмотря на их изменения по форме или агрегатному состоянию, не образовалось.
Опыт1. Закроем пробирку пробкой со вставленной в нее трубкой
2. Опустим конец трубки в стакан с водой. Рукой нагреем пробирку. Объем воздуха в ней увеличивается, и часть воздуха из пробирки выходит в стакан с водой (выделяются пузырьки воздуха).
3. При охлаждении пробирки объем воздуха уменьшается, и вода входит в пробирку.
Вывод. Изменения объема воздуха – физическое явление.
Задания
Приведи 1–2 примера происходящих с веществами изменений, которые можно назвать физическим явлением.
Химическое явление (реакция) – явление, при котором образуются новые вещества.
А по каким признакам можно определить, что произошла химическая реакция? При некоторых химических реакциях происходит выпадение осадка. Другие признаки – изменение цвета исходного вещества, изменение его вкуса, выделение газа, выделение или поглощение тепла и света.
Примеры таких реакций рассмотри в таблице
Признаки химических реакций | ||||
Изменение цвета исходного вещества | Изменение вкуса исходного вещества | Выпадение осадка | Выделение газа | Появление запаха |
Реакция | |
Изменение цвета | |
Изменение вкуса | |
Выделение газа |
В живой и неживой природе постоянно протекают различные химические реакции. Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Наш с вами организм тоже настоящая фабрика химических превращений одних веществ в другие.
Понаблюдаем за некоторыми химическими реакциями.
Опыты с огнем самостоятельно проводить нельзя!!!
Опыт 1
Подержим над огнем кусочек белого хлеба, содержащего органические вещества.
Наблюдаем:
1. обугливание, то есть изменение цвета;
2. появление запаха.
Вывод. Произошло химическое явление (образовалось новое вещество — уголь)
Опыт 2
Приготовим стаканчик с крахмалом. Добавим немного воды, перемешаем. Затем капнем раствором йода.
Наблюдаем признак реакции: изменение цвета (посинение крахмала)
Вывод. Произошла химическая реакция. Крахмал превратился в другое вещество.
Опыт 3
1. Разведем в стакане небольшое количество питьевой соды.
2. Добавим туда несколько капель уксуса (можно взять сок лимона или раствор лимонной кислоты).
Наблюдаем выделение пузырьков газа.
|
Вывод. Выделение газа – один из признаков химической реакции.
Некоторые химические реакции сопровождаются выделением тепла.
Задания
Поместите в стеклянную баночку (или стакан) несколько кусочков сырого картофеля. Добавьте к ним перекись водорода из домашней аптечки. Объясните, по какому признаку можно определить, что произошла химическая реакция.
«Физические и химические явления (химические реакции). Примеры химических и физических явлений в природе
Ручаюсь, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Ну ладно, если мама не любит серебро, а в походы вы не никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Химическое явление происходит тогда, когда одни вещества превращаются в другие: у новых веществ другой состав и новые свойства. Если припомнить еще и физику, то запомните, что химические явления происходят на молекулярном и атомарном уровне, но не затрагивают состав ядер атомов.
С точки же зрения химии это не что иное, как химическая реакция. А для каждой химической реакции обязательно возможно выделить характерные признаки:
- в ходе реакции может выпасть осадок;
- может измениться цвет вещества;
- следствием протекания реакции может стать выделение газа;
- может быть выделена либо поглощена теплота;
- также реакция может сопровождаться выделением света.
Также давно определен список необходимых для протекания химической реакции условий:
- контакт: чтобы реагировать, вещества должны соприкасаться.
- измельчение: для успешного протекания реакции, вступающие в нее вещества должны быть как можно мельче измельчены, идеальный вариант – растворены;
- температура: очень многие реакции напрямую зависят от температуры веществ (чаще всего их требуется нагреть, но некоторые наоборот – охладить до определенной температуры).

Записывая буквами и цифрами уравнение химической реакции, вы тем самым описываете суть химического явления. А закон сохранения массы – одно и самых главных правил при составлении таких описаний.
Химические явления в природе
Вы, конечно, понимаете, что химия происходит не только в пробирках в школьной лаборатории. Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
Итак, первым делом поговорим про фотосинтез . Это процесс, во время которого растения поглощают углекислый газ из атмосферы и под воздействием солнечного света вырабатывают кислород. Этим кислородом мы и дышим.
Вообще фотосинтез протекает в две фазы, и освещение нужно только для одной. Ученые проводили различные опыты и выяснили, что фотосинтез протекает даже при слабом освещении. Но с увеличением количества света процесс значительно ускоряется. Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
В процессе фотосинтеза задействованы фотоны, которые излучает солнце, и специальные пигментные молекулы растений – хлорофилл. В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
С точки зрения химии при фотосинтезе происходит цепочка преобразований, результатом которой является кислород, вода и углеводы в качестве запаса энергии.
Первоначально считалось, что кислород образуется в результате расщепления углекислого газа. Однако позже Корнелиус Ван Ниль выяснил, что кислород образуется в результате фотолиза воды. Позднейшие исследования подтвердили эту гипотезу.
Описать суть фотосинтеза можно с помощью вот такого уравнения: 6СО 2 + 12Н 2 О + свет = С 6 Н 12 О 6 + 6О 2 + 6Н 2 О.
Дыхание , наше с вами в том числе, – это тоже химическое явление. Мы вдыхаем выработанный растениями кислород, а выдыхаем углекислый газ.
Но не только углекислый газ образуется в результате дыхания. Главное в этом процессе то, что благодаря дыханию выделяется большое количество энергии, и этот способ ее получения очень эффективен.
Кроме того, промежуточным итогом разных этапов дыхания является большое число различных соединений. А те в свою очередь служат основой для синтеза аминокислот, белков, витаминов, жиров и жирных кислот.
Процесс дыхания сложный и разбит на несколько этапов. На каждом из которых в ход идет большое количество ферментов, выполняющих роль катализаторов. Схема химических реакций дыхания практически одинаковая у животных, растений и даже бактерий.
С точки зрения химии дыхание – это процесс окисления углеводов (как вариант: белков, жиров) с помощью кислорода, в результате реакции получаются вода, углекислый газ и энергия, которую клетки запасают в АТФ: С 6 Н 12 О 6 + 6О 2 = СО 2 + 6Н 2 О + 2,87 * 10 6 Дж.
Кстати, мы говорили выше, что химические реакции могут сопровождаться излучением света. В случае с дыханием и сопутствующими ему химическими реакциями это тоже верно. Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
Горят, конечно, не только твердые вещества, просто с их помощью было удобнее привести пример в данном случае.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
Схематически реакцию можно записать так: вещество + О 2 → оксиды + энергия.
Как природное химическое явление рассматриваем мы и гниение .
По сути, это тот же процесс, что и горение, только протекает он гораздо медленней. Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.
Если снова обратимся к нашему списку признаков химической реакции, то многие из них обнаружим и в этом случае. В частности, имеется исходное вещество, реагент, продукты реакции. Из характерных признаков отметим выделение теплоты, газов (сильнопахнущих), изменение цвета.
Для круговорота веществ в природе гниение имеет очень большое значение: позволяет перерабатывать белки погибших организмов в соединения, пригодные к усвоению растениями. И круг начинается сначала.
И круг начинается сначала.
Уверена, вы замечали, как летом легко дышится после грозы. И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
Озон (О 3) в чистом виде представляет собой газ синего цвета. В природе наибольшая концентрация озона – в верхних слоях атмосферы. Там он выполняет роль щита нашей планеты. Который защищает ее от солнечной радиации из космоса и не дает Земле остывать, поскольку поглощает и ее инфракрасное излучение.
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца (3О 2 + УФ свет → 2О 3). А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О 3 .
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.
Кстати, дезинфицирующие свойства полученного лабораторным путем озона широко используются для озонирования воды, предохранения продуктов от порчи, в медицине и косметологии.
Разумеется, это далеко не полный список удивительных химических явлений в природе, которые делают жизнь на планете такой разнообразной и прекрасной. Вы сможете узнать о них больше, если будете внимательно смотреть по сторонам и держать уши открытыми. Вокруг полно удивительных явлений, которые только и ждут, чтобы вы ими заинтересовались.
Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне: например, заваривание чая. Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Если в этот же чай насыпать сахар, в результате химической реакции получится раствор, который снова будет обладать набором новых характеристик. В первую очередь, новым, сладким, вкусом.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе .
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот – коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: C n H 2n+2 + (1,5 n +0,5) O 2 = nCO 2 + (n +1) H 2 O . В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).
Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) – тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe 2 O 3 (точнее, Fe 2 O 3 * H 2 O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O 2 + H 2 O + CO 2 = Cu 2 CO 5 H 2 (или CuCO 3 * Cu(OH) 2). Полученный в итоге основной карбонат меди встречается и в природе – в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях – это образование темного налета сульфида серебра Ag 2 S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H 2 S + O 2 = 2Ag 2 S + 2H 2 O.
Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H 2 S + O 2 = 2Ag 2 S + 2H 2 O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО 3 и Mg СО 3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом .
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO 3 + C H 3 COOH = CH 3 COONa + H 2 O + CO 2 . Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно – она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта – это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить. К ним относится и горение воды . Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды – это химическое явление , при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва. Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО 3 . Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку – их называют сталагмиты . А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты .
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Динамические изменения встроены в саму природу. Все меняется так или иначе каждый момент. Если вы внимательно осмотритесь, вы найдете сотни примеров физических и химических явлений, которые являются вполне себе естественными преобразованиями.
Изменения — единственная константа во Вселенной
Как ни странно, изменение является единственной константой в нашей Вселенной. Чтобы понять физические и химические явления (примеры в природе встречаются на каждом шагу), принято классифицировать их по типам, в зависимости от характера конечного результата, вызванного ими. Различают физические, химические и смешанные изменения, которые содержат в себе и первые, и вторые.
Физические и химические явления: примеры и значение
Что такое физическое явление? Любые изменения, происходящие в веществе без изменения его химического состава, являются физическими. Они характеризуется изменениями физических атрибутов и материального состояния (твердое, жидкое или газообразное), плотности, температуры, объема, которые происходят без изменения его фундаментальной химической структуры. Не происходит создание новых химических продуктов или изменения общей массы. Кроме того, этот тип изменений обычно является временным и в некоторых случаях полностью обратимым.
Когда вы смешиваете химикаты в лаборатории, можно легко увидеть реакцию, но в мире вокруг вас происходит множество химических реакций каждый день. Химическая реакция изменяет молекулы, в то время как физическое изменение только перестраивает их. Например, если мы возьмем газ хлора и металлический натрий и объединим их, мы получим столовую соль. Полученное вещество сильно отличается от любого из его составных частей. Это химическая реакция. Если затем растворить эту соль в воде, мы просто смешиваем молекулы соли с молекулами воды. В этих частицах нет изменений, это физическое преобразование.
Примеры физических изменений
Все состоит из атомов. При соединении атомов образуются разные молекулы. Различные свойства, которые наследуют объекты, являются следствием различных молекулярных или атомных структур. Основные свойства объекта зависят от их молекулярного расположения. Физические изменения происходят без изменения молекулярной или атомной структуры объектов. Они просто преобразуют состояние объекта, не изменяя его природы. Плавление, конденсация, изменение объема и испарения являются примерами физических явлений.
Плавление, конденсация, изменение объема и испарения являются примерами физических явлений.
Дополнительные примеры физических изменений: металл, расширяющийся при нагревании, передача звука через воздух, замерзание воды зимой в лед, медь втягивается в провода, формирование глины на разных объектах, мороженое плавится до жидкости, нагревание металла и преобразование его в другую форму, сублимация йода при нагревании, падение любого объекта под действием силы тяжести, чернила поглощаются мелом, намагничивание железных гвоздей, снеговик, тающий на солнце, светящиеся лампы накаливания, магнитная левитация объекта.
Как различать физические и химические изменения?
Множество примеров химических явлений и физических можно встретить в жизни. Часто трудно определить разницу между ними, особенно когда оба могут происходить одновременно. Чтобы определить физические изменения, задайте следующие вопросы:
- Является ли состояние состояния объекта изменением (газообразным, твердым и жидким)?
- Является ли изменение чисто ограниченным физическим параметром или характеристикой, такой как плотность, форма, температура или объем?
- Является ли химическая природа объекта изменением?
- Возникают ли химические реакции, приводящие к созданию новых продуктов?
Если ответ на один из первых двух вопросов да, и ответы на последующие вопросы отсутствуют, это, скорее всего, это физическое явление. И наоборот, если ответ на любой из двух последних вопросов положительный, в то время как первые два отрицательные, это, безусловно, химическое явление. Трюк состоит в том, чтобы просто четко наблюдать и анализировать то, что вы видите.
И наоборот, если ответ на любой из двух последних вопросов положительный, в то время как первые два отрицательные, это, безусловно, химическое явление. Трюк состоит в том, чтобы просто четко наблюдать и анализировать то, что вы видите.
Примеры химических реакций в повседневной жизни
Химия происходит в окружающем вас мире, а не только в лаборатории. Материя взаимодействует для образования новых продуктов посредством процесса, называемого химической реакцией или химическим изменением. Каждый раз, когда вы готовите или убираете, это химия в действии. Ваше тело живет и растет благодаря химическим реакциям. Есть реакции, когда вы принимаете лекарства, зажигаете спичку и вздыхаете. Вот 10 химических реакций в повседневной жизни. Это всего лишь небольшая выборка из тех примеров физических и химических явлений в жизни, которые вы видите и испытываете много раз каждый день:
- Фотосинтез. Хлорофилл в листьях растений превращает углекислый газ и воду в глюкозу и кислород.
 Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.
Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород. - Аэробное клеточное дыхание является реакцией с кислородом в человеческих клетках. Аэробное клеточное дыхание является противоположным процессом фотосинтеза. Разница заключается в том, что молекулы энергии объединяются с кислородом, которым мы дышим, чтобы высвободить энергию, необходимую нашим клеткам, а также углекислый газ и воду. Энергия, используемая клетками, представляет собой химическую энергию в виде АТФ.
- Анаэробное дыхание. Анаэробное дыхание производит вино и другие ферментированные продукты. Ваши мышечные клетки выполняют анаэробное дыхание, когда вы исчерпываете подаваемый кислород, например, при интенсивном или продолжительном упражнении. Анаэробное дыхание дрожжами и бактериями используется для ферментации для производства этанола, углекислого газа и других химических веществ, которые производят сыр, вино, пиво, йогурт, хлеб и многие другие распространенные продукты.

- Сгорание — это тип химической реакции. Это химическая реакция в повседневной жизни. Каждый раз, когда вы зажигаете спичку или свечу, разжигаете костер, вы видите реакцию горения. Сжигание объединяет энергетические молекулы с кислородом для получения двуокиси углерода и воды.
- Ржавчина — общая химическая реакция. Со временем железо развивает красное, шелушащееся покрытие, называемое ржавчиной. Это пример реакции окисления. Другие повседневные примеры включают формирование вердигров на меди и потускнение серебра.
- Смешивание химических веществ вызывает химические реакции. Пекарский порошок и пищевая сода выполняют аналогичные функции при выпечке, но они по-разному реагируют на другие ингредиенты, поэтому вы не всегда можете заменить их на другой. Если вы комбинируете уксус и пищевую соду для химического «вулкана» или молока с порошком для выпечки в рецепте, вы испытываете реакцию двойного смещения или метатезиса (плюс некоторые другие). Ингредиенты рекомбинируют для получения газообразного диоксида углерода и воды.
 Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов.
Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов. - Батареи являются примерами электрохимии. Батареи используют электрохимические или окислительно-восстановительные реакции для превращения химической энергии в электрическую.
- Пищеварение. Тысячи химических реакций происходят во время пищеварения. Как только вы положите пищу в рот, фермент в вашей слюне, называемый амилазой, начинает разрушать сахара и другие углеводы в более простые формы, которые ваше тело может поглощать. Соляная кислота в вашем желудке реагирует с пищей, чтобы ее разрушить, а ферменты расщепляют белки и жиры, чтобы они могли всасываться в кровь через стенки кишечника.
- Кислотно-базовые реакции. Всякий раз, когда вы смешиваете кислоту (например, уксус, лимонный сок, серную кислоту, соляную кислоту) со щелочью (например, пищевой содой, мылом, аммиаком, ацетоном), вы выполняете кислотно-щелочную реакцию.
 Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O.
Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O. - Мыло и моющие средства. Их очищают путем химических реакций. Мыло эмульгирует грязь, что означает, что масляные пятна связываются с мылом, чтобы их можно было снять водой. Моющие средства снижают поверхностное натяжение воды, поэтому они могут взаимодействовать с маслами, изолировать их и смывать.
- Химические реакции при приготовлении пищи. Кулинария — один большой практический эксперимент по химии. Приготовление использует тепло, чтобы вызвать химические изменения в пище. Например, когда вы сильно кипятите яйцо, сероводород, полученный нагреванием яичного белка, может реагировать с железом из яичного желтка, образуя серо-зеленое кольцо вокруг желтка. Когда вы готовите мясо или выпечку, реакция Майяра между аминокислотами и сахарами дает коричневый цвет и желательный вкус.

Другие примеры химических и физических явлений
Физические свойства описывают характеристики, которые не изменяют вещество. Например, вы можете изменить цвет бумаги, но это еще бумага. Вы можете кипятить воду, но когда вы собираете и конденсируете пар, это все еще вода. Вы можете определить массу листа бумаги, и это все еще бумага.
Химическими свойствами являются те, которые показывают, как вещество реагирует или не реагирует с другими веществами. Когда металлический натрий помещают в воду, он реагирует бурно, образуя гидроксид натрия и водород. Достаточное тепло выделяется тем, что водород вырывается в пламя, реагируя с кислородом в воздухе. С другой стороны, когда вы кладете кусок медного металла в воду, реакция не возникает. Таким образом, химическое свойство натрия заключается в том, что он реагирует с водой, а химическое свойство меди заключается в том, что это не так.
Какие еще можно привести примеры химических явлений и физических? Химические реакции всегда происходят между электронами в валентных оболочках атомов элементов в периодической таблице. Физические явления на низких энергетических уровнях просто включают механические взаимодействия — случайные столкновения атомов без химических реакций, таких как атомы или молекулы газа. Когда энергии столкновений очень велики, целостность ядра атомов нарушается, что приводит к делению или слиянию вовлеченных видов. Спонтанный радиоактивный распад обычно считается физическим явлением.
Физические явления на низких энергетических уровнях просто включают механические взаимодействия — случайные столкновения атомов без химических реакций, таких как атомы или молекулы газа. Когда энергии столкновений очень велики, целостность ядра атомов нарушается, что приводит к делению или слиянию вовлеченных видов. Спонтанный радиоактивный распад обычно считается физическим явлением.
С давних времен люди собирали сведения о том мире, в котором они живут. Была лишь одна наука, объединяющая всю информацию о природе, которую человечество накопило на тот момент. Тогда еще люди не знали, что они наблюдают примеры физических явлений. В настоящее время такая наука носит название «естествознание».
Что изучает физическая наука
Со временем научные представления об окружающем мире заметно изменились — их стало гораздо больше. Естествознание раскололось на много отдельных наук, среди которых: биология, химия, астрономия, география и другие. В ряде этих наук не последнее место занимает физика. Открытия и достижения в этой области позволили человечеству обладать новыми знаниями. К ним можно отнести структуру и поведение различных объектов всяких размеров (начиная с гигантских звезд и заканчивая мельчайшими частицами — атомами и молекулами).
Открытия и достижения в этой области позволили человечеству обладать новыми знаниями. К ним можно отнести структуру и поведение различных объектов всяких размеров (начиная с гигантских звезд и заканчивая мельчайшими частицами — атомами и молекулами).
Физическое тело — это…
Существует специальный термин «материя», которым в кругах ученых называют все, что есть вокруг нас. Состоящее из материи физическое тело — это какое-либо вещество, занимающее определенное место в пространстве. Любое физическое тело в действии можно назвать примером физического явления. Опираясь на это определение, можно сказать, что любой предмет является физическим телом. Примеры физических тел: кнопка, блокнот, люстра, карниз, Луна, мальчик, облака.
Что такое физическое явление
Любая материя находится в постоянном изменении. Одни тела двигаются, другие соприкасаются с третьими, четвертые крутятся. Не зря много лет назад философом Гераклитом была произнесена фраза «Все течет, все меняется». У ученых есть даже специальный термин таким изменениям — это все явления.
У ученых есть даже специальный термин таким изменениям — это все явления.
К физическим явлениям относится все то, что движется.
Какие существуют типы физических явлений
Это явления, когда из-за воздействия температуры некоторые тела начинают трансформироваться (изменяется форма, размер и состояние). Пример физических явлений: под воздействием теплого весеннего солнца тают сосульки и превращаются в жидкость, с наступлением холодов лужи замерзают, кипящая вода становится паром.
- Механические.
Эти явления характеризуют смену положения одного тела по отношению к остальным. Примеры: часы идут, мяч прыгает, дерево качается, ручка пишет, вода течет. Все они находятся в движении.
- Электрические.
Характер этих явлений полностью оправдывает свое название. Слово «электричество» уходит корнями в греческий язык, где «электрон» значит «янтарь». Пример достаточно простой и многим наверняка знакомый. При резком снятии с себя шерстяного свитера слышится небольшой треск. Если проделать это, отключив в комнате свет, то можно увидеть искорки.
Если проделать это, отключив в комнате свет, то можно увидеть искорки.
Тело, участвующее в явлении, которое связанно со светом, называют светящимся. В качестве примера физических явлений можно привести всем известную звезду нашей Солнечной системы — Солнце, а также любую другую звезду, лампу и даже жучка-светлячка.
Распространение звука, поведение звуковых волн при столкновениях с препятствием, а также иные явления, которые так или иначе связаны со звуком, относятся к этому типу физических явлений.
Они происходят благодаря свету. Так, например, человек и животные способны видеть, потому что есть свет. В эту группу также включены явления распространения и преломления света, его отражение от предметов и прохождение сквозь разные среды.
Теперь вы знаете, какие бывают физические явления. Однако стоит понимать, что между природными и физическими явлениями существует определенная разница. Так, при природном явлении происходит одновременно несколько физических явлений. Например, при ударе молнии в землю происходят следующие явления: магнитное, звуковое, электрическое, тепловое и световое.
Например, при ударе молнии в землю происходят следующие явления: магнитное, звуковое, электрическое, тепловое и световое.
0 V_V
Физические явления окружают нас все время. В каком-то смысле, всё, что мы видим — это физические явления. Но, строго говоря, их делят на несколько видов:
· механические
· звуковые
· тепловые
· оптические
· электрические
· магнитные
Пример механических явлений — это взаимодействия каких-то тел, например мяча и пола, когда мяч отскакивает при ударе. Вращение Земли — тоже механическое явление.
Звуковые явления — это распространение звука в какой-то среде, например в воздухе или в воде. К примеру, эхо, звук пролетающего самолета.
Оптические явления — всё, что связано со светом. Преломление света в призме, отражения света в воде или зеркале.
Тепловые явления связаны с тем, что различные тела меняют свою температуру и физическое / агрегатное состояние: лёд плавится и превращается в воду, вода испаряется и превращается в пар.
Электрические явления связаны с возникновением электрических зарядов. Например, когда электризуется одежда или другие ткани. Или во время грозы появляется молния.
Магнитные явления связаны с электрическими, но касаются взаимодействия магнитных полей. Например, работа компаса, северное сияние, притяжение двух магнитов друг к другу.
0 buzz
25.06.2018 оставил(а) комментарий:
Явления, при которых не происходит превращений одних веществ в другие, относят к физическим явлениям. Физические явления могут привести к изменению, например, агрегатного состояния или температуры, но состав веществ останется тем же.
Все физические явления можно разделить на несколько групп.
Механические явления – это явления, которые происходят с физическими телами при их движении относительно друг друга (обращение Земли вокруг Солнца, движение автомобилей, полёт парашютиста).
Электрические явления – это явления, которые возникают при появлении, существовании, движении и взаимодействии электрических зарядов (электрический ток, телеграфирование, молния при грозе).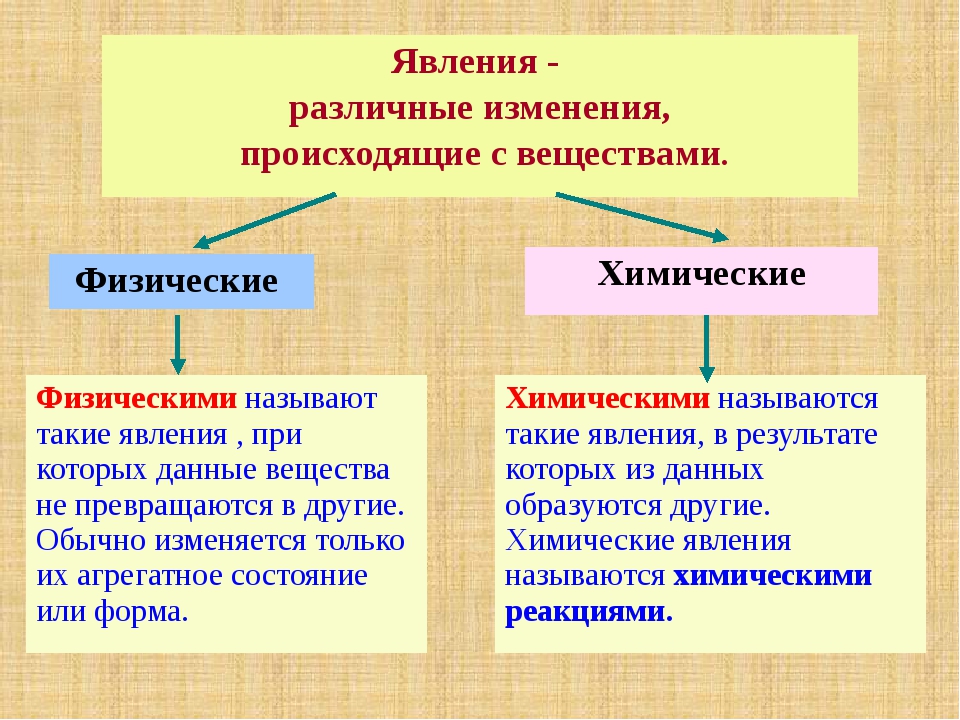
Магнитные явления – это явления, связанные с возникновением у физических тел магнитных свойств (притяжение магнитом железных предметов, поворот стрелки компаса на север).
Оптические явления – это явления, которые происходят при распространении, преломлении и отражении света (радуга, миражи, отражение света от зеркала, появление тени).
Тепловые явления – это явления, которые происходят при нагревании и охлаждении физических тел (таяние снега, кипение воды, туман, замерзание воды).
Атомные явления – это явления, которые возникают при изменении внутреннего строения вещества физических тел (свечение Солнца и звезд, атомный взрыв).
0 Oleg74
25.06.2018 оставил(а) комментарий:
Природные явления — это изменения в природе. Сложные природные явления рассматривают как совокупность физических явлений — таких, которые можно описать с помощью соответствующих физических законов. Физические явления бывают тепловые, световые, механические, звуковые, электромагнитные и др.
Механические физические явления
Полет ракеты, падение камня, вращение Земли вокруг Солнца.
Световые физические явления
Вспышка молнии, свечение электрической лампочки, свет от костра, солнечные и лунные затмения, радуга.
Тепловые физические явления
Замерзание воды, таяние снега, нагрев пищи, сгорания топлива в цилиндре двигателя, лесной пожар.
Звуковые физические явления
Колокол, пение, раскаты грома.
Электромагнитные физические явления
Разряд молнии, электризация волос, притяжение магнитов.
Например, грозы можно рассматривать как совокупность молнии (электромагнитное явление), раскатов грома (звуковое явление), движения облаков и падения капель дождя (механические явления), пожара, что может возникнуть в результате попадания молнии в дерево (тепловое явление).
Изучая физические явления, ученые, в частности, устанавливают их взаимосвязь (разряд молнии — это электромагнитное явление, которое обязательно сопровождается в канале молнии значительным повышением температуры — тепловое явление). Исследование этих явлений в их взаимосвязи позволило не только лучше понять природное явление — грозу, но и найти путь для практического применения электрического разряда — электросварки металлических деталей.
Исследование этих явлений в их взаимосвязи позволило не только лучше понять природное явление — грозу, но и найти путь для практического применения электрического разряда — электросварки металлических деталей.
Об окружающем мире. Кроме обычного любопытства, это было вызвано практическими нуждами. Ведь, например, если знаешь, как поднять
и переместить тяжелые камни, то сможешь возвести прочные стены и построить дом, жить в котором удобнее, чем в пещере или землянке. А если научишься выплавлять металлы из руд и изготавливать плуги, косы, топоры, оружие и т. п., сможешь лучше вспахать поле и получить более высокий урожай, а в случае опасности суме ешь защитить свою землю.
В древности существовала только одна наука — она объединяла все знания о природе, которые накопило к тому времени человечество. В наши дни эта наука называется естествознанием.
Узнаём о физической науке
Еще одним примером электромагнитного поля является свет. С некоторыми свойствами света вы познакомитесь при изучении раздела 3.
3. Вспоминаем о физических явлениях
Материя вокруг нас постоянно изменяется. Некоторые тела перемещаются относительно друг друга, часть из них сталкиваются и, возможно, разрушаются, из одних тел образуются другие… Перечень таких изменений можно продолжать и продолжать — недаром еще в глубокой древности философ Гераклит заметил: «Все течет, все меняется». Изменения в окружающем нас мире, то есть в природе, ученые называют специальным термином — явления.
Рис. 1.5 . Примеры природных явлений
Рис. 1.6. Сложное природное явление — грозу можно представить как совокупность целого ряда физических явлений
Восход и закат Солнца, сход снежной лавины, извержение вулкана, бег лошади, прыжок пантеры — все это примеры природных явлений (рис. 1.5).
Чтобы лучше понять сложные природные явления , ученые разделяют их на совокупность физических явлений — явлений, которые можно описать с помощью физических законов.
На рис. 1.6 показана совокупность физических явлений, образующих сложное природное явление — грозу. Так, молния — огромный электрический разряд — представляет собой электромагнитное явление. Если молния попадет в дерево, то оно вспыхнет и начнет выделять тепло — физики в таком случае говорят о тепловом явлении. Грохот грома и потрескивание пылающего дерева — звуковые явления.
Примеры некоторых физических явлений приведены в таблице. Взгляните, например, на первую строку таблицы. Что может быть общего между полетом ракеты, падением камня и вращением целой планеты? Ответ прост. Все приведенные в этой строке примеры явлений описываются одними и теми же законами — законами механического движения. С помощью этих законов можно вычислить координаты любого движущегося тела (будь то камень, ракета или планета) в любой интересующий нас момент времени.
Рис. 1.7 Примеры электромагнитных явлений
Каждый из вас, снимая свитер или расчесывая волосы пластмассовым гребнем, наверняка обращал внимание на появляющиеся при этом крохотные искры. И эти искры, и могучий разряд молнии относятся к одним и тем же электромагнитным явлениям и, соответственно, подчиняются одним и тем же законам. Поэтому для изучения электромагнитных явлений не стоит дожидаться грозы. Достаточно изучить, как ведут себя безопасные искорки, чтобы понять, чего следует ждать от молнии и как избежать возможной опасности. Впервые такие исследования провел американский ученый Б. Франклин (1706-1790), который изобрел эффективное средство защиты от грозового разряда — молниеотвод.
И эти искры, и могучий разряд молнии относятся к одним и тем же электромагнитным явлениям и, соответственно, подчиняются одним и тем же законам. Поэтому для изучения электромагнитных явлений не стоит дожидаться грозы. Достаточно изучить, как ведут себя безопасные искорки, чтобы понять, чего следует ждать от молнии и как избежать возможной опасности. Впервые такие исследования провел американский ученый Б. Франклин (1706-1790), который изобрел эффективное средство защиты от грозового разряда — молниеотвод.
Изучив физические явления по отдельности, ученые устанавливают их взаимосвязь. Так, разряд молнии (электромагнитное явление) обязательно сопровождается значительным повышением температуры в канале молнии (тепловое явление). Исследование этих явлений в их взаимосвязи позволило не только лучше понять природное явление — грозу, но и найти путь практического применения электромагнитных и тепловых явлений. Наверняка каждый из вас, проходя мимо строительной площадки, видел рабочих в защитных масках и ослепительные вспышки электросварки. Электросварка (способ соединения металлических деталей с помощью электрического разряда) — это и есть пример практического использования научных исследований.
Электросварка (способ соединения металлических деталей с помощью электрического разряда) — это и есть пример практического использования научных исследований.
4. Определяем, что же изучает физика
Теперь, когда вы узнали, что собой представляют материя и физические явления, пришла пора определить, что же является предметом изучения физики. Эта наука изучает: структуру и свойства материи; физические явления и их взаимосвязь.
- подводим итоги
Окружающий нас мир состоит из материи. Существует два вида материи: вещество, из которого состоят все физические тела, и поле.
В мире, который нас окружает, постоянно происходят изменения. Эти изменения называются явлениями. Тепловые, световые, механические, звуковые, электромагнитные явления — все это примеры физических явлений.
Предмет изучения физики — структура и свойства материи, физические явления и их взаимосвязь.
- Контрольные вопросы
Что изучает физика? Приведите примеры физических явлений. Можно ли считать физическими явлениями события, которые происходят во сне или в воображении? 4. Из каких веществ состоят следующие тела: учебник, карандаш, футбольный мяч, стакан, автомобиль? Какие физические тела могут состоять из стекла, металла, дерева, пластмассы?
Можно ли считать физическими явлениями события, которые происходят во сне или в воображении? 4. Из каких веществ состоят следующие тела: учебник, карандаш, футбольный мяч, стакан, автомобиль? Какие физические тела могут состоять из стекла, металла, дерева, пластмассы?
Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. — X.: Издательство «Ранок», 2007. — 192 с.: ил.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты ДополненияУзнаем чем физические явления отличаются от химических? Физические и химические явления: примеры
Часто от многих людей, которые обсуждают тот или иной процесс, можно услышать слова: «Это физика!» или «Это химия!» Действительно, практически все явления в природе, в быту и в космосе, с которыми встречается человек в течение своей жизни, можно отнести к одной из этих наук. Интересно разобраться, чем физические явления отличаются от химических.
Интересно разобраться, чем физические явления отличаются от химических.
Прежде чем отвечать на вопрос, чем физические явления отличаются от химических, необходимо разобраться, какие объекты и процессы исследует каждая из этих наук. Начнем с физики.
С древнегреческого языка слово «fisis» переводится, как «природа». То есть, физика — это наука о природе, которая изучает свойства объектов, их поведение в различных условиях, преобразования между их состояниями. Цель физики заключается в определении законов, которые регулируют происходящие природные процессы. Для этой науки не важно, из чего состоит изучаемый объект, и каков его химический состав, для нее важно лишь, как будет себя вести объект, если воздействовать на него теплом, механической силой, давлением и так далее.
Наука химия
В отличие от физики, химия является наукой, изучающей структуру, состав и свойства материи, а также ее изменение в результате химических реакций. То есть, объектом изучения химии является химический состав и его изменение в ходе определенного процесса.
Химия, как и физика, имеет множество разделов, каждый из которых изучает определенный класс химических веществ, например, органическая и неорганическая, био- и электрохимия. На достижения этой науки опираются исследования в медицине, биологии, геологии и даже астрономии.
Интересно отметить, что химия, как наука, не признавалась древнегреческими философами из-за ее ориентированности на эксперимент, а также из-за псевдонаучных знаний, которые ее окружали (напомним, что современная химия «родилась» из алхимии). Только с эпохи Возрождения и во многом благодаря работам английского химика, физика и философа Роберта Бойля химию стали воспринимать как полноценную науку.
Примеры физических явлений
Можно привести огромное число примеров, которые подчиняются физическим законам. Например, каждый школьник знает уже в 5 классе физическое явление — движение автомобиля по дороге. При этом не важно, из чего состоит этот автомобиль, откуда он берет энергию, чтобы двигаться, важно лишь то, что он перемещается в пространстве (по дороге) вдоль некоторой траектории с определенной скоростью. Более того, процессы разгона и торможения автомобиля также являются физическими. Движением автомобиля и других твердых тел занимается раздел физики «Механика».
Более того, процессы разгона и торможения автомобиля также являются физическими. Движением автомобиля и других твердых тел занимается раздел физики «Механика».
Еще один всем известный пример физических явлений — таяние льда. Лед, будучи твердым состоянием воды, при атмосферном давлении может сколь угодно долго существовать при температурах ниже 0 oC, но, если температуру окружающей среды увеличить хотя бы на долю градуса, либо, если льду непосредственно передать тепло, например, взяв его в руку, то он начнет таять. Этот процесс, который идет с поглощением тепла и изменением агрегатного состояния материи, является исключительно физическим явлением.
Другими примерами физических явлений являются плавание тел в жидкостях, вращение планет по своим орбитам, электромагнитное излучение тел, преломление света при переходе через границу двух разных прозрачных сред, полет снаряда, растворение сахара в воде и другие.
Примеры химических явлений
Как было сказано выше, любые процессы, которые происходят с изменением химического состава тел, принимающих в них участие, изучаются химией. Если возвращаться к примеру с автомобилем, то можно сказать, что процесс сжигания топлива в его двигателе является ярким примером химического явления, поскольку в результате него углеводороды, взаимодействуя с кислородом, приводят к образованию совершенно других продуктов сгорания, основными из которых являются вода и углекислый газ.
Если возвращаться к примеру с автомобилем, то можно сказать, что процесс сжигания топлива в его двигателе является ярким примером химического явления, поскольку в результате него углеводороды, взаимодействуя с кислородом, приводят к образованию совершенно других продуктов сгорания, основными из которых являются вода и углекислый газ.
К еще одному из ярких примеров рассматриваемого класса явлений относится процесс фотосинтеза в зеленых растениях. Изначально они располагают водой, углекислым газом и солнечным светом, после же завершения фотосинтеза исходных реагентов уже нет, а на их месте образуются глюкоза и кислород.
В общем случае можно говорить, что любой живой организм представляет собой настоящий химический реактор, поскольку в нем происходят огромное количество преобразовательных процессов, например, распад аминокислот и образование из них новых протеинов, перевод углеводородов в энергию для мышечных волокон, процесс дыхания человека, при котором гемоглобин связывает кислород, и многие другие.
Одним из удивительных примеров химических явлений в природе признано холодное свечение светлячков, которое является результатом окисления специального вещества — люциферина.
В технической сфере примером химических процессов является изготовление красителей для одежды и продуктов питания.
Отличия
Чем физические явления отличаются от химических? Ответ на этот вопрос можно понять, если проанализировать приведенную выше информацию об объектах изучения физики и химии. Основным отличием между ними является изменение химического состава рассматриваемого объекта, наличие которого свидетельствует о преобразованиях в нем, в случае же неизменных химических свойствах тела говорят о физическом явлении. Важно не путать перемену в химическом составе и изменение структуры, под которой понимается пространственное расположение атомов и молекул, образующих тела.
Обратимость физических и необратимость химических явлений
В некоторых источниках, при ответе на вопрос, чем физические явления отличаются от химических, можно встретить информацию о том, что физические явления являются обратимыми, а химические — нет, однако, это не совсем верно.
Направление любого процесса можно определить, используя законы термодинамики. Эти законы говорят, что всякий процесс может идти самопроизвольно только в случае уменьшения его энергии Гиббса (уменьшении внутренней энергии и увеличении энтропии). Однако, этот процесс всегда можно обратить вспять, если использовать внешний источник энергии. Для примера скажем, что недавно ученые открыли обратный фотосинтезу процесс, который является химическим явлением.
Процесс горения
Этот вопрос был специально вынесен в отдельный пункт, поскольку многие люди считают горение химическим явлением, но это не верно. Однако, считать процесс горения физическим явлением, тоже будет неправильно.
Распространенное явление горения (костер, сгорание топлива в двигателе, газовая конфорка или горелка и т. д.) — это сложный физико-химический процесс. С одной стороны, он описывается цепью химических реакций окисления, но с другой стороны, в результате этого процесса происходит сильное тепловое и световое электромагнитное излучение, а это уже область физики.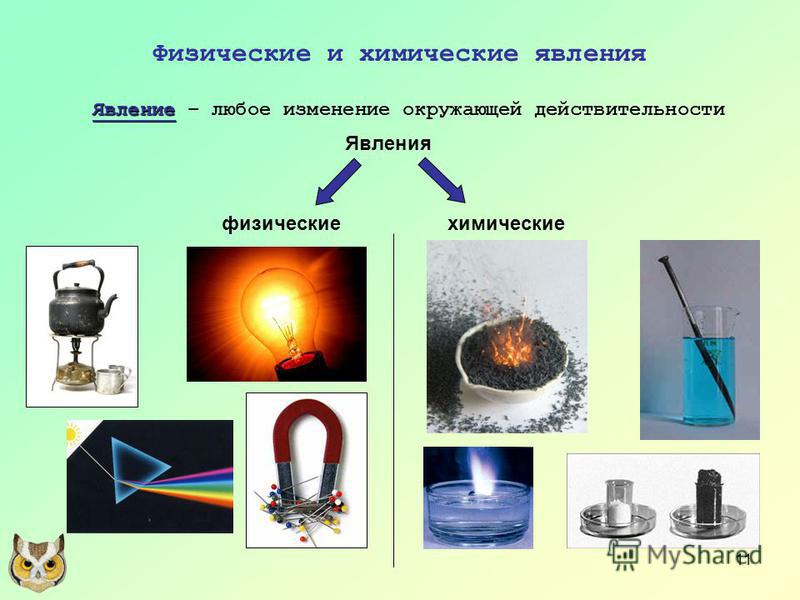
Где находится граница между физикой и химией?
Физика и химия — это две разные науки, которые обладают различными методами исследования, при этом физика может быть как теоретической, так и практической, химия же является, в основном, практической наукой. Однако, в некоторых областях эти науки соприкасаются настолько близко, что граница между ними размывается. Ниже приводятся примеры научных отраслей, в которых трудно определить, «где физика, а где химия»:
- квантовая механика;
- ядерная физика;
- кристаллография;
- материаловедение;
- нанотехнологии.
Как видно из списка, физика и химия тесно пересекаются, когда рассматриваемые явления имеют атомный масштаб. Такие процессы принято называть физико-химическими. Любопытно отметить, что единственным человеком, который получил Нобелевскую премию по химии и физике одновременно, является Мария Склодовская-Кюри.
Ответы | § 12. Явления физические и химические. Признаки химических реакций — Химия, 7 класс
1.
 Какие явления называются физическими? Приведите три примера физических явлений, которые вы можете наблюдать в повседневной жизни.
Какие явления называются физическими? Приведите три примера физических явлений, которые вы можете наблюдать в повседневной жизни.
Физическими называются явления, при которых изменяется состояние вещества или внешняя форма физических тел.
Например, плавление металла, таяние льда, испарение воды.
2. Какие явления называются химическими? Как они называются иначе? Перечислите важнейшие признаки химических реакций.
Явления, при которых одни вещества превращаются в другие, называются химическим реакциями.
Признаки химических реакций: выделение газа, образование или исчезновение осадка, изменение цвета, появление запаха, излучение света, выделение или поглощение теплоты.
3. Приведите примеры химических реакций, протекающих в организме человека, в природе.
В природе: ржавление железа, образование озона, фотосинтез.
В теле человека: дыхание (человек потребляет кислород, выделяет углекислый газ), жир превращается в углекислый газ и воду.
4. К каким явлениям — физическим или химическим относятся: а) испарение спирта; б) горение бензина; в) плавление сахара при нагревании; г) потемнение медной пластинки в пламени спиртовки; д) прокисание молока; е) гниение мяса?
Физические явление: испарение спирта, плавление сахара при нагревании.
Химические явления: горение бензина, потемнение медной пластинки в пламени спиртовки, прокисание молока, гниение мяса.
5. Опишите химические реакции, протекающие при нагревании малахита, горении магния, смешивании растворов медного купороса и соды.
При нагревании малахита наблюдается изменение цвета, при горении магния – изменение цвета, выделение теплоты, появление запаха. При смешивании растворов медного купороса и соды, выпадает осадок голубого цвета.
6. Какие условия необходимы для начала и осуществления химических реакций? Зачем перед началом реакции твердые вещества измельчают?
Главное необходимое условие для протекания реакций– это соприкосновение веществ. Но, некоторым может потребоваться нагревание, другим – освещение. Перед началом твердые вещества измельчают, чтобы увеличить площадь соприкосновения.
7.
 В каких случаях нагревание требуется только для начала реакций?
В каких случаях нагревание требуется только для начала реакций?
Деревянная лучинка, смесь железа и серы могу долгое время сохраняться при комнатной температуре, реакции начинаются только при нагревании.
8. Для удаления ржавчины с железных изделий их опускают в горячий водный раствор лимонной кислоты. Через некоторое время ржавчина исчезает, а жидкость окрашивается в желтый цвет. К каким явлениям — физическим или химическим — относится описанный процесс?
Эти признаки (исчезновение ржавчины, окрашивание жидкости в желтый цвет) свидетельствует о протекание химической реакции.
9. Какие признаки химических реакций наблюдаются при «извержении химического вулкана» — разложении одного из соединений хрома при нагревании (рис. 47)? Видеозапись данного опыта можно увидеть в Интернете, набрав в поисковике «Химический вулкан».
При таком явление можно наблюдать выделение газа, излучение света, выделение теплоты, изменение цвета.
Присоединяйтесь к Telegram-группе @superresheba_7, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!Чем отличаются химические явления от физических
Изменения, происходящие с окружающими нас объектами, классифицируются как химические и физические явления. Чтобы научиться распознавать те и другие, необходимо разобраться в самой их сути.
Чтобы научиться распознавать те и другие, необходимо разобраться в самой их сути.
Определение
Химическими называют явления, приводящие к возникновению абсолютно иных веществ из исходных. Примеры: горение щепки, получение кефира из молока, образование крахмала в растениях.
Физическими называют явления, не затрагивающие молекулярную структуру веществ. Примеры: лепка из пластилина, образование инея, лопается шарик.
к содержанию ↑Сравнение
Таким образом, решающим критерием становится глубина происходящих изменений. Отличие химических явлений от физических состоит в том, что в первом случае исходные вещества полностью разрушаются, а во втором они остаются сами собой. Иными словами, химические процессы приводят к более кардинальным изменениям, ведь они протекают на молекулярном уровне.
Подобные реакции могут происходить при непосредственном контакте веществ в отсутствие дополнительных факторов, а также под действием электричества, световых волн, при нагревании или участии катализаторов. На выходе получаются вещества с новым составом и свойствами. К примеру, ржавчина, в которую на воздухе под воздействием влаги преобразуется слой железного листа, –это вещество совсем с другими характеристиками, чем само железо.
На выходе получаются вещества с новым составом и свойствами. К примеру, ржавчина, в которую на воздухе под воздействием влаги преобразуется слой железного листа, –это вещество совсем с другими характеристиками, чем само железо.
О том, что произошло химическое превращение, свидетельствуют определенные признаки. В одном случае меняется вкус (как у капусты после квашения), в другом – цвет (посинение крахмального раствора при добавлении в него капли йода), в третьем – выделяется газ (взаимодействие соды и уксуса). Может также образоваться осадок, появиться особый запах или произойти выработка тепла.
В чем разница между химическими и физическими явлениями? В том, что последние, осуществляясь без разрушения молекул, влекут за собой изменения иного характера. Например, наблюдается переход в какое-то другое агрегатное состояние (твердый шоколад в ладони тает). Меняться могут форма (раскатывание теста), размеры (уменьшение длины проводов в мороз), положение в пространстве (падение мяча). Но химический состав во всех случаях остается прежним.
Но химический состав во всех случаях остается прежним.
Таблица
| Химические явления | Явления физической природы |
| Разрушение исходных веществ | Молекулярный состав не затрагивается |
| Получение других веществ с присущими им свойствами | В результате новые вещества не образуются |
| Признаки: выработка тепла, выделение газа, появление осадка, изменение таких характеристик, как вкус, цвет, запах | Могут меняться: размеры, форма, положение в пространстве, агрегатное состояние |
Химические явления, их признаки — ТЕЛА,ВЕЩЕСТВА И ЯВЛЕНИЯ ВОКРУГ НАС — ЕСТЕСТВОЗНАНИЕ 5 КЛАСС
РАЗДЕЛ I. ТЕЛА,ВЕЩЕСТВА И ЯВЛЕНИЯ ВОКРУГ НАС
§15. Химические явления, их признаки
Изучение параграфа поможет вам:
• приводить примеры химических явлений и называть их признаки;
• различать химические и физические явления.
Ознакомление со смесями и физическими явлениями позволило вам сделать вывод, что и в смесях и во время физических явлений состав веществ остается неизменным, а компоненты смесей сохраняют свои свойства. Так, во время плавления льда, кипения и замерзания воды ее молекулы сохраняются.
Химические явления. Химические явления коренным образом отличаются от физических. До начала химического явления существуют одни вещества, после него они превращаются в другие.
Химические явления — это изменения, в результате которых одни вещества превращаются в другие. их еще называют химическими реакциями.
Чтобы убедиться, произошло ли химическое явление, надо обнаружить образование новых веществ. Проще всего это сделать, когда наше зрение фиксирует признаки химического явления: выделение газа, образование осадка, изменение цвета, появление света и тепла. В изображенных на рис. 39 (см. с. 64) примерах химических явлений присутствуют эти признаки.
К признакам химических явлений относится и появление запаха. Достаточно летом подержать мясные продукты несколько дней и даже часов не в холодильнике, как
Достаточно летом подержать мясные продукты несколько дней и даже часов не в холодильнике, как
Приведите доказательства того, что в смесях их компоненты сохраняют свойства.
Рис. 39. Признаки химических явлений: а — выделение газа; б — образование осадка; в — изменение цвета; г — появление света и тепла
они испортятся и станут несъедобными. О том, что произошло химическое явление, будет свидетельствовать появление неприятного запаха.
Признаками химических явлений является выделение газа, образование осадка, изменение цвета, появление запаха, света и тепла.
Гниение как природное химическое явление. Задумывались ли вы над тем, почему в густом лесу мы не «тонем» в опал ом листве и куда в природе исчезают опавшие ветки деревьев, плоды, засохшая трава? Действительно, есть над чем задуматься и поучиться у природы, чтобы не иметь мороки с мусором.
Оказывается, что при благоприятных условиях отмершие остатки растений и животных перегнивают. Гниением называют природное химическое явление, во время которого органические вещества, преимущественно белки, превращаются в другие органические, а также неорганические вещества. Вследствие этого почва обогащается питательными веществами (перегноем, или гумусом). Гниению способствуют влажность, бактерии, ограничен доступ воздуха. Признаком этого природного химического явления является выделение тепла.
Гниением называют природное химическое явление, во время которого органические вещества, преимущественно белки, превращаются в другие органические, а также неорганические вещества. Вследствие этого почва обогащается питательными веществами (перегноем, или гумусом). Гниению способствуют влажность, бактерии, ограничен доступ воздуха. Признаком этого природного химического явления является выделение тепла.
В результате гниения образуются более простые вещества, они попадают в почву, воду, воздух и снова поглощаются растениями и участвуют в образовании новых органических веществ.
Благодаря гниению не накапливаются отмершие остатки организмов, а почва обогащается перегноем.
Опавшие листья, перегнивая, обогащает почву питательными веществами
Консервирование — способ препятствование гниению
Это важное в природе химическое явление в быту лини не всегда является желаемым, потому что через него продукты питания становятся непригодными к употреблению. Способами, препятствующими гниению органических веществ пищи, есть консервирования, варки, соления, замораживания.
Способами, препятствующими гниению органических веществ пищи, есть консервирования, варки, соления, замораживания.
В природе происходит множество химических явлений.
Так в растениях из углекислого газа и воды образуются органические вещества и необходимый для жизни кислород. Благодаря химическим явлениям организм животных и человека получает все необходимые для роста и развития вещества.
Копилка знаний
Химические явления люди научились осуществлять в лабораториях и на заводах. Насколько это важно сейчас, вы убеждаетесь постоянно. Прежде всего следует назвать производство металлов, каучука и резины, пластмасс, покрытий для крыш и полов, цемента, удобрений для растений, пищевых добавок для животных. Каждое из этих производств человек осваивал в разные времена. Изучая историю, вы узнаете о бронзовом и железном веке. Названия подтверждают важность освоенных человеком химических явлений, благодаря которым ей удалось заменить каменный копье, деревянную борону металлическими орудиями.
Станьте исследователями природы
Высушите скорлупу двух куриных яиц и измельчите ее. Полученный порошок разделите на две части и поместите его в две прозрачные сосуды. В одну налейте 2 столовые ложки воды, во вторую — столько же уксуса. Наблюдайте за изменениями ей в обоих сосудах. В какой из них произошло химическое явление? Как вы об этом узнали?
Проверка знаний
1. Какие явления относятся к химическим? Приведите примеры химических явлений.
2 Назовите признаки химических явлений.
3. Почему скисание молока относится к химических явлений, а таяние льда — к физическим?
4. Запишите в тетрадь химические явления, которые приходилось совершать вам и членам вашей семьи в быту. Укажите признаки этих явлений.
Явления NGSS — Пример научного явления
Считается ли это химической реакцией?
Откуда мы знаем?
Какие химические вещества?
Почему они реагируют?
Откуда берется энергия?
Куда уходит энергия?
Как выпускается?
Как он хранился в первую очередь?
Есть что-нибудь о материале?
Могут ли вопросы Crosscutting Concept помочь нам в этом разобраться?
1. Какие паттернов я замечаю в этом явлении?
Какие паттернов я замечаю в этом явлении?
2. Каковы границы этого явления? Каковы его компоненты и как они взаимодействуют с ?
3. Что происходит на ненаблюдаемом уровне с по , что вызывает наблюдаемых функций или процессов?
4. Какая шкала или шкала объясняют это явление и как я могу описать его количественно ?
5.Как энергия и / или материя втекают, выходят или входят в границы явления?
6. Как структура явления (или его компонентов) соотносится с его функцией ?
7. При каких условиях это явление стабильно ? При каких условиях меняет ?
(Список исходил от блестящего педагога Хизер Майло !!)
Вещества состоят из атомов разных типов, которые по-разному сочетаются друг с другом.
 Атомы образуют молекулы размером от двух до тысяч атомов. (MS-PS1-1)
Атомы образуют молекулы размером от двух до тысяч атомов. (MS-PS1-1)Твердые тела могут состоять из молекул или представлять собой протяженные структуры с повторяющимися субъединицами (например, кристаллы). (MS-PS1-1)
Вещества химически реагируют характерным образом.В химическом процессе атомы, из которых состоят исходные вещества, перегруппировываются в разные молекулы, и эти новые вещества имеют свойства, отличные от свойств реагентов. (MS-PS1-2), (MS-PS1-3), (MS-PS1-5)
Общее количество атомов каждого типа сохраняется, и, таким образом, масса не изменяется. (MS-PS1-5)
Некоторые химические реакции выделяют энергию, другие накапливают энергию. (MS-PS1-6)
Термин «тепло», используемый в повседневном языке, относится как к тепловой энергии (движению атомов или молекул внутри вещества) и передача этой тепловой энергии от одного объекта к другому.
 В науке тепло используется только для этого второго значения; это относится к энергии, передаваемой из-за разницы температур между двумя объектами. (вторичный по отношению к MS-PS1-4)
В науке тепло используется только для этого второго значения; это относится к энергии, передаваемой из-за разницы температур между двумя объектами. (вторичный по отношению к MS-PS1-4) Температура системы пропорциональна средней внутренней кинетической энергии и потенциальной энергии на атом или молекулу (в зависимости от того, что является подходящим строительным блоком для материала системы). Детали этой связи зависят от типа атома или молекулы и взаимодействия между атомами в материале.Температура не является прямым показателем общей тепловой энергии системы. Полная тепловая энергия (иногда называемая полной внутренней энергией) системы зависит от температуры, общего числа атомов в системе и состояния материала. (вторичный по отношению к MS-PS1-4)
Какая наука стоит за этим ?? Примечание: не смотрите сюда, пока не попробуете написать свои собственные объяснения! — http://jchemed.chem.wisc.edu/blog/how-does-orange-peel-pop-balloon-chemistry-course
Ожидаемые характеристики
MS-PS1-2.
Анализируйте и интерпретируйте данные о свойствах веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция. [Уточнение: Примеры реакций могут включать сжигание сахара или стальной ваты, реакцию жира с гидроксидом натрия и смешивание цинка с хлористым водородом.] [ Граница оценки: Оценка ограничивается анализом следующих свойств: плотность, плавление точка, температура кипения, растворимость, воспламеняемость и запах.]
Химические явления — обзор
2 Моделирование реактора
Соответствующие и полезные модели должны учитывать все физические и химические явления, связанные с процессом осаждения. К ним относятся диффузия газообразных частиц к растущей поверхности и от нее в неизотермическом поле потока, адсорбция реагентов и их диффузия на твердых поверхностях, поверхностные реакции и включение атомов в растущую пленку. В зависимости от того, какой из этих шагов определяет скорость, становятся очевидными два различных температурных режима. При низких температурах преобладают кинетические аспекты, приводящие к скорости роста, которая сильно зависит от температуры. При более высоких температурах преобладают явления переноса через газовую фазу и наблюдается плавная зависимость скорости роста от температуры. Это называется режимом роста массопереноса, и эпитаксиальный рост обычно происходит в этом режиме, потому что эти условия приводят к максимально допустимой скорости роста. Однако реакторы при очень низких давлениях могут работать в кинетически контролируемом режиме, когда поверхностные реакции определяют скорость процесса.
При низких температурах преобладают кинетические аспекты, приводящие к скорости роста, которая сильно зависит от температуры. При более высоких температурах преобладают явления переноса через газовую фазу и наблюдается плавная зависимость скорости роста от температуры. Это называется режимом роста массопереноса, и эпитаксиальный рост обычно происходит в этом режиме, потому что эти условия приводят к максимально допустимой скорости роста. Однако реакторы при очень низких давлениях могут работать в кинетически контролируемом режиме, когда поверхностные реакции определяют скорость процесса.
Из предыдущего анализа следует, что полное моделирование процессов осаждения включает понимание явлений, происходящих на различных масштабах длины (Carrà and Masi 1998). Как правило, при моделировании эпитаксиальных реакторов все этапы на поверхности, участвующие в механизме роста террасы-ступеньки-излома, типичного для кремниевой эпитаксии, не включаются в формулировку модели, поскольку они включены в морфологические модели, решенные « a priori ». Чаще оперативные условия эпитаксии определяются экспериментально.Таким образом, модели обращаются только к масштабу реактора, где рассматриваемые явления относятся к области гидродинамики, явлений переноса, газовой фазы и кинетики поверхности, анализ которой может быть выполнен с помощью традиционного подхода, основанного на непрерывных уравнениях сохранения.
Чаще оперативные условия эпитаксии определяются экспериментально.Таким образом, модели обращаются только к масштабу реактора, где рассматриваемые явления относятся к области гидродинамики, явлений переноса, газовой фазы и кинетики поверхности, анализ которой может быть выполнен с помощью традиционного подхода, основанного на непрерывных уравнениях сохранения.
Соответственно, общая модель реактора для эпитаксии кремния включает непрерывность, импульс и уравнения сохранения энергии вместе с уравнением сохранения массы для прекурсора осаждения, записанным для псевдостационарных условий (Jensen 1993).Поскольку системы CVD обычно работают в разбавленных условиях, можно использовать более простой закон Фика для массового потока вместо подробных уравнений Стефана – Максвелла. Кроме того, учитывая важную роль эффекта термодиффузии, такой вклад должен быть включен в выражение потока массы всякий раз, когда внутри реактора присутствуют большие градиенты температуры (Coltrin и др. , 1986). Что касается энергетического баланса, вклады теплоты реакции и теплоты, генерируемой вязкой диссипацией, обычно не учитываются из-за обычно низких конверсий и высоких разбавлений в этих реакторах.Согласно рассмотренной выше гипотезе уравнения модели типового реактора для CVD-эпитаксии кремния следующие:
Что касается энергетического баланса, вклады теплоты реакции и теплоты, генерируемой вязкой диссипацией, обычно не учитываются из-за обычно низких конверсий и высоких разбавлений в этих реакторах.Согласно рассмотренной выше гипотезе уравнения модели типового реактора для CVD-эпитаксии кремния следующие:
(1) ρu⋅∇u + ∇P = ρg + ∇⋅ [μ∇u + μ∇ut − 23μI∇⋅u]
(2) ρu = 0
(3) ρCPu⋅∇T = ∇⋅ (kT∇T)
(4) ρu⋅∇ωi = −∇⋅ [ρDi (∇ωi − αiωi∇lnT)] + Mi∑m − 1NRGvimGR˜mG
, где u — вектор скорости газа, g , P , ρ, μ, C p и k T — ускорение свободного падения, давление в системе, массовая плотность и вязкость газа, удельная теплоемкость газовой смеси и ее теплопроводность соответственно.ω i , D i , α i и M i — массовая доля частицы i , ее бинарный коэффициент диффузии внутри газа-носителя, коэффициент термодиффузии и его молекулярный вес, соответственно, а ν и указывают его стехиометрический коэффициент в реакции м и соответствующую скорость реакции. I , а верхние индексы t, G и S указывают единичную матрицу, транспонированную матрицу или вектор и величину, относящуюся к газу или поверхности, соответственно.Из-за обычно низких рабочих давлений и высоких температур, существующих в этих реакторах, плотность газа можно рассчитать с помощью уравнения состояния идеальных газов (ρ = PM T / RT ). Кроме того, необходимо учитывать температурную зависимость всех физических и химических свойств, присутствующих в модели (Jensen 1993, Masi и др. . 1996, Yang и др. . 1992).
I , а верхние индексы t, G и S указывают единичную матрицу, транспонированную матрицу или вектор и величину, относящуюся к газу или поверхности, соответственно.Из-за обычно низких рабочих давлений и высоких температур, существующих в этих реакторах, плотность газа можно рассчитать с помощью уравнения состояния идеальных газов (ρ = PM T / RT ). Кроме того, необходимо учитывать температурную зависимость всех физических и химических свойств, присутствующих в модели (Jensen 1993, Masi и др. . 1996, Yang и др. . 1992).
Граничные условия уравнений. (1) — (4) специфичны для конфигурации реактора, но некоторые из них носят общий характер, например, условия отсутствия проскальзывания и проникновения на твердых стенках.Из-за включения атомов и высвобождения газообразных частиц на границе роста должна существовать строго конечная скорость, нормальная к подложке, но такое значение обычно настолько мало, что им можно пренебречь. Скорость потока на входе обычно указывается, а на выходе создаются условия отсутствия напряжения или полностью развитого потока. Тепловые граничные условия существенно влияют на поток. Как правило, рассматривается упрощенная модель системы с постоянными температурами токоприемника и стенки, но в более подробных расчетах следует включать соответствующие граничные условия теплового потока, отражающие преобладающие условия (Kleijn et al .1996 г., Toprac и др. . 1994). Что касается граничного условия сохранения массы, обычно не предполагается, что чистый поток на нереагирующих поверхностях. На поверхностях осаждения поток массы приравнивается к чистой скорости включения за счет поверхностных химических реакций, R˜mS:
Скорость потока на входе обычно указывается, а на выходе создаются условия отсутствия напряжения или полностью развитого потока. Тепловые граничные условия существенно влияют на поток. Как правило, рассматривается упрощенная модель системы с постоянными температурами токоприемника и стенки, но в более подробных расчетах следует включать соответствующие граничные условия теплового потока, отражающие преобладающие условия (Kleijn et al .1996 г., Toprac и др. . 1994). Что касается граничного условия сохранения массы, обычно не предполагается, что чистый поток на нереагирующих поверхностях. На поверхностях осаждения поток массы приравнивается к чистой скорости включения за счет поверхностных химических реакций, R˜mS:
(5) −ρDin⋅ (∇ωi − αiωi∇lnT) + Mi∑m − 1NRSvimSR˜mS
Поскольку уравнения модели нелинейны, их приходится решать численно. Доступны коммерческие коды вычислительной гидродинамики общего назначения для решения уравнений CVD (например,g., CFX4, FIDAP, FLUENT, MP-SALSA и PHOENICS-CVD). Все эти коды имеют разумные возможности для обработки сложных симуляций потока: двумерные модели с большим кинетическим механизмом или трехмерные модели в условиях ограничения переноса и умеренно сложной геометрии представляют пределы существующей сложности моделирования. Учитывая резкий рост возможностей компьютеров, эти ограничения будут сняты в ближайшем будущем.
Все эти коды имеют разумные возможности для обработки сложных симуляций потока: двумерные модели с большим кинетическим механизмом или трехмерные модели в условиях ограничения переноса и умеренно сложной геометрии представляют пределы существующей сложности моделирования. Учитывая резкий рост возможностей компьютеров, эти ограничения будут сняты в ближайшем будущем.
Пример уровня точности, который может быть достигнут с помощью этого моделирования, можно вывести из рис.2 (Маси и др. , 1996). Там, помимо естественного результата двумерного моделирования с точки зрения линий тока и изотерм, показано сравнение расчетного и экспериментального профиля скорости роста (без настройки каких-либо параметров) для эпитаксиального осаждения кремния из SiCl 4 / H 2 смеси в бочкообразном реакторе. Согласие будет даже лучше, если исследовать геометрически более простые реакторы (Habuka и др. . 1996, Kleijn и др. . 1996).
Рис. 2. Моделирование цилиндрического реактора LPE 861 для эпитаксии кремния. Атмосферное давление; температура токоприемника = 1523К; температура стенок = 460К; H 2 расход = 0,41 гс -1 ; SiCl 4 расход = 0,28 г / с -1 ; наклон приемника = 3 °; длина токоприемника = 0,45 м; Диаметр пластины = 0,127 м. (а) Пример рассчитанных линий тока, изотерм и линий изокомпозиции. (b) Сравнение расчетных (линии) и экспериментальных значений скорости роста вдоль продольной средней линии токоприемника для двух разных диаметров колокола (по Masi et al .1996).
Атмосферное давление; температура токоприемника = 1523К; температура стенок = 460К; H 2 расход = 0,41 гс -1 ; SiCl 4 расход = 0,28 г / с -1 ; наклон приемника = 3 °; длина токоприемника = 0,45 м; Диаметр пластины = 0,127 м. (а) Пример рассчитанных линий тока, изотерм и линий изокомпозиции. (b) Сравнение расчетных (линии) и экспериментальных значений скорости роста вдоль продольной средней линии токоприемника для двух разных диаметров колокола (по Masi et al .1996).
Когда геометрия реактора может быть уменьшена до более простых воздуховодов (кольцевых или прямоугольных) или почти «без стенки», можно также использовать более простые модели, полученные из приведенных выше уравнений. Они относятся к консолидированным отношениям, полученным с помощью теории пограничного слоя для оценки параметров переноса массы и тепла. Полученные одномерные модели могут удовлетворительно описывать эволюцию скорости роста только по главной координате рассматриваемого реактора. Примеры, приведенные в литературе, относятся к вертикальным, горизонтальным и цилиндрическим реакторам (Carrà and Masi 1998).
Примеры, приведенные в литературе, относятся к вертикальным, горизонтальным и цилиндрическим реакторам (Carrà and Masi 1998).
Помимо вычислительных трудностей, оценка параметров процесса представляет собой проблему. Оценка термодинамических (например, энтальпии и теплоемкости) и транспортных параметров (например, вязкости, теплопроводности и диффузии) проще, чем оценка кинетических (например, параметров скорости реакции). Доступен большой набор термодинамических параметров для всех молекул и радикалов, участвующих в осаждении кремния. Значения определены экспериментально или с помощью квантово-химических расчетов (Chase et al .1985, Coltrin и др. . 1986). Параметры переноса можно оценить с помощью консолидированных соотношений, полученных из молекулярной теории газов, как функции параметров Леннарда-Джонса (Рейд и др. , 1986). Установление подробного химического механизма требует сочетания экспериментального и теоретического анализа. Теоретические оценки констант скорости реакции « a priori » возможны с помощью теории переходного состояния в сочетании с подходящими квантово-химическими программами « ab initio » (например. г., AMPAC, Gaussian98). В связи с их промышленным значением кинетика разложения большинства прекурсоров кремния изучена подробно. Таким образом, для этих видов теперь доступны почти консолидированные химические механизмы. Обсуждение вовлеченных реакций и оценка их констант скорости приведены ниже.
г., AMPAC, Gaussian98). В связи с их промышленным значением кинетика разложения большинства прекурсоров кремния изучена подробно. Таким образом, для этих видов теперь доступны почти консолидированные химические механизмы. Обсуждение вовлеченных реакций и оценка их констант скорости приведены ниже.
Что такое химические явления? — WhatMaster
Мы объясняем, что такое химические явления, их характеристики, классификацию и примеры. Кроме того, физические явления.
Что такое химические явления?
Химические явления — это термодинамические процессы, в которых два или более веществ изменяют свою молекулярную структуру и генерируют новые вещества , называемые продуктами, будь то химические элементы или соединения. Химические явления также называют химическими реакциями или химическими изменениями, термины, которые в основном являются синонимами.
В химических явлениях происходит значительное изменение вещества, которое никогда не бывает таким же в начале реакции, как в конце, так что это обычно необратимо и не всегда наблюдается невооруженным глазом . С другой стороны, пропорции материи и энергии всегда остаются неизменными.
С другой стороны, пропорции материи и энергии всегда остаются неизменными.
Химические реакции являются обычным явлением в наши дни, и многие из них являются ключевыми при производстве продуктов, получении энергии и других процессах, важных для общества.
Типы химических реакций
Химические реакции классифицируются, прежде всего, по типу участвующих химических элементов.Таким образом, у нас будут органические и неорганические химические реакции, и каждый тип классифицируется независимо:
Неорганические реакции . Они могут быть четырех разных типов:
- Реакции синтеза или присоединения . Два реагента объединяются друг с другом, в результате получается другое вещество.
- Анализ или реакции разложения . Сложное вещество вступает в реакцию с другим веществом (или реагентом) и распадается на два своих простейших компонента.

- Реакции вытеснения . Соединение или элемент занимает место другого в более крупном или более сложном соединении, заменяя его и оставляя свободным.
- Реакции двойного замещения . Два реагента обмениваются соединениями или химическими элементами одновременно.
Органические реакции . С другой стороны, органические реакции зависят от типа рассматриваемого органического соединения, поскольку каждая функциональная группа имеет ряд конкретных реакций: алканы, алкены, спирты, кетоны, альдегиды и т. Д.
Примеры химических явлений
Любая химическая реакция — хороший пример химических явлений, даже тех, которые происходят внутри нашего тела. Можно упомянуть несколько простых случаев, а именно:
- Окисление . Это явление можно увидеть в металлах, особенно в солевой среде (поскольку соль действует как катализатор, ускоряя реакцию между кислородом и металлом), и заключается в образовании слоя мочи (или оксида) на поверхности ржавого металла.
 .Это также происходит внутри нашего тела, поскольку с кислородом, который мы получаем при дыхании, мы затем приступаем к окислению молекул глюкозы, получая таким образом химическую энергию.
.Это также происходит внутри нашего тела, поскольку с кислородом, который мы получаем при дыхании, мы затем приступаем к окислению молекул глюкозы, получая таким образом химическую энергию. - Горение . Классический пример: мы зажигаем бумагу спичкой и наблюдаем, как она превращается в пепел. В этих типах реакций участвуют горючие материалы (бумага) и окислитель (кислород из воздуха) при повышении температуры.
- Коррозия . Химические ожоги, результат контакта кислоты или сильного основания с кожей (или любым органическим веществом), то есть химической реакции, в которой эти вещества резко восстанавливают органическое вещество.
- Производство солей . Когда кислота и металл смешиваются, как в случае проливания содержимого старых батарей в отсек дистанционного управления, образуется какая-то соль, в зависимости от металла и кислоты.
Явления химические и физические явления

Разница между физическими и химическими явлениями связана с типом изменения материи. Физические явления — это изменения структуры, состояния, при которых вещество остается химически неизменным .
Например, если мы заморозим воду, мы можем превратить ее в твердое тело (лед), но при этом она будет состоять из водорода и кислорода.
Вместо этого химические явления реорганизуют молекулярную природу материи, создавая и разрушая атомные связи и создавая новые вещества. Это связано с тем, что происходит химическая реакция, обычно необратимая, в результате чего образуются вещества, совершенно отличные от исходных.
Например, после сжигания бумаги и превращения ее в пепел мы не можем восстановить ее до первоначального состояния.
18 химических реакций для усиления вашего увлечения наукой
Химия — одна из самых завораживающих (а иногда и опасных) наук. Хотя некоторые химические реакции являются частью нашей повседневной жизни, например, смешивание сахара с кофе, другие более сложны и требуют контролируемых условий для визуализации эффектов. Это особенно актуально для ситуаций, когда реакция может привести к возгоранию, опасным испарениям, взрыву или потоку искр.
Это особенно актуально для ситуаций, когда реакция может привести к возгоранию, опасным испарениям, взрыву или потоку искр.
Самый безопасный способ испытать такие реакции — смотреть издалека, например, через экран компьютера. Ниже представлены 18 ярких видеороликов, которые разожгут вашу страсть к химическим реакциям.
1. Диэтилцинк и воздух
Диэтилцинк — очень нестабильное соединение. Он будет бурно реагировать и воспламеняться при контакте с водой, воздухом и практически всем, что может принять пару электронов или отдать протон. Поставляется в герметичных тубах с углекислым газом и может использоваться в качестве авиационного топлива.В этом видео, когда он вступает в контакт с кислородом, он горит с образованием оксида цинка, CO 2 и воды.
2. Цезий и вода
com/embed/D4pQz3TC0Jo» allowfullscreen=»allowfullscreen»/>
Цезий — один из наиболее реактивных щелочных металлов. Когда он вступает в контакт с водой, он реагирует с образованием гидроксида цезия и газообразного водорода. Эта реакция происходит так быстро, что вокруг цезия образуется пузырек водорода, который поднимается на поверхность, после чего цезий подвергается воздействию воды, вызывая дальнейшую экзотермическую реакцию, таким образом воспламеняя газообразный водород.Этот цикл повторяется до тех пор, пока не будет исчерпан весь цезий.
Цезий чаще всего используется в качестве бурового раствора. Он также полезен при изготовлении специального оптического стекла, оборудования для радиационного контроля и в атомных часах.
3. Глюконат кальция и тепло
Глюконат кальция обычно используется для лечения дефицита кальция. Однако при нагревании глюконат кальция разрушается и окисляется, образуя водяной пар и диоксид углерода. Продукты распада — оксид кальция и углерод — имеют больший объем, чем исходное вещество, поэтому образуется «змейка».
Продукты распада — оксид кальция и углерод — имеют больший объем, чем исходное вещество, поэтому образуется «змейка».
4. Трииодид азота и прикосновение
Это неорганическое соединение можно приготовить дома, но имейте в виду, что это очень опасно. Соединение образуется в результате осторожной реакции йода и аммиака при взаимодействии йода с водным раствором аммиака. В результате получается чрезвычайно чувствительное контактное взрывчатое вещество. Небольшие количества взорвутся с громким резким щелчком при легком прикосновении к перышку, выпуская пурпурное облако паров йода.
5. Дихромат аммония и нагревание
При комнатной температуре дихромат аммония — также известный как «Везувианский огонь» — существует в виде оранжевых кристаллов. Когда он воспламеняется, он разлагается экзотермически, образуя искры, пар и газообразный азот, как при небольшом извержении вулкана. Он также производит «золу» зеленого оксида хрома (III). Дихромат аммония используется в пиротехнике, фотографии и литографии. Также его можно использовать в качестве протравы при окрашивании пигментов.
Когда он воспламеняется, он разлагается экзотермически, образуя искры, пар и газообразный азот, как при небольшом извержении вулкана. Он также производит «золу» зеленого оксида хрома (III). Дихромат аммония используется в пиротехнике, фотографии и литографии. Также его можно использовать в качестве протравы при окрашивании пигментов.
6.Перекись водорода и йодид калия
Когда перекись водорода и йодид калия смешиваются в надлежащих пропорциях, перекись водорода разлагается очень быстро. В эту реакцию часто добавляют мыло для образования пенистого вещества, которое иногда называют «зубной пастой слона».
Мыльная вода улавливает кислород, продукт реакции, в результате чего образуется множество пузырьков. В то время как перекись водорода часто используется в качестве дезинфицирующего средства, йодид калия можно использовать в качестве лекарства — он используется для лечения гипертиреоза.
7. Хлорат калия и сахар
Мармеладные мишки в основном состоят только из сахарозы, а хлорат калия используется во взрывчатых веществах, фейерверках и спичках. Однако, когда мармеладных мишек опускают в хлорат калия и добавляют каплю серной кислоты в качестве катализатора, эти два химиката бурно вступают в реакцию друг с другом, выделяя большое количество тепловой энергии, эффектное лиловое пламя и много дыма. очень экзотермическая реакция горения.
8. Реакция Белоусова-Жаботинского (BZ)
Реакция BZ представляет собой семейство колеблющихся химических реакций, образованных комбинацией брома и кислоты. Реакция является ярким примером неравновесной термодинамики и приводит к красочным химическим колебаниям, которые вы видите в этом видео.
9. Окись азота и дисульфид углерода
Реакция, часто называемая «лающей собакой», представляет собой химическую реакцию, которая возникает в результате воспламенения сероуглерода и окиси азота или закиси азота в течение длительного времени. трубка.Реакция дает ярко-синюю вспышку и лающий или лающий звук.
Когда смесь воспламеняется, волна горения распространяется по трубе. Газ перед фронтом волны сжимается и взрывается на расстоянии, которое зависит от длины трубки. В результате экзотермической реакции разложения монооксида азота (окислитель) и сероуглерода (топливо) образуются азот, монооксид углерода, диоксид углерода, диоксид серы и сера.
В апреле 1853 года Юстус фон Либих, который считается одним из главных основоположников современной органической химии, провел реакцию лая собаки перед членами баварской королевской семьи.К сожалению, стеклянная тара разбилась, в результате чего пострадали семья и сам Либих.
10. Сплав NaK и вода
Сплав NaK представляет собой металлический сплав, образованный смешением натрия и калия в отсутствие воздуха, обычно в керосине. Этот чрезвычайно реактивный сплав будет реагировать с воздухом, но при контакте с водой происходит еще более бурная реакция. Тепло, выделяемое этой реакцией, быстро плавит натрий и калий, и его часто бывает достаточно для воспламенения образующегося газообразного водорода.
Хотя реакция может показаться простой, ученые все еще не знают, почему процесс происходит так быстро.
11. Термит и лед
Вы когда-нибудь думали, что смешивание огня и льда может привести к взрыву?
Вот что происходит, когда вам немного помогает термит, который представляет собой смесь алюминиевого порошка и оксида металла, такого как железо. Когда эта смесь воспламеняется, происходит экзотермическая окислительно-восстановительная реакция, т.е.е. химическая реакция, в которой электроны передаются между двумя веществами. В результате реакции выделяется большое количество тепла в виде пламени и искр, а также поток расплавленного железа и оксида алюминия.
Когда эта смесь воспламеняется, происходит экзотермическая окислительно-восстановительная реакция, т.е.е. химическая реакция, в которой электроны передаются между двумя веществами. В результате реакции выделяется большое количество тепла в виде пламени и искр, а также поток расплавленного железа и оксида алюминия.
Когда термит помещается на лед и воспламеняется с помощью пламени, лед немедленно поджигается и выделяется большое количество тепла в виде взрыва. Нет единого научного мнения о том, почему термит в сочетании со льдом вызывает взрыв. Но одно ясно из демонстрационного видео — не пробуйте это дома!
12.Осциллирующие часы Бриггса-Раушера
Реакция Бриггса-Раушера — одна из очень немногих колеблющихся химических реакций. Три раствора, необходимые для этого наблюдения, представляют собой разбавленную смесь серной кислоты (H 2 SO 4 ) и йодата калия (KIO 3 ), разбавленную смесь малоновой кислоты (HOOOCCH 2 COOH), сульфата марганца. Моногидрат (MnSO 4 . H 2 O) и крахмал витекс, и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
Моногидрат (MnSO 4 . H 2 O) и крахмал витекс, и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
Реакция дает ошеломляющие визуальные эффекты, поскольку цвет раствора меняется взад и вперед. Чтобы инициировать реакцию, три бесцветных раствора смешивают вместе. Полученный раствор будет циклически менять цвет с прозрачного на янтарный на темно-синий в течение 3-5 минут, прежде чем станет темно-синим.
13. Переохлаждение воды
В этом эксперименте очищенная вода охлаждается ниже точки замерзания, а затем кристаллизуется в лед с помощью одного крана.Это можно сделать дома с помощью бутылки с дистиллированной водой. Просто дайте ему остыть в морозильной камере в течение двух часов. Затем выньте его и встряхните или постучите.
Поскольку вода не имеет примесей, молекулы воды не имеют ядра, вокруг которого могут образовываться твердые кристаллы. Внешняя энергия, обеспечиваемая в виде крана, заставит молекулы переохлажденной воды образовывать твердые кристаллы посредством зародышеобразования и запустит цепную реакцию, которая быстро кристаллизует воду во всей бутылке.
Внешняя энергия, обеспечиваемая в виде крана, заставит молекулы переохлажденной воды образовывать твердые кристаллы посредством зародышеобразования и запустит цепную реакцию, которая быстро кристаллизует воду во всей бутылке.
Ферромагнитная жидкость состоит из ферромагнитных частиц нанометрового размера, взвешенных в жидкости-носителе, такой как органический растворитель или масло. Магнитные частицы также покрыты поверхностно-активным веществом для предотвращения комкования. Первоначально они были обнаружены Исследовательским центром НАСА в 1960-х годах в рамках исследования по поиску методов контроля жидкостей в космосе.
Под воздействием сильных магнитных полей феррожидкости будут создавать впечатляющие формы и узоры.Эти жидкости могут быть приготовлены путем объединения пропорций соли Fe (II) и солей Fe (III) в щелочном растворе с образованием Fe 3 O 4.
Если вы можете найти немного сухого льда (замороженного углекислого газа), попробуйте этот эксперимент, чтобы создать гигантский пузырь дома, но при этом не забудьте принять соответствующие меры предосторожности с сухим льдом!
Возьмите миску и наполовину наполните ее водой. Смочите жидкое мыло водой и перемешайте.Намочите края миски пальцами и добавьте в раствор сухой лед. Окуните круглую полоску ткани в мыльную воду и протяните ее по всему краю миски. Подождите немного, пока сухой ледяной газ не окажется внутри мыльного пузыря, который начнет постепенно расширяться по мере расширения газа CO 2 .
16. Тиоцианат ртути и тепло
Когда тиоцианат ртути (II) воспламеняется, это приводит к быстрой экзотермической реакции, которая вызывает растущий столб, напоминающий змею, и разноцветное пламя, эффект, также известный как Змея фараона.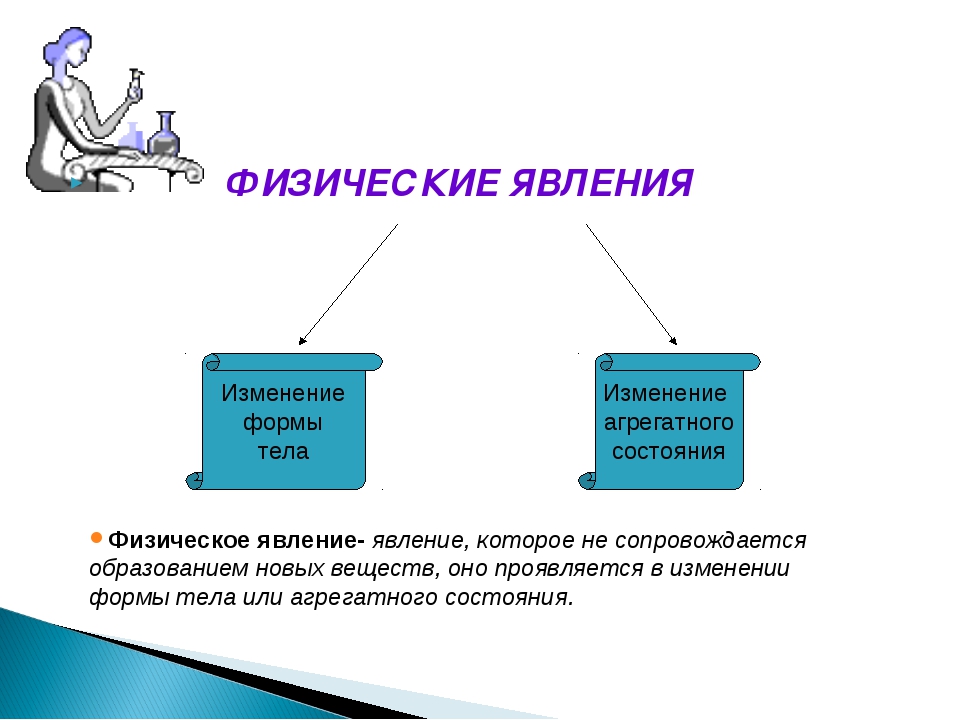 Раньше тиоцианат ртути использовался в фейерверках. Все соединения ртути токсичны, и самый безопасный способ провести этот эксперимент — в вытяжном шкафу.
Раньше тиоцианат ртути использовался в фейерверках. Все соединения ртути токсичны, и самый безопасный способ провести этот эксперимент — в вытяжном шкафу.
Охлаждение сверхпроводника ниже температуры перехода сделает его диамагнитным, заставляя его парить на выше магнита. Этот эффект привел к концепции транспортировки без трения, когда объект может левитировать по рельсам, а не прикрепляться к колесам.Однако этот эффект можно легко воспроизвести в лаборатории. Вам понадобится сверхпроводник и неодимовый магнит, а также жидкий азот. Охладите сверхпроводник жидким азотом и поместите сверху магнит, чтобы наблюдать левитацию.
18. Сверхтекучий гелий
Сверхтекучая среда — это состояние вещества, в котором вещество ведет себя как жидкость с нулевой вязкостью. Точка, в которой жидкость переходит в сверхтекучую, называется лямбда-точкой.Охлаждение гелия до его лямбда-точки (-271 ° C) сделает его сверхтекучим, известным как гелий II.
Точка, в которой жидкость переходит в сверхтекучую, называется лямбда-точкой.Охлаждение гелия до его лямбда-точки (-271 ° C) сделает его сверхтекучим, известным как гелий II.
Способность гелия оставаться жидкостью при очень низких температурах позволяет ему образовывать конденсат Бозе-Эйнштейна, при этом отдельные частицы перекрываются, пока не станут вести себя как одна большая частица. В этом состоянии без трения гелий будет делать то, что другие жидкости не могут, например, проходить сквозь трещины, толщиной с молекулы, преодолевать гравитацию, взбираясь по стенкам тарелки, и оставаться неподвижным внутри движущегося контейнера.
Примеры химических изменений в повседневной жизни
Химические изменения могут напоминать фейерверки или взрывы. Однако некоторые примеры химических изменений неуловимы. Изучите примеры химических изменений в кулинарии, природе и вашем доме. Получите представление о разнице между физическими и химическими изменениями.
Примеры химических изменений
Не все реакции являются химическими. Однако если в результате реакции образуется новое вещество, значит, вы наблюдаете химическое изменение.Например, фейерверк, закрывающий небо четвертого июля, является результатом химического изменения. Фотосинтез у растений также является примером химической реакции. В этом случае солнечный свет превращается в пищу для растения. Обычно химические реакции имеют несколько сигналов, в том числе:
- Изменение цвета
- Высвобождение или поглощение энергии
- Изменение запаха
- Производство газа
Химические изменения происходят повсюду вокруг вас, даже в вашем собственном доме.Изучите несколько забавных примеров из кулинарии, природы и вашего дома.
Примеры химических изменений в кулинарии
Когда вы смешиваете муку и сахар, чтобы сделать торт, вы можете не подумать, что это химическая реакция, но это так. Выпечка торта — классический пример, когда новое вещество создается путем смешивания муки, сахара, ванили, какао и тепла. Вот еще несколько примеров приготовления.
Вот еще несколько примеров приготовления.
Rising Bread
Рост хлеба — это здорово, не так ли? Не так много! Однако не все химические изменения вызывают восхищение.Хотя дрожжи, вызывающие подъем хлеба, не вызывают острых ощущений, они представляют собой химические изменения. Почему? Итак, дрожжи расщепляют крахмал в хлебном тесте на сахар, который превращается в углекислый газ и этанол. Углекислый газ заставляет хлеб подниматься.
Карамелизация
Любите карамелизированный лук? В любом случае, это отличный пример химического изменения. При карамелизации сахар расщепляется, чтобы создать специфический аромат и вкус.
Майяр Браунинг
Майяр Браунинг — странное название, но благодаря ему получается восхитительная коричневая корочка на хлебе и жареном на гриле мясе.Браунинг Майяра, названный в честь химика Луи-Камиля Майяра, представляет собой серию химических реакций, начинающихся с аминокислот и сахара.
Природные примеры химических изменений
Кулинария — не единственное место, где вы видите химические изменения. От того, как ваше тело переваривает пищу до горящей спички, когда вы ударяете по ней, химические реакции можно найти повсюду. Погрузитесь в несколько примеров из природы и вашего дома.
От того, как ваше тело переваривает пищу до горящей спички, когда вы ударяете по ней, химические реакции можно найти повсюду. Погрузитесь в несколько примеров из природы и вашего дома.
Листья, меняющие цвет
Эти прекрасные цвета осени не случаются.Они появились благодаря химическим изменениям в листьях. Обычно листья зеленые из-за хлорофилла, используемого для фотосинтеза. Однако, прежде чем деревья вздремнут зимой, хлорофилл в листьях разрушается. Когда хлорофилл расщепляется, каротин и антоцианы, естественным образом содержащиеся в листьях в течение всего лета, занимают центральное место, создавая красивые красные и желтые цвета.
Souring Food
Одной из ключевых характеристик химического изменения является запах, поэтому люди могут нюхать продукты, чтобы узнать, испортились ли они.Например, молоко портится из-за брожения. Здесь лактоза превращается в молочную кислоту бактериями, пережившими пастеризацию.
Возгорание
Когда что-то подвергается химической реакции, это становится чем-то другим.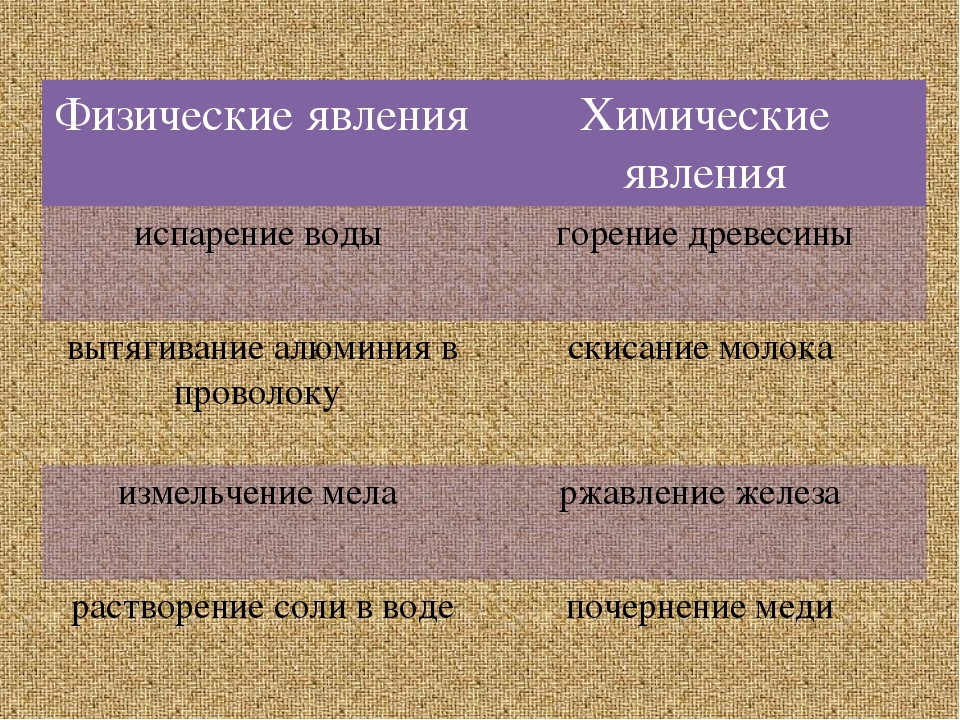 Например, когда дерево горит, оно превращается в золу. Причина ожога древесины — это горение.
Например, когда дерево горит, оно превращается в золу. Причина ожога древесины — это горение.
Смешивание пищевой соды и уксуса
Если вы смешаете кислоту, такую как уксус, с основанием, например, пищевой содой, вы получите химическую реакцию.В этом случае он начинает пузыриться. Это отличный способ создать самодельный вулкан.
Ржавчина автомобиля
Ваша машина никогда не должна ржаветь. Однако где бы вы ни жили, это неизбежно. Ржавчина — это химическое изменение, происходящее при контакте железа с металлом. Если ваш автомобиль не сделан из пластика или пузыря, он найдет способ заржаветь.
Химические изменения против физических изменений
Непонятной областью в химии может быть разница между химическими и физическими изменениями.В то время как химическое изменение — это когда что-то становится новым веществом, физическое изменение — это когда вещество меняет форму, но остается прежним. Например, когда вода замораживается, она меняет форму, но остается водой. Когда вода испаряется в воздух, она меняет форму, но остается водой. Если измельчить кусок сыра, сыр останется сыром, но изменит форму.
Когда вода испаряется в воздух, она меняет форму, но остается водой. Если измельчить кусок сыра, сыр останется сыром, но изменит форму.
Веселые химические изменения
Химия — это развлечение. Если вы когда-нибудь строили самодельный вулкан, вы знаете, что это может быть захватывающе.Однако не все изменения являются химическими. Химические изменения происходят только тогда, когда образуется новое вещество. Имея твердое представление о химических изменениях, проверьте биотические факторы и абиотические факторы.
Самый быстрый словарь в мире: Vocabulary.com
химическое явление любое природное явление, связанное с химией
физическое явление природное явление, связанное с физическими свойствами материи и энергии
механическое явление физическое явление, связанное с равновесием или движением предметов
геологическое явление природное явление, связанное со структурой или составом земли
оптическое явление физическое явление, связанное со светом или с его участием
электрическое явление физическое явление, связанное с электричеством
Феномен Любое состояние или процесс, известный через органы чувств
природное явление Все неискусственные явления
химический элемент любое из более чем 100 известных веществ (из которых 92 встречаются в природе), которые не могут быть разделены на более простые вещества и которые по отдельности или в комбинации составляют все вещество
психический феномен Явления, которые кажутся противоречащими физическим законам и предполагают возможность причинной связи психическими процессами
органическое явление природное явление с участием живых растений и животных
химическая нотация обозначение, используемое химиками для выражения технических фактов в химии
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
процедуры химической защиты, связанные с принятием мер защиты от нападений с использованием химических агентов
химическое машиностроение отрасль машиностроения, которая занимается проектированием, строительством и эксплуатацией установок и оборудования, используемых в промышленных химических процессах
Феномен Тарчанова — изменение электрических свойств кожи в ответ на стресс или тревогу; можно измерить либо путем регистрации электрического сопротивления кожи, либо путем регистрации слабых токов, генерируемых телом
химическая формула: обозначение вещества с использованием символов составляющих его элементов
Процесс химического изменения, определяемый составом и структурой веществ
химическая реакция процесс, в котором вещества превращаются в другие
эпифеномен вторичный феномен, являющийся побочным продуктом другого явления
Химические изменения | |||
I Это F нашего июля в Провиденс, Род-Айленд.Блестящий фейерверки взрываются в ночном небе. Когда ты смотришь на фейерверк, вы видите ослепительные искры красной, белой и синей струйкой вниз во всех направлениях. Взрыв фейерверка — это пример химического изменения. Во время химического изменения вещества заменяются на другие вещества. Другими словами, состав изменения содержания. | |||
Знаки химических изменений Как узнать, является ли изменение химическое изменение? Если вы думаете, что не знакомы с химическими изменениями, подумай еще раз. | Физические изменения относительно легко
идентифицировать.Если изменяется только форма вещества, вы наблюдаете
физическое изменение. Обычное физическое изменение происходит, когда материя меняется от одной фазы к другой. Когда кубик льда тает за Например, становится жидкой водой. Твердый лед и жидкая вода имеют такой же состав. Единственное отличие — форма. | ||
| C ol o r
Изменения Как и в случае с осенними листьями, изменение окраски ключ, чтобы указать на химическое изменение. Возможно, вы нашли наполовину съеденное яблоко, которое превращается коричневый. Причина в том, что химические изменения происходят, когда пища портит. | Вы только что стали свидетелями впечатляющего химическое изменение, если вы видели изменение листьев цвет осенью. | ||
| Когда ты испечь пирог, энергия поглощается жидким тестом, поскольку оно превращается в жидкое смешать в торт. | Энергия — Поглощено или высвобождено Еще один признак химического изменения — выброс или усиление энергии объектом. Многие вещества поглощают энергию, чтобы претерпеть химическое изменение. Энергия поглощается во время химических изменений. в кулинарии, как при выпекании торта. | ||
| Энергия также может быть выпущена во время химической смены. Фейерверки
упомянутые выше высвобождают энергию в виде света
что вы можете видеть. Вы также можете видеть, что энергия высвобождается, когда в этом видеоролик, когда натрий и хлор смешиваются с водой. | |||
| Запах
Изменения Достаточно одного опыта с тухлым яйцом, чтобы научиться что они пахнут иначе, чем свежие яйца. Когда портятся яйца и еда, они претерпевают химическое изменение.Изменение запаха — ключ к разгадке химическая замена . | Когда вы чувствуете странный запах в еде такие как курица, свинина из майонеза, вы знаете, что еда подверглась химическое изменение. Вы можете использовать эту подсказку, чтобы не есть испорченные еда и заболевание. | ||
| Производство
Газы или твердые вещества Образование газа — ключ к разгадке химического изменения.Пузырьки газа, которые вы наблюдали, образуются при приеме антацида. падение в воду — пример изменения. Еще один признак того, что произошло химическое изменение, — это образование твердого тела. Твердое вещество, выделяющееся из раствора во время химическое изменение называется осадком. | |||
| Когда дерево горит, оно превращается в кучу пепла и газы, поднимающиеся в воздух.После того, как дрова обожжены, его нельзя восстановлен в первоначальном виде в виде бревна. | Не легко
перевернутый Чем отличаются друг от друга физические и химические изменения Другие? Подумайте на мгновение о льду. После того, как лед тает в жидкую воду, вы можете повторно заморозить ее в твердый лед, если температура капли. Замораживание и таяние — это физические изменения. Вещества образуется во время химических изменений, однако не может легко превратиться обратно в исходные вещества. | ||
| Химический и физический Изменить | T самая важная важная вещь , которую вы должны запомнить, это что при физическом изменении состав вещества не меняется и при химическом изменении состав вещества менять. | ||
| Химическая промышленность
Реакции Химические изменения также называются химическими Реакции.Химические реакции включают сочетание различных вещества. В результате химической реакции образуется новое вещество с новым и различные физические и химические свойства. Дело никогда уничтожено или создано химическим путем реакции. Частицы одного вещества перестраиваются, образуя новое вещество. То же количество частиц, что существуют до реакции существуют после реакции. | |||
| Чтобы создать собственное химическое изменение,
нажмите на Fireworks. Найти
больше интересной информации о фейерверках, которые вы видите, нажмите
здесь. Хранение потребительских фейерверков в Род-Айленде запрещено законом. однако есть еще много возможностей насладиться прекрасным показывать. Хотя редко случается, возможно, что компонент фейерверка упадет на землю без взрыва. | |||

 Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.
Это одна из самых распространенных ежедневных химических реакций, а также одна из самых важных, поскольку именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород.
 Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов.
Углекислый газ образует пузырьки и помогает «выращиванию» хлебобулочных изделий. Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов. Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O.
Эти процессы нейтрализуют друг друга, получая соль и воду. Хлорид натрия не является единственной солью, которая может быть образована. Например, здесь приведено химическое уравнение для реакции кислотно-щелочной реакции, в которой образуется хлорид калия, обычный заменитель столовой соли: HCl + KOH → KCl + H 2 O.
 Атомы образуют молекулы размером от двух до тысяч атомов. (MS-PS1-1)
Атомы образуют молекулы размером от двух до тысяч атомов. (MS-PS1-1) В науке тепло используется только для этого второго значения; это относится к энергии, передаваемой из-за разницы температур между двумя объектами. (вторичный по отношению к MS-PS1-4)
В науке тепло используется только для этого второго значения; это относится к энергии, передаваемой из-за разницы температур между двумя объектами. (вторичный по отношению к MS-PS1-4) 
 .Это также происходит внутри нашего тела, поскольку с кислородом, который мы получаем при дыхании, мы затем приступаем к окислению молекул глюкозы, получая таким образом химическую энергию.
.Это также происходит внутри нашего тела, поскольку с кислородом, который мы получаем при дыхании, мы затем приступаем к окислению молекул глюкозы, получая таким образом химическую энергию.