«Периодический закон и Периодическая таблица Д.И. Менделеева»
Периодический закон и периодическая система химических элементов Д.И.Менделеева.
“О сколько нам открытий чудных
Готовит просвещенья дух,
И опыт, сын ошибок трудных,
И гений, парадоксов друг,
И случай, бог – изобретатель…”(А.С.Пушкин)
Цели урока.
Обобщить и систематизировать знания и умения учащихся по изученной теме. Учащиеся должны знать терминологию по теме “Периодический закон”, строение периодической системы химических элементов Д.И.Менделеева (ПСХЭМ) и строение атома, значение периодического закона. Уметь по электронной формуле атома определять химический символ элемента, положение его в ПСХЭМ, работать самостоятельно и коллективно, выделять главное, сравнивать, делать выводы и прогнозы.
Оборудование.
Портрет Д.И.Менделеева, электронная ПСХЭМ, карточки с заданиями, конверты с заданиями, жетоны для оценивания ответов (Подготовленные для печати карточки расположены в приложениях <Приложение1> – <Приложение4>, цитаты к домашнему заданию расположены в <Приложении5>).
Ход урока
(1 минута)
Учитель. Добрый день, ребята и гости! Ребята, будьте внимательны и сосредоточены! Наш урок посвящен периодическому закону, ПСХЭМ и строению атома. Начнем урок.
1. Разминка. (Работаем с таблицей элементов)
(4 минуты)
- Какой элемент не имеет “постоянной прописки” в таблице? (Н)
- Какой элемент назван в честь России? (Рутений)
- Какой элемент “говорит”, что он, это не он. (неон)
- Какой элемент обречён на вечные муки?.
 .. историки
(Тантал)
.. историки
(Тантал) - Какой элемент настоящий гигант? (Титан)
- Какой элемент вращается вокруг солнца?
- Какой элемент назван в честь Д.И. Менделеева? (101Менделевий)
Элемент №101 был впервые получен в начале 1955 г. в Радиационной лаборатории Калифорнийского университета группой американских ученых.
— Какую формулировку Периодического закона дал Д.И. Менделеев?
— Как звучит современная формулировка закона?
Конечно, вклад Д.И. Менделеева в развитие химии огромный, но он работал над проблемой классификации элементов не в одиночку. И до него, и после него были сделаны открытия, позволившие раскрыть сущность закона и подтвердить те данные, которые Менделеев мог только предполагать.
2. Ученые-химики.
(5 минут)
(на доске — портреты ученых)
- До сих пор используется модель атома,
предложенная в 1911г.
 Какой ученый её предложил?
(Эрнест Резерфорд, шотландец по происхождению,
один из 12 детей)
Какой ученый её предложил?
(Эрнест Резерфорд, шотландец по происхождению,
один из 12 детей) - Ирландский ученый, предложивший назвать частицы, переносящие электричество – электронами. Греч. – “янтарь” ( 1891 г Джордж Джонстон Стони)
- Английский и французский учёный, доказавшие, что электроны отрицательно заряжены. (Джозеф Томсон и Жан Перрен)
- Один из них вычислил скорость электрона и его массу. (300 тыс. км/с, в 2 тыс. раз легче водорода). (Джозеф Томсон)
Вопрос классу. Что является графическим изображением периодического Закона? (Периодическая таблица Д.И. Менделеева)
3. Экспресс-экзамен.
(7 минут)
(Учитель поочередно предлагает ученикам
карточки с вопросами. Каждый ученик должен
ответить один раз. За правильный ответ – жетон
определенного цвета, ответ неполный – жетон
другого цвета, неверный ответ – жетон-штраф ).
1. Какую информацию о строении атома даёт…:
(вопрос на доске пишется тем же цветом что и карточки)
| Порядковый номер элемента | Номер группы | Номер периода |
2. Как определить, пользуясь таблицей Менделеева…
(цвет вопроса тот же что и карточки)
Число протонов в атоме Число нейтронов Число электронов
Заряд ядра атома Кол – во энергетических уровней Кол –во электронов на внешнем уровне
4. Работа с электронной таблицей и у доски.
Работа с электронной таблицей и у доски.
(10 минут)
Учитель. Теперь проверим на практике, как вы умеете применять свои знания.
(Задание выполняют по 2 ученика на доске, остальные в тетрадях- число, тема, № урока)
После сделанного задания ученик подходит к электронной таблице и показывает элемент, класс проверяет правильность записи на доске. На электронной таблице отображается строение атома.
- Записать строение атома с №6 №9
- Усложняем задание + 12 )2 ) ) …)2 ) )5
- И ещё сложнее – масса нейтронов = массе протонов=20. Написать строение атома.
Учитель. Итак, экзамен вы сдали, я ваши знания проверила. А теперь вы проверьте работу одного ученика (запись на доске).
1S22S22P7 1S22S22P6 3S
С проверкой справились. А вот с шифровкой
справитесь? (учитель раздаёт на каждую парту
одну шифровку – работа в парах.) Показать
расшифрованный элемент на электронной таблице.
А вот с шифровкой
справитесь? (учитель раздаёт на каждую парту
одну шифровку – работа в парах.) Показать
расшифрованный элемент на электронной таблице.
ШИФРОВКИ:
Показать элемент у которого 13 протонов в ядре. ) ) )8
Элемент у которого число протонов = возрасту Менделеева, на момент открытия Периодического Закона. ) ) )9)2
Если к числу электронов прибавить число протонов, то получится 28. Si 1S22S22P63S23P64S1
Учитель.
5. Игра “Путаница”
1. Отличаются, химического, нейтронов, элемента, изотопы, числом, одного.
(Изотопы одного химического элемента отличаются числом нейтронов..)
2. Атома, положительно, ядро, заряжено. (Ядро атома заряжено положительно.)
3. Нейтронов, ядро, и, состоит, атома, протонов, из.
(Ядро атома состоит из протонов и нейтронов.)
4. Ядра, определяется, масс, и, масса, протонов, атома, нейтронов, суммой.
(Масса ядра атома определяется суммой масс протонов и нейтронов.)
5. Равно, в, число, числу, электронов, протонов, атоме.
(Число электронов в атоме равно числу протонов.)
6. Числом, ядра, заряд, протонов, атома, определяется.
(Заряд ядра атома определяется числом
протонов.
6. Физкульт. – минутка. “Живые элементы”
(5 минут)
Представим на минутку, что вы – это химические элементы.(раздаются карточки с химическими символами, которые дети готовили на первых уроках)
Учитель.
– Ну-ка, встаньте дружно в ряд — металлический отряд!
А теперь отряд постройся так, чтоб радиус разросся!
Самый сильный где металл?
Вопросы команде за партами –
— Назовите особенности строения атомов металлов.
А теперь предстань пред нами неметаллов дружный ряд.
Как построиться прилично, чтобы свойства увеличились?
Самый сильный окислитель — ?
Вопросы команде за партами –
— Назовите особенности строения атомов неметаллов.
7. А теперь играем в “да — нет — ку”.
(3 минуты)
(если предложение верно – пишем “+”, если неверно – “-”)
- Годом открытия Д.
 И.Менделеевым периодического
закона считают 1834г. (- )
И.Менделеевым периодического
закона считают 1834г. (- ) - Физический смысл порядкового номера химического элемента в том, что он определяет атомную массу элемента. (- )
- Число протонов в ядре атома равно числу электронов; (+)
- Металлические свойства слева направо ослабевают; (+)
- Принцип заполнения электронами энергетических ячеек предложил химик Паули (+)
САМОПРОВЕРКА
(2 минуты)
(ответы на доске, спрятаны за “чистым” листом)
А вот ответ на первый вопрос диктанта. На лист заранее нанести реактив – KCNS и из пульверизатора распределить хлорид железа (III), 1869 год – год открытия закона.
ПОДВОДИМ ИТОГИ
(2 минуты)
— Сделайте вывод об изменении свойств элементов в пределах одного периода.
— Сделайте вывод об изменении свойств
элементов в пределах одной группы.
— Как взаимосвязаны изменения свойств элементов и способность отдавать или принимать электроны?
Эта закономерность будет составлять основу нашей следующей темы – “Химическая связь”.
Домашнее задание – найти высказывания известных людей о значении Периодического закона
Выставление оценок, комментарии, оценка урока учащимися.
Ребята, спасибо за урок! Я закончу его строками из стихотворения С.Щипачева “Читая Менделеева”:
“Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится, мир живой,
Входи в него, вдыхай, руками трогай”.
Приложение 2
Приложение 3
ГДЗ (ответы) Химия 8 класс Григорович А.
 В., 2016 §8 Значение Периодического закона. Научная прозорливость Д. И. Менделеева » Допомога учням
В., 2016 §8 Значение Периодического закона. Научная прозорливость Д. И. Менделеева » Допомога учнямДругие задания смотри здесь…
Контрольные вопросы
Вопрос 1 Опишите научное значение Периодического закона.
Периодический закон — фундаментальный закон природы, который позволяет объяснить и предсказать свойства химических элементов и образованных ими соединений.
Почему попытки классификации химических элементов, сделанные до Менделеева, нельзя считать фундаментальными законами природы?
Никому из ученых до Менделеева не удавалось, даже с использованием определенных знаний о химических свойствах, выстроить систему для всех известных к тому времени элементов, прежде всего из-за того, что свойства многих элементов были определены неправильно или не определены вообще, а закон должен не только объяснять факты и явления, но и предопределять новые открытия.
Вопрос 2 Каким образом Периодический закон позволяет предсказать свойства химических элементов и образованных ими химических соединений? Приведите конкретные примеры. Свойства новых открытых элементов — их назвали Галлием и Германием — практически совпали с предсказанными Менделеевым свойствами Экаалюминия и Экасилиция.
Свойства новых открытых элементов — их назвали Галлием и Германием — практически совпали с предсказанными Менделеевым свойствами Экаалюминия и Экасилиция.
Вопрос 3 Объясните, почему открытие инертных газов поставило под вопрос справедливость Периодического закона. Инертные газы не реагировали ни с одним веществом и попытки получить соединения инертных элементов с другими элементами не давали результатов, таким образом, появились элементы с неизвестными валентностями, и им не было места в Периодической системе. Так как новые элементы были чрезвычайно химически инертны, Д.И.Менделеев расположил их между элементами групп галогенов и щелочных элементов в отдельную группу с номером 0 (в современной Периодической системе они расположены в VIII группе). Так периоды Периодической системы получили свое логическое завершение.
Задания для усвоения материала
Упражнение 1 На основе Периодического закона определите значения относительных атомных масс Галлия и Селена. Сравните полученные данные с приведенными в Периодической системе.
Сравните полученные данные с приведенными в Периодической системе.
Д.И.Менделеев определял свойства какого-либо неизвестного элемента как средние между свойствами элементов, окружающих его в Периодической системе. Так, слева и справа от Германия расположены соответственно Галлий и Арсен, а сверху и снизу — Силиций и Станнум. По методу Менделеева, относительная атомная масса Германия должна быть равна среднему арифметическому относительных атомных масс этих четырех элементов.
Ar(Ga)=(Ar(Zn)+Ar(Ge)+Ar(Al)+Ar(In)):4=(65,41+72,64+26,982+114,82):4=
=69,96 Полученное число близкое к значению относительной атомной массы Галлию (69,72)
Аналогично вычислим значение относительной атомной массы Селена.
Ar(Se)=(Ar(As)+Ar(Br)+Ar(S)+Ar(Te)):4=(74,922+79,904+32,06+127,6):4=
=78,62 Полученное число близкое к значению относительной атомной массы Cелена (78,96)
Упражнение 2 Составьте формулы соединений с Хлором тех элементов, существование которых было предсказано Д. И. Менделеевым (№21 Скандий Sc, №31 Галлий Ga, №32 Гермаий Ge)..
И. Менделеевым (№21 Скандий Sc, №31 Галлий Ga, №32 Гермаий Ge)..
Ответ: ScCl2, GaCl3, GeCl4
Упражнение 3 Назовите известные вам простые вещества, молекулы которых в газообразном состоянии являются:
а) одноатомными
Инертные газы — гелий Не, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn
б) двухатомными
Кислород O2, азот N2, водород H2, хлор Cl2, фтор F2, бром Br2, иод I2
Упражнение 5 Какие нарушения в закономерном изменении свойств элементов второго периода будут возникать, если элемент Бериллий поместить в соответствии с его бывшим (неправильным) значением относительной атомной массы (13,5)? Бериллий — металлический элемент, а в ошибочном случае размещался бы среди неметаллических элементов.
Упражнение 6 Химические элементы А, Б и В относятся к главным подгруппам II, IV и VI групп соответственно (верно IV, VI, и II групп соответственно). Химические элементы А и Б относятся к одному периоду и образуют друг с другом два соединения: одно способно гореть, а другое — нет. Соединения этих трех элементов распространены в природе и применяются в производстве строительных материалов. Назовите эти элементы.
Химические элементы А и Б относятся к одному периоду и образуют друг с другом два соединения: одно способно гореть, а другое — нет. Соединения этих трех элементов распространены в природе и применяются в производстве строительных материалов. Назовите эти элементы.
Ответ: Карбон, Оксиген и Кальций
Карбон С и Оксиген О — относятся к одному (2) периоду, образуя соединения СО — угарный газ, что способен гореть и СО2 —углекислий газ, что не поддерживает горение. Соединение этих трех элементов СаСО3 распространена в природе (входит в состав известняка, мела, мрамора) и применяется в производстве строительных материалов.
Упражнение 7 Определите в Периодической системе элемент, высший оксид которого имеет валентность не больше IV и относительную молекулярную массу (с точностью до единицы).
По условию валентность не больше IV, поэтому определяем среди таких оксидов:
R2О (І), RO (ІІ), R2O3 (ІІІ), RO2(IV).
а) 94
Mr(R2O)=2•Ar(R)+Ar(О), отсюда Ar(R)=(Mr(R2O)-Ar(О)):2=(94-16):2=39 Такую относительную атомную массу имеет Калий.
Mr(RO)=Ar(R)+Ar(О), отсюда Ar(R)=Mr(RO)-Ar(О)=94-16=78 — не подходит
Mr(R2O3)=2•Ar(R)+3•Ar(О), отсюда Ar(R)=(Mr(R2O)-3•Ar(О)):2=(94-3•16):2=23 — не подходит
Mr(RO2)=Ar(R)+2•Ar(О), отсюда Ar(R)=Mr(R2O)-2•Ar(О)=94-2•16=62 — не подходит
Ответ: Кальций Са
б) 102
Mr(R2O)=2•Ar(R)+Ar(О), отсюда Ar(R)=(Mr(R2O)-Ar(О)):2=(102-16):2=43 — не подходит
Mr(RO)=Ar(R)+Ar(О), отсюда Ar(R)=Mr(RO)-Ar(О)=102-16=86 — не подходит
Mr(R2O3)=2•Ar(R)+3•Ar(О), отсюда Ar(R)=(Mr(R2O)-3•Ar(О)):2=(102-3•16):2=27 Такую относительную атомную массу имеет Алюминий.
Mr(RO2)=Ar(R)+2•Ar(О), отсюда Ar(R)=Mr(R2O)-2•Ar(О)=102-2•16=70 — не подходит
Ответ: Алюминий Al
Другие задания смотри здесь…
Урок №49. Повторение и обобщение по теме « Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома»
Урок №49. Повторение и обобщение по теме « Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома»
Сделайте характеристику лития и фтора по плану в тетради.
План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
1.Название
2.Химический знак
3.Порядковый номер
4.Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6.Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов =
атомная масса (Ar из таблицы Менделеева)
– число протонов.
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s— и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s— и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d— элементов на
последнем уровне число электронов всегда равно 2 (исключения – хром, медь,
серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n2, где n – номер энерг. уровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV – 32 электрона и т.д.
9.Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
Помните! На s – орбитали максимум может быть 2
электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента — водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d— и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11.Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего
водородного соединения дана под группой химических элементов (RH4, RH3 и т. д.) – только для элементов 4 -8 групп.
д.) – только для элементов 4 -8 групп.
Задание для самостоятельной работы:
Дайте характеристику следующим элементам по плану: кальций, фосфор по желанию, высылать работу не нужно.
План характеристики химического элемента по его положению в Периодической системе элементов Д. И. Менделеева
Тренажёр №1 «Характеристика элемента металла по его положению в Периодической системе элементов Д. И. Менделеева»
Тренажёр №2 «Характеристика элемента неметалла по его положению в Периодической системе элементов Д. И. Менделеева»
Тестовые задания по теме «Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома»
Вариант I
1. Группа элементов, образованная только металлами
1) S, Ca, O 2) Cu, Ca, Na 3) Cu, Fe, P 4) H, O, S
2. Периодический закон открыл
1) И. Деберейнер 2) А. Шанкуртуа 3) Д. И. Менделеев 4) У. Одлинг
Деберейнер 2) А. Шанкуртуа 3) Д. И. Менделеев 4) У. Одлинг
3. Химический элемент – это вид атомов с одинаковым
1) числом нейтронов 3) массой
2) зарядом ядра 4) числом нейтронов и протонов
4. Электроны атома в совокупности образуют
1) орбиталь 3) электронную оболочку атома
2) электронное облако 4) электронный слой
5. Число нейтронов в изотопе равно:
1) 18 2) 17 3) 52 4) 18,5
6. В одном периоде находятся элементы
1) Li, Na, K 2) Li, Be, B 3) Cu, Ag, Au 4) O, S, Cr
7. На третьем энергетическом уровне максимально может находиться
1) 8 электронов 2) 2 электрона 3) 32 электрона 4) 18 электронов
8. Электроны, которые образуют орбиталь гантелеобразной формы, называют
1) d-электронами 3) p-электронами
2) f-электронами 4) s- электронами
9. Электронная формула магния Mg
Электронная формула магния Mg
1) 1s2 2s2 2p6 3s2 2)1s2 2s2 2p6 3s1 3p1 3) 1s2 2s2 2p6 3p2 4) 1s2 2s2 2p5 3s2 3p1
10. Сравнительные размеры атомных радиусов кислорода и азота правильно отражает условная запись
1) O ˂ N 2) O = N 3) O > N 4) O <= N
11. Выраженность металлических свойств у лития и калия правильно отражает условная запись
1) Li < K 2) Li = K 3) Li > K 4) Li <= K
12. Неметаллические свойства у атомов элементов IVA-группы (сверху вниз)
1) убывают 3) сначала убывают, а затем возрастают
2) возрастают 4) остаются неизменными
13. Формула высшего оксида азота N
1) NH₃ 2) NO₂ 3) N₂O₅ 4) NO
14. Формула летучего водородного соединения элемента Э, электронная формула которого 1s2 2s2 2p6 3s2 3p4
1) ЭН₂ 2) ЭН₄ 3) ЭН 4) ЭН₆
Вариант II
1. Группа элементов, образованная только неметаллами
Группа элементов, образованная только неметаллами
1) S, Ca, O 2) Cu, Ca, N 3) Cu, Fe, P 4) H, O, S
2. Планетарную модель атома предложил
1) М. В. Ломоносов
2) Д. И. Менделеев
3) Э. Резерфорд
4) А. Беккерель
3. Превращение атомов одних элементов в атомы других элементов называют реакциями
1) окислительно-восстановительными 3) соединения
2) Замещения 4) ядерными
4. Номера периода показывают
1) массу атома
2) число электронов на внешнем энергетическом уровне
3) число электронных энергетических уровней
4) заряд ядра атома
5. Число протонов в изотопе кислорода равно:
1) 7 2) 8 3) 15 4) 23
6. В VA-группу входят элементы
1) C, N, O 2) N, P, V 3) P, As, Sb 4) O, S, Se
7. Электроны, которые образуют орбиталь шарообразной формы, называют
1) d-электронами 3) p-электронами
2) f-электронами 4) s-электронами
8. Максимальное число d-орбиталей на одном энергетическом уровне
Максимальное число d-орбиталей на одном энергетическом уровне
1) 5 2) 1 3) 3 4) 7
9. Электронная формула серы S
1) 1s2 2s2 2p6 3s4 3p2 2) 1s2 2s2 2p6 3s3 3p3 3) 1s2 2s2 2p6 3s2 3p4 4) 1s2 2s2 2p5 3p6
10. Сравнительные размеры атомных радиусов кислорода и селена правильно отражает условная запись
1) O < Se 2) O = Se 3) O > Se 4) O <= Se
11. Выраженность металлических свойств у углерода и кремния правильно отражает условная запись
1) C < Si 2) C = Si 3) C > Si 4) C <= Si
12. Неметаллические свойства у атомов элементов 2-го периода (слева направо)
1) убывают 3) Сначала убывают, а затем возрастают
2) возрастают 4) остаются неизменными
13. Формулы высшего оксида серы S
1)H₂S 2) SO₂ 3) SO 4) SO₃
14. Формула летучего водородного соединения элемента Э, электронная формула которого 1s2 2s2 2p6 3s2 3p5
1) ЭН₂ 2) ЭН₄ 3) ЭН 4) ЭН₇
План-конспект урока » Периодическая система химических элементов»
Тема урока: Периодическая система химических элементов.
Цель урока: рассмотреть периодическую систему химических элементов.
Задачи урока:
1) дать понятие о структуре периодической системы;
2) помочь учащимся выяснить сходство и различие в характере изменения свойств атомов элементов больших и малых периодов, особенности групп А и групп В.
3) обучать умению обобщать полученные сведения.
Тип урока: урок изучения нового материала
Методы: словесные, словесно-наглядные.
Формируемые понятия: периодическая система, главная группа, побочная группа, период.
Развиваемые понятия: периодический закон, периодичность, систематизация.
Литература для учителя: учебник 8 класса,
Сечко, О. И. Химия: 7 – 8 классы: дидактические материалы: пособие для учителей общеобразоват. учреждений / О. И. Сечко, И. И. Окова. – Минск: Аверсэв, 2009. – 128 с.
Литература для учащихся: учебник 8 класса
Ход урока
1) Организация начала занятия
Здравствуйте!
Присаживайтесь. Кто дежурный? Кто сегодня отсутствует? У всех есть всё
необходимое на партах? Приступим к занятию.
Кто дежурный? Кто сегодня отсутствует? У всех есть всё
необходимое на партах? Приступим к занятию.
2) Проверка выполнения домашнего задания
2 ученика вызываются к доске для выполнения письменного задания (задания на карточках).
1. Составить уравнения реакций полной нейтрализации между кислотами (серная, фосфорная) и основаниями (гидроксид натрия и гидроксид магния). Назвать все образующиеся соединения.
Решение.
H2SO4 + 2 NaOH →Na2SO4 + 2H2O (сульфат натрия)
H2SO4 + Mg(OH)2 → MgSO4 + 2H2O (сульфат магния)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (фосфат натрия)
2H3PO4 + 3Mg(OH)2 → Mg3(PO4)2 + 6H2O (фосфат магния)
2. Составьте уравнения реакций, при помощи которых можно осуществить превращения согласно приведенной схеме:
Mg→MgO→ Mg(OH)2 →MgCl2
Решение.
2Mg + O2 → 2MgO
MgO + H2O → Mg(OH)2
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
В это время остальной класс занят фронтальным опросом.
Вопросы:
1. Какие характеристики химических элементов взял Д. И. Менделеев за основу своей систематизации? (атомная масса).
2. Почему открытый Д. И. Менделеевым закон носит название «периодического»? Каков смысл этого названия? (смысл заключается в том, что по мере непрерывного увеличения относительной атомной массы через определенное число элементов регулярно появляется схожесть состава и свойств соединений элементов).
3. Сформулируйте периодический закон.(отвечает несколько человек).
4. В каком году был открыт периодический закон? (1869).
5.
Как
изменяются металлические свойства простых веществ в периодах с возрастанием
относительных атомных масс элементов, которые образуют эти вещества?
(уменьшаются).
6. Как изменяются неметаллические свойства простых веществ в периодах с возрастанием относительных атомных масс элементов, которые образуют эти вещества? (увеличиваются).
7. Как изменяются свойства высших оксидов и соответствующих им гидроксидов (оснований и кислот) с возрастанием относительных атомных масс? (от основных к кислотным).
Учитель проходит по классу и проверяет наличие домашнего задания в тетрадях.
Зачитывается сообщение «Интересные факты из жизни Д. И. Менделеева».
3) Подготовка к основному этапу занятия
На предыдущем уроке мы рассмотрели периодический закон Д. И. Менделеева. Опираясь на периодический закон, Менделеев построил естественную классификацию химических элементов – периодическую систему химических элементов. Ее графическим изображением является таблица, которая так и называется – периодическая система химических элементов. Запишите в тетради тему урока.
4) Усвоение новых знаний и способов действий.
Формы таблиц различны (показать различные изображения таблицы Менделеева). В настоящее время наиболее широко используется таблица, представленная на первом форзаце учебника.
Каждый химический элемент занимает одну клетку, в которой указаны химический знак элемента, его название, значение относительной атомной массы и его атомный (порядковый) номер.
Основные структурные единицы периодической системы это периоды и группы. Горизонтальные ряды элементов называются периодами, а вертикальные столбцы – группами. Всего в таблице 7 периодов. Первые три периода называются малыми, остальные четыре большими. В таблице 18 групп. Группы А называются главными, а группы В – побочными. (записать в тетради определение периода и группы). В каждой группе находятся элементы со сходными химическими свойствами их атомов. Номер группы указывает (римскими цифрами), как правило, высшую валентность элементов в соединениях с кислородом.
Причину периодичности в изменении свойств химических
элементов можно объяснить только на основе знаний о строении атома. К изучению
строения атома мы приступим на следующем уроке.
К изучению
строения атома мы приступим на следующем уроке.
5) Первичная проверка понимания
Давайте повторим:
Как назвал Д. И. Менделеев естественную классификацию химических элементов?(периодическая система химических элементов).
Назовите основные структурные единицы периодической системы. (периоды и группы).
Что такое период? (период – это горизонтальный ряд химических элементов, расположенных в порядке возрастания их относительных атомных масс, начинающийся щелочным металлом (или водородом) и заканчивающийся благородным газом).
Какие свойства элементов закономерно изменяются в периоде? (металлические и неметаллические свойства).
Дайте определение понятию «группа».(группа – это вертикальный ряд химических элементов в периодической системе, атомы которых обладают сходными свойствами).
6) Закрепления знаний и способов действий
1.
Вычислить
массовую долю кислорода в высшем оксиде химического элемента, порядковый номер которого
17.
Решение.
Элемент: хлор
Высший оксид: Cl2O7
Ответ: = 61%
2. Формула высшего оксида некоторого химического элемента ЭО. Укажите атомные номера, символы, номера периодов и типы групп трех химических элементов которые могут соответствовать данной формуле (задание выполняется устно).
7) Контроль и самопроверка знаний.
Весь класс проверяет правильность выполнения письменного задания в тетради. Исправляются ошибки на доске.
8) Подведение итогов занятия
Сегодня мы рассмотрели периодическую систему химических элементов, изучили такие понятия как период и группа, закрепили полученные знания. Все ли вам было понятно? Для того чтобы лучше усвоить изученный материал необходимо выполнить домашнее задание.
9) Информация о домашнем задании. Инструктаж по его выполнению.
Запишите задание на дом: § 8 задания 5 – 8.
10) Рефлексия
Продолжить предложения:
1) Сегодня на уроке я узнал…
2) Сегодня на уроке мне понравилось…
3)
Периодический закон и ПСХЭ — ХИМИЯ!FOREVER!
Кроссенс – это ассоциативная головоломка.
Рассмотрите изображения. Как они связаны между собой?
Какой химический термин их объединяет?
Догадались? Напишите определение.
кроссенс1
кроссенс1
Тема урока: Периодический закон и Периодическая таблица Д.И. Менделеева
Цель урока: знать формулировку Периодического закона Д.И. Менделеева и структуру Периодической таблицы.
1. Запишите в тетрадь тему урока.
2. Прочитайте § 50 в учебнике и изучите материал этого урока на сайте. Просмотрите видео ролик.
Периодический закон и Периодическая система химических элементов .mp4
3.Сравните новую и старую формулировки Периодического закона. Выпишите новую формулировку закона в тетрадь, обозначив год открытия. Выучите её.
Периодическая система химических элементов Д. И. Менделеева
И. Менделеева
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева.
Полудлинный вариант таблицы Д.И. Менделеева.
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Длинный вариант таблицы Д.И. Менделеева.
1. Период – горизонтальный ряд химических элементов, начинающийся щелочным металлом (или водородом) и заканчивающийся инертным (благородным) газом.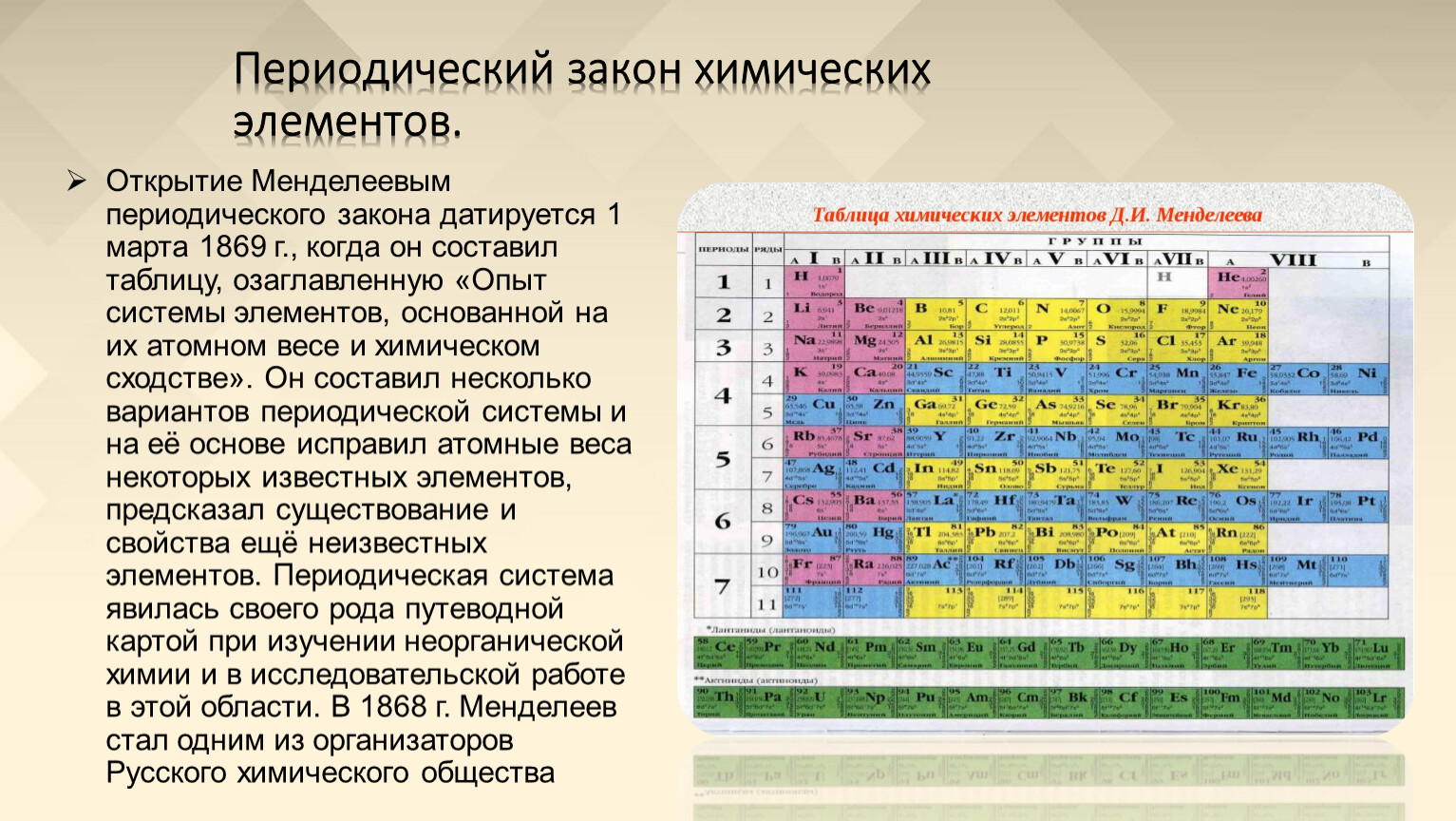
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств.
В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов).
Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl).
В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
2. Группы — вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O, F).
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I — III групп образуют твердые вещества — гидриды (водород в степени окисления — 1), а IV — VII групп — газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) — нейтральны, V группы (ЭН3) — основания, VI и VII групп (Н2Э и НЭ) — кислоты.
| |
|
4. Прочитайте § 51 в учебнике. Продолжите 10 закономерностей изменений свойств, запишите в рабочую тетрадь… Выучите их.
Используйте глаголы: уменьшаются,усиливаются,увеличиваются,ослабевают.
1. Атомные радиусы элементов СЛЕВА НАПРАВО вдоль периода _______________2. СВЕРХУ ВНИЗ в группе атомные радиусы элементов ____________________
3. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов ________________
4. При перемещении СВЕРХУ ВНИЗ в группе металлические свойства элементов ________________
5. При перемещении вдоль периода СПРАВА НАЛЕВО неметаллические свойства элементов ________________
6. При перемещении СВЕРХУ ВНИЗ в группе неметаллические свойства элементов ________________
При перемещении СВЕРХУ ВНИЗ в группе неметаллические свойства элементов ________________
7. СЛЕВА НАПРАВО окислительные свойства_________________________
8. СЛЕВА НАПРАВО восстановительные свойства_________________________
9. Электроотрицательность СЛЕВА НАПРАВО_________________________
10. При перемещении СВЕРХУ ВНИЗ по группам электроотрицательность __________________
Если Вы хорошо изучили эту часть урока,ответьте на вопросы теста
Основные понятия:
1. Порядковый номер химического элемента — номер, данный элементу при его нумерации. Показывает общее число электронов в атоме и число протонов в ядре, определяет заряд ядра атома данного химического элемента.
2. Период – химические элементы, расположенные в строчку (периодов всего 7). Период определяет количество энергетических уровней в атоме.
Малые периоды (1 – 3) включают только s- и p- элементы (элементы главных подгрупп) и состоят из одной строчки; большие (4 – 7) включают не только s- и p- элементы (элементы главных подгрупп), но и d- и f- элементы (элементы побочных подгрупп) и состоят из двух строчек.
3. Группы – химические элементы, расположенные в столбик (групп всего 8). Группа определяет количество электронов внешнего уровня для элементов главных подгрупп, а так же число валентных электронов в атоме химического элемента.
Главная подгруппа (А) – включает элементы больших и малых периодов (только s- и p- элементы).
Побочная подгруппа (В) – включает элементы только больших периодов (только d- или f- элементы).
4. Относительная атомная масса (Ar) – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина (для расчётов берут округлённое значение).
Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д. И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.
Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить 😉
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д. И. Менделеева — это фтор.
И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
История периодической таблицы
В 1669 Немецкий торговец и алхимик-любитель Хенниг Бранд попытался создать Философский камень ; предмет, который якобы мог превращать металлы в чистое золото. Он нагрел остатки кипяченой мочи, и жидкость выпала и загорелась. Это было первое открытие фосфора.
Он нагрел остатки кипяченой мочи, и жидкость выпала и загорелась. Это было первое открытие фосфора.В 1680 Роберт Бойль также открыл фосфор, и это стало достоянием общественности.
В 1809 было открыто не менее 47 элементов, и ученые начали видеть закономерности в характеристиках.
В 1863 Английский химик Джон Ньюлендс разделил открытые тогда 56 элементов на 11 групп, исходя из характеристик.
В 1869 Русский химик Дмитрий Менделеев начал разработку периодической таблицы, расположив химические элементы по атомной массе. Он предсказал открытие других элементов и оставил для них свободные места в своей периодической таблице.
В 1886 французский физик Антуан Беккерель впервые открыл радиоактивность.Студент Томсона из Новой Зеландии Эрнест Резерфорд назвал три типа излучения; альфа-, бета- и гамма-лучи. Мария и Пьер Кюри начали работать над излучением урана и тория, а впоследствии открыли радий и полоний. Они обнаружили, что бета-частицы были заряжены отрицательно.
Они обнаружили, что бета-частицы были заряжены отрицательно.
В 1894 Сэр Уильям Рамзи и лорд Рэлей открыли благородные газы, которые были добавлены в периодическую таблицу как группу 0.
В 1897 Английский физик Дж.Дж. Томсон впервые открыл электроны; небольшие отрицательно заряженные частицы в атоме. Джон Таунсенд и Роберт Милликен точно определили их заряд и массу.
В 1900 Беккерель обнаружил, что электроны и бета-частицы, определенные Кюри, — одно и то же.
В 1903 Резерфорд объявил, что радиоактивность вызывается распадом атомов.
В 1911 Резерфорд и немецкий физик Ганс Гейгер открыли, что электроны вращаются вокруг ядра атома.
В 1913 Бор обнаружил, что электроны движутся вокруг ядра по дискретным энергиям, называемым орбиталями. Излучение испускается при движении с одной орбиты на другую.
В 1914 Резерфорд впервые определил протоны в атомном ядре. Он также впервые преобразовал атом азота в атом кислорода. Английский физик Генри Мозли предоставил атомные номера, основанные на количестве электронов в атоме, а не на основе атомной массы.
Он также впервые преобразовал атом азота в атом кислорода. Английский физик Генри Мозли предоставил атомные номера, основанные на количестве электронов в атоме, а не на основе атомной массы.
В 1932 Джеймс Чедвик впервые открыл нейтроны, и были идентифицированы изотопы.Это была полная основа для периодической таблицы. В том же году англичанин Кокрофт и ирландец Уолтон впервые расщепили атом, бомбардировав литий в ускорителе частиц, превратив его в два ядра гелия.
В 1945 Гленн Сиборг идентифицировал лантаноиды и актиноиды (атомный номер >92), которые обычно помещаются ниже таблицы Менделеева.
Источники
Манхэттенский проект
Википедия
Эволюция периодической системы
Примечание редактора: Это только текстовая версия.Полную версию с иллюстрацией можно приобрести здесь (PDF).
Периодическая таблица элементов — один из самых влиятельных символов в науке: единый документ, объединяющий большую часть наших знаний по химии. Версия висит на стене почти каждой химической лаборатории и лекционного зала в мире. Действительно, ничего подобного в других научных дисциплинах не существует.
Версия висит на стене почти каждой химической лаборатории и лекционного зала в мире. Действительно, ничего подобного в других научных дисциплинах не существует.
История периодической системы классификации элементов насчитывает более 200 лет.На протяжении всей своей долгой истории периодическая таблица оспаривалась, изменялась и совершенствовалась по мере развития науки и открытия новых элементов [см. «Создание новых элементов» Питера Армбрустера и Фрица Петера Хессбергера]. Но, несмотря на кардинальные изменения, происшедшие в науке за последнее столетие, а именно на развитие теорий относительности и квантовой механики, революции в фундаментальной природе периодической системы не произошло. В некоторых случаях новые результаты первоначально ставили под сомнение теоретические основы периодической таблицы, но каждый раз ученым в конечном итоге удавалось включить результаты, сохранив при этом фундаментальную структуру таблицы.Примечательно, что периодическая таблица примечательна как своими историческими корнями, так и актуальностью в наши дни.
Термин «периодический» отражает тот факт, что химические свойства элементов проявляются через определенные регулярные промежутки времени. Если бы не упрощение, обеспечиваемое этой таблицей, изучающим химию пришлось бы изучать свойства всех 112 известных элементов. К счастью, периодическая таблица позволяет химикам работать, осваивая свойства горстки типичных элементов; все остальные попадают в так называемые группы или семейства со сходными химическими свойствами.(В современной периодической таблице группе или семейству соответствует один вертикальный столбец.)
Открытие периодической системы классификации элементов представляет собой кульминацию ряда научных разработок, а не внезапный мозговой штурм со стороны одного человека. Тем не менее, историки обычно считают одно событие официальным рождением современной периодической таблицы: 17 февраля 1869 года русский профессор химии Дмитрий Иванович Менделеев завершил первую из своих многочисленных периодических таблиц.В него вошли 63 известных элемента, расположенных в порядке возрастания атомного веса; Менделеев также оставил место для еще не открытых элементов, для которых он предсказал атомный вес.
Однако до открытия Менделеева другие ученые активно разрабатывали некую организующую систему для описания элементов. Например, в 1787 году французский химик Антуан Лавуазье вместе с Антуаном Фуркруа, Луи-Бернаром Гитоном де Морво и Клодом-Луи Бертолле составил список из 33 элементов, известных в то время.Однако такие списки являются просто одномерными представлениями. Сила современной таблицы заключается в ее двух- или даже трехмерном отображении всех известных элементов (и даже тех, которые еще предстоит открыть) в логической системе точно упорядоченных строк и столбцов.
В ранней попытке организовать элементы в осмысленный ряд немецкий химик Иоганн Доберейнер указал в 1817 году, что многие из известных элементов могут быть организованы по их сходству в группы по три, которые он назвал триадами.Доберейнер выделил триады элементов лития, натрия и калия, а также хлора, брома и йода. Он заметил, что если три члена триады расположить в порядке их атомного веса, то свойства среднего элемента окажутся между свойствами первого и третьего элементов. Например, литий, натрий и калий энергично реагируют с водой. Но литий, самый легкий из триады, реагирует мягче, чем два других, тогда как самый тяжелый из трех, калий, взрывается бурно.Кроме того, Доберейнер показал, что атомный вес среднего элемента близок к среднему значению весов первого и третьего членов триады. Работа Доберейнера вдохновила других на поиск корреляций между химическими свойствами элементов и их атомными весами. Одним из тех, кто продолжал использовать триадный подход в 19 веке, был Петер Кремерс из Кельна, который предположил, что определенные элементы могут принадлежать двум триадам, расположенным перпендикулярно. Кремерс, таким образом, открыл новые горизонты, сравнивая элементы в двух направлениях, что позже оказалось существенным аспектом системы Менделеева.
Например, литий, натрий и калий энергично реагируют с водой. Но литий, самый легкий из триады, реагирует мягче, чем два других, тогда как самый тяжелый из трех, калий, взрывается бурно.Кроме того, Доберейнер показал, что атомный вес среднего элемента близок к среднему значению весов первого и третьего членов триады. Работа Доберейнера вдохновила других на поиск корреляций между химическими свойствами элементов и их атомными весами. Одним из тех, кто продолжал использовать триадный подход в 19 веке, был Петер Кремерс из Кельна, который предположил, что определенные элементы могут принадлежать двум триадам, расположенным перпендикулярно. Кремерс, таким образом, открыл новые горизонты, сравнивая элементы в двух направлениях, что позже оказалось существенным аспектом системы Менделеева.
В 1857 году французский химик Жан-Батист-Андре Дюма отказался от идеи триад и вместо этого сосредоточился на разработке набора математических уравнений, которые могли бы объяснить увеличение атомного веса между несколькими группами химически сходных элементов. Но, как теперь признают химики, любая попытка установить организующий паттерн, основанный на атомном весе элемента, не увенчается успехом, потому что атомный вес не является фундаментальным свойством, характеризующим каждый из элементов.
Но, как теперь признают химики, любая попытка установить организующий паттерн, основанный на атомном весе элемента, не увенчается успехом, потому что атомный вес не является фундаментальным свойством, характеризующим каждый из элементов.
Периодические свойства
Важнейшей характеристикой системы Менделеева было то, что она иллюстрировала периодичность или повторение свойств элементов через определенные регулярные интервалы.Эта особенность наблюдалась ранее в расположении элементов по атомному весу, разработанном в 1862 году французским геологом Александром-Эмилем Бегуйе де Шанкуртуа. Система опиралась на довольно сложную геометрическую конфигурацию: де Шанкуртуа расположил элементы в порядке возрастания атомного веса вдоль спирали, вписанной в поверхность цилиндра и наклоненной под углом 45 градусов к основанию.
Первый полный виток спирали совпал с элементом кислородом, а второй полный виток пришелся на серу.Элементы, расположенные вертикально на поверхности цилиндра, как правило, обладали схожими свойствами, поэтому такое расположение позволило зафиксировать некоторые закономерности, которые позже стали центральными в системе Менделеева. Тем не менее по ряду причин система де Шанкуртуа не оказала большого влияния на ученых того времени: в его исходной статье не было диаграммы таблицы, система была довольно сложной, а химическое сходство между элементами отображалось не очень убедительно. .
Тем не менее по ряду причин система де Шанкуртуа не оказала большого влияния на ученых того времени: в его исходной статье не было диаграммы таблицы, система была довольно сложной, а химическое сходство между элементами отображалось не очень убедительно. .
Несколько других исследователей выдвинули свои версии периодической таблицы в 1860-х годах. Используя недавно стандартизированные значения атомных весов, английский химик Джон Ньюлендс предположил в 1864 году, что, когда элементы расположены в порядке атомного веса, любой из элементов проявляет свойства, аналогичные свойствам элементов, находящихся на восемь позиций впереди и на восемь позиций позади в списке. — особенность, которую Ньюлендс назвал «законом октав».
В своей первоначальной таблице Ньюлендс оставил пустые места для отсутствующих элементов, но его более известная версия 1866 года не включала эти открытые места.Другие химики сразу же высказали возражения против таблицы, потому что она не сможет вместить какие-либо новые элементы, которые могут быть обнаружены. Более того, некоторые исследователи открыто высмеивали идеи Ньюлендса. На собрании Химического общества в Лондоне в 1866 году Джордж Кэри Фостер из Университетского колледжа Лондона спросил Ньюлендса, рассматривал ли он упорядочение элементов в алфавитном порядке, потому что любое расположение может привести к случайным совпадениям. По итогам собрания Химическое общество отказалось опубликовать статью Ньюлендса.
Более того, некоторые исследователи открыто высмеивали идеи Ньюлендса. На собрании Химического общества в Лондоне в 1866 году Джордж Кэри Фостер из Университетского колледжа Лондона спросил Ньюлендса, рассматривал ли он упорядочение элементов в алфавитном порядке, потому что любое расположение может привести к случайным совпадениям. По итогам собрания Химическое общество отказалось опубликовать статью Ньюлендса.
Однако, несмотря на плохой прием, работа Ньюлендса представляет собой первый случай, когда кто-либо использовал последовательность порядковых чисел (в данном случае основанную на последовательности атомных весов) для организации элементов. В этом отношении Ньюлендс предвосхитил современную организацию периодической таблицы, основанную на последовательности так называемых атомных чисел. (Понятие атомного номера, которое указывает количество протонов, присутствующих в ядре атома, не было установлено до начала 20-го века.)
Современная периодическая таблица
Химик Юлиус Лотар Мейер из Бреслауского университета в Германии в процессе пересмотра своего учебника по химии в 1868 году составил периодическую таблицу, которая оказалась удивительно похожей на знаменитую версию Менделеева 1869 года, хотя Лотару Мейеру не удалось правильно классифицировать все элементы. Но таблица не появлялась в печати до 1870 года из-за задержки издателя — фактора, который способствовал ожесточённому спору о приоритете между Лотаром Мейером и Менделеевым.
Но таблица не появлялась в печати до 1870 года из-за задержки издателя — фактора, который способствовал ожесточённому спору о приоритете между Лотаром Мейером и Менделеевым.
Примерно в то же время Менделеев составил свою собственную таблицу Менделеева, когда тоже писал учебник по химии. В отличие от своих предшественников, Менделеев был достаточно уверен в своей периодической таблице, чтобы использовать ее для предсказания нескольких новых элементов и свойств их соединений. Он также скорректировал атомные веса некоторых уже известных элементов. Интересно, что Менделеев признался, что видел некоторые более ранние таблицы, такие как таблицы Ньюлендса, но утверждал, что не знал о работе Лотара Мейера при разработке своей диаграммы.
Хотя прогностический аспект таблицы Менделеева был большим достижением, историки, по-видимому, слишком придавали ему значение, которые обычно предполагали, что таблица Менделеева была принята именно из-за этой особенности. Эти ученые не заметили, что цитата Лондонского королевского общества, сопровождавшая медаль Дэви (которую Менделеев получил в 1882 г. ), вообще не упоминает о его предсказаниях. Вместо этого способность Менделеева учитывать уже известные элементы, возможно, способствовала принятию периодической системы не меньше, чем его поразительные предсказания.Хотя многие ученые помогли разработать периодическую систему, Менделеев получает большую часть заслуг в открытии химической периодичности, потому что он возвысил это открытие до закона природы и провел остаток своей жизни, смело исследуя его последствия и защищая его справедливость.
), вообще не упоминает о его предсказаниях. Вместо этого способность Менделеева учитывать уже известные элементы, возможно, способствовала принятию периодической системы не меньше, чем его поразительные предсказания.Хотя многие ученые помогли разработать периодическую систему, Менделеев получает большую часть заслуг в открытии химической периодичности, потому что он возвысил это открытие до закона природы и провел остаток своей жизни, смело исследуя его последствия и защищая его справедливость.
Защита периодической таблицы была непростой задачей — ее точность часто подвергалась сомнению последующими открытиями. Один примечательный случай произошел в 1894 году, когда Уильям Рамзи из Университетского колледжа Лондона и лорд Рэлей (Джон Уильям Струтт) из Королевского института в Лондоне открыли элемент аргон; в течение следующих нескольких лет Рамзи объявил об идентификации четырех других элементов — гелия, неона, криптона и ксенона, известных как благородные газы.(Последний из известных благородных газов, радон, был открыт в 1900 году немецким физиком Фридрихом Эрнстом Дорном. )
)
Название «благородный» происходит от того факта, что все эти газы кажутся обособленными от других элементов, редко взаимодействуя с ними с образованием соединений. В результате некоторые химики предположили, что благородным газам даже не место в периодической таблице. Эти элементы не были предсказаны Менделеевым или кем-либо еще, и только после шести лет интенсивных усилий химики и физики смогли успешно включить благородные газы в таблицу.В новом расположении была введена дополнительная колонка между галогенами (газообразные элементы фтор, хлор, бром, йод и астат) и щелочными металлами (литий, натрий, калий, рубидий, цезий и франций).
Второй пункт разногласий связан с точным порядком элементов. В исходной таблице Менделеева элементы располагались в соответствии с атомным весом, но в 1913 году голландский физик-любитель Антон ван ден Брук предположил, что принцип упорядочения периодической таблицы заключается в ядерном заряде каждого атома.Физик Генри Мозли, работавший в Манчестерском университете, проверил эту гипотезу также в 1913 году, незадолго до своей трагической гибели в Первой мировой войне. Мозли начал с фотографирования рентгеновского спектра 12 элементов, 10 из которых занимали последовательные места в спектре. периодическая таблица. Он обнаружил, что частоты признаков, называемых К-линиями, в спектре каждого элемента прямо пропорциональны квадратам целых чисел, представляющих положение каждого последующего элемента в таблице. Как
Мозли начал с фотографирования рентгеновского спектра 12 элементов, 10 из которых занимали последовательные места в спектре. периодическая таблица. Он обнаружил, что частоты признаков, называемых К-линиями, в спектре каждого элемента прямо пропорциональны квадратам целых чисел, представляющих положение каждого последующего элемента в таблице. Как
Мозли, это было доказательством того, что «в атоме есть фундаментальная величина, которая увеличивается регулярными шагами по мере того, как мы переходим от одного элемента к другому.Эта фундаментальная величина, впервые названная атомным числом в 1920 году Эрнестом Резерфордом, который тогда работал в Кембриджском университете, теперь определяется как число протонов в ядре.
Работа Мозли предоставила метод, который можно было использовать для точного определения того, сколько пустых мест осталось в периодической таблице. После этого открытия химики обратились к использованию атомного номера в качестве фундаментального принципа упорядочения периодической таблицы вместо атомного веса. Это изменение решило многие застарелые проблемы с расположением элементов.Например, когда йод и теллур были упорядочены по атомному весу (с йодом первым), два элемента оказались неправильно расположены с точки зрения их химического поведения. Однако при упорядочении по атомному номеру (сначала теллура) два элемента находились на своих правильных позициях.
Это изменение решило многие застарелые проблемы с расположением элементов.Например, когда йод и теллур были упорядочены по атомному весу (с йодом первым), два элемента оказались неправильно расположены с точки зрения их химического поведения. Однако при упорядочении по атомному номеру (сначала теллура) два элемента находились на своих правильных позициях.
Понимание атома
Периодическая таблица вдохновила на работу не только химиков, но и физиков-атомщиков, пытавшихся понять структуру атома.В 1904 г., работая в Кембридже, физик Дж. Дж. Томсон (открывший также электрон) разработал модель атома, уделив пристальное внимание периодичности элементов. Он предположил, что атомы определенного элемента содержат определенное количество электронов, расположенных концентрическими кольцами. Более того, согласно Томсону, элементы с аналогичной конфигурацией электронов будут иметь аналогичные свойства; Таким образом, работа Томсона дала первое физическое объяснение периодичности элементов. Хотя Томсон представлял, что кольца электронов лежат внутри основного тела атома, а не циркулируют вокруг ядра, как считается сегодня, его модель действительно представляет собой первый случай, когда кто-либо обратился к расположению электронов в атоме, концепция, которая пронизывает всю науку. вся современная химия.
Хотя Томсон представлял, что кольца электронов лежат внутри основного тела атома, а не циркулируют вокруг ядра, как считается сегодня, его модель действительно представляет собой первый случай, когда кто-либо обратился к расположению электронов в атоме, концепция, которая пронизывает всю науку. вся современная химия.
Датский физик Нильс Бор, первым применивший квантовую теорию к изучению строения атома, также руководствовался расположением элементов в периодической системе.В модели атома Бора, разработанной в 1913 году, электроны обитают в ряде концентрических оболочек, окружающих ядро. Бор пришел к выводу, что элементы одной и той же группы периодической таблицы могут иметь одинаковую конфигурацию электронов на внешней оболочке и что химические свойства элемента будут в значительной степени зависеть от расположения электронов на внешней оболочке его атома.
Модель атома Бора также служила для объяснения того, почему благородные газы не обладают реакционной способностью: благородные газы обладают полными внешними электронными оболочками, что делает их необычайно стабильными и маловероятными для образования соединений. Действительно, большинство других элементов образуют соединения, чтобы получить полные внешние электронные оболочки. Более поздний анализ того, как Бор пришел к этим электронным конфигурациям, предполагает, что он действовал больше как химик, чем принято считать. Бор вывел электронные конфигурации не из квантовой теории, а из известных химических и спектроскопических свойств элементов.
Действительно, большинство других элементов образуют соединения, чтобы получить полные внешние электронные оболочки. Более поздний анализ того, как Бор пришел к этим электронным конфигурациям, предполагает, что он действовал больше как химик, чем принято считать. Бор вывел электронные конфигурации не из квантовой теории, а из известных химических и спектроскопических свойств элементов.
В 1924 году другой физик, уроженец Австрии Вольфганг Паули, решил объяснить длину каждой строки или периода в таблице.В результате он разработал принцип исключения Паули, который гласит, что никакие два электрона не могут находиться в точно таком же квантовом состоянии, которое определяется тем, что ученые называют квантовыми числами. Длины различных периодов вытекают из экспериментальных данных о порядке заполнения электронных оболочек и из квантово-механических ограничений на четыре квантовых числа, которые могут принимать электроны.
Модификации квантовой теории, сделанные Вернером Гейзенбергом и Эрвином Шредингером в середине 1920-х годов, привели к появлению квантовой механики в том виде, в котором она используется по сей день.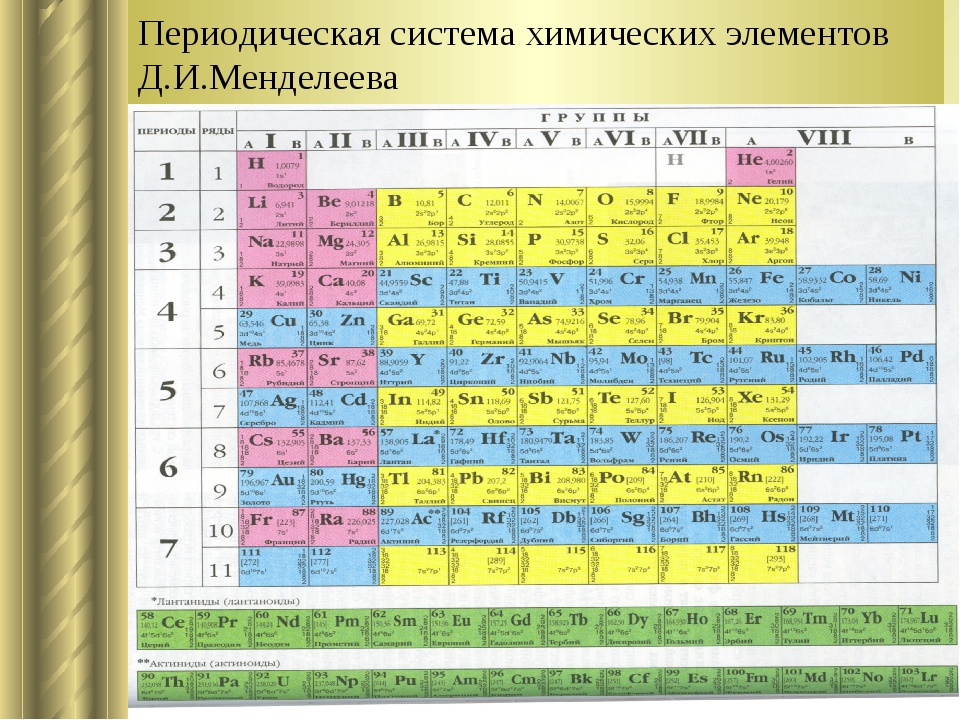 Но влияние этих изменений на периодическую таблицу было довольно минимальным. Несмотря на усилия многих физиков и химиков, квантовая механика не может больше объяснить периодическую таблицу. Например, он не может объяснить из первых принципов порядок, в котором электроны заполняют различные электронные оболочки. Электронные конфигурации атомов, на которых основано наше современное понимание периодической таблицы, не могут быть получены с помощью квантовой механики (это потому, что фундаментальное уравнение квантовой механики, уравнение Шредингера, не может быть точно решено для других атомов, кроме водорода).В результате квантовая механика может воспроизвести оригинальное открытие Менделеева только с помощью математических приближений — она не может предсказать периодическую систему.
Но влияние этих изменений на периодическую таблицу было довольно минимальным. Несмотря на усилия многих физиков и химиков, квантовая механика не может больше объяснить периодическую таблицу. Например, он не может объяснить из первых принципов порядок, в котором электроны заполняют различные электронные оболочки. Электронные конфигурации атомов, на которых основано наше современное понимание периодической таблицы, не могут быть получены с помощью квантовой механики (это потому, что фундаментальное уравнение квантовой механики, уравнение Шредингера, не может быть точно решено для других атомов, кроме водорода).В результате квантовая механика может воспроизвести оригинальное открытие Менделеева только с помощью математических приближений — она не может предсказать периодическую систему.
Вариации на тему
В последнее время исследователи предложили различные подходы к отображению периодической системы. Например, Фернандо Дюфур, профессор химии на пенсии из колледжа Ахунцик в Монреале, разработал трехмерную периодическую таблицу, которая отображает фундаментальную симметрию периодического закона, в отличие от общепринятой двухмерной формы таблицы. То же достоинство можно увидеть и в версии таблицы Менделеева в форме пирамиды, форме, предложенной во многих случаях, но совсем недавно уточненной Уильямом Б. Дженсеном из Университета Цинциннати.
То же достоинство можно увидеть и в версии таблицы Менделеева в форме пирамиды, форме, предложенной во многих случаях, но совсем недавно уточненной Уильямом Б. Дженсеном из Университета Цинциннати.
Другим отклонением стало изобретение периодических систем, направленных на обобщение свойств соединений, а не элементов. В 1980 году Рэй Хефферлин из Южного адвентистского университета в Колледждейле, штат Теннеси, разработал периодическую систему для всех мыслимых двухатомных молекул, которые могли образоваться между первыми 118 элементами (на сегодняшний день открыто только 112).
Диаграмма Хефферлина показывает, что определенные свойства молекул — например, расстояние между атомами и энергия, необходимая для ионизации молекулы, — проявляются в регулярных закономерностях. Эта таблица позволила ученым успешно предсказать свойства двухатомных молекул.
Аналогичным образом Джерри Р. Диас из Университета Миссури в Канзас-Сити разработал периодическую классификацию типа органических молекул, называемых бензоидными ароматическими углеводородами. Соединение нафталин (C10H8), обнаруженное в нафталиновых шариках, является простейшим примером.Система классификации Диаса аналогична триадам элементов Доберейнера: любая центральная молекула триады имеет общее число атомов углерода и водорода, которое является средним значением фланговых элементов как вниз, так и по таблице. Эта схема применялась для систематического изучения свойств бензоидных ароматических углеводородов и с использованием теории графов позволила предсказать стабильность и реакционную способность некоторых из этих соединений.
Соединение нафталин (C10H8), обнаруженное в нафталиновых шариках, является простейшим примером.Система классификации Диаса аналогична триадам элементов Доберейнера: любая центральная молекула триады имеет общее число атомов углерода и водорода, которое является средним значением фланговых элементов как вниз, так и по таблице. Эта схема применялась для систематического изучения свойств бензоидных ароматических углеводородов и с использованием теории графов позволила предсказать стабильность и реакционную способность некоторых из этих соединений.
Тем не менее, именно периодическая таблица элементов оказала самое широкое и продолжительное влияние.После более чем 200-летнего развития благодаря работе многих людей периодическая таблица остается в центре изучения химии. Она считается одной из самых плодотворных идей в современной науке, возможно, сравнимой с теорией эволюции Чарльза Дарвина. В отличие от таких теорий, как ньютоновская механика, она не была фальсифицирована или революционизирована современной физикой, но адаптировалась и совершенствовалась, оставаясь по существу невредимой.
Дополнительная литература
Периодическая система химических элементов: история первых ста лет.Дж. В. ван Спронсен. Эльзевир, 1969.
Удивительная периодическая таблица: десять замечательных фактов. Деннис Х. Руврей в Chemical Intelligencer, Vol. 2, № 3, стр. 39–47; Июль 1996 г.
Классификация, симметрия и периодическая таблица. Уильям Б. Дженсен в книге «Вычисления и математика с приложениями», Vol. 12Б, №№ 1–2, стр. 487–510; 1989.
Плюс са Изменение. Э. Р. Шерри в « Химии в Великобритании», Vol. 30, № 5, стр. 379–381; Май 1994.
Электрон и периодическая таблица.Эрик Р. Шерри в American Scientist, Vol. 85, страницы 546–553; Ноябрь – декабрь 1997 г.
Открытые учебники | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7А
Класс 7Б
Класс 7 (объединенные A и B)
Африкаанс
Граад 7А
Граад 7Б
Graad 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 8А
Класс 8Б
Класс 8 (объединенные А и В)
Африкаанс
Граад 8А
Граад 8Б
Graad 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 9А
Класс 9Б
Класс 9 (объединенные А и В)
Африкаанс
Граад 9А
Граад 9Б
Graad 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4А
Класс 4Б
Класс 4 (объединенные А и В)
Африкаанс
Граад 4А
Граад 4Б
Graad 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 5А
Класс 5Б
Класс 5 (объединенные A и B)
Африкаанс
Граад 5А
Граад 5Б
Graad 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 6А
Класс 6Б
Класс 6 (объединенные A и B)
Африкаанс
Граад 6А
Граад 6Б
Graad 6 (A en B saam)
Пособия для учителя
Лицензирование нашей книги
Эти книги не только бесплатны, но и имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте здесь больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без торговой марки)
Эти версии одного и того же контента без торговой марки доступны для вас, чтобы вы могли делиться ими, адаптировать, преобразовывать, изменять или развивать их любым способом, при единственном требовании — отдать должное Сиявуле. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Как Менделеев упорядочил периодическую таблицу
Как Менделеев устроил периодическую таблицу Периодический закон Менделеева и периодическая таблица Менделеева
Работая систематически над физическими и химическими свойствами элементов, Дмитрий Инванович Менделеев заметил элементы регулярно менялись с атомной массой.Он расположил 63 известных тогда элемента в таблице на основе сходства свойств. Оказалось, что большинство элементов заняли места в таблице в порядке возрастания их атомных масс. В 1869 году Менделеев сформулировал закон, известный сейчас как периодический закон. Закон гласит следующее.
Свойства элементов являются периодическими функциями их атомных масс. Это означает, что , если элементы расположены в порядке возрастания атомных масс, то элементы с аналогичными свойствами повторяются через равные промежутки времени.
На основе периодического закона Менделеев представил свою классификацию в виде таблицы, известной сейчас как Периодическая таблица Менделеева . Упрощенная версия этой периодической таблицы приведена ниже. В этой таблице медь, серебро и золото находятся в группах I и VIII.
Группы → Периоды ↓ | Я | II | III | И.В. | V | В.И. | VII | VIII | |||
| 1 Н 1 | |||||||||||
| 2 | 7 Li | Be 9.4 | B 11 | C 12 | N 14 | O 16 | 16 | F 19 | |||
| 3 | Na 23 | мг 24 | AL 29. | SI 28 | P 31 | S 32 | 32 CL 35.59 | ||||
4 | 4 | K 39 | CA 40 | ? | Ti 48 | V 51 | CR 52 | MN 55 | FR CO Ni Cu 56 59 59 63 | 59 63||
| 5 | CU 63 | ZN 65 | ? 68 | ? 72 | как 75 | SE 78 | |||||
6 | RB 85 | SR 87 | YT 88 | Zr 90 | Nb 94 | Mo 96 | ? 100 | 9000 R RH PD AG 104 104 106 108 | |||
7 | 7 | CD 112 | в | 113 | Sn 118 | SB 122 | Te 125 | Я 127 | |||
8 | Cs 133 | Ба 137 | Ди 138 | Се 140 | ? | ? | ? | ? | |||
9 | ? | ? | ? | ? | ? | ? | ? | ||||
10 | ? | ? | Er 178 | La 180 | Ta 182 | W 184 | 9052 ?OS IR PT AU 195 197 1 | ||||
11 | Au | 9 HG | Hg 200 | TL 204 | PB 207 | BI 208 | ? | ? | |||
12 | ? | ? | ? | Чт 231 | ? | U 240 |
Эта таблица состоит из вертикальных столбцов, называемых группами, и горизонтальных строк, называемых периодами. В таблице всего восемь групп. Менделеев оставил несколько вакантных мест (показаны вопросительными знаками) для еще не открытых элементов. Тогда благородные газы не были открыты. Поэтому он не предусмотрел для них места в своей периодической таблице.
В таблице всего восемь групп. Менделеев оставил несколько вакантных мест (показаны вопросительными знаками) для еще не открытых элементов. Тогда благородные газы не были открыты. Поэтому он не предусмотрел для них места в своей периодической таблице.
Идея Манделеева замечательна тем, что в основу классификации он положил фундаментальное свойство атома (атомную массу). При классификации элементов особое внимание он уделял факторам буксировки.
1. Похожие элементы были сгруппированы вместе.
2. Элементы расположены в порядке возрастания атомной массы.
Люди также спрашивают
Модифицированная версия Периодической таблицы Менделеева:
Элементы, которые не были открыты и для которых Менделеев оставил свободные места, были открыты позже. Некоторыми из них являются скандий (Sc), галлий (Ga) и германий (Ge). Эти элементы были размещены на своих местах в таблице. Элементы гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn) стали известны только к концу девятнадцатого века. Эти элементы, называемые благородными газами, были помещены в таблицу в отдельную группу, названную 0-й группой. Тогда периодическую таблицу пришлось изменить. Модифицированная версия таблицы показана ниже.
Эти элементы, называемые благородными газами, были помещены в таблицу в отдельную группу, названную 0-й группой. Тогда периодическую таблицу пришлось изменить. Модифицированная версия таблицы показана ниже.
| серии лантанидов * (наряду с langhanum) | Се | Пр | Nd | Рт | Sm | Eu | Б | Тб | Dy | Хо | ER | TM | YB | YB | LU |
| | (наряду с актинием) (наряду с актинием) | TH | PA | U | NP | PU | утра | см | CM | BK | CF | ES | FM | MD | MD | NO | LR | LR | |
Особенности модифицированной версии периодической таблицы Менделеева:
1. Группы на подгруппы : Каждая группа этой периодической таблицы далее делится на две подгруппы A и B. Свойства элементов внутри подгруппы более похожи, но отличаются от свойств элементов других подгрупп. Например, литий (Li), натрий (Na), калий (K) и др. подгруппы IA имеют близкое сходство свойств, но почти не имеют сходства с чеканными металлами (Cu, Ag и Au) подгруппы IB. .
Группы на подгруппы : Каждая группа этой периодической таблицы далее делится на две подгруппы A и B. Свойства элементов внутри подгруппы более похожи, но отличаются от свойств элементов других подгрупп. Например, литий (Li), натрий (Na), калий (K) и др. подгруппы IA имеют близкое сходство свойств, но почти не имеют сходства с чеканными металлами (Cu, Ag и Au) подгруппы IB. .
Менделеев разрешил представлять подгруппы внутри одной группы.
2. Предсказание ошибок: Эта периодическая таблица может предсказывать ошибки в атомных массах некоторых элементов на основе их положения в периодической таблице. Например, когда была опубликована таблица Менделеева, экспериментальное значение атомной массы бериллия (Ве) мы предполагалось равной 13,65, а его валентность — 3. Значит, положение Ве должно было быть где-то в другом месте, но Менделеев поместил его в соответствующем месте на основе его свойств. Далее он предположил, что атомная масса Be нуждается в корректировке. Менделеев предсказал его атомную массу 9,1 и валентность 2. Последние исследования подтвердили его правоту.
Менделеев предсказал его атомную массу 9,1 и валентность 2. Последние исследования подтвердили его правоту.
Аналогичным образом была скорректирована атомная масса урана со 120 до 240. Были также внесены поправки в атомные массы золота, платины и т. д.
3. Предсказания свойств высших к неоткрытым элементам : элементов в порядке возрастания их атомных масс. Однако в некоторых местах этот порядок приходилось игнорировать, чтобы убедиться, что элементы со схожими свойствами попадают в одну группу.При этом он оставил несколько вакантных мест в таблице. Эти вакантные места были зарезервированы для еще не обнаруженных элементов. Менделеев был уверен, что эти элементы будут открыты позже и займут освободившиеся места. Мало того, он также предсказал свойства этих неоткрытых элементов на основе этого изучения им свойств соседних элементов. Удивительно, но когда впоследствии были обнаружены недостающие элементы периодической таблицы Менделеева, их свойства оказались очень похожими на предсказанные Менделеевым.
Элементы скандий, галлий и германий не были известны в 1871 году, но их существование было предсказано Менделевым. Он назвал эти элементы эка-бором, эка-алюминием и эка-кремнием, когда эти элементы были открыты, они были названы скандием, галлием и германием соответственно, и было обнаружено, что их свойства хорошо согласуются с предсказанными Менделеевым. Свойства ка-алюминия (предсказанные Менделеевым) и галлия (открытые позднее) приведены в табл.
90 525 +недвижимости
Галлий
Атомная масса
Формула оксида
GA 2 O 3
GACL 3
, учитывая его атомную массу, титан (Ti) должен был быть помещен в периодической таблице ниже алюминия, но Менделеев поместил его ниже кремния (Si), потому что свойства титана были аналогичны свойствам кремния. Таким образом, в таблице Менделеева под алюминием остался пробел. Этот пробел был заполнен обнаруженным позже галлием. Было обнаружено, что свойства галлия (Ga) аналогичны свойствам бора и алюминия.
Таким образом, в таблице Менделеева под алюминием остался пробел. Этот пробел был заполнен обнаруженным позже галлием. Было обнаружено, что свойства галлия (Ga) аналогичны свойствам бора и алюминия.
4. Основные элементы нетронуты: Все основные элементы периодической таблицы Менделеева сохранились и сегодня. Даже когда был открыт новый класс элементов, т. е. инертные газы, они нашли место в отдельной группе, называемой нулевой группой. Существующий порядок таблицы Менделеева ничуть не был нарушен.
Расхождения в периодической таблице Менделеева :
Периодическая таблица Менделеева имеет следующие дефекты.
1. Положение водорода : Положение водорода в периодической таблице аномально. Водород напоминает щелочные металлы (Li, Na, K и др.). Таким образом, он может быть помещен в группу галогенов (VII A)
2. Положение лантаноидов и актинидов: Элементы с атомным номером 57-71 известны под общим названием лантаноиды. Им не место в периодической таблице.Все они были помещены в одну и ту же позицию в группе III и периоде 6. Точно так же актиниды (атомные номера 89–103) также не имеют надлежащего места в периодической таблице. Эти элементы также были помещены в ту же позицию, в группу III и период 7.
Им не место в периодической таблице.Все они были помещены в одну и ту же позицию в группе III и периоде 6. Точно так же актиниды (атомные номера 89–103) также не имеют надлежащего места в периодической таблице. Эти элементы также были помещены в ту же позицию, в группу III и период 7.
3. Некоторые сходные элементы разделены, а некоторые разнородные элементы помещены в группу: Некоторые сходные элементы разделены в периодической таблице. Например, медь (Cu) и ртуть (Hg), серебро (Ag) и таллий (Tl), а также барий (Ba) и свинец (Pb).С другой стороны, некоторые разнородные элементы были объединены в одну группу. Например, медь (Cu), серебро (Ag) и золото (Au) помещены в группу I наряду с щелочными металлами. Точно так же марганец (Mn) помещается в группу галогенов.
4. Наличие некоторых аномальных пар элементов: В периодической таблице Менделеева элементы расположены в порядке возрастания атомной массы. В некоторых местах этот приказ был проигнорирован.
(а) Атомная масса аргона равна 40, а калия — 39.Но в таблице Менделеева аргон стоит перед калием.
(b) Позиции кобальта и никеля не в правильном порядке. Кобальт (при массе = 58,9) ставится перед никелем (при массе = 58,6).
(c) Теллур (ат. масса = 127,6) помещается перед йодом (ат. масса = 126,9).
(d) Торий (при массе = 232,12) помещается перед протактинием (при массе = 231)
5. Положение изотопов: Изотопы элемента не имеют места в периодической таблице.
Неспособность периодического закона Менделеева объяснить неправильный порядок атомных масс некоторых элементов и положение изотопов привели ученых, работающих в этой области, к выводу, что атомная масса не может быть основой для классификации элементов.Должно существовать более фундаментальное свойство элементов, которое может быть положено в основу классификации.
Аномальные пары элементов
Элемент → | Ар | К | Ко | Ni | Te | Я | Th | Па |
Атомная масса | 40 | 39 | 59,9 | 58,6 | 127. 6 6 | 126,9 | 232,12 | 231 |
| Группа | 0 | И.А. | VIII | VIII | VI В | VII B | III B | III B |
21 увлекательное занятие по периодической таблице для студентов-химиков всех возрастов
Периодическая таблица элементов является ключом к пониманию и усвоению химических концепций. Эти упражнения с периодической таблицей веселые и увлекательные, и вы можете использовать многие из них как с младшими, так и со старшими учениками.Выберите несколько, чтобы попробовать в своем собственном классе!
Напоминаем, что WeAreTeachers может собирать долю продаж по ссылкам на этой странице. Спасибо за Вашу поддержку!
1. Начните с якорной диаграммы
Периодическая таблица — гениальная конструкция, но она требует небольшого пояснения. Эти якорные диаграммы объясняют структуру и детали и являются отличным справочником для использования во всех ваших действиях с периодической таблицей.
Узнать больше: Школьный
2.Исследуйте иллюстрированную диаграмму периодической таблицы
Учителя любят эту таблицу, и не зря. Это оживляет таблицу, помогая студентам-химикам понять, какую роль каждый элемент играет в окружающем нас мире. Вы можете бесплатно распечатать его копии или купить плакаты и наборы открыток. Есть даже интерактивная версия!
Узнайте больше: elements.wlonk.com
3. Раскрась и узнай об элементах
Вы можете использовать эту умную книжку-раскраску для всех видов занятий с периодической таблицей.Попробуйте несколько бесплатных печатных страниц с сайта автора Терезы Бондора здесь. Если они вам нравятся, купите книжку-раскраску «Периодическая таблица элементов» на Amazon.
4. Спойте песенку из таблицы Менделеева
Хотя детям не обязательно запоминать периодическую таблицу, такие песни могут помочь, если они захотят попробовать! Нам нравится этот новый современный подход, но и старая классика Тома Лерера 1959 года тоже доставляет массу удовольствия.
5. Соберите модель из коробок для яиц
Любите хорошие поделки из вторсырья? Это деятельность, которую вы ищете! Накопите картонные коробки для яиц и используйте их для создания модели таблицы Менделеева.
Узнайте больше: Странные несоциализированные школьники
6. Создайте колоду карт элементов
Эти бесплатные распечатанные карточки отлично подходят для повторения элементов, особенно если вы работаете над запоминанием некоторых или всех из них.
Подробнее: Домашнее школьное творчество
7. Изготовьте элемент очистителя труб модели
.Получите более глубокое представление о конструкции каждого элемента, создавая модели с помпонами, бусинами и ершиками для труб.
Узнать больше: Учи рядом со мной
8. Найдите элементы, чтобы выиграть игру
Узнайте, где расположен каждый элемент на столе, а также их аббревиатуры в этой простой (и бесплатной) компьютерной игре «укажи и щелкни».
Узнайте больше: Мистер Нуссбаум Обучение + развлечение
9. Отправляйтесь на поиски элементов
Отправьте учащихся на поиск реальных примеров различных элементов.Они будут удивлены тем, как легко их найти.
Узнать больше: Pinay Homeschooler
10. Составьте периодическую таблицу гигантских плиток
Этот классический исследовательский проект объединяется в гигантской периодической таблице. Вы можете использовать доску для плакатов или добавить трехмерный элемент, вместо этого создав плитки на коробках для пиццы.
Узнать больше: миссмиклиус
11. Играть в периодическую таблицу Морской бой
Вот еще одна веселая игра, которая поможет детям познакомиться с тем, где на столе находятся различные элементы.Узнайте, как играть по ссылке.
Узнать больше: Учи рядом со мной
12. Превратите элементы в супергероев (или злодеев)
Это такой забавный поворот в обычном проекте по исследованию элементов. Учащиеся узнают больше о характеристиках своей стихии, а затем решают, супергерой это или злодей!
Учащиеся узнают больше о характеристиках своей стихии, а затем решают, супергерой это или злодей!
Узнайте больше: Morpho Science/Teachers Pay Teachers
13. Загрузите приложение Atomidoodle
Это классное маленькое приложение, доступное как в Apple AppStore, так и в Google Play, предлагает учащимся рисовать пути в лабиринтах.Они используют слияние (сложение) и деление (деление) для создания новых атомов, изучая при этом сотни фактов об элементах.
Подробнее: Атомидудл
14. Сортировать «периодических людей» в таблицу
Это умное задание дает учащимся возможность увидеть, как Менделеев сортировал элементы, чтобы создать свою блестящую периодическую таблицу. Получите бесплатно по ссылке.
Подробнее: Sunrise Science
15. Повесьте таблицу Менделеева на потолок
Источник: Sentinel округа Джексон
Используйте все свободное пространство вашего класса, превратив потолочные плитки в огромную таблицу Менделеева! Клейкий винил хорошо подходит для этого амбициозного проекта.
16. Разгадать
Тайна периодической таблицыЧитателям средней школы понравится этот рассказ о разработке периодической таблицы, они узнают о различных ученых, участвовавших в процессе. Купить The Mystery of the Periodic Table на Amazon можно здесь.
17. Знакомство с персонажами Элемента
Каждый элемент имеет свой собственный набор характеристик, которые почти можно назвать его личностью. В этом и заключается идея этих невероятно забавных карт, которые представляют элементы как живых персонажей.Вы можете использовать набор из них для всех видов периодической таблицы.
Подробнее: Элементы — эксперименты в дизайне персонажей
18. Победить в квесте с таблицей Менделеева
Эскейп-комнаты в моде, и в классе тоже очень весело. Создайте свой собственный набор задач, основанных на химии, или купите эту готовую квест-комнату с таблицей Менделеева на сайте Teachers Pay Teachers.
Узнайте больше: Наука Кеслера
19.Сделать пиксельную графику периодической таблицы
В этой бесплатной интерактивной программе учащиеся отвечают на вопросы об элементах, чтобы разблокировать квадраты периодической таблицы, создав пиксельную картинку. Бонус: пусть дети создают свои собственные пиксельные картинки, используя таблицу!
Узнайте больше: Преподавание вне теста
20. Соберите разноцветные плитки
Эти разноцветные детали соединяются друг с другом, образуя интерактивную головоломку, которую можно использовать для множества различных действий с периодической таблицей.Купите набор на Amazon.
21. Соревнуйтесь в периодической таблице Бинго
Бинго — это всегда весело, но эта версия также поможет вам выучить различные сокращения элементов. Сделайте свои карты или купите готовый набор по ссылке.
Узнать больше: Семейство с питанием от STEAM
Хотите больше практической науки? Попробуйте лучшие научные наборы для детей, выбранные учителями.
Plus, 20 лучших научных досок объявлений и идей декора классных комнат.
Разработка периодической таблицы — BBC Bitesize
В 1800-х годах ученые открыли много новых элементов, но не существовало системы для их организации. Ученые пытались найти сходство в их свойствах, чтобы систематизировать их осмысленным образом.
Ранние попытки систематизировать элементы
Джон Ньюлендс заметил, что если элементы упорядочить по атомному весу, то каждый восьмой элемент будет иметь сходные свойства.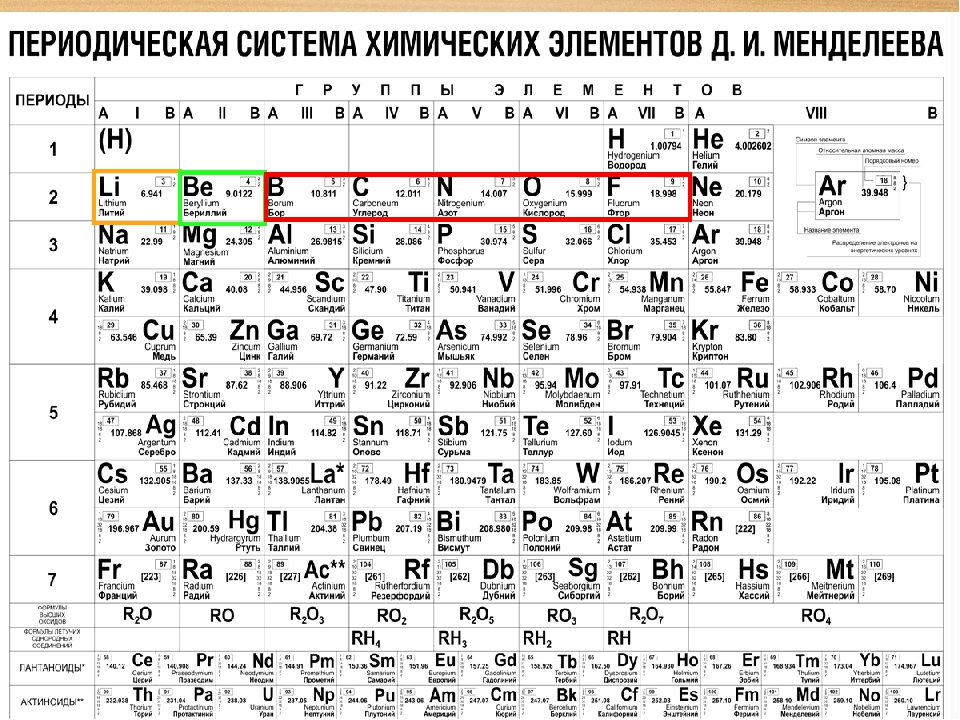 Например, натрий находится на восемь позиций дальше, чем литий, и реагирует очень похоже.
Например, натрий находится на восемь позиций дальше, чем литий, и реагирует очень похоже.
Например, литий (Li), натрий (Na) и калий (K) реагируют с водой одинаково.
| 0.0.$blocks-article-row-1.1:$zk8ssk7-1=10.1.1.$4.$0.0.$0″/> | |
|---|---|
| Li | bp4iuaykti.3.1.$blocks-divider-blocks-grid-container-3.0.0.$blocks-article-row-1.1:$zk8ssk7-1=10.1.1.$4.$1.$0.$1″> Литий |
| Na | натрия |
| K | Калий |
Закономерности и тенденции в периодической таблице. а. Каждый маленький блок периодической таблицы представляет собой
а. Каждый маленький блок периодической таблицы представляет собой
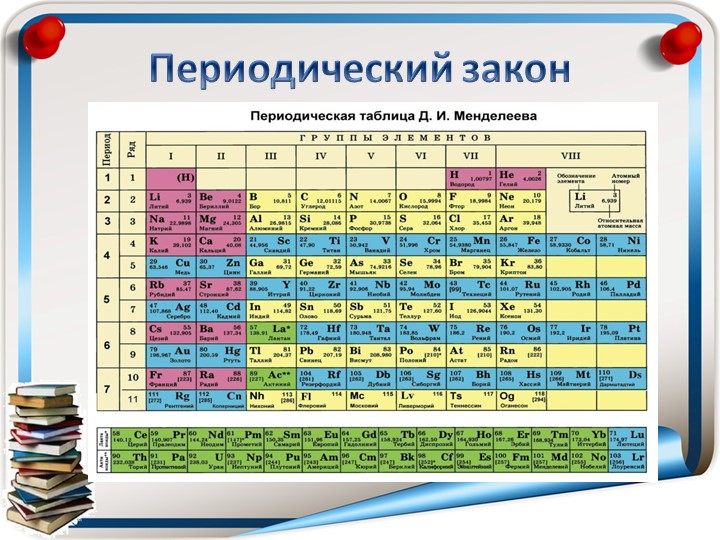 Двигаясь влево или вправо в ряду, атомы имеют тенденцию уменьшаться или увеличиваться в размере, а их реактивность увеличивается и уменьшается.Существуют определенные закономерности в расположении элементов в периодической таблице. Независимо от того, какие цели планирует ваша компания, денежный поток по-прежнему является ресурсом компании, а денежные средства — целью бизнеса. В этой статье мы собираемся изучить тенденции в периодической таблице и физико-химические свойства элементов и их вариации по группам и периодам. Прогнозирование свойств с помощью периодической таблицы. Калифорнийские стандарты научного содержания: • 1. образование. бор 4. Он измеряет изменение энергии в атоме, которое происходит, когда атом получает электрон.Разрабатывайте и используйте модели, в том числе электронную конфигурацию атомов и ионов, для прогнозирования периодических тенденций элемента. и график, показывающий уровни энергии, и таблица Менделеева помогает. «ПЕРИОДИЧЕСКИЙ ЗАКОН») — закономерные изменения (или закономерности) свойств с увеличением атомного веса; как химические, так и физические свойства изменяются «периодически» (повторяющаяся картина).
Двигаясь влево или вправо в ряду, атомы имеют тенденцию уменьшаться или увеличиваться в размере, а их реактивность увеличивается и уменьшается.Существуют определенные закономерности в расположении элементов в периодической таблице. Независимо от того, какие цели планирует ваша компания, денежный поток по-прежнему является ресурсом компании, а денежные средства — целью бизнеса. В этой статье мы собираемся изучить тенденции в периодической таблице и физико-химические свойства элементов и их вариации по группам и периодам. Прогнозирование свойств с помощью периодической таблицы. Калифорнийские стандарты научного содержания: • 1. образование. бор 4. Он измеряет изменение энергии в атоме, которое происходит, когда атом получает электрон.Разрабатывайте и используйте модели, в том числе электронную конфигурацию атомов и ионов, для прогнозирования периодических тенденций элемента. и график, показывающий уровни энергии, и таблица Менделеева помогает. «ПЕРИОДИЧЕСКИЙ ЗАКОН») — закономерные изменения (или закономерности) свойств с увеличением атомного веса; как химические, так и физические свойства изменяются «периодически» (повторяющаяся картина). • Первый и самый важный – атомный радиус. е. Экранирование: это «Обнаружение закономерностей и тенденций Периодической таблицы с помощью КПК»?? План урока подходит для 10-го класса.Периодическую таблицу можно использовать для предсказания количества внешних электронов элемента. литий 2. Галогены Элементы 7 группы периодической таблицы. к. Периодическая таблица элементов была создана в 1800-х годах, когда исследователи заметили закономерности в реакционной способности и характеристиках элементов, если их упорядочить по атомной массе. Энергия ионизации элемента обычно увеличивается слева направо. А. Рассчитанные температуры плавления и кипения амеров. Тенденции в периодической таблице. Расположение элементов в периодической таблице в группы и периоды с предсказуемыми свойствами позволяет предположить определенные закономерности в электронных конфигурациях.Эти закономерности называются периодическими трендами. Вопрос: Как изменяются атомный радиус, энергия ионизации и сродство к электрону в периодической таблице? 1.
• Первый и самый важный – атомный радиус. е. Экранирование: это «Обнаружение закономерностей и тенденций Периодической таблицы с помощью КПК»?? План урока подходит для 10-го класса.Периодическую таблицу можно использовать для предсказания количества внешних электронов элемента. литий 2. Галогены Элементы 7 группы периодической таблицы. к. Периодическая таблица элементов была создана в 1800-х годах, когда исследователи заметили закономерности в реакционной способности и характеристиках элементов, если их упорядочить по атомной массе. Энергия ионизации элемента обычно увеличивается слева направо. А. Рассчитанные температуры плавления и кипения амеров. Тенденции в периодической таблице. Расположение элементов в периодической таблице в группы и периоды с предсказуемыми свойствами позволяет предположить определенные закономерности в электронных конфигурациях.Эти закономерности называются периодическими трендами. Вопрос: Как изменяются атомный радиус, энергия ионизации и сродство к электрону в периодической таблице? 1. Расчетные точки плавления и температуры кипения амера. Ответ (1 из 1): Щелочные металлы представляют собой один из лучших примеров групповых трендов свойств в периодической таблице с хорошо охарактеризованным гомологическим поведением вниз по группе. В течение периода наблюдается еще одна тенденция: переход от металла к неметаллу. В общем, в течение одного… Он сдал своему издателю первый том своего учебника по неорганической химии, но с трудом… SensoryPlay.Разрабатывайте и используйте модели, в том числе электронную конфигурацию атомов и ионов, для прогнозирования элементов. Периодическая таблица представляет собой табличное расположение химических элементов, упорядоченных по их атомному номеру, электронным конфигурациям и повторяющимся химическим свойствам. Основные периодические тенденции включают электроотрицательность, энергию ионизации, сродство к электрону, атомные радиусы, ионный радиус, металлический характер и химическую реактивность. Используйте периодическую таблицу в качестве модели для предсказания относительных свойств элементов на основе так называемой периодической таблицы, поскольку она выделяет повторяющиеся (периодические) модели свойств.
Расчетные точки плавления и температуры кипения амера. Ответ (1 из 1): Щелочные металлы представляют собой один из лучших примеров групповых трендов свойств в периодической таблице с хорошо охарактеризованным гомологическим поведением вниз по группе. В течение периода наблюдается еще одна тенденция: переход от металла к неметаллу. В общем, в течение одного… Он сдал своему издателю первый том своего учебника по неорганической химии, но с трудом… SensoryPlay.Разрабатывайте и используйте модели, в том числе электронную конфигурацию атомов и ионов, для прогнозирования элементов. Периодическая таблица представляет собой табличное расположение химических элементов, упорядоченных по их атомному номеру, электронным конфигурациям и повторяющимся химическим свойствам. Основные периодические тенденции включают электроотрицательность, энергию ионизации, сродство к электрону, атомные радиусы, ионный радиус, металлический характер и химическую реактивность. Используйте периодическую таблицу в качестве модели для предсказания относительных свойств элементов на основе так называемой периодической таблицы, поскольку она выделяет повторяющиеся (периодические) модели свойств. 3 … нет Если вы ищете информацию о тенденциях в периодической таблице, вы попали в нужную сеть. Остерегайтесь гораздо больше об этом. Составьте список всех шаблонов и тенденций, которые вы можете найти, двигаясь горизонтально слева направо в сортировке карточек. Эти тенденции в периодической таблице возникают из-за особого расположения элементов в соответствии с Периодическим законом. 5 см в глубину) раствора хлорида щелочноземельного металла в каждую лунку в горизонтальном ряду следующим образом (см. рис. 1): В совместной деятельности вы будете использовать 40 карточек и составить периодическую таблицу пришельцев.С открытием атомного числа и его использованием в качестве основы современной Периодической таблицы химики-неорганики, по-видимому, в значительной степени игнорировали закономерности в… Ключ к ответу на лист периодического тренда. 15 декабря 2021 г. Первоначальные Периодические таблицы были построены в порядке атомной массы. Сэр Исаак Ньютон, в Query 31, раздел в его 1717 … C: ПЕРИОДИЧЕСКАЯ ТАБЛИЦА В химии термин элементы основан на их атомной структуре.
3 … нет Если вы ищете информацию о тенденциях в периодической таблице, вы попали в нужную сеть. Остерегайтесь гораздо больше об этом. Составьте список всех шаблонов и тенденций, которые вы можете найти, двигаясь горизонтально слева направо в сортировке карточек. Эти тенденции в периодической таблице возникают из-за особого расположения элементов в соответствии с Периодическим законом. 5 см в глубину) раствора хлорида щелочноземельного металла в каждую лунку в горизонтальном ряду следующим образом (см. рис. 1): В совместной деятельности вы будете использовать 40 карточек и составить периодическую таблицу пришельцев.С открытием атомного числа и его использованием в качестве основы современной Периодической таблицы химики-неорганики, по-видимому, в значительной степени игнорировали закономерности в… Ключ к ответу на лист периодического тренда. 15 декабря 2021 г. Первоначальные Периодические таблицы были построены в порядке атомной массы. Сэр Исаак Ньютон, в Query 31, раздел в его 1717 … C: ПЕРИОДИЧЕСКАЯ ТАБЛИЦА В химии термин элементы основан на их атомной структуре. Изучение этих тенденций позволяет химикам, ученым и даже нам быстро определять те или иные свойства элемента.Есть несколько тенденций, которые происходят в периодической таблице. Образцы в периодической таблице существуют из-за структуры элементов. На этом уроке 10-классники исследуют элементы в пределах определенного периода периодической таблицы элементов. Объясните закономерности и тенденции в их периодической таблице, поскольку они связаны с традиционной периодической таблицей элементов. См. документ учителя во вспомогательной информации. Он широко используется в химии, физике и других науках и обычно считается символом химии.Замечаете ли вы какие-либо тенденции в отношении числа электронных орбиталей? 6. Периодические тенденции: изменение свойств элементов вниз по группам (от … Тенденции и периодическая таблица). Среди элементов в периодической таблице существует множество закономерностей и тенденций, включая атомный радиус, ионный радиус, энергию ионизации и электроотрицательность элементов.
Изучение этих тенденций позволяет химикам, ученым и даже нам быстро определять те или иные свойства элемента.Есть несколько тенденций, которые происходят в периодической таблице. Образцы в периодической таблице существуют из-за структуры элементов. На этом уроке 10-классники исследуют элементы в пределах определенного периода периодической таблицы элементов. Объясните закономерности и тенденции в их периодической таблице, поскольку они связаны с традиционной периодической таблицей элементов. См. документ учителя во вспомогательной информации. Он широко используется в химии, физике и других науках и обычно считается символом химии.Замечаете ли вы какие-либо тенденции в отношении числа электронных орбиталей? 6. Периодические тенденции: изменение свойств элементов вниз по группам (от … Тенденции и периодическая таблица). Среди элементов в периодической таблице существует множество закономерностей и тенденций, включая атомный радиус, ионный радиус, энергию ионизации и электроотрицательность элементов. каждый элемент. Нажмите на вкладки вверху, чтобы изучить каждый раздел. Скачать. переходные металлы. Вот ряд картин периодической таблицы с самым высоким рейтингом в Интернете.Сейчас я скажу вам неправду. Это может включать запоминание символов элементов, изучение свойств семейств или понимание их общей организации. В этой статье вы найдете помеченную периодическую таблицу элементов, а также информацию о тенденциях, связанных с периодической таблицей, или периодических тенденциях Si P Al. Введение: периодическая таблица названа так потому, что похожие закономерности повторяются или появляются периодически, по всей таблице. ИГРАТЬ В. Основные периодические тренды включают электроотрицательность, энергию ионизации, сродство к электрону, атомные радиусы, ионные … Обновлено 06 октября 2019 г.Ответ (1 из 3): Количество протонов определяет количество электронов в случае неионизированных атомов, а количество электронов определяет химические свойства элементов. Эти закономерности можно обнаружить, исследуя изменения в свойствах сходств и тенденций элементов группы 7 периодической таблицы.
каждый элемент. Нажмите на вкладки вверху, чтобы изучить каждый раздел. Скачать. переходные металлы. Вот ряд картин периодической таблицы с самым высоким рейтингом в Интернете.Сейчас я скажу вам неправду. Это может включать запоминание символов элементов, изучение свойств семейств или понимание их общей организации. В этой статье вы найдете помеченную периодическую таблицу элементов, а также информацию о тенденциях, связанных с периодической таблицей, или периодических тенденциях Si P Al. Введение: периодическая таблица названа так потому, что похожие закономерности повторяются или появляются периодически, по всей таблице. ИГРАТЬ В. Основные периодические тренды включают электроотрицательность, энергию ионизации, сродство к электрону, атомные радиусы, ионные … Обновлено 06 октября 2019 г.Ответ (1 из 3): Количество протонов определяет количество электронов в случае неионизированных атомов, а количество электронов определяет химические свойства элементов. Эти закономерности можно обнаружить, исследуя изменения в свойствах сходств и тенденций элементов группы 7 периодической таблицы. Современная периодическая таблица основана на современном периодическом законе, выдвинутом английским физиком Генри Мозли, который гласит, что «свойства элементов являются периодическими функциями их атомных чисел».Понимание тенденций в периодической таблице может быть чрезвычайно полезным на MCAT. Атомные номера элементов в периодической таблице организованы в хронологическом порядке, начиная с водорода с атомным номером 1, начиная с … 104 строк ни один Менделеев не обнаружил повторяющуюся закономерность или периодическую тенденцию в элементах, которые были известны в то время. Галогены 7-й группы получают более реакционную способность. Зигзагообразный вестибюль и зигзагообразная линия — хорошие места для начала.Электроотрицательность — это способность атома притягивать и связывать электроны. Периодическая таблица, также известная как периодическая таблица (химических) элементов, представляет собой табличное отображение химических элементов. Это многомерное исследование закономерностей и тенденций среди химических элементов.
Современная периодическая таблица основана на современном периодическом законе, выдвинутом английским физиком Генри Мозли, который гласит, что «свойства элементов являются периодическими функциями их атомных чисел».Понимание тенденций в периодической таблице может быть чрезвычайно полезным на MCAT. Атомные номера элементов в периодической таблице организованы в хронологическом порядке, начиная с водорода с атомным номером 1, начиная с … 104 строк ни один Менделеев не обнаружил повторяющуюся закономерность или периодическую тенденцию в элементах, которые были известны в то время. Галогены 7-й группы получают более реакционную способность. Зигзагообразный вестибюль и зигзагообразная линия — хорошие места для начала.Электроотрицательность — это способность атома притягивать и связывать электроны. Периодическая таблица, также известная как периодическая таблица (химических) элементов, представляет собой табличное отображение химических элементов. Это многомерное исследование закономерностей и тенденций среди химических элементов. Рабочий лист тенденций периодической таблицы Actividades En Clase Tabla Periodica Ciencia. Это увеличивает атомный радиус, поскольку электроны в самой внешней оболочке находятся дальше от ядра. Группы в периодической таблице Элементы в одной и той же группе периодической таблицы показывают тенденции физических свойств, таких как точка кипения.Рассчитаны температуры плавления и кипения амера Атомная структура. Хотя есть некоторые тренды, которые идут по строкам, самые важные тренды обнаруживаются, когда вы идете вниз по группам. 2 Периодическая таблица Свойства и закономерности элементов Периодический закон • Дмитрий Менделеев был первым ученым, опубликовавшим систематизированную периодическую таблицу известных элементов. Учиться. Эта книга заставляет задуматься. Изучение периодической таблицы и того, как расположены элементы, необходимы для успеха в химии.Периодические тенденции в свойствах элементов. Длинную форму периодической таблицы или современную периодическую таблицу также можно назвать таблицей Бора, поскольку она соответствует схеме расположения электронов вокруг ядра Бора.
Рабочий лист тенденций периодической таблицы Actividades En Clase Tabla Periodica Ciencia. Это увеличивает атомный радиус, поскольку электроны в самой внешней оболочке находятся дальше от ядра. Группы в периодической таблице Элементы в одной и той же группе периодической таблицы показывают тенденции физических свойств, таких как точка кипения.Рассчитаны температуры плавления и кипения амера Атомная структура. Хотя есть некоторые тренды, которые идут по строкам, самые важные тренды обнаруживаются, когда вы идете вниз по группам. 2 Периодическая таблица Свойства и закономерности элементов Периодический закон • Дмитрий Менделеев был первым ученым, опубликовавшим систематизированную периодическую таблицу известных элементов. Учиться. Эта книга заставляет задуматься. Изучение периодической таблицы и того, как расположены элементы, необходимы для успеха в химии.Периодические тенденции в свойствах элементов. Длинную форму периодической таблицы или современную периодическую таблицу также можно назвать таблицей Бора, поскольку она соответствует схеме расположения электронов вокруг ядра Бора.
 .. историки
(Тантал)
.. историки
(Тантал) Какой ученый её предложил?
(Эрнест Резерфорд, шотландец по происхождению,
один из 12 детей)
Какой ученый её предложил?
(Эрнест Резерфорд, шотландец по происхождению,
один из 12 детей) И.Менделеевым периодического
закона считают 1834г. (- )
И.Менделеевым периодического
закона считают 1834г. (- ) 0528
0528