Валентность — это просто | Решаем химию: вопросы и ответы
От слова «валентность» многие ученики, изучающие химию в 8 классе, впадают в спячку. В школьном курсе химии этому вопросу уделяется не так много времени, хотя валентность – одно их базовых понятий в этой науке. Очень важно досконально разобраться, что такое валентность, как она определяется и какое значение она имеет. Поняв это и научившись составлять формулы и определять валентность элементов, вы существенно облегчите себе изучение химии. Приступаем.
Фото: pixabay.comЧто же такое валентность? Ничего страшного в этом явлении нет.
Валентность – это способность атома образовывать химические связи.
Вы же знаете, что бывают вещества простые, состоящие из атомов одного вида, и сложные, состоящие из атомов разных элементов? Так вот чтобы атомы как-то соединялись между собой, они должны связываться, соединяться. А соединяются они посредством химической связи. Одни атомы могут образовать только одну связь, на большее у них способностей не хватает.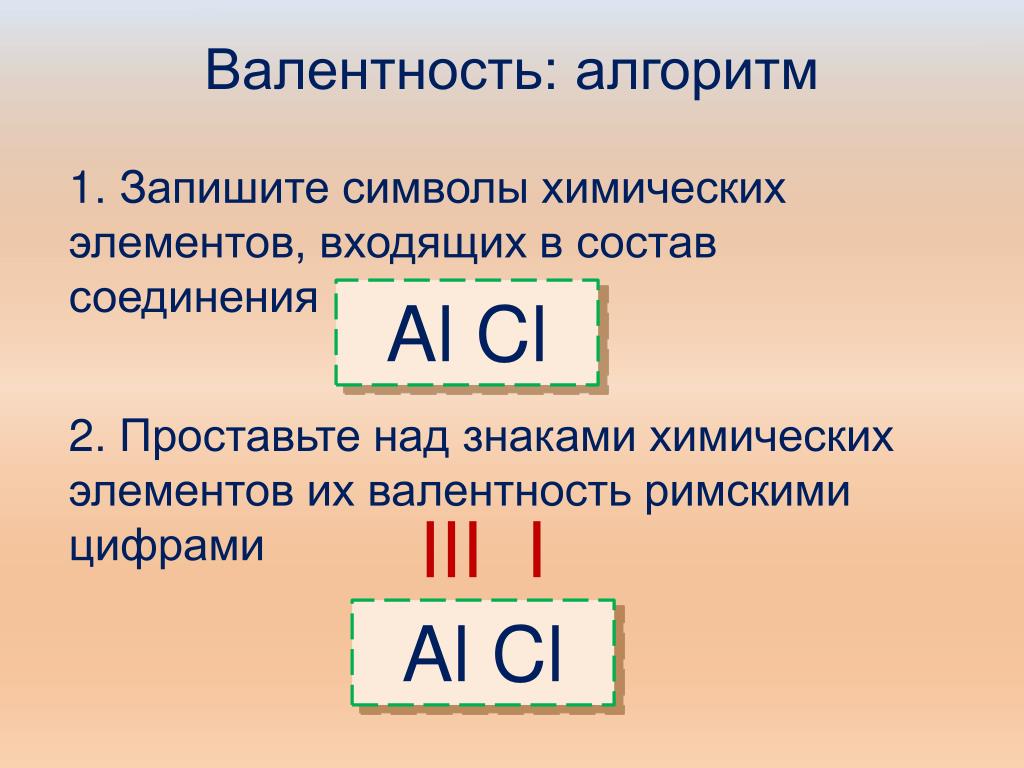 Другие атомы куда мощнее, они могут и несколько связей образовать, чтобы покрепче держаться за окружение. Вот представьте, что у вас только один друг. Надёжный такой, верный друг, который с вами в огонь и в воду. Вы с ним всегда в паре ходите. Это значит, что у вас валентность I (внимание! Читается это не «первая валентность», а «валентность один»!). А теперь представьте, что у вас три верных друга. Вы всегда за них держитесь и твёрдо уверены, что они при вас ежеминутно. Значит, у вас валентность III. В первом случае вы образовали одну крепкую связь, а во втором – три. Вот и вся валентность.
Другие атомы куда мощнее, они могут и несколько связей образовать, чтобы покрепче держаться за окружение. Вот представьте, что у вас только один друг. Надёжный такой, верный друг, который с вами в огонь и в воду. Вы с ним всегда в паре ходите. Это значит, что у вас валентность I (внимание! Читается это не «первая валентность», а «валентность один»!). А теперь представьте, что у вас три верных друга. Вы всегда за них держитесь и твёрдо уверены, что они при вас ежеминутно. Значит, у вас валентность III. В первом случае вы образовали одну крепкую связь, а во втором – три. Вот и вся валентность.
Любой учитель и репетитор по химии скажет вам, что
есть элементы с валентностью постоянной и элементы, у которых валентность может быть разной.
И, как ни странно, они будут правы. Если мы возвратимся к примерам с друзьями, то выглядеть это будет так. Кто-то всю жизнь дружит с одним человеком (у него всегда валентность I), кто-то всю жизнь дружит с тремя (валентность III). А кто-то иногда дружит с одним, иногда с тремя, а иногда — вообще с пятью! Встречали таких в жизни? Вот и среди химических элементов есть такие, которые иногда имеют валентность I, иногда валентность III или даже V. Должна вас немного расстроить: элементы с постоянной валентностью придётся зазубрить. Также навсегда запоминаем, что валентность обозначается римскими цифрами (так повелось, просто смиритесь с этим. Указывается валентность НАД элементом в формуле). Итак, наизусть нужно выучить, что:
А кто-то иногда дружит с одним, иногда с тремя, а иногда — вообще с пятью! Встречали таких в жизни? Вот и среди химических элементов есть такие, которые иногда имеют валентность I, иногда валентность III или даже V. Должна вас немного расстроить: элементы с постоянной валентностью придётся зазубрить. Также навсегда запоминаем, что валентность обозначается римскими цифрами (так повелось, просто смиритесь с этим. Указывается валентность НАД элементом в формуле). Итак, наизусть нужно выучить, что:
· Металлы основной подгруппы первой группы всегда имеют валентность I. Это элементы Li, Na, K, Rb, Cs, Fr.
· Металлы основной подгруппы второй группы всегда имеют валентность II. Это элементы Be, Mg, Ca, Sr, Ba, Ra.
· Водород всегда имеет валентность I.
· Кислород всегда имеет валентность II.
· Элементы Al и В (основная группа третьей подгруппы) всегда имеют валентность III.
· Элементы основной подгруппы седьмой группы чаще (но не всегда!) имеют валентность I. Это элементы F, Cl, Br, I, At. Кстати, эти элементы носят название «галогены» и будьте настороже: галогены любят подшутить и иногда имеют другую валентность. В школьной химии обычно они представляются как одновалентные, но это кокетство, потому что галогены – шалуны.
Это элементы F, Cl, Br, I, At. Кстати, эти элементы носят название «галогены» и будьте настороже: галогены любят подшутить и иногда имеют другую валентность. В школьной химии обычно они представляются как одновалентные, но это кокетство, потому что галогены – шалуны.
Теперь перейдём к элементам с валентностью непостоянной. Это хулиганы, которые любят загадывать загадки и разыгрывать начинающих. Особое коварство они проявляют во время ЕГЭ по химии и даже ОГЭ по химии, запутывая бедных школьников. Итак,
запомните этих головорезов с непостоянной валентностью в лицо:
C (углерод), N (азот), P (фосфор), S (сера), Сr (хром), Fe (железо), Cu (медь).
Конечно же, в таблице Менделеева элементов намного больше. Но в школьном учебнике по химии используется менее половины из них. Дело в том, что в четвёртом периоде таблицы появляются так называемые d-элементы со сложным строением и хитрыми свойствами, о которых школьникам рассказывать не полагается. Да и очень хорошо, нечего голову забивать.
Надеюсь, с понятием «валентность» вы всё-таки разобрались. В следующий раз мы попрактикуемся в определении валентности элементов, если есть формула, и правильном составлении формул веществ, если знаем валентность.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Презентация «Валентность» — химия, презентации
Валентность.
Определение валентности элемента.
Валентность – это число связей, которые данный атом образует с другими атомами.
Валентность обозначается римскими цифрами.
I I I II III I IV I
Бинарные вещества состоят из атомов двух типов химических элементов.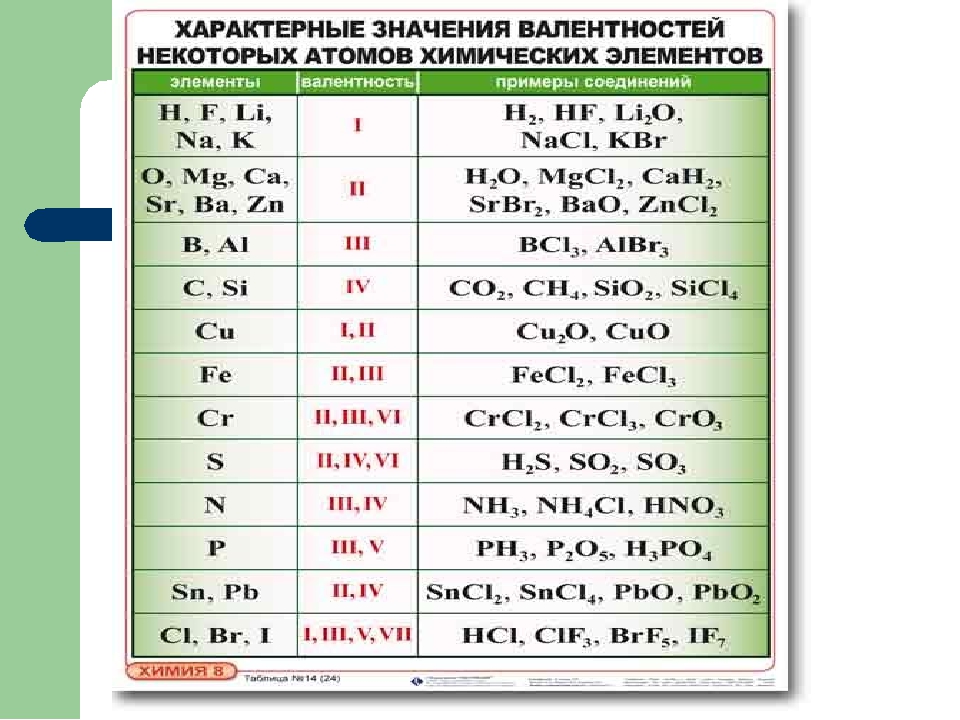
формул по валентности:
1. Записать химические знаки элементов, входящих в состав соединения, и указать их валентности.
Например, составим формулу оксида алюминия – соединения алюминия с кислородом. Запишем знаки химических элементов:
Аl.. O..
Валентность кислорода равна двум, валентность алюминия постоянна, находим значение валентности по таблице учебника, она равна трем. Записываем валентности:
III II
Аl.. O..
формул по валентности:
2. Определить НОК чисел, обозначающих валентность обоих элементов.
НОК – наименьшее общее кратное (из целых положительных чисел, делящееся без остатка на каждое из данных целых чисел).
НОК для II и III = 6
формул по валентности:
3. Разделить НОК на валентность каждого элемента, полученные числа обозначают индексы соответствующих элементов.
6 : II = 3, т.е. индекс при атоме кислорода равен 2
6 : III = 2, т.е. индекс при атоме алюминия равен 3.
4. Записать полученные индексы справа внизу у знаков химических элементов.
III II
Аl2O3
Пример: соединение серы с водородом, при чем валентность серы указана, так как сера имеет переменную валентность.
II
Н..S..
1. Записываем валентность атома водорода:
I II
Н..S..
2. Находим НОК, оно равно двум
3. Находим индексы элементов:
2 : II = 1, т.е. индекс при атоме серы равен 1
2 : I = 2, т.е. индекс при атоме водорода равен 2 4. Записываем формулу с учетом индексов:
I II
Н2S
Определение валентности атомов элементов в соединениях
|
Последовательность действий |
Составление формулы |
|
|
Обозначить известную валентность элемента |
I H2S |
II Al2O3 |
|
Умножить валентность элемента на количество его атомов |
1 ∙ 2 =2 |
2 ∙ 3 = 6 |
|
Поделить полученное число (НОК) на количество атомов другого элемента |
2 : 1 = 2 |
6 : 2 = 3 |
|
Полученный ответ и является искомой валентностью |
I II H2S |
III II Al2O3 |
Расставьте индексы в формулах следующих соединений:
II III
К. ..S… Мg…N…
..S… Мg…N…
IV IV I
Мg…Si… С…Сl…
II I IFe…Сl.. Са…F…
Определите валентности элементов
SiH
4, H2Sе, HF, HBr, РН3CrO3, N2O, CO2, Fe2O3, CO, SO3,
FeO, Cl2O5, MnO, SO2, Cl2O7, NO, K2O, Al2O3, P2O5, NO2, Cr2O3, SiO2, N2O5, B2O3, Mn2O7, CuO, N2O3.
Расставьте индексы в формулах следующих соединений :
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении h3O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
|
Атомный № |
Химический элемент |
Символ |
Валентность химических элементов |
Примеры соединений |
|
1 |
Водород / Hydrogen |
H |
I |
HF |
|
2 |
Гелий / Helium |
He |
отсутствует |
— |
|
3 |
Литий / Lithium |
Li |
I |
Li2O |
|
4 |
Бериллий / Beryllium |
Be |
II |
BeH2 |
|
5 |
Бор / Boron |
B |
III |
BCl3 |
|
6 |
Углерод / Carbon |
C |
IV, II |
CO2, CH4 |
|
7 |
Азот / Nitrogen |
N |
III, IV |
NH3 |
|
8 |
Кислород / Oxygen |
O |
II |
H2O, BaO |
|
9 |
Фтор / Fluorine |
F |
I |
HF |
|
10 |
Неон / Neon |
Ne |
отсутствует |
— |
|
11 |
Натрий / Sodium |
Na |
I |
Na |
|
12 |
Магний / Magnesium |
Mg |
II |
MgCl2 |
|
13 |
Алюминий / Aluminum |
Al |
III |
Al2O3 |
|
14 |
Кремний / Silicon |
Si |
IV |
SiO2, SiCl4 |
|
15 |
Фосфор / Phosphorus |
P |
III, V |
PH3, P2O5 |
|
16 |
Сера / Sulfur |
S |
VI, IV, II |
H2S, SO3 |
|
17 |
Хлор / Chlorine |
Cl |
I, III, V, VII |
HCl, ClF3 |
|
18 |
Аргон / Argon |
Ar |
отсутствует |
— |
|
19 |
Калий / Potassium |
K |
I |
KBr |
|
20 |
Кальций / Calcium |
Ca |
II |
CaH2 |
|
21 |
Скандий / Scandium |
Sc |
III |
Sc2S3 |
|
22 |
Титан / Titanium |
Ti |
II, III, IV |
Ti2O3, TiH4 |
|
23 |
Ванадий / Vanadium |
V |
II, III, IV, V |
VF5, V2O3 |
|
24 |
Хром / Chromium |
Cr |
II, III, VI |
CrCl2, CrO3 |
|
25 |
Марганец / Manganese |
Mn |
II, III, IV, VI, VII |
Mn2O7, Mn2(SO4)3 |
|
26 |
Железо / Iron |
Fe |
II, III |
FeSO4, FeBr3 |
|
27 |
Кобальт / Cobalt |
Co |
II, III |
CoI2, Co2S3 |
|
28 |
Никель / Nickel |
Ni |
II, III, IV |
NiS, Ni(CO)4 |
|
29 |
Медь / Copper |
Сu |
I, II |
CuS, Cu2O |
|
30 |
Цинк / Zinc |
Zn |
II |
ZnCl2 |
|
31 |
Галлий / Gallium |
Ga |
III |
Ga(OH)3 |
|
32 |
Германий / Germanium |
Ge |
II, IV |
GeBr4, Ge(OH)2 |
|
33 |
Мышьяк / Arsenic |
As |
III, V |
As2S5, H3AsO4 |
|
34 |
Селен / Selenium |
Se |
II, IV, VI, |
H2SeO3 |
|
35 |
Бром / Bromine |
Br |
I, III, V, VII |
HBrO3 |
|
36 |
Криптон / Krypton |
Kr |
VI, IV, II |
KrF2, BaKrO4 |
|
37 |
Рубидий / Rubidium |
Rb |
I |
RbH |
|
38 |
Стронций / Strontium |
Sr |
II |
SrSO4 |
|
39 |
Иттрий / Yttrium |
Y |
III |
Y2O3 |
|
40 |
Цирконий / Zirconium |
Zr |
II, III, IV |
ZrI4, ZrCl2 |
|
41 |
Ниобий / Niobium |
Nb |
I, II, III, IV, V |
NbBr5 |
|
42 |
Молибден / Molybdenum |
Mo |
II, III, IV, V, VI |
Mo2O5, MoF6 |
|
43 |
Технеций / Technetium |
Tc |
I — VII |
Tc2S7 |
|
44 |
Рутений / Ruthenium |
Ru |
II — VIII |
RuO4, RuF5, RuBr3 |
|
45 |
Родий / Rhodium |
Rh |
I, II, III, IV, V |
RhS, RhF3 |
|
46 |
Палладий / Palladium |
Pd |
I, II, III, IV |
Pd2S, PdS2 |
|
47 |
Серебро / Silver |
Ag |
I, II, III |
AgO, AgF2, AgNO3 |
|
48 |
Кадмий / Cadmium |
Cd |
II |
CdCl2 |
|
49 |
Индий / Indium |
In |
III |
In2O3 |
|
50 |
Олово / Tin |
Sn |
II, IV |
SnBr4, SnF2 |
|
51 |
Сурьма / Antimony |
Sb |
III, IV, V |
SbF5, SbH3 |
|
52 |
Теллур / Tellurium |
Te |
VI, IV, II |
TeH2, H6TeO6 |
|
53 |
Иод / Iodine |
I |
I, III, V, VII |
HIO3, HI |
|
54 |
Ксенон / Xenon |
Xe |
II, IV, VI, VIII |
XeF6, XeO4, XeF2 |
|
55 |
Цезий / Cesium |
Cs |
I |
CsCl |
|
56 |
Барий / Barium |
Ba |
II |
Ba(OH)2 |
|
57 |
Лантан / Lanthanum |
La |
III |
LaH3 |
|
58 |
Церий / Cerium |
Ce |
III, IV |
CeO2 , CeF3 |
|
59 |
Празеодим / Praseodymium |
Pr |
III, IV |
PrF4, PrO2 |
|
60 |
Неодим / Neodymium |
Nd |
III |
Nd2O3 |
|
61 |
Прометий / Promethium |
Pm |
III |
Pm2O3 |
|
62 |
Самарий / Samarium |
Sm |
II, III |
SmO |
|
63 |
Европий / Europium |
Eu |
II, III |
EuSO4 |
|
64 |
Гадолиний / Gadolinium |
Gd |
III |
GdCl3 |
|
65 |
Тербий / Terbium |
Tb |
III, IV |
TbF4, TbCl3 |
|
66 |
Диспрозий / Dysprosium |
Dy |
III |
Dy2O3 |
|
67 |
Гольмий / Holmium |
Ho |
III |
Ho2O3 |
|
68 |
Эрбий / Erbium |
Er |
III |
Er2O3 |
|
69 |
Тулий / Thulium |
Tm |
II, III |
Tm2O3 |
|
70 |
Иттербий / Ytterbium |
Yb |
II, III |
YO |
|
71 |
Лютеций / Lutetium |
Lu |
III |
LuF3 |
|
72 |
Гафний / Hafnium |
Hf |
II, III, IV |
HfBr3, HfCl4 |
|
73 |
Тантал / Tantalum |
Ta |
I — V |
TaCl5, TaBr2, TaCl4 |
|
74 |
Вольфрам / Tungsten |
W |
II — VI |
WBr6, Na2WO4 |
|
75 |
Рений / Rhenium |
Re |
I — VII |
Re2S7, Re2O5 |
|
76 |
Осмий / Osmium |
Os |
II — VI, VIII |
OsF8, OsI2, Os2O3 |
|
77 |
Иридий / Iridium |
Ir |
I — VI |
IrS3, IrF4 |
|
78 |
Платина / Platinum |
Pt |
I, II, III, IV, V |
Pt(SO4)3, PtBr4 |
|
79 |
Золото / Gold |
Au |
I, II, III |
AuH, Au2O3, Au2Cl6 |
|
80 |
Ртуть / Mercury |
Hg |
II |
HgF2, HgBr2 |
|
81 |
Талий / Thallium |
Tl |
I, III |
TlCl3, TlF |
|
82 |
Свинец / Lead |
Pb |
II, IV |
PbS, PbH4 |
|
83 |
Висмут / Bismuth |
Bi |
III, V |
BiF5, Bi2S3 |
|
84 |
Полоний / Polonium |
Po |
VI, IV, II |
PoCl4, PoO3 |
|
85 |
Астат / Astatine |
At |
нет данных |
— |
|
86 |
Радон / Radon |
Rn |
отсутствует |
— |
|
87 |
Франций / Francium |
Fr |
I |
— |
|
88 |
Радий / Radium |
Ra |
II |
RaBr2 |
|
89 |
Актиний / Actinium |
Ac |
III |
AcCl3 |
|
90 |
Торий / Thorium |
Th |
II, III, IV |
ThO2, ThF4 |
|
91 |
Проактиний / Protactinium |
Pa |
IV, V |
PaCl5, PaF4 |
|
92 |
Уран / Uranium |
U |
III, IV |
UF4, UO3 |
|
93 |
Нептуний |
Np |
III — VI |
NpF6, NpCl4 |
|
94 |
Плутоний |
Pu |
II, III, IV |
PuO2, PuF3, PuF4 |
|
95 |
Америций |
Am |
III — VI |
AmF3, AmO2 |
|
96 |
Кюрий |
Cm |
III, IV |
CmO2, Cm2O3 |
|
97 |
Берклий |
Bk |
III, IV |
BkF3, BkO2 |
|
98 |
Калифорний |
Cf |
II, III, IV |
Cf2O3 |
|
99 |
Эйнштейний |
Es |
II, III |
EsF3 |
|
100 |
Фермий |
Fm |
II, III |
— |
|
101 |
Менделевий |
Md |
II, III |
— |
|
102 |
Нобелий |
No |
II, III |
— |
|
103 |
Лоуренсий |
Lr |
III |
— |
|
Номер |
Элемент |
Символ |
Валентность химических элементов |
Пример |
Что такое валентность в химии определение.
 Валентность это
Валентность этоспособность атома к образованию химических связей. Количественной мерой В. обычно принято считать число других атомов в молекуле, с которыми данный атом образует связи. В. — одно из фундаментальных понятий теории химического строения (см. Химического строения теория). Оно формировалось вместе с понятием химической связи, параллельно с развитием синтетической химии и методов исследования строения и свойств веществ, и его содержание неоднократно расширялось и изменялось по мере того, как экспериментальная химия находила всё новые и новые классы соединений с неизвестными ранее типами взаимодействия атомов в молекуле, а в последние 30-40 лет — с развитием квантовой химии. В настоящее время накопленный химией экспериментальный материал столь обширен и разнообразен, а картина химической связи в разных соединениях столь пестра, что задача нахождения последовательного, единого и всеобъемлющего определения В. представляется крайне сложной. Эти трудности побуждают некоторых химиков вообще отказаться от поисков универсального понятия В. и заменить его набором более узких, но зато более конкретных и более точных понятий (ковалентность, гетеровалентность, координационное число и т.д.), область применимости каждого из которых ограничена соединениями с каким-либо одним преобладающим типом взаимодействия (ковалентным, ионным, координационным и т.д.). Однако до настоящего времени и в специальной, и в учебной литературе В. продолжает широко использоваться и как определение способности атома к образованию связей в самом общем смысле слова, и как количественная мера этой способности, и как синоним предлагаемых более узких понятий.
и заменить его набором более узких, но зато более конкретных и более точных понятий (ковалентность, гетеровалентность, координационное число и т.д.), область применимости каждого из которых ограничена соединениями с каким-либо одним преобладающим типом взаимодействия (ковалентным, ионным, координационным и т.д.). Однако до настоящего времени и в специальной, и в учебной литературе В. продолжает широко использоваться и как определение способности атома к образованию связей в самом общем смысле слова, и как количественная мера этой способности, и как синоним предлагаемых более узких понятий.
Для отдельных классов соединений, где преобладает какой-либо один тип химического взаимодействия, полезную информацию о способности атомов к образованию связей могут дать перечисленные ниже частные понятия (частные определения В.).
1. Определение понятия «валентность» и связь его с другими понятиями химии
Ковалентность — мера способности атома к образованию ковалентных химических связей, возникающих за счёт двух электронов (по одному от каждого атома) и имеющих малополярный характер (см.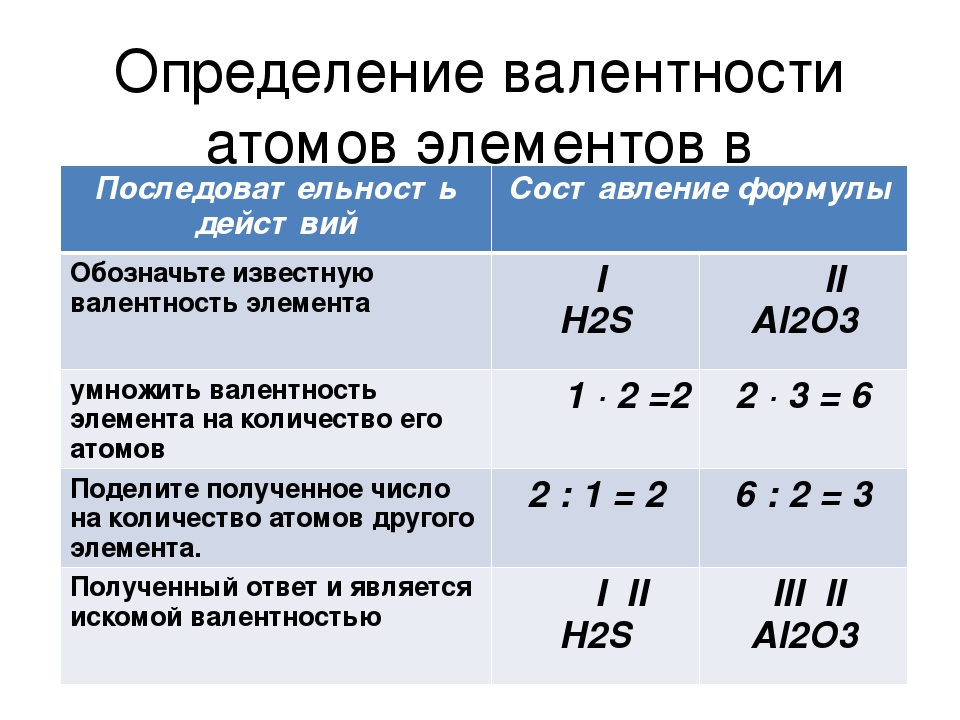 Ковалентная связь (См. Купер)).
Ковалентная связь (См. Купер)).
Ковалентность равна числу неспаренных электронов атома, участвующих в образовании связи, и часто может принимать все значения от 1 до максимальной, которая для большого числа элементов совпадает с номером их группы в периодической системе Менделеева (подробно см. разделы 2 и 3).
Гетеровалентность (употребляются также термины электровалентность и ионная валентность) — мера способности атома к образованию ионных химических связей, возникающих за счёт электростатического взаимодействия ионов, которые образуются при полном (или почти полном) переходе электронов одного атома к другому (см. Ионная связь). Гетеровалентность равна числу электронов, которые атом отдал или получил от другого атома, и совпадает с зарядом соответствующего иона (см. раздел 2).
Координационное число (КЧ) равно числу атомов, ионов или молекул, находящихся в непосредственной близости с данным атомом в молекуле, комплексном соединении или кристалле. В отличие от ковалентности и гетеровалентности, это понятие имеет чисто геометрический смысл и не зависит от характера связи между центральным атомом и лигандом. Так, например, КЧ атомов Al, Si, Р в комплексных ионах 3- , 2- , — равно 6, а КЧ атомов В, Xe, Ni в [ВН 4 ] — , ХеО 4 , Ni (CO) 4 равно 4. В кристалле NaCl каждый атом Na окружен шестью атомами Сl, так что КЧ Na равно 6. Величина КЧ может определяться как относительными размерами атомов, так и другими, более сложными причинами (см. разделы 2 и 3).
Так, например, КЧ атомов Al, Si, Р в комплексных ионах 3- , 2- , — равно 6, а КЧ атомов В, Xe, Ni в [ВН 4 ] — , ХеО 4 , Ni (CO) 4 равно 4. В кристалле NaCl каждый атом Na окружен шестью атомами Сl, так что КЧ Na равно 6. Величина КЧ может определяться как относительными размерами атомов, так и другими, более сложными причинами (см. разделы 2 и 3).
Окислительное число (ОЧ) (или степень окисления) — понятие, получившее в последнее время распространение в неорганической химии, — это электростатический заряд, условно приписываемый атому по следующим правилам. В ионных соединениях ОЧ совпадает с зарядом иона (например, в NaCl ОЧ Na равно +1, ОЧ Cl равно -1). В ковалентных соединениях ОЧ принято считать равным заряду, который получил бы атом, если бы все пары электронов, осуществляющие связь, были целиком перенесены к более электроотрицательным атомам (то есть если условно допустить, что связь имеет полностью ионный характер). Например, в HCl ОЧ Н равно +1, ОЧ Cl равно -1. В элементарных соединениях ОЧ равно 0 (например, в O 2 , Cl 2 , Р 4 , S 8 , в алмазе). При вычислении ОЧ в соединениях, где имеются два связанных атома одного элемента, их общую электронную пару принято делить пополам. Понятие ОЧ полезно при составлении уравнений окислительно-восстановительных реакций, для классификации неорганических и комплексных соединений и т.д.
При вычислении ОЧ в соединениях, где имеются два связанных атома одного элемента, их общую электронную пару принято делить пополам. Понятие ОЧ полезно при составлении уравнений окислительно-восстановительных реакций, для классификации неорганических и комплексных соединений и т.д.
Однако по своему определению ОЧ, в отличие от ковалентности и ионной В., имеющих чёткий физический смысл, носит в общем случае условный характер и, за исключением весьма ограниченного класса соединений с чисто ионной связью, не совпадает ни с эффективными зарядами атомов в соединениях, ни с фактическим количеством связей, которые атом образует. Кроме того, в ряде случаев, в частности, когда электроотрицательности двух разных связанных атомов близки и связь между ними имеет почти чисто ковалентный характер, возникает неопределённость, к какому из них следует целиком относить электронную пару (см. Окислительное число).
2. Эволюция понятия «валентность» и его роль в истории химии
В таком определении В. , естественно, всегда выражается целыми числами. Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом Н был выбран в качестве стандарта, обладающего В., равной 1. В «водородной» шкале кислород и сера имеют В., равную 2, азот и фосфор 3, углерод и кремний 4. Однако «водородной» шкалы оказалось недостаточно: в других соединениях, например в окислах, один и тот же элемент может реализовать В., которые не осуществляются в гидридах (существуют окислы P 2 O 5 , SO 3 и Cl 2 O 7 , но неизвестны гидриды PH 5 , SH 6 и ClH 7). В качестве второго стандарта с В., равной 2, был выбран кислород.
, естественно, всегда выражается целыми числами. Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом Н был выбран в качестве стандарта, обладающего В., равной 1. В «водородной» шкале кислород и сера имеют В., равную 2, азот и фосфор 3, углерод и кремний 4. Однако «водородной» шкалы оказалось недостаточно: в других соединениях, например в окислах, один и тот же элемент может реализовать В., которые не осуществляются в гидридах (существуют окислы P 2 O 5 , SO 3 и Cl 2 O 7 , но неизвестны гидриды PH 5 , SH 6 и ClH 7). В качестве второго стандарта с В., равной 2, был выбран кислород.
Лит.: Сыркин Я. К., Периодическая система и проблема валентности, М., 1971; Сыркин Я. К. и Дяткина М. Е., Химическая связь и строение молекул, М.-Л., 1946; Паулинг Л., Природа химической связи, пер. с англ., М. — Л., 1947; Шусторович Е. М., Новое в учении о валентности, М., 1968; Коулсон Ч., Валентность, пер. с англ. , М., 1965: Маррел Д., Кеттл С., Теддер Д., Теория валентности, пер. с англ., М., 1968; Астахов К. В., Современное состояние периодической системы Д. И. Менделеева, М., 1969.
, М., 1965: Маррел Д., Кеттл С., Теддер Д., Теория валентности, пер. с англ., М., 1968; Астахов К. В., Современное состояние периодической системы Д. И. Менделеева, М., 1969.
Элемента;
> прогнозировать возможные значения валентности элемента, исходя из его размещения в периодической системе;
> определять значения валентности элементов в бинарных соединениях по их формулам;
> составлять формулы бинарных соединений, исходя из значений валентности элементов.
Значение валентности элемента при необходимости указывают в химической формуле римской цифрой над его символом: В математических расчетах и тексте для этого используют арабские цифры.
Определите валентность элементов в молекулах аммиака NH 3 и метана CH 4 .
Сведения о валентности элементов в веществе можно представить другим способом. Сначала записывают на определенном расстоянии друг от друга символы каждого атома, находящегося в молекуле. Затем одновалентный атом соединяют с другим одной черточкой, от двухвалентного атома проводят две черточки и т. д.:
д.:
Такие формулы называют графическими. Они показывают порядок соединения атомов в молекулах.
Молекула простого вещества водорода имеет графическую формулу H-H. Аналогичными являются графические формулы молекул фтора, хлора, брома, иода. Графическая формула молекулы кислорода 0=0, а молекулы азота .
Составляя такие формулы для молекул сложных веществ, следует иметь в виду, что атомы одного элемента, как правило, не соединены между собой.
Изобразите графические формулы молекул аммиака и метана.
Из графической формулы молекулы легко определить валентность каждого атома. Значение валентности равно количеству черточек, которые исходят от атома.
Для соединений ионного и атомного строения графические формулы не используют.
Валентность элемента и его размещение в периодической системе.
Некоторые элементы имеют постоянную валентность.
Это интересно
В начале XIX в. во взглядах на состав химических соединений господствовал
во взглядах на состав химических соединений господствовал
принцип «наибольшей простоты». Так, формулу воды записывали HO, а не H 2 O.
Гидроген и Флуор всегда одновалентны, а Оксиген — двухвалентен. Другие элементы с постоянной валентностью находятся в I-III группах периодической системы, причем значение валентности каждого элемента совпадает с номером группы. Так, элемент I группы Литий одновалентен, элемент II группы Магний двухвалентен, а элемент III группы Бор трехвалентен. Исключениями являются элементы I группы Купрум (значения валентности — I и 2) и Аурум (I и 3).
Большинство элементов имеют переменную валентность. Приводим ее значения для некоторых из них:
Плюмбум (IV группа) — 2,4;
Фосфор (V группа) — 3,5;
Хром (VI группа) — 2, 3, 6;
Сульфур (VI группа) — 2, 4, 6;
Манган (VII группа) — 2, 4, 6, 7;
Хлор (VII группа) — I, 3, 5, 7.
Из этих сведений вытекает важное правило: максимальное значение валентности элемента совпадает с номером группы, в которой он находится1. Поскольку в периодической системе восемь групп, то значения валентности элементов могут быть от I до 8.
Поскольку в периодической системе восемь групп, то значения валентности элементов могут быть от I до 8.
Существует еще одно правило: значение валентности неметаллического элемента в соединении с Гидрогеном или с металлическим элементом равно 8 минус номер группы, в которой размещен элемент. Подтвердим его примерами соединений элементов с Гидрогеном. Элемент VII группы Иод в иодоводороде HI одновалентен (8-7=1), элемент VI группы Оксиген в воде H 2 O двухвалентен (8 — 6 = 2), элемент V группы Нитроген в аммиаке
Nh4 трехвалентен (8 — 5 = 3).
Определение валентности элементов в бинарном соединении по его формуле.
Бинарным 2 называют соединение, образованное двумя элементами.
1 Существует несколько исключений.
2 Термин происходит от латинского слова binarius — двойной; состоящий из двух частей.
Это интересно
Формулы соединений, образованных тремя и более элементами, составляют иначе.
Выяснить значение валентности элемента в соединении нужно тогда, когда элемент имеет переменную валентность. Как выполняют такое задание , покажем на примере.
Как выполняют такое задание , покажем на примере.
Найдем значение валентности Иода в его соединении с Оксигеном, которое имеет формулу I 2 O 5 .
Вы знаете, что Оксиген — двухвалентный элемент. Запишем значение его валентности над символом этого элемента в химической формуле соединения: . На 5 атомов Оксигена приходится 2 * 5 = 10 единиц валентности. Их нужно «распределить» между двумя атомами Иода (10: 2 = 5). Из этого следует, что Иод в соединении пятивалентен.
Формула соединения с обозначением валентности элементов —
Определите валентность элементов в соединениях с формулами CO 2 и Cl 2 O 7 .
Составление химических формул соединений по валентности элементов.
Выполним задание, противоположное предыдущему, — составим химическую формулу соединения Сульфура с Оксигеном, в котором Сульфур шестивалентен.
Сначала запишем символы элементов, образующих соединение, и укажем над ними значения валентности: . Затем находим наименьшее число, которое делится без остатка на оба значения валентности. Это число 6. Делим его на значение валентности каждого элемента и получаем соответствующие индексы в химической формуле соединения: .
Это число 6. Делим его на значение валентности каждого элемента и получаем соответствующие индексы в химической формуле соединения: .
Для проверки химической формулы используют правило: произведения значений валентности каждого элемента на количество его атомов в формуле одинаковы. Эти произведения для только что выведенной химической формулы: 6 -1 = 2-3.
Запомните, что в формулах соединений, в том числе бинарных, сначала записывают символы металлических элементов, а потом — неметаллических. Если соединение образовано только неметаллическими элементами и среди них есть Оксиген или Флуор, то эти элементы записывают последними.
Это интересно
Порядок записи элементов в формуле соединения Оксигена с Флуором такой: OF 2 .
Составьте химические формулы соединений Бора с Флуором и Оксигеном.
Причины соединения атомов друг с другом и объяснение значений валентности элементов связаны со строением атомов. Этот материал будет рассмотрен в 8 классе.
Выводы
Валентность — это способность атома соединяться с определенным количеством таких же или других атомов.
Существуют элементы с постоянной и переменной валентностью. Гидроген и Флуор всегда одновалентны, Оксиген — двухвалентен.
Значения валентности элементов отражают в графических формулах молекул соответствующим количеством черточек возле атомов.
Произведения значений валентности каждого элемента на количество его атомов в формуле бинарного соединения одинаковы.
?
75. Что такое валентность? Назовите максимальное и минимальное значения валентности химических элементов.
76. Укажите символы элементов, имеющих постоянную валентность: К, Ca, Cu, Cl, Zn, F, Н.
77. Определите валентность всех элементов в соединениях, которые имеют такие формулы:
78. Определите валентность элементов в соединениях с такими формулами:
a) BaH 2 , V 2 O 5 , MoS 3 , SiF 4 , Li 3 P; б) CuS, TiCI 4 , Ca 3 N 2 , P 2 O 3 , Mn 2 O 7 .
79. Составьте формулы соединений, образованных элементами с постоянной валентностью: Na…H…, Ba…F…, Al…О…, AI…F….
80. Составьте формулы соединений, используя указанные валентности некоторых элементов:
81. Напишите формулы соединений с Оксигеном таких элементов: а) Лития; б) Магния; в) Осмия (проявляет валентность 4 и 8).
82. Изобразите графические формулы молекул CI 2 O, PH 3 , SO 3 .
83. Определите валентность элементов по графическим формулам молекул:
На досуге
«Конструируем» молекулы
Рис. 45. Модель молекулы метана CH 4
По графическим формулам можно изготовлять модели молекул (рис. 45). Самым удобным материалом для этого является пластилин. Из него делают шарикиатомы (для атомов различных элементов используют пластилин разного цвета). Шарики соединяют с помощью спичек; каждая спичка заменяет одну черточку в графической формуле молекулы.
Изготовьте модели молекул H 2 , O 2 , H 2 O (имеет угловую форму), Nh4 (имеет форму пирамиды), CO 2 (имеет линейную форму).
Валентность — это способность химических элементов удерживать определенное количество атомов других элементов. В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность достаточно просто.
Спонсор размещения P&G Статьи по теме «Как определить валентность» Как доказать амфотерность гидроксидов Как вычислить валентность Как определить химическую формулу
Инструкция
Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
Обратите внимание: если формула двухэлементного вещества написана правильно, то,
при умножении числа атомов каждого элемента на его валентность, у всех элементов
должны получиться одинаковые произведения.
Примите к сведению, что валентность атомов одних элементов постоянна, а других — переменна, то есть, имеет свойство меняться. Например, водород во всех соединениях одновалентен, поскольку образует только одну связь. Кислород способен образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV или VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
Например, водород во всех соединениях одновалентен, поскольку образует только одну связь. Кислород способен образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV или VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто.
Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в Cah3 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V — это валентность атомов элементов, а К — количество атомов в молекуле. С ее помощью легко определить показатель валентности любого элемента, если известны остальные данные.
С ее помощью легко определить показатель валентности любого элемента, если известны остальные данные.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Как простоДругие новости по теме:
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – h3SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома
Валентность — это способность атома присоединять другие атомные группы и отдельные атомы. Это важное понятие позволяет определить, сколько атомов того или иного вещества входит в формулу, и изобразить молекулу вещества графически. Вам понадобится таблица валентностей Спонсор размещения P&G Статьи
«Знание шрифтов – одно из самых элементарных требований, предъявляемых к сыщику!», — так наставлял когда-то великий Шерлок Холмс своего друга и летописца доктора Ватсона. Аналогично этому, можно смело сказать: «Знание того, как составляются химические формулы – одно из самых элементарных
Аналогично этому, можно смело сказать: «Знание того, как составляются химические формулы – одно из самых элементарных
Химия для каждого школьника начинается с таблицы Менделеева и фундаментальных законов. И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
Валентность химического элемента — это способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Нужно помнить, что некоторые атомы одного и того же химического элемента могут иметь разную валентность в разных соединениях. Вам
Валентность – один из основных терминов, употребляемых в теории химического строения. Это понятие определяет способность атома образовывать химические связи и количественно представляет собой число связей, в которых он участвует. Спонсор размещения P&G Статьи по теме «Что такое валентность» Что
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами
Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами
1.3: Валентные электроны и открытые валентности
Валентный электрон — это электрон, который связан с атомом и может участвовать в образовании химической связи; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары. Присутствие валентных электронов может определять химические свойства элемента и то, может ли он связываться с другими элементами: для элемента основной группы валентный электрон может находиться только во внешней электронной оболочке.6 \)) химически инертен. Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, очень реактивен, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также является высоко реактивным из-за тенденции либо получать недостающие валентные электроны (тем самым образуя отрицательный ион), либо делить валентные электроны (тем самым образуя ковалентную связь).
Подобно электрону во внутренней оболочке, валентный электрон обладает способностью поглощать или выделять энергию в виде фотона.Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Число валентных электронов
Число валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории.За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
Периодическая таблица химических элементов
| Группа периодической таблицы | Валентные электроны |
|---|---|
| Группа 1 (I) (щелочные металлы) | 1 |
| Группа 2 (II) (щелочноземельные металлы) | 2 |
| Группы 3-12 (переходные металлы) | 2 * (Оболочка 4s завершена и больше не может удерживать электроны) |
| Группа 13 (III) (группа бора) | 3 |
| Группа 14 (IV) (углеродная группа) | 4 |
| Группа 15 (V) (пниктогены) | 5 |
| Группа 16 (VI) (халькогены) | 6 |
| Группа 17 (VII) (галогены) | 7 |
| Группа 18 (VIII или 0) (благородные газы) | 8 ** |
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов. Вместо этого используется модифицированный метод счета d-электронов. ** За исключением гелия, у которого всего два валентных электрона.
Вместо этого используется модифицированный метод счета d-электронов. ** За исключением гелия, у которого всего два валентных электрона.
Концепция открытой валентности («валентность»)
Валентность (или валентность ) элемента является мерой его объединяющей способности с другими атомами, когда он образует химические соединения или молекулы. Концепция валентности была разработана во второй половине 19 века и успешно объяснила молекулярную структуру многих органических соединений.Поиски основных причин валентности привели к современным теориям химической связи, включая структуры Льюиса (1916), теорию валентных связей (1927), молекулярные орбитали (1928), теорию отталкивания пар электронов валентных оболочек (1958) и все продвинутые методы квантовой химии.
Объединяющая способность или сродство атома элемента определялась числом атомов водорода, с которыми он соединялся. В метане углерод имеет валентность 4; в аммиаке азот имеет валентность 3; в воде кислород имеет валентность два; а в хлористом водороде хлор имеет валентность 1. Хлор, поскольку он имеет валентность, равную единице, может быть заменен водородом, поэтому фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5 . Диаграммы валентности соединения представляют собой взаимосвязь элементов, линии между двумя элементами, иногда называемые связями, представляют насыщенную валентность для каждого элемента. [1] Примеры: —
Хлор, поскольку он имеет валентность, равную единице, может быть заменен водородом, поэтому фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5 . Диаграммы валентности соединения представляют собой взаимосвязь элементов, линии между двумя элементами, иногда называемые связями, представляют насыщенную валентность для каждого элемента. [1] Примеры: —
Валентность описывает только связность, она не описывает геометрию молекулярных соединений или то, что сейчас известно как ионные соединения или гигантские ковалентные структуры.Линия между атомами не представляет собой пару электронов, как на диаграммах Льюиса.
Валентность (химия) — wikidoc
В химии валентность , также известная как валентность , или число валентности , , является мерой количества химических связей, образованных атомами данного элемента. За последнее столетие концепция валентности превратилась в ряд подходов к описанию химической связи, включая структуры Льюиса (1916), теорию валентных связей (1927), молекулярные орбитали (1928), теорию отталкивания электронных пар валентных оболочек (1958). и все передовые методы квантовой химии.
и все передовые методы квантовой химии.
История
Этимология слова «валентность» происходит от 1425 года, что означает «экстракт, подготовка», от латинского valentia «сила, емкость», а химическое значение, относящееся к «объединяющей силе элемента», записано с 1884 года. с немецкого Валенц . [1]
В 1789 году Уильям Хиггинс опубликовал взгляды на то, что он называл комбинациями «предельных» частиц, которые предвосхитили концепцию валентных связей. [2] Если, например, согласно Хиггинсу, сила между конечной частицей кислорода и конечной частицей азота составляла 6, то сила силы была бы соответственно разделена, и аналогично для других комбинаций конечной частицы. частицы:
Однако точное начало теории химических валентностей можно проследить до работы Эдварда Франкленда 1852 года, в которой он объединил старые теории свободных радикалов и «теорию типов» с мыслями о химическом сродстве, чтобы показать, что определенные элементы обладают склонность объединяться с другими элементами с образованием соединений, содержащих 3, т. е.е. в трех группах атомов (например, NO 3 , NH 3 , NI 3 , и т. д.) или 5, то есть в группах из пяти атомов (например, NO 5 , NH 4 O, ПО 5 , и др.), Эквиваленты прилагаемых элементов. По словам Франклина, именно так их родство удовлетворяется лучше всего. Следуя этим примерам и постулатам, Франклин заявляет, насколько очевидно это: [3]
е.е. в трех группах атомов (например, NO 3 , NH 3 , NI 3 , и т. д.) или 5, то есть в группах из пяти атомов (например, NO 5 , NH 4 O, ПО 5 , и др.), Эквиваленты прилагаемых элементов. По словам Франклина, именно так их родство удовлетворяется лучше всего. Следуя этим примерам и постулатам, Франклин заявляет, насколько очевидно это: [3]
| “ | тенденция или закон преобладает (здесь), и что, независимо от того, какими могут быть символы объединяющих атомов, объединяющая сила притягивающего элемента, если мне позволят термин, всегда удовлетворяется одним и тем же числом этих атомов. | ” |
Эту «объединяющую способность» впоследствии американские химики назвали количественной или валентностью (и валентностью). [2]
Обзор
Эта концепция была разработана в середине девятнадцатого века в попытке рационализировать формулы различных химических соединений. В 1919 году Ирвинг Ленгмюр позаимствовал этот термин для объяснения модели кубического атома Гилберта Н. Льюиса, заявив, что «количество пар электронов, которые любой данный атом делит с соседними атомами, называется ковалентностью этого атома.«Приставка co- , например, соавтор, означает вместе, совместно, связанные в действии, партнерские отношения в меньшей степени, и т. Д.; Таким образом, ковалентная связь, по существу, означает, что атомы имеют общую валентность. Следовательно, если у атома, например, была валентность +1, что означало, что у него отсутствовал электрон, а у другого — валентность -1, что означало, что у него был дополнительный электрон, то связь между этими двумя атомами могла бы возникнуть, потому что они будут дополнять или поделиться своими тенденциями к дисбалансу валентности.Впоследствии теперь чаще говорят о ковалентных связях, а не о «валентности», которая вышла из употребления в работе более высокого уровня с достижениями теории химической связи, но все еще широко используется в элементарных исследованиях, где она обеспечивает эвристическое введение в предмет.
В 1919 году Ирвинг Ленгмюр позаимствовал этот термин для объяснения модели кубического атома Гилберта Н. Льюиса, заявив, что «количество пар электронов, которые любой данный атом делит с соседними атомами, называется ковалентностью этого атома.«Приставка co- , например, соавтор, означает вместе, совместно, связанные в действии, партнерские отношения в меньшей степени, и т. Д.; Таким образом, ковалентная связь, по существу, означает, что атомы имеют общую валентность. Следовательно, если у атома, например, была валентность +1, что означало, что у него отсутствовал электрон, а у другого — валентность -1, что означало, что у него был дополнительный электрон, то связь между этими двумя атомами могла бы возникнуть, потому что они будут дополнять или поделиться своими тенденциями к дисбалансу валентности.Впоследствии теперь чаще говорят о ковалентных связях, а не о «валентности», которая вышла из употребления в работе более высокого уровня с достижениями теории химической связи, но все еще широко используется в элементарных исследованиях, где она обеспечивает эвристическое введение в предмет.
Определение «Количество облигаций»
Первоначально считалось, что количество связей, образованных данным элементом, является фиксированным химическим свойством, и на самом деле во многих случаях это хорошее приближение.Например, во многих их соединениях углерод образует четыре связи, кислород — две и водород — одну. Однако вскоре стало очевидно, что для многих элементов валентность может варьироваться между разными соединениями. Одним из первых выявленных примеров был фосфор, который иногда ведет себя так, как если бы его валентность равнялась трем, а иногда — как если бы его валентность была равна пяти. Один из способов решения этой проблемы — указать валентность для каждого отдельного соединения: хотя он устраняет большую часть общности концепции, этот подход породил идею степени окисления (используемой в номенклатуре акций) и лямбда-обозначения в ИЮПАК. номенклатура неорганической химии.
Определение IUPAC
Международный союз теоретической и прикладной химии (IUPAC) предпринял несколько попыток дать однозначное определение валентности. Текущая версия, принятая в 1994 г., [4] :
Текущая версия, принятая в 1994 г., [4] :
- Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут объединяться с атомом рассматриваемого элемента, или с фрагментом, или для которых атом этого элемента может быть замещен.
Это определение повторно устанавливает уникальную валентность для каждого элемента за счет пренебрежения, во многих случаях, значительной частью его химического состава.
Водород и хлор упоминаются по историческим причинам, хотя на практике они в основном образуют соединения, в которых их атомы образуют одинарную связь. Исключения в случае водорода включают ион [HF 2 ] — и различные гидриды бора, такие как диборан: это примеры трехцентровых двухэлектронных связей. Хлор образует ряд фторидов — ClF, ClF 3 и ClF 5 , — следовательно, его валентность согласно определению IUPAC равна пяти.Фтор — это элемент, у которого наибольшее количество атомов соединяется с атомами других элементов: он одновалентен во всех соединениях, кроме иона [H 2 F] + . Фактически, определение ИЮПАК может быть разрешено только путем фиксации валентностей водорода и фтора как одного, соглашение, которому здесь следовали.
Фактически, определение ИЮПАК может быть разрешено только путем фиксации валентностей водорода и фтора как одного, соглашение, которому здесь следовали.
Валентность элементов
Валентности для большинства элементов основаны на фториде с самым высоким содержанием из известных. [5]
Периодическая таблица (валанс)
Другая критика концепции валентности
- Валентность элемента не всегда равна его высшей степени окисления: исключения включают рутений, осмий и ксенон, валентность которых равна шести (гексафториды), но которые образуют соединения с кислородом в степени окисления +8 и хлором, который имеет валентность пять, но самую высокую степень окисления +7 (в перхлоратах).
- Понятие «комбинация» нельзя приравнивать к количеству связей, образованных атомом. Во фториде лития (который имеет структуру NaCl) каждый атом лития окружен шестью атомами фтора, тогда как валентность лития обычно принимается равной единице, как следует из формулы LiF.
 [6]
[6]
Ссылки
Внешние ссылки
Шаблон: PeriodicTablesFooter
af: Валенси ар: تكافؤ bs: Валенсия (Хемия) bg: Валентност ca: Валенсия (química) da: Валенс de: Wertigkeit (Chemie) eo: Valento eu: Balentzia gl: Valencia atómica это: Валенца он: ערכיות ка: ვალენტობა lt: Valentingumas lv: Vērtība (īmija) нл: Валенти (хими) простой: Валентность (химия) fi: Валенси (Кемия) uk: Валентність ur: رف (میاء)
валентных электронов
валентных электроновВалентные электроны
- Валентные электроны — это те электроны, которые находятся в самых высоких
основной уровень энергии .Именно эти электроны в первую очередь взаимодействуют
с другими атомами.
- Кислород имеет 6 валентных электронов: 1s 2 2s 2 2p 4
- Натрий имеет 1 валентный электрон: 1s 2 2s 2 2p 6 3s 1
- Бром имеет 7 валентных электронов: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
- Ксенон имеет 8 валентных электронов: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5 пол 6
- Выберите два элемента из любого столбца и определите, сколько валентных электронов
у этих атомов есть.
 Вы должны заметить определенный узор.
Вы должны заметить определенный узор.
- Экспериментальные данные показывают нам, что атомы наиболее стабильны, когда они полные s- и p-орбитали (8 валентных электронов) в их наивысшей принципиальной энергии уровень.
- Простым доказательством этого являются благородные газы, которые образуют последний столбец справа от таблицы Менделеева. Все эти элементы имеют 8 валентных электронов на их высшем принципиальном уровне энергии.Одно исключение Это Он, который имеет полный основной энергетический уровень с 2 электронами.
- Если атомы не имеют 8 валентных электронов (или двух, если они близки к He), затем они будут реагировать с другими атомами, чтобы получить 8 валентных электронов. Это можно сделать, разделив электроны между атомами, взяв электроны. от других атомов или отдавая электроны другим атомам.
- По сути, атомы наиболее стабильны, когда они могут достичь внешнего электрона.
структура аналогична ближайшему Благородному газу.

- Периодическую таблицу Менделеева можно разделить на две большие группы:
- Металлы (низкая энергия ионизации и низкая электроотрицательность)
- Неметаллы (высокая энергия ионизации и высокая электроотрицательность)
- Если два атома собираются соединиться вместе, у нас есть три возможных категории:
- металл / металл
- металл / неметалл
- неметалл / неметалл
- Виды облигаций, которые могут образовывать
- Если у нас есть пара металл / металл или неметалл / неметалл, тогда каждый атом в паре будет иметь одинаковую электроотрицательность и ионизацию. энергия как атом, с которым она связана.В этой ситуации атомы будут притягивать электроны друг друга примерно с такой же силой, и он будет требуется одинаковое количество энергии, чтобы удалить электрон из каждого атома.
- Когда оба атома в паре одинаково притягивают электроны друг друга
(электроотрицательность) и сопротивляться удалению электрона (ионизация
энергии) аналогичным образом, то они будут делить электроны, образуя ковалентную
связь.

- Если у нас есть пара мета / неметалл, то атом неметалла будет тянуть сильно на слабо удерживаемый (низкая энергия ионизации) электрон металла и атом металла не будет сильно тянуть (низкая электроотрицательность) на сильно удерживаемые (с высокой энергией ионизации) электроны атома неметалла.
- Когда есть большой дисбаланс электроотрицательности и ионизации
энергии между атомами образуется ионная связь .
- Валентные электроны определяют, сколько электронов используется совместно или переносится между атомами.
валентность — Викисловарь
Английский [править]
Этимология 1 [править]
В значении «выдержка, подготовка» от латинского valentia («сила, емкость») (1425). Нынешнее значение слова «объединяющая способность (атома)» происходит от немецкого Valenz (1884 г. ), от того же латинского слова.Лингвистическое определение было сформировано по аналогии с его использованием в химии. Значение «одномерная ценность», используемое в психологии, также происходит от немецкого Valenz (1935).
), от того же латинского слова.Лингвистическое определение было сформировано по аналогии с его использованием в химии. Значение «одномерная ценность», используемое в психологии, также происходит от немецкого Valenz (1935).
Произношение [править]
Существительное [править]
валентность ( счетных и бесчисленных , множественных валентностей )
- (химия, медицина, устаревшее) Выписка; препарат, в настоящее время особенно эффективный против определенного числа штаммов возбудителя.
- (химия) Объединяющая способность атома, радикала или функциональной группы, определяемая количеством электронов, которые они теряют, приобретают или разделяют при объединении с другими атомами и т. Д. [С 1884 г.]
- Синоним: валентность
- (химия) Число сайтов связывания молекулы, такой как антитело или антиген.
- (лингвистика) Количество аргументов, которые может иметь глагол, включая его подлежащее, в диапазоне от нуля (например, «Идет дождь») до трех (например, «Он дает ей цветок») или меньше.
 обычно четыре.
обычно четыре.- Синоним: валентность
Количество связей, которые имеет глагол, составляет то, что мы будем называть валентностью глагола.
- (особенно психология) Одномерное значение, присвоенное объекту, ситуации или состоянию, которое обычно может быть положительным или отрицательным. [с 1935 г.]
гнев и страх отрицательны валентность
- (социология) Ценность.
Альтернативные формы [править]
Производные термины [править]
Связанные термины [править]
Переводы [править]
химия: комбайны
химия: количество сайтов связывания в молекуле
лингвистика: количество аргументов, которые может иметь глагол
психология: одномерное значение, присвоенное объекту, ситуации или состоянию
- Приведенные ниже переводы необходимо проверить и вставить выше в соответствующие таблицы переводов, удалив все числа.
 Числа не обязательно совпадают с числами в определениях. См. Инструкции в Викисловаре: Макет статьи § Переводы.
Числа не обязательно совпадают с числами в определениях. См. Инструкции в Викисловаре: Макет статьи § Переводы.
Проверяемые переводы
Этимология 2 [править]
Эта этимология неполная. Вы можете помочь Викисловарю, подробно остановившись на происхождении этого термина.
Произношение [править]
Существительное [править]
валентность ( множественное число валентность )
- Альтернативное написание слова valance
Дополнительная литература [править]
Анаграммы [править]
Произношение [править]
Существительное [править]
валентность f
- (химия) валентность, валентность
- Синоним: mocenství
- (лингвистика) валентность, валентность
Производные термины [править]
Связанные термины [править]
Дополнительная литература [править]
- валентность в Příruční slovník jazyka českého , 1935–1957
- валентность в Slovník spisovného jazyka českého , 1960–1971, 1989
- valence в Akademický slovník cizích slov , 1995, at prirucka.
 ujc.cas.cz
ujc.cas.cz
Этимология [править]
Обратное формирование из моновалентности . И т. Д.
Произношение [править]
Существительное [править]
валентность f ( множественное число валентности )
- (химия) валентность
- (лингвистика) валентность
См. Также [править]
Дополнительная литература [править]
Анаграммы [править]
Атомы и химия
Валентные электроны
Атомы имеют тенденцию быть химически стабильными, когда каждая электронная оболочка пуста или полна.Частично заполненные оболочки нестабильны. Говоря антропоморфными терминами, атомы немного навязчивы и навязчивы в отношении своих электронных оболочек. Никому не нужна частично заполненная оболочка! Раздражают частично заполненные снаряды. Таким образом, атомы любят торговаться друг с другом, разрабатывать сделки по обмену электронами или обмену ими, чтобы все могли быть счастливы.
Электроны, населяющие частично заполненную оболочку, называются валентными электронами .Валентные электроны участвуют в образовании химических связей между атомами, поэтому химикам полезно знать, сколько валентных электронов имеет каждый тип атома. Чтобы определить количество валентных электронов в атоме любого типа, найдите элемент в периодической таблице и посчитайте в строке слева, как показано в примерах ниже. (Это работает для всех элементов, кроме благородных газов, которые не имеют частично заполненных оболочек и, следовательно, валентных электронов.)
Сколько валентных электронов у атома кислорода? Кислород — шестой элемент во втором ряду.Поскольку это шестой элемент в своем ряду, он имеет шесть валентных электронов. (Обратите внимание, что ряд столбцов пропускается при подсчете во второй строке, потому что в этих столбцах нет элементов для этой строки.)Сколько валентных электронов у натрия? Натрий — первый элемент в третьем ряду. Поскольку это первый элемент в своем ряду, у него всего один валентный электрон.
Сколько валентных электронов у неона? Никто. Это благородный газ, поэтому он не имеет частично заполненных оболочек и, следовательно, валентных электронов.
Атомы водорода и щелочных металлов, перечисленных в первом столбце периодической таблицы, имеют по одному валентному электрону. Эти элементы стремятся отдать валентный электрон в химической реакции. Возьмем, к примеру, литий. Чтобы избежать позора частично заполненной оболочки, литий мог либо отдать свой валентный электрон (тем самым опустошив свою вторую оболочку), либо собрать еще семь (чтобы заполнить ту оболочку, которая может вместить восемь). Что ж, вам не нужно быть атомом лития, чтобы знать, что отдать один электрон намного проще, чем просить своих друзей о семи из них! Точно так же элемент кальций (второй элемент в четвертом ряду) мог либо отдать свои два валентных электрона, чтобы опустошить свою четвертую оболочку, либо собрать еще шестнадцать, чтобы заполнить эту оболочку.Разумеется, отдать два намного проще, чем собрать шестнадцать, поэтому кальций сильно предпочитает отдавать свои два валентных электрона. С другой стороны, элементам с правой стороны периодической таблицы, таким как кислород и фтор, легче заполнить свои оболочки (добавив один или два дополнительных электрона), чем избавиться от множества валентных электронов.
Таким образом, элементы с левой стороны периодической таблицы ( металлов ) имеют тенденцию отдавать валентные электроны, а элементы с правой стороны ( неметаллы ) имеют тенденцию собирать их.Исключение составляет крайний правый столбец. Эти элементы, называемые благородными газами , счастливы именно так. Гелий, например, имеет полностью заполненную внутреннюю оболочку, а все остальные его оболочки совершенно пусты. Аналогично с неоном. Его первые две оболочки полны, а остальные пустые. Гелий, неон и другие благородные газы любят это так: никаких частично заполненных оболочек! Таким образом, благородные газы вообще не вступают в химические реакции. Дворяне редко соизволят пообщаться с простолюдином!
Также стоит отметить, что элементы в нижнем левом и верхнем правом углах периодической таблицы, как правило, имеют более высокую реакционную способность (опять же, за исключением благородных газов).Элемент франций (в нижнем левом углу) является наиболее химически активным металлом; фтор (в правом верхнем углу) — наиболее реактивный неметалл. Чтобы понять, почему это так, рассмотрим следующее. Электроны притягиваются к ядру, но отталкиваются друг от друга. Чем больше в атоме электронов, тем меньше разницы между притяжением ядра. Хотя в ядре франция много положительно заряженных протонов, в нем также много электронов. Итак, с точки зрения любого отдельного электрона остальная часть атома кажется почти нейтральной: она лишь немного привлекательна.Более того, электроны с более высокими энергиями могут легче избежать притяжения ядра и уйти. Валентный электрон франция застрял на очень высокоэнергетической оболочке. Он не может упасть в нижние снаряды, потому что эти снаряды уже полны! Этот печальный, одинокий валентный электрон слишком хочет сбежать.
У фтора, напротив, остается только одно пустое место во второй оболочке. Фтор стремится заполнить это место, чтобы он мог чувствовать себя самодовольным и самодовольным, как его ближайший сосед неон.А с точки зрения блуждающего электрона вторая оболочка атома фтора — довольно привлекательное место для жизни. Счета за энергию дешевы (для достижения второй оболочки требуется относительно мало энергии), а других электронов вокруг не так уж много. Какой электрон не захотел бы там уйти на пенсию?
. [6]
[6]  Вы должны заметить определенный узор.
Вы должны заметить определенный узор.

 обычно четыре.
обычно четыре. Числа не обязательно совпадают с числами в определениях. См. Инструкции в Викисловаре: Макет статьи § Переводы.
Числа не обязательно совпадают с числами в определениях. См. Инструкции в Викисловаре: Макет статьи § Переводы.  ujc.cas.cz
ujc.cas.cz