| Соляная кислота | |
|---|---|
 ( {{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Общие | |
| Систематическое наименование | Хлороводородная кислота |
| Хим. формула | H2O:HCl |
| Рац. формула | HCl |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 36.46 г/моль |
| Плотность | 1.19 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -30 °C |
| • кипения | 48 °C |
| Энтальпия | |
| • образования | -605.22 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты p K a {\displaystyle pK_{a}} | -10 |
| Растворимость | |
| • в воде | смешивается |
| Классификация | |
| Рег. номер CAS | 7647-01-0 |
| Рег. номер EINECS | 933-977-5 |
| екс Алиментариус | E507 |
| RTECS | MW4025000 |
| Безопасность | |
| NFPA 704 | |
| Соляная кислота | |
|---|---|
 ( {{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Общие | |
| Систематическое наименование | Хлороводородная кислота |
| Хим. формула | H2O:HCl |
| Рац. формула | HCl |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 36.46 г/моль |
| Плотность | 1.19 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -30 °C |
| • кипения | 48 °C |
| Энтальпия | |
| • образования | -605.22 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты p K a {\displaystyle pK_{a}} | -10 |
| Растворимость | |
| • в воде | смешивается |
| Классификация | |
| Рег. номер CAS | 7647-01-0 |
| Рег. номер EINECS | 933-977-5 |
| екс Алиментариус | E507 |
| RTECS | MW4025000 |
| Безопасность | |
| NFPA 704 | |
Хлороводородная кислота — это… Что такое Хлороводородная кислота?
- Хлороводородная кислота
ХЛОРОВОДОРОДНАЯ КИСЛОТА (хлористоводородная кислота) — то же, что соляная кислота.
Российская энциклопедия по охране труда. — М.: НЦ ЭНАС. Под ред. В. К. Варова, И. А. Воробьева, А. Ф. Зубкова, Н. Ф. Измерова. 2007.
- Характеристика работы
- Холодильный агент
Смотреть что такое «Хлороводородная кислота» в других словарях:
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что (см.) … Большая политехническая энциклопедия
Хлороводородная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
хлороводородная кислота — то же, что соляная кислота … Энциклопедический словарь
ХЛОРОВОДОРОДНАЯ КИСЛОТА — то же, что соляная кислота … Естествознание. Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота), р р хлороводорода в воде; сильная кислота. Бесцв., дымящая на воздухе жидкость (техн. С. к. желтоватая из за примесей Fe, Сl2 и др.). макс. концентрация (при 20 °С) 38% по массе, плотность такого р ра 1,19 г/см3.… … Естествознание. Энциклопедический словарь
соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
СОЛЯНАЯ КИСЛОТА
— (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране трудаСоляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
СОЛЯНАЯ КИСЛОТА — (хлористоводородная к та, хлороводородная к та), р р НС1 в воде бесцв. жидкость с резким запахом; рильная одноосновная кислота. Хлористый водород НС1 (мол. м. 36,461 ) бесцв. газ с резким запахом, во влажном воздухе сильно дымит; длина связи HЧС1 … Химическая энциклопедия
Список кислот и ангидридов
Хлорид водорода (соляная кислота) — это… Что такое Хлорид водорода (соляная кислота)?
- Хлорид водорода (соляная кислота)
«…Хлорид водорода (HCl) — это бесцветный дымящийся газ с удушливым запахом, получаемым действием водорода (или воды и кокса) на хлор или действием серной кислоты на хлорид натрия.
Он легко сжижается под давлением и легко растворим в воде. Хранится под давлением в жидком виде в стальных баллонах. Также поставляется в концентрированных водных растворах (обычно 28 — 38%) (хлористоводородная кислота, или соляная кислота) в стеклянных, керамических сосудах или в железнодорожных и автоцистернах с резиновой футеровкой. В чистом виде эти растворы с едким запахом бесцветны, при наличии примесей (хлорид железа, мышьяк, диоксид серы, серная кислота) имеют желтоватый цвет. На влажном воздухе над концентрированными растворами появляется белый «дым».
Соляная кислота имеет множество способов применения, например, травление железа, цинка и других металлов, экстракция желатина из костей, очистка животного угля, получение хлоридов металлов и т.п. Газообразный хлорид водорода часто используется в органическом синтезе (например, в производстве хлоропрена, винилхлорида, искусственной камфоры, гидрохлорида каучука)…»
Источник:
«Пояснения к Товарной номенклатуре внешнеэкономической деятельности Российской Федерации (ТН ВЭД России)» (подготовлены ГТК РФ) (том 1, разделы I — VI, группы 1 — 29)
Официальная терминология. Академик.ру. 2012.
- Хлорантранилипрол
- Хлорирование (в металлургии драгоценных металлов)
Смотреть что такое «Хлорид водорода (соляная кислота)» в других словарях:
СОЛЯНАЯ КИСЛОТА — (НСl), водный раствор хлороводорода, бесцветного газа с резким запахом. Получают действием серной кислоты на поваренную соль, как побочный продукт хлорирования углеводородов, или реакцией водорода и хлора. Соляная кислота используется, для… … Научно-технический энциклопедический словарь
СОЛЯНАЯ КИСЛОТА — (хлористоводородная кислота) НСl водный раствор хлористого водорода, сильная одноосновная кислота, летучая, с резким запахом; примеси железа, хлора окрашивают её в желтоватый цвет. Поступающая в продажи концентрированная С. к. содержит 37 %… … Большая политехническая энциклопедия
Хлоридная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Хлористоводородная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Хлороводородная кислота — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Метиосульфония хлорид — Противоязвенные препараты и препараты для лечения гастроэзофагеального рефлюкса (англ. Drugs for peptic ulcer and gastro oesophageal reflux disease (GORD)) группа лекарственных препаратов A02B Анатомо терапевтическо химической классификации (АТХ) … Википедия
определение — 2.7 определение: Процесс выполнения серии операций, регламентированных в документе на метод испытаний, в результате выполнения которых получают единичное значение. Источник … Словарь-справочник терминов нормативно-технической документации
Гидрид алюминия — Гидрид алюминия … Википедия
Е507 — Модель молекулы соляной кислоты Соляная (или соляная) кислота (хлористоводородная кислота) (Hydrochloric acid) HCl, раствор хлористого водорода в воде; сильная одноосновная кислота. Бесцветная, «дымящая» на воздухе, сильно едкая жидкость… … Википедия
Хлороводород — Хлороводород … Википедия
Хлороводородная кислота — Госстандарт
Соля́на́я (хлороводоро́дная, хлористоводоро́дная, — хлори́дная) кислота́, хлористый водород — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.), «дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
Конц. (вес) | Конц. (г/л) | Плотность | Молярность | pH | Вязкость | Удельная | Давление | Т | Т |
10 % | 104,80 | 1,048 | 2,87 M | −0,5 | 1,16 | 3,47 | 0,527 | 103 °C | −18 °C |
20 % | 219,60 | 1,098 | 6,02 M | −0,8 | 1,37 | 2,99 | 27,3 | 108 °C | −59 °C |
30 % | 344,70 | 1,149 | 9,45 M | −1,0 | 1,70 | 2,60 | 1,410 | 90 °C | −52 °C |
32 % | 370,88 | 1,159 | 10,17 M | −1,0 | 1,80 | 2,55 | 3,130 | 84 °C | −43 °C |
34 % | 397,46 | 1,169 | 10,90 M | −1,0 | 1,90 | 2,50 | 6,733 | 71 °C | −36 °C |
36 % | 424,44 | 1,179 | 11,64 M | −1,1 | 1,99 | 2,46 | 14,100 | 61 °C | −30 °C |
38 % | 451,82 | 1,189 | 12,39 M | −1,1 | 2,10 | 2,43 | 28,000 | 48 °C | −26 °C |
Соляная кислота
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре. В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии крепкой серной кислоты на поваренную соль:
NaCl + H2SO4(конц.) (150 °C) → NaHSO4 + HCl↑
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
NaCl + NaHSO4 (>550 °C) → Na2SO4 + HCl↑
Хлороводород прекрасно растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
- Применяют в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с ПАВ используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована в качестве регулятора кислотности, пищевой добавки E507. Применяется для изготовления зельтерской (содовой) воды.
Медицина
- Составная часть желудочного сока; разведенную соляную кислоту ранее назначали внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока.
Особенности обращения
Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные ожоги. Особенно опасно попадание в глаза. При открывании сосудов с соляной кислотой в обычных условиях образуется туман и пары хлороводорода, которые раздражают слизистые оболочки и дыхательные пути.
Реагируя с такими веществами, как хлорная известь, диоксид марганца, или перманганат калия, образует токсичный газообразный хлор.
Хлороводород — Википедия
| Хлороводород | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | хлористый водород |
| Хим. формула | HCl |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 36,4606 г/моль |
| Плотность | 1.477 г/л, газ (25 °C) |
| Энергия ионизации | 12,74 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | −114,22 °C |
| Т. кип. | −85 °C |
| 1500 °C | |
| Кр. точка | 51,4 °C |
| Энтальпия образования | -92,31 кДж/моль |
| Давление пара | 40,5 ± 0,1 атм[1] |
| Химические свойства | |
| pKa | -4; -7 |
| Растворимость в воде | 72,47 (20 °C) |
| Классификация | |
| Рег. номер CAS | 7647-01-0 |
| PubChem | 313 |
| Рег. номер EINECS | 231-595-7 |
| SMILES | |
| InChI | |
| RTECS | MW4025000 |
| ChEBI | 17883 |
| Номер ООН | 1050 |
| ChemSpider | 307 |
| Безопасность | |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хло́роводоро́д[2], хло́ристый водоро́д[3] (HCl) — бесцветный, термически устойчивый ядовитый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При −85,1 °C конденсируется в бесцветную, подвижную жидкость. При −114,22 °C HCl переходит в твёрдое состояние. В твёрдом состоянии хлороводород существует в виде двух кристаллических модификаций: ромбической, устойчивой ниже −174,75 °C, и кубической.
Свойства
Водный раствор хлористого водорода называется соляной кислотой. При растворении в воде протекают следующие процессы:
- H C l + H 2 O → H 3 O + + C l − {\displaystyle {\mathsf {HCl+H_{2}O\rightarrow H_{3}O^{+}+Cl^{-}}}}
Процесс растворения сильно экзотермичен. С водой HCl образует азеотропную смесь, содержащую 20,24 % HCl.
Соляная кислота является сильной одноосновной кислотой, она энергично взаимодействует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями, образуя соли — хлориды:
- M g + 2 H C l → M g C l 2 + H 2 ↑ {\displaystyle {\mathsf {Mg+2HCl\rightarrow MgCl_{2}+H_{2}\uparrow }}}
- F e O + 2 H C l → F e C l 2 + H 2 O {\displaystyle {\mathsf {FeO+2HCl\rightarrow FeCl_{2}+H_{2}O}}}
Хлориды чрезвычайно распространены в природе и имеют широчайшее применение (галит, сильвин). Большинство из них хорошо растворяется в воде и полностью диссоциируют на ионы. Слаборастворимыми являются хлорид свинца(II) (PbCl2), хлорид серебра (AgCl), хлорид ртути(I) (Hg2Cl2, каломель) и хлорид меди(I) (CuCl).
При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:
- M n O 2 + 4 H C l → M n C l 2 + C l 2 ↑ + 2 H 2 O {\displaystyle {\mathsf {MnO_{2}+4HCl\rightarrow MnCl_{2}+Cl_{2}\uparrow +2H_{2}O}}}
При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
- 4 H C l + O 2 → 2 H 2 O + 2 C l 2 ↑ {\displaystyle {\mathsf {4HCl+O_{2}\rightarrow 2H_{2}O+2Cl_{2}\uparrow }}}
Концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
- 2 C u + 4 H C l → 2 H [ C u C l 2 ] + H 2 ↑ {\displaystyle {\mathsf {2Cu+4HCl\rightarrow 2H[CuCl_{2}]+H_{2}\uparrow }}}
Смесь 3 объемных частей концентрированной соляной и 1 объемной доли концентрированной азотной кислот называется «царской водкой». Царская водка способна растворять даже золото и платину. Высокая окислительная активность царской водки обусловлена присутствием в ней хлористого нитрозила и хлора, находящихся в равновесии с исходными веществами:
- 4 H + + 3 C l − + N O 3 − → N O C l + C l 2 + 2 H 2 O {\displaystyle {\mathsf {4H^{+}+3Cl^{-}+NO_{3}^{-}\rightarrow NOCl+Cl_{2}+2H_{2}O}}}
Благодаря высокой концентрации хлорид-ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению:
- 3 P t + 4 H N O 3 + 18 H C l → 3 H 2 [ P t C l 6 ] + 4 N O ↑ + 8 H 2 O {\displaystyle {\mathsf {3Pt+4HNO_{3}+18HCl\rightarrow 3H_{2}[PtCl_{6}]+4NO\uparrow +8H_{2}O}}} [4]
Присоединяется к серному ангидриду, образуя хлорсульфоновую кислоту HSO3Cl:
- S O 3 + H C l → H S O 3 C l {\displaystyle {\mathsf {SO_{3}+HCl\rightarrow HSO_{3}Cl}}}
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
- R — C H = C H 2 + H C l → R — C H C l — C H 3 {\displaystyle {\mathsf {R{\text{-}}CH{\text{=}}CH_{2}+HCl\rightarrow R{\text{-}}CHCl{\text{-}}CH_{3}}}}
- R — C ≡ C H + 2 H C l → R — C C l 2 — C H 3 {\displaystyle {\mathsf {R{\text{-}}C\equiv CH+2HCl\rightarrow R{\text{-}}CCl_{2}{\text{-}}CH_{3}}}}
Получение
В лабораторных условиях хлороводород получают, воздействуя концентрированной серной кислотой на хлорид натрия (поваренную соль) при слабом нагревании:
- N a C l + H 2 S O 4 → N a H S O 4 + H C l ↑ {\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\rightarrow NaHSO_{4}+HCl\uparrow }}}
HCl также можно получить гидролизом ковалентных галогенидов, таких, как хлорид фосфора(V), тионилхлорид (SOCl2), и гидролизом хлорангидридов карбоновых кислот:
- P C l 5 + H 2 O → P O C l 3 + 2 H C l {\displaystyle {\mathsf {PCl_{5}+H_{2}O\rightarrow POCl_{3}+2HCl}}}
- R C O C l + H 2 O → R C O O H + H C l {\displaystyle {\mathsf {RCOCl+H_{2}O\rightarrow RCOOH+HCl}}}
В промышленности хлороводород ранее получали в основном сульфатным методом (методом Леблана), основанном на взаимодействии хлорида натрия с концентрированной серной кислотой. В настоящее время для получения хлороводорода обычно используют прямой синтез из простых веществ:
- H 2 + C l 2 → 2 H C l {\displaystyle {\mathsf {H_{2}+Cl_{2}\rightarrow 2HCl}}}
В производственных условиях синтез осуществляется в специальных установках, в которых водород непрерывно сгорает ровным пламенем в токе хлора, смешиваясь с ним непосредственно в факеле горелки. Тем самым достигается спокойное (без взрыва) протекание реакции. Водород подается в избытке (5 — 10 %), что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту.
Соляную кислоту получают растворением газообразного хлороводорода в воде.
Применение
Водный раствор широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамината натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе. Широкое распространение раствор соляной кислоты получил в производстве мелкоштучных бетонных и гипсовых изделий: тротуарная плитка, железобетонные изделия и т.д.
Безопасность
Хлороводород ядовит. Вдыхание хлороводорода может привести к кашлю, удушению, воспалению носа, горла и верхних дыхательных путей, а в тяжёлых случаях — к отёку легких, нарушению работы кровеносной системы и даже смерти. Контактируя с кожей может вызывать покраснение, боль и серьёзные ожоги. Хлористый водород может вызвать серьёзные ожоги глаз и их необратимое повреждение.
Смертельная концентрация (ЛК50):
3 г/м³ (человек, 5 минут)
1,3 г/м³ (человек, 30 минут)
3,1 г/м³ (крыса, 1 час)
1,1 г/м³ (мышь, 1 час)
Смертельная доза (ЛД50) — 238 мг/кг
Использовался как отравляющее средство во время войн.[источник не указан 2326 дней]
Примечания
Литература
- Левинский М.И, Мазанко А. Ф., Новиков И. Н. «Хлористый водород и соляная кислота» М.:Химия 1985
Ссылки
Хлороводородная кислота Википедия
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота) — раствор хлороводорода ( HCl {\displaystyle {\ce {HCl}}} ) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
История
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis). Иоганн Глаубер в XVII в. получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия[1].
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), мас. % | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность, M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Т. кип., °C | Т. пл., °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)
При низкой температуре хлороводород с водой даёт кристаллогидраты составов HCl ⋅ H 2 O {\displaystyle {\ce {HCl.h3O}}} (т. пл. −15,4 °С), HCl ⋅ 2 H 2 O {\displaystyle {\ce {HCl.2h3O}}} (т. пл. −18 °С), HCl ⋅ 3 H 2 O {\displaystyle {\ce {HCl.3h3O}}} (т. пл. –25 °С), HCl ⋅ 6 H 2 O {\displaystyle {\ce {HCl.6h3O}}} (т. пл. −70 °С). При атмосферном давлении (101,3 кПа) хлороводород с водой образуют азеотропную смесь с т. кип. 108,6 °С и содержанием HCl {\displaystyle {\ce {HCl}}} 20,4 мас. %[2].
Химические свойства
- 2 Na + 2 HCl ⟶ 2 NaCl + H 2 ↑ {\displaystyle {\ce {2Na + 2HCl -> 2NaCl + h3 ^}}} ,
- Mg + 2 HCl ⟶ MgCl 2 + H 2 ↑ {\displaystyle {\ce {Mg + 2HCl -> MgCl2 + h3 ^}}} ,
- 2 Al + 6 HCl ⟶ 2 AlCl 3 + 3 H 2 ↑ {\displaystyle {\ce {2Al + 6HCl -> 2AlCl3 + 3h3 ^}}} .
- Na 2 O + 2 HCl ⟶ 2 NaCl + H 2 O {\displaystyle {\ce {Na2O + 2HCl -> 2NaCl + h3O}}} ,
- MgO + 2 HCl ⟶ MgCl 2 + H 2 O {\displaystyle {\ce {MgO + 2HCl -> MgCl2 + h3O}}} ,
- Al 2 O 3 + 6 HCl ⟶ 2 AlCl 3 + 3 H 2 O {\displaystyle {\ce {Al2O3 + 6HCl -> 2AlCl3 + 3H_2O}}} .
- NaOH + HCl ⟶ NaCl + H 2 O {\displaystyle {\ce {NaOH + HCl -> NaCl + h3O}}} ,
- Ba ( OH ) 2 + 2 HCl ⟶ BaCl 2 + 2 H 2 O {\displaystyle {\ce {Ba(OH)2 + 2HCl -> BaCl2 + 2H_2O}}} ,
- Al ( OH ) 3 + 3 HCl ⟶ AlCl 3 + 3 H 2 O {\displaystyle {\ce {Al(OH)3 + 3HCl -> AlCl3 + 3H_2O}}} .
- Na 2 CO 3 + 2 HCl ⟶ 2 NaCl + H 2 O + CO 2 ↑ {\displaystyle {\ce {Na2CO3 + 2HCl -> 2NaCl + h3O + CO2 ^}}} .
- 2 KMnO 4 + 16 HCl ⟶ 5 Cl 2 ↑ + 2 MnCl 2 + 2 KCl + 8 H 2 O {\displaystyle {\ce {2KMnO4 + 16HCl -> 5Cl_2 ^ + 2MnCl2 + 2KCl + 8h3O}}} .
- NH 3 + HCl ⟶ NH 4 Cl {\displaystyle {\ce {Nh4 + HCl -> Nh5Cl}}} .
- HCl + AgNO 3 ⟶ AgCl ↓ + HNO 3 {\displaystyle {\ce {HCl + AgNO3 -> AgCl v + HNO3}}} .
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
- NaCl + H 2 SO 4 → 150 ∘ C NaHSO 4 + HCl {\displaystyle {\ce {NaCl\ +h3SO4->[150~^{\circ }{\text{C}}]NaHSO4\ +HCl}}} .
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
- 2 NaCl + H 2 SO 4 → 550 ∘ C Na 2 SO 4 + 2 HCl {\displaystyle {\ce {2NaCl\ +h3SO4->[550~^{\circ }{\text{C}}]Na2SO4\ +2HCl}}} .
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
- MgCl 2 ⋅ 6 H 2 O → t , ∘ C MgO + 2 HCl + 5 H 2 O {\displaystyle {\ce {MgCl2.6h3O->[t,~^{\circ }{\text{C}}]MgO\ +2HCl\ +5h3O}}} ,
- AlCl 3 ⋅ 6 H 2 O → t , ∘ C Al ( OH ) 3 + 3 HCl + 3 H 2 O {\displaystyle {\ce {AlCl3.6h3O->[t,~^{\circ }{\text{C}}]Al(OH)3\ +3HCl\ +3h3O}}} .
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
- 2 MgCl 2 + H 2 O ⟶ Mg 2 OCl 2 + 2 HCl {\displaystyle {\ce {2MgCl2 + h3O -> Mg2OCl2 + 2HCl}}} [5]
В промышленности хлороводород получают реакцией горения водорода в хлоре:
H
2
+
Cl
2
⟶
2
HCl
{\displaystyle {\ce {h3 + Cl2 -> 2HCl}}}
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов
HCl
{\displaystyle {\ce {HCl}}}
, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость
HCl
{\displaystyle {\ce {HCl}}}
ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[6].
Литература
- Austin S., Glowacki A. Hydrochloric Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a13_283.
Примечания
Ссылки
- [www.xumuk.ru/encyklopedia/2/4134.html «Соляная кислота» на www.xumuk.ru]
| Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист.Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Формула соляной кислоты — Использование, свойства, структура и формула соляной кислоты
Формула и структура: Химическая формула соляной кислоты — HCl, и ее молекулярный вес составляет 36,47 г / моль. Это раствор хлористого водорода в воде, а HCl используется как синоним как газообразной формы, так и водного раствора. HCl представляет собой простую двухатомную молекулу с поляризованной ковалентной связью между атомом водорода и электроотрицательным атомом хлора.
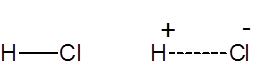
Происхождение: Соляная кислота является основным компонентом естественных кислот желудочного сока в нашем желудке.
Приготовление: Его получают растворением хлористого водорода в воде. Хлористый водород обычно образуется как побочный продукт при промышленном производстве других химикатов. Его также получают в промышленных масштабах путем сжигания водорода в хлоре. Высокие концентрации HCl трудно приготовить из-за испарения.
Физические свойства: соляная кислота представляет собой прозрачный бесцветный раствор с очень резким запахом. Он доступен во многих различных концентрациях в воде, поэтому его точные физические свойства (точка кипения, точка плавления и плотность) меняются соответственно.
Концентрированный сорт (дымящая соляная кислота) содержит около 38% HCl в воде. Содержание HCl промышленного класса составляет от 30% до 35%, в то время как товарного сорта (соляная кислота) — от 20% до 32%. Бытовые чистящие растворы HCl обычно составляют от 10% до 12%, но они все равно нуждаются в дальнейшем разбавлении перед использованием.
Химические свойства: HCl — сильная монопротонная кислота, что означает, что она может выделять только один ион H + (протон). Будучи сильной кислотой, она полностью диссоциирует в воде с образованием ионов гидроксония и хлорида.Он легко реагирует с основаниями с образованием хлоридных солей. Концентрированная HCl растворяет многие металлы и образует окисленные хлориды металлов и газообразный водород. Разбавленная HCl может расщеплять или переваривать многие химические и биологические образцы.
Области применения: соляная кислота имеет множество промышленных применений, например, в производстве различных хлоридов, пластмасс (таких как ПВХ и полиуретан), удобрений и красителей. Он также используется в фотографической, текстильной и резиновой промышленности, а также в производстве желатина, обработке кожи и бытовых чистящих средствах.
Опасность для здоровья / воздействие на здоровье: HCl оказывает сильное разъедающее действие на глаза, кожу и слизистые оболочки. Контакт с кожей приводит к сильным ожогам и рубцам. Вдыхание паров может вызвать раздражение глаз, носа и дыхательных путей. Проглатывание кислоты вызывает повреждение тканей слизистых оболочек, пищевода и желудка.
.Молекулярная масса соляной кислоты
Молярная масса of HCl = 36,46094 г / моль
Перевести граммы соляной кислоты в моль или моль соляной кислоты в граммы
Расчет молекулярной массы:
1.00794 + 35.453
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Хлор | Класс | 35.453 | 1 | 97,236% |
| Водород | H | 1,00794 | 1 | 2,764% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Определение молярной массы начинается с единиц граммов на моль (г / моль).При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий.Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции.Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Если формула, используемая при вычислении молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Часто на этом сайте просят перевести граммы в моль.Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
.