Физические свойства неметаллов — урок. Химия, 8–9 класс.
Из \(118\) известных на данный момент химических элементов \(22\) элемента образуют простые вещества, обладающие неметаллическими свойствами. Неметаллических простых веществ намного больше, чем самих неметаллических химических элементов. Причиной тому служит существование явления, называемого аллотропией.
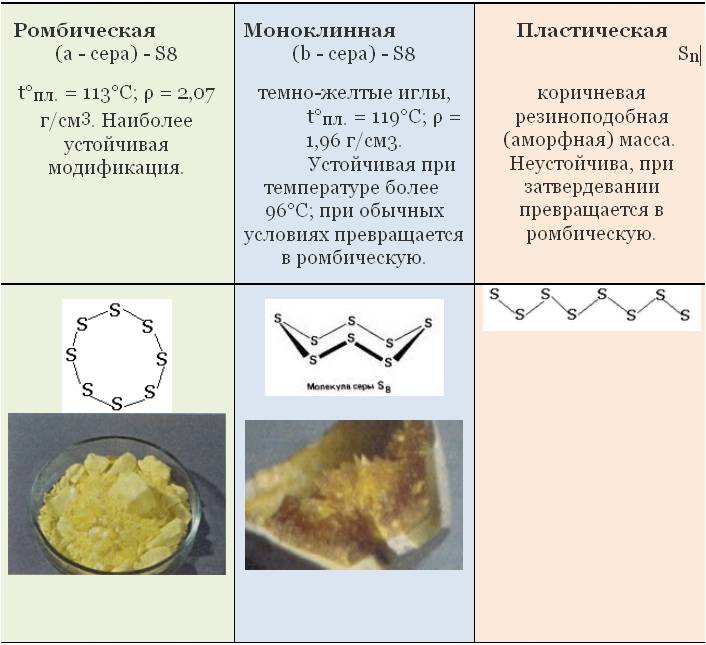
Аллотропия — это способность атомов данного химического элемента образовывать несколько простых веществ, называемых аллотропными видоизменениями, или аллотропными модификациями.
Например, химический элемент кислород \(O\) образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента.
Химический элемент фосфор \(P\) образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
Химический элемент углерод \(C\) образует встречающиеся в природе модификации — алмаз и графит.
Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Аллотропия присуща не всем неметаллических химическим элементам.
Например, водород, азот, элементы \(VII\)A и \(VIII\)A групп не имеют аллотропных модификаций, т. е. каждый из упомянутых элементов образует только одно простое вещество.
Кристаллическая решетка неметаллов
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
Рис. \(1\). Модели кристаллических решёток алмаза (слева) и графита.
Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги — в книге
Другая часть неметаллов имеет молекулярную кристаллическую решетку. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому вещества молекулярного строения при обычных условиях могут быть газами, жидкостями или легкоплавкими твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород h3, фтор F2, хлор Cl2, бром Br2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы — это всё вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов, как бы выполняющих роль молекул).
Рис. \(2\). Модель молекулы серы (слева) и кристалл серы.
Кристалл серы состоит из отдельных молекул \(S_8\)
Физические свойства неметаллов
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов, т. е. не обладают характерным металлическим блеском, ковкостью, пластичностью, высокой тепло- и электропроводностью.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Газообразными неметаллами являются гелий \(He\), неон \(Ne\), аргон \(Ar\), криптон \(Kr\), ксенон \(Xe\) и радон \(Rn\). Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Их называют инертными (или благородными) газами. Каждая «молекула» инертного газа состоит только из одного атома.
Такие химические элементы, как водород \(H\), кислород \(O\), азот \(N\), хлор \(Cl\), фтор \(F\) образуют газообразные вещества, состоящие из двухатомных молекул, соответственно — h3, O2, N2, Cl2, F2.
Из неметаллических простых веществ при обычных условиях жидкостью является только бром, молекулы которого двухатомны — Br2.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Например, химический элемент углерод образует такие твёрдые вещества, как алмаз и графит. Твёрдыми являются кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2.
Цвет и блеск
Только некоторые неметаллы в отличие от металлов имеют блеск.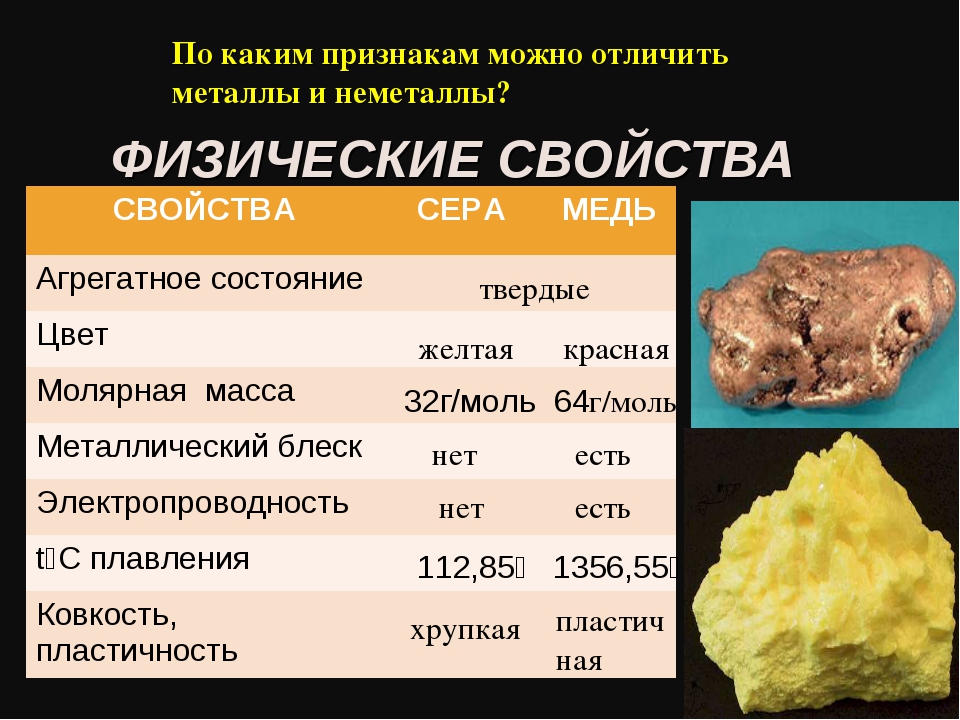 Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
Например, кристаллический иод, кремний и графит не похожи на остальные неметаллы — они имеют блеск, несколько напоминающий блеск металлов.
В отличие от металлов, большинство которых имеют серебристо-серый цвет, окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный — красный фосфор, жёлтый — сера и фтор, красно-бурый — жидкий бром, жёлто-зелёный — хлор, фиолетовый цвет имеют пары иода, синий — жидкий кислород, серый — графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород.
Рис. \(3\). Алмаз
| Рис. \(4\). Иод
|
Рис. | Рис. \(6\). Хлор |
Неметаллы могут находиться в твёрдом, жидком и газообразном агрегатных состояниях.
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеют озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии не обладают пластичностью. Они являются хрупкими.
Электро- и теплопроводность
Неметаллы, за исключением графита, плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками).
Источники:
Рис. 1. Модели кристаллических решёток алмаза (слева) и графита. https://image.shutterstock.com/image-vector/illustration-chemical-carbon-has-several-600w-1717122967.jpg
Рис. 2. Модель молекулы серы (слева) и кристалл серы.
https://image.shutterstock.com/image-vector/illustration-chemical-allotropes-sulfur-including-600w-1732938125.jpg
https://www.shutterstock.com/ru/image-photo/yellow-natural-native-sulfur-crystal-isolated-729259936
Рис. 3. Алмаз https://cdn.pixabay.com/photo/2014/10/24/08/09/diamond-500872_960_720.jpg
Рис. 4. Иод https://image.shutterstock.com/image-photo/solid-iodine-sublimation-flushing-experiment-600w-1409329922.jpg
Рис. 5. Бром https://image.shutterstock.com/image-photo/macroview-on-ampoule-element-no-600w-1739647871.jpg
Рис. 6. Хлор https://image.shutterstock.com/image-photo/chlorine-gaz-glass-round-bottom-600w-713676862.jpg
Металлы ковкость — Справочник химика 21
Что называют ковкостью металлов Какой металл наиболее ковок [c. 98]
98]Вначале металлы как и цветные камешки или перламутровые морские раковины служили лишь украшением. Однако вскоре оказалось, что металлы выгодно отличаются от всех других украшений. Камень при ударе рассыплется в пыль, дерево и кость дают трещины ударяя же по кусочку металла, можно придать ему нужную форму. Это свойство металлов (ковкость) было обнаружено, безусловно, совершенно случайно. Но вскоре после того, как человек узнал о ковкости металлов, он, повинуясь чувству прекрасного (которое всегда живет в нем), начал изготавливать из металлических самородков различные украшения, стараясь подчеркнуть красоту металла. [c.10]
Простая модель металлической связи, основанная на представлении об электронном газе , согласуется также с двумя другими характерными свойствами металлов их ковкостью и пластичностью. Ковкое вещество легко поддается расплющиванию молотом в тонкие листы пластичное вещество можно вытягивать в тонкую проволоку.
Металлы. В металлических кристаллах частицами, составляющими решетку кристалла, служат положительные ионы, связываемые между собой электронами, образующими электронный газ. Легкая подвижность этих электронов и придает металлам все те свойства, которые являются характерными для них, т. е. общими для всех металлов свойствами, по которым мы определяем металличность данного вещества. Сюда относятся как физические свойства, например высокая электропроводность и теплопроводность, ковкость (пластичность), металлическим блеск, так и химические — основной характер низших окислов и т. п.
[c.135] Все металлы представляют собой кристаллические тела, которым присущи особые металлические свойства электропроводность, теплопроводность и ковкость (пластичность). Эти свойства металлов обусловлены особенностями металлической связи. [c.100]
Эти свойства металлов обусловлены особенностями металлической связи. [c.100]
На рис. 21.2 цветные квадратики указывают так называемые полуметаллы (металлоиды)-элементы, обладающие частично металлическими и частично неметаллическими свойствами. Элементы, расположенные вдоль границы между металлами и неметаллами, имеют некоторые свойства, характерные для металлов, но не обладают остальными металлическими свойствами. Например, мышьяк внешне напоминает металлы, но, в то время как последние характеризуются ковкостью, он представляет собой хрупкое вещество, плохо проводящее тепло и электричество.
Большая часть металлов обладает высокой ковкостью, т.е. способностью расплющиваться в тонкие листы, а также пластичностью, т.е. способностью вытягиваться в проволоку. Эти свойства указывают на способность атомов кристаллической решетки металлов скользить друг по другу. Таким свойством не обладают ионные кристаллы, а также кристаллы большинства ковалентных соединений.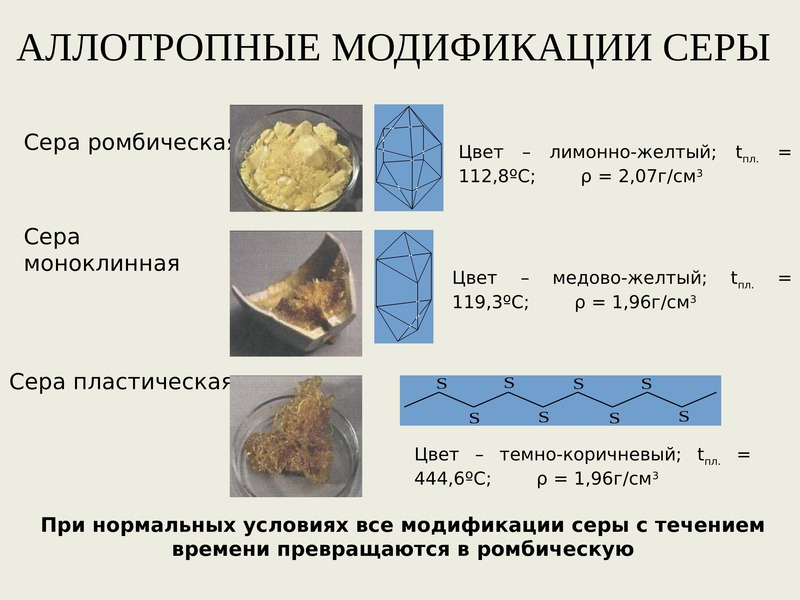 Ионным и ковалентным кристаллам присущи хрупкость и способность легко раскалываться вдоль определенных плоскостей. [c.360]
Ионным и ковалентным кристаллам присущи хрупкость и способность легко раскалываться вдоль определенных плоскостей. [c.360]
Обширные сведения относительно отжига металлов, в частности стали, были получены в последние 100 лет. В металлургии макроскопический отжиг означает придание металлам ковкости, деформируемости и определенной мягкости. Противоположные свойства достигаются закалкой, или упрочнением. В обиходном смысле закалка означает, например, придание стали наибольшей твердости. Промежуточные стадии обработки достигаются в процессе отпуска. С микроскопической точки зрения отжиг, закалка и отпуск могут включать изменение совершенства кристаллов, размера зерен и структуры, химического строения и внутренних напряжений. [c.444]
БЛАГОРОДНЫЕ МЕТАЛЛЫ — золото, серебро и металлы платиновой группы (рутений, родий, палладий, осмий, иридий, платина). Б. м. стойкие против коррозии, тугоплавкие, плохо растворяются в кислотах, характеризуются ковкостью и тягучестью, имеют привлекательный внешний вид.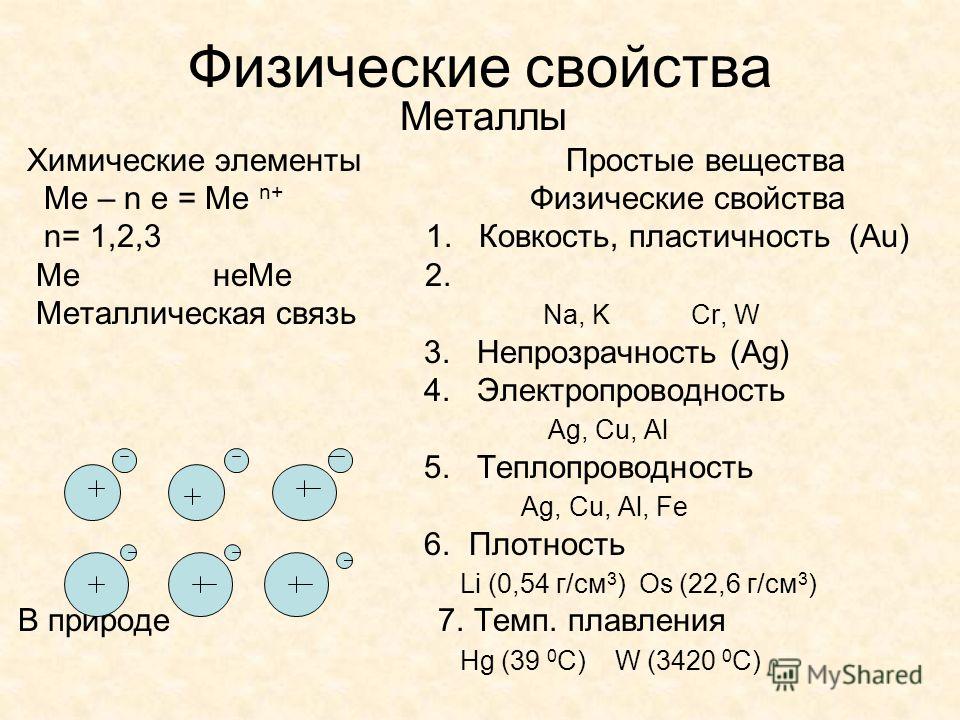 Б. м. широко применяют в технике, ювелирном деле, лабораторной практике.
Б. м. широко применяют в технике, ювелирном деле, лабораторной практике.
Если принять в качестве постулата, что атом в металле имеет много возможностей для образования связей и что структуры с разными координационными числами мало отличаются по устойчивости, то этим можно объяснить характер-нук) для металлов ковкость. Благодаря деформации кристалла некоторые атомы смещаются из стабильных по отношению к соседним атомам положений. Обычно это смещение сильно понижает прочность межатомных связей, и кристалл ломается вследствие того, что конфигурация, возникшая после деформации, неустойчива. В металлах, однако, число и направления связей, которые могут быть образованы атомом с соседними атомами, не очень ограничены, и, следовательно, после деформации первоначальной структуры атом может образовывать связи примерно столь же прочные, как и первоначальные. Благодаря этому металлы обладают специфической способностью восстанавливаться после деформации. [c.
Ответ. Общие физические свойства металлов высокая тепло- и электропроводность, ковкость, пластичность. Хорошая проводимость тепла и электричества объясняется движением свободных электронов по кристаллической решетке металлов. Ковкость и пластичность металлов объясняются движением отдельных слоев ионов относительно друг друга. Отличительные физические свойства металлов — плотность и температуры плавления и кипения. Эти свойства зависят от прочности металлической связи. Металлы главных подгрупп (в-металлы), как правило, — легкие и достаточно легкоплавкие металлы. Напротив, металлы побочных подгрупп ( -металлы) — тяжелые и очень тугоплавкие. [c.159]
Металлические кристаллы (рис. 1.9, в) состоят из положительно заряженных ионов — катионов, между которыми размещаются покинувшие свои атомы электроны — так называемый электронный газ. Природа связи в этих кристаллах обусловлена электростатическим взаимодействием катионов с электронным газом. Энергия связи в решетке металлического типа на порядок меньше, чем в решетке вышерассмотренных типов и составляет 80— 120 кДж/моль.
Чистые металлы хорошо поддаются механической обработке. Следует отметить, что у металлов, содержащих в качестве примесей О, М, С, Н, пластичность, ковкость, тягучесть, твердость, прочность на разрыв и другие механические характеристики резко изменяются,
[c.498] В табл. 21.1 перечислены некоторые отличительные свойства металлов и неметаллов. Металлы в конденсированном состоянии обладают характерным металлическим блеском. Ярко выраженные металлические элементы обладают хорошей электро- и теплопроводностью, а также ковкостью и пластичностью. В отличие от металлов неметаллические элементы не имеют блестящей поверхности и, как правило, являются плохими проводниками тепла и электричества. Семь неметаллических элементов существуют в виде двухатомных молекул. В это число входят пять газов (водород, азот, кислород, фтор и хлор), одна жидкость (бром) и одно летучее твердое вещество (иод). Остальные неметаллы при нормальных условиях существуют в кристаллической форме и могут быть твердыми, как, например, алмаз, или мягкими, как сера. Такое разнообразие свойств объясняется характером химической связи, присущим каждому элементу, как это изложено в разд. 8.7, ч. 1.
В отличие от металлов неметаллические элементы не имеют блестящей поверхности и, как правило, являются плохими проводниками тепла и электричества. Семь неметаллических элементов существуют в виде двухатомных молекул. В это число входят пять газов (водород, азот, кислород, фтор и хлор), одна жидкость (бром) и одно летучее твердое вещество (иод). Остальные неметаллы при нормальных условиях существуют в кристаллической форме и могут быть твердыми, как, например, алмаз, или мягкими, как сера. Такое разнообразие свойств объясняется характером химической связи, присущим каждому элементу, как это изложено в разд. 8.7, ч. 1.
Металлы отличаются характерным металлическим блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии. [c.29]
Титан, цирконий и гафний являются типичными металлами, напоминающими по внешнему виду сталь. Они тугоплавки, хорошо поддаются механической обработке. Однако присутствие в этих металлах примесей кислорода, азота, углерода или водорода весьма отрицательно сказывается на их пластичности, ковкости, прочности на разрыв и других механических характеристиках. Основные константы, характеризующие свойства рассматриваемых металлов [c.283]
Они тугоплавки, хорошо поддаются механической обработке. Однако присутствие в этих металлах примесей кислорода, азота, углерода или водорода весьма отрицательно сказывается на их пластичности, ковкости, прочности на разрыв и других механических характеристиках. Основные константы, характеризующие свойства рассматриваемых металлов [c.283]
Металлы обладают высокой тепло- и электропроводностью, под давлением становятся текучими, что определяет их гибкость и ковкость. Для них характерно свойство испускания (отдачи) электронов в окружающее пространство под действием различных квантов энергии под действием света (фото-), при нагревании (термо-), при разрыве (экзоэлектронная эмиссия). [c.318]
Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении без нарушения связи (тогда как вещества с ковалентной связью хрупки). Этим же объясняется другое характерное свойство металлов — пх ковкость. [c.97]
[c.97]
Многие другие вещества обладают достаточной твердостью (алмаз, кварц и др.). Также блеск, металлический звон, ковкость свойственны отдельным видам керамики. Отдельные полимерные материалы органической природы обладают электропроводностью, соизмеримой с электропроводностью металлов (модифицированный полиацетилен). Однако, только у металлов все эти свойства присутствуют одновременно.
Металлы — это простые вещества, которым одновременно присущи высокие и изотропные электро- и теплопроводность, электронная эмиссия, ковкость, характерные металлический блеск и звон при ударе, в подавляющем больщинстве высокая плотность и твердость в компактном состоянии и при условиях, близких к нормальным. С химической точки зрения, металлы — восстановители в подавляющем большинстве случаев. [c.319]
Высокая химическая устойчивость тантала к различным химическим воздействиям наряду с большой твердостью, тягучестью и ковкостью делает этот металл (также и ЫЬ) весьма пригодным для изготовления ответственных частей заводской химической аппаратуры. Сплавы тантала с углеродом исключительно тверды и находят применение для изготовления важных сварных конструкций (например, для самолетов). В чистом металлическом состоянии ЫЬ и Та находят применение в электротехнической промышленности. [c.375]
Сплавы тантала с углеродом исключительно тверды и находят применение для изготовления важных сварных конструкций (например, для самолетов). В чистом металлическом состоянии ЫЬ и Та находят применение в электротехнической промышленности. [c.375]
Применение. Рассматриваемые металлы V. Nb и Та и их сплавы — важнейшие материалы современной техники. Ванадий — одна из легирующих добавок в специальных сталях. Около 95% добываемого ванадия расходует металлургическая промышленность. Его применяют в качестве присадки к стали для придания ковкости и высокого сопротивления удару. Содержащие ванадий стали используют в автомобилестроении и в военной технике (в частности, делают каски). [c.505]
К металлическим свойствам обычно относят большую электропроводность, высокую тягучесть и ковкость, металлический блеск и высокую отражательную способность в видимой области спектра. В табл. 10 приведены некоторые свойства металлов. Там же для сопоставления даны аналогичные свойства кристаллов других типов алмаза (ковалентный), хлорида натрия (ионный) и серы (молекулярный). [c.79]
[c.79]
По энергии кристаллической решетки металлы занимают промежуточное положение между молекулярными и ковалентными кристаллами. В то же время плотность большинства металлов значительна, что свидетельствует об очень плотной структуре металлических кристаллов. С другой стороны, такие свойства металлов, как высокие ковкость и тягучесть, указывают на отсутствие жесткости в металлических решетках их плоскости довольно легко сдвигаются одна относительно другой. [c.79]
Металлы характеризуются ковкостью. Металлом называется светлое тело, которое ковать можно , так писал Ломоносов. Они обладают также тягучестью металлы можно вытягивать в тонкую проволоку. Однако эти свойства у различных металлов выражены далеко не одинаково. Способность выковываться в тонкие листы в наибольшей степени проявляется у золота, серебра и меди. Металлы ЗЬ, В1, Мп относятся к числу хрупких, ковка и прокат их затруднительны. Соответственно и по способности быть вытянутыми в тонкую проволоку на первом месте стоят золото и серебро, на последнем — висмут и марганец. [c.298]
[c.298]
По физическим свойствам все металлы — твердые вещества (кроме ртути, которая при обычных условиях жидкая), они отличаются от неметаллов особым видом связи (металлическая связь). Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157]
Железо образует множество сплавов с различными металлами и неметаллами одни из них попадают в железо при его выплавке в промышленных условиях (С, S, Р, Si), другие вводятся искусственно (Мп, Ni, Сг и др. ) для придания сплавам технически полезных свойств (твердость, термическая и коррозионная стойкость, ковкость и др.). [c.187]
) для придания сплавам технически полезных свойств (твердость, термическая и коррозионная стойкость, ковкость и др.). [c.187]
Понятие об элементе. Использованное для изготовления сернистого железа металлическое железо теряет свои основные качественные признаки полученное сложное вещество уже не обладает рядом свохтств, характерных для железа (например, не притягивается магнитом). Однако путем химического разложения сернистого же.леза можно вновь выделить металлическое железо, которое снова будет обладать свойствами, характерными д,пя этого металла (ковкостью, тягучестью, магнитными свойствами и т. д.). Это доказывает, что при реакции соединения серы и железа последнее вовсе не исчезло бесследно оно лишь вошло в состав сложного вещества и находится там в особом состоянии. Все это относится и к другой составной части сернистого железа—сере. До опыта сера и железо были простыми веществами, а после опыта они вошли в состав сложного вещества в виде элементов. Таким образом, под термином элемент мы подразумеваем отдельные составные части сложных веществ, находящиеся в них в особом состоянии.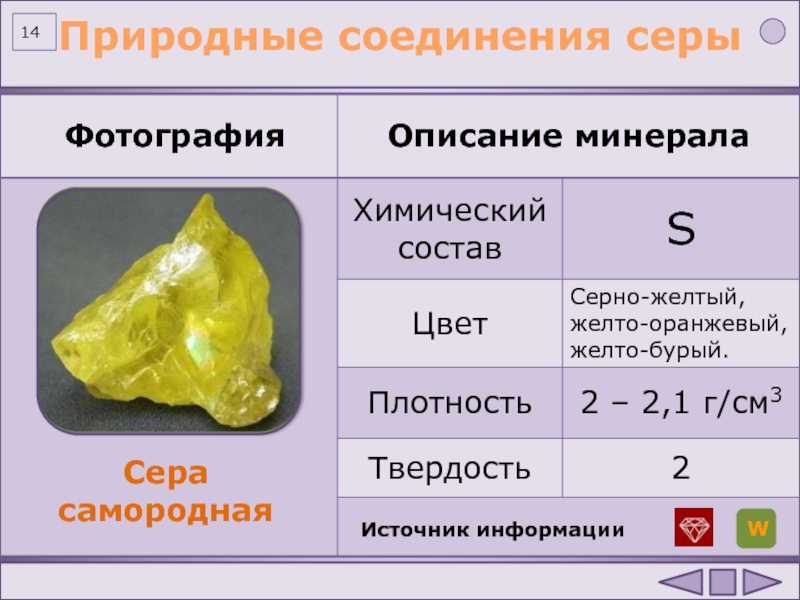 [c.16]
[c.16]
Поглощение водорода цирконием начинается при нагреве выще 300° и сопровождается потерей металлом ковкости. Выдержка насыщенного водородом металла ири температуре выше 1500° в вакууме способствует удалению растворенного в нем газа и воостанавливает ковкость металла. [c.260]
Электропроводность и оптические свойства металлов объясняют с помощью электронной зонной теории, а некоторые другие характерные свойства металлов— ковкость, пластичность и способность к сплавообразованию — легко объяснить их структурными особенностями (см. далее). [c.82]
Уже на ранних этапах развития химии было известно, что различным элементам присущи особые свойства. Вначале элементы подразделяли всего на два типа-металлы и неметаллы. Металлические элементы характеризуются специфическим блеском, ковкостью (их можно расплющивать молотом в тонкие листы), тягучестью (способностью вытягиваться в проволоку), они хорошо проводят тепло и электрический ток, а также образуют с кислородом соединения, обладающие основными свойствами. Неметаллические элементы не имеют характерной внешности, как правило, они плохо проподят тепло и электрический ток и образуют оксиды с кислотными свойствами. [c.303]
Неметаллические элементы не имеют характерной внешности, как правило, они плохо проподят тепло и электрический ток и образуют оксиды с кислотными свойствами. [c.303]
Элементы Сг, Мо и XV имеют высокие температуры плавления и кипения и являются твердыми металлами. Они относительно инертны к коррозии благодаря покрывающей их поверхность прочной оксидной пленке, которая защищает расположенный под ней металл. Тонкий слой СГ2О3 на поверхности металлического хрома делает хромовые покрытия эффективным средством защиты для менее устойчивых металлов, таких, как железо. Наряду с V эти три металла используются главным образом в качестве легирующих добавок в сталях. Ванадий придает стали ковкость, а также сопротивляемость статическим и ударным нагрузкам. Хром позволяет получать нержавеющие стали, стойкие к коррозии, молибден упрочняет сталь, а вольфрам используется для изготовления инструментальных сталей, сохраняющих твердость даже при нагреве до красного каления. [c. 443]
443]
Одним из видов термической обработки является нагрев металлов и сплавов с целью повышения пластичности и ковкости. Другим — обработка готовых изде.лий для получения требуемой кристаллической структуры, снятия наклепа, улучшения качества поверхности и т. п. [c.8]
Производство стали. Чугун — хрупкий материал. При необходимости его перерабатывают в сталь. Для этого из него выжигают избытки углерода и добавляют другие металлы (марганец, никель, хром, молибден и т. п.) для придания специфических свойств, например ковкости, пластичности, прочности или антикоррозионной стойкости. Помимо чугуна в металлощихту можно добавлять стальной и чугунный лом, а также губчатое железо. Используют различные сталелитейные процессы, выбор которых обусловлен видом исходного сырья, стоимостью энергии (прежде, всего электроэнергии), а также требуемыми марками и сортами стали. [c.307]
Металлические и неметаллические элементы различаются по своим физическим и химическим свойствам.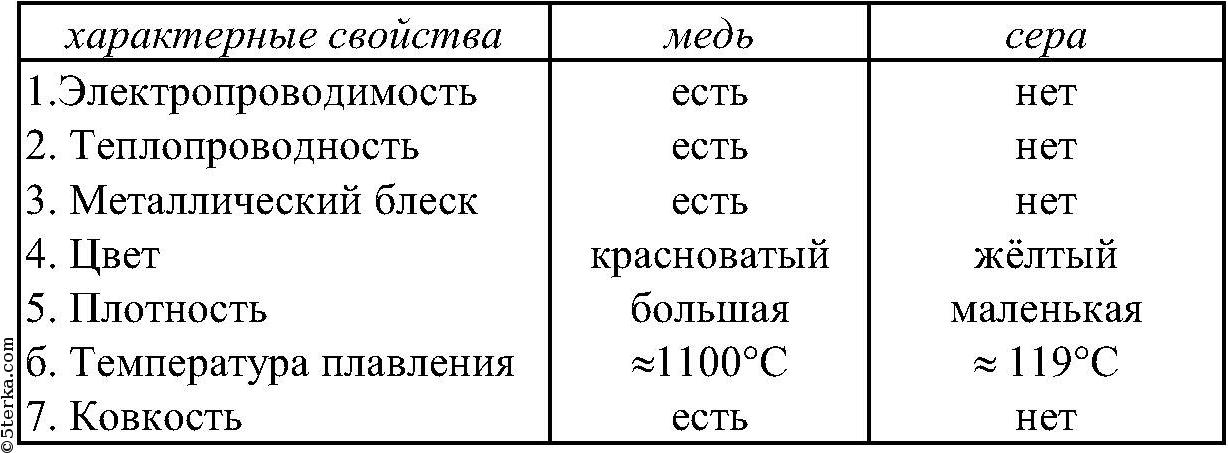 Неметаллические элементы не имеют характерных для металлов блеска, ковкости и пластичности, а также хорошей электро- и теплопроводности. В структуре твердых неметаллических элементов атомы окружены сравнительно небольшим числом ближайших соседей и связаны друг с другом ковалентными связями. Неметаллические элементы характеризуются более высокими энергиями ионизации и электроотрицательностями, чем металлические элементы. Растворимые оксиды неметаллических элементов обычно образуют водные растворы, обладающие кислотными свойствами по этой причине неметаллические оксиды называю 1О1СЛ0ТИЫМИ ангидридами. В отличие от них растворимые оксиды металлов образуют основные растворы, и поэтому называются основными ангидридами. [c.329]
Неметаллические элементы не имеют характерных для металлов блеска, ковкости и пластичности, а также хорошей электро- и теплопроводности. В структуре твердых неметаллических элементов атомы окружены сравнительно небольшим числом ближайших соседей и связаны друг с другом ковалентными связями. Неметаллические элементы характеризуются более высокими энергиями ионизации и электроотрицательностями, чем металлические элементы. Растворимые оксиды неметаллических элементов обычно образуют водные растворы, обладающие кислотными свойствами по этой причине неметаллические оксиды называю 1О1СЛ0ТИЫМИ ангидридами. В отличие от них растворимые оксиды металлов образуют основные растворы, и поэтому называются основными ангидридами. [c.329]
Приведенное выше описание электронного строения металлов является предельно упрощенным. У переходных металлов благодаря участию в перекрывании х-, р- и -ор-биталей атомов возникает довольно сложная зонная структура энергетических уровней. Однако у всех металлических элементов в той или иной степени обнаруживаются такие характерные свойства, как высокие электропроводность и теплопроводность, металлический блеск, пластичность и ковкость.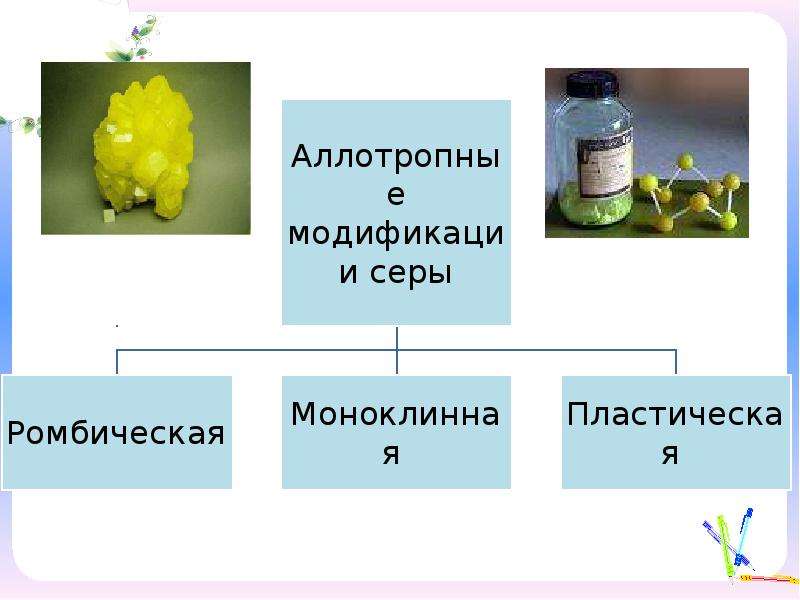 Физические свойства металлов зависят от [c.361]
Физические свойства металлов зависят от [c.361]
Металлическая связь ненасыщена и ненаправлена. Первое следует уже из того, что она объединяет очень большое число атомов и при дальнейшем их увеличении главный ее признак — делокализация электронов — не исчезает, а усиливается. Ненаправленность метгиплической связи обусловлена сферической симметрией облаков 8-электронов перекрьшание, например, трех и более сфер зависит только от расстояний между ними и не зависит от направлений, по которым они сближаются. В этом причина того, что многие металлы могут менять свою форму (ковкость) без потери прочности. [c.151]
Можно ли по следующей совокупности свойств отличить типичные металлы от неметаллов электропроводность, теплопро-Бодиость, ковкость, хрупкость, упругость, светопропускаемость Дайте подробный ответ и укажите известные вам исключения от обычной характеристики металлов. [c.109]
Реакция восстановления протекает ступенчато. Сначала получается Рез04, а в дальнейшем — металл при температуре выше 573 °С образуется еше один промежуточный продукт — оксид железа (II). Прп температуре восстановления 600 °С железо получается в виде несколько спеченного порошка и легко поддается измельчению в ступке, а при 800 °С — в виде трудноизмельчае-мой губки и обладает некоторой ковкостью. Из оксидов железа Рез04, РезОз алюминотермическим путем образуется железо в виде куска. Алюминий берут в соответствии с уравнением реакции (рис. 3). [c.252]
Сначала получается Рез04, а в дальнейшем — металл при температуре выше 573 °С образуется еше один промежуточный продукт — оксид железа (II). Прп температуре восстановления 600 °С железо получается в виде несколько спеченного порошка и легко поддается измельчению в ступке, а при 800 °С — в виде трудноизмельчае-мой губки и обладает некоторой ковкостью. Из оксидов железа Рез04, РезОз алюминотермическим путем образуется железо в виде куска. Алюминий берут в соответствии с уравнением реакции (рис. 3). [c.252]
Несмотря на явную сомнительность пренебрежения электронноионным взаимодействием, теория свободного электрона в состоянии объяснить многие свойства металлов. Так, ненаправленный характер связей ионов с электронным газом в металлических кристаллах объясняет их высокую ковкость и тягучесть. По этой же причине чистые металлы должны кристаллизоваться преимущественно в структурах плотнейших упаковок. И действительно, большая часть металлов имеет или гексагональную, или гранецентрированную кубическую плотнейшую упаковку, аналогичную приведенным на рис.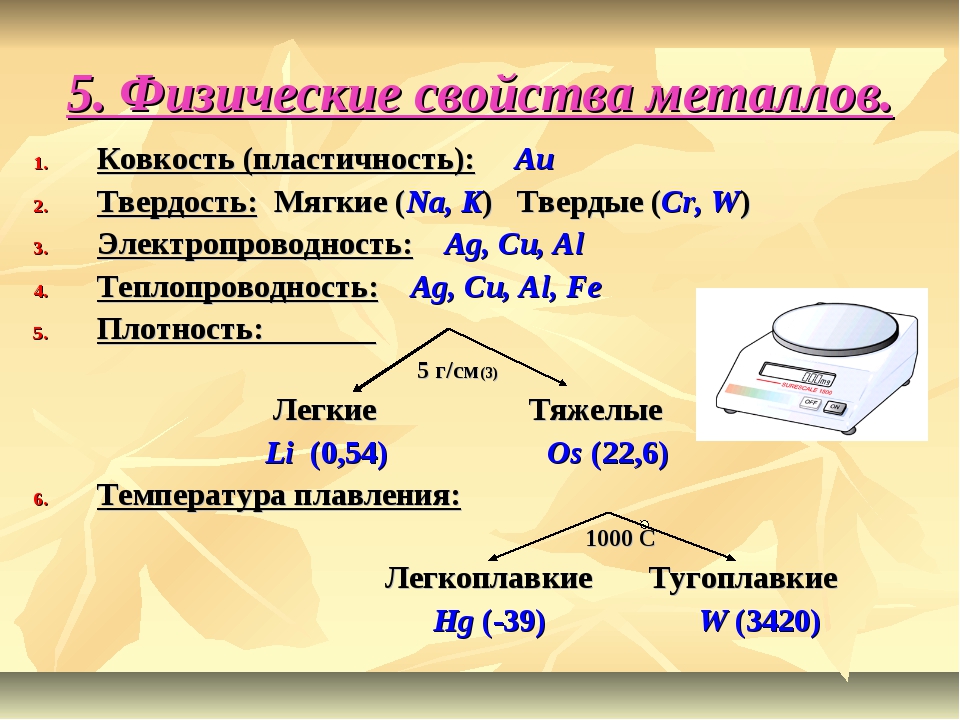 32. [c.80]
32. [c.80]
С особенностями металлической связи связаны такие свойства металлов, как хорошая электрическая проводимость, теплопр овод-ность, пластичность, ковкость и др. [c.147]
Сталь, Металл, Чугун — термины и определения
Справочная информация
Сталь.
Сплав на основе железа, после литья ковкий при некоторых интервалах температур;
содержит марганец, углерод и часто другие легирующие элементы.
В углеродистых и низколегированных сталях, максимальное содержание углерода до 2,0 %;
в высоколегированной стали приблизительно до 2,5 %.
Делением между низколегированными и высоколегированными сталями обычно считается рубеж с содержанием приблизительно 5 % металлических легирующих элементов.
Содержание марганца — также принципиальный дифференцирующий фактор, причем сталь обычно содержит, по крайней мере, 0,25 % Mn, a технически чистое железо значительно меньше.
Легирующий элемент.
Элемент, добавляемый и остающийся в металле, который изменяет его структуру и химический состав.
Легированные стали.
Содержащие определенное количество легирующих элементов (не только углерод, но и некоторое количество марганца, меди, кремния, серы и фосфора) в пределах необходимых для конструкционных легированных сталей, с целью изменения их механических или физических свойств.
Высокопрочные низколегированные стали.
Сталь, спроектированная для обеспечения лучших механических свойств и более высокого сопротивления атмосферной коррозии, чем углеродистая сталь. Эта сталь не должна составлять класс легированных сталей, так как была изготовлена скорее для специальных механических свойств, чем для специального химсостава (HSLA стали имеют предел текучести более чем 275 МПа или 40 ksi). Химический состав HSLA сталей может меняться в зависимости от требуемой толщины и механических свойств. Эти стали имеют низкое содержание углерода (0,05–0,25 %) для того, чтобы получить адекватную деформируемость и свариваемость, и имеют содержание марганца до 2,0 %. Малые количества хрома, никеля, молибдена, меди, азота, ванадия, ниобия, титана, циркония используются в различных комбинациях.
Эти стали имеют низкое содержание углерода (0,05–0,25 %) для того, чтобы получить адекватную деформируемость и свариваемость, и имеют содержание марганца до 2,0 %. Малые количества хрома, никеля, молибдена, меди, азота, ванадия, ниобия, титана, циркония используются в различных комбинациях.
Низколегированные стали.
Класс черных металлов, которые проявляют прочностные свойства, большие, чем простые углеродистые стали, в результате добавления таких легирующих элементов как никель, хром и молибден. Общее содержание легирующих элементов может составлять от 2,07 % до уровня чуть ниже нержавеющих сталей, которые содержат минимум 10 % Сr.
Ковкий чугун.
Чугун, полученный при длительном отжиге белого чугуна, при котором происходят процессы декарбюризации и графитизации, устраняющие частично или полностью цементит. Графит находится в форме углерода отжига. Если преобладает реакция декарбюризации, то продукт имеет светлую поверхность излома — ковкий белосердечный чугун. Если поверхность излома будет темной — темносердечный ковкий чугун. В Соединенных Штатах производится только темносердечный ковкий чугун. Ковкий чугун имеет преимущественно ферритную матрицу; перлитный ковкий чугун может содержать шаровидный перлит или отпущенный мартенсит, в зависимости от термообработки и желаемой твердости.
Если поверхность излома будет темной — темносердечный ковкий чугун. В Соединенных Штатах производится только темносердечный ковкий чугун. Ковкий чугун имеет преимущественно ферритную матрицу; перлитный ковкий чугун может содержать шаровидный перлит или отпущенный мартенсит, в зависимости от термообработки и желаемой твердости.
Серый чугун.
Широкий класс железных литейных сплавов (чугунов), обычно характеризуемых микроструктурой пластинчатого графита в железной матрице. Серый чугун обычно содержит от 2,5 до 4 % С, от 1 до 3 % кремния и добавки марганца, в зависимости от желательной микроструктуры (от 0,1 % Мп в ферритном сером чугуне и до 1,2 % в перлитном). Сера и фосфор также находятся в малых количествах как остаточные примеси.
Чугун.
Родовой термин для большой совокупности литых железных сплавов, в которых содержание углерода превышает растворимость углерода в аустените при эвтектической температуре. Большинство чугунов содержит не меньше 2 % углерода, плюс кремний и серу и может содержать другие легирующие элементы. См. также высокопрочный чугун, ковкий чугун, серый чугун, пластичный чугун и белый чугун.
См. также высокопрочный чугун, ковкий чугун, серый чугун, пластичный чугун и белый чугун.
Чугун с вермикулярным графитом.
Чугун, имеющий графит в форме, промежуточной между формой пластинки, типичной для серого чугуна и сферической формой высокопрочного чугуна. В структуре отсутствует пластинчатый графит, она состоит из 20 % сфероидального графита и 80 % вермикулярного графита (ASTM A247, тип IV). Также известный как CG- чугун. Чугун с вермикулярным графитом аналогичен литому ковкому чугуну, но используется техника, подавляющая образование сфероидального графита. Типичные номинальные составы CG- чугуна содержат от 3,1 до 4,0 % С, от 1,7 до 3,0 % кремния и от 0,1 до 0,6 % марганца.
Полуспокойная сталь.
Состояние поверхности слитка полуспокойной стали близко к поверхности кипящей стали. Остальные характеристики имеют промежуточное значение между кипящей и спокойной сталями.
Спокойная сталь.
Сталь, обрабатываемая сильным раскислителем типа кремния или алюминия для того чтобы снизить содержание кислорода до такого уровня, что не возникает никакой реакции между углеродом и кислородом в течение кристаллизации.
Углеродистая сталь.
Сталь, содержащая не более принимаемых за норму концентрации 1,65 % марганца, 0,60 % кремния и 0,60 % меди — и только несущественное количество любых других элементов кроме углерода, кремния, марганца, меди, серы и фосфора. Низкоуглеродистые стали содержат до 0,30 % углерода, среднеуглеродистые стали содержат от 0,30 до 0,60 % углерода и высокоуглеродистые стали ее держат от 0,60 до 1,00 % С.
Легированные чугуны.
Чугуны, содержащие больше чем 3 % легирующих элементов. Различают легированные белые чугуны, серые чугуны, ковкие чугуны.
Легированный сплав.
Сплав, обогащенный одним или более желательным легирующим элементом, которые добавляются в расплавленный металл для получения необходимой концентрации.
Подшипниковые стали.
Легированные стали, используемые для производства подшипников качения. Обычно производятся из высокоуглеродистых (1,00 %) и низкоуглеродистых (0,20 %) сталей. Высокоуглеродистые стали используются после индукционной поверхностной закалки. Низкоуглеродистые стали цементируют, чтобы обеспечить необходимую поверхностную твердость при сохранении основных свойств.
Высокоуглеродистые стали используются после индукционной поверхностной закалки. Низкоуглеродистые стали цементируют, чтобы обеспечить необходимую поверхностную твердость при сохранении основных свойств.
Инструментальная сталь.
Любая из класса углеродистых и легированных сталей, обычно используемых для изготовления инструментов. Инструментальные стали характеризуются высокой твердостью и сопротивлением истиранию, сохраняя высокую твердость при повышенных температурах. Эти характеристики обычно достигаются высоким содержанием углерода и легированием.
Металл.
1) Непрозрачное блестящее элементарное вещество, которое является хорошим проводником тепла и электричества и, когда отполировано, характеризуется хорошим светоотражением. Большинство металлов ковки и пластичны и отличаются большей плотностью, чем другие элементарные вещества.
2) По своей структуре металлы отличаются от неметаллов их межатомной связью и электронным потенциалом. Металлические атомы имеют тенденцию к потере электронов с орбит. Положительные ионы, сформированные таким образом, скрепляются электронным газом. Способность этих «свободных электронов» к переносу электрических зарядов и тот факт, что эти способности уменьшаются с увеличением температуры, устанавливают главные различия металлических твердых тел.
Металлические атомы имеют тенденцию к потере электронов с орбит. Положительные ионы, сформированные таким образом, скрепляются электронным газом. Способность этих «свободных электронов» к переносу электрических зарядов и тот факт, что эти способности уменьшаются с увеличением температуры, устанавливают главные различия металлических твердых тел.
3) С химической точки зрения, элементарное вещество, чей гидроксид является щелочным.
Прокат.
Любой технический продукт прокатного стана.
Основные отличия чугуна и стали :
Чугун легче стали
Чугун имеет более низкую температуру плавления.
Сталь лучше поддается обработке (сварке, резке, прокатке, ковке).
Изделия из чугуна более пористые их теплопроводность значительно ниже.
Чугун обладает низкой теплопроводностью, а сталь – более высокой.
Чугун — первичный продукт черной металлургии, а сталь является конечным продуктом.
Чугун не закаливают, а некоторые виды стали обязательно подвергают процедуре закалки.
Изделия из чугуна бывают только литыми, а из стали – коваными и сварными.
http://ооостальмаш.рф
Чугун серый ковкий высокопрочный
Надежность и долговечность изделия в современном машиностроении, в значительной мере зависит от свойств применяемых конструкционных материалов. Свыше 80% машиностроительных деталей различной массы и сложности изготавливают из сплавов на основе железа. В зависимости от содержания углерода сплавы на основе железа разделяют на стали и чугуны.
В отличие от стали в чугуне при определенных условиях часть углерода выделяется в виде розеток графита. В сечении такой розетки видны лишь отдельные пластины. Поэтому, на полированном шлифе чугуна заметны изолированные включения графита. Структура матрицы, чаще всего, бывает феррито-перлитной или перлитной. Такой чугун называют серым.
Обычно, в сером чугуне содержится от 2,5% до 3,6% углерода. В определенных количествах в него входят кремний и марганец. Как примеси, постоянно присутствует сера и фосфор.
Как примеси, постоянно присутствует сера и фосфор.
Прочность чугуна определяется наличием в его структуре графита пластинчатой формы. Такие графитовые включения значительно ослабляют матрицу. Под действием нагрузки возникает напряжение в металле с наибольшей концентрацией у концов у графитовых включений. В этих местах появляются микротрещины. Серый чугун имеет относительно невысокую прочность и разрушается без пластической деформации.
Чугун – литейный сплав.
Условия охлаждения чугуна после заполнения литейной формы оказывает решающее влияние на формирование его структуры. В тонких сечениях отливки, где скорость охлаждения в период кристаллизации высокая, образуется структура белого чугуна. Углерод в нем находится в виде цементита, графит отсутствует. В остальных сечениях образуется структура серого чугуна. Химический состав также оказывает влияние на структуру. С повышением содержания марганца и серы увеличивается зона отбела. Увеличение содержания графитизирующих элементов – углерода и кремния, уменьшает склонность чугуна к отбелу. Для получения отливок с заданными свойствами, необходимо в каждом конкретном случае учитывать как химический состав, так и скорость охлаждения чугуна в литейной форме.
Увеличение содержания графитизирующих элементов – углерода и кремния, уменьшает склонность чугуна к отбелу. Для получения отливок с заданными свойствами, необходимо в каждом конкретном случае учитывать как химический состав, так и скорость охлаждения чугуна в литейной форме.
Серый чугун
Несмотря на относительно невысокие механические свойства, серый чугун нашел широкое применение. Потому что легко обрабатывается, обладает повышенной демпфирующей способностью, а так же антифрикационными свойствами. Поскольку графит чугуна удерживает смазку и сам служит смазочным материалом. Сопряженные детали из чугуна легко перемещаются относительно друг друга.
Серый чугун с небольшими добавками хрома и никеля приобретает хорошие упругие свойства. Поршневое кольцо из такого чугуна после снятия нагрузки вновь принимает первоначальные размеры.
Серый чугун обладает высокой жидкотекучестью. При реальных температурах заливки длина спиральной пробы из чугуна почти вдвое больше стальной, что позволяет изготавливать отливки сложной конфигурации.
Серый чугун отличается малой объемной усадкой при кристаллизации, позволяющей во многих случаях обходиться без установки и прибыли. Наиболее распространенный агрегат для выплавки серого чугуна — вагранка с капельником, в котором происходит накапливание металла, а также усреднение его состава и температуры. Для уменьшения склонности чугуна к отбелу, его модифицируют, вводя в жидкий металл кремнийсодержащие добавки. Модифицирование позволяет выравнивать свойства металла в различных сечениях отливки. Что видно на примере измерения твердости чугунов. Не модифицированного и модифицированного.
Глубина отбела на клиновой пробе модифицированного чугуна значительно меньше, чем не модифицированного. Форма графитовых включений в результате модифицирования также изменяется.
Кроме вагранок для выплавки серого чугуна используют электрические печи. Они позволяют выплавлять металл с более высокой температурой, что имеет важное значение для последующей, внепечной обработки чугуна. Формы для получения отливок из серого чугуна изготавливают уплотнением формовочной смеси в опоках. В полость литейной формы для выполнения внутренней конфигурации отливки устанавливают стержни.
Формы для получения отливок из серого чугуна изготавливают уплотнением формовочной смеси в опоках. В полость литейной формы для выполнения внутренней конфигурации отливки устанавливают стержни.
В массовом производстве для мелких чугунных отливок широко применяют автоматические линии безопочной формовки, в том числе с установкой стержней при помощи стержнеукладчика.
Металл формы также заливается автоматически. Отливки из серого чугуна изготавливают не только в песчаных формах, но и металлических. Для получения отливок, имеющих форму тел вращения, широко применяют центробежный способ литья. При этом, повышается производительность труда, не расходуются формовочные материалы, отсутствует литниковая система.
Серый чугун — общепризнанный конструкционный материал. Его применяют для изготовления различных деталей, работающих в условиях статичных нагрузок, вибрации, повышенного трения.
Ковкий чугун
Известно, что такие детали автомобиля, как ступицы колеса, корпус дифференциала, испытывают динамические нагрузки. Можно ли использовать для их изготовления чугун? Можно, если значительно повысить его пластичность. Таким свойством обладает ковкий чугун, в котором графит имеет не пластинчатую, а хлопьевидную форму. По сравнению с серым чугуном в ковком, концентрация графитизирующих элементов – углерода и кремния ниже.
Можно ли использовать для их изготовления чугун? Можно, если значительно повысить его пластичность. Таким свойством обладает ковкий чугун, в котором графит имеет не пластинчатую, а хлопьевидную форму. По сравнению с серым чугуном в ковком, концентрация графитизирующих элементов – углерода и кремния ниже.
По прочности и пластичности ковкий чугун превосходит серый. Изменения химического состава привело к снижению жидкотекучести и росту усадки при затвердевании, что требует установки прибылей даже на мелких отливках. При производстве ковкого чугуна обычно используют дуплекс-процесс.
Выплавляют чугун в огранке, затем транспортируют в раздаточном ковше и переливают в электрическую индукционную печь, где его прогревают перед заливкой для повышения жидкотекучести.
Технологический процесс получения отливок из ковкого чугуна аналогичен получению отливок из серого чугуна. Все большее распространение получают автоматические формовочные линии. Металл в формы заливается на конвейере. Изготовленные отливки должны иметь структуру белого чугуна по всему сечению. Для получения структуры ковкого чугуна их подвергают графитизирующему отжигу в термических печах. В период выдержки происходит разложение цементита белого чугуна и образуется включение графита хлопьевидной формы. После термической обработки отливки правят на специальных прессах.
Изготовленные отливки должны иметь структуру белого чугуна по всему сечению. Для получения структуры ковкого чугуна их подвергают графитизирующему отжигу в термических печах. В период выдержки происходит разложение цементита белого чугуна и образуется включение графита хлопьевидной формы. После термической обработки отливки правят на специальных прессах.
Необходимость использования длительной термической обработки и правки значительно повышает трудоемкость изготовления деталей из ковкого чугуна. Кованая стальная заготовка распределительного вала двигателя заметно отличается от готовой детали.
Литая заготовка по своей конфигурации к ней значительно ближе, что намного снижает трудоемкость механической обработки. То же относится и к коленчатым валам, деталям ответственного назначения. Для замены кованых заготовок литыми, нужен сплав, который совмещал бы механические свойства стали с технологическими и эксплуатационными свойствами чугуна.
Высокопрочный чугун
Такими свойствами обладает высокопрочный чугун, в котором при кристаллизации образуются включения графита шаровидной формы. По сравнению с серым чугуном, высокопрочный, характеризуется повышенным содержанием углерода и кремния. А так же низкой концентрацией серы.Механические свойства чугуна определяют при испытании образцов, специально изготовленных в соответствии с ГОСТом.
По сравнению с серым чугуном, высокопрочный, характеризуется повышенным содержанием углерода и кремния. А так же низкой концентрацией серы.Механические свойства чугуна определяют при испытании образцов, специально изготовленных в соответствии с ГОСТом.
В высокопрочном чугуне шаровидная форма графита, в меньшей степени, чем пластинчатый графит в сером, ослабляет матрицу и значительно снижает концентрацию напряжения при воздействии нагрузки.
По прочности чугун с шаровидной формой графита приближается к стали. Отливки из высокопрочного чугуна подаются обработке так же хорошо, как и из серого. При этом, достигается требуемая точность и чистота поверхности.
Высокопрочный чугун обладает высокой герметичностью. Из него изготавливают цилиндры газомотокомпрессоров, выдерживающие при испытаниях давление до 100 атмосфер.
Вместе с тем, высокопрочный чугун склонен к образованию усадочных раковин, что требует установки прибылей для питания массивных частей отливок.
Для выплавки высокопрочного чугуна широко применяют индукционные тигельные печи, в которых получают чугун нужного состава и температуры, достаточной для последующего модифицирования. В качестве модификаторов используют магний, церий, иттрий, в виде чистых металлов или легатов. Для предотвращения быстрого всплывания и увеличения времени контакта с расплавом, модификатор накрывают стальными листами. Затем из печи выпускают металл в ковш. Такая технология повышает усвоение модификаторов в чугуне и обеспечивает стабильность процесса.
Для снижения склонности чугуна к отбелу, его дополнительно модифицируют ферросилицием. Формы для отливок большой массы, в основном, изготавливают на крупных встряхивающих столах.
Сборку форм и их заливку производят на специальном плацу. В процессе кристаллизации высокопрочного чугуна под воздействием модификаторов в расплаве происходит многократное ветвление пластин графита и образование его включений шаровидной формы. При недостаточном количестве модификатора или неравномерном его распределении в чугуне может образоваться обычный пластинчатый графит.
При недостаточном количестве модификатора или неравномерном его распределении в чугуне может образоваться обычный пластинчатый графит.
Для стабилизации структуры и обеспечении однородности физикомеханических свойств высокопрочного чугуна крупные отливки сложной формы подвергают термической обработке. Например, нормализации.
После механической обработки детали поступают на участок контроля. Детали ответственного назначения проходят дефектоскопию. Замена ряда стальных деталей, испытывающих при эксплуатации большие ударные нагрузки и давление, деталями из высокопрочного чугуна, существенно удешевляет производство некоторых видов машиностроительной продукции.
Из высокопрочного чугуна изготавливают около 50% коленчатых валов для двигателей различного назначения. Эксплуатационные и литейные свойства чугунов обеспечили их широкое применение в различных отраслях машиностроения. Из них получают выше двух третей литых заготовок, используемых промышленностью нашей страны.
Ртутно-серная теория — это.
 .. Что такое Ртутно-серная теория? Крылатый и бескрылый драконы, образующие круг — символы ртути и серы (Eleazar. «Uraltes chymishes Werk», Leipzig, 1760)
.. Что такое Ртутно-серная теория? Крылатый и бескрылый драконы, образующие круг — символы ртути и серы (Eleazar. «Uraltes chymishes Werk», Leipzig, 1760)Ртутно-серная теория — алхимическая теория, объясняющая происхождение и свойства металлов и обосновывающая возможность их трансмутации; наряду с учением Аристотеля об элементах-стихиях составляла теоретическую основу алхимии.
Рациональные основания теории
Учение о четырёх стихиях оказалось не слишком удобным для интерпретации опытных данных, касающихся свойств металлов, поскольку принимало в качестве основных свойств тел, прежде всего, их физические свойства. Развитие алхимической практики потребовало создания новой теории, основанной на химических свойствах веществ. Основой для создания теории стали сложившиеся ещё в александрийскую эпоху представления о ртути как об особом, «первичном» металле, основанные на уникальной способности ртути образовывать амальгамы с другими металлами[1].
Ртутно-серная теория происхождения металлов, призванная объяснять такие свойства металлов, как блеск, ковкость, горючесть, и обосновывать возможность трансмутации, была создана в конце VIII века арабским алхимиком Джабиром ибн Хайяном[2]. Согласно данной теории, в основе всех металлов лежат два «принципа» — ртуть (философская ртуть) и сера (философская сера). Ртуть является «принципом металличности», сера — «принципом горючести». Принципы теории, таким образом, выступали как носители определённых химических свойств металлов, установленных в результате экспериментального изучения действия высоких температур на металлы.
Согласно данной теории, в основе всех металлов лежат два «принципа» — ртуть (философская ртуть) и сера (философская сера). Ртуть является «принципом металличности», сера — «принципом горючести». Принципы теории, таким образом, выступали как носители определённых химических свойств металлов, установленных в результате экспериментального изучения действия высоких температур на металлы.
Алхимические принципы, в свою очередь, образованы элементами-стихиями: ртуть содержит воду и воздух, а сера — землю и огонь. Философская ртуть и философская сера не тождественны ртути и сере как конкретным веществам. Обычные ртуть и сера представляют собой своего рода свидетельства существования философских ртути и серы как принципов, причём принципов скорее духовных, нежели материальных.
Согласно учению Джабира, сухие испарения, конденсируясь в земле, дают серу, мокрые — ртуть. Сера и ртуть, соединясь затем в различных отношениях, и образуют семь металлов: железо, олово, свинец, медь, ртуть, серебро и золото. Золото как совершенный металл образуется, только если вполне чистые сера и ртуть взяты в наиболее благоприятных соотношениях. В земле, согласно Джабиру, образование золота и других металлов происходит постепенно и медленно. «Созревание» золота можно ускорить с помощью некоего «медикамента» или «эликсира», который приводит к изменению соотношения ртути и серы в металлах и к превращению последних в золото и серебро.
Золото как совершенный металл образуется, только если вполне чистые сера и ртуть взяты в наиболее благоприятных соотношениях. В земле, согласно Джабиру, образование золота и других металлов происходит постепенно и медленно. «Созревание» золота можно ускорить с помощью некоего «медикамента» или «эликсира», который приводит к изменению соотношения ртути и серы в металлах и к превращению последних в золото и серебро.
Термин эликсир (al-iksir) происходит от греческого xerion[3], то есть «сухой»; позднее в Европе эта субстанция получила название философского камня (Lapis Philosophorum). Поскольку процесс превращения несовершенных металлов в совершенный может быть отождествлён с излечением металлов, эликсир, согласно представлениям последователей Джабира, должен обладать ещё многими магическими свойствами — исцелять все болезни, и, возможно, давать бессмертие (отсюда — «эликсир жизни»).
Проблема трансмутации металлов, таким образом, в рамках ртутно-серной теории сводится к задаче выделения эликсира, обозначаемого в алхимической символике астрологическим символом Земли.
Поскольку свойства таких веществ, как соли металлов, довольно сложно объяснить с использованием двух принципов, Ар-Рази в конце IX века усовершенствовал теорию, добавив в неё третий принцип, «принцип твёрдости» — философскую соль. Ртуть и сера образуют твёрдые вещества лишь в присутствии этого третьего принципа. В таком виде теория трёх принципов приобрела логическую завершённость; однако в Европе всеобщее признание данный вариант теории получил лишь в XV—XVI веках благодаря работам Василия Валентина, а затем Парацельса и его последователей («спагирики»).
Ртуть и сера в эзотерике и алхимической символике
Неотъемлемой составной частью ртутно-серной теории в европейской алхимической традиции являлось её эзотерическое, спиритуалистическое толкование.
Ртуть (Меркурий) отождествлялся в алхимии с женским, летучим, пассивным началом, а сера (Сульфур) — с мужским, постоянным, активным. Ртуть и сера имели огромное количество символических имён. В алхимической символике они изображались в виде крылатого и бескрылого драконов, либо в виде женщины и мужчины (обычно королевы и короля), одетых в белые и красные одежды соответственно[4]. Соединение короля и королевы составляло алхимический брак; результатом этого брака являлся гермафродит («ребис»), служивший обычно символом эликсира.
Соединение короля и королевы составляло алхимический брак; результатом этого брака являлся гермафродит («ребис»), служивший обычно символом эликсира.
Три алхимических принципа составляли важную часть нумерологических построений алхимиков, согласно которым материя имеет: четыре угла, четыре элемента — в своей добродетели; три угла, три принципа, — в своей субстанции; два угла, два семени, мужское и женское, — в своей материи; один угол, всемирную материю, — в своём корне. Сумма чисел в этом построении равна десяти — числу, ставящемуся в соответствие материи (иногда — золоту).
Литература
- Всеобщая история химии. Возникновение и развитие химии с древнейших времен до XVII века. — М.: Наука, 1980. 399 с.
- Пуассон А. Теории и символы алхимиков // Теории и символы алхимиков. М.: Новый акрополь, 1995. 192 с.
- Рабинович В. Л. Алхимия как феномен средневековой культуры. — М.: Наука, 1979. 392 с.
- Фигуровский Н. А. Очерк общей истории химии. От древнейших времен до начала XIX века.
 — М.: Наука, 1969. 455 с.
— М.: Наука, 1969. 455 с.
Ссылки
Примечания
- ↑ Соловьев Ю. И. История химии. Развитие химии с древнейших времён до конца XIX века. — М.: Просвещение, 1983. С. 16—18.
- ↑ Фигуровский Н. А. Очерк общей истории химии. От древнейших времен до начала XIX века. — М.: Наука, 1969. С. 81—95.
- ↑ Толковый словарь иностранных слов Л. П. Крысина. — М: Русский язык, 1998.
- ↑ Рабинович В. Л. Алхимия как феномен средневековой культуры — М.: Наука, 1979. С. 76—78.
как оно изготавливается и где применяется
Считается, что золото — первый металл, с которым познакомился человек в своей истории. Неудивительно, ведь основной способ его добычи — поиск руды в самородном состоянии. Этот благородный желтый металл используется не только в качестве ювелирных украшений. Играющие на солнце купола церквей и кресты, убранства величественных икон, отделка внешних элементов зданий, а также обрамление статусной мебели и других предметов интерьера — чаще всего применяется технология золочения поверхности с помощью сусального золота.
Что такое сусальное золото
Сусальное золото — это тонкие листы, наклеиваемые на поверхность изделий для создания впечатления, что весь предмет выполнен из желтого металла. Толщина таких листов может достигать нескольких десятков нанометров.
Впервые изготавливать его начали в Китае несколько тысяч лет назад. Производство было достаточно простым, потому что золото — мягкий и ковкий металл, из которого можно получить тончайшие листы без просветов и трещин.
Россия переняла эту уникальную технологию, назвав продукцию сусалью или сусальным золотом. Название произошло от древнерусского слова «сусаль», которое дословно означало «лицо», отсюда несложно понять возникновение термина, ведь позолотой покрывается лишь лицевая сторона изделия.
Классическая проба сусального золота — 960. Именно так цвет золота получается теплый, желтый или так называемый «желтый огненный». Это окраска самородного металла. Только такая проба закреплена ГОСТом и может называться сусальным золотом.
Исходя из дороговизны такой отделки, достаточно часто можно встретить имитацию сусали или различные золотые сплавы. Виды и отличия сусального золота:
- Двойник — при таком сплаве золото наслаивается на серебро.
- Тальма — при этом сплаве золото наслаивается на медь.
- Поталь — имитация сусали без присутствия благородных металлов, изготавливается с помощью пластин металлов (медь и алюминий) или разнообразных сплавов (медь с цинком). При таком способе для защиты от коррозии необходимо покрывать изделие лаком.
- Сульфид олова или Муссивное золото — имитация позолоты с помощью металлизированной краски, в которую добавляют соединение серы и олова.
- Нитрид титана — очень долговечное и износостойкое покрытие, позволяет варьировать оттенки золота с помощью азота.
- Золоченая фольга — одна из самых последних разработок, представляет собой медный сплав, покрытый никелем и кобальтом.
Как изготавливают сусальное золото
Состав сусального золота может разниться. Кроме самого благородного металла, в сплав добавляют серебро, медь, цинк, кадмий, палладий и никель, которые в свою очередь могут дать различные оттенки и цвета сусали: желтый, бледно-желтый, белый, красный, оранжевый или даже зеленый.
Кроме самого благородного металла, в сплав добавляют серебро, медь, цинк, кадмий, палладий и никель, которые в свою очередь могут дать различные оттенки и цвета сусали: желтый, бледно-желтый, белый, красный, оранжевый или даже зеленый.
Делают сусальное золото из небольшого бруска металла, который раскатывают в длинную полосу, а затем нарезают на равные квадраты. Далее эти заготовки вкладывают между тонкими листами из специальной бумаги и собирают в стопки, каждая из которых может содержать до трехсот квадратов. Затем все это кладется под молот, которым наносят до двух тысяч ударов, пока каждый квадрат металла не сплющится в круглую лепешку толщиной в несколько микрон. Потом из этих лепешек вырезают квадраты размером 91,5 мм на 91,5 мм и вкладывают между листами папиросной бумаги в специальную книгу, в которой сусальное золото хранят, транспортируют и продают. Существует два типа листов позолоты: свободные и трансферные. Свободные просто вкладываются в книгу, а трансферные — приклеиваются на шелковую бумагу или кальку.
Руками листочки сусали трогать нельзя — они очень хрупкие и легко рвутся.
Удивительно, но из одного грамма золота можно получить до восемнадцати квадратных метров позолоты.
Производство сусального золота — процесс очень трудоемкий со своими нюансами, от которых зависит качество конечного продукта. В наше время существует три основных способа изготовления сусали:
- Исторический ручной способ, при котором сырье молотом отбивает мастер «золотобоец». Удары следует наносить с определенной силой и в определенном порядке по всей стопке. Сложность такого метода заключается в том, что металл отбивается на глаз, поэтому невозможно сделать сусаль равномерно тонкой и все листы одинаковыми.
- При втором способе используется автоматический молот, под которым мастер перемещает заготовку для нужного сплющивания квадратов золота.
- Самый используемый способ в современном мире — полностью автоматизированный вариант создания сусального золота с помощью запрограммированных роботизированных систем.
 При этом методе качество конечной продукции является наилучшим. Основные заводы производства находятся в Германии и Италии.
При этом методе качество конечной продукции является наилучшим. Основные заводы производства находятся в Германии и Италии.
Где его применяют
Нанесение сусального золота на памятники, картины, иконы и т.д. — самый основной и практичный способ применения позолоты. И дело даже не в том, что отлить золотые предметы намного дороже, особенно учитывая масштабы объектов вроде куполов или фонтанов. Благодаря сусали можно выполнять интересные и, как кажется на первый взгляд, невозможные шедевры!
Степень золочения разных объектов не всегда одинаковая — зависит как от навыка мастера, так и от вида отделываемого изделия. Так, например, на иконы наносят сусальное золото толщиной в 0,36 микрон, а на купола слой будет толще — около 1,6 микрон.
Из листов сусали изготавливают твореное золото. Так называются микроскопические частицы металла в виде порошка, которые применяются для украшения и реставрации икон и картин.
В настоящее время храмы и церкви практически не покрывают сусальным золотом. Сусаль вытесняется более дешевыми материалами, которые еще и лучше по ряду качеств.
Сусаль вытесняется более дешевыми материалами, которые еще и лучше по ряду качеств.
Съедобное сусальное золото
Поскольку такой тонкий металл не имеет острых режущих краев, а высокая проба означает минимум примесей, возникает вопрос: можно ли есть сусальное золото?
Сусальное золото в кулинарии применяют достаточно широко. Есть даже свой номер пищевой добавки — Е175. Во многих элитных ресторанах Индии можно попробовать покрытые позолотой торты и пирожные, в Японии выпить позолоченный кофе, а в Европе найти элитный алкоголь с хлопьями сусального золота. Так, например, в Армении можно столкнуться с коньяком «Золотой», на Украине — с водкой «Золото Полуботка», а в Италии — с шнапсом «Гольдшлегер».
Сколько стоит сусальное золото
Стоимость золота разнится в зависимости от количества необходимого сырья для золочения объекта. Каждая книжка содержит по стандарту шестьдесят листов, поэтому ее хватает на половину квадратного метра позолоты. Чем больше будет затрачено на работу книжек, тем меньше будет цена каждой. Следует помнить, что вес книжек также отличается в зависимости от толщины золотых листов.
Следует помнить, что вес книжек также отличается в зависимости от толщины золотых листов.
Автор статьи: Александр Москалец
Альтерантивное мракобесие. Сера и ртуть.
Теория четырех элементов всем хороша, но малопригодна для систематизации металлов (задача, не решенная и сегодня). В восьмом веке Гебер (Джабир ибн Хайян) предложил ртутно-серную теорию металлов, которая легла в основании европейской алхимии.…теория призвана объяснять такие свойства металлов, как блеск, ковкость, горючесть, и обосновывать возможность трансмутации. Согласно данной теории, в основе всех металлов лежат два «принципа» — ртуть (философская ртуть) и сера (философская сера). Ртуть является «принципом металличности», сера — «принципом горючести». Принципы теории, таким образом, выступали как носители определённых химических свойств металлов, установленных в результате экспериментального изучения действия высоких температур на металлы. Алхимические принципы, в свою очередь, образованы элементами-стихиями: ртуть содержит воду и воздух, а сера — землю и огонь. Философская ртуть и философская сера не тождественны ртути и сере как конкретным веществам. Обычные ртуть и сера представляют собой своего рода свидетельства существования философских ртути и серы как принципов, причём принципов скорее духовных, нежели материальных. Согласно учению Джабира, сухие испарения, конденсируясь в земле, дают серу, мокрые — ртуть. Сера и ртуть, соединясь затем в различных отношениях, и образуют семь металлов: железо, олово, свинец, медь, ртуть, серебро и золото. Золото как совершенный металл образуется, только если вполне чистые сера и ртуть взяты в наиболее благоприятных соотношениях. В земле, согласно Джабиру, образование золота и других металлов происходит постепенно и медленно. «Созревание» золота можно ускорить с помощью некоего «медикамента» или «эликсира», который приводит к изменению соотношения ртути и серы в металлах и к превращению последних в золото и серебро… Ртуть (Меркурий) отождествлялся в алхимии с женским, летучим, пассивным началом, а сера (Сульфур) — с мужским, постоянным, активным.
Философская ртуть и философская сера не тождественны ртути и сере как конкретным веществам. Обычные ртуть и сера представляют собой своего рода свидетельства существования философских ртути и серы как принципов, причём принципов скорее духовных, нежели материальных. Согласно учению Джабира, сухие испарения, конденсируясь в земле, дают серу, мокрые — ртуть. Сера и ртуть, соединясь затем в различных отношениях, и образуют семь металлов: железо, олово, свинец, медь, ртуть, серебро и золото. Золото как совершенный металл образуется, только если вполне чистые сера и ртуть взяты в наиболее благоприятных соотношениях. В земле, согласно Джабиру, образование золота и других металлов происходит постепенно и медленно. «Созревание» золота можно ускорить с помощью некоего «медикамента» или «эликсира», который приводит к изменению соотношения ртути и серы в металлах и к превращению последних в золото и серебро… Ртуть (Меркурий) отождествлялся в алхимии с женским, летучим, пассивным началом, а сера (Сульфур) — с мужским, постоянным, активным.
https://ru.wikipedia.org/wiki/%D0%A0%D1%82%D1%83%D1%82%D0%BD%D0%BE-%D1%81%D0%B5%D1%80%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D0%BE%D1%80%D0%B8%D1%8F
Никогда не мог понять, чем конкретно эта теория не угодила, и почему это не химия, а неизвестно что.
Даже пресловутому флогистону не отказывают в научности (и правильно, т.к. это раняя версия термодинамического взгляда на природу химической реакции). С ртутно-серной теорией, по-моему, ситуация еще более ясная. Тут верная интуция о том, что свойства атомов металлов должны определяться дополнительными принципами. Один из них до сих пор так и называется — металличность («качественная характеристика элемента, отражающая стремление его атомов приобретать положительный заряд»). Металличность усиливается с ростом заряда (увеличением радиуса), и ртуть — прекрасный выбор для иллюстрации этого свойства. Нет ничего странного в утверждении, что более «металличный» металл имеет в себе больше философской ртути. Мы регулярно пользуемся переосмысленными понятиями такого рода, говоря, например, об электричестве (как о некоторой жидкости) и токе (как ее течении). Это не понимают буквально, но, возможно, и напрасно — открыли же недавно электронную вязкость
Это не понимают буквально, но, возможно, и напрасно — открыли же недавно электронную вязкость
http://www.manchester.ac.uk/discover/news/electrons-in-graphene-seen-moving-like-honey
http://www.nature.com/nphys/journal/vaop/ncurrent/full/nphys3667.html
Тут одновременно и конкретное и абстрактное представление и, судя по всему, такое «двоемыслие» было распространено в средние века
http://www.tandfonline.com/doi/full/10.1179/1745823414Y.0000000004#.V52dVvmANBc
Противоположный принцип тоже ретроспективно очевиден — электроотрицательность (способность атома принимать электрон). По шкале Полинга только фтор, кислород, азот и галогены имеют большую электроотрицательность. Во времена Гебера сера была наиболее электроотрицательным из известных элементо, и естественно выбрать ее как воплощение «серного» принципа. «Горючесть» тесно связана с этим свойством, тогда как «блеск, ковкость» — с металличностью. Способность отдавать электрон можно интерпретировать как женское начало, а принимать электрон — как мужское. Каждый металл можно изобразить точкой в пространстве металличности и электроотрицательности, и «трансмутация» — мысленный эксперимент по сближению точек. Не очевидно, что один металл не может иметь химические свойства практически неотличимые от другого (если он имеет ту же металличность и электроотрицательность, неважно как достигнутые). Изменение заряда ядра — наиболее наглядный способ изменения этих свойств, но можно к этому делу подойти иначе, была бы охота (электрон на мюон поменять, скажем).
Каждый металл можно изобразить точкой в пространстве металличности и электроотрицательности, и «трансмутация» — мысленный эксперимент по сближению точек. Не очевидно, что один металл не может иметь химические свойства практически неотличимые от другого (если он имеет ту же металличность и электроотрицательность, неважно как достигнутые). Изменение заряда ядра — наиболее наглядный способ изменения этих свойств, но можно к этому делу подойти иначе, была бы охота (электрон на мюон поменять, скажем).
Сухие (электронами) геберовские испарения, конденсирующиеся в земле — богатые философской серой диэлектрики, образующие ее внешние слои; мокрые испарения — жидкое (богатое философской ртутью) металлическое ядро. С вызреванием металлов в земле Гебер попутал: нуклеосинтез идет в звездах, но это ошибка непринципиальная; существенно, что он предложил эволюционный взгляд на происхождение элементов, до которого мы добрались менее ста лет назад.
Представьте, что вы живете в Персии восьмого века. Заснули, и во сне пришел к вам по лунному лучу архангел Джебраил, объясняя как устроены и откуда взялись металлы. Говорит архангел складно, как положено чистому духу, но понять его трудновато. Как теперь выражаются, понятийный аппарат отсутствует, и тем не менее — о, чудо! — что-то вы все же поняли. Теперь это надо пересказать так, чтобы поняли другиe. Непростая задача…
Заснули, и во сне пришел к вам по лунному лучу архангел Джебраил, объясняя как устроены и откуда взялись металлы. Говорит архангел складно, как положено чистому духу, но понять его трудновато. Как теперь выражаются, понятийный аппарат отсутствует, и тем не менее — о, чудо! — что-то вы все же поняли. Теперь это надо пересказать так, чтобы поняли другиe. Непростая задача…
После пары столетий перепевов Рабиновичей результат был бы, наверно, тот же самый.
И все же, если бы я был архангелом, то обязательно заглянул к угаданному мною сыну аптекаря звездочету Абу Абдаллаху Джабиру ибн Хайян аль-Азди ас-Суфи.
Свойства серы
Свойства серы — Каковы физические свойства серы?
* Аллотропный — Аллотропы представляют собой формы элемента с разными физическими и химическими свойствами, присутствующие в двух или более кристаллических формах в одном физическом состоянии. Свойства серы — Каковы химические свойства серы?
Факты и информация о свойствах серы | ||||||||||||||||||||||||||||||||
Сера ковкая или нет? — AnswersToAll
Сера пластична или не пластична?
Неметаллы обычно хрупкие по своей природе и, следовательно, не могут противостоять внешним воздействиям.Предлагаемые варианты — сера, селен и фосфор. Все эти элементы не являются металлами и, следовательно, не обладают свойством пластичности.
Сера пластична или пластична?
Сера не пластичная, так как ее нельзя сгибать для изготовления проволоки.
Что такое сера пластичная или хрупкая?
сера (S), также обозначаемая как сера, неметаллический химический элемент, принадлежащий к кислородной группе (группа 16 [VIa] периодической таблицы), один из наиболее реактивных элементов.Чистая сера представляет собой хрупкое твердое вещество бледно-желтого цвета без вкуса и запаха, плохо проводящее электричество и не растворимое в воде.
Является ли сера пластичным проводником?
Сера считается неметаллом, поскольку она соответствует 3 физическим свойствам, перечисленным для неметаллов. Кроме того, поскольку сера тусклая и хрупкая в твердой форме, это еще раз объясняет, почему она является плохим проводником, поскольку электронам труднее перемещаться, когда они плотно упакованы в твердое тело.
Что из следующего является податливым?
Платина. — Подсказка: металлы, которые можно расколоть на листы, известны как ковкие металлы. Чем сильнее разрушается металл, тем выше его пластичность. Все металлы, указанные в опции, в той или иной степени ковкие, но среди них золото является наиболее ковким.
Является ли сера пластичным материалом?
Ответ: Сера не является пластичным материалом, потому что это неметалл, и мы знаем, что неметалл не является пластичным и хрупким..
Сера твердая или мягкая?
Внешний вид и твердость материалов
| Объект / Материал | Внешний вид | Твердость |
|---|---|---|
| Утюг | блестящий | Очень жесткий |
| Уголь | тусклый | Не очень сложно |
| сера | тусклый | Не очень сложно |
| Алюминий | блестящий | Очень жесткий |
Какова пластичность кремния?
Кремний обладает высокой теплопроводностью и хорошо проводит тепло.В отличие от металлов, он хрупкий, а не податливый или пластичный.
Является ли азот пластичным?
Неметаллы обладают многими схожими свойствами, в том числе: они либо газ (водород, кислород, азот), либо твердые (углерод, сера) при стандартных условиях. В твердом виде они очень хрупкие. Они не податливы и не пластичны.
В твердом виде они очень хрупкие. Они не податливы и не пластичны.
Почему Sulphur не является проводником?
Пошаговое решение: сера является неметаллом, потому что она соответствует трем физическим свойствам, перечисленным для неметаллов.Это плохой проводник тепла и электричества, потому что электроны не могут двигаться. Электроны серы очень плотно удерживаются и не могут перемещаться, поэтому это скорее изолятор.
Имеет ли сера проводимость?
Измерения на постоянном токе дали значения проводимости 2,0 · 10-10 и 3,5 · 10-9 Ом-1 см-1 для серы и P4S3, соответственно, при 350 ° C, с соответствующими энергиями активации 37,2 ккал / грамм-атом и 7,4. ккал / моль.
Сера и сульфат — это одно и то же?
Сульфат и нитрат — химические соединения, которые часто встречаются в питьевой воде и пищевых продуктах.Это не одно и то же, хотя при употреблении в чрезмерных количествах оба могут вызвать проблемы со здоровьем. Сульфаты, минеральные соли, содержащие серу и часто встречающиеся в природе в пище и воде, также отличаются от сульфитов,…
Является ли сера твердой или газообразной в нормальных условиях?
Сера является обильной, поливалентной и неметаллической. В нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8. Элементная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре.Химически сера реагирует со всеми элементами, кроме золота, платины, иридия, теллура и благородных газов.
В нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8. Элементная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре.Химически сера реагирует со всеми элементами, кроме золота, платины, иридия, теллура и благородных газов.
Сера — это газ, жидкость или металл?
Сера (S), также обозначаемая как сера, неметаллический химический элемент, принадлежащий к кислородной группе (Группа 16 [VIa] периодической таблицы), один из наиболее реактивных элементов. Чистая сера представляет собой хрупкое твердое вещество бледно-желтого цвета без вкуса и запаха, плохо проводящее электричество и не растворимое в воде.
Является ли сера твердым неметаллом?
Сера или сера — один из наиболее реактивных элементов, присутствующих в таблице Менделеева.Это неметалл, который принадлежит к группе 16 (VI A) периодической таблицы. Атомный номер этого химического элемента 16 и символически обозначается как S. При комнатной температуре; элементарная сера представляет собой твердое кристаллическое вещество ярко-желтого цвета.
При комнатной температуре; элементарная сера представляет собой твердое кристаллическое вещество ярко-желтого цвета.
2.5 Металлы, металлоиды и неметаллы | Классификация веществ
2.5 Металлы, металлоиды и неметаллы (ESAAD)
Элементы периодической таблицы также можно разделить в зависимости от того, являются ли они металлами , металлоидов или неметаллов .Зигзагообразная линия разделяет все элементы, которые
металлы из неметаллов. Металлы находятся слева от линии, а неметаллы — на
правильно. Вдоль линии вы найдете металлоиды. Вы должны заметить, что металлов больше, чем неметаллов. Металлы, металлоиды и неметаллы обладают своими специфическими свойствами.
Металлы, металлоиды и неметаллы обладают своими специфическими свойствами.
Рис. 2.6: Упрощенная диаграмма, показывающая часть таблицы Менделеева.
Металлы (ESAAE)
Примеры металлов: медь (\ (\ text {Cu} \)), цинк (\ (\ text {Zn} \)), золото (\ (\ text {Au} \)), серебро. (\ (\ text {Ag} \)), олово (\ (\ text {Sn} \)) и свинец (\ (\ text {Pb} \)).Ниже приведены некоторые свойства металлы:
Медный провод
Теплопроводники
Металлы являются хорошими проводниками тепла и поэтому используются в кухонной утвари, такой как кастрюли и сковороды.
Электропроводники
Металлы являются хорошими проводниками электричества и поэтому используются в электропроводных проводах.
Блестящий металлический блеск
Металлы имеют характерный блестящий вид и часто используются для изготовления украшений.

Ковкий и пластичный
Это означает, что им можно придать форму без разрушения (податливость) и их можно растянуть до тонкости. провода (пластичные), например медные.
Температура плавления
Металлы обычно имеют высокую температуру плавления, поэтому их можно использовать для изготовления кастрюль и другого оборудования. который должен стать очень горячим, но при этом не повредиться.
Плотность
Металлы имеют высокую плотность.
Магнитные свойства
Только три основных металла (железо, кобальт и никель) являются магнитными, остальные — немагнитными.
Вы можете увидеть, как свойства металлов делают их очень полезными в определенных приложениях.
Глядя на металлы
Соберите несколько металлических предметов у себя дома или в школе.Некоторые примеры перечислены ниже:
В группы \ (\ text {3} \) — \ (\ text {4} \) объедините вашу коллекцию металлических предметов.
Какова функция каждого из этих объектов?
Обсудите, почему, по вашему мнению, для изготовления каждого предмета использовался металл. Следует учитывать свойства металлов когда вы ответите на этот вопрос.
Неметаллы (ESAAF)
В отличие от металлов неметаллы являются плохими проводниками тепла, хорошими электрическими изоляторами (что означает, что они (не ) проводят электрический заряд) и не являются ни податливыми, ни пластичными. Неметаллы включают элементы
такие как сера (\ (\ text {S} \)), фосфор (\ (\ text {P} \)), азот (\ (\ text {N} \)) и кислород (\ (\ text {O} \)).
сера
Металлоиды (ESAAG)
Металлоиды или полуметаллы обладают в основном неметаллическими свойствами.Одна из их отличительных характеристик — что их проводимость увеличивается с увеличением их температуры.
Это противоположно тому, что происходит с металлами. Это свойство известно как полупроводимость, и материалы называются полупроводниками. Полупроводники важны в цифровой электронике, например, в компьютерах. В металлоиды включают такие элементы, как кремний (\ (\ text {Si} \)) и германий (\ (\ text {Ge} \)).
Кремниевые чипы
временный текстЧасти периодической таблицы
Когда элементы объединяются, чтобы сформировать соединения, есть два основных типа
соединение, которое может возникнуть. Ионные связи образуются при наличии передача электронов от одного вида к другому, производя
заряженные ионы, которые очень сильно притягиваются друг к другу за счет электростатического
взаимодействия, и ковалентных связей , которые возникают, когда атомы делятся электронами , чтобы произвести нейтральные молекулы.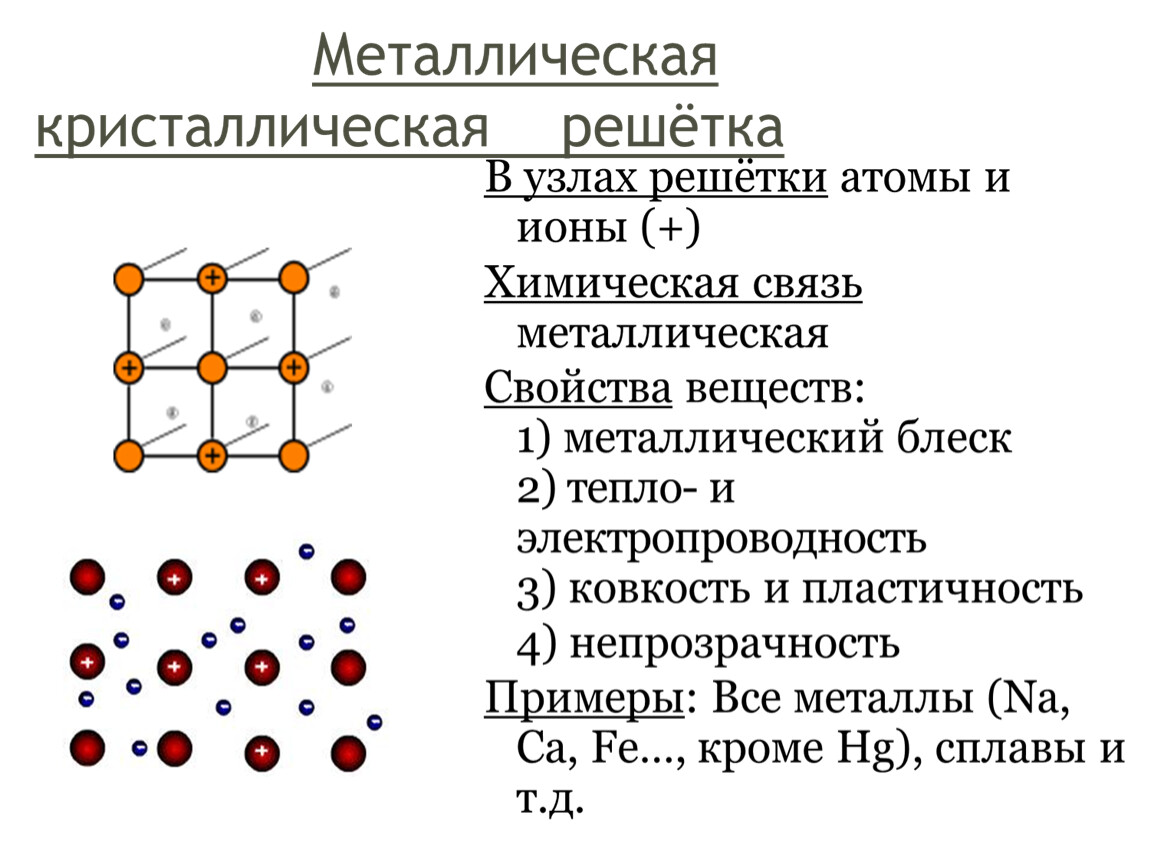 В целом металл и неметаллы объединяются с образованием ионных соединений , а неметаллы соединяются с другими неметаллами с образованием ковалентных соединений (молекулы).
В целом металл и неметаллы объединяются с образованием ионных соединений , а неметаллы соединяются с другими неметаллами с образованием ковалентных соединений (молекулы).
Поскольку металлы в периодической таблице расположены левее, они имеют низкую энергию ионизации и низкое сродство к электрону, поэтому они относительно легко теряют электроны и с трудом их получают. Они также имеют относительно мало валентных электронов и могут образовывать ионы (и тем самым удовлетворять правилу октетов) легче, теряя свою валентность электронов с образованием положительно заряженных катионов .
- Металлы основной группы обычно образуют такие же заряды, как и их номер группы: то есть металлы Группы 1А, такие как натрий и калий образуют заряд +1, металлы группы 2А, такие как магний и кальций образуют 2+ зарядов, а металлы группы 3А, такие как в виде алюминия образуют 3+ заряда.
- Металлы, следующие за переходными металлами (в сторону
нижняя часть групп 4A и 5A) могут потерять либо свои крайние с и p электронов, образующих заряды, идентичные своим
номер группы, или они могут потерять всего p электронов, пока
сохраняя свои два s электронов, образуя заряды, которые являются
номер группы минус два.
 Другими словами, олово и свинец в Группе
4A может образовывать 4+ или 2+ зарядов, а висмут в группе 5A может образовывать заряды 4+ или 2+.
формируют заряд 5+ или 3+.
Другими словами, олово и свинец в Группе
4A может образовывать 4+ или 2+ зарядов, а висмут в группе 5A может образовывать заряды 4+ или 2+.
формируют заряд 5+ или 3+. - Переходные металлы обычно способны образовывать 2+ заряда. теряя валентность с электронов, но также могут терять электроны со своих d орбиталей с образованием других зарядов. Большинство переходных металлов могут образовывать более одного возможного заряда. в ионных соединениях.
Неметаллы находятся правее в таблице Менделеева и имеют
высокие энергии ионизации и
высокое сродство к электрону, поэтому
они относительно легко получают электроны и с трудом теряют их.
У них также больше валентных электронов, и они уже
близко к полному октету из восьми электронов. Неметаллы
набирать электроны до тех пор, пока у них не будет того же количества электронов, что и у
ближайший благородный газ (группа 8А), образующий отрицательно заряженных анионов которые имеют заряды, равные номеру группы минус восемь. Это,
Неметаллы группы 7А образуют заряды 1, неметаллы группы 6А образуют 2-
заряды, а металлы группы 5А образуют 3- заряды.Группа 8А
элементы уже имеют восемь электронов в их валентных оболочках и имеют
малая тенденция к получению или потере электронов, и с трудом
образуют ионные или молекулярные соединения.
Это,
Неметаллы группы 7А образуют заряды 1, неметаллы группы 6А образуют 2-
заряды, а металлы группы 5А образуют 3- заряды.Группа 8А
элементы уже имеют восемь электронов в их валентных оболочках и имеют
малая тенденция к получению или потере электронов, и с трудом
образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в регулярном массиве, называемом кристаллом . решетка силами притяжения между противоположно заряженными катионы и анионы. Эти силы притяжения очень сильны, и поэтому большинство ионных соединений имеют очень высокие температуры плавления.(За Например, хлорид натрия, NaCl, плавится при 80 ° C, а оксид алюминия, Al 2 O 3 , плавится при 2054 ° C.) Ионные соединения: обычно твердые, жесткие и хрупкие. Ионные соединения не проводят электричество, потому что ионы не могут двигаться в твердой фазе, но ионные соединения могут проводить электричество, когда они растворены в вода.
Когда неметаллы объединяются с другими неметаллами, они имеют тенденцию делиться
электроны в ковалентных связях вместо образования ионов, что приводит к
образование нейтральных молекул. (Имейте в виду, что поскольку водород
также неметалл, сочетание водорода с другим неметаллом
также будет образовывать ковалентную связь.) Молекулярные соединения могут быть
газы, жидкости или твердые вещества с низкой температурой плавления и включают широкий спектр
веществ. (См.
Галерея молекул для
примеры.)
(Имейте в виду, что поскольку водород
также неметалл, сочетание водорода с другим неметаллом
также будет образовывать ковалентную связь.) Молекулярные соединения могут быть
газы, жидкости или твердые вещества с низкой температурой плавления и включают широкий спектр
веществ. (См.
Галерея молекул для
примеры.)
Когда металлы соединяются друг с другом, обычно описывается соединение.
как металлическое соединение (вы уже догадались).В этом
модели, каждый атом металла отдает один или несколько своих валентных электронов
сделать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Поскольку электроны в электроне
море может свободно перемещаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы. Атомы металлов могут
проходят друг мимо друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях притяжениями между катионами и
анионы), позволяя металлу раскалывать листы или втягивать
провод.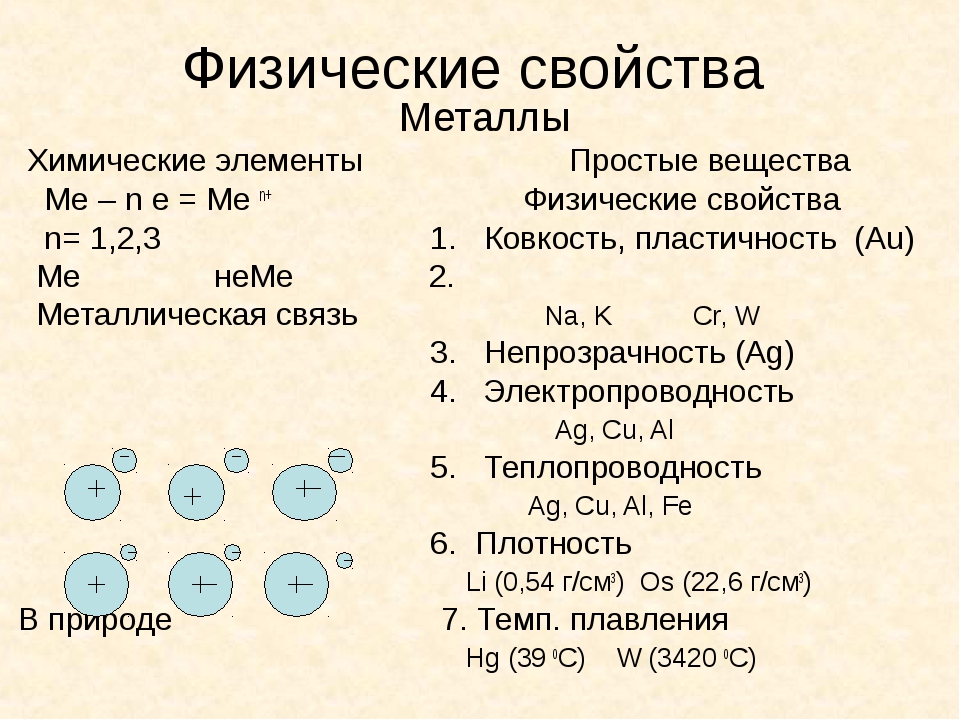 Различные металлы можно легко комбинировать, чтобы получить .
сплавы , физические свойства которых могут сильно отличаться от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
которое намного тверже самого железа; хром, ванадий, никель и
другие металлы также часто добавляют в железо, чтобы сделать стали различных
типы. Латунь — это сплав меди и цинка, который используется
в сантехнике, электрических деталях и музыкальных инструментах. Бронза — это сплав меди и олова, который намного тверже, чем
медь; когда бронза была открыта древними цивилизациями, она ознаменовала
значительный шаг вперед от использования менее прочных каменных орудий.
Различные металлы можно легко комбинировать, чтобы получить .
сплавы , физические свойства которых могут сильно отличаться от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
которое намного тверже самого железа; хром, ванадий, никель и
другие металлы также часто добавляют в железо, чтобы сделать стали различных
типы. Латунь — это сплав меди и цинка, который используется
в сантехнике, электрических деталях и музыкальных инструментах. Бронза — это сплав меди и олова, который намного тверже, чем
медь; когда бронза была открыта древними цивилизациями, она ознаменовала
значительный шаг вперед от использования менее прочных каменных орудий.
Металлы — GRE Предметный тест: химия
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту. Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам Varsity найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Элементы — металлы, неметаллы и металлоиды
Лакшми Картикеян, Программа среднего технического образования (STEP), Anoka — Hennepin ISD # 11, Anoka, MN
На основе
Кеннеди, К. Перспектива свойств металлов и неметаллов
Перспектива свойств металлов и неметаллов
Получено из http: // school.discoveryeducation.com
Сводка
В этом упражнении учащиеся исследуют несколько свойств данных элементов и решат, является ли каждый элемент металлом, неметаллом или металлоидом. Они изучат внешний вид представленных образцов и отметят цвет, блеск и форму. С помощью молотка они определят, хрупкий он или податливый. Они проверит электрическую проводимость и реакционную способность каждого образца с раствором хлористоводородной кислоты и меди (II).
Цели обучения
Из этого задания учащиеся поймут, что каждый элемент классифицируется как металл, неметалл или металлоид (полуметалл) в зависимости от его индивидуальных свойств. Они смогут классифицировать элемент как металл, неметалл или металлоид на основе экспериментальных наблюдений за физическими и химическими свойствами. Это упражнение развивает у студентов навыки наблюдения, вопросов, критического мышления и анализа данных. Ключевые концепции, которые студенты рассмотрят в ходе этого упражнения, заключаются в том, что металлы имеют блеск, они пластичны, являются хорошими проводниками электричества, вступают в реакцию с кислотами и другими водными растворами.Некоторые из словарных слов, которые рассматриваются учащимися в ходе этого упражнения, — это блеск, хрупкость, пластичность, пластичность, электрический проводник и изолятор.
Ключевые концепции, которые студенты рассмотрят в ходе этого упражнения, заключаются в том, что металлы имеют блеск, они пластичны, являются хорошими проводниками электричества, вступают в реакцию с кислотами и другими водными растворами.Некоторые из словарных слов, которые рассматриваются учащимися в ходе этого упражнения, — это блеск, хрупкость, пластичность, пластичность, электрический проводник и изолятор.
Контекст использования
Тип ресурса
Действие: Лабораторное задание
Класс
Средняя школа (9–12)
Формат урока:
Это лабораторное задание.
Необходимое время:
Период одного занятия
Материалы:
Прибор для измерения проводимости
Малые молотки
Планшеты с лунками
Образцы элементов
Знание концепции:
Атомная структура элементов
Физические и химические свойства металлов, неметаллов и металлоидов
Предмет : Химия: Общая химия: Элементы и периодическая таблица
Тип ресурса : Деятельность: Лабораторная работа
Уровень класса : Средняя школа (9-12)
Описание и учебные материалы
Студенты сформируют небольшие лабораторные группы из двух или трех человек.
После того, как я рассмотрю разницу между физическими и химическими свойствами и характеристиками металлов, неметаллов и металлоидов, студенческие группы получат образцы в семи флаконах, которые были закодированы буквами от «a» до «g». Студенческие группы получают образцы углерода (грифель для карандашей), кусочки магниевой ленты, комки кремния, комки серы, железные опилки и кусочки замшелого цинка. Студенты должны сгруппировать образцы по категориям металлов, неметаллов или металлоидов. Они будут смотреть на внешний вид данного образца, чтобы увидеть, имеет ли он блеск или тусклый.Они будут использовать молоток, чтобы проверить, является ли образец хрупким или пластичным.
Они будут использовать тестер проводимости, чтобы проверить, проводит ли образец электричество. Затем они проверит реакционную способность образцов с 0,5 М соляной кислотой и 0,1 М раствором хлорида меди (II). Они возьмут небольшую порцию данных образцов в лунку планшета. К каждому образцу будет добавлено от 15 до 20 капель раствора кислоты, и они будут искать любую реакцию (изменение), происходящую в виде пузырьков газообразного водорода. В случае хлорида меди (II), который представляет собой раствор синего цвета, они будут искать изменение цвета жидкости и образца.
В случае хлорида меди (II), который представляет собой раствор синего цвета, они будут искать изменение цвета жидкости и образца.
Затем группы студентов составят таблицу данных для сравнения наблюдений для данных выборок. Они обсудят свои выводы в своих небольших группах и сгруппируют образцы по двум категориям в зависимости от их физических и химических свойств и выяснят, какие элементы могут входить в любую из групп и почему. Они разделят образцы на металлы, неметаллы и металлоиды.Затем группы представят свои выводы классу и обсудят, как они пришли к своим выводам.
Как класс мы сгруппируем элементы по трем группам после обсуждения критериев распределения элементов по группам.
Учебные заметки и советы
Студенты должны носить защитные очки на протяжении всей лабораторной работы. Я использую тестер проводимости от Flinn Scientific. Если у вас его нет, можно построить простой тестер.(Кац, Д. и Уиллс, К., Журнал химического образования, 1994, стр.330) Для работы с образцами элементов следует использовать щипцы.
 Я также рассматриваю процесс безопасного использования кислот.
Я также рассматриваю процесс безопасного использования кислот.Единственная проблема, которая у нас была, была с углеродом. Студенческие группы классифицировали магний, цинк, железо и олово как металлы; сера как неметалл и кремний и углерод как металлоиды. Углерод проводит электричество и не имеет характерного блеска. Нам необходимо учитывать другие свойства, например, он хрупкий, не вступает в реакцию с двумя жидкостями, поэтому углерод вместе с серой становится неметаллом.
Оценка
Для оценки я использую таблицу данных и их группировку данных выборок по трем категориям.Оценка классификации студентов производится на основе наблюдений студентов, не обязательно на основе фактической выборки. Для оценки также используются обсуждения между студентами и студентами, а также обсуждения от группы к группе. Кроме того, я даю им диаграмму Венна с двумя кружками для сравнения свойств металлов, неметаллов и металлоидов. Я назначаю баллы за заполненную диаграмму Венна. Члены каждой группы получают одинаковые баллы.
Стандарты
II.A.1 — Структура вещества
Я.B.1 — Научный запрос
Ссылки и ресурсы
Элемент Сера — Атом серы
Элемент Сера сера
Сера ( сера ) — химический элемент. в периодической таблице, которая имеет символ S и атомный номер 16. Обильный безвкусный мультивалентный неметалл без запаха, сера — это наиболее известен как желтые кристаллы и встречается во многих сульфидах и сульфатах. минералы и даже в естественном виде (особенно в вулканических регионах).Это важный элемент всех живых организмов и необходим в нескольких аминокислотах и, следовательно, во многих белках. Это прежде всего используется в удобрениях, но также широко используется в порохе, слабительных, спички и инсектициды. Этот неметалл имеет бледно-желтый цвет, мягкий, легкий, с отчетливым запах в сочетании с водородом (запах тухлых яиц). Горит с синее пламя, излучающее специфический удушающий запах (диоксид серы, СО 2 ). Сера нерастворима в воде, но растворима в углероде.
дисульфид. Общие степени окисления серы включают -2, +2, +4 и
+6. Во всех состояниях, твердом, жидком и газообразном, сера имеет аллотропные свойства.
формы, отношения которых до конца не изучены. Кристаллический
можно показать, что сера образует 8-членное серное кольцо, S 8 . Сера нерастворима в воде, но растворима в углероде.
дисульфид. Общие степени окисления серы включают -2, +2, +4 и
+6. Во всех состояниях, твердом, жидком и газообразном, сера имеет аллотропные свойства.
формы, отношения которых до конца не изучены. Кристаллический
можно показать, что сера образует 8-членное серное кольцо, S 8 .Сера может быть получена в двух кристаллических модификациях, в орторомбической октаэдры, или в моноклинных призмах, первая из которых более стабилен при обычных температурах. Он используется во многих промышленных процессах, таких как производство серная кислота (H 2 SO 4 ) для аккумуляторов, производство пороха, и вулканизация резины. Сера используется как фунгицид, а также при производстве фосфорных удобрений. Сульфиты используются для отбеливания бумаги и сухофруктов. Сера тоже находит применение в спичках и фейерверках. Используются тиосульфат натрия или аммония.
как средства для фиксации фотографий.Английская соль, сульфат магния, банка
использоваться как слабительное, как добавка для ванн, как отшелушивающее средство или магний
добавка в питание растений.
Аминокислоты цистеин, метионин, гомоцистеин и таурин содержат
сера, как и некоторые обычные ферменты, что делает серу необходимым компонентом
всех живых клеток. Дисульфидные связи между полипептидами очень
важен в сборке и структуре белка. Некоторые формы бактерий
используйте сероводород (H 2 S) вместо воды в качестве
донор электронов в примитивном процессе, похожем на фотосинтез.Сера
поглощается растениями из почвы в виде сульфат-иона. Неорганические формы серы
входит в состав железо-серных кластеров, а сера является мостиковым лигандом
в сайте Cu A цитохром с оксидазы. Используются тиосульфат натрия или аммония.
как средства для фиксации фотографий.Английская соль, сульфат магния, банка
использоваться как слабительное, как добавка для ванн, как отшелушивающее средство или магний
добавка в питание растений.
Аминокислоты цистеин, метионин, гомоцистеин и таурин содержат
сера, как и некоторые обычные ферменты, что делает серу необходимым компонентом
всех живых клеток. Дисульфидные связи между полипептидами очень
важен в сборке и структуре белка. Некоторые формы бактерий
используйте сероводород (H 2 S) вместо воды в качестве
донор электронов в примитивном процессе, похожем на фотосинтез.Сера
поглощается растениями из почвы в виде сульфат-иона. Неорганические формы серы
входит в состав железо-серных кластеров, а сера является мостиковым лигандом
в сайте Cu A цитохром с оксидазы. Сера (санскрит, sulvere ; лат. sulpur ) была известна в древности и в библейских история Пятикнижия (Бытие). Гомер упомянул «серу, предотвращающую вредителей» в 9 веке до нашей эры и в 424 году до нашей эры племя Бутье разрушило стены города путем сжигания смеси угля, серы и смолы под ними.Где-то в 12 веке китайцы изобрели пистолет. порошок, представляющий собой смесь нитрата калия (KNO 3 ), углерод и сера. Ранние алхимики придавали сере собственный алхимический символ, который представлял собой треугольник на вершине креста. Экспериментируя, алхимики знали, что элемент ртуть может соединяться с серой. В конце 1770-х годов Антуан Лавуазье помог убедить ученых сообщества, что сера была элементом, а не соединением. происшествиеСера встречается в природе в больших количествах в сочетании с другими элементами. в сульфидах (пример: пириты) и сульфатах (например: гипсе). Это
в свободном виде встречается возле горячих источников и вулканических регионов и
в таких рудах, как киноварь, галенит, сфалерит и антимонит. Этот элемент
также в небольших количествах содержится в угле и нефти, которые производят
диоксид серы при горении. Стандарты топлива все чаще требуют серы
быть извлеченным из ископаемого топлива, потому что диоксид серы объединяет
с каплями воды, чтобы вызвать кислотный дождь.Эта извлеченная сера
затем очищается и составляет большую часть производства серы.
Его также добывают на побережье Персидского залива США, закачивая в него горячую воду.
серосодержащие отложения (например, соляные купола), которые плавят серу.
Затем расплавленная сера перекачивается на поверхность. Через свои основные
производное, серная кислота, сера считается одним из наиболее важных
элементы, используемые в качестве промышленного сырья. в сульфидах (пример: пириты) и сульфатах (например: гипсе). Это
в свободном виде встречается возле горячих источников и вулканических регионов и
в таких рудах, как киноварь, галенит, сфалерит и антимонит. Этот элемент
также в небольших количествах содержится в угле и нефти, которые производят
диоксид серы при горении. Стандарты топлива все чаще требуют серы
быть извлеченным из ископаемого топлива, потому что диоксид серы объединяет
с каплями воды, чтобы вызвать кислотный дождь.Эта извлеченная сера
затем очищается и составляет большую часть производства серы.
Его также добывают на побережье Персидского залива США, закачивая в него горячую воду.
серосодержащие отложения (например, соляные купола), которые плавят серу.
Затем расплавленная сера перекачивается на поверхность. Через свои основные
производное, серная кислота, сера считается одним из наиболее важных
элементы, используемые в качестве промышленного сырья. Это имеет первостепенное значение
во все отрасли мировых промышленных комплексов и комплексов удобрений.Производство серной кислоты является основным конечным потребителем серы, и ее потребление
серной кислоты считается одним из лучших показателей
индустриальное развитие страны. Больше серной кислоты производится в
США каждый год, чем любое другое химическое вещество. Это имеет первостепенное значение
во все отрасли мировых промышленных комплексов и комплексов удобрений.Производство серной кислоты является основным конечным потребителем серы, и ее потребление
серной кислоты считается одним из лучших показателей
индустриальное развитие страны. Больше серной кислоты производится в
США каждый год, чем любое другое химическое вещество.Отличительные цвета вулканической луны Юпитера Ио взяты из различные формы мультина, твердой и газообразной серы. Есть также темная область возле лунного кратера Аристарх, которая может быть серой депозит.Сера также присутствует во многих типах метеоритов. Многие из неприятных запахов органических веществ основаны на серосодержащих веществах. такие соединения, как сероводород, имеющий характерный запах тухлых яиц. Растворенный в воде сероводород является кислым (pK a1 = 7,00, pK a2 = 12,92) и будет реагировать с металлами с образованием серия сульфидов металлов. Встречаются природные сульфиды металлов, особенно
те из железа.Сульфиды железа называются железным колчеданом, так называемым железным колчеданом. золото дураков . Интересно, что пириты могут показывать полупроводниковые
свойства. [1] Галенит, сульфид свинца природного происхождения (как
детектор в выпрямителе «кошачий волос») был конечно оригинальным полупроводником
обнаруженный. Встречаются природные сульфиды металлов, особенно
те из железа.Сульфиды железа называются железным колчеданом, так называемым железным колчеданом. золото дураков . Интересно, что пириты могут показывать полупроводниковые
свойства. [1] Галенит, сульфид свинца природного происхождения (как
детектор в выпрямителе «кошачий волос») был конечно оригинальным полупроводником
обнаруженный.Полимерный нитрид серы имеет металлические свойства, даже если он не содержит атомов металлов. Это соединение также имеет необычный электрические и оптические свойства.Аморфная или «пластичная» сера производится путем быстрого охлаждения кристаллической серы. Рентгеновские исследования показывают, что аморфная форма может иметь восемь атомов на спираль. структура К другим важным соединениям серы относятся:
Когда осаждаются сульфидные минералы, изотопное уравновешивание между твердыми частицами и жидкостью может вызвать небольшие различия в DS-34 ценности когенетических минералов.Различия между минералами может использоваться для оценки температуры уравновешивания. DC-13 и dS-34 сосуществующих карбонатов и сульфидов можно использовать для определить pH и летучесть кислорода рудоносного флюида во время рудное образование. В большинстве лесных экосистем сульфаты получают в основном из атмосферы;
выветривание рудных минералов и эвапоритов также вносит свой вклад
сера.  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 \(5\). Бром
\(5\). Бром — М.: Наука, 1969. 455 с.
— М.: Наука, 1969. 455 с. При этом методе качество конечной продукции является наилучшим. Основные заводы производства находятся в Германии и Италии.
При этом методе качество конечной продукции является наилучшим. Основные заводы производства находятся в Германии и Италии. Физические свойства серы следующие:
Физические свойства серы следующие: Вязкость уменьшается выше 190 ° C, и при 300 ° C сера снова становится текучей жидкостью
Вязкость уменьшается выше 190 ° C, и при 300 ° C сера снова становится текучей жидкостью
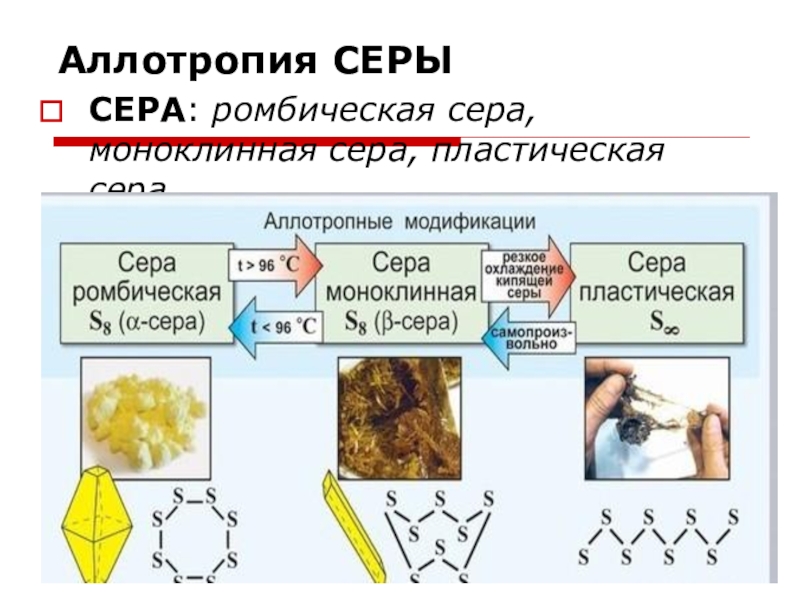
 Другими словами, олово и свинец в Группе
4A может образовывать 4+ или 2+ зарядов, а висмут в группе 5A может образовывать заряды 4+ или 2+.
формируют заряд 5+ или 3+.
Другими словами, олово и свинец в Группе
4A может образовывать 4+ или 2+ зарядов, а висмут в группе 5A может образовывать заряды 4+ или 2+.
формируют заряд 5+ или 3+. 065 а.е.м.
065 а.е.м. 36 К (239,38 F)
36 К (239,38 F) 0 E-22 10 6 / м Ом
0 E-22 10 6 / м Ом


 Это серные эквиваленты эфиров.
Это серные эквиваленты эфиров. Сера с характерным изотопным составом была
использовался для определения источников загрязнения, а обогащенная сера была
добавлен как индикатор в гидологических исследованиях. Отличия в натуральном
изобилие также можно использовать в системах, где имеется достаточное количество
вариация в составе С-34 компонентов экосистемы. Озера Скалистых гор
считается, что в них преобладают атмосферные источники сульфата.
Было обнаружено, что значения dS-34 отличаются от значений в озерах, где, как считается, преобладают
водораздельными источниками сульфатов.
Сера с характерным изотопным составом была
использовался для определения источников загрязнения, а обогащенная сера была
добавлен как индикатор в гидологических исследованиях. Отличия в натуральном
изобилие также можно использовать в системах, где имеется достаточное количество
вариация в составе С-34 компонентов экосистемы. Озера Скалистых гор
считается, что в них преобладают атмосферные источники сульфата.
Было обнаружено, что значения dS-34 отличаются от значений в озерах, где, как считается, преобладают
водораздельными источниками сульфатов.