Реакции ионного обмена и условия их протекания
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
Примеры:
AgNO3 + HCl = AgCl + HNO3
+ HNO3
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2 + H2O
+ H2O
Реакция протекает до конца, так как образуется углекислый газ
II. РИО, идущие с образованием осадка
Посмотрите видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Запишем реакцию: CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
Правила написания уравнений реакций в ионном виде
Интерактивное объяснение алгоритма
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. Помните!
|
На ионы диссоциируют |
|
|
Реагенты (исходные вещества) |
Продукты реакции |
|
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания (включая Ca(OH)2 – M) |
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду: H2CO3 ↔ H2O + CO2↑ H2SO3 ↔ H2O + SO2↑ NH4OH↔ H2O + NH3↑ H2S↑ (сероводород сам выделяется в виде газа) |
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
|
1) Записываем уравнение РИО в молекулярном виде:
|
Взаимодействие сульфата меди (II) и гидроксида натрия: CuSO |
|
2) Используя ТР указываем растворимость веществ воде: — Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓ — Если продукт является газом, справа от химической формулы ставим знак ↑ |
Р Р Р Н CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Молекулярный вид |
|
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ |
Cu2+ + SO42- + 2Na+ + 2OH— = 2Na+ + 2SO4 + Cu(OH)2↓ Полный ионный вид |
|
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции. Помните! РИО необратима и практически осуществима, если в продуктах образуются: газ, вода, осадок |
Cu2+ + 2OH+ = Cu(OH)2↓ Краткий ионный вид Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓ |
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
б) Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl— = 3BaSO4↓ + 2Al3+ + 6Cl—
в) Cокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 (н) + H3PO4 (р) = FePO4↓ + 3H2O
б) Полное ионное уравнение реакции:
Fe(OH)3 + 3H+ + PO43- = FePO4↓ + 3H2O.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
III. РИО, идущие с образованием газа
Посмотрите опыт: “Реакции ионного обмена, идущие с выделением газа»
Na2CO3 + 2HСl = 2NaCl + H2O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + CO2↑ + H2O + 2Cl—
Cокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S↑
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S↑
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2↓ + 3H2O + 3CO2↑
Полное ионное уравнение реакции:
3СaCO3 + 6H+ + 2 РO43- = Са3(PO4)2↓ + 3H2O + 3CO2↑
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
IV. РИО, идущие с образованием малодиссоциирующего веществаПосмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + H2O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3— = Ca
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 (н) + 2H3PO4 (р) = Mg3(PO4)2↓ + 6H2O (мд)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6H2O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
Решение
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
KOH + NH4Cl = KCl + NH4OH
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
KOH (p) + NH4Cl (p) = KCl (p) + NH3 ↑+ H2O
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K+ + OH— + NH4+ + Cl— = K+ + Cl— + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
OH— + NH4+ = NH3 ↑+ H2O
— Делаем вывод:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Задание №2. Дана схема: 2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
Решение
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H+и CO32-.
Например, кислота — H3PO4 (p) и соль -K2CO3 (p).
— Составляем молекулярное уравнение РИО:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3H2CO3 (p)
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3H2O
— Составляем полное ионное уравнение РИО:
6H+ +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
6H+ +3CO32- = 3CO2 ↑ + 3H2O
Сокращаем коэффициенты на три и получаем:
2H+ +CO32- = CO2 ↑ + H2O
— Делаем вывод:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
Решение
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3Na2O + 6H+ + 2PO43- -> 6Na+ + 2PO43- + 3H2O
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H+ -> 6Na+ + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H+ -> 2Na+ + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
“Взаимодействие карбоната натрия с серной кислотой”
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 ->
K2S + H3PO4 ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
“Осаждение сульфата бария”
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S ->
K2SO3 + HCl ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
VII. Тренажеры
Тренажер №1: «Реакции ионного обмена»
Интерактивное задание LearningApps.org по теме: “Реакции между ионами”
ЦОРы
Видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Видео-опыт: “Реакции ионного обмена, идущие с выделением газа»
Видео-опыт: “Реакция нейтрализации”
Презентация по теме Ионные уравнения 9 класс
Инфоурок › Химия ›Презентации›Презентация по теме Ионные уравнения 9 класс
Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Описание слайда:Реакции ионного обмена и условия их протекания.
2 слайд Описание слайда:
Описание слайда:Выберите из перечня веществ электролиты и запишите уравнения диссоциации этих веществ: хлорид магния, сульфат бария, гидроксид калия, кремниевая кислота, карбонат калия, гидроксид меди (II), оксид алюминия, сульфат алюминия, гидроксид бария, соляная кислота.
3 слайд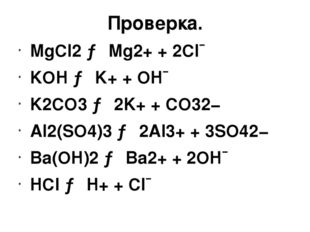 Описание слайда:
Описание слайда:Проверка. MgCl2 → Mg2+ + 2Cl¯ KOH → K+ + OH¯ K2CO3 → 2K+ + CO32− Al2(SO4)3 → 2Al3+ + 3SO42− Ba(OH)2 → Ba2+ + 2OH¯ HCl → H+ + Cl¯
4 слайд Описание слайда:
Описание слайда:Найдите среди предложенных реакций реакции обмена K2CO3 + h3SO4 → K2SO4 + h3O + CO2 Mg + 2HCl → MgCl2 + h3 Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4 NaOH + HCl → NaCl + h3O MgO + SO3 → MgSO4
5 слайд Описание слайда:
Описание слайда:Киc-ло-ты Ос-но-ва-ния
6 слайд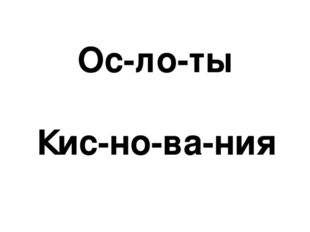 Описание слайда:
Описание слайда:Ос-ло-ты Киc-но-ва-ния
7 слайд Описание слайда:
Описание слайда:Правила техники безопасности: 1. Пользуемся малым количеством реактивов, стараемся их не проливать, чтоб вещества не попадали на кожу лица и рук. 2. Ничего не пробовать на вкус, нюхать летучие вещества с осторожностью. 3. Содержать рабочее место в чистоте и порядке.
8 слайд Описание слайда:
Описание слайда:Реакции между ионами называют ионными реакциями, а уравнения таких реакций – ионными уравнениями.
9 слайд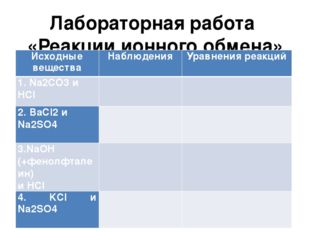 Описание слайда:
Описание слайда:Лабораторная работа «Реакции ионного обмена» Исходные вещества Наблюдения Уравнения реакций 1. Na2CO3иHCl 2. BaCl2иNa2SO4 3.NaOH (+фенолфталеин) иHCl 4. KClиNa2SO4
10 слайд Описание слайда:
Описание слайда:Лабораторная работа «Реакции ионного обмена» Исходные вещества Наблюдения Уравнения реакций 1. Na2CO3иHCl выделяется газ 2. BaCl2иNa2SO4 выпадает белый осадок 3.NaOH (+фенолфталеин) иHCl обесцвечивание раствора 4. KClиNa2SO4 признаков не наблюдается
11 слайд Описание слайда:
Описание слайда:Реакцию взаимодействия сильной кислоты с щелочью называют реакцией нейтрализации.
12 слайд Описание слайда:
Описание слайда:При составлении ионных уравнений руководствуются тем, что: Вещества малорастворимые и нерастворимые, газообразные записывают в молекулярном виде. Вещество, выпавшее в осадок, обозначают — ↓, а газ — ↑. 3.Ионные уравнения бывают полными и сокращенными.
13 слайд Описание слайда:
Описание слайда:Установите соответствие между реагентами и краткими ионными уравнениями реакций между ними.
14 слайд Описание слайда:
Описание слайда:Проверка задания: А-1, Б-1, В-4, Г-3
15 слайд Описание слайда:
Описание слайда:Колдунья с вороном отравили лечебный колодец, в котором был раствор хлористого кальция, который помогал целому городу. Он использовался горожанами при отравлениях, кровотечениях, аллергиях. Они превратили раствор СaCl2 в нерастворимый известняк CaCO3. Помогите жителям “расколдовать” колодец, если в вашем распоряжении есть растворы NaCl, Na2CO3, HCl, h3SO4, Zn(NO3)2.
16 слайд Описание слайда:
Описание слайда:Проверка задания: СаСО3 + 2HCl → CaCl2 + h3O + CO2 ↑
17 слайд Описание слайда:
Описание слайда:Олененок спешит к друзьям. Он шел долгих 3 дня. Ему осталось только перейти реку, но река оказалась испорчена – она наполнена раствором серной кислоты. Помогите Олененку воссоединиться с друзьями, если в вашем распоряжении есть растворы NaCl, Ba(OH)2 HCl, CuSO4, Ba(NO3)2
18 слайд Описание слайда:
Описание слайда:Проверка задания: h3SO4 + Ba(OH)2 → BaSO4 ↑ + 2h3O
19 слайд Описание слайда:
Описание слайда:В сточных водах животноводческих ферм отмечено повышенное содержание катионов Са2+ и Zn2+ . Предложите реактивы, с помощью которых можно очистить воду от этих ионов. Домашнее задание: §9. Решить задачу:
20 слайд Описание слайда:
Описание слайда:Саша и Алеша делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили чернила. Помогите ученикам восстановить запись. Составьте к восстановленным уравнениям полные и сокращенные ионные уравнения

Курс профессиональной переподготовки
Учитель химии

Курс повышения квалификации

Курс профессиональной переподготовки
Учитель биологии и химии
Найдите материал к любому уроку,
указав свой предмет (категорию), класс, учебник и тему:
Выберите категорию: Все категорииАлгебраАнглийский языкАстрономияБиологияВнеурочная деятельностьВсеобщая историяГеографияГеометрияДиректору, завучуДоп. образованиеДошкольное образованиеЕстествознаниеИЗО, МХКИностранные языкиИнформатикаИстория РоссииКлассному руководителюКоррекционное обучениеЛитератураЛитературное чтениеЛогопедия, ДефектологияМатематикаМузыкаНачальные классыНемецкий языкОБЖОбществознаниеОкружающий мирПриродоведениеРелигиоведениеРодная литератураРодной языкРусский языкСоциальному педагогуТехнологияУкраинский языкФизикаФизическая культураФилософияФранцузский языкХимияЧерчениеШкольному психологуЭкологияДругое
Выберите класс: Все классыДошкольники1 класс2 класс3 класс4 класс5 класс6 класс7 класс8 класс9 класс10 класс11 класс
Выберите учебник: Все учебники
Выберите тему: Все темы
также Вы можете выбрать тип материала:

Общая информация
Номер материала: ДБ-952844
Похожие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
Урок химии в 9 классе «Реакции ионного обмена и условия их протекания»
Урок 4. Реакции ионного обмена и условия их протекания»
Учитель химии Ранжурова М.В.
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
Примеры:
AgNO3 + HCl = AgCl + HNO3
+ HNO3
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2 + H2O
+ H2O
Реакция протекает до конца, так как образуется углекислый газ
II. РИО, идущие с образованием осадка
Посмотрите видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Запишем реакцию: CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
Правила написания уравнений реакций в ионном виде
Интерактивное объяснение алгоритма
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. Помните!
Растворимые (P) в воде (см. ТР):1. Соли
2. Кислоты
3. Основания
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
1. Соли
2. Кислоты
3. Основания
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
NH4OH↔ H2O + NH3↑
H2S↑ (сероводородсамвыделяетсяввидегаза)
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
Р Р Р Н
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
Молекулярный вид
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ
Cu2+ + SO42- + 2Na+ + 2OH— = 2Na+ + 2SO4 + Cu(OH)2↓
Полный ионный вид
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
газ, вода, осадок
Cu2+ + 2OH+ = Cu(OH)2↓
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
б) Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl— = 3BaSO4↓ + 2Al3+ + 6Cl—
в) Cокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 (н) + H3PO4 (р) = FePO4↓ + 3H2O
б) Полное ионное уравнение реакции:
Fe(OH)3 + 3H+ + PO43- = FePO4↓ + 3H2O.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
III. РИО, идущие с образованием газа
Посмотрите опыт: “Реакции ионного обмена, идущие с выделением газа»
Na2CO3 + 2HСl = 2NaCl + H2O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + CO2↑ + H2O + 2Cl—
Cокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S↑
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S↑
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2↓ + 3H2O + 3CO2↑
Полное ионное уравнение реакции:
3СaCO3 + 6H+ + 2 РO43- = Са3(PO4)2↓ + 3H2O + 3CO2↑
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
IV. РИО, идущие с образованием малодиссоциирующего вещества
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + H2O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3— = Ca2+ + 2NO3— + H2O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 (н) + 2H3PO4 (р) = Mg3(PO4)2↓ + 6H2O (мд)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6H2O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
Решение
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
KOH + NH4Cl = KCl + NH4OH
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
KOH (p) + NH4Cl (p) = KCl (p) + NH3 ↑+ H2O
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K+ + OH— + NH4+ + Cl— = K+ + Cl— + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
OH— + NH4+ = NH3 ↑+ H2O
— Делаем вывод:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) ималодиссоциирующеевеществовода (H2O).
Задание №2. Дана схема: 2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
Решение
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H+и CO32-.
Например, кислота — H3PO4 (p) и соль -K2CO3 (p).
— Составляем молекулярное уравнение РИО:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3H2CO3 (p)
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑иводу H2O, уравнение примет окончательный вид:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3H2O
— Составляем полное ионное уравнение РИО:
6H+ +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
6H+ +3CO32- = 3CO2 ↑ + 3H2O
Сокращаем коэффициенты на три и получаем:
2H+ +CO32- = CO2 ↑ + H2O
— Делаем вывод:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
Решение
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3Na2O + 6H+ + 2PO43- -> 6Na+ + 2PO43— + 3H2O
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H+ -> 6Na+ + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H+ -> 2Na+ + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
“Взаимодействие карбоната натрия с серной кислотой”
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 ->
K2S + H3PO4 ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
“Осаждение сульфата бария”
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S ->
K2SO3 + HCl ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
VII. Тренажеры
Тренажер №1: «Реакции ионного обмена»
Интерактивное задание LearningApps.org по теме: “Реакции между ионами”
ЦОРы
Видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Видео-опыт: “Реакции ионного обмена, идущие с выделением газа»
Видео-опыт: “Реакция нейтрализации”
Конспект урока по химии в 9 классе по теме «Ионные уравнения реакций».
Конспект урока по химии в 9 классе по теме «Ионные уравнения реакций».
Цели урока:
Научить школьников составлять ионные уравнения реакций
Рассмотреть условия протекания реакций ионного обмена до конца
Продолжать совершенствовать умения и навыки, выполняя химические опыты
Формы, методы и педагогические приемы, используемые на уроке:
Рассказ учителя с элементами беседы
Предварительная проверка знаний учащихся – химический диктант
Лабораторный эксперимент
Самостоятельная работа учащихся с учебником
Интерактивный элемент урока – компьютерная презентация
Ход урока:
1. Организационный момент.
2. Предварительная проверка знаний учащихся – работа по вариантам (задания проецируются на экран). Время выполнения работы – около 6 минут.
1 вариант
2 вариант
3 вариант
1.Разделите перечисленные ниже вещества на два столбика – электролиты и неэлектролиты.
Хлорид натрия (крист.)
Хлорид натрия (раствор)
Сахар (раствор)
Сульфат натрия (раствор)
Гидроксид калия (крист.)
Раствор соляной кислоты
Спирт
Кристаллы сульфата цинка
Раствор гидроксида натрия
Вода дистиллированная
Раствор гидроксида калия
Твердый гидроксид калия
Кристаллы сахара
Раствор серной кислоты
Бензин
2. Составьте уравнения диссоциации перечисленных ниже веществ; назовите полученные ионы.
KOH; H2SO4; Na2CO3
NaOH; H3PO4; BaCl2
Al(NO3)3; Ba(OH)2; HCl
3. Пользуясь таблицей растворимости, определите вещества, которые могут образовать перечисленные ниже ионы.
K+ , Sr2+ , H+ ,Cl— , CO32- , NO3—
H+ , Na+ , Cu2+ , SO42- , I— , OH—
Al3+ , Ca2+ , Li+ , OH— , NO2- , F—
3. Рассказ учителя.
Ребята! Вы уже знакомы с реакциями обмена. Вам также известно, что данные реакции возможны лишь в тех случаях, если в результате реакции выделяется осадок или газ или вода.
До изучения теории электролитической диссоциации реакции обмена рассматривались как взаимодействие кислот, оснований и солей. Теперь вам известно, что в расворах этих веществ молекул практически нет, а есть ионы водорода, гидроксид-ионы, ионы металлов и кислотных остатков. Отсюда следует вывод, что реакции между растворами этих веществ сводятся к взаимодействию ионов.
Найдите в учебнике определение ионных реакций и запишите его в тетрадях. (Затем один из учащихся читает это определение).
Сейчас я сформулирую основные правила составления ионных уравнений реакций:
Формулы веществ малодиссоциирующих, т.е. слабых электролитов, нерастворимых и газообразных веществ записываются в молекулярном виде
Вещество, выпавшее в осадок, обозначают ↓ и ставят ее справа возле формулы; газ — ↑.
Ионные уравнения могут быть полными и сокращенными.
Рассмотрим пример: взаимодействие сульфата натрия и хлорида бария.
1. Составим молекулярное уравнение:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Проверим полученные вещества по таблице растворимости. Вещество BaSO4 — осадок, обозначим его ↓.
2. Составим полное ионное уравнение, которое складывается из схем диссоциации каждого вещества:
2Na+ + SO42- + Ba2+ + 2Cl— = BaSO4↓ + 2Na+ + 2Cl—
3. В полном ионном уравнении есть ионы, не изменившие своего состояния; их нужно зачеркнуть.
4. Исключив эти ионы из уравнения реакции, мы получим сокращенное ионное уравнение:
Ba2+ + SO42- = BaSO4↓
Сущность данной реакции сводится к взаимодействию ионов Ba2+ и SO42- ; в результате этого взаимодействия образуется осадок BaSO4.
Данные ионы могли входить в состав любого электролита и наблюдалась бы аналогичная реакция.
Задание. По таблице растворимости выберите любые другие электролиты, содержащие ионы Ba2+ и SO42- .
Вывод (по заданию): можно взять любой растворимый сульфат и любую растворимую соль бария (или его гидроксид).
Таким образом, сокращенные ионные уравнения показывают сущность процесса, протекающего между растворами электролитов.
4. Химический эксперимент – практические задачи.
Учащимся раздаются карточки-инструкции и они начинают по ним работать, выполняя задания.
Что делали
Что наблюдали
Уравнения реакций
Проведите реакции между парами веществ
1.сульфат меди (II) и гидроксид натрия
2.карбонат натрия и соляная кислота
3. соляная кислота и гидроксид калия (в присутствии индикатора)
Проводя реакцию, ребята записывают наблюдения и составляют уравнения реакций в молекулярной, полной и сокращенной ионной форме.
Затем трое учащихся записывают эти уравнения реакций на доске (осуществляется проверка правильности составления уравнений, а наблюдения просто озвучиваются).
Для того, чтобы проверить степень усвоения данного материала, на следующем уроке я провела такую работу:
Каждый учащийся класса получил карточку с заданиями как теоретическими, так и практическими.
Пример карточки:
№1.
Закончить уравнение реакции:
K2CO3 + H2SO4 ->
Запишите реакцию в полной и сокращенной ионной форме.
Из имеющихся на демонстрационном столе реактивов выберите пару веществ, при взаимодействии которых образуется осадок. Проведите реакцию и запишите ее в молекулярной, полной и сокращенной ионной форме.
№2.
Закончить уравнение реакции:
FeCl3 + NaOH ->
Запишите реакцию в полной и сокращенной ионной форме.
Из имеющихся на демонстрационном столе реактивов выберите пару веществ, при взаимодействии которых образуется газ. Проведите реакцию и запишите ее в молекулярной, полной и сокращенной ионной форме.
Страница не найдена | Футхилл Колледж
Мы поможем вам найти то, что вам нужно
Пришли на эту страницу после поиска в Google?
|
| Также попробуйте выполнить следующие действия. |
Рекомендации по поисковой навигации
Важное примечание о результатах поиска
Если неработающая ссылка включает .php:
- Наш старый веб-сайт использовал расширение.php расширение файла
- На нашем новом сайте используется .html
- Если в результате поиска по вашим ключевым словам вы увидите вторичный вариант для .html , сначала попробуйте .html.
- Некоторые из наших страниц все еще используют старый .php до тех пор, пока они не будут перенесены на новый сайт.
Благодарим вас за терпение!
Сообщить о неработающей ссылке
Помогите нам исправить неработающую ссылку и получить необходимую информацию!
Электронная почта [email protected] и [email protected].
Укажите :
- URL-адрес (веб-адрес) отсутствующей веб-страницы.
- Электронное сообщение, в котором была неработающая ссылка, и от кого она была (если применимо).
- URL-адрес (веб-адрес) поврежденной страницы был связан с и (если применимо).
Большое спасибо за терпение и помощь.
Поделитесь своим мнением
Если у вас есть минутка, мы хотели бы услышать, что вы думаете о нашем сайте!
Электронная почта creamerbradley @ fhda.edu и [email protected].
,чистых ионных уравнений | Молекулярный
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 11-12
- КОНКУРСНЫЙ ЭКЗАМЕН
- BNAT 000 NC
- 000 NC Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- NCERT 9000 9000
- NCERT Exemplar Class
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- 000 NC Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0004
- 000300030004
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- BNAT 000 NC
- 000
- 000
- 000
- 000
- 000
- 000 Microology
- 000
- 000 Microology
- 000 BIOG3000
- FORMULAS
- Математические формулы
- Алгебраические формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 0003000 PBS4000
- 000300030002 Примеры калькуляторов химии Класс 6
- Образцы бумаги CBSE для класса 7
- Образцы бумаги CBSE для класса 8
- Образцы бумаги CBSE для класса 9
- Образцы бумаги CBSE для класса 10
- Образцы бумаги CBSE для класса 11
- Образцы бумаги CBSE чел. для класса 12
- Классы
- CBSE — вопросник за предыдущий год
- CBSE — вопросник за предыдущий год, класс 10
- CBSE — за предыдущий год — вопросник, класс 12
- HC Verma Solutions
- HC Verma Solutions Class 11 Physics
- Решения HC Verma, класс 12, физика
- Решения Лахмира Сингха
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- Заметки CBSE
- , класс
- CBSE Notes
- Примечания CBSE класса 7
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания CBSE класса 12
- Примечания к редакции
- CBSE
- Примечания к редакции класса 10 CBSE