Атомно-молекулярное учение — Википедия
Атомно-молекулярное учение — совокупность теоретических представлений естествознания о дискретном строении веществ.
В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров и многие другие.
Античная атомистика[править | править код]
Представление о том, что материя состоит из отдельных частиц — атомов возникло ещё в древней Греции в V в. до н. э. Атомизм был создан представителями древнегреческой философии Левкиппом (500—440 до н. э.) и его учеником Демокритом (460—370 до н. э.).
Левкипп задался вопросом, можно ли каждую частичку материи, какая бы малая она ни была, разделить на еще более мелкие частицы. Левкипп считал, что в результате такого деления можно получить настолько малую частицу, что дальнейшее деление станет невозможным.
Ученик Левкиппа философ Демокрит назвал эти крошечные частицы «атомами» (атомос-неделимый). Он считал, что атомы каждого элемента имеют особые размеры и форму и что именно этим объясняются различия в свойствах веществ. Вещества, которые мы видим и ощущаем, образуется при соединение между собой атомов различных элементов, и, изменив природу этого соединения, можно одно вещество превратить в другое.
Левкипп, Демокрит и Эпикур, полагали, что твердость материала соответствовала форме атомов, из которых он состоит. Таким образом, атомы железа являются твердыми и прочными с крючками, которые фиксируют их в твердом теле, атомы воды гладкие и скользкие, атомы соли, из-за их вкуса, острые и заостренные и атомы воздуха являются легкими и вращающимися, проникая во все другие материалы. Именно Демокрит был главным сторонником этой точки зрения. Используя аналогии, основанные на чувственном опыте, он описывал атомы различных веществ, как отличными друг от друга по форме, размеру и расположению их частей. Кроме того, связи объяснялись материальными связями, в которых отдельные атомы снабжались насадками: некоторые с крючками и ушками, другие с шариками и гнездами.

Другим воплощением идеи дискретности стали теории Эмпедокла, Платона и Аристотеля об элементах-качествах, однако, они составляли отдельное направление развития представления о веществе и его составе, создав тем самым основу алхимических представлений о трасмутации веществ.
Становление атомистической гипотезы в XVII—XVIII веках[править | править код]
XVII век[править | править код]
С ростом влияния схоластики и упадка Римской империи атомная теория была отвергнута на многие века в пользу различных четырехэлементных теорий и более поздних алхимических теорий. Однако, в 17 веке исследователи вновь вернулись к атомной теории, прежде всего благодаря работам Пьерра Гассенди и Исаака Ньютона. Среди других ученых того времени П. Гассенди глубоко изучил древнюю историю, написал основные труды о натурфилософии Эпикура и стал пропагандистом его идеи. Он рассуждал, что для учета размеров и формы атомов, движущихся в пустоте, могут быть учтены и свойства самого вещества. Тепло было связано с маленькими круглыми атомами, а холод – с пирамидальными атомами с острыми концами, что объясняло ощущение уколов от сильного холода, а твердые тела удерживались вместе переплетающимися крючками.
Ньютон, хотя и признавал различные теории присоединения атомов, находившиеся в то время в моде, т. е. теорию «зацепленных атомов», «склеенных атомов» (тела в состоянии покоя) и теорию «слипания посредством согласованных движений», скорее всего, полагал, как это хорошо сказано в его «Оптике» 1704 года, что частицы притягиваются друг к другу некоторой силой, которая «в непосредственном контакте чрезвычайно сильна, на малых расстояниях выполняет химические взаимодействия и действует на частицы с любым ощутимым эффектом.»
Однако, более конкретно, концепция агрегатов или единиц связанных атомов, то есть «молекул», как сказали бы сегодня, берет свое начало от гипотезы Роберта Бойля 1661 года, в его знаменитом трактате «The Sceptical Chymist», что материя состоит из скоплений частиц (кластеров), и что химические изменения являются результатом перестройки этих кластеров. Р. Бойль утверждал, что основные элементы материи состоят из частиц различного типа и размера, называемых «корпускулами», которые способны организовываться в группы.
В 1680 году французский химик Николя Лемери, взяв за основу корпускулярную теорию, установил, что кислотность любого вещества состоит в его заостренных частицах, а щелочи наделены порами различных размеров. Молекула, согласно этой точке зрения, состояла из корпускул, Объединенных геометрическим соединением точек и пор.
XVIII век[править | править код]
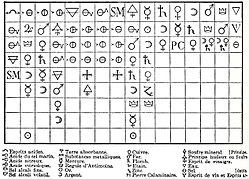 Таблица сродства Этьена Франсуа Жоффруа 1718 года: во главе колонки (столбца) находится вещество, с которым могут сочетаться все перечисленные ниже вещества.
Таблица сродства Этьена Франсуа Жоффруа 1718 года: во главе колонки (столбца) находится вещество, с которым могут сочетаться все перечисленные ниже вещества.Ранним предшественником идеи связанных «комбинаций атомов» была теория «объединения через химическое сродство». Например, в 1718 году, основываясь на концепции Бойля о комбинациях кластеров, французский химик Этьен Франсуа Жоффруа разработал теорию химического сродства для объяснения комбинаций частиц, полагая, что определенная алхимическая «сила» притягивает определенные алхимические компоненты. Имя Жоффруа наиболее известно в связи с его таблицами «сродства» (tables des rapports), которые он представил Французской академии в 1718-1720 годах. Это были списки, составленные путем сопоставления наблюдений за действием веществ друг на друга, показывающие различные степени сродства, проявляемые аналогичными телами для различных реагентов. Эти таблицы сохраняли свою актуальность до конца столетия, пока не были вытеснены более глубокими концепциями, введенными Клодом Бертолле.
Атомистическая гипотеза в XIX веке[править | править код]
Атомистическая теория Дальтона[править | править код]
Перечень символов химических элементов и их атомных весов Дж. Дальтона (1808)Создание научной теории стало возможно только в XVIII-XIX веках, когда физика и химия стали базироваться на точных экспериментальных данных.
Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений (1803). Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. В 1808 году Дальтон изложил свою атомистическую гипотезу в труде «Новая система химической философии».
Основные положения теории Дальтона состояли в следующем (в основе атомно-молекулярного учения лежит принцип дискретности (прерывности строения) веществ)[1]:
- Всякое вещество не является чем-то сплошным, а состоит из отдельных очень малых частиц — все вещества состоят из большого числа атомов (простых или сложных).
- Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
- Частицы (атомы) различных веществ различны — как по массе, так и по свойствам
- Атомы различных элементов способны соединяться между собой в определённых соотношениях.
- Важнейшим свойством атомов является атомный вес.
Уже в 1803 году в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений (атомный вес водорода был принят равным единице). Дальтон ввёл символы химических элементов в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения.
Работы А. Авогадро[править | править код]
Амедео Авогадро предложил новое слово «молекула». Согласно «Краткой историей химии» Партингтона, в своей статье 1811 года «Эссе по определению относительных масс элементарных тел молекул» он, по сути, утверждает:
 | Мельчайшие частицы газов не обязательно являются простыми атомами, но состоят из определенного числа этих атомов, соединенных притяжением, чтобы образовать единую молекулу. |  |
Обратите внимание, что эта цитата не является буквальным переводом. Авогадро использует название «молекула» как для атомов, так и для молекул. В частности, он использует название «элементарная молекула», когда ссылается на атомы, и для усложнения этого вопроса также говорит о «составных атомах» и «составных молекулах».
Во время своего пребывания в Верчелли Авогадро написал краткую записку (меморандум), в которой изложил гипотезу о том, что мы теперь называем законом Авогадро: равные объемы газов при одинаковой температуре и давлении содержат одинаковое число молекул. Этот закон подразумевает, что соотношение, возникающее между весами одинаковых объемов различных газов при одинаковых температуре и давлении, соответствует соотношению между соответствующими молекулярными весами. Следовательно, относительные молекулярные веса можно было теперь вычислить по массам образцов газа.
Авогадро разработал эту гипотезу, чтобы согласовать закон Дж. Л. Гей-Люссака 1808 года об объемах и сочетании газов с атомной теорией Дальтона 1803 года. Самая большая трудность, с которой Авогадро пришлось столкнуться, заключалась в огромной путанице в то время в отношении атомов и молекул. Одним из самых важных вкладов работы Авогадро было четкое разграничение одного от другого, допускающее, что простые вещества тоже могут состоять из молекул, состоящих из атомов. Дальтон же, напротив, не рассматривал такую возможность. Любопытно, что Авогадро рассматривает только молекулы, содержащие четное число атомов; он не говорит, почему нечетные числа опущены.
В 1826 году, опираясь на работу Авогадро, французский химик Жан-Батист Дюма утверждает:
 | Газы при одинаковых условиях состоят из молекул или атомов, расположенных на одинаковом расстоянии, что равносильно тому, что они содержат одинаковое их количество в одном и том же объеме. |  |
В соответствии с этими концепциями в 1833 году французский химик Марк Антуан Огюст Годен представил ясный отчет о гипотезе Авогадро относительно атомных весов, используя «объемные диаграммы», которые ясно показывают как полу-корректную молекулярную геометрию (линейная молекула воды), так и правильные молекулярные формулы, например, H
В двух работах, описывающих его «теорию атомности элементов» (1857-1858 гг.), Фридрих Август Кекуле был первым, кто предложил теорию того, как каждый атом в органической молекуле связан с каждым другим атомом. Он предположил, что атомы углерода в органических соединениях являются четырехвалентными и могут связываться друг с другом, образуя углеродные скелеты молекул.
Съезд химиков в Карлсруэ[править | править код]
С 3 по 5 сентября 1860 года состоялся Международный съезд химиков в Карлсруэ. Это была первая международная конференция, посвященная химии. Большое влияние на ход конгресса оказал итальянский химик Канниццаро. Он на основе закона Авогадро чётко разграничил понятия «атом», «молекула» и «эквивалент» и предложил рациональную систему атомной массы. Свою теорию он изложил в брошюре, которую лично раздал всем участникам конгресса. В своих выступлениях Канниццаро отстаивал закон Авогадро и систему Жерара и указывал на то, что возвращать химию к принципам Берцелиуса нецелесообразно. В целом конгресс положительно отнесся к идеям Канниццаро. Результатом съезда химиков в Карлсруэ стало утверждение атомно-молекулярного учения, были определены понятия атомного веса, а также молекулы и атома. Было установлено, что молекула — это наименьшее количество вещества, вступающее в реакции и определяющее физические свойства, а атом — наименьшее количество элемента, содержащееся в молекулах.
Работы химиков второй половине XIX века[править | править код]
В 1856 году шотландский химик Арчибальд Купер начал исследования по бромированию бензола в лаборатории Шарля Вюрца в Париже. Через месяц после выхода второй статьи Кекуле была опубликована независимая и в значительной степени идентичная теория молекулярного строения Купера. Он предложил очень конкретную идею молекулярной структуры, предположив, что атомы соединяются друг с другом подобно конструктору в определенных трехмерных конструкциях. Купер был первым, кто использовал линии между атомами, в сочетании со старым методом использования скобок, для представления связей, а также постулировал прямые цепочки атомов как структуры одних молекул, кольцеобразные молекулы других, таких как винная кислота и циануровая кислота. В более поздних публикациях связи Купера были представлены с помощью прямых пунктирных линий (хотя неизвестно, является ли это предпочтением наборщика), например, спирт или щавелевая кислота:
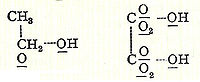 Молекулярные структуры Арчибальда Купера для спирта и щавелевой кислоты, использующие элементарные символы для атомов и линии для связей (1858).
Молекулярные структуры Арчибальда Купера для спирта и щавелевой кислоты, использующие элементарные символы для атомов и линии для связей (1858).В 1861 году неизвестный учитель Венской средней школы по имени Йозеф Иоганн Лошмидт опубликовал за свой счет брошюру под названием «Chemische Studien I», содержащую новаторские молекулярные изображения, которые показывали, как «кольцевые» структуры, так и структуры с двойной связью, такие как:
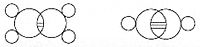 Изображения Й. И. Лошмидта молекул этилена h3C=Ch3 и ацетилена HC≡CH (1861).
Изображения Й. И. Лошмидта молекул этилена h3C=Ch3 и ацетилена HC≡CH (1861).Лошмидт также предложил возможную формулу бензола, но оставил этот вопрос открытым. Первое предложение о современной структуре бензола было сделано Августом Кекуле в 1865 году. Циклическая природа бензола была окончательно подтверждена кристаллографом Кэтлин Лонсдейл. Бензол представляет собой особую проблему в том смысле, что для учета всех связей необходимо наличие чередующихся двойных углеродных связей:
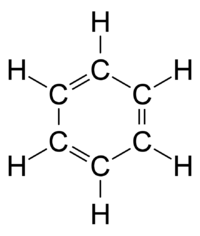 Молекула бензола с чередующимися двойными связями.
Молекула бензола с чередующимися двойными связями.В 1865 году немецкий химик Август Вильгельм фон Гофманн был первым, кто сделал шаростержневые модели молекул, которые он использовал в лекции в Королевском институте Великобритании, такие как метан:
 Модель молекулы метана CH4, созданная Гофманом в 1865 году.
Модель молекулы метана CH4, созданная Гофманом в 1865 году.В основу этой модели легло высказанное ранее в 1855 году его коллегой Уильямом Одлингом предположение о том, что углерод является четырехвалентным. Следует отметить, что цветовая схема Гофмана используется и по сей день: азот – синий, кислород – красный, хлор – зеленый, сера – желтый, водород – белый. Недостатки в модели Гофмана были в основном геометрическими: углеродные связи была показаны в одной плоскости, а не тетраэдрическими, и размеры атомов были непропорциональны, например, углерод был меньше по размеру, чем водород.
В 1864 году шотландский химик-органик Александр Крум Браун начал рисовать изображения молекул, в которых он заключил символы атомов в круги и использовал ломаные линии, чтобы соединить атомы вместе таким образом, чтобы удовлетворить валентность каждого атома. 1873 год, по многим отзывам, стал переломным моментом в истории развития понятия «молекула». В этом году известный шотландский физик Джеймс Клерк Максвелл опубликовал свою знаменитую статью «Молекулы» в сентябрьском номере журнала Nature. Во вступительном разделе к этой статье Максвелл ясно заявляет:
 | Атом — это тело, которое нельзя разрезать пополам; молекула — это наименьшая возможная часть определенного вещества. |  |
После разговора об атомной теории Демокрита Максвелл продолжает говорить нам, что слово «молекула» — это современное слово.
В 1874 году Якоб Хендрик Вант-Гофф и Джозеф Ахилл Ле Бель[en] независимо друг от друга предположили, что явление оптической активности можно объяснить, предположив, что химические связи между атомом углерода и его соседями направлены к углам правильного тетраэдра. Это привело к лучшему пониманию трехмерной природы молекул.
Эмиль Фишер разработал собственную методику проецирования трехмерной структуры молекул на плоскость:

В 1898 году Людвиг Больцман в своих лекциях по теории газа использовал теорию валентности для объяснения феномена молекулярной диссоциации газовой фазы и при этом нарисовал один из первых примитивных, но детальных рисунков перекрывания атомных орбиталей. Отмечая прежде всего известный факт, что пары молекулярного йода диссоциируют на атомы при более высоких температурах, Больцман утверждает, что мы должны объяснить существование молекул, состоящих из двух атомов, «двойного атома», как называет его Больцман, силой притяжения, действующей между двумя атомами. Больцман утверждает, что это химическое притяжение, вследствие определенных фактов химической валентности, должно быть связано с относительно небольшой областью на поверхности атома, называемой чувствительной областью.
Больцман утверждает, что эта «чувствительная область» будет лежать на поверхности атома или может частично находиться внутри атома и будет прочно связана с ним. В частности, он утверждает: «только когда два атома расположены так, что их чувствительные области соприкасаются или частично перекрываются, между ними будет существовать химическое притяжение. Затем мы говорим, что они химически связаны друг с другом.Эта картина подробно описана ниже, показывая α-чувствительную область атома А, перекрывающуюся с β-чувствительной областью атома B:
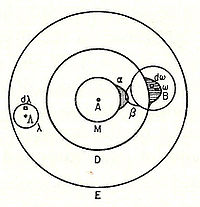 Схема Больцмана 1898 года молекулы I2, показывающая атомную «чувствительную область» (α, β) перекрывания.
Схема Больцмана 1898 года молекулы I2, показывающая атомную «чувствительную область» (α, β) перекрывания.В начале 20-го века американский химик Гильберт Ньютон Льюис, когда преподавал студентам Гарварда, чтобы представлять электроны вокруг атомов, стал символически изображать их точками. Его ученики отдавали предпочтение этим рисункам, что стимулировало его в этом направлении. Из этих лекций Льюис отметил, что элементы с определенным количеством электронов, по-видимому, обладают особой стабильностью. Этот феномен был отмечен немецким химиком Ричардом Абеггом[en] в 1904 году, на который Льюис ссылался как на «закон валентности Абега» (ныне широко известный как правило Абегга[en]). Льюису казалось, что как только вокруг ядра образуется ядро из восьми электронов, слой заполняется и начинается новый слой. Льюис также отметил, что различные ионы с восемью электронами также, по-видимому, обладают особой стабильностью. Исходя из этих взглядов, он предложил «правило восьми» или «правило октета»: ионы или атомы с заполненным слоем из восьми электронов обладают особой стабильностью.
Более того, заметив, что куб имеет восемь углов, Льюис представил себе атом как имеющий восемь сторон, доступных для электронов, подобно углу куба. Впоследствии, в 1902 году, он разработал концепцию, в которой кубические атомы могут соединяться на своих сторонах, образуя кубически структурированные молекулы.
Другими словами, электронно-парные связи образуются, когда два атома имеют общую границу, как в структуре С (ниже). Это приводит к разделению двух электронов. Аналогично, заряженные ионные связи образуются при переносе электрона из одного куба в другой, не разделяя ребра A. промежуточное состояние B, в котором разделяется только один угол, также было постулировано Льюисом.
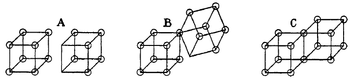 Кубические атомы Льюиса, образующие кубические молекулы
Кубические атомы Льюиса, образующие кубические молекулыСледовательно, двойные связи образуются при совместном использовании грани между двумя кубическими атомами. Это приводит к разделению четырех электронов.
В 1913 году, работая заведующим кафедрой химии в Калифорнийском университете в Беркли, Льюис прочитал предварительный набросок статьи английского аспиранта Альфреда Лаука Парсона[en], который посещал Беркли в течение года. В этой статье Парсон предположил, что электрон – это не просто электрический заряд, но и небольшой магнит (или «Магнетон», как он его называл), и более того, что химическая связь возникает в результате совместного использования двух электронов между двумя атомами. А уже это, согласно Льюису, означало, что связывание происходит, когда два электрона образуют общий край между двумя полными кубами.
Исходя из этих взглядов, в своей знаменитой статье 1916 года «Атом и молекула» Льюис ввел «структуру Льюиса» для представления атомов и молекул, где точки представляют электроны, а линии – ковалентные связи. В этой статье он разработал концепцию электронно-парной связи, в которой два атома могут делиться от одного до шести электронов, образуя таким образом единственную электронную связь, одинарную, двойную, или тройную связь
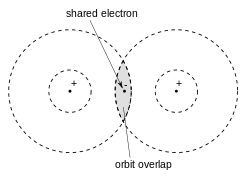 Иллюстрация химической связи по Льюису
Иллюстрация химической связи по ЛьюисуПо словам самого Льюиса:
 | Электрон может быть частью оболочки двух различных атомов, и нельзя сказать, что он принадлежит исключительно одному из них». |  |
Более того, он предположил, что атом имеет тенденцию образовывать ион, получая или теряя некоторое количество электронов, необходимых для завершения куба. Таким образом, структуры Льюиса показывают каждый атом в структуре молекулы, используя его химический символ. Линии рисуются между атомами, которые связаны друг с другом; иногда вместо линий используются пары точек. Избыточные электроны, образующие одиночные пары, представляются в виде пар точек и помещаются рядом с атомами, на которых они находятся:
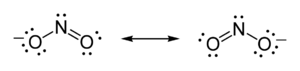 Точечные структуры Льюиса нитрит-иона
Точечные структуры Льюиса нитрит-ионаПодводя итог своим взглядам на новую модель связи, Льюис утверждает:
 | Два атома могут соответствовать «правилу восьми», или «правилу октета», не только путем переноса электронов от одного атома к другому, но и путем совместного использования одной или нескольких пар электронов… Два электрона, соединенные таким образом между двумя атомными центрами и удерживаемые вместе в оболочках двух атомов, я рассматривал как химическую связь. Таким образом, мы имеем конкретную картину этой физической сущности, того «крючка и глаза», который является частью убеждений химика-органика. |  |
На следующий год, в 1917 году, тогда ещё неизвестный американский инженер-химик по имени Лайнус Полинг изучал в Орегонском сельскохозяйственном колледже метод соединения «крючком и ушком» Дальтона, который в то время был актуальным описанием связей между атомами. Каждый атом имел определенное количество «крючков», которые позволяли ему прикрепляться к другим атомам, и определенное количество «ушек», которые позволяли другим атомам прикрепляться к нему. Химическая связь возникла, когда «крючок» и «ушко» соединились. Однако Л. Полинг не был удовлетворен этим архаичным методом и обратился за новым методом к недавно возникшей области знаний — квантовой физике.
В 1927 году немецкие физики Фриц Лондон и Вальтер Гайтлер применили методы квантовой механики для исследования насыщаемых, нединамических сил притяжения и отталкивания, т. е. их обработка валентной связи этой проблемы в их совместной работе была знаковой в том, что она привела химию к квантовой механике. Их работа оказала влияние на Л. Полинга, который только что получил докторскую степень и посетил В. Гайтлера и Ф. Лондона в Цюрихе на стипендии Гуггенгейма.
Впоследствии, в 1931 году, опираясь на работу В. Хайтлера и Ф. Лондона и на теории, найденные в знаменитой статье Г. Льюиса, Полинг опубликовал свою новаторскую статью «Природа химической связи», в которой он использовал квантовую механику для расчета свойств и структур молекул, таких как углы между связями и вращение вокруг связей. На основе этих концепций Л. Полинг разработал теорию гибридизации для учета связей в молекулах, таких как CH4, в которой четыре гибридизованные орбитали sp3 перекрываются орбиталями водорода 1s, образуя четыре σ-связи. Эти четыре связи имеют одинаковую длину и прочность, что дает молекулярную структуру, как показано ниже:
Схематическое представление гибридизованных орбиталей, перекрывающих орбитали атомов водородаБлагодаря этим уникальным теориям, Л. Полинг получил в 1954 году Нобелевскую премию по химии. Примечательно, что он был единственным человеком, который когда-либо выиграл две неразделенные Нобелевские премии, получив ещё Нобелевскую премию мира в 1963 году.
В 1926 году французский физик Жан Перрен получил Нобелевскую премию по физике за убедительное доказательство существования молекул. Он сделал это, вычислив число Авогадро с помощью трех различных методов, каждый из которых включали жидкофазные системы. Во-первых, он использовал мыльную эмульсию гиммигута, во-вторых, проводя экспериментальные работы по броуновскому движению, и в-третьих, подтверждая теорию Эйнштейна о вращении частиц в жидкой фазе.
Атомно-молекулярная теория базируется на следующих законах и утверждениях:
- Все вещества состоят из атомов
- Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
- При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
- При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
- Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции
- Закон постоянства состава (закон кратных отношений) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами
- Аллотропия — существование одного и того же химического элемента в виде нескольких простых веществ, различных по строению и свойствам.
Вытекающие законы и положения[править | править код]
Согласно современным квантово-механическим представлениям, у атомов в молекуле более или менее неизменным остается только остов, то есть ядро и внутренние электронные оболочки, тогда как характер движения внешних (валентных) электронов коренным образом изменяется так, что образуется новая (как бы отдельная), молекулярная электронная оболочка, охватывающая всю молекулу (см. Химическая связь). В этом смысле никаких неизменных атомов в молекулах нет.
Доказательство существования атомов и молекул[править | править код]
Теории Левкипп и Демокрита об атомах не была подтверждена экспериментально, поскольку древние греки вообще не проводили экспериментов, они ставили размышления выше наблюдений.
Первый эксперимент, подтверждающий атомную природу вещества, был проведен лишь спустя 2000 лет. В 1662 г. ирландский химик Роберт Бойль (1627—1691) при сжатии воздуха в U-образной трубке под давлением столбика ртути обнаружил, что объем воздуха в трубке обратно пропорционален давлению:
- pV=Const{\displaystyle pV=Const}
Французский физик Эдм Мариотт (1620—1684) подтвердил это соотношение через 14 лет после Бойля и заметил, что оно выполняется только при постоянной температуре.
Результаты, полученные Бойлем Мариоттом, можно объяснить, только если признать, что воздух состоит из атомов, между которыми имеется пустое пространство. Сжатие воздуха обусловлено сближением атомов и уменьшением объема пустого пространства.
- Начала химии / Н.Е.Кузьменко.: В.В.Еремин, В.А.Попков. — М.: Лаборатория знаний, 2016. — 704 с. — ISBN 978-5-906828-17-0.
Основные положения атомно-молекулярного учения — Справочник химика 21
Таким образом, основные положения атомно-молекулярного учения можно сформулировать следующим образом [c.17]Основные положения атомно-молекулярного учения [c.7]
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ 3. Основные положения атомно-молекулярного учения [c.8]
Основные положения атомно-молекулярного учения можно сформулировать так [c.7]
Основные положения атомно-молекулярного учения закономерно изменялись в процессе его исторического развития. [c.11]
ОСНОВНЫЕ ПОЛОЖЕНИЯ АТОМНО-МОЛЕКУЛЯРНОГО УЧЕНИЯ [c.12]
Основные положения атомно-молекулярного учения Ломоносова изложены в работе Элементы математической химии (1741 г.) этим учением пронизаны и многие другие его работы. [c.12]
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ водород, кислород, азот, хлор. А несколько позже газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения. [c.14]
Именно по такой схеме построена тема Первоначальные химические понятия после накопления фактов осуществляется обобщение, формулирование основных положений атомно-молекулярного учения, которое затем применяется в течение вводного курса. Наглядно это можно выразить схемой 3.2. При ее рассмотрении видно, как осторожно и последовательно формируются представления, как тесно связаны они между собой системой логических связей. По единому направлению стрелок можно заключить, что логическая последовательность введения понятий не нарушается. Возражение вызывает лишь место обобщающего урока. Основные положения атомно-молекулярного учения — это более широкое обобщение, чем типы химических реакций. Поэтому разумнее его провести в самом конце темы. [c.216]
В XVII—XVIII вв. атомизм приобрел механический характер. По сравнению с. предыдущим он был несколько более конкретным, но все же в большой мере оставался абстрактным н мало связанным с экспериментом. Выдающимися представителями здесь были Р. Бойль, который положил атомистику в основу своих химических представлений и объяснял асе химические превращения соединением и разъединением атомов М. В. Ломоносов, он сформулировал основные положения атомно-молекулярного учения. И. Ньютон объяснял взаимодействия атомов при помощи гравитационных сил с использованием атомно-молекулярного учения. [c.11]
В чем состоят основные положения атомно-молекулярного учения Каково их обоснование [c.29]
Основные положения атомно-молекулярного учения. М. В. Ломоносов как основоположник атомно-молекулярного учения. Атомный вес. Молекулярный вес. Грамм-атом, грамм-молекула. Закон сохранения массы веществ, открытый М. В. Ло.моносовым. Постоянство состава вещества. Объяснение основных законов химии с точки зрения атомномолекулярного учения. Закон Авогадро. Грамм-молекулярный объем газообразных веществ. [c.11]
Молекула каждого сложного вещества имеет постоянный атомный состав, т. е. всегда состоит из одних и тех же атомов различных элементов. Вес каждого атома, образующего моле] улу, тоже постоянен. Поэтому остается постоянным и весовое отношение между элементами, образующими сложное вещество. Таким образом, закон постоянства состава вещества может быть иыведен с помощью основных положений атомно-молекулярного учения. [c.25]
С созданием основных положений атомно-молекулярного учения в химии все чаще возникало стремление установить взаимосвязь между различными свойствами атомов и молекул. Если создание Дальтоном атомной теории привело к широкому изучению и экспериментальному определению атомных весов, то введение понятия о молекуле привело не только к развитию методов определения молекулярных весов, но и к изучению свойств составляющих молекулу атомов (атомные объемы, изоморфизм, валентность). [c.52]
Вопросы для самопроверки 1. В чем суть ленинского определения материи 2. Каковы основные положения атомно-молекулярного учения Что означают понятия элемент, атом, молекула вещество 3. Что такое атомная масса элемента, в каких единицах она измеряется Какие методы определения атомных масс элементов известны 4. Что называется относительной плотностью газа Какова зависимость между молекулярной массой газа и его плот- [c.8]
И только в начале XIX столетия английский ученый Джон Дальтон возвращается к атомам как наименьшим частицам материи и вводит в науку этот термин. Этому предшествовали работы таких замечательных ученых, как Р. Бойль (в книге Химик-скептик он нанес сокрушительный удар по представлениям алхимиков), Дж. Пристли и К. В. Шееле (открытие кислорода), Г. Кавендиш (открытие водорода), А. Л. Лавуазье (попытка составить первую таблицу простых веществ), М. В. Ломоносов (основные положения атомно-молекулярного учения, закон сохранения массы), Ж. л. Пруст (закон постоянства состава) и многие другие. [c.3]
Современные комментарии основных положений атомно-молекулярного учения [c.14]
Ломоносов создал стройное атомно-молекулярное учение и впервые применил его в химии. Основные положения атомно-молекулярного учения Ломоносова изложены в работе Элементы математической химии (1Т41) этим учением пронизаны и многие другие его работы. [c.10]
Число Авогадро. Равное число грамм-молекул различных газов при одинаковой температуре и одинаковом давлении занимает равный объем. Согласно закону Авогадро, в равных объемах различных газов при одинаковых условиях содержится одинаковое ч-исло молекул. Следовательно, одна грамм-молекула любого газа содержит одно и то же число молекул. Это число называется числом Авогадро. По наиболее точным измерениям это число Авогадро равно 6,023-10 . Оно определено различными методами (измерение вязкости газов, коэффициента диффузии, электропроводности электролитов и др.). Совпадение результатов, полученных многими методами, служит доказательством справедливости закона Авогадро и основных положений атомно-молекулярного учения. [c.23]
Атомно-молекулярное учение Основные положения атомно-молекулярного учения
Таким образом, основные положения атомно-молекулярного учения можно сформулировать следующим образом [c.17]Основные положения атомно-молекулярного учения [c.7]
Основные положения атомно-молекулярного учения можно сформулировать так [c.7]
Основные положения атомно-молекулярного учения закономерно изменялись в процессе его исторического развития. [c.11]
ОСНОВНЫЕ ПОЛОЖЕНИЯ АТОМНО-МОЛЕКУЛЯРНОГО УЧЕНИЯ [c.12]
Основные положения атомно-молекулярного учения Ломоносова изложены в работе Элементы математической химии (1741 г.) этим учением пронизаны и многие другие его работы. [c.12]
Однако пройдет еще около 100 лет, прежде чем химики вплотную займутся исследованием газов. Тогда-то и последует каскад открытий простых веществ водород, кислород, азот, хлор. А несколько позже газы помогут установить те законы, которые принято называть основными законами химии. Они и позволят сформулировать основные положения атомно-молекулярного учения. [c.14]
Именно по такой схеме построена тема Первоначальные химические понятия после накопления фактов осуществляется обобщение, формулирование основных положений атомно-молекулярного учения, которое затем применяется в течение вводного курса. Наглядно это можно выразить схемой 3.2. При ее рассмотрении видно, как осторожно и последовательно формируются представления, как тесно связаны они между собой системой логических связей. По единому направлению стрелок можно заключить, что логическая последовательность введения понятий не нарушается. Возражение вызывает лишь место обобщающего урока. Основные положения атомно-молекулярного учения — это более широкое обобщение, чем типы химических реакций. Поэтому разумнее его провести в самом конце темы. [c.216]
Теория химического строения была сформулирована А. М. Бутлеровым в 1861 г. А. М. Бутлеров исходил из материалистических представлений, основанных на атомно-молекулярном учении. Открытию теории предшествовала большая экспериментальная работа по изучению свойств и реакционной способности органических молекул. Сущность этой теории заключается в следующих основных положениях. [c.167]
Большой вклад в развитие атомно-молекулярного учения внесли крупнейшие русские и зарубежные ученые М. В. Ломоносов, Лавуазье, Пруст, Дальтон, Авогадро, Канниццаро, Берцелиус, Д. И. Менделеев, А. М. Бутлеров. Окончательно атомно-молекулярное учение утвердилось как научная теория в середине XIX в. Рассмотрим его основные положения. [c.13]
В чем состоят основные положения атомно-молекулярного учения Каково их обоснование [c.29]
В XVII—XVIII вв. атомизм приобрел механический характер. По сравнению с. предыдущим он был несколько более конкретным, но все же в большой мере оставался абстрактным н мало связанным с экспериментом. Выдающимися представителями здесь были Р. Бойль, который положил атомистику в основу своих химических представлений и объяснял асе химические превращения соединением и разъединением атомов М. В. Ломоносов, он сформулировал основные положения атомно-молекулярного учения. И. Ньютон объяснял взаимодействия атомов при помощи гравитационных сил с использованием атомно-молекулярного учения. [c.11]
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый М. В. Ломоносов. Основные положения этого учения изложены в работе Элементы математической химии (1741) и ряде других. Сущность учения Ломоносова можно свести к следующим положениям. [c.10]
С созданием основных положений атомно-молекулярного учения в химии все чаще возникало стремление установить взаимосвязь между различными свойствами атомов и молекул. Если создание Дальтоном атомной теории привело к широкому изучению и экспериментальному определению атомных весов, то введение понятия о молекуле привело не только к развитию методов определения молекулярных весов, но и к изучению свойств составляющих молекулу атомов (атомные объемы, изоморфизм, валентность). [c.52]
Основные положения атомно-молекулярного учения. М. В. Ломоносов как основоположник атомно-молекулярного учения. Атомный вес. Молекулярный вес. Грамм-атом, грамм-молекула. Закон сохранения массы веществ, открытый М. В. Ло.моносовым. Постоянство состава вещества. Объяснение основных законов химии с точки зрения атомномолекулярного учения. Закон Авогадро. Грамм-молекулярный объем газообразных веществ. [c.11]
Молекула каждого сложного вещества имеет постоянный атомный состав, т. е. всегда состоит из одних и тех же атомов различных элементов. Вес каждого атома, образующего моле] улу, тоже постоянен. Поэтому остается постоянным и весовое отношение между элементами, образующими сложное вещество. Таким образом, закон постоянства состава вещества может быть иыведен с помощью основных положений атомно-молекулярного учения. [c.25]
Дальнейшие количественные исследования Дальтона и открытие закона кратных отношений, исследование объемных отношений газов в зависимости от температуры, давления, количеств реагирующих веществ (Дальтон, Гей-Люссак, Авогадро и др.) и позволили создать атомно-молекулярное учение, основные положения которого и были приняты на международном конгрессе химиков в Карлсруэ. [c.13]
Вопросы для самопроверки 1. В чем суть ленинского определения материи 2. Каковы основные положения атомно-молекулярного учения Что означают понятия элемент, атом, молекула вещество 3. Что такое атомная масса элемента, в каких единицах она измеряется Какие методы определения атомных масс элементов известны 4. Что называется относительной плотностью газа Какова зависимость между молекулярной массой газа и его плот- [c.8]
И только в начале XIX столетия английский ученый Джон Дальтон возвращается к атомам как наименьшим частицам материи и вводит в науку этот термин. Этому предшествовали работы таких замечательных ученых, как Р. Бойль (в книге Химик-скептик он нанес сокрушительный удар по представлениям алхимиков), Дж. Пристли и К. В. Шееле (открытие кислорода), Г. Кавендиш (открытие водорода), А. Л. Лавуазье (попытка составить первую таблицу простых веществ), М. В. Ломоносов (основные положения атомно-молекулярного учения, закон сохранения массы), Ж. л. Пруст (закон постоянства состава) и многие другие. [c.3]
Развитие атомно-молекулярного учения
Еще одним подтверждением химической атомистики следует считать открытие французским химиком и физиком Ж.Гей-Люссаком (1778-1850) Закона объемных отношений:
«Объемы газов, вступивших в химическую реакцию, и объемы газов, образовавшихся в результате реакции, относятся между собой как небольшие целые числа».
Удивительно, но факт — против этого закона активно выступал Д.Дальтон. В 1801 г. Д.Дальтону пришла в голову, как он говорил, «смущающая идея», что «в равных объемах газов при одинаковых температуре и давлении содержится равное число частиц». Но вскоре он отказался от этой идеи. В 1811 г. появилась статья итальянца А.Авогадро (1776-1856) «Исследование метода определения относительных масс элементарных молекул веществ и установление отношений, в которых они вступают в соединения». Под элементарными молекулами А.Авогадро понимал атомы, а под интегральными молекулами — молекулы. В статье написано: «Следует, таким образом, принять, что существуют весьма простые отношения между объемами газообразных веществ и числом молекул, которые их образуют. В связи с этим первой гипотезой, которая представляется единственно приемлемой, служит допущение, что «число интегральных молекул в любых газах всегда одинаково в равных объемах». Трагедия Д.Дальтона и современников А.Авогадро состояла в том, что они считали, что все простые вещества (например кислород, азот, водород, хлор и т.д.) состоят из атомов, а не из молекул, как считал А.Авогадро. Однако на статью А.Авогадро не обратили внимания.
Наиболее талантливым последователем химической атомистики Д.Дальтона был шведский ученый И.Берцелиус (1779-1848). Он выполнил тщательные количественные исследования окислов, кислот, солей, оснований с целью определения пропорций, в которых входят в них различные элементы, проверил и перепроверил относительные атомные веса химических элементов. Главным результатом деятельности Берцелиуса в направлении развития химической атомистики можно считать его таблицы атомных весов, рассчитанные на основе весьма тщательных химико-аналитических исследований.
Важной заслугой Берцелиуса была разработка символов химических элементов и правил написания формул химических соединений. Предоставим слово самому Берцелиусу: «Когда мы пытаемся выразить химические пропорции, мы ощущаем необходимость химических символов… Химические символы должны быть буквами с тем, чтобы обеспечить максимальную легкость их написания и устранить затруднения при печатании книг… Я буду применять для химических символов начальные буквы латинских названий каждой элементарной субстанции. Но так как названия некоторых элементарных субстанций начинаются с одних и тех же букв, я буду различать их, пользуясь следующими правилами:
1) В классе, который я называю металлоиды, я буду применять только начальную букву… 2) В классе металлов я буду различать символы, в случае, если названия начинаются с одной и той же буквы как для металлов, так и для металлоидов, таким образом, что буду писать первые две буквы названия металла. 3) Если первые две буквы являются общими для двух металлов, я буду прибавлять к начальной букве первый консонант (созвучную букву)… Например: S — сера, Si — кремний, Sb — сурьма, Sn — олово, C — углерод, Co — кобольт, Cu — медь, O — кислород, Os — осьмий».
Большую помощь химикам в нахождении относительных атомных весов химических элементов — металлов — оказало открытие в 1819 г. французскими физиками П.Дюлонгом и А.Пти закона, по которому произведение удельной теплоемкости металлов на их атомный вес является величиной постоянной, равной 6 кал.
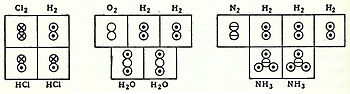
Для того чтобы химики договорились об основных понятиях, ведущими учеными-химиками в 1860 г. в Карлсруэ (Германия) был созван Международный химический конгресс. На конгрессе присутствовали семь русских химиков (среди них Н.Н.Зинин и Д.И.Менделеев). Основным докладчиком был итальянский ученый С.Канниццаро (1826-1910). В 1858 г. он написал небольшую книгу «Конспект курса химической философии», в которой возродил учение А.Авогадро, привлек к обоснованию и нахождению количественных соотношений между атомами химических элементов в молекулах Закон объемных отношений Гей-Люссака, устранил существенный недостаток химической атомистики Д.Дальтона, который отрицал, что простые вещества — водород, азот, хлор, кислород — состоят из молекул (h3, N2, Cl2, O2), а исходя из принципа «максимальной простоты», считал, что они построены из атомов H, N, Cl, O. Доклад С.Канниццаро и его книга смогли убедить Международный конгресс. Итак, основные положения атомно-молекулярного учения можно изложить так:
1. Все вещества состоят из молекул — мельчайших частиц, которые обладают химическими свойствами вещества.
2. Молекулы состоят из атомов: молекулы простых веществ состоят из атомов одного и того же химического элемента, а в молекулы сложных веществ входят атомы двух или большего числа химических элементов.
3. Каждому химическому элементу соответствует свой вид атомов. Атом — это мельчайшая частица химического элемента.
4. При химических реакциях молекулы исходных веществ разрушаются и образуются молекулы продуктов реакции. Атомы химических элементов при химических реакцях сохраняются и лишь переходят из одних молекул в другие.
см. также