Агрегатное состояние вещества. Изменение агрегатных состояний вещества :: SYL.ru
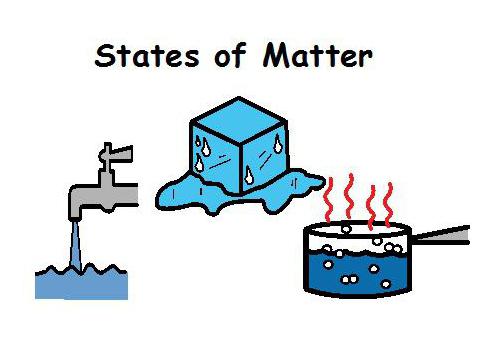
Вся материя может существовать в одном из четырех видов. Каждый из них — это определенное агрегатное состояние вещества. В природе Земли только одно представлено сразу в трех из них. Это вода. Ее легко увидеть и испаренную, и расплавленную, и отвердевшую. То есть пар, воду и лед. Ученые научились проводить изменение агрегатных состояний вещества. Самую большую сложность для них составляет только плазма. Для этого состояния нужны особенные условия.

Что это такое, от чего зависит и как характеризуется?
Если тело перешло в другое агрегатное состояние вещества, то это не значит, что появилось что-то другое. Вещество остается прежним. Если у жидкости были молекулы воды, то такие же они будут и у пара со льдом. Изменится только их расположение, скорость движения и силы взаимодействия друг с другом.
При изучении темы «Агрегатные состояния (8 класс)» рассматриваются только три из них. Это жидкость, газ и твердое тело. Их проявления зависят от физических условий окружающей среды. Характеристики этих состояний представлены в таблице.
| Название агрегатного состояния | твердое тело | жидкость | газ |
| Его свойства | сохраняет форму с объемом | имеет постоянный объем, принимает форму сосуда | не имеет постоянных объема и формы |
| Расположение молекул | в узлах кристаллической решетки | беспорядочное | хаотичное |
| Расстояние между ними | сравнимо с размерами молекул | приблизительно равно размерам молекул | существенно больше их размеров |
| Как двигаются молекулы | колеблются около узла решетки | не перемещаются от места равновесия, но иногда совершают большие скачки | беспорядочное с редкими столкновениями |
| Как они взаимодействуют | сильно притягиваются | сильно притягиваются друг к другу | не притягиваются, силы отталкивания проявляются при ударах |
Первое состояние: твердое тело
Его принципиальное отличие от других в том, что молекулы имеют строго определенное место. Когда говорят про твердое агрегатное состояние, то чаще всего имеют в виду кристаллы. В них структура решетки симметричная и строго периодичная. Поэтому она сохраняется всегда, как далеко не распространялось бы тело. Колебательного движения молекул вещества недостаточно для того, чтобы разрушить эту решетку.
Но существуют еще и аморфные тела. В них отсутствует строгая структура в расположении атомов. Они могут быть где угодно. Но это место так же стабильно, как и в кристаллическом теле. Отличие аморфных веществ от кристаллических в том, что у них нет определенной температуры плавления (отвердевания) и им свойственна текучесть. Яркие примеры таких веществ: стекло и пластмасса.
Второе состояние: жидкость
Это агрегатное состояние вещества представляет собой нечто среднее между твердым телом и газом. Поэтому сочетает в себе некоторые свойства от первого и второго. Так, расстояние между частицами и их взаимодействие похоже на то, что было в случае с кристаллами. Но вот расположение и движение ближе к газу. Поэтому и форму жидкость не сохраняет, а растекается по сосуду, в который налита.
Третье состояние: газ
Для науки под названием «физика» агрегатное состояние в виде газа стоит не на последнем месте. Ведь она изучает окружающий мир, а воздух в нем очень распространен.
Особенности этого состояния заключаются в том, что силы взаимодействия между молекулами практически отсутствуют. Этим объясняется их свободное движение. Из-за которого газообразное вещество заполняет весь объем, предоставленный ему. Причем в это состояние можно перевести все, нужно только увеличить температуру на нужную величину.
Четвертое состояние: плазма
Это агрегатное состояние вещества представляет собой газ, который полностью или частично ионизирован. Это значит, что в нем число отрицательно и положительно заряженных частиц практически одинаковое. Возникает такая ситуация при нагревании газа. Тогда происходит резкое ускорение процесса термической ионизации. Оно заключается в том, что молекулы делятся на атомы. Последние потом превращаются в ионы.

В рамках Вселенной такое состояние очень распространено. Потому что в нем находятся все звезды и среда между ними. В границах Земной поверхности оно возникает крайне редко. Если не считать ионосферы и солнечного ветра, плазма возможна только во время грозы. Во вспышках молнии создаются такие условия, в которых газы атмосферы переходят в четвертое состояние вещества.
Но это не означает, что плазму не создали в лаборатории. Первое, что удалось воспроизвести — это газовый разряд. Теперь плазма заполняет лампы дневного света и неоновую рекламу.

Как осуществляется переход между состояниями?
Для этого нужно создать определенные условия: постоянное давление и конкретную температуру. При этом изменение агрегатных состояний вещества сопровождается выделением или поглощением энергии. Причем этот переход не происходит молниеносно, а требует определенных временных затрат. В течение всего этого времени условия должны быть неизменными. Переход происходит при одновременном существовании вещества в двух ипостасях, которые поддерживают тепловое равновесие.
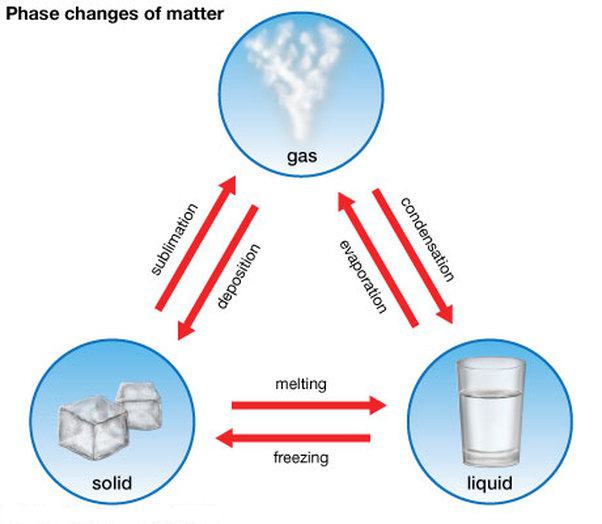
Первые три состояния вещества могут взаимно переходить одно в другое. Существуют прямые процессы и обратные. Они имеют такие названия:
- плавление (из твердого в жидкое) и кристаллизация, например, таяние льда и отвердевание воды;
- парообразование (из жидкого в газообразное) и конденсация, примером является испарение воды и получение ее из пара;
- сублимация (из твердого в газообразное) и десублимация, к примеру, испарение сухого ароматизатора для первого из них и морозные узоры на стекле ко второму.
Физика плавления и кристаллизации
Если твердое тело нагревать, то при определенной температуре, называемой температурой плавления конкретного вещества, начнется изменение агрегатного состояния, которое называется плавление. Этот процесс идет с поглощением энергии, которая называется количеством теплоты и обозначается буквой Q. Для ее расчета потребуется знать удельную теплоту плавления, которая обозначается λ. И формула принимает такое выражение:
Q = λ * m, где m — масса вещества, которое задействовано в плавлении.
Если происходит обратный процесс, то есть кристаллизация жидкости, то условия повторяются. Отличие только в том, что энергия выделяется, и в формуле появляется знак «минус».
Физика парообразования и конденсации
При продолжении нагревания вещества, оно постепенно приблизится к температуре, при которой начнется его интенсивное испарение. Этот процесс называется парообразованием. Оно опять же характеризуется поглощением энергии. Только для его вычисления требуется знать удельную теплоту парообразования r. А формула будет такой:
Q = r * m.
Обратный процесс или конденсация происходят с выделением того же количества теплоты. Поэтому в формуле опять появляется минус.
www.syl.ru
2.3.Изменение агрегатного состояния вещества.
Парообразование.
Парообразование- процесс перехода вещества из жидкого состояния в газообразное. Существует два типа: спокойное парообразование, происходящее при любых температурах с открытой поверхности жидкости, и бурное парообразование, происходящее одновременно как с открытой поверхности, так и внутри жидкости. Процесс парообразование первого типа называют испарением, процесс парообразования второго типа- кипением.
Испарение, кипение.
Испарение- парообразование, происходящее с поверхности жидкости. Скорость испарения зависит от рода жидкости. Испарение происходит при любой температуре и возрастает с ее повышением. Испарение происходит с поверхности жидкости и увеличивается при увеличении этой поверхности. При ветре испарение происходит быстрее. Испарение увеличивается при уменьшении давления. Твердые тела тоже могут испаряться. Внутренняя энергия испаряющейся жидкости уменьшается. Если нет притока энергии извне, то испаряющаяся жидкость охлаждается. Кипение- это интенсивный переход жидкости в пар вследствие образования и роста пузырьков пара, которые при определенной температуре для каждой жидкости всплывают на ее поверхность и лопаются. Температура кипения- это температура, при которой жидкость кипит. Во время кипения температура жидкости не меняется.
Удельная теплота парообразования.
Удельная теплота парообразования (L)- количество теплоты, необходимое для превращения единицы массы одной жидкости в пар той же температуры, при которой находится жидкость. Q=Lm. [Q]=[Дж/кг].
Насыщенный пар.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. При этом сколько молекул покидает жидкость в единицу времени, столько же и конденсируется. Все другие пары называются ненасыщенными. Давление насыщенного пара не зависят от объема, занимаемого паром, а определяются только его температурой. При повышении температуры давление увеличивается. Точка росы- температура, при которой пары, находящиеся в воздухе, становятся насыщенными.
Зависимость давления и плотности насыщенного пара от температуры.
Зависимость давления от температуры, найденная экспериментально, не является прямо пропорциональной, как у идеального газа. С увеличением температуры давление насыщенного пара растет более резко, увеличивается масса пара. Давление насыщенного пара увеличивается как за счет концентрации молекул, так и за счет увеличения их кинетической энергии.
Зависимость температуры кипения от давления.
При уменьшении внешнего давления температура кипения жидкости понижается, а при повышении- повышается. Это был установлено опытным путем.
Критическая температура.
Критическая температура- температура, при которой все физические различия между жидкостью и газом исчезают. Выше критической температуры вещество существует только в газообразном состоянии.
Влажность.
Влажность- физическая величина, измеряемая массой водяного пара, содержащегося в 1 м3 воздуха. Измеряется внесистемной единицей г/м3, так как она по численному значению мало отличается от парциального давления паров воды при тех же условиях, измеренного в мм рт. ст. Парциальное давление- давление пара, занимающего (один) весь предоставленный ему объем.
Относительная влажность.
Относительная влажность- процентное отношение парциального давления паров воды, находящихся в воздухе, к давлению насыщенного пара воды при данной температуре.
Кристаллическое и аморфное состояние вещества.
Кристалл- тело, атомы которого располагаются в пространстве строго упорядоченным образом. В основном, кристаллы- совершенно однородные вещества. Различают монокристаллы (во всем теле одинаковые свойства) и поликристаллы (различное свойства в разных частях тела). Аморфное тело- тело, атомы которого не образуют упорядоченную структуру. Тепловые, электрические и оптические свойства аморфных тел совершенно одинаковы во всех точках. Аморфное состояние- неустойчивое состояние, которое преобразуется в кристаллическое с течением времени.
Удельная теплота плавления.
Q=lm, где l-удельная теплота плавления (кристаллизации) вещества. Удельная теплота плавления вещества- количество теплоты, которое необходимо подвести к единице массы вещества при температуре плавления, чтобы целиком расплавить его. [l]=[Дж/кг].
Уравнение теплового баланса.
В замкнутой системе алгебраическая сумма всех теплот равна нулю. Q1+Q2+…+QN=0. Если Q1+Q2+…+QN>0, то происходит получение системой теплоты извне, если Q1+Q2+…+QN<0, то происходит отдача теплоты системой.
Изменение агрегатного состояния вещества. Тепловые диаграммы.
ОСНОВЫ ТЕОРИИ СУДОВЫХ ХОЛОДИЛЬНЫХ МАШИН.
Способы получения низких температур
Понижение температуры охлаждаемого объекта достигается отводом от него теплоты посредством охлаждения атмосферным воздухом, забортной водой либо рабочим телом. В первом случае процесс охлаждения возможен, если температура окружающей среды (воздуха или воды) ниже температуры охлаждаемого объекта. Он протекает без затрат энергии и называется естественным. К этому процессу относится и охлаждение объекта природным льдом, аккумулирующим естественный холод.
Во втором случае, когда температура охлаждаемого объекта ниже температуры окружающей среды, теплота от него отводится рабочим телом – хладагентом, имеющим еще более низкую температуру. Согласно второму закону термодинамики, для того, чтобы хладагент смог передать теплоту, полученную от объекта охлаждения более теплой окружающей среде, нужно затратить энергию. Такое охлаждение называется искусственным и его предел ограничивается температурой рабочего тела.
В основе искусственного охлаждения лежат физические процессы изменения агрегатного состояния вещества (плавление, кипение, сублимация), расширения и дросселирования газа, вихревого эффекта Ранка, термоэлектрического эффекта Пельтье и др.
Изменение агрегатного состояния вещества. Тепловые диаграммы.
Все вещества, применяемые в холодильной технике, имеют молекулярную структуру. В зависимости от условий они могут находиться в твердом, жидком или газообразном агрегатных состояниях.
Средняя кинетическая энергия молекул твердых тел намного меньше средней потенциальной энергии взаимодействия молекул. Здесь элементарные частицы твердых тел могут только колебаться около определенных положений равновесия. По этим причинам твердые тела, в отличие от жидкостей, сохраняют не только объем, но и форму.
В жидкостях молекулы расположены почти вплотную. Их средняя кинетическая энергия меньше средней потенциальной, и молекулы могут лишь изменять свое положение в веществе. Движение молекул совершается преимущественно в направлении действия силы (например, силы притяжения Земли) по трубопроводу от насоса или компрессора.
Расстояние между молекулами газа при атмосферном давлении во много раз превышает линейные размеры самих частиц, а средняя кинетическая энергия молекул превосходит среднюю потенциальную энергию взаимодействия между ними. По этой причине газ способен расширяться, так как силы притяжения не могут удержать молекулы друг возле друга.
Каждое агрегатное состояние вещества возможно только в определенных пределах значений температуры и давления. По мере изменения этих условий постепенно меняется и соотношение между средними значениями кинетической и потенциальной энергий, пока количественное изменение не перейдет в качественное.
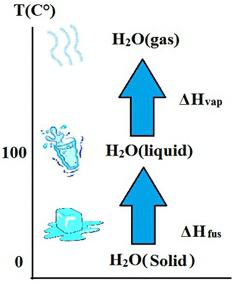
При нагревании твердого тела средняя кинетическая энергия атомов или молекул и амплитуда их колебаний относительно своих центров будут возрастать. Достигнув определенной температуры, называемой температурой плавления, амплитуда колебаний увеличивается настолько, что изменяет порядок в расположении частиц. Вещество теряет свою форму. Процесс превращения твердого вещества в жидкое протекает постепенно, по мере разрушения связей между молекулами, удерживающих эту форму. Вся энергия, подводимая к телу при плавлении, тратится только на разрушение этих связей, поэтому средняя кинетическая энергия частиц, а значит, и температура вещества, в процессе плавления остаются постоянными, меняется только средняя потенциальная энергия взаимодействия частиц.
При температуре плавления внутренняя энергия единицы массы вещества в жидком состоянии больше внутренней энергии этого же количества вещества в твердом состоянии на некоторое значение, называемое
Процесс отвердения вещества происходит в обратном порядке: в охлаждаемом теле средняя кинетическая энергия и скорость молекул уменьшаются до тех пор, пока силы притяжения смогут удержать частицы в изначальном состоянии. Затвердевание вещества, за некоторым исключением, происходит при той же температуре, что и плавление твердых тел.
Температура жидкости, твердого и газообразного вещества зависит от средней кинетической энергии молекул. Каждой температуре соответствует вполне определенное значение этой энергии молекул, но отдельные частицы жидкости имеют большее или меньшее значение кинетической энергии, отличное от среднего значения. Если молекула, обладая достаточной кинетической энергией, окажется у поверхности жидкости, она преодолеет притяжение соседних молекул и оторвется от поверхности тела. Вылетевшие с поверхности жидкости молекулы образуют над жидкостью пар. Процесс перехода молекул со свободной поверхности жидкости в пар называют испарением. Поскольку из жидкости в пар выходят частицы с высокой кинетической энергией, среднее значение кинетической энергии остающихся в жидкости молекул уменьшается, испаряющаяся жидкость охлаждается, а ее температура понижается.
В результате нагрева жидкости средняя кинетическая энергия молекул повышается, и интенсивность испарения ее с поверхности увеличивается. Наконец, при некоторой температуре по всему объему жидкости начинают образовываться центры парообразования в виде пузырьков, внутрь которых также происходит испарение. Когда давление насыщенного пара внутри пузырьков сравнивается с внешним давлением, они всплывают на поверхность, пар выходит из пузырьков и жидкость закипает. Таким образом, кипение представляет собой процесс испарения не только с поверхности жидкости, но и внутрь пузырьков, по всему объему жидкости.
Температуру, при которой жидкость кипит, называют температурой кипения. Для азеотропных жидкостей, например, воды, аммиака, пропана, она не изменяется при постоянном давлении на протяжении всего процесса кипения.
Одно и то же давление насыщенного пара в пузырьках у различных жидкостей образуется при разных температурах кипения. Так, например, температура кипения воды при атмосферном давлении равна +100 °С, а у аммиака она намного ниже и равна -33,4 °С.
В процессе кипения жидкости энергия расходуется частицами, которые участвуют в парообразовании. Кипение будет продолжаться, если будут возникать новые частицы с высокой кинетической энергией, для чего требуется дополнительный подвод теплоты извне. В холодильной технике используются вещества, способные при низких температурах в центрах парообразования создавать высокое давление насыщенного пара, а значит, и кипеть. Процессы охлаждения с применением этих веществ лежат в основе большинства способов искусственного охлаждения.
Количество теплоты, необходимое для превращения в пар единицы массы жидкости, нагретой до температуры кипения, называют удельной теплотой парообразования. Она измеряется в килоджоулях на килограмм (кДж/кг). Таким образом, при одинаковой температуре внутренняя энергия единицы массы вещества в газообразном состоянии больше внутренней энергии этого же количества вещества в жидком состоянии на удельную теплоту парообразования.
Температура кипения зависит не только от свойств жидкости, но и от внешнего давления. Чем выше внешнее давление, тем большее требуется давление в пузырьках насыщенного пара при кипении жидкости и больше энергии подводится для совершения работы против сил внешнего давления. Увеличение энергии вызывает повышение температуры жидкости, поэтому при повышении внешнего давления температура кипения растет. Так, при давлении, в 3 раза превышающем атмосферное, температура кипения воды будет +130 °С, а у аммиака -20 °С. Наоборот, уменьшение внешнего давления приводит к понижению температуры кипения.
Отвод теплоты от насыщенного пара вызывает процесс, обратный кипению, конденсациюпара – превращение пара в жидкость. Конденсация пара происходит при постоянной температуре с выделением теплоты, равной удельной теплоте парообразования. Температура конденсации повышается с ростом внешнего давления и понижается при его уменьшении.
Некоторые твердые вещества, как и жидкости, имеют молекулы, кинетическая энергия которых значительно превосходит среднее значение и достаточна для преодоления потенциальной энергии взаимодействия молекул. Подобные частицы отрываются от других молекул и непосредственно переходят в пар. При этом средняя кинетическая энергия тела, а следовательно, и его температура, уменьшаются. Подобное явление называется сублимацией. Количество теплоты, необходимое для перехода единицы массы твердого тела в пар, минуя жидкую фазу, при постоянной температуре называется удельной теплотой сублимации. Она измеряется в килоджоулях на килограмм (кДж/кг ). Сублимация широко используется в пищевой промышленности при применении сухого льда CO2, температура сублимации которого при нормальных атмосферных условиях равна -78,5 °С. Низкая температура сублимации обеспечивает быстрое и эффективное охлаждение продуктов.
Рассмотренные процессы плавления, затвердевания, кипения, конденсации, сублимации протекают при теплообмене за счет конечной разности температур между двумя взаимодействующими телами, средами, от тела с более высокой температурой к телу с более низкой температурой. Подобные процессы называются необратимыми, так как они не могут повернуть вспять и пройти обратно те же состояния. Примером необратимого процесса может служить также сжатие газа в компрессоре, где не вся подводимая энергия превращается во внутреннюю, часть ее расходуется на нагрев деталей компрессора и рассеивается в окружающую среду. Поэтому, расширяясь, газ не проходит через ту же последовательность равновесных состояний, что и при сжатии.
При описании теоретических процессов сжатия газа и расширения жидкости предполагают, что они протекают без теплообмена с окружающей средой. Поэтому вся работа, совершаемая над газом, превращается во внутреннюю энергию газа. Такие процессы называются адиабатными. Допустим также, что адиабатный процесс сжатия протекает настолько медленно, что в любой момент времени температура и давление газа по всему объему цилиндра будут одинаковыми. Тогда, если после медленного сжатия предоставить газу возможность медленно расширяться, то он пройдет ту же последовательность равновесных состояний, что и при сжатии. Процессы, в которых состояния тела одинаковы в обоих направлениях, называют обратимыми. К обратимым можно отнести процессы конденсации и кипения, протекающие при очень малой разности температур теплообмена.
Если обозначить через q количество теплоты, подведенное к телу в процессе изменения его состояния, а через Т – температуру тела, то второй закон термодинамики для кругового обратимого процесса выражается уравнением
 (1.1)
(1.1)
Подынтегральное выражение определяет дифференциал функции
состояния тела:
dq/Т = ds, (1.2)
а сама функция s называется энтропией тела.
При обратимом круговом процессе сумма энтропии всех тел, участвующих в процессе, остается постоянной. При необратимом процессе сумма энтропии увеличивается. Это замечательное свойство энтропии используется для оценки направления протекающих процессов.
Кроме энтропии часто применяется еще одна функция состояния: энтальпия – количество энергии – теплоты и механической работы, которое нужно подвести к телу, чтобы перевести его из начального состояния в заданное:
i = и + рv, (1.3)
где и – внутренняя тепловая энергия тела;
рv – механическая энергия;
р – давление;
v – удельный объем.
Значение энтальпии отсчитывается от некоторого условного начального состояния тела, принятого за нулевое, потому что обычно требуется знание не абсолютного значения полной энергии тела, а ее изменения, связанного с переходом вещества из одного состояния в другое. Единица измерения энтальпии – джоуль (Дж). Энтальпия, отнесенная к единице массы, называется удельной энтальпией и измеряется в джоулях на килограмм (Дж/кг).
В холодильной технике термодинамические процессы принято изображать на диаграммах s–Т (энтропия – температура) и i–lg р (энтальпия – давление, рис. 1.1).
 |
Рис. 1.1. Тепловые диаграммы
На диаграммах нижняя пограничная кривая (x = 0) отделяет жидкое рабочее вещество, охлажденное ниже температуры конденсации (в холодильной технике часто эти процессы охлаждения области называют переохлаждением) от области парожидкостной смеси (насыщенного пара). Верхняя пограничная кривая (x = 1) разграничивает области насыщенного и перегретого паров. Переохлажденная жидкость образуется при охлаждении насыщенной жидкости, состояние которой характеризуется нижней пограничной кривой (жидкость в состоянии насыщения). Перегретый пар образуется при нагреве насыщенного пара в состоянии, характеризуемом правой пограничной кривой (сухой насыщенный пар).
Точка К, в которой сливаются левая и правая пограничные кривые, называется критической, а параметры, ей соответствующие, критическими. При критической температуре различие между паром и жидкостью исчезает, а теплота парообразованиястановится равной нулю. При значениях температуры выше критической невозможна конденсация пара ни при каких условиях.
Между кривыми x = 0 и x = 1 расположена область парожидкостной смеси (насыщенного пара), на которую нанесены линии постоянного паросодержания (x = const). Они показывают, какое количество пара содержится в единице массы парожидкостной смеси:
x = 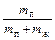 , (1.4)
, (1.4)
где mп – масса пара;
mж – масса жидкости.
На диаграмме s–Т показаны горизонтальные линии постоянных температур (T = const) – изотермы и вертикальные линии постоянных значений энтропии (s = const) – адиабаты. Ломаными линиями изображены изобары (p = const), т.е. линии, каждая точка которых соответствует одинаковому значению давления. В области жидкости все они практически совпадают с левой пограничной кривой, в области насыщенного пара проходят параллельно изотермам, а в области перегретого пара криволинейно поднимаются вверх. Кроме этих кривых на диаграмму нанесены линии постоянных значений энтальпий i = const (изоэнтальпы) и линии постоянных значений удельных объемов v = const (изохоры).
Диаграмма i–lg p образована горизонтальными изобарами (p = const) и вертикальными изоэнтальпами (i = const). Учитывая, что с ростом температуры давление увеличивается быстрее, с целью удобства изображения процессов для давлений введена логарифмическая шкала.
На диаграмме i–lg p наиболее сложную форму имеют изотермы t = const, которые в области докритических значений давления переохлажденной жидкости почти вертикально опускаются вниз, в области парожидкостной смеси идут параллельно изобарам, а в области перегретого пара имеют криволинейную логарифмическую форму.
Диаграмму s-T используют для первоначального изучения процессов, так как площадь под кривой процесса показывает теплоту, участвующую в данном процессе, что очень удобно для анализа эффективности циклов. Диаграмму i-lg p используют при расчетах и исследованиях, поскольку оценки отведенной теплоты и теплоты, эквивалентной затраченной работе сводятся к замеру горизонтальных отрезков на оси i.
Похожие статьи:
poznayka.org
Обобщающий урок «Изменение агрегатных состояний вещества»
Незнающие пусть научаться, а знающие вспомнят еще раз. |
Античный афоризм |
Цели урока.
Образовательная:
- повторить основные формулы раздела тепловые явления с помощью решения задач;
- закрепить знания, умения, навыки, полученные при изучении раздела тепловые явления;
- обеспечить усвоение формул расчёта количества теплоты для различных тепловых процессов;
- научить ребят пользоваться таблицами и формировать у них умение осуществлять самоконтроль с помощью конкретных вопросов и использования дидактического материала.
Развивающая:
- совершенствовать навыки самостоятельной работы, активизировать мышление школьников, умение самостоятельно формулировать выводы, развивать речь;
- тренировка в переводе значения массы, количества теплоты из дополнительных единиц измерения в основные.
Воспитательная:
- развитие познавательного интереса к предмету,
- тренировка рационального метода запоминания формул,
- развитие чувства взаимопонимания и взаимопомощи в процессе совместного решения задач.
Задачи урока.
- Уметь решать расчётные задачи;
- Научиться формулировать чёткие ответы на качественные задачи;
- Уметь пользоваться формулами;
- Отрабатывать навыки перевода значения массы, количества теплоты из дополнительных единиц измерения в основные;
- Отрабатывать навыки соотношения полученных результатов с реальными значениями;
- Уметь пользоваться таблицами:
а) удельная теплоёмкость вещества;
б) температура плавления и кристаллизации;
в) удельная теплота плавления;
г) удельная теплота парообразования. - Уметь, используя жизненный опыт, распознавать основные тепловые явления.
План урока.
- Организационный момент.
- Переходный момент.
- Фронтальный опрос.
- Решение расчётных задач.
- Решение качественных задач.
- Домашнее задание.
- Задания на рефлексию.
- Подведение итогов.
- Резерв. (Выступление “коллекционеров” интересных фактов, загадки).
1. Организационный момент.
2. Переходный момент.
На предыдущих занятиях мы с вами изучали различные агрегатные состояния вещества, тепловые явления и процессы.
Сегодня на уроке мы вместе должны:
- Вспомнить основные формулы для тепловых процессов.
- Решить расчётные и качественные задачи на тепловые явления.
А девиз нашего урока сегодня таков: Незнающие пусть научаться, а знающие вспомнят еще раз.
3. Фронтальный опрос.
Прослушав отрывки из стихов, вам необходимо назвать, какие тепловые явления нашли отражения в данных отрывках.
А. Зачитываем отрывки из стихов.
А.С. Пушкин. “Евгений Онегин”.
Вопрос: Что представляют с точки зрения физики, “на стёклах лёгкие узоры”.
Ответ: Кристаллики замёршей воды, её твёрдое состояние.
Е. Баратынский. “Весна”.
Вопрос: В каком агрегатном состоянии находится вода? Какие тепловые процессы отражены в этом отрывке?
Ответ: Вода в жидком и твёрдом агрегатном состоянии. Процессы нагревания и плавления.
Д.Б. Кедрин. “Мороз на стёклах”.
Вопрос: Какое физическое явление нашло отражение в этом отрывке? Приведите на физическую терминологию процесс “рисование” стужи на окне.
Ответ: Кристаллизация.
И. Суриков. “Золилась заря”.
Вопрос: Какое физическое явление нашло отражение в этом отрывке?
Ответ: Конденсация. Образование росы.
В. Работа с картинками.
Просмотрев слайд, назвать в каком агрегатном состоянии находится вода, указать тепловой процесс, показать формулы для данного теплового процесса.
Сделайте вывод: какие агрегатные состояние вещества существуют природе, причислите тепловые процесс.
4. Решение расчётных задач.
Для решения расчётных задач нам необходимо вспомнить основные формулы, единицы измерения величин связанных с тепловыми явлениями.
Нагревание и охлаждение.
Q = cm (t2 – t1).
Количество теплоты Q, [Q] = 1Дж.
Удельная теплоёмкость вещества с, [c] =
Масса вещества m, [m] = 1 кг.
Температура t, [t] = 1оС.
Приготовить таблицу: “удельная теплоёмкость вещества”.
Для решение, пожалуйста, просмотрите предложенный вам набор задач.
Найдите задачи на названые процессы. Выберите одну из них и решите.
Решение у доски № 1(а) или № 1 (б).
Плавление и кристаллизация.
Q = m.
Количества теплоты Q, [Q] = 1Дж.
Удельная теплота плавления вещества , [] =
Масса вещества m, [m] = 1кг.
Приготовить таблицу: “удельная теплота плавления”.
Найдите задачи на плавление и кристаллизацию.
Решаем у доски № 2 (а) или № 2 (б).
Парообразование и конденсация.
Q = mL
Количества теплоты Q, [Q] = 1Дж.
Масса вещества m, [m] = 1кг.
Удельная теплота парообразования вещества L, [L] =
Приготовить таблицу: “удельная теплота парообразования”.
Найдите задачи на названые процессы. Выберите одну из них и решите.
Решение у доски № 3 (а) или № 3 (б).
5. Решение качественных задач по выбору, с использованием таблиц.
6. Домашнее задание.
Повторить основные формулы, решить качественные задачи, разгадать кроссворд (два последних задания по выбору).
7. Задания на рефлексию.
8. Подведение итогов.
- Какие агрегатные состояния вещества вы знаете? (Твердое, жидкое, газообразное).
- Назвать тепловые процессы. (Нагревание, охлаждение, плавление, кристаллизация, парообразование и конденсация).
- Оцениваем работу учащихся на уроке.
9. Резерв. (Выступление “коллекционеров” интересных фактов, загадки).
Расчётные задачи.
а) Стальное сверло массой 100 г при работе нагрелось от 20 до 120оС. Какое количество теплоты затрачено для нагревания сверла?
| Дано: | CИ | Решение: |
| m=100 г t1 = 20оС t2 = 120оС Q = ? c = |
0,1 кг | Нагревание стали. Q = cm (t2 – t1). Q = · 0,1 кг (120оС — 20оС) = 5000Дж Ответ: Q = 5000Дж = 5кДж. |
Задания на рефлексию.
Моё настроение на уроке. 3.12.2003 физика.
| Начало урока | Середина урока | Конец урока | |
| Плохое | |||
| Хорошее | |||
| Отличное |
1.Сегодня на уроке я научился:
2.Сегодня на уроке мне понравилось:
3. Сегодня на уроке мне не понравилось:
Оформление доски.
Тема: Изменение агрегатных состояний вещества.
Незнающие пусть научаться, а знающие вспомнят еще раз. |
Античный афоризм |
| Твердое состояние | Жидкое состояние | Газообразное состояние |
| Нагревание и охлаждение. Формула: Q=cm (t2 – t1). Количество теплоты Q, Удельная теплоёмкость вещества с, [c] = Масса вещества m, [m] = 1 кг. Температура t, [t] = 1оС. |
Плавление и кристаллизация. Формула: Q = m. Количества теплоты Q, Удельная теплота плавления вещества , Масса вещества m, [m] = 1кг. |
Парообразование и конденсация. Формула: Q = mL Количества теплоты Q, Масса вещества m, [m] = 1кг. Удельная теплота парообразования вещества L, [L] = |
(Оформление магнитной доски рис. 1)
Оборудование:
- компьютер, магнитная доска, магниты, таблицы с формулами,
- новогодняя ёлка украшенная кристаллами соли,
- выставка книг, таблица “агрегатные состояния воды”, дидактический кубик.
Стихи на тепловые явления.
1. А. С. Пушкин “Евгений Онегин”.
В окне увидела Татьяна
Поутру побелевший двор,
Курины, кровли и забор,
На стеклах лёгкие узоры,
Деревья в зимнем серебре…
Что представляют, с точки зрения физики, “на стеклах лёгкие узоры”?
2. Е. Баратынский “Весна”.
Шумят ручьи! Блестят ручьи!
Взревев, река несет
На торжествующем хребте
Поднятый ею лед!
В каком агрегатном состоянии находится вода?
Какие тепловые явления отражены в этом отрывке?
3. Д. Б. Кедрин “Мороз на стеклах”.
Пейзаж тропического лета
Рисует стужа на окне.
Зачем ей розы? Видно это
Зима тоскует о весне.
Какое физическое явления нашло отражение в этом отрывке?
Приведите на физическую терминологию процесс “рисования” стужи на окне.
4. Иван Суриков “Золилась заря”
От цветов на полях
Льётся запах кругом,
И сияет роса
На траве серебром.
Какое физическое явления нашло отражение в этом отрывке?
Загадки на тепловые явления.
| Что за звездочки чудные На пальто и платке? Все, сквозные, вырезные, А возьмёшь – вода в руке. |
Летит – молчит Лежит – молчит Когда умрёт, тогда заревёт. Что это такое? |
В огне не горит, А воде не тонет. |
Расчетные задачи.
1.
а) Стальное сверло массой 100 г при работе нагрелось от 20 до 120оС. Какое количество теплоты затрачено для нагревания сверла?
б) Какое количество теплоты выделилось при охлаждении чугунной детали массой 32 кг, если её температура изменилось от 1015оС до 15оС?
2.
а) Какое количество теплоты, поглощая при плавлении предмет из олова массой 100 г, взятого при температуре плавления?
б) При кристаллизации воды было отдано количество теплоты 102000 Дж. Какова масса полученного льда?
3.
а) Какое количество теплоты необходимо для обращения в пар воды массой 200 г, если жидкость нагрета до температуры кипения?
б) Какова масса воды, образовавшейся при конденсации пара, находящегося при температуре конденсации, если при этом было отдано 345000 Дж теплоты?
Качественные задачи.
1.
а) Приведите примеры различных агрегатных состояний одного и того же вещества.
б) Приведите примеры изучения агрегатных состояний вещества в природе.
2.
а) Температура плавление олова составляет 232оС. В каком агрегатном состояние будет находится олово при температуре 230оС? 233оС?
б) Температура плавления льда составляет 0оС? В каком агрегатном состояние будет находиться вода при температуре — 5оС? +2оС?
3.
а) Можно ли в алюминиевой коробке расплавить железо?
б) При спаиванием стальных деталей иногда пользуются медным припоем. Почему нельзя паять медные детали стальным припоем?
4.
а) Какой процесс позволяет мокрому белью высохнуть даже при сильных морозах?
б) Зачем, дуют на горячий чай, налитый в блюдце? Почему в этом случае чай остывает быстрее?
Качественные задачи. Д/з.
1. Какой из двух металлов (алюминий или медь) вы бы выбрали, чтобы изготовить посуду, годную для расплавления в ней второго металла?
2. Какой из кусков (стальной или вольфрамовый), останется твердым, если будет брошен в расплавленное железо?
3. Можно ли расплавить янтарь, держа его в оловянной ложке? В алюминиевой?
4. Почему бегущая собака высовывает язык?
5. Во время ледохода вблизи реки холоднее, чем вдали от неё. Почему?
6. Сравните кипение и испарение жидкости. Что между ними общего? В чем состоит различие этих явлений?
Выступление “коллекционеров” интересных фактов.
1. Кашалот на лбу имеет спермацетовый орган. Он служит для управления его плавучестью. Спермацетовый орган содержит жир, который заметно изменяет свой объём под влиянием температуры (с погружением на глубину). При понижении температуры жир становится плотнее и из жидкости превращается в беловатую кашицу, состоящую из кристаллов. В таком состоянии он, занимая меньше места, вытесняет меньше воды, поэтому плавучесть кита снижается (уменьшается архимедова сила). Эта способность кашалота особенно интересна для конструкторов батискафов.
2. 4 декабря 1892г. в Саксонии падали хлопья снега, достигавшие в поперечнике 12 см. Объяснить это необычное явление можно так. В верхних слоях атмосферы температура воздуха всегда ниже, чем у земной поверхности. В этих слоях образуются небольшие кристаллы льда – “алмазная” пыль. Падая, они попадают в слои воздуха, температура которых постепенно повышается, и находящийся в этих слоях пар, соприкасаясь с холодной снежинкой и конденсируясь на ней, способствует её росту. Если температура воздуха близка к 0оС, то поверхности снежинок оплавляются и, слипаясь между собой, снежинки образуют крупные хлопья.
3. Большой ущерб наносит народному хозяйству, особенно посевам, град. Чаще всего выпадает град не очень больших размеров (величиной примерно с ноготь), но иногда бывает и весьма кру
urok.1sept.ru
Изменение агрегатных состояний вещества. – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
Урок проводится в рамках подведения итогов главы «Тепловые явления» с целью закрепления полученных знаний. На уроке присутствуют элементы лабораторной работы.Класс: 8 «в»
Цель урока: изучить процессы изменения агрегатных состояний вещества.
Задачи урока:
- Образовательные – сообщение учащимся знаний по физике при изучении темы «Изменение агрегатных состояний вещества», ознакомить учащихся с процессами парообразования, опытным путем получить график изменения агрегатных состояний воды.
- Воспитательные – в целях развития научного мировоззрения учащихся раскрыть причинно-следственные связи в изучаемом материале, формировать умения и навыки учащихся самостоятельно объяснять физические явления и изучать новый материал.
- Развивающие – формировать познавательный интерес к физике и технике, развить творческие способности учащихся, умения размышлять и делать выводы, познакомить учащихся с практическими применениями материала для повышения интереса к изучаемому предмету.
Приборы и материалы: компьютерная презентация «Изменение агрегатных состояний вещества», видеоролики «Кипение воды», «Кипение на ладони», «Кипение при охлаждении», датчик температуры цифровой лаборатории «Архимед».
Таблица 1. СТРУКТУРА И ХОД УРОКА
|
Название используемых ЭОР (с указанием порядкового номера из Таблицы 2 (приложение)) |
Деятельность учителя (с указанием действий с ЭОР, например, демонстрация) |
Деятельность ученика |
|||
|
Организация начала занятия |
[1] Презентация (слайд 1) |
Подготовка учащихся к работе на занятии. Постановка целей и задач урока. |
Участвуют в определении целей. Планируют ход урока. |
||
|
Повторение пройденного материала |
[2] Презентация (слайд 2) |
Обеспечение мотивации и принятия учащимися цели учебно-познавательной деятельности, актуализация опорных знаний и умений |
Готовность учащихся к активной учебно-познавательной деятельности на основе опорных знаний |
||
|
Изложение нового материала |
[3] Презентация (слайд 3) [4] График изменения температуры воды от времени [5] Кипение воды [6] Зависимость температуры кипения [7] Презентация (слайд 6) [8] Кипение при охлаждении [9] Кипение на ладони |
Обеспечивает восприятие, осмысление и первичное запоминание знаний. |
Активные действия с содержанием обучения, максимальное использование самостоятельности в добывании знаний и овладении способами действий. |
||
|
Закрепление знаний и способов действий |
[10] Решите задачу |
Обеспечение усвоения новых знаний и способов действий на уровне применения в измененной ситуации. |
Самостоятельное выполнение заданий, требующих применения знаний в знакомой и измененной ситуации с применением интерактивного тренинга. |
||
|
Домашнее задание |
Формулирует домашнее задание с пояснениями для выполнения. Домашнее задание 1 в учебной среде Moodle, ресурс 18 |
Записывают домашнее задание. Задают вопросы по новой теме и выполнению домашнего задания. |
|||
|
Подведение итогов занятий |
Делает анализ и оценку успешности достижения цели и намечает перспективу последующей работы. Мотивированное выставление оценок. |
Адекватность самооценки учащегося оценке учителя. Получение учащимися информация о реальных результатах учения |
rosuchebnik.ru
Изменение агрегатного состояния вещества – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
авторы: Елена Александровна Иванова , учитель физики, Свердловская область
Разработки уроков (конспекты уроков)
Основное общее образование
Линия УМК А. В. Перышкина. Физика (7-9)
Физика
Поделитесь в соц.сетях
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
Урок по теме «Изменение агрегатного состояния вещества» в 8 классе. Данный урок был проведен в рамках районного конкурса «Педагог года-2016» Байкаловского района Свердловской области, а также в областном туре «Педагогический дебют — 2018» по Свердловской области.
Елена Александровна Иванова
учитель физики, Свердловская область
Поделитесь в соц.сетях
Сказать спасибо автору
Хотите сохранить материал на будущее? Отправьте себе на почту
rosuchebnik.ru
Агрегатное состояние вещества — урок. Физика, 8 класс.
В зависимости от условий одно и то же вещество может находиться в различных агрегатных состояниях: в твёрдом, в жидком и в газообразном.
Обрати внимание!
Молекулы одного вещества, находящегося в разных агрегатных состояниях, не отличаются друг от друга. Различия заключаются в расположении, характере движения и взаимодействия молекул.
В твёрдом состоянии положение молекул упорядочено. Они расположены почти вплотную друг к другу, поэтому притяжение между ними очень большое. Молекулы не могут свободно перемещаться, следовательно, твёрдые тела сохраняют и форму, и объём.

Обрати внимание!
Все твердые вещества, тела, предметы условно подразделяются на:
- кристаллические;
- аморфные.
У молекул жидкости силы взаимодействия меньше, чем у молекул твёрдых тел, и поэтому под действием небольших внешних сил они легко перемещаются. При постоянном объёме жидкость может менять форму, обладает текучестью и малосжимаема.
Молекулы газа слабо связаны друг с другом, и поэтому перемещаются по всему объёму с большими скоростями, часто сталкиваясь друг с другом. Газы не имеют постоянной формы и объёма, легко сжимаемы.

Источники:
https://im0-tub-by.yandex.net/i?id=ff7a3741cb9c01f646f45dfe018f80be&n=33&h=215&w=323
http://www.1zoom.me/big2/789/332635-svetik.jpg
http://vestnikk.ru/uploads/posts/2012-10/1351063322_b8efec71dc0854ded704fa5d7d47228e.jpg
www.yaklass.ru