Определение валентности химических элементов. Составление формул двухэлементных (бинарных) соединений | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема:
Химическая связь
Пример. Сера содержится в VIa, а хлор — в VIIa группе. Значит, высшая валентность серы VI, а хлора — VII (рис. 12.2).
Значение валентности неметаллического элемента в соединении с водородом или металлическим элементом равно разности между числом VIII и номером соответствующей группы.
Пример. Азот содержится в Va группе. Следовательно, в соединениях с водородом и металлическими элементами он проявляет валентность III (VIII — V = III).
Применим приобретенные знания для составления формул двухэлементных (бинарных) соединений.
Рис.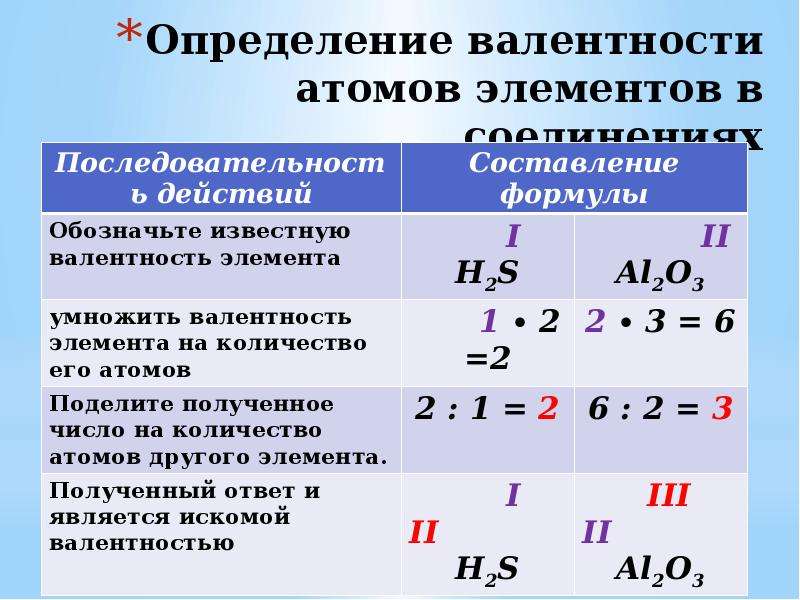 12.2. Определение валентности химических элементов по расположению в периодической системе химических элементов 12.2. Определение валентности химических элементов по расположению в периодической системе химических элементов |
Задание. Составь формулу соединения фосфора с кислородом, в котором фосфор проявляет высшую валентность.
В формулах бинарных соединений символ металлического элемента записывают первым
Составлять химические формулы бинарных соединений нужно по определенному плану:
|
Последовательность действий |
Выполнение действия |
|
1. Запиши химические символы фосфора и кислорода. |
PO |
|
2. Помня, что кислород двухвалентный, обозначь в формуле его валентность римской цифрой над соответствующим символом. |
II PO |
|
3. По периодической системе определи высшую валентность фосфора. Он находится в Va группе, значит его высшая валентность — V. Обозначь ее над символом фосфора. |
V II PO |
|
4. Найди наименьшее общее кратное для значений валентности фосфора и кислорода. Наименьшее число, которое делится без остатка на валентности обоих элементов, — 10. Запиши его арабской цифрой сверху между значениями валентностей. |
V 10 II P O |
|
5. Раздели наименьшее общее кратное на валентность фосфора (10 : V = 2). 2 — нижний индекс; запиши его арабскими цифрами возле символа фосфора справа. |
V 10 II P2 O |
|
6. Раздели наименьшее общее кратное на валентность кислорода (10 : II = 5). 5 — нижний индекс; запиши его арабскими цифрами возле символа кислорода справа. |
V 10 II Р2 O5 |
|
7. Проверь правильность составления формулы соединения. Суммарная валентность всех атомов одного элемента должна равняться суммарной валентности всех атомов другого элемента. Умножь индексы на валентности соответствующих элементов и сравни полученные произведения: 2 • V = 10 и 5 • II = 10. Произведение индекса фосфора в формуле на его валентность равно про изведению индекса кислорода в формуле на его валентность. |
Р2O5 |
Наши действия отображает схема (рис. 12.3):
| Рис. 12.3. Составление формулы соединения фосфора (V) с кислородом |
В формулах бинарных соединений символ кислорода записывают вторым, за исключением соединения с фтором
Определение валентности по формулам бинарных соединений. Зная как соотносятся суммарные валентности атомов каждого из химических элементов в бинарном соединении, можно определить валентность одного из элементов в бинарном соединении по известной валентности другого химического элемента.
Задание. Определи валентность серы в соединении, формула которого H2S.
|
Последовательность действий |
Выполнение действия |
|
1. Запиши химическую формулу вещества. |
H2S |
|
2. Помня, что водород одновалентен, обозначь в формуле его валентность римской цифрой над со ответствующим символом. |
I H2S |
|
3. Найди суммарную валентность атомов водорода, умножив его валентность на индекс: I • 2 = 2. Запиши ее арабской цифрой сверху между символами элементов. |
I 2 H2 S |
|
4. |
I 2 II |
|
5. Проверь правильность определения валентности серы. Суммарная валентность всех атомов одного элемента должна равняться суммарной валентности всех атомов другого элемента. Умножь индексы на валентности соответствующих элементов и сравни полученные произведения: 2 • I = 2 и 1 • II = 2. Произведение индекса водорода в формуле на его валентность равно произведению индекса серы в формуле на ее валентность. Следовательно, валентность серы определена правильно. |
I 2 II H2 S |
Запишем решение в виде схемы (рис. 12.4):
12.4):
| Рис. 12.4. Определение валентности серы в соединении с водородом |
Определить валентность химических элементов в ag2o
Чему равняетсчя высшая валентность фосфора?
Римские цифры валентности химических элементов в бинарных соединениях сн
Выведите формулу двухэлементных соединений
Составьте формулу соединения фтора с литием
Составь формулы бинарных соединений азота кислорода, фтора с кальцием
Составь формулы бинарных соединений с кислородом в которых значения валентности лития, магния, бора, углерода максимальны.
Определи валентность атомов химических элементов по формулам соединений: PH
3, Au2O3, SiH4, Ag2O.
Составь формулы бинарных соединений одно-, двух— и трехвалентных металлических элементов с фтором.
Составь схемы определения валентности элементов по формулам бинарных соединений и решения обратной задачи для случаев, когда: а) значения валентностей химических элементов, которые входят в состав соединения, одинаковы; б) значение валентности одного элемента без остатка делится на значение валентности второго элемента в соединении; в) значения валентностей химических элементов, которые входят в состав соединения, не делятся друг на друга.
Валентность | himiyaklas.ru
Если бы атомы в молекуле ничего не связывало, то она бы развалилась. За счет чего молекула не разваливается?
Атомы в молекуле удерживают химические связи.
Причем разные атомы могут образовывать разное число связей.
Количество связей, которые образует атом называется валентностью. Валентность обозначается римскими цифрами.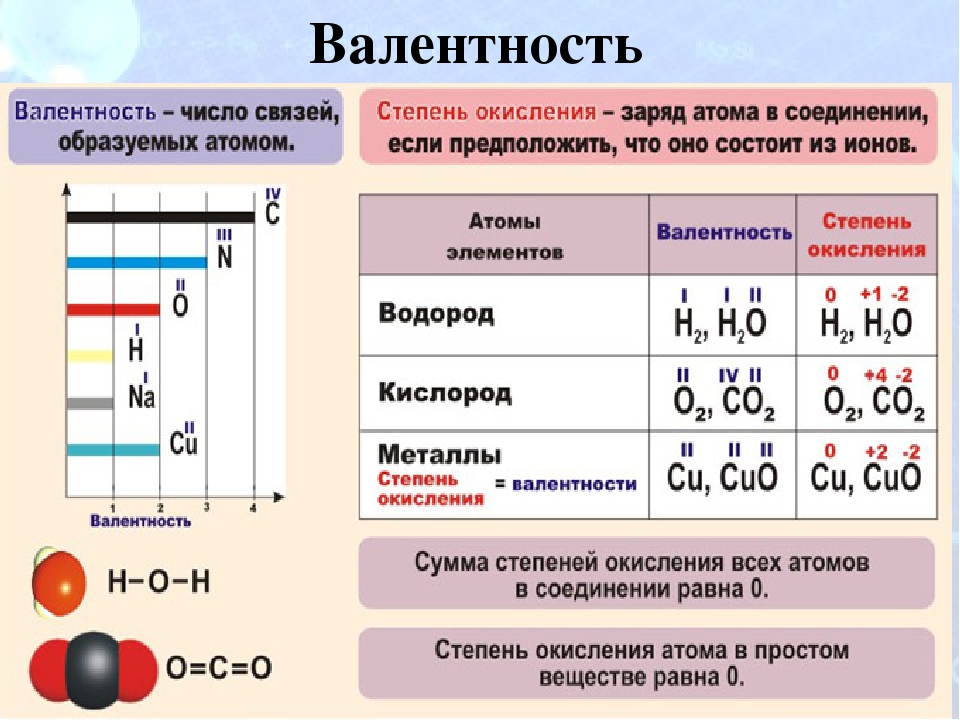
Есть элементы, атомы которых проявляют постоянную валентность во всех соединениях.
Постоянные валентности | |
| Валентность | Элементы |
| I | H, Li, Na, K, Rb, Cs, Ag, F |
| II | Be, Mg, Ca, Sr, Ba, Zn, O а также чаще всего проявляют валентность II: Cu, Ni, Hg, Sn, Pb |
| III | B, Al, Au |
А есть элементы, атомы которых проявляют разные валентности в разных соединениях. Например, сера:
| Элементы, атомы которых проявляют переменную валентность | |
| Элементы | Валетности |
| Fe | II/III |
| Cr | II/III/Vl |
| S | II/IV/VI |
| Mn | II/IV/VI/VII |
| Cl, Br, I | I/III/V/VII |
| P | III/V |
Зная валентность атомов, можно вывести формулу бинарного соединения. [1]
[1]
Схема составления химической формулы бинарного соединения по валентности:
- Нужно расставить валентности над символами элементов.
- Нужно найти наименьшее общее кратное (НОК) двух значений валентности: числа x и y.
- Индекс будет равен НОК разделенный на валентность атома. Формула вещества будет иметь вид:
Например, соединение серы с валентностью VI и кислорода (у кислорода, как мы помним, постоянная валентность II):
Соединение фосфора с валентностью V, и кислорода (постоянная валентность II).
Соединение кальция (постоянная валентность II), и азота с валентностью V.
Номенклатура некоторых бинарный соединений.
Оксид – сложное химическое вещество, состоящее из двух элементов, один из которых – кислород. Кислород записывается на втором месте.
ZnO – оксид цинка.
BaO – оксид бария
Al2O3 – оксид алюминия
Ag2O – оксид серебра
Если у элемента, образующего оксид валентность переменная, то после его названия в скобках указывается та валентность, которую он проявляет в данном веществе:
FeO – оксид железа (II)
Fe2O3 – оксид железа (III)
P2O3 – оксид железа (III)
P2O5 – оксид железа (V)
Cl2O – оксид хлора (I)
Cl2O3 – оксид хлора (III)
Cl2O5 – оксид хлора (V)
Cl2O7 – оксид хлора (VII)
Сульфид – сложное химическое вещество, состоящее из двух элементов, один из которых – сера, проявляющая валентность II. Сера записывается на втором месте. Номенклатура такая же, как у оксидов:
Сера записывается на втором месте. Номенклатура такая же, как у оксидов:
Al2S3 – сульфид алюминия
CuS – сульфид меди (II)
PbS – сульфид свинца (II)
Na2S – сульфид натрия
Фторид (хлорид, бромид, иодид) – сложное химическое вещество, состоящее из двух элементов, один из которых – фтор (хлор, бром, иод), проявляющий валентность I. Фтор (хлор, бром, иод) записывается на втором месте. Номенклатура такая же, как у оксидов и сульфидов.
NaF – фторид натрия
NaCl – хлорид натрия
NaBr – бромид натрия
NaI – иодид натрия
CaF2 – фторид кальция
CaCl2 – хлорид кальция
CaBr2 – бромид кальция
CaI2 – иодид кальция
Нитрид – сложное химическое вещество, состоящее из двух элементов, один из которых – азот, проявляющий валентность III. Азот стоит на втором месте. Другой элемент, как правило, – металл.
Na3N – нитрид натрия
Mg3N2 – нитрид магния
Ca2N3 – нитрид кальция
Фосфид – сложное химическое вещество, состоящее из двух элементов, один из которых – фосфор, проявляющий валентность III. Фосфор стоит на втором месте. Другой элемент, как правило, – металл.
Na3P – нитрид натрия
Mg3P2 – нитрид магния
Ca2P3 – нитрид кальция
Гидрид – сложное химическое вещество, состоящее из двух элементов, один из которых – водород. Водород стоит на втором месте. Другой элемент, как правило, – металл.
KH – гидрид натрия
LiH – гидрид лития
CaH2 – гидрид лития
[1] Бинарное соединение – вещество, состоящее из атомов двух химических элементов: H2O, P2O5, NaCl, H2S.
Валентность учебное пособие по химии
Тема: Валентность Цель: Дать учащимся понятие о валентности как свойстве атомов присоединять определённое 00 1Fчисло атомов дру гого элемента, научить их 00 1Fопределять валентность эле ментов по формулам их соединений. Задачи: 1)Образовательные: -добиться усвоения понятия валентность; -научить определять валентность элементов по формулам их соединений; -повторить, углубить знания о строении вещества; 2)Воспитательные: -дополнить мировоззрение учащихся знаниями о валентности; -продолжить эстетическое воспитание; 3)Развивающие: -продолжить развитие отдельных логических операций и логического мышления в целом; -продолжить развитие познавательного интереса. Тип урока: Изучение нового материала Структура Урока: 1)Повторение пройденного материала не на оценку. (2 мин.) 2)Актуализация знаний. (1 мин) 3)Изучение нового материала. (20-25 мин) 4)Закрепление нового материала. (7 мин) 5)Домашнее задание. (2-3 мин) 6)Подведение итогов. (1-2 мин) Методы организации обучения: Объяснительно-иллюстративные: -устное изложение; -рассказ; -работа с литературой; Оборудование и реактивы: На демонстрационном столе шаростержневые модели веществ, таблица “Постоянные значения валентности некоторых элементов”. Ход урока: Учитель: Добрый день! Начнём наше занятие с повторения, пройденного ма- териала.
Задачи: 1)Образовательные: -добиться усвоения понятия валентность; -научить определять валентность элементов по формулам их соединений; -повторить, углубить знания о строении вещества; 2)Воспитательные: -дополнить мировоззрение учащихся знаниями о валентности; -продолжить эстетическое воспитание; 3)Развивающие: -продолжить развитие отдельных логических операций и логического мышления в целом; -продолжить развитие познавательного интереса. Тип урока: Изучение нового материала Структура Урока: 1)Повторение пройденного материала не на оценку. (2 мин.) 2)Актуализация знаний. (1 мин) 3)Изучение нового материала. (20-25 мин) 4)Закрепление нового материала. (7 мин) 5)Домашнее задание. (2-3 мин) 6)Подведение итогов. (1-2 мин) Методы организации обучения: Объяснительно-иллюстративные: -устное изложение; -рассказ; -работа с литературой; Оборудование и реактивы: На демонстрационном столе шаростержневые модели веществ, таблица “Постоянные значения валентности некоторых элементов”. Ход урока: Учитель: Добрый день! Начнём наше занятие с повторения, пройденного ма- териала. Скажите, какие по составу вещества вы знаете? Ученик: Вещества бывают простые и сложные. Учитель: А чем они различаются? Ученик: Простые вещества состоят из атомов одного вида, а сложные из атомов разного вида. В химических 00 1Fре акциях сложные вещества могут разлагаться с 00 1Fобра зованием нескольких других, а простые нет. Учитель: Чем различаются сложные вещества и смеси? Ученик: Отличие сложных веществ от смесей состоит в том, что смеси могут включать в себя несколько веществ как сложных, так и простых. Учитель: Сравните молекулу воды и молекулу пероксида 00 1Fво дорода h3O2 по их относительным молекулярным массам. Ученик: Относительная молекулярная масса воды равна 18 г/моль, а относительная молекулярная масса 00 1Fпе роксида водорода равна 34 г/моль. Учитель: Вычислите массовую долю кислорода в пероксиде водорода. Ученик: Mr(h3O2)= 1*2+16*2=34 (г/моль). 34 масс. ч. пероксида водорода соответствуют 1 32 масс. ч. кислорода соответствуют x 34:32=1:x x=32*1/34=0,9412, или 94,12% Учитель: Молодцы! Вижу, что вы хорошо усвоили материал предыдущих занятий.
Скажите, какие по составу вещества вы знаете? Ученик: Вещества бывают простые и сложные. Учитель: А чем они различаются? Ученик: Простые вещества состоят из атомов одного вида, а сложные из атомов разного вида. В химических 00 1Fре акциях сложные вещества могут разлагаться с 00 1Fобра зованием нескольких других, а простые нет. Учитель: Чем различаются сложные вещества и смеси? Ученик: Отличие сложных веществ от смесей состоит в том, что смеси могут включать в себя несколько веществ как сложных, так и простых. Учитель: Сравните молекулу воды и молекулу пероксида 00 1Fво дорода h3O2 по их относительным молекулярным массам. Ученик: Относительная молекулярная масса воды равна 18 г/моль, а относительная молекулярная масса 00 1Fпе роксида водорода равна 34 г/моль. Учитель: Вычислите массовую долю кислорода в пероксиде водорода. Ученик: Mr(h3O2)= 1*2+16*2=34 (г/моль). 34 масс. ч. пероксида водорода соответствуют 1 32 масс. ч. кислорода соответствуют x 34:32=1:x x=32*1/34=0,9412, или 94,12% Учитель: Молодцы! Вижу, что вы хорошо усвоили материал предыдущих занятий. Теперь расскажите о 00 1Fкачест венном и количественном составе этих веществ (формулы на доске в столбик) HCl, h3O, Nh4, Ch5. Ученик: HCl-состоит из одного атома водорода и одного атома хлора; h3O-состоит из двух атомов водорода и одного атома кислорода; Ученик: x=2n/m Учитель: x=? 2 x=2n/m 2 Am On Am On “Если рядом с элементом кислород (двухвалентен он, не то, что водород), сумму всех его валентностей найди и на индекс элемента раздели”. Для того чтобы определить валентность элементов по формулам других бинарных соединений (более общий случай), значение валентности одного из элементов обязательно должно быть известно: если значение постоянно, ученик обязан его знать, а если переменно — оно должно быть указано над химическим знаком в формуле. x=? b Am Bn А как здесь определить x? Ученик: x=bn/m Учитель: x=? b x=bn/m b Am Bn Am Bn Обобщите все три схемы. Ученик: Последний графический алгоритм – основной, а 1 и 2 – лишь частные его случаи. Учитель: “Действуй также в каждом случае ином, только помни непременно об одном: чтоб успешно все заданья выполнять, постоянную валентность нужно знать!” (Демонстрирую таблицу с постоянными значениями валентности некоторых элементов).
Теперь расскажите о 00 1Fкачест венном и количественном составе этих веществ (формулы на доске в столбик) HCl, h3O, Nh4, Ch5. Ученик: HCl-состоит из одного атома водорода и одного атома хлора; h3O-состоит из двух атомов водорода и одного атома кислорода; Ученик: x=2n/m Учитель: x=? 2 x=2n/m 2 Am On Am On “Если рядом с элементом кислород (двухвалентен он, не то, что водород), сумму всех его валентностей найди и на индекс элемента раздели”. Для того чтобы определить валентность элементов по формулам других бинарных соединений (более общий случай), значение валентности одного из элементов обязательно должно быть известно: если значение постоянно, ученик обязан его знать, а если переменно — оно должно быть указано над химическим знаком в формуле. x=? b Am Bn А как здесь определить x? Ученик: x=bn/m Учитель: x=? b x=bn/m b Am Bn Am Bn Обобщите все три схемы. Ученик: Последний графический алгоритм – основной, а 1 и 2 – лишь частные его случаи. Учитель: “Действуй также в каждом случае ином, только помни непременно об одном: чтоб успешно все заданья выполнять, постоянную валентность нужно знать!” (Демонстрирую таблицу с постоянными значениями валентности некоторых элементов). Запомнить численные значения постоянной валентности металлов поможет нехитрый текст, комментирующий эту таблицу:”натрий, калий, серебро с водородом заодно. С кислородом – магний, ртуть, кальций, барий и бериллий, с ними цинк не позабудь. Трёхвалентен алюминий”. Валентность разных элементов в соединениях может принимать значения от 1 до 7. Для закрепления материала определите валентность элементов в соединениях: Вариант 1: Sih5, CrO3, Na2O. Вариант 2: h3S, CO2, SO3. Ученик: Вариант 1: 4 1 6 2 1 2 Sih5, CrO3, Na2O. Вариант 2: 1 2 4 2 6 2 h3S, CO2, SO3. Учитель: Домашнее задание: выучить § .Выполните упражнения (с. ). Сегодня на уроке мы узнали, что такое валентность и научились определять валентность элементов по формулам их соединений, узнали, что валентность может быть переменной и постоянной, запомнили несколько значений постоянной валентности некоторых элементов. На этом наш урок заканчивается. Досвидания. Литература: 1)Программа курса химии 8-11 классов общеобразовательных учреждений.
Запомнить численные значения постоянной валентности металлов поможет нехитрый текст, комментирующий эту таблицу:”натрий, калий, серебро с водородом заодно. С кислородом – магний, ртуть, кальций, барий и бериллий, с ними цинк не позабудь. Трёхвалентен алюминий”. Валентность разных элементов в соединениях может принимать значения от 1 до 7. Для закрепления материала определите валентность элементов в соединениях: Вариант 1: Sih5, CrO3, Na2O. Вариант 2: h3S, CO2, SO3. Ученик: Вариант 1: 4 1 6 2 1 2 Sih5, CrO3, Na2O. Вариант 2: 1 2 4 2 6 2 h3S, CO2, SO3. Учитель: Домашнее задание: выучить § .Выполните упражнения (с. ). Сегодня на уроке мы узнали, что такое валентность и научились определять валентность элементов по формулам их соединений, узнали, что валентность может быть переменной и постоянной, запомнили несколько значений постоянной валентности некоторых элементов. На этом наш урок заканчивается. Досвидания. Литература: 1)Программа курса химии 8-11 классов общеобразовательных учреждений.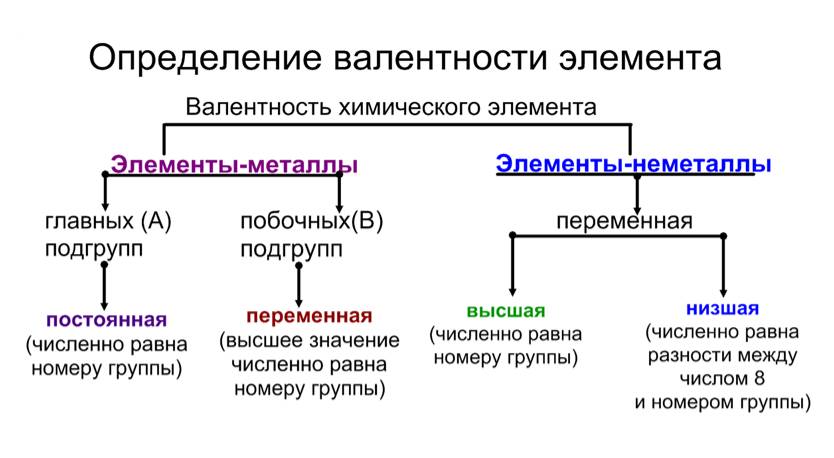 – М.: Просвещение, 1992. 2)Рудзитис Г.Е. и др. Химия 8-класс.-М.: Просвещение, 1992. 3)Химия в школе. Супоницкая И.И. Использование алгоритмов при изучении валентности. N 199 . Записи в тетради Валентность Валентность-это свойство атомов химического элемента присоединять определённое число атомов других химических элементов. HCl-атом хлора удерживает один атом водорода, хлор одновалентен h3O-атом кислорода удерживает два атома водорода, кислород двухвалентен Nh4-атом азота удерживает три атома водорода, азот трёхвалентен Ch5 001F-атом углерода удерживает четыре атома водо рода, углерод четырёхвалентен Валентность водорода во всех его соединениях равна единице. x=? 1 x=1 1 A Hn A Hn Валентность кислорода во всех соединениях равна двум. 1 2 3 4 N2O, NO, N2O3, NO2 x=? 2 x=2n/m 2 Am On Am On Общая формула: x=? b x=bn/m b Am Bn Am Bn : Вариант 1: 4 1 6 2 1 2 Sih5, CrO3, Na2O. или Вариант 2: 1 2 4 2 6 2 h3S, CO2, SO3. Записи на доске Валентность
– М.: Просвещение, 1992. 2)Рудзитис Г.Е. и др. Химия 8-класс.-М.: Просвещение, 1992. 3)Химия в школе. Супоницкая И.И. Использование алгоритмов при изучении валентности. N 199 . Записи в тетради Валентность Валентность-это свойство атомов химического элемента присоединять определённое число атомов других химических элементов. HCl-атом хлора удерживает один атом водорода, хлор одновалентен h3O-атом кислорода удерживает два атома водорода, кислород двухвалентен Nh4-атом азота удерживает три атома водорода, азот трёхвалентен Ch5 001F-атом углерода удерживает четыре атома водо рода, углерод четырёхвалентен Валентность водорода во всех его соединениях равна единице. x=? 1 x=1 1 A Hn A Hn Валентность кислорода во всех соединениях равна двум. 1 2 3 4 N2O, NO, N2O3, NO2 x=? 2 x=2n/m 2 Am On Am On Общая формула: x=? b x=bn/m b Am Bn Am Bn : Вариант 1: 4 1 6 2 1 2 Sih5, CrO3, Na2O. или Вариант 2: 1 2 4 2 6 2 h3S, CO2, SO3. Записи на доске Валентность
Как определить валентность сложных соединениях.
 Что такое валентность
Что такое валентностьЭлектроотрицательность, как и прочие свойства атомов химических элементов, изменяется с увеличением порядкового номера элемента периодически:
График выше демонстрирует периодичность изменения электроотрицательности элементов главных подгрупп в зависимости от порядкового номера элемента.
При движении вниз по подгруппе таблицы Менделеева электроотрицательность химических элементов уменьшается, при движении вправо по периоду возрастает.
Электроотрицательность отражает неметалличность элементов: чем выше значение электроотрицательности, тем более у элемента выражены неметаллические свойства.
Степень окисления
Как рассчитать степень окисления элемента в соединении?
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
К таким элементам относятся:
Элемент | Степень окисления практически во всех соединениях | Исключения |
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = № группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Нахождение степеней окисления элементов в различных соединениях
Пример 1
Определите степени окисления всех элементов в серной кислоте.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF 2). Расставим известные степени окисления:
Обозначим степень окисления серы как x :
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH 4 + (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH 4 + , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH 4 + и анионами Cr 2 O 7 2- .
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y :
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать .
Валентность
Валентность атомов обозначается римскими цифрами: I, II, III и т.д.
Валентные возможности атома зависят от количества:
1) неспаренных электронов
2) неподеленных электронных пар на орбиталях валентных уровней
3) пустых электронных орбиталей валентного уровня
Валентные возможности атома водорода
Изобразим электронно-графическую формулу атома водорода:
Было сказано, что на валентные возможности могут влиять три фактора — наличие неспаренных электронов, наличие неподеленных электронных пар на внешнем уровне, а также наличие вакантных (пустых) орбиталей внешнего уровня. Мы видим на внешнем (и единственном) энергетическом уровне один неспаренный электрон. Исходя из этого, водород может точно иметь валентность, равную I. Однако на первом энергетическом уровне есть только один подуровень — s, т.е. атом водорода на внешнем уровне не имеет как неподеленных электронных пар, так и пустых орбиталей.
Таким образом, единственная валентность, которую может проявлять атом водорода, равна I.
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных () орбиталей валентного уровня. Наличие таких орбиталей на заполняемом уровне приводит к тому, что атом может выполнять роль акцептора электронной пары, т.е. образовывать дополнительные ковалентные связи по донорно-акцепторному механизму. Так, например, вопреки ожиданиям, в молекуле угарного газа CO связь не двойная, а тройная, что наглядно показано на следующей иллюстрации:
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH 3), азотистой кислоты (HNO 2), треххлористого азота (NCl 3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор() предоставляет ее другому атому с вакантной () орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор() предоставляет ее другому атому с вакантной () орбиталью валентного уровня (акцептору). Т.е. для атома азота возможна также валентность IV за счет дополнительной ковалентной связи, образованной по донорно-акцепторному механизму. Так, например, четыре ковалентных связи, одна из которых образована по донорно-акцепторному механизму, наблюдается при образовании катиона аммония:
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии. Атом азота не имеет d -подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5 ? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Атом азота не имеет d -подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO 3 или оксида азота N 2 O 5 ? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованная π -связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O 3 , бензола C 6 H 6 и т.д.
Валентные возможности фосфора
Изобразим электронно-графическую формулу внешнего энергетического уровня атома фосфора:
Как мы видим, строение внешнего слоя у атома фосфора в основном состоянии и атома азота одинаково, в связи с чем логично ожидать для атома фосфора так же, как и для атома азота, возможных валентностей, равных I, II, III и IV, что и наблюдается на практике.
Однако в отличие от азота, атом фосфора имеет на внешнем энергетическом уровне еще и d -подуровень с 5-ю вакантными орбиталями.
В связи с этим он способен переходить в возбужденное состояние, распаривая электроны 3s -орбитали:
Таким образом, недоступная для азота валентность V для атома фосфора возможна. Так, например, валентность, равную пяти, атом фосфора имеет в молекулах таких соединений, как фосфорная кислота, галогениды фосфора (V), оксид фосфора (V) и т.д.
Валентные возможности атома кислорода
Электронно-графическая формула внешнего энергетического уровня атома кислорода имеет вид:
Мы видим на 2-м уровне два неспаренных электрона, в связи с чем для кислорода возможна валентность II. Следует отметить, что данная валентность атома кислорода наблюдается практически во всех соединениях. Выше при рассмотрении валентных возможностей атома углерода мы обсудили образование молекулы угарного газа. Связь в молекуле CO тройная, следовательно, кислород там трехвалентен (кислород — донор электронной пары).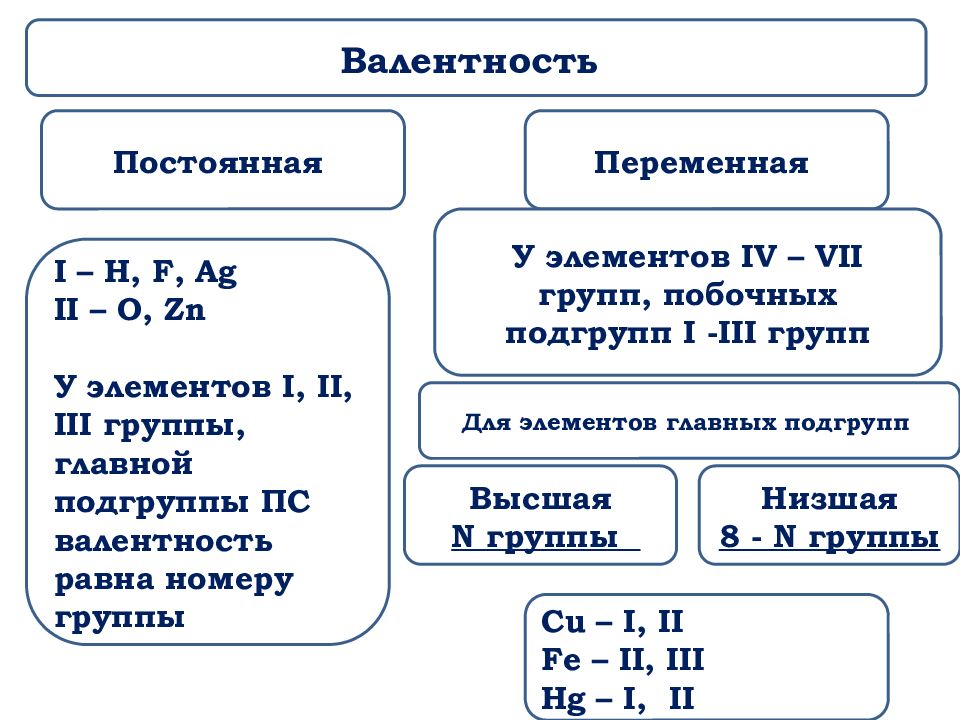
Из-за того что атом азота не имеет на внешнем уровне d -подуровня, распаривание электронов s и p- орбиталей невозможно, из-за чего валентные возможности атома кислорода ограничены по сравнению с другими элементами его подгруппы, например, серой.
Валентные возможности атома серы
Внешний энергетический уровень атома серы в невозбужденном состоянии:
У атома серы, как и у атома кислорода, в обычном состоянии два неспаренных электрона, поэтому мы можем сделать вывод о том, что для серы возможна валентность, равная двум. И действительно, валентность II сера имеет, например, в молекуле сероводорода H 2 S.
Как мы видим, у атома серы на внешнем уровне появляется d -подуровень с вакантными орбиталями. По этой причине атом серы способен расширять свои валентные возможности в отличие от кислорода за счет перехода в возбужденные состояния. Так, при распаривании неподеленной электронной пары 3p -подуровня атом серы приобретает электронную конфигурацию внешнего уровня следующего вида:
В таком состоянии атом серы имеет 4 неспаренных электрона, что говорит нам о возможности проявления атомами серы валентности, равной IV. Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
Действительно, валентность IV сера имеет в молекулах SO 2 , SF 4 , SOCl 2 и т.д.
При распаривании второй неподеленной электронной пары, расположенной на 3s -подуровне, внешний энергетический уровень приобретает конфигурацию:
В таком состоянии уже становится возможным проявление валентности VII. Примером соединений с VI-валентной серой являются SO 3 , H 2 SO 4 , SO 2 Cl 2 и т.д.
Аналогично можно рассмотреть валентные возможности остальных химических элементов.
ОПРЕДЕЛЕНИЕ
Под валентностью подразумевается свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента.
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле — мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H 2 O, NH 3 , CH 4 валентность по водороду хлора равна единице, кислорода — двум, азота — трем, углерода — четырем.
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN 2 O, CO, SiO 2 , SO 3 валентность по кислороду азота равна единице, углерода — двум, кремния — четырем, серы — шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H 2 S), а по кислороду — шести (SO 3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO 2 . В первом из которых валентность углерода равна II, а во втором — четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO 2 . В первом из которых валентность углерода равна II, а во втором — четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая — I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д. И. Менделеева, где они расположены).
И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
Примеры решения задач
ПРИМЕР 1
| Задание | Валентность III характерна для: а)Ca; б) P; в) O; г)Si? |
| Решение | а) Кальций — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кальция равна II. Ответ неверный. б) Фосфор — неметалл. Относится к группе химических элементов с переменной валентностью: высшая определяется номером группы в Периодической таблице Д. |
| Ответ | Вариант (б) |
ПРИМЕР 2
| Задание | Валентность III характерна для: а)Be; б) F; в) Al; г)C? |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем рассматривать каждый из предложенных вариантов в отдельности. а) Бериллий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность бериллия равна II. Ответ неверный. б) Фтор — неметалл. Характеризуется единственно возможным значением валентности равным I. Ответ неверный. в) Алюминий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т. |
| Ответ | Вариант (в) |
Инструкция
Таблица представляет собой структуру, в которой расположены химические элементы по своим принципам и законам. То есть, можно сказать, что таблица – это многоэтажный «дом», в котором «живут» химические элементы, причем каждый их них имеет свою собственную квартиру под определенным номером. По горизонтали располагаются «этажи» — периоды , которые могут быть малые и большие. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Также таблица разделена на «подъезды» — группы, которых всего восемь. Как в любом подъезде квартиры находятся слева и справа, так и здесь химические элементы располагаются по такому же принципу . Только в данном варианте их размещение неравномерно – с одной стороны больше элементов и тогда говорят о главной группе, с другой — меньше и это свидетельствует о том, что группа побочная.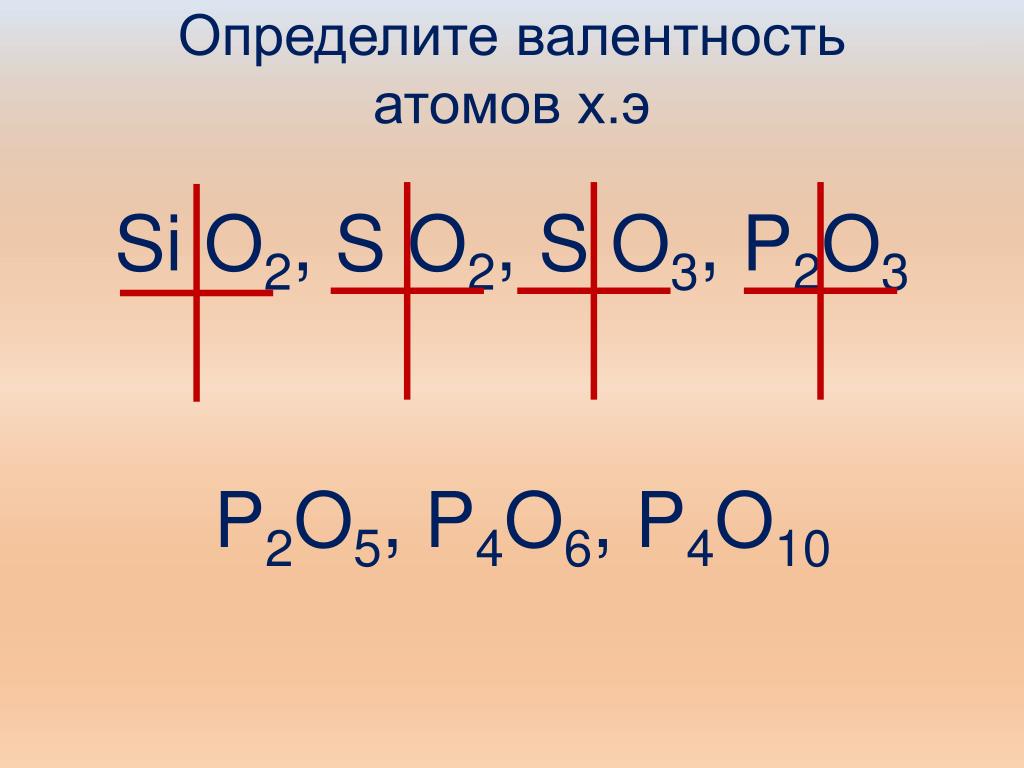
Валентность – это способность элементов образовывать химические связи. Существует валентность постоянная, которая не меняется и переменная, имеющая различное значение в зависимости от того, в состав какого вещества входит элемент. При определении валентности по таблице Менделеева необходимо обратить внимание на такие характеристики: № группы элементы и ее тип (то есть главная или побочная группа). Постоянная валентность в этом случае определяется по номеру группы главной подгруппы. Чтобы узнать значение переменной валентности (если таковая есть, причем, обычно у неметаллов), то нужно из 8 (всего 8 групп – отсюда такая цифра) вычесть № группы, в которой располагается элемент.
Пример № 1. Если посмотреть на элементы первой группы главной подгруппы (щелочные металлы), то можно сделать вывод, что все они имеют валентность, равную I (Li, Na, К, Rb, Cs, Fr).
Пример № 2. Элементы второй группы главной подгруппы (щелочно-земельные металлы) соответственно имеют валентность II (Be, Mg, Ca, Sr, Ba, Ra).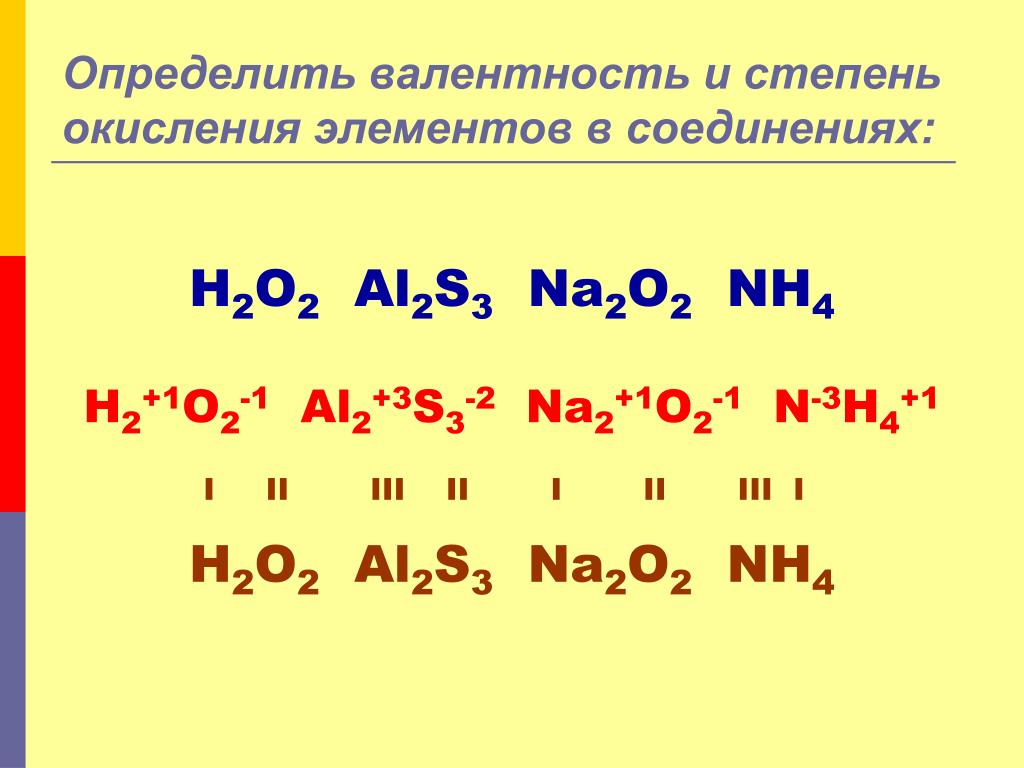
Пример № 3. Если говорить о неметаллах, то например, Р (фосфор) находится в V группе главной подгруппы. Отсюда его валентность будет равна V. Кроме этого фосфор имеет еще одно значение валентности, и для ее определения необходимо выполнить действие 8 — № элемента. Значит, 8 – 5 (номер группы фосфора) = 3. Следовательно, вторая валентность фосфора равна III.
Пример № 4. Галогены находятся в VII группе главной подгруппы. Значит, их валентность будет равна VII. Однако учитывая, что это неметаллы, то нужно произвести арифметическое действие: 8 – 7 (№ группы элемента) = 1. Следовательно, другая валентность галогенов равна I.
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений.
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами называют валентностью элемента .
Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами называют валентностью элемента .
Инструкция
Для примера можно использовать два вещества – HCl и h3O. Это хорошо известные всем соляная кислота и вода. В первом веществе содержится один атом водорода (H) и один атом хлора (Cl). Это говорит о том, в данном соединении они образуют одну связь , то есть удерживают возле себя один атом. Следовательно, валентность и одного, и другого равна 1. Так же просто определить валентность элементов, составляющих молекулу воды. Она содержит два атома водорода и один атом кислорода. Следовательно, атом кислорода образовал две связи для присоединения двух водородов, а они, в свою очередь, по одной связи. Значит, валентность кислорода равна 2, а водорода – 1.
Но иногда приходится сталкиваться с вещества ми более сложными по строению и свойствам составляющих их атомов. Существует два типа элементов: с постоянной (кислород , водород и др.) и непостоянной валентность ю. У атомов второго типа это число зависит от соединения, в состав которого они входят. В качестве примера можно привести серу (S). Она может иметь валентности 2, 4, 6 и иногда даже 8. Определить способность таких элементов, как сера, удерживать вокруг себя другие атомы, немного сложнее. Для этого необходимо знать свойства других составляющих вещества .
Существует два типа элементов: с постоянной (кислород , водород и др.) и непостоянной валентность ю. У атомов второго типа это число зависит от соединения, в состав которого они входят. В качестве примера можно привести серу (S). Она может иметь валентности 2, 4, 6 и иногда даже 8. Определить способность таких элементов, как сера, удерживать вокруг себя другие атомы, немного сложнее. Для этого необходимо знать свойства других составляющих вещества .
Запомните правило: произведение количества атомов на валентность одного элемента в соединении должна совпадать с таким же произведением для другого элемента. Это можно проверить вновь обратившись к молекуле воды (h3O):
2 (количество водорода) * 1 (его валентность ) = 2
1 (количество кислорода) * 2 (его валентность ) = 2
2 = 2 – значит все определено верно.
Теперь проверьте этот алгоритм на более сложном веществе, например, N2O5 – оксиде азота . Ранее указывалось, что кислород имеет постоянную валентность 2, поэтому можно составить уравнение :
2 (валентность кислорода) * 5 (его количество) = Х (неизвестная валентность азота) * 2 (его количество)
Путем несложных арифметических вычислений можно определить, что валентность азота в составе данного соединения равна 5.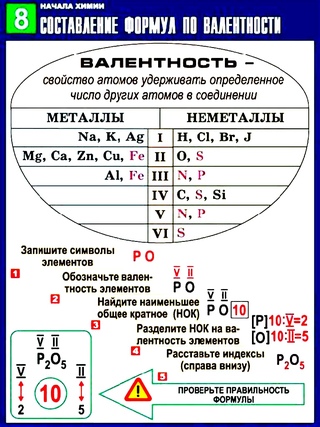
Валентность — это способность химических элементов удерживать определенное количество атомов других элементов. В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность достаточно просто.
Инструкция
Примите к сведению, что валентность атомов одних элементов постоянна, а других — переменна, то есть, имеет свойство меняться. Например, водород во всех соединениях одновалентен, поскольку образует только одну связь . Кислород способен образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV или VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто. Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в Cah3 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V — это валентность атомов элементов, а К — количество атомов в молекуле. С ее помощью легко определить показатель валентности любого элемента, если известны остальные данные.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Видео по теме
Открытие периодического закона и создание упорядоченной системы химических элементов Д.И. Менделеевым стали апогеем развития химии в XIX веке. Ученым был обобщен и систематизирован обширный материал знаний о свойствах элементов.
Ученым был обобщен и систематизирован обширный материал знаний о свойствах элементов.
Инструкция
В XIX веке не было никаких представлений о строении атома. Открытие Д.И. Менделеева являлось лишь обобщением опытных фактов, но их физический смысл долгое время оставался непонятным. Когда появились первые данные о строении ядра и распределении электронов в атомах, это позволило взглянуть на периодический закон и систему элементов по-новому. Таблица Д.И. Менделеева дает возможность наглядно проследить периодичность свойств элементов, встречающихся в природе .
Каждому элементу в таблице присвоен определенный порядковый номер (H — 1, Li — 2, Be — 3 и т.д.). Этот номер соответствует заряду ядра (количеству протонов в ядре) и числу электронов, вращающихся вокруг ядра. Число протонов, таким образом, равно числу электронов, и это говорит о том, что в обычных условиях атом электрически нейтрален .
Деление на семь периодов происходит по числу энергетических уровней атома. Атомы первого периода имеют одноуровневую электронную оболочку, второго — двухуровневую, третьего — трехуровневую и т.д. При заполнении нового энергетического уровня начинается новый период.
Атомы первого периода имеют одноуровневую электронную оболочку, второго — двухуровневую, третьего — трехуровневую и т.д. При заполнении нового энергетического уровня начинается новый период.
Первые элементы всякого периода характеризуются атомами, имеющими по одному электрону на внешнем уровне, — это атомы щелочных металлов. Заканчиваются периоды атомами благородных газов, имеющими полностью заполненный электронами внешний энергетический уровень: в первом периоде инертные газы имеют 2 электрона, в последующих — 8. Именно по причине похожего строения электронных оболочек группы элементов имеют сходные физико-химические свойства .
В таблице Д.И. Менделеева присутствует 8 главных подгрупп. Такое их количество обусловлено максимально возможным числом электронов на энергетическом уровне.
Внизу периодической системы выделены лантаноиды и актиноиды в качестве самостоятельных рядов.
С помощью таблицы Д.И. Менделеева можно пронаблюдать периодичность следующих свойств элементов: радиуса атома, объема атома; потенциала ионизации; силы сродства с электроном; электроотрицательности атома; степени окисления ; физических свойств потенциальных соединений.
Четко прослеживаемая периодичность расположения элементов в таблице Д.И. Менделеева рационально объясняется последовательным характером заполнения электронами энергетических уровней.
Источники:
- Таблица Менделеева
Периодический закон, являющийся основой современной химии и объясняющий закономерности изменения свойств химических элементов, был открыт Д.И. Менделеевым в 1869 году. Физический смысл этого закона вскрывается при изучении сложного строения атома.
Одной из важных в изучении школьных тем является курс, касающийся валентности. Об этом пойдет речь в статье.
Валентность — что это такое?
Валентность в химии означает свойство атомов химического элемента привязывать к себе атомы другого элемента. В переводе с латыни — сила. Выражается она в числах. Например, валентность водорода всегда будет равняться единице. Если взять формулу воды — Н2О, ее можно представить в виде Н — О — Н. Один атом кислорода смог связать с собой два атома водорода. Значит, количество связей, которые создает кислород, равно двум. И валентность этого элемента будет равняться двум.
Значит, количество связей, которые создает кислород, равно двум. И валентность этого элемента будет равняться двум.
В свою очередь, водород будет двухвалентным. Его атом может быть соединен только с одним атомом химического элемента. В данном случае с кислородом. Говоря точнее, атомы в зависимости от валентности элемента, образуют пары электронов. Сколько таких пар образовано — таковой и будет валентность. Числовое значение именуется индексом. У кислорода индекс 2.
Как определить валентность химических элементов по таблице Дмитрия Менделеева
Посмотрев на таблицу элементов Менделеева, можно заметить вертикальные ряды. Их называют группами элементов. От группы зависит и валентность. Элементы первой группы имеют первую валентность. Второй — вторую. Третьей — третью. И так далее.
Есть также элементы с постоянным индексом валентности. Например, водород, группа галогенов, серебро и так далее. Их необходимо выучить обязательно.
Как определить валентность химических элементов по формулам?
Иногда сложно определить по таблице Менделеева валентность. Тогда нужно смотреть конкретную химическую формулу. Возьмем оксид FeO. Здесь и у железа, как у кислорода, индекс валентности будет равняться двум. А вот в оксиде Fe2O3 — по-другому. Железо будет трехвалентным.
Тогда нужно смотреть конкретную химическую формулу. Возьмем оксид FeO. Здесь и у железа, как у кислорода, индекс валентности будет равняться двум. А вот в оксиде Fe2O3 — по-другому. Железо будет трехвалентным.
Нужно помнить всегда разные способы определения валентности и не забывать их. Знать постоянные ее числовые значения. У каких элементов они есть. И, конечно, пользоваться таблицей химических элементов. А также изучать отдельные химические формулы. Лучше представлять их в схематическом виде: Н — О — Н, например. Тогда видны связи. И количество черточек (тире) будет числовым значением валентности.
Валентность элемента и номер главной подгрупп
Высшая валентность элементов определяется в основном номером группы периодической системы, т. е. должна изменяться в пределах от 1 до 8. Однако ход изменения валентности элементов в периодах и группах представляет собой сложную функцию (наблюдается ряд отступлений). Например, в главной пэлементы одновалентны, а в побочной подгруппе этой группы валентность элементов Си, Ag и Аи может быть равна 1, 2 и 3.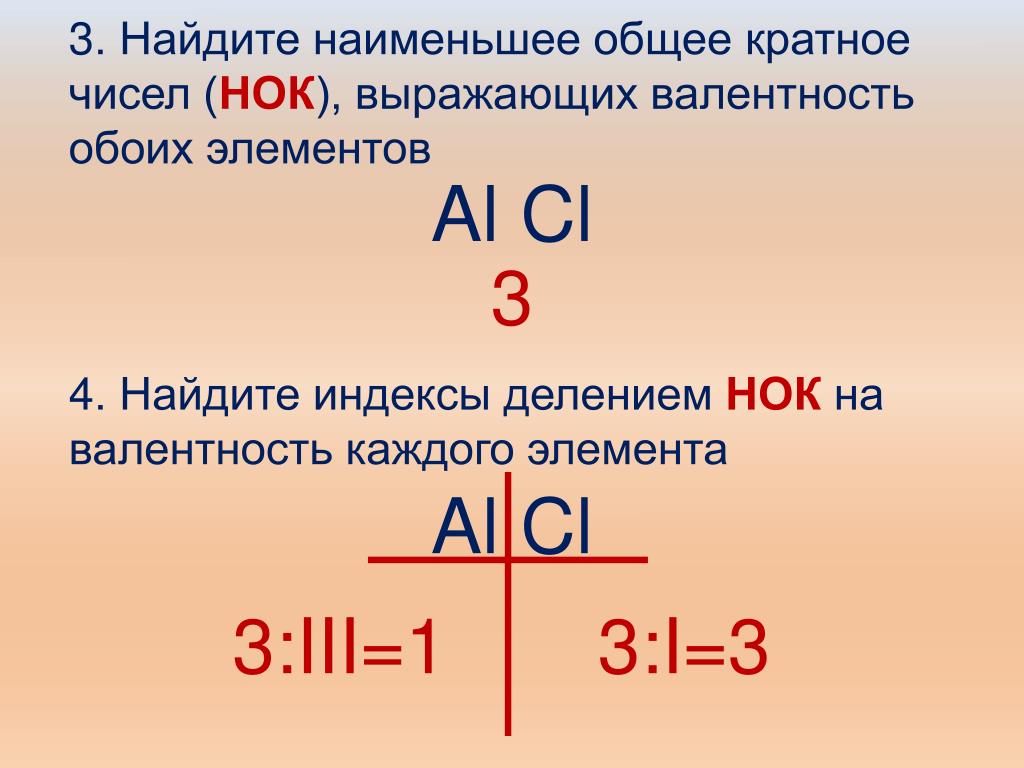 Элементы VHI побочной подгруппы, судя по номеру группы, должны проявлять максимальную валентность 8. Но только для рутения и осмия известны соединения, в которых они восьмивалентны для остальных элементов подгруппы известны максимальные валентности от 4 до 6. [c.77]
Элементы VHI побочной подгруппы, судя по номеру группы, должны проявлять максимальную валентность 8. Но только для рутения и осмия известны соединения, в которых они восьмивалентны для остальных элементов подгруппы известны максимальные валентности от 4 до 6. [c.77]
Рассмотреть особенности строения атомов элементов главной подгруппы третьей группы. Какие валентные состояния характерны для этих элементов Как изменяются их свойства с увеличением порядкового номера элемента [c.244]
I См. также Номер главной подгруппы и валентность (стр. 44). Валентность указывается римской цифрой вверху справа от сим-вола элемента. [c.58]
Какая существует зависимость между числом валентных электронов атома и номером группы, в которой находится элемент а) главной подгруппы, б) побочной подгруппы [c.65]
Хлор находится в УП (нечетной) группе и валентности его будут нечетными 1, 3, 5 и 7. Таким образом, для элементов главных подгрупп четных групп будет характерна переменная четная валентность, для нечетных подгрупп — нечетная. В том и другом случае максимальная валентность не превышает номера группы, т. е. числа электронов на внешней оболочке. [c.76]
Таким образом, для элементов главных подгрупп четных групп будет характерна переменная четная валентность, для нечетных подгрупп — нечетная. В том и другом случае максимальная валентность не превышает номера группы, т. е. числа электронов на внешней оболочке. [c.76]
Элементы побочных подгрупп в какой-то мере сходны с элементами соответствующих главных подгрупп. Сходство в наибольшей степени проявляется у элементов третьей группы, где только начинается ответвление побочных подгрупп. С возрастанием порядкового номера -элемента в группе и номера самой группы (начиная с третьей группы) сходство уменьшается и в восьмой группе почти совсем исчезает. В первой группе вновь появляется отдаленное сходство элементов обеих подгрупп, а во второй сходство весьма сильное электроны (п—1) элементов подгруппы цинка уже не участвуют в валентных связях. [c.318]
Гомология Н и Не со щелочными и щелочноземельными металлами в свете изложенного становится ясной, последует еще указать на причину укрепившегося в науке сопоставления гелия с элементами последовательности N6— Кп. Давно уже полагают, что в Системе имеется нулевая группа элементов, включающая в себя не только неон и его гомологи, но и гелий. Так как номера главных подгрупп теперь обычно сопоставляют с числом внешних валентных дор-электронов, то в последнее время предложено называть неон и его гомологи элементами восьмой группы при этом делается очевидным, что гелий к подгруппе неона принадлежать не может, г Причина сходства Не и Ые, т. е. их функциональной химической инертности, не одинакова для Не она заложена в законченности подоболочки [c.165]
Давно уже полагают, что в Системе имеется нулевая группа элементов, включающая в себя не только неон и его гомологи, но и гелий. Так как номера главных подгрупп теперь обычно сопоставляют с числом внешних валентных дор-электронов, то в последнее время предложено называть неон и его гомологи элементами восьмой группы при этом делается очевидным, что гелий к подгруппе неона принадлежать не может, г Причина сходства Не и Ые, т. е. их функциональной химической инертности, не одинакова для Не она заложена в законченности подоболочки [c.165]
Металлическими элементами, как известно, начинается каждый период, и число их возрастает с увеличением номера периода. Так, если в первом периоде металлических элементов нет совсем, то во втором их два, в третьем три, в четвертом тринадцать, в пятом четырнадцать, в шестом двадцать восемь. В седьмом периоде металлическими должны быть двадцать девять элементов. Металлические элементы по максимальной валентности, формам и свойствам главных соединений подразделяются на группы и подгруппы.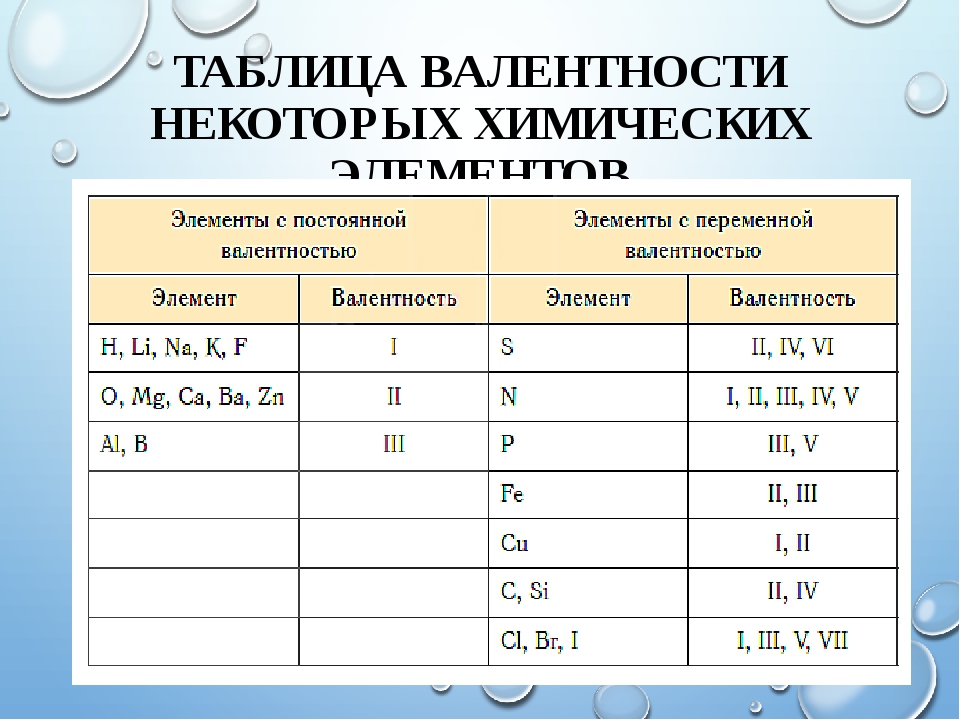 Элементы, составляющие главную подгруппу I группы периодической системы (за исключением водорода), называются щелочными металлами. Элементы главной подгруппы П группы (кроме бериллия) носят название щелочноземельных металлов. [c.200]
Элементы, составляющие главную подгруппу I группы периодической системы (за исключением водорода), называются щелочными металлами. Элементы главной подгруппы П группы (кроме бериллия) носят название щелочноземельных металлов. [c.200]
Современная теория строения атомов и молекул неопровержимо свидетельствует о том, что основой периодического закона является строение электронных оболочек атомов химических элементов. Важнейшая химическая характеристика элементов главных подгрупп — валентность атомов — определяется структурой внешнего электронного слоя, конкретнее — числом неспаренных электронов. Строго обусловленные причины предопределяют периодичность заполнения электронных уровней в атомах с увеличением атомного номера, т. е. с возрастанием числа электронов. Это в свою очередь обусловливает периодическое изменение числа неспаренных элект [c.18]
Первый вариант системы, который Менделеев разослал многим химикам в феврале 1869 г. , был так называемым длиннопериодным. В одной из современных форм такой вариант помещен на втором форзаце. В ней подгруппы в- и р-элементов (главные) помечены буквой А, подгруппы -элементов (побочные) — буквой В рядом с номером группы. Сходство элементов подгрупп А и В одной группы обнаруживается главным образом в высших кислородных соединениях (в соединениях с высшей положительной валентностью). У них гораздо меньше сходства в соединениях с низшей положительной валентностью, мало сходства в простых веществах и совсем нет сходства в водородных соединениях. В строении атомов это сходство проявляется в одинаковом числе электронов, от которых зависит проявление валентности элементов, а различие заключается в том, что эти электроны у главных элементов принадлежат только внешнему уровню, а у побочных распределены по двум уровням (л — 1)й и П8. [c.79]
, был так называемым длиннопериодным. В одной из современных форм такой вариант помещен на втором форзаце. В ней подгруппы в- и р-элементов (главные) помечены буквой А, подгруппы -элементов (побочные) — буквой В рядом с номером группы. Сходство элементов подгрупп А и В одной группы обнаруживается главным образом в высших кислородных соединениях (в соединениях с высшей положительной валентностью). У них гораздо меньше сходства в соединениях с низшей положительной валентностью, мало сходства в простых веществах и совсем нет сходства в водородных соединениях. В строении атомов это сходство проявляется в одинаковом числе электронов, от которых зависит проявление валентности элементов, а различие заключается в том, что эти электроны у главных элементов принадлежат только внешнему уровню, а у побочных распределены по двум уровням (л — 1)й и П8. [c.79]
У элементов главных подгрупп высшая положительная валентность определяется общим числом П5- и пр-электронов внешнего слоя атома. У элементов же побочных подгрупп суммируются пз- и и (п — 1) -электроны внешнего (п) и предвнешнего (п — 1) электронных слоев. Эти суммы и отвечают номеру группы. [c.87]
У элементов же побочных подгрупп суммируются пз- и и (п — 1) -электроны внешнего (п) и предвнешнего (п — 1) электронных слоев. Эти суммы и отвечают номеру группы. [c.87]
Назовите d-элементы IV группы периодической системы, напишите их электронные формулы и укажите различие в строении внешнего электронного слоя нх атомов и атомов элементов главной подгруппы. Приводит ли это к различию в числе валентных электронов Совпадает ли оно с номером группы [c.317]
Из таблицы видно, что в атомах элементов II группы валентными являются п5 -электроны, где п — номер периода. В атомах элементов главной подгруппы пх -электроны служат непосредственной достройкой к оболочке атома соответствующего инертного элемента [c.410]
С увеличением номера периода увеличивается радиус атома и ослабляется связь валентных электронов с ядром. С увеличением номера группы для элементов главных подгрупп увеличивается шсло электронов на внешнем энергетическом уровне, увеличивается заряд ядра и усиливается связь валентных электронов с ядром. [c.77]
[c.77]
Общая характеристика элементов подгруппы титана. Атомы этих элементов имеют электронную конфигурацию (п— )d ns . Их высшая валентность равна четырем, но бывают двух- и трехвалентными. Стабильность высшей валентности немного увеличивается с увеличением порядкового номера, но в главной подгруппе от германия к свинцу она уменьшается. Устойчивость соединений двух- и трехвалентных элементов невелика и убывает от титана к гафнию. Цирконий является немного металличнее титана, а свойства гафния очень близки к цирконию. Отделить гафний от циркония — задача очень сложная. Благодаря лантаноидному сжатию радиусы атома Hf и иона Hf » меньше, чем у циркония, потенциал ионизации (7,3 в) на 0,5 в выше, чем у циркония. Плотность гафния в 2 раза больше плотности циркония, а электродные потенциалы Э/Э у них обоих близки к —1,5 в. Титан обычно не образует ионов Ti . [c.329]
По химической активности и другим химическим свойствам больше всего к щелочным металлам должны приближаться элементы, соседние с ними в периодической системе, образующие главную подгруппу П группы, особенно с большими порядковыми номерами, вследствие этого большими размерами атомов и особенно слабой связью внешних, или валентных, электронов. От атома соседнего щелочного металла атомы элементов рассматриваемого семейства отличаются лишней единицей положительного заряда ядра и добавочным электроном во внешнем слое. Отдавая оба валентных электрона, они обращаются в двукратно положительно заряженные ионы, поэтому во всех соединениях положительно двухвалентны. В качестве представителя таких металлов рассмотрим кальций. [c.132]
От атома соседнего щелочного металла атомы элементов рассматриваемого семейства отличаются лишней единицей положительного заряда ядра и добавочным электроном во внешнем слое. Отдавая оба валентных электрона, они обращаются в двукратно положительно заряженные ионы, поэтому во всех соединениях положительно двухвалентны. В качестве представителя таких металлов рассмотрим кальций. [c.132]
Номер группы периодической системы равняется количеству валентных электронов, находящихся в этой группе элементов. В главных подгруппах помер группы соответствует количеству электронов, находящихся на внеш-етем слое, а в побочных группах номер группы показывает общее количество валентных электронов у данного элемента, т. е. то наибольшее количество электронов, которое атом может отдавать со своего внешнего и предпослед-мего слоя. Исключение составляют элементы восьмой группы и побочной шодгруппы первой группы периодической системы. В восьмой группе, как уже говорилось, не все элементы способны проявлять положительную валентность, равную восьми. Находящиеся в побочной подгруппе первой группы медь, серебро и золото могут проявлять валентность и больше единицы медь бывает двухвалентной, а серебро и золото — трехвалептными. У этих элементов предпоследний 18-й электронный слой еще не является устойчивым. [c.228]
Находящиеся в побочной подгруппе первой группы медь, серебро и золото могут проявлять валентность и больше единицы медь бывает двухвалентной, а серебро и золото — трехвалептными. У этих элементов предпоследний 18-й электронный слой еще не является устойчивым. [c.228]
У благородных газов атомные номера равны 2, 10, 18, 36, 54 и 86. Интервалы равны 2, 8, 8, 18, 18 и 32. За каждым благородным газом следует чрезвычайно химически активный металл, образующий ионы М +. Это щелочные металлы У, Ыа, К, Rb и Сз. Каждому благородному газу предшествует химически активный. ..щелочные металлы неметалл, образующий ионы V . Это галогены стоят друг под другом Р, С1, Вг, I и А1. За щелочными металлами (группа в 1 группе. . 1А, главная подгруппа) следует щелочноземельные металлы Ве, Мд, Са, 5г и Ва,. образующие группу ПА. Галогенам (группа УИБ) предшествуют О, 5, 5е и Те элементы с валентностью, равной 2, свойства которых меняются от неметаллических до металлических.
 В группы 1ИБ, 1УБ и УБ входят. ..в вертикальные элементы, менее похожие друг на друга. Все они группы входят элементы, проявляют типичную для своей группы валентность, [c.50]
В группы 1ИБ, 1УБ и УБ входят. ..в вертикальные элементы, менее похожие друг на друга. Все они группы входят элементы, проявляют типичную для своей группы валентность, [c.50]Алюминий находится в главной подгруппе III группы периодической системы элементов Д. И. Менделеева. Порядковый номер его 13, атомный вес 26,9815. Электронная конфигурация атома алюминия в невозбужденном состоянии ls 2s 2p 3s 3p Валентными являются три электрона s- и р-подуровней последнего слоя, в соответствии с этим алюминий проявляет максимальную валентность 3+. [c.9]
В главные подгруппы попадают s- н р-элемепты, у которых валентными являются s- и р-электроны. Сумма 5- и р-электронов на внещнем уровне равна номеру группы. В побочных подгруппах расположены элементы, в атомах которых происходит заполнение -подуровней предпоследнего уровня. У этих элементов помимо s-электронов внешнего уровня валентными могут быть также -электроны с предпоследнего уровня. Взглянув на периодическую таблицу и подсчитав у какого-нибудь элемента побочной подгруппы П1—VH групп сумму этих S- и -электронов, нетрудно убедиться, что она равна количеству валентных электронов элементов главной подгруппы той же группы. Таким образом, можно сказать, что в основе построения короткой формы периодической таблицы (напомни . еще раз, что она была предложена Д. И. Менделеевым еще в 1871 г. ) лежит заполнение электронами внешнего уровня с учетом -электронов на предпоследнем уровне. [c.117]
Таким образом, можно сказать, что в основе построения короткой формы периодической таблицы (напомни . еще раз, что она была предложена Д. И. Менделеевым еще в 1871 г. ) лежит заполнение электронами внешнего уровня с учетом -электронов на предпоследнем уровне. [c.117]
Магний расположен в главной подгруппе второй группы периодической системы элементов Д. И. Менделеева. Порядковый номер его 12, атомный вес 24,312. Электронная конфигурация атома-магния в невозбужденном состоянии 1х 25 /) 35 валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность 2- -. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации поэтому магний в химич ском отношении очень активен. На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
Группа — совокупность элементов с одинаковым числом валентных электронов, равным номеру группы. Валентные электроны s и р соответствуют элементам главных подгрупп, валентные электроны d и f — элементам побочных подгрупп. [c.84]
Здесь уместно отметить одну важную особенность, свойственную всем элементам побочных подгрупп, кроме ШВ-труппы (подгруппа скандия) усиление химической благородности металлов в пределах группы с увеличением атомного номера элемента. В главных подгруппах и в подгруппе скандия сверху вниз нарастают металлические свойства, а начиная именно с подгруппы титана наблюдается обратная закономерность. С этой точки зрения, элементы IVB-группы, так же как и элементы IVA-группы, являются своеобразной границей, разделяющей две противоположные тенденции. Отмеченное обстоятельство связано с тем, что между IIIB- и IVB-группами вклиниваются семейства /-элементов, что наглядно отражается в развернутой (32-клеточной) форме системы. При этом валентные 6s-электроны тяжелых элементов подгрупп титана, ванадия и т.д., следующих за лантаноидами, обнаруживают эффект проникновения сквозь двойной слой из 5d-и 4/-электронов. Этим и обусловлено ослабление металлических свойств гафния, тантала, вольфрама и т.д. На этой особенности основана интерпретащ1Я закономерностей изменения степеней окисления, кислотно-оснбвных и окислительновосстановительных свойств в группах -элементов. [c.391]
При этом валентные 6s-электроны тяжелых элементов подгрупп титана, ванадия и т.д., следующих за лантаноидами, обнаруживают эффект проникновения сквозь двойной слой из 5d-и 4/-электронов. Этим и обусловлено ослабление металлических свойств гафния, тантала, вольфрама и т.д. На этой особенности основана интерпретащ1Я закономерностей изменения степеней окисления, кислотно-оснбвных и окислительновосстановительных свойств в группах -элементов. [c.391]
Таким образом, валентное число инертных газов равно нулю. Чтобы согласовать номер группы инертных газов с максимальной положительной валентностью, как это сделано для остальных групп периодической системы, эта группа была названа туле-вой группой- ) и помещена в начале периодической системы. При непрерывном расположении элементов, принятом в табл. П (см. приложение), инертные газы попадают в восьмую группу в качестве ее главной подгруппы. Такое расположение согласуется с закономерностями периодической системы, так как при уменьшении отрицательной валентности с возрастанием номера группы, начиная с четвертой главной подгруппы, нулевую валентноать следует ожидать для элементов восьмой главно подгруппы. Двойственность положения инертных газов соответствует их особому характеру по сравнению с элементами остальных главных подгрупп. Подробнее об этом будет сказано в следующей главе. [c.126]
Двойственность положения инертных газов соответствует их особому характеру по сравнению с элементами остальных главных подгрупп. Подробнее об этом будет сказано в следующей главе. [c.126]
Химические свойства элемента определяются количеством валентных электронов. Очень устойчив при химических превращениях благородногазовый октет (s p ). У типических элементов валентные электроны расположены во внешнем слое. Аналоги лития (см. табл. 5.4) имеют только один валентный электрон (s ) У электронов подгруппы бериллия их два (s ) элементы, составляющие главную подгруппу III группы, во внешнем электронном. слое имеют три валентных электрона (s p ), аналоги углерода — четыре электрона (s p ), азота — пять (s p ), кислорода — шесть (s p ) н, наконец, галогенысемь электронов (s p ). Для типических элементов количество валентных электронов совпадает с номером группы в периодической системе элементов. [c.144]
Номера периодов п групп получпли физическое обоснование с точки зрения электронной теории. Номер периода равен числу электронных слоёв у атомов данного периода (слои К, L, М, N, О…). Номер группы определяет число валентных электронов у элементов данной группы, причём для элементов всех главных подгрупп и обеих первых групп (I и И) он определяет число электронов во внешнем слое. [c.189]
Номер периода равен числу электронных слоёв у атомов данного периода (слои К, L, М, N, О…). Номер группы определяет число валентных электронов у элементов данной группы, причём для элементов всех главных подгрупп и обеих первых групп (I и И) он определяет число электронов во внешнем слое. [c.189]
Первый период включает всего два элемента, второй и третий периоды — по восемь, четвертый и пятый — по восемнадцать, шестой, седьмой — по тридцать два элемента. Первые три периода называются малыми, а четвертый и с.аедующие—большими. Большие периоды подразделяются на ряды, малые же периоды совпадают с соответствующими рядами. В каждой группе элементы больших периодов подразделяются на две подгруппы — главную и побочную. Элементы малых периодов — второго и третьего — относятся к главной подгруппе. Основанием для помендеиия элементов в ту или иную группу являлась максимально возможная валентность элемента — ее значению соответствует 1юмер группы псключенпе составляют кислород, фтор, неон и элементы побочной подгруппы VIH группы, валентность которых не достигает соответственно шести, семи и восьми, а таклэлементы побочной подгруппы I группы, валентность которых достигает трех. Номер каждого периода совпадает с числом электронных уровней в оболочках атомов, номер группы — с числом электронов па наружном уровне электронной оболочки, хотя это выполняется только для атомов элементов главных подгрупп. [c.36]
Номер каждого периода совпадает с числом электронных уровней в оболочках атомов, номер группы — с числом электронов па наружном уровне электронной оболочки, хотя это выполняется только для атомов элементов главных подгрупп. [c.36]
Для MerajiflOB в соединениях характерно отдавать свои валентные электроны с образованием положительно заряженных ионов. Элементы главных подгрупп имеют число валентных электронов, равное номеру группы. Поэтому [c.73]
Высшая положительная валентность элементов обычно отвечает номеру группы, причем в высших оксидах и гидроксидах кислотный характер растет слева направо по периодам, а основной — ослабевает. У фтора вообще не обнаружена положительная валентность в соединениях он всегда одновалентен. Положительная валентность кислорода проявляется только в соединениях с фтором и равна двум. Железо, кобальт и никель проявляют высшую валентность соответственно шесть, четыре и три, палладий — четыре, родий, иридий и платина — шесть, бром и астат — пять. У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
ГАЛОГЕНЫ (галоиды) — химические элементы главной подгруппы VII группы периодической системы элементов Д. И. Менделеева фтор F, хлор С1, бром Вг, иод I и астат At. Название галогены происходит от греч. hais — соль и genes — рождать. Неправильное название галоиды , которое ввел Г. И. Гесс, означает солеподобный . Атомы Г. имеют конфигурацию валентных электронов присоединяя один электрон, приобретают конфигурацию инертного газа s p . Все Г.— активные неметаллы, непосредственно соединяются с большинством элементов, образуя галогениды. Г.— энергичные окислители, их окислительная способность падает от F к I. Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
Г.— энергичные окислители, их окислительная способность падает от F к I. Г. в соединениях с электроположительными элементами проявляют степень окисления— 1. С увеличением порядкового номера химическая активность Г. уменьшается, химическгя активность ненов Р , С1 , Вг , 1 увеличивается. С водородом все Г. образуют галогеноводороды — прн обычных условиях газы, из которых по свойствам значительно выделяется НР. Все галогеноводороды хорошо растворяются в воде, образуя сильные кислоты. Кислородные соединения Г. неустойчивы (кроме оксидов I), часто разлагаются со взрывом. Г. и их соединения имеют большое практическое значение в промышленности, в лабораторной практике и в быту. [c.65]
Из приведенных схем видно, что у трехвалентного хрома, двух- и четырехвалентного марганца число валентных электронов меньше числа неспаренных электронов. Данное обстоятельство, а также некоторые другие особенности элементов побочных подгрупп в сильной степени усложняют вопрос о валентностях этих элементов. Объяснить так наглядно и просто валентности элементов побочных подгрупп даже в их простейших соединениях, как это было сделано для элементов главных подгрупп, не представляется возможным. В отличне от элементов главных подгрупп, для которых максимальная валентность равна номеру группы, для некоторых элементов побочных подгрупп могут наблюдаться валентности больше номера группы. Например, для находящихся в первой группе меди и золота наряду с валентностью единица характерна также валентность два и три соответственно. [c.78]
Объяснить так наглядно и просто валентности элементов побочных подгрупп даже в их простейших соединениях, как это было сделано для элементов главных подгрупп, не представляется возможным. В отличне от элементов главных подгрупп, для которых максимальная валентность равна номеру группы, для некоторых элементов побочных подгрупп могут наблюдаться валентности больше номера группы. Например, для находящихся в первой группе меди и золота наряду с валентностью единица характерна также валентность два и три соответственно. [c.78]
В III— VIII группах главных подгрупп расположено 30 р-элементсв и два s-элемента (водород и гелий). В периодах слева направо в атомах р-элементов заполняется электронами р-подуровень от р до р . Валентными являются не только р-электроны, но и s-электроны внешнего уровня атома. Их сумма соответствует номеру группы, в которой расположен элемент, и высшей положительной степени окисления ns p , ns p , ns p , ns p, ns p , ns p . С увеличением числа электронов на внешнем уровне атомов уменьшается восстановительная способность атомов и усиливается их окислительная активность (увеличивается электроотрицательность, сродство к электрону, энергия ионизации элементов). В группах периодической системы сверху вниз у р-элементов заметно усиливаются восстановительные свойства. [c.229]
В группах периодической системы сверху вниз у р-элементов заметно усиливаются восстановительные свойства. [c.229]
Явно выраженная периодичность характерна для энтальпий атомизации простых веществ (рнс. 6). Для элементов малых периодов кривая зависимости энтальпии атомизации от атомного номера нроходит через четко выраженный максимум, приходящийся на элементы IУА-группы (Сал , 31). Это обусловлено, с одной стороны, упрочнением связей в кристаллах по мере увеличения числа валентных электронов от одного до четырех, а с другой — уменьшением прочности кристаллической решетки за счет уменьшения координационного числа ковалентных структур по правилу 8—N после 1УА-группы. Минимумы на кривой соответствуют кристаллам благородных газов, образованным за счет слабых сил межмолекулярного взаимодействия. В больших периодах для 5- и р-элементов (главные подгруппы) эта закономерность также просматривается. Однако на нее накладывается изменение энтальпий в рядах переходных металлов.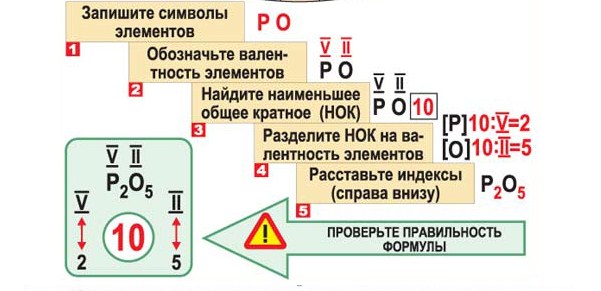 При этом для металлов первой вставной декады, обладающих кайносимметричными Зй-электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная осо- [c.34]
При этом для металлов первой вставной декады, обладающих кайносимметричными Зй-электронами, наблюдается четко выраженная внутренняя периодичность, обусловленная осо- [c.34]
Кислород — элемент с порядковым номером 8, его относительная атомная масса 15,999ж1 . Находится во втором периоде, в главной подгруппе VI группы. Электронное строение атома кислорода и его валентные возможности рассмотрены выше. [c.355]
Каждый период начинается с s-элемента, которые находятся в IA- и ПА-подгруппах (А — главные подгруппы), уО-элементы находятся в 1ПА- и VIIIA-под-группах. Следовательно, суммарное число валентных (внешних) S- и р-элементов равно номеру группы в периодической системе. Например, электронная формула элемента 2-го периода VIA-подгруппы будет оканчиваться. ..2s 2p (2 + 4 = 6), а электронная формула элемента 5-го периода ПА-подгруппы —. . . (2 + 0) Tl т. д. [c.74]
Перед детальным обсуждением структурной химии этих элементов необ. ходимо обратить внимание на одну особенность, прису-П1ую. многим из нпх. Уже от.мечалось ранее, что элементы Си, Ag и Аи могут использовать для связи d-электроны с главным квантовым числом на единицу меньшим, чем у s- и р-орбиталей, причем медь может терять 1 или 2 Зс -электронов и образовывать ионы Си + и Си +. Однако некоторые элементы последующих Б-подгрупп ведут себя совершенно иначе. Кроме образования обычного иона с потерей всех N электронов внешней оболочки N — номер группы в периодической системе) может происходить потеря только р-электронов, а пара s-электро-пов оставаться связанной с ядром в виде так называемой инерт-нон пары. В случае одноатомного иона это означает, что М должен иметь по крайней мере 3 электрона в валентной оболочке и, следовательно, необходимо искать подтверждения факта существования ионов у металлов группы П1Б и нонов в группе IVB. В состоянии одноатомного газа ртуть сохраняет структуру 78 (2) тогда ион (Hg—ng) + (еслн бы такой свободный ион существовал) сохранял такой же эффективный атомный номер (к этому вопросу мы вернемся позже).
ходимо обратить внимание на одну особенность, прису-П1ую. многим из нпх. Уже от.мечалось ранее, что элементы Си, Ag и Аи могут использовать для связи d-электроны с главным квантовым числом на единицу меньшим, чем у s- и р-орбиталей, причем медь может терять 1 или 2 Зс -электронов и образовывать ионы Си + и Си +. Однако некоторые элементы последующих Б-подгрупп ведут себя совершенно иначе. Кроме образования обычного иона с потерей всех N электронов внешней оболочки N — номер группы в периодической системе) может происходить потеря только р-электронов, а пара s-электро-пов оставаться связанной с ядром в виде так называемой инерт-нон пары. В случае одноатомного иона это означает, что М должен иметь по крайней мере 3 электрона в валентной оболочке и, следовательно, необходимо искать подтверждения факта существования ионов у металлов группы П1Б и нонов в группе IVB. В состоянии одноатомного газа ртуть сохраняет структуру 78 (2) тогда ион (Hg—ng) + (еслн бы такой свободный ион существовал) сохранял такой же эффективный атомный номер (к этому вопросу мы вернемся позже). Чрезвычайно низкую степень ионизации галогенидов ртути Сиджвик рассматривал как доказательство инертности пары бх-электро-нов Hg, однако нет сомнения в том, что в кристаллическом HgFa (структура флюорита) присутствуют ионы Hg +. Доказательство существования нонов можно получить, изучая свойства соединений в растворах нли в расплавах, а также природу нх кристаллических структур. [c.287]
Чрезвычайно низкую степень ионизации галогенидов ртути Сиджвик рассматривал как доказательство инертности пары бх-электро-нов Hg, однако нет сомнения в том, что в кристаллическом HgFa (структура флюорита) присутствуют ионы Hg +. Доказательство существования нонов можно получить, изучая свойства соединений в растворах нли в расплавах, а также природу нх кристаллических структур. [c.287]
Как вычислить самую грустную песню на свете
- Мириам Куик
- BBC Culture
Автор фото, Getty Images
Журналистка Мириам Куик решила проверить, как работает новый алгоритм, разработанный компанией Spotify, стоящей за известным музыкальным стриминговым мобильным приложением. Для того чтобы выявить самую грустную песню, когда-либо возглавлявшую хит-парады, она проанализировала более 1000 музыкальных номеров. Результат удивил.
Когда мне было 15, я открыла для себя The Smiths. «Смиты» — название этой группы в Британии долгое время было синонимом несчастной судьбы.
Но я влюбилась в уникальную манеру певца Моррисси быть кокетливо несчастным, в его умение приправить свое несчастье типичным североанглийским юморком, балансируя на грани жалости к себе и самоиронии. Да еще эти замысловатые партии гитары Джонни Марра…
Я всегда начинала плакать в определенные моменты их песен: в конце Hand in Glove, потом в том месте, где перед припевом в Girl Afraid неожиданно сменяются аккорды, а еще в The Queen is Dead, когда он поет: «Мы можем сходить прогуляться туда, где тихо и тепло» (по поводу последнего я до сих пор не могу понять, почему это так сильно действовало на меня).
Спустя 20 лет компания Spotify построила алгоритм, который должен помочь определить количество грусти в песне.
Их стриминговое музыкальное приложение собрало массив данных (к нему можно получить доступ через web API) по каждой из 35 миллионов песен из своего каталога, и каждой песне теперь присвоен индивидуальный индекс, так называемая валентность — от 0 до 1.
«Песни с высокой валентностью звучат более позитивно (радостно, весело, эйфорически), а песни с низкой валентностью — более негативно (грустно, зло, депрессивно)», — объясняют в компании Spotify.
Музыкальные номера проиндексированы и по другим параметрам — например, по энергетике (насколько песня заводная и громкая) и танцевальности (тут объяснять ничего не надо, так ведь?).
Всё это стало настоящим подарком для блогеров и журналистов, умеющих анализировать данные и обожающих всюду искать подвох.
(Кстати, в недавнем академическом исследовании, основанном на открытых данных проекта Acousticbrainz, делается вывод, что на протяжении последних 30 лет песни, попадающие в британские хит-парады, становятся все печальнее.)
Автор фото, Getty Images
Подпись к фото,Показатели музыкальной валентности, составленные Spotify, помогли в разработке «Индекса мрака» песен Radiohead
Но каким образом алгоритм, который не способен ничего чувствовать, может отличить веселую песню от грустной?
«Это с самого начала было сложной для воплощения концепцией — вычислить количество грусти, навеваемой той или иной песней», — рассказывает Чарли Томпсон, ученый, разработавший тот самый «Индекс мрака» Radiohead (можно почитать его блог — RCharlie).
Вдохновленная его достижениями, я решила проверить данные Spotify сама. Мне должны были помочь наиболее популярные песни последних 50 лет — хиты номер один журнала Billboard.
Сперва я собрала все песни, достигавшие вершин хит-парада Billboard Hot 100 с июля 1958 года (когда он начал публиковаться) — список из 1080 номеров.
Потом я сравнила их с данными Spotify. В Spotify не было только одной песни из моего списка — Over and Over группы Dave Clark Five.
Итак, какая же из песен, достигших номера один в хит-параде, была самой грустной?
Don’t worry, be happy
Прежде чем я назову ее, давайте разберемся, чего вообще ожидают от грустной песни.
Возможно, мелодия должна быть написана в минорном ладу? «Мажор как правило ассоциируется с позитивной валентностью или, если быть более точным, с такими эмоциональными состояниями, как счастье или торжественность, а минор — с негативной валентностью (например, грусть или гнев)», — поясняет Руй Педру Паива, профессор информатики Коимбрского университета (Португалия) и специалист по определению эмоций, передаваемых музыкой.
Автор фото, Getty Images
Подпись к фото,Основатель и вокалист группы The Smiths Моррисси во время выступления в 2004 году
Удивительно, но первые номера хит-парада Billboard как будто игнорируют такое определение: хотя количество песен в мажоре более чем вдвое превышает количество минорных, в среднем разницы в валентности между ними нет.
Ну хорошо, тогда грустная песня должна быть медленной, менее энергичной — примерно как движения человека, пребывающего в печали?
Тут, кажется, мы ближе к истине: в хит-парадах Billboard хиты номер один с более низкой валентностью обычно менее энергичны.
Однако у некоторых песен низкая валентность сочетается с довольно высоким уровнем энергии — в частности, у песен, наполненных гневом или злостью.
Возможно, лучшим определением «грустной песни» будет такое: это такая песня, в которой негативное настроение сочетается с низкой энергетикой (таким образом мы отсеиваем злые песни).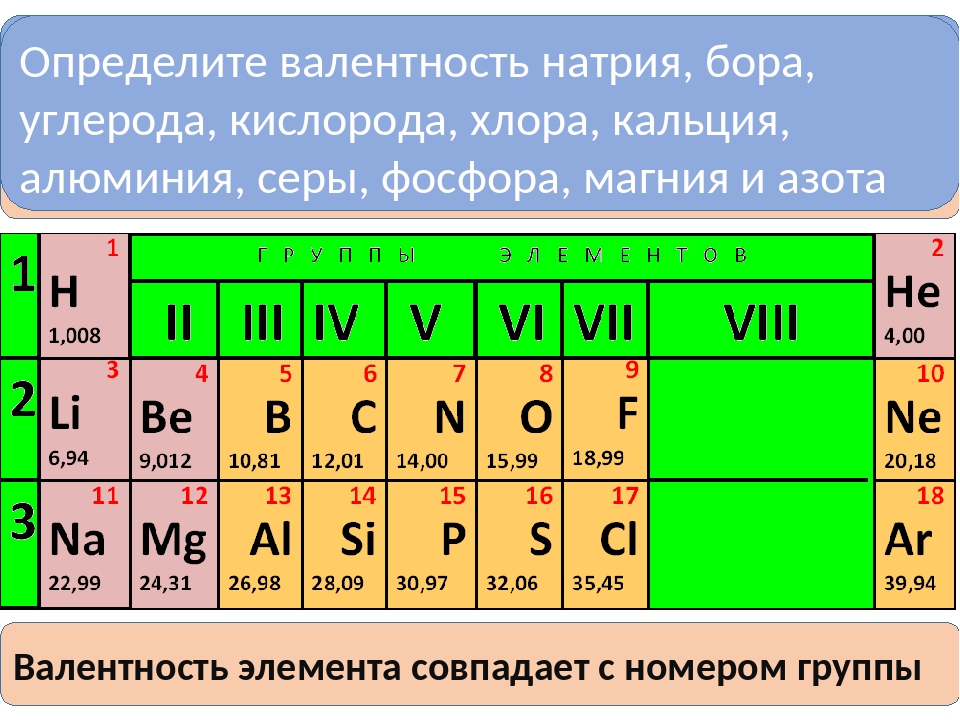
Давайте в нашем поиске самой печальной песни применим валентность и индекс энергетики.
Автор фото, Miriam Quick
Подпись к фото,Таблица, составленная Мириам Куик по данным Spotify — на ней 1080 песен, достигших вершин хит-парада Billboard Hot 100 с июля 1958-го по апрель 2018-го
Вид этой таблицы может показаться знакомым психологам, исследующим и применяющим влияние музыки. Эти специалисты часто используют визуализацию звучащих мелодий, исходя из валентности и энергетики («заводной» способности), и разделяют их на квадранты, основываясь на четырех базовых эмоциях — печаль, счастье, гнев и спокойствие.
Грустные песни (низкая валентность, низкая энергетика) — в нижнем левом углу таблицы, радостные песни (высокая валентность, высокая энергетика) — в правом верхнем, злые песни (низкая валентность, высокая энергетика) — в верхнем левом, спокойные песни (высокая валентность, низкая энергетика) — в нижнем правом.
В целом, хиты, поднимавшиеся на первое место, как правило довольно жизнерадостны — веселый угол нашей таблицы густо населен. Наиболее оптимистичные — Hey Ya!, Macarena (ух!) и… Brown Sugar группы Rolling Stones.
Наиболее оптимистичные — Hey Ya!, Macarena (ух!) и… Brown Sugar группы Rolling Stones.
Don’t Worry, Be Happy — наиболее спокойная, расслабленно звучащая песня. Lose Yourself Эминема царствует в квадранте гнева.
В таблице это не отразилось, но более счастливо звучащие песни как правило наиболее танцевальны. Какая из них самая танцевальная? Это Ice Ice Baby Ваниллы Айс, с чем я абсолютно согласна.
Но давайте наконец посмотрим, какие песни алгоритм Spotify считает самыми несчастными. Заглянем в угол грусти и меланхолии.
Пять самых грустных песен из хитов номер один Billboard
(1958-2018 гг., на основании данных Spotify о валентности и энергетике)
1. The First Time Ever I Saw Your Face — Роберта Флэк (номер 1 в 1972 г.)
2. Three Times a Lady — Commodores (1978 г.)
3. Are You Lonesome Tonight? — Элвис Пресли (1960 г. )
)
4. Mr Custer — Ларри Верн (1960 г.)
5. Still — Commodores (1979 г.)
Итак, согласно этим данным, самая грустная песня, когда-либо поднимавшаяся на вершину хит-парада Billboard, начиная с 1958 года, — это The First Time I Ever Saw Your Face в исполнении Роберты Флэк.
Three Times a Lady группы Commodores — тоже медленная баллада о любви, а Mr Custer — комическая песенка о солдате, который не хочет воевать.
В общем, из пяти «самых грустных» таковыми с полной уверенностью можно назвать только песню Элвиса и Still, еще один номер Commodores. Так что этот алгоритм, безусловно, полезная штука, но в случае с Лайонелом Ричи (Commodores) он не особо помогает.
Безусловно, на настроение песни сильно влияет ее текст. Данные Spotify, судя по всему, не принимают слова во внимание, хотя в некоторых исследованиях и при составлении «Индекса мрака» группы Radiohead удалось найти способ учитывать степень грусти стихов, применяя анализ чувств.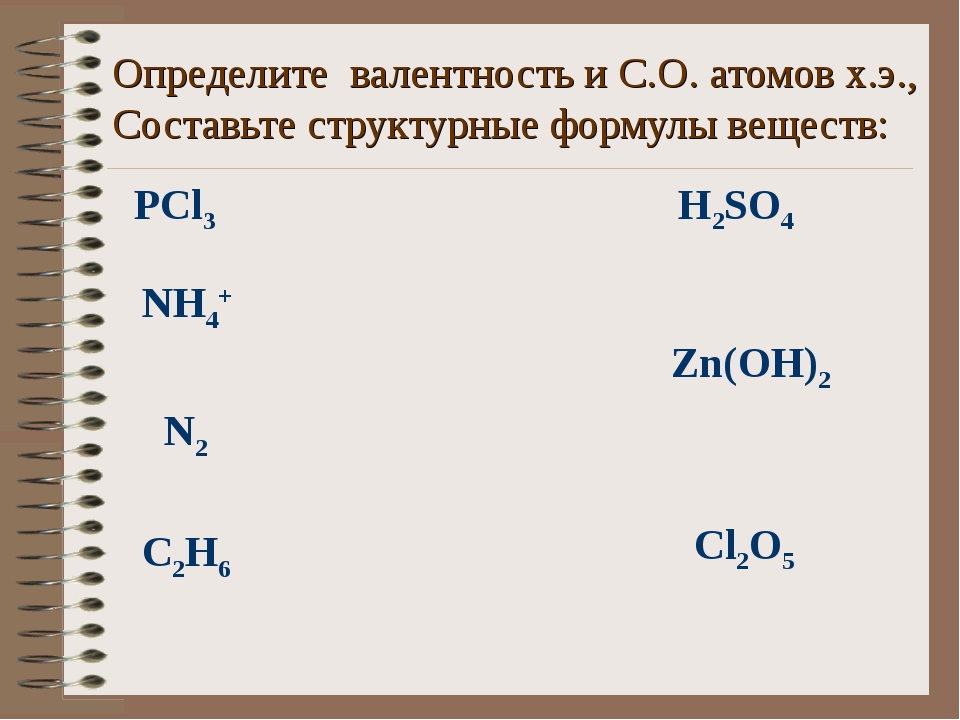
Но на чем же тогда основывается Spotify? Компания не публиковала об этом какой-либо информации, поэтому я решила задать этот вопрос Гленну Макдональду, алхимику данных Spotify. Да-да, это официальное название его должности в компании.
База данных с валентностью была разработана при помощи данных об обучении людей, затем экстраполированных в машинное обучение, сказал он мне. Spotify использует метаданные песни, чтобы помочь редакторам составлять плейлисты, основанные на том или ином настроении, которые так популярны в этом мобильном приложении — «Жизнерадостные поп-хиты», «Легкая музыка нулевых», «Отличный день»…
«Эти данные помогают найти то, на что у обычного человека просто не хватило бы времени. Но человек может выносить субъективные и культурно обоснованные оценки, что компьютеру недоступно».
Тогда я спросила Макдональда, что именно алгоритм научился выделять как радостное и грустное в песне, но его ответ проясняет не слишком много: «Валентность — один из базовых элементов, поэтому ее невозможно объяснить с помощью других».
В настоящее время компания работает над повышением качества системы эмоциональной классификации, обратившись к пользователям с просьбой пометить короткие отрывки из песен словами об их настроении (я, кстати, попробовала это делать — оказалось не так просто).
Этим занимается не только Spotify. Mood 2.0 компании Gracenote использует для классификации настроения песен нейронную сеть, и результаты этого чрезвычайно специфические: например, Give it Away группы Red Hot Chili Peppers на 38% «громкая и задиристая» и на 2% — «отталкивающий тревожный ритм».
Машинное обучение также применяется и в академической сфере — в исследованиях того, как определить эмоции, возникающие от музыки. А это, по словам профессора Паивы, непростая задача: «Эмоциональное восприятие музыки по своей природе субъективно: разные люди от одной и той же песни могут испытывать разные эмоции».
Еще один серьезнейший барьер на пути исследователей — это то, что «не очень понятно, как и почему некоторые элементы в музыке вызывают специфическую эмоциональную реакцию слушателей». Это правда, я вот тоже не понимаю, почему плакала в некоторых местах песен Smiths.
Это правда, я вот тоже не понимаю, почему плакала в некоторых местах песен Smiths.
«Милая, это же наша любимая песня!»
Компьютеры сейчас хорошо обучаемы, но они по-прежнему лишены странностей, свойственных человеку, нашего понимания, основанного на знании культурного контекста, нашей способности помещать в этот — порой очень специфический — контекст то, что мы слышим.
Кроме того, у компьютеров нет эмоциональных воспоминаний, тех автобиографических ассоциаций, которые придают музыке новое значение, обогащают наши чувства, когда мы слушаем песню.
(Эту способность музыки каждый раз напоминать нам о сильных эмоциональных переживаниях из прошлого специалисты назвали феноменом «Милая, это же наша любимая песня!».)
«Когда вы слышите песню, вам тут же может вспомниться, где и когда вы впервые ее услышали, и это влияет на то, какие чувства она у вас теперь всегда будет вызывать, — объясняет исследователь данных Чарли Томпсон. — Когда песню слушает компьютер, он видит перед собой лишь волновую диаграмму».
— Когда песню слушает компьютер, он видит перед собой лишь волновую диаграмму».
Алхимик данных компании Spotify Гленн Макдональд согласен с этим: «Компьютеры не воспринимают музыку в человеческом смысле. Люди всегда слушают ее в определенном контексте — эмоциональном, ностальгическом, языковом, контексте своих опасений и мечтаний. Это то же, что спросить, какие прекрасные виды открываются перед летящим в небе лайнером. Лайнер не ценит красоты видов, это чисто человеческая штука».
Подпись к фото,Песня The First Time Ever I Saw Your Face в исполнении Роберты Флэк, согласно данным Spotify, — самая грустная из тех, что возглавляли хит-парады Billboard. Да неужели?
Так что же делает алгоритм, когда определяет настроение песни? Ведь он не способен классифицировать эмоции, которые вы испытываете, — по крайней мере, пока.
Вместо этого, говорит Паива, большинство современных систем MER (сокращение от music emotion recognition — распознавание эмоций музыки) делает упор на «предполагаемые эмоции». То есть на эмоции, которые тот или иной человек «узнает» в песне: у Эминема — гнев, в диско 1970-х — сексуальность и веселье и так далее.
То есть на эмоции, которые тот или иной человек «узнает» в песне: у Эминема — гнев, в диско 1970-х — сексуальность и веселье и так далее.
(Есть еще один тип эмоции — передаваемая, то есть та, которую композитор или исполнитель, стараются передать слушателям.)
Ощущаемая и предполагаемая эмоции одной и той же песни могут весьма отличаться друг от друга, и двусмысленность слов, которыми мы, люди, описываем то, что чувствуем, ставит компьютеры в тупик.
«Когда человек помечает песню словом «ненависть», это может означать, что она про ненависть — или что этот человек ненавидит подобные песни», — объясняет профессор Паива.
В настоящее время лучшие системы MER примерно на 70% точны в своих оценках статичных эмоций 30-секундных музыкальных отрывков, рассказал он мне.
То есть если вы предложите такому продвинутому алгоритму 10 отрывков песен, он припишет трем из них ошибочные эмоции. Результат неидеальный, и сведение всего настроения песни к единственному показателю лишает нас значительной доли информации о том, как меняются эмоции на протяжении всего прослушивания.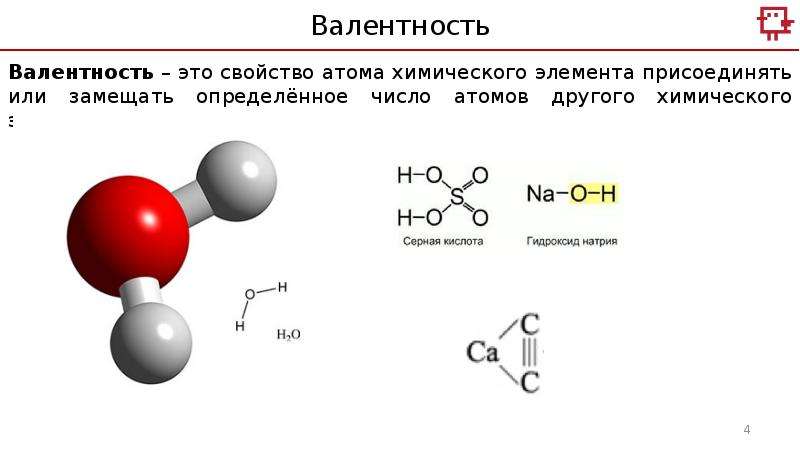
Автор фото, Getty Images
Подпись к фото,В пятерку самых грустных попали две песни группы Commodores — Three Times a Lady и Still
Однако качество оценок систем MER улучшается с течением времени. Через 5-10 лет они будут куда точнее.
У этой технологии хороший потенциал. По мнению Паивы, ее можно будет применять во многих сферах — от музыкальной терапии до индустрии видеоигр и рекламы.
«Мы живем в интересное время», — говорит Никола Диббен, профессор музыки Шеффилдского университета (Великобритания). По ее словам, данные таких стриминговых приложений, как Spotify, Pandora, Tidal или YouTube открывают перед исследователями захватывающие возможности.
Бездонные океаны данных о вкусах аудитории, собранные этими компаниями, — ценный источник знаний для понимания того, как люди используют музыку в тот или иной момент своей жизни — поют ли они в душе или рыдают над какой-то песней после размолвки с любимым.
Когда хочется поплакать
А теперь — о подвохе. Во время одного из выступлений в начале этого года главный экономист Банка Англии Энди Холдейн процитировал исследование ученых калифорнийского университета Клермонт-Грэдуэйт, где отмечалось наличие связи между настроением в песне и потребительским доверием.
Исследователи продемонстрировали, что по флуктуациям в среднем настроении песен, которые слушают пользователи разных стриминговых приложений (в том числе Spotify), можно спрогнозировать месячную прибыль того или иного финансового индекса.
Похоже, что музыкальные вкусы меняются вместе с движением на рынках. Идея необычная, но логика за ней вполне простая: в хорошие времена мы больше слушаем радостной музыки, а в плохие — грустной.
Между тем, в своем выступлении экономист предложил пойти дальше: «Зачем останавливаться на музыке? Знание предпочтений людей в чтении, телепрограммах и радио позволит заглянуть в их души».
Автор фото, Getty Images
Подпись к фото,Из пяти «самых грустных» такими, без сомнения, можно считать только Still и песню Элвиса Пресли Are You Lonesome Tonight?
В речах Холдейна прозвучало что-то оруэлловское. Хотим ли мы открывать свою душу стриминговым компаниям и СМИ? Хотим ли мы, чтобы они продавали друг другу данные о наших вкусах? А если к нам в душу проникнут хакеры?
Конечно, тут легко впасть в излишнюю драматизацию, но доступность данных, собранных разными стриминговыми службами, в сочетании с другой информацией (например, о расположении пользователя) и попытками использовать это для продажи нам продуктов и услуг ставит вопросы о неприкосновенности частной жизни.
Такие вопросы зазвучат куда более громко, если системы MER научатся понимать, что происходит в голове слушателя, точно определять его эмоции, а не исходить из того, что написано на ярлыке той или иной песенки.
«В отличие от нотной записи, виниловых пластинок или кассет, эти новые музыкальные объекты активно слушают нас», — писали в 2016 году о стриминговых услугах Ричард Перселл и Ричард Рэндолл.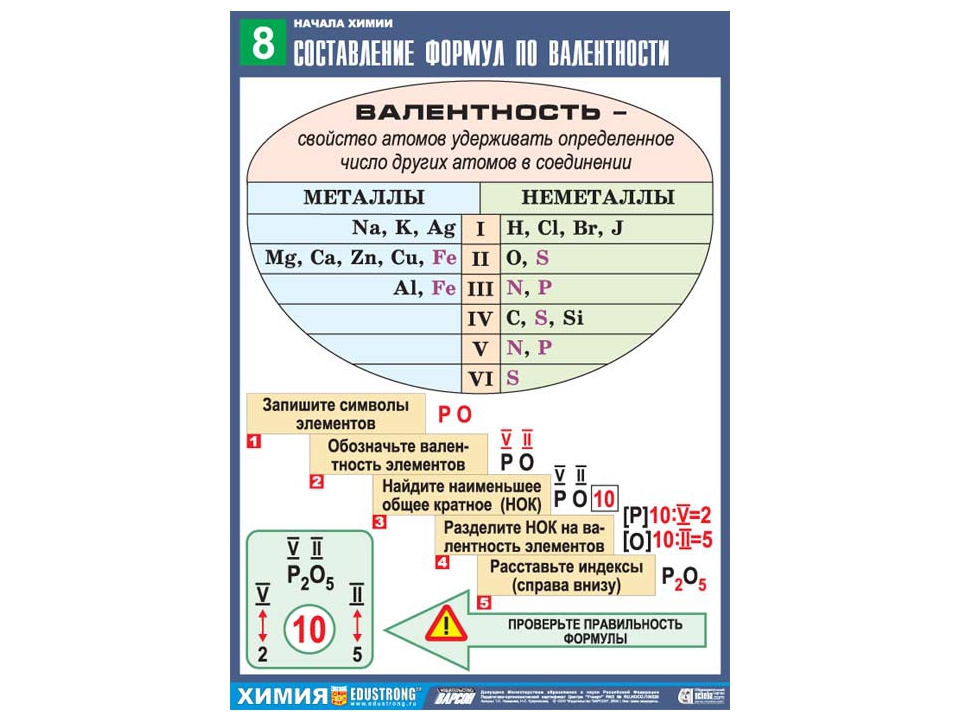 Эти мобильные приложения собирают информацию о наших привычках и, параллельно, как считают многие, меняют их с помощью алгоритмов рекомендаций.
Эти мобильные приложения собирают информацию о наших привычках и, параллельно, как считают многие, меняют их с помощью алгоритмов рекомендаций.
Разрешение коммерческим компаниям заглянуть в нашу душу может привести к тому, что они будут знать черты нашего характера. Если, допустим, вам нравится грустная музыка, вам присуща открытость новому опыту и эмпатия — в куда большей степени, чем тем, кто предпочитает слушать что-то «громкое и задиристое».
Но вот парадокс: грустные песни обычно очень приятно слушать. Они не делают нас грустнее, как делает нас веселей мажорная музыка, и не напрягают, как музыкальное сопровождение в фильме ужасов.
Имеется бесчисленное количество теорий относительно того, почему нам так приятно слушать грустные песни. Возможно, это сродни катарсису? Может быть, мы чувствуем себя лучше, понимая, что эта печаль касается не нас? Или они — своеобразная терапия, повод для рефлексии?
Точно мы пока не знаем, но желание понять, почему музыка нас так трогает, подводит к более сложным вещам, чем простое распихивание песен по четырем эмоциональным углам в таблице.
Распутывание клубка человеческих эмоций — задача для компьютеров пока неподъемная, даже если бы мы очень этого хотели и позволили машине порыться в нашей душе.
Возможно, людям просто нравится отпускать на волю свои чувства, свободно погружаться в звуки и плакать, когда вдруг захочется поплакать. Это не слезы горя, но это все равно слезы.
Прочитать оригинал этой статьи на английском языке модно на сайте BBC Culture.
Вопросы и правильные ответы Химического диктанта 2021
Задания Химического диктанта 1 первый вариант 2020 года.
1. В окружающем нас мире мало чистых веществ, мы живем среди смесей. Найдите одну из них в приведенном ниже списке.
1) гипс 2) сталь 3) сода 4) нашатырь
2. Человеческому организму для нормального функционирования необходимо более 30 элементов. Какой из перечисленных ниже входит в это число?
1) иод 2) технеций 3) плутоний 4) радий
3. Многие любители прекрасного наслаждаются изделиями Императорского фарфорового завода, расписанными различными оттенками синего. Какой элемент придает краскам такой цвет?
Какой элемент придает краскам такой цвет?
1) кремний 2) алюминий 3) натрий 4) кобальт
4. Все металлы хорошо проводят электричество, это их главный отличительный признак. Но есть и один неметалл, который обладает таким же свойством. Назовите его.
1) водород 2) хлор 3) алмаз 4) графит
5. Предметы, изображенные на рисунках, несмотря на внешнее несходство, содержат одно и то же вещество. Укажите формулу этого вещества.
1) CuO 2) Al2O3 3) P2O5 4) CaCO3ВСЕРОССИЙСКИЙ ХИМИЧЕСКИЙ ДИКТАНТВАРИАНТ 11
6. Вопрос для знатоков химии. Одно из основных понятий химии – валентность. Ее легко определить по структурной формуле. Но попробуем найти валентность по молекулярной формуле. В какой молекуле все атомы имеют разную валентность?
1) CO2 2) S8 3) HCN 4) C6H67.
При обмороке к лицу пострадавшего подносят ватку, смоченную нашатырным спиртом. Действующим началом этого средства является…
1) спирт 2) аммиак 3) ацетон 4) вода
8. Золотые медали олимпийских игр Сочи-2014 изготовлены из серебра и покрыты золотом, а вставки в них сделаны из синтетического полимера. Какой полимер использовали для этого?
Какой полимер использовали для этого?
1) крахмал 2) полиэтилен 3) силикон 4) поликарбонат
9. Современные волокна обладают многими ценными свойствами. Есть волокна прочнее стали и при этом легче ее в 5 раз. А самое термостойкое волокно, которое выдерживает температуру до 2500 оС, состоит из атомов только одного элемента. Как называется это волокно? 1) углеродное 2) полиэтиленовое 3) арамидное 4) полиэфирное
10. Во время праздников на улицах надувают воздушные шары. Потом они постепенно сдуваются. Быстрее всех сдуется резиновый шарик, заполненный…
1) гелием 2) азотом 3) кислородом 4) воздухом 11.
Д. И. Менделеев – всемирно известный ученый, поэтому вокруг его имени сформировалось множество мифов. Какое утверждение о Менделееве не является мифом, а соответствует истине?
1) Менделеев изобрел рецепт «русской водки». 2) Поступая в университет, Менделеев завалил экзамен по химии. 3) Периодическая таблица приснилась Менделееву. 4) Менделеев был тестем поэта Александра Блока.
12. На картине, которая находится в одном из музеев Винницы, изображен эпизод встречи двух великих ученых, который имел место в 1855 г. в Симферополе. Кто изображен на картине рядом с молодым Д. И. Менделеевым?
1) И. П. Павлов 2) Н. И. Пирогов 3) З. Фрейд 4) Гиппократ
13. К юбилею Периодического закона в России выпущена периодическая таблица, в которой каждому элементу соответствует тематическая почтовая марка. Какой элемент в этой таблице обозначен маркой Австралии, изображающей рекламу 1930-х гг.?
1) неон 2) натрий 3) теллур 4) молибден
14. Элемент X в виде ионов входит в состав живых клеток, консервирующих средств и подушек безопасности. В виде простого вещества на Земле не встречается, в жидком виде применяется для охлаждения атомных реакторов. Какой это элемент?
1) ртуть 2) углерод 3) натрий 4) азот
15. Зачем зубной врач облучает ультрафиолетовым светом пломбируемый зуб?
1) чтобы лучше видеть 2) для профилактики кариеса 3) для разложения костной ткани 4) для ускорения полимеризации материала пломбы
16. Парниковый эффект сильно заботит ученых-экологов и общественников – борцов за чистую природу. Они требуют ограничить выбросы в атмосферу диоксида углерода – одного из парниковых газов. Однако в атмосфере есть и другие парниковые газы. Назовите один из них.
Парниковый эффект сильно заботит ученых-экологов и общественников – борцов за чистую природу. Они требуют ограничить выбросы в атмосферу диоксида углерода – одного из парниковых газов. Однако в атмосфере есть и другие парниковые газы. Назовите один из них.
1) водород 2) гелий 3) водяной пар 4) кислород
17. В быту можно случайно провести нежелательные химические превращения. Так, железный гвоздь покраснеет, если его опустить в раствор…
1) иода 2) соды 3) гашеной извести 4) медного купороса
18. Лабораторные приборы с каждым годом становятся все более миниатюрными. Изображенный на фото прибор – это электронный датчик…
1) плотности 2) интенсивности окраски 3) температуры 4) температуры плавления
19. Экологические требования иногда приводят к весьма неожиданным перестройкам в цепочках химической промышленности. Так, ужесточение требований к очистке нефти и газа привело к появлению дешевого сырья для одного из химических производств. Это сырье – …
1) водород 2) ртуть 3) сера 4) углерод
20. Один из главных законов природы объясняет, почему происходят химические явления и чем обратимые явления отличаются от необратимых. Какая величина фигурирует в этом законе?
Один из главных законов природы объясняет, почему происходят химические явления и чем обратимые явления отличаются от необратимых. Какая величина фигурирует в этом законе?
1) энергия 2) энтропия 3) теплота 4) масса
21. Химия зародилась в космосе. Изучая химический состав небесных тел, ученые определяют их возраст и историю, узнают о протекающих в них процессах. Взглянув на фотографию небесного тела, определите, атомов какого элемента в нем больше всего.
1) водород 2) гелий 3) азот 4) кислород
22. Когда закончится нефть, людям придется перейти на синтетическое топливо. Его уже научились получать из двух газов, один из которых является простым веществом. Какое это вещество?
1) азот 2) хлор 3) кислород 4) водород
23. В природе все взаимосвязано: в одних процессах вещества расходуются, в других образуются. Какое вещество потребляется животными организмами, но производится растительными?
1) ДНК 2) водород 3) кислород 4) углекислый газ
24. Люди очень давно используют металлы. Изображенное на фото изделие из олова использовали в Средние века в качестве…
Люди очень давно используют металлы. Изображенное на фото изделие из олова использовали в Средние века в качестве…
1) денег 2) оружия 3) украшения 4) эталона массы
25. Некоторые иностранные научно-популярные книги по химии издают без участия научного редактора. Это чревато ошибками. Ниже приведены четыре предложения из одной хорошей книги. Найдите ошибочное.
1) Вещества – они и есть вещества, и никакой «витальной сущности» в них нет.
2) Фосфаты (т.е., полностью окисленные фосфорные соли) играют ключевую роль в биохимии, поскольку относятся к числу важнейших компонентов ДНК.
3) Если подвергнуть металлический натрий воздействию газообразного хлора, можно получить соль.
4) В своем аппарате он [Муассан] использовал электролиз… и пробки из минерала флюорита…, проводя все реакции в химически устойчивом, но невероятно дорогом сосуде из платины и иридия при охлаждении до – 500 оС.
Что такое валентные электроны и как их найти? Где они расположены?
Валентные электроны — это те электроны, которые находятся во внешней оболочке, окружающей атомное ядро.
Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи в химическом соединении — количество связей, которые могут быть образованы между двумя атомами.
Поскольку ковалентные связи образуются за счет разделения электронов в конечной оболочке, число указывает, сколько связей может быть образовано.
Что такое валентные электроны?
Валентные электроны — это электроны, расположенные на внешней оболочке атома. Другими словами, это электроны, которые могут быть получены или потеряны в ходе химической реакции.
Где валентные электроны?
Независимо от типа химической связи между атомами, будь то ионная, ковалентная или металлическая связь, изменения в атомной структуре ограничиваются электронами во внешней оболочке, то есть валентными электронами.
Самый простой метод — это сослаться на атомную конфигурацию элемента и просто подсчитать электроны в самой внешней оболочке. Однако это будет чрезвычайно трудоемкая задача, поскольку нам, возможно, придется рыться в учебниках, чтобы найти конфигурации, которых мы не знаем.
Однако это будет чрезвычайно трудоемкая задача, поскольку нам, возможно, придется рыться в учебниках, чтобы найти конфигурации, которых мы не знаем.
Однако не стоит беспокоиться, так как существует гораздо более простой способ определения этого желанного числа. Это более общий подход, требующий всего лишь вызова одного небольшого великолепного прямоугольного листа бумаги — таблицы Менделеева.
Чтобы определить количество валентных электронов элемента, нам нужно только обратиться к периодической таблице и найти положение элемента в ней.
Валентные электроны и таблица Менделеева
Периодическая таблица Менделеева представляет собой четкое расположение всех элементов, открытых на данный момент. Элементы расположены слева направо в порядке возрастания их атомных номеров или количества протонов или электронов, которые они содержат.
Элементы делятся на четыре категории: элементы основной группы, переходные элементы, лантаноиды и актиниды.Последние два также называются внутренними переходными элементами .
Таблица содержит всего 18 столбцов, формально известных как группы, , а также строки, формально известные как периода. В подтаблице вверху 7 строк, а внизу — 2 строки. Переходные элементы образуют мост или закрепляют переход между элементами 2-й и 13-й групп.
Как найти валентные электроны?
Когда мы спускаемся по группе, количество валентных электронов остается прежним, хотя количество оболочек увеличивается.
В то время как валентные электроны за период постепенно поднимаются на единицу, количество оболочек остается неизменным. Номер периода (номер строки, чтобы напомнить вам), в котором можно найти элемент, указывает количество оболочек, окружающих его ядро.
Итак, какое значение имеет номер группы?
Валентные электроны элементов, отличных от переходных — элементы основной группы
В то время как номер периода указывает количество оболочек, номер группы указывает количество валентных электронов во внешней оболочке. В частности, число в разряде единиц. Однако это верно только для основных элементов группы — элементов, населяющих группы 1-2 и 13-18.
В частности, число в разряде единиц. Однако это верно только для основных элементов группы — элементов, населяющих группы 1-2 и 13-18.
Правило неприменимо к элементам перехода и внутренним элементам перехода (мы рассмотрим эту причину через минуту). Например, натрий (Na) находится в периоде 3, группе 1, что означает, что он имеет 3 оболочки и один электрон в валентной оболочке.
Или вы можете рассматривать хлор в Группе 17. Соответственно, чтобы определить его валентные электроны, мы должны искать только число вместо единиц: 7.Как и ожидалось, это именно количество электронов в его валентной оболочке.
Этот метод простого обращения к периодической таблице и определения соответствующего номера группы устранил хлопоты и сложности, которые когда-то сопровождали трудный поиск индивидуальных атомных конфигураций.
А как насчет валентных электронов промежуточных элементов? Конечно, мы не должны забывать о лантаноидах и актинидах…
Краткое объяснение того, как оболочки заполняются электронами
Переходные элементы мало чем отличаются от металлов, которые идут плечом к плечу в элементах основной группы. Они очень похожи на металлы: они пластичны, пластичны и могут проводить как тепло, так и электричество. Тот факт, что два лучших проводника — медь (Cu) и алюминий (Al) — являются переходными металлами, показывает, насколько их свойства перекрываются.
Они очень похожи на металлы: они пластичны, пластичны и могут проводить как тепло, так и электричество. Тот факт, что два лучших проводника — медь (Cu) и алюминий (Al) — являются переходными металлами, показывает, насколько их свойства перекрываются.
Однако они не дублируют результаты, полученные нами с помощью вышеуказанного метода. Мы не можем подсчитать их валентные электроны, просто ссылаясь на номер их группы.
Чтобы понять это исключение, нам нужно понять, как электроны занимают оболочки в любом элементе .
Однако сначала мы должны отучиться от школьного метода заполнения оболочек вокруг атомного ядра: помните 2..8..8..18 и так далее? Что ж, есть причина, по которой мы распределяем электроны именно таким образом.
Аналогия с солнечной системой, которая описывает упорядочение электронов вокруг атома, совершенно неверна. Его следует немедленно устранить, но поскольку он снимает трудности, связанные с представлением модели закона ual , учебники для средней школы полагаются в первую очередь на это элементарное объяснение.
Электроны не занимают твердые оболочки вокруг своего ядра. Фактически, их положение вокруг ядра весьма неопределенно. Они могут занимать только определенные энергетические уровни вокруг ядра. Скорее всего, их там и можно найти. Технически эти уровни называются квантовыми состояниями и обозначаются так называемыми квантовыми числами n .
Теперь следующее предложение может показаться лицемерным, но квантовые числа можно рассматривать как старые добрые оболочки, но теперь с подоболочками, которые технически известны как орбитали (s, p, d, f).Несмотря на это упрощение, он вполне подходит для ускоренного курса, подобного этому.
Существует правило, ограничивающее количество электронов, которое может вместить суб-оболочка: s-2, p-6, d-10 и f-14. Если этого было недостаточно, добавляя к бреду, оболочки можно заполнять только в определенном порядке, указанном ниже. Назовем его правилом .
Электроны должны заполняться только слева направо именно в этом порядке.
Если бы мы неосознанно распределяли электроны относительно того, как выстроены субоболочки, как показано на рисунке выше, кальций (Ca) с атомным номером 20 имел бы конфигурацию 2,8,10 (2, 2+ 6, 2 + 6 + 2).Любой школьный учебник химии скажет вам, что это неверно, так как точная конфигурация — 2,8,8,2.
Однако, поскольку мы должны соблюдать правило , мы наблюдаем, что 4 должны быть заполнены перед 3d, , так что теперь 8 в 3-й оболочке и 2 в 4-й, что составляет конфигурацию: 2,8,8 , 2. Вуаля! Как весело воскликнул бы Ричард Фейнман: «Удовольствие узнавать все! К сожалению, радость наполовину прожита — причина , самого правила , эта кажущаяся абсурдность, выходит за рамки данной статьи.
Хорошо, теперь, когда мы знаем, как заполняются оболочки, мы можем пойти дальше и найти количество валентных электронов в переходных элементах.
Валентные электроны лантаноидов и актинидов (переходные и внутренние переходные элементы)
Рассмотрим скандий (Sc) с его атомным номером 21. Заполняя электроны в соответствии с нашим правилом , , мы видим, что 21-й электрон занимает 3d-суб- оболочка. Однако, поскольку ранее заполненная 4-я оболочка (4s) имеет 2 электрона и, по-видимому, является самой внешней оболочкой, количество валентных электронов равно 2.
Заполняя электроны в соответствии с нашим правилом , , мы видим, что 21-й электрон занимает 3d-суб- оболочка. Однако, поскольку ранее заполненная 4-я оболочка (4s) имеет 2 электрона и, по-видимому, является самой внешней оболочкой, количество валентных электронов равно 2.
Точно так же каждый переходный элемент в 4-м периоде должен иметь 2 валентных электрона. Причина в том, что хотя 3d заполняется раньше, чем 4s, два электрона, расположенные в 4-й оболочке, являются обитателями самой внешней оболочки и по праву заслуживают обозначения валентных электронов.
Фактически, это верно для переходных элементов в каждый период. Рассмотрим Золото (Au), находящееся в 6 периоде (строке) и 11 группе (столбце). В процессе наполнения его раковин можно понять, что после начинки 5d следует начинка 6s.А поскольку 6-я оболочка расположена выше 5-й, количество валентных электронов равно… * барабанная дробь * … 2!
Тем не менее, именно так электроны в идеале выстроились бы в линию. Энергетические различия между этими оболочками ничтожны, и электроны (или Природа, если на то пошло) жаждут стабильности больше всего на свете. Электрон с радостью совершит прыжок на соседнюю оболочку с относительно эквивалентной энергией, чтобы достичь более стабильной конфигурации.
Энергетические различия между этими оболочками ничтожны, и электроны (или Природа, если на то пошло) жаждут стабильности больше всего на свете. Электрон с радостью совершит прыжок на соседнюю оболочку с относительно эквивалентной энергией, чтобы достичь более стабильной конфигурации.
Хорошим примером является непостоянная конфигурация атома меди (Cu).
Загадочный случай валентных электронов меди
Медь имеет 29 электронов, поэтому самые задние электроны выстраиваются в линию как… 4s2-3d9. Для меди конфигурация немного тревожит — более устойчивая конфигурация будет иметь 10 электронов в трехмерной оболочке, и это именно то, что мы наблюдаем!
Поскольку энергии оболочек сравнимы, электрон с 4s совершает прыжок в 3d, чтобы получить стабильную конфигурацию. Количество валентных электронов теперь 1!
Ряд элементов среди переходных элементов демонстрируют эту странность, которая также наблюдается на внутренних переходных элементах из-за сравнимых уровней энергии оболочек f, d и s.
Таким образом, можно сказать, что количество валентных электронов для переходных элементов и внутренних переходных элементов изменяется непредсказуемым образом.
Хотя количество валентных электронов для переходных элементов все еще можно предсказать — и большинство из них в конечном итоге равняется 2, — такое предсказание для внутренних переходных элементов невозможно имитировать.
Прихотливое поведение их валентных электронов, бесконечно дрожащих и подпрыгивающих в нерешительности, отрицает любые попытки получить уникальную стабильную конфигурацию, что делает предсказать количество валентных электронов практически невозможным!
Что вы знаете о валентных электронах?
Можете ли вы ответить на три вопроса на основе только что прочитанной статьи?
Начать викторинуВаш ответ:
Правильный ответ:
ДалееУ вас {{SCORE_CORRECT}} из {{SCORE_TOTAL}}
Пройти тест еще разРекомендуемая литература
1.
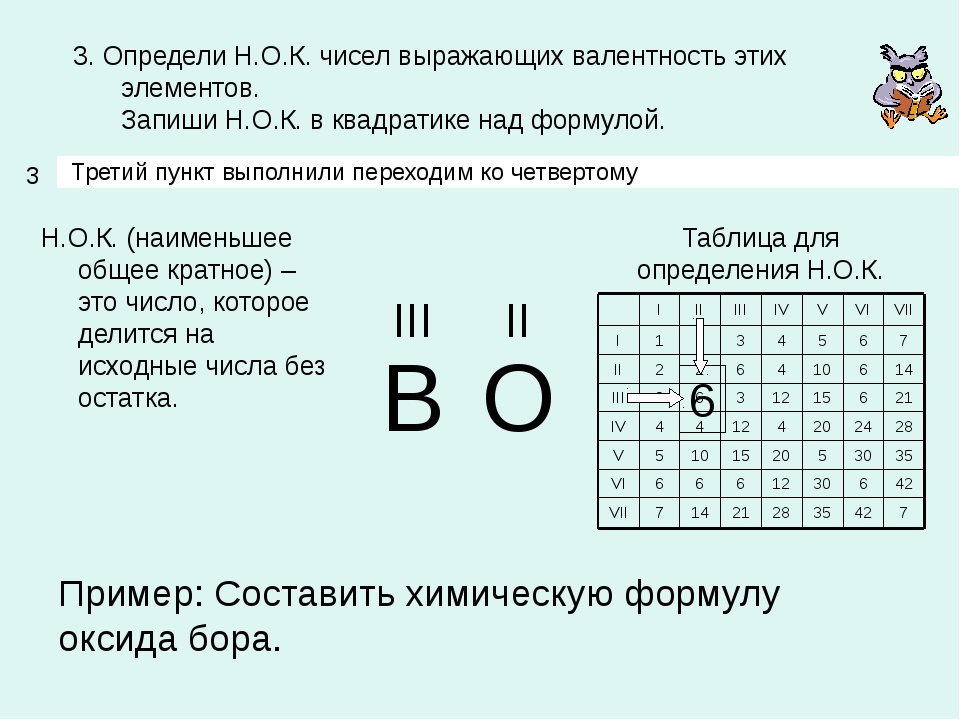 3: Валентные электроны и открытые валентности
3: Валентные электроны и открытые валентностиВалентный электрон — это электрон, который связан с атомом и может участвовать в образовании химической связи; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары. Присутствие валентных электронов может определять химические свойства элемента и то, может ли он связываться с другими элементами: для элемента основной группы валентный электрон может находиться только во внешней электронной оболочке.6 \)) химически инертен. Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, очень реактивен, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также очень реактивен из-за тенденции либо получить недостающие валентные электроны (тем самым образуя отрицательный ион), либо разделить валентные электроны (тем самым образуя ковалентную связь).
Подобно электрону во внутренней оболочке, валентный электрон обладает способностью поглощать или выделять энергию в виде фотона. Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Число валентных электронов
Число валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории.За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
Периодическая таблица химических элементов
| Группа периодической таблицы | Валентные электроны |
|---|---|
| Группа 1 (I) (щелочные металлы) | 1 |
| Группа 2 (II) (щелочноземельные металлы) | 2 |
| Группы 3-12 (переходные металлы) | 2 * (Оболочка 4s завершена и больше не может удерживать электроны) |
| Группа 13 (III) (борная группа) | 3 |
| Группа 14 (IV) (углеродная группа) | 4 |
| Группа 15 (V) (пниктогены) | 5 |
| Группа 16 (VI) (халькогены) | 6 |
| Группа 17 (VII) (галогены) | 7 |
| Группа 18 (VIII или 0) (благородные газы) | 8 ** |
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов. Вместо этого используется модифицированный метод счета d-электронов. ** За исключением гелия, у которого всего два валентных электрона.
Вместо этого используется модифицированный метод счета d-электронов. ** За исключением гелия, у которого всего два валентных электрона.
Концепция открытой валентности («валентность»)
Валентность (или валентность ) элемента является мерой его объединяющей способности с другими атомами, когда он образует химические соединения или молекулы. Концепция валентности была разработана во второй половине 19 века и успешно объяснила молекулярную структуру многих органических соединений.Поиски основных причин валентности привели к современным теориям химической связи, включая структуры Льюиса (1916), теорию валентных связей (1927), молекулярные орбитали (1928), теорию отталкивания пар электронов валентных оболочек (1958) и все продвинутые методы квантовой химии.
Объединяющая способность или сродство атома элемента определялась числом атомов водорода, с которыми он соединялся. В метане углерод имеет валентность 4; в аммиаке азот имеет валентность 3; в воде кислород имеет валентность два; а в хлористом водороде хлор имеет валентность 1. Хлор, поскольку он имеет валентность, равную единице, может быть заменен водородом, поэтому фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5 . Диаграммы валентности соединения представляют собой взаимосвязь элементов, линии между двумя элементами, иногда называемые связями, представляют насыщенную валентность для каждого элемента. [1] Примеры: —
Хлор, поскольку он имеет валентность, равную единице, может быть заменен водородом, поэтому фосфор имеет валентность 5 в пентахлориде фосфора, PCl 5 . Диаграммы валентности соединения представляют собой взаимосвязь элементов, линии между двумя элементами, иногда называемые связями, представляют насыщенную валентность для каждого элемента. [1] Примеры: —
Валентность описывает только связность, она не описывает геометрию молекулярных соединений или то, что сейчас известно как ионные соединения или гигантские ковалентные структуры.Линия между атомами не представляет собой пару электронов, как на диаграммах Льюиса.
Как определить валентность электрона
Валентный электрон — электрон внешней оболочки, связанный с атомом. В атомной химии он участвует в химической связи между атомами (только если внешняя оболочка открыта). Эти электроны могут существовать во внешней оболочке атома, но в случае переходных элементов они также могут жить во внутренней оболочке.
Валентный электрон играет жизненно важную роль в атомной химии.Это помогает в определении химических свойств элемента. Нет. валентных электронов определяет реакционную способность и связывающую способность атома. Согласно теории связи, частицы, которые имеют валентные электроны, делятся ими с другими, образуя химические связи. Чем выше нет. валентного электрона приводит к очень химически реакционному элементу.
Итак, чтобы определить реакционную способность атома, нам нужно определить номер. валентного электрона. Существуют разные способы оценки валентных электронов как для переходных, так и для непереходных элементов.
для непереходных элементов —
В идеальной периодической таблице вы увидите, что каждый столбец отмечен числами (от 1 до 18). Согласно правилу таблицы Менделеева, элементы, присутствующие в столбце, имеют одинаковые номера. валентного электрона в их внешней оболочке.
К сожалению, если в вашей периодической таблице не были присвоены номера для каждой группы, вы можете вручную начать нумеровать их от 1 до 18. Например, над столбцом / группой с H (водород) вверху вы должны написать 1 , а для столбца / группы, начинающейся с Be (Бериллий), вы должны написать 2 и так далее.
Например, над столбцом / группой с H (водород) вверху вы должны написать 1 , а для столбца / группы, начинающейся с Be (Бериллий), вы должны написать 2 и так далее.
Поскольку мы продолжаем работать с непереходными элементами, мы будем игнорировать переходные элементы (которые находятся в прямоугольной рамке, то есть группы с 3 по 12) из периодической таблицы.
Хорошо, тогда. Теперь найдите элемент, валентные электроны которого вы хотите найти. Если это переходный элемент, прокрутите вниз до следующей части этой статьи. Но если это не переходный период, давайте вместе разбираться с ними вместе.
Для облегчения понимания давайте выберем один общий элемент — кислород.Атомный номер кислорода составляет 8. Он находится на вершине группы 16. В этом методе мы можем узнать нет. валентных электронов от номера группы. Правило гласит: «Единица в номере группы — это номер. валентного электрона », т. е .:
- Группа 1: 1 Валентный электрон
- Группа 2: 2 Валентный электрон
- Группа 13: 3 Валентный электрон
- Группа 14: 4 Валентный электрон
- Группа 15: 5 Валентный электрон
- Группа 16: 6 Валентный электрон
- Группа 17: 7 Валентный электрон
- Группа 18: 8 валентных электронов (кроме гелия (He), который имеет два валентных электрона)
Поскольку кислород находится в группе 16, то номервалентного электрона для Кислорода 6.
для переходных элементов —
Что касается валентных электронов, переходные элементы ведут себя иначе, чем непереходные элементы. Объясняя далее, когда частицы располагались в атоме, они соответствовали определенной траектории для их ориентации, которая называется орбиталями. Частицы, которые добавляются на последней орбите, иногда показывают природу валентного электрона. Но после этого они этого не делают. Вместо этого электроны внутренней оболочки действуют как валентный электрон.Таким образом, количество валентных электронов зависит от того, как им манипулировать.
Как и раньше, группа нет. Могу сказать, что нет валентных электронов. Но в случае с переходным элементом он показывает диапазон возможного количества электронов. Это:
- Группа 3: 3 валентных электрона
- Группа 4: от 2 до 4 валентных электронов
- Группа 5: от 2 до 5 валентных электронов
- Группа 6: от 2 до 6 валентных электронов
- Группа 7: от 2 до 7 валентных электронов
- Группа 8: 2 или 3 валентных электрона
- Группа 9: 2 или 3 валентных электрона
- Группа 10: 2 или 3 валентных электрона
- Группа 11: 1 или 2 валентных электрона
- Группа 12: 2 валентных электрона
Я надеюсь, что это объяснение дало вам четкое представление о том, как определить валентный электрон атома.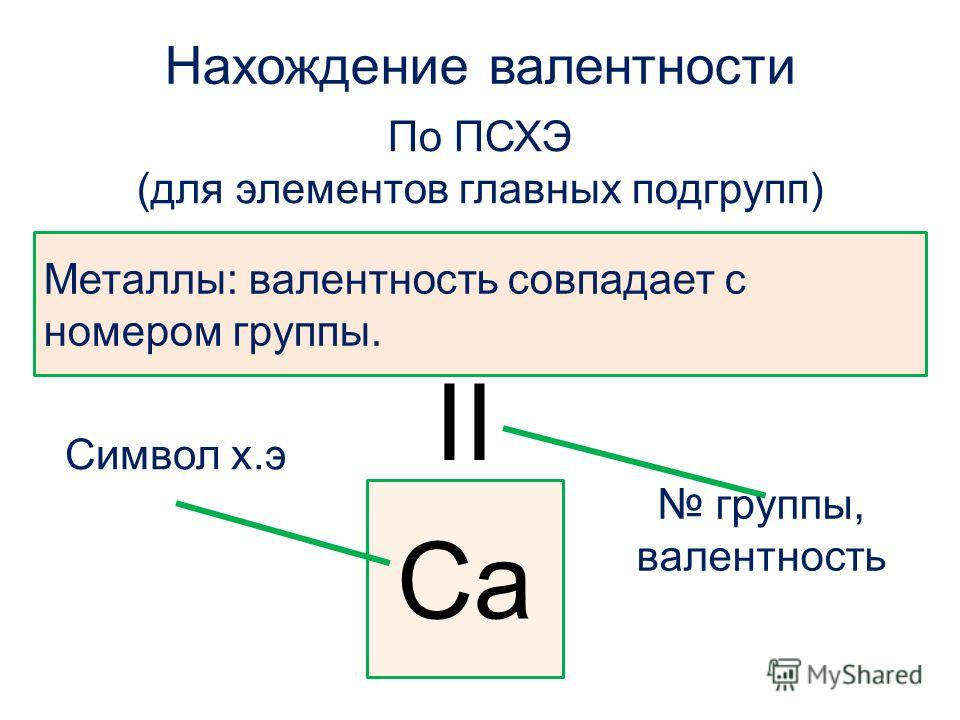
Сколько валентных электронов в цинке?
Что такое валентные электроны? — Урок для детей
Откройте для себя особую группу электронов, называемую валентными электронами.Изучите, как электроны расположены вокруг ядра атома, где расположены валентные электроны и как предсказать количество валентных электронов для элемента.
Эксперимент с катодным излучением: сводка и объяснение
В экспериментах с катодными лучами используются катодные лучи, пучки невидимых частиц в вакуумных ваннах, для изучения поведения субатомных частиц. Узнайте о первом эксперименте с катодными лучами в 1897 году и о том, как результаты были интерпретированы, чтобы доказать присутствие электронов.
Узнайте о первом эксперименте с катодными лучами в 1897 году и о том, как результаты были интерпретированы, чтобы доказать присутствие электронов.
Химические связи I: ковалентные
Ковалентная связь возникает, когда два атома разделяют электроны.Узнайте о химической связи, изучите, как создаются ковалентные связи, обнаружите валентные электроны и изучите структуру молекулы.
Что такое движение? — Определение и уравнения
Движение возникает, когда что-то движется, и является относительным, в зависимости от того, с чем измеряется движение. Изучите определение и уравнения движения и ускорения и научитесь использовать их на примере расчета.
Изучите определение и уравнения движения и ускорения и научитесь использовать их на примере расчета.
Изотопы и средняя атомная масса
Изотопы — это вариации одного и того же элемента с различным числом нейтронов и, следовательно, с разными атомными массами.Узнайте, как ученые рассматривают изотопы при вычислении средней атомной массы.
Электроотрицательность | Примеры и тенденции
Изучите определение электроотрицательности.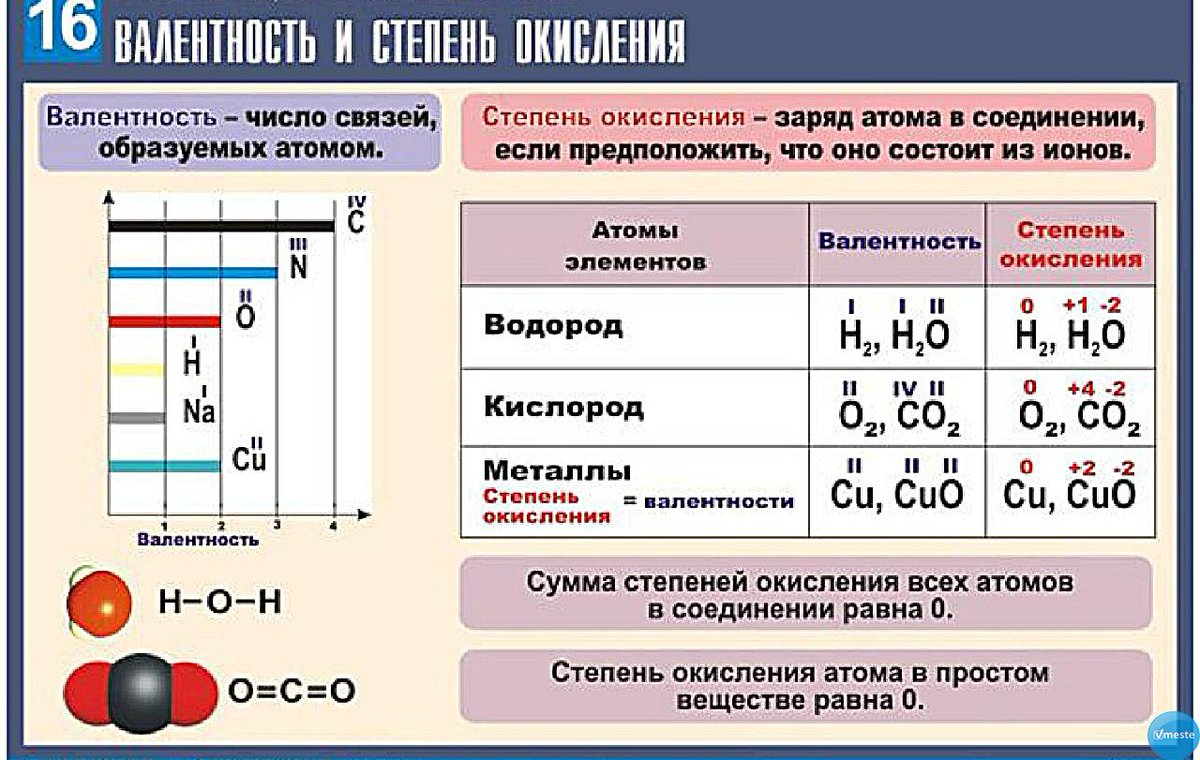 Посмотрите пример электроотрицательности и узнайте, как найти электроотрицательность, используя подходящие инструменты для измерения.
Посмотрите пример электроотрицательности и узнайте, как найти электроотрицательность, используя подходящие инструменты для измерения.
Правило октетов и структура атомов Льюиса
Что такое правило октетов? Изучите определение правила октета и структуры Льюиса.См. Правила построения структуры Льюиса и ее зависимости от таблицы Менделеева.
Точка эквивалентности: определение и расчет
Точка эквивалентности химической реакции достигается, когда количество реагентов достигает идеального. Узнайте больше о точках эквивалентности, более подробно изучив их определение, а также простые, сложные и титрующие примеры расчета.
Узнайте больше о точках эквивалентности, более подробно изучив их определение, а также простые, сложные и титрующие примеры расчета.
Elements для детей: определение и факты
Узнайте о различных элементах, из которых состоит вся материя Вселенной.Узнайте, что определяет элементы, их состояние материи, атомный номер и символ элементов, а также как они расположены в периодической таблице.
Теплопередача и фазовые изменения
Теплообмен происходит, когда предметы с разными температурами вступают в контакт, а фазовые переходы происходят, когда температура влияет на расстояние между молекулами.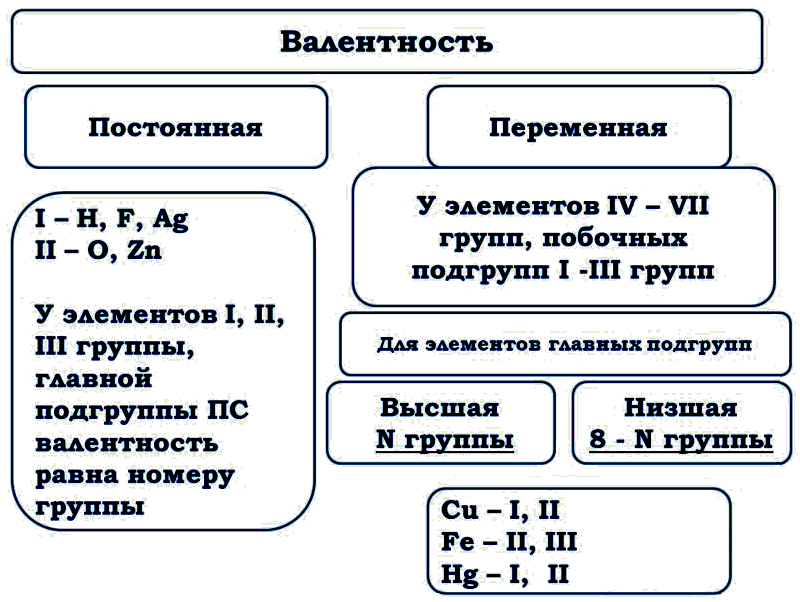 Узнайте о теплопередаче и фазовых изменениях, в том числе о роли, которую первое может сыграть на втором.
Узнайте о теплопередаче и фазовых изменениях, в том числе о роли, которую первое может сыграть на втором.
Неполярная ковалентная связь: определение и примеры
Неполярная ковалентная связь возникает, когда атомы делят свои внешние электроны поровну друг с другом.Узнайте об определении неполярной связи, о том, почему атомы связаны, о равном и неравном распределении электронов и электронной плотности.
Как найти валентные электроны переходного класса по химии класса 11 CBSE
Подсказка: В атомах есть различные оболочки, которые обозначаются K, L, M, N и т. Д. В зависимости от количества электронов в атомах расположены в оболочках, и последняя оболочка атома является валентной оболочкой, а электроны в этой оболочке являются валентными электронами, это верно для репрезентативных элементов, но для переходных элементов последняя оболочка и (n-1) d подоболочка также должны рассматриваться.
Д. В зависимости от количества электронов в атомах расположены в оболочках, и последняя оболочка атома является валентной оболочкой, а электроны в этой оболочке являются валентными электронами, это верно для репрезентативных элементов, но для переходных элементов последняя оболочка и (n-1) d подоболочка также должны рассматриваться. Полное решение:
Мы знаем, что в периодической таблице есть много типов элементов, то есть репрезентативные элементы, переходные элементы и внутренние переходные элементы.
— Периодическая таблица представляет собой расположение элементов в соответствии с их возрастающим числом электронов, и эти электроны заполняются на орбитах в соответствии с их возрастающей энергией. В атомах есть различные оболочки, которые обозначаются буквами K, L, M, N и т. Д., Что представляет собой удельную энергию оболочки.Оболочка K представляет собой 1, оболочка L представляет собой 2, оболочка M представляет собой 3, оболочка N представляет собой 4. Каждая оболочка имеет определенные подоболочки: s, p, d, f и т. Д.
Д.
— В зависимости от количества электроны в атомах расположены в оболочках, и последняя оболочка атома является валентной оболочкой, а электроны в этой оболочке являются валентными электронами, это верно для типичных элементов, но для переходных элементов последняя оболочка и (n-1) d Подоболочка также должна быть рассмотрена, и эти валентные электроны ответственны за образование связи.{2}} $ Итак, взяты 6 электронов d-подоболочки и 2 электрона s-подоболочки.
Примечание: Следует отметить, что переходные элементы имеют большое количество валентных электронов и из-за этого большого количества валентных электронов они могут образовывать координационные соединения и очень реактивны.
Сколько валентных электронов в алюминии?
Сколько валентных электронов у алюминия?
Алюминий — один из первых 20 элементов периодической таблицы Менделеева, и в этой статье о Lacylearning вы узнаете о его валентности и о том, как ее рассчитать!
Алюминиевые валентные электроны Символ этого алюминия — Al, атомный номер этого элемента — 13.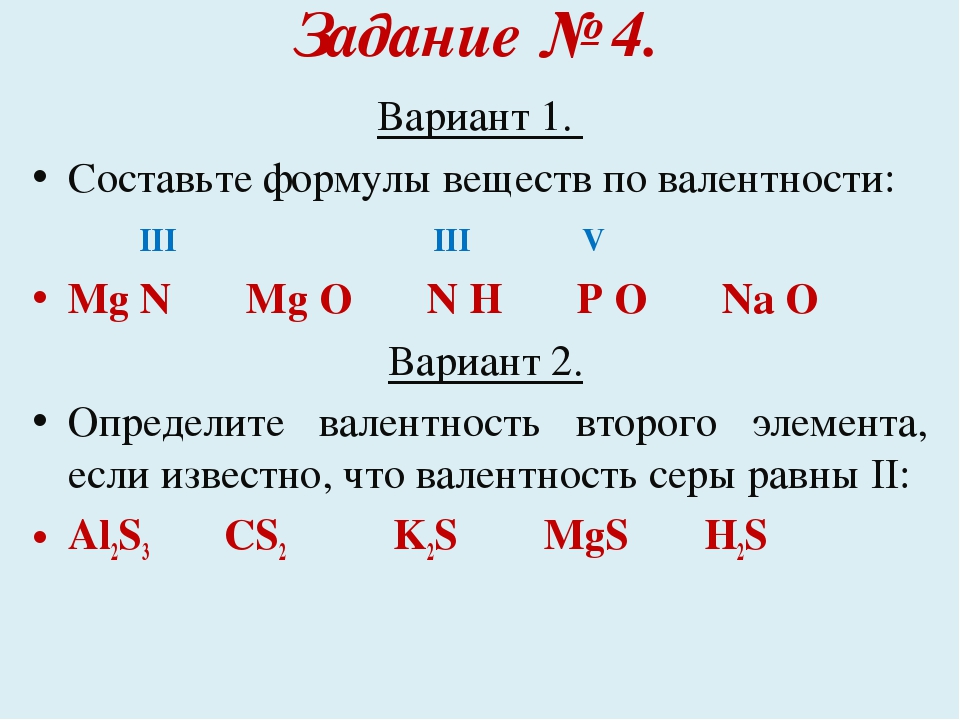 Алюминий имеет серебристо-белый оттенок и встречается в основном в металлической фольге, которую мы используем для упаковки пищевых продуктов.
Алюминий имеет серебристо-белый оттенок и встречается в основном в металлической фольге, которую мы используем для упаковки пищевых продуктов.
Al — цветной металл. Сложные организмы (окаменелости, живые существа и т. Д.) Обычно включают соединения в форме камней, растений и животных. Атомный вес: атомный вес алюминия 26,9815.
Температура плавления алюминия составляет 660 градусов по Цельсию, а температура кипения — 2467 градусов по Цельсию. В таких драгоценных камнях, как топаз, гранат и хризоберилл, можно найти алюминий.
Что такое валентный электрон?
Прежде чем мы продолжим, сколько валентных электронов имеет алюминий, давайте посмотрим, что означает валентность.
Валентный электрон — это электрон, который присутствует во внешней оболочке атома и связан с созданием химической связи. Он может присоединиться к процессу склеивания, когда внешняя оболочка не завершена.
Наличие валентных электронов может влиять на химические свойства элемента, такие как валентность. Это понятие относится к валентному электрону атома и может влиять на многие химические свойства, такие как связь и склонность.
Это понятие относится к валентному электрону атома и может влиять на многие химические свойства, такие как связь и склонность.
Каждый элемент имеет определенную электрическую конфигурацию , и, следовательно, его реакционная способность сильно зависит от него. Валентный электрон элемента основной группы существует исключительно во внешней электронной оболочке; кроме того, валентный электрон переходного металла также может находиться во внутренней оболочке.
Атомы, электронная конфигурация которых заполнена до всех их валентных электронов (как показано в обозначениях благородных газов), химически инертны.
Реакционная способность увеличивается из-за сравнительно низкой энергии, необходимой для удаления дополнительных электронов из атома с более чем одним валентным электроном, образуя положительный ион.
Подробнее о Валенсии
Реактивен из-за тенденции либо приобретать, либо разделять электроны для создания отрицательного иона или ковалентной связи, атом, у которого на один или два электрона меньше, чем в закрытой оболочке
Валентный электрон может получать или отдавать энергию в виде фотона так же, как остовный электрон.
Возбуждение атома — это увеличение энергии, которое побуждает электроны прыгать на внешнюю оболочку. Или, альтернативно, электрон может вырваться из оболочки своего атома, создав ион.Это ионизация, и этот ион — положительный ион. Когда электрон теряет энергию, это вызывает высвобождение фотона.
Теперь давайте посмотрим, для чего его можно использовать, прежде чем мы увидим, сколько валентных электронов имеет алюминий!
Для чего можно использовать алюминий?
Помимо использования в посуде, Египет и Вавилон также использовали алюминий в некоторых других соединениях и лекарствах.
Алюминий также важен для металлов, поскольку он улучшает их качество и характеристики.
Одна из причин, по которой алюминий так важен в строительстве, строительных материалах и кухонной технике, заключается в том, что он используется во многих других важных предметах, таких как авиастроение, строительные материалы, холодильники, кондиционеры, кухонная утварь, электрические проводники и т. Д. посуда для производства продуктов питания.
Д. посуда для производства продуктов питания.
Алюминий бывает двух видов; мягкий вид и самая жесткая разновидность. Алюминий встречается в гораздо более твердой форме в сочетании с кремнием и железом.
Сколько валентных электронов в алюминии
Я советую вам посмотреть это видео, чтобы полностью понять, как мы объясняем конфигурацию валентных электронов алюминия ниже.
Сколько валентных электронов у алюминия для связывания?
Прежде всего, вы должны знать, что каждый элемент нацелен на полную связь, поэтому валентность — это дополнительные атомы, которые он имеет, за пределами последней завершенной оболочки.
Таким образом, алюминий имеет 3 валентных электрона для связывания.
Алюминий — это металл, который имеет 3 валентных электрона, так как 3 электрона находятся на внешней оболочке элемента.
Точечная диаграмма: сколько валентных электронов имеет алюминий
В виде точек показано количество электронов для каждого конкретного элемента, будь то структура электронных валентных точек или диаграмма.
Алюминий занимает третье место среди элементов периодической таблицы. В его химической формуле есть три валентных электрона.
Знак определяется тремя точками, которые его окружают. Вторая точка находится под знаком, а третья точка — с правой стороны символа. Вот оно. Это точечная диаграмма, которую вы можете ясно видеть, и эта диаграмма помогла вам понять ее.
Алюминий находится в периодической таблице, а именно рядом с натрием и калием.
Таблица Менделеева организована по атомному номеру, который совпадает с числом протонов в ядре. В периодической таблице он идет слева направо.
Периодическая таблица Менделеева начинается в верхнем левом углу (атомный номер 1) и заканчивается в правом нижнем углу (атомный номер 118). Таким образом, вы можете просто найти атомный номер алюминия, равный 13, в периодической таблице.
Вы бы Тоже любили читать:
Электронная конфигурация основного состояния алюминия
Электрическая конфигурация основного состояния нейтрального атома алюминия — [Ne] 3s2 3p1 . Из этого вы сможете узнать, сколько валентных электронов имеет алюминий.
Отношение Al к Ne представляет собой благородство прошлого, поэтому оно упоминается как [Ne].
Мы используем обозначения, когда атомы имеют большое количество электронов. Таким образом, химические характеристики элемента напрямую связаны с электронами во внешней оболочке.
Чтобы найти элемент в периодической таблице, просто найдите номер группы (столбец) и номер периода (строка).
Чтобы найти Алюминий в таблице Менделеева, перейдите к современной таблице Менделеева и найдите часть группы 13 и периода 3.
Итак, теперь мы ответили на вопрос о , сколько валентных электронов у алюминия !
Как вы находите валентные электроны и валентность? — Кухня
Количество электронов, которые разделяются, теряются или приобретаются атомом во время химической реакции, называется валентностью элемента. Самая внешняя оболочка атома называется «валентной оболочкой», а электроны, присутствующие в этой оболочке, называются «валентными электронами». Они определяют валентность элемента.
Как проще всего найти валентные электроны?
Для нейтральных атомов количество валентных электронов равно номеру основной группы атома. Номер основной группы элемента можно найти в его столбце в периодической таблице. Например, углерод находится в группе 4 и имеет 4 валентных электрона. Кислород находится в группе 6 и имеет 6 валентных электронов.
Как определить валентность элемента?
Валентность атома элемента определяется количеством электронов в его внешней оболочке, т.е.е. валентной оболочки. Для атомов с менее чем 4 или менее электронами в валентных оболочках (т.е. валентными электронами) валентность = нет. электронов. Для атомов с более чем 4 валентными электронами валентность = 8 — (№
Что такое валентные электроны и валентность?
Валентные электроны — это электроны, находящиеся во внешней оболочке элемента. Число связей, которые может образовать атом, называется валентностью элемента.
Как определить количество валентных электронов в молекуле?
Число валентных электронов для молекул можно рассчитать, сложив валентные электроны всех атомов, образующих соответствующую молекулу. 2⋅1 + 1⋅6 = 8 валентных электронов.
2⋅1 + 1⋅6 = 8 валентных электронов.
Как определить количество валентных электронов в структуре Льюиса?
Определите общее количество валентных электронов в молекуле или ионе. Каждый атом водорода (группа 1) имеет один валентный электрон, углерод (группа 14) имеет 4 валентных электрона, а кислород (группа 16) имеет 6 валентных электронов, всего [(2) (1) + 4 + 6] = 12 валентных электронов. 2.
Какова валентность элемента?
валентность, также обозначаемая как валентность, в химии — свойство элемента, определяющее количество других атомов, с которыми атом элемента может соединяться.Этот термин, введенный в 1868 году, используется для обозначения как мощности комбинации элемента в целом, так и числового значения силы комбинации.
Что такое валентность и валентность электронов, объясняющая на примере?
Валентность элемента можно определить как количество электронов, которое ему нужно получить или потерять, чтобы образовать стабильное соединение с атомами других элементов. Валентные электроны — это электроны, находящиеся во внешней оболочке электрона. Например: электронная конфигурация хлора — 2,8,7.
Валентные электроны — это электроны, находящиеся во внешней оболочке электрона. Например: электронная конфигурация хлора — 2,8,7.
Как определить валентные электроны и валентность?
Математически мы можем сказать, что если самая внешняя оболочка атома содержит 4 или менее 4 электронов, то валентность элемента равна количеству электронов, присутствующих во внешней оболочке, а если она больше 4, то валентность элемента определяется путем вычитания общего количества электронов
Что называется валентностью?
Валентность — это объединяющая сила элемента. Элементы в одной группе периодической таблицы имеют одинаковую валентность.Валентность элемента связана с количеством электронов во внешней оболочке.
Как определить количество электронов в молекуле?
Умножьте атомный номер элемента на количество атомов этого типа (см. Шаг 1) в молекуле. Повторите эти действия для всех элементов в молекуле, затем сложите все продукты, чтобы вычислить количество электронов.



 Раздели суммарную валентность на количество атомов серы: 2 : Ь — II. Полученное частное и будет искомой валентностью серы. Запиши ее значение над соответствующим символом в фор муле соединения. Материал с сайта http://worldofschool.ru
Раздели суммарную валентность на количество атомов серы: 2 : Ь — II. Полученное частное и будет искомой валентностью серы. Запиши ее значение над соответствующим символом в фор муле соединения. Материал с сайта http://worldofschool.ru
 И. Менделеева, в которой он расположен, т.е. равна V, а низшая -разностью между числом 8 и номером группы, т.е. равна III. Это верный ответ.
И. Менделеева, в которой он расположен, т.е. равна V, а низшая -разностью между числом 8 и номером группы, т.е. равна III. Это верный ответ. е. валентность алюминия равна III. Это верный ответ.
е. валентность алюминия равна III. Это верный ответ. Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи в химическом соединении — количество связей, которые могут быть образованы между двумя атомами.
Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи в химическом соединении — количество связей, которые могут быть образованы между двумя атомами.