Задачи по химии. Выход продукта реакции. Примеси. Потери
При восстановлении водородом оксида меди (II) массой 64 кг была получена медь массой 43,52 кг. Укажите выход (%) продукта реакции.
а) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если потери в производстве (реакции) составляют 10%.
б) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если практический выход реакции равен 90%
в) В избытке кислорода сожгли углерод массой 240 г. Укажите массу (г) оксида углерода (IV), который был получен, если исходное вещество содержит 10% примесей по массе.
Над нагретой серой массой 20,48 г пропустили водород. Образовавшийся сероводород пропустили через избыток раствора гидроксида калия. Определите массу (г) образовавшегося сульфида, если выход продукта реакции на первой стадии равен 90%, на второй – 85%.
Кусочек мела массой 2,5 г, массовая доля карбоната кальция в котором равна 95%, опустили в раствор массой 10 г с массовой долей серной кислоты 33,33%. В результате реакции выделился газ объёмом (н.у.) 500 см3. Определите выход (%) продукта реакции.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ, ЦТ и РТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув здесь «Получить все материалы сайта»
Решение расчетных задач по химии

РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ
«НА ВЫХОД ПРОДУКТА ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО»

Массовая доля выхода продукта реакции (ω — «омега»)
— это отношение массы полученного вещества к массе, которая должна была бы получиться в соответствии с расчетом по уравнению реакции
m практическая
ω вых =
m теоретическая

… в реальных химических реакциях масса продукта всегда оказывается меньше расчетной …а? Не знаете?
ПОЧЕМУ?
- Многие химические реакции не доходят до конца.
- При взаимодействии органических веществ часто образуются побочные продукты.
- При гетерогенных реакциях часть веществ просто не вступает в реакции.
- Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений всегда приводит к потерям газообразных веществ.

Три типа задач с понятием «Выход продукта»
1. Даны массы исходного вещества и продукта реакции.
Определить выход продукта реакции.
2. Даны массы исходного вещества и выход продукта реакции.
Определить массу продукта.
3. Даны массы продукта и выход продукта. Определить массу исходного вещества.

Алгоритм решения задач первого типа
(найдите «выход продукта реакции»)
1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и «Найти».
3) Составь уравнение реакции (не забудь расставить коэффициенты).
4) Вычисли массу теоретическую продукта реакции, по уравнению реакции.
5) Вычисли массовую долю продукта реакции по отношению массы практической к массе теоретической, которая указана в «дано».

1. Внимательно прочитай условие задачи
При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции.
2. Составьте «Дано» и «Найти»
Дано: Решение: m(ZnO) = 32,4 г m пр (Zn) = 24 г
Найти:
ω вых (Zn) — ?

3. Составьте уравнение реакции, расставьте коэффициенты
Дано: m(ZnO) = 32,4 г m пр (Zn) = 24 г
Решение:
Найти:
ω вых (Zn) — ?
3ZnO + 2Al = 3Zn + Al 2 O 3

4. Вычисли массу теоретическую продукта реакции
Дано: Решение:
m (ZnO) = 32,4 г 32,4 г ?
m пр (Zn) = 24 г 3ZnO +2 Al =3 Zn + Al 2 O 3
3 моль 3 моль
Найти:
ω вых (Zn) — ?
m теор. (Zn) = n . M = 0,4 моль . 65г/моль = 26 г
32, 4 г
n (Zn) = n (ZnO) = = = 0,4 моль
m (ZnO)
81 г/моль
M (ZnO)

5. Вычисли массовую долю продукта реакции по известной формуле
Дано: Решение:
m (ZnO) = 32,4 г 32,4 г ?
m пр (Zn) = 24 г 3ZnO +2 Al =3 Zn + Al
2 O 33 моль 3 моль
Найти:
ω вых (Zn) — ? По уравнению:
m теор. (Zn) = nM = 0,4 моль 65г/моль = 26 г
m (ZnO)
n (Zn) = n (ZnO) = = = 0,4 моль
32, 4 г
M (ZnO)
81 г/моль
m пр ( Zn)
ω вых = = = 0, 92 (92%)
24 г
m теор (Zn)
26 г
Ответ: 92%

Алгоритм решения задач второго типа
( найдите «массу продукта реакции») (практическую)
1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и «Найти».
3) Составь уравнение реакции (не забудь расставить коэффициенты).
4) Вычисли массу теоретическую продукта реакции, по уравнению реакции.
5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода)

1. Внимательно прочитай условие задачи
Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного.
2. Составьте «Дано» и «Найти»
Дано: Решение: m (Al(OH) 3 )= 23,4 г ω вых (Al 2 O 3 ) = 92%
Найти:
m пр (Al 2 O 3 ) — ?

3) Составь уравнение реакции (не забудь расставить коэффициенты).
Дано: Решение: m (Al(OH) 3 )= 23,4 г ω вых (Al 2 O 3 ) = 92%
Найти:
m пр (Al 2 O 3 ) — ?
2Al(OH) 3 = Al 2 O 3 +3H 2 O

4. Вычисли массу теоретическую продукта реакции
Решение:
Дано: m (Al(OH) 3 )= 23,4 г ω вых (Al 2 O 3 ) = 92%
Найти:
m пр (Al 2 O 3 ) — ?
23,4 г
?
2Al(OH) 3 = Al 2 O 3 +3H 2 O
2 моль
1 моль
= 0,15 моль
По уравнению:
23,4 г
m (Al(OH) 3 )
n(Al 2 O 3 ) = ½ n(Al(OH) 3 = ½ =
M (Al(OH) 3 )
78 г /моль
m теор. (Al 2 O 3 ) = n M = 0,15 моль 102 г/моль = 15,3 г

5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода)
Решение:
Дано: m (Al(OH) 3 )= 23,4 г ω вых (Al 2 O 3 ) = 92%
Найти:
m пр (Al 2 O 3 ) — ?
23,4 г
?
2Al(OH) 3 = Al 2 O 3 +3H 2 O
1 моль
2 моль
= 0,15 моль
По уравнению:
23,4 г
m (Al(OH) 3 )
n(Al 2 O 3 ) = ½ n(Al(OH) 3 = ½ =
M (Al(OH) 3 )
78 г /моль
m теор. (Al 2 O 3 ) = n M = 0,15 моль 102 г/моль = 15,3 г
m пр. (Al 2 O 3 ) = 15,3 г 0,92 = 14 г
Ответ: 14 грамм

Алгоритм решения задач третьего типа
( Определить массу исходного вещества )
1) Прочитай внимательно условие задачи.
2) Запиши: «Дано» и «Найти».
3) Составь уравнение реакции (не забудь расставить коэффициенты).
4) Вычисли массу теоретическую продукта реакции, по обратной формуле (m пр / ω вых ) .
5) Вычисли массу исходного вещества по уравнению реакции.

1. Внимательно прочитай условие задачи
При действии оксида углерода (II) на оксид железа (III) получено железо массой 11,2 г.
Найдите массу использованного оксида железа (III), учитывая, что доля выхода продуктов реакции составляет 80% от теоретически возможного.
2. Составьте «Дано» и «Найти»
Дано:
Решение:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
M (Fe 2 O 3 ) — ?

3) Составь уравнение реакции (не забудь расставить коэффициенты).
Дано:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
M (Fe 2 O 3 ) — ?
Решение:
Fe 2 O 3 + 3CO = 2Fe + 3CO 2

4) Вычисли массу теоретическую продукта реакции, по обратной формуле (m пр / ω вых ) .
Дано:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
M (Fe 2 O 3 ) — ?
Решение:
Fe 2 O 3 + 3CO = 2Fe + 3CO 2
m пр (Fe)
11,2 г
m теор = = =14 г
ω вых (Fe)
0, 8

5) Вычисли массу исходного вещества по уравнению реакции.
Дано:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
M (Fe 2 O 3 ) — ?
Решение:
Fe 2 O 3 + 3CO = 2Fe + 3CO 2
m пр (Fe)
11,2 г
m теор = = =14 г
ω вых (Fe)
0, 8
По уравнению:
14 г
m (Fe)
n(Fe 2 O 3 ) = ½ n (Fe) = ½ = ½ = 0,125 моль
56 г/моль
M (Fe)
m(Fe 2 O 3 ) = n M = 0,125 моль 160 г/моль = 20 г
Ответ: 20 грамм
Задачи на практический выход
Задачи на практический выход.
1 .Вычислите объем аммиака, который можно получить, нагревая 20г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 98%.
Решение:
2NH4Cl + Ca(OH)2 = 2NH3 +H2O; Mr(NH4Cl) =53,5
20 Х, 98%
NH4Cl +0,5Са(ОH)2 = NH3 +0,5H2O
53,5 22,4
1)Рассчитаем теоретический выход
20/53,5=Х/22,4; Х=8,37л( это теоретический выход)
2) Рассчитаем практический выход
V(практического)=V(теоретического)/выход прдукта*100%
V(практического)=8,37л*98%/(делим на) 100% = 8.2л
Ответ: 8,2 л NНз
2.Из 320г сернистого колчедана, содержащего 45% серы, было получено 405г серной кислоты (расчёт на безводную кислоту). Вычислите массовую долю выхода серной кислоты.
Решение:
Составим схему производственного получения серной кислоты
320г 45% 405г, ή-?
FeS2→ S→ H2SO4
32г 98г
1)Рассчитаем долю серы в колчедане
ω=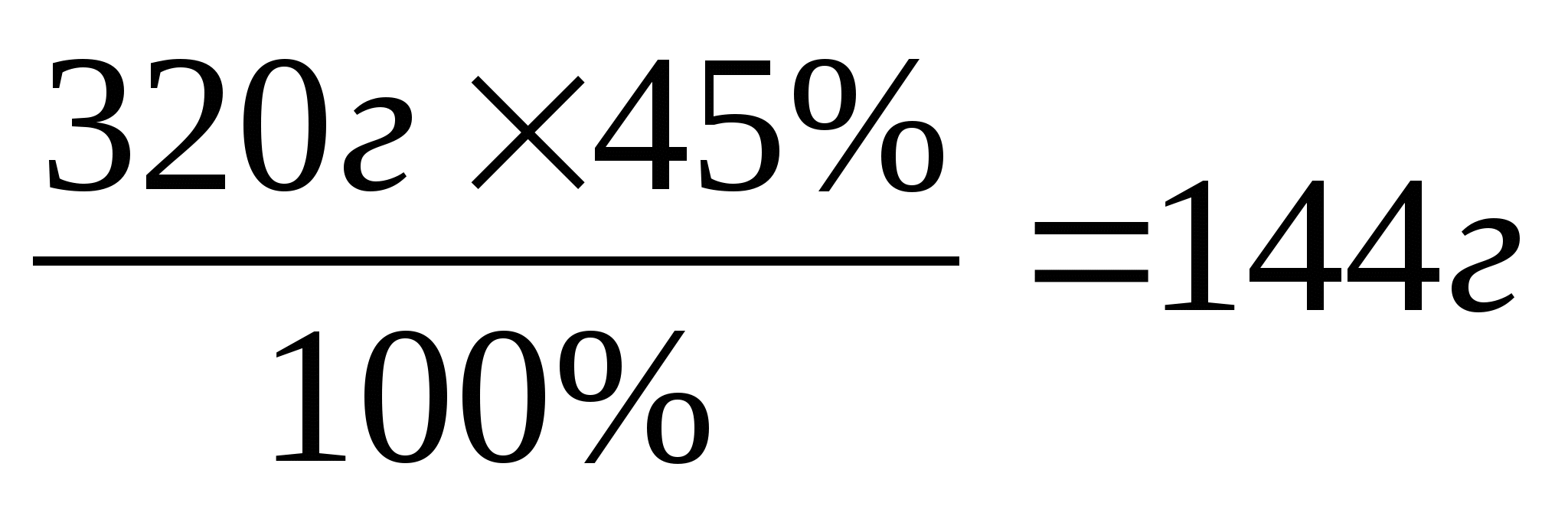
2)Рассчитаем теоретический выход серной кислоты
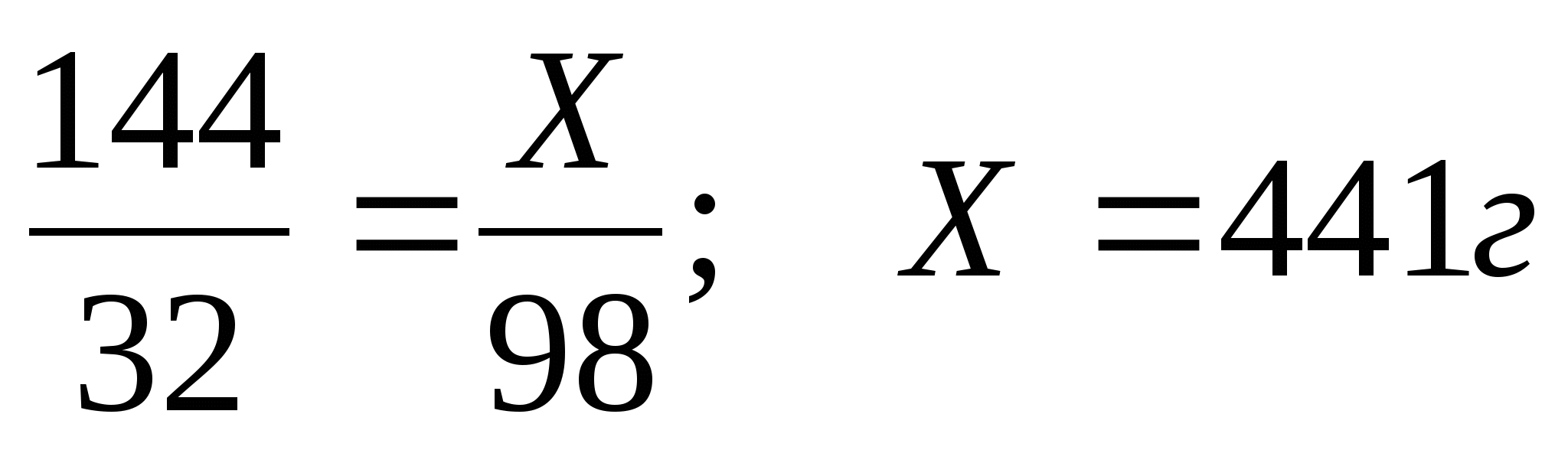
3) Рассчитаем выход продукта в процентах
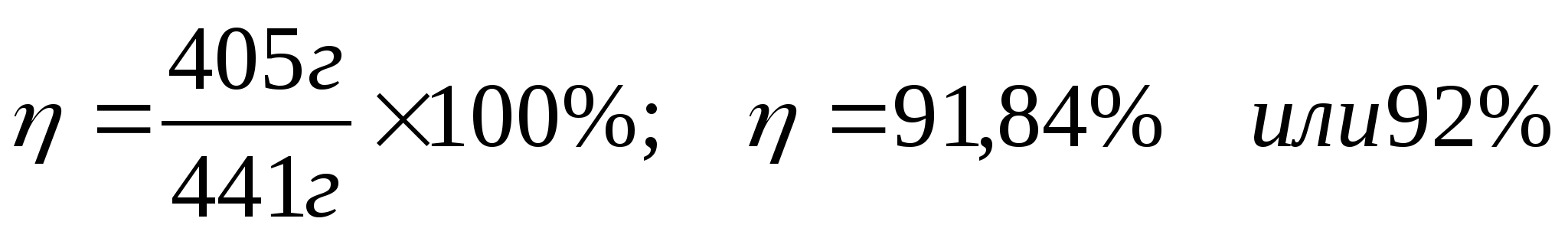
Ответ:92%
З.Вычислите массу фосфора необходимую для получения 200 кг фосфорной кислоты, если массовая доля выхода продукта составляет 90%.
Решение:
Составим схему производственного получения фосфорной кислоты
Х 200кг,ή=90%
P → H3PO4
31кг 98кг
1)Рассчитаем массу теоретического выхода фосфорной кислоты
mт =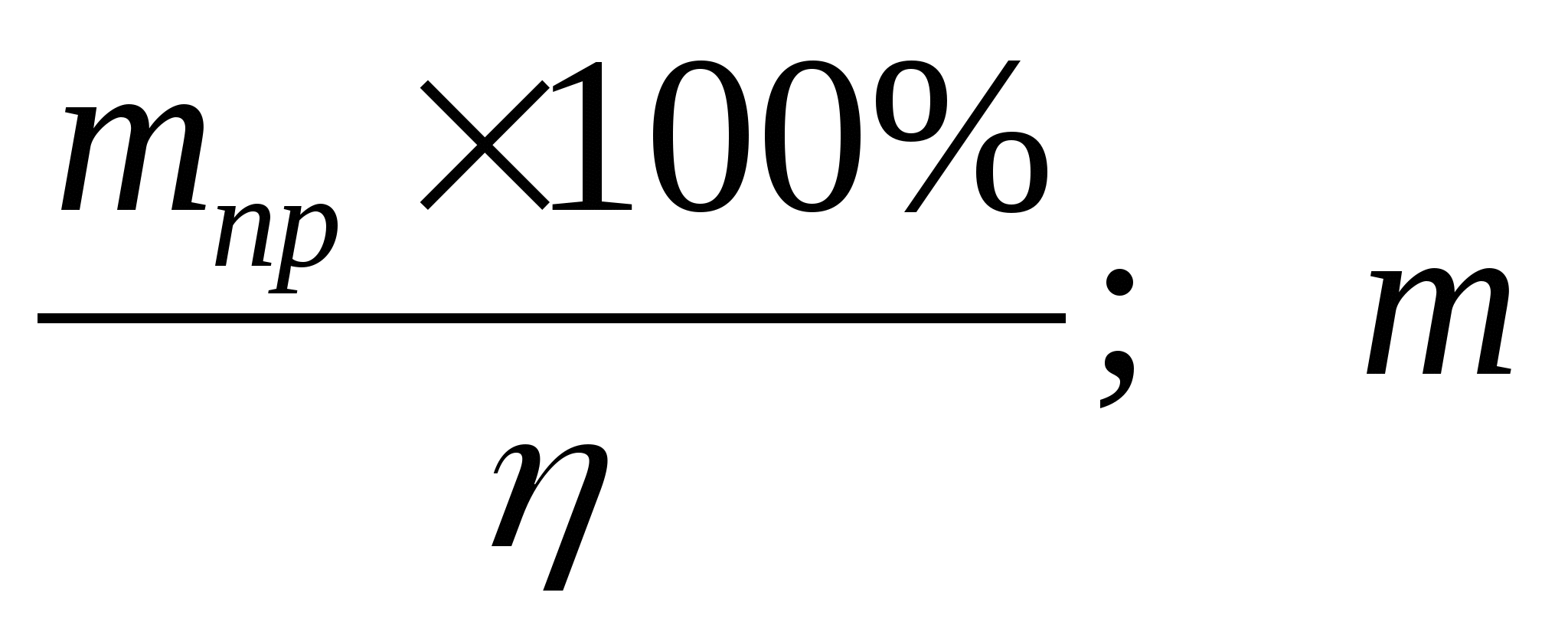


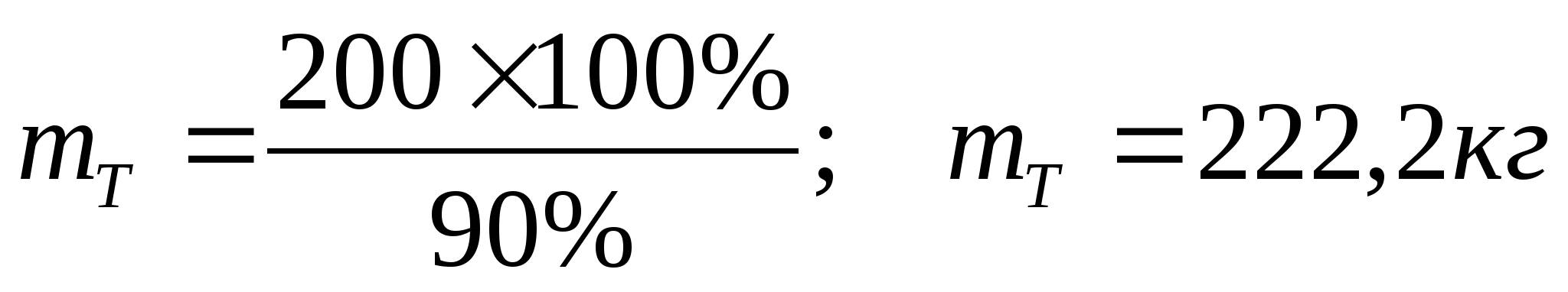
2) Рассчитаем массу фосфора
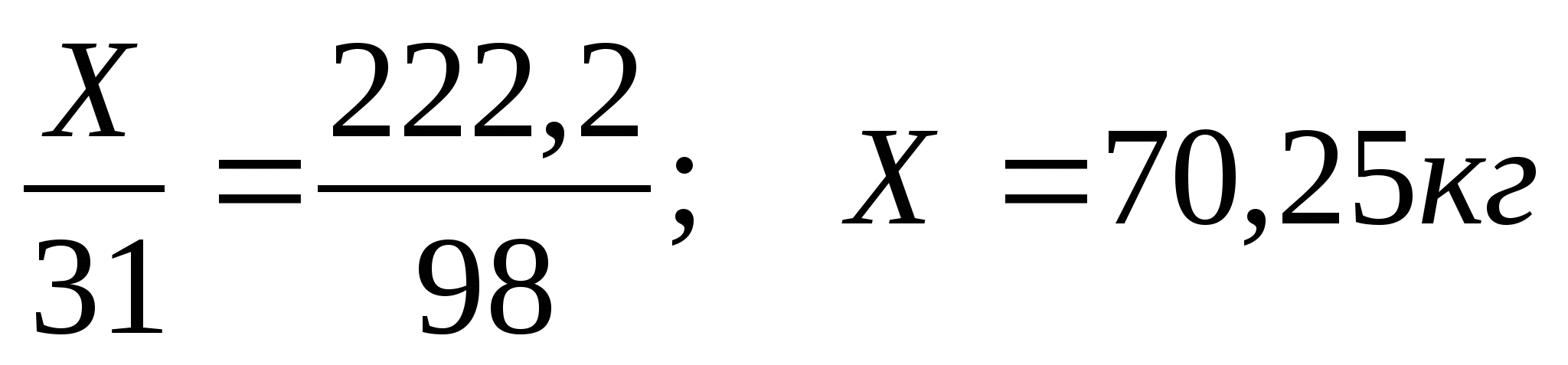
Ответ:70,Зкг
4.Юный химик на занятиях кружка решил получить азотную кислоту реакцией обмена между нитратом калия и концентрированной серной кислотой. Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
5.При нагревании нитрита аммония NН4NO2 образуются азот и вода. Вычислите объем азота (н. у), который можно получить при разложении 6,4г нитрита аммония, если объемная доля выхода азота составляет 89%.
6.Вычислите объем оксида азота (II), который можно получит при каталитическом окислении в лаборатории 5,6л аммиака, если объемная доля выхода оксида азота (II) равна 90%.
7.Металлический барий получают восстановлением его оксида металлическим алюминием c образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 кг оксида бария было получено 3,8 кг бария.
Ответ: 92,5%
8.Определите, какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 2,1 л (н. у) оксида азота (IV), если объемная доля выхода оксида азота (IV) равна 94%.
Ответ: 3,19
9.Какой объем оксида серы (IV) надо взять для реакции окисления кислородом, чтобы получить оксид серы (VI) массой 20г. если выход продукт равен 80% (н.у).?
Решение:
2SO2 + O2 = 2SO3; V.(SO2) =22.4л; Mr(SO3) =80
1) Рассчитаем теоретический выход
m(теорет) = 
2)Рассчитаем массу SO2

Ответ: 7л
10.При нагревании смеси оксида кальция массой 19,6г с коксом массой 20г получили карбид кальция массой 16г. Определите выход карбида кальция, если массовая доля углерода в коксе составляет 90%.
Ответ: 71.4%
11 .Через раствор массой 50г с массовой долей иодида натрия 15% пропустили избыток хлора, выделился йод массой 5,6г. Определите выход продукта реакции от теоретически возможного в %.
Ответ: 88,2%.
12.Определить выход силиката натрия в % к теоретическому, если при сплавлении 10 кг гидроксида натрия с оксидом кремния (IV) получено 12,2 кг силиката натрия. Ответ 80%
13.Из 4 кг оксида алюминия удаётся выплавить 2 кг алюминия. Вычислите массовую долю выхода алюминия от теоретически возможного.
Ответ:94,3%
14.Вьичислите объем аммиака, который получается при нагревании смеси хлорида аммония массой 160,5 г и гидроксида кальция, если объемная доля выхода аммиака от теоретически возможного составляет 78%.
Ответ:52.4л
15.Какое количество аммиака потребуется для получения 8 т нитрата аммония, если выход продукта составляет 80% от теоретически возможного?
Ответ:2,IЗт
16.Какое количество уксусного альдегида может быть получено по реакции Кучерова, если в реакцию вступило 83,6 л ацетилена, а практический выход составил 80% от теоретически возможного?
Ответ: 131,З6г
17.Какое количество бензола потребуется для получения 738г нитробензола, если практический выход составляет 92% от теоретического.?
Ответ 508.75г
1 8.При нитрировании 46,8 бензола получено 66,42г нитробензола. Определите практический выход нитробензола в % от теоретически возможного.
Ответ: 90%
19.Сколько граммов бензола можно получить из 22,4 л ацетилена, если практический выход бензола составил 40%.?
20.Какой объем бензола (ρ=0,9г/см3) потребуется, чтобы получить 30,75г нитробензола, если выход при нитровании составляет 90% от теоретически возможного?
21 .Из 32г этилена было получено 44г спирта. Вычислите практический выход продукта в % от теоретически возможного.
22.Сколько граммов этилового спирта можно получить из 1м3 природного газа, содержащего 6% этилена, если практический выход составил 80%?
23.Какое количество кислоты и спирта необходимо для получения 29,6г уксуснометилового эфира, если его выход составил 80% от теоретически возможного?
24.При гидролизе 500кг древесины, содержащей 50% целлюлозьг, получается 70кг глюкозы. Вычислите ее практический выход в % от теоретически возможного.
Ответ:25%
25.Сколько глюкозы получается из 250 кг опилок, содержащих 40% глюкозы. Какое количество спирта можно получить из этого количества глюкозы при 85%-ном практическом выходе?
Ответ:43,43г
26.Сколько граммов нитробензола нужно взять, чтобы восстановлением получить 186г анилина, выход которого составляет 92% от теоретического 27. Вычислите массу сложного эфира, который получили из 460г муравьиной кислоты и 460г этилового спирта. Выход эфира от теоретически возможного составляет 80%.
28.При обработке 1т фосфорита, содержащего 62% фосфата кальция, серной кислотой было получено 910,8кг суперфосфата. Определить выход суперфосфата в % по отношению к теоретическому.
Са3 (РО4)2 + 2Н2S04 = Са (Н2Р04 )2 + 2СаS04
Ответ: 90%
З0.Для получения кальциевой селитры, 1т мела обработали разбавленной азотной кислотой. При этом выход кальциевой селитры составил 85% по отношению к теоретическому. Сколько селитры было получено?
Ответ: 1394кг
31 .Из 56кг азота было синтезировано 48 кг аммиака. Каков выход аммиака в процентах к теоретическому.
Ответ: 70,5%
32. 34 кг аммиака пропустили через раствор серной кислоты. Выход сульфата аммония составил 90% от теоретического. Сколько килограммов сульфата аммония получено?
Ответ:118,8кг
З3.При окислении З4кг аммиака было получено 54кг окиси азота (II).Вычислить выход окиси азота в % по отношению к теоретическому.
Ответ: 90%
34.В лаборатории аммиак получают взаимодействием хлористого аммония с гашёной известью. Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Ответ:30,6г
35.Из 60кг водорода и соответствующего количества азота было синтезировано 272 кг аммиака. Каков выход аммиака в % к теоретически возможному?
Ответ:80%
36. Из 86,7г натриевой селитры, содержащей 2% примесей, получено 56,7г азотной кислоты, каков выход азотной кислоты в % к теоретически возможному?
Ответ: 90%.
37.При пропускания аммиака через 6Зкг 50% раствора азотной кислоты было получено З8кг аммиачной селитры. Каков выход ее в % к теоретически возможному?
Ответ: 95%
38.Для получения фосфорной кислоты было израсходовано ЗI4кг фосфорита, содержащего 50% фосфата кальция. Выход фосфорной кислоты составил 95%.Сколько кислоты было получено?
Ответ:94,Зкг
39.49кг 50% раствора серной кислоты было нейтрализовано гашёной известью, причем получилось 30,6кг сульфата кальция. Определить выход продукта в % к теоретическому.
Ответ:90%
40.Фосфор получают в технике по уравнению реакции;
Саз (Р04)2 + 3SiО2+5С →ЗСaSiО3 + 2Р +5СО
Каков выход фосфора в % к теоретическому, если его получилось 12,4 кг из 77 кг фосфорнокислого кальция?
Ответ: 80,5%
41 .Вычислите выход карбида кальция в % к теоретическому, если 15,2кг его
были получены из I4кг окиси кальция.
Ответ: 95%
42. Ацетилен получают взаимодействием .карбида кальция с водой
СаС2+2Н20= Са(ОН)2+С2Н2
Сколько граммов ацетилена получится, если израсходовано 33,7г карбида кальция, содержащего 5% примесей и выход ацетилена составил 90% к теоретическому?
Ответ: 11,7г
43.При действии соляной кислоты на 50г мела получилось 20г углекислого газа. Каков выход его в % к теоретическому?
Ответ: 90,9%
44.При обжиге 1т известняка, содержащего 10% примесей, выход углекислого газа составил 95%. Сколько килограммов углекислого газа было получен?
Ответ: 376,2 кг.
45. Определить выход силиката натрия в % к теоретическому, если при сплавлении 10кг едкого натра с песком получено 12,2 кг силиката натрия.
Ответ: 80.02%
Определение массовой или объемной доли выхода продукта реакции (в%) от теоретически возможного
Просмотр содержимого документа
«Определение массовой или объемной доли выхода продукта реакции (в%) от теоретически возможного»
Алгоритм VII. Определение массовой или объемной доли выхода продукта реакции (в%) от теоретически возможного
Задача VII.1.
Последовательность действий | При термическом разложении метана массой 32 г на углерод и водород образовался водород объемом 7,5л (н.у.). Вычислите объемную долю (%) выхода водорода от теоретически возможного |
Кратко записать условие задачи | Дано: m( Ch5) = 32 г V пр (Н2)= 7,5 л Найти: φ (h3)- ? |
Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении | CН4 = C + 2H2 |
Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением | 32 г X л CН4 = C + 2H2 1 моль 2 моль 22,4 л/моль |
Найти относительные молекулярные массы, молярные массы веществ, используемых при решении задачи | M (Ch5) = 16 Mr (Ch5) =16 г/моль |
Найти количества веществ, вступающих в реакцию | По уравнению реакции 1 моль Ch5 — 2 моль h3 По условию 2 моль Ch5 — 4 моль h3 |
Определить объем теоретический водорода | Vтеор(h3)=Vm*n(h3) Vтеор(h3)= 22?4 л/моль*2 моль=44,8 л |
Найти объемную долю (%) выхода водорода от теоретически возможного | φ (h3)=Vпр(h3)/Vтеор*100% φ (h3)=7,5 л/44,8 л*100%=16,7% |
Сформулировать ответ | Объемная доля (%) выхода водорода от теоретически возможного при термическом разложении метана массой 32 г на углерод и водород с образованием водорода объемом 7,5л (н.у.) составляет 16,7 % |
Задача VII.2.
Последовательность действий | В результате прямой гидратации 112 м3 (н.у.) этилена получили 172,5 кг этилового спирта. Вычислить выход спирта (%) от теоретически возможного |
Кратко записать условие задачи | Дано: V(C2h5)=112 м3 m(C2H5OH)=172,5 кг Найти: φ (C2H5OH)- ? |
Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении | C2Н4+h3O = C2H5OH |
Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением | 112 м3 172,5 г, X% C2Н4+h3O = C2H5OH 1 моль 1 моль |
Найти относительные молекулярные массы, молярные массы веществ, используемых при решении задачи | M (C2H5OH) = 46 Mr (C2H5OH)=46 г/моль=0,046 кг/моль |
Найти количества веществ, вступающих в реакцию | По уравнению реакции 1 моль Ch5 — 1 моль h3 По условию nтеор (C2H5OH)= n теор (C2h5) |
Определить количество вещества этилена и этилового спирта | n теор (C2h5)=V/Vm 3 n теор (C2h5)=112*10л/22,4 л/моль=5000 моль nтеор (C2H5OH)=5000 моль |
Найти объемную долю (%) выхода спирта от теоретически возможного | φ (C2H5OH)=172,5кг/5000 моль*0,046 кг/моль * 100%=75% |
Сформулировать ответ | Выход спирта (%) от теоретически возможного в результате прямой гидратации 112 м3 (н.у.) этилена, в результате которой получили 172,5 кг этилового спирта составит 75% |
Задача VII.3.
Последовательность действий | Какой объем (н.у.) этилена можно получить при каталитической дегидрировании 1,5 т этана, если выход продукта реакции составляет 90 % от теоретически возможного? |
Кратко записать условие задачи | Дано: φ (C2h5)=90% m(C2H6)=1500 кг Найти: V (C2h5) -? |
Записать уравнение реакции, подчеркнуть формулы тех веществ, которые используются в решении | C2Н6 = C2H4 + h3 |
Записать данные задачи и искомые над формулами, под формулами – количественные характеристики, необходимые для расчетов в соответствии с уравнением | 1500кг Xл C2Н6 = C2H4 + h3 1 моль 1 моль |
Найти относительные молекулярные массы, молярные массы веществ, используемых при решении задачи | M (C2H6) = 30 Mr (C2H6)=30 г/моль=0,03 кг/моль |
Найти количества веществ, вступающих в реакцию | По уравнению реакции 1 моль Ch5 — 1 моль C2H6 По условию nтеор (Ch5)= n теор (C2H6) |
Определить количество вещества этилена и этилового спирта | n теор (C2H6)=m/M n теор (C2H6)=1500кг/0,03 кг/моль=50000 моль nтеор (C2h5)=50000 моль |
Найти V пр этилена | Vпр (C2h5)= n (C2h5)* V теор *φ/100% Vпр (C2h5)=50000*22,4*90/100=1008000л |
Сформулировать ответ | При каталитической дегидрировании 1,5 т этана, если выход продукта реакции составляет 90 % от теоретически возможного, можно получить 1008000 л этилена |
Задачи для самостоятельного решения.
Задача VII.4. Какую массу пропилового спирта потребуется окислить для получения 13,92 г пропионового альдегида, если выход последнего составляет 80% от теоретически возможного?
Задача VII.5. Газ, образующийся при нагревании 29,95 мл предельного одноатомного спирта с концентрированной серной кислотой, присоединяет 8,96 л водорода в присутствии катализатора. Определите молекулярную формулу исходного спирта, если выход углерода составляет 90 % от теоретического
Задача VII.6. Один из методов получения уксусной кислоты заключается в каталитическом окислении бутана. Какую массу раствора уксусной кислоты концентрацией 90% можно получить окислением 100 л бутана, если выход целевого продукта 65%?
Задача VII.7. При гидрировании этилена объемом 20 л (н.у.) получили 18 л этана. Рассчитайте объемную долю выхода этана
Задача VII.8. При пропускании 7 л этилена с водородом над нагретым катализатором получили 6 л этана. Вычислите объемную долю (%) выхода этана от теоретического . Объемы газов измерены при н.у.
Задача VII.9. Вычислите массовую долю в % выхода бензола от теоретически возможного, если известно, что из 11,2 л ацетилена (н.у.) было получено 10 г бензола
Задача VII.10. В лаборатории из 156 г бензола при реакции нитрования было получено 220 г нитробензола. Каков выход нитробензола (%) от теоретически возможного?
Сценарий урока по теме «Решение задач на выход продукта от теоретически возможного»
9 класс. Расчеты по химическим уравнениям на выход продукта от теоретически возможного.
Тип урока: урок усвоения новых знаний
Цели: 1. Создание условий для развития навыков решения задач по уравнениям реакций, используя алгоритмы, закрепления навыков и умений расчетов по химическим формулам.
2. Развитие умения анализировать, рассуждать, умения работать в парах.
3. Воспитание чувства взаимопомощи, ответственности.
Оборудование: компьютер, медиапроектор, экран, карточки с алгоритмами решения задач и задачами для самостоятельного решения.
Ход урока:
Организационный момент.
Вызов.
№
Деятельность учителя
Деятельность ученика
1
Давайте вспомним, что такое химическая формула?
Химическая формула – условная запись качественного и количественного состава вещества при помощи химических знаков индексов.
2
Какую информацию дает нам химическая формула?
Какие расчеты можно произвести по формуле вещества?
Из химической формулы вещества можем узнать о качественном составе (вещество состоит из атомов ….) и количественном составе (в состав входит… атомов химического элемента).
Можно рассчитать:
— относительную молекулярную массу (Mr = 142),
— молярную массу вещества (М = 142 г/моль),
— массовые доли элементов в веществе (ω(Na) = 32%, ω(S) = 23%, ω(О) = 45%)
3
Какую информацию о реакции можно получить по соответствующему химическому уравнению?
Na2SO4 + BaCl2 = 2 NaCl + BaSO4
При взаимодействии сульфата натрия с хлоридом бария образуется хлорид натрия и сульфат бария. Это реакция обмена.
4
Какие расчеты мы проводили по уравнениям реакции?
В реальных химических реакциях масса продукта всегда оказывается меньше расчетной. Не знаете почему?
Отвечают на вопрос.
Выдвигают гипотезы.
5
Сформулируйте тему урока.
Исходя из темы, сформулируйте цель урока, чему мы должны научиться сегодня?
Как будем работать?
Выдвигают гипотезы.
Формулируют тему.
Научиться решать задачи по уравнениям реакций на выход продукта.
Используя алгоритмы и работая в парах.
Осмысление.
7
В чем состоит учебная задача?
Разобрать алгоритм решения задач. Решить самостоятельно задачи с взаимопроверкой. Решить задачи на закрепление.
8
Демонстрация слайдов презентации с алгоритмом решения задач на выход продукта.
Анализируют алгоритм решения задач данного типа.
Работают в парах с алгоритмами (приложение), решают задачи с взаимопроверкой. После усвоения материала проводят первичное закрепление – самостоятельно решают задачи с последующей проверкой учителем.
Рефлексия. Оценивают свою деятельность на уроке.
Что нового изучили?
Какова была цель урока? Достигли ли е?
Какие возникали сложности при решении задач?
Что необходимо знать для успешного решения задач?
На что необходимо обратить внимание при решении задач?
Домашняя работа: решить две задачи (условия на карточках).
Приложение
Алгоритм решения задач на выход продукта от теоретически возможного выхода
1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и что «Найти».
!!! Если в условии задачи есть слова «получилось», «образовалось», то это практически полученное количество и масса.
3) Составьте уравнение реакции (не забудь расставить коэффициенты).
4) Помни: то, что считаем по уравнению – это теоретическое количество и масса.
5) Если выход продукта дан, то находим:
— по уравнению реакции количество, массу или объём теоретический;
— затем по формуле массу или объём практический.
6) Если дана масса или объём практический, то находим:
— по уравнению количество, массу или объём теоретический;
— затем по формуле массовую или объёмную долю выхода продукта реакции.
ω вых = m (практич.) или ω вых = V (практич.)
m (теоретич.) V (теоретич.)
Задачи для совместного решения
Задача 1. Сколько азотной кислоты можно получить из 14 т аммиака, если выход кислоты составляет 87 % по сравнению с теоретическим?
Задача 2. При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции.
Задачи для самостоятельного решения
Задача 3. Вычислите объём оксида серы (IV), который надо взять для реакции с кислородом, чтобы получить оксид серы (VI) массой 20 г. Массовая доля выхода продукта равна 80 %. Объём рассчитайте при нормальных условиях.
Задача 4. При действии оксида углерода (II) на оксид железа (III) получено железо массой 11,2 г.Найдите массу использованного оксида железа (III), учитывая, что доля выхода продуктов реакции составляет 80% от теоретически возможного.
Алгоритм 11 Вычисление выхода продукта реакции по известной массе реагента и известной массе прод
Алгоритм 11
Вычисление выхода продукта реакции по известной массе реагента и известной массе продукта реакции
Пример. При окислении 160г оксида серы(IV) кислородом удалось получить 180 г оксида серы(VI). Вычислите выход продукта реакции от теоретически возможного для условий, в которых проводилась реакция.
С помощью соответствующих обозначений запишем условие задачи, найдем молярные массы веществ, о которых идет речь в условии задачи
Дано:
m(SO2)=160г
mnp(S03)=180г
?=?%
M(SO2)=64 г/моль
M(SO3)=80 г/моль
Найдем количество вещества исходного реагента
n(SO2)=2,5моль
Запишем уравнение реакции. Расставим коэффициенты
2SO2 + O2 = 2SO3
Над формулами веществ запишем данные о количествах веществ, найденных из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции
2,5моль ? моль
2S02 + 02 = 2S03
2моль 2 моль
Вычислим количество вещества продукта реакции. Для этого составим пропорцию
= откуда х=2,5моль.
Следовательно, теоретически n(SO3)=2,5моль
Найдем массу продукта реакции при 100%-м выходе продукта (теоретически возможную массу)
m(SO3)=n(S03)•M(S03)
mт(SO3)=2,5моль•80г/моль=200г
Найдем выход продукта реакции от теоретически возможного. Для этого составим пропорцию и решим уравнение.
200г SO3 образуется при выходе 100%
180г SO3 образуется при выходе а %,
а•200=180•100%,
а=90%.
Следовательно, ?=90%.
Запишем ответ
Ответ: ?=90%
Выход продукта реакций — Справочник химика 21
Как уже было указано выше, константа равновесия для каждой реакции при определенной температуре есть величина постоянная. Следовательно, зная величину К, можно вычислить количества веществ в равновесных состояниях данной реакции, а отсюда — и максимальные выходы продуктов реакции (для данных условий). [c.177]Комбинируя различные условия, в настоящее время при нитровании пропана в газовой фазе можно получить следующие выходы продуктов, реакции (в %) [c.127]
Однако простейшие реакции встречаются сравнительно редко в промышленных условиях. Поэтому, как правило, зависимость между выходом продуктов реакции и временем реагирования, найденная опытным нутом, может быть выражена либо в виде эмпирических уравнений, либо в виде кинетических кривых. [c.265]
Константа равновесия — важная характеристика реакции. По ее значению можно судить о направлении процесса при исходном соотношении концентраций реагирующих веш,еств, о максимально возможном выходе продукта реакции при тех или иных условиях. [c.179]
II — выход продуктов реакции , [c.279]
Уравнение (98) получило очень широкое применение в практике техно-химических расчетов, так оно дает возможность рассчитывать максимальный выход продуктов реакции, т. е. выход их в момент равновесия, процент превращения исходных веществ в конечные продукты реакции и другие показатели производственного процесса. [c.175]
ВХОД паров 2 — выход продуктов реакции з — вход с хла-ждающой воды 4 — выход пароп воды. [c.277]
Выход продуктов реакции (в %), получаемых в одинаковых условиях газофазного нитрования этана, пропана, н- и изобутана, приведен в табл. 9 3. Здесь же приведен также выход за проход, рассчитанный по азотной кислоте, который показывает, сколько получается нитропарафина, из 100 частей азотной кислоты за один проход через реакционный сосуд. При этом избраны не наилучшие условия нитрования однако из таблицы видно, как улучшается нитрование с повышением молекулярного веса углеводородов. [c.293]
Выход продуктов реакции, полученных в одинаковых условиях газофазного нитрования этана, пропана, к-бутана и изобутана [c.293]
Выход продуктов реакции (в вес.%) при пиролизе сырой нефти [701 прп 760 С без расщепления С2/С3 (I) и с расщеплением Са/С (II) приведен ниже (соотношение сырая нефть теплоноситель = = 1 30, предварительный нагрев нефти — до 380 °С) [c.27]
При[этих условиях выход продуктов реакции составляет (в мол. %) [c.74]
Место отбора образца для анализа 1 — вход сырья на высоте 10% от высоты всего слоя 2 — середина слоя, 50% высоты 3 — выход продуктов реакции, 90% высоты. [c.130]
В газовой фазе доля более напряженных конформаций, в том числе и некоторых г-конформаций для Сб-дегидроциклизации, тем меньше, чем выше их напряженность. Как уже указывалось (см. разд. 1.2), конформации одного вещества более или менее быстро переходят друг в друга, однако при постоянной температуре их соотношение не меняется. На поверхности катализатора из-за адсорбции молекулы могут оказаться временно зафиксированными в /»-конформации, т. е. при таком расположении главной углеводородной цепи, которое энергетически невыгодно, но зато пространственно наиболее благоприятно для образования переходного состояния. В то же время, чем более напряжена г-конформация, тем менее прочно ее фиксирование, короче продолжительность жизни на поверхности катализатора, а следовательно, меньше вероятность прореагировать. Соответственно, меньше будет предэкспоненциальный член уравнения Аррениуса. Если же при этом реакция идет ио нулевому порядку и энергии активации для Сб-дегидроциклизации разных углеводородов одинаковы, то между значениями энергии перехода от обычных к г-кон-формациям и выходами п