Как находить индексы химических элементов. Составление формул веществ при помощи валентности
ОПРЕДЕЛЕНИЕ
Под валентностью подразумевается свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента.
Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле — мера его способности) к образованию химических связей (рис. 1). В представлении метода валентных связей числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Рис. 1. Схематическое образование молекул воды и аммиака.
Таблица валентности химических элементов
Первоначально за единицу валентности принимали валентность водорода. Валентность другого элемента при этом выражали числом атомов водорода, которые присоединяет к себе или замещает один атом этого элемента (т.н. валентность по водороду). Например, в соединениях состава HCl, H 2 O, NH 3 , CH 4 валентность по водороду хлора равна единице, кислорода — двум, азота — трем, углерода — четырем.
Потом было решено, что определить валентность искомого элемента можно и по кислороду, валентность которого, как правило, равна двум. В этом случае валентность химического элемента рассчитывается как удвоенное число атомов кислорода, которое может присоединить один атом данного элемента (т.н. валентность по кислороду). Например, в соединениях составаN 2 O, CO, SiO 2 , SO 3 валентность по кислороду азота равна единице, углерода — двум, кремния — четырем, серы — шести.
На деле оказалось, что у большинства химических элементов значения валентности в водородных и в кислородных соединениях различны: например, валентность серы по водороду равна двум (H 2 S), а по кислороду — шести (SO 3). Кроме того, большинство элементов проявляют в своих соединениях различную валентность. Например, углерод образует два оксида: монооксид CO и диоксид CO 2 . В первом из которых валентность углерода равна II, а во втором — четырем. Откуда следует, что охарактеризовать валентность элемента каким-нибудь одним числом, как правило, нельзя.
Высшая и низшая валентности химических элементов
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая — I.
Существуют элементы с т.н. постоянной валентностью (металлы IA и IIA групп, алюминий водород, фтор, кислород), которые в своих соединениях проявляют единственную степень окисления, которая чаще всего совпадает с номером группы Периодической таблицы Д.И. Менделеева, где они расположены).
Элементы, для которых характерны несколько значений валентности (причем не всегда это высшая и низшая валентность) называются переменновалентными. Например, для серы характерны валентности II, IV и VI.
Для того, чтобы легче было запомнить сколько и какие валентности характерны для конкретного химического элемента используют таблицы валентности химических элементов, которые выглядят следующим образом:
Примеры решения задач
ПРИМЕР 1
| Задание | Валентность III характерна для: а)Ca; б) P; в) O; г)Si? |
| Решение | а) Кальций — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кальция равна II. Ответ неверный. б) Фосфор — неметалл. Относится к группе химических элементов с переменной валентностью: высшая определяется номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. равна V, а низшая -разностью между числом 8 и номером группы, т.е. равна III. Это верный ответ. |
| Ответ | Вариант (б) |
ПРИМЕР 2
| Задание | Валентность III характерна для: а)Be; б) F; в) Al; г)C? |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем рассматривать каждый из предложенных вариантов в отдельности. а) Бериллий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность бериллия равна II. Ответ неверный. б) Фтор — неметалл. Характеризуется единственно возможным значением валентности равным I. Ответ неверный. в) Алюминий — металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность алюминия равна III. Это верный ответ. |
| Ответ | Вариант (в) |
Для того чтобы научиться составлять химические формулы необходимо выяснить закономерности, согласно которым атомы химических элементов соединяются между собой в определенных соотношениях. Для этого сравним качествен-ный и количественный состав соединений, формулы кото-рых HCl, H 2 O, NH 3 , CH 4 (рис. 12.1)
По качественному составу эти вещества схожи:в состав каждой из молекул входят атомы водорода. Тем не менее их количественный состав неодинаков. Атомы хлора, кислорода, азота, углерода соединены соответственно с одним, двумя, тремя и четырьмя атомами водорода
Эту закономерность подметил еще в начале XI в. Дж. Дальтон. Со временем И. Я. Берцелиус обнаружил, что наиболь-шее количество атомов, соединенных с атомом химического элемента, не превышает определенной величины. В 1858 г. Э. Франкленд назвал «соединительной силой» способность атомов связывать или замещать определенное число других атомов Термин «валентность» (от лат. valentia — «сила») предложил в 1868 г. немецкий химик К. Г. Вихельхауз.
Валентность — общее свойство атомов. Она характе-ризует способность атомов химически (валентными си-лами) взаимодействовать друг с другом.
Валентность многих химических элементов определили на основе экспериментальных данных о количественном и качественном составе веществ. За единицу валентности бы-ла принята валентностьатома водорода. Если атом хими-ческого элемента соединен с двумя одновалентными атома-ми, то его валентность равна двум. Если он соединен с тремя одновалентными атомами, то он — трехвалентен и т. д.
Наи-высшее значение валентности химических элементов — VIII .
Валентность обозначают римскими цифрами. Обозначим валентность в формулах рассмотренных соединений:
Также ученые обнаружили, что немало элементов в раз-ных соединениях проявляют разные значения валентности. То есть существуют химические элементы с постоянной и переменной валентностью.
Можно ли определить валентность по положению хими-ческого элемента в периодической системе?
Элемент | Валентность | Элемент | Валентность |
Водород (Н) | Кальций (Са) | ||
Натрий (Na) | Барий (Ва) | ||
Кислород(O) | |||
Бериллий(Be) | Алюминий (Al) | ||
Магний (Mg) |
Элемент | Валентность | Элемент | Валентность |
Железо (Fe) | |||
Марганец (Mg) | |||
II, III, VI Материал с сайта | |||
Серебро (Ag) | Фосфор (P) | ||
Золото (Au) | Мышьяк (As) | ||
Углерод (C) |
teplogi.ru
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
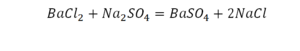
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.

Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
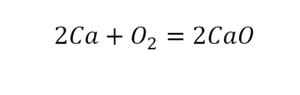
Следующий пример.

2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
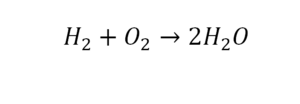
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
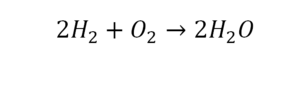
Проверяем. Если везде одинаково, то ставим «равно».

Последний пример в элементарных реакциях.

Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
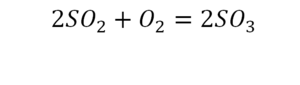
Уравняли.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
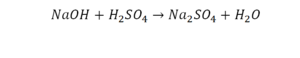
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
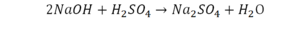
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.

Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».

Следующий пример:

Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.

Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».

Последний пример:
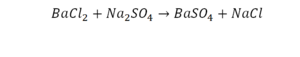
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.

Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
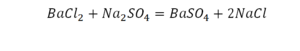
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
liveposts.ru
Определение индексов в формуле вещества
Задача 1.1.
Некоторый образец вещества содержит 156 г калия, 2 моль атомов углерода и 3,6 х 1024 атомов кислорода. Определить формулу вещества.
Дано:
масса калия: m(К) — 156 г;
количество вещества углерода: n(С) = 2 моль;
число атомов кислорода: N(О)= 3,6 . 1024 атомов.
Найти: формулу вещества.
Решение:
Шаг 1. Из условия однозначно следует, что вещество состоит только из калия, углерода и кислорода. Обозначим формулу как КхСуОz. Следовательно, требуется определить неизвестные индексы х,у,z.
Шаг 2. В условии нет указаний на химическую реакцию.
Шаг 3. Вычислим соотношение количеств вещества (n, моль) калия, углерода и кислорода в данном образце.
Количество вещества углерода уже дано в условии. Остается определить количество вещества калия и кислорода.Количество вещества калия легко определить, используя соотношение: m = n . М.
Количество вещества атомов кислорода определяем, используя соотношение:
N = n . NА = n . 6 . 1023
Шаг 4. Находим простейшую формулу.
Следуя выводу, сделанному при рассмотрении четвертого шага общего алгоритма (в предыдущем разделе), можно записать:
N(К) : N(С) : N(О) = 4 : 2 : 6
Выбираем наименьшее значение (в данном случае «2») и делим на него все три числа.
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: К2С1О3.
Шаг 5. Выявление истинной формулы.
Запись К2С1О3 отражает химическую суть вещества. Это карбонат калия. В данном случае запись простейшей формулы совпадает с истинной1.
Ответ: К2С1О3.
Комментарии:
1 Напомним, что отсутствие индекса под знаком элемента подразумевает индекс равный «1».
buzani.ru
Как найти индекс в химии?
нструкция
1)
Допустим, вам надо определить, какова формула у оксида серы. Из самого названия вещества следует, что каждая его молекула состоит только из двух элементов: кислорода (О) и серы (S). Состав молекулы зависит от величины валентности каждого из этих элементов, то есть от того, какое количество химических связей атом элемента способен образовать с другими атомами.
2)
Кислород в обычном состоянии – газ, сера – твердое вещество. Оба эти элемента имеют ярко выраженные неметаллические свойства. Следовательно, они оба подчиняются правилу: каждый неметалл имеет высшую валентность, соответствующую номеру группы таблицы Менделеева, в которой он расположен, и низшую, соответствующую остатку от вычитания номера этой группы из восьми. То есть поскольку и кислород, и сера расположены в 6-й группе таблицы Менделеева, их высшая валентность равна 6, а низшая — 2.
3)
Теперь надо определить, какую из этих валентностей имеет кислород, а какую – сера. Ведь невозможно, чтобы оба эти элемента в соединении имели одновременно либо высшую, либо низшую валентность. Теперь в действие вступает еще одно правило: «При соединении двух неметаллов тот из них, который находится ближе к верхнему правому углу таблицы Менделеева, имеет низший показатель валентности» . Еще раз посмотрите в таблицу. Вы видите, что кислород располагается выше серы, следовательно, он находится ближе к верхнему правому углу. Таким образом, в соединении с серой он будет иметь низшую валентность, равную 2. А сера, соответственно, имеет высшую валентность, равную 6.
4)
Остается последний шаг. Какие индексы будут у каждого из этих элементов? Известно, что произведения величин валентностей элементов, умноженные на их индексы, должны численно совпадать. Валентность серы в три раза больше валентности кислорода, следовательно, индекс кислорода должен быть в три раза больше индекса серы. Отсюда следует: формула соединения SO3.
1 Нравится Пожаловаться
strinfo.ru
напомощь! как определить валентность веществ?
Определение валентности элементов по формулам их соединений. Составление химических формул по валентности Определение валентности элементов по формулам их соединений. Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элементов. Например, если дана формула оксида меди CuO, то валентность меди можно определить следующим образом. Валентность кислорода равна двум, а на один атом кислорода приходится адин атом меди. Следовательно, валентность меди также равна двум. Несколько сложнее определить валентность по формулам соединений, образованных не одним, а несколькими атомами химических элементов. Например, чтобы определить валентность железа в оксиде железа Fe2O3, рассуждают так. Валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равна шести (2 * 3).Следовательно, шесть валентностей приходятся на два атома железа, а на один атом железа приходятся три единицы валентности (6:2). При определении валентности элемента по формуле следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента. Итак, валентность элементов по формулам можно определить следующим образом: 1. Пишут химическую формулу вещества и отмечают валентность известных известного элемента: ….II.I…II….IICuOh3SSO3Fe2O3 2. Находят и записывают общее число валентностей (наименьшее общее кратное) известного элемента. 3. Вычисляют и поставляют над химическими знаками валентность другого элемента. Для этого общее число валентностей делят на индекс этого элемента. Составление химических формул по валентности. Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. Сведения о валентности некоторых элементов приведены в таблице. Валентность Химические элементыПримеры формул соединений I II III I и II II и III II и IV III и V II, III и VI II, IV и VIС постоянной валентностью H, Na, K, Li O, Be, Mg, Ca, Ba, Zn Al, B С переменной валентностью Cu Fe, Co, Ni Sn,Pb P Cr S h3O, Na2O MgO, CaO Al2O3 Cu2O, CuO FeO, Fe2O3 SnO, SnO2 Ph4, P2O5 CrO, Cr2O3, CrO3 h3S, SO2, SO3 При составлении химических формул можно соблюдать следующий порядок действий: 1. Пишут рядом химические знаки элементов, которые входят в состав соединения. 2. Над знаками химических элементов проставляют их валентность. 3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов. 4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс 1 не пишут) . В названии веществ, образованных элементами с переменной валентностью, пишут в скобках цифру, показывающую валентность данного элемента в это соединении. Например, CuO — оксид меди (II), Cu2O оксид меди (I), FeCl2 — хлорид железа (II), FeCl3 — хлорид железа (III).
Максимальная валентность = номеру периода, или по количеству электронов на последнем энергетическом уровне.
ДОЛОПБДООИЛИЛ мсптвслрп
Определение валентности элементов по формулам их соединений. Составление химических формул по валентности Определение валентности элементов по формулам их соединений. Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элементов. Например, если дана формула оксида меди CuO, то валентность меди можно определить следующим образом. Валентность кислорода равна двум, а на один атом кислорода приходится адин атом меди. Следовательно, валентность меди также равна двум. Несколько сложнее определить валентность по формулам соединений, образованных не одним, а несколькими атомами химических элементов. Например, чтобы определить валентность железа в оксиде железа Fe2O3, рассуждают так. Валентность кислорода равна двум. Общее число единиц валентностей трех атомов кислорода равна шести (2 * 3).Следовательно, шесть валентностей приходятся на два атома железа, а на один атом железа приходятся три единицы валентности (6:2). При определении валентности элемента по формуле следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента. Итак, валентность элементов по формулам можно определить следующим образом: 1. Пишут химическую формулу вещества и отмечают валентность известных известного элемента: ….II.I…II….IICuOh3SSO3Fe2O3 2. Находят и записывают общее число валентностей (наименьшее общее кратное) известного элемента. 3. Вычисляют и поставляют над химическими знаками валентность другого элемента. Для этого общее число валентностей делят на индекс этого элемента. Составление химических формул по валентности. Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. Сведения о валентности некоторых элементов приведены в таблице. Валентность Химические элементыПримеры формул соединений I II III I и II II и III II и IV III и V II, III и VI II, IV и VIС постоянной валентностью H, Na, K, Li O, Be, Mg, Ca, Ba, Zn Al, B С переменной валентностью Cu Fe, Co, Ni Sn,Pb P Cr S h3O, Na2O MgO, CaO Al2O3 Cu2O, CuO FeO, Fe2O3 SnO, SnO2 Ph4, P2O5 CrO, Cr2O3, CrO3 h3S, SO2, SO3 При составлении химических формул можно соблюдать следующий порядок действий: 1. Пишут рядом химические знаки элементов, которые входят в состав соединения. 2. Над знаками химических элементов проставляют их валентность. 3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов. 4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс 1 не пишут) . В названии веществ, образованных элементами с переменной валентностью, пишут в скобках цифру, показывающую валентность данного элемента в это соединении. Например, CuO — оксид меди (II), Cu2O оксид меди (I), FeCl2 — хлорид железа (II), FeCl3 — хлорид железа (III).
Просто Забудь Тетрадку !
touch.otvet.mail.ru
Что такое химическая формула, индекс, коэффициент???
Хими́ческая фо́рмула — отражение информации о составе и структуре веществ с помощью химических знаков, чисел и разделяющих знаков — скобок. Например Н2О — формула воды. коэффициент — это число, которое ставиться перед хим формулой, для уравнения реакции. индекс — это число которое стоит справа от хим элемента, например в воде (Н2О) оно равно 2.
Химическая формула — это условная запись состоящая из хим. знаков и индексов. Индекс обозначает число атомов. Если требуется обозначить не один, а несколько атомов, то перед хим. знаком ставят соответствующую цифру, которая называется коэффициентом
Так, Аня, ти молодець!!!! Значить недаром все це вчила))))))
Хими́ческая фо́рмула — отражение информации о составе и структуре веществ с помощью химических знаков, чисел и разделяющих знаков — скобок. Например Н2О — формула воды. коэффициент — это число, которое ставиться перед хим формулой, для уравнения реакции. индекс — это число которое стоит справа от хим элемента, например в воде (Н2О) оно равно 2.
химическая формула-это условная запись состава вещества посредством химических знаков и индексов «3CuC » это есть формула. 3 это коефициент, коефициент орбозночает число молекул. 2 цифра 2 стоящяя в формуле внизу у знака элемента Ci-хлор называют индексом, индекс обозночает число атомов .
touch.otvet.mail.ru