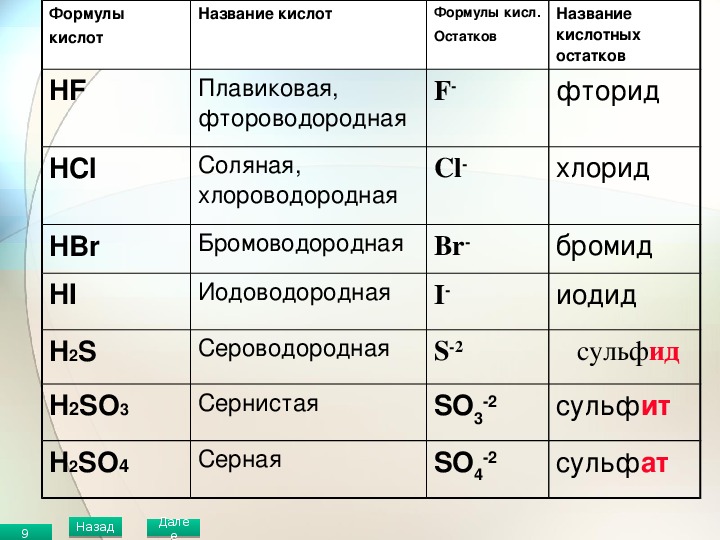
Сернистая кислота соли, — Справочник химика 21
Сероводородная кислота, образование кислых и средних солей. Гидролиз сульфидов. Растворимость сульфидов. Оксид серы (IV), строение молекулы, получение. Физические и химические свойства. Получение сернистой кислоты. Соли кислые и средние. Окислительно-восстановительные свойства соединений серы со степенью окисления +4. Оксид серы (IV), строение молекулы, получение. Физические и химические свойства. Получение серной кислоты. Химические свойства разбавленной и концентрированной серной кислоты (взаимодействие с металлами, неметаллами, органическими веществами). [c.7]Сульфиты см. Сернистой кислоты соли 932. я-Сульфофенил-метилпиразолон няющиеся Горючий Б [c.284]
Диоксид серы и гидросульфит, находящиеся в варочной кислоте, взаимодействуют с лигнином, образуя уже при 70°С активную лигносульфоновую кислоту и ее кальциевую, магниевую, натриевую или аммонийную соль.
Сернистой кислоты соли — — — — 16 — — [c.265]
Реакция Клауса в водных растворах может протекать через образование промежуточных солей сернистых кислот, которые обладают различной устойчивостью. В определенных условиях эти соединения могут оказаться термодинамически более стабильными чем элементная сера, и вместо нее могут получиться другие, нежелательные [c.197]
Восстановители — сернистая кислота, соли железа (П), металлические алюминий и цинк (в щелочном растворе) восстанавливают хлораты до хлоридов [c. 535]
535]
Возможно сульфирование и другими а1гентам1и олеумом, три-оксидом серы и его соединениями с ароматическими аминами (например, с пиридином, хлорсульфоновой кислотой), солями сернистой и серной кислот. Считается, что сульфирующим агентом, непосредственно атакующим ароматическое ядро, является ион + [c.27]
Соединения r(VI) — сильные окислители. Они быстро восстанавливаются до Сг(1П) сероводородом, сернистой кислотой, солями Fe(II), этиловым спиртом и т. д. [c.16]
Из этих данных можно прийти к заключению, что сернистая кислота, соли которой применяются для получения сульфоновых
Сернистой кислоты соли Серной кислоты соли в пересчете иа ЗО Сероводородной кислоты соли в пересчете на Сероуглерод [c.204]
При взаимодействии галоидного алкила со щелочной солью сернистой кислоты в водном растворе скорее можно ожидать образования сульфокислоты [36, 37], чем эфира сернистой кислоты. В случае замены щелочной соли сернистокислым аммонием [38] получающаяся аммониевая соль сульфокислоты легче превра- [c.109]
В случае замены щелочной соли сернистокислым аммонием [38] получающаяся аммониевая соль сульфокислоты легче превра- [c.109]
Соли сернистой кислоты называют сульфитами. В соответствии с двухосновностью сернистой кислоты известны кислые сульфиты (гидросульфиты) и средние сульфиты. Гидросульфиты за исключением известных в кристаллическом состоянии МН50з (М = Na, К, Rb, Сз) устойчивы лишь в растворах им, по-видимому, отвечает торая из приведенных структур Нг50з. Сульфиты могут быть выделены большинству этих солей отвечает первая структура h3SO1 (исключение составляют соли некоторых малоактивных металлов). Ион SO3 имеет форму пирамиды с атомом S в вершине. Хорошо растворимы лишь сульфиты щелочных металлов. Соли сернистой кислоты можно получить по реакциям [c.448]
Этансульфокислота. В этом разделе приведены только реакции, не упомянутые при рассмотренип общих методов получения сульфокислот. Встряхивание диэтилсульфита с иодистым этилом [54] в щелочном растворе или просто гидролиз диэтилсульфита холодным раствором 20%-ной щелочи [87] ведет к образованию некоторого количества щелочной соли этансульфокислоты. Аналогичные. результаты дает действие иодистого этила на натриевую соль кислого этилового эфира сернистой кислоты. Последняя в присутствии солеи, например роданида натрия, претерпевает перегруппировку, превращаясь в натриевую соль этансульфокислоты [88]. Сернистокислый натрий может быть алкилирован [89] путем нагревания с натриевой солью этилсерной кислоты в концентрированном водном растворе до температуры 110—120° в течение 3 час.
Аналогичные. результаты дает действие иодистого этила на натриевую соль кислого этилового эфира сернистой кислоты. Последняя в присутствии солеи, например роданида натрия, претерпевает перегруппировку, превращаясь в натриевую соль этансульфокислоты [88]. Сернистокислый натрий может быть алкилирован [89] путем нагревания с натриевой солью этилсерной кислоты в концентрированном водном растворе до температуры 110—120° в течение 3 час.
Прп встряхивании иодистого метила с диэтилсульфитом и разбавленным раствором едкого кали [54] образуется калиевая соль метансульфокислоты. Она получается, вероятно, гидролизом диэтилсульфита [15] в сернистокислый калий и алкилированием последнего. Действием соответствующих металлических солей сернистой кислоты на иодистый метил приготовлены [55] также и другие щелочные соли метансульфокислоты. [c.114]
Безводная метансульфокислота плавится при 20° и имеет т. кип. 167° при 10 мм [59]. С водой она образует как моно-, так и тригидрат. Судя по температуре кипения, она является ассоциированной жидкостью. При сплавлении с едким кали [60] выделяется водород, а реакционная смесь содержит калиевые соли угольной и сернистой кислот. [c.115]
кип. 167° при 10 мм [59]. С водой она образует как моно-, так и тригидрат. Судя по температуре кипения, она является ассоциированной жидкостью. При сплавлении с едким кали [60] выделяется водород, а реакционная смесь содержит калиевые соли угольной и сернистой кислот. [c.115]
Физические свойства солей оксисульфокислот согласуются с их строением. Спектр поглош ения этих соединений содержит полосу с длиной волны 4992 А, характерную для сульфокислот [222] и отличную от полосы ноглош ения солей сернистой кислоты. Растворы свободных кислот обнаруживают высокую электропроводность, указывающую на присутствие типичных сульфокислот [222, 223]. [c.144]
Таурин синтезирован также присоединением сернистой кислоты к этиленимину [161а] из 2-бромэтиламина и сернистокислого аммония или сернистокислого натрия [1456, 1616,г], присоединением аммиака к натриевой соли этиленсульфокислоты [161в], окислением 2-меркаптотиазолина бромной водой [162] [c. 133]
133]
При кипении раствора сернистая кислота полностью разлагается. Сернистая кислота, как и серная, двухосновна и образует два ряда солей (гидросульфиты и сульфиты), используемые для отбелки тканей, бумаги и т. д. Сернистый газ SO2, образующийся при обжиге сульфидных руд, служит сырьем для производства серной кислоты.
Гидрометаллургия охватывает способы получения металлов из растворов их солей. В гидрометаллургии в большом масштабе применяют экстрагирование —отделение растворимого вещества от нерастворимого с помощью определенных растворителей. В качестве растворителей используют жидкости, извлекающие добываемый металл из руды и пе растворяющие пустую породу и неценные минералы. Растворителями служат слабый раствор серной кислоты, растворы цианистого калия, гидроокиси аммония Nh5OH, сернистой кислоты, солей окисного (трехвалентного) железа и т. д. Например, при обработке слабой серной кислотой руд, содержащих медь в виде окиси СиО, протекает реакция [c. 326]
326]
Disulfilokoballoat n соль кобальт(2)-сернистой кислоты, соль ди-сульфито-кобальт(2)-кпслоты, Ma [c.123]
В этом разделе будут рассмотрены сульфокислоты, содержащие сульфогруппы в боковой цепи ароматических соединений. Бензольное кольцо сульфируется легче, чем большинство алифатических групп, и поэтому для получения арилалкилсульфокислот обычно служат методы не использующие реакцию прямого замещения. Толуол-ш-сульфокислота [69 г, 119] наиболее легко получается из хлористого бензила и щелочной соли сернистой кислоты в щелочном растворе. Она приготовлена также нагреванием хлористого бензила с раствором гидросульфита натрия в присутствии цинковой пыли [120] окислением дибензилдисульфида азотной кислотой [121] и нагреванием метилбензилкетона с концентрированной серной кислотой [122] [c.127]
Реакции осаждения. Восстановители (сернистая кислота, соли железа(П), металлические А1 и Zn, формальдегид) восстанавливают хлорат-ион до хлорид-иона, который легко обнаруживают по образованию осадка Ag l, растворимого в Nh5OH [647].
Будучи двухосновной (К 2Л0 , /(г = 6,3 10 ), сернистая кислота обра ует два ряда солей. Средние ее соли называются сульфитами, кислые — гидросульфитами. [c.386]
Отделение серной кислоты от сульфокислот, образ тощихся в ре- зультате гидролитических реакций, основано на растворимости их солей бария в воде. Поэтому исследуемый водный раствор отработанной кислоты титруется —1/5-норм, щелочью для определения общего содержания кислот в присутствии фенолфталеина. В другой порции этого же раствора НгЗОд определяетбя в виде BaSOi. Сернистая кислота при этом определяется вместе с сульфокиалотами. Сульфокислоты обыкновенно рассчитываются как серная кислота. [c.346]
Щелочные отходы от выщелачивания керосиновых и масляных дистил-. гятов большинства нефтей представляют собой коллоидный водный раствор натриевых солей нафтеновых кислот (а иногда и некоторого количества кислых сульфосоединений), в котором также коллоидально растворено минеральное масло. В щелочных отходах присутствуют также натриевые соли кислых сернистых соединений, а иногда серной и сернистой кислот. В щелочных отходах от очистки бензиновых фракций соли нафтеновых кислот не содержатся, так же как и углеводороды. Таклсе очень мало солей нафтеновых кислот в отходах от выщелачивания дистиллятов урало-волжских нефтей. Очень часто в щелочных отходах встречаются феноляты натрия. [c.795]
В щелочных отходах присутствуют также натриевые соли кислых сернистых соединений, а иногда серной и сернистой кислот. В щелочных отходах от очистки бензиновых фракций соли нафтеновых кислот не содержатся, так же как и углеводороды. Таклсе очень мало солей нафтеновых кислот в отходах от выщелачивания дистиллятов урало-волжских нефтей. Очень часто в щелочных отходах встречаются феноляты натрия. [c.795]
Принимая во внимание, что этиловый эфир хлорсульфоновой кислоты обычно ведет себя как алкилирующий агент, кажется странным, что он не алкилирует натриевые производные этиловых эфиров ацетоуксусно и малоново кислот. В сухом этиловом эфире при НИЗКО температуре вместо этого происходит только хлорирован1 е и образование натриевой соли кислого этилового эфира сернистой кислоты
Полибромсоединения значительно отличаются друг от друга своим отношением к солям сернистой кислоты. Бромистый этилен и 1,2,3-трибромнропан дают соли соответствующих сульфокислот, из 2,3-дибромбутана получается смесь изомерных оксисульфокислот, тогда как соединения, содержащие галоид у третичного углеродного атома, образуют ненасыщенные кислоты. Поведение других ди- и трибромзамещенных соединений представляет большой интерес. [c.195]
Поведение других ди- и трибромзамещенных соединений представляет большой интерес. [c.195]
Соли иодметансульфокислоты в последнее время стали пользоваться большим вниманием вследствие применения их в урологической практике [76] в качестве реагентов, контрастных по отношению к рентгеновским лучам. Натр иевая соль иодметапсуль-фокислоты приготовлена почти с количественным выходом действием йодоформа [77] на водный раствор сернистокислого натрия. Согласно некоторым патентным данным [77г, 78], ее можно получить путем взаимодействия иодистого метилена с различными солями сернистой кислоты. Основательно исследована реакция обмена атомов хлора хлорметансульфокислоты на атомы иода [79], осуществляемая при нагревании хлорзамещенной сульфокислоты с иодидом [c.120]
Действие сульфитов на диазосоединения. Непосредственно из диазониевых солей получены лишь немногие сульфокислоты. Так, из сульфата бензолдиазония образуется под действием сульфита натрия и гидроокиси меди [975] бензолсульфокислота. Обработкой хлоридов толуолдиазония сернистой кислотой [976] получены все три толуолсульфокислоты. л-Диазобензойная кислота с сернистым ангидридом в спиртовом растворе дает лг-суль-фобензойную кислоту [977]. Аналогичным образом получено нижеследующее сложное производное имидазола [978а] [c.152]
Обработкой хлоридов толуолдиазония сернистой кислотой [976] получены все три толуолсульфокислоты. л-Диазобензойная кислота с сернистым ангидридом в спиртовом растворе дает лг-суль-фобензойную кислоту [977]. Аналогичным образом получено нижеследующее сложное производное имидазола [978а] [c.152]
Соли этих сульфокислот устойчивы в нейтральном и щелочном растворах, но при кипячении с кислотой они разлагаются с образованием триарилкарбинола и двуокиси серы. Продуктами взаимодействия сернистой кислоты с красителями типа малахитовой зелени и парарозанилина [142] являются амино- и диалкилами-нотриарилметансульфокислогы [c.130]
Он может быть приготовлен также путем обработки изэтионата калия дымящей серной кислотой [237, 272]. Бисульфитное соединение сульфоацетальдегида образуется, вероятно, нри взаимодействии 1,1,2-трихлор-или трибромэтана со щелочной солью сернистой кислоты [273] [c.151]
Некоторые а-сульфоацилпропзводные мочевины и гуанидина синтезированы действием щелочной соли сернистой кислоты на соответствующие хлор- или бромсоединения [321].
 [c.160]
[c.160]Прямым сульфированием глутаровой кислоты и взаимодействием щелочной соли сернистой кислоты с дибромглутаровой кислотой получаются как мезокислота, так и dl-a, а -дисульфоглу-таровая кнслота [427]. Глютаконовая кислота присоединяет [c.174]
Этан-1,2-дисульфокислота приготовлена окислением этиленмер-каптана [473], этилентиоцианата [454, 474] и некоторых циклических соединений [475], содержащих атомы серы, связанные с соседними атомами углерода. Она образуется с небольшим выходом при сульфировании нитроэтана [477], нитрила и амида пропионовой. кислоты [476] и при электролизе сульфоацетата бария [478]. Действие насыщенного раствора щелочной соли сернистой кислоты на бромистый этилен [Збв, 454, 479] нри температуре кипения смеси ведет к получению этан-1,2-дисульфокислоты с выходом 95%. В небольших количествах аммониевая соль кислоты образуется также при обработке 1,1,2-трибромэтана кипящим раствором сернистокислого аммония [440]. [c. 185]
185]
Важнейшие соли серной кислоты — Справочник химика 21
К важнейшим солям серной кислоты относятся следующие. [c.464]Соли серной кислоты иначе называются сульфатами. Важнейшими из них являю-тся следующие. [c.218]
П. Назовите важнейшие соли серной кислоты. Для каждой из них укажите [c.13]
Весьма большое применение имеют соли серной кислоты. Остановимся на важнейших из них . [c.127]
Назовите важнейшие соли серной кислоты. Для каждой из них укажите а) химическое и техническое название б) формулу образуемого ею кристаллогидрата в) практическое применение. [c.226]
С Одной из важнейших характеристик веш,ества является его плотность, обычно обозначаемая греческой буквой р . Всякие примеси к какому-либо веществу обязательно изменяют его плотность.
 Поэтому по величине плотности можно судить о чистоте и качестве взятого вещества. В химических лабораториях особенно часто определяют плотность растворов и других жидкостей. Определив плотность, можно узнать концентрацию вещества в данном растворе. Например, концентрацию растворов солей или щелочей можно определить, узнав их плбтность. Имеются таблицы, в которых указано, какой плотности соответствует определенное содержание вещества. Это же относится и к растворам многих кислот. Так, в таблице можно найти, что при плотности серной кислоты, равной 1,835 г/сл ,в 100 г ее содержится 95,72 г чистой серной кислоты. Или раствор едкого натра плотностью 1,430 г см содержит 40% вес. едкого натра, т. е. в 100 г этого раствора будет содержаться 40 г твердого едкого натра. [c.161]
Поэтому по величине плотности можно судить о чистоте и качестве взятого вещества. В химических лабораториях особенно часто определяют плотность растворов и других жидкостей. Определив плотность, можно узнать концентрацию вещества в данном растворе. Например, концентрацию растворов солей или щелочей можно определить, узнав их плбтность. Имеются таблицы, в которых указано, какой плотности соответствует определенное содержание вещества. Это же относится и к растворам многих кислот. Так, в таблице можно найти, что при плотности серной кислоты, равной 1,835 г/сл ,в 100 г ее содержится 95,72 г чистой серной кислоты. Или раствор едкого натра плотностью 1,430 г см содержит 40% вес. едкого натра, т. е. в 100 г этого раствора будет содержаться 40 г твердого едкого натра. [c.161]Многие соли серной кислоты имеют большое практическое значение. Укажем важнейшие из них. [c.234]
Укажите важнейшие соли серной кислоты. Где они применяются [c.221]
В аналитической химии очень важную роль играет образование осадков — соединений, мало растворимых в воде. Осадки выпадают тогда, когда ионы, соединяясь друг с другом, образуют малорастворимые химические соединения. Например, при смешивании растворов соли серной кислоты и соли бария всегда образуется практически нерастворимая соль — сульфат бария [c.27]
Осадки выпадают тогда, когда ионы, соединяясь друг с другом, образуют малорастворимые химические соединения. Например, при смешивании растворов соли серной кислоты и соли бария всегда образуется практически нерастворимая соль — сульфат бария [c.27]
Серная кислота — один из важнейших продуктов основной химической промышленности-, к последней относится производство кислот, щелочей, солей, минеральных удобрений и хлора. Основным потребителем серной кислоты является производство минеральных удобрений. Она служит также для получения многих других кислот, применяется в большом количестве в органическом синтезе, при производстве взрывчатых веществ, для очистки керосина, нефтяных масел и продуктов коксохимической промышленности (бензола, толуола), при изготовлении красок, травлении черных металлов (снятие окалины). [c.466]
В таблице VIII-1 приведены названия важнейших кислот и их анионов. Валентность последних отмечена числом штрихов. Названия анионов одновременно служат и в качестве группового названия солей данной кислоты. Например, все средние соли серной кислоты называются сульфатами, азотной — нитратами и т. д. Соль КН2РО4 называется дигидрофосфатом калия, Са(НСОз)а — гидрокарбонатом кальция (или бикарбонатом кальция) и т. д. При этом необходимо обратить внимание на следующее. [c.189]
Например, все средние соли серной кислоты называются сульфатами, азотной — нитратами и т. д. Соль КН2РО4 называется дигидрофосфатом калия, Са(НСОз)а — гидрокарбонатом кальция (или бикарбонатом кальция) и т. д. При этом необходимо обратить внимание на следующее. [c.189]
Так как серная кислота сильная и притом нелетучая (вследствие высокой температуры кипения), она применяется при Получении ряда важных для промышленности кислот соляной, азотной и др. Она необходима в производстве искусственного волокна, эфира, для получения ряда солей серной кислоты (сульфатов), находящих применение в промышленности, в сельском хозяйстве. [c.471]
Сорбция SO2 анионитами описана в ряде работ и патентов, например [263, 545, 546]. При десорбции растворами щелочи или аммиака образуются менее концентрированные растворы сульфитов и сульфатов, чем при сорбции на солевых формах карбоксильных катионитов (до 10—15 вес. %). Очистка газов от SOg с помощью ионитов нашла промышленное применение [473, 547, 548] и, по-видимому, явится важным методом производства солей серных кислот. [c.193]
%). Очистка газов от SOg с помощью ионитов нашла промышленное применение [473, 547, 548] и, по-видимому, явится важным методом производства солей серных кислот. [c.193]
К наиболее важному способу получения галогеноводородов относится реакция какой-либо галогенидной солп с сильной нелетучей кислотой. Фтороводород и хлороводород получают именно таким способом — путем реакции между наиболее дешевой легко доступной солью и концентрированной серной кислотой [c.293]
Важнейшие соли серной кислоты. Медный купорос Си80,1 -ЗНгО применяется для изготовления зеленых н синих красок, для борьбы с вредителями растений и в электротехнике. [c.151]
Для процесса запекания практически важно наличие возможно большей в верхности бисульфата амина, что достигается распределением ого тонким слоем на листе- жести, растиранием корки, применением вакуума и тону подобными мерами. Наиболее благоприятными температурами процесса являются 170-—220° С однако в када-v дом отдельном случае температуры различны и должны устанавливаться путем проб-, ных опытов. Процесс лучше вести в вакууме (Ml], так как при этом сульфирование проходит быстрее, более гладио и устраняется опасность обугливания. Применяемые. для запекания бисульфаты должны быть возможно более чистыми, поскольку ордер-1 жащанся иногда в соли серная кислота моз ет способствовать иному направлении » сульфирования. Сульфируемое соединение лучше всего растворить Е ледяной уксусной кислоте, вылить раствор в рассчитанное количество концентрированной серной кясн лоты и удалить уксусную кислоту в вакууме ОСТЯГОЕ количественно состоим из бисульфата. [c.566]
Процесс лучше вести в вакууме (Ml], так как при этом сульфирование проходит быстрее, более гладио и устраняется опасность обугливания. Применяемые. для запекания бисульфаты должны быть возможно более чистыми, поскольку ордер-1 жащанся иногда в соли серная кислота моз ет способствовать иному направлении » сульфирования. Сульфируемое соединение лучше всего растворить Е ледяной уксусной кислоте, вылить раствор в рассчитанное количество концентрированной серной кясн лоты и удалить уксусную кислоту в вакууме ОСТЯГОЕ количественно состоим из бисульфата. [c.566]
Формование волокна. Формование вискозного волокна, как принято в производстве химических волокон, называют прядением, а вискозу, соответственно, — прядильным раствором. Формование — важнейшая стадия технологического процесса, условия которой определяют структуру и свойства волокна. Формование осуществляют мокрым способом, т.е. прядильный раствор продавливают через фильеры (нитеобразователи) с отверстиями диаметром 0,04. ..0,10 мм в осадительную ванну -раствор, содержащий серную кислоту и ее соли. Серная кислота необходима для разложения ксантогената с получением регенерированной целлюлозы. Соли (сульфаты натрия, цинка и др.) регулируют процесс коагуляции. Состав ванны зависит от вида формуемого волокна. [c.593]
..0,10 мм в осадительную ванну -раствор, содержащий серную кислоту и ее соли. Серная кислота необходима для разложения ксантогената с получением регенерированной целлюлозы. Соли (сульфаты натрия, цинка и др.) регулируют процесс коагуляции. Состав ванны зависит от вида формуемого волокна. [c.593]
Сульфат натрия. — История открытия. Открытие важнейшей из солей серной кислоты-сульфата натрия связано с именем современника Парацельса химика-тех-нолога Глаубера. Наилучшую характеристику этого исследователя-практика-, близкого производству и чуждого всякой мистики, мы находим в первой истории химии, вышедшей в конце XVHI в. [c.293]
Сера — необходимый элемент питания растений и наряду с азотом и фосфором имеет очень важное значение в их жизни. При недостатке серы листья приобретают желтоватую или светлую окраску, сходную с окраской при азотном голодании, ухудшается рост и развитие растений и заметно снижается урожай. Сера поглощается растением из почвы в виде ее высшего окисла, аниона 80 , источником которого служат различные соли серной кислоты Са804, MgS04, К28О4, (КН4)2804 и др. Растения могут усваивать [c.178]
Растения могут усваивать [c.178]
Наибольшая масса серной кислоты применяется в содовом производстве для реакций с поваренною солью, для приготовления из соответственных солей азотной, соляной и других летучих кислот, для приготовления серноаммиачной соли квасцов, купоросов, удобрительного суперфосфата (гл. 19, доп. 501) и других солей серной кислоты, для обработки костяной золы при получении фосфора, для растворения металлов, напр., серебра при отделении его от золота, для чистки металлов от ржавчины и т. п. Большие количества купоросного масла идут также для обработки органических веществ напр., при добыче из сала стеарина или стеариновой кислоты, для очищения керосина и разных растительных масел, при получении нитроклетчатки и нитроглицерина, для-растворения индиго или кубовой краски и других красильных веществ, для превращения бумаги в растительный пергамент, для получения эфира из спирта, для приготовления разных искусственных духов из сивушного масла, для извлечения растительных кислот щавелевой, винной, лимонной, для превращения небродящих крахмалистых веществ в бродящую глюкозу и во множестве других производств. Едва найдется другое, искусственно добываемое, вещество, столь часто применяемое в технике, как серная кислота. Где нет заводов для ее добывания — немыслимо выгодное производство многих других веществ, имеющих важное техническое значение. Там, где техническая деятельность развита, там потребляется и много серной кислоты серная кислота, сода и известь суть важнейшие из искусственно добываемых химических деятелей, применяемых на заводах. [c.222]
Едва найдется другое, искусственно добываемое, вещество, столь часто применяемое в технике, как серная кислота. Где нет заводов для ее добывания — немыслимо выгодное производство многих других веществ, имеющих важное техническое значение. Там, где техническая деятельность развита, там потребляется и много серной кислоты серная кислота, сода и известь суть важнейшие из искусственно добываемых химических деятелей, применяемых на заводах. [c.222]
Для получения хромового ангидрида насыщенный раствор двухромовокалиевой соли при обыкновенной температуре приливают тонкою струею к равному объему чистой серной кислоты. При смешении, разумеется, температура повышается. При медленном охлаждении хромовый ангидрид выделяется в длинных игольчатых кристаллах красного цвета, ногда в несколько сантиметров длиною. Чтобы освободить кристаллы от маточного раствора, их кладут на пористую глиняную массу, напр., на кирпич (ни процеживания, ни промывания здесь употребить нельзя, потому что бумагою хромовый ангидрид восстановляется, а промыванием растворяется).
 Весьма важно обратить здесь внимание на то, что при разложении хромовых соединений никогда не выделяется гидрата хромовой кислоты, а всегда ангидрид СгО . Соответственный гидрат СгО Н- или какой-либо другой даже вовсе неизвестны. Тем не менее надо принять, что хромовая кислота двуосновна, потому что она образует соли изоморфные или совершенно аналогические с солями серной кислоты, которая есть лучший пример двуосновных кислот. Доказательство этому видно и в том, что СгО при нагревании с Na l и H SO дает летучий хлорангидрид rO l с двумя [атомами] хлора, как следует для двуосновной кислоты. Хромовый ангидрид представляет красное кристаллическое вещество, при нагревании дающее черную массу при накаливании до 190° плавится, выше 250° выделяет кислород и оставляет двуокись хрома СгО [556], а при еще более возвышенной температуре — окись хрома СгЮ . Хромовый ангидрид чрезвычайно легко растворяется в воде, притягивает даже влагу воздуха, но определенного соединения с водою, как сказано выше, не образует.
Весьма важно обратить здесь внимание на то, что при разложении хромовых соединений никогда не выделяется гидрата хромовой кислоты, а всегда ангидрид СгО . Соответственный гидрат СгО Н- или какой-либо другой даже вовсе неизвестны. Тем не менее надо принять, что хромовая кислота двуосновна, потому что она образует соли изоморфные или совершенно аналогические с солями серной кислоты, которая есть лучший пример двуосновных кислот. Доказательство этому видно и в том, что СгО при нагревании с Na l и H SO дает летучий хлорангидрид rO l с двумя [атомами] хлора, как следует для двуосновной кислоты. Хромовый ангидрид представляет красное кристаллическое вещество, при нагревании дающее черную массу при накаливании до 190° плавится, выше 250° выделяет кислород и оставляет двуокись хрома СгО [556], а при еще более возвышенной температуре — окись хрома СгЮ . Хромовый ангидрид чрезвычайно легко растворяется в воде, притягивает даже влагу воздуха, но определенного соединения с водою, как сказано выше, не образует. Уд. вес кристаллов равен 2,7 (сплавленных 2,6). Раствор представляет совершенно ясные кислотные свойства из угольных солей выделяет угольную кислоту, в солях бария, свинца, серебра и ртути производит осадок нарастворимых солей. [c.236]
Уд. вес кристаллов равен 2,7 (сплавленных 2,6). Раствор представляет совершенно ясные кислотные свойства из угольных солей выделяет угольную кислоту, в солях бария, свинца, серебра и ртути производит осадок нарастворимых солей. [c.236]Как свободная сера, так и ее соединения нашли широкое применение в промышленности. Свободная сера идет на производство резины. Для придания каучуку (естественный продукт, добываемый из различных каучуконосных растений) эластических свойств его нагревают с серой. Сернистый газ, полученный при обжиге сульфидных руд цветных металлов, а также путем сжигания пиритов, служит для получения серной кислоты — одного из важнейших продуктов основной химической промышленности. Имеют широкое применение в различ1ных отраслях промышленности соли серной кислоты. [c.198]
Прежде чем перейти к рассмотрению ряда способов приготовления искусственной соды, появившихся в последующие пятнадцать лет, остановимся еще на одном важном событии в истории химии, происшедшем за 100 слишком лет до рассматриваемого нами времени мы имеем в виду открытие, сделанное одним из крупнейших химиков XVII в. — Рудольфом Глаубером, который 1658 г., разлагая поваренную соль серной кислотой, получил хлористый водород, сгущенный им в соляную кислоту, и серно- [c.17]
— Рудольфом Глаубером, который 1658 г., разлагая поваренную соль серной кислотой, получил хлористый водород, сгущенный им в соляную кислоту, и серно- [c.17]
Наиболее важными из дихроматов являются дихромат калия К2СГ2О7 и дихромат натрия Na2 r207-2h30, образующие оранжево-красные кристаллы. Обе соли, известные также под названием хромпиков, широко применяются в качестве окислителей при производстве многих органических соединений, в кожевенной промышленности при дублении кож, в спичечной и текстильной промышленности. Смесь концентрированной серной кислоты с водным раствором дихромата калия или натрия под названием хромовой смеси часто применяется для энергичного окисления и для очистки химической посуды. Все соли хромовых кислот ядовиты. [c.514]
Помимо этих продуктов Ловиц исследовал в отношении действия угля и ряд других веществ. Наиболее важным в научном и практическом отношениях является многолетнее исследование по изучению способов приготовления уксусной киатоты. В то время чистая уксусная кислота еще не была известна. Для фармацевтических целей пользовались обычно крепленым винным уксусом, приготовлявшимся различными методами. Более популярным был метод Вестендорфа. Этот метод состоял в нейтрализации слабого уксуса едким натром и последующем разложении выделенной выпариванием соли серной кислотой с отгонкой образовавшейся уксусной кислоты Пытаясь очистить слабый уксус от посторонних примесей, Ловиц применил уголь. Он добился при этом осветления и очистки уксуса, но оказалось, что крепость кислоты пос.те такой очистки заметно падает вследствие того, что некоторая часть уксуса остается на угле . Ловицу пришлось поставить ряд дополнительных опытов. Применяя. [c.429]
В то время чистая уксусная кислота еще не была известна. Для фармацевтических целей пользовались обычно крепленым винным уксусом, приготовлявшимся различными методами. Более популярным был метод Вестендорфа. Этот метод состоял в нейтрализации слабого уксуса едким натром и последующем разложении выделенной выпариванием соли серной кислотой с отгонкой образовавшейся уксусной кислоты Пытаясь очистить слабый уксус от посторонних примесей, Ловиц применил уголь. Он добился при этом осветления и очистки уксуса, но оказалось, что крепость кислоты пос.те такой очистки заметно падает вследствие того, что некоторая часть уксуса остается на угле . Ловицу пришлось поставить ряд дополнительных опытов. Применяя. [c.429]
В этой первой работе Ловица дается описание способа очистки виннокаменной кислоты путем ее перевода (взаимодействием с мелом) в виннокислый кальций и разложения соли серной кислотой. Сообщаются условия кристаллизации очищенной кислоты. Важно указание автора о свойствах раствора кислоты, частично обуглившейся при случайном недосмотре. Такой раствор, содержащий углеподобный осадок, после отстаивавия в течение 8 дней становится прозрачным, и выделяющиеся из него кристаллы совершенно бесцветны. Дается попытка объяснения роли этого углеподобного осадка. [c.577]
Такой раствор, содержащий углеподобный осадок, после отстаивавия в течение 8 дней становится прозрачным, и выделяющиеся из него кристаллы совершенно бесцветны. Дается попытка объяснения роли этого углеподобного осадка. [c.577]
Некоторые наиболее важные процессы алкилирования ароматики практикуются в промышленности реакция бензола с этиленом с образованием этилбензола, который затем дегидрируется в стирол алкилирование моноядерной ароматики с пропиленом, что дает соответствующие изопропил-производные, которые в свою очередь превращаются в фенол, крезол и т. д. через промежуточные гидроперекиси (т. е. фенол и ацетон от гидроперекиси цимола) алкилирование бензола и нафталина с алкил-хлоридами с длинными цепочками для производства соответствующей алкилароматики, которая сульфируется в ядре серной кислотой (натриевой солью) для применения в очистке и, наконец, алкилирование фенолов с олефинами или алкильными галогенидами с целью получения алкилированных фенолов, использующихся как присадки (или как промежуточные продукты в производстве присадок) к топливам и маслам. Первый и третий процессы проходят в присутствии хлористого алюминия, который наряду с другими галогенидами металлов является наиболее важным [c.133]
Первый и третий процессы проходят в присутствии хлористого алюминия, который наряду с другими галогенидами металлов является наиболее важным [c.133]
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитруюш,им и окисляюш,им действием по отношению органических соединений в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике. [c.208]
Среди кислородсодержащих кислот и их солей к наиболее важным окислителям относятся КМПО4, К2СГО4, КгСгаО/, концентрированная серная кислота, азотная кислота и нитраты, кислородсодержащие кислоты галогенов и их соли. [c.161]
Еще Вертело пытался ускорить реакцию между этиленом и серной кислотой, применяя в качестве катализаторов соли ртути. Фритцше [38] считал, что этилсерная кислота сама по себе достаточно акти1 ный катализатор.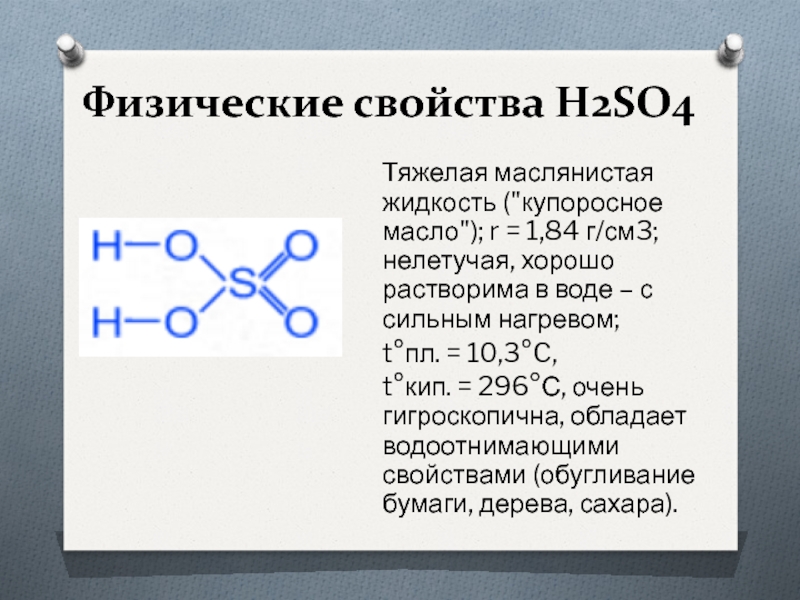 Это было подтверждено в работе [39]. В дальнейшем были изучены многие катализаторы [40, 41], причем наиболее эффективными оказались соли серебра, железа, меди и окислов ванадия. Действие солей в болынинстве случаев не зависит от аниона, но поскольку мы имеем дело с серной кислотой, рекомендуе -ся употреблять сульфаты (несколько отличаются друг от друга по действию соли одно- и двухвалентной меди). Иногда специфичность действия приписывается аммиачным солям [42] и циановым комплексам металлов [43], но, по нашему мнению, главная роль во всяком молекулярном комплексе принадлежит металлу (например, железу в соли Мора и ферроциановых соединениях). Различие может заключаться лишь в неодинаковом физическом состоянии катализатора в серной кислоте и в последующем изменении состояния с превращением части молекул серной кислоты в молекулы этилсерной кислоты или с введением влаги в серную кислоту. Сравнение действия различных катализаторов может привести к одним и тем же выводам кривые относительной интенсивности действия в ряду каталитических добавок приблизительно одного порядка.
Это было подтверждено в работе [39]. В дальнейшем были изучены многие катализаторы [40, 41], причем наиболее эффективными оказались соли серебра, железа, меди и окислов ванадия. Действие солей в болынинстве случаев не зависит от аниона, но поскольку мы имеем дело с серной кислотой, рекомендуе -ся употреблять сульфаты (несколько отличаются друг от друга по действию соли одно- и двухвалентной меди). Иногда специфичность действия приписывается аммиачным солям [42] и циановым комплексам металлов [43], но, по нашему мнению, главная роль во всяком молекулярном комплексе принадлежит металлу (например, железу в соли Мора и ферроциановых соединениях). Различие может заключаться лишь в неодинаковом физическом состоянии катализатора в серной кислоте и в последующем изменении состояния с превращением части молекул серной кислоты в молекулы этилсерной кислоты или с введением влаги в серную кислоту. Сравнение действия различных катализаторов может привести к одним и тем же выводам кривые относительной интенсивности действия в ряду каталитических добавок приблизительно одного порядка. Абсолютные значения каталитического действия здесь не важны, поскольку они зависят от условий эксперимента. [c.22]
Абсолютные значения каталитического действия здесь не важны, поскольку они зависят от условий эксперимента. [c.22]
При получении солей синтетическими способами в качестве исходных материалов используются главным образом полупродукты основной химической промышленности или отходы различных гфоизводств. Синтез солей основан на реакциях нейтрализации. Таким образом получают, например, важнейшие азотные удобрения из кислот и щелочей. Большое количество солей получается в качестве побочных продуктов других производств. Например, в производстве глинозема из нефелина в качестве побочных продуктов получают поташ К2СО3 и соду ЫагСОз. Из отходящих газов цветной металлургии и производства серной кислоты, содержащих 50г, получают сульфиты. Нитрат кальция, применяемый как удобрение, можно получить из отбросных нитрозных газов производ- [c.142]
Одним из преимуществ гидроэлектрометаллургических методов является то, что они часто позволяют более полно по сравнению с металлургическими переделами перерабатывать бедные и полиметаллические руды с раздельным получением всех полезных компонентов, а основного — в виде продукта высокой чистоты. Так, цинковые заводы одновременно с цинком выпускают кадмий, свинец, соли или концентраты меди и кобальта, ряд редких металлов и концентратов, а также серную кислоту медерафннировочные заводы — медь и шламы, содержащие благородные металлы. Стоимость попутно получаемых продуктов — важный фактор при определении рентабельности гидроэлектрометаллургического производства по сравнению с пирометаллургическим. [c.233]
Так, цинковые заводы одновременно с цинком выпускают кадмий, свинец, соли или концентраты меди и кобальта, ряд редких металлов и концентратов, а также серную кислоту медерафннировочные заводы — медь и шламы, содержащие благородные металлы. Стоимость попутно получаемых продуктов — важный фактор при определении рентабельности гидроэлектрометаллургического производства по сравнению с пирометаллургическим. [c.233]
С В. активно взаимодействует с кислородом и образует пентоксид УгО . При 700° С С азотом образует нитрид УМ, с углеродом — карбид УС, обладающий высокой твердостью и т. пл. 2800° С. Из оксидов В. важнейшим является УаОб, применяемый в качестве катализатора в производстве серной кислоты и в органическом синтезе в реакциях окисления. У2О5 — ангидрид ванадат-ной кислоты, растворяется в щелочах, образуя соли — ванадаты. В. применяется для легирования сталей, имеющих высокую твердость, упругость, сопротивление истиранию (содержание В. 0,15— 0,25%). В. является компонентом сплавов для постоянных магнитов. Соединения [c.52]
Соединения [c.52]
%d1%81%d0%be%d0%bb%d1%8c%20%d1%81%d0%b5%d1%80%d0%bd%d0%be%d0%b9%20%d0%ba%d0%b8%d1%81%d0%bb%d0%be%d1%82%d1%8b — со всех языков на все языки
Все языкиРусскийАнглийскийИспанский────────Айнский языкАканАлбанскийАлтайскийАрабскийАрагонскийАрмянскийАрумынскийАстурийскийАфрикаансБагобоБаскскийБашкирскийБелорусскийБолгарскийБурятскийВаллийскийВарайскийВенгерскийВепсскийВерхнелужицкийВьетнамскийГаитянскийГреческийГрузинскийГуараниГэльскийДатскийДолганскийДревнерусский языкИвритИдишИнгушскийИндонезийскийИнупиакИрландскийИсландскийИтальянскийЙорубаКазахскийКарачаевскийКаталанскийКвеньяКечуаКиргизскийКитайскийКлингонскийКомиКомиКорейскийКриКрымскотатарскийКумыкскийКурдскийКхмерскийЛатинскийЛатышскийЛингалаЛитовскийЛюксембургскийМайяМакедонскийМалайскийМаньчжурскийМаориМарийскийМикенскийМокшанскийМонгольскийНауатльНемецкийНидерландскийНогайскийНорвежскийОрокскийОсетинскийОсманскийПалиПапьяментоПенджабскийПерсидскийПольскийПортугальскийРумынский, МолдавскийСанскритСеверносаамскийСербскийСефардскийСилезскийСловацкийСловенскийСуахилиТагальскийТаджикскийТайскийТатарскийТвиТибетскийТофаларскийТувинскийТурецкийТуркменскийУдмуртскийУзбекскийУйгурскийУкраинскийУрдуУрумскийФарерскийФинскийФранцузскийХиндиХорватскийЦерковнославянский (Старославянский)ЧеркесскийЧерокиЧеченскийЧешскийЧувашскийШайенскогоШведскийШорскийШумерскийЭвенкийскийЭльзасскийЭрзянскийЭсперантоЭстонскийЮпийскийЯкутскийЯпонский
Все языкиРусскийАнглийскийИспанский────────АймараАйнский языкАлбанскийАлтайскийАрабскийАрмянскийАфрикаансБаскскийБашкирскийБелорусскийБолгарскийВенгерскийВепсскийВодскийВьетнамскийГаитянскийГалисийскийГреческийГрузинскийДатскийДревнерусский языкИвритИдишИжорскийИнгушскийИндонезийскийИрландскийИсландскийИтальянскийЙорубаКазахскийКарачаевскийКаталанскийКвеньяКечуаКитайскийКлингонскийКорейскийКрымскотатарскийКумыкскийКурдскийКхмерскийЛатинскийЛатышскийЛингалаЛитовскийЛожбанМайяМакедонскийМалайскийМальтийскийМаориМарийскийМокшанскийМонгольскийНемецкийНидерландскийНорвежскийОсетинскийПалиПапьяментоПенджабскийПерсидскийПольскийПортугальскийПуштуРумынский, МолдавскийСербскийСловацкийСловенскийСуахилиТагальскийТаджикскийТайскийТамильскийТатарскийТурецкийТуркменскийУдмуртскийУзбекскийУйгурскийУкраинскийУрдуУрумскийФарерскийФинскийФранцузскийХиндиХорватскийЦерковнославянский (Старославянский)ЧаморроЧерокиЧеченскийЧешскийЧувашскийШведскийШорскийЭвенкийскийЭльзасскийЭрзянскийЭсперантоЭстонскийЯкутскийЯпонский
Открытый урок «Серная кислота и ее соли»
Урок в 9 классе «Серная кислота и ее соли»
Цели:
а) познавательная – формировать умения характеризовать свойства серной кислоты в свете теории электролитической диссоциации, окислительно-восстановительных реакций, подтверждать соответствующими уравнениями химических реакций;
б) развивающая – усложнение смысловой функции речи, способность анализировать, обобщать, сравнивать;
в) воспитывающая – толерантное отношение к высказываниям других, дисциплинированность и собранность.
Задачи:
конкретизировать общие знания учащихся о свойствах кислот в свете теории электролитической диссоциации (ТЭД) на примере разбавленной серной кислоты;
конкретизировать знания учащихся об окислительных свойствах кислот на примере концентрированной серной кислоты;
показать народнохозяйственное значение этой кислоты и её солей.
Оборудование и материалы:
серная кислота (разбавленная), раствор хлорида бария, пробирки, лакмусовые полоски;
компьютер, проектор, экран, компьютерная презентация;
на ученических столах разложены периодическая система химических элементов Д.И. Менделеева и «Таблица растворимости кислот, оснований и солей в воде», а также схема «Взаимодействие концентрированной серной кислоты с металлами», инструктивные карты, таблицы для рефлексии, фишки для оценивания, домашнее задание (кроссворд «Свойства серной кислоты»)
Ход урока.
Химический состав свой изменять
Должны все формы жизни в вечном споре.
Они живут, чтоб умереть им вскоре
И умирают, чтоб ожить опять.
(Эразм Дарвин, дед Чарльза Дарвина)
I. Организационный момент. Проверка домашнего задания.
Мы с вами продолжаем изучение особой подгруппы элементов. Что это за группа? Кокой элемент мы изучаем наиболее подробно? (ответы)
Для того, чтобы продолжить, необходимо вспомнить, о чем мы говорили с вами раньше.
Фронтальный опрос:
1.Какие соединения образует сера?
2.Что такое сероводородная вода?
3.Может ли сероводород проявлять окислительные свойства? Почему?
4.Химические свойства сернистого газа?
5.Какие химические свойства проявляет оксид серы (VI)?
II.Изучение нового материала.
1.Постановка проблемы.
Известно, что оксиды серы вызывают больше болезней, чем выхлопные газы автомобилей. Эти загрязнения поступают от электростанций, заводов и жилых домов.
Эти загрязнения поступают от электростанций, заводов и жилых домов.
Оксиды серы и тонкие частицы пыли обычно концентрируются в местах интенсивного сжигания угля и очень опасны зимой, когда для обогрева приходится сжигать большое количество топлива. Около 20 тыс. т. оксидов серы ежегодно выбрасывается в атмосферу, там они соединяются с водяными парами и уносятся на большие расстояния, где и выпадают вместе с атмосферными осадками в виде ядовитых «кислотных» дождей, растворов сернистой и серной кислоты.
Сернистую кислоту мы изучили на прошлом уроке, а сегодня мы познакомимся со свойствами и применением серной кислоты и ее солей. Итак, тема нашего урока «Серная кислота и ее соли». Запишите ее в тетради.
2.История.
Первое упоминание об этом веществе встречается у арабских и европейских алхимиков Х века. Из-за масляного вида ее называли купоросным маслом и серным маслом. В 1595году алхимик Андрей Либавий установил тождественность обоих веществ. С того времени это «масло» стали называть серной кислотой, — формула которой H2SO4.
3. Нахождение в природе.
Вам известно, что серная кислота в природе в чистом виде встречается довольно редко, т.е. ее добывают промышленным способом на производствах из различных производных серы. А вот сера в природе встречается гораздо чаще, хотя и в соединениях. Давайте вспомним о нахождении серы в природе.
4. Характеристика соединения.
А теперь давайте поработаем с учебником и дадим характеристику этому веществу.
Первая группа описывает физические свойства кислоты, также должны привести молекулярную и структурную формулы ее, степень окисления центрального атома и относительную молекулярную массу.
Вторая группа должны изучить стадии получения серной кислоты.
Третья группа ищет и доказывает генетическую связь серной кислоты с другими классами соединений.
Даю вам на эту работу 5 минут.
Молодцы! Все справились со своими заданиями. А теперь самое время отдохнуть!
5. Физминутка (сценка «Кислоты»)
Физминутка (сценка «Кислоты»)
В некотором царстве, в тридевятом Химическом государстве жил-был царь, великий химический государь. И правил он царством неорганических веществ. Познакомимся с жителями этой удивительной страны. Вон там, в сторонке, встретились две сестры, и, кажется, у них что-то случилось.
Кислота H2SO4. Здравствуй, сестра!
Кислота HCl. Здравствуй, родная! Что-то ты неважно выглядишь. Расскажи, что у тебя случилось.
Кислота H2SO4. Ты и не представляешь, как я устала, вся из сил выбилась. Ты разве ничего не слыхала? К нам в царство приехали добры молодцы: такие красивые, такие блестящие металлы.
Кислота HCL. Ах, да! Я их видела краем глаза. Такой егоза Na, легкий Аl и такой крутой молодец Fе.
Ах, да! Я их видела краем глаза. Такой егоза Na, легкий Аl и такой крутой молодец Fе.
Кислота H2SO4. Да, но не о них речь. С ними у меня хорошие отношения, без всяких проблем. Меня интересуют другие: такие блестящие, такие дорогие, прямо никак к ним не подобраться.
Кислота HCl. Ах, да! Припоминаю. Видела я тут двух франтов: Аg и Аu, кажется. Ну и какие проблемы, милая сестра?
Кислота H2SO4. Да вот никак не могу с ними договориться. Хоть плачь!
Кислота HCl. Что ты, дорогая. Плакать нам никак нельзя, а то слабыми станем. Хотя ко мне это не относится. Я сильна, я прекрасна, я просто обворожительна! Я этих молодцев быстро в оборот возьму. Недаром я зовусь Соляной.
Недаром я зовусь Соляной.
Кислота H2SO4. Уж больно ты высокого мнения о себе. Я не хуже тебя, все металлы от меня без ума. Вот только эти двое никак не поддаются. Ну да ладно, найду я на них управу!
Ах вот что у них случилось! Ребята, кто может пояснить, в чем дело? Почему у серной кислоты такие проблемы с Аg и Аu?
6.Химические свойства:
Отдохнули, можно и поработать! Рассмотрим теперь химические свойства серной кислоты.
Концентрированная серная кислота является сильным окислителем, но в качестве окислителя выступают не ионы водорода, а сера, входящая в состав кислоты. Поэтому водород никогда не выделяется при взаимодействии металлов с концентрированной серной кислотой. Продукты восстановления зависят как от активности металла, так и от условий протекания реакции (концентрации кислоты, температуры и т.д.) Общая закономерность такова: чем выше активность металла, тем полнее идет восстановление кислоты (т. е. тем больше электронов принимает сера).
е. тем больше электронов принимает сера).
-активными
-средней химической активности
-при t с мало активными
2. Fe и Al пассивируются концентрированной серной кислотой, т.е. покрываются защитной пленкой, поэтому эту кислоту можно перевозить в стальных и алюминиевых цистернах.
3.Будучи нелетучей сильной кислотой она способна вытеснять другие кислоты из их солей.
4.Способна отнимать воду из молекул органических веществ.
(видео демонстрация опытов: обугливание бумаги и сахара)
5.Хорошо растворяет оксид серы(VI), раствор SO3 в H2SO4 называют олеумом.
1.Сильный электролит (распадается на ионы)
2. Реагирует с металлами, стоящими в ряду активности левее водорода
3. С основными оксидами
4. С гидроксидами (реакция нейтрализации)
5. Разбавленная серная кислота реагирует с солями (если среди продуктов одно вещество будет не электролитом)
Мы разобрали свойства концентрированной серной кислоты, но чаще пользуются разбавленной кислотой. Получают ее разбавлением. Правило разбавления вы знаете, повторим его еще раз. (ответы учеников).
Получают ее разбавлением. Правило разбавления вы знаете, повторим его еще раз. (ответы учеников).
Что произойдет, если кислота попадет на кожу рук или лица? (ответы)
Какую медицинскую помощь необходимо оказать? (ответы)
Так как серная кислота двухосновна, то она образует 2 ряда солей: какие? (ответы).
кислые (гидросульфаты) и средние (сульфаты). Все ли соли серной кислоты растворимы? (ответы). Сульфаты большинства металлов хорошо растворимы в воде. Нерастворимыми являются соли ЩЗМ, Ag и Pb. Для определения серной кислоты и ее солей существует качественная реакция. Какое вещество будет являться реактивом на сульфат-ион? Почему? (ответы учеников)
Д.И. Менделеев говорил: «Опыт — это единственный верный путь спрашивать природу и слышать ответ в ее лаборатории». Поэтому и мы с вами сегодня проведем эксперимент.
III. Химический эксперимент
Перед вами в 3-х пробирках находятся растворы солей натрия – сульфата, карбоната и хлорида. Ваша задача определить каждое вещество и результаты записать себе в тетрадь в молекулярном и ионном виде.
Ваша задача определить каждое вещество и результаты записать себе в тетрадь в молекулярном и ионном виде.
Но сначала давайте вспомним, какие правила необходимо соблюдать при работе с химическими веществами? (ответы учащихся)
6. Применение.
Очень долго серная кислота не находила применения. Но как только началось ее использование, кислоту возвеличили. Ее стали называть хлебом химической промышленности.
Широкое применение имеют и соли серной кислоты. Наибольшее значение имеют уже известные нам сульфат натрия или глауберова соль, гипс, сульфат бария и медный купорос. (Сообщение ученика о применении кислоты.)
7. Экологическая безопасность
В начале урока у нас прозвучал позвучала проблема экологического характера. Давайте послушаем о мерах защиты окружающей среды.
Мероприятия, обеспечивающие эффективность природоохранительных мер.
Для вредных веществ в атмосфере законодательно установлены предельно допустимые концентрации, не вызывающие ощутимых последствий. ПДК (SO2) – 0,05 мг/м3. С целью предотвращения загрязнения атмосферы разработаны мероприятия, обеспечивающие правильное сжигание топлива, переход на газифицированное центральное отопление, установку очистных сооружений, которые позволяют экономить сырье, предотвращают загрязнение воздуха. Например, улавливание серы из выделяющихся газов дает возможность увеличить выпуск серной кислоты.
ПДК (SO2) – 0,05 мг/м3. С целью предотвращения загрязнения атмосферы разработаны мероприятия, обеспечивающие правильное сжигание топлива, переход на газифицированное центральное отопление, установку очистных сооружений, которые позволяют экономить сырье, предотвращают загрязнение воздуха. Например, улавливание серы из выделяющихся газов дает возможность увеличить выпуск серной кислоты.
Вводятся технологии, при которых образование отходов сводится к минимуму. Этой же цели служит переход на другие виды топлива для автомобилей (сжиженный газ, этиловый спирт, при сжигании которого образуется меньше вредных веществ). Большое значение имеет правильная планировка городов, зеленые насаждения. Деревья поглощают вредные газы. Например, сернистый газ хорошо поглощается тополем, липой, кленом, конским каштаном.
Вопрос: Какой можно сделать вывод о вредном воздействии на природу?
Применение серной кислоты определяется ее свойствами – это вещество используют как кислоту, окислитель и обезвоживающее средство. В условиях антропогенного загрязнения, когда серная кислота входит в состав кислотных дождей, возможны повреждения и гибель клеток растений, обезвоживание растительных тканей.
В условиях антропогенного загрязнения, когда серная кислота входит в состав кислотных дождей, возможны повреждения и гибель клеток растений, обезвоживание растительных тканей.
IV. Закрепление.
Сегодня мы с вами узнали очень много еще об одном соединении серы – серной кислоте. А теперь ответьте на несколько вопросов.
1.Царица Сера разрешила двум принцам поздороваться с принцессой Серной кислотой, поцеловав ей ручку. Первым к ней подошел Алюминий, но его поцелуй ничем не тронул сердце принцессы. Вторым был принц Лакмус. Поцеловав р учку, он покраснел от смущения. Почему так произошло?
2.Серная кислота – загадочная незнакомка. Кто-нибудь знает ее родителей? Союз газа и воды привел к появлению необыкновенной особы. Ее назвали Серной кислотой. Напишите уравнения реакции получения серной кислоты в промышленности.
3.Почему концентрированную серную кислоту хранят в стальных резервуарах, для хранения меньше 75% — резервуары покрываются кислотоупорными материалами?
4. Можно ли с помощью кусочка мела определить, в какой склянке разбавленная соляная, а в какой – разбавленная серная кислота? Почему?
Можно ли с помощью кусочка мела определить, в какой склянке разбавленная соляная, а в какой – разбавленная серная кислота? Почему?
5.Это серное соединение,
Для него найдется применение:
Его больные выпивают,
И их рентгеном облучают.
На мониторе язва выявляется.
Как соединенье называется? (бария)
Применение нашел в скульптуре,
А также и в архитектуре.
Кто-то руку поломает,
Он при травме помогает,
И для дома плиты льют.
Ну так, как его зовут? (гипс)
V. Рефлексия « Плюс-минус-интересно»
VI. Домашнее задание.
§ 21, выучить химические свойства серной кислоты
Выполнить задание 2 на стр. 78
Решить кроссворд «Свойства серной кислоты»
VII. Итоги урока.
Подведение итогов урока. Оценивание учеников за работу на уроке.
кислородная кислота | химическое соединение | Британика
Азотная кислота, HNO 3 , была известна алхимикам 8-го века как «aqua fortis» (сильная вода). Он образуется в результате реакции пятиокиси азота (N 2 O 5 ) и двуокиси азота (NO 2 ) с водой. Небольшие количества азотной кислоты обнаруживаются в атмосфере после гроз, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу.Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов). Нитрат калия, KNO 3 , иногда называемый бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; Например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), а NaNO 3 и NaHSO 4 являются нелетучими солями, азотная кислота легко удаляется перегонкой.
Он образуется в результате реакции пятиокиси азота (N 2 O 5 ) и двуокиси азота (NO 2 ) с водой. Небольшие количества азотной кислоты обнаруживаются в атмосфере после гроз, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу.Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов). Нитрат калия, KNO 3 , иногда называемый бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; Например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), а NaNO 3 и NaHSO 4 являются нелетучими солями, азотная кислота легко удаляется перегонкой.
В промышленных масштабах азотная кислота производится по процессу Оствальда. Этот процесс включает окисление аммиака NH 3 до оксида азота NO, дальнейшее окисление NO до диоксида азота NO 2 и последующее превращение NO 2 в азотную кислоту (HNO 3 ). . Это поточный процесс, при котором смесь аммиака и избыточного воздуха нагревается до 600–700 °C (от 1100 до 1300 °F) и проходит через платино-родиевый катализатор. (Катализатор увеличивает скорость реакции, не расходуясь при этом сам.) Поскольку происходит окисление до NO, эта газообразная смесь буквально сгорает пламенем. Добавляется дополнительный воздух для окисления NO до NO 2 . NO 2 , избыток кислорода и нереакционноспособный азот из воздуха пропускают через распыляемую воду, где образуются HNO 3 и NO по мере диспропорционирования NO 2 . Газообразный NO рециркулирует в процессе с большим количеством воздуха, а жидкая HNO 3 отбирается и концентрируется. Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
В чистом виде азотная кислота представляет собой бесцветную жидкость, которая кипит при 86 ° C (187 ° F) и замерзает при -42 ° C (-44 ° F). Под воздействием света или тепла он разлагается с образованием кислорода, воды и смеси оксидов азота (в основном NO 2 ).
4HNO 3 + свет (или тепло) → 4ΝΟ 2 + 2H 2 O + O 2 Следовательно, азотная кислота часто имеет желтый или коричневый цвет из-за NO 2 , который образуется при ее разложении. Азотная кислота стабильна в водном растворе, а 68-процентные растворы кислоты (т.е., 68 граммов HNO 3 на 100 граммов раствора) продается как концентрированная HNO 3 . Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; Например,
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.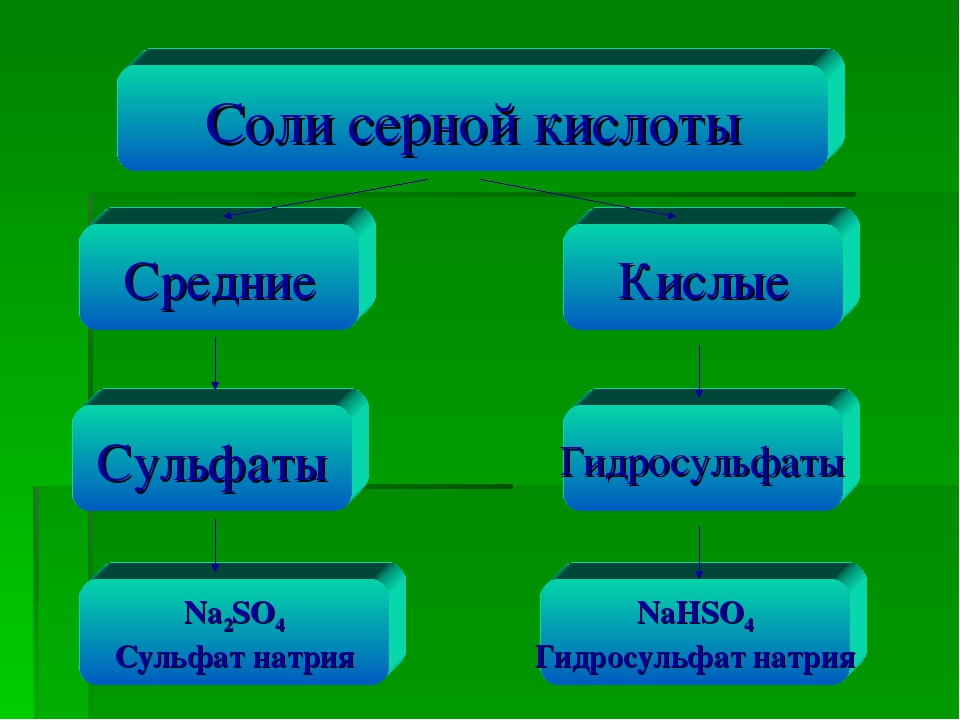 Кроме того, многие соединения окисляются HNO 3 .Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 . Царская водка («царская вода»), смесь одной части концентрированной HNO 3 и трех частей концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Кроме того, многие соединения окисляются HNO 3 .Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 . Царская водка («царская вода»), смесь одной части концентрированной HNO 3 и трех частей концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Действие азотной кислоты на металл обычно приводит к восстановлению кислоты (т.д., уменьшение степени окисления азота). Продукты реакции определяются концентрацией HNO 3 , вовлеченным металлом (т. е. его реакционной способностью) и температурой. В большинстве случаев образуется смесь оксидов азота, нитратов и других продуктов восстановления. Относительно нереакционноспособные металлы, такие как медь (Cu), серебро (Ag) и свинец (Pb), восстанавливают концентрированную HNO 3 прежде всего до NO 2 . Реакция разбавленной HNO 3 с медью дает NO, тогда как более активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O.При использовании чрезвычайно разбавленной HNO 3 может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
Реакция разбавленной HNO 3 с медью дает NO, тогда как более активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O.При использовании чрезвычайно разбавленной HNO 3 может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
Нитраты, представляющие собой соли азотной кислоты, образуются при взаимодействии металлов или их оксидов, гидроксидов или карбонатов с азотной кислотой. Большинство нитратов растворимы в воде, и азотная кислота в основном используется для получения растворимых нитратов металлов.Все нитраты разлагаются при нагревании и могут происходить со взрывом. Например, при нагревании нитрата калия (KNO 3 ) образуется нитрит (соединение, содержащее NO 2 — ) и выделяется газообразный кислород. 2КНО 3 + нагрев → 2КНО 2 + О 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в
2Cu(NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 .
Нитрат аммония, (NH 4 ) 2 NO 3 , производит закись азота, N 2 O, и особенно опасен при нагревании или детонации.
2КНО 3 + нагрев → 2КНО 2 + О 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в
2Cu(NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 .
Нитрат аммония, (NH 4 ) 2 NO 3 , производит закись азота, N 2 O, и особенно опасен при нагревании или детонации.
Азотная кислота широко используется в лаборатории и в химической промышленности как сильная кислота и как окислитель. Кислота широко используется в производстве взрывчатых веществ, красителей, пластмасс и лекарств. Нитраты ценны как удобрения. Порох представляет собой смесь нитрата калия, серы и древесного угля. Аммонал, взрывчатое вещество, представляет собой смесь аммиачной селитры и алюминиевой пудры.
Серная кислота — MOTM май 2008 г.
Серная кислота — MOTM май 2008 г. — версия JmolПравописание
Если вы хотите, чтобы эта молекула месяца была на мочевой кислоте sul ph , а не на мочевой кислоте sul f , нажмите на знак опасности (справа). Раньше его называли «купоросным маслом». На самом деле было бы даже лучше назвать его серной (VI) кислотой.
Раньше его называли «купоросным маслом». На самом деле было бы даже лучше назвать его серной (VI) кислотой.
Контактный процесс
Серная кислота производится в больших количествах, чем любая другая кислота. Почти каждое промышленное изделие в современном мире на каком-то этапе своей истории контактирует с H 2 SO 4 . Это настолько важно, что когда-то годовое производство серной кислоты считалось мерой степени индустриализации страны и заслужило прозвище «король химикатов».
Серная кислота (H 2 SO 4 ) по-прежнему является чрезвычайно важным химическим веществом, используемым в производстве удобрений и взрывчатых веществ. В настоящее время он производится из диоксида серы по контактному процессу. В этом процессе кислород, O 2 , и диоксид серы, SO 2 , реагируют вместе при 450°C и давлении 2 атмосферы с помощью оксида ванадия(V) с образованием триоксида серы, SO 3 , газа в 98 % урожай. Затем его растворяют в воде, получая H 2 SO 4 .[Обратите внимание, что прямое растворение SO 3 в воде нецелесообразно из-за сильно экзотермической природы реакции, при которой вместо жидкости образуется коррозионный туман. Вместо этого SO 3 может быть поглощен существующим H 2 SO 4 с получением олеума (H 2 S 2 O 7 ), который затем может быть смешан с водой с образованием серной кислоты. ]. Исходная реакция образования SO 3 имеет высокую энергию активации и поэтому без катализатора протекает очень медленно.Это стало экономически жизнеспособным только тогда, когда в 1746 году Джон Робак разработал процесс со свинцовой камерой, который катализировал реакцию с использованием оксидов азота через промежуточное образование HOSO 2 ONO. Можно утверждать, что открытие этого процесса послужило катализатором промышленной революции (а также реакции!) в Великобритании и в результате даже помогло создать Британскую империю!
Затем его растворяют в воде, получая H 2 SO 4 .[Обратите внимание, что прямое растворение SO 3 в воде нецелесообразно из-за сильно экзотермической природы реакции, при которой вместо жидкости образуется коррозионный туман. Вместо этого SO 3 может быть поглощен существующим H 2 SO 4 с получением олеума (H 2 S 2 O 7 ), который затем может быть смешан с водой с образованием серной кислоты. ]. Исходная реакция образования SO 3 имеет высокую энергию активации и поэтому без катализатора протекает очень медленно.Это стало экономически жизнеспособным только тогда, когда в 1746 году Джон Робак разработал процесс со свинцовой камерой, который катализировал реакцию с использованием оксидов азота через промежуточное образование HOSO 2 ONO. Можно утверждать, что открытие этого процесса послужило катализатором промышленной революции (а также реакции!) в Великобритании и в результате даже помогло создать Британскую империю!
Свойства серной кислоты
При комнатной температуре чистая серная кислота (100 %) представляет собой ковалентную жидкость. Концентрированная серная кислота 98% (18,7 М) представляет собой маслянистую жидкость плотностью 1,83 г/см 3 . Он разлагается при его к.п. (330C) и образует белые пары.
Концентрированная серная кислота 98% (18,7 М) представляет собой маслянистую жидкость плотностью 1,83 г/см 3 . Он разлагается при его к.п. (330C) и образует белые пары.
H 2 SO 4 (л) H 2 O (г) + SO 3 (г).
Обратная реакция — как получить серную кислоту.
Для получения информации о безопасности щелкните здесь.
В концентрированном виде обладает несколькими важными свойствами; кислота, окислитель и осушитель, что делает его очень универсальным реагентом.На вкус кислый, а не в лаборатории! Он превращает синий лакмус в красный, за исключением случаев, когда это ковалентная молекула , т.е. . 100% H 2 SO 4 .
Концентрированная серная кислота очень гигроскопична. Его сродство к воде настолько велико, что если оставить стакан наполовину наполненным конц. H 2 SO 4 в течение трех недель его объем значительно увеличился бы, и он стал бы более разбавленным, потому что поглотил бы так много водяного пара из воздуха.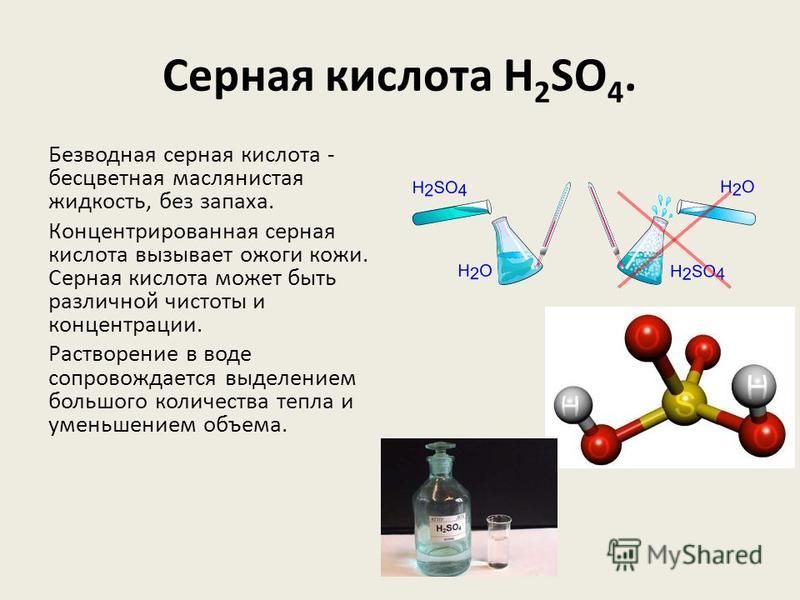
Тест на серную кислоту (и растворимые сульфаты)
Сначала добавьте разбавленную HNO 3 . Это необходимо для предотвращения осаждения других нерастворимых соединений бария, таких как BaCO 3 или BaSO 3 . Во-вторых, добавьте Ba(NO 3 ) 2 (водн.). Если присутствует серная кислота или сульфат, немедленно будет наблюдаться белый осадок.
Ba 2+ (водн.) + SO 4 2- (водн.) BaSO 4 (тв.) [белый]
В качестве окислителя
Горячая концентрированная серная кислота является окислителем, когда она принимает электроны.Электроны поставляются восстановителем в реакции:
2 H 2 SO 4 (водн.) + 2e — SO 4 2- (водн.) + 2 H 2 O (л) + SO 2 0 Zn (т) + 2 H 2 SO 4 (конц. Fe (т) + 2 H 2 SO 4 (конц.) FeSO 4 (водн.) + 2H 2 O (л) + SO 2 (г) Mg (т) + 2 H 2 SO 4 (конц.) MgSO 4 (водн.) + 2H 2 O (л) + SO 2 (г) Cu (т) + 2 H 2 SO 4 (конц.) CuSO 4 (водн.) + 2H 2 O (л) + SO 2 (г) S (т) + 2 H 2 SO 4 (конц.) 2 H 2 O (л) + 3 SO 2 (г) C (тв) + 2 H 2 SO 4 (конц) 2 H 2 O (л) + 2 SO 2 (г) + CO 2 (г) Двуокись серы можно определить с помощью полоски фильтровальной бумаги, смоченной дихроматом калия, цвет которой меняется с оранжевого на зеленый. Хлориды реагируют только одним образом, независимо от температуры. NaCl (т) + H 2 SO 4 (л) HCl (г) + NaHSO 4 (т) Видны туманные пары газообразного хлороводорода. Причина, по которой газообразный хлор не образуется, заключается в том, что серная кислота недостаточно мощна для окисления ионов хлора. Ионы брома являются более сильным восстановителем, чем ионы хлорида. Поскольку ионы брома больше ионов хлорида, их электроны легче удалить. Ионы брома восстанавливают серную кислоту до диоксида серы в два этапа. NaBr (т) + H 2 SO 4 (л) HBr (г) + NaHSO 4 (т) 2 HBr (г) + H 2 SO 4 (л) Br 2 (л) + 2 H 2 O (л) + SO 2 (г) Иодид-ионы даже больше, чем бромид-ионы, а йодид-электроны еще легче удалить. Уравнение 1: 8 HI (г) + H 2 SO 4 (л) 4 I 2 (т) + H 2 S (г) + 4 H 2 9000 Уравнение 2: 6 HI (г) + H 2 SO 4 (л) 3 I 2 (т) + S (т) + 3 H 2 O (л) Уравнение 3: 2 HI (г) + H 2 SO 4 (л) I 2 (т) + SO 2 (г) + H 2 0 Что можно ожидать, если конц.серной кислоты добавляли к твердому йодиду натрия? Концентрированная серная кислота очень хорошо удаляет воду из сахаров. C 12 H 22 O 11 (S) + N H 2 SO 4 (L) 12 C (S) + 11 H 2 O (L) + N H 2 SO 4 (л) Серная кислота также может быть использована для дегидратации натриевых солей некоторых карбоновых кислот. Это использование серной кислоты уже упоминалось на странице «Молекула месяца», посвященной угарному газу.Реакции включают протонирование кислотой с последующей дегидратацией. Разбавленная серная кислота нейтрализует основные оксиды или гидроксиды с образованием сульфатных солей и воды. Не забывайте, что серная кислота — сильная кислота (полностью ионизируется в воде). CuO (т) + H 2 SO 4 (водн. ZnO (т) + H 2 SO 4 (водн.) ZnSO 4 (водн.) + H 2 O (л) Cu(OH) 2 (т) + H 2 SO 4 (водн.) CuSO4 (водн.) + 2 H 2 O (л) Zn(OH) 2 (т) + H 2 SO 4 (водн.) ZnSO4 (водн.) + 2 H 2 O (л) Поскольку серная кислота является двухосновной (ионизируется в две стадии), при взаимодействии с гидроксидом натрия она может образовывать две возможные соли натрия.Чтобы увидеть, какая из них предпочтительнее, вам нужно рассмотреть стехиометрию (количество молей в сбалансированном уравнении) для следующих двух реакций. 2 NaOH (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + 2 H 2 O (л) NaOH (водн.) + H 2 SO 4 (водн.) NaHSO 4 (водн. Разбавленная серная кислота нейтрализует основные карбонаты с образованием сульфатных солей, воды и углекислого газа, что приводит к вскипанию (как показано на фото справа). Na 2 CO 3 (AQ) + H 2 SO 4 (AQ) Na 2 SO 4 (AQ) + H 2 O (L) + CO 2 ( г) MgCO 3 (водн.) + H 2 SO 4 (водн.) MgSO 4 (водн.) + H 2 O (л) + CO 2 (г) Скорость реакции зависит не только от площади поверхности карбоната, концентрации и температуры кислоты, но и от растворимости сульфата.Когда мрамор (CaCO 3 ) реагирует с разбавленным H 2 SO 4 , он сначала вскипает, но поскольку сульфат кальция лишь умеренно растворим в воде, как только он образуется в виде отложений на поверхности мрамора, реакция вскоре замедляется. Разбавленная серная кислота реагирует с металлами выше водорода в ряду реакционной способности с образованием сульфатных солей и газообразного водорода. Обратите внимание, что реакции металлов с концентрированной серной кислотой различны. Mg (т) + H 2 SO 4 (водн.) MgSO 4 (водн.) + H 2 (г) Zn (т) + H 2 SO 4 (водн.) ZnSO 4 (водн.) + H 2 (г) Fe (т) + H 2 SO 4 (водн.) FeSO 4 (водн.) + H 2 (г) Железо очищают от ржавчины перед покрытием оловом для получения белой жести и цинком для получения оцинкованного железа. Самое большое (80%) использование серной кислоты в производстве сульфатов. Гипс представляет собой CaSO 4 .2H 2 O и используется для изготовления гипсовых плит, а также гипсовых слепков (см. 2 NaOH (водн.) + H 2 SO 4 (водн.) Na 2 SO 4 (водн.) + H 2 O (л) NaOH (водн.) + H 2 SO 4 (водн.) NaHSO 4 (водн.) + H 2 O (л) В 1999 году на спутнике Юпитера Европе была обнаружена твердая (замороженная) серная кислота.Ученые даже идентифицировали твердые гидраты серной кислоты, такие как гемитрискадекагидрат (H 2 SO 4 . Ароматическое сульфирование происходит при замене H на SO 3 H (группа сульфоновой кислоты).
В случае бензола его необходимо нагревать с конц. H 2 SO 4 в течение 8 ч для получения бензолсульфокислоты.
Эта реакция слишком медленная, и ее нельзя пытаться использовать, поскольку бензол вызывает лейкемию у детей. Вместо этого лучше (быстрее и безопаснее) использовать толуол (метилбензол), так как метильная группа (CH 3 ) высвобождает электроны и ускоряет реакцию. Процедура такова: Добавьте 30 капель конц. H 2 SO 4 по 12 капель (толуола) в пробирке. Нагревайте до тех пор, пока метилбензол не растворится в кислотном слое. Вылейте смесь в 30 см 3 холодного насыщенного раствора хлорида натрия. Образуются белые кристаллы метилбензолсульфонатов натрия.Метильная группа орто-пара направляющая. Вернуться на страницу «Молекула месяца». При вдыхании: Примите меры предосторожности для обеспечения собственной безопасности перед попыткой спасения (например, наденьте соответствующее защитное снаряжение). Вынести пострадавшего на свежий воздух.Сохраняйте состояние покоя в удобном для дыхания положении. Если дыхание затруднено, обученный персонал должен дать экстренную подачу кислорода. НЕ позволяйте пострадавшему двигаться без необходимости. Симптомы отека легких могут проявляться с задержкой. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу. Контакт с кожей: Избегать прямого контакта. При необходимости наденьте одежду химической защиты. Быстро снять загрязненную одежду, обувь и кожаные изделия (напр. Попадание в глаза: Избегать прямого контакта.При необходимости наденьте химические защитные перчатки. Быстро и аккуратно промокните или смахните химическое вещество с лица. Немедленно промойте загрязненный глаз (глаза) чуть теплой водой со слабой струей в течение не менее 30 минут, удерживая веко (веки) открытыми. Если контактная линза присутствует, НЕ откладывайте промывание и не пытайтесь снять линзу. Нейтральный солевой раствор можно использовать, как только он будет доступен. Проглатывание: Попросить пострадавшего прополоскать рот водой. Если рвота возникает естественным образом, наклоните пострадавшего вперед, чтобы уменьшить риск аспирации. Попросите пострадавшего снова прополоскать рот водой. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу. Первая помощь Комментарии: Некоторые из рекомендуемых здесь процедур первой помощи требуют продвинутого обучения оказанию первой помощи.Все процедуры оказания первой помощи должны периодически проверяться врачом, знакомым с химическим веществом и условиями его использования на рабочем месте. Весь контент
Картинки 0 3 2 Серная кислота (или серная кислота в британском английском) — сильная минеральная кислота с химической формулой H 2 SO 4 .Он растворим в воде при любых концентрациях. Серная кислота имеет множество применений и производится в больших количествах, чем любое другое химическое вещество, кроме воды. Мировое производство в 2001 году составило 165 миллионов тонн при приблизительной стоимости 8 миллиардов долларов. Основные области применения включают переработку руды, производство удобрений, переработку нефти, переработку сточных вод и химический синтез.Многие белки состоят из серосодержащих аминокислот (таких как цистеин и метионин), которые производят серную кислоту при метаболизме в организме. Открытие серной кислоты приписывается алхимику восьмого века Джабиру ибн Хайяну (Геберу). Позже его исследовал врач и алхимик IX века Ибн Закария ар-Рази (Расес), который получил вещество путем сухой перегонки минералов, в том числе гептагидрата сульфата железа(II) (FeSO 4 • 7H 2 O ) и пентагидрат сульфата меди(II) (CuSO 4 • 5H 2 O). Серная кислота была известна средневековым европейским алхимикам как масло купороса , спирт купороса или просто купорос , среди других названий.Слово купорос происходит от латинского vitreus (что означает «стекло») для стекловидного вида сульфатных солей, которые также носили название купорос. Соли, получившие это название, включали сульфат меди (II) (синий купорос или иногда римский купорос), сульфат цинка (белый купорос), сульфат железа (II) (зеленый купорос), сульфат железа (III) (марсианский купорос), и сульфат кобальта (II) (красный купорос). Знаете ли вы? Купорос считался наиболее важным алхимическим веществом, предназначенным для использования в качестве философского камня. В качестве среды для взаимодействия веществ использовался высокоочищенный купорос. Во многом это было связано с тем, что кислота не вступает в реакцию с золотом, что часто является конечной целью алхимических процессов. Важность купороса для алхимии подчеркивается в алхимическом девизе, бэкрониме, [2] Visita Interiora Terrae Rectificando Invenies Occultum Lapidem («Посетите недра земли и исправление (т.е. очищение) вы найдете спрятанный/секретный камень’). [3] В семнадцатом веке немецко-голландский химик Иоганн Глаубер получил серную кислоту путем сжигания серы вместе с селитрой (нитрат калия, KNO 3 ) в присутствии пара. По мере разложения селитры она окисляет серу до SO 3 , которая соединяется с водой с образованием серной кислоты. В 1746 году в Бирмингеме Джон Робак начал производить серную кислоту таким образом в камерах, облицованных свинцом, которые были прочнее, дешевле и могли быть больше, чем стеклянные контейнеры, использовавшиеся ранее. Этот процесс со свинцовой камерой позволил эффективно индустриализировать производство серной кислоты и с некоторыми усовершенствованиями оставался стандартным методом производства в течение почти двух столетий. Серная кислота Робака содержала всего около 35–40 процентов серной кислоты.Более поздние усовершенствования процесса со свинцовой камерой французским химиком Жозефом-Луи Гей-Люссаком и британским химиком Джоном Гловером улучшили этот показатель до 78 процентов. Однако производство некоторых красителей и другие химические процессы требуют более концентрированного продукта, и на протяжении восемнадцатого века его можно было получить только путем сухой перегонки минералов с помощью техники, аналогичной первоначальным алхимическим процессам. В 1831 году британский торговец уксусом Перегрин Филипс запатентовал гораздо более экономичный процесс производства триоксида серы и концентрированной серной кислоты, теперь известный как контактный процесс. Практически все мировые запасы серной кислоты в настоящее время производятся этим методом. Хотя можно получить почти 100-процентную серную кислоту, она теряет газ триоксид серы (SO 3 ) при температуре кипения с образованием 98,3-процентной кислоты. Учитывая, что серная кислота является сильной кислотой, 0,50-молярный (М) раствор этой кислоты имеет рН, близкий к нулю. Также доступны различные степени чистоты. Техническая марка H 2 SO 4 нечиста и часто окрашена, но пригодна для изготовления удобрений.Чистые сорта, такие как класс Фармакопеи США (USP), используются для изготовления фармацевтических препаратов и красителей. При добавлении высоких концентраций SO 3 (g) к серной кислоте образуется H 2 S 2 O 7 . Его называют пиросерной кислотой, дымящей серной кислотой или олеумом. Менее распространенное название – кислота Нордгаузена. Концентрация олеума выражается либо в процентах SO 3 (называемых процентами олеума), либо в процентах H 2 SO 4 (количество, полученное при добавлении H 2 O).Обычные концентрации составляют 40% олеума (109% H 2 SO 4 ) и 65% олеума (114,6% H 2 SO 4 ). Чистый H 2 S 2 O 7 представляет собой твердое вещество с температурой плавления 36 °C. Безводный H 2 SO 4 — очень полярная жидкость с диэлектрической проницаемостью около 100. Это свойство возникает из-за того, что она может диссоциировать путем протонирования себя, процесс, известный как аутопротолиз . Реакции с металлами
 ) ZnSO 4 (водн.) + 2H 2 O (л) + SO 2 (г)
) ZnSO 4 (водн.) + 2H 2 O (л) + SO 2 (г) Реакции с неметаллами
Галогенные соли с конц.
 серная кислота
серная кислота Хлориды
Бромиды
Йодиды
 Ионы йодида восстанавливают концентрированную серную кислоту до газообразного йодистого водорода, который дополнительно восстанавливает серную кислоту тремя способами при комнатной температуре.
Ионы йодида восстанавливают концентрированную серную кислоту до газообразного йодистого водорода, который дополнительно восстанавливает серную кислоту тремя способами при комнатной температуре. Применение серной кислоты
 Когда элементы воды удаляются из сахарозы, это приводит к черной массе углерода (см. фото слева и страницу «Молекула месяца» о глюкозе).
Когда элементы воды удаляются из сахарозы, это приводит к черной массе углерода (см. фото слева и страницу «Молекула месяца» о глюкозе). Реакции серной кислоты
С основаниями
 ) CuSO 4 (водн.) + H 2 O (л)
) CuSO 4 (водн.) + H 2 O (л) ) + H 2 O (л)
) + H 2 O (л) С карбонатами

С металлами
Сульфаты
 фото справа). Слабительное « английская соль » представляет собой MgSO 4 .7H 2 O, а зеленый купорос представляет собой FeSO 4 .7H 2 O. .Сульфат калия необычен тем, что кристаллизуется без кристаллизационной воды и имеет формулу K 2 SO 4 . Поскольку серная кислота является двухосновной (двухосновной), она способна образовывать две соли в зависимости от количества щелочи, присутствующей в реакционной смеси;
фото справа). Слабительное « английская соль » представляет собой MgSO 4 .7H 2 O, а зеленый купорос представляет собой FeSO 4 .7H 2 O. .Сульфат калия необычен тем, что кристаллизуется без кристаллизационной воды и имеет формулу K 2 SO 4 . Поскольку серная кислота является двухосновной (двухосновной), она способна образовывать две соли в зависимости от количества щелочи, присутствующей в реакционной смеси; Серная кислота в космосе
 6H 2 O).
6H 2 O). Сульфирование
и наконец.
 ..
.. Даже Барт Симпсон может произнести серную кислоту
Серная кислота : Ответы OSH
 г. ремешки, ремни). Быстро и аккуратно промокните или смахните излишки химикатов. Немедленно промойте слегка теплой, слабо проточной водой в течение не менее 30 минут. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. Если это можно сделать безопасно, продолжайте промывать во время транспортировки в больницу. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу. Упакуйте в двойной пакет, запечатайте, наклейте этикетку и оставьте загрязненную одежду, обувь и изделия из кожи на месте происшествия для безопасной утилизации.
г. ремешки, ремни). Быстро и аккуратно промокните или смахните излишки химикатов. Немедленно промойте слегка теплой, слабо проточной водой в течение не менее 30 минут. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. Если это можно сделать безопасно, продолжайте промывать во время транспортировки в больницу. Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу. Упакуйте в двойной пакет, запечатайте, наклейте этикетку и оставьте загрязненную одежду, обувь и изделия из кожи на месте происшествия для безопасной утилизации. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. При необходимости продолжайте промывание во время транспортировки в больницу. Следите за тем, чтобы загрязненная вода не попала в незатронутый глаз или на лицо.Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу.
НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. При необходимости продолжайте промывание во время транспортировки в больницу. Следите за тем, чтобы загрязненная вода не попала в незатронутый глаз или на лицо.Немедленно позвоните в токсикологический центр или к врачу. Лечение требуется срочно. Транспортировка в больницу. О действии кислот на соли, обычно называемые гипероксимуриатами, и на образующиеся из них газы по JSTOR
Перейти к основному содержанию Есть доступ к библиотеке? Войдите через свою библиотеку
О
Служба поддержки
Журналы и книги
Журналы и книги Серная кислота — Энциклопедия Нового Света
Серная кислота Общие Систематическое название серная кислота Другие названия масло купоросное Молекулярная формула H 2 SO 4 (водный) Молярная масса 98.  08 г моль −1
08 г моль −1 Внешний вид прозрачная, бесцветная,
жидкость без запаха CAS-номер [7664-93-9] Недвижимость Плотность и фаза 1,84 г · см −3 , жидкость Растворимость в воде полностью смешиваемый
(экзотермический) Температура плавления 10 °С (283 К) Точка кипения 338 °С (611 К) ПК и −3 (оспаривается, см. обсуждение)
1.99 Вязкость 26,7 сП при 20°C Опасности Паспорт безопасности Внешний паспорт безопасности Классификация ЕС Коррозионный ( C ) NFPA 704 Ш R-фразы Р35 S-фразы С1/2, С26, С30, С45 Температура вспышки негорючий Номер РТЭКС ВС5600000 Страница дополнительных данных Структура и свойства n , ε r и т. 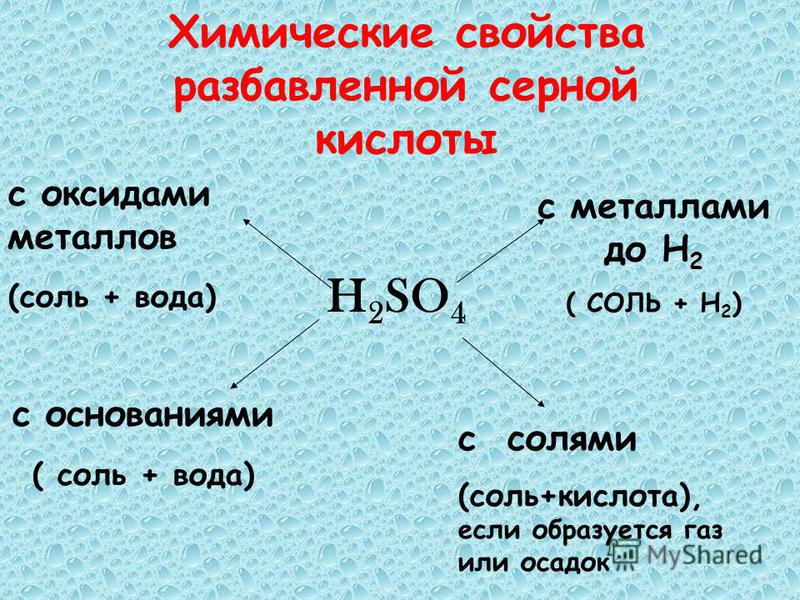 д.
д. Термодинамические данные Фазовое поведение
Твердое, жидкое, газообразное Спектральные данные УФ, ИК, ЯМР, МС Родственные соединения Родственные сильные кислоты Селеновая кислота
Соляная кислота
Азотная кислота Родственные соединения Сероводород
Сернистая кислота
Пероксимоносерная кислота
Триоксид серы
Олеум Если не указано иное, данные приведены для материалов
в их стандартном состоянии (при 25 °C, 100 кПа)
Отказ от ответственности и ссылки на Infobox  Когда-то он был известен как масло купороса , термин, введенный алхимиком восьмого века Джабиром ибн Хайяном (Гебером), вероятным первооткрывателем этого химического вещества. [1]
Когда-то он был известен как масло купороса , термин, введенный алхимиком восьмого века Джабиром ибн Хайяном (Гебером), вероятным первооткрывателем этого химического вещества. [1] История серной кислоты
 При нагревании эти соединения разлагаются на оксид железа (II) и оксид меди (II) соответственно с выделением воды и триоксида серы. Сочетание воды с триоксидом серы дало разбавленный раствор серной кислоты. Этот метод был популяризирован в Европе благодаря переводам арабских и персидских трактатов и книг европейских алхимиков, в том числе немца XIII века Альберта Великого.
При нагревании эти соединения разлагаются на оксид железа (II) и оксид меди (II) соответственно с выделением воды и триоксида серы. Сочетание воды с триоксидом серы дало разбавленный раствор серной кислоты. Этот метод был популяризирован в Европе благодаря переводам арабских и персидских трактатов и книг европейских алхимиков, в том числе немца XIII века Альберта Великого. На диаграмме молекулы серной кислоты Джона Дальтона 1808 года показан центральный атом серы, связанный с тремя атомами кислорода.
На диаграмме молекулы серной кислоты Джона Дальтона 1808 года показан центральный атом серы, связанный с тремя атомами кислорода. В 1736 году Джошуа Уорд, лондонский фармацевт, использовал этот метод, чтобы начать первое крупномасштабное производство серной кислоты.
В 1736 году Джошуа Уорд, лондонский фармацевт, использовал этот метод, чтобы начать первое крупномасштабное производство серной кислоты. Пирит (дисульфид железа, FeS 2 ) нагревали на воздухе с получением сульфата железа (II) (FeSO 4 ), который окисляли при дальнейшем нагревании на воздухе с образованием сульфата железа (III) (Fe 2 (SO 4 ) 3 ).Когда сульфат железа (III) нагревали до 480 ° C, он разлагался на оксид железа (III) и триоксид серы, которые можно было пропускать через воду с образованием серной кислоты любой концентрации. Стоимость этого процесса предотвратила широкомасштабное использование концентрированной серной кислоты.
Пирит (дисульфид железа, FeS 2 ) нагревали на воздухе с получением сульфата железа (II) (FeSO 4 ), который окисляли при дальнейшем нагревании на воздухе с образованием сульфата железа (III) (Fe 2 (SO 4 ) 3 ).Когда сульфат железа (III) нагревали до 480 ° C, он разлагался на оксид железа (III) и триоксид серы, которые можно было пропускать через воду с образованием серной кислоты любой концентрации. Стоимость этого процесса предотвратила широкомасштабное использование концентрированной серной кислоты. Серная кислота в различных концентрациях
 98-процентный сорт более стабилен при хранении, что делает его обычной формой для «концентрированной» серной кислоты. Другие концентрации серной кислоты используются для других целей. Некоторые распространенные концентрации указаны ниже.
98-процентный сорт более стабилен при хранении, что делает его обычной формой для «концентрированной» серной кислоты. Другие концентрации серной кислоты используются для других целей. Некоторые распространенные концентрации указаны ниже.
Физические свойства
 [4] Это протонирование происходит в высокой степени, более чем в десять миллиардов раз превышающей уровень, наблюдаемый в воде. Его можно представить следующим образом:
[4] Это протонирование происходит в высокой степени, более чем в десять миллиардов раз превышающей уровень, наблюдаемый в воде. Его можно представить следующим образом:
Этот процесс позволяет протона быть высоко мобильными в H 2 SO 4 . Это также делает серную кислоту отличным растворителем для многих реакций. На самом деле химическое равновесие более сложное, чем показано выше.В равновесии 100 процентов H 2 SO 4 содержат следующие вещества (цифры в скобках указывают количества в молях на килограмм растворителя):
- ГСО 4 − (15,0)
- H 3 SO 4 + (11.3)
- Н 3 О + (8,0)
- ГС 2 О 7 − (4.
 4)
4) - H 2 S 2 O 7 (3,6)
- Н 2 О (0.1).
Химические свойства
Реакция с водой
Реакция серной кислоты с водой (называемая реакцией гидратации) сопровождается выделением большого количества тепла, поэтому ее называют экзотермической реакцией. Если к концентрированной серной кислоте добавить воду, она может закипеть и опасно плеваться. Одна из причин такого поведения связана с относительной плотностью двух жидкостей. Вода имеет меньшую плотность, чем серная кислота, и имеет тенденцию плавать над кислотой.
Для безопасного разбавления кислоты всегда следует добавлять кислоту в воду (небольшими порциями), а не воду в кислоту. [5]
Реакцию лучше всего рассматривать как образование ионов гидроксония следующим образом:
то- HSO 4 — + H 2 O → H 2 O → H 3 O + + SO + + SO 4 2-
Поскольку гидратация серной кислоты термодинамически выгодно, [6] Серная кислота является отличным обезвоживающим средством и используется для приготовления многих сухофруктов. Сродство серной кислоты к воде настолько велико, что она удаляет атомы водорода и кислорода из других соединений. Например, смешивание крахмала (C 6 H 12 O 6 ) n и концентрированной серной кислоты даст элементарный углерод и воду, которые поглощаются серной кислотой (которая становится слегка разбавленной):
Сродство серной кислоты к воде настолько велико, что она удаляет атомы водорода и кислорода из других соединений. Например, смешивание крахмала (C 6 H 12 O 6 ) n и концентрированной серной кислоты даст элементарный углерод и воду, которые поглощаются серной кислотой (которая становится слегка разбавленной):
- (C 6 H 12 O 6 ) n → 6C + 6H 2 O.
Действие серной кислоты можно увидеть, если пролить ее на бумагу; крахмал реагирует, придавая вид обожженного, углерод появляется, как сажа в огне.Более драматическая иллюстрация возникает, когда серную кислоту добавляют к столовой ложке белого сахара в чашке, когда из чашки выходит высокий твердый столб черного пористого углерода с сильным запахом карамели.
Другие реакции серной кислоты
Как кислота, серная кислота реагирует с большинством оснований с образованием соответствующих сульфатов. Например, сульфат меди (II), знакомая голубая соль меди, используемая для гальваники и в качестве фунгицида, получается реакцией оксида меди (II) с серной кислотой:
Например, сульфат меди (II), знакомая голубая соль меди, используемая для гальваники и в качестве фунгицида, получается реакцией оксида меди (II) с серной кислотой:
- CuO + H 2 SO 4 → CuSO 4 + H 2 O
Серная кислота может использоваться для вытеснения более слабых кислот из их солей.Например, его реакция с ацетатом натрия дает уксусную кислоту:
H 2 SO 4 + CH 3 COONa → NaHSO 4 + CH 3 COOH
Аналогично, реакция серной кислоты с нитратом калия может быть использована для получения азотной кислоты вместе с осадком бисульфата калия. С самой азотной кислотой серная кислота действует как кислота и дегидратирующий агент, образуя ион нитрония NO 2 + , что важно в реакциях нитрования с участием электрофильного ароматического замещения.Этот тип реакции, в которой происходит протонирование атома кислорода, важен во многих реакциях органической химии, таких как этерификация по Фишеру и дегидратация спиртов.
Серная кислота реагирует с большинством металлов в одной реакции замещения с образованием газообразного водорода и сульфата металла. Разбавленный H 2 SO 4 воздействует на железо, алюминий, цинк, марганец и никель, но для олова и меди требуется горячая концентрированная кислота. Однако свинец и вольфрам устойчивы к серной кислоте.Реакция с железом типична для большинства этих металлов, но реакция с оловом необычна тем, что при ней образуется двуокись серы, а не водород. Эти реакции показаны здесь:
- Fe(тв) + H 2 SO 4 (водн.) → H 2 (г) + FeSO 4 (водн.)
- Sn(тв) 900 0 900 0 2 H 2 90 4 (водн.) → SnSO 4 (водн.) + 2 H 2 O(ж) + SO 2 (г)
Производство
Серная кислота производится из серы, кислорода и воды контактным способом.
На первом этапе сера сжигается для получения диоксида серы.
- (1) S(т) + O 2 (г) → SO 2 (г)
Этот продукт затем окисляют до триоксида серы с использованием кислорода в присутствии катализатора на основе оксида ванадия(V).
- (2) 2 SO 2 + O 2 (г) → 2 SO 3 (г) (в присутствии V 2 O 5 ) 90 с водой (обычно в виде 97-98 процентов H 2 SO 4 , содержащего от двух до трех процентов воды) для получения 98-99-процентной серной кислоты.
- (3) SO 3 (г) + H 2 O(ж) → H 2 SO 4 (л)
- (3) H 2 SO 4 (L) + SO 3 → H 2 S 2 O 7 (L)
- (4) H 2 S 2 O 7 O 7 (L) + H 2 O (L) → 2 H 2 SO 4 (L)
- CA 5 F (PO 5 F (PO 4 ) 3 + 5 ч 2 + 5 ч 2 SO 4 + 10 H 2 O → 5 CASO 4 • 2 ч 2 O + HF + 3 H 3 PO 4
- AL 2 O 3 + 3 H 2 + 3 H 2 SO 4 → AL 2 (SO 4 ) 3 + 3 H 2 O
- 2 H 2 SO 4 → 2 SO 2 + 2 H 2 O + O 2 (830°C)
- I 2 + SO 2 + 2 H 2 O → 2 HI + H 2 SO 4 (120°C)
- 2 HI → I 2 + H 2 (320°C)
- FES 2 + 7/2 O 2 + H 2 O → Fe 2+ O → Fe 2+ + 2 SO 4 2- + 2 ч +
- Fe 2+ + 1/4 O 2 + H + → Fe 3+ + 1/2 H 2 O
- Fe 3+ + 3 H 2 O → Fe(OH) 3 + 3 H +
- СО 2 → СО + О
- SO 2 + O → SO 3
- SO 3 + H 2 O → H 2 SO 4
- ↑ Амин А. Хайралла, Очерк арабского вклада в медицину , глава 10 (Бейрут, 1946).
- ↑ Бэкроним — это тип аббревиатуры, которая начинается как обычное слово и позже интерпретируется как аббревиатура.

- ↑ Упоминается в L’Azoth des Philosophes алхимиком пятнадцатого века Василием Валентином.
- ↑ Н.Н. Гринвуд и А. Эрншоу, Химия элементов (Оксфорд, Великобритания: Pergamon Press, 1984, ISBN 0080220576), 837-845.
- ↑ Чтобы запомнить это правило, было придумано несколько мнемоник, например:
- Всегда делай все как надо, добавляй кислоту в воду.Если вы думаете, что ваша жизнь слишком спокойна, добавьте воду к кислоте.
- А.А.: Добавить кислоту.
- Капля кислоты, а не воды.
- ↑ Изменение энтальпии реакции ΔH = -880 кДж/моль.
- ↑ Филип Дж. Шенье, Обзор промышленной химии (Нью-Йорк: Springer, 2002, ISBN 0306472465), 45–57.
- Агаманолис, Д.П. «Метаболические и токсические нарушения.В: Prayson R. (ed.) Невропатология: том в серии основ диагностической патологии . Филадельфия: Elsevier/Churchill Livingstone, 2005.

- Чанг, Раймонд. Химия , 9-е изд. Нью-Йорк: McGraw-Hill Science/Engineering/Math, 2006. ISBN 0073221031 .
- Шенье, Филип Дж. Обзор промышленной химии . Нью-Йорк: Springer, 2002. ISBN 0306472465 .
- Давенпорт, В. Г. и М. Дж. Кинг. Производство серной кислоты: анализ, контроль и оптимизация .Elsevier Science, 2005. ISBN 0080444288
- Гринвуд, Н. Н. и А. Эрншоу. Химия элементов , 2-е изд. Оксфорд, Великобритания; Берлингтон, Массачусетс: Баттерворт-Хайнеманн, Elsevier Science, 1998. ISBN 0750633654.
- Хайралла, Амин А. Обзор вклада арабского языка в медицину . Бейрут, 1946 год.
- Лиде, Дэвид Р. CRC Справочник по химии и физике , 87-е изд. Бока-Ратон, Флорида: CRC Press, 2006. ISBN 0849304873
Обратите внимание, что непосредственное растворение SO 3 в воде нецелесообразно, т.к. реакция сильно экзотермична и вместо жидкости образуется туман.
Альтернативный метод заключается в абсорбции SO 3 в H 2 SO 4 с получением олеума (H 2 S 2 O 7 ). Затем олеум разбавляют с образованием серной кислоты.
Oleum реагируют с водой в в концентрированном виде H 2 SO 4 .
Использование
Серная кислота является очень важным товарным химическим продуктом, и производство серной кислоты в стране является хорошим показателем ее промышленной мощи. [7] Серная кислота в основном используется (60 процентов от общего количества во всем мире) в «мокром методе» производства фосфорной кислоты, используемой для производства фосфатных удобрений и тринатрийфосфата для моющих средств. Этот метод предполагает использование фосфатной породы, и ежегодно перерабатывается более 100 миллионов метрических тонн. Это сырье, показанное ниже как фторапатит (Ca 5 F(PO 4 ) 3 ) (хотя точный состав может варьироваться), обрабатывается 93-процентной серной кислотой для получения сульфата кальция (CaSO 4 ). , фтористый водород (HF) и фосфорная кислота (H 3 PO 4 ). HF удаляют в виде плавиковой кислоты. Общий процесс можно представить следующим образом:
HF удаляют в виде плавиковой кислоты. Общий процесс можно представить следующим образом:
Серная кислота в больших количествах используется в производстве чугуна и стали, главным образом, в качестве травильной кислоты, используемой для удаления окисления, ржавчины и окалины с прокатного листа и заготовок перед продажей в автомобиль и белый металл. товарный бизнес.Использованная кислота часто повторно используется на установке регенерации отработанной кислоты (SAR). Эти установки сжигают отработанную кислоту с природным газом, газом нефтепереработки, мазутом или другим подходящим источником топлива. Этот процесс сжигания производит газообразный диоксид серы (SO 2 ) и триоксид серы (SO 3 ), которые затем используются для производства «новой» серной кислоты.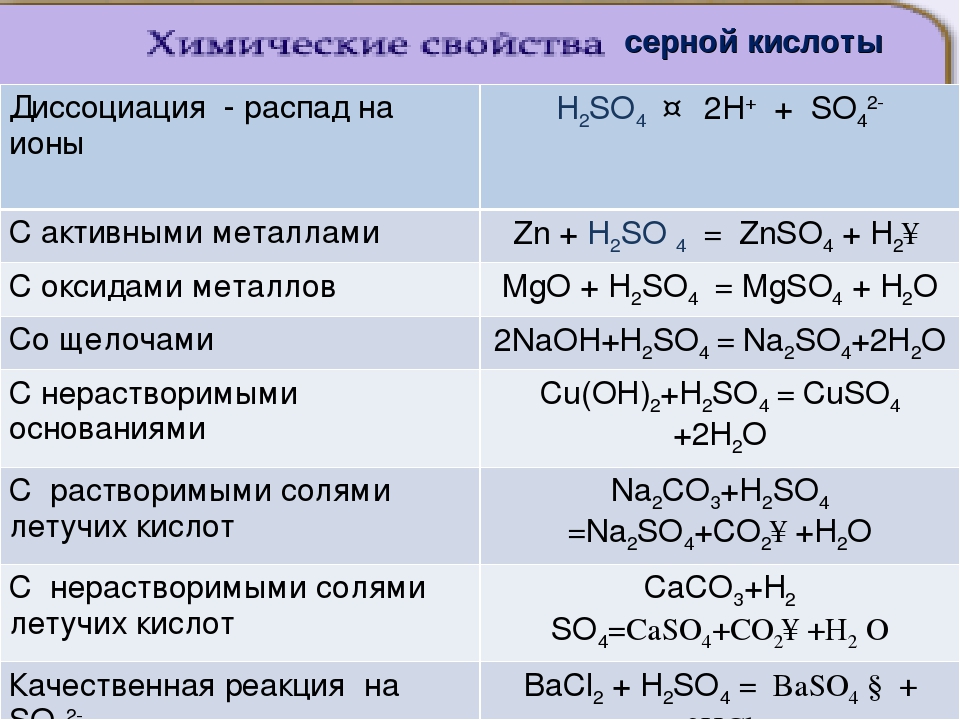 Эти типы заводов являются обычным дополнением к металлургическим заводам, нефтеперерабатывающим заводам и другим местам, где серная кислота потребляется в больших масштабах, поскольку эксплуатация завода SAR намного дешевле, чем покупка товара на открытом рынке.
Эти типы заводов являются обычным дополнением к металлургическим заводам, нефтеперерабатывающим заводам и другим местам, где серная кислота потребляется в больших масштабах, поскольку эксплуатация завода SAR намного дешевле, чем покупка товара на открытом рынке.
Сульфат аммония, важное азотное удобрение, чаще всего производится в качестве побочного продукта коксовых заводов, снабжающих металлургические заводы. Реакция аммиака, образующегося при термическом разложении угля, с отработанной серной кислотой позволяет кристаллизовать аммиак в виде соли (часто коричневой из-за загрязнения железом) и продается в агрохимической промышленности.
Другим важным применением серной кислоты является производство сульфата алюминия, также известного как квасцы для изготовления бумаги.Он может вступать в реакцию с небольшим количеством мыла на волокнах бумажной массы с образованием желеобразных карбоксилатов алюминия, которые помогают коагулировать волокна целлюлозы на поверхности твердой бумаги. Он также используется для получения гидроксида алюминия, который используется на водоочистных сооружениях для фильтрации примесей, а также для улучшения вкуса воды. Сульфат алюминия получают реакцией боксита с серной кислотой:
Он также используется для получения гидроксида алюминия, который используется на водоочистных сооружениях для фильтрации примесей, а также для улучшения вкуса воды. Сульфат алюминия получают реакцией боксита с серной кислотой:
Серновая кислота используется для различного назначения в химической промышленности.Например, это обычный кислотный катализатор для превращения циклогексаноноксима в капролактам, используемый для изготовления нейлона. Он используется для производства соляной кислоты из соли по процессу Мангейма. Много
H 2 SO 4 используется в нефтепереработке, например, в качестве катализатора реакции изобутана с изобутиленом с получением изооктана, соединения, повышающего октановое число бензина (бензина). Серная кислота также важна в производстве красителей.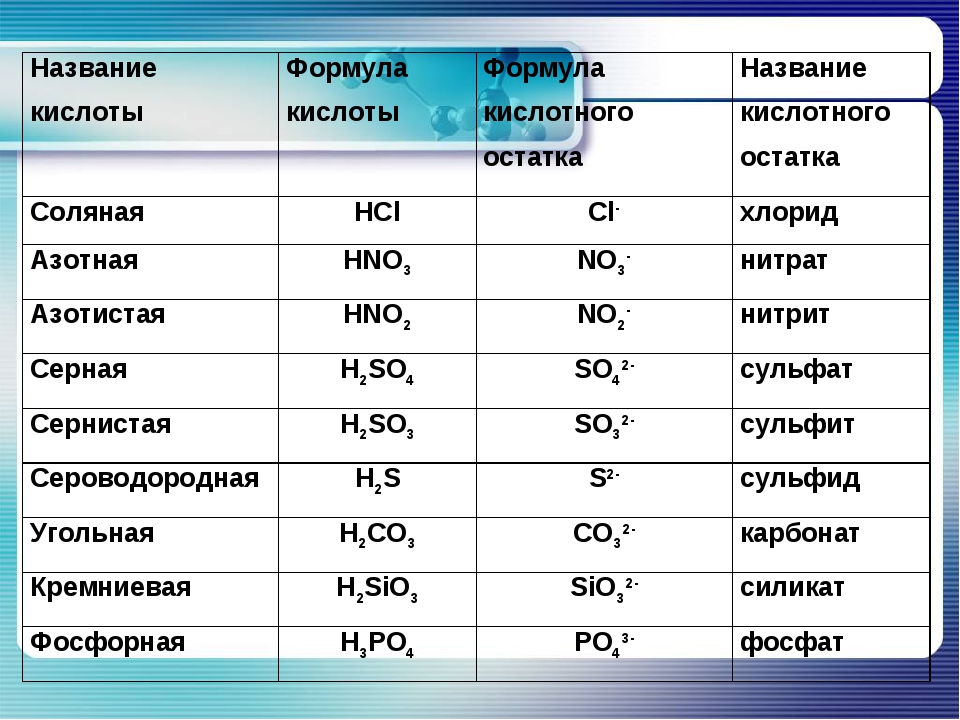
Смесь серной кислоты и воды иногда используется в качестве электролита в различных типах свинцово-кислотных аккумуляторов, где она подвергается обратимой реакции, при которой свинец и диоксид свинца превращаются в сульфат свинца (II).Серная кислота также является основным ингредиентом некоторых очистителей канализации, используемых для устранения засоров, состоящих из бумаги, тряпок и других материалов, которые трудно растворяются растворами щелочи.
Серная кислота также используется в качестве общего дегидратирующего агента в концентрированной форме. См. Реакция с водой.
Серо-йодный цикл
Серно-йодный цикл представляет собой серию термохимических процессов, используемых для получения водорода. Он состоит из трех химических реакций, чистым реагентом которых является вода, а чистыми продуктами являются водород и кислород.
Соединения серы и йода извлекаются и используются повторно, поэтому процесс рассматривается как цикл. Этот процесс является эндотермическим и должен происходить при высоких температурах, поэтому необходимо подводить энергию в виде тепла.
Этот процесс является эндотермическим и должен происходить при высоких температурах, поэтому необходимо подводить энергию в виде тепла.
Серно-йодный цикл был предложен как способ обеспечения водородом экономики, основанной на водороде. Он не требует углеводородов, как современные методы парового риформинга.
Цикл серы и йода в настоящее время изучается как возможный метод получения водорода, но концентрированная коррозионная кислота при высоких температурах представляет в настоящее время непреодолимую угрозу безопасности, если процесс будет построен в больших масштабах.
Экологические аспекты
Серная кислота является составной частью кислотных дождей и образуется в результате окисления диоксида серы в атмосфере в присутствии воды, т.е.е. окисление сернистой кислоты. Диоксид серы является основным продуктом сжигания серы в серосодержащих топливах, таких как уголь или нефть.
Серная кислота образуется в природе при окислении сульфидных минералов, таких как сульфид железа.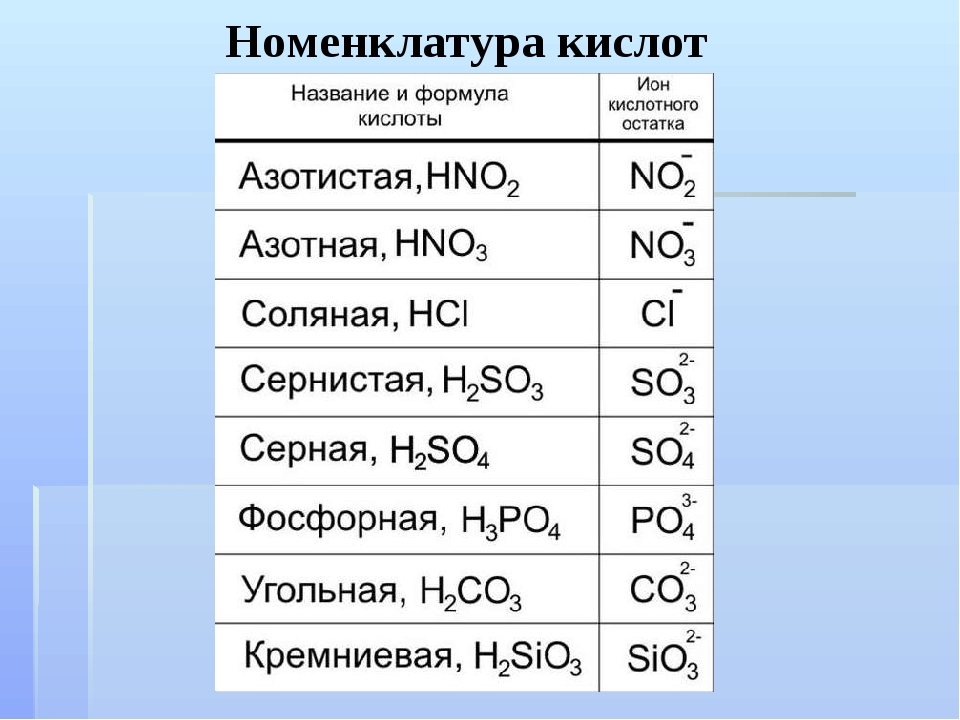 Полученная вода может быть очень кислой и называется дренажом кислотных пород (ARD). Образовавшаяся таким образом кислая вода может растворять металлы, присутствующие в сульфидных рудах, что приводит к ярко окрашенным и токсичным потокам. Окисление сульфидного пирита молекулярным кислородом дает железо (II) или Fe 2+ :
Полученная вода может быть очень кислой и называется дренажом кислотных пород (ARD). Образовавшаяся таким образом кислая вода может растворять металлы, присутствующие в сульфидных рудах, что приводит к ярко окрашенным и токсичным потокам. Окисление сульфидного пирита молекулярным кислородом дает железо (II) или Fe 2+ :
The Fe 2+ может быть дополнительно окислен до Fe 3+ в соответствии с:
может быть получено 9 и Fe 39011 в виде гидроксида или водного оксида.Уравнение образования гидроксида:
пирит. Когда происходит окисление пирита железом (III), процесс может стать быстрым, и в результате этого процесса в ARD были измерены значения pH ниже нуля.
ARD также может производить серную кислоту с более низкой скоростью, так что способность нейтрализации кислоты (ANC) водоносного горизонта может нейтрализовать образовавшуюся кислоту.В таких случаях общая концентрация растворенных твердых веществ (TDS) в воде может быть увеличена за счет растворения минералов в результате реакции нейтрализации кислоты с минералами.
Серная кислота образуется в верхних слоях атмосферы Венеры в результате фотохимического воздействия Солнца на двуокись углерода, двуокись серы и водяной пар. Ультрафиолетовые фотоны с длиной волны менее 169 нм могут фотодиссоциировать углекислый газ на монооксид углерода и атомарный кислород. Атомарный кислород очень реактивен; когда он вступает в реакцию с диоксидом серы, следовым компонентом венерианской атмосферы, в результате получается триоксид серы, который может соединяться с водяным паром, другим следовым компонентом атмосферы Венеры, с образованием серной кислоты.
В верхних, более холодных частях атмосферы Венеры серная кислота может существовать в виде жидкости, а густые облака серной кислоты полностью закрывают поверхность планеты. поверхность сверху. Основной облачный слой простирается на высоте 45–70 км над поверхностью планеты, а более тонкие туманы простираются от 30 до 90 км над поверхностью.
поверхность сверху. Основной облачный слой простирается на высоте 45–70 км над поверхностью планеты, а более тонкие туманы простираются от 30 до 90 км над поверхностью.
Инфракрасные спектры, полученные в ходе миссии НАСА «Галилео», показывают отчетливые абсорбции на Европе, спутнике Юпитера, которые были приписаны одному или нескольким гидратам серной кислоты. Интерпретация спектров несколько спорна. Некоторые планетологи предпочитают приписывать спектральные характеристики иону сульфата, возможно, как части одного или нескольких минералов на поверхности Европы.
Безопасность
Лабораторные опасности
Коррозионные свойства серной кислоты усиливаются ее сильно экзотермической реакцией с водой.Следовательно, ожоги от серной кислоты потенциально более серьезны, чем ожоги от сопоставимых сильных кислот (например, соляной кислоты), поскольку возникает дополнительное повреждение тканей из-за обезвоживания и, в частности, из-за тепла, выделяющегося при реакции с водой, т. е. вторичное термическое повреждение. Опасность, очевидно, выше при использовании более концентрированных препаратов серной кислоты, но следует помнить, что даже обычный лабораторный «разбавленный» сорт (примерно один М, десять процентов) обугливает бумагу в результате обезвоживания, если оставить ее в контакте на достаточное время. время.Стандартная первая помощь при попадании кислоты на кожу, как и при других разъедающих агентах, заключается в орошении большим количеством воды: Мытье должно продолжаться в течение достаточного времени — не менее десяти-пятнадцати минут — для охлаждения ткани. вокруг ожога кислотой и для предотвращения вторичного повреждения. Загрязненную одежду следует немедленно снять, а кожу под ней тщательно промыть.
е. вторичное термическое повреждение. Опасность, очевидно, выше при использовании более концентрированных препаратов серной кислоты, но следует помнить, что даже обычный лабораторный «разбавленный» сорт (примерно один М, десять процентов) обугливает бумагу в результате обезвоживания, если оставить ее в контакте на достаточное время. время.Стандартная первая помощь при попадании кислоты на кожу, как и при других разъедающих агентах, заключается в орошении большим количеством воды: Мытье должно продолжаться в течение достаточного времени — не менее десяти-пятнадцати минут — для охлаждения ткани. вокруг ожога кислотой и для предотвращения вторичного повреждения. Загрязненную одежду следует немедленно снять, а кожу под ней тщательно промыть.
Приготовление разбавленной кислоты также может быть опасным из-за выделения тепла в процессе разбавления.Важно, чтобы концентрированная кислота добавлялась в воду, а не наоборот, чтобы воспользоваться относительно высокой теплоемкостью воды. Добавление воды к концентрированной серной кислоте приводит в лучшем случае к рассеиванию аэрозоля серной кислоты, в худшем — к взрыву. Приготовление растворов с концентрацией более шести М (35 процентов) является наиболее опасным, поскольку выделяемого тепла может быть достаточно для кипения разбавленной кислоты: эффективное механическое перемешивание и внешнее охлаждение (например,г. ледяная ванна) необходимы.
Приготовление растворов с концентрацией более шести М (35 процентов) является наиболее опасным, поскольку выделяемого тепла может быть достаточно для кипения разбавленной кислоты: эффективное механическое перемешивание и внешнее охлаждение (например,г. ледяная ванна) необходимы.
Промышленные опасности
Хотя серная кислота негорючая, контакт с металлами в случае утечки может привести к выделению газообразного водорода. Рассеивание кислотных аэрозолей и газообразного диоксида серы представляет дополнительную опасность пожаров, связанных с серной кислотой. В качестве огнетушащего вещества следует использовать воду , а не из-за риска дальнейшего рассеивания аэрозолей: по возможности предпочтительнее использовать двуокись углерода.
Серная кислота не считается токсичной, за исключением ее очевидной коррозионной опасности, и основными профессиональными рисками являются контакт с кожей, приводящий к ожогам (см. выше), и вдыхание аэрозолей.Воздействие аэрозолей в высоких концентрациях приводит к немедленному и сильному раздражению глаз, дыхательных путей и слизистых оболочек: оно быстро прекращается после воздействия, хотя существует риск последующего отека легких, если повреждение тканей было более серьезным. При более низких концентрациях наиболее часто сообщаемым симптомом хронического воздействия аэрозолей серной кислоты является эрозия зубов, обнаруженная практически во всех исследованиях: признаки возможного хронического повреждения дыхательных путей по состоянию на 1997 г. неубедительны.В Соединенных Штатах допустимый предел воздействия (ПДК) для серной кислоты установлен на уровне одного мг/м 3 : пределы в других странах аналогичны. Интересно, что были сообщения о приеме внутрь серной кислоты, что приводило к дефициту витамина B12 с подострой комбинированной дегенерацией. В таких случаях чаще всего поражается спинной мозг, но в зрительных нервах может наблюдаться демиелинизация, потеря аксонов и глиоз.
При более низких концентрациях наиболее часто сообщаемым симптомом хронического воздействия аэрозолей серной кислоты является эрозия зубов, обнаруженная практически во всех исследованиях: признаки возможного хронического повреждения дыхательных путей по состоянию на 1997 г. неубедительны.В Соединенных Штатах допустимый предел воздействия (ПДК) для серной кислоты установлен на уровне одного мг/м 3 : пределы в других странах аналогичны. Интересно, что были сообщения о приеме внутрь серной кислоты, что приводило к дефициту витамина B12 с подострой комбинированной дегенерацией. В таких случаях чаще всего поражается спинной мозг, но в зрительных нервах может наблюдаться демиелинизация, потеря аксонов и глиоз.
См. также
Примечания
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
Внешние ссылки
Все ссылки получены 5 января 2020 г.
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен быть указан в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен быть указан в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
4.10: Кислоты, основания и соли
Помимо бинарных молекулярных соединений, большинство неорганических соединений можно классифицировать как кислоты, основания или соли.Здесь кратко рассматриваются эти три категории соединений и их названия.
Кислоты
Кислоты характеризуются ионом H + , присутствие которого в воде делает воду кислой . Кислота либо содержит этот ион, либо образует его при растворении в воде. Серная кислота, H 2 SO 4 , является примером соединения, которое содержит ион H + . Растворенная в воде молекула серной кислоты существует в виде ионов 2 H + и ионов 1 SO 4 2-.{-}\]
В этом случае только небольшая часть молекул CO 2 , растворенных в воде, вступает в описанную выше реакцию с образованием H + , поэтому водные растворы CO 2 являются слабокислыми , а диоксид углерода классифицируется как а слабая кислая . Именно присутствие растворенного CO 2 из диоксида углерода, естественным образом присутствующего в воздухе, делает осадки, выпадающие даже из незагрязненной атмосферы, слегка кислыми, и, как обсуждалось в главе 9, слабокислотные свойства CO 2 очень важны для природных условий. воды в окружающей среде.Другие кислоты, такие как соляная кислота, HCl, полностью диссоциируют до H + и аниона (в случае HCl анион Cl — ) при растворении в воде; такими кислотами являются сильные кислоты.
воды в окружающей среде.Другие кислоты, такие как соляная кислота, HCl, полностью диссоциируют до H + и аниона (в случае HCl анион Cl — ) при растворении в воде; такими кислотами являются сильные кислоты.
Название кислот следует определенным правилам. В случае кислоты, которая содержит только H и один другой элемент, кислота является водородной кислотой. Таким образом, HCl называется гидро хлор ic кислотой. Несколько другие правила применяются, когда кислота содержит кислород.Некоторые элементы образуют кислоты, в которых анион имеет различное количество кислорода; примерами являются H 2 SO 4 и H 2 SO 3 . Кислота с большим количеством кислорода является «-ic» кислотой, поэтому H 2 SO 4 является серной кислотой. Кислота с меньшим количеством кислорода является «-овой» кислотой, поэтому H 2 SO 3 представляет собой сернистую кислоту. Большее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «пер-», а меньшее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «гипо-».Эти названия очень хорошо показаны названиями оксикислот хлора. Таким образом, названия HClO 4 , HClO 3 , HClO 2 и HClO — это, соответственно, хлорная кислота, хлорноватистая кислота, хлорноватистая кислота и хлорноватистая кислота.
Большее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «пер-», а меньшее количество кислорода, чем даже «-овая» кислота, обозначается приставкой «гипо-».Эти названия очень хорошо показаны названиями оксикислот хлора. Таким образом, названия HClO 4 , HClO 3 , HClO 2 и HClO — это, соответственно, хлорная кислота, хлорноватистая кислота, хлорноватистая кислота и хлорноватистая кислота.
Кислоты чрезвычайно важны как промышленные химикаты, в окружающей среде и в отношении зеленой химии. Ежегодно в США производится около 40 миллионов метрических тонн (40 миллиардов килограммов) серной кислоты. Это синтетический химикат номер 1, в основном из-за его применения для обработки фосфатных минералов для производства фосфорных удобрений для сельскохозяйственных культур.Серная кислота также используется в больших количествах для удаления коррозии со стали, этот процесс называется травлением стали. Другие основные области применения включают синтез моющих средств, переработку нефти, производство свинцовых аккумуляторных батарей и синтез спирта. Ежегодно в США производится около 7-8 миллионов тонн азотной кислоты HNO 3 , что ставит ее на 10-е место, а соляная кислота занимает примерно 25-е место с годовым объемом производства около 3 миллионов метрических тонн.
Ежегодно в США производится около 7-8 миллионов тонн азотной кислоты HNO 3 , что ставит ее на 10-е место, а соляная кислота занимает примерно 25-е место с годовым объемом производства около 3 миллионов метрических тонн.
Кислоты важны для окружающей среды.Неправильно утилизированная кислота вызвала серьезные проблемы вокруг опасных отходов. Серная кислота наряду с небольшими количествами соляной и азотной кислот являются основными составляющими кислотных дождей (см. главу 10). Кислоты занимают видное место в практике зеленой химии. Регенерация и утилизация кислот широко распространены в практике промышленной экологии. Как отмечалось ранее, большая часть серной кислоты, производимой в настоящее время, использует в качестве источника серы потенциальные отходы и загрязняющие вещества, сероводород H 2 S, удаляемые из источников высокосернистого природного газа.
В тех случаях, когда можно использовать относительно слабую кислоту, уксусная кислота, полученная путем ферментации углеводов, является отличной зеленой альтернативой более сильным кислотам, таким как серная кислота. Дрожжи могут превращать углеводы в этанол (этиловый спирт, который присутствует в алкогольных напитках), а другие микроорганизмы в присутствии воздуха превращают этанол в уксусную кислоту с помощью того же процесса, что уксус, разбавленный раствор уксусной кислоты, производится из сидра. или вино. Структурная формула уксусной кислоты
Дрожжи могут превращать углеводы в этанол (этиловый спирт, который присутствует в алкогольных напитках), а другие микроорганизмы в присутствии воздуха превращают этанол в уксусную кислоту с помощью того же процесса, что уксус, разбавленный раствор уксусной кислоты, производится из сидра. или вино. Структурная формула уксусной кислоты
, в котором только один из 4 атомов Н способен ионизироваться с образованием иона Н+.Производство уксусной кислоты является экологичным процессом, в котором используются биологические реакции, воздействующие на возобновляемое сырье биомассы. Как слабая кислота, уксусная кислота относительно безопасна в использовании, и контакт с людьми обычно не очень опасен (мы глотаем разбавленную уксусную кислоту в виде уксуса, но чистая уксусная кислота воздействует на плоть и используется для удаления бородавок с кожи). Еще одним преимуществом уксусной кислоты является то, что она является биоразлагаемой, поэтому любое ее попадание в окружающую среду не сохраняется.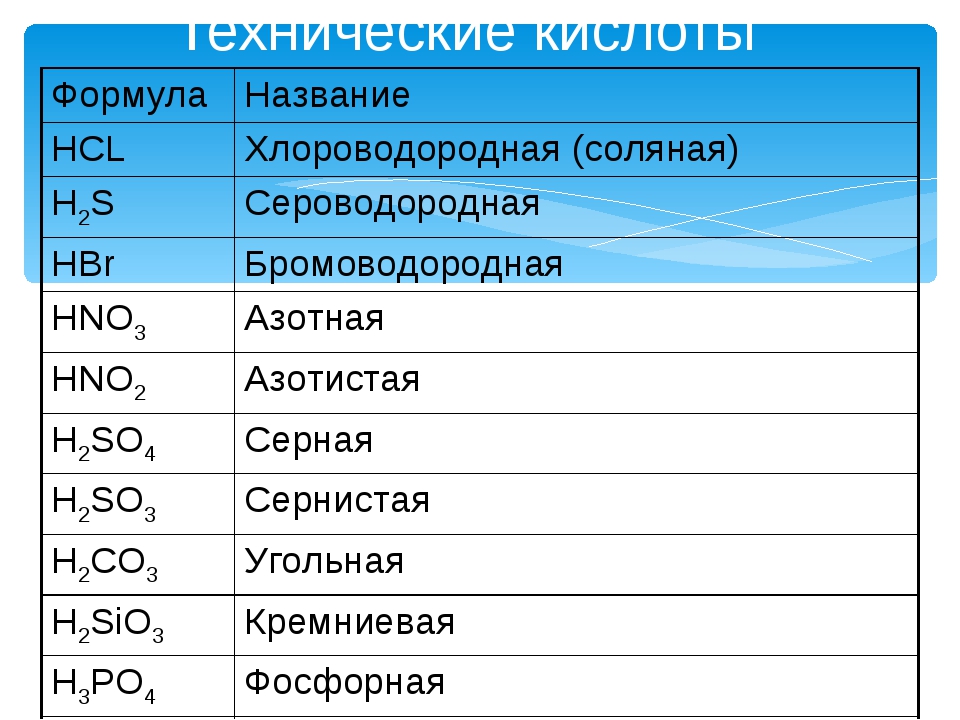
Основания
Основание либо содержит гидроксид-ион, OH — , либо реагирует с водой с образованием гидроксида.{-}\]
Только небольшая часть молекул аммиака подвергается этой реакции в воде, поэтому аммиак не образует много OH-в воде и известен как слабое основание . Гидроксиды металлов, такие как КОН, которые полностью диссоциируют в воде, представляют собой сильных основания . Гидроксиды металлов называются по названию металла, за которым следует слово «гидроксид». Следовательно, Mg(OH) 2 представляет собой гидроксид магния.
Соли
Кислоты и основания реагируют с образованием соли , ионного соединения, которое имеет катион, отличный от H+, и анион, отличный от OH — .Этот тип реакции всегда производит воду и известен как реакция нейтрализации . Наиболее известной солью является хлорид натрия, NaCl. Хотя обычно это то, что имеют в виду, говоря о «соли», есть и много других солей. К ним относятся хлорид кальция, CaCl 2 , используемый для таяния дорожного льда, карбонат натрия, Na 2 CO 3 , используемый в чистящих составах, и хлорид калия, KCl, источник калийного удобрения для сельскохозяйственных культур. Типичной реакцией нейтрализации является реакция между NaOH и соляной кислотой HCl с образованием хлорида натрия:
Хотя обычно это то, что имеют в виду, говоря о «соли», есть и много других солей. К ним относятся хлорид кальция, CaCl 2 , используемый для таяния дорожного льда, карбонат натрия, Na 2 CO 3 , используемый в чистящих составах, и хлорид калия, KCl, источник калийного удобрения для сельскохозяйственных культур. Типичной реакцией нейтрализации является реакция между NaOH и соляной кислотой HCl с образованием хлорида натрия:
\[\underbrace{NaOH}_{\textrm{Base}} + \underbrace{HCl}_{\textrm{кислота}} \rightarrow \underbrace{NaCl}_{\textrm{соль, хлорид натрия}} + \ underbrace {H_ {2} O} _ {\ textrm {вода}} \]
Соли имеют очень простое название, состоящее только из названия катиона, за которым следует название аниона.Заряды ионов определяют формулы солей, поэтому нет необходимости добавлять префиксы для обозначения относительных номеров каждого иона. Следовательно, CaCl 2 — это просто хлорид кальция, а не дихлорид кальция. Как отмечалось ранее в этой главе, к названиям солей, содержащих более одного типа катиона или более одного типа аниона, добавляются префиксы, чтобы показать относительное количество ионов. Например, KH 2 PO 4 называется дигидрофосфатом калия.
Например, KH 2 PO 4 называется дигидрофосфатом калия.
| Сульфат магния | Препарат, используемый для лечения судорог во время беременности, нефрита у детей, дефицита магния и тетании. |
| Полисульфат пентозана | Сульфатированный пентозилполисахарид, используемый для лечения болей в мочевом пузыре и дискомфорта, вызванного интерстициальным циститом. |
| Марганец | Переходный металл, используемый для добавления марганца во время полного парентерального питания (ППП). |
| Сульфат меди | Соединение, используемое в качестве добавки меди для внутривенного введения при полном парентеральном питании (ППП). |
| Квасцы калия | Квасцы калия признаны FDA безопасными и используются в гомеопатических или безрецептурных продуктах. Из-за его присутствия в нескольких различных препаратах основные показания для… Из-за его присутствия в нескольких различных препаратах основные показания для… |
| Сульфат цинка | Препарат, используемый для восполнения низкого уровня цинка или предотвращения дефицита цинка, или для проверки дефицита цинка. |
| Сульфат натрия | Вещество, используемое для очищения кишечника перед колоноскопией или бариевой клизмой Рентгенологическое исследование. |
| Тиосерная кислота | Донор серы, используемый для последовательного применения с нитритом натрия для лечения острого отравления цианидом, которое считается опасным для жизни. |
| Сульфат бария | Контрастное вещество, используемое для компьютерной томографии желудочно-кишечного тракта. |
| Сульфат алюминия | Лекарство, используемое для профилактики инфекций и лечения незначительных кровотечений. |
 4)
4)
