Ковалентные неполярные и полярные связи — урок. Химия, 8–9 класс.
Общие электронные пары, образующиеся в простых веществах h3,O2,Cl2,F2,N2, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
Рассмотрим образование ковалентных связей в сложных веществах.
1. Образование молекулы хлороводорода.
У атома водорода на внешнем уровне — один электрон. У хлора на внешнем уровне — семь электронов, один из которых неспаренный.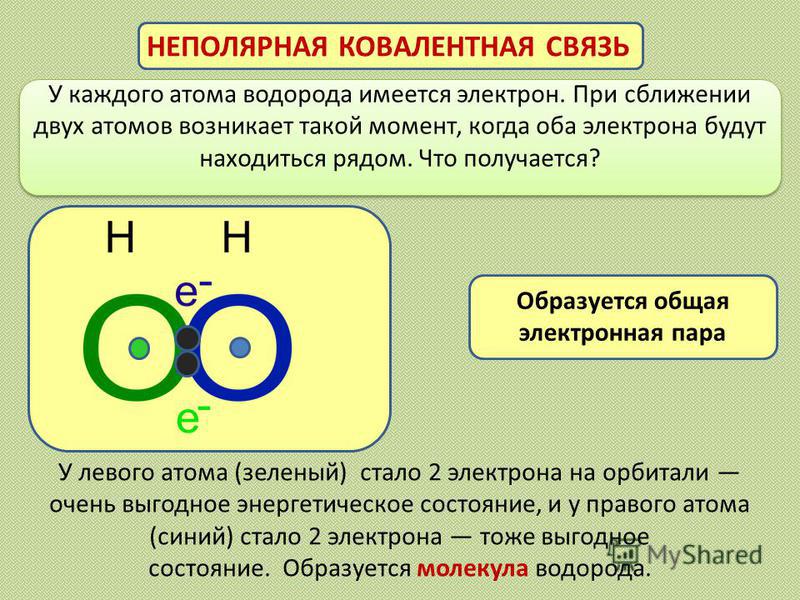
Образуется одна общая электронная пара, которая смещена к атому хлора. В результате
появляются частичные заряды: на атоме хлора — отрицательный, а на атоме водорода — положительный. Сдвиг электронной плотности принято обозначать греческой буквой дельта δ:
Рис. \(1\). Образование молекулы хлороводорода
Структурная формула хлороводорода H−Cl
Подобным образом соединяются атомы в молекулах других галогеноводородов:
H−F,H−Br,H−I.
2. Образование молекулы воды.
На внешнем уровне атома кислорода — шесть электронов, два из которых неспаренные.
Атом кислорода образует две общие электронные пары с двумя атомами водорода.
Электронная плотность этих общих пар сдвинута к более электроотрицательному кислороду. Атом кислорода имеет отрицательный заряд, а атомы водорода — положительный.
Рис. \(2\). Образование молекулы воды
Сходное строение имеет молекула сероводорода.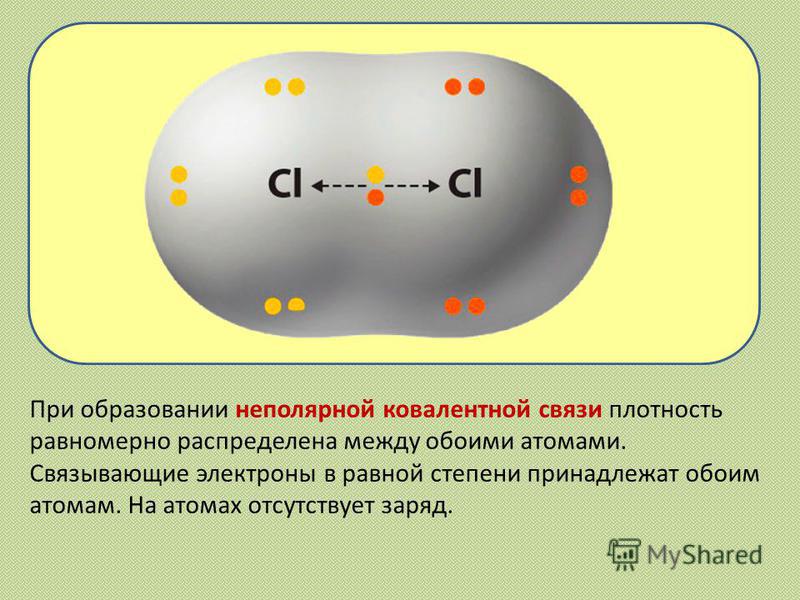 Структурные формулы воды и сероводорода:
Структурные формулы воды и сероводорода:
H−OH−S||HH
3. Образование молекулы аммиака.
У атома азота — пять внешних электронов, три из которых неспаренные.
Атом азота присоединяет к себе три атома водорода.
Азот — более электроотрицательный элемент, поэтому на его атоме будет отрицательный заряд, а на атомах водорода — положительные заряды.
Рис. \(3\). Образование молекулы аммиака
Структурная формула аммиака:
H−N−H|H
Для того чтобы определить знаки частичных зарядов на атомах в веществе, надо сравнить ЭО неметаллов.
Пример:
определим частичные заряды атомов в соединении CCl4.
Вспомним положение углерода и хлора в ряду ЭО:
По положению элементов в этом ряду видно, что более электроотрицательный элемент в этой паре — хлор.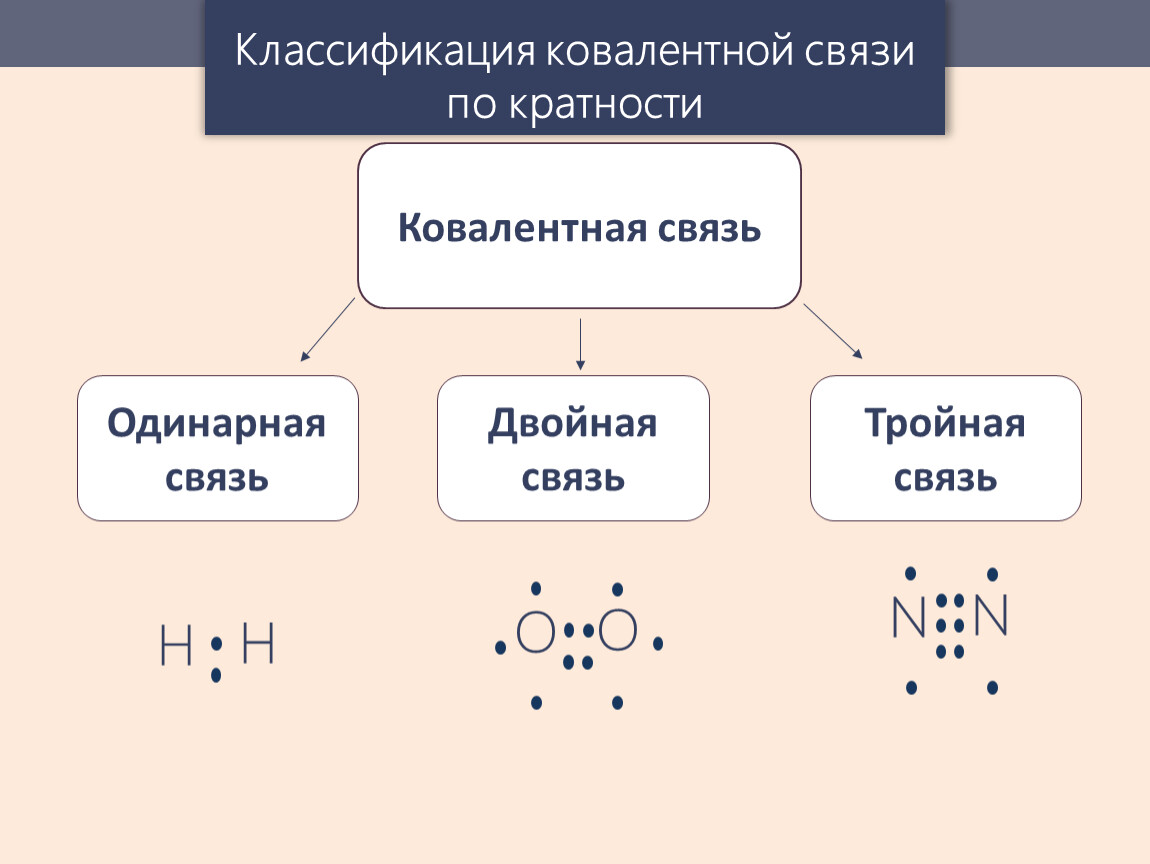 Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
C+δCl4−δ.
Полярную ковалентную связь часто изображают стрелкой: H→Cl. Стрелка показывает направление смещения общей электронной плотности.
Источники:
Рис. 1. Образование молекулы хлороводорода © ЯКласс
Рис. 2. Образование молекулы воды © ЯКласс
Рис. 3. Образование молекулы аммиака © ЯКласс
Ковалентная связь — полярная и неполярная, механизмы образования » HimEge.ru
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов.
Электроотрицательность неметаллов довольно велика, так что при химическом взаимодействии двух атомов неметаллов полный перенос электронов от одного к другому (как в случае ионной связи) невозможен.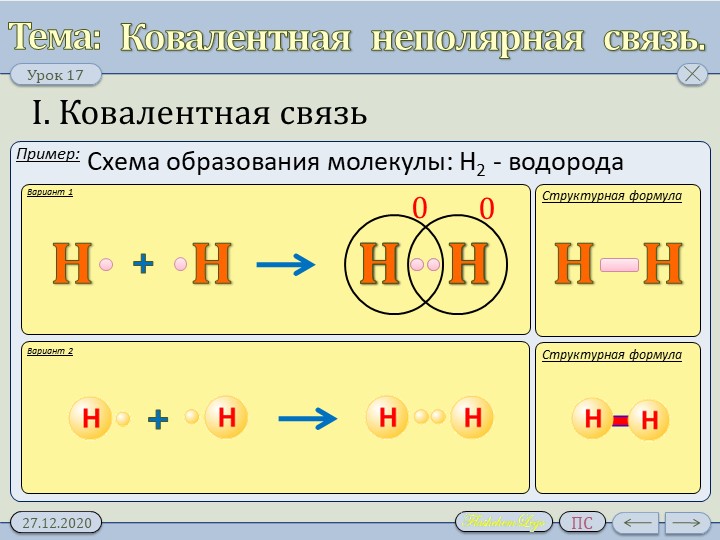 В этом случае для выполнения правила октета необходимо объединение электронов.
В этом случае для выполнения правила октета необходимо объединение электронов.
В качестве примера обсудим взаимодействие атомов водорода и хлора:
H 1s1 — один электрон
Cl 1s2 2s22p6 3s23p5 — семь электронов на внешнем уровне
Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку. И каждый из атомов выделяет „в общее пользование” по одному электрону. Тем самым правило октета оказывается выполненным. Лучше всего изображать это с помощью формул Льюиса:
- Образование ковалентной связи
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора — восемь электронов (свои плюс обобществленный электрон атома водорода). Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора.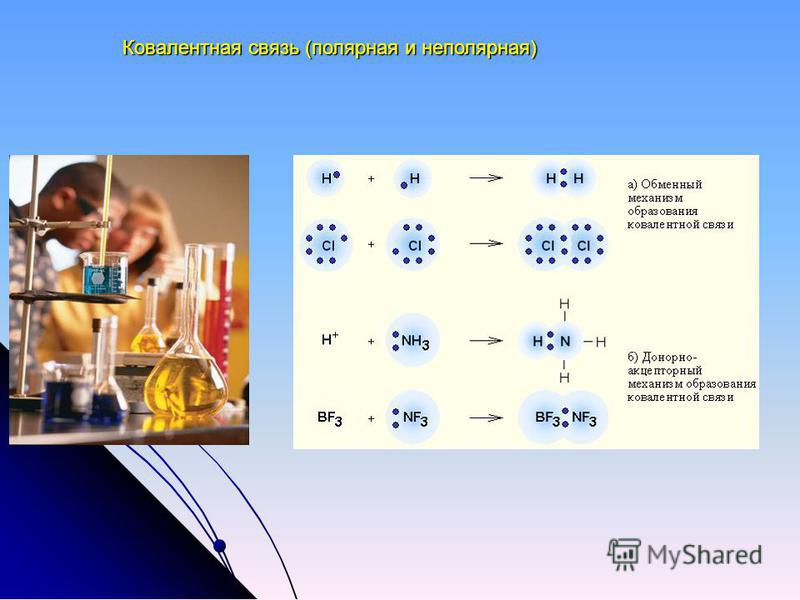 Образовавшаяся при связывании двух атомов частица называется молекулой.
Образовавшаяся при связывании двух атомов частица называется молекулой.
Неполярная ковалентная связь
Ковалентная связь может образоваться и между двумя одинаковыми атомами. Например:
- Образование ковалентной неполярной связи
Эта схема объясняет, почему водород и хлор существуют в виде двухатомных молекул. Благодаря спариванию и обобществлению двух электронов удается выполнить правило октета для обоих атомов.
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода О2 или азота N2. Атомы азота имеют по пять валентных электронов, следовательно, для завершения оболочки требуется еще по три электрона. Это достигается обобществлением трех пар электронов, как показано ниже:
Ковалентные соединения — обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому. В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора. Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется
Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется
- Типы химической связи
В таблице ниже перечислены основные типы связей и примеры веществ:
- Типы химической связи
Обменный и донорно-акцепторный механизм образования ковалентной связи
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Ковалентная неполярная связь | Решаем химию: вопросы и ответы
Молекулы образуются из атомов, но почему атомы соединяются в молекулы? Дело в том, что их удерживают вместе химические связи.
Химическая связь – это взаимодействие атомов, посредством которого они и удерживаются в молекуле или кристалле.
«Ответственность» за образование химической связи несут неспаренные электроны, находящиеся на внешнем электронном уровне. При этом электроны атомов, которые образуют молекулу, образуют электронную пару (или несколько). Ниже мы рассмотрим, как образуется ковалентная связь и, в частности, ковалентная неполярная связь.
Ковалентная неполярная связьЧто такое ковалентная связь
Выше мы узнали, что связь – это фактически пара электронов, которая образуется из электронов, находящихся на внешних слоях атомов. Эта электронная пара находится между связанными атомами.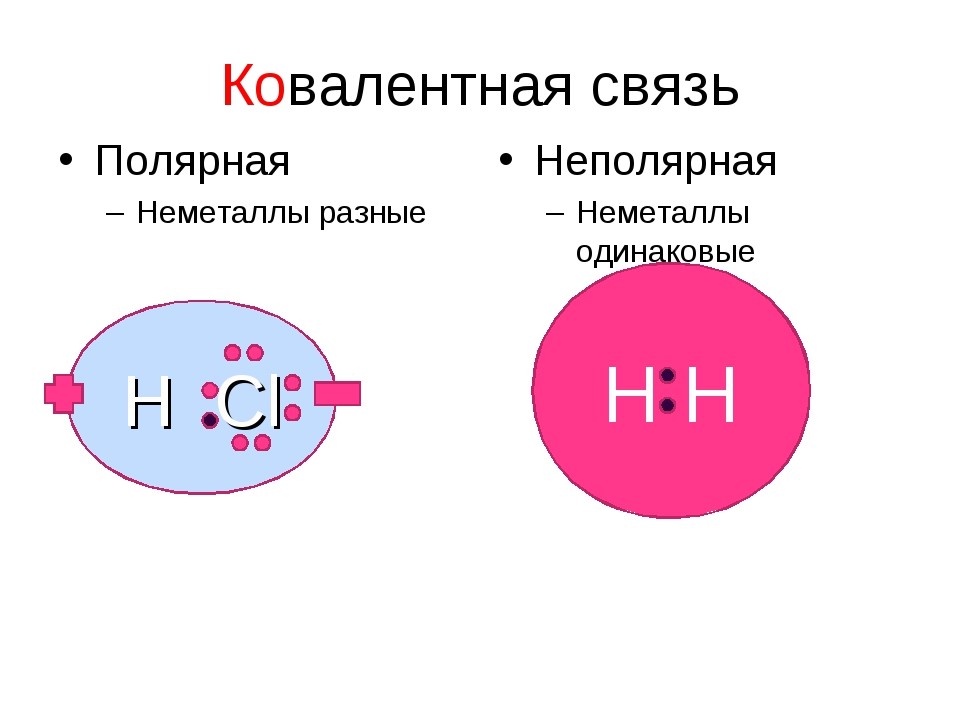 Такой вид связи называют ковалентной. Самый простой пример, объясняющий процесс образования ковалентной химической связи, — это образование молекулы водорода Н2. У каждого атома водорода имеется лишь один электрон (водород — это первый элемент периодической таблицы). Когда два атома водорода сближаются, эти электроны образуют пару, и находится она между двумя атомами. Выглядит процесс так:
Такой вид связи называют ковалентной. Самый простой пример, объясняющий процесс образования ковалентной химической связи, — это образование молекулы водорода Н2. У каждого атома водорода имеется лишь один электрон (водород — это первый элемент периодической таблицы). Когда два атома водорода сближаются, эти электроны образуют пару, и находится она между двумя атомами. Выглядит процесс так:
Н∙ + ∙Н → Н : Н
Для удобства электронную пару обозначают чёрточкой, то есть структурно молекула водорода можно изобразить так: Н—Н. Обратите внимание на следующий факт: в данной молекуле имеются
два одинаковых атома, поэтому электронная пара расположена ровно посередине между атомами, она никуда не смещается. И эта связь носит название «ковалентная неполярная».
Ковалентная неполярная связь
Ковалентная неполярная связь образуется посредством электронной пары, которая находится посередине между атомами в молекуле и не смещена ни к одному из атомов. Вполне можно сказать, что
Вполне можно сказать, что
ковалентная неполярная связь всегда будет образовывать лишь при условии, что молекула образована двумя одинаковыми атомами
(потому что только в таком случае пара электронов будет располагаться посередине). Таким образом, в молекулах газов всегда имеется ковалентная неполярная связь (Н2, Сl2, F2, О2 и пр).
Напомню, что химическая связь может быть образована одной парой электронов (как в молекуле водорода) или несколькими. Рассмотрим для примера молекулу кислорода О2. Если обратиться к таблице Менделеева, то можно понять, что у кислорода имеется на внешнем слое шесть электронов, из которых два неспаренные. Схематично процесс образования молекулы выглядит так:
Ковалентная неполярная связьКак видно, в этом случае получается две электронные пары. Они расположены ровно посередине между атомами кислорода, то есть образуется ковалентная неполярная связь, к тому же двойная. Молекула кислорода выглядит так: О=О.
Молекула кислорода выглядит так: О=О.
Если же мы рассмотрим образование молекулы азота (у атома азота на внешнем электронном слое пять электронов, из которых неспаренных три), то снова увидим образование ковалентной неполярной связи, но на этот раз тройной (за счёт трёх электронных пар). Схематично молекула азота можно изобразить так: N≡N.
Таким образом, ковалентная неполярная связь образуется парой электронов, которая расположена между атомами и не смещена ни к одному из них. Именно так построены двухатомные молекулы газов. А как образуются молекулы других веществ, например, воды или углекислого газа, которые состоят из разных атомов? Это мы обсудим здесь.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
просто и понятно о ее значении в химии
Определение и характеристикаОпределение и характеристика
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.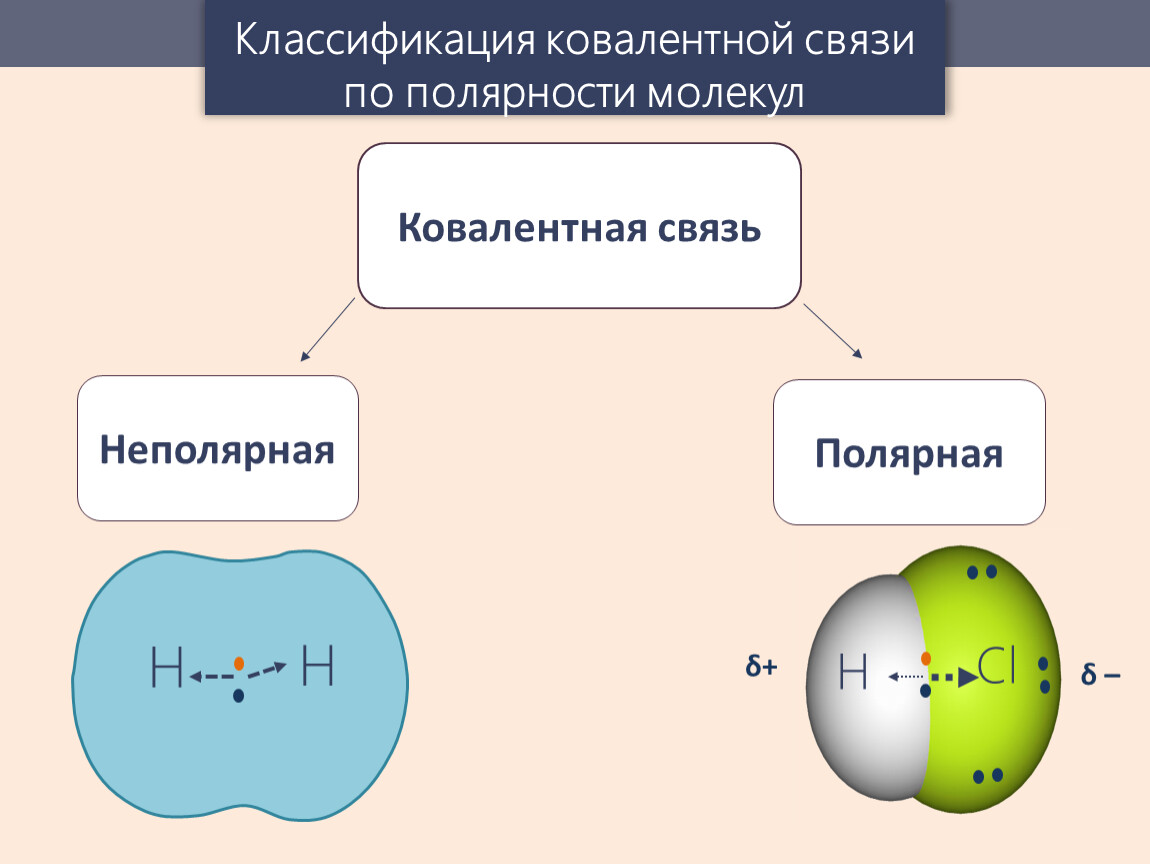
Типы связи
В целом есть два типа ковалентной связи:
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Неполярная связь
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Полярная связь
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Covalent Bond.
ковалентная неполярная — Справочник химика 21
Приведите примеры, когда один и тот же элемент может образовывать различные виды химической связи ионную, ковалентную полярную и ковалентную неполярную, [c.45] На электронных схемах пару точек, изображающих электроны, при помощи которых осуществляется химическая связь, принято располагать либо посередине между символами атомов, либо ближе к одному из них, в зависимости от того, идет ли речь о ковалентной неполярной или полярной связи или о ионной связи.
Ковалентная неполярная связь возникает между атомами одного элемента, например N5, Н2, СЬ, О2. Связь эта образуется при взаимодействии (перекрывании) электронных облаков, происходящем при сближении атомов, обладающих электронами с противоположно направленными спинами , При этом происходит образование общей пары электронов (спаривание) по следующей схеме [c.104]
Одной из важных характеристик ковалентной связи н широком понимании этого определения, т. е, ковалентно-неполярной и ковалентно-полярной, является прочность связи, которая оценивается энергией, необходимой для ее разрыва. [c.49]
Алмаз представляет собой чрезвычайно твердые, в чистом состоянии бесцветные, абсолютно прозрачные кристаллы, сильно преломляющие свет. Плотность алмаза 3,51 г/см . Углеродные атомы в кристаллах алмаза связаны ковалентными неполярными связями, правильно ориентированными в пространстве. Каждый атом углерода связан [c.83]
Каждый атом углерода связан [c.83]
В молекулах углеводородов все связи ковалентные неполярные, поэтому атомы водорода не могут быть замещены на атомы металла. [c.222]
Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления. Причины различной растворимости веществ пока не выяснены, хотя их связывают с характером взаимодействия молекул растворителя и растворенного вещества. Например, известно, что молекулярные кристаллы, структурными единицами которых являются молекулы с ковалентным неполярным типом связи (сера и др.), практически нерастворимы в воде, так как энергия разрушения кристаллической решетки настолько велика, что не может быть компенсирована теплотой сольватации, которая очень мала. [c.63]
Можно ли считать, что ковалентная неполярная связь характерна только для газообразных веществ, состоящих из одиночных молекул (нет) [c.102]
Ковалентная связь, образованная атомами с одинаковой электроотрицательностью, является неполярной. При ковалентной неполярной связи электронная плотность общей пары электронов распределяется в пространстве симметрично относительно ядер обоих атомов. [c.64]
При ковалентной неполярной связи электронная плотность общей пары электронов распределяется в пространстве симметрично относительно ядер обоих атомов. [c.64]
Пели вещество состоит из атомов одного химического элемента (неметалла), то электроотрицательности всех атомов, очевидно, одинаковы. Связь ковалентная неполярная. [c.68]
Какой тип химической связи характерен для простого вещества кремния (ковалентная неполярная связь) [c.102]
Кадры диафильма позволяют понять механизм образования ковалентной неполярной связи при образовании молекулы водорода, показывают, что при сближении атомов водорода происходит перекрывание их электронных облаков. При этом электроны обобществляются между двумя ядерными центрами и возникает молекулярное электронное облако. В диафильме показана как символическая схема, так и перекрывание электронных облаков. [c.124]
По электроотрицательности азот уступает лишь кислороду и фтору, 1Ю-этому только в связях с атомами О и Р атом N поляризован положительно.
 Соединения с хлором, бромом и некоторыми другими элементами близки к ковалентным неполярным. В соединениях с остальными элементами азот имеет отрицательный эф ктивный заряд. [c.397]
Соединения с хлором, бромом и некоторыми другими элементами близки к ковалентным неполярным. В соединениях с остальными элементами азот имеет отрицательный эф ктивный заряд. [c.397]Связь между частицами простого вещества Металлическая (катионно-электронная) Ковалентная неполярная [c.301]
Однако и в этом нитрате, как и в Hg(NOз)2, ртуть находится в степени окисления -] 2, образуя радикал Нд2 с ковалентной неполярной связью меж- 2. Зависимость ско- [c.337]
Как образуется ковалентная неполярная связь в молекуле хлора [c.64]
Ковалентная неполярная связь. При соединении атомов с одинаковыми электроотрицательностями образуются молекулы с ковалентной неполярной связью. Вспомним, что такая связь, например, существует в молекулах газообразных веществ, состоящих из одинаковых атомов Нг, Рг, СЬ, Ог, N2. В этих случаях химические связи образуются за счет общих электронных пар, т. е. при перекрывании соответствующих электронных облаков, обусловленном электронно-ядерным взаимодействием, которое осуществляется при сближении атомов. [c.73]
[c.73]
Ковалентная неполярная связь в чистом виде может возникать только между одинаковыми атомами за счет объединения электронов с различными спинами в электронные пары, число которых определяет количество связей в молекуле. Однако понятие ковалентной неполярной связи можно распространить и на объединение различных атомов, если они сходны между собой по электроотрицательности (ЭО). [c.70]
В окислительно-восстановительных процессах с участием пероксидов степени окисления атомов кислорода изменяются сложно, так как ковалентные неполярные связи между атомами кислорода переходят в ковалентно-полярные или даже ионные. Расчет коэффициентов лучше вести по следующей схеме [c.294]
Рассмотрим последовательность составления электронных формул веществ с ковалентной неполярной связью (на примере молекулы азота N2). [c.73]
Так как между полярными молекулами также существуют силы электростатического притяжения, то температуры плавления и кипения этих соединений гораздо выше, чем у веществ с ковалентной неполярной связью. [c.74]
[c.74]
Между атомами могут возникать различные взаимодействия в зависимости от их физико-химических характеристик, а главным образом от значений электроотрицательности (ЭО), определяющей ориентировку электронов относительно атомов, уже вошедших в состав молекулы. Основными видами связи можно считать связи, устанавливающиеся между атомами, вступающими в соединение между собой а) ковалентная неполярная связь б) ковалентная полярная и в) ионная связь. К основным видам связи следует отнести и металлическую связь, однако она характерна не для замкнутых молекул, а для кристаллов металлического типа. Вообще говоря, ионная связь также характерна для кристаллического состояния веществ. [c.70]
КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ [c.70]
Возникновение и особенности ковалентной неполярной связи рассмотрим на примере строения самой простой молекулы — молекулы водорода. При сближении [c.71]
Рассмотренными тремя основными видами химической связи (ковалентная неполярная, ковалентная полярная и ионная) далеко не [c. 85]
85]
Атомные решетки построены из атомов, связанных между собой ковалентными неполярными связями. Эти химические связи определяют геометрию кристаллов и энергию кристаллической решетки, которая характеризует прочность и устойчивость данного кристалла. Так как строение атома периодично, то, казалось бы, и строение кристаллов тоже должно быть периодичным, но это выполняется не строго, поскольку атомы могут перестраивать свои орбитали при различных степенях возбуждения и таким образом изменять свои химические связи. Это ведет к образованию различных форм кристаллов — полиморфизму или аллотропическим модификациям у данного элемента. У его электронных аналогов, находящихся в разных периодах, возможно возникновение других форм связи за счет наличия другого числа свободных орбиталей. [c.103]
Металлические кристаллы отличаются от всех остальных кристаллов высокой пластичностью, электрической проводимостью и теплопроводностью. Эти свойства, а также и многие другие обусловлены особым видом связи между атомами металла — металлической связью. Она возникает между атомами металлов в результате их сближения за счет перекрытия внешних орбиталей. Эта связь не является ковалентной неполярной связью, так как электроны не фиксируются между двумя атомами, а переходят в состояние проводимости и могут принадлежать всем атомам данного кристалла и даже куска металла, содержащего громадное количество кристаллических зерен. Эти мигрирующие электроны, или обобщенные электроны, — электроны проводимости (свободные электроны или электронный газ) — и осуществляют ненаправленную связь между остовами атомов в кристаллической решетке металлов (подробнее о возникновении связи см. гл. 10). [c.108]
Она возникает между атомами металлов в результате их сближения за счет перекрытия внешних орбиталей. Эта связь не является ковалентной неполярной связью, так как электроны не фиксируются между двумя атомами, а переходят в состояние проводимости и могут принадлежать всем атомам данного кристалла и даже куска металла, содержащего громадное количество кристаллических зерен. Эти мигрирующие электроны, или обобщенные электроны, — электроны проводимости (свободные электроны или электронный газ) — и осуществляют ненаправленную связь между остовами атомов в кристаллической решетке металлов (подробнее о возникновении связи см. гл. 10). [c.108]
Остановимся еще на одном важном понятии — электроотрицательности (ЭО). Мерой ЭО по Малликену служит арифметическая сумма энергии ионизации / и сродства к электрону ЭО = / -Ь . Чаще пользуются относительной ЭО по Полингу ее обозначают X. Рассуждения Полинга таковы. В молекулах и Вг связи ковалентные неполярные. Если в молекуле АВ связь была бы тоже неполярная, то должно быть справедливо равенство [c. 82]
82]
Если подвергнем такому же исследованию растворы в воде веществ, в молекулах которых имеются лишь ковалентные неполярные или малополярные связи, например, растворы кислорода, спирта, сахара, то убедимся, что лампочка при погружении стержней прибора в такие растворы не засветится эти растворы не проводят электрический ток. [c.4]
При растворении в воде или расплавлении соединений с ковалентными неполярными или малополярными связями, например сахара, происходит только распад его кристаллов на отдельные молекулы, ионов не образуется, и раствор или расплав сахара тока не проводит. [c.6]
Для двухатомных молекул характер связи между атомами обусловливает и свойства самой молекул1>1. Так, утри образовании ковалентно-неполярных связей в молекулах, например типа Xj, общее электронное облако симметрично располагается между ядрами обоих атомов, центры тяжести гшложительных пада т 1Г м о м ё iff ы э л ект р и. ч е с к и х д и п олей таких связей й молекул в целом равны нулю. Такие молекулы называются неполярными. [c.52]
ч е с к и х д и п олей таких связей й молекул в целом равны нулю. Такие молекулы называются неполярными. [c.52]
Природа физико-химических взаимодействий в промывочных жидкостях определяется действующими межатомными и молекулярными силами. Эти силы, обусловленные расположением и движением в атомах и молекулах электрических зарядов и вследствие этого имеющие электрическую природу, определяют свойства и характер взаимодействия компонентов, которые содержатся в фазах промывочных жидкостей — минералов, воды, химических реагентов, газов и др. Несмотря на единую электрическую природу, эти силы различны, а потому отличаются и связи, возникающие при их взамодействии. В настоящее время различают пять основных форм связи ионную (гетеронолярную), ковалентную (неполярную или гомеополярную), водородную, металлическую и молекулярно-поляризационную, обусловленную силами Ван-дер-Ва-альса. [c.7]
П. Укажите тип связей атомов хлора в молекуле новэмбихина, 1) связанного с С-атшом. 2) несвязанного с С-атомом. а. Ионная б. Ковалентная неполярная в. Ковалентная полярная [c.238]
2) несвязанного с С-атомом. а. Ионная б. Ковалентная неполярная в. Ковалентная полярная [c.238]
Однако и в этом нитрате, как и в Hg(N0.ч)2, ртуть находится в двухвалентном состоянии, образуя радикал Hg с ковалентной неполярной связью между двумя атомами ртути ——Hg—. Аналогично существуют два хлорида ртути Hg l2, известный под названием сулема , и Hg2 l2 — под названием каломель . Соединения Hg2 в зависимости от условий могут быть восстановителями и окислителями. Например [c.308]
Алмаз — бесцветное кристаллическое вещество, самое твердое из всех природных веществ. Углеродные атомы в кристаллах алмаза находятся в состоянии 5р -гибриднзации (с. 47). Они связаны прочными ковалентными неполярными связями. Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлениях от центра тетраэдра к его вершинам при расстоянии между атомами 0,154 нм (рис. 4.1). Все это обусловливает исключительную твердость, значительную плотность (3,5 г/см ) и другие характерные свойства алмаза. Поэтому его широко применяют для резки стекла, бурения горных пород и шлифования особо твердых материалов. Алмаз плохо проводит теплоту и практически не проводит электрический ток. Образцы его в чистом виде- [c.127]
Поэтому его широко применяют для резки стекла, бурения горных пород и шлифования особо твердых материалов. Алмаз плохо проводит теплоту и практически не проводит электрический ток. Образцы его в чистом виде- [c.127]
Из курса химии VIII класса вам известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом возникают различного рода химические связи ионная, ковалентная (неполярная и полярная), металлическая и водородная. Вспомним, что один из существенных показателей, определяющих, какая связь образуется между атомами — ионная или ковалентная,— это электроотрицательность, т. е. способность атомов притягивать к себе электроны от других атомов. При этом следует учесть, что электроотрицательности атомов злементов изменяются постепенно. В периодах периодической системы слева направо численные значения электроотрицательностей возрастают, а в группах сверху вниз — уменьшаются. Так как тип связи зависит от разности значений электроотрицательностей соединяющихся атомов элементов, то провести резкую границу между отдельными типами химической связи нельзя. В зависимости от того, к какому из предельных случаев химическая связь ближе по своему характеру, ее относят к ионной или ковалентной полярной. [c.72]
В зависимости от того, к какому из предельных случаев химическая связь ближе по своему характеру, ее относят к ионной или ковалентной полярной. [c.72]
Большое количество информации, получаемой экспериментальным путем с помошью новых методов исследования строения ве-шестяа (молекулярные спектры, ядерный магнитный резонанс, электронный парамагнитный резонанс, дифракция электронов и т. д.) позволяет уточнять существующие теории и расчеты. Даже в простых молекулах, построенных за счет ковалентной неполярной связи, иногда получается несовпадение теории с экспериментом. Примером может служить молекула О2 (см. табл. 3.2), для объяснения парамагнетизма которой приходится допустить или наличие трехэлектронной связи за счет взаимодействия электронов неподеленных электронных пар, или миграцию электронов с одной р-орбиталн на другую, так чтобы в каждый момент в молекуле кислорода имелись непарные электроны, создающие магнитный момент. [c.86]
ковалентная связь (неполярная и полярная)
Примеры веществ: О2, O3, N2, F2, Cl2, Br2, I2
Примеры веществ: H2O, NH3, бинарные соединения и оксиды неметаллов, кислоты, органические вещества.
|
Химическая связь — основные виды, типы и характеристики
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара.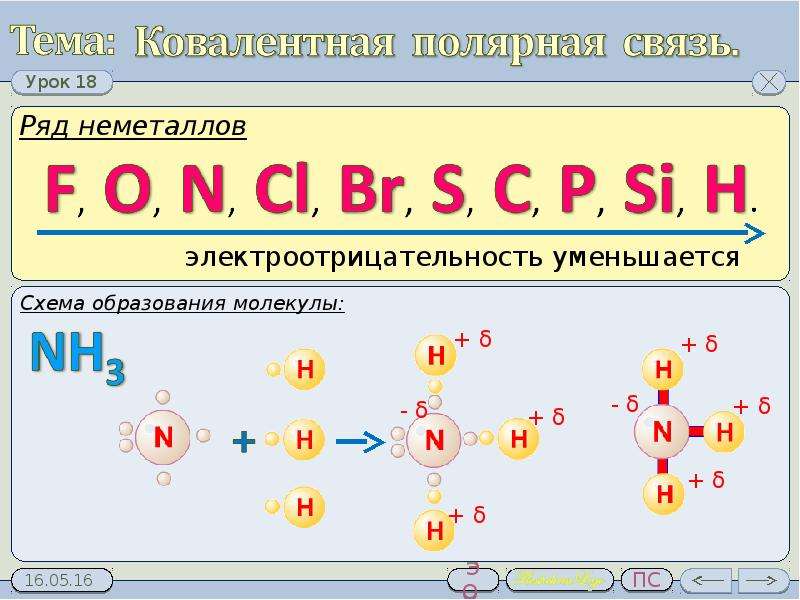 Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.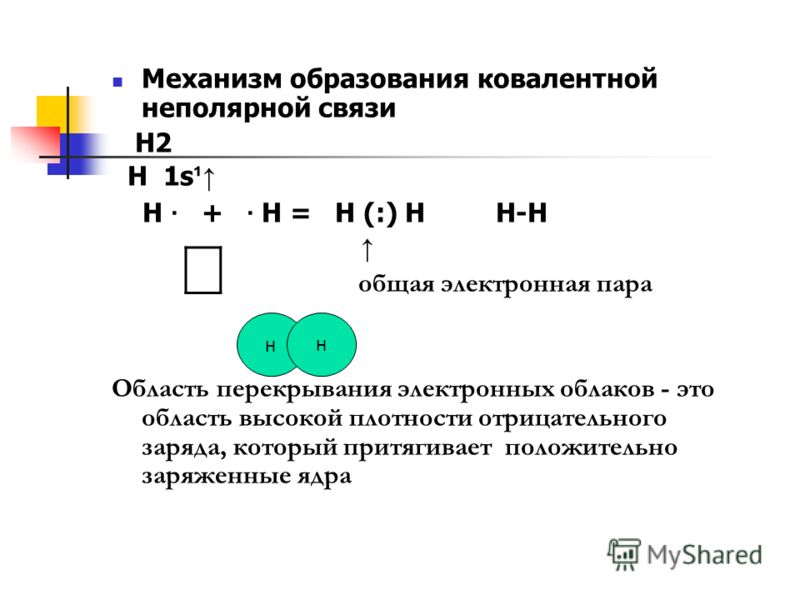
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.

Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.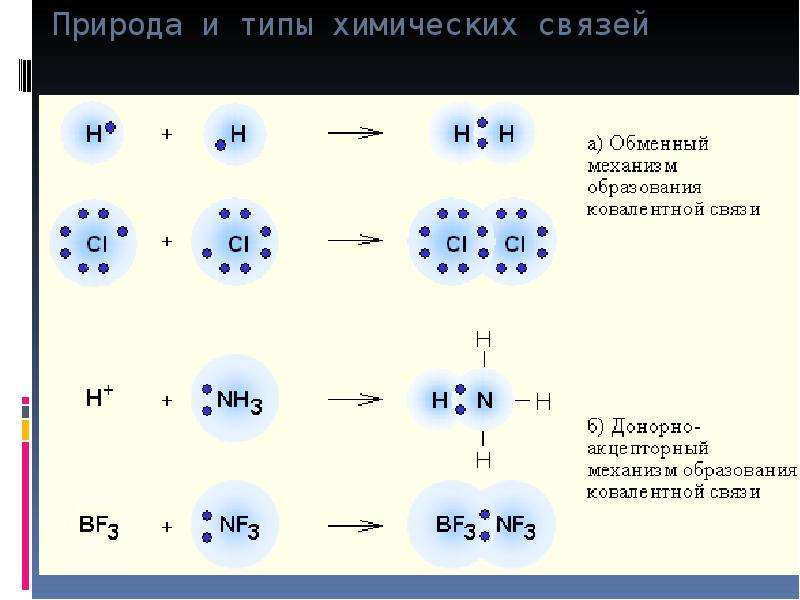
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Ковалентная связь | Ионная связь |
|---|---|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
ненаправленность,
делокализованный характер,
многоэлектронность.
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Полярные и неполярные ковалентные связи: определения и примеры — видео и стенограмма урока
Полярные ковалентные связи
Вы когда-нибудь видели, как двое детей играют, и один ребенок ведет себя как хулиган по отношению к другому ребенку? Ребенок-хулиган, кажется, проводит больше времени, играя с игрушкой, чем другой ребенок. Они не одинаково делятся игрушками.
Они не одинаково делятся игрушками.
Это неравное разделение также происходит с типом связи, называемым полярной ковалентной связью. Полярная ковалентная связь — это тип химической связи, при которой пара электронов неравномерно распределяется между двумя атомами.В полярной ковалентной связи электроны не разделены поровну, потому что один атом проводит с электронами больше времени, чем другой. В полярных ковалентных связях один атом имеет более сильное притяжение, чем другой атом, и притягивает электроны. Помните, как электроны несут отрицательный заряд? Что ж, когда электроны проводят больше времени с одним атомом, это заставляет этот атом нести частичный отрицательный заряд. Атом, который не проводит столько времени с электронами, несет частичный положительный заряд. Чтобы вспомнить полярную ковалентную связь, вместо этого скажите «ковалентный пуллер» и помните, что один атом «притягивает» электроны больше, чем другой.
На самом деле ваша жизнь зависит от полярных ковалентных связей. Вы ведь пьете воду? Молекула воды, сокращенно h3O, является примером полярной ковалентной связи. Электроны распределяются неравномерно: атом кислорода проводит с электронами больше времени, чем атомы водорода. Поскольку электроны проводят больше времени с атомом кислорода, он несет частично отрицательный заряд.
Другой пример полярной ковалентной связи — между водородом и атомом хлора. В этой связи атом хлора проводит с электронами больше времени, чем атом водорода. Из-за этого неравного распределения электронов атом хлора несет частичный отрицательный заряд, а атом водорода несет частичный положительный заряд.
Как предсказать тип связи с помощью электроотрицательности
Вам может быть интересно: как узнать, какой тип связи будет возникать между атомами? Вы можете предсказать, какой тип связи образуется, глядя на электроотрицательность каждого атома, участвующего в связи. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи. Некоторые атомы имеют более высокую электроотрицательность, а другие — более низкую. Электроотрицательность похожа на перетягивание каната между двумя атомами. Если у вас есть один человек на стороне веревки, которая сильнее другого, то этот более сильный человек будет тянуть сильнее, таща другого человека в своем направлении. С другой стороны, если бы у вас было два человека равной силы, тогда веревка не смещалась бы ни в одном направлении и оставалась бы в одном и том же месте.
Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи. Некоторые атомы имеют более высокую электроотрицательность, а другие — более низкую. Электроотрицательность похожа на перетягивание каната между двумя атомами. Если у вас есть один человек на стороне веревки, которая сильнее другого, то этот более сильный человек будет тянуть сильнее, таща другого человека в своем направлении. С другой стороны, если бы у вас было два человека равной силы, тогда веревка не смещалась бы ни в одном направлении и оставалась бы в одном и том же месте.
Как в перетягивании каната, если у вас есть более сильный атом с более высокой электроотрицательностью, он сможет тянуть электроны в своем направлении. Поскольку атомы имеют разную электроотрицательность, электроны распределяются неравномерно. С другой стороны, если у вас есть два атома с одинаковой силой или одинаковой электроотрицательностью, то электроны не будут тянуться в каком-либо одном направлении и останутся посередине двух атомов.Поскольку тяги нет, электроны распределяются между двумя атомами поровну.
С другой стороны, если у вас есть два атома с одинаковой силой или одинаковой электроотрицательностью, то электроны не будут тянуться в каком-либо одном направлении и останутся посередине двух атомов.Поскольку тяги нет, электроны распределяются между двумя атомами поровну.
Помните, как периодическая таблица Менделеева похожа на дорожную карту, которая может рассказать вам свойства каждого элемента? Дополнительная тенденция, которую может определить периодическая таблица Менделеева, — это электроотрицательность элемента. Прежде чем я опишу тенденцию, сначала вспомните, что водород считается неметаллом и перемещается в крайнее правое положение вместе с другими неметаллами. Тенденция электроотрицательности, которую я собираюсь описать, не включает благородные газы и большинство переходных металлов.Помните, благородные газы расположены в последнем столбце периодической таблицы, а переходные металлы расположены в группах с 3 по 12 периодической таблицы. Теперь, когда вы знаете исключения, основная тенденция заключается в том, что при движении слева направо электроотрицательность увеличивается, а при движении снизу вверх электроотрицательность увеличивается.
Используя эту тенденцию, вы можете увидеть, что в правом верхнем углу находятся наиболее электроотрицательные элементы, такие как кислород, хлор и фтор. И наименее электроотрицательные элементы находятся в нижнем левом углу, такие как франций, цезий, барий и радий.
Теперь, когда вы знаете тенденции электроотрицательности периодической таблицы Менделеева, вы можете определить тип связи, которая будет образовываться в молекуле. Если электроотрицательность между двумя атомами в основном одинакова, образуется неполярная ковалентная связь . Например, два атома фтора имеют одинаковую электроотрицательность. Поскольку между двумя атомами нет разницы в электроотрицательности, они в равной степени будут разделять электроны, образуя неполярную ковалентную связь.
Если атомы расположены близко друг к другу в периодической таблице, они будут иметь немного другую электроотрицательность.Если разница в электроотрицательности между двумя атомами небольшая, то образуется полярная ковалентная связь . Эта небольшая разница в электроотрицательности заставляет один атом иметь более сильное притяжение электронов, чем другой атом. Это более сильное притяжение заставляет электроны распределяться неравномерно и проводить больше времени рядом с атомом с более высокой электроотрицательностью. Например, глядя на атомы, входящие в состав молекулы воды, вы можете увидеть, что атомы водорода и кислорода расположены довольно близко в периодической таблице.Поскольку они расположены довольно близко друг к другу, разница в электроотрицательности будет незначительной. Атом кислорода имеет более высокую электроотрицательность, чем атомы водорода, поэтому электроны проводят больше времени вокруг кислорода.
Эта небольшая разница в электроотрицательности заставляет один атом иметь более сильное притяжение электронов, чем другой атом. Это более сильное притяжение заставляет электроны распределяться неравномерно и проводить больше времени рядом с атомом с более высокой электроотрицательностью. Например, глядя на атомы, входящие в состав молекулы воды, вы можете увидеть, что атомы водорода и кислорода расположены довольно близко в периодической таблице.Поскольку они расположены довольно близко друг к другу, разница в электроотрицательности будет незначительной. Атом кислорода имеет более высокую электроотрицательность, чем атомы водорода, поэтому электроны проводят больше времени вокруг кислорода.
Краткое содержание урока
В этом уроке вы узнали о двух типах связей: неполярных ковалентных и полярных ковалентных. Неполярные ковалентные связи — это тип химической связи, при которой два атома разделяют пару электронов друг с другом. Полярная ковалентная связь — это тип химической связи, при которой пара электронов неравномерно распределяется между двумя атомами. Вы также узнали, как можно посмотреть на тенденции электроотрицательности периодической таблицы, чтобы предсказать тип связи, которая будет образовываться. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи.
Вы также узнали, как можно посмотреть на тенденции электроотрицательности периодической таблицы, чтобы предсказать тип связи, которая будет образовываться. Электроотрицательность — это то, насколько сильно атом будет притягивать электроны от другого атома в химической связи.
Глядя на таблицу Менделеева, при движении слева направо электроотрицательность увеличивается, а при движении снизу вверх электроотрицательность увеличивается. Используя эту тенденцию, вы можете увидеть, что в правом верхнем углу находятся наиболее электроотрицательные элементы, такие как кислород, хлор и фтор.И наименее электроотрицательные элементы находятся в нижнем левом углу, такие как франций, цезий, барий и радий. Если электроотрицательность двух атомов в основном одинакова, образуется неполярная ковалентная связь, а если электроотрицательность немного отличается, образуется полярная ковалентная связь.
Результаты обучения
После этого урока вы сможете:
- различать неполярные и полярные ковалентные связи
- Приведите примеры каждого типа облигации
- Объясните, что такое пептидная связь.

- Определить электроотрицательность
- Объясните, как предсказать, образуется ли неполярная ковалентная связь или полярная ковалентная связь, используя тенденции электроотрицательности периодической таблицы.
Polar vs.Неполярный
Полярный vs. неполярный В зависимости от относительной электроотрицательности двух атомов, разделяющих электроны, может происходить частичный перенос электронной плотности от одного атома к другому. Когда электроотрицательности не равны, электроны не распределяются поровну и возникают частичные ионные заряды.Чем больше разница электроотрицательностей, тем более ионная связь. Частично ионные связи называются полярными ковалентными связями .
Неполярные ковалентные связи с равным распределением электронов связи возникают, когда электроотрицательности двух атомов равны.
Полярные и неполярные ковалентные связи- Связь между двумя атомами неметалла, имеющими одинаковые электроотрицательность и, следовательно, имеют равное распределение связывающего электрона пара
- Пример: в H-H каждый атом H имеет электроотрицательность.
 значение 2,1, поэтому ковалентная связь между ними считается неполярной
значение 2,1, поэтому ковалентная связь между ними считается неполярной
Полярная ковалентная связь
- Связь между двумя атомами неметалла, имеющими разные электроотрицательности и, следовательно, неравномерное распределение связывающего электрона пара
- Пример: в H-Cl электроотрицательность Cl атом равен 3.0, а атома H — 2,1
- В результате получается связь, в которой электронная пара смещается. к более электроотрицательному атому. Тогда этот атом получает частично отрицательный заряд, в то время как менее электроотрицательный атом имеет частично положительный заряд. разделение заряда или диполь связи можно проиллюстрировать с помощью стрелка, направленная в сторону более электроотрицательного атома.
Греческая буква дельта означает «частично».
- Внутри молекулы каждая полярная связь имеет диполь связи
- Полярная молекула всегда содержит полярные связи, но
некоторые молекулы с полярными связями неполярны.

Полярный Молекула
- Молекула, в которой присутствующие диполи связи не компенсируют друг друга и, таким образом, получают молекулярный диполь . (см. ниже) . Отмена зависит от формы молекулы или стереохимии. и ориентация полярных связей.
Молекулярный диполь
- Результат диполей связи в молекуле.
- Связанные диполи могут или не могут аннулировать, тем самым производя либо неполярные молекулы, если они сокращаются, либо полярные, если они не отменить
- Примеры:
- CO 2 представляет собой линейную молекулу с 2 равные и противоположно направленные диполи связи, поэтому связь полярности отменяются, и молекула неполярна.
- HCN представляет собой линейную молекулу с двумя диполями связей, расположенными в одном направлении. и не равны, поэтому полярности связей не сокращаются и молекула полярный
- Больше примеров можно найти в Таблице: Стереохимия.
 некоторых общих молекул
некоторых общих молекул
- Для фигурных диаграмм:
- Сплошные линии представляют облигации, которые находятся в той же . самолет как у страницы
- Пунктирными линиями обозначены облигации, которые направлены с на . Самолет страницы
- Клин указывает облигации, которые направлены на штук. самолет ст.
- При определении формы молекул электронные пары кратного облигации считаются группой, поскольку все сформированные облигации имеют одинаковое направление
НАЗАД НА ГЛАВНУЮ СТРАНИЦУ
4.4: Полярные и неполярные ковалентные связи
Электроотрицательность и полярность связи
Хотя мы определили ковалентную связь как разделение электронов, электроны в ковалентной связи не всегда одинаково распределяются между двумя связанными атомами. Если связь не соединяет два атома одного и того же элемента, всегда будет один атом, который притягивает электроны в связи сильнее, чем другой атом, как показано на рисунке \ (\ PageIndex {1} \). Когда возникает такой дисбаланс, возникает накопление некоторого отрицательного заряда (называемого частичным отрицательным зарядом и обозначенного δ-) на одной стороне связи и некоторого положительного заряда (обозначенного δ +) на другой стороне связи.Ковалентная связь с неравномерным распределением электронов, как показано в части (b) рисунка \ (\ PageIndex {1} \), называется полярной ковалентной связью. Ковалентная связь с равным распределением электронов (часть (а) на рисунке \ (\ PageIndex {1} \)) называется неполярной ковалентной связью.
Когда возникает такой дисбаланс, возникает накопление некоторого отрицательного заряда (называемого частичным отрицательным зарядом и обозначенного δ-) на одной стороне связи и некоторого положительного заряда (обозначенного δ +) на другой стороне связи.Ковалентная связь с неравномерным распределением электронов, как показано в части (b) рисунка \ (\ PageIndex {1} \), называется полярной ковалентной связью. Ковалентная связь с равным распределением электронов (часть (а) на рисунке \ (\ PageIndex {1} \)) называется неполярной ковалентной связью.
Рисунок \ (\ PageIndex {1} \) Полярные и неполярные ковалентные связи. (а) Электроны в ковалентной связи в равной степени разделяются обоими атомами водорода. Это неполярная ковалентная связь. (б) Атом фтора притягивает электроны в связи больше, чем атом водорода, что приводит к дисбалансу в распределении электронов.Это полярная ковалентная связь.
Любая ковалентная связь между атомами разных элементов является полярной связью, но степень полярности сильно различается.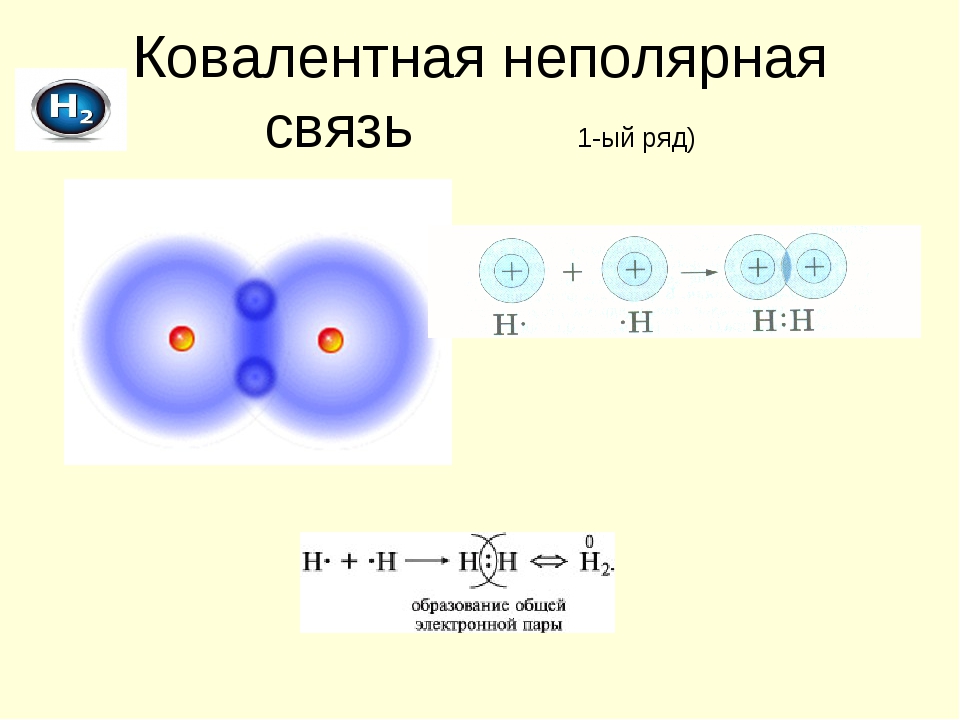 Некоторые связи между различными элементами только минимально полярны, в то время как другие сильно полярны. Ионные связи можно считать предельной полярностью, когда электроны передаются, а не разделяются. Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность, которая является относительной мерой того, насколько сильно атом притягивает электроны, когда он образует ковалентную связь.Существуют различные числовые шкалы для оценки электроотрицательности. На рисунке \ (\ PageIndex {2} \) показана одна из самых популярных — шкала Полинга. О полярности ковалентной связи можно судить, определив разницу в электроотрицательностях двух атомов, образующих связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс в распределении электронов в связи. Хотя нет никаких жестких правил, общее правило состоит в том, что разница в электроотрицательностях меньше примерно 0.4 связь считается неполярной; если разница больше 0,4, связь считается полярной.
Некоторые связи между различными элементами только минимально полярны, в то время как другие сильно полярны. Ионные связи можно считать предельной полярностью, когда электроны передаются, а не разделяются. Чтобы судить об относительной полярности ковалентной связи, химики используют электроотрицательность, которая является относительной мерой того, насколько сильно атом притягивает электроны, когда он образует ковалентную связь.Существуют различные числовые шкалы для оценки электроотрицательности. На рисунке \ (\ PageIndex {2} \) показана одна из самых популярных — шкала Полинга. О полярности ковалентной связи можно судить, определив разницу в электроотрицательностях двух атомов, образующих связь. Чем больше разница в электроотрицательностях, тем больше дисбаланс в распределении электронов в связи. Хотя нет никаких жестких правил, общее правило состоит в том, что разница в электроотрицательностях меньше примерно 0.4 связь считается неполярной; если разница больше 0,4, связь считается полярной. Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Разность электроотрицательностей, равная нулю, конечно же, указывает на неполярную ковалентную связь.
Если разница в электроотрицательностях достаточно велика (обычно больше примерно 1,8), полученное соединение считается ионным, а не ковалентным. Разность электроотрицательностей, равная нулю, конечно же, указывает на неполярную ковалентную связь.
Рисунок \ (\ PageIndex {2} \) Электроотрицательность различных элементов. Популярная шкала электроотрицательностей имеет значение для атомов фтора, равное 4.0, максимальное значение.
Пример \ (\ PageIndex {1} \)
Опишите разницу электроотрицательностей между каждой парой атомов и результирующую полярность (или тип связи).
- C и H
- H и H
- Na и Cl
- O и H
Раствор
- Углерод имеет электроотрицательность 2,5, а водород — 2,1. Разница составляет 0,4, что довольно мало. Поэтому связь C – H считается неполярной.
- Оба атома водорода имеют одинаковое значение электроотрицательности — 2,1.
 Разница равна нулю, значит связь неполярная.
Разница равна нулю, значит связь неполярная. - Электроотрицательность натрия составляет 0,9, а хлора — 3,0. Разница составляет 2,1, что довольно велико, поэтому натрий и хлор образуют ионное соединение.
- При 2,1 для водорода и 3,5 для кислорода разница электроотрицательностей составляет 1,4. Мы ожидаем очень полярной связи, но не настолько полярной, чтобы связь O – H считалась ионной.
Упражнение
Опишите разницу электроотрицательностей между каждой парой атомов и результирующую полярность (или тип связи).
- C и O
- N и H
- N и N
- C и F
Когда связи молекулы полярны, молекула в целом может демонстрировать неравномерное распределение заряда в зависимости от того, как ориентированы отдельные связи. Например, ориентация двух связей O – H в молекуле воды (рис. \ (\ PageIndex {3} \)) изогнута: один конец молекулы имеет частично положительный заряд, а другой конец — частично отрицательный. обвинение. Короче говоря, сама молекула полярна.Полярность воды оказывает огромное влияние на ее физические и химические свойства. (Например, температура кипения воды [100 ° C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C = O в диоксиде углерода являются полярные, они лежат прямо напротив друг друга и, таким образом, нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа.(Например, углекислый газ превращается в газ при -77 ° C, что почти на 200 ° ниже, чем температура, при которой закипает вода.)
обвинение. Короче говоря, сама молекула полярна.Полярность воды оказывает огромное влияние на ее физические и химические свойства. (Например, температура кипения воды [100 ° C] высока для такой маленькой молекулы и связана с тем, что полярные молекулы сильно притягиваются друг к другу.) Напротив, в то время как две связи C = O в диоксиде углерода являются полярные, они лежат прямо напротив друг друга и, таким образом, нейтрализуют эффекты друг друга. Таким образом, молекулы углекислого газа в целом неполярны. Отсутствие полярности влияет на некоторые свойства углекислого газа.(Например, углекислый газ превращается в газ при -77 ° C, что почти на 200 ° ниже, чем температура, при которой закипает вода.)
Рисунок \ (\ PageIndex {3} \) Физические свойства и полярность. На физические свойства воды и углекислого газа влияет их полярность.
Упражнения по обзору концепции
На что указывает электроотрицательность атома?
Какой тип связи образуется между двумя атомами, если разница в электроотрицательности мала? Середина? Большой?
ответы
Электроотрицательность — это качественная мера того, насколько атом притягивает электроны ковалентной связью.

Ключевые выводы
- Ковалентные связи между разными атомами имеют разную длину связи.
- Ковалентные связи могут быть полярными или неполярными, в зависимости от разницы электроотрицательностей между задействованными атомами.
Авторы и авторство
Типы ковалентных связей: полярные и неполярные
Электроны по-разному разделяются на ионные и ковалентные связи. Ковалентные связи могут быть неполярными или полярными и реагировать на электростатические заряды.
Ионные связи , как и в поваренной соли (NaCl), возникают из-за электростатических сил притяжения между положительно заряженными (Na +) и отрицательно заряженными (Cl-) ионами. Во втором блоке мы сравнили атомы со щенками и электроны с костями, аналогично тому, как работает связь. При ионной связи каждый щенок начинается с электронной кости, но один щенок действует как вор и крадет кость другого щенка (см. Рис. 3-1a). Теперь у одного щенка две электронные кости, а у одного — нет. Поскольку электронные кости в нашей аналогии имеют отрицательный заряд, щенок-вор получает отрицательный заряд из-за дополнительной кости.Щенок, потерявший электронную кость, заряжается положительно. Поскольку у щенка, потерявшего свою кость, заряд противоположен щенку-воришке, щенки удерживаются вместе за счет электростатических сил, как ионы натрия и хлора!
Рис. 3-1a). Теперь у одного щенка две электронные кости, а у одного — нет. Поскольку электронные кости в нашей аналогии имеют отрицательный заряд, щенок-вор получает отрицательный заряд из-за дополнительной кости.Щенок, потерявший электронную кость, заряжается положительно. Поскольку у щенка, потерявшего свою кость, заряд противоположен щенку-воришке, щенки удерживаются вместе за счет электростатических сил, как ионы натрия и хлора!
В ковалентных связях , как и газообразный хлор (Cl2), оба атома делятся друг с другом электронами и прочно удерживаются на них. В нашей аналогии каждый щенок снова начинается с электронной кости. Однако вместо того, чтобы один щенок украл кость у другого, оба щенка держатся за обе кости (см. Рис.3-1b).
Некоторые ковалентно связанные молекулы, такие как газообразный хлор (Cl2), в равной степени разделяют свои электроны (как два одинаково сильных щенка, каждый из которых держит обе кости). Другие ковалентно связанные молекулы, такие как газообразный фтороводород (HF), не разделяют электроны поровну. Атом фтора действует как немного более сильный щенок, который немного сильнее притягивает общие электроны (см. Рис. 3-1c). Несмотря на то, что электроны во фтористом водороде являются общими, фторсодержащая сторона молекулы воды сильнее притягивает отрицательно заряженные общие электроны и становится отрицательно заряженной.Атом водорода имеет небольшой положительный заряд, потому что он не может так крепко держаться за отрицательные электронные кости. Ковалентные молекулы с таким типом неравномерного распределения заряда имеют полярность и полярность . Молекулы с полярными ковалентными связями имеют положительную и отрицательную стороны.
Атом фтора действует как немного более сильный щенок, который немного сильнее притягивает общие электроны (см. Рис. 3-1c). Несмотря на то, что электроны во фтористом водороде являются общими, фторсодержащая сторона молекулы воды сильнее притягивает отрицательно заряженные общие электроны и становится отрицательно заряженной.Атом водорода имеет небольшой положительный заряд, потому что он не может так крепко держаться за отрицательные электронные кости. Ковалентные молекулы с таким типом неравномерного распределения заряда имеют полярность и полярность . Молекулы с полярными ковалентными связями имеют положительную и отрицательную стороны.
Рис. 3-1: Бондинг на примере щенка. В этой аналогии каждый щенок представляет собой атом, а каждая кость представляет собой электрон.
Вода — полярная ковалентная молекула
Вода (h3O), как и фтористый водород (HF), представляет собой полярную ковалентную молекулу. Если вы посмотрите на диаграмму воды (см. Рис. 3-2), вы увидите, что два атома водорода неравномерно распределены вокруг атома кислорода. Неравное распределение электронов между атомами и несимметричная форма молекулы означает, что молекула воды имеет два полюса — положительный заряд на водородном полюсе (сбоку) и отрицательный заряд на кислородном полюсе (сбоку). Мы говорим, что молекула воды электрически полярна.
Если вы посмотрите на диаграмму воды (см. Рис. 3-2), вы увидите, что два атома водорода неравномерно распределены вокруг атома кислорода. Неравное распределение электронов между атомами и несимметричная форма молекулы означает, что молекула воды имеет два полюса — положительный заряд на водородном полюсе (сбоку) и отрицательный заряд на кислородном полюсе (сбоку). Мы говорим, что молекула воды электрически полярна.
Рис. 3-2: Различные способы представления полярного распределения электронов в молекуле воды.Каждая диаграмма показывает несимметричную форму молекулы воды. На (а) и (б) полярные ковалентные связи показаны линиями. В части (c) полярные ковалентные связи показаны в виде электронных точек, общих для атомов кислорода и водорода. В части (d) диаграмма показывает относительный размер атомов, а связи представлены касанием атомов.
Деятельность
Полярная ковалентная связь водорода и кислорода в воде приводит к интересному поведению, su
Ориентация молекулы
Вода притягивается положительными и отрицательными электростатическими силами, потому что жидкие полярные молекулы ковалентной воды могут перемещаться, чтобы они могли ориентироваться в присутствии электростатической силы. (см. рис. 3-4).
(см. рис. 3-4).Эти силы можно увидеть на следующем видео:
Хотя мы не можем видеть отдельные молекулы, мы можем сделать вывод из наших наблюдений, что в присутствии отрицательного заряда молекулы воды поворачиваются так, что их положительные полюса водорода обращены к отрицательно заряженному объекту. То же самое было бы верно в присутствии положительно заряженного объекта; молекулы воды поворачиваются так, что отрицательные полюса кислорода обращены к положительному объекту.См. Рис. 3-5 для интерпретации художника.Симметрия и асимметрия
Помните, что в полярной молекуле притяжение одного атома сильнее, чем другого. Полярные ковалентные молекулы существуют всякий раз, когда существует асимметрия или неравномерное распределение электронов в молекуле. Один или несколько из этих асимметричных атомов притягивают электроны сильнее, чем другие атомы. Например, у полярного соединения метилового спирта отрицательный полюс состоит из углерода и водорода, а положительный — из кислорода и водорода (см.рис.3-6).
Например, у полярного соединения метилового спирта отрицательный полюс состоит из углерода и водорода, а положительный — из кислорода и водорода (см.рис.3-6).
 См. Рис. 3-6 для примеров полярных и неполярных молекул.
См. Рис. 3-6 для примеров полярных и неполярных молекул.Полярная ковалентная связь — обзор
9.35.5.2.4 Ковалентные твердые вещества
В хорошем первом приближении и с правдоподобными результатами соединения, образующие полярные ковалентные связи, часто можно успешно описать с помощью ионных эмпирических потенциалов.Это особенно верно до тех пор, пока локальные координационные полиэдры анионов, которые окружают отдельные катионы, высокосимметричны, а общее распределение заряда в твердом теле приблизительно изотропно. В таком случае ковалентные и ионные модели во многих случаях создают один и тот же набор кандидатов в низкоэнергетические структуры, только с некоторыми разными ранжированием энергии в более высоких минимумах и, возможно, разными энергетическими барьерами между минимумами. Однако это не относится к системам, в которых важные локальные минимумы демонстрируют различные виды анизотропных связей, например, sp 2 — и sp 3 -гибридизированные атомы углерода, и затем необходимо выполнить глобальную оптимизацию ab initio энергетический ландшафт.
Например, в нитриде бора присутствует несколько видов, в основном ковалентных, вкладов в общую энергию, и глобальный поиск должен выполняться на уровне ab initio. Система BN особенно интересна как тестовая система, потому что экспериментально наблюдаемые модификации включают как слоистые структуры (гексагональный BN), так и трехмерные сети (типа вюрцита и сфалерита). При глобальной оптимизации, использующей как функционалы Хартри – Фока, так и функционалы плотности, 247 действительно были обнаружены все экспериментально наблюдаемые типы структур.Кроме того, было предсказано несколько новых модификаций, таких как слоистые структуры, но с порядком наложения, отличным от экспериментально наблюдаемой структуры h-BN. Сила общего ландшафтного подхода была впечатляюще продемонстрирована открытием двух замечательных новых каркасных структур с низкими энергиями, демонстрирующих структуру β-BeO и частичную структуру Al в SrAl 2 , соответственно.
В другом недавнем исследовании использовалось сочетание интеллектуального анализа данных, генерации сети и локальной оптимизации с ab initio расчетами энергии (DFT) для предсказания кристаллических структур нитридов и фосфидов группы 14. 384 Важным шагом было создание новых кандидатов путем разумной замены атомов разных типов в известных базовых сетях, что привело к появлению множества интересных структур. Эта процедура в некоторой степени похожа на один из подходов, используемых для поиска кандидатов в кристаллы в системе Si 3 B 3 N 7 . 55
384 Важным шагом было создание новых кандидатов путем разумной замены атомов разных типов в известных базовых сетях, что привело к появлению множества интересных структур. Эта процедура в некоторой степени похожа на один из подходов, используемых для поиска кандидатов в кристаллы в системе Si 3 B 3 N 7 . 55
Прочие аспекты ковалентных облигаций
9.4 Другие аспекты ковалентных облигаций
Цели обучения
- Опишите неполярную связь и полярную связь.
- Используйте электроотрицательность, чтобы определить, будет ли связь между двумя элементами неполярной ковалентной, полярной ковалентной или ионной.
- Опишите энергию ковалентной связи.
Рассмотрим молекулу H 2 :
Поскольку ядра каждого атома H содержат протоны, электроны в связи притягиваются к ядрам (притягиваются противоположные заряды). Но поскольку два атома, участвующие в ковалентной связи, являются атомами H, каждое ядро притягивает электроны на одинаковую величину.Таким образом, электронная пара делится на два атома поровну. Равное распределение электронов в ковалентной связи называется неполярной ковалентной связью. Равное распределение электронов в ковалентной связи.
Но поскольку два атома, участвующие в ковалентной связи, являются атомами H, каждое ядро притягивает электроны на одинаковую величину.Таким образом, электронная пара делится на два атома поровну. Равное распределение электронов в ковалентной связи называется неполярной ковалентной связью. Равное распределение электронов в ковалентной связи.
Теперь рассмотрим молекулу HF:
В ковалентную связь вовлечены два разных атома. В ядре атома H есть один протон, который притягивает пару электронов. Однако в ядре атома F девять протонов, что в девять раз больше, чем у атома H.Атом F притягивает электроны настолько сильнее, что электроны остаются ближе к атому F, чем к атому H; электроны больше не сбалансированы между двумя ядрами. Вместо представления молекулы HF как
, ковалентная связь может быть более уместной, так как
с электронами в связи, находящимися ближе к атому F, чем к атому H. Поскольку электроны в связи находятся ближе к атому F, эта сторона молекулы принимает частичный отрицательный заряд, который обозначается как δ− (δ — греческая буква дельта в нижнем регистре). Другая сторона молекулы, атом H, принимает частичный положительный заряд, который обозначается как δ +:
Другая сторона молекулы, атом H, принимает частичный положительный заряд, который обозначается как δ +:
Ковалентная связь между разными атомами, которая в разной степени притягивает общие электроны и вызывает дисбаланс в распределении электронов, называется полярной ковалентной связью Неравное распределение электронов в ковалентной связи.
Технически любая ковалентная связь между двумя разными элементами полярна. Однако важна степень полярности.Ковалентная связь между двумя разными элементами может быть настолько несбалансированной, что связь, по существу, неполярная. Связь может быть настолько полярной, что электрон фактически переходит от одного атома к другому, образуя настоящую ионную связь. Как мы судим о степени полярности?
Ученые разработали шкалу, которая называется электроотрицательностью. Качественная шкала для оценки того, насколько атомы любого элемента притягивают электроны. Шкала для оценки того, насколько атомы любого элемента притягивают электроны. Электроотрицательность — это безразмерное число; чем выше число, тем больше атом притягивает электроны.Общая шкала электроотрицательности показана на рисунке 9.2 «Электроотрицательность элементов».
Электроотрицательность — это безразмерное число; чем выше число, тем больше атом притягивает электроны.Общая шкала электроотрицательности показана на рисунке 9.2 «Электроотрицательность элементов».
Рисунок 9.2 Электроотрицательность элементов
Электроотрицательность используется для определения полярности ковалентных связей.
Полярность ковалентной связи может быть оценена путем определения разницы электроотрицательностей двух атомов, участвующих в ковалентной связи, как показано в следующей таблице:
| Разница электроотрицательности | Тип облигации |
|---|---|
| 0 | неполярный ковалентный |
| 0–0.4 | слабополярный ковалентный |
| 0,4–1,9 | определенно полярно-ковалентный |
| > 1,9 | вероятно ионный |
Пример 7
Какова полярность каждой облигации?
- C – H
- O – H
Решение
Используя рисунок 9.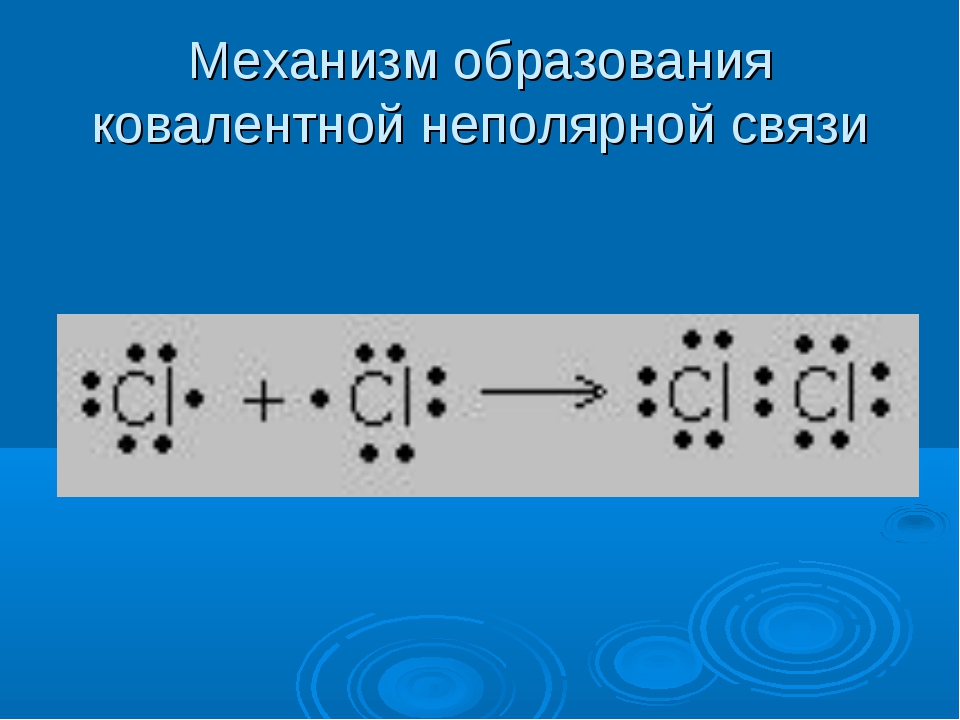 2 «Электроотрицательности элементов», мы можем вычислить разность электроотрицательностей атомов, участвующих в связи.
2 «Электроотрицательности элементов», мы можем вычислить разность электроотрицательностей атомов, участвующих в связи.
- Для связи C – H разница электроотрицательностей составляет 2,5 — 2,1 = 0,4. Таким образом, мы прогнозируем, что эта связь будет слегка полярной ковалентной.
- Для связи O – H разница в электроотрицательностях составляет 3,5 — 2,1 = 1,4, поэтому мы прогнозируем, что эта связь будет определенно полярно ковалентной.
Проверьте себя
Какова полярность каждой облигации?
- Rb – F
- P – Cl
Ответы
- вероятно ионный
- полярный ковалентный
Полярность ковалентной связи может иметь значительное влияние на свойства вещества.Если вся молекула полярна, вещество может иметь более высокие точки плавления и кипения, чем ожидалось; кроме того, он может быть или не быть растворимым в различных других веществах, таких как вода или гексан.
Должно быть очевидно, что ковалентные связи стабильны, потому что существуют молекулы. Однако они могут быть разрушены, если молекуле будет передано достаточно энергии. Для большинства ковалентных связей между любыми двумя заданными атомами необходимо подвести определенное количество энергии. Хотя точное количество энергии зависит от молекулы, приблизительное количество энергии, которое необходимо передать, аналогично, если атомы в связи одинаковы.Приблизительное количество энергии, необходимое для разрыва ковалентной связи, называется энергией связи. Приблизительное количество энергии, необходимое для образования ковалентной связи. ковалентной связи. В таблице 9.2 «Энергии связи ковалентных связей» перечислены энергии связи некоторых ковалентных связей.
Таблица 9.2 Энергии связи ковалентных связей
| Облигация | Энергия (кДж / моль) | Облигация | Энергия (кДж / моль) | |
|---|---|---|---|---|
| C – C | 348 | N – N | 163 | |
| С = С | 611 | N = N | 418 | |
| C≡C | 837 | NN | 946 | |
| C – O | 351 | N – H | 389 | |
| C = O | 799 | O – O | 146 | |
| C – Cl | 328 | O = O | 498 | |
| C – H | 414 | O – H | 463 | |
| Ф – Ф | 159 | S – H | 339 | |
| H – Cl | 431 | S = O | 523 | |
| H – F | 569 | Si – H | 293 | |
| H – H | 436 | Si – O | 368 |
Некоторые тенденции очевидны из Таблицы 9. 2 «Связанные энергии ковалентных связей». Для связей, которые включают одни и те же два элемента, двойная связь прочнее одинарной, а тройная связь сильнее двойной связи. Энергии кратных связей не являются точными кратными энергии одинарной связи; для связей углерод-углерод энергия увеличивается несколько меньше, чем в два или в три раза больше энергии связи C – C, в то время как для связей азот-азот энергия связи увеличивается со скоростью, большей, чем кратная энергии одинарной связи N – N. Энергии связи в таблице 9.2 «Энергии связи ковалентных связей» — средние значения; точное значение энергии ковалентной связи будет немного отличаться среди молекул с этими связями, но должно быть близко к этим значениям.
2 «Связанные энергии ковалентных связей». Для связей, которые включают одни и те же два элемента, двойная связь прочнее одинарной, а тройная связь сильнее двойной связи. Энергии кратных связей не являются точными кратными энергии одинарной связи; для связей углерод-углерод энергия увеличивается несколько меньше, чем в два или в три раза больше энергии связи C – C, в то время как для связей азот-азот энергия связи увеличивается со скоростью, большей, чем кратная энергии одинарной связи N – N. Энергии связи в таблице 9.2 «Энергии связи ковалентных связей» — средние значения; точное значение энергии ковалентной связи будет немного отличаться среди молекул с этими связями, но должно быть близко к этим значениям.
Для разрыва ковалентных связей всегда требуется энергия; то есть разрыв ковалентной связи всегда является эндотермическим процессом . Таким образом, Δ H для этого процесса положительно:
Молекула – O – H → Молекула – O + H Δ H ≈ +463 кДж / моль Однако при создании ковалентной связи всегда выделяется энергия; Создание ковалентных связей всегда является экзотермическим процессом . Таким образом, Δ H для этого процесса отрицательно:
Таким образом, Δ H для этого процесса отрицательно:
Энергии связи можно использовать для оценки изменения энергии химической реакции. Когда связи в реагентах разрываются, изменение энергии для этого процесса является эндотермическим. Когда в продуктах образуются связи, изменение энергии для этого процесса является экзотермическим. Мы комбинируем положительное изменение энергии с отрицательным изменением энергии, чтобы оценить общее изменение энергии реакции.Например, в
2H 2 + O 2 → 2H 2 Oмы можем нарисовать электронные точечные диаграммы Льюиса для каждого вещества, чтобы увидеть, какие связи разорваны и какие связи образуются:
(Неподеленные электронные пары на атомах O опущены для ясности.) Мы разрываем две связи H – H и одну двойную связь O – O и формируем четыре одинарные связи O – H. Энергия, необходимая для разрыва связей, следующая:
| 2 H – H связи: | 2 (+436 кДж / моль) |
| 1 Связь O = O: | +498 кДж / моль |
| Всего: | +1,370 кДж / моль |
Энергия, выделяемая при образовании четырех связей O – H, следующая:
| 4 связи O – H: | 4 (-463 кДж / моль) |
| Всего: | -1,852 кДж / моль |
Объединяя эти два числа:
| +1,370 кДж / моль + (-1,852 кДж / моль) | |
| Чистое изменение: | −482 кДж / моль ≈ Δ H |
Фактическая Δ H составляет -572 кДж / моль; мы отклоняемся примерно на 16% — хотя и не идеально, разница в 16% является разумной, поскольку мы использовали оценочные, а не точные энергии связи.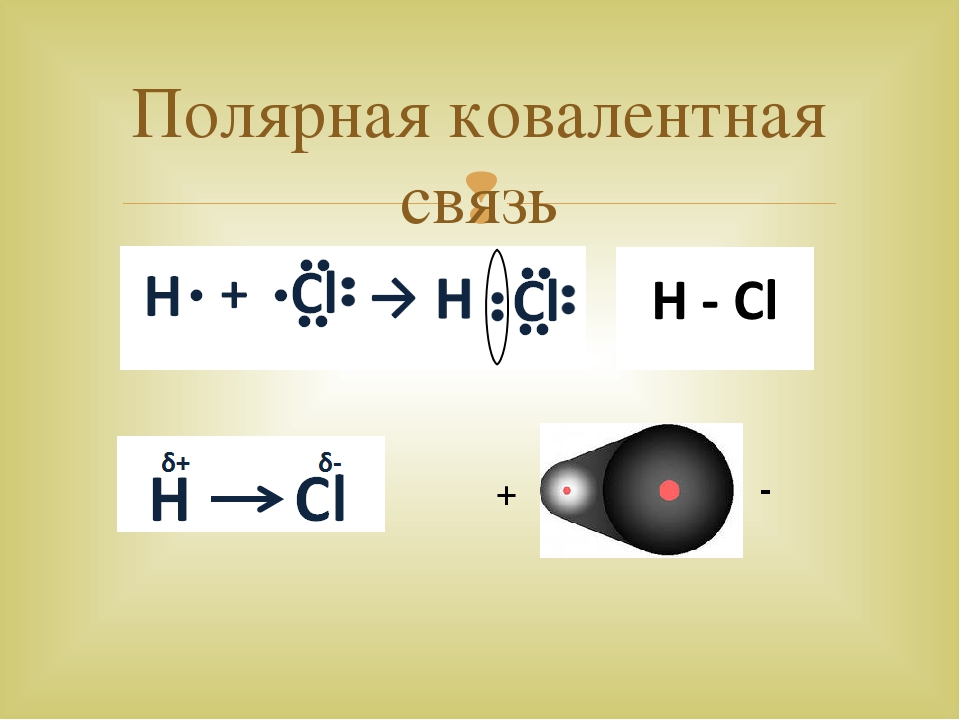
Пример 8
Оцените изменение энергии этой реакции.
Решение
Здесь мы разрываем двойную связь C – C и одинарную связь H – H и делаем одинарную связь C – C и две одинарные связи C – H. Разрыв связи является эндотермическим, а образование связи — экзотермическим. За разрыв облигаций:
| 1 С = С: | +611 кДж / моль |
| 1 H – H: | +436 кДж / моль |
| Всего: | +1,047 кДж / моль |
Для оформления облигаций:
| 1 К – С: | −348 кДж / моль |
| 2 C – H: | 2 (-414 кДж / моль) |
| Итого | -1,176 кДж / моль |
В целом изменение энергии составляет +1,047 + (-1,176) = -129 кДж / моль.
Проверьте себя
Оцените изменение энергии этой реакции.
Ответ
−295 кДж / моль
Основные выводы
- Ковалентные связи могут быть неполярными или полярными, в зависимости от электроотрицательности задействованных атомов.
- Ковалентные связи могут быть разорваны, если к молекуле добавлена энергия.
- Образование ковалентных связей сопровождается выделением энергии.
- Энергии ковалентных связей можно использовать для оценки изменений энтальпии химических реакций.
Упражнения
Приведите пример неполярной ковалентной связи. Откуда вы знаете, что он неполярный?
Приведите пример полярной ковалентной связи.
 Откуда вы знаете, что он полярный?
Откуда вы знаете, что он полярный?Как узнать, какая сторона полярной связи имеет частичный отрицательный заряд? Определите отрицательно заряженную сторону каждой полярной связи.
- H – Cl
- H – S
Как узнать, какая сторона полярной связи имеет частичный положительный заряд? Определите положительно заряженную сторону каждой полярной связи.
- H – Cl
- N-F
Обозначьте связь между данными атомами как неполярную ковалентную, слегка полярную ковалентную, определенно полярную ковалентную или, вероятно, ионную.

- H и C
- C и F
- K и F
Обозначьте связь между данными атомами как неполярную ковалентную, слегка полярную ковалентную, определенно полярную ковалентную или, вероятно, ионную.
- S и Cl
- П и О
- CS и O
Какая ковалентная связь сильнее — связь C – C или связь C – H?
Какая ковалентная связь сильнее — двойная связь O – O или двойная связь N – N?
Оцените изменение энтальпии этой реакции.
№ 2 + 3H 2 → 2NH 3 Начните с рисования электронных точечных диаграмм Льюиса для каждого вещества.
Начните с рисования электронных точечных диаграмм Льюиса для каждого вещества.Оцените изменение энтальпии этой реакции. Начните с рисования электронных точечных диаграмм Льюиса для каждого вещества.
HN = NH + 2H 2 → 2NH 3Оцените изменение энтальпии этой реакции.Начните с рисования электронных точечных диаграмм Льюиса для каждого вещества.
CH 4 + 2O 2 → CO 2 + 2H 2 OОцените изменение энтальпии этой реакции. Начните с рисования электронных точечных диаграмм Льюиса для каждого вещества.
4NH 3 + 3O 2 → 2N 2 + 6H 2 O
ответов
H – H; он неполярен, потому что два атома имеют одинаковую электроотрицательность (ответы могут быть разными).

- слабополярный ковалентный
- определенно полярно-ковалентный
- вероятно ионный
полярных и неполярных молекул
полярных и неполярных молекулПолярные и неполярные молекулы
Масло и вода не смешиваются, верно? Вот почему вы взбалтываете заправку для салата; временно заставить их вместе. Почему добавление небольшого количества средства для мытья посуды (мыла) помогает удалить жир с грязной посуды лучше, чем вода? Почему химчистка удаляет пятна, которых не убирают мыло и вода? Ответ связан с химическими свойствами используемых нами растворителей и химическими свойствами веществ, которые мы пытаемся растворить (растворенных веществ). Мы вернемся к этим примерам позже.
Почему добавление небольшого количества средства для мытья посуды (мыла) помогает удалить жир с грязной посуды лучше, чем вода? Почему химчистка удаляет пятна, которых не убирают мыло и вода? Ответ связан с химическими свойствами используемых нами растворителей и химическими свойствами веществ, которые мы пытаемся растворить (растворенных веществ). Мы вернемся к этим примерам позже.
масло и вода несовместимы
Химические связи : Атомы ищут более стабильные состояния.Структура атома похожа на структуру Солнечной системы. Большие протоны (с положительным зарядом) и нейтроны (без заряда) находятся в ядре или центре. Крошечные электроны (с отрицательным зарядом) быстро вращаются по орбитам вокруг ядра, образуя электронные оболочки на разных расстояниях, во многом подобно планетам и другим объектам, которые вращаются вокруг Солнца. Атомы каждого элемента имеют различное количество электронов в их внешних оболочках. Атомы становятся более стабильными, когда их внешние электронные оболочки опустошаются или заполняются. Один из способов достижения этой цели состоит в том, чтобы два атома делили между собой один или несколько электронов, чтобы каждый из них мог заполнить или опустошить эту самую внешнюю оболочку. Но они могут делиться электроном (ами), только если они остаются близко друг к другу, и это называется ковалентной связью. В других ситуациях один атом может стать более стабильным, потеряв электроны, а другой может стать более стабильным, получив их. Атом, получивший электрон (помните, что электроны имеют отрицательный заряд), становится отрицательно заряженным (-1), а атом, потерявший электрон, становится положительно заряженным (+1).Вот небольшая шутка, которая поможет вам вспомнить …
Один из способов достижения этой цели состоит в том, чтобы два атома делили между собой один или несколько электронов, чтобы каждый из них мог заполнить или опустошить эту самую внешнюю оболочку. Но они могут делиться электроном (ами), только если они остаются близко друг к другу, и это называется ковалентной связью. В других ситуациях один атом может стать более стабильным, потеряв электроны, а другой может стать более стабильным, получив их. Атом, получивший электрон (помните, что электроны имеют отрицательный заряд), становится отрицательно заряженным (-1), а атом, потерявший электрон, становится положительно заряженным (+1).Вот небольшая шутка, которая поможет вам вспомнить …
Когда атом теряет электрон, его чистый заряд изменяется от 0 (нейтральный) до +1 (положительный)
Образование ионной связи — это окислительно-восстановительная реакция. Один атом теряет электроны (окисление), а другой получает электроны (восстановление) . Атомы, несущие заряд, положительный или отрицательный, называются ионами, и, поскольку противоположности притягиваются, они могут образовывать ионную связь. Ионные и ковалентные связи являются наиболее важными во всей химии.Вот небольшая шутка, которая поможет вам вспомнить …
Атомы, несущие заряд, положительный или отрицательный, называются ионами, и, поскольку противоположности притягиваются, они могут образовывать ионную связь. Ионные и ковалентные связи являются наиболее важными во всей химии.Вот небольшая шутка, которая поможет вам вспомнить …
С ионными связями атомы отдают или принимают электроны. В случае ковалентных связей они должны их разделить.
противоположные полюса магнита притягиваются
А теперь подумайте о магните. Магниты имеют как положительный (+) полюс, так и отрицательный (-) полюс. То же самое и с батареями. Земля тоже. Когда вещи разные на каждом конце, мы называем их полярными . У некоторых молекул тоже есть положительные и отрицательные концы, и когда они есть, мы называем их полярными.Если нет, мы называем их неполярными. Полярные предметы могут притягиваться и отталкиваться (противоположные заряды притягиваются, одинаковые заряды отталкиваются). Два магнита на изображении выше будут притягиваться, потому что их противоположные полюса находятся рядом. Переверните одну из них, и они будут отталкивать друг друга.
Переверните одну из них, и они будут отталкивать друг друга.
молекулы воды полярны
Вода — полярная молекула. Хотя общий заряд молекулы нейтрален, ориентация двух положительно заряженных атомов водорода (+1 каждый) на одном конце и отрицательно заряженного кислорода (-2) на другом конце дает ей два полюса.Это свойство заставляет молекулы воды слабо притягиваться к другим молекулам воды (от положительного к отрицательному, от отрицательного к положительному) и приводит к сцеплению воды с самой собой. Например, капли воды на плоском куске стекла образуют капли и поднимаются вверх.
фосфолипидный бислой клеточной мембраны
Ваши клеточные мембраны состоят из двух слоев фосфолипидов. Полярные головки (круглые части , фосфо ) обращены наружу, а неполярные хвосты (липиды — помните, что липиды — это жиры) обращены к середине мембраны.Вода, которая является полярной, поэтому прилипает к себе и прилипает к фосфатам на внешней и внутренней поверхностях мембраны, но она отталкивается (точно так же, как масло и вода отталкивают друг друга) от центра мембраны.
 . Головы гидрофильные (водолюбивые), а хвосты гидрофобные (водобоязненные). Эта продуманная конструкция делает клеточные мембраны влажными на своей поверхности, но водонепроницаемыми в середине. Небольшие неполярные молекулы, такие как кислород и углекислый газ, могут дрейфовать прямо через мембрану, но все полярные или большие молекулы застревают, и их необходимо будет активно переносить через одни из ворот клетки.
. Головы гидрофильные (водолюбивые), а хвосты гидрофобные (водобоязненные). Эта продуманная конструкция делает клеточные мембраны влажными на своей поверхности, но водонепроницаемыми в середине. Небольшие неполярные молекулы, такие как кислород и углекислый газ, могут дрейфовать прямо через мембрану, но все полярные или большие молекулы застревают, и их необходимо будет активно переносить через одни из ворот клетки.сечение мыльной «мицеллы»
Так почему мыло и моющие средства моют нашу посуду и нашу одежду? Мыла химически похожи на клеточные мембраны. Когда мыло добавляется в воду, оно образует структуры, называемые мицеллами. Головки мыльных мицелл полярны, а хвосты, которые обращены внутрь, чтобы отступить от полярной воды, неполярны. Когда мыльная мицелла сталкивается с маслом или жиром, эти неполярные материалы вынуждены проникать внутрь мицеллы, чтобы уйти от полярной воды и полярных головок мицеллы, где они и удерживаются.Когда мыльная вода смывается, вместе с ней смываются застрявшие жир и масло.
Мини-эксперимент 1 : Налейте немного воды в неглубокую миску. Теперь возьмите отрезок нити или длинный волос и положите его на воду замкнутым контуром. Капните несколько капель растительного масла внутрь петли нити и аккуратно перемешайте масло. Теперь добавьте средство для мытья посуды за пределы петли бечевки и осторожно перемешайте его с водой. Удалите нить и посмотрите, что произойдет.
Мини-эксперимент 2 : Вот драматический эксперимент, который вы можете провести с пищевым красителем, мылом для посуды и молоком.Посмотрите видео, чтобы увидеть, как это будет выглядеть. Почему это работает? Подсказка: молоко содержит жиры, а мыло отталкивает жиры. Пищевой краситель переносится с молоком, поскольку он отступает от жиров.
.


 О.<1.7
О.<1.7 82
82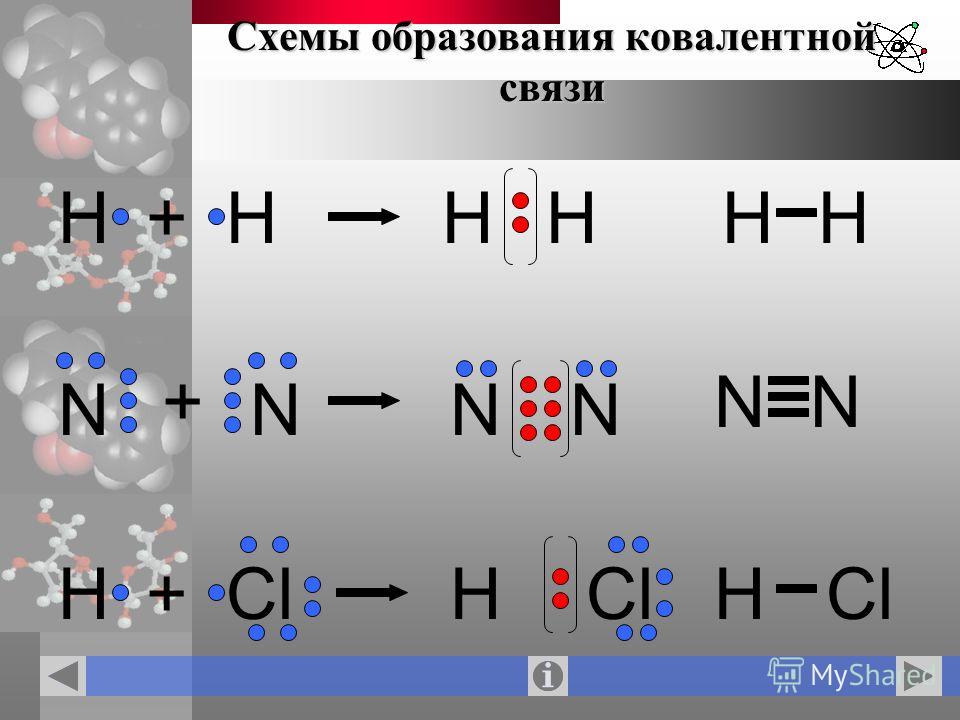




 значение 2,1, поэтому ковалентная связь между ними считается неполярной
значение 2,1, поэтому ковалентная связь между ними считается неполярной
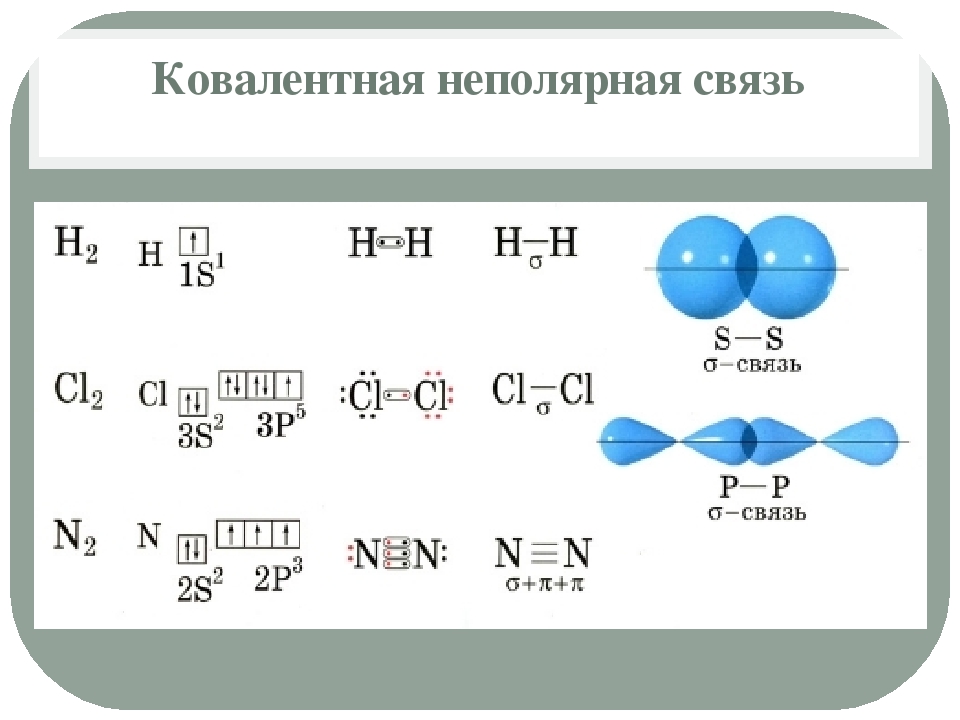 некоторых общих молекул
некоторых общих молекул  Разница равна нулю, значит связь неполярная.
Разница равна нулю, значит связь неполярная.
 Откуда вы знаете, что он полярный?
Откуда вы знаете, что он полярный?
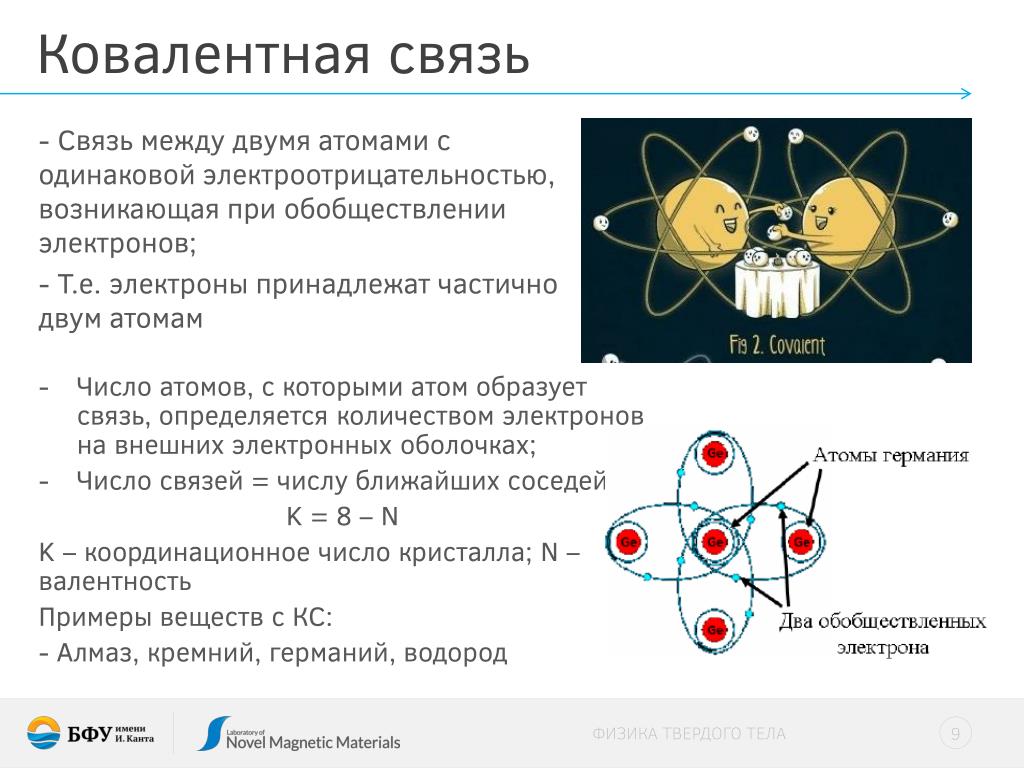 Начните с рисования электронных точечных диаграмм Льюиса для каждого вещества.
Начните с рисования электронных точечных диаграмм Льюиса для каждого вещества.