что это такое простыми словами
Про энтальпию на простом языке
При работе с какими-либо расчётами, вычислениями и выполнении прогноза разнообразных явлений, связанных с теплотехникой, каждый сталкивается с понятием энтальпия. Но для людей, специальность которых не касается теплоэнергетики или которые лишь поверхностно сталкиваются с подобными терминами, слово «энтальпия» будет наводить страх и ужас. Итак, давайте разберёмся, действительно ли всё так страшно и непонятно?
Если попытаться сказать совсем просто, под термином энтальпия понимается энергия, которая доступна для преобразования в теплоту при некотором постоянном давлении. Понятие энтальпия в переводе с греческого значит «нагреваю». То есть формулу, содержащую элементарную сумму внутренней энергии и произведенную работу, называют энтальпией. Эта величина обозначается буквой i.
Если записать вышесказанное физическими величинами, преобразовать и вывести формулу, то получится i = u + pv (где u – внутренняя энергия; p, u – давление и удельный объем рабочего тела в том же состоянии, для которого взято значение внутренней энергии). Энтальпия — аддитивная функция, т. е. энтальпия всей системы равна сумме всех составляющих её частей.

Термин «энтальпия» сложен и многогранен.
Но если постараться в нём разобраться, то всё пойдёт очень просто и понятно.
- Во-первых, чтобы понять, что же такое энтальпия, стоит узнать общее определение, что мы и сделали.
- Во-вторых, стоит найти мпеханизм появления этой физической единицы, понять, откуда она взялась.
- В-третьих, нужно найти связь с другими физическими единицами, которые неразрывно с ними взаимосвязаны.
- И, наконец, в-четвёртых, нужно посмотреть примеры и формулу.
Ну, что же, механизм работы понятен. Вам лишь нужно внимательно читать и вникать. С термином «Энтальпии» мы уже разобрались, также привели и его формулу. Но тут же возникает ещё один вопрос: откуда взялась эта формула и почему энтропия связана, к примеру, с внутренней энергией и давлением?
Суть и смысл
Для того, чтобы попытаться выяснить физический смысл понятия «энтальпия» нужно знать первый закон термодинамики:
энергия не исчезает в никуда и не возникает из ничего, а лишь переходит из одного вида в другой в одинаковых количествах. Таким примером может служить переход теплоты (тепловой энергии) в механическую энергию, и наоборот.
Уравнение первого закона термодинамики нам нужно преобразить в вид dq = du + pdv = du + pdv + vdp – vdp = d(u + pv) – vdp. Отсюда мы видим выражение (u + pv). Именно это выражение и называется энтальпией (полная формула приводилась выше).
Энтальпия также является величиной состояния, потому что составляющие u (напряжение) и p (давление), v (удельный объём) имеют для каждой величины определенные значения. Зная это, первый закон термодинамики возможно переписать в виде: dq = di – vdp.
В технической термодинамике используются значения энтальпии, которые высчитываются от условно принятого нуля. Все абсолютные значения этих величин весьма трудно определить, так как для этого необходимо учесть все составляющие внутренней энергии вещества при изменении его состояния от О к К.
Формулу и значения энтальпии привёл в 1909 г. учёный Г.Камерлинг-Оннесом.
В выражении i — удельная энтальпия, для всей массы тела полная энтальпия обозначается буквой I, по всемирной системе единиц энтальпия измеряется в Джоулях на килограмм и рассчитывается как:
i=mi=U+pv.
Функции
Энтальпия («Э») является одной из вспомогательных функций, благодаря использованию которой можно значительно упростить термодинамический расчёт. Так например, огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах или камере сгорания газовых турбин и реактивных двигателей, а также в теплообменных аппаратах) осуществляют при постоянном давлении. По этой причине в таблицах термодинамических свойств обычно приводят значения энтальпии.
Условие сохранения энтальпии лежит, в частности, в основе теории Джоуля — Томсона. Или эффекта, нашедшего важное практическое применение при сжижении газов. Таким образом, энтальпия есть полная энергия расширенной системы, представляющая сумму внутренней энергии и внешней – потенциальной энергии давления. Как любой параметр состояния, энтальпия может быть определена любой парой независимых параметров состояния.
Также, исходя из приведённых выше формул, можно сказать: «Э» химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Итак, вот мы и разобрали понятие «энтальпии». Стоит отметить, что «Э» неразрывно связана с энтропией, о которой вы также можете прочесть позже.
Энтальпия для начинающих (I-d диагр). Расчет количества конденсата. Скрытая холодопроизводительность
Энтальпия. Этому элементу I-d диаграммы я посвятил отдельную тему, потому как для меня этот элемент являлся наименее понятным среди остальных (температуры, влагосодержания и относительной влажности) и требующим разбора других попутных понятий.Продублирую рисунок из прошлой статьи http://mrcynognathus.livejournal.com/7641.html:

Не буду глубоко вдаваться в терминологию, скажу лишь, что я понимаю энтальпию воздуха, как энергию, которую хранит в себе определенный объем воздуха. Эта энергия является потенциальной, то есть в условии равновесия воздух не тратит эту энергию и не поглощает её из других источников.
Не буду даже приводить пример для разъяснения своего определения (хотя хотел), потому как, по моему мнению, это запутает и уведет в сторону.
Сразу к делу – что главное мы можем взять из энтальпии? – отвечаю – энергию (или количество теплоты), которую нужно передать воздуху, чтобы нагреть его или отнять, чтобы его охладить (или осушить).
Например, у нас есть задача — посчитать какой мощности нам нужен калорифер, чтобы осенью или весной подать в помещение 1200 м3/ч нагретого до температуры плюс 20 градусов наружного воздуха. Расчетная температура наружного воздуха в переходный период – плюс 10 градусов при энтальпии 26,5 кДж/кг (по СП 60.13330.2012).
Задача решается легко. Для того чтобы решить такую простую задачку используя и-д диаграмму, нам необходимо ввести в уровень понимания единицы измерения некоторых физических величин:
1) Энтальпия – килоДжоуль/килограмм . То есть количество потенциальной энергии в одном килограмме воздуха. Здесь все просто – если энтальпия равна 20, то это означает, что в одном килограмме данного воздуха находится 20 килоджоулей потенциальной теплоты или 20000 джоулей.
2) Мощность калорифера – Ватты, но в то же время ватты можно разложить на Джоуль/секунда. То есть, сколько может выдать калорифер энергии за одну секунду. Чем больше энергии нам сможет выдать калорифер за секунду, тем он мощнее. И тут все просто.
Итак, берем I-d диаграмму и ставим на ней точку наружного воздуха. После, проводим прямую линию вверх (идет нагрев воздуха без изменения влагосодержания).

Мы получаем точку на j-d диаграмме с температурой плюс 20 градусов и энтальпией 36,5 кДж/кг. Возникает вопрос – что, же, черт возьми, нам дальше делать с этой гребанной информацией?! 🙂
Во первых, обратим внимание на то, что мы производили все операции с одним килограммом воздуха (это косвенно видно по единице измерения энтальпии кДж/кг).
Во вторых, у нас был килограмм воздуха с 26,5 кДж, а стал с 36,5 кДж потенциальной энергии. То есть килограмму воздуха сообщили 10 кДж для того чтобы его температура поднялась с плюс 10 градусов до плюс двадцати.
Дальше мы переведем 1200 м3/ч в кг/с(килограммы/секунда, т.к. на I—d диаграмме используются эти единицы измерения), умножив 1200 на 1,25 кг/м3 (один метр кубический десятиградусного воздуха весит 1,25 килограмма), что даст нам 1500 кг/ч, а затем разделив на 3600 (обратите внимание на логику перевода между системами – делим мы на 3600 не потому что мы так зазубрили или запомнили, а потому что за секунду у нас воздуха пройдет меньше чем за час, меньше в 3600 раз) получаем итог 0,417 кг/с.
Идем дальше. Мы получили, что за одну секунду проходит 0,417 кг воздуха. И мы знаем, что каждому килограмму необходимо передать (сообщить) 10 кДж для того, чтобы нагреть его до температуры плюс 20 градусов. Сообщаем, умножая 0,417 кг/с на 10 кДж/кг, и получая 4,17 кДж/с (килограммы сократились) или 4170 Дж/с, что равно 4170 Вт (определено нами ранее по тексту). Вот мы и получили мощность нашего калорифера.
Кондиционирование
Охлаждение происходит по тому же принципу, но только немного сложнее из-за выделения влаги из воздуха.
Выделение влаги (конденсата) из воздуха происходит тогда, когда температура воздуха при охлаждении достигает точки росы на линии относительной влажности 100%. В предыдущей статье я описал этот процесс: http://mrcynognathus.livejournal.com/7641.html
Вроде бы, нет ничего сложного — охлаждаем воздух с температурой плюс 20 градусов и относительной влажностью 50% до плюс 12 градусов (как это обычно происходит в сплит-системах), проводя прямую вертикально вниз из точки 20-ти градусного воздуха до точки 12-ти градусного воздуха.
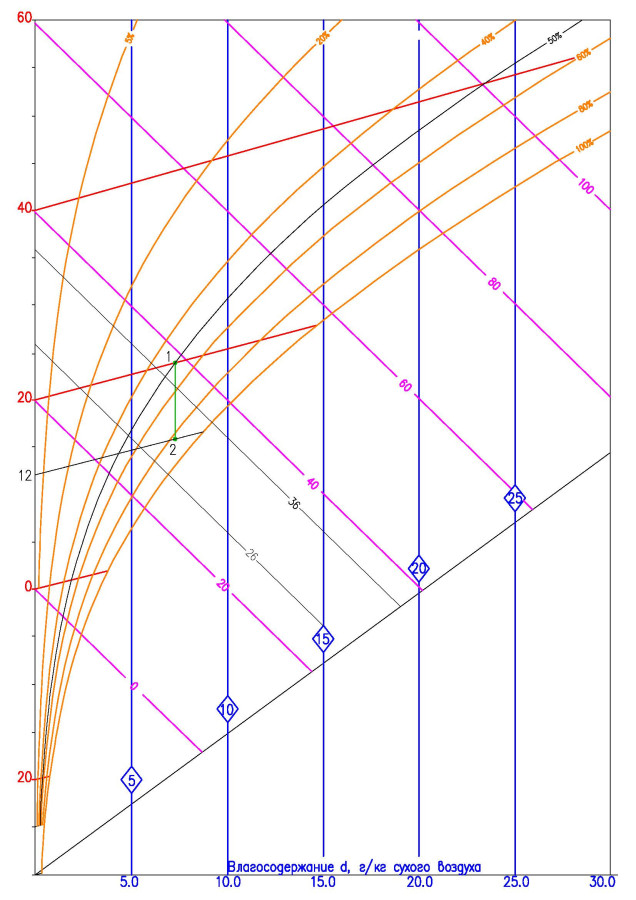
И что мы видим – никаких влаговыделений. Влагосодержание осталось на прежнем уровне – 8 г/кг. Но мы то знаем, что при работе кондиционера идет обильное влаговыделение (конденсат активно капает из дренажной трубки, выведенной на фасад здания) – этот факт подтверждается неоднократным наблюдением гуляющего по летним улицам.
Возникает вопрос – откуда же влага? Ответ: дело в том, что через внутренний блок кондиционера проходят медные трубки, которые охлаждаются хладагентом до температур, которые ниже плюс 12 градусов, и в связи с этим охлаждаемый воздух делится на слои с различной температурой, примерно как на рисунке ниже (предположим, что трубки охлаждаются до плюс 5 градусов). Сразу скажу, что это далекий от действительности, но показывающий общий смысл вышесказанных мною слов рисунок (прошу меня за него не ругать)
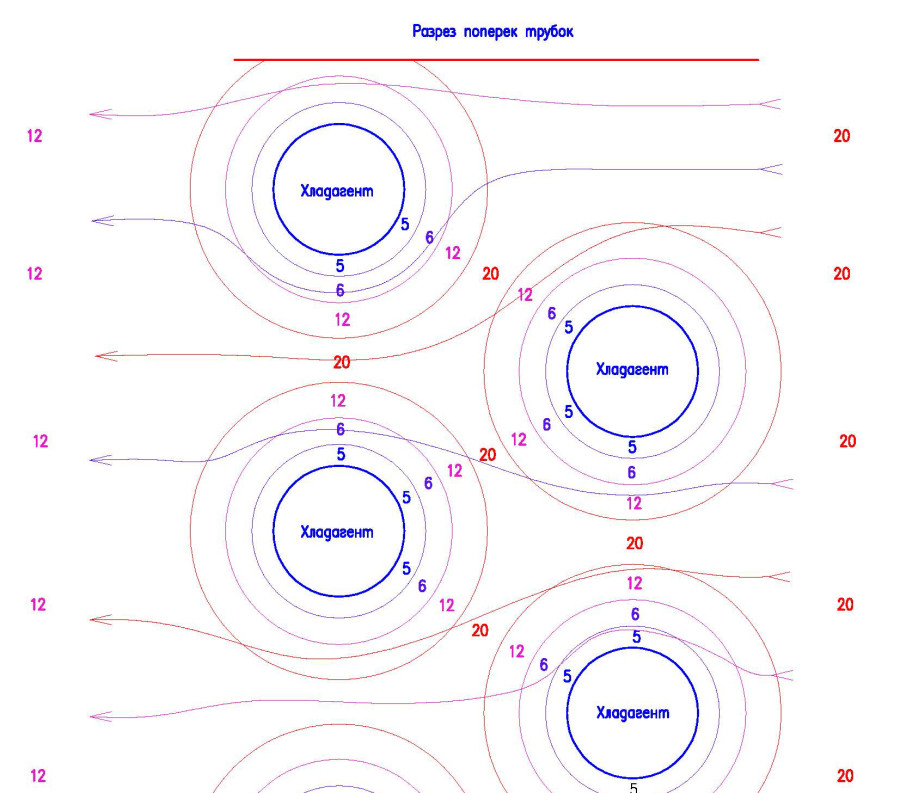
Поэтому из того воздуха, который соприкасается с трубками(и оребрением) и выпадает влага. А тот воздух, что не успел охладиться до точки росы, или успел, но избежал контакта с охлажденной поверхностью, минует процесс влаговыделения и несет в себе столько же влаги, сколько он нес в себе до охлаждения (по сути).
Для того чтобы провести правильную прямую процесса охлаждения воздуха в таком охладителе (где температура хладагента ниже температуры точки росы), нам необходимо учесть каждый воздушный поток с различными тепловлажностными параметрами воздуха и найти на графике точки смешения всех этих потоков – что по моему мнению – не реально (у меня просто не хватит мозгов на это)! Но…
…Я пришел к вот такому решению (скорее всего не я такой один) — у нас есть температура входящего воздуха, есть температура хладагента и есть температура получаемого воздуха, и я считаю, что нам достаточно провести линию процесса охлаждения части воздуха до плюс 5 градусов и найти точку смешения 5-ти градусного воздуха и 20-ти градусного воздуха. То есть, я предполагаю, что проходя через внутренний блок кондиционера, воздух делится на два потока – тот, который охлаждается до плюс пяти градусов и выдает нам наибольшее количество влаги, и тот который вообще не охлаждается, а на выходе эти два потока смешиваются и образуют поток воздуха с температурой плюс 12 градусов и определенным влагосодержанием.
Я считаю, что для достижения тех целей, которые я преследую, результата, полученного при таком упрощении, вполне достаточно. А какие же цели я преследую?
Первая цель – это определение максимального влаговыделения для того, чтобы рассчитать систему конденсатоотвода (особенно актуально это при системах кондиционирования, в составе которых две и более охлаждающих установок)
Вторая цель – учесть количество холода, идущего на перевод воды из газообразного состояния в жидкое (на конденсацию влаги; так назывемая скрытая холодопроизводительность). Особенно актуально это при охлаждении (отведении тепла) во влажных помещениях. Например, нам необходимо отвести от определенного насоса 2 кВт тепла, которые он выделяет в помещение. Если мы не учтем, что помещение влажное (влажное, по каким либо причинам) и установим в помещение сплит-систему мощностью 2,5 кВт, то мы можем получить (при определенных условиях), что сплит-система тратит 1 кВт лишь для того, чтобы перевести пар во влагу, а на удаление теплоизбытков тратит оставшиеся 1,5 кВт, что меньше на 500 Вт необходимого, и что может привести к перегреву насоса и скорого его выхода из строя.
Итак, делим поток на два потока, один из которых охлаждаем до плюс пяти — отрезок 1-2, а другой оставляем не тронутым — точка 1.

Смешиваем эти два потока, объединяя получившиеся точки прямой 1-3-2, и находим нашу 12-ти градусную точку на получившейся прямой.

Оставляем прямую 1-3 как линию процесса охлаждения воздуха в сухом охладителе с температуры плюс 20 градусов до плюс 12 градусов с выделением конденсата.

Для того чтобы узнать количество конденсата, выпавшего на оребрении и трубках охладителя нам необходимо вычесть влагосодержание получившегося воздуха из влагосодержания необработанного воздуха 7,3 г/кг – 6,3 г/кг. В итоге мы получим, что из каждого килограмма прошедшего через охладитель воздуха выделится 1 грамм конденсата. Чтобы узнать расход конденсата, нам необходимо узнать, сколько килограммов воздуха проходит через теплообменник за определенное время. Например, если нам необходимо охладить 1400 м3/ч воздуха с температуры плюс 20 градусов с относительной влажностью 50% до температуры плюс 12 градусов, то мы переведем 1400 м3/ч в 1680 кг/ч и получим, что за час обработки воздуха выделится 1680 грамм конденсата (по одному грамму на каждый килограмм воздуха), что равно 0,47 г/с (грамм/секунда) и 0,47 * 10-3 кг/с.
Полная холодопроизводительность находится так же, как мы искали теплопроизводительность калорифера ранее. Берем энтальпию начальной точки 28 кДж/кг, вычитаем из нее энтальпию конечной точки 38,5 кДж/кг, получая отрицательное число 10,5 кДж/кг (минус указывает на то, что энергия отдается хладагенту). Переводим 1680 кг/ч в килограмм/секунда, что будет равняться 0,47 кг/с. В итоге получаем 4,935 кДж/с, что равно 4,935 кВт мощности.
Подпишись на мой YouTube-канал FAN-tastiK — канал о проектировании Вентиляции, Кондиционирования и Отопления
Если есть необходимость определить скрытую холодопроизводительность , можно найти её, отталкиваясь от количества выделенного конденсата, используя удельную теплоту парообразования:
Теплота, требуемая для конденсации влаги, находится по формуле: Q = L * m,
где L – удельная теплота парообразования; m – масса влаги.
L воды равно: 2260 кДж/кг.
Для того, чтобы перевести 0,47 грамма воды из газообразного состояния в жидкое состояние за секунду нам требуется 2260 Дж * 103 * 0,47 кг/с * 10-3 = 1063 Дж/с, что равно 1063 Вт.
Итак скрытая холодопроизводительность данного процесса равна 1063 Вт.
Это Все
Собственно, это все, что я хотел рассмотреть в данной статье. Прошу не бранить меня за наивную упрощенность описанного мною — я постарался объяснить в первую очередь себе — что такое энтальпия и как ей пользоваться. Надеюсь Вам было интересно и полезно. Спасибо за внимание.
P.S. Эта статья не в коем случае не является учебным пособием. Она лишь мое субъективное видение вопроса. Я бы даже сказал — каждое слово, написанное в этой статье, является ошибочным. Информацию, достойную носить звание «Научная истина» ищите в учебниках.
P.P.S Предыдущая статья, в которой я описывал собственное видение таких элементов I-d диаграммы (диаграммы Рамзина) как температура, влагосодержание, относительная влажность находится здесь: http://mrcynognathus.livejournal.com/7641.html
Энтальпия — это… Что такое Энтальпия?
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня площадью S с грузом весом Р = pS, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
Изменение энтальпии (или Тепловой эффект химической реакции) не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра, являющегося функцией состояния, равно нулю, отсюда , или же
Дифференциал энтальпии, выраженный в собственных переменных — через энтропию S и давление p:
Поскольку в квазиравновесных процессах — количество теплоты, подведенной к системе, отсюда вытекает физический смысл введения понятия энтальпии: ее изменение — это тепло, подведенное к системе в изобарическом процессе (при постоянном давлении). Практическое применение этой функции основано на том, что множество химических процессов в реальных или лабораторных условиях реализуются именно при постоянном (атмосферном) давлении, когда резервуар открыт. Так, энтальпия образования — количество энергии, которое выделяется или поглощается при образовании сложного вещества из простых веществ.
Все химические реакции сопровождаются выделением (экзотермические) или поглощением (эндотермические) тепла. Мерой теплоты реакции служит изменение энтальпии ΔН, которая соответствует теплообмену при постоянном давлении. В случае экзотермических реакций система теряет тепло и ΔН — величина отрицательная. В случае эндотермических реакций система поглощает тепло и ΔН — величина положительная.
Энтальпией системы удобно пользоваться в тех случаях, когда в качестве независимых переменных, определяющих состояние системы, выбирают давление р и температуру Т
В этом случае изменение энтальпии в изобарическом процессе практически удобно рассчитывать, зная теплоемкость при постоянном давлении (термохимический закон Кирхгофа):
При этом используется эмпирическое разложение теплоёмкости в ряд по степеням Т:
Энтальпия — величина аддитивная (экстенсивная), т. е. для сложной системы равна сумме энтальпий её независимых частей . Подобно другим термодинамическим потенциалам, энтальпия определяется с точностью до постоянного слагаемого, которому в термодинамике часто придают произвольные значения (например, при расчете и построении тепловых диаграмм). При наличии немеханических сил величина энтальпии системы равна
где — обобщённая сила; — обобщённая координата.
Примеры
Инвариантная энтальпия в релятивистской термодинамике
При построении релятивистской термодинамики (с учетом специальной теории относительности) обычно наиболее удобным подходом является использование так называемой инвариантной энтальпии — для системы, находящейся в некотором сосуде.
При этом подходе температура определяется как лоренц-инвариант. Энтропия — также инвариант. Поскольку стенки влияют на систему, наиболее естественной независимой переменной является давление , в связи с чем в качестве термодинамического потенциала удобно брать именно энтальпию[1].
Для такой системы «обычная» энтальпия и импульс системы образуют 4-вектор, и за определение инвариантной энтальпии, одинаковой во всех системах отсчёта, берётся инвариантная функция этого 4-вектора:
Основное уравнение релятивистской термодинамики записывается через дифференциал инвариантной энтальпии следующим образом:
Пользуясь этим уравнением, можно решить любой вопрос термодинамики движущихся систем, если известна функция .
См. также
Источники
- Болгарский А. В., Мухачев Г. А., Щукин В. К., «Термодинамика и теплопередача» Изд. 2-е, перераб. и доп. М.: «Высшая школа», 1975, 495 с.
- Харин А. Н., Катаева Н. А., Харина Л. Т., под ред. проф. Харина А. Н. «Курс химии», М.: «Высшая школа», 1975, 416 с.
Примечания
Стандартные энтальпии образования Δ Hoобр., стандартные энергии Гиббса образования Δ Goобр. неорганических веществ и их стандартные энтропии So при 298,15 К
|
|
Вещество и состояние |
Δ Hoобр., 298,15 кДж/моль | ΔGoобр., 298,15 кДж/моль | So, 298,15 Дж/(моль К) |
| Ag (кр.) | 0 | 0 | 42,55 |
| Ag+ (р-р; бесконечн.Н2О) | 105,6 | 77,13 | 72,6 |
| AgBr (кр.) | -100,7 | -97,2 | 107,1 |
| AgCl (кр.) | -127,1 | -109,8 | 96,1 |
| AgCl2— (р-р; , гип.недисс.) | -245,2 | -214,8 | 228,9 |
| AgCN (кр.) | 145,9 | 156,9 | 107,2 |
| Ag(CN)2— (р-р; бесконечн.Н2О, гип.недисс.) | 269,0 | 301,7 | 201,3 |
| AgF (кр.) | -205,9 | -187,9 | 84 |
| AgF (р-р; 20Н2О) | -223,5 | — | — |
| AgF (р-р; 50Н2О) | -223,7 | — | — |
| AgF (р-р; 1000Н2О) | -223,7 | — | — |
| AgF (р-р; бесконечн.Н2О) | -225,9 | -200,6 | 58,8 |
| AgI (кр.) | -61,9 | -66,4 | 115,5 |
| Ag(NH3)2+ (р-р; бесконечн.Н2О, гип.недисс.) | -111,2 | -17,6 | 246 |
| AgNO3 (кр.) | -124,5 | -33,6 | 140,9 |
| AgNO3 (р-р; 50Н2О) | -103,7 | — | — |
| AgNO3 (р-р; 1000Н2О) | -101,7 | — | — |
| AgNO3 (р-р; бесконечн.Н2О) | -101,8 | -34,5 | 219,8 |
| Ag2О (кр.) | -31,1 | -11,3 | 121,0 |
| Ag |
Энтальпия
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Определением этой величины служит тождество: H=U+PV
Размерность энтальпии-Дж/моль.
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
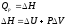
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Энтропия
Основное содержание второго начала термодинамики заключается в постулировании существования функции, называемой энтропией S, которая для обратимых процессов определяется по уравнению
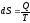
а для самопроизвольных

Изменение энтропии реакции можно рассчитать по формуле

Зависимость изменения энтропии от температуры выражается законом Кирхгофа:

Для
изолированной системы изменение энтропии
– критерий возможности самопроизвольного
протекания процесса. Если 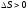 ,
то процесс возможен; если
,
то процесс возможен; если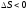 ,
то в прямом направлении процесс
невозможен; если
,
то в прямом направлении процесс
невозможен; если ,
то в системе равновесие.
,
то в системе равновесие.
Термодинамические потенциалы. Свободная энергия Гиббса и Гельмгольца.
Дл я характеристики процессов, протекающих в закрытых системах, введем новые термодинамические функции состояния: изобарно-изотермический потенциал (свободная энергия Гиббса G) и изохорно-изотермический потенциал (свободная энергия Гельмгольца F).
Для закрытой системы, в которой осуществляется равновесный процесс при постоянных температуре и объеме, выразим работу данного процесса. Которую обозначим Аmax (посколько работа процесса, проводимого равновесно, максимальна):
Amax=T∆S-∆U
Введем функцию F=U-TS-изохорно-изотермический потенциал, определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях и получим:
∆F=∆U-T∆S
Изменение энергии Гельмгольца определяется только начальным и конечным состоянием системы и не зависит от характера процесса, поскольку оно определяется двумя функциями состояния: U и S. Напомним, что от способа проведения процесса при переходе системы из начального в конечное состояние может зависеть величина полученной или затраченной работы, но не изменение функции.
Закрытую систему, находящуюся в изобарно- изотермических условиях, характеризует изобарно-изотермический потенциал G:
G=U+PV-TS=H-TS
∆G=∆H-T∆S
Дифференциалэнергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — черездавлениеp итемпературуT:

Для системы с переменным числом частиц этот дифференциал записывается так:
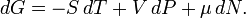
Здесь 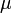 —химический
потенциал, который можно определить
как энергию, которую необходимо затратить,
чтобы добавить в систему ещё одну
частицу.
—химический
потенциал, который можно определить
как энергию, которую необходимо затратить,
чтобы добавить в систему ещё одну
частицу.
Анализ уравнения ∆G=∆H-T∆S позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный (ΔH) или энтропийный (ΔS · T).
Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса не зависит от пути процесса, следовательно можно получать разные неизвестные значения энергий Гиббса образования из уравнений, в которых с одной стороны записанны суммы энергий продуктов реакции, а с другой — суммы энергий исходных веществ.
При пользовании значениями стандартной энергии Гиббса критерием принципиальной возможности процесса в нестандартных условиях принимается условие ΔG° < 0, а критерием принципиальной невозможности — условие ΔG° > 0. В то же время, если стандартная энергия Гиббса равна нулю, это не означает, что в реальных условиях (отличных от стандартных) система будет в равновесии.
Условия самопроизвольного протекания процессов в закрытый системах :
∆G<0, dG<0;
∆F<0,dF<0.
Обсуждение:Энтальпия — Википедия
Я не знаток термодинамики, но у меня возникло чёткое впечатление, что смысл такой величины как энтальпия реакции (образования) статья не объясняет. Incnis Mrsi 21:25, 26 апреля 2008 (UTC)
- Ну есть верное зерно доля в этой критике. Надо что-то дописать, наверное, про химию. —Egor 21:34, 26 апреля 2008 (UTC)
- Ну а почему бы не выделить в отдельную статью? Я стаб сделала, можно туда же добавить энтальпии сгорания, растворения и тп…Ptichka 03:55, 27 апреля 2008 (UTC)
- Лучше пока сделать единую статью, она не слишком велика. Если разделы будут увеличиваться, можно будет выделять статьи, оставив краткие описания разделов и в этой статье. —Egor 05:38, 27 апреля 2008 (UTC)
- Даже сейчас, через десять лет после этой дискуссии, изложение вопроса о связи энтальпии с тепловым эффектом химической реакции нельзя признать вполне удовлетворительным. —Ahasheni (обс.) 01:11, 16 декабря 2018 (UTC)
- Чего греха таить, не тепловым же эффектом единым, но главный вопрос неорганики о направленности реакций через энтропийный вклад в изменении энергии Гиббса никак не освещён здесь. Зато есть странная табличка с хаотической выборкой энтальпий образования. «Краткий справочник ф.-х. величин» цитировать в этой статье бессмысленно — понимания предмета у читателя это не добавит, на мой взгляд. Dantiras (обс.) 10:10, 18 декабря 2018 (UTC)
- Спасибо, Коллега Dantiras. Ссылку на Краткий справочник я что-то не нашёл. Табличку сделаю более полной (из енвики), но скрою — или вообще уберу, я этот раздел толком не читал ещё. Про изменение энергии Гиббса не понял, статья ведь об энтальпии. Вы энтальпию называете энергией Гиббса? Ahasheni (обс.) 15:39, 18 декабря 2018 (UTC)
- Нет. Я называю всё своими именами (базис кратко можно увидеть здесь). Т.е. в статье об энтальпии необходимо отразить, что её изменение вместе с TΔS{\displaystyle T\Delta S} является определяющим фактором того, возможна ли термодинамически химическая реакция вообще. В любом случае развивать сильно мысль не стоит, бо это нужно отредиректить в статью об энергии Гиббса, но не указать такую (более фундаментальную нежели тепловой эффект х.р.) для химии информацию необходимо. Dantiras (обс.) 17:05, 18 декабря 2018 (UTC)
- Да, понятно. Спасибо, сделаем. —Ahasheni (обс.) 17:40, 18 декабря 2018 (UTC)
- А касательно таблицы энтальпий образования… Имелось в виду, что она вовсе не нужна (ВП:НЕСПРАВОЧНИК, на раскрытие темы эта информация не влияет, только занимает место и наглядной её нельзя назвать) — достаточно просто указать, что энтальпии образования могут быть как положительными, так и отрицательными (т.е. текущий текст данного раздела чуть расширить за счёт пары слов об органике, благообразить формульной записью и снабдить всё это ссылками). Кому нужны энтальпии пусть идут в статьи о конкретных веществах или ищут классический «Краткий справочник ф.-х. величин» под ред. Равделя или расширенные тематические гроссбухи. Dantiras (обс.) 17:05, 18 декабря 2018 (UTC)
- Убрал таблицу энтальпий образования. —Ahasheni (обс.) 17:40, 18 декабря 2018 (UTC)
- Нет. Я называю всё своими именами (базис кратко можно увидеть здесь). Т.е. в статье об энтальпии необходимо отразить, что её изменение вместе с TΔS{\displaystyle T\Delta S} является определяющим фактором того, возможна ли термодинамически химическая реакция вообще. В любом случае развивать сильно мысль не стоит, бо это нужно отредиректить в статью об энергии Гиббса, но не указать такую (более фундаментальную нежели тепловой эффект х.р.) для химии информацию необходимо. Dantiras (обс.) 17:05, 18 декабря 2018 (UTC)
- Спасибо, Коллега Dantiras. Ссылку на Краткий справочник я что-то не нашёл. Табличку сделаю более полной (из енвики), но скрою — или вообще уберу, я этот раздел толком не читал ещё. Про изменение энергии Гиббса не понял, статья ведь об энтальпии. Вы энтальпию называете энергией Гиббса? Ahasheni (обс.) 15:39, 18 декабря 2018 (UTC)
- Чего греха таить, не тепловым же эффектом единым, но главный вопрос неорганики о направленности реакций через энтропийный вклад в изменении энергии Гиббса никак не освещён здесь. Зато есть странная табличка с хаотической выборкой энтальпий образования. «Краткий справочник ф.-х. величин» цитировать в этой статье бессмысленно — понимания предмета у читателя это не добавит, на мой взгляд. Dantiras (обс.) 10:10, 18 декабря 2018 (UTC)
- Даже сейчас, через десять лет после этой дискуссии, изложение вопроса о связи энтальпии с тепловым эффектом химической реакции нельзя признать вполне удовлетворительным. —Ahasheni (обс.) 01:11, 16 декабря 2018 (UTC)
- Лучше пока сделать единую статью, она не слишком велика. Если разделы будут увеличиваться, можно будет выделять статьи, оставив краткие описания разделов и в этой статье. —Egor 05:38, 27 апреля 2008 (UTC)
- Ну а почему бы не выделить в отдельную статью? Я стаб сделала, можно туда же добавить энтальпии сгорания, растворения и тп…Ptichka 03:55, 27 апреля 2008 (UTC)
Подраздел об открытых системах в главе о сложных системах либо вообще не нужен, либо, если всё-таки использовать его для вывода теплового эффекта химических реакций, как это сделано в статье Тепловой эффект химической реакции) его стоит перенести в раздел Энтальпия образования. —Ahasheni (обс.) 17:33, 21 декабря 2018 (UTC)
- Предлагаю Удалить подраздел об открытых системах в главе о сложных системах. Ahasheni (обс.) 16:56, 30 декабря 2018 (UTC)
- Нет реакции. Хорошо, передвинул этот подраздел в главу Энтальпия образования. —Ahasheni (обс.) 21:47, 1 января 2019 (UTC)
- Требуется реакция? Извольте, моё мнение таково: Вы плотно занимаетесь этой статьёй, Вам и определять её структуру. —Mayyskiyysergeyy (обс.) 21:52, 1 января 2019 (UTC)
- Нет реакции. Хорошо, передвинул этот подраздел в главу Энтальпия образования. —Ahasheni (обс.) 21:47, 1 января 2019 (UTC)
Энтальпия с точки зрения классификации термодинамических функций состояния[править код]
Множество: функции состояния —> подмножество: характеристические функции состояния —> подмножество: характеристические функции состояния с размерностью энергии (термодинамические потенциалы) —> элемент множества: энтальпия. —Mayyskiyysergeyy (обс.) 01:11, 14 декабря 2018 (UTC)
- Я бы сказал, что речь здесь идёт не об энтальпии с точки зрения классификации термодинамических функций состояния, а о термодинамических потенциалах с точки зрения классификации термодинамических функций состояния. То есть как это связано именно с энтальпией, я не усматриваю. —Ahasheni (обс.) 02:07, 14 декабря 2018 (UTC)
—> элемент множества: энтальпия.
- Я сторонник дедуктивного подхода, когда от общего (множества функций состояния) идут к частному (элементу множества с названием «энтальпия»). —Mayyskiyysergeyy (обс.) 06:36, 14 декабря 2018 (UTC)
Вопросы для обсуждения[править код]
- А почему статья «Энтальпия» в ВП должна быть чисто термодинамической направленности? —Ahasheni (обс.) 19:34, 19 декабря 2018 (UTC)
- Совсем даже не обязана, просто иной направленности в текущем тексте не просматривается. То обстоятельство, что вместо принятых в феноменологической термодинамике названий переменных состояния «масса» m{\displaystyle m} и «количество (число молей)» n{\displaystyle n} вещества задействован традиционный для статистической физики термин «число частиц» N{\displaystyle N} вовсе не означает применения методов статистической физики в статье Энтальпия. Действительно, поскольку, по определению,
- N≡mNAM=nNA=nRk{\displaystyle N\equiv {\frac {mN_{A}}{M}}=nN_{A}={\frac {nR}{k}}}
- (где M{\displaystyle M} — молярная масса компонента, NA{\displaystyle N_{A}} — число Авогадро, R{\displaystyle R} — универсальная газовая постоянная, k{\displaystyle k} — постоянная Больцмана), то очевидно (поскольку M{\displaystyle M}, NA{\displaystyle N_{A}}, R{\displaystyle R} и k{\displaystyle k} — константы), что обращение к переменной N{\displaystyle N} подразумевает неявное обращение к одной из двух переменных: либо к массе m{\displaystyle m}, либо к количеству вещества n{\displaystyle n}, но никак не к числу реальных частиц вещества в системе. —Mayyskiyysergeyy (обс.) 23:53, 19 декабря 2018 (UTC)
- В моле водорода при температуре порядка десяти тысяч кельвинов будет четыре числа Авогадро частиц (включая свободные электроны), при трёх миллиардах около десяти чисел Авогадро (включая электрон-позитронные пары), при ещё более высоких температурах вообще наплевать, сколько там молей и каких барионов. Откуда такое утверждение о числе частиц вообще, да ещё и как определение? —
Как я понимаю, Вы не удосужились прочитать приведённый выше текст, где чётко сказано, что термодинамическая переменная N{\displaystyle N} не имеет никакого отношения к числу реальных частиц в системе, хотя в учебниках её и именуют таким образом. Что касается вопроса: «Откуда такое утверждение…, да ещё и как определение?», то неужели же в 21 веке трудно самому найти нужную информацию? Если Ваше железо не позволяет нормально работать в сети, то поменяйте железо, чтобы не просить кажинный раз: «Дяденька, дайте ссылку на АИ!» Сколько можно попрошайничать? Надо бы когда-то и самому мозги и руки задействовать. Памятуя о Ваших отношениях с химической термодинамикой, я подсказываю Вам, как оно правильно: в книгах по химической термодинамике под термином «число частиц» понимают число условных частиц, грамотно называемых формульными единицами; под системами, состоящими из частиц одного вида, подразумевают однокомпонентные системы; представление о независимых компонентах системы необходимо для того, чтобы избежать явного рассмотрения химических реакций тогда, когда это не требуется по условиям задачи. Вы же, вместо того, чтобы поблагодарить меня за бесплатное репетиторство, почему-то окрысились и упорно пытаетесь — да ещё и с издёвкой — опровергнуть информацию, содержащуюся в следующих статьях Википедии:
Количество вещества,
Моль,
Постоянная Больцмана,
Универсальная газовая постоянная,
Формульная единица,
Число Авогадро.
Кратко и чётко рассмотрение связи между компонентами, частицами и формульными единицами дано в книге Хаазе[1], а все формулы, на которые Вы требуете дать ссылку, в одну кучу собраны в книге Свиридовых[2]. —Mayyskiyysergeyy (обс.) 11:14, 20 декабря 2018 (UTC)
Примечания[править код]
Литература[править код]
Компоненты, частицы и формульные единицы[править код]
Запишем фундаментальное уравнение Гиббса для открытой однокомпонентной системы в двух вариантах:
- dU=TdS−PdV+μdm,{\displaystyle \mathrm {d} U=T\mathrm {d} S-P\mathrm {d} V+\mu \mathrm {d} m,}
- dU=TdS−PdV+μNdN,{\displaystyle \mathrm {d} U=T\mathrm {d} S-P\mathrm {d} V+\mu _{N}\mathrm {d} N,}
где m — масса или количество вещества компонента. А что понимать под N? Если, как сказано в статье, N — число частиц одного сорта, то приведённая формула автоматически становится неверной. Простейший пример: однокомпонентная система вода — пар. Жидкая вода содержит несколько десятков (если не сотен) сортов частиц — ионы разных сортов, мономер h3O{\displaystyle H_{2}O}, димеры, тримеры, … С водяным паром дело обстоит попроще, ибо в нём отсутствуют ионы. Как же быть? Следует (в примечании, например) уточнить, что применительно к рассматриваемой ситуации под частицей подразумевается не реальный физический объект, а условная частица с формулой h3O{\displaystyle H_{2}O}; в химии эти условные расчётные объекты называют «формульными единицами». —Mayyskiyysergeyy (обс.) 06:47, 19 декабря 2018 (UTC)
- Написал, как в Ландау и Лифшице: рассматривается система, состоящая из одинаковых частиц. Зубарев даже одинаковость частиц не оговаривает. N — любая экстенсивная величина, характеризующая количество вещества. Чем, например, килограмм воды не частица? Тогда N и m вообще одно и то же. Не стоит, на мой взгляд, вводить термины «компонент» и «однокомпонентная» в этом контексте. —Ahasheni (обс.) 14:09, 19 декабря 2018 (UTC)
- «Статистическая физика» Ландау — это не курс химической термодинамики, там и энтальпию называют древним термином. Посмотрите Ансельма Ансельм А. И. Основы статистической физики и термодинамики. — 2-е изд., стереотип.. — СПб.: Лань, 2007. — С. 225. — 427 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-0756-9., который правильно говорит о числе частиц компонента. Авторитет Ландау без оговорки о формульных единицах (частицах компонента) превращает — в голове неискушённого пользователя — использованное в «Статистическая физике» упрощение в ошибку, рассматриваемую как истина в последней инстанции. Ещё раз: упрощённый подход допустим, но он пригоден только для однокомпонентных систем и не подходит для рассмотрения фазовых и химических равновесий в многокомпонентных система, и это обстоятельство должно быть упомянуто в статье. —Mayyskiyysergeyy (обс.) 14:46, 19 декабря 2018 (UTC)
- Оговорка (скопированная из Ландау) о том, что речь идёт о системе, состоящей из одинаковых частиц, на мой взгляд, вполне достаточна. А что Ландау — это не курс химической термодинамики, так Википедия и подавно не курс химической термодинамики. —Ahasheni (обс.) 19:49, 19 декабря 2018 (UTC)
- Из текста статьи неискушённый пользователь может сделать неправильный вывод о том, что в статье речь идёт о реальных частицах вещества. Но в термодинамике любая система рассматривается как континуум, то есть ни о каких реальных частицах в системе с бесконечным числом степеней свободы речи быть не может. Если в одном учебнике излагают и статфизику, и термодинамику, то единообразия для говорят либо просто о частицах (для однокомпонентных систем), либо о частицах компонентов (для многокомпонентных систем), при этом авторы учебников обычно — кто от избытка профессионализма (считая излишним объяснять грамотным людям очевидные вещи), кто по небрежности и забывчивости, а кто и просто от безграмотности — не упоминают, что N{\displaystyle N} есть просто вспомогательная величина, вычисляемая по формуле N=nNA=nRk{\displaystyle N=nN_{A}={\frac {nR}{k}}} (где n{\displaystyle n} — число молей компонента, NA{\displaystyle N_{A}} — число Авогадро, R{\displaystyle R} — универсальная газовая постоянная, k{\displaystyle k} — постоянная Больцмана) и условно называемая числом частиц компонента. Вообще-то это одна из целей Википедии — пояснять обычным пользователям, что хотел сказать грамотный автор хорошей книги пользователям подготовленным, понимающим, что h3O{\displaystyle H_{2}O} есть обозначение для формульной единицы воды, состоящей из реальных частиц h3O{\displaystyle H_{2}O}, (h3O)2{\displaystyle (H_{2}O)_{2}}, (h3O)3{\displaystyle (H_{2}O)_{3}}, …, (h3O)x{\displaystyle (H_{2}O)_{x}}, (h4O)+{\displaystyle (H_{3}O)^{+}}, (OH)−{\displaystyle (OH)^{-}} и др.
- Оговорка (скопированная из Ландау) о том, что речь идёт о системе, состоящей из одинаковых частиц, на мой взгляд, вполне достаточна. А что Ландау — это не курс химической термодинамики, так Википедия и подавно не курс химической термодинамики. —Ahasheni (обс.) 19:49, 19 декабря 2018 (UTC)
- «Статистическая физика» Ландау — это не курс химической термодинамики, там и энтальпию называют древним термином. Посмотрите Ансельма Ансельм А. И. Основы статистической физики и термодинамики. — 2-е изд., стереотип.. — СПб.: Лань, 2007. — С. 225. — 427 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-0756-9., который правильно говорит о числе частиц компонента. Авторитет Ландау без оговорки о формульных единицах (частицах компонента) превращает — в голове неискушённого пользователя — использованное в «Статистическая физике» упрощение в ошибку, рассматриваемую как истина в последней инстанции. Ещё раз: упрощённый подход допустим, но он пригоден только для однокомпонентных систем и не подходит для рассмотрения фазовых и химических равновесий в многокомпонентных система, и это обстоятельство должно быть упомянуто в статье. —Mayyskiyysergeyy (обс.) 14:46, 19 декабря 2018 (UTC)
- Оговорка (скопированная из Ландау) о том, что речь идёт о системе, состоящей из одинаковых частиц, на мой взгляд, вполне достаточна.
- Зря Вы собственное неправильное толкование предмета обсуждения пытаетесь прикрыть авторитетом Ландау. Смотрим § 42 «Статистической физики»[1], в примечании читаем: «N = 6,023•1023 — число Авогадро». Смотрим статью Формульная единица и книгу[2], читаем: «Число формульных единиц, содержащихся в одном моле любого вещества, называется числом Авогадро, оно равно 6,022045•1023». Вывод очевиден: под переменной N академик Ландау понимал число формульных единиц, не имеющее прямого отношения к числу реальных частиц в системе. А что касается терминологии, то помнится, в книге Ландау и энтальпия названа тепловой функцией: смысл понятия определяет его содержание, а не сопоставленный понятию термин в названии. —Mayyskiyysergeyy (обс.) 05:48, 20 декабря 2018 (UTC)
Примечания[править код]
Литература[править код]
В данной главе из Ландау-Лифшица число частиц в некотором объёме идеального газа входит в формулу PV=NkT{\displaystyle PV=NkT}. Здесь N — полное число частиц в объёме: число молекул, если речь идёт водороде при не слишком высоких температурах, число недиссоцированных молекул плюс число атомов, если при более высоких температурах водород частично диссоциирован, плюс число ионов и электронов, если при ещё более высоких температурах началась ионизация. Утверждение, что число частиц в 2 граммах водорода равно числу Авогадро, справедливо только для первой ситуации из описанных, когда только и применимо понятие грамм-молекулы. —Ahasheni (обс.) 19:27, 21 декабря 2018 (UTC)
В связи с дискуссией на тему «Компоненты, частицы и формульные единицы» предлагаю решить простенькую задачу: сколько частиц содержит 1 (один) кристалл поваренной соли NaCl? Уточнение: поскольку размер кристалла в задаче не указан, нужна формула, связывающая массу кристалла и число частиц в нём. —Mayyskiyysergeyy (обс.) 10:36, 22 декабря 2018 (UTC)
Итог[править код]
Я добавил в статью комментарий о том, что понятие «число частиц» в статистической физике, например, в книге Ландау-Лифшица и в цитированной статье Зубарева, относится, в частности, к числу фотонов чёрного излучения, в каковом случае уж точно вопрос о молях и формульных единицах даже не может быть поставлен. Предлагаю считать вопрос исчерпанным и дисукуссию закрытой. И ЛЛ и Зубарев источники вполне авторитетны, переданы точно, по правилам ВП здесь не о чем спорить. Ahasheni (обс.) 17:08, 30 декабря 2018 (UTC)
- Увы, простейший, но принципиально важный для термодинамики открытых систем вопрос пока остаётся без ответа: выдаваемый за ответ «Итог» не более чем отписка типа «в огороде бузина, а в Киеве дядька». А завершается итог изумительнейшим перлом
…к числу фотонов чёрного излучения, в каковом случае уж точно вопрос о молях и формульных единицах даже не может быть поставлен.
- из которого следует, что кочующее из учебника в учебник утверждение о тождественном равенстве нулю химического потенциала фотонного газа вообще бессмысленно. Ну и ну! Как говорил райкинский персонаж: «Грубо сказать нельзя, а мягко говоря — нет слов». А вот само напоминание о существовании такой термодинамической системы непостоянного состава с частицами нулевой массы покоя, как фотонный газ, полезно и, быть может, даже уместно, ибо в Википедии даже приведена формула для энтальпии фотонного газа:
| H=(3Pα)14S.{\displaystyle H=\left({\frac {3P}{\alpha }}\right)^{\mathsf {\frac {1}{4}}}S.} | (Каноническое уравнение состояния для энтальпии фотонного газа) |
—Mayyskiyysergeyy (обс.) 17:45, 30 декабря 2018 (UTC)
- Википедия не АИ. Давление фотонного газа есть треть плотности его энергии (Формула 63.17 из Статистической физики Ландау-Лицшица), следовательно четверть плотности энтальпии. И то, и другое, как для идеального газа с показателем адиабаты 4/3. А не к ночи будь помянутое «Каноническое уравнение состояние», если и уместно в ВП вообще, то никак не в применении к фотоном газу. Ahasheni (обс.) 19:48, 30 декабря 2018 (UTC)
- Коллеги, открою вам по дружбе широко известную в узких кругах тайну: в кристаллах гомодесмической (координационной) структуры — галогенидах щелочных металлов типа NaCl{\displaystyle {\ce {NaCl}}} (структуры с ионной связью), сульфиде цинка и алмазе (структуры с ковалентной связью), кристаллах благородных газов (структуры с ван-дер-ваальсовой связью), металлах (структуры с металлической связью) — все атомы объединены в пространственный каркас при помощи однотипных взаимодействий, так что невозможно выделить обособленные структурные фрагменты, такие как молекулы или протяжённые фрагменты (слои, цепи)[1][2], то есть весь кристалл, вне зависимости от его размеров и массы, является одной гигантской частицей[3][4][5]:
| N=1.{\displaystyle N=1.} |
- Ответ на поставленный в начале комментария вопрос найден, но из этого ответа проистекает следующий вопрос. А именно, в преамбуле статьи Термодинамика читаем: «Процессы, происходящие в термодинамических системах, описываются макроскопическими величинами (температура, давление, концентрации компонентов), которые вводятся для описания систем, состоящих из большого числа частиц…», и, следовательно, термодинамическое описание неприменимо к отдельным частицам. Но мы-то с вами знаем, что даже к одному-единственному кристаллу поваренной соли термодинамика применима! Налицо противоречие. Как его разрешить? Заинтересовавшиеся найдут ответ в учебнике Ансельма[6], и ответ этот прямо связан с грамотным использованием в статистической физике и термодинамике термина частица. —Mayyskiyysergeyy (обс.) 20:28, 30 декабря 2018 (UTC)
А не к ночи будь помянутое «Каноническое уравнение состояние», если и уместно в ВП вообще, то никак не в применении к фотоном газу.
Будем исходить из того, что применимость термодинамики к фотонному газу под сомнение не ставится. А это означает, что придуманный Планком термин «каноническое уравнение состояния», имеющий право на существование для любой термодинамической системы[7], применим и к фотонному газу вне зависимости от нашего отношения к такому подходу. —Mayyskiyysergeyy (обс.) 20:50, 31 декабря 2018 (UTC)
- Добавил раздел «Плотность энергии и энтальпии идеального газа». Приведённые там соотношения справедливы и для энтальпии фотонного газа. —Ahasheni (обс.) 22:47, 31 декабря 2018 (UTC)
- Для классического идеального газа имеем:
- U(T)=CVT,{\displaystyle U(T)=C_{V}T,\qquad \qquad \qquad \qquad }(Внутренняя энергия 1 моля классического идеального газа как функция T[8][9][10])
- H(T)=CPT,{\displaystyle H(T)=C_{P}T,\qquad \qquad \qquad \qquad }(Энтальпия 1 моля классического идеального газа как функция T[11][10][12])
- Для фотонного газа справедливы соотношения:
- U(T)=αVT4,{\displaystyle U(T)=\alpha VT^{4},\qquad \qquad \qquad \qquad }(Внутренняя энергия фотонного газа как функция T[13][14][15])
- H(T)=43αVT4,{\displaystyle H(T)={\frac {4}{3}}\alpha VT^{4},\qquad \qquad \qquad \qquad }(Энтальпия фотонного газа как функция T[16][17])
- Идеальный и фотонный газы — редчайшие случаи, когда в силу простоты (с точки зрения математического описания свойств термодинамических систем) зависимость термодинамических потенциалов U{\displaystyle U} и H{\displaystyle H} (и/или их плотностей) от своих естественных независимых переменных удаётся выразить в явном виде:
- U(S,V)=CVVˇγ−1exp(S−S0CV)+U0,{\displaystyle U(S,V)={\frac {C_{V}}{{\check {V}}^{{\mathsf {\gamma }}-1}}}\exp \left({\frac {S-S_{0}}{C_{V}}}\right)+U_{0},\qquad \qquad \qquad \qquad }(Внутренняя энергия 1 моля классического идеального газа как функция S и V[18])
- H(S,P)=CPexp(S−S0CP)Pγ−1γ+H0,{\displaystyle H(S,P)=C_{P}\exp \left({\frac {S-S_{0}}{C_{P}}}\right)P^{\frac {\gamma -1}{\gamma }}+H_{0},\qquad \qquad \qquad \qquad }(Энтальпия 1 моля классического идеального газа как функция S и P[19])
- U(S)=αV(3S4αV)43,{\displaystyle U(S)=\alpha V\left({\frac {3S}{4\alpha V}}\right)^{\mathsf {\frac {4}{3}}},\qquad \qquad \qquad \qquad }(Внутренняя энергия фотонного газа как функция S[20])
- H(S,P)=(3Pα)14S,{\displaystyle H(S,P)=\left({\frac {3P}{\alpha }}\right)^{\mathsf {\frac {1}{4}}}S,\qquad \qquad \qquad \qquad }(Энтальпия фотонного газа как функция S и P[20])
- где S0{\displaystyle S_{0}}, U0{\displaystyle U_{0}} и H0{\displaystyle H_{0}} — константы, зависящие от выбора точек начала отсчёта соответствующих величин; CV{\displaystyle C_{V}} — мольная теплоёмкость при постоянном объёме, равная 3R2{\displaystyle {\frac {3R}{2}}} для одноатомных газов, 5R2{\displaystyle {\frac {5R}{2}}} для двухатомных газов и многоатомных газов с линейными молекулами, и 3R{\displaystyle 3R} для многоатомных газов с нелинейными молекулами; CP{\displaystyle C_{P}} — мольная теплоёмкость при постоянном давлении, равная CV+R{\displaystyle C_{V}+R}; Vˇ{\displaystyle {\check {V}}} — безразмерная величина, численно совпадающая со значением объёма V{\displaystyle V} в используемой системе единиц измерения; γ{\displaystyle \gamma } — показатель адиабаты, равный 53{\displaystyle {\frac {5}{3}}} для одноатомных газов, 75{\displaystyle {\frac {7}{5}}} для двухатомных газов и многоатомных газов с линейными молекулами, и 43{\displaystyle {\frac {4}{3}}} для многоатомных газов с нелинейными молекулами; α{\displaystyle \alpha } — радиационная постоянная. Обратите внимание, что в приведённых формулах по существующей в математическом аппарате термодинамики идеального газа традиции опущен стоящий перед экспонентой и равный 1{\displaystyle 1} множитель c размерностью температуры, и что в термодинамические соотношения для фотонного газа объём входит не как переменная состояния, а как характеризующий систему числовой параметр.
- Поскольку во все эти уравнения входит энтропия S{\displaystyle S}, не относящаяся к непосредственно измеримым физическим величинам, становится понятным, почему вместо важных в теоретическом плане зависимостей U=U(S,V){\displaystyle U=U(S,V)} и H=H(S,P){\displaystyle H=H(S,P)} в практических расчётах используют функции U=U(T){\displaystyle U=U(T)} и H=H(T){\displaystyle H=H(T)}. —Mayyskiyysergeyy (обс.) 19:45, 1 января 2019 (UTC)
Примечания[править код]
- ↑ Антипов Е. В., Абакумов А. М., Кристаллохимия // Большая российская энциклопедия, т. 16, 2010, с. 54.
- ↑ Зоркий П. М., Кристаллохимия // Химическая энциклопедия, т. 2, 1990, с. 536.
- ↑ Волькенштейн М. В., Молекула // Большая советская энциклопедия (3-е изд.), т. 16, 1974, с. 448.
- ↑ Шубников А. В., Кристаллы // Большая советская энциклопедия (2-е изд.), т. 23, 1953, с. 425.
- ↑ Киселев А. П., Крашенинников А. А., Основы общей химии, 2012, с. 8.
- ↑ Ансельм А. И., Основы статистической физики и термодинамики, 2007, с. 164, 225.
- ↑ Сивухин Д. В., Общий курс физики, т. 2, 2005, § 45, формула (45.8), с. 136—137.
- ↑ Миронова Г. А. и др., Молекулярная физика и термодинамика в вопросах и задачах, 2012, формула (8.100), с. 244.
- ↑ Сивухин Д. В., Общий курс физики, т. 2, 2005, § 19, формула (19.8), с. 71.
- ↑ 1 2 Полторак О. М., Термодинамика в физической химии, 1991, с. 75.
- ↑ Миронова Г. А. и др., Молекулярная физика и термодинамика в вопросах и задачах, 2012, формула (8.101), с. 244.
- ↑ Беляев Н. М., Термодинамика, 1987, с. 186.
- ↑ Миронова Г. А. и др., Молекулярная физика и термодинамика в вопросах и задачах, 2012, формула (8.124), с. 249.
- ↑ Сычёв В. В., Сложные термодинамические системы, 2009, § 9.2, формула (9.13), с. 212.
- ↑ Landsberg P. T., Thermodynamics and Statistical Mechanics, 1978, expression (13.11), p. 211.
- ↑ Миронова Г. А. и др., Молекулярная физика и термодинамика в вопросах и задачах, 2012, формула (8.128), с. 250.
- ↑ Landsberg P. T., Thermodynamics and Statistical Mechanics, 1978, expression (13.7), p. 210.
- ↑ Базаров И. П., Термодинамика, 2010, с. 111.
- ↑ Базаров И. П., Термодинамика, 2010, с. 118.
- ↑ 1