Оксиды амфотерные — Справочник химика 21
Амфотерные гидроксиды и оксиды. Амфотерность (двойственность свойств) гидроксидов и оксидов некоторых элементов проявляется в образовании ими двух рядов солей. Например, для гидроксида и оксида алюминия [c.98]Гидроксиды щелочных металлов проявляют все характерные свойства оснований они взаимодействуют С кислотными и амфотерными оксидами, амфотерными гидроксидами, кислотами, солями. В водных растворах щелочей растворяются некоторые металлы, образующие амфотерные гидроксиды (бериллий, алюминий, цинк, олово и др.), например [c.247]
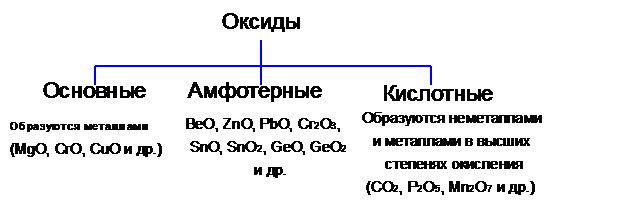
Все характеристические оксиды, как известно, относятся к оснбвным й кислотным. Первые являются оксидами металлов, вторые генетически связаны с неметаллами. Поскольку нет четкой границы между металлами и неметаллами, существует большая группа амфотерных оксидов. Амфотерность определяется не только положением элемента в Периодической системе, но и зависит от его степени окисления.

Щелочи реагируют с кислотами, кислотными оксидами, амфотерными гидроксидами, с образованием солей [c.65]
Платиновые металлы разрушаются при нагревании, со щелоча ми в присутствии кислорода, поскольку их оксиды амфотерны. Поэтому в платиновой посуде нельзя плавить щелочи, для этого используют железную, никелевую или серебряную посуду. Плати новые изделия нельзя нагревать во внутреннем конусе пламени газовой горелки и в коптящем пламени, так как с углеродом платина легко образует карбид и разрушается.
Разрушение оксидов амфотерных металлов происходит также при их сплавлении с основаниями, причем после частичного разрыва связи металл— кислород в кристаллической решетке происходит образование комплексного оксо-иона [c.392]
Оксиды амфотерные — оксиды, проявляющие свойства как основных, так и кислотных оксидов. [c.375]
Оксиды МО2 образуются при накаливании металлов в токе кислорода. АЯобр и оксидов приведены в табл. 17.41. Оксиды амфотерны с преобладанием основных свойств. [c.513]
Основный оксид Амфотерный оксид Кислотный оксид
Известны два оксида олова — окись ЗпО и двуокись ЗпОг-Оба оксида амфотерны, взаимодействуют с кислотами [c.270]
Основный гидроксид, щелочь. Белый, имеет ионное строение Na+OH . Плавится и кипит без разложения. Расплывается на воздухе, поглощает углекислый газ. Хорошо растворим в воде (с высоким э/сзо-эффектом), создает в растворе сильнощелочную среду. Нейтрализуется кислотами, реагирует с кислотными оксидами, амфотерными гидроксидами и оксидами. Концентрированный раствор разъедает стекло. Применяется в производстве бумаги, мыла и искусственного волокна, как осушитель газов. Распространенный реагент в лабораторной практике. Вызывает тяжелые ожоги кожи и глаз. [c.109]
Нейтрализуется кислотами, реагирует с кислотными оксидами, амфотерными гидроксидами и оксидами. Концентрированный раствор разъедает стекло. Применяется в производстве бумаги, мыла и искусственного волокна, как осушитель газов. Распространенный реагент в лабораторной практике. Вызывает тяжелые ожоги кожи и глаз. [c.109]
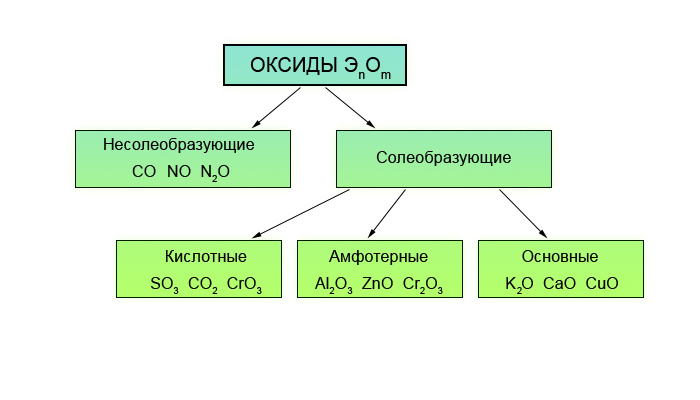
Оксиды — соединения элементов с кислородом. Они подразделяются на солеобразующие и несолеобразующие. В свою очередь, солеобразующие оксиды подразделяются на основные, кислотные и амфотерные. Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Кислотные оксиды образуют соль при взаимодействии с основаниями или основными оксидами. Амфотерные оксиды образуют соли при взаимодействии как с кислотами или кислотными оксидами, так и с основаниями или основными оксидами.
[c.23]Этот оксид амфотерный и из него получают соли двухвалентного олова, рассматриваемые в товарной позиции 2841.
 Используется в органическом синтезе как восстановитель и катализатор. [c.69]
Используется в органическом синтезе как восстановитель и катализатор. [c.69]Взаимодействие с кислотными и амфотерными сксндами (см. выше Общие свойства кислотных оксидов , Амфотерные оксиды ) растьор, ( [c.156]
Амфотерные оксиды. Амфотерными называются такие оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, т. е. обладают двойственными свойствами. К ним относятся некоторые оксиды металлов ZnO, AI2O3, Сг Оз и др.
Основные и амфотерные оксиды — это соединения металлов и амфотер-ных элементов с кислородом. Взаимодействуя с кислотными оксидами или кислотами, такие оксиды образуют соли. Некоторые из основных оксидов могут реагировать с водой, превращаясь в сильные основания — щелочи. Первым основным оксидом, с которым имел дело человек, был оксид кальция СаО — негашеная известь, которая образуется при обжиге известняка (карбоната кальция СаСОд). Почти одновременно (а может быть, и раньше) люди узнали другой оксид, амфотерный. Это был драгоценный камень рубин, оксид алюминия AlgOg, прозрачные кристаллы которого имеют кроваво-красный цвет из-за примеси оксида хрома СгдОд. Рубины с незапамятных времен украшали короны властителей — царей, королей, султанов…
Это был драгоценный камень рубин, оксид алюминия AlgOg, прозрачные кристаллы которого имеют кроваво-красный цвет из-за примеси оксида хрома СгдОд. Рубины с незапамятных времен украшали короны властителей — царей, королей, султанов…
Основные и амфотерные оксиды — это соединения металлов и амфотер ных элементов с кислородом Взаимодействуя с кислотными оксидами или кислотами, такие оксиды образуют соли Некоторые из основных оксидов могут реагировать с водой, превращаясь в сильные основания — щелочи Первым основным оксидом, с которым имел дело чело век, был оксид кальция СаО — негашеная известь, которая образуется при обжиге известняка (карбоната кальция СаСОд) Почти одновременно (а может быть, и раньше) люди узнали другой оксид, амфотерный Это был драгоценный камень рубин, оксид алюминия AlgOg, прозрач [c.70]
В щелочах взаимодействие идет труднее и образуются комплексные соединения Маз[1п(ОН)б] или Ма[Т1(0Н)4]. Причем TI2O3 не растворяется, а лишь пептизируется, дробясь на отдельные агрегаты типа ТЬОз-дгНгО.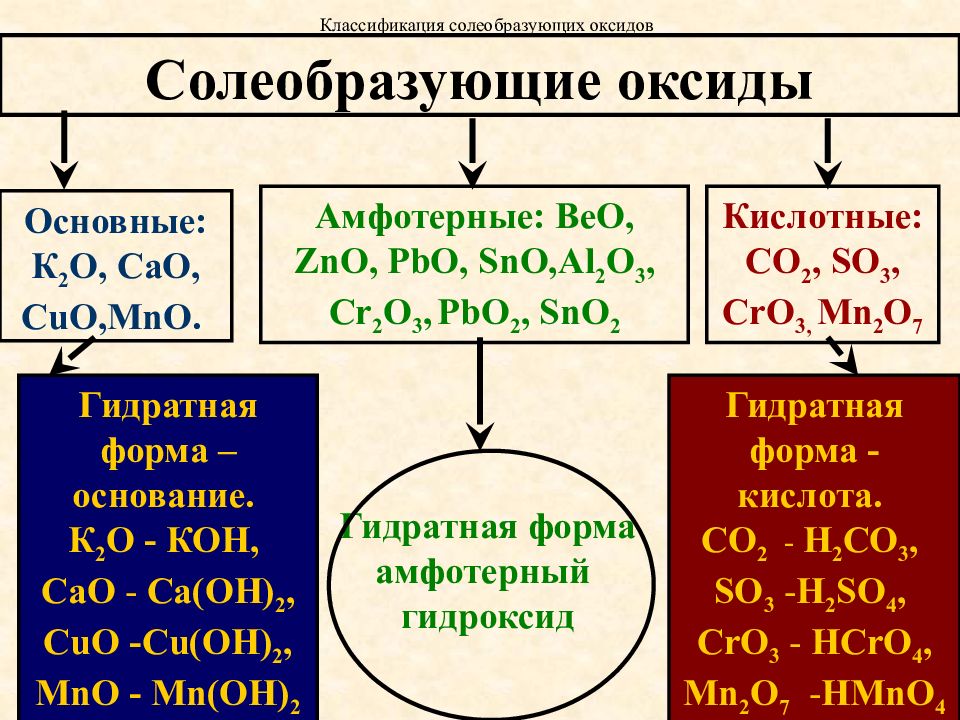
Кислоты и основания. При взаимодействии (прямом или косвенном) оксидов с водой образуются их гидратные формы, которые имеют характер кислот, оснований или амфотерных гидроксидов.
Неорганическая химия (1989) — [ c.62 ]
Общая химия в формулах, определениях, схемах (1996) — [ c.20 ]
Общая химия (1979) — [ c.349 ]
Общая химия в формулах, определениях, схемах (0) — [ c.20 ]
Химия (2001) — [ c.255 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.20 ]
Общая химия в формулах, определениях, схемах (0) — [ c.20 ]
Аккумулятор знаний по химии (1977) — [
c. 15
]
15
]
Аккумулятор знаний по химии (1985) — [ c.15 ]
Химия
ОКСИДЫ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Задания
7. Ответы
|
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород со степенью окисления -2. |
КЛАССИФИКАЦИЯ
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Оксиды не диссоциируют на ионы.
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ
1. Взаимодействие металлов с кислородом:
Взаимодействие металлов с кислородом:
4Li+O2= 2Li2O
2. Взаимодействие неметаллов с кислородом:
S+O2=
SO2
3. Разложение оснований при нагревании:
Cu(OH)2=CuO+H2O
4. Разложение некоторых солей при нагревании:
CaCO3=
CaO+ CO2
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
Основные оксиды:
1. Основный оксид + вода = основание
Na2O + H2O = 2NaOH
2. Основный оксид + кислота = соль + вода
CaO + 2HCl
= CaCl2 +H2O
3. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
Кислотные оксиды:
1. Кислотный оксид + вода = кислота
P2O5+3H2O = 2H3PO4
2. Кислотный оксид + основание = соль + вода
Кислотный оксид + основание = соль + вода
SO3 + 2NaOH
= Na2SO4
+ H2O
3. Кислотный оксид + основный оксид = соль
CaO + SO3 = CaSO4
Амфотерные оксиды:
1. Амфотерный оксид + кислота = соль(1 типа) + вода
ZnO +H2SO4
= ZnSO4 + H2O
2. Амфотерный оксид + щёлочь = соль(2 типа) +
вода
ZnO + 2NaOH = Na2ZnO2
+ H2O
Оксиды некоторых металлов можно восстановить до
металла при нагревании с углём, оксидом углерода(II),
водородом или алюминием (алюминотермия).
Fe2O3 + 3C = 2Fe + 3CO
CuO + H2 = Cu + H2O
Fe2O3 + 2Al = 2Fe + Al2O3
NiO + CO = Ni + CO2
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
оксиды, назовите их, определите тип.
Из приведённого перечня выберите
оксиды, назовите их, определите тип.
1)Na2O2 2)
Li2O 3) Al 2O3
4) FeO 5) P2O5 6) CO2 7) OF2
8) MgO
Задание 2. С
какими из перечисленных веществ может реагировать а)
Li2O
б)CO2 в)Al2O3
1)Na2O 2)SO3 3)H2O
4)NaOH 5)H2SO4 6)Na2SO4
7)O2 8) AlCl3
ОТВЕТЫ.
Наверх
Как определить характер оксида.
Поговорим о том, как определить характер оксида. Начнем с того, что все вещества принято подразделять на две группы: простые и сложные. Простые вещества подразделяют на металлы и неметаллы. Сложные соединения делят на четыре класса: основания, оксиды, соли, кислоты.
Определение
Так как характер оксидов зависит от их состава, для начала дадим определение данному классу неорганических веществ. Оксиды представляют собой которые состоят из двух элементов. Особенность их в том, что кислород всегда располагается в формуле вторым (последним) элементом.
Самым распространенным вариантом считают взаимодействие с кислородом простых веществ (металлов, неметаллов). Например, при взаимодействии магния с кислородом образуется проявляющий основные свойства.
Номенклатура
Характер оксидов зависит от их состава. Существуют определенные правила, по которым называют такие вещества.
Если оксид образован металлами главных подгрупп, валентность не указывается. Например, оксид кальция СаО. Если же в соединении первым располагается металл подобной подгруппы, который обладает переменной валентностью, то она обязательно указывается римской цифрой. Ставится после названия соединения в круглых скобках. Например, существуют оксиды железа (2) и (3). Составляя формулы оксидов, нужно помнить о том, что сумма степеней окисления в нем должна быть равна нулю.
Составляя формулы оксидов, нужно помнить о том, что сумма степеней окисления в нем должна быть равна нулю.
Классификация
Рассмотрим, как характер оксидов зависит от степени окисления. Металлы, имеющие степень окисления +1 и +2, образуют с кислородом основные оксиды. Специфичной особенностью таких соединений является основный характер оксидов. Такие соединения вступают в химическое взаимодействие с солеобразующими оксидами неметаллов, образуя с ними соли. Кроме того, реагируют с кислотами. Продукт взаимодействия зависит от того, в каком количестве были взяты исходные вещества.
Неметаллы, а также металлы со степенями окисления от +4 до +7, образуют с кислородом кислотные оксиды. Характер оксидов предполагает взаимодействие с основаниями (щелочами). Результат взаимодействия зависит от того, в каком количестве была взята исходная щелочь. При ее недостатке в качестве продукта взаимодействия образуется кислая соль. Например, в реакции оксида углерода (4) с гидроксидом натрия образуется гидрокарбонат натрия (кислая соль).
В случае взаимодействия кислотного оксида с избыточным количеством щелочи продуктом реакции будет средняя соль (карбонат натрия). Характер кислотных оксидов зависит от степени окисления.
Они подразделяются на солеобразующие оксиды (в которых степень окисления элемента равна номеру группы), а также на безразличные оксиды, не способные образовывать соли.
Амфотерные оксиды
Есть и амфотерный характер свойств оксидов. Суть его заключается во взаимодействии этих соединений и с кислотами, и со щелочами. Какие оксиды проявляют двойственные (амфотерные) свойства? К ним относят бинарные соединения металлов со степенью окисления +3, а также оксиды бериллия, цинка.
Способы получения
Существуют различные способы Самым распространенным вариантом считают взаимодействие с кислородом простым веществ (металлов, неметаллов). Например, при взаимодействии магния с кислородом образуется проявляющий основные свойства.
Кроме того, получить оксиды можно и при взаимодействии сложных веществ с молекулярных кислородом. Например, при горении пирита (сульфида железа 2) можно получить сразу два оксида: серы и железа.
Например, при горении пирита (сульфида железа 2) можно получить сразу два оксида: серы и железа.
Еще одним вариантом получения оксидов считается реакция разложения солей кислородсодержащих кислот. Например, при разложении карбоната кальция можно получить углекислый газ и оксид кальция
Основные и амфотерные оксиды образуются и при разложении нерастворимых оснований. Например, при прокаливании гидроксида железа (3) образуется оксид железа (3), а также водяной пар.
Заключение
Оксиды являются классом неорганических веществ, имеющем широкое промышленное применение. Они используются в строительной сфере, фармацевтической промышленности, медицине.
Кроме того, амфотерные оксиды часто используют в органическом синтезе в качестве катализаторов (ускорителей химических процессов).
Несолеобразующие (безразличные, индифферентные) оксиды СО, SiO, N 2 0, NO.
Солеобразующие оксиды:
Основные.
Оксиды, гидраты которых являются основания
ми. Оксиды металлов со степенями окисления +1 и +2 (реже +3). Примеры: Na 2 O — оксид натрия, СаО — оксид кальция, CuO — оксид меди (II), СоО — оксид кобальта (II), Bi 2 O 3 — оксид висмута (III), Mn 2 O 3 — оксид марганца (III).
Примеры: Na 2 O — оксид натрия, СаО — оксид кальция, CuO — оксид меди (II), СоО — оксид кобальта (II), Bi 2 O 3 — оксид висмута (III), Mn 2 O 3 — оксид марганца (III).
Амфотерные. Оксиды, гидраты которых являются амфотерными гидроксидами. Оксиды металлов со степенями окисления +3 и +4 (реже +2). Примеры: Аl 2 O 3 — оксид алюминия, Cr 2 O 3 — оксид хрома (III), SnO 2 — оксид олова (IV), МnO 2 — оксид марганца (IV), ZnO — оксид цинка, ВеО — оксид бериллия.
Кислотные. Оксиды, гидраты которых являются кислородсодержащими кислотами. Оксиды неметаллов. Примеры: Р 2 О 3 — оксид фосфора (III), СO 2 — оксид углерода (IV), N 2 O 5 — оксид азота (V), SO 3 — оксид серы (VI), Cl 2 O 7 — оксид хлора (VII). Оксиды металлов со степенями окисления +5, +6 и +7. Примеры: Sb 2 O 5 — оксид сурьмы (V). СrОз — оксид хрома (VI), МnОз — оксид марганца (VI), Мn 2 O 7 — оксид марганца (VII).
Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например: оксид меди (II) CuO черного цвета, оксид кальция СаО белого цвета — твердые вещества. Оксид серы (VI) SO 3 — бесцветная летучая жидкость, а оксид углерода (IV) СО 2 — бесцветный газ при обычных условиях.
Оксид серы (VI) SO 3 — бесцветная летучая жидкость, а оксид углерода (IV) СО 2 — бесцветный газ при обычных условиях.
CaO, СuО, Li 2 O и др. основные оксиды; ZnO, Аl 2 O 3 , Сr 2 O 3 и др. амфотерные оксиды; SiO 2 , Р 2 O 5 , СrO 3 и др. кислотные оксиды.
SO 3 , Cl 2 O 7 , Мn 2 O 7 и др..
Газообразные:
CO 2 , SO 2 , N 2 O, NO, NO 2 и др..
Растворимые:
а) основные оксиды щелочных и щелочноземельных металлов;
б) практически все кислотные оксиды (исключение: SiO 2).
Нерастворимые:
а) все остальные основные оксиды;
б) все амфотерные оксиды
1. Кислотно-основные свойства
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые иллюстрируются следующей схемой:
(только для оксидов щелочных и щелочно-земельных металлов) (кроме SiO 2).
Амфотерные оксиды, обладая свойствами и основных и кислотных оксидов, взаимодействуют с сильными кислотами и щелочами:
2. Окислительно — восстановительные свойства
Окислительно — восстановительные свойства
Если элемент имеет переменную степень окисления (с. о.), то его оксиды с низкими с. о. могут проявлять восстановительные свойства, а оксиды с высокими с. о. — окислительные.
Примеры реакций, в которых оксиды выступают в роли восстановителей:
Окисление оксидов с низкими с. о. до оксидов с высокими с. о. элементов.
2C +2 O + O 2 = 2C +4 O 2
2S +4 O 2 + O 2 = 2S +6 O 3
2N +2 O + O 2 = 2N +4 O 2
Оксид углерода (II) восстанавливает металлы из их оксидов и водород из воды.
C +2 O + FeO = Fe + 2C +4 O 2
C +2 O + H 2 O = H 2 + 2C +4 O 2
Примеры реакций, в которых оксиды выступают в роли окислителей:
Восстановление оксидов с высокими с о. элементов до оксидов с низкими с. о. или до простых веществ.
C +4 O 2 + C = 2C +2 O
2S +6 O 3 + H 2 S = 4S +4 O 2 + H 2 O
C +4 O 2 + Mg = C 0 + 2MgO
Cr +3 2 O 3 + 2Al = 2Cr 0 + 2Al 2 O 3
Cu +2 O + H 2 = Cu 0 + H 2 O
Использование оксидов малоактивных металлов дпя окисления органических веществ.
Некоторые оксиды, в которых элемент имеет промежуточную с. о., способны к диспропорционированию;
например:
2NO 2 + 2NaOH = NaNO 2 + NaNO 3 + H 2 O
1. Взаимодействие простых веществ — металлов и неметаллов — с кислородом:
4Li + O 2 = 2Li 2 O;
2Cu + O 2 = 2CuO;
4P + 5O 2 = 2P 2 O 5
2. Дегидратация нерастворимых оснований, амфотерных гидроксидов и некоторых кислот:
Cu(OH) 2 = CuO + H 2 O
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
H 2 SO 3 = SO 2 + H 2 O
H 2 SiO 3 = SiO 2 + H 2 O
3. Разложение некоторых солей:
2Cu(NO 3) 2 = 2CuO + 4NO 2 + O 2
CaCO 3 = CaO + CO 2
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O
4. Окисление сложных веществ кислородом:
CH 4 + 2O 2 = CO 2 + H 2 O
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
4NH 3 + 5O 2 = 4NO + 6H 2 O
5.Восстановление кислот-окислителей металлами и неметаллами:
Cu + H 2 SO 4 (конц) = CuSO 4 + SO 2 + 2H 2 O
10HNO 3 (конц) + 4Ca = 4Ca(NO 3) 2 + N 2 O + 5H 2 O
2HNO 3 (разб) + S = H 2 SO 4 + 2NO
6. Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Взаимопревращения оксидов в ходе окислительно-восстановительных реакций (см. окислительно-восстановительные свойства оксидов).
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород (К — О — К; Са « О; 0«Sb0 и др.). Все оксиды делятся на несоле- и солеобразующие. Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота (I) N20, оксид азота (И) N0 и др. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Так, например:
CuO + h3S04 — CuS04 + Н20, MgO + С02 = MgC03.
Основными могут быть только оксиды металлов. Однако не все оксиды металлов являются основными — многие из них относятся к амфотерным или кислотным (так, Сг203 — амфотерный, а Сг03 — кислотный оксид). Часть основных оксидов растворяется в воде, образуя соответствующие основания:
Na20 + Н20 — 2NaOH.
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Так, например:
S02 + 2К0Н — K2S03 + Н20, Р4О10 + бСаО = 2Са3(Р04)2.
Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (В203; N205; Мп207). Многие кислотные оксиды (их также называют ангидридами) соединяются с водой, образуя кислоты:
N203 + Н20 — 2HN02.
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. К амфотерным оксидам относятся: ZnO; А1203; Сг203; Mn02; Fe203 и др. Например, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом калия: ZnO + 2НС1 = ZnCl2 + Н20,
ZnO + 2 КОН = K2Zn02 + Н20, ZnO + 2КОН + Н20 — K2. Амфотерная природа оксидов, нерастворимых в растворах кислот, и гидроксидов доказывается с помощью более сложных реакций. Так, прокаленные оксиды алюминия и хрома (III) практически нерастворимы в растворах кислот и в щелочах. В реакции сплавления их с дисуль-фатом калия проявляются основные свойства оксидов:
А1203 + 3K2S207« 3K2S04 + A12(S04)3.
Так, например:
S02 + 2К0Н — K2S03 + Н20, Р4О10 + бСаО = 2Са3(Р04)2.
Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (В203; N205; Мп207). Многие кислотные оксиды (их также называют ангидридами) соединяются с водой, образуя кислоты:
N203 + Н20 — 2HN02.
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. К амфотерным оксидам относятся: ZnO; А1203; Сг203; Mn02; Fe203 и др. Например, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом калия: ZnO + 2НС1 = ZnCl2 + Н20,
ZnO + 2 КОН = K2Zn02 + Н20, ZnO + 2КОН + Н20 — K2. Амфотерная природа оксидов, нерастворимых в растворах кислот, и гидроксидов доказывается с помощью более сложных реакций. Так, прокаленные оксиды алюминия и хрома (III) практически нерастворимы в растворах кислот и в щелочах. В реакции сплавления их с дисуль-фатом калия проявляются основные свойства оксидов:
А1203 + 3K2S207« 3K2S04 + A12(S04)3. При сплавлении с гидроксидами выявляются кислотные свойства оксидов:
А1203 + 2КОН — 2КА102 4- Н20.
Таким образом, амфотерным оксидам присущи свойства как основных, так и кислотных оксидов. Отметим, что у различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, т. е. у этого оксида основная и кислотная функции выражены примерно в одинаковой мере. Оксид железа (III) — Fe203 — обладает преимущественно основными свойствами; кислотные свойства проявляет, только взаимодействуя со щелочами при высоких температурах:
Fe203 + 2NaOH « 2NaFe02 + Н20.
Способы получения оксидов
[Т] Получение из простых веществ:
2Са + 02 = 2СаО.
\2\ Разложение сложных веществ:
а) разложение оксидов
4Сг03 = 2Сг203 + 302!;
б) разложение гидроксидов
Са(ОН)2 = СаО + Н20;
в) разложение кислот
н2со3 = н2о + со2Т;
г) разложение солей
Взаимодействие кислот — окислителей с металлами и неметаллами:
Си + 4HN03(Koim, = Cu(N03)2 + 2N02t + 2Н20,
С + 2h3S04 (кояд, — С02| + 2S02t + 2Н20.
При сплавлении с гидроксидами выявляются кислотные свойства оксидов:
А1203 + 2КОН — 2КА102 4- Н20.
Таким образом, амфотерным оксидам присущи свойства как основных, так и кислотных оксидов. Отметим, что у различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, т. е. у этого оксида основная и кислотная функции выражены примерно в одинаковой мере. Оксид железа (III) — Fe203 — обладает преимущественно основными свойствами; кислотные свойства проявляет, только взаимодействуя со щелочами при высоких температурах:
Fe203 + 2NaOH « 2NaFe02 + Н20.
Способы получения оксидов
[Т] Получение из простых веществ:
2Са + 02 = 2СаО.
\2\ Разложение сложных веществ:
а) разложение оксидов
4Сг03 = 2Сг203 + 302!;
б) разложение гидроксидов
Са(ОН)2 = СаО + Н20;
в) разложение кислот
н2со3 = н2о + со2Т;
г) разложение солей
Взаимодействие кислот — окислителей с металлами и неметаллами:
Си + 4HN03(Koim, = Cu(N03)2 + 2N02t + 2Н20,
С + 2h3S04 (кояд, — С02| + 2S02t + 2Н20. Вытеснение летучего оксида менее летучим при высокой температуре:
Na2CO„ + Si02 = Na2Si03 + С02 f.
сплавление
Вопросы и задачи для самостоятельного решения
L Укажите, какие неорганические вещества называют оксидами. Что лежит в основе разделения оксидов на соле- и несолеобразующие; по каким химическим свойствам солеобразующие оксиды делятся на основные, кислотные и амфотерные.
2. Определите, к какому типу относятся следующие оксиды:
CaO, SiO, BaO, Si02, S03, Р4О10, FeO, СО, ZnO, Cr203, NO.
3. Укажите, какие основания соответствуют следующим оксидам:
Na20, CaO, А1203, CuO, FeO, Fe203.
4. Укажите, ангидридами каких кислот являются следующие оксиды:
С02, S02, S03, N203, N205, Cr03, P4O10.
5. Укажите, какие из перечисленных ниже оксидов растворимы в воде:
CaO, CuO, Cr203, Si02, FeO, К20, СО, N02, Cr03, ZnO, А1203.
6. Укажите, с какими из перечисленных ниже веществ будет реагировать оксид углерода (IV):
S02, КОН, Н20, Са(ОН)2, СаО.
7. Напишите уравнения реакций, отражающие свойства следующих основных оксидов:
FeO, Cs20, HgO, Bi203.
Вытеснение летучего оксида менее летучим при высокой температуре:
Na2CO„ + Si02 = Na2Si03 + С02 f.
сплавление
Вопросы и задачи для самостоятельного решения
L Укажите, какие неорганические вещества называют оксидами. Что лежит в основе разделения оксидов на соле- и несолеобразующие; по каким химическим свойствам солеобразующие оксиды делятся на основные, кислотные и амфотерные.
2. Определите, к какому типу относятся следующие оксиды:
CaO, SiO, BaO, Si02, S03, Р4О10, FeO, СО, ZnO, Cr203, NO.
3. Укажите, какие основания соответствуют следующим оксидам:
Na20, CaO, А1203, CuO, FeO, Fe203.
4. Укажите, ангидридами каких кислот являются следующие оксиды:
С02, S02, S03, N203, N205, Cr03, P4O10.
5. Укажите, какие из перечисленных ниже оксидов растворимы в воде:
CaO, CuO, Cr203, Si02, FeO, К20, СО, N02, Cr03, ZnO, А1203.
6. Укажите, с какими из перечисленных ниже веществ будет реагировать оксид углерода (IV):
S02, КОН, Н20, Са(ОН)2, СаО.
7. Напишите уравнения реакций, отражающие свойства следующих основных оксидов:
FeO, Cs20, HgO, Bi203.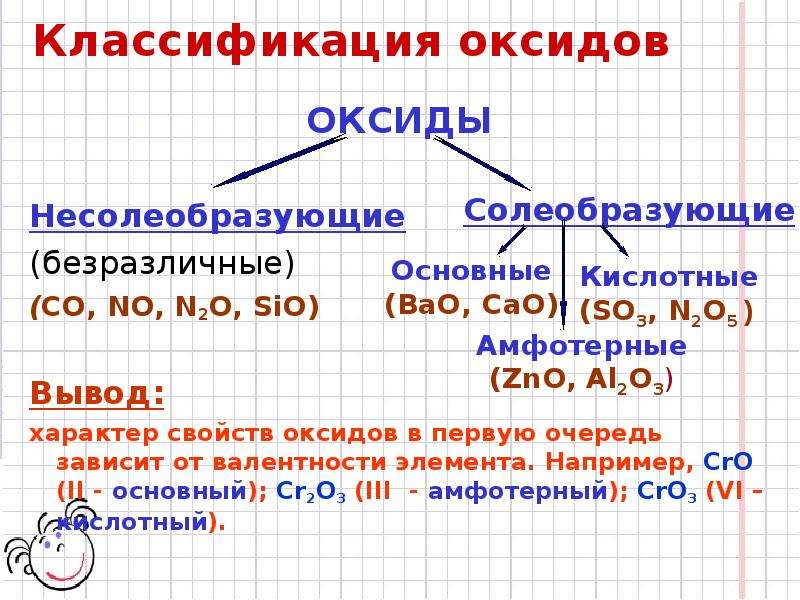 Напишите уравнения реакций, доказывающие кислотный характер следующих оксидов:
S03, Mn207, Р4О10, Cr03, Si02.
9. Покажите, каким образом можно доказать амфо-терный характер следующих оксидов: ZnO, А1203, Сг203.
10. На примере реакций получения оксида серы (IV) укажите основные способы получения оксидов.
11. Закончите уравнения следующих химических реакций, отражающие способы получения оксидов:
1) Li + 02->
2) Si2H6 + 02 —
3) PbS + 02
4) Са3Р2 + 02
5) А1(ОН)з —
6) Pb(N03)2 U
7) HgCl2 + Ва(ОН)2
8) MgC03 + HN03 —
9) Са3(Р04)2 + Si02 —
10) С02 + С £
11) Cu + HNO3(30o/o) £
12) С + h3S04 (конц)
12. Определите формулу оксида, образованного элементом со степенью окисления +2, если известно, что для растворения 4,05 г его потребовалось 3,73 г соляной кислоты.
Ответ: СиО.
13. При взаимодействии оксида углерода (IV) с едким натром образовалось 21 г гидрокарбоната натрия. Определите объем оксида углерода (IV) и массу гидроксида натрия, затраченные на получение соли.
Ответ: 5,6 л С02; 10 г NaOH.
Напишите уравнения реакций, доказывающие кислотный характер следующих оксидов:
S03, Mn207, Р4О10, Cr03, Si02.
9. Покажите, каким образом можно доказать амфо-терный характер следующих оксидов: ZnO, А1203, Сг203.
10. На примере реакций получения оксида серы (IV) укажите основные способы получения оксидов.
11. Закончите уравнения следующих химических реакций, отражающие способы получения оксидов:
1) Li + 02->
2) Si2H6 + 02 —
3) PbS + 02
4) Са3Р2 + 02
5) А1(ОН)з —
6) Pb(N03)2 U
7) HgCl2 + Ва(ОН)2
8) MgC03 + HN03 —
9) Са3(Р04)2 + Si02 —
10) С02 + С £
11) Cu + HNO3(30o/o) £
12) С + h3S04 (конц)
12. Определите формулу оксида, образованного элементом со степенью окисления +2, если известно, что для растворения 4,05 г его потребовалось 3,73 г соляной кислоты.
Ответ: СиО.
13. При взаимодействии оксида углерода (IV) с едким натром образовалось 21 г гидрокарбоната натрия. Определите объем оксида углерода (IV) и массу гидроксида натрия, затраченные на получение соли.
Ответ: 5,6 л С02; 10 г NaOH. 14. При электролизе 40 моль воды выделилось 620 г кислорода. Определите выход кислорода.
Ответ: 96,9%.
Определите массу кислой и средней солей, которые могут быть получены при взаимодействии 5,6 л S02 с гидроксидом калия. Чему равна масса щелочи в каждом отдельном случае?
Ответ: 30 г KHS03; 39,5 г K2S03; 14 г КОН; 28 г КОН.
16. Определите простейшую формулу соединения, содержащего 68,4% хрома и 31,6% кислорода.
Ответ: Сг203.
17. Определите степень окисления марганца в оксиде, если известно, что на 1 г марганца приходится 1,02 г кислорода.
Ответ: +7.
18. В оксиде одновалентного элемента массовая доля кислорода 53,3 %. Назовите элемент.
Ответ: литий.
19. Определите массу воды, необходимой для растворения 188 г оксида калия, если получили раствор с массовой долей КОН 5,6 %.
Ответ: 3812 г.
20. При восстановлении углеродом 32 г оксида железа (III) образовалось 20,81 г железа. Определите выход железа.
Ответ: 90 %.
14. При электролизе 40 моль воды выделилось 620 г кислорода. Определите выход кислорода.
Ответ: 96,9%.
Определите массу кислой и средней солей, которые могут быть получены при взаимодействии 5,6 л S02 с гидроксидом калия. Чему равна масса щелочи в каждом отдельном случае?
Ответ: 30 г KHS03; 39,5 г K2S03; 14 г КОН; 28 г КОН.
16. Определите простейшую формулу соединения, содержащего 68,4% хрома и 31,6% кислорода.
Ответ: Сг203.
17. Определите степень окисления марганца в оксиде, если известно, что на 1 г марганца приходится 1,02 г кислорода.
Ответ: +7.
18. В оксиде одновалентного элемента массовая доля кислорода 53,3 %. Назовите элемент.
Ответ: литий.
19. Определите массу воды, необходимой для растворения 188 г оксида калия, если получили раствор с массовой долей КОН 5,6 %.
Ответ: 3812 г.
20. При восстановлении углеродом 32 г оксида железа (III) образовалось 20,81 г железа. Определите выход железа.
Ответ: 90 %.
Химические соединения, состоящие из кислорода и любого другого элемента периодической системы, называют оксидами.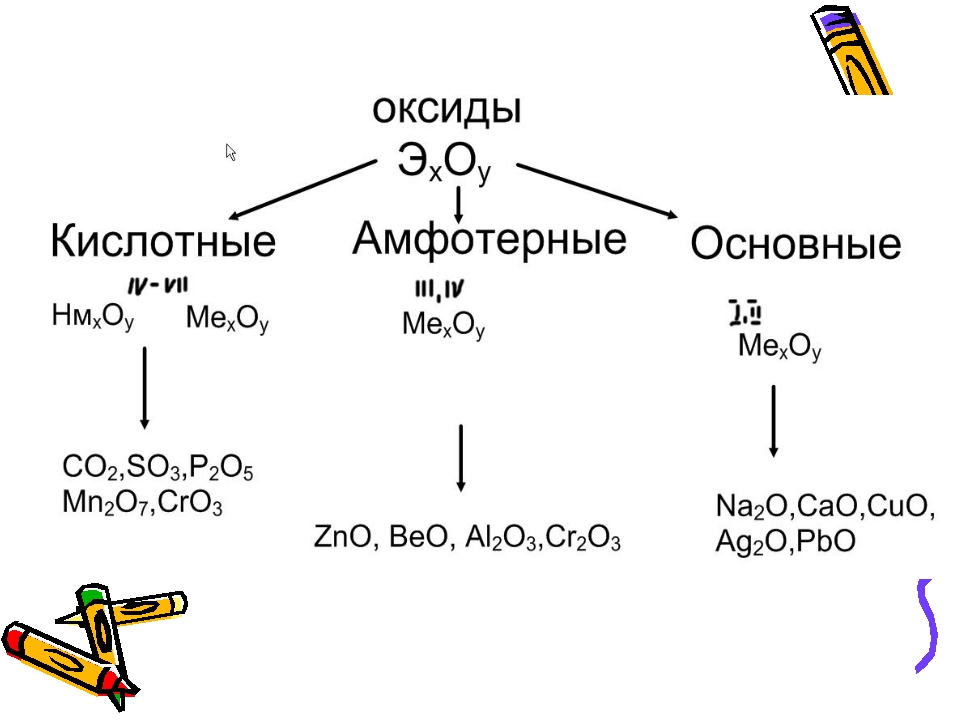 В зависимости от свойств, их классифицируют на основные, амфотерные и кислотные. Характер оксидов можно определить теоретически и практическим путем.
В зависимости от свойств, их классифицируют на основные, амфотерные и кислотные. Характер оксидов можно определить теоретически и практическим путем.
Вам понадобится
- — периодическая система;
- — лабораторная посуда;
- — химические реактивы.
Инструкция
- Вам необходимо хорошо представлять, как изменяются свойства химических элементов в зависимости от их местоположения в таблице Д.И. Менделеева. Поэтому повторите периодический закон, электронное строение атомов (от него зависит степень окисления элементов) и прочее.
- Не прибегая к практическим действиям, вы сможете установить характер оксида, используя только периодическую систему. Ведь известно, что в периодах, в направлении слева направо щелочные свойства оксидов сменяются на амфотерные, а затем — на кислотные. Например, в III периоде оксид натрия (Na2O) проявляет основные свойства, соединение алюминия с кислородом (Al2O3) имеет амфотерный характер, а окисл хлора (ClO2) – кислотный.

- Имейте в виду, в главных подгруппах щелочные свойства оксидов усиливаются сверху вниз, а кислотность наоборот ослабевает. Так, в I группе у оксида цезия (CsO) основность сильнее, чем у оксида лития (LiO). В V группе оксид азота (III) — кислотный, а оксид висмута (Bi2O5) уже основный.
- Другой способ определения характера оксидов. Допустим, дана задача опытным путем доказать основные, амфотерные и кислотные свойства оксида кальция (CaO), оксида 5-валентного фосфора (P2O5(V)) и оксида цинка (ZnO).
- Сначала возьмите две чистые пробирки. Из склянок, с помощью химического шпателя, насыпьте в одну немного CaO, а в другую P2O5. Затем налейте в оба реактива по 5-10 мл дистиллированной воды. Стеклянной палочкой мешайте до полного растворения порошка. Опустите кусочки лакмусовой бумаги в обе пробирки. Там, где находится оксид кальция – индикатор станет синего цвета, что является доказательством основного характера исследуемого соединения. В пробирке с оксидом фосфора (V) бумага окрасится в красный цвет, следовательно, P2O5 – кислотный оксид.

- Так как оксид цинка не растворим в воде, для доказательства его амфотерности проведите реакции с кислотой и гидроксидом. В том и другом случае кристаллы ZnO вступят в химическую реакцию. Например:
ZnO + 2KOH = K2ZnO2 + h3O
3ZnO + 2h4PO4→ Zn3(PO4)2↓ + 3h3O
Химические соединения, состоящие из кислорода и любого другого элемента периодической системы, называют оксидами. В зависимости от свойств, их классифицируют на основные, амфотерные и кислотные. Характер оксидов можно определить теоретически и практическим путем.
Вам понадобится
- — периодическая система;
- — лабораторная посуда;
- — химические реактивы.
Инструкция
Вам необходимо хорошо представлять, как изменяются свойства химических элементов в зависимости от их местоположения в таблице Д.И. Менделеева. Поэтому повторите периодический закон, электронное строение атомов (от него зависит степень окисления элементов) и прочее.
Не прибегая к практическим действиям, вы сможете установить характер оксида, используя только периодическую систему. Ведь известно, что в периодах, в направлении слева направо щелочные свойства оксидов сменяются на амфотерные, а затем — на кислотные. Например, в III периоде оксид натрия (Na2O) проявляет основные свойства, соединение алюминия с кислородом (Al2O3) имеет амфотерный характер, а окисл хлора (ClO2) – кислотный.
Ведь известно, что в периодах, в направлении слева направо щелочные свойства оксидов сменяются на амфотерные, а затем — на кислотные. Например, в III периоде оксид натрия (Na2O) проявляет основные свойства, соединение алюминия с кислородом (Al2O3) имеет амфотерный характер, а окисл хлора (ClO2) – кислотный.
Имейте в виду, в главных подгруппах щелочные свойства оксидов усиливаются сверху вниз, а кислотность наоборот ослабевает. Так, в I группе у оксида цезия (CsO) основность сильнее, чем у оксида лития (LiO). В V группе оксид азота (III) — кислотный, а оксид висмута (Bi2O5) уже основный.
Другой способ определения характера оксидов. Допустим, дана задача опытным путем доказать основные, амфотерные и кислотные свойства оксида кальция (CaO), оксида 5-валентного фосфора (P2O5(V)) и оксида цинка (ZnO).
Сначала возьмите две чистые пробирки. Из склянок, с помощью химического шпателя, насыпьте в одну немного CaO, а в другую P2O5. Затем налейте в оба реактива по 5-10 мл дистиллированной воды. Стеклянной палочкой мешайте до полного растворения порошка. Опустите кусочки лакмусовой бумаги в обе пробирки. Там, где находится оксид кальция – индикатор станет синего цвета, что является доказательством основного характера исследуемого соединения. В пробирке с оксидом фосфора (V) бумага окрасится в красный цвет, следовательно, P2O5 – кислотный оксид.
Стеклянной палочкой мешайте до полного растворения порошка. Опустите кусочки лакмусовой бумаги в обе пробирки. Там, где находится оксид кальция – индикатор станет синего цвета, что является доказательством основного характера исследуемого соединения. В пробирке с оксидом фосфора (V) бумага окрасится в красный цвет, следовательно, P2O5 – кислотный оксид.
Так как оксид цинка не растворим в воде, для доказательства его амфотерности проведите реакции с кислотой и гидроксидом. В том и другом случае кристаллы ZnO вступят в химическую реакцию. Например:
ZnO + 2KOH = K2ZnO2 + h3O
3ZnO + 2h4PO4 Zn3(PO4)2 + 3h3O
Обратите внимание
Запомните, характер свойств оксида напрямую зависит от валентности элемента, входящего в его состав.
Полезный совет
Не забывайте, что еще существуют так называемые безразличные (несолеобразующие) оксиды, не реагирующие в обычных условиях ни с гидроксидами, ни с кислотами. К ним относятся оксиды неметаллов с валентностью I и II, например: SiO, CO, NO, N2O и т. д., но встречаются и «металлические»: MnO2 и некоторые другие.
д., но встречаются и «металлические»: MnO2 и некоторые другие.
Внимание, только СЕГОДНЯ!
Все интересное
В зависимости от кислотно-основных свойств химических элементов, складываются и их возможные реакции. Причем эти свойства влияют не только на элемент, но и на его соединения. Что такое кислотно-основные свойства
Основные свойства проявляют…
Важнейшие классы неорганических соединений – оксиды, кислоты, основания, амфотерные гидроксиды и соли. Для каждого из этих классов характерны свои общие свойства и способы получения. К настоящему моменту известно более 100 тысяч различных…
Одними из основных в химии являются 2 понятия: «простые вещества» и «сложные вещества». Первые образованы атомами одного химического элемента и подразделяются на неметаллы и металлы. Оксиды, гидроксиды, соли — это классы…
Существует 3 вида оксида меди. Отличаются они друг от друга валентностью. Соответственно, существуют одновалентный, двухвалентный и трехвалентный оксиды меди. Каждый из оксидов имеет свои химические свойства. Инструкция 1Оксид меди (I) — Cu2O. В…
Каждый из оксидов имеет свои химические свойства. Инструкция 1Оксид меди (I) — Cu2O. В…
Хлор способен образовывать несколько различных оксидов. Все они применяются в промышленности в больших объемах, так как востребованы во многих областях промышленности. Хлор образует с кислородом целый ряд оксидов, общее число которых составляет…
Знания химических свойств кислот, в частности, их взаимодействие с оксидами, сослужат хорошую службу при выполнении самых разнообразных заданий по химии. Это позволит решить расчетные задачи, осуществить цепочку превращений, выполнить задания…
Существует множество неорганических веществ, которые подразделяются на классы. Для того чтобы правильно классифицировать предложенные соединения, необходимо иметь представление об особенностях строения каждой группы веществ, которых всего четыре.…
Эквивалент – такое количество химического элемента, которое либо связывает, либо замещает один моль атомов водорода. Соответственно, масса одного эквивалента называется эквивалентной массой (Мэ), и выражается в г/моль.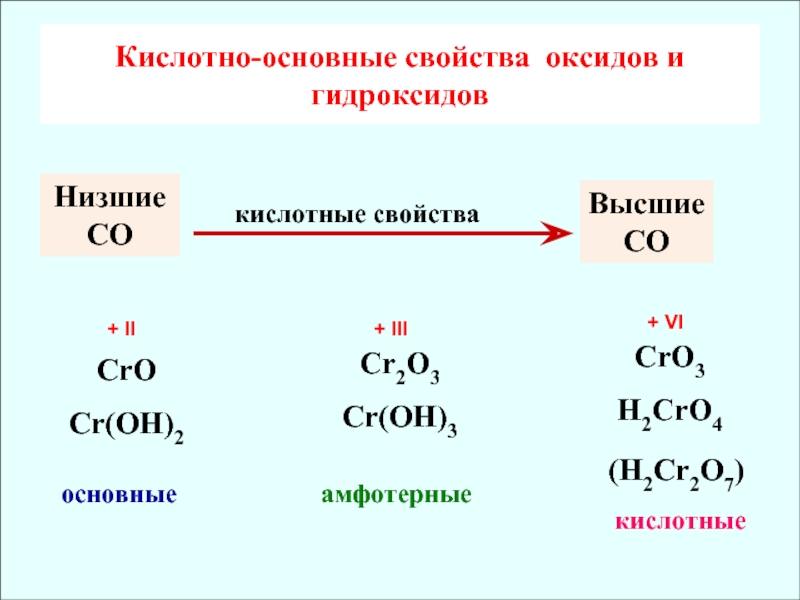 Перед учащимися на химии часто…
Перед учащимися на химии часто…
Оксид – химическое соединение, которое состоит из двух элементов. Один из элементов оксида — кислород. По характеру оксиды классифицируются на кислотные и основные. Кислотность или основность можно доказать, зная химические свойства веществ, и…
Химические свойства вещества — это способность изменять свой состав в ходе химических реакций. Реакция может протекать либо в виде саморазложения, либо при взаимодействии с другими веществами. Свойства вещества зависят не только от его состава, но и…
Тест » Кислотные и основные оксиды»
Тест по теме: «Обобщение сведений о важнейших классах неорганических соединений»
8 класс.
Вопрос № 1
Определите характер оксидов К2О, Al2 О3, BaO, SO3,СrО3.
1) К2О, BaO — кислотные; SO3, СrО3-амфотерные, Al2 О3— основный
2) К2О, СrО3— основные; BaO — кислотный; SO3, Al2 О3— амфотерные.
3) К2О, BaO — основные; Al2 О3-амфотерный; SO3, СrО3— кислотные
(Верный ответ — 3.)
Определите характер оксидов. Na2O, Сг2Оз, СО2,СоО, Мn2О7.
1) Na2O, Сг2О3 — кислотные; СО2, СоО— амфотерные. Мn2О7— основный
2) Na2O, Сг2О3— основные; СоО, СО2— кислотные, Мn2О7— амфотерный.
3) Na2O, СоО — основные; Сг2О3 — амфотерный, СО2 Мn2О7— кислотные.
(Верный ответ — 3.)
Вопрос № 3
С какими из перечисленных веществ могут взаимодействовать кислотные оксиды: вода, кислота, основание, основный оксид, амфотерный оксид, амфотерный гидроксид. Приведите уравнения реакций
Приведите уравнения реакций
1) Вода, кислота, основание
2) Вода, основание, основный оксид, кислота.
3) Вода, основание, основный оксид, амфотерный оксид, амфотерный гидроксид.
4) Кислота, амфотерный оксид, амфотерный гидроксид.
(Верный ответ — 3.)
С какими из перечисленных веществ могут взаимодействовать основные оксиды: вода, кислота, основание, кислотный оксид, основный оксид, амфотерный оксид. Приведите уравнения реакций.
1) Вода, основание, основный оксид.
2) Вода, кислота, основание.
3) Вода, амфотерный оксид, основный оксид.
4) Вода, кислота, кислотный оксид, амфотерный оксид.
5) Вода, кислота, основание, амфотерный оксид.
(Верный ответ — 4.)
Вопрос № 5
Какие из перечисленных веществ реагируют с водой: СО2, CaO, SO3HCl, NH3, N2, Сu, Na?
1) HCl, N2, Сu.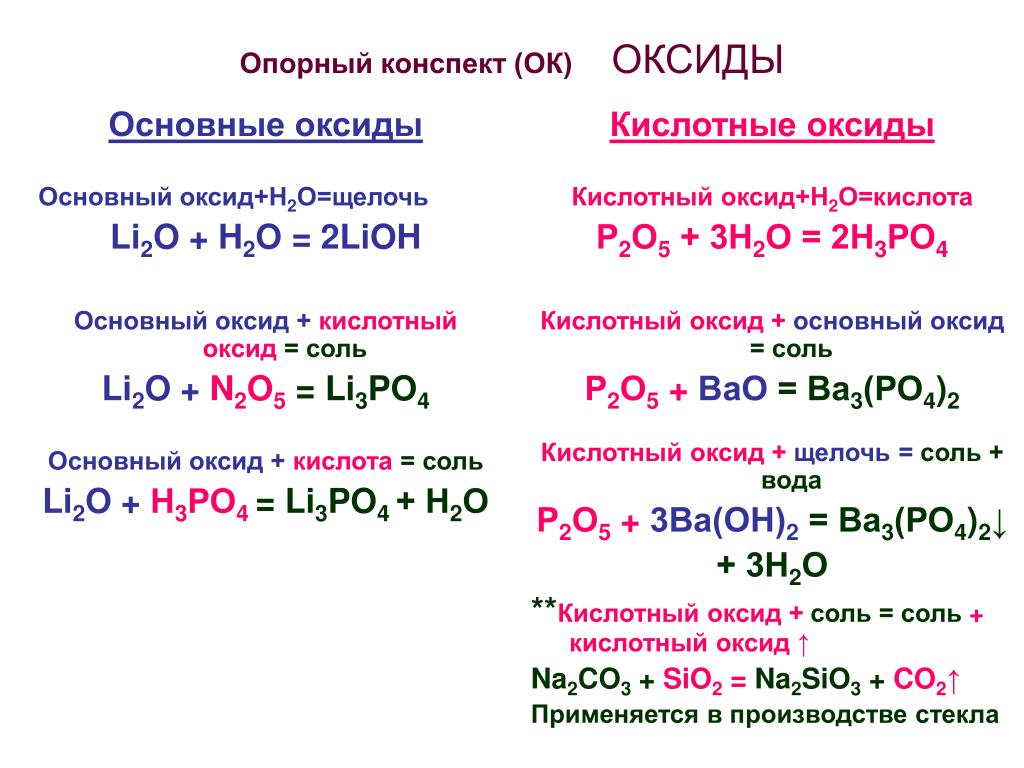
2) СО2, Сu, HCl.
3) N2, CaO, NH3.
4) CO2, CaO, SO3, NH3, Na.
5) SO3, CaO, N2.
(Верный ответ — 4.)
Вопрос № 6
Какие соли можно получить при взаимодействии гидроксида бария и серной кислоты?Приведите уравнения реакций
1) Сульфат
2) Сульфат, гидросульфат.
3) Сульфат, гидросульфат, гидроксосульфат
4) Сульфат, гидроксисульфат.
( Верный ответ — 3.)
Вопрос № 7
Какие соли можно получить при взаимодействии гидроксида цезия и серной кислоты? Приведите уравнения реакций
1) Сульфат, гидроксисульфат.
2) Сульфат, гидросульфат, гидроксисульфат.
3) Сульфат, гидросульфат
(Верный ответ — 3. )
)
Вопрос № 8
Какие соли можно получить при взаимодействии гидроксида магния и азотной кислоты? Приведите уравнения реакций.
1) Нитрат, гидронитрат, гидрокси-нитрат
2) Нитрат
3) Нитрат, гидроксинитрат.
(Верный ответ – 3)
Вопрос № 9
Какие соли можно получить при взаимодействии гидроксида натрия и фосфорной кислоты? Приведите уравнения реакций
1) Фосфат, гидрофосфат.
2) Фосфат, гидрофосфат, дигидро-фосфат.
3) Фосфат, гидроксифосфат.
4) Фосфат
(Верный ответ — 2.)
Какие соли можно получить при взаимодействии гидроксида кальция и соляной кислоты? Приведите уравнения реакций.
1) Хлорид.
2) Хлорид,гидрохлорид.
3)Хлорид,гидроксихлорид.
(Верный ответ — 3.)
Определите характер оксидов: СгО, Cr2О3 СrО3. Приведите уравнения возможных реакций с КОН и HCl.
1) СгО — кислотный, Cr2О3— основный, СrО3 — амфотерный.
2) СгО — основный, Cr2О3— кислотный, СrО3 — амфотерный.
3) СгО — основный, Cr2О3— кислотный, СrО3— амфотерный
(Верный ответ — 3.)
Определите характер оксидов: МnО, МnО2 , Мn2О7.
1) МnО — кислотный, МnО2 — основный, Мn2О7— амфотерный.
2) МnО — основный, МnО2 — кислотный, Мn2О7 — амфотерный.
3) МnО — основный, МnО2 — амфотерный, Мn2О7 — кислотный.
(Верный ответ — 2.)
Оксиды амфотерные — Энциклопедия по машиностроению XXL
Оксид цинка ZnO. Имеет амфотерный ха-)актер, но основные свойства преобладают. [c.381]Оксид цинка ZnO. Имеет амфотерный характер, но основные свойства преобладают. В присутствии АЬОз (от 6 до 8 %) происходит нежелательное образование шпинели. Если содержание ZnO превышает поглощающую способность шлака, то она образует суспензию или восстанавливается до газообразного цинка, что вредно сказывается на работе печи. [c.381]
Защитные пленки на алюминии имеют амфотерный характер, растворяясь в сильных кислотах (неокисляющих) и особенно легко —в щелочах. Установлено, что водный оксид алюминия из растворов алюминиевых солей начинает осаждаться в интервалах рН=3- -9, причем максимум осаждения приходится на pH = 5- -7. Таким образом максимальные защитные свойства оксидных пленок на алюминии будут проявляться в нейтральных средах. Известно, что в сильно кислых и особенно в щелочных средах алюминий активируется, потенциал его делается весьма отрицатель-
[c.259]
Таким образом максимальные защитные свойства оксидных пленок на алюминии будут проявляться в нейтральных средах. Известно, что в сильно кислых и особенно в щелочных средах алюминий активируется, потенциал его делается весьма отрицатель-
[c.259]
Для большинства металлов, кроме амфотерных (AI, Сг), повышение pH раствора способствует повышению перенапряжения процесса вследствие того, что растворимость анодных оксидов и гидроксидов с увеличением pH уменьшается. Наиболее полные данные о влиянии pH в равновесных условиях можно получить из диаграмм Пурбэ. Однако данные диаграммы известны лишь для чистых металлов. [c.58]
Оксиды и соответствующие им гидроксиды имеют различный характер (основной, амфотерный, кислотный) в зависимости от природы металла и его валентности в этих соединениях, о чем будет сказано ниже. [c.46]
Окись алюминия А1.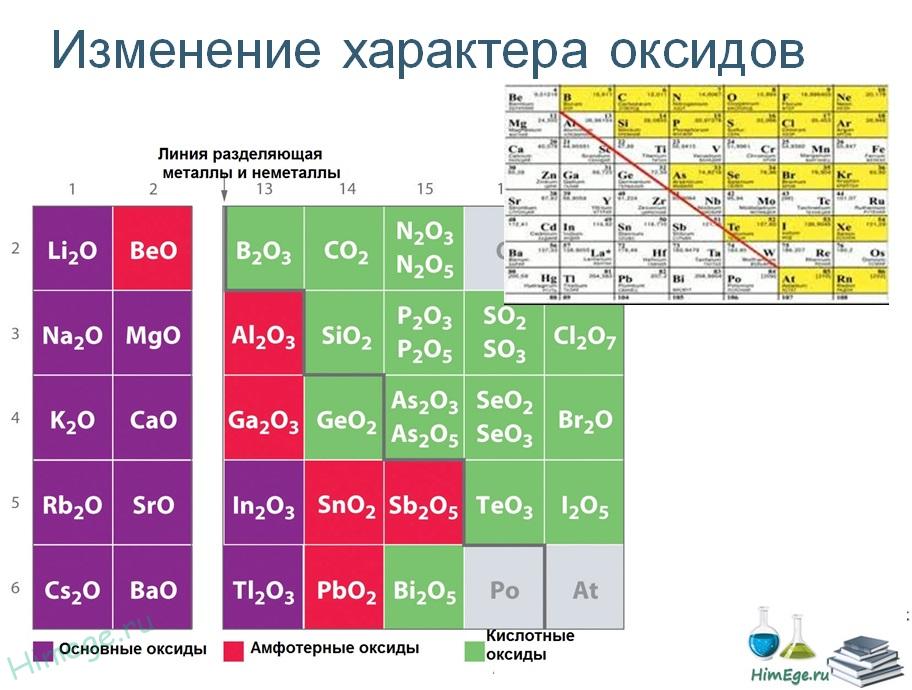 ,0, (Т л = 2050 °С у = 3,6 -f- 4,0 г/сж ) — амфотерный оксид, реагирующий с кислотными и основными оксидами. Повышает вязкость шлаков, склонна к образованию шпинелей. Нерастворима в металле.
[c.244]
,0, (Т л = 2050 °С у = 3,6 -f- 4,0 г/сж ) — амфотерный оксид, реагирующий с кислотными и основными оксидами. Повышает вязкость шлаков, склонна к образованию шпинелей. Нерастворима в металле.
[c.244]
Алюминий—А1 (Гпл =658 С Г , п =2500 °С т=2,7 г/с.и=>)— наиболее сильный раскислитель этой группы (рис. 124). Образует амфотерный оксид АиОд. Раскисление жидкого металла алюминием сопровождается значительным выделением тепла, обеспечивающим дополнительный подогрев металла сварочной ванны,что благотворно [c.252]
При пользовании несколькими раскислителями подбирают их так, чтобы продуктами раскисления являлись бы основные, кислотные и амфотерные оксиды. Эти оксиды, соединяясь. между собой, быстрее поднимаются вверх в сварочный шлак и не оказывают вредного влияния. [c.128]
Химическое воздействие расплавленного шлака на металл шва в значительной степени определяется соотношением в его составе кислых, основных и амфотерных оксидов. Фториды и
[c.72]
Фториды и
[c.72]
ОСНОВНОГО шлака обеспечивается высокая степень десульфурации металла. Фторид кальция был введен как бескислородный компонент, разжижающий шлак и делающий его более подви/ ным и активным, а глинозем — как очень стойкий оксид, амфотерный по химическим свойствам. По диаграммам плавкости было определено соотношение компонентов шлакообразующей основы СаО А1.,0з aF, = 1 2 9, при котором обеспечивается температура плавления шлака около 1300 X. [c.387]
Наиболее устойчивая форма оксида алюминия — а-корунд AI2O3 — амфотерный оксид, образующий соли как в )щелочной среде, чем пользуются при подготовке к сварке, протравливая поверхности соединяемых деталей и электродной проволоки. Субоксиды алюминия получаются при сплавлении AI2O3 с алюминием [c.325]
В шлаках АЬОз ведет себя как амфотерный оксид, образуя соли с Si02 (муллит), и реагирует с основными оксидами, образуя комплексные анионы
[c.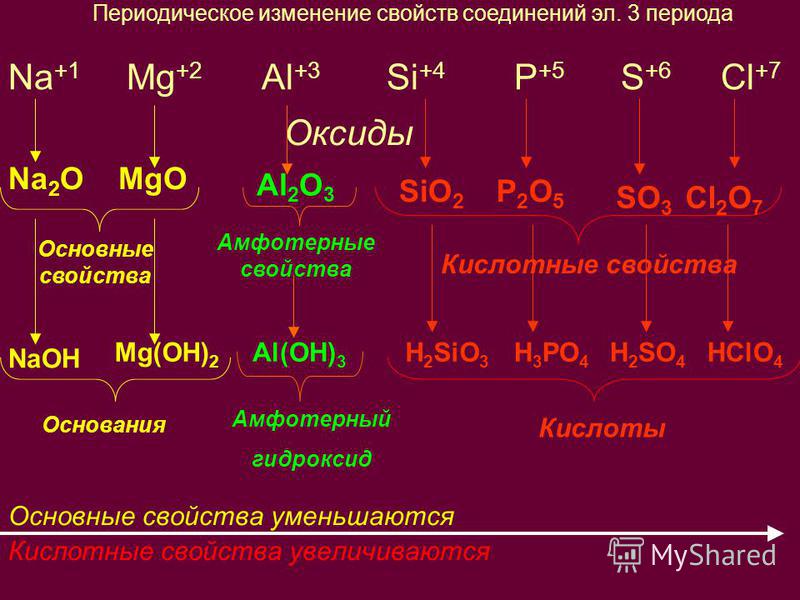 353]
353]
С кислородом хром образует следующие оксиды кислотный СгОз, амфотерный СГ2О3 и основной СгО. Наиболее важным в металлургии является оксид СГ2О3. Его удельный вес 5,21 г/см температура плавления 2275°С. [c.85]
Кривая растворимости СиО (рис. 11.12) (кривая /) построена на основе термодинамических данных [3 ]. При увеличении pH от 3 до 7 концентрация раствора, насыщенного оксидом меди, уменьшается от 1 до 10 моль/л. Дальнейшее повышение pH приводит к такому же резкому увеличению растворимости в результате образования в растворе анионов НСиОг и СиОа . Подобный ход кривых растворимости характерен для всех амфотерных оксидов. Заштрихованный прямоугольник соответствует реально наблюдаемым концентрациям Си + в системах охлаждения. Из [c.213]
Образующийся при взаимодействии алюминия с кислородом безводный оксид АЬОз (глинозем) может существовать в двух модификациях а-АгОз и 7-AI2O3 первая из них кристаллизуется в гексагональной системе, а вторая—в кубической. При нагреве 7-AI2O3 выше 900 °С начинается его превращение в а-А Оз, которое полно-ст зю завершается выше 1200 °С. Кристаллическая модификация 7-AI2O3 обладает высокой гигроскопичностью, а а-А Оз практически совсем влагу не впитывает. Оксиды алюминия амфотерны.
[c.316]
При нагреве 7-AI2O3 выше 900 °С начинается его превращение в а-А Оз, которое полно-ст зю завершается выше 1200 °С. Кристаллическая модификация 7-AI2O3 обладает высокой гигроскопичностью, а а-А Оз практически совсем влагу не впитывает. Оксиды алюминия амфотерны.
[c.316]
Ag, Ni, Со, Си также не взаимодействуют с расплавленными карбонатами в отсутствие кислорода в системе. Но уже незначительные количества его вызывают образование на металлической поверхности слоев низших оксидов NiO, СоО, uaO, которые не пассивируют металлы (рис, 13.4). Окись серебра AggO распадается в расплаве, благодаря чему появляется мелкодисперсное серебро. Более активные металлы Fe, Мп, Y, Ti, Zr, r, А1 и др. восстанавливают углерод карбонатных анионов до элементарного состояния или его окиси, а поверхность ме таллов покрывается слоем оксидов, малорастворимых в расплаве. При этом амфотерные или кислотные оксиды могут дальше взаимодействовать с карбонатным расплавом и образовывать еще более труднорастворимые солевые
[c. 372]
372]
Амфотерные металлы (2п, А1, 5п, РЬ) достаточноустойчивы в нейтральных, но нестойки в кислой и щелочной средах, так как в них растворимы их оксиды. [c.28]
Гидроксиды металлов. Любой оксид (окисел) каждого элемента (Э), в том числе и металла, можно изобразить общей формулой ЭгОд, где п — валентность элемента соответствующие же им гидроксиды (гидраты окислов)—формулой ЭО Н . Такое изображение пока не предопределяет, каков характер этих гидроксидов — основный, амфотерный или кислотный. Этот характер предопределяется местом разрыва связей (Э—О, О—Н> в данной молекуле. Если распад произойдет по схеме [c.54]
Титан образует ряд оксидов. Из них наиболее изучены Т10г, Т12 0з. Двуокись титана Т10г—амфотерный порошок белого цвета, практически не растворимый в воде и разбавленных кислотах. Двуокись титана является основным продуктом переработки титанового сырья. [c.174]
Щелочноземельные вяжущие моно- или полиминеральные вещества представлены а основном оксидами — R0, силикатами — xRO SIO2. солями амфотерных оксидов — их
[c.5]
солями амфотерных оксидов — их
[c.5]
В кислых шлаках наиболее сильными основными выступают оксиды щелочных и щелочноземельных металлов, слабее— амфотерные оксиды. Из кислотных оксидов после ЗЮа наиболее сильные 1102 и Р2О5. [c.240]
Удаление фосфора из сварочной ванны основано на его окислении и последующем связывании фосфорного ангидрида Р Од в прочное легкоотшлаковываемое комплексное соединение. По возрастающей силе сродства к ангидриду РаОб основные и амфотерные оксиды можно расположить в следующий ряд [c.265]
При переделе легированной шихты в шлаках также могут содержаться в значительных количествах оксиды СгаОз и V2O3 (амфотерные), ТЮз и WO3 (кислотные). В отдельных случаях может иметь практическое значение содержание в шлаках оксидов щелочных металлов Na20 и 1 0. [c.72]
Как и в предыдущей формуле, константа равновесия здесь выражена как отношение концентраций по массе, что является приближенным для компонентов реальных сталеплавильных шлаков, обычно существенно отличающихся от идеальных растворов ввиду высокого содержания Si02 и амфотерных оксидов. Истинная константа равновесия должна иметь вид для реакции (144)
[c.214]
Истинная константа равновесия должна иметь вид для реакции (144)
[c.214]
Глинозем как амфотерный оксид снижает концентрацию анионов 0 , т. е. уменьшает фактическую основность шлака, тем самым ухудшает фосфоропоглотительную способность шлака. Однако повышение содержания AI2O3 до 10—12% улучшает жидкоподвижность шлака и ускоряет растворение извести. Поэтому присутствие в шлаке AI2O3 не более указанных пределов обычно положительно влияет на дефосфорацию металла. [c.218]
С кислородом хром может образовать три оксида основной СгО, амфотерный СГ2О3 и кислотный СгОз. Наиболее устойчивым при высоких температурах сталепла- [c.252]
В химических соединениях свииец проявляет степени окисления +2 и + 4. В низшей степени окисления более устойчив, в высшей проявляет окислительные свойства. Свинец устойчив в соляной и серной кислотах вследствие пассивации поверхности плохо растворимыми солями, легко растворяется в азотной и уксусной кислотах.
 Оксиды свинца амфотерны, низший оксид РЬО взаимодействует с высшим РЬО , образуя РЬз04. Свинец и его соединения ядовиты, предельно допустимая концентрация в воздухе составляет 0,01 мг/м [5]. Свинец очень пластичный металл, легко прокатывается в тонкие листы, мягкий и ковкий. Температура рекристаллизации свинца 0°С, поэтому получить свинец в наклепанном состоянии при комнатной температуре нельзя. Свойства свинца сильно зависят от наличия примесей.
[c.391]
Оксиды свинца амфотерны, низший оксид РЬО взаимодействует с высшим РЬО , образуя РЬз04. Свинец и его соединения ядовиты, предельно допустимая концентрация в воздухе составляет 0,01 мг/м [5]. Свинец очень пластичный металл, легко прокатывается в тонкие листы, мягкий и ковкий. Температура рекристаллизации свинца 0°С, поэтому получить свинец в наклепанном состоянии при комнатной температуре нельзя. Свойства свинца сильно зависят от наличия примесей.
[c.391]Цинк, алюминий, олово, свпиец устойчивы в нейтральных средах, но разрушаются в щелочных и кислых средах (рис. 49, е). Неустойчивость этих металлов в кислых и щелочных средах объясняется их амфотерностью, т. е. растворимостью оксидов этих металлов в кислотах и щелочах. К металлам, устойчивым в кислых, но нестойким в щелочных средах, относятся молибден, та.птал, вольфрам (рис. 49,г). К металлам, малостойким в кислых средах, но устойчивым в щелочных, относятся викель, кадмий (рис. 49, ). Для каждого металла имеется опре-
[c. 93]
93]
Здравствуйте, я знаю, что такое амфотерные оксиды, но какой фактор определяет, является ли оксид амфотерным?
Основные оксиды
Металлический характер увеличивается справа налево и сверху вниз в Периодической таблице.
Самые металлические элементы образуют самые основные оксиды.
Даже если оксиды нерастворимы в воде, мы все равно называем их основными оксидами, потому что они вступают в реакцию с кислотами.
# «MgO (s) + 2HCl (водн.) → MgCl» _2 «(водн.)» + «H» _2 «O» (l) «#
Кислые оксиды
Неметаллический символ увеличивается слева направо и снизу вверх в Периодической таблице.
Самые неметаллические элементы образуют наиболее кислые оксиды.
Они реагируют с водой с образованием оксокислот. Например,
# «SO» _2 «(вод.)» + «H» _2 «O (l)» → «H» _2 «SO» _3 «(вод.)» #
Даже если оксид нерастворим в воде, мы все равно относим его к кислому, если он реагирует с основаниями с образованием солей.
Например,
# «TeO» _2 «(s)» + «2NaOH (водн.)» → «Na» _2 «TeO» _3 «(водн.)» + «H» _2 «O (l)» #
Амфотерные оксиды
Некоторые оксиды реагируют как с кислотами, так и с основаниями, то есть они амфотерные .»-» «(водн.)» #
Более легкие элементы групп 2 и 13, некоторые из # «d» # — блочных элементов и более тяжелые элементы групп 14 и 15 содержат амфотерные оксиды.
Самые основные оксиды находятся в нижнем левом углу Периодической таблицы, а самые кислые оксиды — в верхнем правом углу, поэтому неудивительно, что граница между кислотными и основными оксидами проходит по диагонали.
Амфотеризм и степени окисления
Амфотеризм зависит от степени окисления оксида.
Нет простого способа предсказать, какие элементы будут амфотерными.
Амфотерный характер оксида, вероятно, отражает способность металла поляризовать окружающие ионы оксида, то есть придавать значительный ковалентный характер связи # «M-O» #.
Эта способность увеличивается с увеличением степени окисления, поскольку положительный характер центрального атома увеличивается.
Однако в группе 15 амфотерными являются только оксиды с более низкой степенью окисления.
Оксиды с более высокой степенью окисления слишком кислые, чтобы быть амфотерными.
Амфотерные оксиды — Идентификация, примеры, периодическая таблица и использование
Амфотерные оксиды — это оксиды, которые ведут себя как основные, так и кислотные оксиды. Амфотерные оксиды содержат свойства кислотных и основных оксидов, которые нейтрализуют как кислоты, так и основания. Это простое значение амфотерных оксидов.
Амфотерные оксиды растворяются в воде с образованием щелочных растворов. Щелочные растворы содержат ионы гидроксида.Таким образом, оксид алюминия (который представляет собой Al \ [_ {2} \] O \ [_ {3} \]) реагирует с соляной кислотой с образованием воды и хлорида алюминия. Оксид алюминия — амфотерный оксид.
С раствором гидроксида натрия получается вода и алюминат натрия (NaAlO \ [_ {2} \]). Другие распространенные примеры амфотерных оксидов включают SnO, ZnO и PbO. Al \ [_ {2} \] O \ [_ {3} \] — амфотерный оксид. Формула амфотерного оксида — Al \ [_ {2} \] O \ [_ {3} \].
Идентификация амфотерных оксидов
Оксиды представляют собой соединения металлов или неметаллов с кислородом.Есть четыре типа оксидов. Амфотерные оксиды классифицируются как оксиды металлов, которые реагируют как с кислотами, так и с основаниями, а также с образованием воды и солей. Амфотерные оксиды, среди нескольких других, включают оксид цинка и оксид свинца. Примеры включают белки и аминокислоты, которые имеют классы карбоновых кислот, амины и молекулы, которые могут быть самоионизированными, такие как вода.
Амфотерные оксиды — это кислородные соединения, которые обладают как основными, так и кислотными характеристиками. Эти оксиды подвергаются реакции нейтрализации с образованием воды и соли при взаимодействии с кислотой.
Это описывает важные свойства соединений. Таким же образом щелочь реагирует с образованием как соли, так и воды, демонстрируя кислотные свойства. Примером может служить оксид алюминия.
Все оксиды могут образоваться при нагревании элемента в кислороде. Реакция водных растворов тригалогенидов металлов с гидроксидом приводит к образованию оксидов в гидратированной форме. Спускаясь вниз по группе, происходит переход от кислых оксидов через амфотерные к основным из-за усиления металлического характера элементов, о которых идет речь.Формула амфотерного оксида — Al \ [_ {2} \] O \ [_ {3} \].
Оксиды группы 13 элементов
Оксиды
Свойства
Al \ [_ {2} \] O \ [_ {3} \]
Амфотерный
B \ [_ {2} \] O \ [_ {3} \]
Слабокислый
In \ [_ {2} \] O \ [_ {3} \]
Слабое основание
Ga \ [_ {2} \] O \ [_ {3} \]
Амфотерный
Tl \ [_ {2} \] O \ [_ {3} \]
Окисляющий, основной
Примеры амфотерных оксидов
Термин амфотерный означает как основание, так и кислоту.
Амфотерные оксиды обладают как кислотными, так и основными свойствами. Оксиды цинка и алюминия являются примерами. Когда они вступают в реакцию с кислотами, они образуют соли. Кроме того, они реагируют со щелочами с образованием сложных солей.
Примеры амфотерных оксидов
Давайте посмотрим на некоторые примеры амфотерных оксидов или список амфотерных оксидов ниже:
ZnO (s) + 2NaOH (водн.) → Na \ [_ {2} \] ZnO \ [_ {2 } \] (водн.) + H \ [_ {2} \] O (l)
ZnO (s) + 2HNO \ [_ {3} \] (водн.) → Zn (NO \ [_ {3} \ ]) \ [_ {2} \] (водн.) + H \ [_ {2} \] O (l)
Al \ [_ {2} \] O \ [_ {3} \] (s) + 2NaOH (водн.) → 2NaAlO \ [_ {2} \] (водн.) + H \ [_ {2} \] O (l)
Al \ [_ {2} \] O \ [_ {3} \] (s) + 6HCl (aq) → 2AlCl \ [_ {3} \] (aq) + 3H \ [_ {2} \] O (l)
Это список нескольких амфотерных оксидов.{2 -} \]. Следует отметить, что алюминат и цинкат натрия растворимы в воде.
Амфотерные оксиды в Периодической таблице
В данный период оксиды прогрессируют от сильно основных до слабоосновных оксидов, амфотерных и слабокислых до сильнокислых оксидов.
Некоторые примеры: MgO, Na \ [_ {2} \] O, P \ [_ {4} \] O \ [_ {10} \], Al \ [_ {2} \] O \ [_ {3} \], Cl \ [_ {2} \] O \ [_ {7} \] и SO \ [_ {3} \]. Также кислотность увеличивается с увеличением степени окисления. Например, MnO
Существует тенденция изменения кислотности оксидов в периодической таблице. В общем, тенденция по периоду — основная → амфотерная → кислая. В таблице ниже представлена тенденция изменения кислотности оксидов за период 3.
Na \ [_ {2} \] O
Al \ [_ {2} \ ] O \ [_ {3} \]
MgO
P \ [_ {4} \] O \ [_ {18} \]
SiO \ [_ {2} \]
Cl \ [_ {2} \] O \ [_ {7} \]
SO \ [_ {2} \]
Сильно основной
Амфотерный
Основной
Кислый
Слабокислый
Сильно кислый
Кислый
Самые основные оксиды могут быть найдены в нижней части групп I и II, и основность имеет тенденцию к увеличивайте периодическую группу вниз.
Следовательно, для Группы V кислотность оксидов равна P \ [_ {2} \] O \ [_ {3} \] (кислая), NO \ [_ {2} \] (кислая), As \ [_ {2} \] O \ [_ {3} \] (амфотерный). Bi \ [_ {2} \] O \ [_ {3} \] (основной), Sb \ [_ {2} \] O \ [_ {3} \] (амфотерный).
В первичных группах амфотерных элементов основность оксидов увеличивается с увеличением атомного номера вниз по группе, например, BeO
Некоторые амфотерные оксиды и их химическая основа
Химическая причина проста.{-} \] ионы в растворе. Таким образом, это основной оксид.
Теперь, поскольку калий содержит только заряд +1, он не сильно притягивается к ОН- воды, и, следовательно, мы видим реакцию только с водой кислорода.
Но если мы возьмем пример амфотерного оксида, скажем оксида алюминия, мы увидим, что алюминий несет очень высокий положительный заряд +3, что заставляет его притягиваться к гидроксильной группе воды.
Следовательно, он может реагировать с водой с высвобождением протонов вместо гидроксильных групп.{2 -} \] будет реагировать с протонами в растворе, а также действовать как основной оксид.
Следовательно, мы называем Al \ [_ {2} \] O \ [_ {3} \] амфотерным оксидом. Несколько других примеров приведены как Fe \ [_ {3} \] O \ [_ {4} \], Fe \ [_ {2} \] O \ [_ {3} \], PbO, ZnO, Cr \ [_ {2} \] O \ [_ {3} \], PbO \ [_ {2} \] и т. Д. Другой интересный и важный момент заключается в том, что большинство (но не все) амфотерные оксиды относятся к d- блок периодической таблицы. Al \ [_ {2} \] O \ [_ {3} \] — амфотерный оксид.
Причина, по которой алюминий амфотерный
Алюминий имеет электроотрицательность 1.5. В точке, где оксиды амфотерных элементов начинают подкисляться.
Оксиды элементов с электроотрицательностью до 1,5 легко выделяют кислород в воде, чтобы захватить водородную воду, образуя ионы гидроксида. Часто это происходит из-за ионного связывания; таким образом, связь между кислородом и элементом легко разрывается в воде.
Однако, если оно превышает 1,5, элемент будет сильно удерживать кислород и вместо этого будет образовывать кислоты путем ковалентной связи с большим количеством атомов кислорода с образованием кислотных анионов.В атомах кислорода будет существовать отрицательный заряд.
Al \ [_ {2} \] O \ [_ {3} \], будучи ровно 1,5, с равной вероятностью либо выделяет, либо захватывает кислород из-за де-факто ионной / ковалентной природы его связей. В то время как в кислых условиях протоны, присутствующие в растворе, будут протонировать воду, образующую кислород, и соответствующую соль Al.
Однако в определенных основных условиях ионы гидроксида способствуют образованию большего количества ионов гидроксида из атомов кислорода Al за счет образования воды и гидратированного алюминатного комплекса.Здесь реакция намного сложнее, чем обычная кислотно-основная реакция.
Считаются ли оксиды металлов амфотерными оксидами? №
№.
Амфотеризм описывается как характерное выражение неметаллической природы металла, поскольку это относится к его способности каким-либо образом проявлять неметаллические свойства. Другими словами, чтобы объяснить, что амфотеризм некоторых оксидов, вероятно, связан со способностью самого металла поляризовать оксидные ионы, с которыми он связан, так что значительный процент ковалентного характера может быть введен в связь.
Вот почему типичные амфотерные оксиды металлов (а также гидроксиды) происходят из «пограничного» металла:
Al, — образует Al \ [_ {2} \] O \ [_ {3} \] и Al (OH) \ [_ {3} \];
Zn, — образует ZnO и Zn (OH) \ [_ {2} \];
Be, — образует BeO и Be (OH) \ [_ {2} \];
Sn, — образует SnO и Sn (OH) \ [_ {2} \];
Ga, — образует Ga \ [_ {2} \] O \ [_ {3} \] и Ga (OH) \ [_ {3} \].
Другими словами, оксиды металлов таких металлов, как металлы 1 и 2 групп (за исключением Be), не проявляют амфотеризм.
Кроме того, степень окисления также играет важную роль: хотя не существует четкой тенденции, как показывает практическое правило, амфотерное поведение катиона металла увеличивается с увеличением степени окисления, что очень сильно, скажем, в оксиды переходных металлов.
Чтобы сохранить его по-разному, подобно тому, как переходные металлы имеют катионы металлов с различными зарядами, а кислотность катиона увеличивается с увеличением его заряда, некоторые переходные металлы действительно образуют оксиды, которые являются кислотными, основными или амфотерными.
Некоторые общие области применения солей амфотерного оксида
Ниже приведены некоторые из наиболее распространенных областей применения солей амфотерного оксида:
Оксид цинка (ZnO) может использоваться в качестве добавки в ряде продуктов и материалов, включая пластмассы , каучуки, стекло, керамика, смазки, цемент, мази, краски, герметики, клеи, продукты питания, пигменты, антипирены, батареи и ленты для оказания первой помощи — все это ферриты (соединения, содержащие Fe \ [_ {2} \] O \ [_ {3} \]).
Оксид алюминия (Al \ [_ {2} \] O \ [_ {3} \]) также используется в производстве алюминия.Кроме того, будучи довольно химически белым и инертным, этот оксид является предпочтительным наполнителем для пластмасс. Это частый ингредиент солнцезащитного крема и иногда присутствует в косметических средствах, таких как губная помада, лак для ногтей и румяна. Иногда оксид алюминия используется в составе нескольких стекол. Его можно использовать в качестве катализатора дегидратации спирта до алкенов и процесса Клауса. Оксид алюминия называют амфотерным оксидом.
Оксид свинца (PbO) широко используется при производстве стекла.В зависимости от типа стекла преимущество использования PbO в стекле может заключаться в снижении вязкости стекла, увеличении показателя преломления стекла, повышении способности стекла и увеличении удельного электрического сопротивления стекла поглощать рентгеновские лучи.
. Добавление PbO в промышленную керамику (и стекло) делает их электрически и магнитно инертными (повышает температуру Кюри) и обычно используется для этих целей.
Что такое амфотерные оксиды? | Учиться.com
Константа равновесия (K) и коэффициент реакции (Q)
Константа равновесия K — это число, которое выражает соотношение продуктов и реагентов в реакции, когда она достигает химического равновесия.Изучите состояние равновесия и значение химического равновесия и коэффициента реакции (Q).
Кислотные и основные солевые растворы: объяснение и примеры
Солевой раствор может считаться кислым, основным или нейтральным в зависимости от pH, который влияет на ионы, с которыми он взаимодействует.
Узнайте о солевых растворах, изучив соль на молекулярном уровне и влияние pH на солевые растворы.
Тарифная константа и тарифные законы
Закон скорости определяется как соотношение между скоростью реакции и концентрацией реагентов.Узнайте о законе скорости, константе скорости и о том, как использовать уравнения закона скорости для определения порядка реакции для одного или двух реагентов.
Титрование сильной кислоты или сильного основания
В кислотно-щелочной химии титрование можно использовать для определения концентрации неизвестного раствора.
Узнайте о титровании, титранте, реакции нейтрализации и точке эквивалентности, а также о том, как выполнять титрование и интерпретировать кривую титрования.
Химические связи I: ковалентные
Ковалентная связь возникает, когда два атома разделяют электроны.Узнайте о химической связи, изучите, как создаются ковалентные связи, обнаружите валентные электроны и изучите структуру молекулы.
Амфипротические вещества: определение и примеры
Амфипротические вещества — это вещества, которые могут действовать как кислоты или основания, поскольку они могут как отдавать, так и принимать протон.
Узнайте об определении амфипротических веществ и откройте для себя примеры амфипротических соединений.
Небензодиазепиновые депрессанты: седативные снотворные и противотоксичные препараты
Небензодиазепиновые анксиолитики, седативные и снотворные средства — это лекарства, используемые для уменьшения беспокойства, успокоения и подавления физических реакций и, соответственно, для сна.Просмотрите примеры небензодиазепиновых депрессантов и узнайте о функции препарата и его влиянии на центральную нервную систему.
Продукты для дома с кислотами, основаниями и солями
Основания и кислоты служат разным целям.
В сочетании они образуют соль. Узнайте больше о кислотах, основаниях и солях, в том числе о том, где они встречаются в домашних условиях.
Лимфатическая жидкость: состав и функция
Лимфатическая жидкость транспортирует и поддерживает иммунные клетки, действуя как интерстициальная жидкость между тканями.Изучите состав, расположение и функцию лимфатической жидкости в организме.
Константа диссоциации и автоионизация воды
Константа автоионизации используется для определения концентрации гидроксида или ионов гидроксония в растворе.
Изучите автоионизацию воды, константу Kw и способы определения концентрации ионов.
Гептан: структура, применение и формула
Гептан — это насыщенный углеводород с прямой цепью, используемый для определения нулевой точки по шкале октанового числа.Изучите структуру и формулу гептана и узнайте его общие источники, способы использования и меры безопасности.
Основание конъюгата: определение и обзор
Конъюгированные основания — это частицы, оставшиеся после того, как кислота потеряла атом водорода.
Изучите типы этих оснований и посмотрите, как они соотносятся с кислотами на примерах реакций.
Аррениусовское определение кислот и оснований
Что такое кислоты и основания Аррениуса? Изучите определения кислот и оснований Аррениуса.См. Список кислот и оснований Аррениуса и ограничения модели Аррениуса.
Амфотерные оксиды — Синтез, свойства, идентификация
Термин «амфотерный» происходит от греческого слова amphoteroi (ἀμφότεροι) , что означает «оба». Амфотерные оксиды — это оксиды элементов (обычно металлов), которые проявляют амфотерное поведение.
Амфотеризм или амфотерное поведение — это свойство соединения действовать как кислота и как основание .В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Пример амфотерных оксидов: Оксид алюминия Al 2 O 3 является амфотерным оксидом, поскольку он может нейтрализовать как HCl, так и NaOH.
Другими элементами, образующими амфотерные оксиды, являются галлий, индий, скандий, титан, цирконий, ванадий, хром, олово, железо, кобальт, медь, цинк, свинец, серебро, золото, германий, сурьма, висмут, бериллий и теллур.
СинтезПоскольку амфотерные оксиды являются оксидами определенных элементов, они являются прямым результатом горения этих элементов на воздухе. Например, оксид цинка (II) образуется в результате прямого сгорания Zn в большом количестве воздуха:
2Zn (т) + O 2 (г) -> 2ZnO (т)
Аналогично
4Al (s) + 3O 2 (g) -> 2Al 2 O 3 (s)
Оксид свинца (II) получают путем нагревания нитрата свинца (II):
2Pb (NO 3 ) 2 -> \ (\ Delta \) 2PbO (s) + 4NO 2 + O 2 (г)
Оксид олова (II), также известный как Оксид олова может быть получен путем нагревания оксида олова (II) в инертной среде.
Оксид олова (II) образуется, когда соли олова реагируют с щелочью, такой как гидроксид натрия.
SnCl 2 + 2NaOH -> Sn (OH) 2 + 2NaCl
Sn (OH) 2 -> \ (\ Delta \) SnO + H 2 O
Амфотерные оксиды в Периодической таблицеФизические свойства амфотерных оксидов
- В определенный период таблицы Менделеева оксиды переходят от основных к амфотерным и, наконец, к кислотным. Например, рассмотрим 3 элемента периода rd : Na 2 O и MgO основные, Al 2 O 3 амфотерный, SiO 2 слабокислый, P 2 O 5 , P 2 O 3 , SO 2 , SO 3 , Cl 2 O и Cl 2 O 7 являются кислыми.
- Вниз по группам основность увеличивается с увеличением атомного номера.
Рассмотрим оксиды группы 15:
NO 2 и P 2 O 3 являются кислыми, As 2 O 3 и Sb 2 O 3 являются амфотерными, Bi 2 O 3 является базовым.- Кислотность также увеличивается с увеличением степени окисления того же элементарного оксида. Пример: ряд кислотности для оксидов марганца составляет
Mn 2 O 7 > Mn 2 O 3 > MnO
Аналогично для мышьяка и сурьмы
As 2 O 5 > As 2 O 3
и
Sb 2 O 5 > Sb 2 O 3Амфотерные оксиды обычно имеют очень высокие температуры плавления и кипения.У них есть гигантские ковалентные структуры, для разрушения которых требуется много энергии.
Амфотерные оксиды не растворимы в воде.
Химические свойства амфотерных оксидовАмфотерные оксиды реагируют как с кислотами, так и с основаниями.
Basic NatureОсновная природа амфотерных оксидов выясняется из их реакции с кислотами.
Амфотерные оксиды реагируют с обычными неорганическими кислотами с образованием соли металла и воды.
ZnO (т.) + 2HNO 3 (водн.) -> Zn (NO 3 ) 2 (водн.) + H 2 O (л)
Al 2 O 3 (т.) + 6HCl (водн.) -> 2AlCl 3 (водн.) + 3H 2 O (л)
SnO (т.) + 2HCl (водн.) -> SnCl 2 (водн.) + H 2 O (л)
PbO (s) + 2HNO 3 (водн.) -> Pb (NO 3 ) 2 (водн.) + H 2 O (л)
As 2 O 3 (т) + 6HCl (водн.) -> 2AsCl (водн.) + 3H 2 O (л)
Кислая природаКислотная природа амфотерных оксидов становится очевидной из их реакции с основаниями.Амфотерные оксиды реагируют с обычными неорганическими основаниями с образованием сложных солей металлов и воды.
ZnO (т) + 2NaOH (водн.) -> Na 2 ZnO 2 (водн.
) + H 2 O (л)
Обратите внимание, что Na 2 ZnO 2 в действительности смешивается с водой.
Таким образом, более точное уравнение:
ZnO (s) + 2NaOH (водн.) + H 2 O (l) -> Na 2 [Zn (OH) 4 ] (водн.)
, где Na 2 [Zn (OH) 4 ] представляет собой гидратированный цинкат натрия, а анион представляет собой [Zn (OH) 4 ] +2 .
Al 2 O 3 (т) + 2NaOH (водн.) -> 2NaAlO 2 (водн.) + H 2 O (л)
или
Al 2 O 3 (т) + 2NaOH (водн.) + 3H 2 O (л) -> 2Na [Al (OH) 4 ] (водн.)
, где Na [Al (OH) 4 ] представляет собой гидратированный алюминат натрия, а [Al (OH) 4 ] +1 представляет собой анион.
PbO (s) + 2NaOH (водн.) + H 2 O (l) -> Na 2 [Pb (OH) 4 ] (водн.
)
SnO (s) + 4NaOH (водн.) + H 2 O (l) <=> Na 4 [Sn (OH) 6 ] (водн.)
Идентификация амфотерных оксидовАмфотерный оксид может нейтрализовать как кислоту, так и основание .Итак, чтобы определить, является ли соединение амфотерным, необходимо наблюдать его реакцию с кислотой, такой как HCl, и реакцию с основанием, например NaOH.
После подтверждения того, что данное вещество является амфотерным, нам необходимо выяснить, является ли данное вещество оксидом или нет. Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. Д. Если все тесты показывают отрицательные результаты, данное соединение является оксидом.
Использование и применениеОбщие применения некоторых амфотерных оксидов:
Часто задаваемые вопросы Что такое амфотерные оксиды?
- Оксид свинца (II): Добавление PbO в стекло увеличивает его электрическое сопротивление, показатель преломления и способность поглощать рентгеновские лучи.
В то же время снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.
PbO также используется в керамической промышленности для изготовления керамических изделий, которые являются магнитно и электрически инертными.- Оксид цинка: Оксид цинка широко используется в цементной и косметической промышленности. Он также используется для изготовления сухих ячеек и других типов постоянных ячеек.
- Оксид алюминия: Руды оксида алюминия, такие как бокситы, присутствуют в земной коре.Во-первых, эти руды концентрируются с образованием чистого оксида алюминия. Этот оксид алюминия затем используется в процессе Холла-Эру для получения чистого металлического алюминия.
Амфотерные оксиды — это оксиды элементов (обычно металлов), которые проявляют амфотерные свойства. Амфотеризм или амфотерное поведение — это свойство соединения действовать как кислота и как основание.
Как определить амфотерные оксиды?В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
Амфотерный оксид может нейтрализовать как кислоту, так и основание. Таким образом, чтобы определить, является ли соединение амфотерным, необходимо наблюдать его реакцию с кислотой, такой как HCl, и реакцию с основанием, например NaOH.
Является ли вода амфотерным соединением?
После подтверждения того, что данное вещество является амфотерным, нам необходимо выяснить, является ли данное вещество оксидом или нет. Проводятся тесты на другие анионы, такие как сульфат, нитрат, нитрит, хлорид и т. Д. Если все тесты показывают отрицательные результаты, данное соединение является оксидом.Да, вода — это амфотерное соединение.
H 2 O <=> H 3 O + + OH —
Кислотное поведение:
H 2 O (кислота) + NH 3 (основание) -> NH 4 + + OH —
Основное поведение:
H 2 O (основание) + HCl (кислота) -> Cl — + H 3 O +Разница между кислотными и основными оксидами
Автор: Мадху
Ключевое различие — кислотные и основные оксиды
Оксиды — это соединения, в которых по крайней мере один атом кислорода присоединен к другому элементу.
Оксиды образуются, когда определенный элемент реагирует с кислородом. Поскольку кислород обладает высокой реакционной способностью по своей природе, он реагирует с металлическими и неметаллическими элементами и образует оксиды этих элементов. Этот кислород поступает из воздуха или воды. Из-за высокой электроотрицательности кислород может реагировать практически со всеми элементами, кроме благородных газов. Основные типы оксидов включают кислотные оксиды, основные оксиды, амфотерные оксиды и нейтральные оксиды. Эта классификация проводится в соответствии с природой и свойствами этих оксидов.Ключевое различие между кислотными и основными оксидами состоит в том, что кислотных оксидов образуют кислоты при растворении в воде , тогда как основных оксидов образуют основания при растворении в воде.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое кислые оксиды
3. Что такое основные оксиды
4. Сравнение бок о бок — кислотные и основные оксиды
5.Резюме
Что такое кислотные оксиды?
Кислые оксиды образуются при реакции неметалла с кислородом.Кислые оксиды реагируют с водой с образованием водных кислот. Эти кислотные соединения состоят из атомов кислорода, водорода и атомов этого конкретного неметалла, связанных ковалентными связями. Эти кислотные соединения называются ангидридами кислот, поскольку они производят кислотное соединение этого оксида при растворении в воде. Например, диоксид серы называется сернистым ангидридом, а триоксид серы — серным ангидридом. Оксиды кислот могут реагировать с основанием с образованием его соли. Обычно кислотные оксиды имеют низкие температуры плавления и низкие температуры кипения, за исключением оксидов, таких как диоксид кремния, которые имеют тенденцию образовывать гигантские молекулы.Эти оксиды растворяются в основаниях и образуют соль и воду. Когда кислый оксид растворяется в воде, это снижает pH пробы воды из-за образования ионов H + . Некоторые общие примеры кислотных оксидов: CO 2 , P 2 O 5 , NO 2 , SO 3 и т.
д. Следующая реакция представляет собой пример растворения кислотного оксида в воде.
SO 3 (с) + H 2 O (л) → H 2 SO 4 (водн.)
Рисунок 01: Диоксид азота при разных температурах
Что такое основные оксиды?
Основные оксиды образуются в результате реакции кислорода с металлами.Из-за разницы в электроотрицательности кислорода и металлов большинство основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами. Эти оксиды активно реагируют с водой с образованием основных соединений. Эти оксиды также реагируют с кислотами и образуют соль и воду. Когда в воду добавляют основной оксид, pH воды увеличивается из-за образования гидроксильных ионов (OH — ). Некоторые примеры обычных основных оксидов: Na 2 O, CaO, MgO и т. Д. Следующий пример показывает растворение основного оксида в воде.
Na 2 O (с) + H 2 O (л) → NaOH (водн.
)
Рисунок 02: Оксид магния (пример основного оксида)
В чем разница между кислотными и основными оксидами?
Кислотные и основные оксиды
Кислые оксиды образуются при взаимодействии кислорода с неметаллами. Основные оксиды образуются при взаимодействии кислорода с металлами. Реакция с водой Кислые оксиды реагируют с водой с образованием кислотных соединений. Основные оксиды реагируют с водой с образованием основных соединений. Реакция с кислотой Кислые оксиды не реагируют с кислотами. Основные оксиды реагируют с кислотами с образованием соли. Реакция с основанием Кислые оксиды реагируют с основаниями с образованием соли. Основные оксиды не реагируют с основаниями. Облигации Кислые оксиды имеют ковалентные связи. Основные оксиды имеют ионные связи. Влияние на pH Когда кислые оксиды растворяются в воде, это снижает pH. Растворение основных оксидов вызывает повышение pH. Прочие наименования Кислотные оксиды также известны как ангидриды кислот. Основные оксиды также называются основными ангидридами. Резюме — Кислые и основные оксиды
Оксиды — это соединения, в которых по крайней мере один атом кислорода связан с другим элементом. Этот элемент может быть металлическим или неметаллическим. В зависимости от свойств оксиды могут быть кислотными или основными. Если конкретный оксид может реагировать с кислотой, но не с основанием, он называется основным оксидом. Если оксид реагирует с основанием, но не с кислотами, это кислотный оксид.
Ключевое различие между кислотными оксидами и основными оксидами заключается в том, что кислотные оксиды образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Литература:
1. Дунк В., 2013. Показ слайдов. [Онлайн]
Доступно по адресу: https://www.slideshare.net/bsvab/acidic-and-basic-oxides-16541388 [дата обращения 26.05.2017].
2. Чанг Р., 2010. Химия. 10-е изд. Нью-Йорк: Макгроу-Хилл.
3. Хестра, Б., 2016. libretexts. [Онлайн] Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Descriptive_Chemistry/Main_Group_Reactions/Compounds/Oxides [доступ 26 мая 2017 г.].Изображение предоставлено:
1. «Двуокись азота при разных температурах» Эфрамгольдберг — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
2. «Оксид магния» Валкерма. Собственная работа (на основании заявлений об авторском праве) (общественное достояние) через Commons Wikimediaоксидов; кислотные, основные, амфотерные Классификация оксидов .
.. Страницы 1-13 — Flip PDF Скачать
2P32 — Основы неорганической химии Д-р М. Пилкингтон Лекция 22 — Кислотно-основные свойства оксидов и гидроксидов в водном растворе • Оксиды; кислотный, основной, амфотерный • Классификация оксидов — оксидная кислотность и основность • Гидролиз оксоанионов • Периодичность оксида кислотно-основного характера • Реакции кислотных и основных оксидов1.Оксиды Кислород образует соединения со всеми элементами, кроме He, Ne, Ar и Kr. Он напрямую реагирует со всеми элементами, кроме галогенов, с некоторыми благородными металлами, например. Ag, Au и благородные газы. Что касается гидридов, существуют различия в типах встречающихся связей. Оксиды металлов представляют собой ионные твердые вещества, оксиды неметаллов представляют собой дискретные молекулярные ковалентные газы и жидкости. Оксиды более тяжелых неметаллов и полуметаллов обычно представляют собой твердые ковалентные полимерные вещества. Оксиды переходных металлов иногда нетиохиометрические.
1
Изменение кислотно-основных свойств оксидов в водном растворе сильно коррелирует с положением линии металл-неметалл. Оксиды в водном растворе (кислые и основные ангидриды) Один из наиболее важных аспектов Свойства оксидов — это их кислотно-основные свойства. Многие оксиды являются основными или кислыми ангидридами; то есть они представляют собой соединения, которые образуются при удалении воды из соответствующего основания или кислоты. Ионные оксиды обычно представляют собой основные ангидриды, тогда как ковалентные оксиды обычно представляют собой кислые ангидриды. Оксиды полуметаллов представляют собой амфотерные ангидриды, способные действовать как кислота или основание, в зависимости от обстоятельств. Если мы перечислим оксиды определенного периода , например В-третьих, мы находим упорядоченное развитие их кислотно-основного характера. Сила кислоты увеличивается с кислотностью задействованного катиона Na + Cl + 7Na2O, MgO, Al2O3, SiO2, P4O10, SO3, Cl2O7Na (OH) Mg (OH) 2 Al (OH) 3 Si (OH) 4 h4PO4 h3SO4 HClO4 (золь) (инсоль) амфотерная слабая кислота очень сильная кислота.
ОСНОВНОЙ ОКСИД КИСЛОТНЫЙ ОКСИД АМФОТЕРНЫЙ ОКСИД сильное основание Амфотерные частицы Сильная кислота 2
Ионные оксиды характеризуются присутствием оксидного иона O2-, который, как и ион H +, не может существовать отдельно в водном растворе. Реакция между оксидом и молекула воды показана ниже: O2- 2 O H- + HOH 2-заряженный оксид атакует и образует связь с частично положительным атомом водорода молекулы воды.Последующий разрыв связи ОН дает два гидроксид-иона. Константа равновесия для этой реакции больше 1022, поэтому эта реакция находится далеко вправо. Например, оксид натрия: Na2O (s) + h3O (l) 2NaOH ( водн.) 2Na + + 2OH- (водн.) Процесс представляет собой последовательность от оксида металла до гидроксида металла, который диссоциирует на водный гидроксид и ионы металлов. Оксид натрия, следовательно, является основным ангидридом; он производит основной гидроксид натрия в водном растворе. Обратите внимание на большую степень ионного характера оксида, чем он более щелочной.
Оксиды неметаллов вступают в реакцию с водой с образованием так называемых оксокислот или оксикислот, то есть кислот, содержащих звено NM-OH, где NM = неметалл. оксид металла обычно характеризуется полярными ковалентными связями, а не ионными связями оксида металла. 3
Например, OH + H 2h3O NMO22- + 2h4O + NM OO - H + NM OH оксокислота Частично отрицательный атом кислорода молекулы воды будет атаковать частично положительный атом неметалла в то же время, что и кислород оксида притягивается к одному из атомов водорода воды. Разрыв связи ОН в воде приводит к образованию оксокислоты, которая расщепляется с образованием соответствующего водного аниона и ионов гидроксония. Триоксид серы представляет собой ангидрид серной кислоты. Амфотерные оксиды — часто оксиды полуметаллов. Хотя сами оксиды не слишком растворимы в воде, они могут реагировать как с кислотами, так и с основаниями.ZnO также является амфотерным. + 6H + 2Al3 + (водный) + 3h3O 2 [Al (OH) 4] — (водный) Al2O3 (s) + OH- + 3h3O 4
Гидролиз оксоанионов Неметаллы существуют в водном растворе в виде оксокислот, которые ионизируются с оксоанионы в растворе.
Оксоанионы (комбинации кислорода и NM) гидратированы в водном растворе. В этом случае электростатическое притяжение возникает между электронными парами на оксоанионных атомах кислорода и частично положительными атомами H молекул воды. . Гидратация — экзотермический процесс. Энергия гидратации увеличивается с увеличением заряда и уменьшением размера. Если взаимодействие между анионом и атомом H воды достаточно сильное, H можно удалить из воды, образуя гидроксид-ион, что приведет к получению основного раствора.MOxy- + h3O [MO (x-1) OH] (y-1) + OH- При определении основности оксоаниона мы должны принимать во внимание заряд, количество оксогрупп и электроотрицательность. Оксоанионы можно разделить на категории, которые описывают степень, в которой они гидролизуются.Влияние заряда на основность Увеличение заряда аниона увеличивает его склонность к гидролизу и образованию основных растворов. Значения pKb оксоаниона уменьшаются на 4-5 единиц для каждого дополнительного отрицательного заряда на анионе.
Влияние количества оксогрупп Поскольку большинство неметаллов проявляют более одной степени окисления, они могут образовывать оксоанионы, которые различаются числом оксогрупп (кислород, непосредственно связанный с металлом). Например, хлор образует четыре различных оксоаниона: ClO-, ClO2-, ClO3-, ClO4-.Добавление дополнительного кислорода снижает основность оксоаниона. Влияние электроотрицательности По мере уменьшения электроотрицательности атома неметалла основность оксоаниона увеличивается. 5
Классификация оксоанионов кратко изложена ниже Классификация Результирующая формула Неосновная содержит оксогруппы и бесплатно Слабая основная, без заряда и без оксогрупп Умеренно основная, без оксогрупп и заряд -1/2 или -1, без оксогрупп, и с зарядом, более сильная. отрицательный -1Example1.Рассмотрим оксоанион формулы MO4-. Для этой формулы эффект одной единицы отрицательного заряда нейтрализует эффект двух оксогрупп. Если мы удалим отрицательный заряд и две оксогруппы, то получится формула MO2.
Этот анион относится к неосновным 2. Рассмотрим оксоанион формулы MO34-. Три оксогруппы нейтрализуют 1,5 единицы отрицательного заряда. Полученная формула становится M-2.5. Этот оксоанион будет очень щелочным. В таблице на следующем слайде перечислены рассчитанные pKb для важных простых оксоанионов элементов.6
Сводка тенденций изменения числа оксо-групп в оксо-анионах Оксоанионы, имеющие наименьшие центральные атомы, принадлежат к блоку Периода 2p. Они могут иметь максимальную координацию 3 и вмещают либо 3 оксогруппы, либо две оксогруппы плюс один неподеленный p-электрон. 7
Центральные атомы p-блока периодов 3 и 4, а также атомы 3-го блока 4 и атомы d-блока периодов 4 и 5 имеют большие радиусы и могут иметь максимальное координационное число 4.Если валентные орбитали равны 3p, 4p или 4d, центральный атом может вместить 4 оксогруппы и неподеленные p-электроны. Центральные атомы p-блока и d-блока Периода 6 имеют максимальное координационное число 6. Если валентные орбитали на центральном атоме — это 5p, 5d, 5f, 6p или 6d, центральный атом может вмещать 4-6 оксогрупп и неподеленные пары p-орбиталей.
8
2. Подводя итог — классификация оксидов Кислый оксид — при взаимодействии с h3Oe образует кислоту.г. SO3 + h3O h3SO4SO2 + h3O h3SO3CO2 + h3O h3CO3 Основной оксид — образует основание при реакции с h3O. Na2O + h3O 2NaOH CaO + h3O Ca (OH) 2 Амфотерные оксиды — реагируют с h3O с образованием гидроксида, который далее реагирует либо с кислотами, либо с основаниями. Например, ZnO, BeO-, Al2O3-, Ga2O3-, Sn2O2-, PbO2-Единица Е-ОН в водном растворе; (где E = элемент) Мы знаем, что оксиды металлов и монометаллов реагируют с водой с образованием соединений с блоком E-O-H. Если E представляет собой металл, блок действует как основание, выделяя гидроксид-ионы в растворе. Если E — неметалл, высвобождаются ионы гидроксония. Почему разница? Как природа E определяет, будет ли единица кислотной, щелочной или амфотерной? Чтобы ответить на этот вопрос, мы внимательно смотрим на относительную электроотрицательность атомов внутри единицы. 9
гидроксид = OH- = основание X OH гидроксоний = h4O + = кислота где разрыв связи? Для металла (ENs 0.
7-1.5) X OH X + + OH- Получение основания в растворе. Большая разница в электроотрицательности между металлом и кислородом, что делает связь M-O более полярной. Более полярная связь МО подвержена атаке со стороны полярных молекул воды. Это приводит к разрыву связи МО с образованием водного катиона металла и аниона гидроксида в растворе. Для неметалла (ENs 2.3-3.5) В этом случае Связь ОН является более полярной и восприимчивой к атаке со стороны молекул воды, что приводит к образованию ионов оксоаниона и гидроксония в растворе.X OH XO- + H + Получение кислого раствора. Для полуметалла Две связи звена E-O-H имеют примерно одинаковую полярность, и любая из них может быть разорвана в зависимости от обстоятельств. В данном случае единица амфотерная. 10
3. Периодичность кислотно-основного характера оксида Мы только что видели, что для неметалла, как единица X-O-H расщепляется между атомами кислорода и водорода под воздействием полярной воды. Два дополнительных фактора также важны при определении относительной силы кислоты: 1.
Электроотрицательность центрального атома 2. Число негидроксильных атомов кислорода, связанных с центральным атомом. По мере того, как электроотрицательность центрального атома увеличивается, его способность отбирать электронную плотность от соседних атомов. Окружающие атомы кислорода имеют высокую электроотрицательность, поэтому центральный атом не может отбирать у них электронную плотность. Электронная плотность происходит от связей O-H.Атом H имеет низкую электроотрицательность. Электронная плотность удаляется из связи O-H, H становится более частично положительным, и, следовательно, связь O-H более полярна и восприимчива к атаке со стороны молекул воды. Кислотная сила оксикислоты увеличивается по мере увеличения электроотрицательности центрального атома. Например, серная кислота является более сильной кислотой, чем селеновая кислота, фосфорная кислота сильнее мышьяковой кислоты, а хлорная кислота сильнее надбромовой кислоты. По мере увеличения количества негидроксильных атомов кислорода они забирают больше электронной плотности из центрального атома, делая ее частично положительной.
В свою очередь, центральный атом теперь забирает больше электронной плотности из единственного доступного источника, то есть связи O-H. Снова атом H становится частично положительным, и связь O-H становится более полярной и, следовательно, более восприимчивой к атаке воды. В результате увеличивается количество негидроксильных атомов кислорода, увеличивается и сила оксикислоты. Например, сила кислоты увеличивается от азотистой кислоты до азотной кислоты и от серной до серной кислоты. 11
А как насчет переходных металлов? CrIIO является основным и растворяется в кислотах. CrIII2O3 является амфотерным, он растворяется в кислотах (Cr3 +) и основаниях [Cr (OH) 3] — CrVIO3 — это кислотный оксид, который растворяется в воде с образованием h4CrO4 (хромовой кислоты). Кислотность оксида увеличивается по мере увеличения заряда «катиона». ”Увеличивается (так с увеличением степени окисления центрального атома). Кислотность оксида также увеличивается с уменьшением размера (по мере уменьшения ионного радиуса увеличивается прочность связи X-OH и диссоциация иона H +).
CrO3 аналогичен SO3h3CrO4 h3SO4 Хромовая кислота Серная кислота4. Реакции кислотных и основных оксидов 1. С h3O для получения кислоты или основанийCaO + h3O Ca (OH) 2основной оксид N2O5 + h3O 2HNO3кислый оксид2. Взаимодействуют друг с другом с образованием солей. Na2O (s) + SO3 (г) Na2SO4 (s) основной кислый солевой оксид 12
CaO + Cl2O Ca (OCl) 2основная кислота солевой оксид 3.Кислотный оксид + основная соль или соль + h3OCO2 + NaOH NaHCO3CO2 + 2NaOH Na2CO3 + h3O (CO2 — ангидрид h3CO3) 3. Основной оксид + кислотная соль + h3OMgO + 2HCl MgCl2 + h3O 13
Элементы группы 16 (халькогены)
22.4 Элементы группы 16 (халькогены)
Цель обучения
- Чтобы понять тенденции в свойствах и реакционной способности элементов группы 16: халькогенов.
Халькогены являются первой группой в блоке p , в которой отсутствуют стабильные металлические элементы. Все изотопы полония (Po), единственного металла в группе 16, радиоактивны, и только один элемент в группе, теллур (Te), может даже быть описан как полуметалл.
Как и в группах 14 и 15, самый легкий элемент группы 16, кислород, встречается в природе как свободный элемент.
Из группы 16 элементов в древности была известна только сера; другие не были обнаружены до конца 18 и 19 веков.Сера часто встречается в виде желтых кристаллических отложений по существу чистого S 8 в районах интенсивной вулканической активности или вокруг горячих источников. Еще в 15 веке до нашей эры сера использовалась в качестве фумиганта в гомеровской Греции, потому что при сжигании она выделяла пары SO 2 , токсичные для большинства организмов, включая паразитов, прячущихся в стенах и под полом домов. Следовательно, ссылки на серу часто встречаются в древней литературе, часто в контексте религиозного очищения.Фактически, ассоциация серы с божественным была настолько распространенной, что префиксы thio — (что означает «сера») и theo — (что означает «бог») имеют один и тот же корень в древнегреческом языке. Хотя сера используется в основном в производстве серной кислоты, сера также используется для производства пороха и в качестве сшивающего агента для резины, что позволяет резине сохранять свою форму, но сохраняет свою гибкость.
Обратите внимание на узор
Группа 16 — первая группа в блоке p без стабильных металлических элементов.
Кислород не был открыт до 1771 года, когда шведский фармацевт Карл Вильгельм Шееле обнаружил, что нагревательные соединения, такие как KNO 3 , Ag 2 CO 3 и HgO, производят бесцветный газ без запаха, который поддерживает горение лучше, чем воздух. Однако результаты не были опубликованы сразу, поэтому работа Шееле оставалась неизвестной до 1777 года. К сожалению, это было почти два года спустя 9-1014 после публикации статьи английского химика Джозефа Пристли, в которой описывалось выделение того же газа с помощью увеличительного стекла. стекло для фокусировки солнечных лучей на образце HgO.Кислород используется в основном в сталелитейной промышленности во время преобразования сырого чугуна в сталь с использованием процесса Бессемера. (Для получения дополнительной информации о процессе Бессемера см.
Главу 23 «The».) Еще одним важным промышленным использованием кислорода является производство TiO 2 , который обычно используется в качестве белого пигмента в красках, бумаге и пластмассах.
Месторождение кристаллической серы. Это месторождение серы расположено вокруг вулканического жерла в кратере Килауэа, Гавайи.
Теллур был случайно обнаружен в 1782 году австрийским химиком Францем Йозефом Мюллером фон Райхенштейном, главным инспектором шахт в Трансильвании, который также отвечал за анализ проб руды. Серебристо-белый металл имел ту же плотность, что и сурьма, но имел совсем другие свойства. Поскольку его было трудно анализировать, Мюллер назвал его metallum problematicum (что означает «сложный металл»). Название теллур (от латинского tellus , что означает «земля») было придумано другим австрийским химиком Мартином Клапротом, который в 1798 году продемонстрировал, что «трудный металл» Мюллера на самом деле является новым элементом.
Теллур используется для окраски стекла и керамики, при производстве капсюлей-детонаторов и в термоэлектрических устройствах.
Селен (Se) был впервые выделен в 1817 году шведским химиком Йенсом Якобом Берцелиусом, который также открыл кремний. Он вложил деньги в завод по производству серной кислоты и решил исследовать дурно пахнущий загрязнитель, который образовал красный осадок. Хотя первоначально он думал, что загрязнитель был теллуром, дальнейшие исследования показали, что на самом деле это был новый элемент, похожий на теллур.Чтобы подчеркнуть сходство, Берцелиус назвал новый элемент селеном (от греческого selene , что означает «луна»). Селен используется в основном как второстепенный ингредиент для обесцвечивания стекла. Поскольку селен светочувствителен, он также используется для получения изображений в процессе фотокопирования (рис. 22.12 «Химия фотокопирования»).
Йенс Якоб Берцелиус (1779–1848)
Берцелиус родился в хорошо образованной шведской семье, но оба родителя умерли, когда он был молод.
Он изучал медицину в Университете Упсалы, где его эксперименты с электрошоковой терапией заставили его интересы обратиться к электрохимии. Берцелиус разработал систему химических обозначений, которую мы используем сегодня. Кроме того, он открыл шесть элементов (церий, торий, селен, кремний, титан и цирконий).
Рис. 22.12. Химия фотокопирования
Поскольку аморфный селен является светочувствительным полупроводником, воздействие света на электростатически заряженную пленку Se приводит к тому, что положительный заряд на пленке разряжается во всех областях оригинала, которые белые.Темные области в исходном изображении блокируют свет и создают невидимое, положительно заряженное изображение. Для создания изображения на бумаге отрицательно заряженные частицы тонера притягиваются к положительному изображению, переносятся на отрицательно заряженный лист чистой бумаги и сливаются с бумагой при высокой температуре, чтобы получить устойчивое изображение.
Самый тяжелый халькоген, полоний, был выделен после невероятных усилий Марии Кюри.
(Дополнительную информацию о радиоактивности и полонии см. В главе 1 «Введение в химию», раздел 1.5 «Атом».) Хотя ей так и не удалось получить макроскопические количества элемента, который она назвала в честь своей родной страны, Польши, она продемонстрировала, что химический состав этого элемента требует отнесения его к группе 16. Мари Кюри была награждена вторым. Нобелевская премия по химии 1911 г. за открытие радия и полония.
Приготовление и общие свойства элементов группы 16
Кислород является самым распространенным элементом в земной коре и гидросфере (около 44% и 86% по массе соответственно).Тот же процесс, который используется для получения азота из атмосферы, производит чистый кислород. Кислород также можно получить электролизом воды, разложением пероксидов или супероксидов щелочных или щелочноземельных металлов или термическим разложением простых неорганических солей, таких как хлорат калия, в присутствии каталитического количества MnO 2 :
Уравнение 22.
2KClO3 (тв) ⇌ΔMnO2 (тв) 2KCl (тв) + 3O2 (г)33
(Для получения дополнительной информации об электролизе см. Главу 19 «Электрохимия».Для получения дополнительной информации о щелочных и щелочноземельных металлах см. Главу 21 «Периодические тенденции и».)
В отличие от кислорода, сера не очень распространена, но она содержится в виде элементарной серы в горных породах над соляными куполами, которые часто сопровождают месторождения нефти (рис. 2.22 «25 основных химических веществ, произведенных в США в 2002 году *»). Сера также извлекается из H 2 S и сероорганических соединений в сырой нефти и угле и из сульфидных руд металлов, таких как пирит (FeS 2 ).
Пирит (FeS 2 ). Из-за блестящих золотисто-желтых кубических кристаллов FeS 2 иногда ошибочно принимают за золото, отсюда и его общее название «золото дураков».
Однако настоящее золото намного плотнее, чем FeS 2 , и оно мягкое и податливое, а не твердое и хрупкое.
Поскольку селен и теллур химически подобны сере, они обычно обнаруживаются как второстепенные примеси в сульфидных рудах металлов и обычно извлекаются как побочные продукты.Но даже в этом случае в земной коре их так же много, как серебра, палладия и золота. Одним из лучших источников селена и теллура является «шлам», образующийся при электролитической очистке меди. Оба эти элемента печально известны отвратительным запахом многих своих соединений. Например, когда организм поглощает даже следовые количества теллура, диметилтеллур [(CH 3 ) 2 Te] вырабатывается и медленно выделяется при дыхании и потоотделении, что приводит к интенсивному запаху, напоминающему чеснок, который обычно называют « теллуровое дыхание.”
С их нс 2 np 4 электронных конфигураций, халькогены на два электрона отстают от заполненной валентной оболочки.
Таким образом, в реакциях с металлами они имеют тенденцию приобретать два дополнительных электрона с образованием соединений в степени окисления -2. Эта тенденция наиболее велика для кислорода, халькогена с наивысшей электроотрицательностью. Более тяжелые, менее электроотрицательные халькогены могут потерять либо четыре н.п. электронов, либо четыре н.п. и два нс электронов с образованием соединений в степени окисления +4 и +6 соответственно, как показано в Таблице 22.4 «Избранные свойства элементов группы 16». Как и в случае с другими группами, самый легкий член в группе, в данном случае кислород, сильно отличается от других по размеру, энергии ионизации, электроотрицательности и сродству к электрону, поэтому его химический состав уникален. Также, как и в других группах, второй и третий члены (сера и селен) обладают схожими свойствами из-за экранирующих эффектов. Только полоний является металлическим, образуя либо гидратированный ион Po 2+ , либо ион Po 4+ в водном растворе, в зависимости от условий.
Таблица 22.4. Выбранные свойства элементов группы 16
Имущество Кислород Сера Селен Теллур Полоний атомный символ O S SE Te Po атомный номер 8 16 34 52 84 атомная масса (а. е.м.)
16.00 32,07 78,96 127,60 209 конфигурация валентных электронов * 2 с 2 2 с 4 3 с 2 3 с 4 4 с 2 4 с 4 5 с 2 5 с 4 6 с 2 6 с 4 точка плавления / температура кипения (° C) −219 / −183 115/445 221/685 450/988 254/962 плотность (г / см 3 ) при 25 ° C 1. 31 (г / л)
2,07 4,81 6,24 9,20 атомный радиус (пм) 48 88 103 123 135 первая энергия ионизации (кДж / моль) 1314 1000 941 869 812 нормальная степень окисления -2 +6, +4, −2 +6, +4, −2 +6, +4, −2 +2 (+4) ионный радиус (пм) † 140 (-2) 184 (-2), 29 (+6) 198 (-2), 42 (+6) 221 (−2), 56 (+6) 230 (-2), 97 (+4) сродство к электрону (кДж / моль) −141 −200 −195 −190 -180 электроотрицательность 3. 4
2,6 2,6 2,1 2,0 стандартный восстановительный потенциал ( E °, V) (E 0 → H 2 E в кислотном растворе) +1,23 +0,14 -0,40 -0,79 -1.00 продукт реакции с O 2 – СО 2 SEO 2 ТеО 2 PoO 2 тип оксида – кислая кислая амфотерный базовый продукт реакции с N 2 НЕТ, НЕТ 2 нет нет нет нет продукт реакции с X 2 O 2 F 2 SF 6 , S 2 Класс 2 , S 2 Br 2 SEF 6 , SEX 4 TeF 6 , TeX 4 PoF 4 , PoCl 2 , PoBr 2 продукт реакции с H 2 H 2 O H 2 S H 2 SE нет нет * Показанная конфигурация не включает заполненные подоболочки d и f . † Значения, указанные для гексакатионов, даны для шестикоординатных ионов и являются лишь оценочными значениями. Реакции и соединения кислорода
Как и в группах 14 и 15, самый легкий член группы 16 имеет наибольшую тенденцию к образованию множественных связей. Таким образом, элементарный кислород встречается в природе в виде двухатомного газа, который содержит чистую двойную связь: O = O. Как и в случае с азотом, электростатическое отталкивание между неподеленными парами электронов на соседних атомах не позволяет кислороду образовывать стабильные сцепленные соединения.Фактически, за исключением O 2 , все соединения, содержащие связи O – O, потенциально взрывоопасны. Озон, пероксиды и супероксиды потенциально опасны в чистом виде. Озон (O 3 ), один из самых сильных известных окислителей, используется для очистки питьевой воды, поскольку он не дает характерного вкуса, присущего хлорированной воде.
Перекись водорода (H 2 O 2 ) настолько термодинамически нестабильна, что при загрязнении имеет тенденцию к взрывному разложению:
Уравнение 22.34
2h3O2 (ж) → 2h3O (л) + O2 (г) ΔG ° = −119 кДж / мольОбратите внимание на узор
Как и в группах 14 и 15, самый легкий элемент в группе 16 имеет наибольшую тенденцию к образованию множественных связей.
Несмотря на прочность связи O = O (DO2 = 494 кДж / моль), O 2 чрезвычайно реактивен, вступая в непосредственную реакцию почти со всеми другими элементами, кроме благородных газов. Некоторые свойства O 2 и родственных ему частиц, такие как ионы пероксида и супероксида, приведены в Таблице 22.5 «Некоторые свойства O». За некоторыми исключениями, химический состав кислорода ограничен отрицательными состояниями окисления из-за его высокой электроотрицательности (χ = 3,4).
В отличие от других халькогенов, кислород не образует соединений со степенью окисления +4 или +6. Кислород уступает только фтору по способности стабилизировать высокие степени окисления металлов как в ионных, так и в ковалентных соединениях. Например, AgO представляет собой стабильное твердое вещество, которое содержит серебро в необычном состоянии Ag (II), тогда как OsO 4 представляет собой летучее твердое вещество, содержащее Os (VIII).Поскольку кислород настолько электроотрицателен, связь O – H является очень полярной, создавая большой дипольный момент связи, что делает водородную связь гораздо более важной для соединений кислорода, чем для аналогичных соединений других халькогенов.
Таблица 22.5 Некоторые свойства O 2 и родственных диатомовых видов
Виды Приказ на облигации Кол-во непарных e — O – O Расстояние (pm) * O 2 + 2. 5
1 112 О 2 2 2 121 О 2 — 1,5 1 133 O 2 2- 1 0 149 * Источник данных: Лаури Васька, «Дикислородно-металлические комплексы: к единому взгляду», Счета химических исследований 9 (1976): 175. Оксиды металлов обычно являются основными, а оксиды неметаллов — кислотными, тогда как оксиды элементов, которые расположены на диагональной полосе полуметаллов или около нее, обычно являются амфотерными. Некоторые оксиды, такие как CO и PbO 2 , нейтральны и не реагируют с водой, водной кислотой или водным основанием. Оксиды неметаллов обычно представляют собой ковалентные соединения, в которых связи между кислородом и неметаллом поляризованы (E δ + –O δ– ).Следовательно, неподеленная пара электронов в молекуле воды может атаковать частично положительно заряженный атом E с образованием оксокислоты. Примером может служить реакция триоксида серы с водой с образованием серной кислоты:
Уравнение 22.35
H 2 O (л) + SO 3 (г) → H 2 SO 4 (водн.)Оксиды полуметаллов и таких элементов, как Al, которые находятся рядом с разделительной линией металл / неметалл, являются амфотерными, как и ожидалось:
Уравнение 22.
Al 2 O 3 (т.) + 6H + (водн.) → 2Al 3+ (водн.) + 3H 2 O (л)36
Уравнение 22.37
Al 2 O 3 (т) + 2OH — (водн.) + 3H 2 O (л) → 2Al (OH) 4 — (водн.)Обратите внимание на узор
Оксиды металлов имеют тенденцию быть основными, оксиды неметаллов — кислотными, а оксиды элементов в диагональной полосе полуметаллов или около нее — обычно амфотерными.
Пример 7
Для каждой реакции объясните, почему образуются данные продукты.
- Ga 2 O 3 (т) + 2OH — (водн.) + 3H 2 O (л) → 2Ga (OH) 4 — (водн.)
- 3H 2 O 2 (вод.
) + 2MnO 4 — (вод.) + 2H + (водн.) → 3O 2 (г) + 2MnO 2 (с) + 4H 2 O (л)
- KNO 3 (т) → Δ KNO (с) + O 2 (г)
Дано: сбалансированные химические уравнения
Спрашивали: почему данные продукты образуют
Стратегия:
Классифицируйте тип реакции.Используя периодические тенденции изменения атомных свойств, термодинамики и кинетики, объясните, почему образуются наблюдаемые продукты реакции.
Решение:
- Галлий — это металл. Мы ожидаем, что оксиды металлических элементов будут основными и, следовательно, не будут реагировать с водным основанием. Однако внимательный взгляд на таблицу Менделеева показывает, что галлий близок к диагональной линии полуметаллов.
Более того, алюминий, элемент сразу после галлия в группе 13, является амфотерным.Следовательно, мы прогнозируем, что галлий будет вести себя как алюминий (уравнение 22.37).
- Перекись водорода — это окислитель, который может принимать два электрона на молекулу, давая две молекулы воды. Однако с сильным окислителем H 2 O 2 может также действовать как восстановитель, теряя два электрона (и два протона) с образованием O 2 . Поскольку другим реагентом является перманганат, который является сильным окислителем, единственной возможной реакцией является окислительно-восстановительная реакция, в которой перманганат является окислителем, а пероксид водорода — восстановителем.Напомним, что восстановление перманганата часто дает MnO 2 , нерастворимое коричневое твердое вещество. Восстановление MnO 4 — до MnO 2 представляет собой трехэлектронное восстановление, тогда как окисление H 2 O 2 до O 2 представляет собой двухэлектронное окисление.
- Это реакция термического разложения. Поскольку KNO 3 содержит азот в его самой высокой степени окисления (+5) и кислород в самой низкой степени окисления (-2), вероятна окислительно-восстановительная реакция.Окисление кислорода в нитрате до атомарного кислорода — это двухэлектронный процесс на атом кислорода. Азот, вероятно, принимает два электрона, потому что оксоанионы азота известны только в состояниях окисления +5 (NO 3 — ) и +3 (NO 2 — ).
Упражнение
Определите продукты каждой реакции и напишите сбалансированное химическое уравнение для каждой реакции.
- SiO 2 (т.) + H + (водн.) →
- NO (г) + O 2 (г) →
- SO 3 (г) + H 2 O (л) →
- H 2 O 2 (водн.
) + I — (водн.) →
Ответ:
- SiO 2 (т) + H + (водн.) → реакции нет
- 2НО (г) + O 2 (г) → 2НО 2 (г)
- SO 3 (г) + H 2 O (л) → H 2 SO 4 (водн.)
- H 2 O 2 (водн.) + 2I — (водн.) → I 2 (водн.) + 2OH — (водн.)
Реакции и соединения более тяжелых халькогенов
Поскольку большинство более тяжелых халькогенов (группа 16) и пникогенов (группа 15) являются неметаллами, они часто образуют аналогичные соединения.Например, оба элемента третьего периода этих групп (фосфор и сера) образуют сцепленные соединения и образуют несколько аллотропов. В соответствии с периодическими тенденциями, тенденция к катетеризации уменьшается по мере того, как мы спускаемся вниз по столбцу.
Сера и селен образуют довольно обширную серию связанных разновидностей. Например, элементарная сера образует кольца S 8 , упакованные вместе в сложную конструкцию «коленчатый вал» (рис. 18.15 «Две формы элементарной серы и термодинамический цикл, показывающий переход от одного к другому»), а расплавленная сера содержит длинные цепи. атомов серы, соединенных S – S связями.Более того, как сера, так и селен образуют полисульфиды (S n 2-) и полиселениды (Se n 2-) с n ≤ 6. Единственным стабильным аллотропом теллура является серебристо-белое вещество, свойства и структура которого аналогичны таковым у одного из аллотропов селена. Полоний, напротив, не проявляет тенденции к образованию цепных соединений. Поразительное снижение структурной сложности от серы к полонию согласуется с уменьшением прочности одинарных связей и усилением металлического характера по мере того, как мы спускаемся по группе.
Как и в группе 15, реакционная способность элементов в группе 16 снижается от самой легкой до самой тяжелой. Например, селен и теллур реагируют с большинством элементов, но не так легко, как сера. Как и ожидалось для неметаллов, сера, селен и теллур не реагируют с водой, водной кислотой или водным основанием, но все они растворяются в сильно окисляющих кислотах, таких как HNO 3 , с образованием оксокислот, таких как H 2 SO 4 . В отличие от других халькогенов, полоний ведет себя как металл, растворяясь в разбавленной HCl с образованием растворов, содержащих ион Po 2+ .
Обратите внимание на узор
Так же, как и в других группах, тенденция к катетированию, сила одинарных связей и реакционная способность снижаются по группе.
Фтор непосредственно реагирует со всеми халькогенами, кроме кислорода, с образованием гексафторидов (YF 6 ), которые являются чрезвычайно стабильными и инертными соединениями.
Известны четыре дополнительных стабильных фторида серы; таким образом, степени окисления серы варьируются от +1 до +6 (Рисунок 22.13 «Структуры известных фторидов серы»). Напротив, только четыре фторида селена (SeF 6 , SeF 4 , FSeSeF и SeSeF 2 ) и только три теллура (TeF 4 , TeF 6 и Te 2 F 10 ).
Рисунок 22.13 Структуры известных фторидов серы
Известно пять стабильных фторидов серы, содержащих серу в степенях окисления от +1 до +6.Все они являются летучими молекулярными соединениями, которые сильно различаются по стабильности и токсичности. Хотя и SF 6 , и S 2 F 10 очень стабильны, S 2 F 10 токсичен, а SF 6 нет. Остальные три являются высокореактивными веществами.
Прямая реакция более тяжелых халькогенов с кислородом при повышенных температурах дает диоксиды (YO 2 ), которые демонстрируют широкий спектр структур и свойств.
Как и ожидалось, диоксиды становятся все более металлическими по характеру в группе, и координационное число халькогена постоянно увеличивается. Таким образом, SO 2 — это газ, который содержит молекулы V-образной формы (как предсказывает модель отталкивания пар электронов с валентной оболочкой), SeO 2 — белое твердое тело с бесконечной цепочечной структурой (каждая Se имеет трехкоординатную структуру), TeO 2 представляет собой светло-желтое твердое вещество с сетчатой структурой, в которой каждый атом Те представляет собой четырехкоординатный атом, а PoO 2 представляет собой желтое ионное твердое вещество, в котором каждый ион Po 4+ является восьмикоординатным.
Диоксиды серы, селена и теллура реагируют с водой с образованием слабых дипротонных оксокислот (H 2 YO 3 — сернистая, селеновая и теллуровая кислоты соответственно). И серная кислота, и селеновая кислота (H 2 SeO 4 ) являются сильными кислотами, но теллуровая кислота [Te (OH) 6 ] совсем другая.
Поскольку теллур больше, чем сера или селен, он образует более слабые π-связи с кислородом. В результате наиболее стабильной структурой теллуровой кислоты является Te (OH) 6 с шестью связями Te – OH, а не связями Te = O.Таким образом, теллуровая кислота ведет себя как слабая трипротонная кислота в водном растворе, последовательно теряя атомы водорода, связанные с тремя атомами кислорода. Как и ожидалось для соединений, которые содержат элементы в их наивысшей доступной степени окисления (в данном случае +6), серная, селеновая и теллуровая кислоты являются окислителями. Поскольку стабильность наивысшей степени окисления снижается с увеличением атомного номера, теллуровая кислота является более сильным окислителем, чем серная кислота.
Обратите внимание на узор
Стабильность наивысшей степени окисления халькогенов снижается вниз по колонке.
Сера и, в меньшей степени, селен реагируют с углеродом с образованием обширного ряда соединений, структурно сходных с их кислородными аналогами. Например, CS 2 и CSe 2 являются летучими жидкостями, которые содержат связи C = S или C = Se и имеют ту же линейную структуру, что и CO 2 . Однако, поскольку эти двойные связи значительно слабее, чем связь C = O, CS 2 , CSe 2 и родственные соединения менее стабильны и более реакционноспособны, чем их кислородные аналоги.Халькогены также напрямую взаимодействуют почти со всеми металлами с образованием соединений с широким диапазоном стехиометрии и разнообразной структурой. Халькогениды металлов могут содержать либо простой халькогенид-ион (Y 2-), как в Na 2, S и FeS, либо полихалькогенид-ионы (Y n 2-), как в FeS 2 и Na 2 S 5 .
Обратите внимание на узор
Диоксиды элементов группы 16 становятся все более основными, и координационное число халькогена постепенно увеличивается вниз по группе.
Ионные халькогениды, такие как Na 2 S, реагируют с водной кислотой с образованием бинарных гидридов , таких как сероводород (H 2 S). Поскольку прочность связи Y – H уменьшается с увеличением атомного радиуса, стабильность бинарных гидридов быстро снижается по группе. Возможно, удивительно, что сероводород с его знакомым запахом тухлых яиц намного более токсичен, чем цианистый водород (HCN), газ, используемый для казни заключенных в «газовой камере».«Сероводород в относительно низких концентрациях подавляет обонятельные рецепторы в носу, что позволяет ему достигать токсичных уровней без обнаружения и делает его особенно опасным.
Пример 8
Для каждой реакции объясните, почему образуется данный продукт или почему реакция не происходит.
- SO 2 (г) + Cl 2 (г) → SO 2 Cl 2 (л)
- SF 6 (г) + H 2 O (л) → нет реакции
- 2Se (s) + Cl 2 (г) → Se 2 Cl 2 (л)
Дано: сбалансированные химические уравнения
Спрошено: почему данные продукты (или их нет) образуют
Стратегия:
Классифицируйте тип реакции.Используя периодические тенденции изменения атомных свойств, термодинамики и кинетики, объясните, почему образуются продукты реакции или почему реакции не происходит.
Решение:
Один из реагентов (Cl 2 ) — окислитель. Если другой реагент может быть окислен, вероятна окислительно-восстановительная реакция. Диоксид серы содержит серу в степени окисления +4, что на 2 меньше, чем ее максимальная степень окисления.Диоксид серы также известен как мягкий восстанавливающий агент в водном растворе, производящий серную кислоту в качестве продукта окисления. Следовательно, вероятна окислительно-восстановительная реакция. Простейшей реакцией является образование SO 2 Cl 2 (сульфурилхлорид), который представляет собой тетраэдрическую разновидность с двумя связями S – Cl и двумя связями S = O.
- Гексафторид серы — это галогенид неметалла. Такие соединения обычно активно взаимодействуют с водой с образованием оксокислоты неметалла и соответствующей галогенводородной кислоты.В этом случае, однако, мы имеем высокостабильный вид, предположительно потому, что все доступные орбитали серы являются связывающими орбиталями. Таким образом, маловероятно, что SF 6 вступит в реакцию с водой.
- Вот реакция халькогена с галогеном. Галоген — хороший окислитель, поэтому можно ожидать, что произойдет окислительно-восстановительная реакция. Только фтор способен окислять халькогены до степени окисления +6, поэтому мы должны выбирать между SeCl 4 и Se 2 Cl 2 в качестве продукта.Стехиометрия реакции определяет, какой из двух будет получен: SeCl 4 или Se 2 Cl 2 .
Упражнение
Определите продукты каждой реакции и напишите сбалансированное химическое уравнение для каждой реакции.
- Те (тв) + Na (тв) → Δ
- SF 4 (г) + H 2 O (л) →
- CH 3 SeSeCH 3 (soln) + K (s) →
- Li 2 Se (s) + H + (водн.) →
Ответ:
- Te (s) + 2Na (s) → Na 2 Te (s)
- SF 4 (г) + 3H 2 O (л) → H 2 SO 3 (вод.) + 4HF (вод.)
- CH 3 SeSeCH 3 (soln) + 2K (s) → 2KCH 3 Se (soln)
- Li 2 Se (s) + 2H + (водн.) → H 2 Se (г) + 2Li + (водн.)
Сводка
Поскольку электроотрицательность халькогенов уменьшается вниз по группе, то же самое происходит и с их тенденцией приобретать два электрона с образованием соединений в степени окисления -2.Самый легкий член, кислород, имеет наибольшую тенденцию к образованию множественных связей с другими элементами. Однако он не образует стабильных сцепленных соединений из-за отталкивания неподеленных пар электронов на соседних атомах. Из-за его высокой электроотрицательности химический состав кислорода обычно ограничивается соединениями, в которых он имеет отрицательную степень окисления, а его связи с другими элементами имеют тенденцию быть очень полярными. Оксиды металлов обычно являются основными, а оксиды неметаллов — кислотными, тогда как оксиды элементов на границе раздела между металлами и неметаллами являются амфотерными.Реакционная способность, сила множественных связей с кислородом и тенденция к образованию катенированных соединений снижаются по группе, тогда как максимальные координационные числа увеличиваются. Поскольку связи Te = O сравнительно слабые, наиболее стабильная оксокислота теллура содержит шесть связей Te – OH. Стабильность наивысшей степени окисления (+6) снижается по группе. Двойные связи между S или Se и атомами второго ряда слабее, чем аналогичные связи C = O из-за меньшего перекрытия орбиталей. Стабильность бинарных гидридов снижается по группе.
Основные выводы
- Халькогены не содержат стабильных металлических элементов.
- Склонность к катетированию, сила одинарных связей и реактивность уменьшаются по мере продвижения вниз по группе.
Концептуальные проблемы
В отличие от других халькогенов, кислород не образует соединений со степенью окисления +4 или +6.Почему?
Классифицируйте каждый оксид как основной, кислотный, амфотерный или нейтральный.
- CaO
- СО 2
- НЕТ
- Rb 2 O
- Пбо 2
Классифицируйте каждый оксид как основной, кислотный, амфотерный или нейтральный.
- BaO
- Br 2 O
- SnO
- B 2 O 3
- Сб 2 О 3
Поляризация оксида влияет на его растворимость в кислотах или щелочах.Исходя из этого, ожидаете ли вы, что RuO 2 будет кислым, основным или нейтральным оксидом? Является ли соединение ковалентным? Обоснуйте свои ответы.
Расположите CrO 3 , Al 2 O 3 , Sc 2 O 3 и BaO в порядке увеличения основности.
По мере увеличения атомного номера элементов группы 16 сложность их аллотропов уменьшается.Какие факторы объясняют эту тенденцию? Какой халькоген, по вашему мнению, будет полимеризоваться наиболее легко? Почему?
Расположите H 3 BO 3 , HIO 4 и HNO 2 в порядке увеличения силы кислоты.
OF 2 , SO 2 , P 4 O 6 , SiO 2 и Al 2 O 3 , что является наиболее ионным?
CO 2 , NO 2 , O 2 , SO 2 , Cl 2 O, H 2 O, NH 3 и CH 4 , которые вы ожидаете иметь
- самая полярная ковалентная связь (и)?
- наименьшая полярная ковалентная связь (и)?
Из Na 2 O 2 , MgO, Al 2 O 3 и SiO 2 , что является наиболее кислотным?
Приведите пример
- ковалентный гидрид, который участвует в сильной водородной связи.
- амфотерный оксид.
Связь Si – O короче и прочнее, чем ожидалось. Какие орбитали используются в этой связи? Ожидаете ли вы, что Si будет таким же образом взаимодействовать с Br? Почему или почему нет?
ответов
Кислород занимает второе место по электроотрицательности среди всех элементов; следовательно, он предпочитает разделять или принимать электроны от других элементов.Только с фтором кислород образует соединения с положительной степенью окисления.
- базовый
- кислая
- амфотерный
- кислая
- амфотерный
CrO 3
2 O 3 2 O 3 Наиболее полярный: H 2 O; наименее полярный: O 2
- H 2 O, HF или NH 3
- SnO или Al 2 O 3
Структура и реакционная способность
Учитывая его положение в периодической таблице, предсказать следующие свойства селена:
- химические формулы его наиболее распространенного оксида, наиболее распространенного хлорида и наиболее распространенного гидрида
- растворимость его гидрида в воде и кислотность или основность полученного раствора
- основной ион в водном растворе
Используя аргументы, основанные на электроотрицательности, объясните, почему ZnO является амфотерным.Какой продукт вы ожидаете, когда ZnO реагирует с водным раствором
?
- кислота?
- база?
Напишите вычисленное химическое уравнение реакции серы с
.
- O 2 (г).
- S 2- (водн.).
- F 2 (г).
- HNO 3 (водн.).
Ответ
- S 8 + 😯 2 → Δ 8SO 2 (г)
- S 8 (s) + 8S 2- (водн.


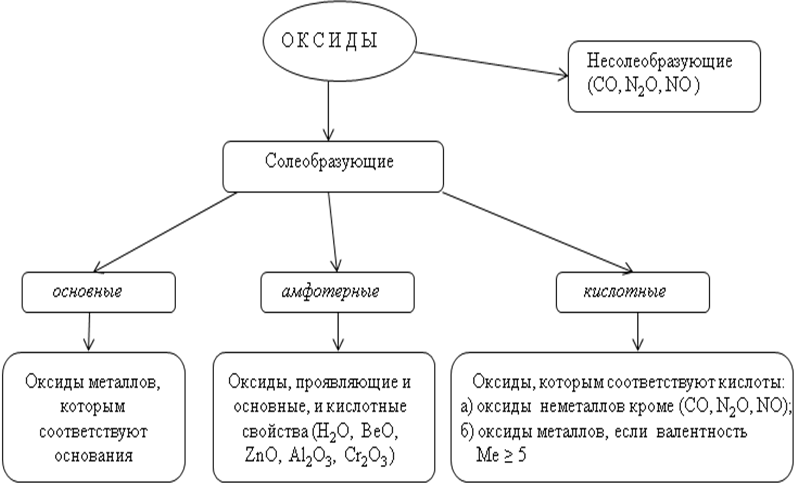 Например,
Например,
 С раствором гидроксида натрия получается вода и алюминат натрия (NaAlO \ [_ {2} \]). Другие распространенные примеры амфотерных оксидов включают SnO, ZnO и PbO. Al \ [_ {2} \] O \ [_ {3} \] — амфотерный оксид. Формула амфотерного оксида — Al \ [_ {2} \] O \ [_ {3} \].
С раствором гидроксида натрия получается вода и алюминат натрия (NaAlO \ [_ {2} \]). Другие распространенные примеры амфотерных оксидов включают SnO, ZnO и PbO. Al \ [_ {2} \] O \ [_ {3} \] — амфотерный оксид. Формула амфотерного оксида — Al \ [_ {2} \] O \ [_ {3} \]. Это описывает важные свойства соединений. Таким же образом щелочь реагирует с образованием как соли, так и воды, демонстрируя кислотные свойства. Примером может служить оксид алюминия.
Это описывает важные свойства соединений. Таким же образом щелочь реагирует с образованием как соли, так и воды, демонстрируя кислотные свойства. Примером может служить оксид алюминия. Амфотерные оксиды обладают как кислотными, так и основными свойствами. Оксиды цинка и алюминия являются примерами. Когда они вступают в реакцию с кислотами, они образуют соли. Кроме того, они реагируют со щелочами с образованием сложных солей.
Амфотерные оксиды обладают как кислотными, так и основными свойствами. Оксиды цинка и алюминия являются примерами. Когда они вступают в реакцию с кислотами, они образуют соли. Кроме того, они реагируют со щелочами с образованием сложных солей.
 Следовательно, для Группы V кислотность оксидов равна P \ [_ {2} \] O \ [_ {3} \] (кислая), NO \ [_ {2} \] (кислая), As \ [_ {2} \] O \ [_ {3} \] (амфотерный). Bi \ [_ {2} \] O \ [_ {3} \] (основной), Sb \ [_ {2} \] O \ [_ {3} \] (амфотерный).
Следовательно, для Группы V кислотность оксидов равна P \ [_ {2} \] O \ [_ {3} \] (кислая), NO \ [_ {2} \] (кислая), As \ [_ {2} \] O \ [_ {3} \] (амфотерный). Bi \ [_ {2} \] O \ [_ {3} \] (основной), Sb \ [_ {2} \] O \ [_ {3} \] (амфотерный).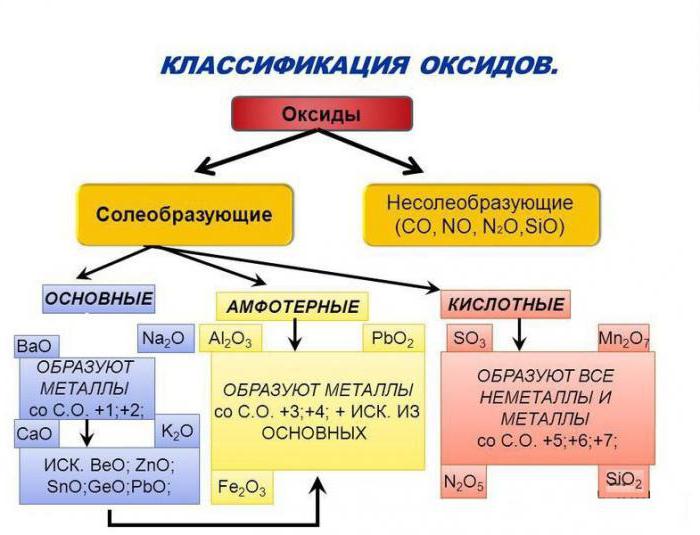 Следовательно, он может реагировать с водой с высвобождением протонов вместо гидроксильных групп.{2 -} \] будет реагировать с протонами в растворе, а также действовать как основной оксид.
Следовательно, он может реагировать с водой с высвобождением протонов вместо гидроксильных групп.{2 -} \] будет реагировать с протонами в растворе, а также действовать как основной оксид.
 Амфотеризм описывается как характерное выражение неметаллической природы металла, поскольку это относится к его способности каким-либо образом проявлять неметаллические свойства. Другими словами, чтобы объяснить, что амфотеризм некоторых оксидов, вероятно, связан со способностью самого металла поляризовать оксидные ионы, с которыми он связан, так что значительный процент ковалентного характера может быть введен в связь.
Амфотеризм описывается как характерное выражение неметаллической природы металла, поскольку это относится к его способности каким-либо образом проявлять неметаллические свойства. Другими словами, чтобы объяснить, что амфотеризм некоторых оксидов, вероятно, связан со способностью самого металла поляризовать оксидные ионы, с которыми он связан, так что значительный процент ковалентного характера может быть введен в связь.

 . Добавление PbO в промышленную керамику (и стекло) делает их электрически и магнитно инертными (повышает температуру Кюри) и обычно используется для этих целей.
. Добавление PbO в промышленную керамику (и стекло) делает их электрически и магнитно инертными (повышает температуру Кюри) и обычно используется для этих целей. Узнайте о солевых растворах, изучив соль на молекулярном уровне и влияние pH на солевые растворы.
Узнайте о солевых растворах, изучив соль на молекулярном уровне и влияние pH на солевые растворы. Узнайте о титровании, титранте, реакции нейтрализации и точке эквивалентности, а также о том, как выполнять титрование и интерпретировать кривую титрования.
Узнайте о титровании, титранте, реакции нейтрализации и точке эквивалентности, а также о том, как выполнять титрование и интерпретировать кривую титрования. Узнайте об определении амфипротических веществ и откройте для себя примеры амфипротических соединений.
Узнайте об определении амфипротических веществ и откройте для себя примеры амфипротических соединений. В сочетании они образуют соль. Узнайте больше о кислотах, основаниях и солях, в том числе о том, где они встречаются в домашних условиях.
В сочетании они образуют соль. Узнайте больше о кислотах, основаниях и солях, в том числе о том, где они встречаются в домашних условиях. Изучите автоионизацию воды, константу Kw и способы определения концентрации ионов.
Изучите автоионизацию воды, константу Kw и способы определения концентрации ионов. Изучите типы этих оснований и посмотрите, как они соотносятся с кислотами на примерах реакций.
Изучите типы этих оснований и посмотрите, как они соотносятся с кислотами на примерах реакций.
 Оксид олова (II) образуется, когда соли олова реагируют с щелочью, такой как гидроксид натрия.
Оксид олова (II) образуется, когда соли олова реагируют с щелочью, такой как гидроксид натрия.
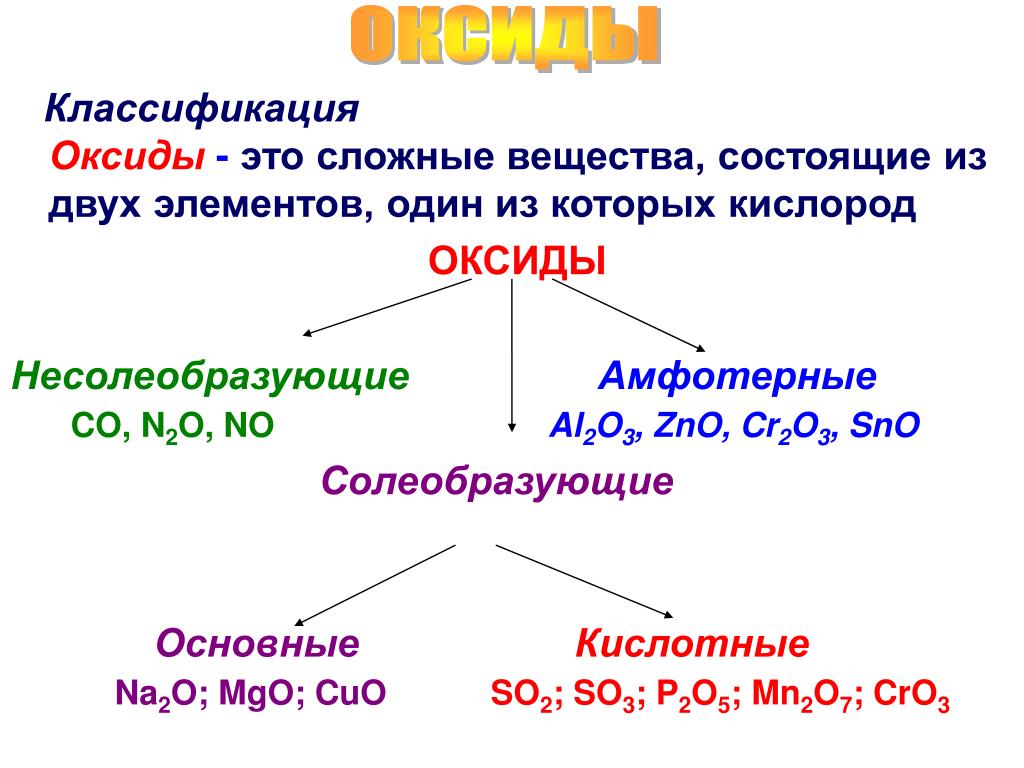 Амфотерные оксиды реагируют с обычными неорганическими кислотами с образованием соли металла и воды.
Амфотерные оксиды реагируют с обычными неорганическими кислотами с образованием соли металла и воды. ) + H 2 O (л)
) + H 2 O (л)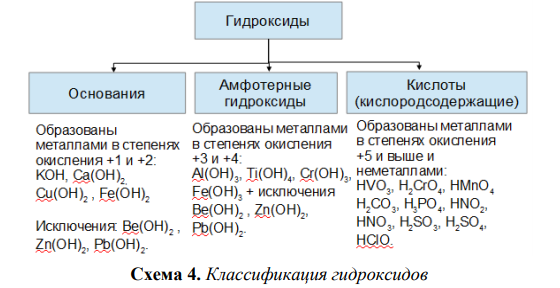 )
) В то же время снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.
В то же время снижает вязкость стекла. Следовательно, PbO необходим для стекольной промышленности.  В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание.
В зависимости от реагентов и других условий реакции соединение ведет себя либо как кислота, либо как основание. Оксиды образуются, когда определенный элемент реагирует с кислородом. Поскольку кислород обладает высокой реакционной способностью по своей природе, он реагирует с металлическими и неметаллическими элементами и образует оксиды этих элементов. Этот кислород поступает из воздуха или воды. Из-за высокой электроотрицательности кислород может реагировать практически со всеми элементами, кроме благородных газов. Основные типы оксидов включают кислотные оксиды, основные оксиды, амфотерные оксиды и нейтральные оксиды. Эта классификация проводится в соответствии с природой и свойствами этих оксидов.Ключевое различие между кислотными и основными оксидами состоит в том, что кислотных оксидов образуют кислоты при растворении в воде , тогда как основных оксидов образуют основания при растворении в воде.
Оксиды образуются, когда определенный элемент реагирует с кислородом. Поскольку кислород обладает высокой реакционной способностью по своей природе, он реагирует с металлическими и неметаллическими элементами и образует оксиды этих элементов. Этот кислород поступает из воздуха или воды. Из-за высокой электроотрицательности кислород может реагировать практически со всеми элементами, кроме благородных газов. Основные типы оксидов включают кислотные оксиды, основные оксиды, амфотерные оксиды и нейтральные оксиды. Эта классификация проводится в соответствии с природой и свойствами этих оксидов.Ключевое различие между кислотными и основными оксидами состоит в том, что кислотных оксидов образуют кислоты при растворении в воде , тогда как основных оксидов образуют основания при растворении в воде.  Резюме
Резюме д. Следующая реакция представляет собой пример растворения кислотного оксида в воде.
д. Следующая реакция представляет собой пример растворения кислотного оксида в воде. )
) 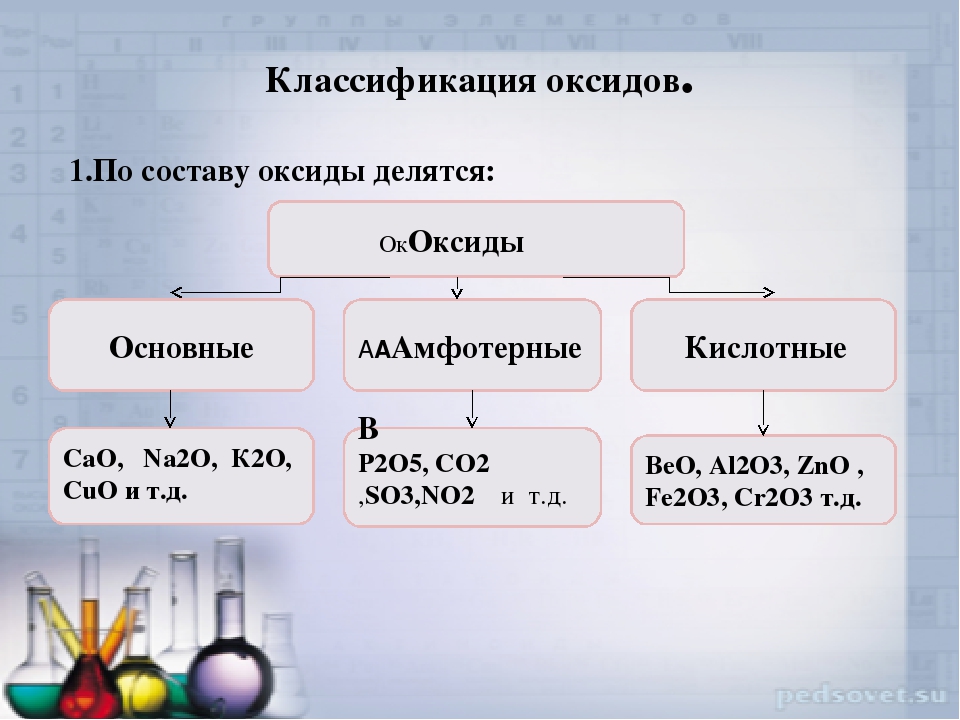
 Ключевое различие между кислотными оксидами и основными оксидами заключается в том, что кислотные оксиды образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Ключевое различие между кислотными оксидами и основными оксидами заключается в том, что кислотные оксиды образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде. .. Страницы 1-13 — Flip PDF Скачать
.. Страницы 1-13 — Flip PDF Скачать 1
1 ОСНОВНОЙ ОКСИД КИСЛОТНЫЙ ОКСИД АМФОТЕРНЫЙ ОКСИД сильное основание Амфотерные частицы Сильная кислота 2
ОСНОВНОЙ ОКСИД КИСЛОТНЫЙ ОКСИД АМФОТЕРНЫЙ ОКСИД сильное основание Амфотерные частицы Сильная кислота 2 Оксиды неметаллов вступают в реакцию с водой с образованием так называемых оксокислот или оксикислот, то есть кислот, содержащих звено NM-OH, где NM = неметалл. оксид металла обычно характеризуется полярными ковалентными связями, а не ионными связями оксида металла. 3
Оксиды неметаллов вступают в реакцию с водой с образованием так называемых оксокислот или оксикислот, то есть кислот, содержащих звено NM-OH, где NM = неметалл. оксид металла обычно характеризуется полярными ковалентными связями, а не ионными связями оксида металла. 3 Оксоанионы (комбинации кислорода и NM) гидратированы в водном растворе. В этом случае электростатическое притяжение возникает между электронными парами на оксоанионных атомах кислорода и частично положительными атомами H молекул воды. . Гидратация — экзотермический процесс. Энергия гидратации увеличивается с увеличением заряда и уменьшением размера. Если взаимодействие между анионом и атомом H воды достаточно сильное, H можно удалить из воды, образуя гидроксид-ион, что приведет к получению основного раствора.MOxy- + h3O [MO (x-1) OH] (y-1) + OH- При определении основности оксоаниона мы должны принимать во внимание заряд, количество оксогрупп и электроотрицательность. Оксоанионы можно разделить на категории, которые описывают степень, в которой они гидролизуются.Влияние заряда на основность Увеличение заряда аниона увеличивает его склонность к гидролизу и образованию основных растворов. Значения pKb оксоаниона уменьшаются на 4-5 единиц для каждого дополнительного отрицательного заряда на анионе.
Оксоанионы (комбинации кислорода и NM) гидратированы в водном растворе. В этом случае электростатическое притяжение возникает между электронными парами на оксоанионных атомах кислорода и частично положительными атомами H молекул воды. . Гидратация — экзотермический процесс. Энергия гидратации увеличивается с увеличением заряда и уменьшением размера. Если взаимодействие между анионом и атомом H воды достаточно сильное, H можно удалить из воды, образуя гидроксид-ион, что приведет к получению основного раствора.MOxy- + h3O [MO (x-1) OH] (y-1) + OH- При определении основности оксоаниона мы должны принимать во внимание заряд, количество оксогрупп и электроотрицательность. Оксоанионы можно разделить на категории, которые описывают степень, в которой они гидролизуются.Влияние заряда на основность Увеличение заряда аниона увеличивает его склонность к гидролизу и образованию основных растворов. Значения pKb оксоаниона уменьшаются на 4-5 единиц для каждого дополнительного отрицательного заряда на анионе.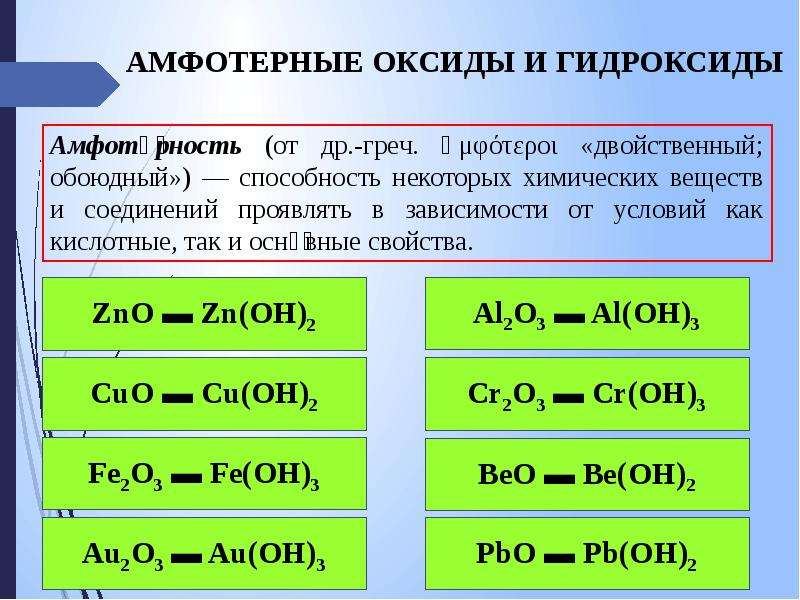 Влияние количества оксогрупп Поскольку большинство неметаллов проявляют более одной степени окисления, они могут образовывать оксоанионы, которые различаются числом оксогрупп (кислород, непосредственно связанный с металлом). Например, хлор образует четыре различных оксоаниона: ClO-, ClO2-, ClO3-, ClO4-.Добавление дополнительного кислорода снижает основность оксоаниона. Влияние электроотрицательности По мере уменьшения электроотрицательности атома неметалла основность оксоаниона увеличивается. 5
Влияние количества оксогрупп Поскольку большинство неметаллов проявляют более одной степени окисления, они могут образовывать оксоанионы, которые различаются числом оксогрупп (кислород, непосредственно связанный с металлом). Например, хлор образует четыре различных оксоаниона: ClO-, ClO2-, ClO3-, ClO4-.Добавление дополнительного кислорода снижает основность оксоаниона. Влияние электроотрицательности По мере уменьшения электроотрицательности атома неметалла основность оксоаниона увеличивается. 5 Этот анион относится к неосновным 2. Рассмотрим оксоанион формулы MO34-. Три оксогруппы нейтрализуют 1,5 единицы отрицательного заряда. Полученная формула становится M-2.5. Этот оксоанион будет очень щелочным. В таблице на следующем слайде перечислены рассчитанные pKb для важных простых оксоанионов элементов.6
Этот анион относится к неосновным 2. Рассмотрим оксоанион формулы MO34-. Три оксогруппы нейтрализуют 1,5 единицы отрицательного заряда. Полученная формула становится M-2.5. Этот оксоанион будет очень щелочным. В таблице на следующем слайде перечислены рассчитанные pKb для важных простых оксоанионов элементов.6 8
8 7-1.5) X OH X + + OH- Получение основания в растворе. Большая разница в электроотрицательности между металлом и кислородом, что делает связь M-O более полярной. Более полярная связь МО подвержена атаке со стороны полярных молекул воды. Это приводит к разрыву связи МО с образованием водного катиона металла и аниона гидроксида в растворе. Для неметалла (ENs 2.3-3.5) В этом случае Связь ОН является более полярной и восприимчивой к атаке со стороны молекул воды, что приводит к образованию ионов оксоаниона и гидроксония в растворе.X OH XO- + H + Получение кислого раствора. Для полуметалла Две связи звена E-O-H имеют примерно одинаковую полярность, и любая из них может быть разорвана в зависимости от обстоятельств. В данном случае единица амфотерная. 10
7-1.5) X OH X + + OH- Получение основания в растворе. Большая разница в электроотрицательности между металлом и кислородом, что делает связь M-O более полярной. Более полярная связь МО подвержена атаке со стороны полярных молекул воды. Это приводит к разрыву связи МО с образованием водного катиона металла и аниона гидроксида в растворе. Для неметалла (ENs 2.3-3.5) В этом случае Связь ОН является более полярной и восприимчивой к атаке со стороны молекул воды, что приводит к образованию ионов оксоаниона и гидроксония в растворе.X OH XO- + H + Получение кислого раствора. Для полуметалла Две связи звена E-O-H имеют примерно одинаковую полярность, и любая из них может быть разорвана в зависимости от обстоятельств. В данном случае единица амфотерная. 10 Электроотрицательность центрального атома 2. Число негидроксильных атомов кислорода, связанных с центральным атомом. По мере того, как электроотрицательность центрального атома увеличивается, его способность отбирать электронную плотность от соседних атомов. Окружающие атомы кислорода имеют высокую электроотрицательность, поэтому центральный атом не может отбирать у них электронную плотность. Электронная плотность происходит от связей O-H.Атом H имеет низкую электроотрицательность. Электронная плотность удаляется из связи O-H, H становится более частично положительным, и, следовательно, связь O-H более полярна и восприимчива к атаке со стороны молекул воды. Кислотная сила оксикислоты увеличивается по мере увеличения электроотрицательности центрального атома. Например, серная кислота является более сильной кислотой, чем селеновая кислота, фосфорная кислота сильнее мышьяковой кислоты, а хлорная кислота сильнее надбромовой кислоты. По мере увеличения количества негидроксильных атомов кислорода они забирают больше электронной плотности из центрального атома, делая ее частично положительной.
Электроотрицательность центрального атома 2. Число негидроксильных атомов кислорода, связанных с центральным атомом. По мере того, как электроотрицательность центрального атома увеличивается, его способность отбирать электронную плотность от соседних атомов. Окружающие атомы кислорода имеют высокую электроотрицательность, поэтому центральный атом не может отбирать у них электронную плотность. Электронная плотность происходит от связей O-H.Атом H имеет низкую электроотрицательность. Электронная плотность удаляется из связи O-H, H становится более частично положительным, и, следовательно, связь O-H более полярна и восприимчива к атаке со стороны молекул воды. Кислотная сила оксикислоты увеличивается по мере увеличения электроотрицательности центрального атома. Например, серная кислота является более сильной кислотой, чем селеновая кислота, фосфорная кислота сильнее мышьяковой кислоты, а хлорная кислота сильнее надбромовой кислоты. По мере увеличения количества негидроксильных атомов кислорода они забирают больше электронной плотности из центрального атома, делая ее частично положительной. В свою очередь, центральный атом теперь забирает больше электронной плотности из единственного доступного источника, то есть связи O-H. Снова атом H становится частично положительным, и связь O-H становится более полярной и, следовательно, более восприимчивой к атаке воды. В результате увеличивается количество негидроксильных атомов кислорода, увеличивается и сила оксикислоты. Например, сила кислоты увеличивается от азотистой кислоты до азотной кислоты и от серной до серной кислоты. 11
В свою очередь, центральный атом теперь забирает больше электронной плотности из единственного доступного источника, то есть связи O-H. Снова атом H становится частично положительным, и связь O-H становится более полярной и, следовательно, более восприимчивой к атаке воды. В результате увеличивается количество негидроксильных атомов кислорода, увеличивается и сила оксикислоты. Например, сила кислоты увеличивается от азотистой кислоты до азотной кислоты и от серной до серной кислоты. 11 CrO3 аналогичен SO3h3CrO4 h3SO4 Хромовая кислота Серная кислота4. Реакции кислотных и основных оксидов 1. С h3O для получения кислоты или основанийCaO + h3O Ca (OH) 2основной оксид N2O5 + h3O 2HNO3кислый оксид2. Взаимодействуют друг с другом с образованием солей. Na2O (s) + SO3 (г) Na2SO4 (s) основной кислый солевой оксид 12
CrO3 аналогичен SO3h3CrO4 h3SO4 Хромовая кислота Серная кислота4. Реакции кислотных и основных оксидов 1. С h3O для получения кислоты или основанийCaO + h3O Ca (OH) 2основной оксид N2O5 + h3O 2HNO3кислый оксид2. Взаимодействуют друг с другом с образованием солей. Na2O (s) + SO3 (г) Na2SO4 (s) основной кислый солевой оксид 12 Как и в группах 14 и 15, самый легкий элемент группы 16, кислород, встречается в природе как свободный элемент.
Как и в группах 14 и 15, самый легкий элемент группы 16, кислород, встречается в природе как свободный элемент.
 Главу 23 «The».) Еще одним важным промышленным использованием кислорода является производство TiO 2 , который обычно используется в качестве белого пигмента в красках, бумаге и пластмассах.
Главу 23 «The».) Еще одним важным промышленным использованием кислорода является производство TiO 2 , который обычно используется в качестве белого пигмента в красках, бумаге и пластмассах. Теллур используется для окраски стекла и керамики, при производстве капсюлей-детонаторов и в термоэлектрических устройствах.
Теллур используется для окраски стекла и керамики, при производстве капсюлей-детонаторов и в термоэлектрических устройствах. Он изучал медицину в Университете Упсалы, где его эксперименты с электрошоковой терапией заставили его интересы обратиться к электрохимии. Берцелиус разработал систему химических обозначений, которую мы используем сегодня. Кроме того, он открыл шесть элементов (церий, торий, селен, кремний, титан и цирконий).
Он изучал медицину в Университете Упсалы, где его эксперименты с электрошоковой терапией заставили его интересы обратиться к электрохимии. Берцелиус разработал систему химических обозначений, которую мы используем сегодня. Кроме того, он открыл шесть элементов (церий, торий, селен, кремний, титан и цирконий). (Дополнительную информацию о радиоактивности и полонии см. В главе 1 «Введение в химию», раздел 1.5 «Атом».) Хотя ей так и не удалось получить макроскопические количества элемента, который она назвала в честь своей родной страны, Польши, она продемонстрировала, что химический состав этого элемента требует отнесения его к группе 16. Мари Кюри была награждена вторым. Нобелевская премия по химии 1911 г. за открытие радия и полония.
(Дополнительную информацию о радиоактивности и полонии см. В главе 1 «Введение в химию», раздел 1.5 «Атом».) Хотя ей так и не удалось получить макроскопические количества элемента, который она назвала в честь своей родной страны, Польши, она продемонстрировала, что химический состав этого элемента требует отнесения его к группе 16. Мари Кюри была награждена вторым. Нобелевская премия по химии 1911 г. за открытие радия и полония. 33
33 Однако настоящее золото намного плотнее, чем FeS 2 , и оно мягкое и податливое, а не твердое и хрупкое.
Однако настоящее золото намного плотнее, чем FeS 2 , и оно мягкое и податливое, а не твердое и хрупкое. Таким образом, в реакциях с металлами они имеют тенденцию приобретать два дополнительных электрона с образованием соединений в степени окисления -2. Эта тенденция наиболее велика для кислорода, халькогена с наивысшей электроотрицательностью. Более тяжелые, менее электроотрицательные халькогены могут потерять либо четыре н.п. электронов, либо четыре н.п. и два нс электронов с образованием соединений в степени окисления +4 и +6 соответственно, как показано в Таблице 22.4 «Избранные свойства элементов группы 16». Как и в случае с другими группами, самый легкий член в группе, в данном случае кислород, сильно отличается от других по размеру, энергии ионизации, электроотрицательности и сродству к электрону, поэтому его химический состав уникален. Также, как и в других группах, второй и третий члены (сера и селен) обладают схожими свойствами из-за экранирующих эффектов. Только полоний является металлическим, образуя либо гидратированный ион Po 2+ , либо ион Po 4+ в водном растворе, в зависимости от условий.
Таким образом, в реакциях с металлами они имеют тенденцию приобретать два дополнительных электрона с образованием соединений в степени окисления -2. Эта тенденция наиболее велика для кислорода, халькогена с наивысшей электроотрицательностью. Более тяжелые, менее электроотрицательные халькогены могут потерять либо четыре н.п. электронов, либо четыре н.п. и два нс электронов с образованием соединений в степени окисления +4 и +6 соответственно, как показано в Таблице 22.4 «Избранные свойства элементов группы 16». Как и в случае с другими группами, самый легкий член в группе, в данном случае кислород, сильно отличается от других по размеру, энергии ионизации, электроотрицательности и сродству к электрону, поэтому его химический состав уникален. Также, как и в других группах, второй и третий члены (сера и селен) обладают схожими свойствами из-за экранирующих эффектов. Только полоний является металлическим, образуя либо гидратированный ион Po 2+ , либо ион Po 4+ в водном растворе, в зависимости от условий.
 е.м.)
е.м.) 31 (г / л)
31 (г / л) 4
4
 Перекись водорода (H 2 O 2 ) настолько термодинамически нестабильна, что при загрязнении имеет тенденцию к взрывному разложению:
Перекись водорода (H 2 O 2 ) настолько термодинамически нестабильна, что при загрязнении имеет тенденцию к взрывному разложению: В отличие от других халькогенов, кислород не образует соединений со степенью окисления +4 или +6. Кислород уступает только фтору по способности стабилизировать высокие степени окисления металлов как в ионных, так и в ковалентных соединениях. Например, AgO представляет собой стабильное твердое вещество, которое содержит серебро в необычном состоянии Ag (II), тогда как OsO 4 представляет собой летучее твердое вещество, содержащее Os (VIII).Поскольку кислород настолько электроотрицателен, связь O – H является очень полярной, создавая большой дипольный момент связи, что делает водородную связь гораздо более важной для соединений кислорода, чем для аналогичных соединений других халькогенов.
В отличие от других халькогенов, кислород не образует соединений со степенью окисления +4 или +6. Кислород уступает только фтору по способности стабилизировать высокие степени окисления металлов как в ионных, так и в ковалентных соединениях. Например, AgO представляет собой стабильное твердое вещество, которое содержит серебро в необычном состоянии Ag (II), тогда как OsO 4 представляет собой летучее твердое вещество, содержащее Os (VIII).Поскольку кислород настолько электроотрицателен, связь O – H является очень полярной, создавая большой дипольный момент связи, что делает водородную связь гораздо более важной для соединений кислорода, чем для аналогичных соединений других халькогенов. 5
5
 36
36 ) + 2MnO 4 — (вод.) + 2H + (водн.) → 3O 2 (г) + 2MnO 2 (с) + 4H 2 O (л)
) + 2MnO 4 — (вод.) + 2H + (водн.) → 3O 2 (г) + 2MnO 2 (с) + 4H 2 O (л) Более того, алюминий, элемент сразу после галлия в группе 13, является амфотерным.Следовательно, мы прогнозируем, что галлий будет вести себя как алюминий (уравнение 22.37).
Более того, алюминий, элемент сразу после галлия в группе 13, является амфотерным.Следовательно, мы прогнозируем, что галлий будет вести себя как алюминий (уравнение 22.37).
 ) + I — (водн.) →
) + I — (водн.) →

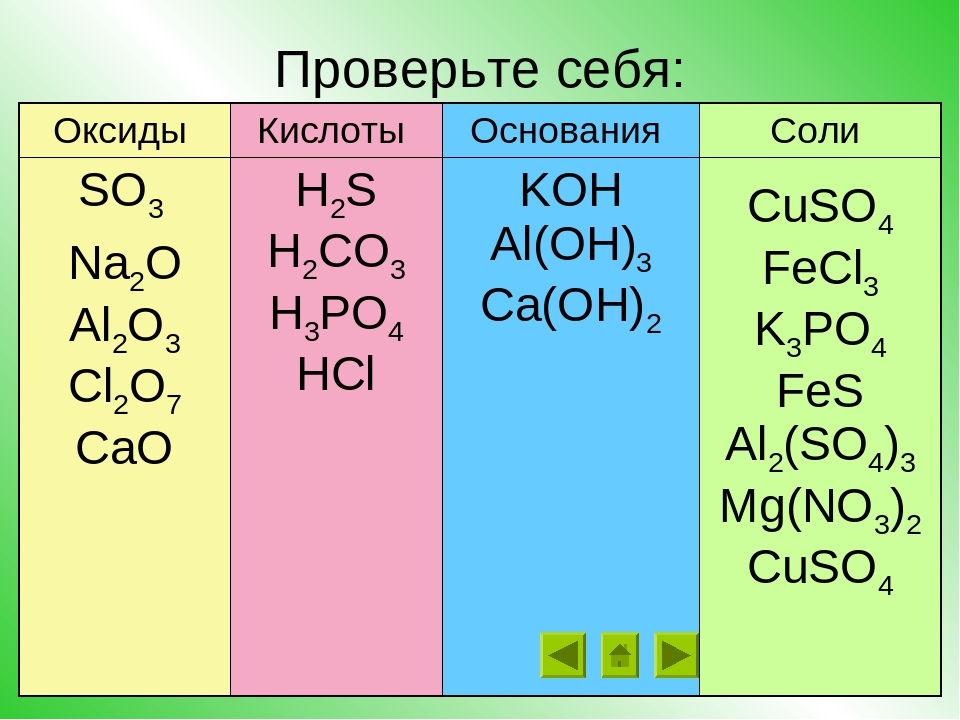 Известны четыре дополнительных стабильных фторида серы; таким образом, степени окисления серы варьируются от +1 до +6 (Рисунок 22.13 «Структуры известных фторидов серы»). Напротив, только четыре фторида селена (SeF 6 , SeF 4 , FSeSeF и SeSeF 2 ) и только три теллура (TeF 4 , TeF 6 и Te 2 F 10 ).
Известны четыре дополнительных стабильных фторида серы; таким образом, степени окисления серы варьируются от +1 до +6 (Рисунок 22.13 «Структуры известных фторидов серы»). Напротив, только четыре фторида селена (SeF 6 , SeF 4 , FSeSeF и SeSeF 2 ) и только три теллура (TeF 4 , TeF 6 и Te 2 F 10 ). Как и ожидалось, диоксиды становятся все более металлическими по характеру в группе, и координационное число халькогена постоянно увеличивается. Таким образом, SO 2 — это газ, который содержит молекулы V-образной формы (как предсказывает модель отталкивания пар электронов с валентной оболочкой), SeO 2 — белое твердое тело с бесконечной цепочечной структурой (каждая Se имеет трехкоординатную структуру), TeO 2 представляет собой светло-желтое твердое вещество с сетчатой структурой, в которой каждый атом Те представляет собой четырехкоординатный атом, а PoO 2 представляет собой желтое ионное твердое вещество, в котором каждый ион Po 4+ является восьмикоординатным.
Как и ожидалось, диоксиды становятся все более металлическими по характеру в группе, и координационное число халькогена постоянно увеличивается. Таким образом, SO 2 — это газ, который содержит молекулы V-образной формы (как предсказывает модель отталкивания пар электронов с валентной оболочкой), SeO 2 — белое твердое тело с бесконечной цепочечной структурой (каждая Se имеет трехкоординатную структуру), TeO 2 представляет собой светло-желтое твердое вещество с сетчатой структурой, в которой каждый атом Те представляет собой четырехкоординатный атом, а PoO 2 представляет собой желтое ионное твердое вещество, в котором каждый ион Po 4+ является восьмикоординатным. Поскольку теллур больше, чем сера или селен, он образует более слабые π-связи с кислородом. В результате наиболее стабильной структурой теллуровой кислоты является Te (OH) 6 с шестью связями Te – OH, а не связями Te = O.Таким образом, теллуровая кислота ведет себя как слабая трипротонная кислота в водном растворе, последовательно теряя атомы водорода, связанные с тремя атомами кислорода. Как и ожидалось для соединений, которые содержат элементы в их наивысшей доступной степени окисления (в данном случае +6), серная, селеновая и теллуровая кислоты являются окислителями. Поскольку стабильность наивысшей степени окисления снижается с увеличением атомного номера, теллуровая кислота является более сильным окислителем, чем серная кислота.
Поскольку теллур больше, чем сера или селен, он образует более слабые π-связи с кислородом. В результате наиболее стабильной структурой теллуровой кислоты является Te (OH) 6 с шестью связями Te – OH, а не связями Te = O.Таким образом, теллуровая кислота ведет себя как слабая трипротонная кислота в водном растворе, последовательно теряя атомы водорода, связанные с тремя атомами кислорода. Как и ожидалось для соединений, которые содержат элементы в их наивысшей доступной степени окисления (в данном случае +6), серная, селеновая и теллуровая кислоты являются окислителями. Поскольку стабильность наивысшей степени окисления снижается с увеличением атомного номера, теллуровая кислота является более сильным окислителем, чем серная кислота.