Гидролиз солей — электролит
Сильные кислоты диссоциируют в растворах на ионы полностью.
HCl => H+ + Cl—
H2SO4=> 2H+ +
Выбери правильный ответ.
Трудно? Ладно, здесь подсказка.
Положи перед собой таблицу растворимости — заряд аниона указан в левом столбце!
Как узнать сильная кислота или слабая?
В таблице растворимости три сильных кислоты H2SO4, HCl, HNO3, соли всех остальных кислот подвергаются гидролизу по I ступени.
Cлабые основания обычно не растворимы. NН4ОН исключение — слабое, но растворимое.
Сильные основания диссоциируют на ионы полностью:
КОН => К+ + ОН—
NаОН=> Nа+ + ОН—
Определите какое основание слабое (пользуйтесь таблицей растворимости)
Совет — Если вы ошибаетесь — внимательно рассмотрите таблицу растворимости:
на пересечении ионов, из которых состоят основания стоит буква Н — основание
нерастворимое, значит слабое. NН4ОН — исключение —
растворимое, но слабое.
NН4ОН — исключение —
растворимое, но слабое.
Еще раз.
Соль АICI3 образована слабым основанием АI(ОН)3 сильной кислотой НСI.
Теперь определите сами какой кислотой и каким основанием образованы соли. (Если ответ верен, то загорается зеленый цвет, если не верен — красный.)
AI(NO3)3
слабое основание
слабая кислота
сильное основание
сильная кислота
CuCI2
слабое основание
слабая кислота
сильное основание
сильная кислота
FeCI3
слабое основание
слабая кислота
сильное основание
сильная кислота
NH4CIO
слабое основание
слабая кислота
сильное основание
сильная кислота
ВаСIО
слабое основание
слабая кислота
сильное основание
сильная кислота
Разница между сильными и слабыми основаниями — Разница Между
Основание — это любое соединение, которое может нейтрализовать кислоту. Следовательно, основание должно иметь гидроксильную группу (-ОН), которая может высвобождаться в виде гидроксильного иона. Поск
Следовательно, основание должно иметь гидроксильную группу (-ОН), которая может высвобождаться в виде гидроксильного иона. Поск
Главное отличие — сильные против слабых основ
Основание — это любое соединение, которое может нейтрализовать кислоту. Следовательно, основание должно иметь гидроксильную группу (-ОН), которая может высвобождаться в виде гидроксильного иона. Поскольку кислоты способны высвобождать протоны (ионы H +), эти протоны могут быть нейтрализованы гидроксильными ионами, высвобождаемыми основанием. Основания можно разделить на два основных типа: сильные основания и слабые основания. Сильные основания очень реактивны и едкие. Но слабые основания не так уж реактивны. Существует ряд сильных оснований и слабых оснований, которые очень полезны в лабораторных и промышленных применениях. Основное различие между сильной и слабой основой состоит в том, что 
Ключевые области покрыты
1. Что такое сильная база
— определение, свойства, реакции с примерами
2. Что такое слабая база
— определение, свойства, реакции с примерами
3. В чем разница между сильными и слабыми основаниями
— Сравнение основных различий
Ключевые слова: кислоты, диссоциация, константа диссоциации, гидроксильный ион, сильные основания, слабые основания
Что такое сильная база
Сильное основание — это соединение, которое может полностью диссоциировать на катион и гидроксильный ион в водном растворе. Гидроксиды металлов группы 1 и группы 2 обычно считаются сильными основаниями, поскольку они состоят из катионов, которые очень малы по сравнению с гидроксильными ионами. Следовательно, они имеют сильную ионную связь. В водном растворе эти два иона могут быть полностью разделены, обеспечивая систему гидроксильными ионами.
Некоторые основания не полностью растворены в воде; например, гидроксид кальция. Но он также считается сильным основанием, потому что он может полностью распасться на ионы. PH раствора дает нам представление о типе присутствующего там основания. Если значение pH очень близко к 14, то этот раствор является сильно основным. Высокое значение pH означает очень низкую концентрацию H+ ионов.
Рисунок 1: NaOH является сильным основанием и вызывает коррозию из-за высокой реакционной способности.
Молекулярная формула основания будет определять количество гидроксильных ионов, высвобождаемых этим основанием. Сильное основание, имеющее одну гидроксильную группу на одну молекулу, высвобождает один моль гидроксильных ионов на один моль основания. Пример: NaOH является сильной основой. Он выделяет один гидроксильный ион на одну молекулу NaOH.
Что такое слабая база
Слабое основание — это соединение, которое частично диссоциирует на гидроксильный ион, а катион создает равновесное состояние. Это называется слабым основанием, поскольку оно не может полностью диссоциировать на свой катион и гидроксильный анион. РН раствора можно использовать для приблизительной идентификации присутствия слабого основания. Значения рН выше 7 считаются слабыми основаниями.
Это называется слабым основанием, поскольку оно не может полностью диссоциировать на свой катион и гидроксильный анион. РН раствора можно использовать для приблизительной идентификации присутствия слабого основания. Значения рН выше 7 считаются слабыми основаниями.
Рисунок 2: Гидроксид аммония является слабым основанием.
Слабые основания могут создавать равновесие в водном растворе; поскольку основание частично диссоциирует на ионы, оставшиеся молекулы основания и диссоциированные ионы находятся в равновесии. При данной температуре диссоциация слабого основания дает такое же соотношение между ионами и оставшимся основанием. Эта постоянная величина называется константой равновесия, Kb. Для слабых оснований значение КБ очень низкое. Другими словами, если значение pKb очень высоко, оно имеет характеристики слабого основания. Но если значение pKb очень низкое, его можно отнести к категории сильных оснований, а не слабых оснований.
Разница между сильными и слабыми основаниями
Определение
Сильные основания: Сильное основание — это соединение, которое может полностью диссоциировать на катион и гидроксильный ион в водном растворе.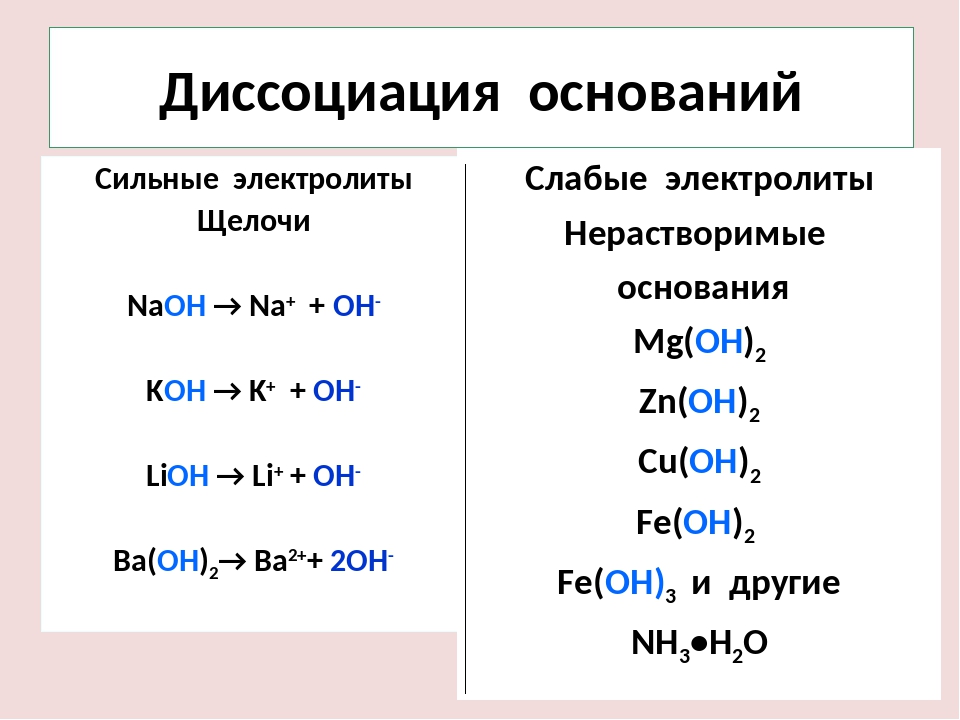
Слабые базы: Слабое основание — это соединение, которое частично диссоциирует на гидроксильный ион и катион, создавая условия равновесия.
диссоциация
Сильные основания: Сильные основания диссоциируют на ионы почти на 100%.
Слабые базы: Слабые основания частично диссоциируют на ионы.
pH
Сильные основания: Значение pH ближе к 14 указывает на сильное основание.
Слабые базы: Значение pH ближе к 7, но выше 7 указывает на слабое основание.
Реактивность
Сильные основания: Сильные основания очень реактивны.
Слабые базы: Слабые основания менее реактивны по сравнению с сильными основаниями.
ПКБ
Сильные основания: Значение pKb для сильных оснований почти равно нулю или очень низкое значение.
Слабые базы: Значение pKb для слабых оснований очень высоко.
Заключение
Сильные основания и слабые основания являются основными соединениями, которые могут высвобождать гидроксильные ионы (ОН–) в водный раствор. Хотя оба они являются базовыми, между ними есть несколько отличий. Основное различие между сильным основанием и слабым основанием состоит в том, что сильные основания могут полностью диссоциировать, чтобы дать системе все доступные гидроксильные ионы, в то время как слабые основания частично диссоциируют, давая некоторые из их гидроксильных ионов.
Рекомендации:
1. «Сильная основа: определение и примеры». Study.com,
Основания слабые — Справочник химика 21
В объемном анализе применяется также взаимодействие сильной кислоты и слабого основания. Слабыми основаниями являются аммиак, амины, анионы слабых кислот, входящие в состав солей. Анионы сильных кислот в водных растворах практически не проявляют основных свойств. Малодиссоциированные гидроксиды металлов тоже являются слабыми основаниями, но они не имеют значения в объемном анализе в силу их нерастворимости в воде. В общем виде реакция взаимодействия слабого основания (В) с сильной кислотой выглядит следующим образом [c.97]
В общем виде реакция взаимодействия слабого основания (В) с сильной кислотой выглядит следующим образом [c.97]
Слабая кислота и ее соль защищают следующим образом раствор от изменения pH при добавлении небольшого количества кислоты или основания. Если добавляется основание, слабая кислота буфера его нейтрализует, предотвращая сильное изменение pH если добавляется кислота, то она нейтрализуется основанием — анионом слабой кислоты, также не допуская сильного изменения pH. [c.459]
Кислотно-основное титрование. При титровании сильной кислоты сильным основанием получают кривую, представленную на рис. Д.134, а. При титровании сильной кислотьг слабым основанием, например гидроксидом аммония, после точки эквивалентности угол подъема прямой невелик, что связано с диссоциацией образовавшейся соли и подавлением диссоциации избытка основания (буферное действие катионов соли, В данном случае ЫН4+).
Описывать вид кривой титрования сильной кислоты сильным основанием, слабой кислоты сильным основанием или слабого основания сильной кислотой. [c.137]
Объясните, почему а) нитроуксусная кислота сильнее, чем уксусная б) анилин как основание слабее, чем метиламин в) крезол менее сильная кислота, чем фенол. [c.175]
Избыток ионов ОНз обусловливает кислую среду раствора. Этот наиболее часто встречающийся случай характерен для двух- и трехзарядных катионов (Си +, Ре , Сг ), т. е. катионов, образующих слабые основания. Очевидно, чем основание слабее, тем гидролиз протекает интенсивнее.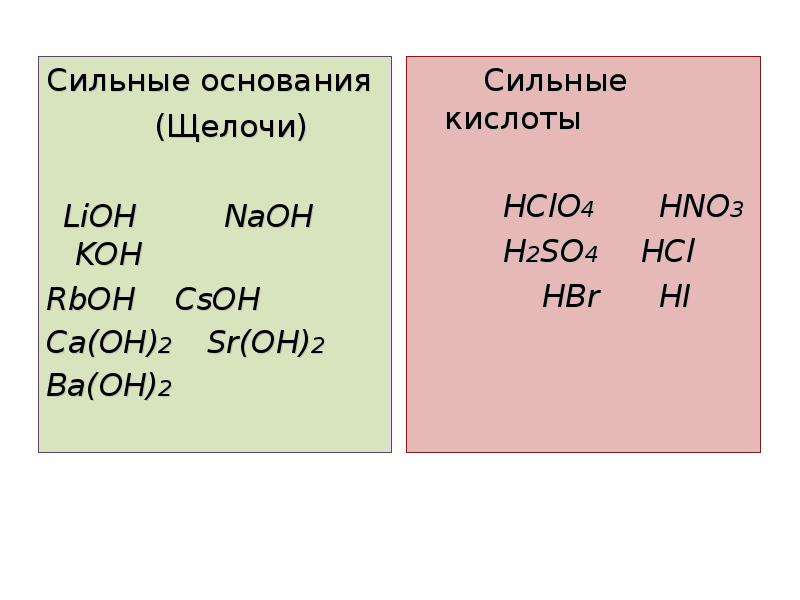
Такой процесс протекает быстро, если д нуклеофил — сопряженное основание слабой Ц кислоты (метанол), а уходящая группа- N0 [c.231]
Гидролизу подвержены соли слабых кислот и слабых оснований, слабых кислот и сильных оснований, сильных кислот и слабых оснований. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. [c.61]
Для расчета потенциала водородного электрода до и после точки эквивалентности при потенциометрическом титровании сильной кислоты сильным основанием следует пользоваться уравнениями (6) и (86), сильного основания сильной кислотой — уравнениями (86) и (6), сильной кислоты слабым основанием—(6) и (96), слабого основания сильной кислотой—(96) и (6), слабой кислоты сильным основанием—(76) и (86), сильного основания слабой кислотой—(86) и (76) и, наконец, слабой кислоты слабым основанием — уравнениями (76) и (96), а слабого основания слабой кислотой — уравнениями (96) н (76).
Как уже говорилось, нейтрализация любой сильной кислоты любым сильным основанием сопровождается одним и тем же тепловым эффектом, так как она сводится к одному и тому же процессу — образованию молекул воды из ионов водорода и гидроксид-иона. Однако при нейтрализации сильной кислоты слабым основанием, слабой кислоты сильным или слабым основанием тепловые эффекты различны. Напишем ионно-молекулярные уравнения подобных реакций. [c.246]
Олефины, как мягкие основания, слабо комплексуются с протоном (жесткой кислотой), но образуют устойчивые комплексы с мягкими кислотами (ионами Р1, Рс1, N1 и др.). [c.237]
Перечислите все различия между кривыми титрования сильным основание. слабой и сильной кислот. [c.185]
Видно, что эта величина является константой основности сопряженного основания слабой кислоты и для нее можно написать [c.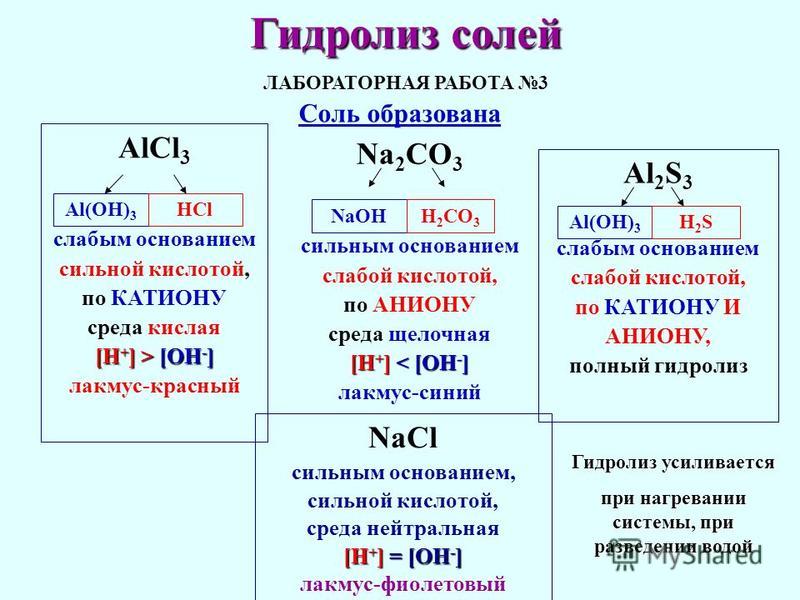 237]
237]
Составляя подобным же образом таблицу изменения потенциала водородного электрода при титровании сильных кислот слабыми основаниями, слабых кислот сильными или слабыми основаниями (и наоборот) убедимся, что скачок потенциала р зко уменьшается с понижением степени диссоциации реагирующих кислот и оснований. Это обстоятельство отражено в уравнениях (76) и (96), поскольку в них входят константы диссоциации кислот и оснований. [c.42]
Реакции, протекающие в процессе титрования слабых электролитов. При титровании в водном растворе сильной кислотой слабого основания или сильным основанием слабой кислоты pH мало изменяется вблизи точки эквивалентности (см, книга 2, гл. II, 5 и 6) кривые титрования имеют пологий характер скачок титрования у точки эквивалентности уменьшается с увеличением рА титруемого основания или кислоты.
Опыт 4. Изменение электропроводности при нейтрализации слабого основания слабой кислотой. Испытайте электропроводность 25%-ного раствора аммиака (см. опыт 2). Слейте раствор аммиака в стакан и прибавляйте к нему понемногу (осторожно ) концентрированную уксусную кислоту. Дайте раствору охладиться и снова испытайте его электропроводность. Чем объяснить большую электропроводность раствора [c.119]
Испытайте электропроводность 25%-ного раствора аммиака (см. опыт 2). Слейте раствор аммиака в стакан и прибавляйте к нему понемногу (осторожно ) концентрированную уксусную кислоту. Дайте раствору охладиться и снова испытайте его электропроводность. Чем объяснить большую электропроводность раствора [c.119]
Можно найти примеры и для реакции вытеснения сильным основанием слабого основания, например, [c.41]
В1(0Н)з белое твердое в-во основание слабый восстано- витель [c.547]
Сильное основание, слабая кислота. Реакция раствора — щелочная. В зависимости от валентности катиона и аниона могут иметь место следующие частные случаи [c.198]
Опыт 2. Определение теплоты нейтрализации слабого основания слабой кислотой. Проведите опыт, описанный выше, взяв 1 н. раств0(ры аммиака и уксусной кислоты. Вычислите теплоту нейтрализации в расчете на I эквивалент уксусной кислоты. Сравните результаты с данными предыдущего опыта. [c.21]
[c.21]
III. Слабое основание, слабая кислота. Реакция раствора и характер образующихся при гидролизе продуктов, кроме валентностей атиона и аниона, зависят [c.198]
Стойкость к набуханию в жидкостях зависит от типа полисилоксана и от содержания наполнителя. Обычные силоксановые вулканизаты, как правило, сильно набухают в неполярных жидкостях и слабо в полярных, а бензомаслостойкие (фтор- и нитрилсилоксановые)—наоборот [3, с. 154—156 33 72, с. 176]. Меньше набухают твердые (более наполненные) вулканизаты. Набухание увеличивается с повышением температуры и сопровождается ухудшением механических показателей, не всегда обратимым, так как некоторые жидкости разрушают сетку вулканизата. Примерами жидкостей, в которых обычные вулканизаты набухают на 100—275%, а бензомаслостойкие на 5—30%, являются ССЦ, хлороформ, толуол, ксилол, циклогексан, фреон-114, керосин, силиконовые масла. В ацетоне, наоборот, первые набухают на 15—25%, вторые на 150—200%. Фторсилоксановые резины разрушаются фреоном-22 и этаноламином. Оба типа вулканизатов стойки к водным растворам солей, кислот и оснований, слабо (на 5—25%) набухают в спиртах, ацетонитриле, ледяной уксусной кислоте, средне (на 40—50%) в дихлорэтане и дибутилфталате, сильно (больше 150%) в бутилацетате. [c.495]
Фторсилоксановые резины разрушаются фреоном-22 и этаноламином. Оба типа вулканизатов стойки к водным растворам солей, кислот и оснований, слабо (на 5—25%) набухают в спиртах, ацетонитриле, ледяной уксусной кислоте, средне (на 40—50%) в дихлорэтане и дибутилфталате, сильно (больше 150%) в бутилацетате. [c.495]
При титровании сильного основания слабой кислотой электропроводность после достижения минимума возрастает очень слабо, так как при избытке малодиссоциированной кислоты в растворе появляется небольшое количество свободных ионов, которое не может сильно увеличить электропроводность. Поэтому eefBb ВС располагается в этом случае почти горизонтально. Подобные же соотношения имеют место при титровании сильной кислоты слабым основанием. [c.413]
Эти азотистые основания слабо растворимы в воде, одна1Ю в составе нуклеозидов и нуклеотидов их растворимость увеличивается. Они характеризуются высокой температурой плавления >300°С. [c. 109]
109]
В качестве рабочих растворов при титровании обычно применяют растворы сильных кислот и оснований. Чаще всего необходимо определять сильные кислоты и основания, слабые кислоты и основания, а также их соли. Ошибки титрования при этом можно разделить на две группы. В одних случаях изменение окраски индикатора наблюдается при некотором избытке свободной сильной кислоты или щелочи. В других случаях в конце титрования, т. е. в момент изменения окраски индикатора, в растворе остается некоторое количество неоттитрованной слабой кислоты или ее соли (то же относится к слабым основаниям). К этой же второй группе относится титрование до кислой соли, причем иногда изменение окраски индикатора наступает только после введения некоторого избытка рабочего раствора однако в этом случае избыток NaOH или НС1 не остается свободным, а образует среднюю соль или слабую кислоту. [c.319]
Для каждого из следующих соединений укажите, является ли оно сильной кислотой, сильным основанием, слабой кислотой или слабым основанием НВг, КОН, Н3РО4, h4Nh3, NH , N, RbjO.
 [c.107]
[c.107]Слабое основание — слабая кислота AI Ss, (NHil S, Fe (СНзСОО)з и др. Да, в сильной стеиеии Близка к нейтральной -7 [c.36]
Nh5OH —основание слабое, малодиссоциирующее, НС1 — кислота сильная, распадается на ионы в высокой степени. Вследствие этого в растворе [Н 1 > [ОН 1 и pH [c.216]
С достаточной определенностью можно выделить группу лигандов, являющихся сопряженными основаниями слабых или сильных кислот. К ним относятся Н2О (ион оксония Н3О+) гидроксильный ион 0Н (Н20) N1 3 (катион аммония ЫН ) молекулы КЫХд, содержащие аминогруппу — ЫХг (катионкис- [c.614]
Слабое основание и сильная кислота при гидролизе солей
Чтобы понять, как протекает гидролиз солей в их водных растворах, для начала приведем определение данного процесса.
Определение и особенности гидролиза
Данный процесс предполагает химическое действие ионов воды с ионами соли, в результате образуется слабое основание (или кислота), а также изменяется реакция среды. Любая соль может быть представлена как продукт химического взаимодействия основания и кислоты. В зависимости от того, какова их сила, выделяют несколько вариантов протекания процесса.
Любая соль может быть представлена как продукт химического взаимодействия основания и кислоты. В зависимости от того, какова их сила, выделяют несколько вариантов протекания процесса.
Типы гидролиза
В химии рассматривается три разновидности протекания реакции между катионами соли и воды. Каждый процесс осуществляется с изменением рН среды, поэтому предполагается использование для определения водородного показателя разных видов индикаторов. Например, для кислой среды применяют фиолетовый лакмус, для щелочной реакции подойдет фенолфталеин. Проанализируем подробнее особенности каждого варианта гидролиза. Сильные и слабые основания можно определить по таблице растворимости, а силу кислот выявляем по таблице.
Гидролиз по катиону
В качестве примера такой соли рассмотри хлорид железа (2). Гидроксид железа (2) — это слабое основание, а соляная кислота является сильной. В процессе взаимодействия с водой (гидролиза) происходит образование основной соли (гидроксохлорида железа 2), а также образуется соляная кислота. В растворе появляется кислая среда, определить ее можно с помощью синего лакмуса (рН меньше 7). При этом сам гидролиз протекает по катиону, так как использовано слабое основание.
В растворе появляется кислая среда, определить ее можно с помощью синего лакмуса (рН меньше 7). При этом сам гидролиз протекает по катиону, так как использовано слабое основание.
Приведем еще один пример протекания гидролиза для описываемого случая. Рассмотрим соль хлорид магния. Гидроксид магния — это слабое основание, а соляная кислота – сильная. В процессе взаимодействия с молекулами воды хлорид магния превращается в основную соль (гидроксохлорид). Гидроксид магния, формула которого в общем виде представлена в виде М(ОН)2, малорастворим в воде, но сильная хлороводородная кислота придает раствору кислую среду.
Гидролиз по аниону
Следующий вариант гидролиза характерен для соли, которая образована сильным основанием (щелочью) и слабой кислотой. В качестве примера для данного случая рассмотрим карбонат натрия.
В данной соли есть сильное основание натрия, а также слабая угольная кислота. Взаимодействие с молекулами воды протекает с образованием кислой соли – гидрокарбоната натрия, то есть идет гидролиз по аниону. Кроме того, в растворе образуется гидроксид натрия, который придает раствору щелочную среду.
Кроме того, в растворе образуется гидроксид натрия, который придает раствору щелочную среду.
Приведем еще один пример для данного случая. Сульфит калия — это соль, которая образована сильным основанием – едким калием, а также слабой сернистой кислотой. В процессе взаимодействия с водой (при гидролизе) происходит образование гидросульфита калия (кислой соли) и гидроксида калия (щелочи). Среда в растворе будет щелочная, подтвердить ее можно с помощью фенолфталеина.
Полный гидролиз
Соль слабой кислоты и слабого основания подвергается полному гидролизу. Попробуем выяснить, в чем его особенность, и какие продукты будут образовываться в результате данной химической реакции.
Проанализируем гидролиз слабого основания и слабой кислоты на примере сульфида алюминия. Данная соль образована гидроксидом алюминия, который является слабым основанием, а также слабой сероводородной кислотой. При взаимодействии с водой наблюдается полный гидролиз, в результате которого образуется газообразный сероводород, а также в виде осадка гидроксид алюминия. Такое взаимодействие протекает и по катиону, и по аниону, поэтому такой вариант гидролиза считается полным.
Такое взаимодействие протекает и по катиону, и по аниону, поэтому такой вариант гидролиза считается полным.
Также в качестве примера взаимодействия по данному типу соли с водой можно привести сульфид магния. В составе данной соли есть гидроксид магния, формула его — Mg(OH)2. Это слабое основание, нерастворимое в воде. Кроме того, внутри сульфида магния есть сероводородная кислота, являющаяся слабой. При взаимодействии с водой происходит полный гидролиз (по катиону и аниону), в результате чего образуется в виде осадка гидроксид магния, а также в виде газа выделяется сероводород.
Если рассматривать гидролиз соли, которая образована сильной кислотой и сильным основанием, то следует отметить, что он не протекает. Среда в растворах таких солей, как хлорид натрия, нитрат калия, остается нейтральной.
Заключение
Сильные и слабые основания, кислоты, которыми образованы соли, влияют на результат гидролиза, реакцию среды в образующемся растворе. Подобные процессы широко распространены в природе.
Гидролиз имеет особое значение в химическом преобразовании земной коры. В ней содержатся сульфиды металлов, малорастворимые в воде. По мере их гидролиза происходит образование сероводорода, его выброс в процессе вулканической деятельности на поверхность земли.
Силикатные породы при переходе в гидроксиды, вызывают постепенное разрушение горных пород. Например, такой минерал как малахит, является продуктом гидролиза карбонатов меди.
Интенсивный процесс гидролиза происходит также и в Мировом океане. Гидрокарбонаты магния и кальция, которые выносятся водой, обладают слабощелочной средой. В таких условиях отлично протекает процесс фотосинтеза в морских растениях, интенсивнее развиваются морские организмы.
В нефти есть примеси воды и солей кальция и магния. В процессе нагревания нефти, происходит их взаимодействие с водяными парами. В ходе гидролиза образуется хлороводород, при взаимодействии которого с металлом, происходит разрушение оборудования.
Гидролиз в химии — что это такое? Примеры и определение
Определение гидролиза
Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н+ и ОН− ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
Например:
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты h3SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты h3CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H+ или гидроксильная группа OH− .
Запоминаем!
Важное условие гидролиза — наличие в составе соли слабого иона.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.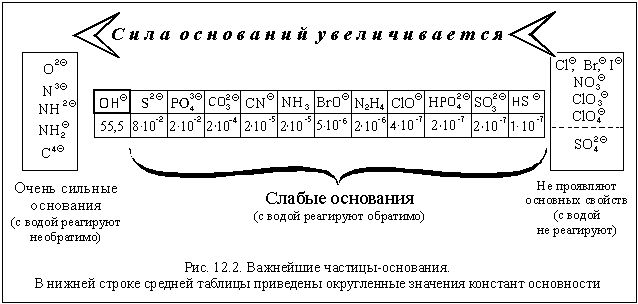
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так: XY + HOH ↔ XH + HOY В данном случае:
|
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Важно!
В учебном материале и в задачах вместо словосочетания «среда раствора» можно встретить «водородный показатель pH». По сути это одно и то же. В нейтральной среде pH = 7, в кислой среде с избытком положительно заряженных ионов водорода H+ — pH меньше 7, а в щелочной среде с избытком отрицательно заряженных ионов OH− — pH больше 7.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH−. В итоге образуется раствор с избытком ионов водорода H+.
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Пример:
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4+ связывает ионы воды OH−.
Молекулярное уравнение: NH4NO3 + H2O ↔ NH4OH + HNO3
Ионное уравнение: NH4+ + NO3− + HOH ↔ NH4OH + H+ + NO3−
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H+ в молекуле воды. В итоге получается раствор с повышенным содержанием OH−.
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Пример:
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2− связывает ионы воды H+.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K+ + NO2− + HOH ↔ HNO2 + K+ + OH−
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH− а анион кислоты связывает ионы H+
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Пример:
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4+ + CN− + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Важно!
При взаимодействии гидрофосфатов с водой среда всегда будет щелочной. Дигидрофосфаты, гидросульфиты и гидросульфаты всегда дают кислую среду, независимо от силы основания. Например, гидросульфит натрия имеет сильное основание и слабую кислоту, исходя из чего можно было бы предположить образование щелочной среды. Но ввиду особенностей диссоциации в водном растворе pH будет меньше 7 (кислая среда).
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Важно!
Определить среду водного раствора, получившегося в результате гидролиза кислых солей, бывает непросто. В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
В данном случае кроме гидролизации одновременно идет диссоциация аниона соли, и какой будет среда — зависит от преобладания того или иного процесса. Если преобладает гидролиз — среда щелочная, если диссоциация — кислая.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Al2S3+ 6H2O= 2AL(OH)3↓ + 3H2S↑
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
CaC2+ 2H2O= Ca(OH)2+ C2H2↑
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h = nгидр/nобщ.* 100% h — степень гидролиза, nгидр. — количество гидролизованного вещества, nобщ. — общее количество растворенного в воде вещества. |
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.

Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.

Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Гидролиз солей. Степень и константа гидролиза
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
hгидр = (nгидр/nобщ)·100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
K = [HA]·[MOH]/[MA]·[H2O]
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
K·[H2O]= Kг,
тогда соотношение для константы гидролиза соли Kгбудет иметь такой вид:
Kг = [HA]·[MOH]/[MA]
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Kг = С·h2/(1- h), моль/л
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Kг = С·h2
Зная, константу гидролиза, можно определить pH среды:
Kг = [HA]·[MOH]/[MA]
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH—]2/[MA]
Используя это выражение можно вычислить pH раствора
[OH—] = (Kг·[MA])1/2 моль/л
[H+] = 10-14/[OH—] моль/л
pH = -lg[H+]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
Na+ + HOH ↔ реакция практически не протекает
Cl— + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т. е. рН ˂ 7:
е. рН ˂ 7:
NH4Cl ↔ NH4+ + Cl—
NH4+ + HOH ↔ NH4OH + H+
Cl—+ HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Kг = KH2O/Kосн
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe2+ + 2Cl—
| I ступень | Fe2++ HOH ↔ (FeOH)+ + H+ FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH)+ + HOH ↔ Fe(OH)2 + H+ (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Kг1 = Kh3O/Kосн2
Kг2 = Kh3O/Kосн1
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Kг1 > Kг2
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй.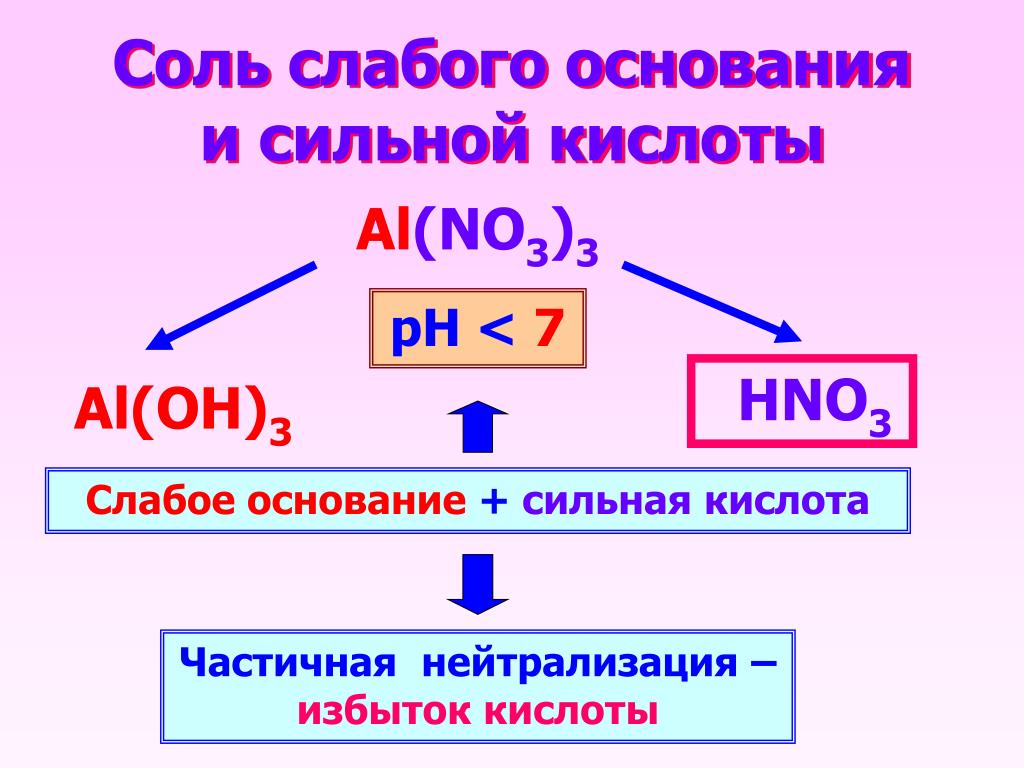 Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kгнамного больше Kосн, то среда сильнокислая, при Kгнамного меньшей Kосн — среда слабокислая, а если Kги Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na+ + CN—
CN— + HOH ↔ HCN + OH—
Na+ + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Kг = KH2O/Kк-ты
Т. е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na2SO3 ↔ 2Na+ + SO32-
| I ступень | SO32- + HOH ↔ HSO3— + OH— Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3— + HOH ↔ H2SO3 + OH— NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Kг1 = Kh3O/Kк-ты2
Kг2 = Kh3O/Kк-ты1
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kгнамного больше Kк-ты, то среда сильнощелочная, при Kгнамного меньшей Kк-ты — среда слабощелочная, а если Kги Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S↑
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Kг = KH2O/(Kк-ты·Kосн)
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al3+ + 3Cl—
Al3+ + 3HOH ↔ Al(OH)3 + 3H+
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na+ + S2-
S2- + 2HOH ↔ H2S + 2OH—
Суммарная реакция гидролиза:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.

- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
Гидроксид меди слабое или сильное основание. Сильные и слабые электролиты
Все кислоты, их свойства и основания делятся на сильные и слабые. Но не смейте путать такие понятия как «сильная кислота» или «сильное основание» с их концентрацией. Например, нельзя сделать концентрированный раствор слабой кислоты или разбавленный раствор сильного основания. Например, соляная кислота, когда растворяется в воде то отдает каждой из двух молекул воды по одному своему протону.
Например, соляная кислота, когда растворяется в воде то отдает каждой из двух молекул воды по одному своему протону.
Когда происходит химическая реакция в ионе гидроксония ион водорода очень прочно связывается с молекулой воды. Сама реакция будет происходит до тех пор, пока полностью не исчерпаются ее реагенты. Наша вода в этом случае играет роль основания, так как получает протон от соляной кислоты. Кислоты, которые диссоциируются нацело в водных растворах, называются сильными.
Когда нам известно самая начальная концентрация сильной кислоты, то в данном случае не составляет труда подсчитать какая концентрация ионов гидроксония и хлорид-ионов в растворе. Например, если вы возьмете и в 1 литр воды растворите 0,2 моля газообразной соляной кислоты, концентрация ионов после диссоциации будет точно такой же.
Примеры сильных кислот:
1) HCl — соляная кислота;
2) HBr — бромводород;
3) HI — йодоводород;
4) HNO3 — азотная кислота;
5) HClO4 — хлорная кислота;
6) h3SO4 — серная кислота.
Все известные кислоты (за исключением серной кислоты), представлены в списке выше и являются монопротоновыми, так как их атомы отдают по одному протону; молекулы серной кислоты могут с легкостью отдавать два своих протона, именно поэтому серная кислота является дипротоновой.
К сильным основаниям относятся электролиты, они полностью диссоциируются в водных растворах с образованием гидроксид-иона.
Аналогично с кислотами, вычислить концентрацию гидроксид-иона очень просто, если вы узнаете исходную концентрацию раствора. Например, раствор NaOH с концентрацией 2 моль/л диссоциирует на такую же концентрацию ионов.
Слабые кислоты. Основания и свойства
Что касается слабых кислот, то они диссоциируются не полностью, то есть частично. Различать сильные и слабые кислоты очень просто: если в справочной таблице рядом с названием кислоты показана ее константа то эта кислота является слабой; если же константа не приведена то данная кислота является сильной.
Слабые основания также хорошо реагируют с водой с образованием равновесной системы. Слабые кислоты также характеризуются константой диссоциации К.
Слабые кислоты также характеризуются константой диссоциации К.
Основания | |||||
Средней силы | |||||
Гидроксиды щелочных металлов (KOH, NaOH, ZiOH), Ba(OH) 2 и др. | Na 4 OH и нерастворимые в воде основания (Ca(OH) 2 , Zi(OH) 2 , AL(OH) 3 и др. | ||||
Константа
гидролиза равна отношению произведения
концентраций
продуктов гидролиза к
концентрации негидролизованной соли.
Пример 1. Вычислить степень гидролиза NH 4 Cl.
Решение: Из таблицы находим Кд(NH 4 ОН)=1,8∙10 -3 , отсюда
Кγ=Кв/Кд к = =10 -14 /1,8∙10 -3 = 5,56∙10 -10 .
Пример 2. Вычислить степень гидролиза ZnCl 2 по 1 ступени в 0,5 М растворе.
Решение: Ионное уравнение гидролиза Zn 2 + H 2 OZnOH + + H +
Kд ZnOH +1=1,5∙10 -9 ; hγ=√(Кв/ [Кд осн ∙Cм]) = 10 -14 /1,5∙10 -9 ∙0,5=0,36∙10 -2 (0,36%).
Пример 3. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na 2 CO 3 ; в) ZnSO 4 . Определите реакцию среды растворов этих солей.
Решение: а)
Цианид калия KCN
— соль слабой одноосновной кислоты
(см. табл. I
приложения) HCN
и сильного основания КОН. При растворении
в воде молекулы KCN
полностью диссоциируют на катионы К +
и анионы CN — .
Катионы К +
не могут связывать ионы ОН —
воды, так как КОН — сильный электролит.
Анионы же CN —
связывают ионы Н +
воды, образуя молекулы слабого элекролита
HCN. Соль гидролизуется по аниону.
Ионно-молекулярное уравнение гидролиза
Соль гидролизуется по аниону.
Ионно-молекулярное уравнение гидролиза
CN — + Н 2 О HCN + ОН —
или в молекулярной форме
KCN + Н 2 О HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН — , поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б) Карбонат натрия Na 2 CO 3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО 3 2- , связывая водородные ионы воды, образуют анионы кислой соли НСО — 3 , а не молекулы Н 2 СО 3 , так как ионы НСО — 3 диссоциируют гораздо труднее, чем молекулы Н 2 СО 3 . В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CO 2- 3 +H 2 OHCO — 3 +ОН —
или в молекулярной форме
Na 2 CO 3 + Н 2 О NaHCO 3 + NaOH
В растворе появляется избыток ионов ОН — , поэтому раствор Na 2 CO 3 имеет щелочную реакцию (рН > 7).
в)
Сульфат цинка ZnSO 4
— соль слабого многокислотного основания
Zn(OH) 2
и сильной кислоты H 2 SO 4 . В этом случае катионы Zn +
связывают гидроксильные ионы воды,
образуя катионы основной соли ZnOH + .
Образование молекул Zn(OH) 2
не происходит, так как ионы ZnOН +
диссоциируют гораздо труднее, чем
молекулы Zn(OH) 2 .
В обычных условиях гидролиз идет по
первой ступени. Соль гидролизуется по
катиону. Ионно-молекулярное уравнение
гидролиза
В этом случае катионы Zn +
связывают гидроксильные ионы воды,
образуя катионы основной соли ZnOH + .
Образование молекул Zn(OH) 2
не происходит, так как ионы ZnOН +
диссоциируют гораздо труднее, чем
молекулы Zn(OH) 2 .
В обычных условиях гидролиз идет по
первой ступени. Соль гидролизуется по
катиону. Ионно-молекулярное уравнение
гидролиза
Zn 2+ + Н 2 ОZnOН + + Н +
или в молекулярной форме
2ZnSO 4 + 2Н 2 О (ZnOH) 2 SO 4 + H 2 SO 4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO 4 имеет кислую реакцию (рН
Пример 4. Какие продукты образуются при смешивании растворов A1(NO 3) 3 и К 2 СО 3 ? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение. Соль A1(NO 3) 3 гидролизуется по катиону, а К 2 СО 3 — по аниону:
А1 3+ + Н 2 О А1ОН 2+ + Н +
СО 2- 3 + Н 2 О НСО — з + ОН —
Если
растворы этих солей находятся в одном
сосуде, то идет взаимное усиление
гидролиза каждой из них, ибо ионы Н +
и ОН — образуют
молекулу слабого электролита Н 2 О. При этом гидролитическое равновесие
сдвигается вправо и гидролиз каждой из
взятых солей идет до конца с образованием
А1(ОН) 3
и СО 2
(Н 2 СО 3).
Ионно-молекулярное уравнение:
При этом гидролитическое равновесие
сдвигается вправо и гидролиз каждой из
взятых солей идет до конца с образованием
А1(ОН) 3
и СО 2
(Н 2 СО 3).
Ионно-молекулярное уравнение:
2А1 3+ + ЗСО 2- 3 + ЗН 2 О = 2А1(ОН) 3 + ЗСО 2
молекулярное уравнение: ЗСО 2 + 6KNO 3
2A1(NO 3) 3 + ЗК 2 СО 3 + ЗН 2 О = 2А1(ОН) 3
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH) 2 . Однако существуют исключения. Так, гидроксиды Zn(OH) 2 , Be(OH) 2 , Pb(OH) 2 , Sn(OH) 2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH) 2 , Be(OH) 2 , Pb(OH) 2 , Sn(OH) 2 . Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH) 2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P 2 O 5 , SO 3 , N 2 O 5 , с образованием средних солей:
Нерастворимые основания вида Me(OH) 2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Например:
Cu(OH) 2 + CO 2 = (CuOH) 2 CO 3 + H 2 O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na образуется соль Na 3 :
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH) 2 , устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH) 2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с сильными кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH) 3, не реагируют с такими кислотами, как H 2 S, H 2 SO 3 и H 2 СO 3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO 3 , P 2 O 5 , N 2 O 5):
Амфотерные гидроксиды металлов в степени окисления +3, т. е. вида Me(OH) 3 , не реагируют с кислотными оксидами SO 2 и СO 2 .
е. вида Me(OH) 3 , не реагируют с кислотными оксидами SO 2 и СO 2 .
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду.
Гидролиз соли» — Формировать представление о химии как производительной силе общества. Уксусная кислота СН3СООН– самая древняя из органических кислот. В кислотах — группы карбоксильные, Но все кислоты здесь — несильные.
Все кислоты, их свойства и основания делятся на сильные и слабые. Например, нельзя сделать концентрированный раствор слабой кислоты или разбавленный раствор сильного основания. Наша вода в этом случае играет роль основания, так как получает протон от соляной кислоты. Кислоты, которые диссоциируются нацело в водных растворах, называются сильными.
Например, нельзя сделать концентрированный раствор слабой кислоты или разбавленный раствор сильного основания. Наша вода в этом случае играет роль основания, так как получает протон от соляной кислоты. Кислоты, которые диссоциируются нацело в водных растворах, называются сильными.
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3 n h3O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется.
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Все основания являются твердыми веществами, имеющими различную окраску. Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При обжиге содержащих мышьяк кобальтовых минералов выделяется летучий ядовитый оксид мышьяка.
Такие свойства молекулы воды вам уже известны. II) и раствором уксусной кислоты. HNO2) — только один протон.
HNO2) — только один протон.
Все основания – твёрдые вещества, которые имеют различную окраску. 1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
Охладите емкости, например, поместив их в сосуд со льдом. Три раствора останутся прозрачными, а четвертый быстро помутнеет, начнет выпадать белый осадок. Вот в нем-то и находится соль бария. Отложите эту емкость в сторону. Можно быстро определить углекислый барий и другим способом. Это довольно просто сделать, вам понадобятся фарфоровые чашки для выпаривания и спиртовка. Если это соль лития – цвет будет ярко-красным. Кстати, если бы таким же образом испытали соль бария – цвет пламени должен был быть зеленым.
Электролит – вещество, которое в твердом состоянии является диэлектриком, то есть не проводит электрического тока, однако, в растворенном или расплавленном виде становится проводником. Запомните, что степень диссоциации и, соответственно, сила электролита находятся в зависимости от многих факторов: природы самого электролита, растворителя, температуры. Поэтому само это разделение в известной степени условно. Ведь одно и то же вещество может при различных условиях быть и сильным электролитом, и слабым.
Запомните, что степень диссоциации и, соответственно, сила электролита находятся в зависимости от многих факторов: природы самого электролита, растворителя, температуры. Поэтому само это разделение в известной степени условно. Ведь одно и то же вещество может при различных условиях быть и сильным электролитом, и слабым.
Гидролиз не идет, новых соединений не образуется, кислотность среды не изменяется. Как меняется кислотность среды? Уравнения реакций можно пока не записывать. Нам осталось последовательно обсудить 4 группы солей и для каждой из них привести специфический «сценарий» гидролиза. В следующей части мы начнем с солей, образованных слабым основанием и сильной кислотой.
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. H раствора, какими общими свойствами обладают кислоты и основания. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса.
Чем этот показатель ниже, тем сильнее кислота. Сильная или слабая — это нужно в справочнике к.-н. смотреть, но классику нужно знать. Сильные — это такие кислоты, которые могут вытеснить из соли анион другой кислоты.
Сильная или слабая — это нужно в справочнике к.-н. смотреть, но классику нужно знать. Сильные — это такие кислоты, которые могут вытеснить из соли анион другой кислоты.
Мы дали определение гидролиза , вспомнили некоторые факты о солях . Сейчас мы обсудим сильные и слабые кислоты и выясним, что «сценарий» гидролиза зависит именно от того, какой кислотой и каким основанием образована данная соль.
← Гидролиз солей. Часть I
Сильные и слабые электролитыНапомню, что все кислоты и основания можно условно разделить на сильные и слабые . Сильные кислоты (и, вообще, сильные электролиты) в водном растворе диссоциируют практически полностью. Слабые электролиты распадаются на ионы в незначительной степени.
К сильным кислотам относятся:
- H 2 SO 4 (серная кислота),
- HClO 4 (хлорная кислота),
- HClO 3 (хлорноватая кислота),
- HNO 3 (азотная кислота),
- HCl (соляная кислота),
- HBr (бромоводородная кислота),
- HI (иодоводородная кислота).

Ниже приведен список слабых кислот:
- H 2 SO 3 (сернистая кислота),
- H 2 CO 3 (угольная кислота),
- H 2 SiO 3 (кремниевая кислота),
- H 3 PO 3 (фосфористая кислота),
- H 3 PO 4 (ортофосфорная кислота),
- HClO 2 (хлористая кислота),
- HClO (хлорноватистая кислота),
- HNO 2 (азотистая кислота),
- HF (фтороводородная кислота),
- H 2 S (сероводородная кислота),
- большинство органических кислот, напр., уксусная (CH 3 COOH).
Естественно, невозможно перечислить все существующие в природе кислоты. Приведены лишь наиболее «популярные». Следует также понимать, что разделение кислот на сильные и слабые является достаточно условным.
Существенно проще обстоят дела с сильными и слабыми основаниями. Можно воспользоваться таблицей растворимости . К сильным основаниям относятся все растворимые в воде основания, кроме NH 4 OH. Эти вещества называют щелочами (NaOH, KOH, Ca(OH) 2 и т. д.)
Слабые основания — это:
- все нерастворимые в воде гидроксиды (напр.
 , Fe(OH) 3 , Cu(OH) 2 и т. д.),
, Fe(OH) 3 , Cu(OH) 2 и т. д.), - NH 4 OH (гидроксид аммония).
Читающим эту статью может показаться, что мы уже забыли об основной теме разговора, и ушли куда-то в сторону. Это не так! Наша беседа о кислотах и основаниях, о сильных и слабых электролитах имеет прямое отношение к гидролизу солей . Сейчас вы в этом убедитесь.
Итак, позвольте изложить вам основные факты:
- Не все соли подвергаются гидролизу. Существуют гидролитически устойчивые соединения, например, хлорид натрия.
- Гидролиз солей может быть полным (необратимым) и частичным (обратимым).
- В ходе реакции гидролиза происходит образование кислоты или основания, изменяется кислотность среды.
- Принципиальная возможность гидролиза, направление соответствующей реакции, ее обратимость или необратимость определяются силой кислоты и силой основания , которыми образована данная соль.
- В зависимости от силы соответствующей кислоты и соотв.
 основания, все соли можно условно разделить на 4 группы . Для каждой из этих групп характерен свой «сценарий» гидролиза.
основания, все соли можно условно разделить на 4 группы . Для каждой из этих групп характерен свой «сценарий» гидролиза.
Пример 4 . Соль NaNO 3 образована сильной кислотой (HNO 3) и сильным основанием (NaOH). Гидролиз не идет, новых соединений не образуется, кислотность среды не изменяется.
Пример 5 . Соль NiSO 4 образована сильной кислотой (H 2 SO 4) и слабым основанием (Ni(OH) 2). Идет гидролиз по катиону, в ходе реакции образуются кислота и основная соль.
Пример 6 . Карбонат калия образован слабой кислотой (H 2 CO 3) и сильным основанием (KOH). Гидролиз по аниону, образование щелочи и кислой соли. Щелочная среда раствора.
Пример 7 . Сульфид алюминия образован слабой кислотой (H 2 S) и слабым основанием (Al(OH) 3). Идет гидролиз как по катиону, так и по аниону. Необратимая реакция. В ходе процесса образуются H 2 S и гидроксид алюминия. Кислотность среды меняется в незначительной степени.
Попробуйте самостоятельно:
Упражнение 2 . К какому типу относятся следующие соли: FeCl 3 , Na 3 PO 3 , KBr, NH 4 NO 2 ? Подвергаются ли эти соли гидролизу? По катиону или по аниону? Что образуется в ходе реакции? Как меняется кислотность среды? Уравнения реакций можно пока не записывать.
К какому типу относятся следующие соли: FeCl 3 , Na 3 PO 3 , KBr, NH 4 NO 2 ? Подвергаются ли эти соли гидролизу? По катиону или по аниону? Что образуется в ходе реакции? Как меняется кислотность среды? Уравнения реакций можно пока не записывать.
Нам осталось последовательно обсудить 4 группы солей и для каждой из них привести специфический «сценарий» гидролиза. В следующей части мы начнем с солей, образованных слабым основанием и сильной кислотой.
Советы по определению кислотной и щелочной прочности — Концепция
Вот несколько советов и приемов, которые помогут определить, является ли кислота или основание сильной или слабой, а также кислотой или основанием. Здесь у нас есть список, так что у меня есть сильные кислоты.
Сильные кислоты легче запомнить, их всего шесть. Первые 3, которые я собираюсь записать, — это HCL; Соляная кислота, HBr; Бромистоводородная кислота и HI; Йодоводородная кислота. Теперь, если вы заметили, что n-ионы здесь — это Cl, Br и I, значит, все они галогены из группы 7a. Если у меня есть передний водород и галоген, и он водный, то у нас есть сильная кислота. Помните, сильный означает, что он полностью диссоциирует, поэтому он диссоциирует на ионы H +, а затем на ионы n, так что в данном случае; Cl-, Br- и I-.
Если у меня есть передний водород и галоген, и он водный, то у нас есть сильная кислота. Помните, сильный означает, что он полностью диссоциирует, поэтому он диссоциирует на ионы H +, а затем на ионы n, так что в данном случае; Cl-, Br- и I-.
Включены все галогены, кроме ВЧ, поэтому не ВЧ. HF на самом деле является слабой кислотой, поэтому просто Cl, Br и I, потому что у них много электронов. Они не так электроотрицательны, как фтор. Фтор — это особый случай. В любом случае остальные 3; HNO3 Азотная кислота, h3SO4 Серная кислота, полностью диссоциирует только первый протон, а затем HClO4 Хлорная кислота.Итак, HNO3, h3SO4, HClO4 и т. Д. Эти 3 также являются сильными кислотами.
Иногда периодическая кислота HIO4 считается сильной, но не всегда. Затем нужно добавить еще один: Hydronium иногда считают сильной кислотой. Это ваши 7, которые вы бы знали, и самый простой способ их идентифицировать — это запомнить. Если вы запомните сильные кислоты, это упростит задачу.
Теперь перейдем к сильной базе. Все сильные основания, если вы заметили LiOH. У нас есть гидроксид натрия NaOH, гидроксид калия KOH, гидроксид рубидия RbOH, а затем CsOH.Обратите внимание, из какой группы происходит катион, это все катионы группы 1A. Кроме того, все они содержат гидроксид, потому что сильные основания содержат гидроксид. Все катионы группы 1A, катионы металлов плюс гидроксид — все это сильные основания. Затем, переходя к группе 2А, если мы спустимся вниз по списку гидроксид кальция, гидроксид стронция и гидроксид бария. Катионы этой группы 2A с гидроксидом считаются сильными основаниями, они имеют ограниченную растворимость.
Все сильные основания, если вы заметили LiOH. У нас есть гидроксид натрия NaOH, гидроксид калия KOH, гидроксид рубидия RbOH, а затем CsOH.Обратите внимание, из какой группы происходит катион, это все катионы группы 1A. Кроме того, все они содержат гидроксид, потому что сильные основания содержат гидроксид. Все катионы группы 1A, катионы металлов плюс гидроксид — все это сильные основания. Затем, переходя к группе 2А, если мы спустимся вниз по списку гидроксид кальция, гидроксид стронция и гидроксид бария. Катионы этой группы 2A с гидроксидом считаются сильными основаниями, они имеют ограниченную растворимость.
Бериллий и магний, которые являются первыми двумя элементами в группе 2А, не являются сильными основаниями, поэтому не учитываются.Вот только эти 8, так что вы снова запоминаете их, а затем сидите прямо там. Это сильные основания, катионы группы 1A образца плюс гидроксид или катионы группы 2A плюс гидроксид, но здесь перечислены только эти три.
Теперь перейдем к слабым кислотам. Когда у вас слабая кислота, у вас есть практически любая кислота с формулой, и обычно вы обычно видите их с буквой H впереди. Итак, начнем с H в формуле, так что это водород, потому что именно там передается водород, H +.Вы можете увидеть это как, например, в HF, или в HC2h402, уксусной кислоте. У вас впереди буква H, и это не одна из тех сильных кислот. Давайте посмотрим, у вас обычно есть H плюс у вас есть n ion. Вот водород, фтор, водород и ацетат-ион.
Когда у вас слабая кислота, у вас есть практически любая кислота с формулой, и обычно вы обычно видите их с буквой H впереди. Итак, начнем с H в формуле, так что это водород, потому что именно там передается водород, H +.Вы можете увидеть это как, например, в HF, или в HC2h402, уксусной кислоте. У вас впереди буква H, и это не одна из тех сильных кислот. Давайте посмотрим, у вас обычно есть H плюс у вас есть n ion. Вот водород, фтор, водород и ацетат-ион.
Или другой вариант, если он заканчивается на COOH. Как Ch4COOH, и это также уксусная кислота, и обратите внимание, как это протон или H +, который отдается, когда кислоты отдают свой протон. Вот так бы и было.Слабые кислоты обычно имеют водород впереди или COOH, и последний водород — это тот, который передается в дар.
Кроме того, у нас есть слабые основы, это последний вариант, который мы собираемся рассмотреть. Слабые базы — это в основном любые базы с вашей аминогруппой. Возможно, вы видели слово «аминокислота» как «аминокислота», как на уроке биологии. Амино-группа — это что-то вроде Nh3 или имеет некоторые вариации. Вариация может быть похожа на N или NH, значит, они у нас есть. Примеры слабых оснований — это метиламин N2h5 или Ch4Nh3.Здесь есть водороды, но, если вы заметили, есть некоторая вариация аминогруппы с азотом.
Амино-группа — это что-то вроде Nh3 или имеет некоторые вариации. Вариация может быть похожа на N или NH, значит, они у нас есть. Примеры слабых оснований — это метиламин N2h5 или Ch4Nh3.Здесь есть водороды, но, если вы заметили, есть некоторая вариация аминогруппы с азотом.
У вас есть слабые основания, и, как правило, помните, что они принимают протоны, поэтому они могут принимать H +. Подводя итог сильным кислотам и сильным основаниям; сильные кислоты — это только эти 6 или 7 здесь, которые перечислены. Сильными основаниями являются только те 8, которые перечислены из катионов группы 1A и группы 2A плюс гидроксид. Если вы запомните те слабые кислоты и слабые основания, их довольно легко идентифицировать.У слабых кислот есть H в начале или на конце COOH, а у слабых оснований есть аминогруппа, обычно что-то с азотом.
Имейте в виду, что не все является кислотой или щелочью. Некоторые вещи представляют собой просто старые ионные соединения, поэтому убедитесь, что если вы посмотрите на них, они соблюдают эти правила. Надеюсь, эти уловки помогут вам определить, является ли кислота или основание сильной или слабой, и немного больше помогут вам в химии кислотных оснований. Всего хорошего.
Надеюсь, эти уловки помогут вам определить, является ли кислота или основание сильной или слабой, и немного больше помогут вам в химии кислотных оснований. Всего хорошего.
Сильные и слабые кислоты и основания
Добавление пищевой соды в уксус вызывает образование пузырьков и пенообразование.Это реакция между кислотой и основанием. Но что делает кислоту и основание сильными или слабыми? Давайте взглянем.
Согласно определениям Бренстеда-Лоури, кислоты и основания характеризуются обменом ионов водорода. Кислоты — это молекулы, которые отдают один ион водорода в растворе, а основания — один ион водорода.
Сильные кислоты и основания полностью ионизируются в водном растворе. Слабые кислоты и основания также ионизируются, но только частично, и реакция обратима. Итак, как мы узнаем, сильная или слабая кислота или основание? Простой способ определить силу — добавить кислоту или основание к воде — высокая реакционная способность означает более сильную кислоту или основание. Эта реактивность измеряется величиной, называемой значением \ (K_a \) или \ (K_b \). Он говорит нам, насколько реакционноспособна кислота или основание, в зависимости от того, сколько ионов гидроксония или гидроксида образуется во время реакции.
Эта реактивность измеряется величиной, называемой значением \ (K_a \) или \ (K_b \). Он говорит нам, насколько реакционноспособна кислота или основание, в зависимости от того, сколько ионов гидроксония или гидроксида образуется во время реакции.
Другой способ определить силу кислоты или основания — это энергия связи. Для кислот, когда энергия связи мала, связь молекулы кислоты легко разрывается, и иону водорода требуется меньше энергии для диссоциации. Следовательно, сильная кислота будет иметь низкую энергию связи. Точно так же основная молекула с сильной связью между гидроксид-ионом и положительным ионом будет слабым основанием, в то время как сильное основание будет иметь низкую энергию связи.
Электроотрицательность также может определять силу кислоты или основания. Электроотрицательность — это мера того, насколько хорошо атом или молекула разделяют электрон. Когда молекула имеет высокую электроотрицательность, это сильная кислота. Однако сильные основания имеют меньшую электроотрицательность.
Другой способ определения силы — это измерение стабильности основания конъюгата кислоты , которое является частью молекулы, оставшейся после диссоциации. Более стабильное основание конъюгата означает, что кислота будет сильнее — молекула более стабильна без иона водорода и, следовательно, с большей вероятностью высвобождает его.
Теперь, когда мы рассмотрели свойства, которые делают сильные кислоты и основания, давайте рассмотрим некоторые общие примеры, с которыми вы, вероятно, знакомы. Аккумуляторная кислота — это сильная кислота. Он сильно реагирует, «разъедая» материалы, к которым прикасается. Это одна из причин, по которой мы не разрезаем аккумуляторные батареи. Если бы мы это сделали, на наши руки попала бы аккумуляторная кислота, кислота начала бы реагировать, и наша кожа начала бы растворяться! Отбеливатель и щелочь — примеры сильных оснований. Они также могут повредить нашу кожу, поэтому воду добавляют в отбеливатель или щелок, прежде чем использовать их для очистки.
Нас окружают примеры слабых кислот и слабых оснований! За столом для завтрака кофе и апельсиновый сок являются примерами слабых кислот. Также на кухне есть образец слабого основания: пищевая сода! Мы можем добавить пищевую соду в слабую кислоту, белый уксус, чтобы увидеть бурную реакцию!
Мы надеемся, что вы почувствуете себя подготовленными и воодушевленными этим обзором кислот и оснований, спасибо за просмотр!
СИЛЬНЫЕ И СЛАБЫЕ ОСНОВЫ На этой странице объясняются термины «сильный» и «слабый» применительно к базам.В рамках этого он определяет и объясняет K b и pK b . Мы собираемся использовать определение основания Бренстеда-Лоури как вещества, которое принимает ионы водорода (протоны). | ||||||||||||||||
Примечание: Если вы не знаете, что такое теория Бренстеда-Лоури, вам следует прочитать о теориях кислот и оснований на другой странице в этом разделе.  Вам не нужно тратить время на чтение кислот и оснований Льюиса для целей данной страницы. Вам не нужно тратить время на чтение кислот и оснований Льюиса для целей данной страницы. Используйте кнопку НАЗАД в браузере, когда будете готовы вернуться на эту страницу. | ||||||||||||||||
Обычный способ сравнения силы оснований — посмотреть, насколько легко они производят гидроксид-ионы в растворе. Это может быть связано с тем, что они уже содержат ионы гидроксида, или потому, что они отбирают ионы водорода от молекул воды для образования ионов гидроксида. Прочные основания Объяснение термина «сильная база» Сильное основание — это полностью ионный гидроксид натрия или гидроксид калия.Вы можете думать о соединении как о 100% расщепленном на ионы металлов и гидроксид-ионы в растворе. Каждый моль гидроксида натрия растворяется с образованием одного моля гидроксид-ионов в растворе. Некоторые сильные основания, такие как гидроксид кальция, плохо растворяются в воде. Определение pH сильного основания Помните, что: Поскольку pH является мерой концентрации ионов водорода, как раствор, содержащий ионы гидроксида, может иметь pH? Чтобы понять это, нужно знать об ионном продукте для воды. | ||||||||||||||||
Важно: Если вы не понимаете, что такое ионный продукт для воды, вы должны перейти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, когда будете готовы вернуться на эту страницу. | ||||||||||||||||
Везде, где есть вода, устанавливается равновесие. Используя упрощенную версию этого равновесия: В присутствии дополнительных гидроксид-ионов, скажем, гидроксида натрия, равновесие все еще существует, но положение равновесия сдвинуто влево согласно принципу Ле Шателье. | ||||||||||||||||
Примечание: Если вы не понимаете принцип Ле Шателье, вам следует перейти по этой ссылке, прежде чем продолжить. Убедитесь, что вы понимаете влияние концентрации на положение равновесия. Используйте кнопку НАЗАД в браузере, когда будете готовы вернуться на эту страницу. | ||||||||||||||||
Ионов водорода будет гораздо меньше, чем в чистой воде, но ионы водорода все равно будут.PH является мерой их концентрации. Схема метода определения pH сильного основания
Пример Чтобы найти pH 0.500 моль дм -3 раствор гидроксида натрия: Поскольку гидроксид натрия полностью ионный, каждый его моль дает такое же количество молей гидроксид-ионов в растворе. [OH — ] = 0,500 моль дм -3 | ||||||||||||||||
Примечание: Вы должны быть осторожны здесь, если у вас есть основание, такое как гидроксид кальция, Ca (OH) 2 . Каждый моль гидроксида кальция производит в растворе вдвое больше гидроксид-ионов. | ||||||||||||||||
Теперь вы используете значение K w для температуры вашего раствора. Обычно вы принимаете это как 1,00 x 10 -14 моль 2 дм -6 . [H + ] [OH — ] = 1,00 x 10 -14 Это верно независимо от того, чистая вода или нет. В этом случае у нас есть значение для концентрации гидроксид-иона. Подставляя, получаем: [H + ] x 0.500 = 1,00 x 10 -14 Если вы решите это для [H + ], а затем преобразуете его в pH, вы получите pH 13,7. | ||||||||||||||||
Примечание: Если вы хотите увидеть больше примеров и попробовать себя (с приведенными полностью отработанными решениями), вас может заинтересовать моя книга расчетов по химии.  Это также включает обратную проблему, которая немного более запутана — определение концентрации сильного основания по его pH. Это также включает обратную проблему, которая немного более запутана — определение концентрации сильного основания по его pH. | ||||||||||||||||
Слабые основания Объяснение термина «слабая база» Аммиак — типичное слабое основание.Сам по себе аммиак, очевидно, не содержит гидроксид-ионов, но он реагирует с водой с образованием ионов аммония и гидроксид-ионов. Однако реакция обратима, и в любой момент около 99% аммиака все еще присутствует в виде молекул аммиака. Только около 1% фактически произвел ионы гидроксида. Слабое основание — это основание, которое не полностью превращается в гидроксид-ионы в растворе. | ||||||||||||||||
Важно: То, что следует ниже, не требуется ни в одной из текущих программ британского уровня A ‘. | ||||||||||||||||
Сравнение сильных сторон слабых оснований в растворе: K b Когда слабое основание реагирует с водой, положение равновесия меняется от основания к основанию. Вы можете измерить положение равновесия, написав константу равновесия для реакции. Чем ниже значение константы, тем левее положение равновесия. В этом случае константа равновесия обозначается K b . Это определяется как: | ||||||||||||||||
Примечание: Если вы хотите узнать, почему вода не указана в нижней части этого выражения, вы найдете объяснение на странице о сильных и слабых кислотах с соответствующей константой, K a . Используйте кнопку НАЗАД в браузере, когда будете готовы вернуться на эту страницу. | ||||||||||||||||
pK b Связь между K b и pK b такая же, как и между всеми другими терминами «p» в этой теме: В таблице приведены некоторые значения для K b и pK b для некоторых слабых оснований.
По мере того, как вы спускаетесь по таблице, значение K b увеличивается. Значит, укрепляются базы. Чем больше K b , тем меньше pK b . Чем ниже значение pK b , тем прочнее основание. Это в точности соответствует соответствующему термину для кислот, pK a — чем меньше значение, тем сильнее кислота. | ||||||||||||||||
Примечание: Если вы заинтересованы в дальнейшем изучении органических оснований, вы найдете их объяснения в другом месте на сайте. | ||||||||||||||||
Перейти в меню кислотно-щелочного равновесия. . . В меню «Физическая химия». . . В главное меню. . . © Джим Кларк, 2002 г. (изменено в ноябре 2013 г.) | ||||||||||||||||
Кислотно-основные пары, сила кислот и оснований и pH
Кислотно-основные пары, Сила кислот и оснований и pH
Кислотно-щелочной конъюгат Пары
Кислоты и основания существуют как сопряженных кислотно-основных пар . В
термин конъюгат происходит от латинского корня, означающего
«соединены вместе» и относятся к тому, что соединено,
особенно парами, такими как кислоты и основания Бренстеда.
В
термин конъюгат происходит от латинского корня, означающего
«соединены вместе» и относятся к тому, что соединено,
особенно парами, такими как кислоты и основания Бренстеда.
Каждый раз, когда кислота Бренстеда действует как H + -ион донор, он образует сопряженное основание. Представьте себе обычную кислоту, HA. Когда эта кислота отдает воде ион H + , один продукт реакции представляет собой ион A —, который является ионом водорода акцептор, или основание Бренстеда.
| HA | + | H 2 O | H 3 O + | + | А — | |
| кислота | база |
И наоборот, каждый раз, когда база
приобретает ион H + , продукт представляет собой кислоту Бренстеда, HA.
| А — | + | H 2 O | HA | + | ОН — | |
| основание | кислота |
Кислоты и основания в модели Брнстеда поэтому существуют как сопряженные пары, формулы которых связаны соотношением приобретение или потеря иона водорода.
Мы используем символы HA и A — для сопряженной пары кислота-основание не означает, что все кислоты
нейтральные молекулы или что все основания являются отрицательными ионами. Это
означает только, что кислота содержит ион H + , который
нет в сопряженной базе. Кислоты или основания Бренстеда могут
быть нейтральными молекулами, положительными ионами или отрицательными ионами. Разные
Кислоты Бренстеда и их сопряженные основания приведены в таблице.
ниже.
Разные
Кислоты Бренстеда и их сопряженные основания приведены в таблице.
ниже.
Типичный Брнстед Кислоты и их сопряженные основания
| Кислота | База | ||
| H 3 O + | H 2 O | ||
| H 2 O | ОН — | ||
| ОН — | O 2- | ||
| HCl | Класс | Класс — | |
| H 2 SO 4 | HSO 4 — | ||
| HSO 4 — | СО 4 2- | ||
| NH 4 + | NH 3 | ||
| NH 3 | NH 2 — |
Соединение может быть как кислотой Бренстеда
и база Брнстеда. H 2 O, OH —, HSO 4 —,
и NH 3 , например, можно найти в обоих столбцах в
таблица выше. Вода — прекрасный пример такого поведения
потому что он одновременно действует как кислота и основание, когда он
образует ионы H 3 O + и OH —.
H 2 O, OH —, HSO 4 —,
и NH 3 , например, можно найти в обоих столбцах в
таблица выше. Вода — прекрасный пример такого поведения
потому что он одновременно действует как кислота и основание, когда он
образует ионы H 3 O + и OH —.
Сильный и слабые кислоты и основания
Многие хозяйственные магазины продают «муриатик».
кислота»
6 M раствор соляной кислоты HCl ( водн. ) в
чистые кирпичи и бетон.В продуктовых магазинах продается уксус, который
a 1 M раствор уксусной кислоты: CH 3 CO 2 H.
Хотя оба вещества являются кислотами, соляную кислоту использовать нельзя.
кислота в заправке для салатов, а уксус неэффективен для очистки
кирпичи или бетон.
Разница между ними в том, что соляная кислота — сильная кислота , а уксус — слабая Кислота . Соляная кислота сильна, потому что она очень хорошо перенос иона H + на молекулу воды.В 6 M раствор соляной кислоты, 99,996% молекул HCl вступают в реакцию с водой для образования H 3 O + и Cl — ионы.
HCl ( водн., ) + H 2 O ( л ) H 3 O + ( водн. ) + Cl — ( водн. )
Уксус — слабая кислота, потому что он не очень хорошо переносит ионы H + в воду. В растворе 1 M меньше 0.4% от CH 3 CO 2 H молекулы реагируют с водой с образованием H 3 O + и CH 3 CO 2 — ионов.
CH 3 CO 2 H ( водн.
) + H 2 O ( л ) H 3 O + ( водн. ) + CH 3 CO 2 — ( водн. )
Более 99,6% молекул уксусной кислоты остаются нетронутыми.
В Константа равновесия диссоциации кислоты, K a
Относительная сила кислот часто описывается в терминах кислотной диссоциации константа равновесия , K a . К понять природу этой константы равновесия, давайте предположим что реакция между кислотой и водой может быть представлена как следующее общее уравнение.
| HA ( водн. ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + А — ( водн. ) ) |
Другими словами, некоторые из HA молекулы реагируют с образованием H 3 O + и A — ионы, как показано на рисунке ниже.
По соглашению концентрации этих ионов в молях на литр равны представлены символами [H 3 O + ] и [A — ]. Концентрация молекул ГК, которые остаются в растворе, составляет представлен символом [HA].
Значение K a для кислоты рассчитывается по следующему уравнению.
Когда сильная кислота растворяется в
вода, кислота активно реагирует с водой с образованием H 3 O + и ионов A — .(Только небольшая остаточная концентрация
молекулы ГК остаются в растворе).
концентрации H 3 O + и A — следовательно, намного больше, чем концентрация HA
молекул, поэтому K a для сильной кислоты
более 1.
Пример: соляная кислота имеет a K a примерно 1 x 10 6 .
Слабые кислоты, напротив, незначительно реагирует с водой.Произведение концентраций ионов H 3 O + и A — составляет поэтому меньше, чем концентрация остаточной ГК молекулы. В результате K a для слабого кислота меньше 1.
Пример: уксусная кислота имеет K a всего 1,8 x 10 -5 .
K a банка поэтому может использоваться для различения сильных кислот и слабых кислоты.
| Сильные кислоты: | К а > 1 | |
| Слабые кислоты: | К а <1 |
В Относительные силы конъюгированных кислотно-основных пар
- Сильные кислоты имеют слабое сопряженное основание.

Пример: HCl — сильная кислота. Если HCl — сильная кислота, она должна быть хорошим донором протонов. HCl может быть хорошим донором протонов, однако, если ион Cl — является плохим акцептором протонов. Таким образом, ион Cl — должен быть слабая база.
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + | Cl — ( водн. ) | ||
| Сильный кислота | слабое база |
- Прочные основания имеют слабую сопряженную кислоту .

Пример. Рассмотрим соотношение между концентрацией аммония (NH 4 + ) и его сопряженное основание, аммиак (NH 3 ). NH 4 + ион — слабая кислота, потому что аммиак — достаточно хорошее основание.
| NH 4 + ( водн. ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + | NH 3 ( водн. ) | |
| Слабая кислота | Хорошо база |
| Практическая задача 3: Используйте кислотную диссоциацию
константы равновесия сопряженных кислот этих
оснований для прогнозирования наличия CH 3 CO 2 — ион или ион OH — является более сильным основанием.
Нажмите здесь, чтобы проверить свой ответ на практическую задачу 3 |
Сравнение Относительная сила пар кислот и оснований
Значение K a для кислоты можно использовать, чтобы решить, сильная ли это кислота или
слабая кислота в абсолютном смысле.Его также можно использовать для
сравните относительную силу пары кислот.
Пример: рассмотрим HCl и H 3 O + ион.
| HCl | К а = 1 х 10 6 | |
| H 3 O + | К а = 55 |
Эти K a значения показывают, что оба являются сильными кислотами, но HCl более сильная кислоты, чем ион H 3 O + .
Высокая доля HCl молекулы в водном растворе реагируют с водой с образованием H 3 O + и ионы Cl — . Теория Брнстеда предполагает, что каждый кислотно-основная реакция превращает кислоту в сопряженное основание и основание в его сопряженную кислоту.
Есть две кислоты и две
оснований в этой реакции. Однако более сильная кислота находится на
левая часть уравнения.
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + Cl — ( водн. ) | ||
| сильнее кислота | слабее кислота |
Общие правила предполагают, что
более сильная из пары кислот должна образовывать более слабую из пары
сопряженные основания. Тот факт, что HCl является более сильной кислотой, чем H 3 O + ион означает, что ион Cl — является более слабым основанием, чем
вода.
Тот факт, что HCl является более сильной кислотой, чем H 3 O + ион означает, что ион Cl — является более слабым основанием, чем
вода.
| Кислотная сила: | HCl> H 3 O + | |
| Базовая прочность: | Класс — |
Таким образом, уравнение для реакцию HCl с водой можно записать следующим образом.
| HCl ( г ) | + | H 2 O ( л ) | H 3 O + ( водн. ) ) | + | Cl — ( водн. ) | ||
| сильнее кислота | сильнее база | слабее кислота | слабее база |
Неудивительно, что 99.996% молекул HCl в растворе 6 M реагируют с вода с образованием ионов H 3 O + и Cl — ионы. Более сильная из пары кислот должна реагировать с более сильная пара оснований с образованием более слабой кислоты и более слабой база.
Давайте посмотрим на относительную концентрации уксусной кислоты и иона H 3 O + .
| CH 3 CO 2 H | К а = 1. 8 х 10 -5 8 х 10 -5 | |
| H 3 O + | К а = 55 |
Значения K a для этих кислот предполагают, что уксусная кислота является гораздо более слабой кислотой чем ион H 3 O + , что объясняет, почему уксусная кислота — это слабая кислота в воде. И снова реакция между кислотой и водой должно превратить кислоту в ее конъюгировать основание и основание в его конъюгат с кислотой.
Но на этот раз сильнее кислота и более сильное основание находятся в правой части уравнения.
| CH 3 CO 2 H ( водн. ) | + | H 2 O ( л ) | H 3 O + ( водн. ) ) | + | CH 3 CO 2 — ( водн. ) | |
| слабее кислота | слабее база | сильнее кислота | сильнее база |
В результате только некоторые из CH 3 CO 2 H молекулы фактически отдают ион H + воде молекула с образованием H 3 O + и CH 3 CO 2 — ионы.
Величина K a также можно использовать для объяснения того, почему некоторые соединения, которые квалифицируются как
Кислоты или основания Бренстеда не действуют как кислоты или основания, когда они
растворить в воде. При значении K a для кислоты относительно большой, кислота реагирует с водой до тех пор, пока
практически все молекулы кислоты были израсходованы. Серная кислота ( K a = 1 x 10 3 ),
например, реагирует с водой до 99.9% H 2 SO 4 молекулы в растворе 1 M потеряли протон с образованием HSO 4 — ионы.
Серная кислота ( K a = 1 x 10 3 ),
например, реагирует с водой до 99.9% H 2 SO 4 молекулы в растворе 1 M потеряли протон с образованием HSO 4 — ионы.
H 2 SO 4 ( водн. ) + H 2 O ( л ) H 3 O + ( водн. ) + HSO 4 — ( водн. )
As K a становится меньше, степень реакции кислоты с водой уменьшается.
До K a для кислоты значительно больше, чем значение K a для воды кислота в некоторой степени ионизируется. Уксусная кислота, для Например, до некоторой степени реагирует с водой с образованием H 3 O + и CH 3 CO 2 —, или ацетат-ионы.
CH 3 CO 2 H ( водн.
) + H 2 O ( л ) H 3 O + ( водн. ) + CH 3 CO 2 — ( водн. )
Как K a значение для кислоты приближается к K a для вода, соединение становится более похожим на воду по кислотности.Хотя это все еще кислота Бренстеда, она настолько слабая, что мы можем невозможно обнаружить эту кислотность в водном растворе.
Некоторые потенциальные кислоты Бренстеда настолько слабы, что их значения K a меньше воды. Аммиак, например, имеет K a всего 1 х 10 -33 . Хотя NH 3 может быть Кислота Бренстеда, поскольку она может действовать как донор иона водорода, нет никаких доказательств этой кислотности, когда он растворяется в воде.
В Выравнивающий эффект воды
Все сильные кислоты и основания кажутся
иметь одинаковую крепость при растворении в воде, независимо от
значение K a . Это явление
известный как эффект выравнивания воды
склонность воды ограничивать силу сильных кислот и
базы. Мы можем объяснить это, заметив, что сильные кислоты реагируют
обильно водой с образованием H 3 O + ион.Более 99% молекул HCl в соляной кислоте
реагирует с водой с образованием H 3 O + и Cl — ионы, например,
Это явление
известный как эффект выравнивания воды
склонность воды ограничивать силу сильных кислот и
базы. Мы можем объяснить это, заметив, что сильные кислоты реагируют
обильно водой с образованием H 3 O + ион.Более 99% молекул HCl в соляной кислоте
реагирует с водой с образованием H 3 O + и Cl — ионы, например,
HCl ( г ) + H 2 O ( л ) H 3 O + ( водн. ) + Cl — ( водн. )
и более 99% H 2 SO 4 молекулы в растворе 1 M реагируют с водой с образованием H 3 O + ионы HSO 4 — ионы.
H 2 SO 4 ( водн. ) + H 2 O ( л ) H 3 O + ( водн. ) + HSO 4 — ( водн.
)
Таким образом, сила сильного кислоты ограничено силой кислоты (H 3 O + ) образуется, когда молекулы воды захватывают ион H + .
Подобное явление происходит в решения сильных оснований.Сильные основания количественно реагируют с вода с образованием иона OH —. Как только это произойдет, решение не может стать более простым. Сила сильного баз ограничено прочностью основания (OH — ) образуется, когда молекулы воды теряют ион H + .
В Преимущества определения Бренстеда
Определение Брнстеда кислоты и основания имеют много преимуществ перед аррениусовыми и операционные определения.
- Расширяет список потенциальные кислоты включают положительные и отрицательные ионы, так как а также нейтральные молекулы.
- Расширяет список
основания для включения любой молекулы или иона по крайней мере с одним
пара несвязывающих валентных электронов.

- Это объясняет роль вода в кислотно-основных реакциях: вода принимает H + ионы из кислот с образованием H 3 O + ион.
- Его можно расширить до включают растворители, кроме воды, и реакции, которые происходят в газовой или твердой фазах.
- Связывает кислоты и основания на сопряженные кислотно-основные пары.
- Это может объяснить соотношение между силой кислоты и ее сопряженное основание.
- Он может объяснить различия в относительной силе пары кислот или пары базы.
- Это может объяснить выравнивающий эффект воды тот факт, что сильные кислоты и основания имеют одно и то же прочность при растворении в воде.
Благодаря этим преимуществам,
всякий раз, когда химики используют слова кислота или основание без какого-либо дальнейшего описания, они относятся к
Brnsted acid или Brnsted base .
pH Как мера концентрации H 3 O + Ион
Чистая вода одновременно является слабой кислотой и слабая база.Сама по себе вода образует очень небольшое количество ионов H 3 O + и OH —, которые характеризуют водные растворы более сильных кислот и оснований.
| H 2 O ( л ) | + | H 2 O ( л ) | H 3 O + ( водн. ) | + | ОН — ( водн. ) | ||
| основание | кислота | кислота | база |
Концентрации H 3 O + и ионы OH — в воде могут быть определены тщательно
измерение способности воды проводить электрический ток. В
25 o C, концентрации этих ионов в чистой воде
составляет 1,0 x 10 -7 моль на литр.
В
25 o C, концентрации этих ионов в чистой воде
составляет 1,0 x 10 -7 моль на литр.
[H 3 O + ] = [OH — ] = 1,0 x 10 -7 M (при 25 ° C)
Когда мы добавляем сильную кислоту в вода, концентрация иона H 3 O + увеличивается.
HCl ( водн., ) + H 2 O ( л ) H 3 O + ( водн. ) + Cl — ( водн. )
При этом ОН — концентрация ионов уменьшается, поскольку H 3 O + ионы, образующиеся в этой реакции, нейтрализуют часть OH — ионы в воде.
H 3 O + ( водн. ) + OH — ( водн. ) 2 H 2 O ( л )
Продукт
концентрации H 3 O + и OH — ионы постоянны, независимо от того, сколько кислоты или основания добавлено к
вода. В чистой воде при 25 o C продукт
концентрация этих ионов составляет 1,0 x 10 -14 .
В чистой воде при 25 o C продукт
концентрация этих ионов составляет 1,0 x 10 -14 .
[H 3 O + ] [OH — ] = 1.0 х 10 -14
Диапазон концентраций H 3 O + и ионов OH — в водном растворе настолько велики, что с ним сложно работать. В 1909 году датский биохимик С.П.Л. Соренсон предложил указывать концентрацию H 3 O + ion в логарифмической шкале, которую он назвал шкалой pH . Поскольку концентрация ионов H 3 O + в воде почти всегда меньше единицы, логарифм этих концентраций отрицательное число.Чтобы избежать постоянной работы с отрицательные числа, Соренсон определил pH как отрицательное значение журнала концентрации ионов H 3 O + .
pH = -log [H 3 O + ]
Концепция pH-компрессов
диапазон концентраций ионов H 3 O + в
масштаб, с которым намного проще обращаться. Как H 3 O + концентрация ионов уменьшается примерно с 10 0 до 10 -14 ,
pH раствора увеличивается от 0 до 14.
Как H 3 O + концентрация ионов уменьшается примерно с 10 0 до 10 -14 ,
pH раствора увеличивается от 0 до 14.
Если концентрация H 3 O + ион в чистой воде при 25 o C составляет 1,0 x 10 -7 M , pH чистой воды 7.
pH = -log [H 3 O + ] = -log (1,0 x 10 -7 ) = 7
Когда pH раствора менее 7, раствор кислый. Когда pH больше 7, решение простое.
| Кислый: | pH <7 | |
| Базовый: | pH> 7 |
pH кислот и оснований
pH раствора зависит от
сила кислоты или основания в растворе.Измерения
поэтому pH разбавленных растворов являются хорошими индикаторами
относительная сила кислот и оснований. Значения pH 0,10 M растворы ряда распространенных кислот и оснований приведены в
Таблица ниже.
Значения pH 0,10 M растворы ряда распространенных кислот и оснований приведены в
Таблица ниже.
pH 0,10 М растворов обычных кислот и оснований
| Соединение | pH | |
| HCl (соляная кислота) | 1.1 | |
| H 2 SO 4 (серная кислота) | 1,2 | |
| NaHSO 4 (гидросульфат натрия) | 1,4 | |
| H 2 SO 3 (сернистая кислота) | 1,5 | |
| H 3 PO 4 (фосфорная кислота) | 1.5 | |
| HF (плавиковая кислота) | 2,1 | |
| CH 3 CO 2 H (уксусная кислота) | 2,9 | |
| H 2 CO 3 (угольная кислота) | 3,8 (насыщенный раствор) | |
| H 2 S (сероводород) | 4. 1 1 | |
| NaH 2 PO 4 (дигидрофосфат натрия) | 4,4 | |
| NH 4 Cl (хлорид аммония) | 4,6 | |
| HCN (синильная кислота) | 5,1 | |
| Na 2 SO 4 (сульфат натрия) | 6.1 | |
| NaCl (хлорид натрия) | 6,4 | |
| NaCH 3 CO 2 (ацетат натрия) | 8,4 | |
| NaHCO 3 (бикарбонат натрия) | 8,4 | |
| Na 2 HPO 4 (гидрофосфат натрия) | 9.3 | |
| Na 2 SO 3 (сульфит натрия) | 9,8 | |
| NaCN (цианид натрия) | 11,0 | |
| NH 3 (водный аммиак) | 11,1 | |
| Na 2 CO 3 (карбонат натрия) | 11. 6 6 | |
| Na 3 PO 4 (фосфат натрия) | 12,0 | |
| NaOH (натрий гидроксид, щелочь) | 13,0 |
Сильные и слабые кислоты и основания
Один из способов помочь учащимся понять разницу между «сильным» и «слабым», разбавленным и концентрированным — это заставить их выполнять последовательные разбавления 1:10.Сильная кислота, сильное основание, слабая кислота и слабое основание покажут, что pH изменяется на 1 целое значение для каждого разведения. Для сильной кислоты или основания потребуется больше разведений, чтобы достичь того же значения, что и для слабого основания. Это говорит о том, что в сильных кислотах и основаниях больше частиц, ответственных за кислотность / щелочность, чем в слабых. Этому можно противопоставить концентрированные растворы, в которых большое количество любого вещества может быть растворено в воде. Это не зависит от того, является ли кислота / основание «сильной» или «слабой», но в равной степени применимо к некислотным веществам, таким как хлорид натрия или сахар.
Это не зависит от того, является ли кислота / основание «сильной» или «слабой», но в равной степени применимо к некислотным веществам, таким как хлорид натрия или сахар.
Задание 5 в этом ресурсе «Изучение химии» (страницы 15–20) можно использовать, чтобы помочь студентам понять, что происходит на молекулярном уровне. Это задание 5 из набора для студентов «Кислоты и щелочи».
Концентрация кислоты или щелочи — это мера того, сколько кислоты или щелочи растворено в известном объеме жидкости, например вода. Молярность раствора — это мера концентрации: количество молей, растворенных в 1000 см3 воды. Концентрация растворов обычно выражается в молях на литр раствора.(Литр равен 1 дм3 или 1000 см3.) Такой способ определения концентрации иногда называют «молярностью».
В концентрированной кислоте или щелочи растворено относительно большое количество растворенного вещества по сравнению с разбавленной кислотой или щелочью. Однако это не говорит нам, какова концентрация ионов H + в кислоте или ионов OH- в щелочи. Это зависит от силы кислоты или щелочи. Сила относится к степени ионизации воды.
Это зависит от силы кислоты или щелочи. Сила относится к степени ионизации воды.
Сильная кислота или щелочь — это кислота, почти или полностью ионизированная в воде.Примеры: соляная кислота, азотная кислота и серная кислота. Гидроксид натрия и калия являются примерами сильных оснований.
С другой стороны, слабая кислота или щелочь ионизируются в воде лишь частично. Этановая, лимонная и угольная кислоты — все слабые кислоты. Молекула этановой кислоты и ионы достигают динамического равновесия, причем равновесие обычно находится слева, поэтому присутствует мало H +.
Можете ли вы определить следующее: слабая кислота, сильная кислота, слабое основание, сильное основание или нейтраль? Как это определить?
Просто из # K_a # или # «pKa» #.(+) # в раствор с # «pKa» ~~ -7 #. Сильная кислота .
 74 #). Часто называется уксусной кислотой. Считается слабой кислотой , но все же значительно диссоциирует свой протон.
74 #). Часто называется уксусной кислотой. Считается слабой кислотой , но все же значительно диссоциирует свой протон.Таким образом, # «NH» _4 «OH» # значительно диссоциирует с образованием # «NH» _3 # в растворе, и большинство считает его сильной кислотой , даже несмотря на то, что его # «pKa» # настолько близок к # «pKa» # «HCN» #.
Наконец, убедитесь, что вы знаете, что кислотность и основность — все относительно . Вы ДОЛЖНЫ сравнить # pKa # s. Сильные кислоты считаются сильными только потому, что они значительно диссоциируют в воде .
Если бы вода имела более низкий # «pKa» #, эти сильные кислоты были бы слабее. Точно так же, если вы растворите # «HCl» # в # «H» _2 «SO» _4 #, # «HCl» # будет считаться слабой кислотой!
Точно так же, если вы растворите # «HCl» # в # «H» _2 «SO» _4 #, # «HCl» # будет считаться слабой кислотой!
Кислоты и основания
Согласно теории Бренстеда, кислота является донором протонов , а основание является акцептором протонов . В кислотно-основной реакции каждая сторона равновесия имеет кислотный и основной реагент или продукт, и они могут быть нейтральными частицами или ионами.
Структурно связанные пары кислота-основание, такие как {H-A и A: (-) } или {B: (-) и B-H}, называются конъюгированными парами .Вещества, которые могут служить как кислотами, так и основаниями, например вода, называются амфотерными .
Кислотность
Относительная сила группы кислот может быть оценена путем измерения степени реакции каждого члена с общим основанием. Вода прекрасно служит общей базой для таких определений. Таким образом, для кислоты H-A ее сила пропорциональна степени ее реакции с основной водой, которая задается константой равновесия K eq .
Поскольку эти исследования обычно экстраполируются на высокие разведения, молярная концентрация воды (55,5) постоянна и может быть исключена из знаменателя. Полученное значение K называется константой кислотности , K a . Ясно, что сильные кислоты имеют больше K и , чем более слабые кислоты. Действительно, если HA полностью ионизируется в растворе, K a стремится к бесконечности ([HA] почти равно нулю). Из-за очень большого диапазона концентраций кислоты (более 10 40 ) обычно используется логарифмическая шкала кислотности (pK a ).Более сильные кислоты имеют меньшие или более отрицательные значения pK и , чем более слабые кислоты.
Во всех приведенных выше примерах вода действует как общее основание, причем самая слабая кислота и самое слабое основание будут преобладать и обязательно будут находиться на одной и той же стороне равновесия). В идеале следует использовать концентрацию кислоты не более 0,1 М. Поскольку вода является амфотерной, она может подвергаться автопротолизу, как показано в следующем уравнении. Автоионизация показана как Keq, и если рассматривать концентрацию воды, как и раньше, константа кислотности (K a ) для воды обозначается K w (водная постоянная).Таким образом, pH чистой воды составляет 7,0.
Поскольку вода является амфотерной, она может подвергаться автопротолизу, как показано в следующем уравнении. Автоионизация показана как Keq, и если рассматривать концентрацию воды, как и раньше, константа кислотности (K a ) для воды обозначается K w (водная постоянная).Таким образом, pH чистой воды составляет 7,0.
Диапазон выделяемых сильных кислот ограничен. Таким образом, кислоты, которые сильнее, чем катион гидроксония, H 3 O (+) , и слабые кислоты, имеющие сопряженные основания сильнее, чем гидроксид-анион, OH (-) , не могут быть измерены непосредственно в водном растворе. Если сильная кислота (HA) имеет Ka = 100, 0,1 М раствор в воде будет полностью ионизирован, давая концентрацию гидроксония 100 и концентрацию [HA] 10 -4 .Подобный раствор кислоты в 10 3 раз сильнее будет необнаружимо из-за этого выравнивающего эффекта растворителя. Термин выравнивающий эффект относится к влиянию амфотерного растворителя, такого как вода, на измерения кислотности и основности. Сила сильной кислоты выравнивается основностью растворителя, а основность сильных оснований также ограничивается кислотностью растворителя.
Сила сильной кислоты выравнивается основностью растворителя, а основность сильных оснований также ограничивается кислотностью растворителя.
Поскольку многие органические реакции протекают либо в водной среде (живые клетки), либо гасятся или обрабатываются в воде, важно учитывать, как кислотно-щелочная равновесная смесь конъюгата изменяется с изменением pH.Эту информацию предоставляет простая связь, известная как уравнение Хендерсона-Хассельбаха .
Когда pH водного раствора или смеси равен pK a кислотного компонента, концентрации кислотных и основных конъюгированных форм должны быть равны (логарифм 1 равен 0). Если pH снижен на две или более единицы по сравнению с pK a , концентрация кислоты будет больше 99%. С другой стороны, если pH (относительно pK a ) повышается на две или более единицы, концентрация основания конъюгата будет более 99%.Следовательно, смеси кислых и некислотных соединений легко разделяются путем регулирования pH водного компонента при двухфазной экстракции растворителем.
Основность
В водном растворе основание представляет собой растворенное вещество, которое увеличивает концентрацию гидроксид-ионов. Алкоксиды металлов, такие как NaOCH 3 и KOC (CH 3 ) 3 , реагируют с водой с образованием сольватированных катионов металлов и ионов алкоксида и гидроксида. Эти 100% ионизации делают такие соединения очень сильными основаниями.Многие нейтральные основания представляют собой соединения азота. Для этого мы можем записать основные-кислотные равновесия, которые определяют K b и соответствующий pK b , как показано для аммиака в первом уравнении ниже. Однако более распространенной процедурой является определение кислотности сопряженных кислот оснований, как показано во втором уравнении (эти сопряженные кислоты обычно являются «ониевыми» катионами). Значения pK и для оснований в этой системе пропорциональны прочности основания.Обратите внимание, что в таких отношениях pK a + pK b = 14.
Большинство простых алкиламинов имеют pK a в диапазоне от 9,5 до 11,0, а их водные растворы являются основными (имеют pH От 11 до 12, в зависимости от концентрации). Первые четыре соединения в следующей таблице, включая аммиак, попадают в эту категорию. Последние шесть соединений (цветные ячейки) являются значительно более слабыми основаниями вследствие трех факторов. Первый из них — гибридизация азота.В пиридине азот sp 2 гибридизован, а в нитрилах (последняя запись) азот sp гибридного соединения является частью тройной связи. В каждом из этих соединений (заштриховано красным) несвязывающая электронная пара локализована на атоме азота, но увеличение s-символа приближает его к ядру азота, уменьшая его тенденцию связываться с протоном. Во-вторых, анилин и п-нитроанилин (первые две структуры, закрашенные зеленым) являются более слабыми основаниями из-за делокализации несвязывающей пары электронов азота в ароматическое кольцо (и нитрозаместитель).Это та же делокализация, которая приводит к активации бензольного кольца в сторону электрофильного замещения. В самом деле, анилин является более слабым основанием, чем циклогексиламин, примерно в миллион раз, благодаря тому же фактору фенол является более сильной кислотой, чем циклогексанол. Эта делокализация электронной пары сопровождается определенной степенью регибридизации атома азота аминогруппы, но делокализация электронной пары, вероятно, является основным фактором пониженной основности этих соединений. Подобная делокализация электронных пар ответственна за очень низкую основность (и нуклеофильную реакционную способность) амидных атомов азота (последняя заштрихованная структура).
В самом деле, анилин является более слабым основанием, чем циклогексиламин, примерно в миллион раз, благодаря тому же фактору фенол является более сильной кислотой, чем циклогексанол. Эта делокализация электронной пары сопровождается определенной степенью регибридизации атома азота аминогруппы, но делокализация электронной пары, вероятно, является основным фактором пониженной основности этих соединений. Подобная делокализация электронных пар ответственна за очень низкую основность (и нуклеофильную реакционную способность) амидных атомов азота (последняя заштрихованная структура).
Теория Льюиса
Согласно теории Льюиса, кислота является акцептором пары электронов , а основание является донором пары электронов . Базы Льюиса также являются базами Бронстеда; однако многие кислоты Льюиса, такие как BF 3 , AlCl 3 и Mg 2+ , не являются кислотами Бренстеда. Продукт кислотно-основной реакции Льюиса представляет собой нейтральный, диполярный или заряженный комплекс, который может быть стабильной ковалентной молекулой. Как показано в верхней части следующего рисунка, координированное ковалентное связывание фосфорного основания Льюиса с борной кислотой Льюиса создает комплекс, в котором формальный заряд бора отрицательный, а заряд фосфора положительный.В этом комплексе бор приобретает конфигурацию неоновой валентной оболочки, а фосфор — конфигурацию аргона. Два примера кислотно-основного равновесия Льюиса, которые играют роль в химических реакциях, показаны в уравнениях 1 и 2 ниже.
Как показано в верхней части следующего рисунка, координированное ковалентное связывание фосфорного основания Льюиса с борной кислотой Льюиса создает комплекс, в котором формальный заряд бора отрицательный, а заряд фосфора положительный.В этом комплексе бор приобретает конфигурацию неоновой валентной оболочки, а фосфор — конфигурацию аргона. Два примера кислотно-основного равновесия Льюиса, которые играют роль в химических реакциях, показаны в уравнениях 1 и 2 ниже.
В первом примере электронодефицитный атом алюминия связывается с ковалентным атомом хлора, разделяя одну из его несвязывающих пар валентных электронов, и, таким образом, достигает октета аргоноподобной валентной оболочки.Поскольку это разделение является односторонним (хлор вносит вклад в оба электрона), как показано, и алюминий, и хлор имеют формальные заряды. Если связь углерод-хлор в этом комплексе разрывается, и оба связывающих электрона остаются с более электроотрицательным атомом (хлор), углерод принимает положительный заряд. Мы называем такие виды углерода Карбокатионы . Карбокатионы также являются кислотами Льюиса, как показывает обратная реакция. Если заместители (R) на этих атомах не велики, комплекс будет находиться в равновесии.Однако стерические затруднения объемных заместителей могут препятствовать образованию комплексов. Полученная смесь несвязанных пар кислота / основание Льюиса была названа «фрустрированной» и демонстрирует необычные химические и каталитические свойства. Комбинация P (трет-бутил) 3 и B (C 6 F 5 ) 3 является примером.
Мы называем такие виды углерода Карбокатионы . Карбокатионы также являются кислотами Льюиса, как показывает обратная реакция. Если заместители (R) на этих атомах не велики, комплекс будет находиться в равновесии.Однако стерические затруднения объемных заместителей могут препятствовать образованию комплексов. Полученная смесь несвязанных пар кислота / основание Льюиса была названа «фрустрированной» и демонстрирует необычные химические и каталитические свойства. Комбинация P (трет-бутил) 3 и B (C 6 F 5 ) 3 является примером.
Многие карбокатионы (но не все) могут также действовать как кислоты Бренстеда. Уравнение 3 иллюстрирует это двойное поведение для (CH 3 ) 3 C (+); кислотный центр Льюиса окрашен в красный цвет, а три из девяти кислых атомов водорода окрашены в оранжевый цвет.В своей роли кислоты Бренстеда карбокатион отдает протон основанию (гидроксид-анион) и превращается в стабильную нейтральную молекулу, имеющую двойную связь углерод-углерод.
Терминология, относящаяся к номенклатуре кислотно-основного состава Льюиса, часто используется химиками-органиками. Здесь термин электрофил соответствует кислоте Льюиса, а нуклеофил соответствует основанию Льюиса.
Электрофил : атом, ион или молекула с недостатком электронов, которые имеют сродство к электронной паре и будут связываться с основанием или нуклеофилом.
Нуклеофил : атом, ион или молекула, имеющая электронную пару, которая может быть подарена при связывании с электрофилом (или кислотой Льюиса).
Некоторая путаница в различении основности (основной силы) и нуклеофильности (нуклеофильной силы) неизбежна. Поскольку основность — менее хлопотное понятие; с него удобно начинать.
Основность относится к способности основания принимать протон . Основность может быть связана с pK a соответствующей конъюгированной кислоты. Самые сильные основания имеют самые слабые сопряженные кислоты и , наоборот, . В кислотно-щелочном равновесии самая слабая кислота и самое слабое основание будут преобладать, и они обязательно будут на одной стороне равновесия.
Самые сильные основания имеют самые слабые сопряженные кислоты и , наоборот, . В кислотно-щелочном равновесии самая слабая кислота и самое слабое основание будут преобладать, и они обязательно будут на одной стороне равновесия.
Растворители, такие как уксусная кислота, ацетонитрил и нитрометан, часто используются для изучения очень сильных кислот. Аналогичным образом, очень слабокислые растворители, такие как диметилсульфоксид (ДМСО), ацетонитрил, толуол, амины и аммиак, могут использоваться для изучения кислотности очень слабых кислот.Измерения в этих растворителях можно экстраполировать на воду, и многие из них имеют большую погрешность. И для кислот, и для оснований указанные значения pK и , экстраполированные на воду, являются приблизительными. Таблица некоторых основных реагентов приведена ниже. Диапазон основностей замечателен, он охватывает более пятидесяти степеней десяти!
| База | Я (-) | Класс (-) | H 2 O | CH 3 CO 2 (-) | RS (-) | CN (-) | РО (-) | NH 2 (-) | CH 3 (-) |
|---|---|---|---|---|---|---|---|---|---|
Conj. Кислота Кислота | HI | HCl | H 3 O (+) | CH 3 CO 2 H | RSH | HCN | ROH | NH 3 | CH 4 |
| pK a | -9 | -7 | -1,7 | 4,8 | 8 | 9.1 | 16 | 33 | 48 |
Нуклеофильность — более сложное свойство. Обычно это относится к скорости реакции замещения в
галогенсодержащий атом углерода эталонного галогенида алкила, такого как CH 3 -Br.
Таким образом, нуклеофильность реагента Nu: (-) в следующей реакции замещения изменяется, как показано на диаграмме ниже. Диапазон реакционной способности этих реагентов превышает 5000 раз, причем тиолат является наиболее реактивным.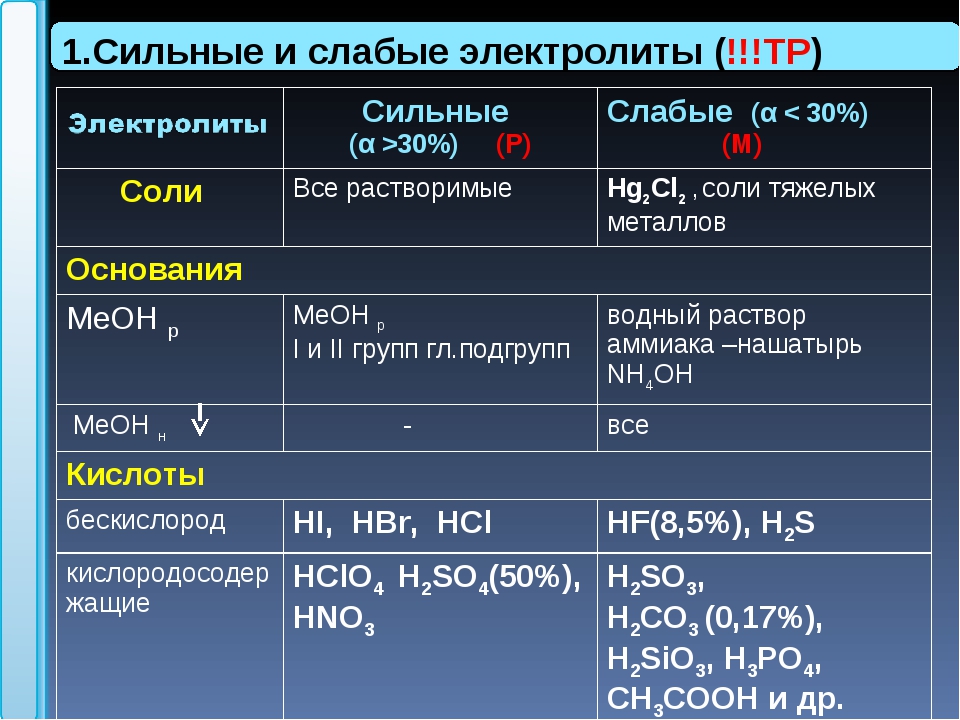 Ясно, что есть существенные различия между этими нуклеофильностями и основностями, обсужденными выше.
Ясно, что есть существенные различия между этими нуклеофильностями и основностями, обсужденными выше.
Нуклеофильность: CH 3 CO 2 (-) |
| Были задокументированы некоторые полезные тенденции: (i) Для данного элемента отрицательно заряженные частицы являются более нуклеофильными (и основными), чем эквивалентные нейтральные частицы. (ii) Для данного периода таблицы Менделеева нуклеофильность (и основность) уменьшается при движении слева направо. (iii) Для данной группы таблицы Менделеева нуклеофильность увеличивается сверху вниз ( , то есть с увеличением размера), , хотя существует зависимость от растворителя из-за водородных связей.  Основность различается противоположным образом. Основность различается противоположным образом. |
Для двух или более молекул, содержащих нуклеофильные атомы одного вида и заряда, более сильное основание обычно является более сильным нуклеофилом.Таким образом, 2,2,2-трифторэтоксид (pK a 12) является более слабым основанием и нуклеофилом, чем этоксид (pK a 16). Заметное исключение из этого правила возникает, когда вицинальный (соседний) атом несет несвязывающую электронную пару. Двумя распространенными примерами этого исключения, называемого альфа-эффект , являются гидроксид-ион (pK a 15,7) по сравнению с ионом гидропероксида (pK a 11,6) и аммиак (pK a 9,3) по сравнению с гидразином (pK а 8,0). В каждой из этих пар более слабое основание — более сильный нуклеофил.
Сольватация нуклеофильных анионов заметно влияет на их реакционную способность. Указанные выше нуклеофильности были получены в результате реакций в растворе метанола. Полярные протонные растворители, такие как вода и спирты, сольватируют анионы за счет взаимодействия водородных связей, как показано на диаграмме справа. Эти сольватированные частицы более стабильны и менее реакционноспособны, чем несольватированные «голые» анионы. Полярные апротонные растворители, такие как ДМСО (диметилсульфоксид), ДМФ (диметилформамид) и ацетонитрил, не сольватируют анионы почти так же хорошо, как метанол, но обеспечивают хорошую сольватацию сопутствующих катионов.Следовательно, большинство обсуждаемых здесь нуклеофилов быстрее реагируют в растворах, приготовленных из этих растворителей. Такие эффекты растворителя более выражены для небольших основных анионов, чем для крупных слабоосновных анионов. Таким образом, для реакции в растворе ДМСО наблюдается следующий порядок реактивности:
Полярные протонные растворители, такие как вода и спирты, сольватируют анионы за счет взаимодействия водородных связей, как показано на диаграмме справа. Эти сольватированные частицы более стабильны и менее реакционноспособны, чем несольватированные «голые» анионы. Полярные апротонные растворители, такие как ДМСО (диметилсульфоксид), ДМФ (диметилформамид) и ацетонитрил, не сольватируют анионы почти так же хорошо, как метанол, но обеспечивают хорошую сольватацию сопутствующих катионов.Следовательно, большинство обсуждаемых здесь нуклеофилов быстрее реагируют в растворах, приготовленных из этих растворителей. Такие эффекты растворителя более выражены для небольших основных анионов, чем для крупных слабоосновных анионов. Таким образом, для реакции в растворе ДМСО наблюдается следующий порядок реактивности:
| Нуклеофильность: I (-) (-) |
В отличие от порядка в метаноле (показанном выше), этот рейтинг примерно соответствует порядку увеличения основности. Нейтральные основания, такие как аммиак и простые первичные и вторичные амины, имеют схожую основность (pKa = 9–11) и также являются хорошими нуклеофилами. В реакциях с бромистым метилом в метаноле их нуклеофильность больше, чем Cl (-) , и меньше, чем N 3 (-) . В слабоосновных апротонных растворителях они реагируют с умеренными электрофилами, такими как алкилгалогениды (Cl, Br и I) и карбонильные группы (альдегиды, кетоны, сложные эфиры и ангидриды), давая четвертичные соли из первых и имины, енамины и амиды из последних. .Третичные амины и объемные вторичные амины являются более бедными нуклеофилами и ведут себя исключительно как основания.
Нейтральные основания, такие как аммиак и простые первичные и вторичные амины, имеют схожую основность (pKa = 9–11) и также являются хорошими нуклеофилами. В реакциях с бромистым метилом в метаноле их нуклеофильность больше, чем Cl (-) , и меньше, чем N 3 (-) . В слабоосновных апротонных растворителях они реагируют с умеренными электрофилами, такими как алкилгалогениды (Cl, Br и I) и карбонильные группы (альдегиды, кетоны, сложные эфиры и ангидриды), давая четвертичные соли из первых и имины, енамины и амиды из последних. .Третичные амины и объемные вторичные амины являются более бедными нуклеофилами и ведут себя исключительно как основания.
Эффекты растворителя
Кислоты
Ионизация группы кислот в данном растворителе может использоваться как мера силы кислоты, и в таких случаях растворитель служит общим эталонным основанием. Определение значений K a и pK a для любой системы растворителей может быть выполнено таким же образом, как и в воде; однако кислотности, полученные для группы кислот, измеренные в разных растворителях, обычно будут разными, как по числовому значению для каждого, так и иногда в относительном порядке.
| A – H и кислота | + | Sol: Растворитель | | A: (-) сопряженное основание | + | Sol – H (+) сопряженная кислота |
Есть несколько факторов, которые влияют на измерения кислотности, сделанные в воде и других растворителях. Эти:
1. Ионизация кислоты дает ионы. Растворители с большими диэлектрическими постоянными способствуют образованию и разделению заряда.2. Конъюгированная кислота из растворителя представляет собой катион, который стабилизируется за счет ассоциации с другими молекулами растворителя, явление, называемое сольватацией.
3. Основание, сопряженное с кислотой, представляет собой анион, который в большинстве случаев также стабилизируется сольватацией.
 В качестве примеров рассмотрим следующие данные, полученные для шести сильных кислот в трех распространенных растворителях.
В качестве примеров рассмотрим следующие данные, полученные для шести сильных кислот в трех распространенных растворителях.
| ||||||||||||||||||||||||||||
| * Хлорная кислота и трифторметансульфоновая кислота полностью ионизированы в воде и ДМСО. Значение pK a , равное –10, является приблизительным и предназначено для отражения высокой степени диссоциации. |
Все три растворителя имеют довольно высокие диэлектрические постоянные, но вода (ε = 80) значительно больше, чем ДМСО (ε = 46,7) или ацетонитрил (ε = 37,5). Более высокая кислотность (более низкая pK a ) последних четырех соединений в воде может быть отнесена на счет диэлектрической разницы; тем не менее, лучшая сольватация анионов, обеспечиваемая водой, считается основным фактором.И ДМСО, и ацетонитрил являются плохими растворителями для сольватации анионов, следовательно, ионизационное равновесие, показанное выше, будет смещено влево.
Полезно сначала сосредоточить внимание на различиях pK a между водой и ДМСО. Мы делаем это, потому что вода и ДМСО имеют схожую основность, поэтому стабилизация видов кислоты, сопряженной с растворителем, не должна существенно отличаться. HBr и HCl отображают pK a s в ДМСО, которые примерно на 9-10 раз больше, чем в воде, а более слабая кислота HF второго периода показывает еще большее изменение (pK a = 3.17 в воде и 15 в ДМСО). Все сопряженные основания этих кислот представляют собой одноатомные анионы. Поскольку отрицательный заряд локализован, стабилизация анионов путем сольватации, вероятно, является наиболее важным фактором в установлении положения этих равновесий. Напротив, сопряженные основания из серной кислоты и трифторуксусной кислоты внутренне стабилизированы делокализацией заряда по двум или трем атомам кислорода. Следовательно, важность сольватации менее важна, и изменение кислотности в ДМСО снижается до 4-х кратных десяти.
HBr и HCl отображают pK a s в ДМСО, которые примерно на 9-10 раз больше, чем в воде, а более слабая кислота HF второго периода показывает еще большее изменение (pK a = 3.17 в воде и 15 в ДМСО). Все сопряженные основания этих кислот представляют собой одноатомные анионы. Поскольку отрицательный заряд локализован, стабилизация анионов путем сольватации, вероятно, является наиболее важным фактором в установлении положения этих равновесий. Напротив, сопряженные основания из серной кислоты и трифторуксусной кислоты внутренне стабилизированы делокализацией заряда по двум или трем атомам кислорода. Следовательно, важность сольватации менее важна, и изменение кислотности в ДМСО снижается до 4-х кратных десяти.
Когда ацетонитрил является растворителем, измеренное значение pK a s этих кислот показывает дальнейшее увеличение, и даже самые сильные кислоты не диссоциируют полностью. Это изменение может быть связано в значительной степени с уменьшением сольватации растворителя, сопряженного с кислотой, которая является основной разновидностью катионов в разбавленных растворах. Поскольку как катионные, так и анионные частицы от кислотной ионизации плохо стабилизируются сольватацией, равновесие диссоциации находится далеко влево (небольшая ионизация).
Поскольку как катионные, так и анионные частицы от кислотной ионизации плохо стабилизируются сольватацией, равновесие диссоциации находится далеко влево (небольшая ионизация).
| Соединение | H 2 O | ДМСО | CH 3 CN |
|---|---|---|---|
| C 2 H 5 OH | 17 | 29 | 42 |
| CF 3 CH 2 OH | 12,4 | 23,5 | 33,5 |
| C 6 H 5 C≡CH | 19 | 29 | 40.6 |
| C 4 H 9 SH | 10,5 | 17 | 28,6 |
| CH 3 CO 2 H | 4,8 | 12,8 | 22,3 |
| C 6 H 5 CO 2 H | 4,2 | 11,1 | 20,7 |
| C 6 H 5 OH | 10 | 18 | 26,6 |
| C 6 H 5 SH | 6. 6 6 | 10,3 | 20,6 |
Большинство органических соединений являются гораздо более слабыми кислотами, чем сильные кислоты, описанные выше. Поэтому представляет интерес определить изменения кислотности, которые имеют место, когда такие соединения исследуются в тех же трех растворителях. Первые четыре соединения в этой таблице (заштрихованные светло-зеленым) представляют собой слабые кислоты с сопряженными основаниями, в которых заряд локализован на одном атоме (O, C и S). Замена воды в растворителе на ДМСО снижает кислотность на 10–12 десятичных степеней для атомов второго периода (C и O) и на 6.5 для третьего периода сульфгидриловой кислоты. Так же, как и в более кислых случаях, рассмотренных выше, сольватация сопряженных основных анионов является важным стабилизирующим фактором в воде, хотя более низкая плотность заряда серы снижает ее значение. Дальнейшее увеличение pK a , которое происходит в растворах ацетонитрила, относительно ДМСО, довольно равномерное (от 10 до 12 единиц) и немного больше, чем сдвиг, обнаруженный для сильных кислот.
Последние четыре соединения (заштрихованы синим) имеют сопряженные основания, стабилизированные делокализацией заряда.Здесь снижение кислотности при переходе от воды к ДМСО снижается до 7-8 десятичных степеней для кислорода и менее 4 для серы. Как отмечалось ранее, делокализация заряда внутри аниона снижает важность стабилизации сольватации. Увеличение pK a , обнаруженное для растворов ацетонитрила, остается примерно таким же и может быть связано с плохой сольватацией в этом растворителе.
За исключением производного ацетилена, все предыдущие соединения являются гетероатомными кислотами.Подобные измерения для группы активированных угольных кислот показывают согласие с предыдущим анализом и иллюстрируют способ, которым делокализация анионного заряда снижает pK — разницу между измерениями воды и ДМСО. Обратите внимание на близкую идентичность второго и третьего примеров в следующей таблице. Как и ожидалось, увеличение pK на при переходе в ацетонитрил из ДМСО остается примерно постоянным (около 11).
| Соединение | H 2 O | ДМСО | CH 3 CN |
|---|---|---|---|
| (CH 3 CO) 2 CH 2 | 9 | 13.3 | 24,4 |
| (NC) 2 CH 2 | 11,2 | 11,2 | 22,2 |
| (C 6 H 5 SO 2 ) 2 CH 2 | 11,6 | 12,2 | 23,2 |
| (C 2 H 5 OCO) 2 CH 2 | 13,5 | 16,4 | 27,8 |
| C 4 H 4 CH 2 циклопентадиен | 15. 0 0 | 18,0 | 31,2 |
Основания
Наиболее распространенное обозначение для сообщения об относительной силе оснований нейтрального основания (B 🙂 — это pK a соответствующих конъюгированных кислот (эти конъюгированные кислоты часто называют «ониевыми» катионами) . Следующее уравнение показывает равновесие, участвующее в этой взаимосвязи. Обратите внимание, что сильные основания будут иметь слабокислые сопряженные кислоты, поэтому pK a пропорционально основной силе нейтрального основания.
| B – H (+) сопряженная кислота | + | Sol: растворитель | | B: основание | + | Sol – H (+) конъюгированная кислота |
Ранее определенные факторы, которые влияли на кислотность, теперь могут быть повторно исследованы для этого нового равновесия.
1. Ионы присутствуют в обеих частях уравнения. Следовательно, различия в диэлектрической проницаемости растворителей должны быть относительно несущественным фактором.
2. И основание, и катионы сопряженной кислоты в растворителе стабилизируются путем сольватации. Это будет решающим фактором, связанным с основностью растворителя.
3. В приведенном выше уравнении нет анионов; однако для нейтрализации заряда требуется противоанион. Поскольку один и тот же анион будет присутствовать в обеих частях уравнения, его влияние на это равновесие будет исключено.
В следующей таблице приведены значения pK и для некоторых важных азотных оснований, некоторые структуры которых показаны справа.В примерах триэтиламина и DABCO в верхней части таблицы катионный заряд относительно локализован на одном атоме азота. Заряд в лутидине может быть делокализован на кольцевых атомах углерода за счет ароматической стабилизации. Последние три примера представляют собой соединения, в которых заряд делокализован за счет резонанса (протонирование происходит у голубого азота) или внутренней водородной связи (протонная губка).
В отличие от более ранних примеров кислоты pK a s, значения для этих катионов аммония почти идентичны в воде и растворителях ДМСО.Действительно, тот факт, что большинство DMSO pK a s немного ниже, чем их водные аналоги, предполагает, что DMSO является немного более щелочным, чем вода. В ацетонитриле все значения pK и примерно на 10 единиц выше, чем значения для ДМСО.
|
Указанное выше влияние растворителя на кислотность и основность может вызвать неожиданные изменения в простых кислотно-основных равновесиях. Если уксусная кислота и триэтиламин смешиваются вместе в воде, происходит быстрый перенос протона с почти количественным образованием ацетата триэтиламмония. Конъюгированные кислоты различаются по силе на 10 6 , и самая слабая из них находится в равновесии.Когда те же два соединения объединяются в растворе ДМСО, перенос протонов незначителен, поскольку уксусная кислота теперь более чем в 10 3 раз слабее кислоты, чем катион триэтиламмония.
Кислотность по Гаммету
Измерения ионизации водных растворов кислот (и оснований) обычно ограничиваются диапазоном pH от 1,5 до 13. Относительные значения более сильных кислот (и оснований) требуют использования других растворителей, а из-за различий в диэлектрической проницаемости сольватация, и прочие отклонения от идеала, устойчивые отношения не достигаются. Выход из этой ситуации был предложен Луи Хэмметом (Колумбийский университет). Хэмметт предложил использовать серию слабых индикаторных оснований, в которых соотношение [B] / [BH + ] можно было определить колориметрически из-за отчетливо окрашенного конъюгата кислоты. Когда отношение [B] к [BH + ] становится особенно малым и экспериментально невозможно точно измерить, другой, менее щелочной индикатор, перекрывающий первый, может служить для расширения диапазона кислотности. Дополнительные более слабые индикаторные основания позволили бы тогда перепрыгнуть через шкалу кислотности, увеличив ее примерно в 10 10 раз.Для этого определяли функцию кислотности H o , как показано с помощью следующего уравнения.
Выход из этой ситуации был предложен Луи Хэмметом (Колумбийский университет). Хэмметт предложил использовать серию слабых индикаторных оснований, в которых соотношение [B] / [BH + ] можно было определить колориметрически из-за отчетливо окрашенного конъюгата кислоты. Когда отношение [B] к [BH + ] становится особенно малым и экспериментально невозможно точно измерить, другой, менее щелочной индикатор, перекрывающий первый, может служить для расширения диапазона кислотности. Дополнительные более слабые индикаторные основания позволили бы тогда перепрыгнуть через шкалу кислотности, увеличив ее примерно в 10 10 раз.Для этого определяли функцию кислотности H o , как показано с помощью следующего уравнения.
 Преобладающая разновидность кислоты в разбавленных водных растворах — H 3 O + , поэтому шкала pH является наиболее часто используемой функцией кислотности в таких системах.В концентрированной серной кислоте преобладающим видом кислоты является H 3 SO 4 + , гораздо более сильная кислота, таким образом, H o является расширением шкалы pKa для очень сильных кислот.
Ключевым фактором для измерения значимого H o является выбор подходящего растворителя. Идеально. желателен слабоосновный протонный растворитель, имеющий большую диэлектрическую проницаемость, значительную степень автопротолиза и хорошую сольватацию ионов. Нетрадиционным выбором Хамметта была безводная серная кислота .Несмотря на очевидные опасения по поводу коррозионной активности, гигроскопичности и вязкости, этот выбор оказался вдохновляющим, о чем свидетельствуют следующие характеристики. Поскольку следы воды нежелательны, необходимо титрование SO 3 (дымящая серная кислота) до максимальной температуры плавления.
Преобладающая разновидность кислоты в разбавленных водных растворах — H 3 O + , поэтому шкала pH является наиболее часто используемой функцией кислотности в таких системах.В концентрированной серной кислоте преобладающим видом кислоты является H 3 SO 4 + , гораздо более сильная кислота, таким образом, H o является расширением шкалы pKa для очень сильных кислот.
Ключевым фактором для измерения значимого H o является выбор подходящего растворителя. Идеально. желателен слабоосновный протонный растворитель, имеющий большую диэлектрическую проницаемость, значительную степень автопротолиза и хорошую сольватацию ионов. Нетрадиционным выбором Хамметта была безводная серная кислота .Несмотря на очевидные опасения по поводу коррозионной активности, гигроскопичности и вязкости, этот выбор оказался вдохновляющим, о чем свидетельствуют следующие характеристики. Поскольку следы воды нежелательны, необходимо титрование SO 3 (дымящая серная кислота) до максимальной температуры плавления.
| автопротолиз 2 H 2 SO 4 H 3 SO 4 (+) + HSO 4 (-) |
|
В следующих таблицах перечислены некоторые индикаторные основания Hammett и H o некоторых очень сильных кислот или «суперкислот». Значение pKa индикаторных оснований определяли в водных растворах сильных кислот H 2 SO 4 и HClO 4 . Значения Ho были определены в безводной серной кислоте, и значения выше -16 являются оценочными.
|
|
|---|
Прочные основания
Химикам-органикам нужны основы разной силы в качестве реагентов, адаптированных к требованиям конкретных реакций.Нейтральные соединения азота могут охватывать диапазон основности примерно 10 10 , как показано в следующей таблице. Пиридин обычно используется в качестве акцептора кислоты в реакциях с образованием побочных продуктов минеральных кислот. Его основность и нуклеофильность могут быть изменены стерическими препятствиями, как в случае лутидина (pK a = 6,3), или резонансной стабилизацией, как в случае 4-диметиламинопиридина (pK a = 9,2). Основание Хюнига относительно ненуклеофильно (из-за стерических затруднений) и, как DBU, часто используется в качестве основания в реакциях элиминирования E2, проводимых в неполярных растворителях.Основание Бартона представляет собой сильное, слабонуклеофильное нейтральное основание, которое используется в тех случаях, когда электрофильное замещение DBU или других аминовых оснований является проблемой.
Основание Хюнига относительно ненуклеофильно (из-за стерических затруднений) и, как DBU, часто используется в качестве основания в реакциях элиминирования E2, проводимых в неполярных растворителях.Основание Бартона представляет собой сильное, слабонуклеофильное нейтральное основание, которое используется в тех случаях, когда электрофильное замещение DBU или других аминовых оснований является проблемой.
Самыми сильными основаниями, доступными химикам-органикам, являются соли алкоксидов щелочных металлов, такие как трет-бутоксид калия (pK a = от 16 до 19), алкилы щелочных металлов, такие как реактивы Гриньяра, н-бутиллитий и димсил натрия (pK a = От 28 до 40 лет) и амидные соли щелочных металлов, такие как LDA (pK a = от 30 до 40) и гидрид натрия (pK a ~ 42).Все эти мощные основания являются потенциальными нуклеофилами (некоторые в большей степени, чем другие) и имеют частично ионные связи с металлами. Основания в этих диапазонах pKa используются для превращения слабых кислот C-H в пригодные для использования карбанионные металлические реагенты.
* ДМСО = диметилсульфоксид | Некоторые примеры получения алкилметаллов вместе с аналогичными металлическими основаниями амидов показаны в следующих уравнениях. Иодид метилмагния: CH 3 I + Mg — > CH 3 MgI (эфирный раствор) Бутиллитий: 2 Li + C 4 H 9 X — > C 4 H 9 Li + LiX (где X = Cl, Br) Тритил-натрий *: (C 6 H 5 ) 3 CCl + 2 Na — > (C 6 H 5 ) 3 CNa + NaCl Димсил натрия: CH 3 SOCH 3 + NaH — > CH 3 SOCH 2 Na + H 2 LDA : [(CH 3 ) 2 ) CH] 2 NH + C 4 H 9 Li — > [(CH 3 ) 2 ) CH] 2 NLi + C 4 H 10 LiHMDS: {(CH 3 ) 3 Si} 2 NH + C 4 H 9 Li — > {(CH 3 ) 3 Si} 2 NLi + C 4 H 10 * Этот анион красного цвета и служит индикатором.  Это также одноэлектронный восстановитель. Это также одноэлектронный восстановитель. Алкилирование нитрила: RCH 2 CN + LDA — > RCHCNLi + {(CH 3 ) 2 ) C} 2 NH; RCHCNLi + R’X — > R’RCHCN + LiX Альдегиды, кетоны и сложные эфиры, имеющие активированные C-H-группы, можно аналогичным образом превратить в их сопряженные основания с последующим алкилированием или присоединением к электрофильным функциям. |
* TMP = 2,2,6,6-Тетраметилпиперидин * HMDS = Бис (триметилсилил) амин |
Неионные сверхоснования
Недавно был получен и изучен новый класс неметаллических, слабонуклеофильных, нейтральных оснований. Некоторые примеры показаны на следующей диаграмме.
Основным сайтом в основании Веркаде является атом фосфора, сопряженная кислота стабилизируется трансаннулярным связыванием с азотом.Сила этих оснований может быть изменена заместителями во фланкирующих атомах азота. Фосфазеновые основания Швезингера увеличивают свою силу, поскольку дополнительные фосфазеновые звенья добавляются вместе с основным сайтом (голубой атом азота). Все значения pK и для этих оснований измерены в ацетонитриле.
Кинетическая кислотность
Наиболее распространенная кислотно-основная терминология, pK a , отражает равновесную кислотность, экстраполированную или нормированную на воду.В следующем уравнении основание B: (-) M (+) отрывает протон от кислоты HA с образованием пары сопряженных кислот и оснований (A: (-) M (+ ) и BH). Скорость прямого отрыва протона составляет k f , а скорость обратного переноса протона составляет k r . Этот вид равновесия обычно характеризуется константой равновесия K eq , которая представляет собой отношение констант скорости (k f / k r ).Если H-A является более слабой кислотой, чем H-B, равновесие будет находиться слева, и K экв. будет меньше 1.
| H-A + B: (-) M (+) | A: (-) M (+) + B-H | |
| (кислота 1 ) (основание 1 ) | (основание 2 ) (кислота 2 ) |
В случаях, когда H-A намного слабее, чем H-B, K eq может быть слишком маленьким для измерения, но при определенных обстоятельствах можно определить скорость прямого отрыва протона.Если меченый изотопом конъюгат кислоты основания используется в качестве растворителя для реакции (B-D в следующих уравнениях), то любое происходящее отщепление протона будет отмечено преобразованием H-A в D-A. Уравнение, закрашенное зеленым сверху, показывает начальную потерю протона, а второе уравнение описывает быстрое дейтерирование промежуточного сопряженного основания, A: (-) . По мере протекания этих реакций реагент H-A будет все чаще обозначаться как D-A, и скорость изотопного обмена будет указывать на кинетическую кислотность H-A .Предполагается, что кинетическая кислотность примерно пропорциональна равновесной (термодинамической) кислотности, но это не всегда верно.
| растворитель = B-D | ||
| H-A + B: (-) M (+) | A: (-) M (+) + B-H | |
| D-A + B: (-) M (+) | A: (-) M (+) + B-D |
Следующая диаграмма представляет собой поучительный пример этих принципов.Первое уравнение, выделенное желтым цветом, дает важную информацию о тяжелой воде (оксид дейтерия), которая будет использоваться в качестве растворителя в нашем эксперименте. Тяжелая вода во многих отношениях похожа на воду, но она на 10% плотнее и в десять раз слабее кислоты. 1 молярная концентрация дейтероксида натрия будет служить основанием, а эквимолярное количество 3,3-диметил-1-бутина будет служить слабой кислотой. Самый кислый водород в этом углеводороде (окрашен в красный цвет) находится в C-1. На практике нам потребуется использовать сорастворитель для полного растворения углеводорода в тяжелой воде, но это было опущено, чтобы упростить обсуждение.
Второе уравнение описывает существенные изменения, ожидаемые при объединении этих реагентов в тяжелом водном растворителе. Поскольку концевой алкин представляет собой намного более слабую кислоту, чем тяжелая вода, кислотно-щелочное равновесие не благоприятствует его сопряженному основанию. Тем не менее, если образуется ацетилид-анион даже в низкой концентрации, он должен быстро отреагировать, отрывая дейтерий от соседней молекулы оксида дейтерия. Результатом будет наблюдаемый обмен дейтерия на водород, свидетельствующий о том, что произошла кислотно-основная реакция.
Поле с зеленым затенением содержит уравнения, которые помогают нам интерпретировать экспериментальные результаты. Чтобы оценить равновесную кислотность субстрата, нам необходимо измерить константу равновесия K eq для начального кислотно-щелочного равновесия, показанного в верхней части заштрихованной рамки. Поскольку мы знаем K a 3,3-диметил-1-бутина и тяжелой воды, мы можем оценить K eq , разделив первое (10 -25 ) на второе (10 -17 ).Этот расчет показывает K eq , который было бы трудно измерить напрямую из-за его небольшой величины (10 -8 ). В самом деле, равновесная концентрация ацетилид-аниона оценивается только в 2 * 10 -10 M.
. Если мы рассмотрим этот эксперимент с точки зрения кинетики, можно получить легко наблюдаемые доказательства терминальной алкиновой кислотности. Последние три строки уравнений в зеленой заштрихованной рамке проясняют это. Поскольку K eq представляет собой отношение констант прямой и обратной скорости, можно сделать выводы о скорости отрыва концевых протонов от алкина.Это приводит к выводу, что будет происходить достаточно быстрый обмен водород-дейтерий, даже если анион ацетилида никогда не присутствует в концентрациях, превышающих 10 -9 M.
Этот пример также демонстрирует пределы подхода изотопного обмена. Подложка из 3,3-диметил-1-бутина также имеет девять других атомов водорода (окрашенных в оранжевый цвет), которые не обмениваются на дейтерий в этих условиях. Мы знаем, что эти водороды гораздо менее кислые (K a ок.10 -48 ), и интересно рассмотреть их возможное участие в кислотно-основных реакциях с помощью предыдущего анализа. Расчетное значение K eq для такого образования карбаниона составляет примерно 10 -30 с учетом девятикратного увеличения концентрации. Это означает концентрацию одного карбаниона на каждые 10 9 литр раствора. Кинетический анализ столь же обескураживает. Константа прямой скорости оценивается в 10 -20 Ms -1 .Следовательно, время, необходимое для обмена половины этих атомов водорода на дейтерий, составит около 100 веков!
Для изучения кинетической кислотности чрезвычайно слабых кислот (pK a s = от 30 до 50) необходимо использовать более сильные основания, которые, конечно, имеют гораздо более слабые сопряженные кислоты. Для этой цели были использованы амидные анионы (pK a s = от 26 до 36).
Путем сравнения скоростей водородного обмена для различных соединений в идентичных условиях можно составить таблицы относительных кинетических кислот.Об интересном примере такого исследования сообщалось для группы нитроалканов, имеющих кислые α-атомы водорода. Удаление α-водорода основанием приводит к образованию конъюгированного основания, называемого аци-анионом , как показано здесь.
По сравнению с обсуждавшимся выше концевым алкином такие нитроалканы представляют собой относительно сильные C-H кислоты.Поскольку они являются более сильными кислотами, чем вода, эксперименты по кинетическому обмену должны проводиться в более мягких условиях, чем те, которые используются для терминального алкина. Это достигается за счет использования меньших концентраций основания и снижения температуры реакции обмена. Точные значения pK и 2-нитропропана, нитроэтана и нитрометана могут быть измерены непосредственно в водном растворе. Эти кинетическая и равновесная кислотности перечислены в таблице справа. Обратите внимание, что для этих трех соединений кинетическая кислотность изменяется противоположно равновесной кислотности.Кинетический порядок, кажется, отражает стерические препятствия и стабильность карбанионов; тогда как равновесие способствует усиленному замещению двойной связи аци-аниона. |
|
Исследования изотопного обмена, катализируемого основаниями, в соединениях, включающих более одного набора кислых водородов, дают дополнительную информацию о создании и использовании нуклеофильных конъюгированных оснований. Кетоны представляют собой множество примеров образования региоизомерного енолятного основания, и на следующей диаграмме показаны два таких случая. Как отмечалось в исследовании нитроалканов, атомы водорода на α-метильной группе обмениваются быстрее, чем на более замещенных α-атомах углерода.Уравнения на диаграмме показывают только исходный продукт от единственного обмена. Эти продукты содержат дополнительные α-водороды, которые также обмениваются в последующих реакциях такого рода, так что полная замена всех α-водородов дейтерием происходит за короткое время.
Относительная стабильность полученных енолятов увеличивается при замещении двойной связи енолята. Уравнения, показывающие равновесные концентрации этих изомерных енолятов, будут отображены при нажатии кнопки Toggle Equations .Для определения енолят-анионного равновесия для этих кетонов использовали объемный сильный щелочной бис (триметилсилил) амид натрия (pK a = 26).
При повторном нажатии кнопки Toggle Equations выше будут отображаться относительные скорости обмена α-водорода для некоторых замещенных циклогексанонов. И снова менее замещенные α-углероды обмениваются быстрее, но обнаружено, что более высокозамещенные еноляты преобладают в условиях равновесия.Третье нажатие кнопки Toggle Equations отобразит энергетический профиль для случая 2-метилциклогексанона, который должен прояснить различие между кинетической и равновесной кислотностью. Также показаны два других примера. Эти дисплеи могут периодически переключаться.
Большинство углеродных кислот образуют сопряженные основания, которые стабилизируются делокализацией заряда на соседних гетероатомах. Эта резонансная стабилизация требует значительной структурной реорганизации исходного соединения, которая, в свою очередь, создает энергетический барьер, замедляющий скорость отрыва протонов.Например, альфа-углерод кетона или сложного эфира должен подвергаться повторной гибридизации при образовании енолят-аниона. Стереоэлектронные требования этого изменения были описаны выше, и неудивительно, что образование енолят-аниона происходит намного медленнее, чем перенос эквивалентных протонов между спиртами и другими гидроксильными соединениями. Скорости депротонирования фенола и нитрометана, соединений с почти идентичными pK и (10,0), являются поучительным примером этого фактора структурной реорганизации.Кислый протон в феноле связан с кислородом, поэтому депротонирование требует небольшого изменения структуры и происходит очень быстро. Нитрометан — это углеродная кислота. Депротонирование до аци-аниона включает значительные структурные изменения и в миллион раз медленнее, чем образование фенолята. Эти структурные изменения показаны на следующей диаграмме.
Обратите внимание, что электронная пара O-H в феноле остается в основном на кислороде в соответствующем сопряженном основании, тогда как электронная пара C-H в нитрометане преимущественно смещена на кислород в его сопряженном основании (окрашен в синий цвет).Обозначенные здесь тенденции немного упрощены, поскольку не учитывались влияния растворителей и катионов.
Эта страница является собственностью Уильяма Ройша.




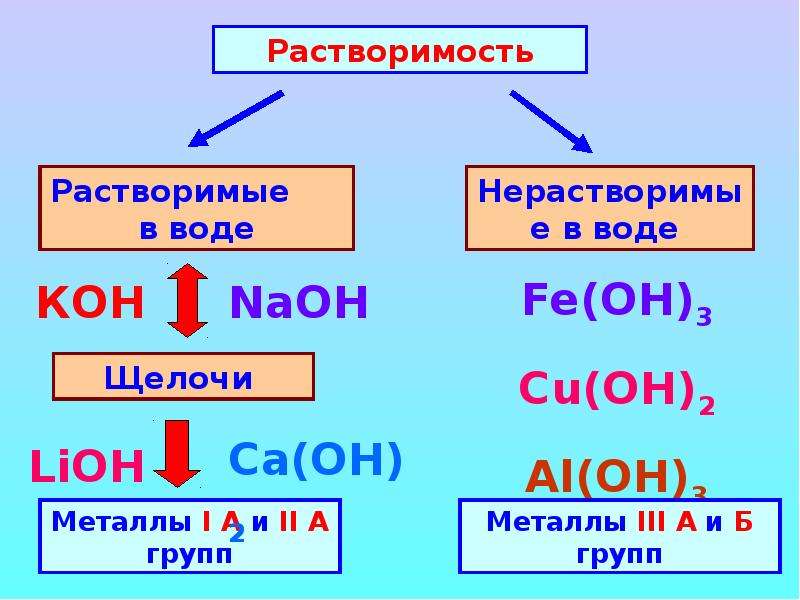 , Fe(OH) 3 , Cu(OH) 2 и т. д.),
, Fe(OH) 3 , Cu(OH) 2 и т. д.), основания, все соли можно условно разделить на 4 группы . Для каждой из этих групп характерен свой «сценарий» гидролиза.
основания, все соли можно условно разделить на 4 группы . Для каждой из этих групп характерен свой «сценарий» гидролиза. Это не имеет значения — то, что растворяется, по-прежнему на 100% ионизировано на ионы кальция и ионы гидроксида. Гидроксид кальция по-прежнему считается сильным основанием из-за 100% ионизации.
Это не имеет значения — то, что растворяется, по-прежнему на 100% ионизировано на ионы кальция и ионы гидроксида. Гидроксид кальция по-прежнему считается сильным основанием из-за 100% ионизации.

 Чем левее, тем слабее основание.
Чем левее, тем слабее основание.

 ) + H 2 O ( л )
H 3 O + ( водн. ) + CH 3 CO 2 — ( водн. )
) + H 2 O ( л )
H 3 O + ( водн. ) + CH 3 CO 2 — ( водн. )


 )
+ H 2 O ( л )
H 3 O + ( водн. ) + CH 3 CO 2 — ( водн. )
)
+ H 2 O ( л )
H 3 O + ( водн. ) + CH 3 CO 2 — ( водн. ) )
)
 7
7 3
3 22
22 1
1 Во всех случаях используются инертные растворители, такие как бензол, циклогексан, тетрагидрофуран и простой эфир. Поскольку эти реакции продолжаются до завершения, стрелки равновесия не нарисованы.
Во всех случаях используются инертные растворители, такие как бензол, циклогексан, тетрагидрофуран и простой эфир. Поскольку эти реакции продолжаются до завершения, стрелки равновесия не нарисованы.