Общие способы получения средних солей — урок. Химия, 8–9 класс.
Соли образуются в результате целого ряда химических превращений. Выбор способа получения каждой конкретной соли зависит от целого ряда факторов, в частности от доступности исходных веществ, а в промышленности определяется в первую очередь экономической целесообразностью.
Разберём некоторые общие подходы к выбору способов получения средних солей.
1. Соли образуются при взаимодействии металлов с неметаллами.
Например, при взаимодействии железа с хлором образуется хлорид железа(\(III\)):
2Fe+3Cl2⟶t°2FeCl3.
При нагревании смеси железа с серой образуется сульфид железа(\(II\)):
Fe+S⟶t°FeS.
2. Соли образуются при взаимодействии металлов с кислотами.
Например, при взаимодействии железа с соляной кислотой образуется хлорид железа(\(II\)):
Fe+2HCl→FeCl2+h3↑.
При взаимодействии магния с серной кислотой образуется сульфат магния:
Mg+h3SO4→MgSO4+h3↑.
3. Из одних солей могут быть получены другие в реакциях замещения с металлами.
Например, сульфат железа(\(II\)) можно получить в реакции взаимодействия железа с сульфатом меди(\(II\)):
Fe+CuSO4→FeSO4+Cu↓.
Нитрат магния можно получить в реакции взаимодействия магния с нитратом серебра:
Mg+2AgNO3→MgNO32+2Ag↓.
4. Соли образуются при взаимодействии основных, кислотных или амфотерных оксидов с оксидами, принадлежащими к другой группе оксидов.
Например, при взаимодействии основного оксида кальция с кислотным оксидом углерода(\(IV\)) образуется карбонат кальция:
CaO+CO2→CaCO3.
При нагревании смеси основного оксида магния с амфотерным оксидом алюминия образуется алюминат магния:
MgO+Al2O3⟶t°MgAlO22.

5. Соли образуются при взаимодействии основных и амфотерных оксидов с кислотами.
Например, сульфат меди(\(II\)) можно получить, используя оксид меди(\(II\)) и серную кислоту:
CuO+h3SO4→CuSO4+h3O.
Хлорид цинка можно получить, используя оксид цинка и соляную кислоту:
ZnO+2HCl→ZnCl2+h3O.
6. Соли образуются при взаимодействии кислотных и амфотерных оксидов с основаниями.
Например, при пропускании оксида углерода(\(IV\)) через раствор гидроксида кальция образуется осадок карбоната кальция (известковая вода мутнеет):
CaOh3+CO2→CaCO3↓+h3O.
При взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуется сульфит натрия:
2NaOH+SO2→Na2SO3+h3O.
7. Соли образуются при взаимодействии кислот с основаниями или с амфотерными гидроксидами.
Например, сульфат меди(\(II\)) можно получить, используя гидроксид меди(\(II\)) и серную кислоту:
CuOh3+h3SO4→CuSO4+2h3O.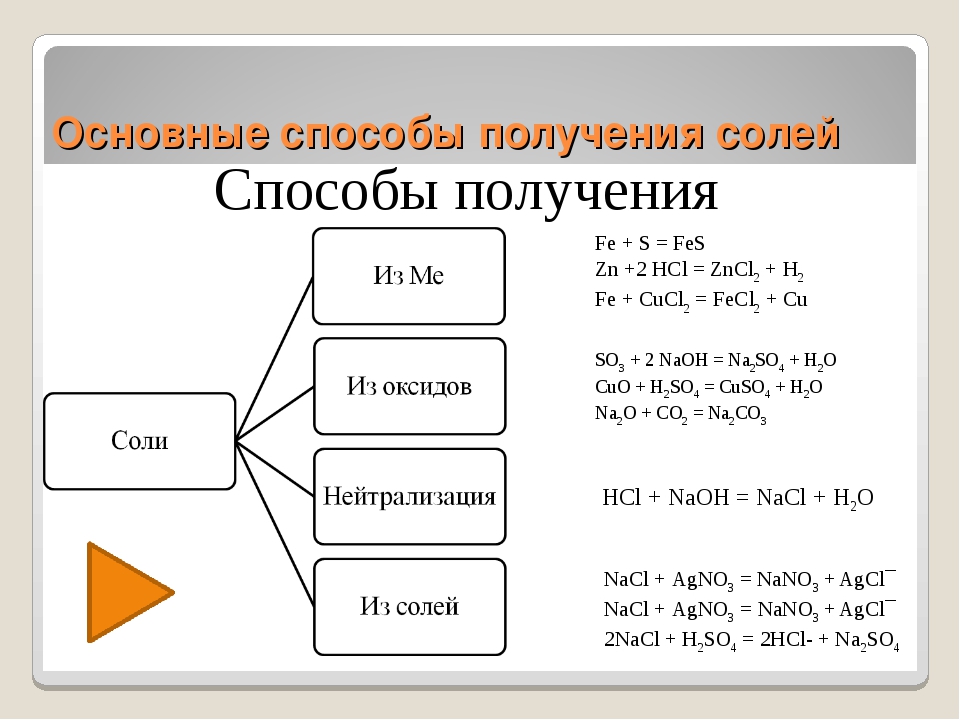
Нитрат алюминия образуется в результате взаимодействия гидроксида алюминия с азотной кислотой:
AlOh4+3HNO3→AlNO33+3h3O.
8. Соли можно получить, используя химическую реакцию обмена, протекающую между кислотой и другой солью.
Например, при взаимодействии сульфида железа(\(II\)) с серной кислотой образуется сульфат железа(\(II\)):
FeS+h3SO4→FeSO4+h3S↑.
Хлорид кальция образуется при взаимодействии соляной кислоты (водного раствора хлороводорода) с карбонатом кальция:
CaCO3+2HCl→CaCl2+h3O+CO2↑.
9.
Соли образуются при взаимодействии щелочей с растворимыми в воде солями.Например, нитрат натрия образуется в результате химической реакции, протекающей между гидроксидом натрия и нитратом меди(\(II\)):
2NaOH+CuNO32→2NaNO3+CuOh3↓.
Сульфат калия образуется в реакции обмена, протекающей между гидроксидом калия и сульфатом железа(\(II\)):
2KOH+FeSO4→K2SO4+FeOh3↓.
10. Соли образуются в реакциях обмена, протекающих между другими солями.
Например, чтобы получить бромид серебра, можно в качестве исходных веществ использовать нитрат серебра и бромид калия:
AgNO3+KBr→AgBr↓+KNO3.
Сульфат бария образуется в реакции обмена, протекающей между сульфатом натрия и хлоридом бария:
Na2SO4+BaCl2→BaSO4↓+2NaCl.
11. Соли можно получить, разлагая некоторые другие соли.
2KClO3⟶катализаторt°2KCl+3O2.
Осадок карбоната кальция образуется при разложении гидрокарбоната кальция:
CaHCO32⇄t°CaCO3↓+h3O+CO2↑.
Химия
СОЛИ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
Получение
5. Важнейшие химические
свойства
6. Специфические свойства
7. Задания
8. Ответы
|
Соли – |
КЛАССИФИКАЦИЯ
По химическому составу соли классифицируют на средние, кислые, основные и двойные.
Отдельным типом солей являются комплексные соли
(соли с комплексными катионами или анионами) . В формулах этих солей
комплексный ион заключён в квадратные скобки.
Комплексные ионы
— это сложные ионы, состоящие из ионов элемента (комплексообразователя)
и связанных с ним нескольких молекул или ионов (лигандов).
Примеры комплексных
солей приведены ниже.
а) С комплексным анионом:
K
K2[PtCl]6 — гексахлороплатинат(IV) калия, К3[Fe(CN)6] — гексацианоферрат(III) калия.
б) С комплексным катионом:
[Cr(NH3)6]Cl3 — хлорид гексаамминхрома (III),
[Ag(NH3)2]Cl
— хлорид диамминсеребра (I)
[Cu(NH3)4]SO4
— сульфат тетраамминмеди
(II)
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые соли при растворении в воде
диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl → Na+
K2SO4 → 2K+ + SO42-
Al(NO3)3 → Al3+ + 3NO3—
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ СОЛЕЙ
1. Металл + неметалл = соль
2Fe + 3Cl2
= 2FeCl3
2. Металл + кислота = соль + водород
Zn + 2HCl
= ZnCl2 + H2↑
3. Металл + соль = другой металл + другая соль
(согласно электрохимическому ряду напряжений металлов)
Fe + CuSO4 = Cu + FeSO4
4. Кислота + основный (амфотерный) оксид = соль
+ вода
3H2SO4+Al2O3=Al2(SO4)3+
3H2O
5. Кислота + основание = соль + вода
H2SO4
+ 2NaOH = Na
При неполной нейтрализации многоосновной кислоты основанием получают кислую соль:
H2SO4 + NaOH = NaHSO4 + H2O
При неполной нейтрализации многокислотного основания кислотой получают основную соль:
Zn(OH)2 + HCl = ZnOHCl + H2O
6. Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4
= BaSO4 + 2HCl
7. Основный (амфотерный) оксид + кислота = соль
+ вода
CaO + 2HCl = CaCl2 +H2O
8. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
9. Кислотный оксид + основание = соль + вода
SO3 + 2NaOH = Na2SO4
+ H2O
10. Щёлочь + соль = основание + другая соль
CuSO4 + 2NaOH
= Cu(OH)2
+ Na2SO4
11. Реакция обмена между солями: соль(1) + соль
(2) = соль(3) + соль(4)
NaCl + AgNO3 =Na NO3
+ AgCl
12. Кислые соли могут быть получены
действием избытка кислоты на средние соли и оксиды:
Na2SO4
+ H2SO4
= 2NaHSO4
Li2O
+ 2H2SO4
= 2LiHSO4 + H2O
13.
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Соль + щёлочь = другая соль + другое
основание
CuCl2 + 2KOH = 2KCl + Cu(OH)2
2. Соль + кислота = другая соль + другая кислота
BaCl2 +
H2SO4
= BaSO4 + 2HCl
3. Соль(1) + соль (2) = Соль(3) + соль(4)
Na2SO4 + BaCl2
=2NaCl + BaSO4
4. Соль + металл = другая соль + другой металл
(согласно электрохимическому ряду напряжений металлов)
Zn + Pb(NO3)2
= Pb + Zn(NO3)2
5. Некоторые соли разлагаются при нагревании
CaCO3 = CaO + CO2
KNO3 = KNO2
+ O2
СПЕЦИФИЧЕСКИЕ ХИМИЧЕСКИЕ СВОЙСТВА
Специфические химические свойства солей зависят от
того, какой катион и какой анион образуют данную соль.
|
Специфические свойства солей по катиону |
Специфические свойства солей по аниону |
|
Ag+ + Cl— = AgCl↓ белый творожистый осадок Cu2+ + 2OH— = Cu(OH)2↓ синий осадок Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический осадок Fe3+ + 3SCN— = Fe(SCN)3 кроваво-красное окрашивание Al3+ + 3OH— = Al(OH)3↓ белый желеобразный осадок Ca2+ + CO32- = CaCO3↓ белый осадок |
Ag+ + Cl— = AgCl↓ белый творожистый осадок Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический осадок 2H+ + SO32- = H2O + SO2↑ газ с резким запахом 2H+ + CO32- = H2O + CO2↑ газ без запаха 3Ag+ + PO43- = Ag3PO4↓ жёлтый осадок 2H+ + S2- = H2S↑ газ с неприятным запахом тухлых яиц |
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
соли, назовите их, определите тип.
Из приведённого перечня выберите
соли, назовите их, определите тип.
1) КNO2
2)
LiOH 3) CaS 4) CuSO4 5) P2O5
6) Al(OH)2Cl 7) NaHSO3 8) H2SO4
Задание 2. С какими из перечисленных веществ
может реагировать а) BaCl2 б)
CuSO4 в)
Na2CO3?
1)Na2O 2)HCl 3)H2O 4) AgNO3 5)HNO3
6)Na2SO4 7)BaCl2 8)Fe
9)Cu(OH)2 10) NaOH
ОТВЕТЫ.
Наверх
Самая соль: новые виды наркотиков привлекли все группы населения | Статьи
Российские социологи зафиксировали появление в обществе наркотиков «выходного дня» и новой схемы их «контролируемого» потребления. Эти данные приводят ученые сектора социологии девиантного поведения Федерального научно-исследовательского социологического центра РАН. В результате действия новой схемы у людей растягивается период приобретения зависимости. Есть риск, что через десятилетие мы можем получить население, вовлеченное в потребление наркотиков во всех возрастных группах, говорят социологи. Результаты исследования социологов подтверждает официальная статистика МВД. Эксперты Минздрава напоминают, что «контролируемое» потребление наркотиков — это миф.
В результате действия новой схемы у людей растягивается период приобретения зависимости. Есть риск, что через десятилетие мы можем получить население, вовлеченное в потребление наркотиков во всех возрастных группах, говорят социологи. Результаты исследования социологов подтверждает официальная статистика МВД. Эксперты Минздрава напоминают, что «контролируемое» потребление наркотиков — это миф.
Согласно официальному ответу МВД на запрос «Известий», в последние годы отмечается трансформация российского нелегального наркорынка в сторону вытеснения наркотиков растительного происхождения синтетическими. Это связано с их относительной дешевизной, доступностью и возможностью изготовления в условиях подпольных нарколабораторий.
С 2011 года удельный вес «синтетики» в общей массе изымаемых наркотических средств постепенно увеличивался. В 2017 году эта доля достигла 26,1%.
При этом, как писали «Известия, в прошлом году заболеваемость наркоманией в России достигла исторического минимума — 11,1 нового случая на 100 тыс. населения. Всего на учете, по данным на 2017 год, состояло 259,5 тыс. больных наркоманией, зафиксировал Минздрав. Это минимальный показатель с 2003-го. Тогда в стране числилось 326,6 тыс. «официальных» наркоманов.
населения. Всего на учете, по данным на 2017 год, состояло 259,5 тыс. больных наркоманией, зафиксировал Минздрав. Это минимальный показатель с 2003-го. Тогда в стране числилось 326,6 тыс. «официальных» наркоманов.
Фото: РИА Новости/Александр Вильф
Некоторые специалисты стали говорить о стабилизации наркоситуации, другие же отказывались признать позитивные изменения, наблюдая за постепенно разворачивающейся новой схемой «контролируемого» потребления наркотиков. Это означает, что потребители не становятся зависимыми за недели и месяцы. Они могут годами использовать наркотик по выходным дням. Однако, по словам специалистов, такое потребление только растягивает период вовлечения в сильную зависимость.
Исследование сектора девиантного поведения Института социологии РАН, поддержанное грантом РФФИ, показывает, что на сегодняшний день наркоситуация в России представляет собой состояние сжатой пружины: через несколько лет общество может быть втянуто в наркопотребление во всех возрастных группах и социальных статусах. Даже пожилые люди сейчас нередко употребляют наркотики.
Даже пожилые люди сейчас нередко употребляют наркотики.
В старших возрастных группах (после 50 лет) выявлена незначительная доля женщин-потребительниц, для которых характерна «аптечная наркомания». По словам старшего научного сотрудника Федерального научно-исследовательского социологического центра РАН Виктории Брюно, это связано с привычкой у пожилых людей к ежедневному употреблению лекарств.
— Нередко всё начинается с того, что пожилая женщина с молодости привыкла снимать головную боль лекарством. Постепенно она увеличивает его дозу, а потом начинает использовать для этого каннабиноиды, — говорит эксперт.
Главная проблема современной наркотизации заключается в том, что рынок заполонили новые — синтетические наркотики. Эти наркотики, часто называемые «легкими» или «тихими», порождают идеологию «безопасного наркопотребления».
Фото: ТАСС/DPA/Frank May
По данным социологов, если в 2007 году «новые наркотики» употребляли лишь в 19 субъектах, то в 2018 году зафиксировано их систематическое использование практически во всех регионах. Ассортимент химических стимуляторов расширяется, и некоторые наркосодержащие препараты, еще не попавшие в запрещенные списки, продаются под видом лекарственных. Также большое распространение получили так называемые дизайнерские наркотики, формула вещества которых меняется для того, чтобы избежать выявления разработанными методами. Сейчас можно говорить уже о четырех поколениях «дизайнерских» наркотиков, которые доступны в России. Особую опасность представляет совместное употребление «новых» наркотических веществ с «традиционными» наркотиками, а также с алкоголем.
Ассортимент химических стимуляторов расширяется, и некоторые наркосодержащие препараты, еще не попавшие в запрещенные списки, продаются под видом лекарственных. Также большое распространение получили так называемые дизайнерские наркотики, формула вещества которых меняется для того, чтобы избежать выявления разработанными методами. Сейчас можно говорить уже о четырех поколениях «дизайнерских» наркотиков, которые доступны в России. Особую опасность представляет совместное употребление «новых» наркотических веществ с «традиционными» наркотиками, а также с алкоголем.
Анализ первых проб наркотика позволил выделить и значимые поколенческие различия. Ранние (до 16 лет) пробы характерны только для двух возрастных групп: 30–39 лет и 24–29 лет. В младшей возрастной группе (18–23 года на момент опроса) и в старшей (40–55) респонденты значительно реже приобретали первый наркотический опыт в таком раннем возрасте. Очень поздние первые пробы (после 30 лет) характерны только для тех, кому сейчас 50–55 лет.
Проведенный учеными мониторинг интернет-ресурсов показал, что в рамку новой модели потребления активно включены люди в возрасте 30–40 лет, семейные, образованные, профессиональные, с высоким уровнем доходов, с устоявшимся кругом интересов — хорошо социально адаптированные.
Фото: ИЗВЕСТИЯ/Павел Бедняков
Причины распространенности наркотиков новой волны ученые видят в установлении более тесных связей между странами, новых возможностях приготовления наркотиков из аптечных средств, расширении рынка психоактивных средств в связи с распространенностью даркнета и росте «серого поля» потребителей. В этой группе находятся те люди, которые не попадают в поле зрения ни правоохранительных органов, ни медиков и имеют иные личностные характеристики и ценностные ориентации, нежели потребители наркотиков конца ХХ века.
Проблема больных и врачейПо словам руководителя сектора социологии девиантного поведения Маргариты Поздняковой, в настоящее время наркоситуация требует особых форм социального контроля и обязательного участия специалистов различных областей знания.
Фото: РИА Новости/Алексей Сухоруков
— Исследование показало, что, к сожалению, в научном сообществе и СМИ проблему наркотиков до сих пор презентуют прежде всего как проблему «больных» и «врачей». При таком подходе снимается ответственность с потребителя наркотиков: индивид не несет ответственности за свою болезнь вследствие того, что он находится в рабской зависимости от психоактивного вещества. То есть сам факт зависимости и делает его больным. Такой подход играет как позитивную, так и негативную роль, однако он упускает из виду личность потребителя как субъекта собственной воли, отказывая ему в способности самостоятельно принимать решения, управлять своей жизнью и соответственно контролировать употребление, — подчеркивает эксперт.
Социолог отмечает, что в среде отечественных медиков, и в первую очередь наркологов, существует общее недоверие к феномену «контролируемого» потребления.
Минздрав предупреждаетДоктор медицинских наук, директор Национального научного центра наркологии — филиала ФГБУ «ФМИЦПН им. В.П. Сербского» Минздрава Татьяна Клименко опровергает возможность «контролируемого потребления».
В.П. Сербского» Минздрава Татьяна Клименко опровергает возможность «контролируемого потребления».
— Это миф, который строится на основе опросов, проводимых социологами. Любой наркоман или алкоголик мечтает достичь контролируемого поведения. На начальных стадиях это получается. Но через некоторое время мы наблюдаем обычное течение болезни, — утверждает эксперт.
Татьяна Клименко подтверждает, что медики также фиксируют изменение структуры потребления наркотиков и связано это прежде всего с выходом на рынок новых наркотиков — солей и спайсов.
— Мы не наблюдаем активного потребления наркотиков лицами пожилого возраста. Основными потребителями остаются всё же молодежь и люди среднего возраста, — подчеркивает эксперт.
Недооцененная опасностьВсе эти данные говорят о том, что социологи правильно «ухватили» саму суть изменений в схеме потребления наркотических средств. По их мнению, общество недооценивает опасность, связанную с вовлечением в употребление наркотиков всех групп населения.
Фото: РИА Новости/Павел Бедняков
В Федеральном научно-исследовательском социологическом центре РАН уверены, что для изменения создавшейся ситуации нужно детально разработать методы профилактики для каждой возрастной группы в отдельности. Также они надеются на повышение научной обоснованности предложений, которые будут внесены в новый документ Стратегии государственной антинаркотической политики Российской Федерации.
ЧИТАЙТЕ ТАКЖЕ
Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.

Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Соль из платины | Наука и жизнь
Объединив цезий, платину и водород, можно получить соединение, которое будет совсем не похоже ни на платину, ни на цезий, ни тем более на водород.
Интерметаллическая двойная платиновая соль – именно так называется соединение, синтезированное химиками из Эймской лаборатории (США). Его название может легко напугать человека, далёкого от химии, однако, разобравшись, что это такое, и преодолев страх перед непонятными словами, мы окажемся перед вполне разумным вопросом: «как?» Как вообще можно получить такое соединение? А человек практического склада ума может спросить ещё и зачем нужны двойные платиновые соли.
Так выглядит металлическая платина. (Фото: Periodictableru, Wikimedia Commons, CCA 3.0)
Жидкий металлический цезий в запаянной ампуле (температура плавления цезия +29 оС). (Фото: Dnn87, Wikimedia Commons, CC BY-SA 3.0)
Слева – раствор итерметаллической соли CsAu (аурид цезия) в аммиаке; справа – та же соль, в кристаллической форме. (Фото: Chemical Society Reviews.)
Кристаллическая структура Cs9Pt4H. (Фото: Ames Laboratory, U.S. Department of Energy.)
Кристаллы двойной интерметаллической платиновой соли и «обычного» платинида цезия. (Фото: Ames Laboratory, U.S. Department of Energy.)
‹
›
То вещество, которое удалось получить исследователям, имеет химическую формулу Cs9Pt4H и представляет собой прозрачные кристаллы красного оттенка. Правда, подержать их в руках не получится: каждый кристалл размером в десять раз меньше миллиметра, а самое главное – они чрезвычайно боятся кислорода и воды. Получали Cs9Pt4H так: смешали вместе порошок мелкодисперсной платины, металлический цезий, а также его гидрид, а затем расплавили смесь дуговым электрическим разрядом. Результат стал неожиданностью даже для экспериментаторов, поскольку обычно продуктом подобных реакций становятся сероватые сплавы, а никак не симпатичные кристаллы.
Получали Cs9Pt4H так: смешали вместе порошок мелкодисперсной платины, металлический цезий, а также его гидрид, а затем расплавили смесь дуговым электрическим разрядом. Результат стал неожиданностью даже для экспериментаторов, поскольку обычно продуктом подобных реакций становятся сероватые сплавы, а никак не симпатичные кристаллы.
Так что же она такое, интерметаллическая двойная соль? Каждое слово здесь определяет класс химических соединений. Самый общий класс, конечно, это соли: кристаллические вещества, состоящие из положительно и отрицательно заряженных частиц. Привычная для нас поваренная соль состоит из ионов натрия (заряженных положительно) и ионов хлора (заряженных отрицательно). Как правило, положительный заряд в солях несут атомы различных металлов, а отрицательный – атомы неметаллов. (Хотя и те, и другие могут быть не одиночными атомами, а группами атомов, разделёнными по тому же принципу.)
Однако наша платиновая соль не простая, а интерметаллическая – то есть и в роли положительной, и в роли отрицательной частицы в ней выступают разные металлы. Тут нужно уточнить отличие интерметаллической соли от металлического сплава. Если вы сплавите вместе два разных металла, то в результате получите некое вещество, свойства которого будут вполне металлическими, пусть и отличающимися от «исходников». Например, металлы в сплавах сохраняют способность проводить электрический ток – это особенность электронной структуры вещества. А вот совсем другой расклад получается, если два металла объединяться в соль – тогда полученное вещество перестаёт быть металлом и начинает проявлять абсолютно другие свойства.
Тут нужно уточнить отличие интерметаллической соли от металлического сплава. Если вы сплавите вместе два разных металла, то в результате получите некое вещество, свойства которого будут вполне металлическими, пусть и отличающимися от «исходников». Например, металлы в сплавах сохраняют способность проводить электрический ток – это особенность электронной структуры вещества. А вот совсем другой расклад получается, если два металла объединяться в соль – тогда полученное вещество перестаёт быть металлом и начинает проявлять абсолютно другие свойства.
Классический пример такой интерметаллической соли – аурид цезия, желтое кристаллическое вещество, которое получается при нагревании металлических цезия и золота. Аурид цезия может, к примеру, растворяться в жидком аммиаке, что, согласитесь, совсем не характерно для металлов. Если же кому-то захочется получить из него золото, то достаточно бросить соль в воду, и в результате реакции выделится вожделенный жёлтый металл. Но коль скоро золото ведёт себя таким образом, то почему бы не последовать за ним и другому благородному металлу – платине?
Сказано – сделано, и в начале 2000-х химики из университета Макса Планка в Германии получают платинид того же цезия, то есть почти ту самую интерметаллическую платиновую соль. Осталось только сделать её двойной. Соль называют двойной, если в ней есть две разные положительно заряженные частицы и одна заряженная отрицательно, или же наоборот, как в случае с нашей сложной солью, Cs9Pt4H, которую синтезировали сотрудники Эймской лаборатории. (Полностью результаты их экспериментов описаны в статье в Angewandte Chemie.)
Осталось только сделать её двойной. Соль называют двойной, если в ней есть две разные положительно заряженные частицы и одна заряженная отрицательно, или же наоборот, как в случае с нашей сложной солью, Cs9Pt4H, которую синтезировали сотрудники Эймской лаборатории. (Полностью результаты их экспериментов описаны в статье в Angewandte Chemie.)
Атомы цезия здесь играют роль положительно заряженных частиц, а платина и водород – отрицательно заряженных. В таком веществе платина больше напоминает по свойствам хлор в поваренной соли, нежели какой-то металл. Синтез таких нестандартных соединений – это не просто удовлетворение химического азарта, вроде «смотрите, какие вещества мы умеем варить» (хотя, конечно же, без него не обходится). Такие вещества с необычными конфигурациями элементов проявляют нестандартные свойства, в том числе вызванные различными электронными эффектами. Например, стабильность интерметаллических солей платины связана с проявлением релятивистских эффектов, которые характерны для «тяжёлых» атомов.
Так что даже неорганическая химия даже в наше время может дарить необычные сюрпризы, вроде таких вот неожиданных веществ. Да и согласитесь, ведь просто забавно из двух самых настоящих металлических металлов получить «неметаллические» маленькие красные кристаллы.
ЗАДАНИЯ ПО ХИМИИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ПО ТЕМЕ «СОЛИ»
ЗАДАНИЯ ПО ХИМИИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ПО ТЕМЕ «СОЛИ»- Срок Нет даты выполнения
- Баллы Нет
|
1. Закончите уравнения реакций. Определите, какие соли (средние, кислые, основные) получаются при данном мольном соотношении реагентов. Назовите эти соли. |
|
|
Исходные вещества |
Продукты реакции |
|
2NaOH + H2SO4 = |
|
|
KOH + H2SO4 = |
|
|
3Ca(OH)2 + 2H3PO4 = |
|
|
Ca(OH)2 + H3PO4 = |
|
|
Ca(OH)2 + HBr = |
|
|
Ca(OH)2 + 2HBr = |
|
|
2. |
|
|
3. Напишите формулы следующих солей |
|
|
Название соли |
Формула |
|
хлорид натрия |
|
|
нитрат натрия |
|
|
гидросульфат калия |
|
|
нитрат серебра |
|
|
гидрокарбонат натрия |
|
|
сульфид натрия |
|
|
нитрат алюминия |
|
|
сульфат железа (III) |
|
|
4. |
|
|
Исходные вещества |
Продукты реакции |
|
AgNO3 + FeCl3 = |
|
|
Na2S + HCl = |
|
|
Ba(NO3)2 + Al2(SO4)3 = |
|
|
(NH4)2SO4 + KOH = |
|
|
K2S + HNO3 = |
кислая соль + … |
|
Mg(OH)2 + H2SO4 = |
основная соль + . |
0
Критерий оценки
Невозможно изменить критерий оценки после того, как вы начали использовать его.Заголовок
Вы уже оценили студентов с помощью этого критерия оценки. Серьезные изменения могут повлиять на результаты оценки.
Для создания записей видео и звука на компьютере должна быть включена веб-камера. Если на компьютере отсутствует веб-камера, можно записывать звуковые сообщения, установив подключаемый модуль Google Video Chat.
Про соль с точки зрения химика / Хабр
На самом деле этот пост был подготовлен еще в апреле 2014 года, я не смог тогда его опубликовать. Являлся вторым в ожидавшейся серии. Можете глянуть
первый. На эту тему писать меня сподвигло желание внести немного ясности в представления о некоторых химических аспектах нашего бытия. Пользуясь тем, что химия — наука, не слишком популярная в массах, нам иногда рекламщики и пресса выдают такие перлы, что у меня не хватает слов для описания эмоций. Так что попробуем слегка рассеять туман, ну и чтоб это было интересно и актуально для наших условий. Недавно встретил похожую переводную публикацию, тоже про соль. Серьёзную и хорошо сделанную, правда, слегка не о нашей действительности.
Пользуясь тем, что химия — наука, не слишком популярная в массах, нам иногда рекламщики и пресса выдают такие перлы, что у меня не хватает слов для описания эмоций. Так что попробуем слегка рассеять туман, ну и чтоб это было интересно и актуально для наших условий. Недавно встретил похожую переводную публикацию, тоже про соль. Серьёзную и хорошо сделанную, правда, слегка не о нашей действительности.
Итак — про соль
Так в Африке ею и торгуют. Толщина кусков, вероятно определяется толщиной пласта. Слабенькие пласты.
Солить или не солить. А зачем вообще соль, может лучше без неё? Заменитель соли? Ценная соль с минералами и розового цвета — а зачем козе баян? Рекламные посты — хороший способ приготовить лапшу на уши.
Итак, продолжим наши игры. Сегодня начнем, в меру сил и способностей, прояснять ряд кухонных вопросов, ведь химия — это не только скучные строчки в учебнике. Химия окружает нас и даже, варится внутри нас, это также новые материалы и технологии, окружающие нас. Да, микросхему не сделаешь, без химически сверхчистого и однородного кристалла кремния или другого полупроводника.
Да, микросхему не сделаешь, без химически сверхчистого и однородного кристалла кремния или другого полупроводника.
Вопросы, что есть и как готовить, что, где содержится ядовитого — любимая тема интернет-изданий. Если всё это прочитать, а ещё, не дай Бог, всему этому поверить, в голове точно шарики за ролики зайдут. Постараемся не спеша, разобраться в сегодняшней теме.
Соль и соль, что с неё взять… Ага! Пищевая добавка, эта Ваша соль. Ядовитая. Смертельная доза для среднего человека 200 грамм. Соль настолько искажает вкус продуктов, что мы начинаем их есть в количествах, больших достаточных. Про невкусность продуктов без соли — проверяйте, не боюсь. Избыток соли повышает артериальное давление и кислотность, он вообще вреден, как и избыток еды вообще. Просто беда. Вроде правда. Но это не 100% правды, даже в очень чёрном, есть немножко белого и наоборот. А, казалось бы, натуральный продукт, да еще и древний — в основном, мы едим соль из древних морских отложений, так что современных технологических загрязнений и радиации (современной, созданной человеком) там быть не может. Почему-то об этом забывают говорить в рекламе. А чего её рекламировать — самый дешёвый продукт.
Почему-то об этом забывают говорить в рекламе. А чего её рекламировать — самый дешёвый продукт.
Солевой пласт. Видны слои отлагавшейся в древности соли
Соль бывает каменная — это дроблёный пласт древнего высохшего моря, в нём попадаются древние песчинки, и есть примеси естественных морских солей калия, кальция, магния. Эти-то примеси и оказывают благотворное влияние на жёсткость квашеных огурцов.
Выварочная или соль Экстра, это соль, очищенная перекристаллизацией, и от примесей, и от песчинок.
А вот так добывают каменную соль. Толщина пласта, не то что в Африке
Ещё туда добавляют немного соединений йода — такая соль может попахивать йодом, но сильно злобствовать на этот счёт не надо, йод предохраняет от ряда серьёзных проблем со здоровьем. Когда их нет, мы их склонны недооценивать, а случись они у нас, страдали бы потом всю жизнь. Так что терпим благосклонно. Причём я-то живу у моря, на побережье с йодом лучше, но ем и не жужжу.
Теперь вопрос — а если мы вообще не будем употреблять соль в пищу? Если питаться продуктами совсем без соли, да при большой нагрузке, да еще при жаре — можно даже умереть. От нехватки соли. Соль выводится с потом, тот самый хлористый натрий(и не только). Тепловой удар, если кто с ним сталкивался, это и есть нарушение водно-солевого обмена.
Тут мы немного поговорим как используется соль в организме, потому что, важность соли для организма не только в её участии в образовании из неё соляной кислоты для переваривания пищи. Это, как в той истории про боксёра, у которого спросили, зачем ему голова. — «А ещё, я в неё ем» — был ответ. Соль в растворе, состоит большей частью, из ионов натрия и хлора, и используется нашим организмом в механизме передачи нервных импульсов — сигналов, идущих от клетки к клетке. Это значит, что любые движения нашего тела и органов, происходят не без участия соли. Как это работает: — Понятно, что в теле проводов нет, поэтому клетки обходятся своими отростками — иногда довольно длинными, их называют аксонами и дендритами. Но важно не это, важно то что клетке надо передать сигнал действия другой клетке. Это делается электрическим путем.
Но важно не это, важно то что клетке надо передать сигнал действия другой клетке. Это делается электрическим путем.
А электрический потенциал участок клетки получает за счет разности концентраций калия и натрия. По принципу действия, это похоже на действие батарейки — ионы туда — сюда, и вот уже есть ток. Для того, что бы этот механизм работал, в клетке поддерживается повышенная концентрация ионов калия, а снаружи, в межклеточном пространстве, больше натрия. Когда надо передать сигнал действия, клетка в этом месте меняет соотношение калий-натрий(открываются каналы, пропускающие внутрь натрий или другие каналы, пропускающие калий наружу). Понятно, что соотношение концентраций натрия-калия должно выдерживаться очень точно — если оно нарушается, нарушается передача импульсов. Жизнь останавливается. Отсюда мы можем понять, почему кардиологи, так носятся с этим калием -он очень, очень важен— сердце самый важный мускульный орган и если в нем проблемы с импульсами -плохо всему организму.
Так же из соли, наш желудок приготавливает соляную кислоту, которой и переваривает пищу. Избыток кислоты приводит к изжоге, различным воспалениям, вплоть до язвы. Недостаток — не позволяет нормально переваривать пищу.
Так что опять — всё хорошо в меру, соль тоже.
При жаре, большой физической нагрузке, вместе с потом, выводится значительное количество соли. Именно соли, живой организм старается удерживать соли калия. При этом могут возникнуть нарушения баланса натрий/калий — тепловой удар.
Некогда в Германии судили медсестру — массовую убийцу. На деле она убивала безнадёжных больных, вероятно из жалости. Инъекцией хлористого калия, как сообщали в прессе. Равновесие нарушалось и…
Так что, давайте поговорим о модных и дорогих разновидностях соли: — морской и гималайской. Их пропагандируют как полезную альтернативу обычной «белой смерти». Понятную и верную информацию очень трудно выудить среди рекламных публикаций. Ложь, незнание, передергивание — в итоге, умудряются так объяснить вопрос, что и у меня — человека с хорошим химическим образованием, голова кругом идет. Сначала я попытался выяснить состав продажной морской соли: — 97-98.5% хлористый натрий, остальное, как сказано: « 1,5-3 % — это извлеченные из морской воды полезные макро- и микроэлементы (калий, кальций, магний, йод и др.).» Причем сайт даже ничего не скрывает — заголовок — «развод по-русски»
Сначала я попытался выяснить состав продажной морской соли: — 97-98.5% хлористый натрий, остальное, как сказано: « 1,5-3 % — это извлеченные из морской воды полезные макро- и микроэлементы (калий, кальций, магний, йод и др.).» Причем сайт даже ничего не скрывает — заголовок — «развод по-русски»
Морская соль — модный аксессуар
Может, это я такой без чувства юмора, а там тонкий стёб?.. Нууу, очень тонкий.
Господи, прошу дай мне терпения! «Извлеченные из морской воды полезные макро и микро элементы…»никто их не извлекал. В мелкой луже происходит выпаривание морской воды, в таких условиях начинает выпадать в первую очередь соль, чем мельче лужа и жестче (то есть быстрее процесс) выпаривание, тем больше примесей из морской воды захватывают кристаллы соли. Выпавшие на дно кристаллы сгребают в зависимости от технологии — чем-нибудь. Это и есть продукт. Оставшийся рассол сливают — в нем осталось мало соли и много солей калия и магния- а они горькие. Поэтому получается, что в зависимости от момента сгребания кристаллов может очень сильно меняться состав соли.
А вот так добывают морскую соль
Состав океанской воды, взял из Википедии. В океанской воде(я взял данные по ней, хотя они и не сильно различаются по морям — но океанская вода, она основа) -почти 78% натрий хлористый, сиречь — соль. Остальные примеси — ионы магния — 3,7% (если считать по чистому магнию), кальция — 1,2% (то же), калия 1,1%, в форме хлоридов, сульфатов и даже бромидов. Остальное до суммы 100%- придется на сульфат, хлорид и бромид — ионы, связанные с этими кальцием, магнием и калием — мы ведь считаем их, по чистым ионам. Естественно, содержатся и почти все остальные элементы, но уже вовсе, в ничтожных количествах. Не без труда, удалось найти более подробные данные по составу пищевой морской соли: — кальций — не больше 0,5 %, калий 0,2%, магний — 0,1% Как видим, гораздо беднее состава морской воды. Попробуем посчитать, какую долю минеральных веществ мы получим из «морской соли». Будем считать, что съедаем 10 грамм соли в день -это вообще-то многовато, ведь есть соль в хлебе, колбасе и т. д. Получилось что в 10 граммах «морской соли» -содержится 3% рекомендованной дневной нормы (RPN) магния, 6% — кальция, и 1,1 процента калия. Впрочем, состав такой соли может меняться в разы от партии к партии, что тоже не воодушевляет. По йоду морская соль в 40 раз беднее йодированной — технология такая, часть улетучивается, йод — он такой, да его туда и не добавляют, сколько есть, столько есть. В йодированную соль, добавляют более стойкое соединение йода — йодат калия (он не так выветривается), и то, за год, взаимодействуя с кислородом и углекислотой воздуха, йод испаряется почти полностью. Так что рассматривать морскую соль как источник минералов неправильно. Немного развлечёмся, почитаем дальше про соль, а я покомментирую. Очень восхитило выражение «путем вакуумного выпаривания рассола практически все полезные соединения разрушаются – в такой соли остается 99,9 % NaCl. Такую соль называю «белой смертью», потребление которой следует строго ограничивать» Как понять — хлорид калия или сульфат магния разрушатся от выпаривания? Это же не витамины, которые превратятся во что-нибудь менее ценное, простым солям разрушаться дальше некуда, причём от вакуумного выпаривания.
д. Получилось что в 10 граммах «морской соли» -содержится 3% рекомендованной дневной нормы (RPN) магния, 6% — кальция, и 1,1 процента калия. Впрочем, состав такой соли может меняться в разы от партии к партии, что тоже не воодушевляет. По йоду морская соль в 40 раз беднее йодированной — технология такая, часть улетучивается, йод — он такой, да его туда и не добавляют, сколько есть, столько есть. В йодированную соль, добавляют более стойкое соединение йода — йодат калия (он не так выветривается), и то, за год, взаимодействуя с кислородом и углекислотой воздуха, йод испаряется почти полностью. Так что рассматривать морскую соль как источник минералов неправильно. Немного развлечёмся, почитаем дальше про соль, а я покомментирую. Очень восхитило выражение «путем вакуумного выпаривания рассола практически все полезные соединения разрушаются – в такой соли остается 99,9 % NaCl. Такую соль называю «белой смертью», потребление которой следует строго ограничивать» Как понять — хлорид калия или сульфат магния разрушатся от выпаривания? Это же не витамины, которые превратятся во что-нибудь менее ценное, простым солям разрушаться дальше некуда, причём от вакуумного выпаривания. К слову — самый щадящий способ, температура-то процесса — градусов 30, в отсутствие кислорода воздуха. Даже витамины не разрушаются. Только я лично, сомневаюсь, что такую дорогую технологию будут применять для приготовления просто очищенной соли. Не зачем. Может писавший имеет в виду те 2% примесей, которые отделяются при очистке? Да, они полезны, но с питьевой водой мы их получаем гораздо больше. Итак, в очищенной соли, действительно 99,9% натрия хлористого. Нам говорят, что это называют «белой смертью». Значит морскую соль, в которой натрия хлористого на 2-3% меньше, надо называть «на 98% белой смертью». Рекламщик не знает того, что учёные доказали еще 250 лет назад — вещества не исчезают и не появляются ниоткуда (Ещё солнце наше М.В.Ломоносов занимался). А ещё, он утверждает, что из-за двух — трёх процентов примесей, остальные 97-98% стали мёдом. На лицо попытка сделать бочку мёда из… э-э-э — доступных веществ и ложки мёда. В реальности, вред уменьшился лишь на два-три процента, да и то, при условии, что Вы не станете солить больше, чтобы компенсировать недосол.
К слову — самый щадящий способ, температура-то процесса — градусов 30, в отсутствие кислорода воздуха. Даже витамины не разрушаются. Только я лично, сомневаюсь, что такую дорогую технологию будут применять для приготовления просто очищенной соли. Не зачем. Может писавший имеет в виду те 2% примесей, которые отделяются при очистке? Да, они полезны, но с питьевой водой мы их получаем гораздо больше. Итак, в очищенной соли, действительно 99,9% натрия хлористого. Нам говорят, что это называют «белой смертью». Значит морскую соль, в которой натрия хлористого на 2-3% меньше, надо называть «на 98% белой смертью». Рекламщик не знает того, что учёные доказали еще 250 лет назад — вещества не исчезают и не появляются ниоткуда (Ещё солнце наше М.В.Ломоносов занимался). А ещё, он утверждает, что из-за двух — трёх процентов примесей, остальные 97-98% стали мёдом. На лицо попытка сделать бочку мёда из… э-э-э — доступных веществ и ложки мёда. В реальности, вред уменьшился лишь на два-три процента, да и то, при условии, что Вы не станете солить больше, чтобы компенсировать недосол. На практике, примеси магния и кальция могут заметно повлиять на жесткость огурцов при квашении и варёных овощей при варке — из-за содержания солей магния и кальция, правда доля магния и кальция из водопроводной воды, в масштабах нашего потребления велика. Кстати, мощные осмотические (мембранной технологии) системы очистки воды могут существенно снизить содержание этих важных элементов в питьевой воде. Это надо просто учитывать в своём рационе, чтоб потом не случилось неприятностей типа частых переломов костей и быстрого разрушения зубов. И крохи из морской соли тут не помогут. Молочные продукты, минеральная вода и т. д. Верный сигнализатор малого содержания кальция/магния в воде — отсутствие накипи в чайнике.
На практике, примеси магния и кальция могут заметно повлиять на жесткость огурцов при квашении и варёных овощей при варке — из-за содержания солей магния и кальция, правда доля магния и кальция из водопроводной воды, в масштабах нашего потребления велика. Кстати, мощные осмотические (мембранной технологии) системы очистки воды могут существенно снизить содержание этих важных элементов в питьевой воде. Это надо просто учитывать в своём рационе, чтоб потом не случилось неприятностей типа частых переломов костей и быстрого разрушения зубов. И крохи из морской соли тут не помогут. Молочные продукты, минеральная вода и т. д. Верный сигнализатор малого содержания кальция/магния в воде — отсутствие накипи в чайнике.
Продолжим — крупные крупинки соли приятны на вид, и медленно растворяются, потому приятны на вкус. А вот ещё, посмотрим рекламный фрагмент, — вообще достойно «занесения в анал к историкам»:- «Во-первых, находящаяся в недрах Земли соль, подвергается воздействию высоких давлений и температур, становится пластичной и благодаря этому выходит на поверхность Земли, создавая огромные пики. Что происходит с 1,5-3% элементов в это время? Большая часть из них распадается…» У-у-у, атомы распадаются от давления, силен мужик, руками рельсы рвёт. Температуры высокие. Явно перепутал высохшее древнее море с кимберлитовой трубкой, где рождались алмазы. И где у нас такие огромные пики соли в Украине? А в Саксонии? А в Белоруссии? Древнее море было большим, испарялось медленно, потому разделение получилось очень хорошим, примесей немного, но это как где. Да, земная поверхность двигалась, изгибалась, но важно что верхние слои не пропустили вниз воду, а то соль вымыло бы. В Саксонии, больше 150 лет назад, когда начинали разведку соляных пластов, хотели даже остановить работы, потому что верхние слои были богаты сульфатами калия, магния, а соли было мало. Это теперь калийные соли — очень ценятся. Тогда было не так. Только когда пробурились поглубже, пошла хорошая соль и люди поняли какая ценность там лежит.
Что происходит с 1,5-3% элементов в это время? Большая часть из них распадается…» У-у-у, атомы распадаются от давления, силен мужик, руками рельсы рвёт. Температуры высокие. Явно перепутал высохшее древнее море с кимберлитовой трубкой, где рождались алмазы. И где у нас такие огромные пики соли в Украине? А в Саксонии? А в Белоруссии? Древнее море было большим, испарялось медленно, потому разделение получилось очень хорошим, примесей немного, но это как где. Да, земная поверхность двигалась, изгибалась, но важно что верхние слои не пропустили вниз воду, а то соль вымыло бы. В Саксонии, больше 150 лет назад, когда начинали разведку соляных пластов, хотели даже остановить работы, потому что верхние слои были богаты сульфатами калия, магния, а соли было мало. Это теперь калийные соли — очень ценятся. Тогда было не так. Только когда пробурились поглубже, пошла хорошая соль и люди поняли какая ценность там лежит.
Ах да! Ещё одно свойство соли с примесями — она заметно сильнее слёживается.
Следующим пунктом поговорим про розовую гималайскую соль — нашел, вроде бы, честный пост про неё. Подземная каменная соль, окрашенная слегка солями железа — ну было в том древнем море много железа, не страшно. И тут- фанфары! — «По разным данным, гималайская соль содержит от 82 до 92 микроэлементов, в то время, когда в обыкновенной поваренной их всего — 2.» Какие 92 микроэлемента, последний не искусственный элемент — уран, номер 92. Отнимем инертные газы, их 6 и технеций, его совсем нет в природе, он искусственно получен, потому так и называется. Почему инертные газы — а они ни с чем не реагируют в природе, вот и не удержаться им в соли. Да и зачем они нам, если они никак не воздействуют на организм. На самом деле, при больших давлениях этих газов, немного влияют на ту самую передачу импульсов, и получается нечто вроде опьянения. Но где соль, а где 10 атмосфер ксенона. Итак, получилось 85, считая с полонием и другими менее опасными ядами. Нашел я выписку этих анализов. Вот ведь, не поленились анализы делать на элементы, которых в природе почти нет. Реально нашли около 30 элементов, остальные цифры показывают, что содержание ниже чувствительности применявшегося метода или его нет в природе, так как не стоек. Причем чувствительность хорошая -1 миллиграмм на тонну. Впрочем и в морской воде, и в нас, всё это тоже найдётся. Всё дело в точности анализа. Охмуреж. Делается вывод что нашли, хотя опыт показал, что не нашли. Где логика? Да и с микроэлементами не так — в энциклопедии дается такое определение микроэлементов: «химические элементы, необходимые живым организмам для обеспечения нормальной жизнедеятельности». Их не так много — штук 15, до 30. Так что на самом деле — соль как соль, правда красивая и кристаллики приятные.
Реально нашли около 30 элементов, остальные цифры показывают, что содержание ниже чувствительности применявшегося метода или его нет в природе, так как не стоек. Причем чувствительность хорошая -1 миллиграмм на тонну. Впрочем и в морской воде, и в нас, всё это тоже найдётся. Всё дело в точности анализа. Охмуреж. Делается вывод что нашли, хотя опыт показал, что не нашли. Где логика? Да и с микроэлементами не так — в энциклопедии дается такое определение микроэлементов: «химические элементы, необходимые живым организмам для обеспечения нормальной жизнедеятельности». Их не так много — штук 15, до 30. Так что на самом деле — соль как соль, правда красивая и кристаллики приятные.
Розовая гималайская соль — гламурненькая
Так что кушайте ту соль, какая нравится, но помните — это просто соль. Морская и каменная — с примесями магния, кальция, калия, что иногда неплохо. Соль очищенная, мелкая — хорошо сыплется. Главное, не драматизируйте вопрос выбора — хорошее настроение, очень важный фактор нашего самочувствия.
Но есть другие варианты замены соли — соль где сильно снижено содержание хлорида натрия. Заменой на что-нибудь другое. Это уже в случае, когда явно нельзя, но очень хочется. Это уже с медиками и конкретно. Я встречался только с одним из них — солью в которой 30% соли и 70% хлористого калия. Конечно, вкус сильно отличается — если лизнуть, то даже жгучий, но для сердечно-сосудистой системы калий очень нужен, так что это вполне себе вариант, кому актуально. Я немного использую. Но не увлекайтесь! Избыток калия тоже может быть опасен! В случае проблем с почками.
Соль с содержанием хлористого калия 70%
Выводы: Какая соль вам нравится, такую и кушайте. Замена на морскую соль — ничего не решит. Просто солите меньше. Йодированную не избегайте. Каменная — хороша для засолки огурцов, да и вообще неплоха. Морская и Гималайская — красиво смотрятся в солонке.
Классическая соль. Главное — не пересаливать.
В заключение добавлю, что есть еще такое интересное применение соли и шахт остающихся от её выработки — лечение астмы и других заболеваний лёгких. Глубоко под землю не добирается пыльца растений, бактерии и всякая пыль, там сухо. В солевой шахте, в воздухе находятся, в основном, мелкие частицы соли. Специалисты расскажут подробнее, но лечение пребыванием в соляных выработках, уже давно известно и отзывы о нём были самые положительные.
Глубоко под землю не добирается пыльца растений, бактерии и всякая пыль, там сухо. В солевой шахте, в воздухе находятся, в основном, мелкие частицы соли. Специалисты расскажут подробнее, но лечение пребыванием в соляных выработках, уже давно известно и отзывы о нём были самые положительные.
В белорусских соляных шахтах. Дети подземелья 8).
Прошу заметить — то что я рассказываю, это не запрет и не приказание как жить. Это значит, что сейчас считается, что так делать лучше, а я постарался в этом разобраться и донести это до Вас. В конце концов, ведь не все мы делаем зарядку, хотя это и полезно?
Если этот пост понравился, есть ещё про сахара/углеводы: Про сахар. Какие бывают сахара. Про кленовый сахар и сахар ли он? Что общего у омара, тарантула, ёлки, гриба, мёда и ракеты «Кассам». Ставим химический опыт по превращению крахмала… Как блеснуть эрудицией. Фруктоза — польза и вред, две стороны вопроса. Кто виноват в том, что от молока болит живот. Как получается, что кислое варенье меньше засахаривается. Из чего делают сахар. Про тростниковый сахар — едим ради его вкуса.
Из чего делают сахар. Про тростниковый сахар — едим ради его вкуса.
Получение солей из кислот и оснований — Получение солей — Eduqas — GCSE Chemistry (Single Science) Revision — Eduqas
Растворимая соль может быть получена путем взаимодействия кислоты с подходящим нерастворимым реагентом, включая:
- металл
- металл оксид
- карбонат
Выбор нерастворимого реагента зависит от конкретной необходимой соли. Например, медь не реагирует с разбавленными кислотами, поэтому соли меди получают с использованием оксида меди (II) или карбоната меди (II), а не металлической меди.С другой стороны, натрий слишком реактивен, чтобы его можно было безопасно использовать — опять же, металл не используется для производства солей натрия.
Поскольку в результате реакции между металлами и кислотами образуется легковоспламеняющийся водород, химики обычно получают соли путем реакции оксида металла или карбоната металла с кислотой.
Название соли
Название соли состоит из двух частей. Первая часть происходит из металла, оксида металла или карбоната металла. Вторая часть происходит от кислоты:
- соляная кислота дает хлоридные соли
- азотная кислота дает нитратные соли
- серная кислота дает сульфатные соли
В таблице приведены некоторые примеры солей, полученных с помощью различных комбинаций нерастворимых реагентов и кислот .
| Соляная кислота | Серная кислота | Азотная кислота | |
|---|---|---|---|
| Оксид меди (II) | Хлорид меди (II) | 1n708zi2zm2.0.0.0.1:0.1.0.$0.$2.$4.$2.$0.$2″> Сульфат меди (II) | Нитрат меди (II) |
| Гидроксид алюминия | Хлорид алюминия | Сульфат алюминия | Нитрат алюминия |
| Карбонат цинка | Хлорид цинка | 1n708zi2zm2.0.0.0.1:0.1.0.$0.$2.$4.$2.$2.$2″> Сульфат цинка | Нитрат цинка |
Получение соли
Этот метод показывает, как растворимый соль производится из кислоты и нерастворимого реагента.Чтобы проиллюстрировать метод, используются соляная кислота и карбонат цинка:
- Добавьте немного разбавленной соляной кислоты в химический стакан.
- Добавьте порошкообразный карбонат цинка в немного кислоты, по одному шпателю за раз, перемешивая, чтобы перемешать. Смесь закипит.
- Продолжайте добавлять порошок, пока он не станет избытком (остается некоторое количество непрореагировавшего порошка).

- Отфильтруйте смесь в химическом стакане, чтобы удалить излишки карбоната цинка.
Чистые сухие кристаллы хлорида цинка можно получить путем кристаллизации, затем фильтрации для удаления избытка раствора с последующей сушкой на часовом стекле или в теплой духовке.
Причины для каждой стадии
- кислота нагревается, чтобы ускорить реакцию
- смесь будет шипеть, потому что реакция кислоты с карбонатом дает газообразный диоксид углерода
- если имеется избыток твердого реагента, все кислоты будет реагировать
- $3″> непрореагировавший нерастворимый реагент удаляется, оставляя раствор, содержащий только соль и воду
Как определить соль? — Соляная библиотека
Говоря простым языком, соль — это то, что мы используем в повседневной жизни в основном для приготовления пищи или придания вкуса еде, не так ли? Однако как определить соль в химии?
Как Koyuncu Salt, ведущий турецкий экспортер соли, мы объясним такие важные темы, как: как определить соль? Какой самый простой способ определить соль при анализе соли? и как сделать простой анализ соли? Приступим.
Что такое соль в химии?
Чтобы ответить на вопрос «как определить соль?» нужно понимать, к чему относится соль в химии. В химии соль — это химическое соединение, получаемое в результате реакции кислоты с основанием. Соль состоит из двух противоположно заряженных ионов; положительный ион (катион) основания и отрицательный ион (анион) кислоты.
Химическая реакция , в результате которой образуется соль, называется нейтрализацией, которая происходит между кислотой и основанием.Обычно соль также относится к поваренной соли, которая состоит из натрия и хлорида (NaCl). Обычно соль состоит из положительных ионов металла (Na1 +) и отрицательных ионов неметалла (CI1-).
Как соль связана вместе?
Прежде всего, вам нужно понять, как образуются ионы, чтобы понять, как соли связаны друг с другом. Ионы образуются двумя способами.
Положительный ион : Когда атом теряет электрон, он становится катионом. Теряя отрицательно заряженный электрон, атом становится положительным.
Отрицательный ион : атом может получить электрон, чтобы стать анионом, что связано с правилом октетов , как обычно говорят химики. Это означает, что атом может получить стабильность за счет восьми валентных или внешних электронов. Потеря или получение электронов для образования иона — способ добиться этого.
Итак, когда металлический натрий встречается с газообразным хлоридом, они оба образуют ионы, и происходит реакция. В результате натрий приобретает положительный заряд, и два противоположно заряженных иона связываются вместе.
Свойства соли
Можно ответить на вопрос «как определить соль?» путем проведения солевого анализа. Тем не менее, мы обсудим темы анализа соли и «как вы делаете простой анализ соли?» позже в статье. А пока давайте рассмотрим свойства соли, которая в первую очередь делает соль «солью».
● Соль имеет строго упорядоченное образование молекул, которое придает ей форму кристаллической структуры или белого кристаллического порошка.
● Соль прозрачная и бесцветная.
● При определенных условиях растворяется в воде.
● Соль также гигроскопична, что означает, что она может впитывать влагу из влажной атмосферы (относительная влажность выше 75% или высыхает)
● Плавится при 801 ° C.
● Он начинает испаряться при температуре чуть выше 1413 ° C.
● Соль — это электролит. Растворяясь в воде, соль создает свободно текущие ионы и заставляет воду проводить электричество.
Теперь, когда мы рассмотрели основную информацию для идентификации соли как химического соединения в целом, мы можем более подробно остановиться на том, «как вы можете идентифицировать соль?» путем определения солевого анализа.
Что такое анализ соли?
Также известный как систематический качественный анализ или качественный неорганический анализ , солевой анализ — это идентификация катиона и аниона неорганической соли. Этот анализ проводится путем систематической серии тестов и наблюдений, чтобы доказать отсутствие или присутствие катионов и анионов.
Как сделать простой анализ соли?
Как указано выше в определении солевого анализа, соль может быть идентифицирована путем проведения солевого анализа, который выявляет ее катионы и анионы. Тогда как проще всего определить соль при анализе соли? Давайте разберем анализ соли на шаги, чтобы получить лучший ответ на вопрос «как вы проводите простой анализ соли?»
Шаг № 1 Приобретите неорганическую соль, которую вы определите.
Step # 2 Сделайте предварительные тесты на анионы, пока не получите положительный результат.
Шаг № 3 Проведите предварительные тесты на катионы, как только вы получите положительные результаты предварительных тестов на анионы, и тестируйте, пока не получите положительный результат.
Шаг № 4 Проведите подтверждающие тесты для обоих после получения положительных результатов.
Шаг № 5 Как только вы определите катионы и анионы, получите химическую формулу соли, уравновешивая заряды.
Как определить простую соль
Существует определенная базовая процедура определения соли, которой можно следовать.
1. Посмотрите на внешний вид соединения
Обычно соединение находится в твердой форме. Более того, как мы упоминали ранее, говоря о свойствах соли, она имеет кристаллическую форму и прозрачный или белый цвет. Однако ионы переходных элементов могут быть окрашены. Например;
Например;
2. Проверьте эффект нагрева
Нагрейте соединение в пробирке. При нагревании происходит конденсация жидкости внутри трубки? Скорее всего, это вода, а это значит, что имеющееся у вас соединение является гидратом.Если при нагревании выделяется газ, обратите внимание на его цвет и запах.
3. Проведите испытание пламенем
Проведение испытания пламенем — это еще один способ ответить на вопрос: «Какой самый простой способ определить соль при анализе соли?» Растворы ионов могут вызвать изменение цвета пламени в соответствии с характеристиками атома.
Для этого испытания растворы ионов смешивают с концентрированной HCl и затем нагревают на проволочном пламени (никель или хром).
4.Проверить его реакцию с соляной кислотой
HCl по каплям добавляют к раствору до тех пор, пока тест не станет кислым до лакмусовой бумаги. Наблюдайте за любой реакцией. Любой катион, образующий нерастворимый хлорид, образует осадок.
5. Обратите внимание на его растворимость в воде
Как сделать простой анализ соли? Вы можете поместить небольшой шпатель состава в 1 мл воды, чтобы проверить его растворимость в воде. Если соединение растворимо, оно растворяется после значительного перемешивания.
Если какое-то количество растворяется, а какое-то нет, то соединение является умеренно растворимым. Он также может быть нерастворимым, в этом случае соединение вообще не растворяется.
Это некоторые из способов идентифицировать соль. Если вас интересуют различные применения и типы соли, вы можете прочитать наши статьи « Применение соли в промышленности » и « Кошерная соль: Что особенного в кошерной соли? Почему это называется кошерным? ”
6.Ситовый анализ
Используя разные сита, соль можно определить по размеру гранул.
7. Анализ влажности
Начинается с измерения веса соли по комнатной температуре. После этого соль нагреется до 140 градусов Цельсия. Это приведет к полной потере влаги.
Это приведет к полной потере влаги.
Вес нагретой соли снова измеряется. Разница между первым измерением и вторым измерением дает нам влажность, поэтому вы можете определить соотношение влаги в соли.
Свойства соли Как соль связана вместе? Что такое соль в химии? Как определить соль? анализ соли
Соль — натрий, вода, ионы и основания
Соль, наиболее известной из которых является хлорид натрия или поваренная соль, представляет собой соединение, образованное химической реакцией кислоты с основанием. Во время этой реакции кислота и основание нейтрализуются с образованием соли, воды и тепла . Хлорид натрия , распространен в природе в виде отложений на суше, образованных испарением древних морей, а также растворен в океанах. Соль является важным соединением, имеющим множество применений, включая для консервирования продуктов , для производства мыла , а также для защиты от обледенения дорог и пешеходных дорожек. Он также является основным источником хлора, и натрия для промышленных химикатов.
Во время этой реакции кислота и основание нейтрализуются с образованием соли, воды и тепла . Хлорид натрия , распространен в природе в виде отложений на суше, образованных испарением древних морей, а также растворен в океанах. Соль является важным соединением, имеющим множество применений, включая для консервирования продуктов , для производства мыла , а также для защиты от обледенения дорог и пешеходных дорожек. Он также является основным источником хлора, и натрия для промышленных химикатов.
С точки зрения химии, соль может быть любым соединением, образованным реакцией кислоты с основанием. Энергия в виде тепла выделяется во время этой реакции нейтрализации , поэтому она считается экзотермической. Наиболее распространенная соль, хлорид натрия (NaCl), является продуктом реакции между соляной кислотой (HCl) и основанием гидроксидом натрия (NaOH). В этой реакции положительно заряженные ионов водорода (H +) кислоты притягиваются к отрицательно заряженным гидроксильным ионам (OH-) основания. Эти ионы объединяются и образуют воду. После образования воды ионы натрия и хлора остаются растворенными, а кислота и основание нейтрализуются. Твердая соль образуется, когда вода испаряется и отрицательно заряженные ионы хлора соединяются с положительно заряженными ионами натрия.
Эти ионы объединяются и образуют воду. После образования воды ионы натрия и хлора остаются растворенными, а кислота и основание нейтрализуются. Твердая соль образуется, когда вода испаряется и отрицательно заряженные ионы хлора соединяются с положительно заряженными ионами натрия.
Твердый хлорид натрия существует в форме крошечных частиц кубической формы, называемых кристаллами. Эти кристаллы бесцветны, имеют плотность 2,165 г / см 3 и плавятся при 1472 ° F (800.8 ° С). Они также растворяются в воде, разделяя на компоненты ионы натрия и хлора. Этот процесс, известный как ионизация, важен для многих промышленных химических реакций .
Поваренная соль (хлорид натрия) встречается повсюду в природе. Он растворен в океанах со средней концентрацией 2,68%. На суше широко распространены толстые солевые отложения, образовавшиеся в результате испарения доисторических океанов. Эти отложения представляют собой истинные осадочные породы , и называются каменной солью или галитом.
Люди получают соль из окружающей среды разными способами. Месторождения твердых солей добываются непосредственно в виде каменной соли и очищаются. Соль из морской воды выделяется путем солнечного испарения. Подземные солевые месторождения разрабатываются растворным способом. Этот тип добычи включает закачку воды под землю для растворения солевого месторождения , извлечение воды с растворенной в ней солью и испарение воды для выделения соли.
Соль не только важна для выживания большинства растений и животных, но и широко используется во многих отраслях промышленности.В пищевой промышленности он используется для консервирования мяса и рыбы , потому что он может замедлить рост вредных для здоровья микроорганизмов . Он также используется для улучшения вкуса многих продуктов. В косметической промышленности из него делают мыло и шампуни. В других отраслях химической промышленности он является основным источником натрия и хлора, которые являются сырьем, используемым для различных химических реакций. Соль используется при производстве бумаги , резины и керамики .И его обычно используют для защиты от обледенения дорог зимой.
Соль используется при производстве бумаги , резины и керамики .И его обычно используют для защиты от обледенения дорог зимой.
5.1: Сахар и соль — Chemistry LibreTexts
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \ (\ ce {NaCl} \), представляющей соотношение 1: 1 ионов натрия и хлорида. Он обычно используется в качестве приправы и пищевого консерванта. Соль можно создать, сложив вместе два очень реактивных элемента: металлический натрий (\ (\ ce {Na (s)} \) и газообразный хлор (\ (\ ce {Cl2 (g)} \).
)\ [\ ce {2Na (s) + Cl2 (g) \ rightarrow 2NaCl (s)} \ label {eq1} \]
Элемент натрия (Рисунок \ (\ PageIndex {1a} \)) — очень реактивный металл; при возможности он вступит в реакцию с потом на ваших руках и образует гидроксид натрия, который является очень едким веществом.Элемент хлор (рис. \ (\ PageIndex {1b} \)) — это бледно-желтый едкий газ, который не следует вдыхать из-за его ядовитости. Однако объедините эти два опасных вещества вместе, и они вступят в реакцию с образованием ионного соединения хлорида натрия (рис. \ (\ PageIndex {1c} \)), известного просто как соль.
Однако объедините эти два опасных вещества вместе, и они вступят в реакцию с образованием ионного соединения хлорида натрия (рис. \ (\ PageIndex {1c} \)), известного просто как соль.
Видео \ (\ PageIndex {1} \): Приготовление столовой соли с использованием металлического натрия и газообразного хлора
Еще одно соединение — сахар, общее название сладких растворимых углеводов, многие из которых используются в пище. Сахар имеет химическую формулу \ (\ ce {C12h32O11} \) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют разные типы сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ ref {eq1}).Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ ref {eq2} и продемонстрировано в видео \ (\ PageIndex {2} \).
Сахар имеет химическую формулу \ (\ ce {C12h32O11} \) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют разные типы сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ ref {eq1}).Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ ref {eq2} и продемонстрировано в видео \ (\ PageIndex {2} \).
\ [\ ce {C12h32O11 (s) + тепло → 12C (s) + 11h3O (g)} \ label {eq2} \]
Видео \ (\ PageIndex {2} \): Научный эксперимент на кухне показывает, что происходит с молекулами сахара, когда они нагреваются. Эксперимент не разочаровал!
Как и соль, сахар имеет радикально другие свойства (как физические, так и химические), чем составляющие его элементы. Это различие в свойствах составляющих элементов и соединений является главной особенностью химических реакций.
Это различие в свойствах составляющих элементов и соединений является главной особенностью химических реакций.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Химия соли на кухне
Соль кажется достаточно распространенной, но у нее есть поразительные свойства.Предоставлено: Shutterstock.Когда мы говорим «соль», мы обычно имеем в виду то, что мы посыпаем чипсами, а именно хлорид натрия (NaCl). Но, технически говоря, это всего лишь один из примеров соли.
В химии соль — это ионное соединение, которое образуется в результате реакции нейтрализации кислоты и основания. Позвольте мне объяснить это вам.
Молекулы, обладающие электрическим зарядом, называются ионами. Те, у кого положительный заряд — это катионы, а те, у кого отрицательный заряд — анионы. Они похожи на противоположные концы магнита, поэтому анионы притягивают катионы.
Те, у кого положительный заряд — это катионы, а те, у кого отрицательный заряд — анионы. Они похожи на противоположные концы магнита, поэтому анионы притягивают катионы.
Кислоты — это вещества, которые выделяют положительно заряженные ионы водорода (H +), когда находятся в воде, в то время как основания выделяют отрицательно заряженные ионы гидроксида (OH-) в воде. При смешивании они нейтрализуют друг друга и образуют соль.
Итак, соли состоят только из положительно заряженных катионов, связанных с отрицательно заряженными анионами. Хлорид натрия — это положительный ион натрия (Na +), связанный с отрицательным ионом хлорида (Cl-).Свойства солей различаются в зависимости от того, какие ионы сочетаются.
Соленый
Не все соли безопасны для употребления, и не все они соленые на вкус. Катион определяет, имеет ли соль соленый вкус, а анион определяет интенсивность этого аромата.
Чтобы взаимодействовать с нашими вкусовыми рецепторами, соли сначала должны расщепиться — или диссоциировать — на свои ионы. Для этого нужен раствор, например, слюна или вода. Поэтому, если вы высунете язык, пока он не высохнет, и посолите его, вы не почувствуете солености.
Для этого нужен раствор, например, слюна или вода. Поэтому, если вы высунете язык, пока он не высохнет, и посолите его, вы не почувствуете солености.
Хотя добавление солей в воду — довольно безопасная химическая реакция, в элементарном состоянии каждый компонент может быть очень реактивным. И натрий, и хлор бурно реагируют с водой, но стабильны, когда их ионы находятся вместе в соли.
Люди добавляли соль в пищу на протяжении тысячелетий по двум простым причинам: это дешевый и естественный консервант; и это улучшает вкус еды.
Добавление соли продлевает срок хранения пищи за счет снижения «водной активности» продуктов.Соль по существу впитывает воду, создавая «сухую» среду, в которой затрудняется рост бактерий, портящих пищу. Соль также вытягивает воду из влажных внутренностей бактерий в более сухую среду, убивая их.
При правильном уровне соль приятна на вкус. Вполне вероятно, что соленый превратился в приятный вкус, побуждающий нас потреблять необходимое количество. Соли важны во многих биологических процессах, таких как передача нервных сигналов, поэтому нам нужно немного соли в нашем рационе.
Соль также усиливает вкус. Добавьте немного соли, и почти все станет вкуснее. Например, добавление соли в куриный суп не только делает его более соленым, но и делает его вкус более густым, сбалансированным и более «куриным». Соль делает это разными способами.
Соль подавляет неприятный привкус пищи, позволяя преобладать более приятным. Когда исследователи смешали горький и сладкий растворы во вкусовом тесте, добавление соли сделало вкус смеси более сладким. Но в сладком растворе добавление соли не так сильно улучшило вкус.
Но в сладком растворе добавление соли не так сильно улучшило вкус.
Многие витамины и антиоксиданты горькие на вкус. Добавление соли к продуктам, которые естественным образом содержат или обогащены этими горькими соединениями, улучшает их вкус. Вот почему мы часто добавляем соль в наши зеленые овощи.
Соль также снижает количество несвязанной воды, известное как «активность воды». Это приводит к относительному увеличению концентрации других ароматических компонентов, улучшая аромат, вкус и «густоту» пищевых продуктов.
Это может улучшить вкус продуктов с низким содержанием жира или сахара. Так что проверьте свои пищевые панели; возможно, вы обмениваете лишние килоджоули на избыток соли, которая не обязательно полезна для здоровья.
Когда образуется, соль образует кристаллы. Предоставлено: Тим Симпсон / Flickr, CC BY.Защитное питание
Привычное употребление слишком большого количества соли связано с такими заболеваниями, как сердечно-сосудистые и почечные заболевания. Избыток соли в разовой дозе тоже не годится.При отсутствии достаточного количества воды избыток соли нарушает процессы, зависящие от конкретной концентрации соли.
Избыток соли в разовой дозе тоже не годится.При отсутствии достаточного количества воды избыток соли нарушает процессы, зависящие от конкретной концентрации соли.
Избыток соли также стимулирует рецепторы горького и кислого вкуса, как часть «защитного приема пищи». Вот почему добавление соли в пищу улучшает вкус, а слишком много соли портит ее.
Уровень соли, приятный или неприятный на вкус, варьируется от человека к человеку. Отчасти это связано с нашими генами, но акклиматизация также происходит в зависимости от наших обычных диетических привычек.
Люди с диетой, обычно богатой солью, адаптируются к большему количеству соли. Те, кто придерживается низкосолевой диеты в молодом возрасте, едят меньше соли и имеют более низкое кровяное давление в более позднем возрасте. Однако мы можем использовать эту акклиматизацию в обратном порядке как стратегию для уменьшения потребления соли.
Это может быть постепенное добавление меньшего количества в вашу собственную пищу, а также то, что производители продуктов питания постепенно снижают уровни в своих продуктах, позволяя потребителям адаптироваться.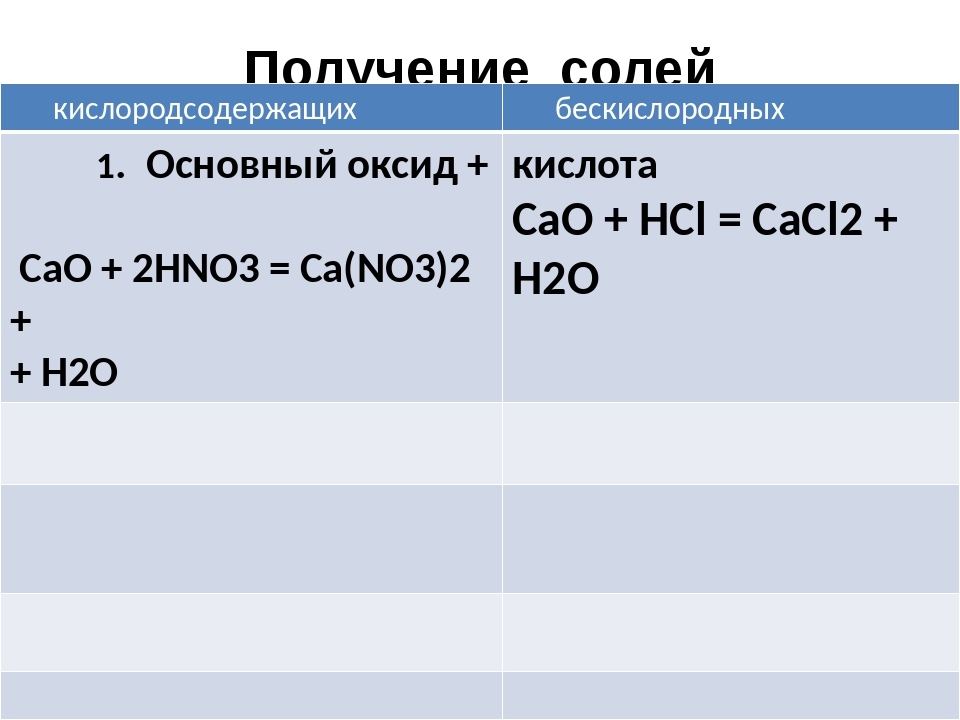
Хлорид калия — еще одна соль, которая иногда используется для замены хлорида натрия.Однако, поскольку он также имеет горький вкус, он может действовать только в качестве частичной замены. Используя еще более сложные смеси солей, мы можем усилить солевой вкус и, таким образом, использовать меньше.
Другой подход — заставить соль растворяться более эффективно, чтобы вкус ощущался быстрее. Если вы добавляете соль на поверхность продуктов, а не смешиваете ее, соль быстрее впадает в слюну. Уменьшение размера частиц соли, что увеличивает площадь поверхности, также позволяет соли быстрее растворяться в слюне, увеличивая «соленость».
Другое интересное решение было недавно предложено группой японских исследователей: вилка, которая слегка поражает ваш язык электрическим током во время еды. Электрический импульс имитирует соленый вкус и снижает потребность в добавлении соли в пищу.
Большая часть соли, которую мы едим, скрыта в пище, которую многие люди даже не называют «соленой».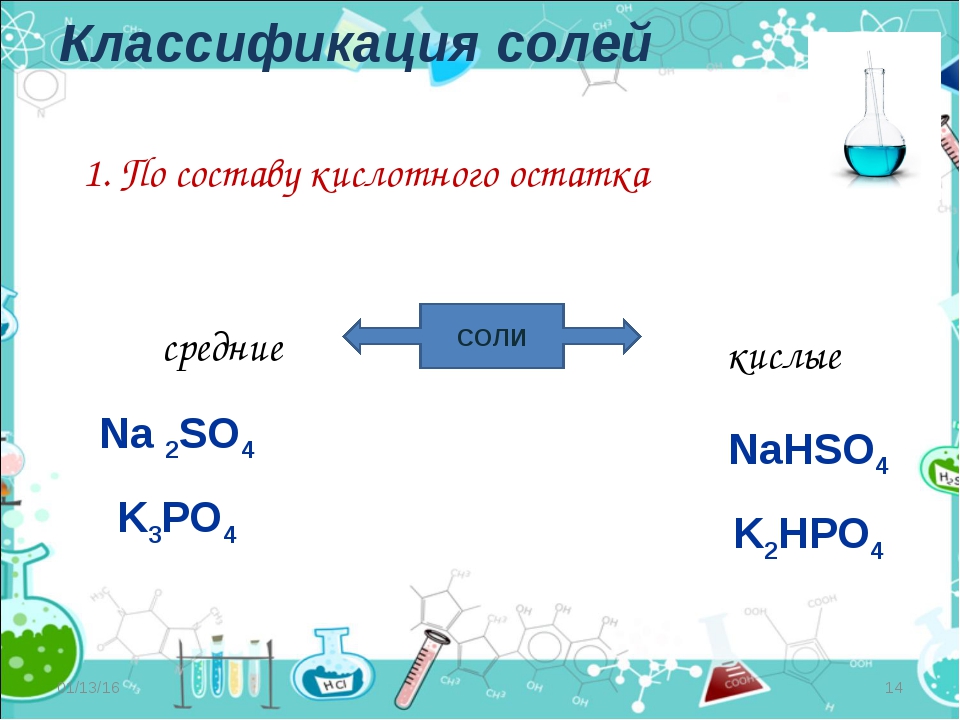 А австралийцы едят больше, чем рекомендовано. Итак, теперь, когда вы знаете эту науку, вы можете использовать ее, чтобы делать осознанный выбор соленой пищи.
А австралийцы едят больше, чем рекомендовано. Итак, теперь, когда вы знаете эту науку, вы можете использовать ее, чтобы делать осознанный выбор соленой пищи.
Жир и соль вместе — токсичная смесь для нашего здоровья и талии.
Эта история любезно опубликована The Conversation (по лицензии Creative Commons-Attribution / Без производных).
Ссылка :
Химия соли на кухне (2016, 6 мая)
получено 25 декабря 2021 г. с https: // medicalxpress.ru / news / 2016-05-chemistry-salt-kitchen.html
с https: // medicalxpress.ru / news / 2016-05-chemistry-salt-kitchen.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
примеров солей в химии | Education
В химии соли — это ионные продукты, когда кислота реагирует с основанием и нейтрализует.В твердом виде соли имеют нейтральный заряд. При растворении в воде они становятся ионами. Некоторые соли можно отличить по цвету. Химики часто используют испытания пламенем, чтобы наблюдать цвета, возникающие при возбуждении электронов пламенем. Многие соли обычно встречаются и используются в домашних условиях.
Многие соли обычно встречаются и используются в домашних условиях.
Хлорид натрия
Поваренная соль или хлорид натрия — это ионный продукт комбинации щелока или гидроксида натрия и соляной кислоты. От прозрачного до молочно-белого, хлорид натрия ценился как приправа к пище уже более 2000 лет.Это было так высоко, что римляне платили своим солдатам соляными пайками. Вкус мяса и пищевых продуктов усиливается за счет добавления поваренной соли.
Дихлорат аммония
Используемый в литографии, очистке масел и некоторых формах фотографического проявления, дихромат аммония представляет собой оранжевый кристалл. Это сильный агент окисления и может вызвать серьезные ожоги кожи, если обращаться с ним без защиты. Одно из забавных применений дихромата аммония на уроках естественных наук — это поджечь небольшую кучу химического вещества и позволить ученикам наблюдать.Небольшая кучка дихромата аммония окислится и сформирует образец вулкана. Студентам нравится наблюдать, как летят искры, когда пепел образует типичный вулканический конус.
Сульфат магния
Сульфат магния представляет собой белый кристалл природного происхождения, также известный как английская соль. Это продукт химической реакции между гидроксидом магния и серной кислотой. В натуральной медицине английскую соль можно использовать как слабительное. Раствор солей используется во многих домах в качестве замачивания при болях в ногах, ушибах и растяжениях.Некоторым людям нравится добавлять это химическое вещество в воду в ванне.
Бикарбонат натрия
Бикарбонат натрия — белый, встречающийся в природе продукт, широко известный как пищевая сода. Хотя он встречается в природе, он может быть образован в результате химической реакции гидроксида натрия и диоксида углерода. Он также производится реакцией гидроксида натрия и угольной кислоты. Бикарбонат натрия обычно используется в выпечке. В научных проектах ученики начальной школы часто используют реакцию бикарбоната натрия и уксусной кислоты для имитации извержения вулкана.
Ссылки
Ресурсы
Биография писателя
Рассел Грей — профессор педагогических наук в различных университетах. Он специализируется на обучении лучшим практикам преподавания, образовательным технологиям и поликультурному образованию. Грей имеет докторскую степень. и преподает более 30 лет.
Он специализируется на обучении лучшим практикам преподавания, образовательным технологиям и поликультурному образованию. Грей имеет докторскую степень. и преподает более 30 лет.
Почему вода растворяет соль? | Глава 5: Молекула воды и растворение
Сделайте модель кристалла соли.
Спроецировать изображение Кристалл хлорида натрия.
Напомните студентам, что зеленые шары представляют собой отрицательные ионы хлорида, а серые шары — положительные ионы натрия.
Спросите студентов:
- Что такого такого в молекулах воды и ионах в соли, которые могут сделать воду способной растворять соль?
- Положительные и отрицательные полярные концы молекулы воды притягиваются к отрицательным ионам хлора и положительным ионам натрия в соли.
Раздайте каждому ученику лист с упражнениями.
Учащиеся запишут свои наблюдения и ответят на вопросы о задании в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Вопрос для расследования
Как соль растворяется в воде?
Материалы
- Рабочий лист с ионами натрия, хлорида и молекулами воды
- Строительная бумага, любой цвет
- Ножницы
- Лента или клей
Процедура
Изготовить модель кристалла соли
- Вырежьте ионы и молекулы воды.
- Расположите ионы на листе цветной бумаги так, чтобы они изобразили двумерный кристалл соли. Пока не приклеивайте эти части скотчем.
Спроецируйте изображение и попросите учащихся смоделировать, что происходит, когда соль растворяется в воде.
Покажите студентам серию из четырех картинок, которые помогут объяснить процесс растворения соли в воде.
Спроецируйте изображение растворения хлорида натрия в воде.
Укажите, что несколько молекул воды могут расположиться рядом с ионом и помочь удалить его из кристалла. Покажите студентам, что положительная область молекулы воды будет притягиваться к отрицательному иону хлорида и что отрицательная область молекулы воды будет притягиваться к положительному иону натрия.
Смоделируйте, как вода растворяет соль
Посмотрите на картинки, показывающие, как молекулы воды растворяют соль.Затем расположите молекулы воды вокруг ионов натрия и хлора в правильной ориентации. Положительная часть молекул воды должна находиться около отрицательного хлорид-иона. Отрицательная часть молекул воды должна находиться рядом с положительным ионом натрия.
- Перемещайте молекулы воды, а также ионы натрия и хлора, чтобы смоделировать, как вода растворяет соль.
- Прикрепите к бумаге молекулы и ионы, изображающие растворяющую воду соль.

Спроектируйте анимацию «Растворение хлорида натрия в воде».
Укажите, что молекулы воды притягиваются к ионам натрия и хлора кристалла соли. Объясните, что положительная область молекулы воды притягивается отрицательным хлорид-ионом. Вода с отрицательной областью молекулы воды притягивается к положительному иону натрия. Растворение происходит, когда притяжение между молекулами воды и ионами натрия и хлорида преодолевает притяжение ионов друг к другу. Это заставляет ионы отделяться друг от друга и тщательно смешиваться с водой.
Скажите студентам, что количество вещества, которое может растворяться в жидкости (при определенной температуре), называется растворимостью. Подчеркните сходство слов «растворяться» и «растворимость». Также скажите им, что растворенное вещество называется растворенным веществом. Вещество, которое растворяет, называется растворителем.
Предложите учащимся провести эксперимент, чтобы выяснить, лучше ли растворять соль вода или изопропиловый спирт.

Попросите учащихся сделать прогноз:
- Подумайте о полярности молекул воды и молекул спирта. Как вы думаете, алкоголь будет так же хорошо, лучше или хуже, чем вода, при растворении соли?
Обсудите, как настроить тест для сравнения того, как вода и спирт растворяют соль. Убедитесь, что учащиеся указали такие переменные, как:
- Количество использованной воды и спирта
- Количество соли, добавленной к каждой жидкости
- Температура каждой жидкости
- Объем перемешивания
Вопрос для расследования
Спирт растворяет соль так же хорошо, лучше или хуже, чем вода?
Материалы для каждой группы
- Вода
- Изопропиловый спирт (70% или выше)
- Соль
- Остаток
- 2 прозрачных пластиковых стакана
- 2 маленьких пластиковых стакана
- Цилиндр градуированный
Процедура
- В отдельных чашках отмерьте два образца соли по 5 г каждый.

- Налейте 15 мл воды и спирта в отдельные чашки.
В то же время добавьте воду и спирт к образцам соли.
- Вращайте обе чашки одинаково примерно 20 секунд и проверьте количество растворенной соли.
- Поверните еще 20 секунд и проверьте. Прокрутите последние 20 секунд и проверьте.
- Осторожно слейте воду и спирт из чашек и сравните количество нерастворенной соли, оставшейся в каждой чашке.
Ожидаемые результаты
В чашке с водой будет меньше нерастворенной соли, чем спирта. Это означает, что в воде растворено больше соли, чем в спирте.
Обсудите, как разница в полярности спирта и воды объясняет, почему вода растворяет соль лучше, чем спирт.
Подробнее о полярности читайте в разделе «Биография учителя».
Спросите студентов:
- Спирт растворяет соль так же хорошо, лучше или хуже, чем вода?
- Спирт растворяет соль хуже, чем вода.
- Откуда ты знаешь?
- В чашке с алкоголем осталось больше соли.

- Подумайте о полярности воды и спирта, чтобы объяснить, почему вода растворяет больше соли, чем спирт.
- Попросите учащихся взглянуть на модели молекул воды и спирта на их рабочих листах.
Напомните студентам, что изопропиловый спирт имеет атом кислорода, связанный с атомом водорода, поэтому он имеет некоторую полярность, но не такую большую, как вода. Поскольку вода более полярна, чем спирт, она притягивает положительные ионы натрия и отрицательные ионы хлора лучше, чем спирт. Вот почему вода растворяет больше соли, чем спирт. Другими словами, растворимость соли в воде выше, чем в спирте.
Попросите учащихся сравнить растворимость двух различных ионных веществ в воде.
Сравните растворимость ионных веществ карбоната кальция (CaCO 3 ) и карбоната натрия (Na 2 CO 3 ) в воде.
Спросите студентов:
- Как бы вы могли сравнить растворимость хлорида кальция и карбоната кальция?
- Учащиеся должны предложить отмерить равные количества каждого вещества и добавить равное количество воды той же температуры.

Вопрос для расследования
Все ли ионные вещества растворяются в воде?
Материалы для каждой группы
- Карбонат натрия
- Карбонат кальция
- Вода
- 2 прозрачных пластиковых стакана
- 2 маленьких пластиковых стакана
- Остаток
Процедура
- Этикетка двух прозрачных пластиковых стаканчиков с карбонатом натрия и карбонатом кальция.
- Отмерьте по 2 г карбоната натрия и карбоната кальция и положите их в чашки с этикетками.
- Отмерьте по 15 мл воды в каждую из двух пустых чашек.
Одновременно налейте воду в чашки с карбонатом натрия и карбонатом кальция.
- Осторожно взболтайте обе чашки.
Ожидаемые результаты
Карбонат натрия растворяется, а карбонат кальция — нет.Объясните, что не все твердые частицы с ионной связью растворяются в воде.
Обсудите наблюдения студентов.

Спросите студентов:
- Все ли ионные вещества растворяются в воде? Откуда вы знаете?
- Поскольку карбонат кальция не растворяется в воде, учащиеся должны понимать, что не все ионные вещества растворяются в воде.
Объясните: на молекулярном уровне ионы, составляющие карбонат кальция, притягиваются друг к другу настолько сильно, что притяжение молекулами воды не может их разлучить.Это хорошо, потому что карбонат кальция — это материал, из которого сделаны морские раковины и птичьи яйца. Фосфат кальция — еще одно твердое ионное вещество, которое не растворяется в воде. Это хорошо еще и тем, что из этого материала сделаны кости и зубы.
Карбонат натрия полностью распадается на ионы, которые объединяются в воде, образуя раствор. Ионы натрия и карбоната не оседают на дно и не могут быть отфильтрованы из воды.
Но карбонат кальция не распадается на ионы. Вместо этого его просто смешивают с водой. Если дать достаточно времени, карбонат кальция осядет на дно или его можно будет отфильтровать из воды. Карбонат натрия, растворенный в воде, является хорошим примером раствора, а нерастворенный карбонат кальция — это смесь, а не раствор.
Карбонат натрия, растворенный в воде, является хорошим примером раствора, а нерастворенный карбонат кальция — это смесь, а не раствор.
Примечание. Карбонат-ион отличается от одноатомных ионов, таких как натрий (Na + ) и хлорид (Cl — ), которые студенты уже видели.Карбонат-ион (CO 3 2-) состоит из более чем одного атома. Эти типы ионов, называемые многоатомными ионами, состоят из группы ковалентно связанных атомов, действующих как единое целое. Обычно они приобретают или теряют один или несколько электронов и действуют как ион. Другой распространенный многоатомный ион — это сульфат-ион (SO 4 2-). Этот ион является частью соли Эпсома в виде сульфата магния (MgSO 4 ) и многих удобрений в виде сульфата калия (K 2 SO 4 ).Вы можете решить, хотите ли вы познакомить студентов с этими двумя обычными многоатомными ионами.


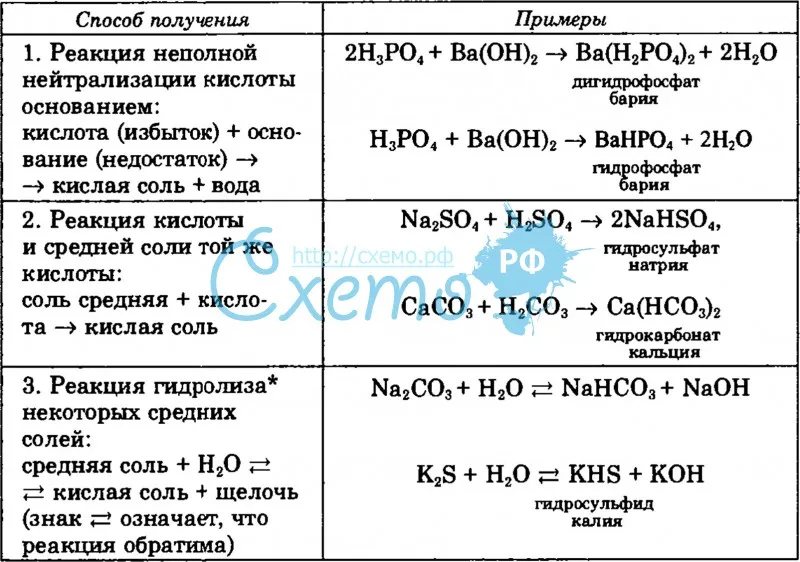 Напишите уравнения реакций нейтрализации, в которых получаются следующие соли: Na2CO3, NaHCO3, Na3PO4, AlCl3, Al(OH)Cl2.
Напишите уравнения реакций нейтрализации, в которых получаются следующие соли: Na2CO3, NaHCO3, Na3PO4, AlCl3, Al(OH)Cl2. Продолжите уравнения реакций и уравняйте их. Если есть продукты, выпадающие в осадок или выделяющиеся в виде газа, поставьте после них стрелку вниз или вверх.
Продолжите уравнения реакций и уравняйте их. Если есть продукты, выпадающие в осадок или выделяющиеся в виде газа, поставьте после них стрелку вниз или вверх. ..
..



