Амфотерные металлы, что это в химии
Амфотерные тела – это такие вещества, которые напоминают своим строением, характеристиками металлические элементы. К тому же им свойственна и химическая двойственность.
Амфотерные тела – это не металлы, а их формы: оксиды, соли и т. д. Ряд оксидов может сочетать в себе 2 свойства и при определенных условиях проявлять параметры как кислот, так и щелочей.
Известными не понаслышке амфотерными материалами является алюминий, хром, цинк и т. д.
Впервые сам термин «амфотерность» появился в начале 19 столетия. На тот период химические компоненты классифицировали на основании их похожих свойств, которые можно наблюдать во время протекания реакций.
Амфотерные металлы: особенности, виды
Перечень амфотерных металлов немалый, причем далеко не все из них являются чистыми амфотерными, а лишь условными.
Вещества все обозначены в таблице Менделеева под определенными порядковыми номерами.
Металл алюминий повсеместно применяется в быту и промышленности в самых различных областях. Его используют для изготовления фюзеляжей самолетов, кухонной посуды, автомобильных кузовов, электрических приборов, электронной техники, приборов для тепловых сетей. Алюминий отличается от других металлов тем, что всегда остается химически активным. На поверхности стабильно располагается оксидная пленка, которая защищает материал от окисления. Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом. Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой.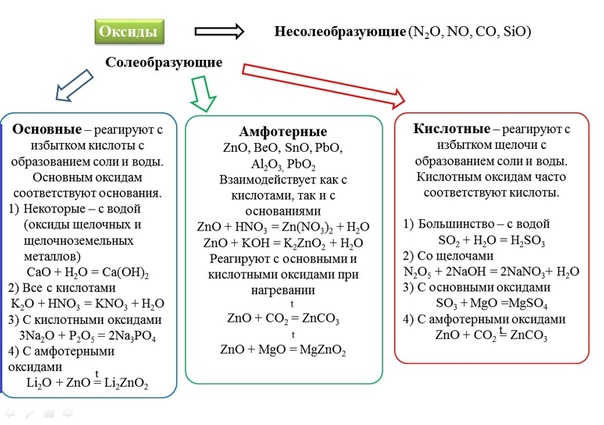
Не при всех условиях вещество вступает с реакцию с водородом.
Еще один типичный представитель амфотерных металлов – железо, который располагается под номером 26 в Таблице и находится между марганцем и кобальтом.
Железо считается одним из самых доступных элементов, залежи которого расположены в земной коре. Он одновременно является компонентом бело-серебристого цвета с хорошей ковкостью при высоких температурах. В то же время вещество может быть коррозировать при сильном нагревании. А в случае помещения его в среду чистого кислорода можно ожидать воспламенения и даже перегорания железа. Также, находясь на открытом воздухе, железо под воздействием высокой влажности начинает стремительно окисляться и даже ржаветь. А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
Свойства амфотерных веществ
Главные характеристики этих веществ заключены в самом понятии амфотерности. Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде. А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде. А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
В процессе соединения амфотерных материалов с кислотными реагентами или оксидами они показывают химическую реакцию, характерную для оснований. В случае, когда металлы реагируют с основаниями, регистрируются, наоборот кислотные характеристики.
Если амфотерные гидроксиды подвергнуть нагреванию, то в результате они распадутся на оксид и воду.
Отметим, что амфотерные материалы обладают самыми различными свойствами, которые изучаются научными светилами до сих пор. Свойства также можно разобрать, сравнивая их с характеристиками обычных материалов. Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Амфотерные тела демонстрируют сразу 2 свойства: окислительное и восстановительное. При этом некоторые соединения имеют отрицательный уровень окисления.
Все металлы, представленные в таблице Менделеева, образуют основные оксиды и гидроксиды.
Интересный момент – металлы могут окисляться далеко не со всеми кислотами в реакциях. Само окисление может не давать взаимодействие с азотной кислотой.
Простые амфотерные материалы имеют различную структуру и характеристики.
Некоторые вещества имеют такие характеристики, что их принадлежность к определенному классу можно выявить даже визуально. Так, мы сразу понимаем, что медь и алюминий – это металл.
Неметалл и металл: в чем же разница
Известно, что металлы выделяют электроны со своего внешнего электронного поля (облака). В свою очередь неметаллы притягивают такие электроны.
Также металлы хорошо проводят электроток и тепло, в отличие от неметаллов, полностью лишенных таких свойств.
Основания амфотерных маметиралов
При располагающих условиях основания нерастворимы в воде, можно сказать, являются довольно слабыми электролитами. Образуются они в результате химической реакции солей металла и щелочной жидкости. Такая химическая реакция опасна для лаборанта, поэтому для получения гидроксидов необходимо вводить едкие вещества осторожно, капля за каплей.
Амфотерные материалы реагируют с кислотами в роли оснований. В случае когда гидроксид цинка реагирует с соляной кислотой, то на выходе получится хлорид цинка. При реакции с основаниями материалы, напротив, выступают кислотами.
Общие свойства кислотных оксидов — Справочник химика 21
Исключительно важно освоить прогнозирующую роль периодического закона и периодической системы элементов Д. И. Менделеева. Тогда, даже не прибегая к учебнику, удастся многое рассказать о свойствах элементов и нх соединений. Так, по положению элемента в периодической системе можно описать строение атома — заряд и состав ядра, электронную конфигурацию атома. А по последней определить степени окисления элемента, возможность образования молекулы в обычных условиях, тип кристаллической решетки простого вещества в твердом состоянии. Наконец, можно определить формулы высших оксидов и гидроксидов элементов, изменение их кислотно-основных свойств по горизонтали и вертикали периодической системы, а также формулы различных бинарных соединений с оценкой характера химических связей. Это значительно облегчит изучение свойств элементов, простых веществ и их соединений. Начинать следует с рассмотрения общей характеристики каждой подгруппы.
Так, по положению элемента в периодической системе можно описать строение атома — заряд и состав ядра, электронную конфигурацию атома. А по последней определить степени окисления элемента, возможность образования молекулы в обычных условиях, тип кристаллической решетки простого вещества в твердом состоянии. Наконец, можно определить формулы высших оксидов и гидроксидов элементов, изменение их кислотно-основных свойств по горизонтали и вертикали периодической системы, а также формулы различных бинарных соединений с оценкой характера химических связей. Это значительно облегчит изучение свойств элементов, простых веществ и их соединений. Начинать следует с рассмотрения общей характеристики каждой подгруппы. Кислотные свойства в наибольшей степени выражены у оксидов хлора, так как разность электроотрицательностей хлора и кислорода наименьшая (разд. 35.2.1). В соответствии с общими закономерностями С /) дает наиболее сильную кислоту (табл.
 В.26). Следует учитывать также свойства воды как растворителя. В таблице В.26 указаны продукты, образующиеся при взаимодействии оксидов галогенов с водой. Свойство оксидов, а следовательно, и кислородных кислот образовывать соединения полимерного типа в соответствии с общими правилами (разд. 35.2.1) наиболее типично для иода. Перечень извест- [c.503]
В.26). Следует учитывать также свойства воды как растворителя. В таблице В.26 указаны продукты, образующиеся при взаимодействии оксидов галогенов с водой. Свойство оксидов, а следовательно, и кислородных кислот образовывать соединения полимерного типа в соответствии с общими правилами (разд. 35.2.1) наиболее типично для иода. Перечень извест- [c.503]Среди простых соединений металлов важнейшее значение имеют оксиды. На свойствах оксидов в значительной мере сказывается химический характер металлов. В молекулах простых оксидов все атомы кислорода непосредственно связаны с атомами металла и не связаны друг с другом. Их состав выражается общей формулой МеО /2> где п — окислительное число металлического элемента. Оксиды наиболее активных металлов характеризуются основными свойствами. По мере уменьшения активности металлов свойства их оксидов изменяются от типично основных через амфотерные к кислотным. [c.261]
Если потенциалопределяющими ионами являются ионы Н+ и ОН , то отсутствие заряда на поверхности (например, оксидов элементов) будет соответствовать определенному значению pH, называемому изоэлектрической точкой.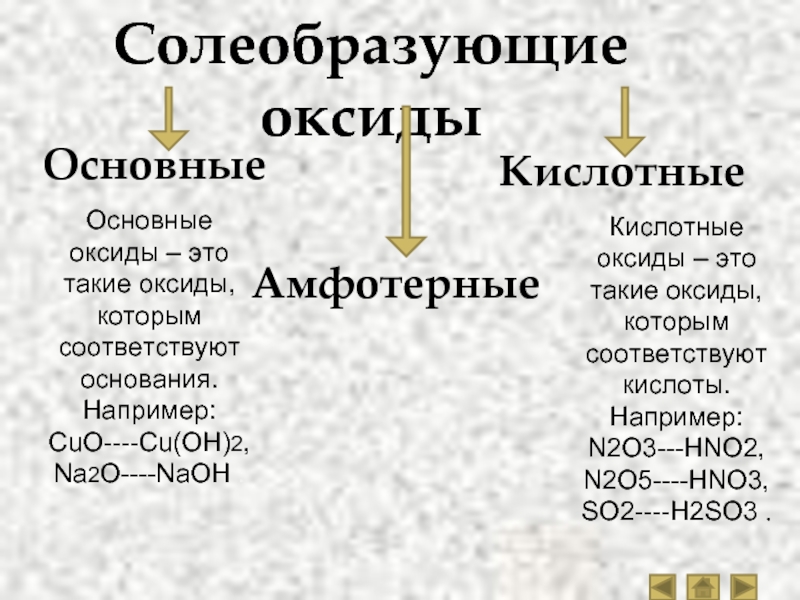
Общие свойства кислотных оксидов [c.150]
На примере гидридов и оксидов типических элементов хорошо иллюстрируется корреляция между валентностью и номером группы элемента. Элементы, расположенные в левом нижнем углу периодической системы, представляют собой металлы. Они образуют ионные гидриды и оксиды, водные растворы которых обладают основными свойствами. Элементы, расположенные в верхнем правом углу периодической системы, являются неметаллами. Их соединения с водородом и оксиды представляют собой небольщие молекулы с ковалентными связями при нормальных условиях они существуют в форме жидкостей или газов и проявляют кйслотные свойства. В промежуточной части периодической таблицы между ее верхним правым и нижним левым углами находятся элементы, которые обнаруживают постепенно изменяющиеся свойства.
Всем стеклам присущи некоторые общие свойства прозрачность, низкая теплопроводность, диэлектрические свойства, высокая химическая стойкость к кислотным реагентам. Свойства стекол зависят от их состава, от соотношения основных и кислотных оксидов.
Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды [c.227]
Оксид ХОз имеет кислотный характер. Он образует ряд кислот, содержащих один или несколько атомов X в молекуле (изополикислоты).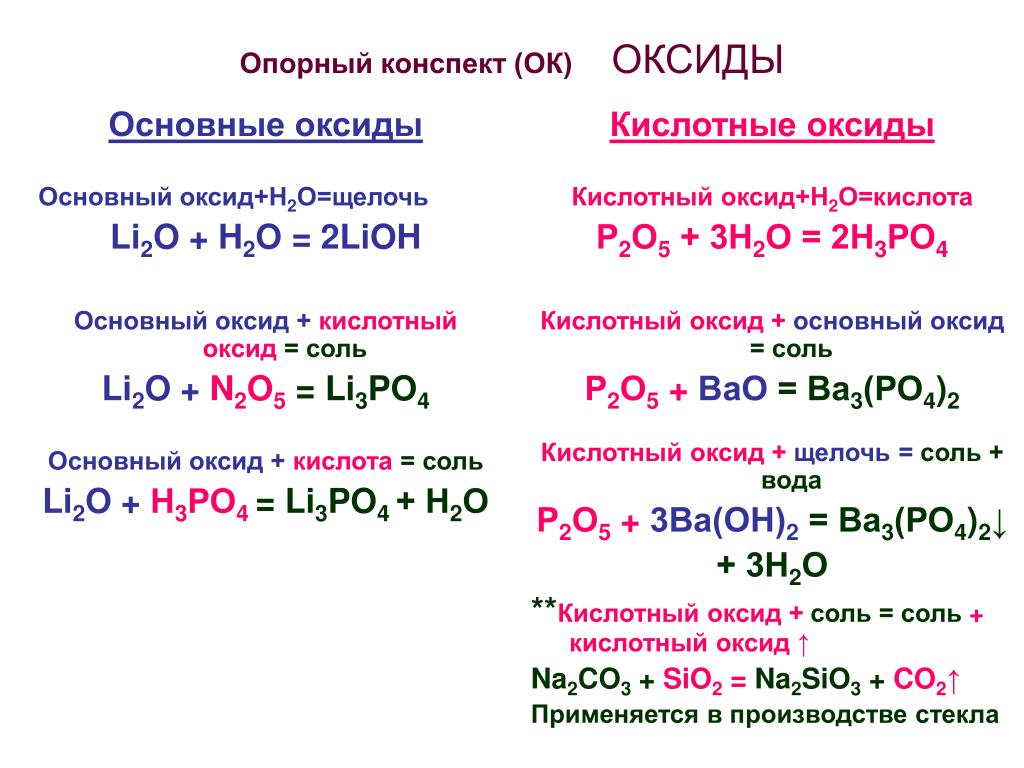 Бариевые и свинцовые соли некоторых из этих кислот находят непосредственное практическое применение. Сильные окислительные свойства растворимых солей этих кислот в кислой среде широко используются в количественном анализе. Название элемента X связано с некоторым общим свойством его соединений, [c.146]
Бариевые и свинцовые соли некоторых из этих кислот находят непосредственное практическое применение. Сильные окислительные свойства растворимых солей этих кислот в кислой среде широко используются в количественном анализе. Название элемента X связано с некоторым общим свойством его соединений, [c.146]
Кинетика изомеризации парафиновых углеводородов. Во всех работах, посвященных кинетике изомеризации парафиновых углеводородов на бифункциональных катализаторах [19, 21, 24, 27-36], за исключением [11], стадией, лимитирующей общую скорость реакции изомеризации, считается алкильная перегруппировка карбкатионов. Эта точка зрения подтверждается данными о селективном действии различных промоторов и ядов на металлические и кислотные участки катализатора [19, 30]. Серии опытов по влиянию фтора, натрия, железа и платины на активность алюмоплатиновых катализаторов в реакции изомеризации к-гексана проводились при 400 °С, давлении 4 МПа и изменении объемной скорости подачи и-гексана от 1,0 до 4,0 ч [30].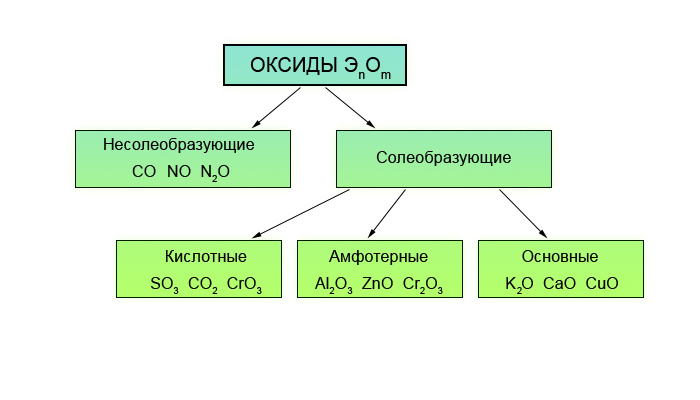 Опыты на платинированном оксиде алюминия, промотированном различными количествами фтора — от О до 15% (рис. 1.7), показали, что по мере увеличения количества фтора в катализаторе до 5% наблюдался значительный рост его изомеризу-ющей активности поскольку удельная поверхность катализатора не подвергалась заметным изменениям, рост каталитической активности объясняется изменением химических свойств активной поверхности, а именно усилением кислотности. [c.17]
Опыты на платинированном оксиде алюминия, промотированном различными количествами фтора — от О до 15% (рис. 1.7), показали, что по мере увеличения количества фтора в катализаторе до 5% наблюдался значительный рост его изомеризу-ющей активности поскольку удельная поверхность катализатора не подвергалась заметным изменениям, рост каталитической активности объясняется изменением химических свойств активной поверхности, а именно усилением кислотности. [c.17]
Таким образом, сравнивая кислотно-основные свойства оксидов и гидроксидов мышьяка и его аналогов, можно сделать общий вывод, что в ряду Аз(+3)—5Ь(+3)—В1(+3) наблюдается нарастание основных свойств, а в ряду В (+5)—5Ь(+5)—А5(+5) нарастание кислотных свойств при одновременном увеличении стабильности производных в этих же направлениях [c.291]
Если подобное семейство оксидов образует неметалл (например, азот), то общая тенденция сохраняется, но свойства оксидов смещены в направлении увеличения кислотности в последовательности N 03, N 04, N 05 [c. 24]
24]
Взаимодействие с кислотными и амфотерными сксндами (см. выше Общие свойства кислотных оксидов , Амфотерные оксиды ) растьор, ( [c.156]
ОСНОВАНИЯ НЕОРГАНИЧЕСКИЕ -класс неорганических соединений общей формулы Ме (0Н) , где Ме — металл, п — валентность металла. Общим свойством О. н. является то, что они в водных растворах диссоциируют на положительно заряженные ионы металлов и отрицательно заряженные ионы гидроксила ОН «. О. н., растворимые в воде, называют щелочами. О. н. образуются главным образом при взаимодействии соответствующих солей со щелочами, активных металлов с водой, основных оксидов с водой и др. Нерастворимые в воде О. н. получают реакцией обмена между растворимой солью данного металла и раствором щелочи. Число гидроксильных групп в О. и., которые способны замещаться кислотными остатками с образованием солей, определяют его кислотность. Например, КОН — однокислот- [c.184]
Общая характеристика группы.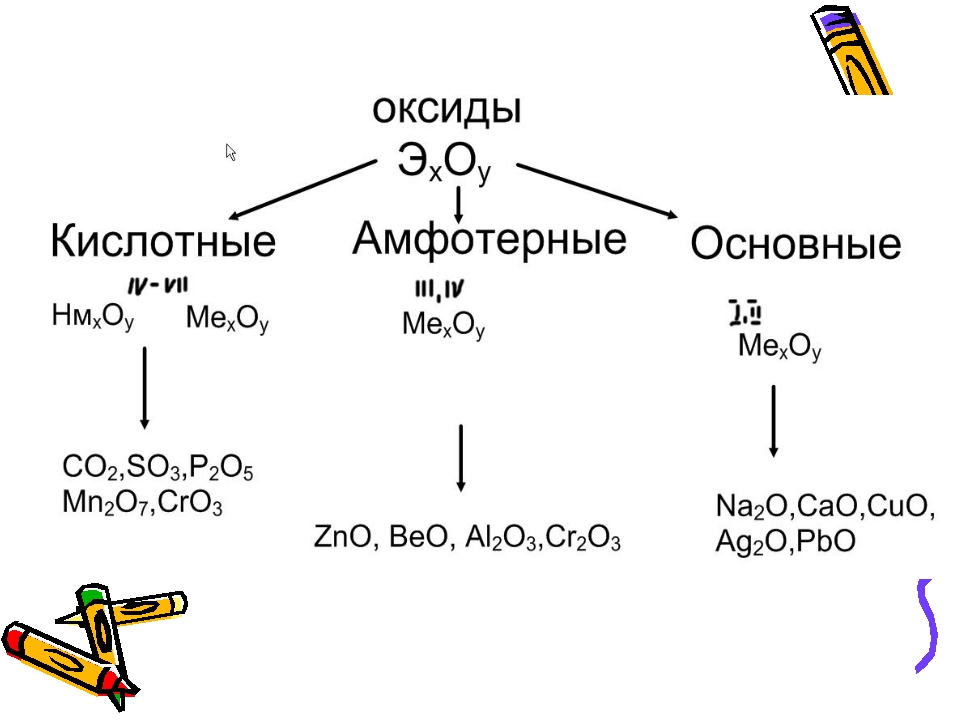 У всех элементов третьей группы высшая степень окисления в соответствии с номером группы равна трем. Этому отвечают их оксиды типа КаОз. По химическому характеру только окись бора В2О3 является кислотным оксидом оксиды алюминия А Оз, индия 1П2О3 и галлия ОэгОз обладают амфотерными свойствами, а все остальные являются основными с постепенным усилением основных свойств при переходе к элементам с ббльшей атомной массой. [c.72]
У всех элементов третьей группы высшая степень окисления в соответствии с номером группы равна трем. Этому отвечают их оксиды типа КаОз. По химическому характеру только окись бора В2О3 является кислотным оксидом оксиды алюминия А Оз, индия 1П2О3 и галлия ОэгОз обладают амфотерными свойствами, а все остальные являются основными с постепенным усилением основных свойств при переходе к элементам с ббльшей атомной массой. [c.72]
Согласно теории электролитической диссоциации все общие щелочные свойства растворов — мыльность на ощупь, изменение цвета индикаторов, взаимодейств е с кислотами, кислотными оксидами, солями— обусловлены присутствием гидроксид-ионов ОН, [c.75]
Среди соединений металлов важнейшее значение имеют оксиды. Их состав выражается общей формулой МехОу, где атомы кислорода непосредственно связаны с атомами металла и не связаны друг с другом. Оксиды наиболее активных металлов характеризуются основными свойствами. По мере уменьшения активности металлов свойства их оксидов изменяются от типично основных через амфотерные к кислотным. [c.76]
[c.76]
В приведенном выше ряду оксидов марганца слева направо усиливаются окислительные свойства самих оксидов и их гидроксидов, у которых изменяются и кислотно-основные свойства от основных Мп(ОН)а и Мп(ОН)з через амфотерные Мп(0Н)4 или МпО(ОН)а к кислотным HjMnOi и НМпО. Зта закономерность является общей для оксидов и для гидроксидов других элементов с изменяющимися окислительными числами (гл. V, 9). [c.184]
Почти все элементы главных подгрупп IV—VII групп периодической системы представляют собой неметаллы, в то время как элементы побочных подгрупп — металлы. Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно- резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисленности, их аналогичные соединения проявляют существенное сходство. Так, хром, расположенный в побочной подгруппе VI группы, образует кислотный оксид СгОз, близкий по свойствам к триоксиду серы 50з.
 Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава Н2ЭО4. Точно так же оксиды марганца и хлора, соответствующие высшей степени окисленности этих элементов, — МпгО и СЬО — обладают сходными свойствами и представляют собой ангидриды сильных кислот, отвечающих общей формуле НЭО4. [c.626]
Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава Н2ЭО4. Точно так же оксиды марганца и хлора, соответствующие высшей степени окисленности этих элементов, — МпгО и СЬО — обладают сходными свойствами и представляют собой ангидриды сильных кислот, отвечающих общей формуле НЭО4. [c.626] Кислородные соединения элементов VI группы. Сера, селен, и теллур образуют по два окисла общей формулы К02(802, ЗеОг) и К0з(50з и ТеОз), соответствующие степеням окисления + 4 и +6. Оксиды обоих типов обладают кислотными свойствами. Так, оксиды серы называются сернистым 50г и серным 50з ангидридами или соответственно диоксидом и триоксидом серы. Соответствующие им кислоты сернистая НгЗОз и серная Н2504 резко отличаются по свойствам. Сернистая кислота легко распадается на ангидрид и воду при нормальных условиях и сравнительно мало распадается на ионы. Это вызвано тем, что в сернистой кислоте меньше кислорода, чем в серной кис-. лоте и серная кислота более полярное вещество. Поэтому серная кислота устойчива в водных растворах и распадается с выделением воды при температуре выше 300 °С. Ее степень дис- [c.314]
лоте и серная кислота более полярное вещество. Поэтому серная кислота устойчива в водных растворах и распадается с выделением воды при температуре выше 300 °С. Ее степень дис- [c.314]
С кислородом элементы подгруппы азота образуют оксиды общей формулы КзОз и НаОз. Оксидам соответствуют кислоты НКО. и НКОз (и ортокислоты НзН04, кроме азота). В пределах подгруппы характер оксидов изменяется так ЫаОз— кислотный оксид Р4О6 — слабо кислотный оксид АзаОз — амфотерный оксид с преобладанием кислотных свойств ЗЬаОз — амфотерный оксид с преобладанием основных свойств В120з — основной оксид. Таким образом, кислотные свойства оксидов состава РаОз и КаОз уменьшаются с ростом порядкового номера элемента (см. табл. 10.1, п. 1). [c.183]
В триаде Ti-Zr-Hf с валентной конфигурацией атомов 5- Т и 2г обнаруживают состояния окисления 4-2, 4- 3 и 4-4. тогда как НГ имеет только одно состояние окисления 4-4. В этом случае мы сталкиваемся с примером общей закономерности, присущей переходным металлам низшие степени окисления играют меньшую роль для переходных металлов второго и третьего рядов, потому что в их атомах валентные электроны нах. одятся на большем удалении от ядра. В условиях когда эти атомы могут терять валентные электроны, они чаще всего теряют их полностью. В низших состояниях окисления Т1 образует ионные соединения, а в состоянии окисления 4- 4 его соединения имеют более ковалентный характер и он обладает неметаллическими свойствами. Оксид титана(Н), ТЮ, представляет собой ионное соединение основного типа со структурой кристалла Na l. В отличие от этого диоксид титана, Т Ог,-белый нерастворимый пигмент, об.падающий как кислотными, так и основными свойствами. [c.440]
одятся на большем удалении от ядра. В условиях когда эти атомы могут терять валентные электроны, они чаще всего теряют их полностью. В низших состояниях окисления Т1 образует ионные соединения, а в состоянии окисления 4- 4 его соединения имеют более ковалентный характер и он обладает неметаллическими свойствами. Оксид титана(Н), ТЮ, представляет собой ионное соединение основного типа со структурой кристалла Na l. В отличие от этого диоксид титана, Т Ог,-белый нерастворимый пигмент, об.падающий как кислотными, так и основными свойствами. [c.440]
Эти соединения в водных растворах проявляют слабые кислотные свойстйа кислотность и восстановительные свойства их возрастают в ряду НгЗ — НгТе, что связано с увеличением радиуса иона. В соединениях с кислородом сера, селен и теллур образуют вещества общей формулы ЭО, ЭО2 и ЭО3, в которых соответственно имеют степень окисления +2, +4 и +6. Оксиды типа ЭО2 и ЭОз образуют соответствующие кислоты НгЗОз, НгЗеОз, Н2504, Н25е04 и т. д. [c.81]
д. [c.81]
Элементы подгруппы углерода образуют оксиды общей формулы НОг и КО, а водородные соединения — КН4. Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные—у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений НН4 СН4 — прочное вещество, а РЬН4 — в свободном виде не выделено. [c.126]
Таким образом, из рассмотрения характеристических соединений следуют общие выводы о закономерностях изменения кислотно-основных, окислительно-восстановительных свойств и стабильности соответствующих степеней окисления. Так, для железа из известных степеней окисления +2, +3 и +6 наиболее стабильна в обычных условиях степень окисления +3. При переходе к кобальту и никелю повышается стабильность низшей степени окисления, в то время как высшая степень окисления +6 для них не свойственна вовсе. Для первых двух элементов триады (Ре и Со), для которых сгабильности степеней окисления +2 и -НЗ сопоставимы, существуют смешанные оксиды Э3О4 шпинельного типа, в то время как для никеля подобный оксид неизвестен, что свидетельствует о меньшей стабильности степени окисления -Ь3 для этого элемента. [c.405]
Для первых двух элементов триады (Ре и Со), для которых сгабильности степеней окисления +2 и -НЗ сопоставимы, существуют смешанные оксиды Э3О4 шпинельного типа, в то время как для никеля подобный оксид неизвестен, что свидетельствует о меньшей стабильности степени окисления -Ь3 для этого элемента. [c.405]
Элементы подгруппы углерода образуют оксиды общей формулы КОа и КО, а водородные соединения —формулы НН4. Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основнью — у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений КН4 СН — прочное вещество, а РЬН в свободном виде не выделено. В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус (п. 3 и 6 табл. 11.1), т. е. неметаллические свойства ослабевают, а металлические усиливаются. [c.206]
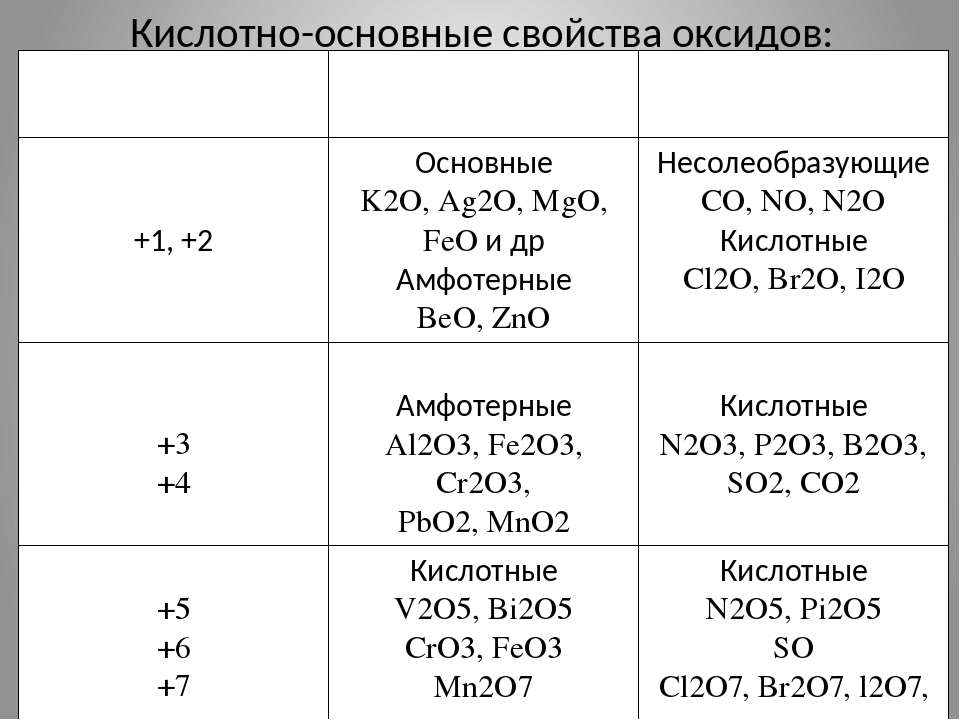
Характеристика ХЭ по кислотно-основным свойствам.
 Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксидыХарактеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Как же определить: кислотными или основными свойствами будет обладать то или иное соединение? Это совсем несложно, достаточно просто посмотреть Периодическую систему химических элементов Д.И. Менделеева.
Большинство химических
элементов в таблице являются металлами, именно они и образуют основные
оксиды, которым соответствуют основания. Однако, нужно знать,
что если у металла степень окисления от +1 до +3, то оксид в
таком случае будет основным, ему будет соответствовать основание,
но если у металла будет высокая степень окисления, такая как +6, +7,
то тогда его оксид будет проявлять кислотные свойства и соответствовать
ему будет не основание, а кислота.
Например, у марганца (Mn) возможны степени окисления: +2, +4, +6, +7. Если в оксиде у марганца степень окисления +2, то такой оксид будет основным, если +4, то амфотерным, если +6 или +7, то такие оксиды будут кислотным. Поэтому, чем выше степень окисления элемента, тем ярче выражены кислотные свойства.
А
что же такое амфотерные оксиды и гидроксиды. Это слово, наверняка, вы
слышали, но этому понятию ранее не придавалось никакого значения. Попробуйте
сами догадаться, а для этого мы проведем опыт по получению гидроксида цинка
(Zn(OH)2)
и исследованию его свойств. Для этого, в две пробирки нальем раствора соли хлорида
цинка (ZnCl2)
и добавим в каждую несколько капель раствора гидроксида натрия (NaOH).
При этом можно наблюдать выпадение осадка белого цвета. Таким образом,
мы получили гидроксид цинка реакцией обмена между хлоридом цинка
и гидроксидом натрия.
Таким образом,
мы получили гидроксид цинка реакцией обмена между хлоридом цинка
и гидроксидом натрия.
Исследуем свойства гидроксида цинка. Для этого, в одну пробирку мы прильем соляной кислоты (HCl), и что же мы наблюдаем, осадок начинает растворяться. Во вторую пробирку прильем раствора гидроксида натрия (NaOH), и в этом случае осадок тоже растворяется.
Какой
же все-таки двуличный этот гидроксид цинка: он вступает в реакции и с
кислотами, и с основаниями. Значит, все гидроксиды, которые реагируют и
с основаниями, и с кислотами называются амфотерными. Они могут вести
себя как кислоты в реакциях со щелочами и как основания в реакциях с
кислотами. Т.е. в зависимости от условий они могут проявлять как
кислотные свойства, так и основные. Значит, и записать химическую
формулу гидроксида цинка можно по-разному: в виде кислоты H2ZnO2
и в виде основания Zn(OH)2.
Давайте запишем уравнения этих реакций:
В первой реакции образуется соль хлорид цинка (ZnCl2), а во второй комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]).
И цинк, и его оксид будут тоже амфотерными соединениями.
Например, цинк реагирует с кислотами: если в пробирку с цинком прилить серной кислоты (H2SO4), то будет выделяться газ. В результате этой реакции образуется соль – сульфат цинка (ZnSO4) и выделяется газ – водород (H2).
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H2↑
Цинк
будет реагировать и со щелочами. Запомните, если реакция протекает в
растворе, то образуется комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]),
при сплавлении образуется соль – цинкат натрия (Na2ZnO2),
но водород выделяется в обоих случаях.
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2NaOH = Na2ZnO2 + H2↑
Аналогично ведет себя и оксид цинка, т.е. он реагирует с кислотами и с основаниями.
Например, в реакции оксида цинка (ZnO) с соляной кислотой образуется соль – хлорид цинка, в реакции оксида цинка с раствором гидроксида натрия образуется опять комплексная соль – тетрагидроксоцинкат натрия, а при сплавлении с гидроксидом натрия – цинкат натрия.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2H+ = Zn2+ + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
А сейчас послушайте историю про двуличного Алюминия.
Жил
да был на свете хитрец-наглец по имени Алюминий. Его владения находились
между двумя могущественными королевствами. Одним королевством правил молодой
жизнерадостный король Натрий. Все в его королевстве было голубым:
чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы
благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые
люди. Работалось и жилось в королевстве легко, свободно, радостно. А это
вызывало сильную зависть у правительницы другого королевства – Серы. Она
вся пожелтела от зависти и злобы, порой даже начинала плавиться от
внутреннего жара или гореть лиловым пламенем. Наконец ее терпение
лопнуло после одного пышного празднества, устроенного Натрием в честь рождения
сына, и Сера объявила войну Натрию.
Его владения находились
между двумя могущественными королевствами. Одним королевством правил молодой
жизнерадостный король Натрий. Все в его королевстве было голубым:
чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы
благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые
люди. Работалось и жилось в королевстве легко, свободно, радостно. А это
вызывало сильную зависть у правительницы другого королевства – Серы. Она
вся пожелтела от зависти и злобы, порой даже начинала плавиться от
внутреннего жара или гореть лиловым пламенем. Наконец ее терпение
лопнуло после одного пышного празднества, устроенного Натрием в честь рождения
сына, и Сера объявила войну Натрию.
Натрий,
никогда и никому не желавший зла, по характеру мягкий, как воск, хоть
ножом его режь, не был готов к войне. Он обратился к Алюминию: «Помоги,
ведь мы с тобой из одного семейства – металлов». Алюминий согласился, но
решил устроить так, чтобы оба войска перебили друг друга и он завладел бы и
тем, и другим королевством.
Алюминий согласился, но
решил устроить так, чтобы оба войска перебили друг друга и он завладел бы и
тем, и другим королевством.
Войска Натрия и Серы сражались, не жалея сил, выделяя огромное количество теплоты. А Алюминий со своим войском все выгадывал удобную позицию: если побеждало войско Натрия, он стремился быть в его гуще, если одерживало верх войско Серы, он перекидывался на его сторону. Наконец и Натрий, и Сера поняли хитрость и двойственность замыслов Алюминия. Оба послали самых сильных воинов с приказом уничтожить негодяя и предателя.
Алюминий увидел, что с двух сторон к нему стремительно приближаются два всадника. Вскоре два копья с силой вонзились в его безвольное тело.
Как видите, алюминий тоже проявляет двойственность свойств, т.е. он тоже является амфотерным, значит, его оксид и гидроксид тоже будут амфотерными.
Алюминий,
как и цинк, реагирует с кислотами. Например, в реакции с серной кислотой
(H2SO4)
он также образует соль – сульфат алюминия (Al2(SO4)3)
и при этом выделяется газ – водород (H2).
Например, в реакции с серной кислотой
(H2SO4)
он также образует соль – сульфат алюминия (Al2(SO4)3)
и при этом выделяется газ – водород (H2).
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Алюминий реагирует и со щелочами: если реакция алюминия с гидроксидом натрия (NaOH) протекает в растворе, то в этом случае, как и в случае с цинком, образуется комплексная соль тетрагидроксоалюминат натрия (2Na[Al(OH)4])
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
Оксид
алюминия и его гидроксид ведет себя тоже двойственно.
При реакции оксида алюминия (Al2O3)
с соляной кислотой (HCl), он ведет
себя, как основный оксид, при этом образуется соль – хлорид алюминия (AlCl3). А при взаимодействии с раствором щелочи, этот же оксид ведет себя как
кислота, при этом образуется комплексная соль – тетрагидроксоалюминат
натрия (Na[Al(OH)4]),
или гексагидроксоалюминат натрия (Na3[Al(OH)6]),
что будет верно в любом случае. А вот при сплавлении со щелочью,
образуется соль – метаалюминат натрия (NaAlO2).
А при взаимодействии с раствором щелочи, этот же оксид ведет себя как
кислота, при этом образуется комплексная соль – тетрагидроксоалюминат
натрия (Na[Al(OH)4]),
или гексагидроксоалюминат натрия (Na3[Al(OH)6]),
что будет верно в любом случае. А вот при сплавлении со щелочью,
образуется соль – метаалюминат натрия (NaAlO2).
Гидроксид алюминия (Al(OH)3)тоже является амфотерным, поэтому он реагирует с кислотами и с основаниями.
Например,
в реакции соляной кислотой (HCl),
он себя ведет, как основание, при этом образуется соль – хлорид алюминия
(AlCl3)
и вода (H2O) , а вот в реакции с гидроксидом натрия
(NaOH), он ведет себя, как
кислота. Если реакция протекает в растворе, то образуется комплексная
соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]),
или гексагидроксоалюминат натрия (Na3[Al(OH)6]),
а при сплавлении другая соль – метаалюминат натрия (NaAlO2).
Будьте внимательны, посмотрите амфотерные элементы в периодической таблице. Интересно, что элементы побочных подгрупп, в промежуточной степени окисления также могут проявлять амфотерные свойства, эти элементы еще называют переходными элементами или переходными металлами.
К амфотерным элементам относятся: Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, Cr, Mn, Fe, Zn, Cd, Au и др.
План урока: Реакции оксидов
План урока: Реакции оксидов | НагваПортал деактивирован. Обратитесь к администратору портала.
Этот план урока включает в себя цели, предпосылки и исключения
урок, обучающий студентов тому, как описывать и записывать уравнения реакций оксидов.
Цели
Студенты смогут
- понимать, что оксид представляет собой соединение, содержащее кислород и другой элемент,
- определять и понимать, является ли оксид основным или кислотным, в зависимости от того, является ли он оксидом металла или неметалла,
- понимать термин амфотерный и, следовательно, что амфотерный оксид основан на его реакции с кислотами и основаниями,
- определить и понять нейтральные оксиды на основании отсутствия у них реакции с кислотами или основаниями,
- написать химические уравнения для реакции оксидов с кислотами,
- определить кислоту используются из продуктов данной химической реакции,
- описывают тесты pH, чтобы определить, является ли оксид кислотным или основным,
- определяют порядок реакционной способности элементов, используя их реакцию с кислородом.
Предпосылки
Студенты уже должны быть знакомы с
- кислотность и щелочность,
- рН,
- химические формулы и названия соединений.

Исключения
Студенты не будут оплачивать
- электролиз,
- сложные оксиды.
Nagwa — стартап в области образовательных технологий, цель которого — помочь учителям учить, а ученикам учиться.
Copyright © 2022 Nagwa
Все права защищены
Nagwa использует файлы cookie, чтобы обеспечить вам максимальное удобство на нашем веб-сайте. Узнайте больше о нашей Политике конфиденциальности.
Кислоты и основания — Кислоты и основания — Национальная редакция 5 Chemistry Revision
Шкала pH
Насколько кислым или щелочным является вещество (pH вещества) можно измерить с помощью шкалы pH, непрерывного диапазона, простирающегося ниже 0 выше 14.Наиболее распространенные значения рН находятся в диапазоне от 0 до 14.
Кислоты имеют рН менее 7.
Щелочи имеют рН более 7.
Вода и нейтральные растворы имеют рН ровно 7.
pH является мерой концентрации ионов водорода в растворе.
Образующие кислоты и щелочи
1xqqe3scxuw.0.0.0.1:0.1.0.$0.$2.$1″> Щелочи являются растворимыми основаниями. Щелочной раствор может образовываться при растворении оксида металла в воде. Кислый раствор может образоваться при растворении оксида неметалла в воде.{}\]Посмотрите это видео, чтобы увидеть процедуру эксперимента по изучению влияния углекислого газа на pH.
Определение рН оксидов | Эксперимент
В этом эксперименте учащиеся тестируют образцы ряда оксидов в воде с раствором универсального индикатора, наблюдая, как меняется их рН. Они устанавливают представление о том, что растворимые оксиды металлов являются щелочными, а оксиды неметаллов — кислыми.
Сам эксперимент довольно короткий, но до и после практической работы должно быть достаточно времени для обсуждения.
Оборудование
Аппарат
- Защита для глаз
- Пробирки, 6 шт.
- Штатив для пробирок
- Цветовая шкала pH
Химикаты
- Доступ к решениям следующим образом (см.
 примечания 10 и 11 ниже):
примечания 10 и 11 ниже):- Азотная(V) кислота (с маркировкой «Окись азота и вода»), 0,2 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО)
- Фосфорная(V) кислота (с маркировкой «Фосфор(V) оксид и вода»), 0,2 М
- Серная(VI) кислота (с маркировкой «Двуокись серы и вода»), 0.2 М
- Гидроксид калия (с маркировкой «Оксид калия и вода»), 0,2 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО)
- Гидроксид натрия (с маркировкой «Окись натрия и вода»), 0,2 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО)
- Известковая вода (с маркировкой «Окись кальция и вода»)
- Универсальный индикаторный раствор (ЛЕГКОВОСПЛАМЕНЯЮЩИЙСЯ), полный спектр, во флаконе-капельнице (или флаконе с пипеткой-капельницей)
Здоровье, безопасность и технические примечания
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Азотная(V) кислота, HNO 3 (водн.), (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см.
 карту опасностей CLEAPSS HC067 и книгу рецептов CLEAPSS RB061.
карту опасностей CLEAPSS HC067 и книгу рецептов CLEAPSS RB061. - Фосфорная(V) кислота, H 3 PO 4 (водн.) – см. карту опасности CLEAPSS HC072 и книгу рецептов CLEAPSS RB065.
- Серная(VI) кислота, H 2 SO 4 (водн.) — см. карту опасности CLEAPSS HC098a и книгу рецептов CLEAPSS RB098.
- Раствор гидроксида калия, KOH (водный), (РАЗДРАЖАЮЩИЙ) – см. карту опасности CLEAPSS HC091b и книгу рецептов CLEAPSS RB071.
- Раствор гидроксида натрия, NaOH (водный), (РАЗДРАЖАЮЩИЙ) – см. карту опасности CLEAPSS HC091a и книгу рецептов CLEAPSS RB085.
- Известковая вода, Ca(OH) 2 (водн.), (рассматривать как РАЗДРАЖАЮЩЕЕ) – см. карту опасности CLEAPSS HC018 и книгу рецептов CLEAPSS RB020.
- Универсальный индикаторный раствор (ВЫСОКО ВОСПЛАМЕНЯЕМЫЙ) — см. карточку опасности CLEAPSS HC032 и книгу рецептов CLEAPSS RB000.
- Растворы могут поставляться в небольших маркированных бутылочках для капельницы или в небольших конических колбах с пипеткой-капельницей.
 Если времени мало, растворы могут быть предоставлены в маркированных пробирках.
Если времени мало, растворы могут быть предоставлены в маркированных пробирках. - Концентрации растворов не являются критическими (подходит 0,1 или 0,2 М ). Однако они должны быть менее 0,5 М. При предлагаемых концентрациях растворы фосфорной и серной кислот представляют минимальную опасность. Однако может быть целесообразно пометить растворы как РАЗДРАЖАЮЩИЕ.
Процедура
- Поместите 2 см 3 образцов каждого раствора «оксида и воды» в отдельные пробирки.
- В каждую пробу добавить по 3 капли раствора универсального индикатора. Обратите внимание на цвет индикатора в каждом образце.
- Запишите результаты в подходящую таблицу, указав название оксида, цвет универсального индикатора, рН и является ли оксид кислым, щелочным или нейтральным в воде.
Учебные заметки
Растворы не упоминаются и не маркируются как «раствор оксидов», поскольку оксиды не растворяются — они реагируют с водой.Подход «оксид и вода» позволяет сосредоточиться на главном моменте обучения без необходимости охвата другого набора реакций (хотя их можно было бы изучить с соответствующей группой студентов).
Обычно оксиды металлов являются основными, а оксиды неметаллов — кислотными. Некоторые оксиды металлов реагируют с водой, образуя щелочные растворы. Важно отметить, что некоторые оксиды металлов не реагируют с водой. Они нейтральны в воде, потому что они нерастворимы, но они все еще являются основаниями, потому что реагируют с кислотами.Оксиды неметаллов реагируют с водой с образованием кислот.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
Как отличить основные оксиды от кислотных? — Ответы на все
Как отличить основные оксиды от кислотных?
Кислотные оксиды реагируют с водой, образуя кислый раствор. Они могут реагировать с основанием с образованием соли. Основные оксиды реагируют с водой, образуя основной раствор, и они могут реагировать с кислотой с образованием соли. Кислотные оксиды имеют низкий pH, тогда как основные оксиды имеют высокий pH.
Как определить, является ли оксид кислотно-основным или амфотерным?
Оксид, который соединяется с водой с образованием кислоты, называется кислотным оксидом. Оксид, который дает основание в воде, известен как основной оксид. Амфотерный раствор — это вещество, которое может химически реагировать как с кислотой, так и с основанием.
Как вы делаете кислотные оксиды?
Оксиды серы Двуокись серы реагирует с водой с образованием слабой сернистой кислоты: SO2 + h3O → h3SO. Триоксид серы образует с водой сильную серную кислоту: SO3 + h3O → h3SO.
Как узнать, какой оксид является самым основным?
Подсказка: Основность оксида зависит от размера центрального атома, степени окисления центрального атома и металлического характера элемента. Чем больше размер, тем металличнее оксиды, что, в свою очередь, увеличивает основность.
Какой оксид является самым основным?
- Na2O — самый основной оксид.
- Al2O3 является амфотерным.
- P2O5 – кислотный оксид.
- SiO2 — слабокислотный оксид.Следовательно, вариант (D) является правильным ответом.
Является ли bi2o3 кислотным или основным?
Оксид висмута считается основным оксидом, что объясняет высокую реакционную способность по отношению к СО2. Однако при введении в структуру оксида висмута кислых катионов типа Si(IV) реакция с СО2 не происходит.
Является ли geo2 кислотным или основным?
Кремний является неметаллом, а продукт гидролиза кремния является основанием, поэтому оксид кремния является кислым, поскольку он реагирует с основанием. GeO2 реагирует как с кислотой, так и с основанием, поэтому является амфотерным оксидом.
GeO2 реагирует как с кислотой, так и с основанием, поэтому является амфотерным оксидом.
Является ли CaO основным оксидом?
Оксид кальция (CaO) представляет собой оксид металла. Как и другие оксиды металлов, это основной оксид, поскольку он растворяется в воде с образованием гидроксида кальция.
Что такое кислотный флюс?
Кислотный флюс: Кислотный флюс — это флюс, полученный из таких веществ, как кислота Льюиса, таких как SiO2, h4PO4 и т. д. Он используется при сварке металлов, металлургии с извлечением или плавке. Силикагель используется для удаления основных примесей, таких как известь CaO или MgO.
Кислотно-щелочное поведение оксидов периода 3 элемента
Металлы реагируют с кислородом воздуха для получения оксидов металлов, таких как оксид магния.Неметаллы реагируют с кислородом воздуха с образованием оксидов неметаллов.
Сера неметалл горит на воздухе с образованием диоксида серы: сера + кислород → диоксид серы
Здесь мы будем обсудить реакции оксидов элементов 3-го периода (натрий в хлор) с водой и с кислотами или основаниями, где это уместно (как и прежде, аргон опущен потому что он не образует оксида).
 Тенденция в
кислотно-щелочное поведение можно резюмировать следующим образом: Кислотность
увеличивается слева направо, варьируя от сильно основных оксидов слева до
сильнокислотные справа, с амфотерным оксидом (оксидом алюминия) в
середина. Амфотерный оксид — это тот, который проявляет как кислотные, так и основные
характеристики. Оксид натрия
представляет собой простой сильно основной оксид. Он является основным, поскольку содержит оксид
ион O2-, который является очень сильным основанием с высокой тенденцией к соединению с
ионы водорода.
Тенденция в
кислотно-щелочное поведение можно резюмировать следующим образом: Кислотность
увеличивается слева направо, варьируя от сильно основных оксидов слева до
сильнокислотные справа, с амфотерным оксидом (оксидом алюминия) в
середина. Амфотерный оксид — это тот, который проявляет как кислотные, так и основные
характеристики. Оксид натрия
представляет собой простой сильно основной оксид. Он является основным, поскольку содержит оксид
ион O2-, который является очень сильным основанием с высокой тенденцией к соединению с
ионы водорода.Реакция с водой : Оксид натрия экзотермически реагирует с холодной водой с образованием раствор гидроксида натрия. Концентрированный раствор оксида натрия в воде будет иметь pH 14. Na2O+h3O→2NaOH
реакция с кислотами: Являясь сильным основанием, оксид натрия также реагирует с кислотами. Например, он реагирует с разбавленной соляной кислотой с образованием раствора хлорида натрия. Магний оксид представляет собой еще один простой основной оксид, который также содержит оксидные ионы. Тем не мение,
он не такой сильноосновной, как оксид натрия, потому что ионы оксида не такие
слабосвязанный.В оксиде натрия твердое тело удерживается вместе за счет притяжения
между 1+ и 2- ионами. В оксиде магния притяжение находится между 2+ и
2- ионы. Из-за более высокого заряда металла требуется больше энергии, чтобы
разорвать эту ассоциацию. Даже с учетом других факторов (таких как энергия
освобождается от ионно-дипольных взаимодействий между катионами и водой), сетка
эффект заключается в том, что реакции с участием оксида магния всегда будут менее
экзотермичен, чем у оксида натрия. реакция
с водой: На первый взгляд, порошок оксида магния не вступает в реакцию.
с водой.Однако рН полученного раствора составляет около 9, , что указывает на
образовались гидроксид-ионы. На самом деле, некоторое количество гидроксида магния
образуется в результате реакции, но, поскольку эти вещества почти нерастворимы, небольшое количество гидроксида
ионы действительно растворяются. Реакция выглядит следующим образом: MgO+h3O→Mg(OH)2
Тем не мение,
он не такой сильноосновной, как оксид натрия, потому что ионы оксида не такие
слабосвязанный.В оксиде натрия твердое тело удерживается вместе за счет притяжения
между 1+ и 2- ионами. В оксиде магния притяжение находится между 2+ и
2- ионы. Из-за более высокого заряда металла требуется больше энергии, чтобы
разорвать эту ассоциацию. Даже с учетом других факторов (таких как энергия
освобождается от ионно-дипольных взаимодействий между катионами и водой), сетка
эффект заключается в том, что реакции с участием оксида магния всегда будут менее
экзотермичен, чем у оксида натрия. реакция
с водой: На первый взгляд, порошок оксида магния не вступает в реакцию.
с водой.Однако рН полученного раствора составляет около 9, , что указывает на
образовались гидроксид-ионы. На самом деле, некоторое количество гидроксида магния
образуется в результате реакции, но, поскольку эти вещества почти нерастворимы, небольшое количество гидроксида
ионы действительно растворяются. Реакция выглядит следующим образом: MgO+h3O→Mg(OH)2 Реакция
с кислотами : Оксид магния реагирует с кислотами, как это предсказано для простого металла
окись. Например, он реагирует с теплой разбавленной соляной кислотой с образованием
раствор хлорида магния.MgO+2HCl→MgCl2+h3O
Например, он реагирует с теплой разбавленной соляной кислотой с образованием
раствор хлорида магния.MgO+2HCl→MgCl2+h3O
Реакция с кислотами : Оксид алюминия содержит оксид-ионы и, таким образом, реагирует с кислотами в так же, как оксиды натрия или магния.
Оксид алюминия реагирует с горячим разбавить соляной кислотой, чтобы получить раствор хлорида алюминия. Al2O3+6HCl→2AlCl3+3h3O
Этот реакция и другие проявляют амфотерную природу оксида алюминия.
Реакция с основаниями: Оксид алюминия также проявляет кислотные свойства, как показано в его реакции с основаниями, такими как гидроксид натрия.Различные алюминаты (соединения в алюминий является компонентом отрицательного иона), что возможно потому что алюминий может образовывать ковалентные связи с кислородом.
Это возможно, потому что разница электроотрицательностей между алюминием и кислородом невелика, в отличие от разница между натрием и кислородом, например (электроотрицательность увеличивается за период) Алюминий оксид реагирует с горячим концентрированным раствором гидроксида натрия с образованием бесцветный раствор тетрагидроксоалюмината натрия: Al2O3+2NaOH+3h3O→2NaAl(OH)4 4.Кремний диоксид ( оксид кремния(IV)) Кремний слишком близок по электроотрицательности к кислороду, чтобы образовывать ионные связи. Следовательно, поскольку диоксид кремния не содержит ионов оксида, он не имеет основных характеристики. На самом деле он очень слабокислотный, реагирующий с сильными основаниями. Реакция
с водой : Диоксид кремния не реагирует с водой из-за термодинамических
трудность разрушения его сетевой ковалентной структуры. Реакция
с основаниями : Диоксид кремния реагирует с горячим концентрированным гидроксидом натрия
раствор, образующий бесцветный раствор силиката натрия: В другой
пример реакции кислого диоксида кремния с основанием, доменной печью.
извлечение железа, оксид кальция из известняка реагирует с диоксидом кремния до
производят жидкий шлак, силикат кальция:
Реакция
с водой : Диоксид кремния не реагирует с водой из-за термодинамических
трудность разрушения его сетевой ковалентной структуры. Реакция
с основаниями : Диоксид кремния реагирует с горячим концентрированным гидроксидом натрия
раствор, образующий бесцветный раствор силиката натрия: В другой
пример реакции кислого диоксида кремния с основанием, доменной печью.
извлечение железа, оксид кальция из известняка реагирует с диоксидом кремния до
производят жидкий шлак, силикат кальция:SiO2+CaO→CaSiO3(1.8)
Два оксиды фосфора, оксид фосфора(III), P4O6, и оксид фосфора(V), P4O10, рассматриваются в этой статье. Фосфор(III) оксид : Оксид фосфора (III) реагирует с холодной водой с образованием раствора слабая кислота, h4PO3, известная как фосфористая кислота, ортофосфорная кислота или фосфоновая кислота:Ниже приведено изображение структуры полностью протонированной кислоты:
. протоны
остаются связанными до тех пор, пока не будет добавлена вода; даже тогда, потому что фосфористая кислота
слабая кислота, несколько молекул кислоты депротонированы. Фосфористая кислота имеет pKa
2,00, которая является более кислой, чем обычные органические кислоты, такие как этановая кислота
Фосфористая кислота имеет pKa
2,00, которая является более кислой, чем обычные органические кислоты, такие как этановая кислота
(рКа = 4.76).
Фосфор(III) оксид вряд ли будет реагировать непосредственно с основанием. В фосфористой кислоте два атома водорода в группах -ОН являются кислотными, но третий атом водорода является нет. Следовательно, возможны две реакции с основанием, подобным натрию. гидроксида, в зависимости от количества добавленного основания: 2NaOH+h4PO3→Na2HPO3+2h3O Во-первых реакции только один из протонов реагирует с гидроксид-ионами основания.Во втором случае (при использовании вдвое большего количества гидроксида натрия) реагируют оба протона. Если вместо этого оксид фосфора (III) реагирует непосредственно с раствором гидроксида натрия, возможны те же соли: 4NaOH+P4O6+2h3O→4Nah3PO3 9NaOH+P4O6→4Na2HPO3+2h3O Фосфор(V) оксид: оксид фосфора (V) бурно реагирует с водой с образованием раствора содержащие смесь кислот, природа которых зависит от реакции условия. Обычно рассматривается только одна кислота, фосфорная (V) кислота, h4PO4.
(также известный как фосфорная кислота или ортофосфорная кислота).
Обычно рассматривается только одна кислота, фосфорная (V) кислота, h4PO4.
(также известный как фосфорная кислота или ортофосфорная кислота).P4O10+6h3O→4h4PO4
Полностью протонированная кислота имеет следующую структуру: Фосфорная(V) кислота — еще одна слабая кислота с pKa 2,15, что немного слабее, чем фосфористая кислота. Растворы каждой из этих кислот с концентрацией около 1 моль дм-3 имеют рН около 1. Фосфорный (V) оксид также вряд ли будет реагировать непосредственно с основанием, но рассматриваются гипотетические реакции. В кислотной форме молекула имеет три кислые группы -ОН, которые могут вызвать трехстадийную реакцию с натрием гидроксид: 2NaOH+h4PO4→Na2HPO4+2h3O 3NaOH+h4PO4→Na3PO4+3h3O Похожий на оксид фосфора (III), если оксид фосфора (V) непосредственно реагирует с натрием раствор гидроксида, та же возможная соль, что и на третьем этапе (и только это соль) образуется:12NaOH+P4O10→4Na3PO4+6h3O
Два оксида также рассматриваются: диоксид серы, SO2, и триоксид серы, SO3.
Сера диоксид : диоксид серы хорошо растворим в воде, реагируя с образованием раствора сернистой кислоты (также известной как серная (IV) кислота), h3SO3, как вы увидите на реакция ниже. Этот вид существует только в растворе, и любая попытка изолировать, он выделяет диоксид серы.
То протонированная кислота имеет следующую структуру: сернистый кислота также является относительно слабой кислотой с pKa около 1,8, но слегка сильнее, чем две указанные выше фосфорсодержащие кислоты.разумно концентрированный раствор сернистой кислоты имеет рН около 1. Сера диоксид также непосредственно реагирует с основаниями, такими как раствор гидроксида натрия. При барботировании диоксида серы через раствор гидроксида натрия сначала образуется натрий. раствором сульфита, а затем раствором гидросульфита натрия, если диоксида серы в избытке. Другой важная реакция диоксида серы с основным оксидом кальция с образованием сульфит кальция (также известный как сульфат кальция (IV)).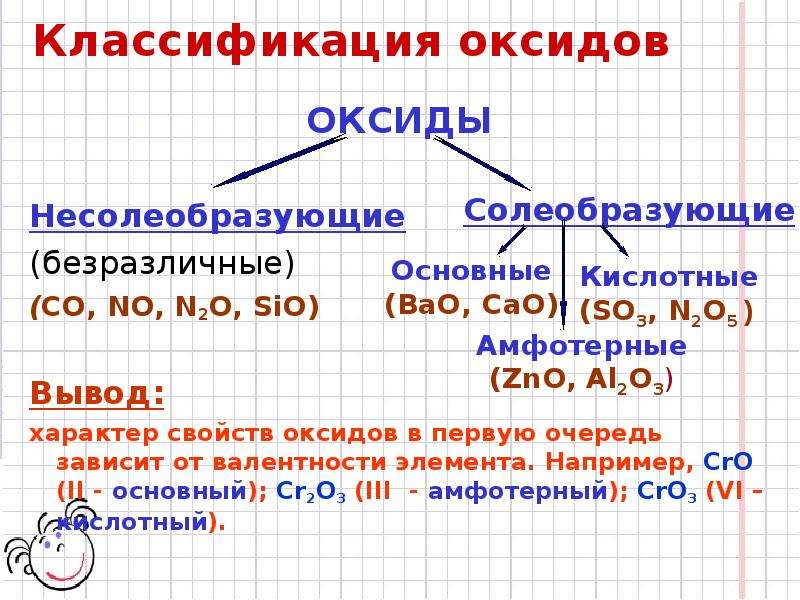 это из важных
способы удаления диоксида серы из дымовых газов электростанций. Сера
триоксид : Триоксид серы бурно реагирует с водой, образуя туман из
капли концентрированной серной кислоты.
это из важных
способы удаления диоксида серы из дымовых газов электростанций. Сера
триоксид : Триоксид серы бурно реагирует с водой, образуя туман из
капли концентрированной серной кислоты.Ниже представлена протонированная структура:
.серный кислота является сильной кислотой, и растворы обычно имеют рН около 0. кислота реагирует с водой с образованием иона гидроксония (ион водорода в растворе) и ион гидросульфата. Эта реакция протекает практически до конца: h3SO4(водн.)+h3O(ж)→h4P++HSO-4(водн.)
Секунда протон труднее удалить.На самом деле ион гидросульфата представляет собой относительно слабая кислота, близкая по силе к кислотам, рассмотренным выше.
Этот реакцию правильнее описать как равновесие: HSO−4(водн.)+h3O⇌h4O+(водн.)+SO2−4(водн.) Это полезно если вы понимаете, почему серная кислота является более сильной кислотой, чем сернистая кислота. Вы можете применить те же рассуждения к другим кислотам, с которыми вы столкнетесь в этой статье.
серный кислота сильнее сернистой кислоты, потому что, когда ион водорода теряется из одна из групп -ОН серной кислоты, отрицательный заряд остается на кислороде растекается (делокализован) по иону, взаимодействуя с двойной связью атомы кислорода.
Отсюда следует, что большее количество атомов кислорода с двойными связями в ионе делает возможна большая делокализация; большая делокализация приводит к большей стабильности, уменьшая вероятность того, что ион рекомбинирует с ионом водорода и вернется в неионизированное состояние. кислота. сернистый кислота имеет только один кислород с двойной связью, тогда как серная кислота имеет два; в дополнительная двойная связь обеспечивает гораздо более эффективную делокализацию, стабильный ион и более сильная кислота. Серная кислота проявляет все реакции, характерные сильной кислоты.Например, при реакции с гидроксидом натрия образуется натрий сульфат; в этой реакции оба кислотных протона реагируют с гидроксид-ионами как показано: 2NaOH+h3SO4→Na2SO4+2h3O В Принцип гидросульфата натрия можно получить, используя вдвое меньше натрия. гидроксид; при этом удаляется только один из кислых атомов водорода. Сера
Сам триоксид также непосредственно реагирует с такими основаниями, как оксид кальция, образуя
сульфат кальция: Этот
реакция аналогична реакции с двуокисью серы, рассмотренной выше.хлор
образует несколько оксидов, но только два (оксид хлора(VII), Cl2O7 и
оксид хлора (I), Cl2O). Также известен оксид хлора (VII).
в виде гептоксида дихлора и оксида хлора (I) в виде монооксида дихлора. Хлор(VII)
оксид: оксид хлора (VII) является высшим оксидом хлора — атом хлора
находится в максимальной степени окисления +7. Он продолжает тенденцию высочайшего
оксиды элементов периода 3 в более сильные кислоты. Хлор(VII)
оксид реагирует с водой с образованием очень сильной кислоты, хлорной (VII) кислоты, а также
известный как хлорная кислота.Как в
серной кислоты, рН типичных растворов хлорной кислоты около 0.
Нейтральная хлорная (VII) кислота имеет следующую структуру: Когда
ион хлората (VII) (перхлорат-ион) образуется при потере протона (в реакции
с водой, например), заряд делокализован по каждому атому кислорода в
ион.
гидроксид; при этом удаляется только один из кислых атомов водорода. Сера
Сам триоксид также непосредственно реагирует с такими основаниями, как оксид кальция, образуя
сульфат кальция: Этот
реакция аналогична реакции с двуокисью серы, рассмотренной выше.хлор
образует несколько оксидов, но только два (оксид хлора(VII), Cl2O7 и
оксид хлора (I), Cl2O). Также известен оксид хлора (VII).
в виде гептоксида дихлора и оксида хлора (I) в виде монооксида дихлора. Хлор(VII)
оксид: оксид хлора (VII) является высшим оксидом хлора — атом хлора
находится в максимальной степени окисления +7. Он продолжает тенденцию высочайшего
оксиды элементов периода 3 в более сильные кислоты. Хлор(VII)
оксид реагирует с водой с образованием очень сильной кислоты, хлорной (VII) кислоты, а также
известный как хлорная кислота.Как в
серной кислоты, рН типичных растворов хлорной кислоты около 0.
Нейтральная хлорная (VII) кислота имеет следующую структуру: Когда
ион хлората (VII) (перхлорат-ион) образуется при потере протона (в реакции
с водой, например), заряд делокализован по каждому атому кислорода в
ион. Это делает ион очень стабильным, что делает хлорную (VII) кислоту очень сильной. Хлорная (VII)
кислота реагирует с раствором гидроксида натрия с образованием раствора натрия
хлорат (VII): Хлор(VII)
сам оксид также реагирует непосредственно с раствором гидроксида натрия, давая
тот же продукт: 2NaOH+Cl2O7→2NaClO4+h3O Хлор(I)
оксид: оксид хлора (I) гораздо менее кислый, чем оксид хлора (VII).Он реагирует
с водой до некоторой степени, чтобы получить хлорную (I) кислоту, HOCl-HOCl-
также известный как хлорноватистая кислота. То
Структура хлорной (I) кислоты точно соответствует ее формуле HOCl. Она имеет
нет кислорода с двойными связями и нет способа делокализации заряда по
отрицательный ион, образованный потерей водорода. Таким образом, отрицательный ион образовался
не очень стабилен и легко возвращает свой протон, чтобы вернуться к кислоте.
Хлорная (I) кислота очень слабая (pKa = 7,43) и реагирует с гидроксидом натрия.
раствора с получением раствора хлората натрия(I) (гипохлорита натрия): Хлор(I)
оксид также реагирует непосредственно с гидроксидом натрия с образованием того же продукта:
Это делает ион очень стабильным, что делает хлорную (VII) кислоту очень сильной. Хлорная (VII)
кислота реагирует с раствором гидроксида натрия с образованием раствора натрия
хлорат (VII): Хлор(VII)
сам оксид также реагирует непосредственно с раствором гидроксида натрия, давая
тот же продукт: 2NaOH+Cl2O7→2NaClO4+h3O Хлор(I)
оксид: оксид хлора (I) гораздо менее кислый, чем оксид хлора (VII).Он реагирует
с водой до некоторой степени, чтобы получить хлорную (I) кислоту, HOCl-HOCl-
также известный как хлорноватистая кислота. То
Структура хлорной (I) кислоты точно соответствует ее формуле HOCl. Она имеет
нет кислорода с двойными связями и нет способа делокализации заряда по
отрицательный ион, образованный потерей водорода. Таким образом, отрицательный ион образовался
не очень стабилен и легко возвращает свой протон, чтобы вернуться к кислоте.
Хлорная (I) кислота очень слабая (pKa = 7,43) и реагирует с гидроксидом натрия.
раствора с получением раствора хлората натрия(I) (гипохлорита натрия): Хлор(I)
оксид также реагирует непосредственно с гидроксидом натрия с образованием того же продукта:Разница между кислотными и основными оксидами
Основное отличие — кислотные и основные оксиды
Оксид — это любое химическое соединение, содержащее один или несколько атомов кислорода. Оксиды могут быть кислотными или основными в зависимости от их химического состава, реакций и рН. Кислотные оксиды реагируют с водой, образуя кислый раствор. Они могут реагировать с основанием с образованием соли. Основные оксиды реагируют с водой, образуя основной раствор, и они могут реагировать с кислотой с образованием соли. Кислотные оксиды имеют низкий pH, тогда как основные оксиды имеют высокий pH. Однако основное различие между кислотными оксидами и основными оксидами заключается в том, что кислых оксидов образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Оксиды могут быть кислотными или основными в зависимости от их химического состава, реакций и рН. Кислотные оксиды реагируют с водой, образуя кислый раствор. Они могут реагировать с основанием с образованием соли. Основные оксиды реагируют с водой, образуя основной раствор, и они могут реагировать с кислотой с образованием соли. Кислотные оксиды имеют низкий pH, тогда как основные оксиды имеют высокий pH. Однако основное различие между кислотными оксидами и основными оксидами заключается в том, что кислых оксидов образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Ключевые области охвата
1. Кислотный оксид
– Определение, химические свойства, оксиды неметаллов, примеры
2. Что такое основной оксид
– Определение, химические свойства, оксиды металлов, примеры3 3 8 904 В чем разница между кислотными и основными оксидами
– Сравнение ключевых различий
Ключевые термины: кислота, ангидриды кислот, оксид кислоты, основание, ангидриды оснований, основной оксид, оксид неметалла, оксид металла, оксид, pH, соль
Что такое кислотный оксид
Кислотные оксиды — это соединения, которые могут образовывать кислые растворы при растворении в воде. Кислотные оксиды образуются при взаимодействии неметалла с кислородом. Иногда кислотные оксиды образуются, когда металлы (с более высокими степенями окисления) также реагируют с кислородом. Кислотные оксиды реагируют с водой и образуют водные кислоты.
Кислотные оксиды образуются при взаимодействии неметалла с кислородом. Иногда кислотные оксиды образуются, когда металлы (с более высокими степенями окисления) также реагируют с кислородом. Кислотные оксиды реагируют с водой и образуют водные кислоты.
Кислотные оксиды классифицируются как ангидриды кислот . Это потому, что они производят кислотное соединение этого оксида при растворении в воде. Например, диоксид серы называется сернистым ангидридом, а триоксид серы называется серным ангидридом. Кислотные оксиды могут реагировать с основанием с образованием его соли.
Обычно кислотные оксиды имеют низкие температуры плавления и низкие температуры кипения, за исключением таких оксидов, как диоксид кремния, которые склонны образовывать гигантские молекулы. Эти оксиды растворяются в основаниях и образуют соль и воду. Когда кислотный оксид растворяется в воде, он снижает рН пробы воды из-за образования ионов Н + . Некоторыми распространенными примерами кислотных оксидов являются CO 2 , P 2 O 5 , NO 2 , SO 3 и т. д.
д.
Рисунок 1: SO3 — оксид неметалла (кислотный оксид)
Оксиды неметаллов
Оксиды неметаллов представляют собой оксидные соединения, образованные неметаллическими элементами.Большинство элементов p-блока являются неметаллами. Они образуют различные оксидные соединения. Оксиды неметаллов являются ковалентными соединениями, поскольку они делят электроны с атомами кислорода, образуя молекулы оксида. Большинство оксидов неметаллов после реакции с водой дают кислоты. Следовательно, оксиды неметаллов являются кислотными соединениями. Например, когда SO 3 растворяют в воде, получается раствор H 2 SO 4 , который является очень кислым. Оксиды неметаллов реагируют с основаниями с образованием солей.
Что такое основной оксид
Основные оксиды, также называемые ангидридами оснований , представляют собой соединения, которые могут образовывать основные растворы при растворении в воде. Основные оксиды образуются в результате реакции кислорода с металлами. Из-за разницы в электроотрицательности кислорода и металлов большинство основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами.
Основные оксиды образуются в результате реакции кислорода с металлами. Из-за разницы в электроотрицательности кислорода и металлов большинство основных оксидов имеют ионную природу. Таким образом, они имеют ионные связи между атомами.
Основные оксиды активно реагируют с водой, образуя основные соединения. Эти оксиды реагируют с кислотами и образуют соль и воду. При добавлении в воду основного оксида рН воды увеличивается за счет образования гидроксильных ионов (ОН – ). Некоторыми примерами распространенных основных оксидов являются Na 2 O, CaO, MgO и т. д.Следовательно, оксиды металлов в основном являются основными оксидами.
Рис. 2: MgO — основной оксид. Это оксид металла.
Оксиды металлов
Оксиды металлов представляют собой химические соединения, содержащие металл и один или несколько атомов кислорода. Здесь степень окисления кислорода равна -2, и это по существу анион, тогда как металл является катионом. Щелочные металлы (элементы группы 1), щелочноземельные металлы (элементы группы 2) и переходные металлы (некоторые элементы d-блока) образуют основные оксиды.Но металлы с высокими степенями окисления могут образовывать оксиды ковалентной природы. Они более кислые, чем основные.
Щелочные металлы (элементы группы 1), щелочноземельные металлы (элементы группы 2) и переходные металлы (некоторые элементы d-блока) образуют основные оксиды.Но металлы с высокими степенями окисления могут образовывать оксиды ковалентной природы. Они более кислые, чем основные.
Количество атомов кислорода, которые связываются с ионом металла, зависит от степени окисления иона металла. Щелочные металлы образуют только одновалентные катионы. Поэтому они образуют только оксиды типа М 2 О (где М — ион металла, О — анион оксида). Щелочноземельные металлы образуют двухвалентные катионы. Поэтому они образуют оксиды типа МО. Эти соединения являются основными.
Разница между кислотными и основными оксидами
Определение
Кислотные оксиды: Кислотные оксиды — это соединения, которые могут образовывать кислые растворы при растворении в воде.
Основные оксиды: Основные оксиды представляют собой соединения, которые могут образовывать основные растворы при растворении в воде.
Формирование
Кислотные оксиды: Кислотные оксиды образуются при взаимодействии кислорода с неметаллами.
Основные оксиды: Основные оксиды образуются при взаимодействии кислорода с металлами.
Реакция с водой
Кислотные оксиды: Кислотные оксиды реагируют с водой с образованием кислотных соединений.
Основные оксиды: Основные оксиды реагируют с водой с образованием основных соединений.
Реакция с кислотами
Кислотные оксиды: Кислотные оксиды не реагируют с кислотами.
Основные оксиды: Основные оксиды реагируют с кислотами с образованием соли.
Реакция с основаниями
Кислотные оксиды: Кислотные оксиды реагируют с основаниями с образованием соли.
Основные оксиды: Основные оксиды не реагируют с основаниями.
Облигации
Кислотные оксиды: Кислотные оксиды имеют ковалентные связи.
Основные оксиды: Основные оксиды имеют ионные связи.
Влияние на рН
Кислотные оксиды: Когда кислотные оксиды растворяются в воде, pH снижается.
Основные оксиды: Растворение основных оксидов в воде вызывает повышение pH.
Другие названия
Кислотные оксиды: Кислотные оксиды также известны как ангидриды кислот.
Основные оксиды: Основные оксиды также называются основными ангидридами.
Заключение
Оксиды — это соединения, в которых хотя бы один атом кислорода связан с другим элементом. Этот элемент может быть металлом или неметаллом. Оксиды могут быть кислотными или основными в зависимости от их свойств. Если определенный оксид может реагировать с кислотой, но не может реагировать с основанием, его называют основным оксидом. Если оксид реагирует с основанием, но не с кислотой, то это кислый оксид. Ключевое различие между кислотными и основными оксидами заключается в том, что кислые оксиды образуют кислоты при растворении в воде, тогда как основные оксиды образуют основания при растворении в воде.
Артикул:
1. «Кислотный оксид». Википедия, Фонд Викимедиа, 29 декабря 2017 г., доступно здесь.
2. Либретексты. «Окислы». Химия LibreTexts, Libretexts, 23 августа 2017 г., доступно здесь.
Изображение предоставлено:
1. «Триоксид серы SO3» Yikrazuul — собственная работа (общественное достояние) через Commons Wikimedia
2. «Окись магния» Walkerma предполагается — предполагается собственная работа (на основании заявлений об авторских правах) (общественное достояние) через Commons Wikimedia
Простые оксиды — Учебный материал для IIT JEE
Оксиды неметаллов имеют тенденцию быть кислыми, оксиды металлов имеют тенденцию быть основными, а оксиды элементов в полосе полуметаллов от угла к углу или близко к ней в целом амфотерны.
Оксид представляет собой бинарное соединение , полученное при взаимодействии кислорода с другим элементом. По содержанию кислорода оксиды можно разделить на смешанные оксиды и простые оксиды.
Простые оксиды
Простые оксиды — это оксиды, которые несут только то количество атомов кислорода, которое допускается нормальной валентностью его металла.
Пример : H 2 O, MgO& Al 2 O 3.
Смешанные оксиды
Два простых оксида объединяются, образуя смешанные оксиды.
Пример : Диоксид свинца (PbO 2 ) и монооксид свинца (PbO) вместе образуют смешанный оксид сурика (Pb 3 O 4 ).
Оксид железа (Fe 2 O 3 ) и оксид железа (FeO) вместе образуют смешанный оксид оксида железа и железа (Fe 3 O 4 ).
Классификация простых оксидов
Простые оксиды на основе их химического поведения могут быть дополнительно классифицированы на кислотные оксиды, основные оксиды, амфотерные оксиды и нейтральные оксиды .
Кислотный оксид
Оксид, который реагирует с водой с образованием кислоты, называется Кислотный оксид . Пример: оксиды немалочных металлов, таких как 2, CO 2 , SO 3 , CL 2 O 7, P 2 O 5 , & N 2 O 5 , или оксиды металлов с высокими степенями окисления, такие как CrO 3, Mn 2 O 7 , &V 2 O 5 , имеют кислотную природу.
- Диоксид серы растворяется и вступает в реакцию с водой с образованием сернистой кислоты.
SO 2 + h3O → H 2 SO 3
Двуокись серы Вода Сернистая кислота
- Хромовый ангидрид реагирует с водой с образованием хромовой кислоты.
CR 2 O 3 + H 2 O → H 2 CR 2 O 4
Хромовый ангидрид Вода Хромовая кислота
Основной оксид
Оксид, который реагирует с водой с образованием основания, называется основным оксидом .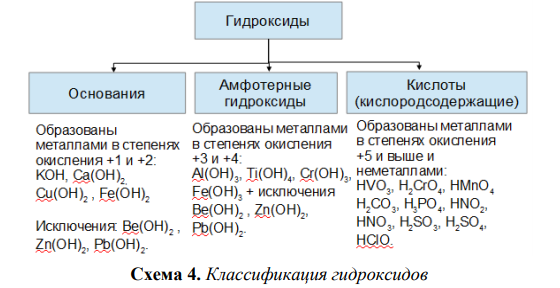
Пример : Оксиды большинства металлов, такие как Na 2 O, CaO, BaO, являются основными по своей природе.
- Оксид кальция реагирует с водой с образованием гидроксида кальция, основания.
CaO + H 2 O → Ca(OH) 2
Оксид кальция Вода Гидроксид кальция
Оксиды амфотерные
Некоторые оксиды металлов проявляют двойное поведение, то есть проявляют характеристики как кислоты, так и основания.Эти оксиды металлов известны как Амфотерные оксиды . Они могут реагировать как со щелочами, так и с кислотами.
Пример : Оксид цинка при реакции с концентрированным гидроксидом натрия ведет себя как кислый оксид, но при реакции с соляной кислотой действует как основной оксид.
ZnO + 2H 2 O + 2NaOH → Na 3 Zn[OH] 4 + H 2
Оксид цинка Вода NaOH (конц. ) Цинкат натрия Водород
) Цинкат натрия Водород
ZnO + 2HCl → ZnCl 2 + H 2 O
Оксид цинка Соляная кислота Хлорид цинка Вода
Оксид алюминия — еще один пример, который реагирует как с щелочами, так и с кислотами.
Al 2 O 3 (т) + 6NaOH (водн.) + 3H 2 O (л) → 2Na 3 [Al(OH) 6 ] (водн.)
Al 2 O 3 (т) + 6HCl (водн.) + 9H 2 O (л) → 2[Al(H 2 O) 6 ] 3+ + 6Claq — (водный)
Нейтральные оксиды
Нейтральные оксиды, как следует из названия, не проявляют склонности к образованию солей ни с кислотами, ни с основаниями.
Пример : Закись азота и окись углерода являются нейтральными оксидами.
Посмотрите это видео для получения дополнительной информации

 примечания 10 и 11 ниже):
примечания 10 и 11 ниже):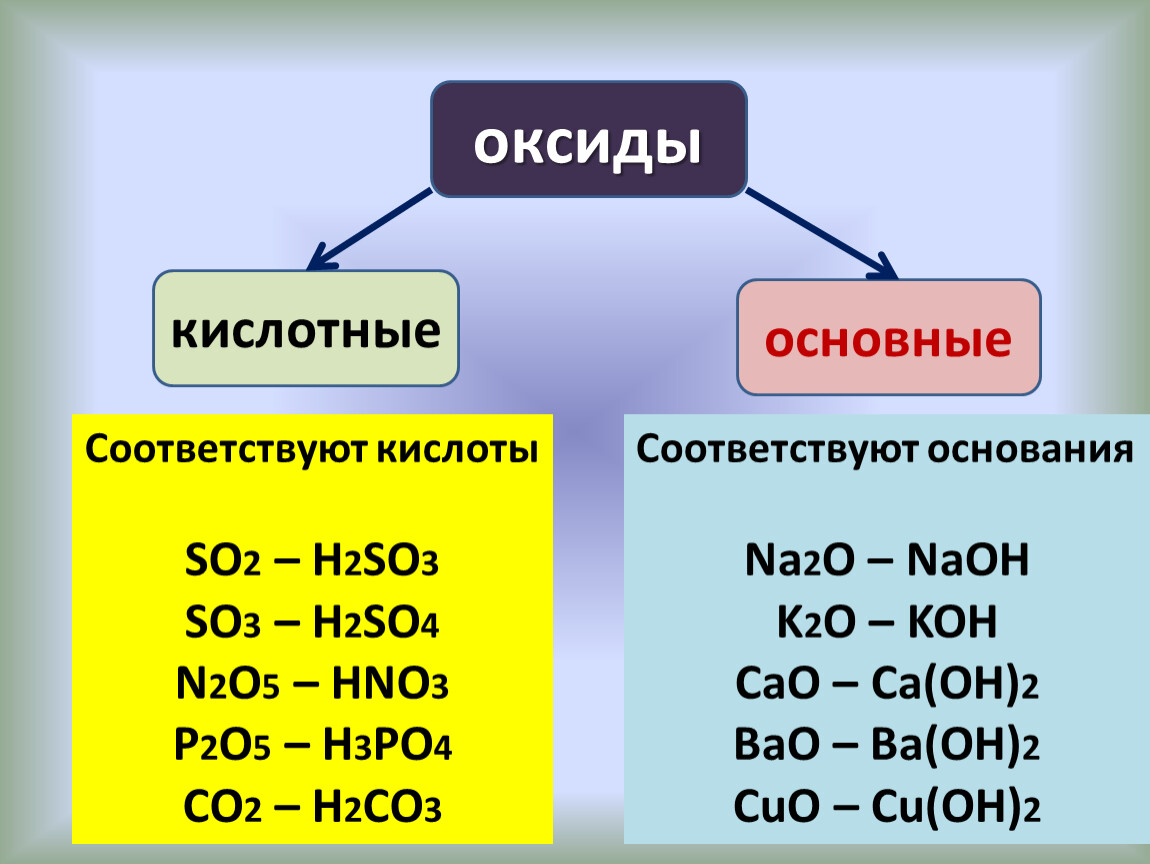 карту опасностей CLEAPSS HC067 и книгу рецептов CLEAPSS RB061.
карту опасностей CLEAPSS HC067 и книгу рецептов CLEAPSS RB061. Если времени мало, растворы могут быть предоставлены в маркированных пробирках.
Если времени мало, растворы могут быть предоставлены в маркированных пробирках.