ХИМИЯ: Алгоритмы решения типовых задач
ХИМИЯ: Алгоритмы решения типовых задач
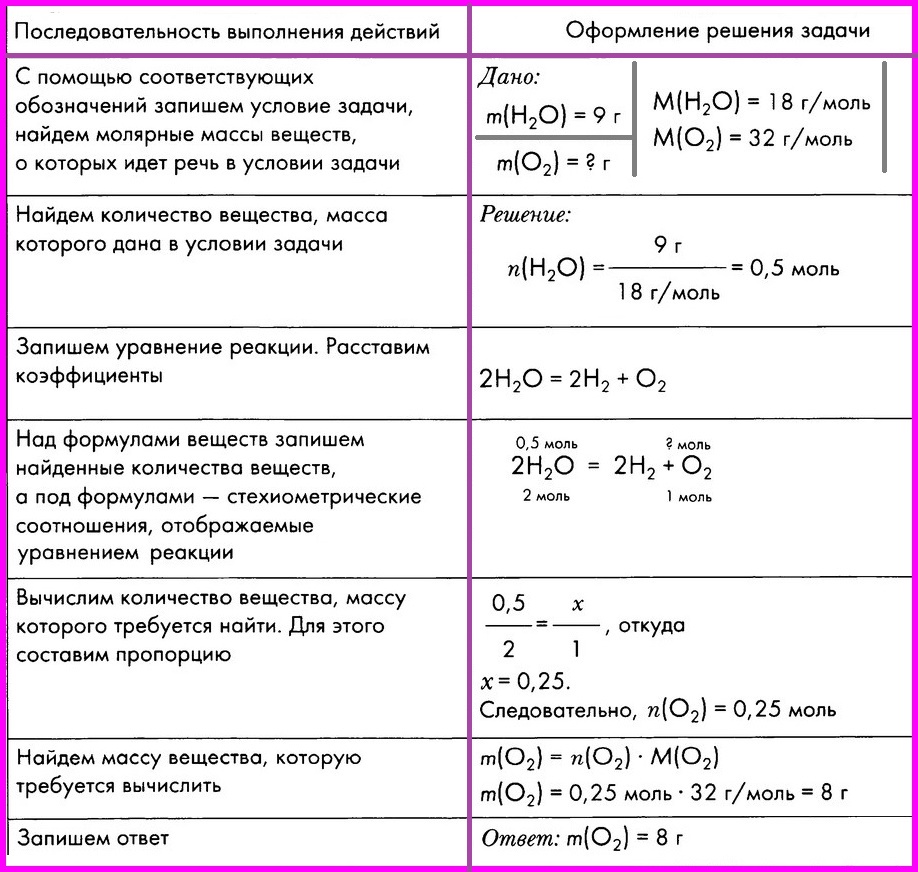
Алгоритм № 1. Вычисление массы вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.

Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.

Алгоритм № 4. Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.

Алгоритм № 5. Вычисление массовой доли вещества в растворе
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.

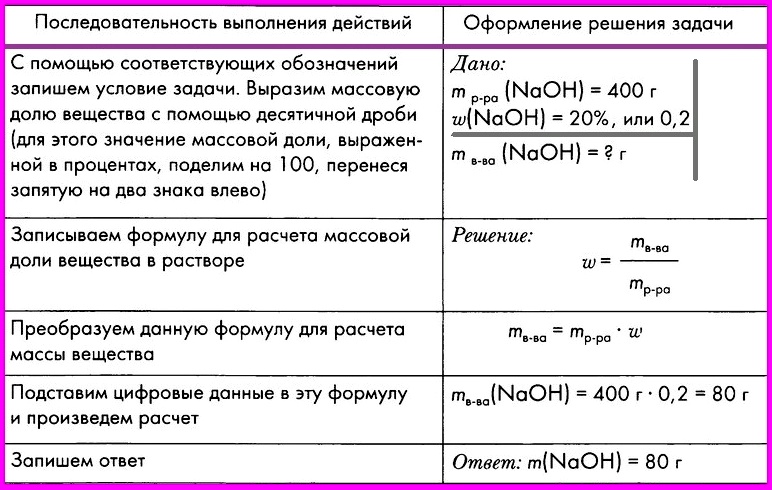
Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.
Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.

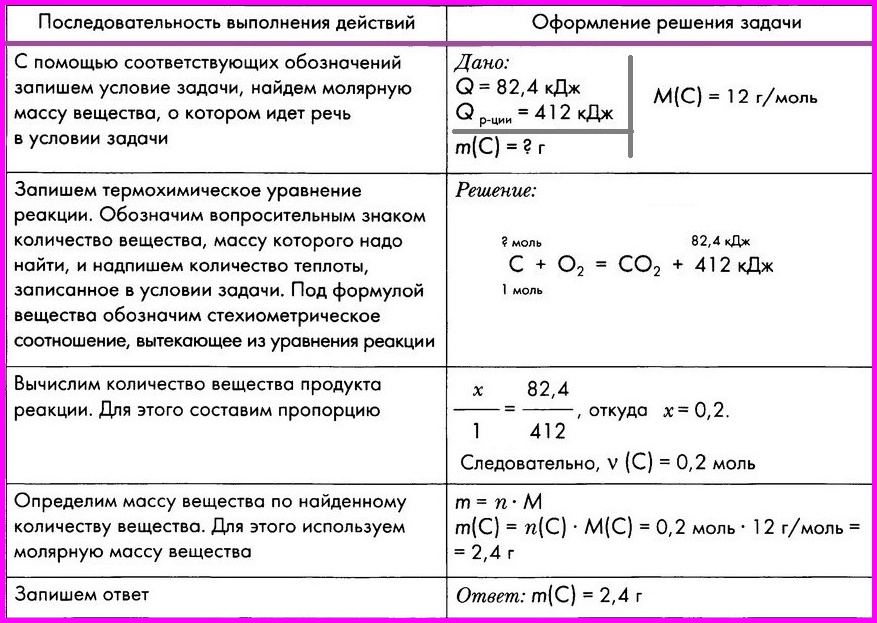
Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.

ХИМИЯ: Алгоритмы решения типовых задач. Выберите дальнейшие действия:
пошаговая инструкция для новичков :: SYL.ru
Наверное, каждый школьник или студент технического ВУЗа хотя бы раз задавался вопросом о том, как решить задачи по химии. Как показывает практика, большинство учеников считают эту науку сложной и непостижимой, часто они попросту не верят в свои силы и сдаются, так и не раскрыв свой потенциал.
На самом же деле химия является проблемой только с психологической точки зрения. Преодолев себя, осознав свои возможности, вы с легкостью освоите азы этого предмета и перейдете к более сложным вопросам. Итак, учимся решать задачи по химии быстро, правильно и легко, а также получаем максимальное удовольствие от результата.
Почему не стоит бояться вникать в науку
Химия – это не совокупность непонятных формул, обозначений и веществ. Это наука, тесно связанная с окружающей средой. Сами того не осознавая, мы сталкиваемся с ней на каждом шагу. При приготовлении пищи, влажной уборке дома, стирке, прогулке на свежем воздухе мы постоянно используем химические знания.
Следуя этой логике, когда вы поймете, как научиться решать задачи по химии, вы сможете значительно облегчить себе жизнь. А вот люди, которые сталкиваются с наукой во время учебы или работы на производстве, вообще не могут обойтись без специальных знаний и умений. Работникам медицинской сферы химия нужна не меньше, поскольку любой человек этой профессии обязан знать, как то или иное лекарство влияет на организм пациента.
Химия – это наука, которая присутствует в нашей жизни постоянно, она взаимосвязана с человеком, она является его частью. Поэтому любой ученик, осознает он это или нет, способен освоить эту отрасль знаний.

Основы химии
Прежде чем размышлять над вопросом о том, как научиться решать задачи по химии, важно понять, что без базовых знаний вам не обойтись. Азы любой науки – это фундамент ее постижения. Даже опытные специалисты при решении сложнейших задач используют эту основу, возможно, сами того не осознавая.
Итак, ознакомьтесь со списком информации, который вам понадобится:
- Валентность элементов – это фактор, с участием которого решаются любые задачи. Формулы веществ, уравнения не будут составлены правильно без этих знаний. Узнать, что такое валентность, можно в любом учебнике химии, поскольку это основное понятие, которое любой ученик должен освоить еще на первом уроке.
- Таблица Менделеева знакома практически каждому человеку. Научитесь ею правильно пользоваться, и вы сможете не удерживать у себя в голове множество сведений.
- Научитесь определять, с каким веществом вы имеете дело. Жидкое, твердое и газообразное состояние предмета, с которым вам предстоит работать, может о многом рассказать.
После получения вышеперечисленных знаний вопросов о том, как решить задачи по химии, у многих людей станет гораздо меньше. Но если вы все же так и не смогли поверить в себя, читайте далее.

Пошаговая инструкция решения любой задачи
После прочтения предыдущей информации у многих может возникнуть мнение, что крайне просто решать задачи по химии. Формулы, которые необходимо знать, возможно, действительно просты, но для освоения науки вам понадобится собрать все свое терпение, трудолюбие и настойчивость. С первого раза немногим людям удается достичь своей цели.
Со временем, при проявлении настойчивости, вы сможете решить абсолютно любую задачу. Обычно процесс состоит из таких этапов:
- Оформление краткого условия задачи.
- Составление уравнения реакции.
- Расставление коэффициентов в уравнении.
- Решение уравнения.
Опытные педагоги по химии уверяют, что для свободного решения любого типа задач нужно самостоятельно упражняться на 15 аналогичных заданиях. После этого вы свободно овладеете заданной тематикой.

Немного о теории
Нельзя размышлять о том, как решить задачи по химии, не освоив в нужной степени теоретический материал. Каким бы сухим, бесполезным и неинтересным он ни казался, это основа ваших умений. Теория применяется всегда и во всех науках. Без ее существования практика не имеет смысла. Изучайте школьную программу по химии последовательно, шаг за шагом, не пропуская даже, как вам кажется, незначительных сведений, чтобы в конечном итоге заметить прорыв в ваших знаниях.
Как решить задачи по химии: время на обучение
Часто ученики, которые освоили определенный тип задач, двигаются дальше, забывая о том, что закрепление и повторение знаний – это процесс, не менее важный, чем их получение. Каждая тема должна быть закреплена, если вы рассчитываете на долгосрочный результат. В противном случае вы очень быстро забудете всю информацию. Поэтому не ленитесь, уделите больше времени каждому вопросу.

Наконец, не забывайте о мотивации – двигателе прогресса. Хотите стать отличным химиком и удивлять окружающих огромным багажом знаний? Действуйте, старайтесь, решайте, и у вас все получится. Тогда уже с вами будут советоваться по всем химическим вопросам.
Расчётные задачи по химии. Химия, 8–9 класс: уроки, тесты, задания.
Вход Вход
Регистрация
Вход
Регистрация
 Начало
Начало
 Поиск по сайту
Поиск по сайту

 Учебные заведения
Учебные заведения
 Предметы
Предметы
 Проверочные работы
Проверочные работы
 Обновления
Обновления
 Новости
Новости
 Переменка
Переменка
 Отправить отзыв
Отправить отзыв

- Предметы
- Химия
- 8–9 класс
-
Физические величины
-
Относительная атомная и молекулярная массы. Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
Комбинированные задачи
Алгоритм решения задачи 35 (С5). Подготовка к ЕГЭ по химии. Задача №35
В настоящее время на Едином госэкзамене по химии во второй (более сложной) предлагается шесть заданий. Первые четыре не связаны с количественными расчетами, последние два — это достаточно стандартные задачи.
Этот урок целиком посвящен разбору задачи №35 (С5). Кстати, ее полное решение оценивается в три балла (из 60).
Начнем с несложного примера.
Пример 1. 10,5 г некоторого алкена способны присоединить 40 г брома. Определите неизвестный алкен.
Решение. Пусть молекула неизвестного алкена содержит n атомов углерода. Общая формула гомологического ряда CnH2n. Алкены реагируют с бромом в соответствии с уравнением:
CnH2n + Br2 = CnH2nBr2.
Рассчитаем количество брома, вступившего в реакцию: M(Br2) = 160 г/моль. n(Br2) = m/M = 40/160 = 0,25 моль.
Уравнение показывает, что 1 моль алкена присоединяет 1 моль брома, следовательно, n(CnH2n) = n(Br2) = 0,25 моль.
Зная массу вступившего в реакцию алкена и его количество, найдем его молярную массу: М(CnH2n) = m(масса)/n(количество) = 10,5/0,25 = 42 (г/моль).
Теперь уже совсем легко идентифицировать алкен: относительная молекулярная масса (42) складывается из массы n атомов углерода и 2n атомов водорода. Получаем простейшее алгебраическое уравнение:
12n + 2n = 42.
Решением этого уравнения является n = 3. Формула алкена: C3H6.
Ответ: C3H6.
Приведенная задача — типичный пример задания №35. 90% реальных примеров на ЕГЭ строятся по аналогичной схеме: есть некоторое органическое соединение X, известен класс, к которому оно относится; определенная масса X способна прореагировать с известной массой реагента Y. Другой вариант: известна масса Y и масса продукта реакции Z. Конечная цель: идентифицировать Х.
Алгоритм решения подобных заданий также достаточно очевиден.
- 1) Определяем общую формулу гомологического ряда, к которому относится соединение Х.
- 2) Записываем реакцию исследуемого вещества Х с реагентом Y.
- 3) По массе Y (или конечного вещества Z) находим его количество.
- 4) По количеству Y или Z делаем вывод о количестве Х.
- 5) Зная массу Х и его кол-во, рассчитываем молярную массу исследуемого вещества.
- 6) По молярной массе X и общей формуле гомологического ряда можно определить молекулярную формулу Х.
- 7) Осталось записать ответ.
Рассмотрим этот алгоритм подробнее, по пунктам.
1. Общая формула гомологического ряда
Наиболее часто используемые формулы сведены в таблицу:
| Гомологический ряд | Общая формула |
| Алканы | CnH2n+2 |
| Алкены | CnH2n |
| Алкины | CnH2n-2 |
| Диены | CnH2n-2 |
| Арены | CnH2n-6 |
| Предельные одноатомные спирты | CnH2n+1ОН |
| Предельные альдегиды | CnH2n+1СОН |
| Предельные монокарбоновые кислоты | CnH2n+1СОOН |
Кстати, нет необходимости механически запоминать формулы всевозможных гомологических рядов. Это не только невозможно, но и не имеет ни малейшего смысла! Гораздо проще научиться самостоятельно выводить эти формулы. Как это сделать, я, возможно, расскажу в одной из следующих публикаций.
2. Уравнение реакции
Нет надежды, что мне удастся перечислить ВСЕ реакции, которые могут встретиться в задаче 35. Напомню лишь наиболее важные:
1) ВСЕ органические вещества горят в кислороде с образованием углекислого газа, воды, азота (если в соединении присутствует N) и HCl (если есть хлор):
CnHmOqNxCly + O2 = CO2 + H2O + N2 + HCl (без коэффициентов!)
2) Алкены, алкины, диены склонны к реакциям присоединения (р-ции с галогенами, водородом, галогенводородами, водой):
CnH2n + Cl2 = CnH2nCl2
CnH2n + H2 = CnH2n+2
CnH2n + HBr = CnH2n+1Br
CnH2n + H2O = CnH2n+1OH
Алкины и диены, в отличие от алкенов, присоединяют до 2 моль водорода, хлора или галогенводорода на 1 моль углеводорода:
CnH2n-2 + 2Cl2 = CnH2n-2Cl4
CnH2n-2 + 2H2 = CnH2n+2
При присоединении воды к алкинам образуются карбонильные соединения, а не спирты!
3) Для спиртов характерны реакции дегидратации (внутримолекулярной и межмолекулярной), окисления (до карбонильных соединений и, возможно, далее до карбоновых кислот). Спирты (в т.ч., многоатомные) реагируют с щелочными металлами с выделением водорода:
CnH2n+1OH = CnH2n + H2O
2CnH2n+1OH = CnH2n+1OCnH2n+1 + H2O
2CnH2n+1OH + 2Na = 2CnH2n+1ONa + H2
4) Химические свойства альдегидов весьма разнообразны, однако здесь мы вспомним лишь об окислительно — восстановительных реакциях:
CnH2n+1COH + H2 = CnH2n+1CH2OH (восстановление карбонильных соединений в прис. Ni),
CnH2n+1COH + [O] = CnH2n+1COOH
Для последней реакции записана лишь схема, поскольку в качестве окислителей могут выступать разные соединения.
Обращаю внимание на весьма важный момент: окисление формальдегида (НСОН) не останавливается на стадии муравьиной кислоты, НСООН окисляется далее до СО2 и Н2О.
5) Карбоновые кислоты проявляют все свойства «обычных» неорганических кислот: взаимодействуют с основаниями и основными оксидами, реагируют с активными металлами и солями слабых кислот (напр., с карбонатами и гидрокарбонатами). Весьма важной является реакция этерификации — образование сложных эфиров при взаимодействии со спиртами.
CnH2n+1COOH + KOH = CnH2n+1COOK + H2O
2CnH2n+1COOH + CaO = (CnH2n+1COO)2Ca + H2O
2CnH2n+1COOH + Mg = (CnH2n+1COO)2Mg + H2
CnH2n+1COOH + NaHCO3 = CnH2n+1COONa + H2O + CO2
CnH2n+1COOH + C2H5OH = CnH2n+1COOC2H5 + H2O
Ну, кажется, пора остановиться — я же не собирался писать учебник по органической химии. В заключение этого раздела хотелось бы еще раз напомнить о коэффициентах в уравнениях реакций. Если вы забудете их расставить (а такое, к сожалению, встречается слишком часто!) все дальнейшие количественные расчеты, естественно, становятся бессмысленными!
3. Нахождение количества вещества по его массе (объему)
Здесь все очень просто! Любому школьнику знакома формула, связывающая массу вещества (m), его количество (n) и молярную массу (M):
m = n*M или n = m/M.
Например, 710 г хлора (Cl2) соответствует 710/71 = 10 моль этого вещества, поскольку молярная масса хлора = 71 г/моль.
Для газообразных веществ удобнее работать с объемами, а не с массами. Напомню, что количество вещества и его объем связаны следующей формулой: V = Vm*n, где Vm — молярный объем газа (22,4 л/моль при нормальных условиях).
4. Расчеты по уравнениям реакций
Это, наверное, главный тип расчетов в химии. Если вы не чувствуете уверенности при решении подобных задач, необходимо тренироваться.
Основная идея заключается в следующем: количества реагирующих веществ и образующихся продуктов относятся так же, как соответствующие коэффициенты в уравнении реакции (вот почему так важно правильно их расставить!)
Рассмотрим, например, следующую реакцию: А + 3B = 2C + 5D. Уравнение показывает, что 1 моль А и 3 моль B при взаимодействии образуют 2 моль C и 5 моль D. Количество В в три раза превосходит количество вещества А, количество D — в 2,5 раза больше количества С и т. д. Если в реакцию вступит не 1 моль А, а, скажем, 10, то и количества всех остальных участников реакции увеличатся ровно в 10 раз: 30 моль В, 20 моль С, 50 моль D. Если нам известно, что образовалось 15 моль D (в три раза больше, чем указано в уравнении), то и количества всех остальных соединений будут в 3 раза больше.
5. Вычисление молярной массы исследуемого вещества
Масса Х обычно дается в условии задачи, количество Х мы нашли в п. 4. Осталось еще раз использовать формулу М = m/n.
6. Определение молекулярной формулы Х.
Финальный этап. Зная молярную массу Х и общую формулу соответствующего гомологического ряда, можно найти молекулярную формулу неизвестного вещества.
Пусть, например, относительная молекулярная масса предельного одноатомного спирта равна 46. Общая формула гомологического ряда: CnH2n+1ОН. Относительная молекулярная масса складывается из массы n атомов углерода, 2n+2 атомов водорода и одного атома кислорода. Получаем уравнение: 12n + 2n + 2 + 16 = 46. Решая уравнение, получаем, что n = 2. Молекулярная формула спирта: C2H5ОН.
Задача решена. Не забудьте записать ответ!
Конечно, не все задачи С 5 полностью соответствуют приведенной схеме. Никто не может дать гарантии, что на реальном ЕГЭ по химии вам попадется что-либо, дословно повторяющее приведенные примеры. Возможны незначительные вариации и даже сильные изменения. Все это, однако, не слишком важно! Не следует механически запоминать приведенный алгоритм, важно понять СМЫСЛ всех пунктов. Если будет понимание смысла, никакие изменения вам не страшны!
В следующей части мы рассмотрим несколько типичных примеров.