Как уравнивать химические уравнения?
Для того, чтобы научится уравнивать химические уравнения, сначала нужно выделять главные моменты и использовать правильный алгоритм.
Ключевые моменты
Выстроить логику процесса несложно. Для этого выделим следующие этапы:
- Определение типа реагентов (все реагенты органические, все реагенты неорганические, органические и неорганические реагенты в одной реакции)
- Определение типа химической реакции (реакция с изменением степеней окисления компонентов или нет)
- Выделение проверочного атома или группы атомов
Примеры
- Все компоненты неорганические, без изменения степени окисления, проверочным атомом будет кислород – О (его не затронули никакие взаимодействия:
NaОН + НCl = NaCl + h3O
Посчитаем количество атомов каждого элементов правой и левой части и убедимся, что здесь не требуется расстановка коэффициентов (по умолчанию отсутствие коэффициента – это коэффициент равный 1)
NaOH + h3SO4 = Na2
В данном случае, в правой части уравнения мы видим 2 атома натрия, значит в левой части уравнения нам нужно подставить коэффициент 2 перед соединением, содержащим натрий:
2NaOH + h3SO4 = Na2SO4 + h3O
Проверяем по кислороду — О: в левой части 2О из NaОН и 4 из сульфат иона SO4, а в правой 4 из SO4 и 1 в воде. Добавляем 2 перед водой:
Добавляем 2 перед водой:
2NaOH + h3SO4 = Na2SO4 +2h3O
- Все компоненты органические, без изменения степени окисления:
НООС-СOOH + Ch4OH = Ch4OOC-COOCh4 + h3O (реакция возможна при определенных условиях)
В данном случае мы видим, что в правой части 2 группы атомов Ch4, а в левой только одна. Добавляем в левую часть коэффициент 2 перед Ch4OH, проверяем по кислороду и добавляем 2 перед водой
НООС-СOOH + 2Ch4OH = Ch4OOC-COOCh4 + 2h3O
- Органический и неорганические компоненты без изменения степеней окисления:
Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
В данной реакции проверочный атом необязателен. В левой части 1 молекула метиламина Ch4Nh3, а в правой 2. Значит нужен коэффициент 2 перед метиламином.
2Ch4Nh3 + h3SO4 = (Ch4Nh3)2∙SO4
- Органический компонент, неорганический, изменение степени окисления.
СuO + C2H5OH = Cu + Ch4COOH + Н2O
В данном случае необходимо составить электронный баланс, а формулы органических веществ лучше преобразовать в брутто. Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
Проверочным атомом будет кислород – по его количеству видно, что коэффициенты не требуются, электронный баланс подтверждает
CuO + C2H6O = Cu + C2h5O2
Cu+2 +2e = Cu0
2С +2 — 2е = 2С0
C3H8 + O2 = CO2 + h3O
Здесь O не может быть проверочным, так как сам меняет степень окисления. Проверяем по Н.
О2 0 + 2*2 е = 2O-2 (речь идет о кислороде из CO2)
3С (-8/3 ) — 20е = 3С +4 (в органических окислительно-восстановительных реакциях используют условные дробные степени окисления)
Из электронного баланса видно, что для окисления углерода требуется в 5 раз больше кислорода. Ставим 5 перед O2, также из электронного баланса м должны поставить 3 перед С из СО2, проверим по Н, и поставим 4 перед водой
C3H8 + 5O2 = 3CO2 + 4h3O
- Неорганические соединения, изменение степеней окисления.
Na2SO3 + KMnO4 + h3SO4 = Na2SO4 + K2SO4 + Н2О + MnO2
Проверочными будут водороды в воде и кислотные остатки SO4 2- из серной кислоты.
S+4 (из SO3 2-) – 2e = S +6(из Na2SO4)
Mn+7 + 3e = Mn+4
Таким образом нужно поставить 3 перед Na2SO3 и Na2SO4, 2 перед КМnO4 и MNO2.
3Na2SO3 + 2KMnO4 + h3SO4 = 3Na2SO4 + K2SO4 + Н2О +2MnO2
Урок химии в 8-м классе по теме «Химические уравнения»
Цель: научить учащихся составлять химические уравнения. Научить их уравнивать с помощью коэффициентов на основе знания закона сохранения массы вещества М.В. Ломоносова.
Задачи:
- Образовательные:
- продолжить изучение физических и химических явлений с введением понятия «химическая реакция»,
- ввести понятие «химическое уравнение»;
- научить учащихся составлять химические уравнения, уравнивать уравнения с помощью коэффициентов.
- Развивающие:
- продолжить развивать творческий потенциал
личности учащихся через создание ситуации
проблемного обучения, наблюдения, проведения
опытов химических реакций.

- продолжить развивать творческий потенциал
личности учащихся через создание ситуации
проблемного обучения, наблюдения, проведения
опытов химических реакций.
- Воспитательная:
- воспитать умение работать в команде, группе.
Оборудование: табличный материал, справочники, алгоритмы, набор заданий.
Д/О: «Горение бенгальских огней»:, спички, сухое горючее, железный лист/ ТБ при работе с огнём.
ХОД УРОКА
I. Организационный момент
Определение цели урока.
II. Повторение
1) На доске набор физических и химических явлений: испарение воды; фильтрование; ржавление; горение дров; скисание молока; таяние льда; извержение вулкана; растворение сахара в воде.
Задание:
Дать пояснение каждому явлению, назвать практическое применение данного явления в жизни человека.
2) Задание:
На доске нарисована капля воды. Создать полную
схему превращения воды из одного агрегатного
состояния в другое.
III. Д/О «Горение бенгальских огней»
1. Что происходит с магнием, который составляет
основу бенгальского огня ?
2. Что явилось основной причиной такого явления?
3. К какому типу относится данная химическая
реакция?
4. Попробуйте схематично изобразить химическую
реакцию, которую вы наблюдали в этом опыте.
– Предлагаю попробовать составить схему данной реакции:
Mg + воздух = другое вещество
– Как мы узнали, что получилось другое
вещество? (По признакам химической реакции:
изменение окраски, появление запаха.)
– Какой газ находится в воздухе, который
поддерживает горение? (Кислород – О)
IV. Новый материал
Химическую реакцию можно записывать с помощью
химического уравнения.
Можно вспомнить понятия «уравнение», которое
дается в математике. В чем суть самого уравнения?
Что-то уравнивают, какие-то части.
Попробуем дать определение «химического
уравнения», можно смотреть на схему и попытаться
дать определение:
2Mg + О2 = 2 MgО
Химическое уравнение – это условная запись
химической реакции с помощь химических знаков,
формул и коэффициентов.
Химические уравнения записываются на основе
Закона сохранения массы вещества, открытого
М.В.Ломоносовым в 1756 году, который гласит (учебник
стр. 96): «Масса веществ, вступивших в реакцию,
равна массе веществ, получившихся в результате
её».
– Для того чтобы хорошо научиться составлять химические уравнения, нам необходимо вспомнить:
– Что такое коэффициент?
– Что такое индекс?
Не забываем алгоритм «Составление химических формул».

Предлагаю пошаговый алгоритм составления химического уравнения:
V. Составления химического уравнения
1. Записываю в левой части уравнение вступающие в реакцию вещества: Al + O2
2. Ставлю знак «=» и записываю образующиеся вещества в правой части уравнения – продукты реакции: Al + O2 = Al2O3
3. Уравнивать начинаю с того химического элемента, которого больше или с кислорода, затем составляю конструкцию:
Al + O2 = Al2O3
2 /6 3
вступило кислорода «2», а получилось «3», их число не равно.
4. Ищу НОК (наименьшее общее кратное) двух цифр «2» и «3» – это «6»
5. Делю НОК «6» на число «2» и «3»и выставляю в качестве коэффициентов перед формулами.
Al + 3O2 = 2Al2O3
6 = 6
6. Начинаю уравнивать следующие химические
элементы – Al, рассуждаю так же. Вступило Al «1», а
получилось «4», ищу НОК
Начинаю уравнивать следующие химические
элементы – Al, рассуждаю так же. Вступило Al «1», а
получилось «4», ищу НОК
Al + 3O2 = 2Al2O3
1 /4 4
4 = 4
4 Al + 3O2 = 2Al2O3
Коэффициент «1» в уравнениях не пишется, но учитывается при составлении уравнения.
7. Читаю всю запись химического уравнения.
Такое долгое рассуждение позволяет быстро научиться уравнивать в химических уравнениях, учитывая, что правильное составление уравнений реакций для химии имеет большое значение: решение задач, написание химических реакций.
VI. Задание на закрепление
Фосфор + кислород = оксид фосфора (V)
Серная кислота + алюминий = сульфат алюминия +
водород
Вода = водород + кислород
– Работает на доске один сильный ученик.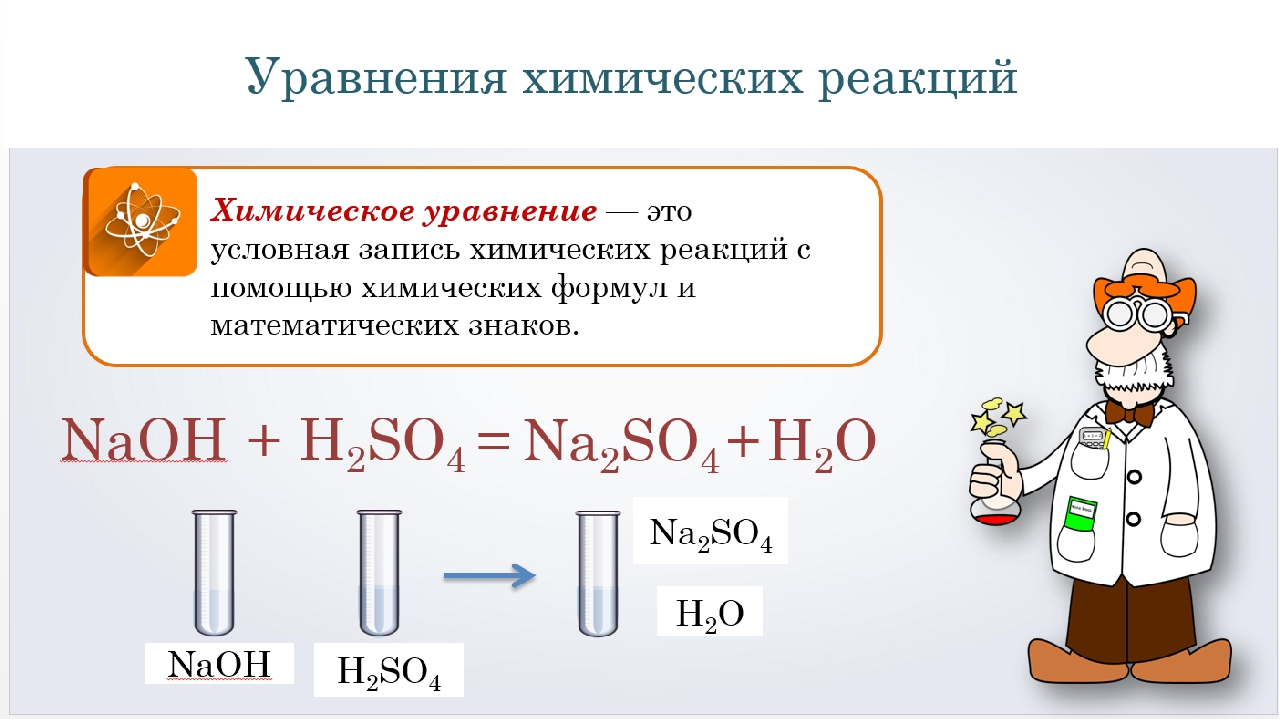
Zn + O2 = ZnO;
H2 + O2 = H2O;
Ba + O2 = BaO;
S + O2= SO2;
Na + O2 = Na2O2;
Fe + O2 = Fe3O4
– Расставить коэффициенты в уравнениях химических реакций.
Химические уравнения отличаются по типам, но это мы рассмотрим на следующем уроке.
VII. Подведение итогов урока
Вывод. Выставление оценок.
VIII. Домашнее задание: § 27, упр. 2, с. 100.
Дополнительный материал: Р.т.с. 90-91, упражнение 2 – индивидуально.
| 1. |
Химическая реакция
Сложность: лёгкое |
1 |
2.
|
Реагенты и продукты реакции
Сложность: лёгкое |
1 |
| 3. |
Сколько атомов в формуле?
Сложность: лёгкое |
1 |
4.
|
Пропущенный коэффициент
Сложность: среднее |
2 |
| 5. |
Найди ошибку в уравнении реакции
Сложность: среднее |
2 |
6.
|
Характеристика реакции
Сложность: среднее |
3 |
| 7. |
Допиши уравнение
Сложность: сложное |
3 |
8.
|
Соответствие между реагентами и продуктами реакции
Сложность: сложное |
3 |
| 9. |
Запиши уравнение реакции
Сложность: сложное |
4 |
Вопрос: Как балансировать химические уравнения? — Образование и коммуникации
Содержание статьи:
Расстановка коэффициентов в химическом уравнении
Показать описаниеХимия 8 класс Химические уравнения.
На этом уроке ты узнаешь что такое схема химической реакции и химическое уравнение, научишься расставлять коэффициенты и превращать схему в уравнение..
подписаться на мой канал здесь https://www.youtube.com/channel/UCEOKbTCXJH8HlF6rRTwtfDw?view_as=subscriber.
#химияснуля, #егэхимия, #огэхимия, #законсохранения, #законсохранениямассывещества, #схемареакции, #химическоеуравнение, #коэффициенты, #превратитьсхемувуравнение, #расставитькоэффициенты, #правилорасстановкикоэффициентов, #какрасставитькоэффициенты
Видео взято с канала: Oksana Antares
Химия 8 Типы химических реакций
Показать описание✓ Наши репетиторы https://znaika.ru/teachers.
✓ Официальный сайт http://znaika.ru/.
Арина Данилова https://youtu.be/DTnkkN9jwbY.
Кто обидел Соболева? https://youtu.be/CDhbRQiUHsY.
В ходе проведения урока, пойдет речь о типах химических реакций. Будет рассказано о простых и сложных веществах, будут приведены примеры разных химических реакций. Учащиеся узнают о классификации химических реакций, а также получат сведения о реакциях разложения, соединения, обмена и замещения. В конце занятия, будут подведены краткие итоги по изученному материалу..
Учащиеся узнают о классификации химических реакций, а также получат сведения о реакциях разложения, соединения, обмена и замещения. В конце занятия, будут подведены краткие итоги по изученному материалу..
★ПОДПИСАТЬСЯ НА КАНАЛ★.
➜ https://www.youtube.com/channel/UCWmEVmo5Wf-z9x8fQTvWnuw?sub_confirmation=1.
Znaika TV Образовательно-развлекательный канал для школьников. Знайка ТВ Учись интересно!.
Образовательно-развлекательный канал для школьников. Онлайн школа будущего. Видео-уроки, профессии будущего, подготовка к олимпиадам и ЕГЭ, интересные опыты и эксперименты, любопытные факты, школьные лайфхаки, интервью со “звездами” и популярными блогерами, DIY, мастер-классы, челленджи, конкурсы, ответы на вопросы — все самое полезное и интересное о школе, школьной программе и школьной жизни!
▰▰▰▰▰▰▰▰▰▰ ПОПУЛЯРНОЕ ВИДЕО ▰▰▰▰▰▰▰▰▰▰.
Истории | School Life ➜ https://goo.gl/hLHt65.
Большая перемена | Fun ➜ https://goo.gl/3GYbRo.
Раздевалка | School fashion ➜ https://goo. gl/8on1R1.
gl/8on1R1.
Каникулы | Adventure ➜ https://goo.gl/NDofCa.
Мастер-классы | DIY ➜ https://goo.gl/xfdjyK.
Полезные советы | School Lifehacks ➜ https://goo.gl/xqWh5T.
Звездолет | Stars ➜ https://goo.gl/SK6r8e.
Олимпиады, ЕГЭ | Сompetition ➜ https://goo.gl/h9GAKq.
Неизведанное | Experiments&Discoveries ➜ https://goo.gl/G777DK.
Будущее | Generation Z ➜ https://goo.gl/WnXJtH.
Видеоуроки | School library ➜ https://goo.gl/HqThC2.
▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰▰.
★МЫ В СОЦИАЛЬНЫХ СЕТЯХ★.
►ВКонтакте: https://vk.com/znaika_ru.
►Facebook: https://www.facebook.com/znaika.tv.
►Instagram: https://www.instagram.com/znaika.ru/.
►Одноклассники: https://ok.ru/znaika.club.
►Twitter: https://twitter.com/znaika_tv.
Библиотека видеоуроков на сайте: https://goo.gl/q3LQsG
Видео взято с канала: Образование. Обучение Znaika TV. Знайка.ру
25. Схема реакции и химическое уравнение
Показать описаниеВ этом уроке ты узнаешь что такое схема химической реакции и химическое уравнение, научишься расставлять коэффициенты и превращать схему в уравнение. .
.
#химияснуля, #егэхимия, #огэхимия, #химиянаотлично, #законсохранения, #законсохранениямассывещества, #схемареакции, #химическоеуравнение, #коэффициенты, #превратитьсхемувуравнение, #расставитькоэффициенты, #правилорасстановкикоэффициентов, #какрасставитькоэффициенты
Видео взято с канала: Птичка Химичка -Химия с Нуля-
89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)
Видео взято с канала: Химия для школьников. доступно
Расстановка коэффициентов в химических реакциях: как просто это сделать
Видео взято с канала: Подготовка к ОГЭ и ЕГЭ
Как уравнивать химические реакции? | Открытый урок | EASY PEASY
Видео взято с канала: Подготовка к ОГЭ онлайн-школа EASY PEASY
Балансирование химических уравнений
Видео взято с канала: KhanAcademyRussian
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).
Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции — водорода и кислорода – справа. Между ними поставим стрелку:
Н2О → Н2 + О2
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Видео — эксперимент: “Нагревание смеси железа и серы”
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
III. Алгоритм составления уравнения химической реакции
|
Составим уравнение химической реакции взаимодействия фосфора и кислорода |
|
1. P + O2 → |
|
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 |
|
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
4P + 5O2 = 2P2O5 |
IV. Работа с тренажерами
V. Задания для закрепления
Задание №1
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
Задание №2
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S
Ответы | § 14.
 Составление уравнений химических реакций — Химия, 7 класс
Составление уравнений химических реакций — Химия, 7 класс1. Что обозначает схема химической реакции? Чем она отличается от уравнения химической реакции?
Уравнение химической реакции – это условная запись реакции с помощью химических формул и знаков «+», «-», «=».
Схема показывает только формулы исходных и конечных веществ. Между ними ставят стрелку, не расставляют коэффициенты.
2. Почему число атомов каждого элемента в обеих частях химического уравнения должно быть одинаковым?
Составление химических уравнений основано на законе сохранения массы веществ при химических реакциях.
3. Какие из приведенных записей представляют собой схемы химических реакций, а какие — уравнения:
а) CaCO3 = CaO + CO2↑;
б) CH4 + O2→ CO2 + H2O;
в) Ca(OH)2 + 2HCl = CaCl2 + 2H2O;
Схемы химических реакция – б, г; уравнения – а, в.
4. Перечислите основные действия, которые необходимо выполнить, чтобы составить уравнение химической реакции.
1. составить формулы исходных и конечных веществ.
2. формулы исходных веществ записать слева, конечных справа.
3. уравнять числа атомов каждого элемента до и после реакции.
4. поставить знак «=».
5. Составьте уравнения химических реакций, приняв во внимание, что в образующихся веществах азот проявляет валентность три, а сера — два: а) магний + азот; б) калий + сера; в) алюминий + азот; г) алюминий + сера.
а) 3Mg+N2=Mg3N2
б) 2K + S = K2S
в) 4Al+3N2=2Al2N3
г) 2Al+3S=Al2S
6. Составьте уравнения химических реакций:
а) Zn + O2 → ; б) H2 + Cl2 → ; в) KClO3 →KCl + O2; г) Al + O2 →Al2О3.
а) 2Zn + O2 =2ZnO
б) H2 + Cl2 = 2HCl
в) 2KClO3 = 2KCl + 3O2↑
г) 4Al + 3O2 = 2Al2О3
7. Вместо знака вопроса запишите формулы веществ и составьте уравнения химических реакций:
а) HgO → Hg + ?; б) H2O→ O2 + ?; в) P + O2 →?; г) Ca + O2 = ?; д) Fe + ? →FeCl3; е) Al + S → ?.
а) 2HgO = 2Hg + O2↑
б) H2O= O2↑ + 2H2
в) 4P + 5O2 = 2P2O5
г) 2Ca + O2 = 2CaO
д) 2Fe + 3Cl2 = 2FeCl3
е) 2Al +3S = Al2S3
8. Для остановки кровотечения и дезинфекции раны ее обрабатывают раствором вещества Н2О2 (т. н. перекиси водорода). При контакте с кровью оно превращается в два новых вещества — Н2О и О2.
 Напишите уравнение соответствующей реакции.
Напишите уравнение соответствующей реакции.9. Перечислите важнейшие химические реакции, протекающие в: а) природе; б) живых организмах; в) быту; г) промышленности.
а) образование озона при грозе, фотосинтез
б) расщепление питательных веществе с целью получения энергии, пищеварение, свёртываемость крови
в) приготовление творога, брожение сока, горение угля, прокисание молока
г) получение металлов из руд, переработка отходов, получение удобрений
Присоединяйтесь к Telegram-группе @superresheba_7, делитесь своими решениями и пользуйтесь материалами, которые присылают другие участники группы!Урок 7. закон сохранения массы веществ. химические уравнения.коэффициенты в уравнениях реакций. типы химических реакций — Химия — 8 класс
Конспект
Закон сохранения массы веществ. Химические уравнения. Коэффициенты в уравнениях реакций
В 1748 году Михаил Васильевич Ломоносов в письме к выдающемуся математику Леонарду Эйлеру написал следующее: «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому. ..». Так Михаил Васильевич сформулировал один из результатов своих опытов по прокаливанию металлов, который стал известен как закон сохранения массы веществ. Суть опытов сводилась к следующему: Ломоносов взвешивал металлы в запаянных ретортах, затем прокаливал содержимое реторты, а потом взвешивал опять. В результате проделанного опыта масса не изменялась. В 1774 году французский химик Антуан Лавуазье, независимо от М.В. Ломоносова, повторил опыты по прокаливанию металлов, на основании которых также сделал вывод о том, что в процессе химической реакции масса веществ не изменяется.
..». Так Михаил Васильевич сформулировал один из результатов своих опытов по прокаливанию металлов, который стал известен как закон сохранения массы веществ. Суть опытов сводилась к следующему: Ломоносов взвешивал металлы в запаянных ретортах, затем прокаливал содержимое реторты, а потом взвешивал опять. В результате проделанного опыта масса не изменялась. В 1774 году французский химик Антуан Лавуазье, независимо от М.В. Ломоносова, повторил опыты по прокаливанию металлов, на основании которых также сделал вывод о том, что в процессе химической реакции масса веществ не изменяется.
В настоящее время закон сохранения массы формулируется так: «масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ».
Химическая реакция – это процесс превращения одних веществ в другие. А каждое вещество имеет свой состав, который можно записать при помощи химической формулы. Это значит, что и химическую реакцию можно записать при помощи условных обозначений.
Химическая реакция между магнием и серой протекает очень бурно. Как же можно записать эту химическую реакцию? В ней магний взаимодействует с серой. Продуктом этой реакции является сульфид магния, вещество, которое состоит из магния и серы. Валентности магния и серы в этом веществе одинаковы: Mg + S = MgS. Магний и сера в этой реакции будут исходными веществами, а сульфид магния – продуктом реакции.
Как же можно записать эту химическую реакцию? В ней магний взаимодействует с серой. Продуктом этой реакции является сульфид магния, вещество, которое состоит из магния и серы. Валентности магния и серы в этом веществе одинаковы: Mg + S = MgS. Магний и сера в этой реакции будут исходными веществами, а сульфид магния – продуктом реакции.
Рассмотрим реакцию между магнием и кислородом. Продукт реакции – оксид магния: Mg + O2 → MgO. Обратите внимание на знак, разделяющий исходные вещества и продукты реакции. Если масса веществ в ходе химической реакции не изменяется, то неизменным является и состав атомов, которые входят в исходные вещества и продукты реакции. А у нас число атомов кислорода в исходных веществах и в продуктах реакции различны. Чтобы прошла эта реакция, молекула кислорода должна вступить в реакцию с двумя атомами магния: 2Mg + O2 = 2MgO. Вот теперь у нас получилось уравнение химической реакции.
Уравнение химической реакции – условная запись химической реакции посредством математических знаков, химических формул и коэффициентов. Уравнение химической реакции показывает сущность химической реакции с позиции атомно-молекулярной теории, т.е. в левой и правой части уравнения должно быть одинаковое число атомов. Для характеристики количественных соотношений между массами вещество вступивших в реакцию и продуктами реакции используют коэффициенты.
Уравнение химической реакции показывает сущность химической реакции с позиции атомно-молекулярной теории, т.е. в левой и правой части уравнения должно быть одинаковое число атомов. Для характеристики количественных соотношений между массами вещество вступивших в реакцию и продуктами реакции используют коэффициенты.
Рассмотрим процесс составления уравнения реакции на примере взаимодействия фосфора с кислородом.
1. Запишем исходные вещества P + O2
2. Составим продукт реакции исходя из валентностей элементов P + O2 → P2O5
3. Определим коэффициенты перед веществами, содержащими кислород. Чтобы число атомов кислорода стало одинаковым, поставим перед молекулой кислорода коэффициент 5, а перед оксидом фосфора 2, таким образом, число атомов кислорода в левой и правой частях уравнения стало одинаковым: P + 5O2 → 2P2O5
4. Коэффициент перед формулой относится к атомам всех химических элементов в веществе. Поэтому в правой части уравнения стало 4 атома фосфора. Для того, чтобы число атомов фосфора было равным, поставим коэффициент 4 перед фосфором в исходном веществе: 4P + 5O2 = 2P2O5
Теперь у нас получилось уравнение химической реакции взаимодействия фосфора с кислородом с образованием оксида фосфора (V).
Справочный материал:
• Закон сохранения массы веществ – масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
• Уравнение химической реакции – условная запись химической реакции посредством математических знаков, химических формул и коэффициентов.
• Уравнение химической реакции показывает сущность химической реакции с позиции атомно-молекулярной теории.
• Коэффициенты в уравнении химических реакций (стехиометрические коэффициенты) – цифры, стоящие перед химическими формулами, характеризуют количественные соотношения между массами вещество вступивших в реакцию и продуктами реакции.
• Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
Как сбалансировать химические уравнения: 11 шагов (с изображениями)
Об этой статье
Соавторы:
Ученый-эколог
Соавтором этой статьи является Bess Ruff, MA. Бесс Рафф — аспирант по географии в Университете штата Флорида. Она получила степень магистра наук об окружающей среде и менеджменте в Калифорнийском университете в Санта-Барбаре в 2016 году.Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала поддержку в исследованиях в качестве аспиранта Группы по устойчивому рыболовству. Эту статью просмотрели 4 287 589 раз (а).
Бесс Рафф — аспирант по географии в Университете штата Флорида. Она получила степень магистра наук об окружающей среде и менеджменте в Калифорнийском университете в Санта-Барбаре в 2016 году.Она проводила исследования для проектов морского пространственного планирования в Карибском бассейне и оказывала поддержку в исследованиях в качестве аспиранта Группы по устойчивому рыболовству. Эту статью просмотрели 4 287 589 раз (а).Соавторы: 164
Обновлено: 3 декабря 2021 г.
Просмотры: 4,287,589
Резюме статьиX Чтобы сбалансировать химическое уравнение, сначала запишите данную формулу с реагентами слева от стрелки и продуктами справа.Например, ваше уравнение должно выглядеть примерно так: «h3 + O2 → h3O». Подсчитайте количество атомов в каждом элементе с каждой стороны уравнения и перечислите их под этой стороной. В уравнении h3 + O2 → h3O 2 атома водорода добавляются к 2 атомам кислорода слева, поэтому вы должны написать «H = 2» и «O = 2» под левой стороной.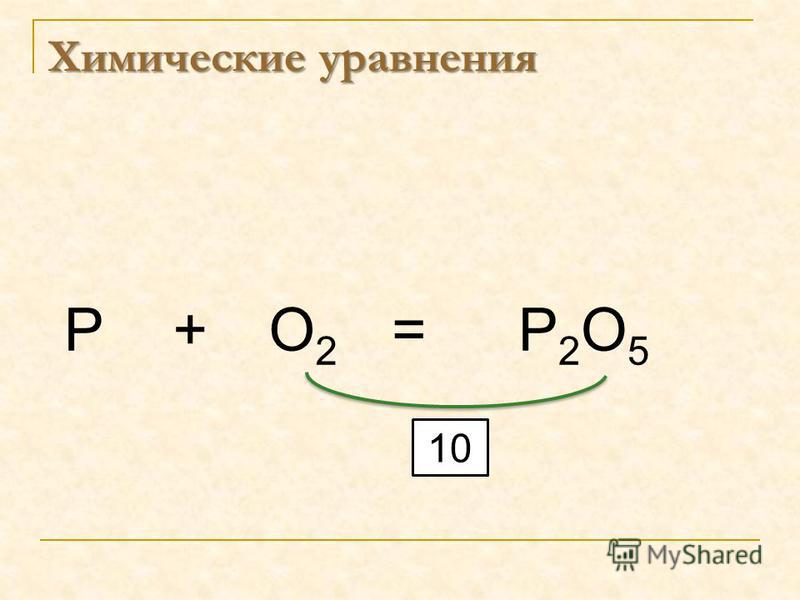 Справа находятся 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе не одинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов с одной стороны, чтобы оно соответствовало другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы на каждой стороне уравнения было по 2 атома кислорода, например h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения есть 4 атома водорода и только 2 атома водорода в левой части. Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково с обеих сторон уравнения, поэтому уравнение сбалансировано.
Справа находятся 2 атома водорода и 1 атом кислорода, поэтому вы должны написать «H = 2» и «O = 1» под правой стороной. Поскольку количество атомов в каждом элементе не одинаково с обеих сторон, уравнение не сбалансировано.Чтобы сбалансировать уравнение, вам нужно добавить коэффициенты, чтобы изменить количество атомов с одной стороны, чтобы оно соответствовало другой. Для уравнения h3 + O2 → h3O вы должны добавить коэффициент 2 перед h3O в правой части, чтобы на каждой стороне уравнения было по 2 атома кислорода, например h3 + O2 → 2h3O. Однако нижние индексы не могут быть изменены и всегда умножаются на коэффициент, что означает, что теперь в правой части уравнения есть 4 атома водорода и только 2 атома водорода в левой части. Чтобы сбалансировать это, добавьте коэффициент 2 перед h3 в левой части уравнения, чтобы с каждой стороны было по 4 атома водорода, например 2h3 + O2 → 2h3O.Теперь количество атомов в каждом элементе одинаково с обеих сторон уравнения, поэтому уравнение сбалансировано. Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз!
Помните, что если перед элементом нет коэффициента, предполагается, что коэффициент равен 1. Чтобы узнать, как сбалансировать химические уравнения алгебраически, прокрутите вниз!
- Печать
- Отправить письмо поклонника авторам
Балансировка химических уравнений: практика и обзор
Внимание: Этот пост был написан несколько лет назад и может не отражать последние изменения в программе AP®.Мы постепенно обновляем эти сообщения и удалим этот отказ от ответственности после обновления этого сообщения. Спасибо за ваше терпение!
Из всех навыков, которые необходимо знать в области химии, уравновешивание химических уравнений, пожалуй, является самым важным, которым нужно овладеть. Многие области химии зависят от этого жизненно важного навыка, включая стехиометрию, анализ реакций и лабораторную работу. Это подробное руководство покажет вам, как уравновесить даже самые сложные реакции, и проведет вас через серию примеров, от простых до сложных.
Конечная цель уравновешивания химических реакций — уравнять обе стороны реакции, реагенты и продукты, по количеству атомов на элемент. Это происходит из универсального закона сохранения массы, который гласит, что материю нельзя ни создать, ни разрушить. Итак, если мы начнем с десяти атомов кислорода перед реакцией, нам нужно закончить с десятью атомами кислорода после реакции. Это означает, что химические реакции не меняют реальных строительных блоков материи; скорее они просто меняют расположение блоков.Легкий способ понять это — изобразить дом из блоков. Мы можем разбить дом на части и построить самолет, но цвет и форма блоков не меняются.
Но как нам сбалансировать эти уравнения? Мы знаем, что количество атомов каждого элемента должно быть одинаковым с обеих сторон уравнения, поэтому для этого достаточно найти правильные коэффициенты (числа перед каждой молекулой). Лучше всего начать с атома, который наименьшее количество раз появляется на одной стороне, и сначала уравновесить его. Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте снова подсчитать количество атомов каждого элемента на каждой стороне, на всякий случай.
Затем перейдите к атому, который появляется вторым наименьшим числом раз, и так далее. В конце не забудьте снова подсчитать количество атомов каждого элемента на каждой стороне, на всякий случай.
Проиллюстрируем это на примере:
P 4 O 10 + H 2 O → H 3 PO 4
Во-первых, давайте посмотрим на элемент, который встречается реже всего. Обратите внимание, что кислород дважды встречается с левой стороны, так что это не лучший элемент для начала.Мы могли бы начать с фосфора или водорода, так что давайте начнем с фосфора. С левой стороны четыре атома фосфора, а с правой — только один. Итак, мы можем поставить коэффициент 4 на молекулу, которая имеет фосфор справа, чтобы уравновесить их.
P 4 O 10 + H 2 O → 4 H 3 PO 4
Теперь мы можем проверить водород. Мы по-прежнему хотим избежать уравновешивания кислорода, потому что он присутствует более чем в одной молекуле с левой стороны. Проще всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, есть две молекулы водорода с левой стороны и двенадцать с правой стороны (обратите внимание, что их по три на молекулу H 3 PO 4 , а у нас четыре молекулы). Итак, чтобы уравновесить их, мы должны поставить шестерку перед H 2 O слева.
Проще всего начать с молекул, которые появляются только один раз с каждой стороны. Итак, есть две молекулы водорода с левой стороны и двенадцать с правой стороны (обратите внимание, что их по три на молекулу H 3 PO 4 , а у нас четыре молекулы). Итак, чтобы уравновесить их, мы должны поставить шестерку перед H 2 O слева.
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
На этом этапе мы можем проверить содержание кислорода, чтобы увидеть, сбалансированы ли они.Слева у нас есть десять атомов кислорода из P 4 O 10 и шесть из H 2 O, всего 16. Справа у нас также 16 (четыре на молекулу, с четырьмя молекулами). ). Итак, кислород уже сбалансирован. Это дает нам окончательное сбалансированное уравнение
P 4 O 10 + 6 H 2 O → 4 H 3 PO 4
Практические задачи по уравновешиванию химических уравнений Попробуйте уравновесить эти десять уравнений самостоятельно, а затем проверьте ответы ниже. Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся вам слишком сложными. Просто не забудьте начать с элемента, который появляется меньше всего, и продолжайте оттуда. Лучший способ подойти к этим проблемам — медленно и систематически. Взгляд на все сразу может легко вызвать ошеломление. Удачи!
Они различаются по уровню сложности, поэтому не расстраивайтесь, если некоторые из них покажутся вам слишком сложными. Просто не забудьте начать с элемента, который появляется меньше всего, и продолжайте оттуда. Лучший способ подойти к этим проблемам — медленно и систематически. Взгляд на все сразу может легко вызвать ошеломление. Удачи!
- CO 2 + H 2 O → C 6 H 12 O 6 + O 2
- SiCl 4 + H 2 O → H 4 SiO 4 + HCl
- Al + HCl → AlCl 3 + H 2
- Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2
- C 7 H 6 O 2 + O 2 → CO 2 + H 2 O
- Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe (OH) 3
- Ca (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3
- KClO 3 → KClO 4 + KCl
- Al 2 (SO 4 ) 3 + Ca (OH) 2 → Al (OH) 3 + CaSO 4
- H 2 SO 4 + HI → H 2 S + I 2 + H 2 O
Комплексные решения:
1. CO 2 + H 2 O → C 6 H 12 O 6 + O 2
CO 2 + H 2 O → C 6 H 12 O 6 + O 2 Первый шаг — сосредоточиться на элементах, которые появляются только один раз с каждой стороны уравнения. Здесь и углерод, и водород соответствуют этому требованию. Итак, начнем с углерода. С левой стороны только один атом углерода, а с правой — шесть. Итак, мы добавляем коэффициент шесть к углеродсодержащей молекуле слева.
6CO 2 + H 2 O → C 6 H 12 O 6 + O 2
Теперь давайте посмотрим на водород.Слева расположены два атома водорода, а справа — двенадцать. Итак, мы добавим коэффициент шесть к водородсодержащей молекуле слева.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + O 2
А теперь пора проверить кислород. Слева всего 18 молекул кислорода (6 × 2 + 6 × 1). Справа восемь молекул кислорода. Теперь у нас есть два варианта выровнять правую часть: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент.Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к О 2 справа. Наш окончательный ответ:
Теперь у нас есть два варианта выровнять правую часть: мы можем либо умножить C 6 H 12 O 6 или O 2 на коэффициент.Однако, если мы изменим C 6 H 12 O 6 , коэффициенты для всего остального в левой части также должны будут измениться, потому что мы изменим количество атомов углерода и водорода. Чтобы предотвратить это, обычно помогает изменить только молекулу, содержащую наименьшее количество элементов; в данном случае O 2 . Итак, мы можем добавить коэффициент шесть к О 2 справа. Наш окончательный ответ:
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2
2.SiCl 4 + H 2 O → H 4 SiO 4 + HCl Единственный элемент, который встречается здесь более одного раза в одной и той же части уравнения, — это водород, поэтому мы можем начать с любого другого элемента. Начнем с кремния. Обратите внимание, что с обеих сторон находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на хлор. Слева расположены четыре атома хлора, а справа — только один. Итак, мы добавим коэффициент четыре справа.
Начнем с кремния. Обратите внимание, что с обеих сторон находится только один атом кремния, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на хлор. Слева расположены четыре атома хлора, а справа — только один. Итак, мы добавим коэффициент четыре справа.
SiCl 4 + H 2 O → H 4 SiO 4 + 4HCl
Теперь давайте посмотрим на кислород. Помните, что сначала мы хотим проанализировать все элементы, которые встречаются только один раз на одной стороне уравнения. Слева всего один атом кислорода, а справа четыре. Итак, мы добавим коэффициент четыре в левую часть уравнения.
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Мы почти закончили! Теперь нам просто нужно проверить количество атомов водорода с каждой стороны.Слева их восемь, а справа тоже восемь, так что мы закончили. Наш окончательный ответ —
SiCl 4 + 4H 2 O → H 4 SiO 4 + 4HCl
Как всегда, не забудьте дважды проверить, что количество атомов каждого элемента уравновешивается с каждой стороны, прежде чем продолжить.
Эта проблема немного сложная, поэтому будьте осторожны. Когда по одну сторону уравнения находится один атом, проще всего начать с этого элемента.Итак, начнем с подсчета атомов алюминия с обеих сторон. Один слева и один справа, поэтому нам пока не нужно добавлять какие-либо коэффициенты. Теперь давайте посмотрим на водород. Еще один слева, но два справа. Итак, мы добавим слева коэффициент два.
Al + 2HCl → AlCl 3 + H 2
Далее мы рассмотрим хлор. Теперь их два слева, а три справа. Это не так просто, как просто прибавить коэффициент к одной стороне.Нам нужно, чтобы количество атомов хлора было одинаковым с обеих сторон, поэтому нам нужно, чтобы два и три были равны. Мы можем добиться этого, найдя наименьшее общее кратное. В этом случае мы можем умножить два на три и три на два, чтобы получить наименьшее общее кратное шести. Итак, умножим 2HCl на три, а AlCl 3 на два:
Al + 6HCl → 2AlCl 3 + H 2
Мы рассмотрели все элементы, поэтому легко сказать, что все готово. Однако всегда проверяйте дважды.В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий в правой части, алюминий больше не сбалансирован. Один слева, а два справа. Итак, добавим еще один коэффициент.
Однако всегда проверяйте дважды.В этом случае, поскольку мы добавили коэффициент к молекуле, содержащей алюминий в правой части, алюминий больше не сбалансирован. Один слева, а два справа. Итак, добавим еще один коэффициент.
2Al + 6HCl → 2AlCl 3 + H 2
Мы еще не закончили. Просматривая уравнение в последний раз, мы видим, что водород также не сбалансирован. Слева их шесть, а справа — двое. Итак, сделав последнюю корректировку, мы получили окончательный ответ:
.2Al + 6HCl → 2AlCl 3 + 3H 2
4.Na 2 CO 3 + HCl → NaCl + H 2 O + CO 2Надеюсь, к этому моменту балансировка уравнений станет проще, и вы научитесь этому. Глядя на натрий, мы видим, что он встречается дважды слева и один раз справа. Итак, мы можем добавить наш первый коэффициент к NaCl справа.
Na 2 CO 3 + HCl → 2NaCl + H 2 O + CO 2
Теперь давайте посмотрим на углерод. Один слева и один справа, поэтому нет никаких коэффициентов для добавления.Поскольку кислород присутствует более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Один слева и два справа, поэтому мы добавим коэффициент слева.
Один слева и один справа, поэтому нет никаких коэффициентов для добавления.Поскольку кислород присутствует более чем в одном месте слева, мы оставим его напоследок. Вместо этого посмотрите на водород. Один слева и два справа, поэтому мы добавим коэффициент слева.
Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
Затем, глядя на хлор, мы видим, что он уже сбалансирован по два с каждой стороны. Теперь мы можем вернуться к изучению кислорода. Их три слева и три справа, поэтому наш окончательный ответ —
.Na 2 CO 3 + 2HCl → 2NaCl + H 2 O + CO 2
5.C 7 H 6 O 2 + O 2 → CO 2 + H 2 O Мы можем начать балансировать это уравнение, посмотрев на углерод или водород. Глядя на углерод, мы видим, что семь атомов слева и только один справа. Итак, мы можем добавить коэффициент семь справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + H 2 O
Тогда для водорода шесть атомов слева и два справа.Итак, мы добавим коэффициент три справа.
C 7 H 6 O 2 + O 2 → 7CO 2 + 3H 2 O
Теперь с кислородом все станет немного сложнее. Кислород присутствует в каждой молекуле в уравнении, поэтому мы должны быть очень осторожны при его балансировке. Слева четыре атома кислорода, справа 17. Нет очевидного способа уравновесить эти числа, поэтому мы должны использовать небольшой трюк: дроби. Теперь, когда мы пишем наш окончательный ответ, мы не можем включать дроби, так как это неправильная форма, но иногда помогает использовать их для решения проблемы.Также старайтесь избегать чрезмерных манипуляций с органическими молекулами. Вы можете легко идентифицировать органические молекулы, также известные как молекулы CHO, потому что они состоят только из углерода, водорода и кислорода. Мы не любим работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы обычно более стабильны, чем молекулы меньшего размера, и с меньшей вероятностью вступят в реакцию в больших количествах.
Мы не любим работать с этими молекулами, потому что они довольно сложные. Кроме того, более крупные молекулы обычно более стабильны, чем молекулы меньшего размера, и с меньшей вероятностью вступят в реакцию в больших количествах.
Итак, чтобы уравновесить четыре и семнадцать, мы можем умножить 0 2 слева на 7.5. Это даст нам
C 7 H 6 O 2 + 7,5O 2 → 7CO 2 + 3H 2 O
Помните, что дроби (и десятичные дроби) не допускаются в формальных сбалансированных уравнениях, поэтому умножьте все на два, чтобы получить целые числа. Наш окончательный ответ —
.2C 7 H 6 O 2 + 15O 2 → 14CO 2 + 6H 2 O
6. Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + Fe (OH) 3- Начнем с балансировки утюга с двух сторон. У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
У левого их два, а у правого только один. Итак, мы добавим коэффициент два справа.
Fe 2 (SO 4 ) 3 + KOH → K 2 SO 4 + 2Fe (OH) 3-
Затем мы можем взглянуть на серу. Слева их три, а справа только один. Итак, мы добавим коэффициент три в правую часть.
Fe 2 (SO 4 ) 3 + KOH → 3K 2 SO 4 + 2Fe (OH) 3-
Мы почти закончили.Осталось только сбалансировать калий. Один атом слева и шесть справа, поэтому мы можем уравновесить их, добавив коэффициент шесть. Итак, наш окончательный ответ —
.Fe 2 (SO 4 ) 3 + 6KOH → 3K 2 SO 4 + 2Fe (OH) 3-
7. Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + CaSiO 3 Глядя на кальций, мы видим, что их три слева и один справа, поэтому мы можем добавить коэффициент три справа, чтобы уравновесить их.
Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Затем, что касается фосфора, мы видим, что их два слева и четыре справа. Чтобы уравновесить их, добавьте слева коэффициент два.
2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 3CaSiO 3
Обратите внимание, что таким образом мы изменили количество атомов кальция слева.Каждый раз, когда вы добавляете коэффициент, дважды проверяйте, влияет ли шаг на какие-либо элементы, которые вы уже сбалансировали. В этом случае количество атомов кальция слева увеличилось до шести, а справа осталось три, поэтому мы можем изменить коэффициент справа, чтобы отразить это изменение.
2Ca 3 (PO 4 ) 2 + SiO 2 → P 4 O 10 + 6CaSiO 3
Поскольку кислород присутствует в каждой молекуле в уравнении, мы его пока пропустим. Сосредоточившись на кремнии, мы видим, что один слева, а шесть справа, поэтому мы можем добавить коэффициент слева.
Сосредоточившись на кремнии, мы видим, что один слева, а шесть справа, поэтому мы можем добавить коэффициент слева.
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
Теперь проверим количество атомов кислорода с каждой стороны. Слева есть 28 атомов, а справа также 28. Итак, после проверки того, что все остальные атомы одинаковы с обеих сторон, мы получаем окончательный ответ
2Ca 3 (PO 4 ) 2 + 6SiO 2 → P 4 O 10 + 6CaSiO 3
8.KClO 3 → KClO 4 + KCl Эта проблема особенно сложна, потому что каждый атом, кроме кислорода, присутствует в каждой молекуле в уравнении. Итак, поскольку кислород появляется наименьшее количество раз, мы начнем с него. Их три слева и четыре справа. Чтобы уравновесить их, мы находим наименьшее общее кратное; в данном случае 12. Добавляя коэффициент четыре слева и три справа, мы можем уравновесить содержание кислорода.
Добавляя коэффициент четыре слева и три справа, мы можем уравновесить содержание кислорода.
4KClO 3 → 3KClO 4 + KCl
Теперь мы можем проверить калий и хлор.Четыре молекулы калия слева и четыре справа, поэтому они уравновешены. Хлор также сбалансирован, по четыре с каждой стороны, поэтому мы закончили с окончательным ответом
.4KClO 3 → 3KClO 4 + KCl
9. Al 2 (SO 4 ) 3 + Ca (OH) 2 → Al (OH) 3 + CaSO 4Здесь мы можем начать с балансировки атомов алюминия с обеих сторон. Слева есть две молекулы, а справа только одна, поэтому мы добавим коэффициент два справа.
Al 2 (SO 4 ) 3 + Ca (OH) 2 → 2Al (OH) 3 + CaSO 4
Теперь мы можем проверить серу. Их три слева и только один справа, поэтому добавление коэффициента три уравновесит их.
Al 2 (SO 4 ) 3 + Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
Переходя к кальцию, слева только один, а справа три, поэтому мы должны добавить коэффициент три.
Al 2 (SO 4 ) 3 + 3Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
Дважды проверив все атомы, мы видим, что все элементы сбалансированы, поэтому наше окончательное уравнение —
.Al 2 (SO 4 ) 3 + 3Ca (OH) 2 → 2Al (OH) 3 + 3CaSO 4
10. H 2 SO 4 + HI → H 2 S + I 2 + H 2 O Так как водород встречается более одного раза слева, мы временно пропустим его и перейдем к сере.Один атом слева и один справа, так что балансировать пока нечего. Если посмотреть на кислород, их четыре слева и один справа, поэтому мы можем добавить коэффициент четыре, чтобы уравновесить их.
H 2 SO 4 + HI → H 2 S + I 2 + 4H 2 O
Есть только один йод слева и два справа, поэтому простое изменение коэффициента может уравновесить их.
H 2 SO 4 + 2HI → H 2 S + I 2 + 4H 2 O
Теперь мы можем взглянуть на самый сложный элемент: водород.Слева их четыре, а справа десять. Итак, мы знаем, что нам нужно изменить коэффициент либо H 2 SO 4 , либо HI. Мы хотим изменить что-то, что впоследствии потребует наименьшего количества настроек, поэтому мы изменим коэффициент HI. Чтобы в левой части было десять атомов водорода, нам нужно, чтобы в HI было восемь атомов водорода, поскольку в H 2 SO 4 уже есть два. Итак, изменим коэффициент с 2 на 8.
H 2 SO 4 + 8HI → H 2 S + I 2 + 4H 2 O
Однако это также изменяет баланс йода. Слева их восемь, а справа только двое. Чтобы исправить это, мы добавим справа коэффициент 4. Убедившись, что все остальное уравновешено, мы получаем окончательный ответ
Слева их восемь, а справа только двое. Чтобы исправить это, мы добавим справа коэффициент 4. Убедившись, что все остальное уравновешено, мы получаем окончательный ответ
H 2 SO 4 + 8HI → H 2 S + 4I 2 + 4H 2 O
Как и в случае с большинством других навыков, практика приводит к совершенству при изучении того, как уравновесить химические уравнения. Продолжайте усердно работать и постарайтесь решить как можно больше задач, чтобы отточить свои навыки балансировки.
Есть ли у вас какие-нибудь советы или рекомендации, которые помогут сбалансировать химические уравнения? Дайте нам знать об этом в комментариях!
Давайте применим все на практике. Ответьте на этот вопрос общей практики химии: Ищете дополнительную практику по общей химии? На Albert.io вы можете найти тысячи практических вопросов. Albert.io позволяет настроить процесс обучения так, чтобы он ориентировался на практику там, где вам больше всего нужна помощь. Мы зададим вам сложные практические вопросы, которые помогут вам достичь совершенства в общей химии.
Мы зададим вам сложные практические вопросы, которые помогут вам достичь совершенства в общей химии.
Начните практиковать здесь .
Вы преподаватель или администратор, заинтересованный в улучшении успеваемости учащихся по общей химии?
Узнайте больше о наших школьных лицензиях здесь, .
Урок в одиннадцатом классе «Уравновешивание химических уравнений»
На этом уроке учащиеся узнают две вещи. Во-первых, они начинают учиться уравновешивать химические уравнения.Конечно, их учат уравновешивать химические уравнения, но обучение придет после того, как студенты получат возможность попрактиковаться в этом навыке. Некоторые ученики усваивают навык быстрее, чем другие, но практика — отличный уравнитель.
Во-вторых, они изучают навык, который я называю артикуляцией. Под артикуляцией я подразумеваю, что хочу, чтобы студенты могли писать о том, как что-то делать. Уравновешивание химических уравнений — это навык, которым могут овладеть некоторые студенты, но они не могут объяснить, как это сделать. Я хочу сказать классу сегодня, что если вы сможете сформулировать, как что-то делать, у вас будет больше шансов по-настоящему изучить этот навык, потому что для выражения того, что вы знаете, используются другие навыки и другая часть мозга. Артикулируя, человек устанавливает больше связей между нейронами мозга, которые связаны с навыком.
Я хочу сказать классу сегодня, что если вы сможете сформулировать, как что-то делать, у вас будет больше шансов по-настоящему изучить этот навык, потому что для выражения того, что вы знаете, используются другие навыки и другая часть мозга. Артикулируя, человек устанавливает больше связей между нейронами мозга, которые связаны с навыком.
Этот урок соответствует основной дисциплинарной идее NGSS из HS-PS1-7. Используйте математические представления, чтобы подтвердить утверждение, что атомы и, следовательно, масса сохраняются во время химической реакции .Сегодня основное внимание уделяется умению уравновешивать реакции, но я все же отмечаю, что причина сбалансированной химической реакции заключается в том, что химические реакции перестраивают атомы, и поэтому любое количество атомов, с которым вы начинаете, также заканчивается.
Точно так же он согласуется с пересекающейся концепцией NGSS Энергия: общее количество энергии и вещества в закрытых системах сохраняется .
Урок соответствует Практике учёного NGSS Использование математики и вычислительного мышления , потому что он использует математические представления явлений для подтверждения утверждений.В данном случае речь идет о законе сохранения массы. Он также согласуется с Практикой «Получение, оценка и передача информации» , потому что студентов просят приложить значительные усилия для формулирования процедуры, которую они используют для уравновешивания уравнений.
Что касается предшествующих знаний или навыков, учащиеся должны иметь базовое понимание того, как используются коэффициенты и индексы для описания атомов каждого элемента, как описано в этом уроке.
Для этого урока не нужны специальные материалы.
Как сбалансировать химические уравнения: 3 простых шага
Химическое уравнение говорит вам, что происходит во время химической реакции. Сбалансированное химическое уравнение содержит правильное количество реагентов и продуктов, удовлетворяющих Закону сохранения массы.
В этой статье мы поговорим о том, что такое химическое уравнение, как уравновесить химические уравнения, и дадим вам несколько примеров, которые помогут в вашей практике уравновешивания химических уравнений.
Что такое химическое уравнение?
Проще говоря, химическое уравнение сообщает вам, что происходит в химической реакции . Вот как выглядит химическое уравнение:
Fe + O2 → Fe2O3
В левой части уравнения находятся реагенты. Это материалы, с которыми вы начинаете химическую реакцию.
В правой части уравнения находятся продукты. Эти продукты представляют собой вещества, образующиеся в результате химической реакции.
Для того, чтобы химическая реакция была правильной, она должна удовлетворять так называемому Закону сохранения массы, , который гласит, что масса не может быть создана или разрушена во время химической реакции. Это означает, что каждая сторона химического уравнения должна иметь одинаковое количество массы, потому что количество массы нельзя изменить.
Если в вашем химическом уравнении массы в левой и правой частях уравнения различаются, вам необходимо сбалансировать химическое уравнение.
Как сбалансировать химические уравнения — объяснение и пример
Уравновешивание химических уравнений означает, что вы пишете химическое уравнение правильно, чтобы на каждой стороне стрелки было одинаковое количество массы.
В этом разделе мы собираемся объяснить, как сбалансировать химическое уравнение на примере реальной жизни, химическом уравнении, которое возникает, когда железо ржавеет:
Fe + O 2 → Fe 2 O 3
# 1: Определите продукты и реагенты
Первым шагом в балансировании химического уравнения является определение ваших реагентов и ваших продуктов. Помните, ваши реагенты находятся в левой части уравнения. Товары находятся на правой стороне.
Для этого уравнения нашими реагентами являются Fe и O 2 . Наши продукты — Fe 2 и O3.
Наши продукты — Fe 2 и O3.
# 2: Запишите количество атомов
Затем вам нужно определить, сколько атомов каждого элемента присутствует на каждой стороне уравнения. Это можно сделать, просмотрев индексы или коэффициенты. Если нет нижнего индекса или коэффициента, то у вас просто один атом чего-то.
Fe + O 2 → Fe 2 O 3
Со стороны реагента у нас есть один атом железа и два атома кислорода.
Что касается продукта, у нас есть два атома железа и три атома кислорода.
Когда вы записываете количество продуктов, вы можете видеть, что уравнение не сбалансировано, потому что есть разные количества каждого атома на стороне реагента и на стороне продукта.
Это означает, что нам нужно добавить коэффициенты, чтобы сбалансировать это уравнение.
# 3: добавить коэффициенты
Ранее я упоминал, что есть два способа определить, сколько атомов определенного элемента существует в химическом уравнении: взглянув на индексы и взглянув на коэффициенты.
Когда вы уравновешиваете химическое уравнение, вы меняете коэффициенты. Вы никогда не меняете индексы.
Коэффициент — это множитель целого числа. Чтобы сбалансировать химическое уравнение, вы добавляете эти целые числовые множители (коэффициенты), чтобы убедиться, что на каждой стороне стрелки находится одинаковое количество атомов.
Вот что важно помнить о коэффициентах: они применяются к каждой части продукта. Например, возьмите химическое уравнение воды: h3O. Если вы добавили коэффициент, чтобы получилось 2H 2 O, то коэффициент будет кратным для всех присутствующих элементов. Итак, 2H 2 O означает, что у вас есть четыре атома водорода и два атома кислорода. Вы не просто умножаете против первого присутствующего элемента.
Итак, в нашем химическом уравнении (Fe + O 2 → Fe 2 O 3 ) любой коэффициент, который вы добавляете к продукту, должен отражаться в реагентах.
Давайте посмотрим, как сбалансировать это химическое уравнение.
Что касается продукта, у нас есть два атома железа и три атома кислорода. Давайте сначала займемся железом.
При первом взгляде на это химическое уравнение вы можете подумать, что работает что-то вроде этого:
2Fe + O 2 → Fe 2 O 3
Хотя это уравновешивает атомы железа (остается по два с каждой стороны), кислород все еще неуравновешен. Это означает, что нам нужно продолжать поиски.
Если взять в первую очередь железо, мы знаем, что будем работать с кратным двум, поскольку на стороне продукта присутствуют два атома железа.
Зная, что использовать два в качестве коэффициента не получится, давайте попробуем следующее кратное двум: четыре.
4Fe + O 2 → 2Fe 2 O 3
Это создает баланс для железа, имея по четыре атома на каждой стороне уравнения. Кислород еще не совсем сбалансирован, но на стороне продукта у нас есть шесть атомов кислорода. Шесть кратно двум, поэтому мы можем работать с этим на стороне реагента, где присутствуют два атома кислорода.
Шесть кратно двум, поэтому мы можем работать с этим на стороне реагента, где присутствуют два атома кислорода.
Это означает, что мы можем записать наше сбалансированное химическое уравнение следующим образом:
4Fe + 3O 2 → 3Fe 2 O 3
3 Великих Источника Балансировки Химических Уравнений Практика
Есть много мест, где вы можете практиковать балансирование химических уравнений онлайн.
Вот несколько мест с практическими задачами, которые вы можете использовать:
Уравновешивание химических уравнений: основные выводы
Уравновешивание химических уравнений кажется сложным, но на самом деле это не так уж сложно!
Ваша главная цель при балансировке химических уравнений — убедиться, что на каждой стороне стрелки химического уравнения присутствует одинаковое количество реагентов и продуктов.
Что дальше?
Ищете другие руководства по химии ? У нас есть статьи, в которых рассматриваются шесть примеров физических и химических изменений, 11 правил растворимости и константа растворимости (K sp ), а также информация по AP Chem, IB Chemistry и Regents Chemistry.
Пишете исследовательскую работу для школы, но не знаете, о чем писать? В нашем справочнике по темам исследовательских работ есть более 100 тем в десяти категориях, так что вы можете быть уверены, что найдете идеальную тему для вас.
Хотите узнать самые быстрые и простые способы конвертировать градусы Фаренгейта в градусы Цельсия? Мы вас прикрыли! Ознакомьтесь с нашим руководством по лучшим способам преобразования Цельсия в Фаренгейта (или наоборот).
Вы изучаете облака в своем классе естественных наук? Получите помощь по определению различных типов облаков с помощью нашего экспертного руководства.
Сбалансированное химическое уравнение: определение и примеры — видео и стенограмма урока
Шаги по уравновешиванию уравнения
Практика всегда добивается совершенства.В общем, чтобы сбалансировать уравнение, нам нужно сделать следующее:
- Подсчитайте атомы каждого элемента в реагентах и продуктах.

- Использовать коэффициенты; при необходимости разместите их перед составами.
Шаги просты, но это процесс проб и ошибок. Давайте рассмотрим еще несколько примеров уравнений и методов, которые можно использовать для балансировки каждого из них.
Пример 1
Это реакция между метаном (Ch5) и кислородом (O2) с образованием диоксида углерода (CO2) и воды (h3O).
Показанная реакция представляет собой реакцию горения : соединение реагирует с кислородом с образованием диоксида углерода и воды. Метод заключается в том, чтобы сначала уравновесить атомы углерода (C), затем атомы водорода (H), а затем атомы кислорода (O).
В этом случае атомы углерода (C) уже сбалансированы. Итак, теперь мы посмотрим на атомы водорода (H). Есть 4 атома водорода (H) на стороне реагентов и 2 атома водорода (H) на стороне продуктов.Чтобы уравновесить их, мы ставим коэффициент 2 перед h3O.
Теперь атомы водорода (H) уравновешены. Из-за коэффициента 2 перед h3O всего на стороне продуктов находится 4 атома кислорода (O). Чтобы уравновесить атомы кислорода с обеих сторон, мы ставим коэффициент 2 перед O2. Теперь химическое уравнение сбалансировано.
Пример 2
Это реакция между оксидом железа (Fe2O3) и углеродом (C) с образованием железа (Fe) и диоксида углерода (CO2).
Эта реакция не сбалансирована. Во-первых, нам нужно сбалансировать атомы кислорода. Делаем это так, чтобы с каждой стороны было по 6 атомов кислорода. Для этого нам нужно поставить коэффициент 2 перед Fe2O3 и коэффициент 3 перед CO2.
Теперь, когда атомы кислорода уравновешены, нам нужно сначала уравновесить атомы железа (Fe). Для этого нам нужно поставить коэффициент 4 перед Fe на стороне продуктов.Теперь, когда атомы Fe уравновешены, мы можем уравновесить атомы углерода. Мы делаем это, устанавливая коэффициент 3 перед C на стороне реагентов. Теперь химическое уравнение сбалансировано.
Для этого нам нужно поставить коэффициент 4 перед Fe на стороне продуктов.Теперь, когда атомы Fe уравновешены, мы можем уравновесить атомы углерода. Мы делаем это, устанавливая коэффициент 3 перед C на стороне реагентов. Теперь химическое уравнение сбалансировано.
Пример 3
При работе с химическими уравнениями с многоатомными ионами , которые представляют собой ионы, состоящие из более чем одного атома, существует специальный метод для уравновешивания химического уравнения.
Метод состоит в том, чтобы рассматривать многоатомный ион целиком, как если бы это был только один атом.Давайте посмотрим на это химическое уравнение.
Многоатомный ион в данном случае — PO4 (зеленый). Мы будем рассматривать весь этот многоатомный ион как один атом. Со стороны реагентов есть один ион PO4, а со стороны продуктов — два иона PO4.
Первый шаг — сбалансировать многоатомные ионы с обеих сторон. Для этого мы ставим коэффициент 2 перед Na3PO4. Атомы натрия (Na) удваиваются, и PO4 теперь сбалансирован с обеих сторон.
Следующий шаг — уравновесить атомы магния (Mg), натрия (Na) и хлора (Cl). Сначала мы уравновешиваем атомы магния, задав коэффициент 3 перед MgCl2.
Затем мы уравновешиваем атомы Na и Cl с обеих сторон, помещая коэффициент 6 перед NaCl. В результате получается сбалансированное уравнение:
Пример 4
Давайте рассмотрим реакцию между алюминием (Al) и серной кислотой (h3SO4).В этой реакции наш многоатомный ион, который мы будем считать за один атом, — это SO4. Со стороны реагентов имеется один ион SO4, а со стороны продуктов — три иона SO4.
Сначала нам нужно сбалансировать ионы SO4, и для этого мы ставим коэффициент 3 перед h3SO4.
Атомы водорода и алюминия неуравновешены. Следующий шаг — уравновесить атомы водорода (H), поставив коэффициент 3 перед h3.
Последний шаг — уравновесить атомы алюминия (Al). Мы делаем это, помещая коэффициент 2 перед Al. Теперь химическое уравнение сбалансировано.
Краткое содержание урока
Согласно закону сохранения массы , масса реагентов должна быть равна массе продуктов, когда происходит химическая реакция. Это означает, что количество различных атомов, участвующих в реагирующих веществах, должно оставаться неизменным после того, как реакция протекает.Там, где есть химическая реакция, есть химическое уравнение. Химическое уравнение необходимо сбалансировать так, чтобы оно подчинялось закону сохранения массы. Сбалансированное химическое уравнение возникает, когда количество различных атомов элементов на стороне реагентов равно количеству различных атомов элементов на стороне продуктов.
Уравновешивание химических уравнений — это процесс проб и ошибок. При балансировании химических уравнений нам сначала нужно подсчитать различные атомы на стороне реагентов и на стороне продуктов.Если уравнение не сбалансировано, нам нужно использовать коэффициенты , которые представляют собой числа, которые мы ставим перед реагирующими веществами, чтобы сбалансировать уравнение. Если перед химической формулой нет коэффициента, это означает, что коэффициент равен единице.
Для реакций горения метод заключается в уравновешивании атомов углерода (C), за которыми следуют атомы водорода (H) и затем атомы кислорода (O). Для атомов, включающих многоатомные ионы, общая методика состоит в том, чтобы считать весь многоатомный ион как один атом, сначала уравновесить их, а затем уравновесить остальные атомы.
Результаты обучения
После того, как вы закончите, вы должны уметь:
- Вспомните, как закон сохранения массы требует сбалансированного химического уравнения
- Укажите шаги по уравновешиванию химического уравнения
- Уравновесить химическое уравнение
Обзор 8.
 P.1.4: CDC, класс 8, наука
P.1.4: CDC, класс 8, наукаCDC 8
Обзор 8.П.1.4
Перейти к содержанию Приборная доскаАвторизоваться
- Овал-95
Панель приборов
- значок-календарь
Календарь
- значок входящей почты
Входящие
История
Помощь
- Мой Dashboard
- CDC 8
- Страницы
- Обзор 8.
 П.1.4
П.1.4
- Дом
- Задания
- Страницы
- Файлы
- Программа
- Модули
- Сотрудничество
- Google Диск
- Значки
- Записная книжка для занятий
- Office 365
- Britannica School
- Discovery Education
- Активно учиться
q13-balance-the-following-equa | LIDO
Решение:
(а) P + O_2 \ → \ P_2O_5
№атомов P&O должно быть равным с обеих сторон
2 атома кислорода на левой стороне и 5 на правой
П + 5O_2 \ → \ 2P_2O_5
Теперь есть 4 атома P на правой стороне и 1 на левой
Теперь уравнение
4П + О_2 \ → \ 2П_2О_5
(б) Na_2O \ + \ H_2O \ → \ NaOH
Число атомов Na, H и O должно быть одинаковым с обеих сторон
2 атома Na на левой и 1 на правой
Na_2O \ + \ H_2O \ → \ 2NaOH
(с) К \ + \ H_2O \ → \ KOH \ + \ H_2
№атомов K, H и O должны быть равны с обеих сторон
2 атома H на левой и 3 на правой
К \ + \ 2H_2O \ → \ 2KOH \ + \ H_2
Теперь есть 1 атом K на левой стороне и 2 на правой стороне
.
2К \ + \ 2H_2O \ → \ 2KOH \ + \ H_2
(г) Fe \ + \ H_2O \ → \ Fe_3O_4 \ + \ H_2
Число атомов Fe, H и O должно быть одинаковым с обеих сторон
1 атом Fe на LHS и 3 на RHS
3Fe \ + \ H_2O \ → \ Fe_3O_4 \ + \ H_2
Один атом O находится на левой панели, а на правой — 4 атома.
3Fe \ + \ 4H_2O \ → \ Fe_3O_4 \ + \ 4H_2
(e) CaO \ + \ HCl \ → \ CaCl_2 \ + \ H_2O
№атомов Ca, Cl, H и O должны быть равны с обеих сторон
1 атом Cl на левой и 2 на правой
CaO \ + \ 2HCl \ → \ CaCl_2 \ + \ H_2O
(е) Fe \ + \ Cl_2 \ → \ FeCl_3
Число атомов Fe и Cl должно быть одинаковым с обеих сторон
2 атома Cl на левой и 3 на правой
2Fe \ + \ 3Cl_2 \ → \ 2FeCl_3
(г) Al \ + \ H_2O \ → \ Al_2O_3 \ + \ H_2
Число атомов Al, H и O должно быть одинаковым с обеих сторон
1 атом Al на левой и 2 на правой
2Al \ + \ H_2O \ → \ Al_2O_3 + \ H_2
1 атом O на левой стороне и 3 на правой
2Al \ + \ 3H_2O \ → \ Al_2O_3 \ + \ 3H_2
(h) Al \ + \ H_2SO_4 \ → \ Al_2 \ left (SO_4 \ right) _ {3 \} + \ H_2
№атомов Al, H и SO4 должно быть равным с обеих сторон
1 атом Al на левой и 2 на правой
2Al \ + \ H_2SO_4 \ → \ Al_2 \ влево (SO_4 \ вправо) _ {3 \} + \ H_2
1 атом SO4 на левой и 3 на правой
2Al \ + \ 3H_2SO_4 \ → \ Al_2 \ влево (SO_4 \ вправо) _ {3 \} + \ 3H_2
(i) Fe_2O_3 \ + \ H_2 \ → \ Fe \ + \ H_2O
Число атомов Fe, H и O должно быть одинаковым с обеих сторон
2 атома Fe на LHS и 1 на RHS
Fe_2O_3 \ + \ H_2 \ → \ 2Fe \ + \ H_2O
3 атома O на левой и 1 правой части
Fe_2O_3 \ + \ 3H_2 \ → \ 2Fe \ + \ 3H_2O
(j) C \ + \ H_2SO_4 \ → \ CO_2 \ + \ H_2O \ + \ SO_2
№атомов C, H и SO должно быть равным с обеих сторон
Есть 4 атома O на левой верхней части и 5 на правой
С \ + \ 2H_2SO_4 \ → \ CO_2 \ + \ 2H_2O \ + \ SO_2
(к) Pb_3O_4 \ → \ PbO \ + \ O_2
Число атомов Pb и O должно быть одинаковым с обеих сторон
3 атома Pb на левой панели и 1 на правой.
Pb_3O_4 \ → \ 3PbO \ + \ O_2
Есть 4 атома O на левой и 3 на правой
2Pb_3O_4 \ → \ 6PbO \ + \ O_2
(l) Al \ + \ O_2 \ → \ Al_2O_3
№атомов Al и O должно быть равным с обеих сторон
1 атом AL на левой и 2 на правой
2Al \ + \ O_2 \ \ → \ Al_2O_3
2 атома O на левой и 3 на правой
4Al \ + \ 3O_2 \ \ → \ 2Al_2O_3
(м) NO \ + \ O_2 \ \ → \ NO_2
Количество атомов N и O должно быть одинаковым с обеих сторон
3 атома O на левой и 2 на правой
2НО \ + \ O_2 \ \ → \ 2НО_2
(п) ZnS \ + \ O_2 \ \ → \ ZnO \ + \ SO_2
№атомов Zn, S и O должны быть равны с обеих сторон
2 атома O на левой и 3 на правой
2ZnS \ + \ 3O_2 \ \ → \ 2ZnO \ + \ 2SO_2
(о) Pb_3O_4 \ + \ HCl \ \ → \ PbCl_2 + \ H_2O \ + \ Cl_2
Число атомов Pb, H, Cl и O должно быть одинаковым с обеих сторон
Есть 4 атома O на левой и 1 правой части
Pb_3O_4 \ + \ 8HCl \ \ → \ PbCl_2 + \ H_2O \ + \ Cl_2
Чтобы уравнять атомы Pb,
Pb_3O_4 \ + \ 8HCl \ \ → \ 3PbCl_2 + \ 4H_2O \ + \ Cl_2
(p) ZnO \ + \ NaOH \ \ → \ Na_2ZnO_2 \ + \ H_2O
№атомов Zn, H, Na и O должны быть равны с обеих сторон
Чтобы сделать атомы Na равными
ZnO \ + \ 2NaOH \ \ → \ Na_2ZnO_2 \ + \ H_2O
(q) H_2S \ + \ Cl_2 \ → \ S \ + \ HCl
Число атомов H, S и Cl должно быть одинаковым с обеих сторон
Чтобы атомы Cl равнялись
H_2S \ + \ Cl_2 \ → \ S \ + \ 2HCl
(r) FeCl_3 \ + \ NaOH \ → \ NaCl \ + \ Fe \ влево (OH \ вправо) _3
Число атомов Fe, O, H и Cl должно быть одинаковым с обеих сторон
Чтобы атомы Cl равнялись
FeCl_3 \ + \ 3NaOH \ → \ 3NaCl \ + \ Fe \ влево (OH \ вправо) _3
(т) Fe_2O_3 \ + \ CO \ → \ Fe \ + \ CO_2
№атомов Fe, O и C должно быть равным с обеих сторон
Чтобы сделать атомы O равными
Fe_2O_3 \ + \ 3CO \ → \ Fe \ + \ 3CO_2
Чтобы число атомов Fe равнялось
Fe_2O_3 \ + \ 3CO \ → \ 2Fe \ + \ 3CO_2
(т) KHCO_3 \ → \ K_2CO_2 \ + \ H_2O \ + \ CO_2
Число атомов K, O, H и C должно быть одинаковым с обеих сторон
Чтобы сделать атомы K равными
2KHCO_3 \ → \ K_2CO_2 \ + \ H_2O \ + \ CO_2
(u) CuO \ + \ NH_3 \ → \ Cu \ + \ H_2O \ + \ N_2
№атомов Cu, O, H и N должны быть равны с обеих сторон
Чтобы сделать N атомов равным
3CuO \ + \ 2NH_3 \ → \ 3Cu \ + \ 3H_2O \ + \ N_2
.

 В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:

 П.1.4
П.1.4