Уравнение химической реакции. Ч.2. Видеоурок. Химия 8 Класс
Урок посвящен продолжению изучения темы «Уравнение химической реакции». В уроке рассматриваются простейшие расчеты по уравнению химической реакции, связанные с соотношением количеств веществ, участвующих в реакции.
Тема: Первоначальные химические представления
Урок: Уравнение химической реакции (Часть2)
Коэффициенты в уравнении химической реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
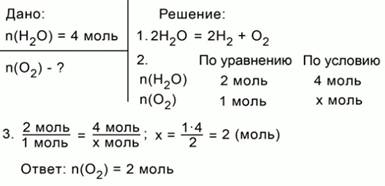
Рис. 1. Оформление краткого условия и решения задачи 1
ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди?
Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.
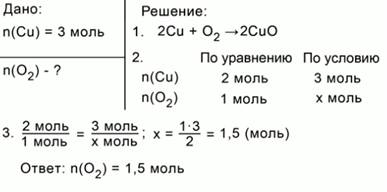
Рис. 2. Оформление краткого условия и решения задачи 2
Список рекомендованной литературы
1. Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: Часть I. – М.: Школьная Пресса, 2002. (с.49-50)
2. Сборник задач и упражнений по химии: 8-й кл.: к учеб П.А. Оржековского и др. «Химия.8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с.38-48)
3. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 42-44)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§18)
5. Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2016. (§20-21)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Тесты по химии (онлайн) (Источник).
2. Chemister.ru (Источник).
3. Alhimik.ru (Источник).
Домашнее задание
1. с.89 №№ 8,9 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 42-44 №№ 6,8,9 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
interneturok.ru
Ребят помогите пожалуйста объясните мне тупому как составлять, уравнивать химические уравнения (8 класс)
<a rel=»nofollow» href=»http://interneturok.ru/ru/school/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/uravnenie-himicheskoy-reaktsii-ch-1″ target=»_blank»>http://interneturok.ru/ru/school/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/uravnenie-himicheskoy-reaktsii-ch-1</a> Посмотри видео урок…
Выходи в скайп Revel33 (Ревел33), объясню. Денег не беру.
Например возьмем такой пример: Zn+HCL Надо соединить сначала боковые вещества, а потом в середине, в данном случае так: Боковые вещества, это Zn и Cl В середине будет : H Теперь соединяем их. Zn+HCL= ZnCl+H (соли всегда назад пишем, т. е. ClZn ни в коем случае не может быть!) Далее ставим валентность, т. к. смотрим на ZnCl,т. к. там два вещества. Смотрим в учебник, на «Растворимость кислот, оснований и солей в воде» — у меня лично так называется. Zn- двух валентен (римская 2),пишем сверху Zn. Далее смотрим на Cl-одно валентен (римская 1),пишем сверху Cl. Теперь валентность крест накрест, т. е. будет ZnCl2 Далее надо расставить коэффициенты. У нас пока что получилось так: Zn+HCL=ZnCl2+H Расставляем коэффициенты. В левой стороне у нас 1 атом хлора, справа 2 атома хлора, т. е. надо уровнять, т. е. будет Zn+2HCL=ZnCl2+H, теперь видим, что в левой стороне теперь у нас два атома водорода (H),т. е. теперь нам надо уровнять в правой стороне, ставим, там где H цифру 2. И тогда получается: Zn+2HCL=ZnCl2+h3 Проверяем правильно ли мы сделали, смотрим на правую и левую часть, Водорода (H) слева два атома и справа два, верно! Хлора (Cl) слева 2 и справа два, верно! Ну как-то так)
touch.otvet.mail.ru
Как научиться решать уравнения химических реакций 8 класс? Помогите пожалуйста!
Составление уравнения химической реакции Процесс составления уравнения химической реакции состоит из двух стадий (этапов). 1. Составление схемы реакции. Схема показывает, какие вещества вступили во взаимодействие и какие получились в результате реакции. Надо помнить, что молекулы простых газообразных веществ почти всегда состоят из двух атомов (O2, Cl2, h3 и т. д.) 2. Подбор коэффициентов к формулам веществ. Необходимо подобрать коэффициенты так, чтобы число атомов каждого элемента в левой и правой частях было одинаково. Правила подбора коэффициентов: — если число атомов элемента в одной части схемы реакции четное, а в другой нечетное, то перед формулой с нечетным числом атомов надо поставить коэффициент 2, а затем уравнивать число всех атомов. — расстановку коэффициентов следует начинать с наиболее сложного по составу вещества и делать это в следующей последовательности: сначала надо уравнять число атомов металлов, затем – кислотных остатков (атомов неметаллов), затем атомов водорода, и последним – атомов кислорода. — если число атомов кислорода в левой и правой частях уравнения одинаково, то коэффициенты определены верно. — после этого стрелку между частями уравнения можно заменить знаком равенства. — коэффициенты в уравнении химической реакции не должны иметь общих делителей. Пример. Составим уравнение химической реакции между гидроксидом железа (III) и серной кислотой с образованием сульфата железа (III). 1. Составим схему реакции: Fe(OH)3 + h3SO4 → Fe2(SO4)3 + h3O 2. Подберем коэффициенты к формулам веществ. Мы знаем, что надо начать с наиболее сложного вещества и последовательно уравнять во всей схеме сначала атомы металлов, потом кислотных остатков, затем водорода и в конце – кислорода. В нашей схеме наиболее сложное вещество — Fe2(SO4)3. В нем два атома железа, а в составе Fe(OH)3 – один атом железа. Значит, перед формулой Fe(OH)3 надо поставить коэффициент 2: 2Fe(OH)3 + h3SO4 → Fe2(SO4)3 + h3O Теперь уравниваем число кислотных остатков SO4. В составе соли Fe2(SO4)3 – три кислотных остатка SO4. Значит, в левой части перед формулой h3SO4 ставим коэффициент 3: 2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + h3O. Теперь уравниваем число атомов водорода. В левой части схемы в гидроксиде железа 2Fe(OH)3 – 6 атомов водорода (2 · 3), в серной кислоте 3h3SO4 – тоже 6 атомов водорода. Всего в левой части 12 атомов водорода. Значит, в правой части перед формулой воды h3O ставим коэффициент 6 – и теперь в правой части тоже 12 атомов водорода: 2Fe(OH)3 + 3h3SO4 → Fe2(SO4)3 + 6h3O. Осталось уравнять число атомов кислорода. Но делать это уже не надо, потому что в левой и правой частях схемы уже одинаковое число атомов кислорода – по 18 в каждой части. Это значит, что схема записана полностью, и мы можем стрелку заменить знаком равенства: 2Fe(OH)3 + 3h3SO4 = Fe2(SO4)3 + 6h3O.
Уравнения химических реакций нельзя решить — это не математические примеры. Их составляют. Ну, или приводят, записывают…
touch.otvet.mail.ru
Как расставлять коэффициенты в химических уравнениях
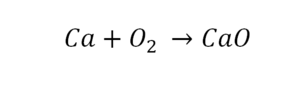
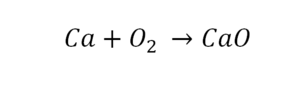 Уравнением реакции в химии называется запись химического процесса с помощью химических формул и математических знаков.
Уравнением реакции в химии называется запись химического процесса с помощью химических формул и математических знаков.Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
…
Вконтакте
Google+
Мой мир
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.Это интересно: алканы — химические свойства предельных углеводородов.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
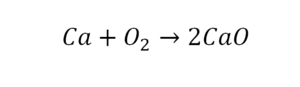
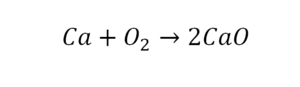
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
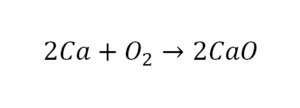
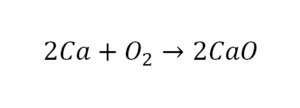
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
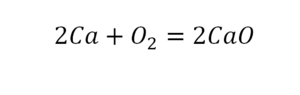
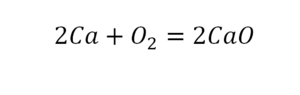
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
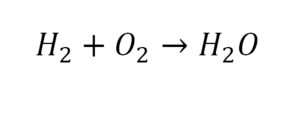
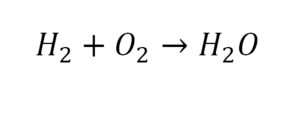
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
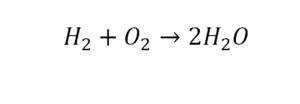
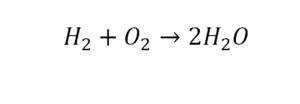
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.


Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
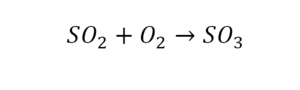
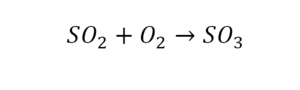
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
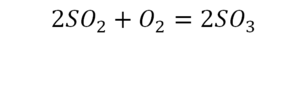
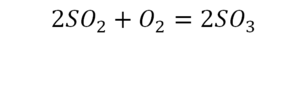
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
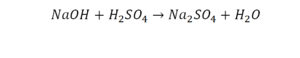
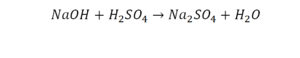
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
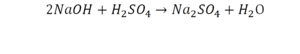
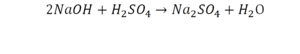
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
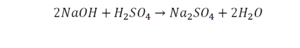
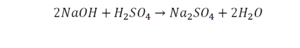
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
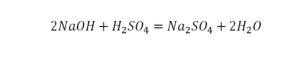
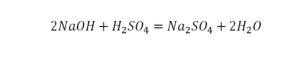
Следующий пример.
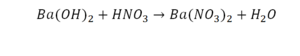
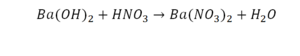
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
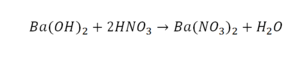
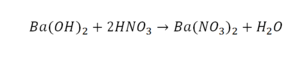
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
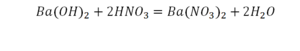
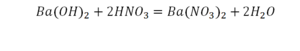
Последний пример.


На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.


Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
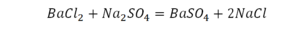
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
obrazovanie.guru
правила, примеры. Запись химической реакции
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий химических процессов и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений — важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.

Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий – металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород — это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na2O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.
Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет оксид магния, в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 — 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O2=MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O2=2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и раствором соляной кислоты. Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl2+H2.
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl2+H2.

Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью химических символов, знаков, коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
fb.ru
План- конспект урока «Химические уравнения»( 8 класс)
Тема: Химические уравнения
Цель: повторить и расширить знания о химических реакциях; сформировать понятие о химическом уравнении как об условном изображении химической реакции; пояснить правила составления уравнений химических реакций, подбора коэффициентов на основании закона сохранения массы вещества; стимулировать познавательную деятельность учащихся через дидактические игры, настроить их на использование имеющихся знаний для изучения нового материала.
Мотивация: Что такое химические уравнения и зачем они нужны?
Оборудование и реактивы: Периодическая система химических элементов
Д. И. Менделеева; карточки.
Тип урока: усвоение новых знаний
Формы проведения: химическая разминка, работа в парах, работа с учебником,
самостоятельная работа.
Ход урока
Организационный этап
Подготовка класса к уроку.
Актуализация опорных знаний
Разминка
1. Что изучает химия? (Вещество.)
2. Что такое вещество? (Это определенный вид материи, то, из чего состоит тело).
3. Как мы выражаем состав вещества? (С помощью химических формул).
4. Как составить химическую формулу? Что для этого необходимо знать?
(Химические знаки элементов, валентность.)
H, O, S, Fe, Cu, Al, Na, Cl.
Ответ по плану:
Название химического элемента,
Название простого вещества
Валентность,
Относительная атомная масса
Выигрышный путь – простые вещества
Какие вещества называются простыми, какие – сложными?
Выигрышный путь – химические явления
Горение угля
Ржавление гвоздя
Плавление стекла
Какие явления называются физическими, какие – химическими?
Перечислите признаки химических реакций.
«При взаимодействии водорода Н2 и кислорода О2 образуется вода Н2О»
«При горении (взаимодействии с кислородом О2) угля С образуется углекислый газ СО2»
О каком явлении идет речь? Как записать данную химическую реакцию?
Проблема: Как записать химическую реакцию?
Что такое химическое уравнение?
Мотивация:
Уравнение – это математическое равенство с одной или несколькими неизвестными величинами.
Возвращаемся к нашим текстам.
Как можно выразить (записать) химическую реакцию?
Какой закон необходимо применять при составлении химических уравнений? О чем он гласит?
Изучение нового материала
Составление уравнений химических реакций взаимодействия простых веществ
Принцип составления уравнений реакций получения бинарных соединений из простых веществ:
в левой части уравнения должны присутствовать те простые вещества, атомы элементов которых присутствуют в соединении в правой части уравнения. Так, для получения, воды, необходимо, чтобы между собой прореагировали водород и кислород.
Запишем уравнение реакции и расставим коэффициенты:
Н2 + O2 H2O .
Укажите в уравнении реагенты и продукты химической реакции.
В общем виде алгоритм составления химического уравнения имеет такой вид с. 66 учебника:
1. Составь схему взаимодействия: слева запиши формулы реагентов, ставя между ними знак «+». Справа запиши формулы продуктов реакции. Если их несколько, также поставь между ними знак «+». Между левой и правой частями схемы поставь знак «».
2. Подбери коэффициенты к формулам каждого из веществ так, чтобы количество атомов каждого элемента в левой части была равна количеству атомов этого элемента в правой части схемы.
3. Сравни количества атомов каждого элемента в левой и правой частях схемы. Если они одинаковы, замени знак «» знаком « = ».
По химическим уравнениям вычисляют массы реагентов и продуктов реакций.
Итак: сформулируем определение химического уравнения:
Химическое уравнение – условная запись химической реакции с помощью химических формул, математических знаков и коэффициентов.
Уравнения химических реакций составляют на основе закона сохранения массы веществ.
Коэффициенты в химическом уравнении показывают простейшие соотношения между количествами структурных частичек реагентов и продуктов реакции.
Количества атомов каждого элемента в левой и правой частях уравнения одинаковы.
Закрепление и обобщение знаний
Задания
«Нагретый железный порошок внесли в колбу с газом желто-зеленого цвета – хлором, молекулы которого двухатомны. Порошок воспламенился, в результате появился коричневый дым, образованный частичками хлорида железа (III)». Запишите уравнение реакции.
2. Подберите коэффициенты для следующих реакций:
а) Fe + Cl2 FeCl3;
б) Na + Br2 NaBr;
в) Р + О2 Р2О3;
г) КС1О3 КС1 + О2;
д) FeCl2 + С12 FeCl3;
е) FeCl3 + Br2 FeBr3 + С12
3. Запишите уравнения взаимодействия следующих простых веществ и расставьте коэффициенты:
а) водорода и серы;
б) магния и кислорода;
в) алюминия и кислорода;
г) алюминия и серы;
д) цинка и кислорода;
е) натрия и серы;
ж) магния и серы.
3. Из каких простых веществ образуются: А1С13, СО2, ZnS, Na2О, CuO, СН4, Са3Р2?
Запишите уравнения реакций.
4. Расставьте коэффициенты в следующих схемах химических реакций. Сумма всех правильно расставленных коэффициентов должна быть равна относительной молекулярной массе гашеной извести Са(ОН)2.
а) Fe(OH)3 Fe2О3 +Н2О;
б) А12О3 + H2SО4 Al2(SО4)3 + Н2О;
в) НС1 + Сг2О3 СгС13 + Н2О;
г) Na + Н2О NaOH + Н2;
д) А1 + О2 А12О3;
е) А1С13 + NaOH А1(ОН)з + NaCl;
ж) Fe2О3 + HNО3 Fe (NО3)з + H2О;
з) А1 + I2 А1I3;
и) Fe2О3 + Н2 Fe + Н2О;
к) Fe + Cl2 FeCl3.
Домашнее задание: Изучить § 20, выучить определения; выполнить задание: № 3, 4, 5 стр.67-68.
Подведение итогов урока.
Итак, сегодня мы узнали, что такое химическое уравнение. Рассмотрели, что нужно для составления химического уравнения.
Чему научились на уроке, какие моменты требуют дальнейшей отработки?
infourok.ru