Скорость химических реакций и ее зависимость от условий протекания
Краткое описание документа:
Скорость химических реакций и ее зависимость от условий протекания
Цели: Сформировать понятие о скорости химических реакций и единицах ее измерения. Установить факторы, влияющие на скорость реакции (природа реагирующих веществ; их концентрация, площадь соприкосновения и температура).Показать значение ее в природе и человеческой деятельности. Углубить знания о катализаторах. Познакомить учащихся с классификацией химических реакций по признаку фазности (агрегатного состояния): гомо и гетерогенных.
Ход урока:
1 этап. Организационный
1.Приветствие: — Здравствуйте ребята! Садитесь.
2. Организация рабочих мест: — Открываем тетради и записываем сегодняшнее число, и тему урока с доски.
3. Оглашение цели урока учащимся
2. Подготовка к основному этапу усвоения учебного материала. Активизация опорных знаний и умений
Зачем нужны знания о скорости химических реакций?
Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
Как определяют скорость механического движения? Какова единица измерения этой скорости?
Как определяют скорость химической реакции?
3.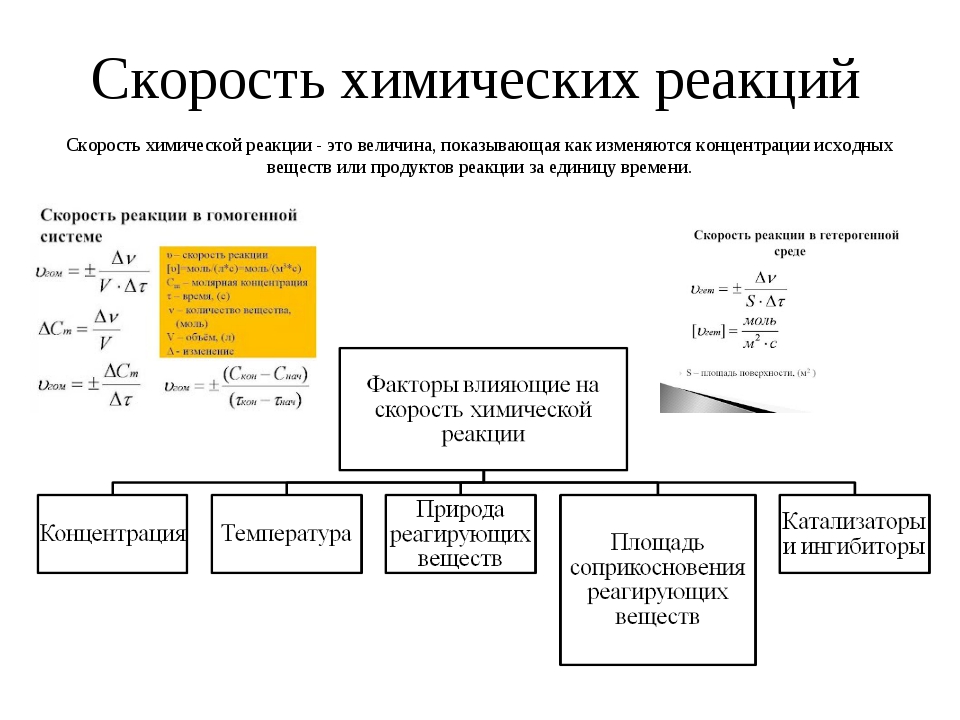 Изучение нового материала Рассмотрим два примера (эксперимент проводит учитель).На столе – две пробирки, в одной раствор щелочи (КOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO4. Что мы наблюдаем?
Изучение нового материала Рассмотрим два примера (эксперимент проводит учитель).На столе – две пробирки, в одной раствор щелочи (КOH), в другой – гвоздь; в обе пробирки приливаем раствор CuSO4. Что мы наблюдаем?
Прогнозируемая деятельность учеников 1-мгновенно, во второй – видимых изменений пока нет.
Составим уравнения реакций (два ученика записывают на доске уравнения):
1. CuSO4 + 2КOH = Cu(OH)2 + К2SO4 ; Cu2+ + 2OH- = Cu(OH)2
2. Fe + CuSO4 = FeSO4 + Cu ; Fe0 + Cu2+ = Fe2++ Cu0
Какой вывод по проведённым реакциям мы можем сделать? Почему одна реакция идёт мгновенно, другая медленно? Для этого необходимо вспомнить, что есть химические реакции, которые протекают во всём объёме реакционного пространства (в газах или растворах), а есть другие, протекающие лишь на поверхности соприкосновения веществ (горение твёрдого тела в газе, взаимодействие металла с кислотой, солью менее активного металла).
По результатам демонстрированного эксперимента учащиеся делают вывод: реакция 1 – гомогенная, а реакция 2– гетерогенная.
Скорости этих реакций будут математически определяться по-разному.
Учение о скоростях и механизмах химических реакций называется химической кинетикой
Как измерить скорость химической реакции?
- самая быстрая змея- черная мамба. Скорость ее движения 16-19 км. Час;
- самое медленное млекопитающее — трехпалый ленивец, передвигающийся по земле со скоростью 1,8-2 м/мин;
- рекорд печатания на машинке – 158 слов в минуту.
Для практики важно знать, за какое время протекает та или иная реакция, какова ее скорость.
Скорость химических реакций принято выражать изменением концентрации реагирующих веществ или продуктов реакции в единицу времени.
Пример измерения скорости химической реакции: 0,5 моль/л.сек, это означает, что каждую секунду в одном литре 0,5моль вещества превращается в другое вещество.
Какие же условия влияют на скорость химической реакции).
Природа реагирующих веществ. В зависимости от того, какие именно вещества реагируют, реакции могут протекать очень быстро (со взрывом), с умеренными скоростями или крайне медленно.
Эта группа проводит реакции взаимодействия с раствором серной кислоты (10%) и магния с тем же раствором кислоты. Природа магния такова, что он быстрее реагирует с кислотой, чем цинк.
Концентрация реагирующих веществ.
Поскольку в основе химической кинетики лежит постулат о том, что взаимодействие между молекулами (или др.), приводящее к образованию новых веществ, происходит только при столкновениях реагирующих частиц, то, чем больше частиц в единице объема, т.е. чем больше их молярная концентрация, чем чаще они за единицу времени сталкиваются и тем выше скорость химической реакции.
Эта группа проводит реакции взаимодействия цинка с серной кислотой 5% и 10%.
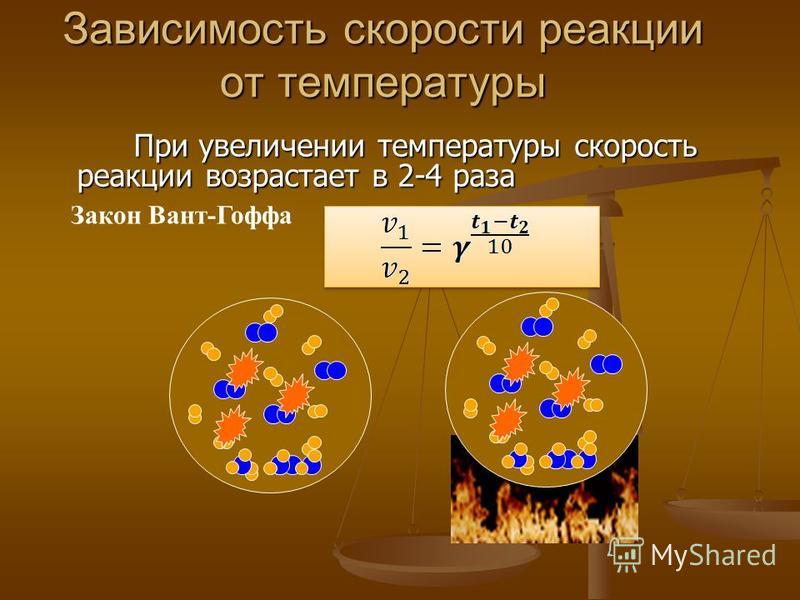
Температура. Для подавляющего большинства самых разных химических реакций скорости их возрастают с увеличением температуры. Причина сильной зависимости скорости реакции от температуры состоит в том, что увеличивается доля частиц, обладающих повышенной энергией, столкновение которых приводит к протеканию химической реакции. Поэтому скорости большинства химических реакций (экзо- и экзотермических, прямых, обратных, гомогенных, гетерогенных и т.д.) даже при незначительном увеличении температуры заметно возрастают. Повышение температуры на каждые 10 градусов скорость увеличивается в 2-4 раза.
Поэтому скорости большинства химических реакций (экзо- и экзотермических, прямых, обратных, гомогенных, гетерогенных и т.д.) даже при незначительном увеличении температуры заметно возрастают. Повышение температуры на каждые 10 градусов скорость увеличивается в 2-4 раза.
Правило Вант-Гоффа: скорость большинства химических реакций при повышении температуры на каждые 10 возрастает в 2-4 раза. Математически правило Вант-Гоффа выражается формулой:
где:– температурный коэффициент; – скорость химической реакции при температурах , соответственно.
Группа проводит реакции взаимодействия оксида меди (порошка) с раствором серной кислоты (10%) без нагревания и с нагреванием.
Катализатор.
Введение в реакционную систему небольших количеств специальных добавок- катализаторов может приводить к значительному увеличению скорости химической реакции. Действие катализатора состоит в том, что в его присутствии реакция протекает по иному маршруту, с меньшей энергией активации. Для обратимых реакций введение катализатора приводит к ускорению как прямой, так и обратной реакции. ( Механизм действия катализаторов не рассматривается). Группа проводит реакцию разложения раствора пероксида водорода с применением дихромата калия.
Для обратимых реакций введение катализатора приводит к ускорению как прямой, так и обратной реакции. ( Механизм действия катализаторов не рассматривается). Группа проводит реакцию разложения раствора пероксида водорода с применением дихромата калия.
Площадь соприкосновения реагирующих веществ, для гетерогенных реакций.
Чем сильнее измельчено вещество, тем больше площадь раздела фаз и тем выше скорость реакции.
Группа проводит реакции взаимодействия гранул цинка с серной кислотой (10%) и порошка цинка с тем же раствором серной кислоты.
Класс заполняет таблицу в тетради.
№ п/п
№ пробирки
Содержание и условия опыта
Наблюдения
Выводы с разъяснением причин
В ходе заполнения последней графы таблицы возникает «разрыв» с появлением информационного запроса о выводах по каждому опыту и объяснению причин наблюдаемых явлений.
4.Закрепление. Решение задач на скорость реакций.
Температурный коэффициент скорости некоторой реакции равен 2,3. Укажите, как изменится скорость этой реакции при повышении температуры на 20 градусов.
5.Домашнее задание: Решение задач
1.Если температурный коэффициент реакции равен 2, то для увеличения скорости реакции в 16 раз температуру нужно увеличить на сколько градусов?
2.Как необходимо изменить температуру в системе, чтобы скорость химической реакции увеличить в 81 раз. Температурный коэффициент равен 3? Правило Вант-Гоффа.
Скорость химической реакции
Дидактический материал
Скорость химической реакции и ее зависимость от различных факторов
1. При обычных условиях с наименьшей скоростью происходит взаимодействие между
1) железом и кислородом
2) магнием и 10%-ным раствором соляной кислоты
3) медью и кислородом
4) цинком и 10%-ным раствором
2.
2СО+O2=2CO + Q необходимо
1) увеличить концентрацию оксида углерода (II)
2) уменьшить концентрацию кислорода
3) понизить давление
4) понизить температуру
3. При комнатной температуре с наибольшей скоростью протекает реакция между
1) Zn и HCl (1 % р-р)
2) Zn и HCl (30 % р-р)
3) Zn и HCl (10 % р-р)
4) ZnCl2 (р-р) и AgNO3 (р-р)
4. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
1) концентрация кислоты
2) измельчение железа
3) температура реакции
4) увеличение давления
5. Для увеличения скорости химической реакции
FeO(тв) + CO(г) → Fe(тв) + СO2 (
необходимо
1) увеличить концентрацию СО2
2) уменьшить концентрацию СО2
3) уменьшить температуру
4) увеличить степень измельчения FeO
6. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
2CuS(тв) + 3О2(г) = 2CuO(тв) + 2SO2 (г) + 2920 кДж
необходимо
1) увеличить концентрацию SО2
2) уменьшить концентрацию SО2
3) уменьшить температуру
4) увеличить степень измельчения CuS
7. Для увеличения скорости химической реакции
Zn(тв) + 2Н+ → Zn2+ + H2 (г) + 154 кДж
необходимо
1) уменьшить концентрацию ионов цинка
2) увеличить концентрацию ионов водорода
3) уменьшить температуру
4) увеличить концентрацию ионов цинка
8. Для увеличения скорости химической реакции
Mg(тв) + 2Н+ → Mg2+ + H2(г) + 462 кДж
необходимо
1) уменьшить концентрацию ионов водорода
2) увеличить концентрацию ионов водорода
3) понизить температуру
4) повысить давление
9. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
Zn(тв) + 2НСl(г) = ZnCl2(тв) + H2(г) + 231 кДж
необходимо
1) увеличить концентрацию водорода
2) увеличить количество цинка
3) уменьшить температуру
4) увеличить концентрацию хлороводорода
10. Для увеличения скорости взаимодействия железа с хлороводородной кислотой следует
1) добавить ингибитор
2) понизить температуру
3) повысить давление
4) увеличить концентрацию соляной кислоты HCl
11. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно
1) разбавить кислоту
2) измельчить мрамор
3) добавить индикатор
4) проводить реакцию в атмосфере инертного газа
12. С наибольшей скоростью при обычных условиях взаимодействуют
1) азот и водород
2) магний и вода
3) раствор гидроксида натрия и соляная кислота
4) сера и железо
13. С наибольшей скоростью при обычных условиях взаимодействуют
С наибольшей скоростью при обычных условиях взаимодействуют
1) цинк и соляная кислота
2) натрий и вода
3) магний и вода
4) свинец и соляная кислота
14. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других — уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты столкновений частиц.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. C наибольшей скоростью реагирует с водородом
1) Сl2
2) F2
3) S
4) C
16. Оцените правильность утверждений.
А. Катализатор — это вещество, которое увеличивает скорость химической реакции, но при этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Для увеличения скорости реакции водорода с азотом
1) охлаждают азотоводородную смесь
2) снижают давление в системе
3) используют катализатор
4) используют циркуляцию азотоводородной смеси
18. При повышении давления увеличивается скорость реакции
1) кислорода с сернистым газом
2) цинка с серной кислотой
3) серы с железом
4) гидроксида натрия с хлоридом меди (II)
19. Катализатор требуется для проведения реакции
1) хлорирования алканов
2) нейтрализации фосфорной кислоты
3) пиролиза метана
4) этерификации уксусной кислоты
20. С наибольшей скоростью при обычных условиях взаимодействуют
1) аммиак и хлороводород
2) азот и водород
3) азот и кислород
4) сернистый газ и кислород
21. Оцените правильность утверждений.
Оцените правильность утверждений.
А. При нагревании скорость многих реакций уменьшается.
Б. Катализатор — это вещество, которое увеличивает скорость химической реакции, но само в ней не расходуется
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
22. Давление влияет на скорость реакции между
1) гидроксидом цинка и азотной кислотой
2) цинком и серной кислотой
3) аммиаком и кислородом
4) серой и алюминием
23. Реакцию, уравнение которой
FeO + 2H+ = Fe2+ + H2O + Q,
можно ускорить, если
1) повысить давление
2) понизить давление
3) повысить температуру
4) понизить температуру
24. Скорость реакции
Zn + H2SO4 = ZnSO4 + H2 + Q
понизится при
1) повышении температуры
2) понижении давления
3) повышении давления
4) разбавлении раствора кислоты
25. Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
1) | Na, Ca, Zn, Cr, Cu |
2) | Mg, Na, Ni, Zn, Cu |
3) | Na, Ba, Fe, Cu, Zn |
4) | Ba, Na, Zn, Cu, Fe |
26. Оцените справедливость суждений.
А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия..
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
27. Скорость реакции
Скорость реакции
N2 + 3H2 = 2NH3 + Q
увеличится при
1) понижении температуры
2) понижении концентрации NH3
3) разбавление смеси аргоном
4) использовании катализатора
28. Какой металл реагирует с серной кислотой быстрее других?
29. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, — это
1) нейтрализация серной кислоты раствором гидроксида натрия
2) горение водорода в кислороде
3) взаимодействие растворов хлорида меди и гидроксида калия
4) горение алюминия в кислороде
Ответ: 1-3, 2-1, 3-4, 4-4, 5-4, 6-4, 7-2, 8-2, 9-4, 10-4, 11-2, 12-3, 14-2, 14-2, 15-2, 16-3, 17-3, 18-1, 19-4, 20-1, 21-2, 22-3, 23-3, 25-44, 25-1, 26-3, 27-4, 28-2, 29-4.
Скорость способы увеличения — Справочник химика 21
Лекция 3. химическое равновесие в технологических процессах. Скорость технологических процессов. Способы увеличения скорости процесса. Лекция 4. Общие закономерности гетерогенных процессов. Равновесие и скорость гетерогенных процессов. Влияние механизма гетерогенного процесса на скорость химико-технологического процесса, 4.2. Химические реакторы [c.282]
химическое равновесие в технологических процессах. Скорость технологических процессов. Способы увеличения скорости процесса. Лекция 4. Общие закономерности гетерогенных процессов. Равновесие и скорость гетерогенных процессов. Влияние механизма гетерогенного процесса на скорость химико-технологического процесса, 4.2. Химические реакторы [c.282]
Регуляторы роста и развития растений модифицируют культуру за счет изменения скорости, способа ее реакции на внешние и внутренние факторы, управляющие всеми стадиями развития этой культуры от прорастания до вегетативного роста, репродуктивного развития, зрелости, старения или созревания вплоть до сохранности урожая после уборки. Возможности растения ограничиваются в большей степени внешними условиями, поэтому урожай напрямую зависит от умения контролировать процессы, происходящие в растениях, с приведением их в соответствие с существующими природными ограничениями, от увеличения сопротивления растения этим ограничениям.
 Регуляторы роста с великим успехом могут помочь земледельцу в решении этих вопросов. [c.55]
Регуляторы роста с великим успехом могут помочь земледельцу в решении этих вопросов. [c.55]Как производителям автомобилей, исследующим способы увеличения срока жизни и мощности автомобиля, лучше определить скорость износа поршневых колец [c.352]
Измельчение и смешение. Во многих процессах химической технологии требуется развить межфазную поверхность для повыщения скорости гетерогенных процессов. Наиболее простой способ увеличения поверхности заключается в измельчении твердых тел и смешении твердых и жидких фаз. [c.111]
Процесс экструзии заготовки в очень сильной мере зависит от реологических свойств полимера и, следовательно, от его температуры. Этот аспект процесса экструзионно-раздувного формования рассмотрен в гл. 15. В то время как процесс раздува протекает быстро, стадия охлаждения является сравнительно продолжительной. Поэтому разработано несколько способов увеличения скорости охлаждения за счет впрыска жидкого диоксида углерода в полость формованного изделия или за счет применения для раздува сжатого воздуха высокого давления с повышенным содержанием влаги [21 ]. [c.26]
[c.26]
Результат реакции определяется термодинамической устойчивостью реагентов и продуктов реакции, а скорость реакции — кинетическими факторами. Если в ходе реакции устанавливается равновесие между реагентами и продуктами, то в равновесной смеси преобладают те соединения, которые термодинамически наиболее устойчивы (т. е. те, которые имеют наиболее прочные связи и молекулы которых образуют наименее упорядоченную систему). Впрочем, иногда можно осуществить и невыгодную с точки зрения термодинамики реакцию, для которой реагенты термодинамически стабильнее продуктов. Такие реакции, конечно, не проводят лишь до достижения равновесия (при этом был бы низкий выход продуктов) а, напротив, все время нарушают равновесие, непрерывно удаляя продукты из реакционной смеси. При этом новые порции реагентов вступают в реакцию с образованием продуктов. Другой способ увеличения выхода заключается в том, что при экзотермических реакциях смесь охлаждают, отбирая выделившееся тепло, а при эндотермических реакциях смесь, напротив, нагревают. Аналогично если для реакций в газовой фазе давление понижается в результате уменьшения суммарного числа молекул продуктов (предполагается, что реакция протекает в закрытом сосуде, например е металлическом автоклаве), то увеличение давления приведет к сдвигу равновесия в сторону продуктов (принцип Ле Шателье). Примером такой реакции может служить присоединение водорода к этилену с образованием этана [c.101]
Аналогично если для реакций в газовой фазе давление понижается в результате уменьшения суммарного числа молекул продуктов (предполагается, что реакция протекает в закрытом сосуде, например е металлическом автоклаве), то увеличение давления приведет к сдвигу равновесия в сторону продуктов (принцип Ле Шателье). Примером такой реакции может служить присоединение водорода к этилену с образованием этана [c.101]
Перечислите все способы увеличения скорости реакций, протекающих в домне. [c.174]
Увеличить эффективность конвективного теплообмена можно двумя способами. Один из этих способов — увеличение массовой скорости продуктов сгорания до величины, при которой достигается достаточно большой коэффициент теплопередачи. Однако обычно этот метод оказывается нецелесообразным вследствие вызываемой им большой потери тяги дымовых газов при прохождении через конвекционную секцию и возникающей необходимости создания повышенного давления в камере сгорания. [c.59]
[c.59]
Один из наиболее широко используемых способов увеличения коэффициента теплоотдачи состоит в применении прерывистых поверхностей с таким расчетом, чтобы уменьшить толшину пограничного слоя у этих поверхностей. На рис. 1-1 показана такая прерывистая поверхность. Развитые поверхности особенно удобны для подобной обработки. Придание поверхности прерывистости увеличивает фактор трения, однако небольшое увеличение интенсивности теплоотдачи может с лихвой возместить значительное увеличение фактора трения,поскольку скорость потока может быть при этом уменьшена, а потери энергии на преодоление трения изменятся пропорционально кубу скорости. [c.14]
Для обеспечения широкого диапазона регулирования без отключения горелок наиболее перспективным является установка многоканальных горелок с отключаемыми периферийными каналами и горелок с изменяющимся сечением амбразуры (см. гл. 5). Для мощных горелок с расходом мазута более 5 т/ч опробовано увеличение скорости воздуха на выходе из амбразуры до 60—65 м/с. При этом удается расширить диапазон регулирования, Увеличение диапазона регулирования мазутных форсунок может быть достигнуто также установкой паромеханических форсунок, сдвоенных механических форсунок и т. и. Однако наиболее радикальным способом увеличения диапазона регулирования является увели- [c.176]
При этом удается расширить диапазон регулирования, Увеличение диапазона регулирования мазутных форсунок может быть достигнуто также установкой паромеханических форсунок, сдвоенных механических форсунок и т. и. Однако наиболее радикальным способом увеличения диапазона регулирования является увели- [c.176]
СПОСОБЫ УВЕЛИЧЕНИЯ СКОРОСТИ ПРОЦЕССА [c.64]
Одной из основных задач технологии является использование всех путей для увеличения скорости технологического процесса и соответствующего повышения производительности аппаратуры. Анализ направлений интенсификации химико-технологических процессов производится при помощи основных формул скорости процесса, согласно которым для повышения скорости процесса следует найти способы увеличения определяющих величин АС, к и Р( о). [c.64]
Формула Стокса (3.8.3) определяет скорость движения частицы относительно той среды, в которой взвешена частица. В реальных же условиях представляет интерес скорость движения (оседания) частиц относительно стенок или дна сосуда, в котором находится взвесь. Например, это может быть емкость для очистки промышленных стоков от взвешенных частиц. Различие между этими двумя скоростями можно не принимать во внимание (что обычно и делается) только в разбавленных суспензиях. В промышленных же условиях всегда актуален вопрос о рациональном использовании оборудования, в том числе емкостей для отделения дисперсной фазы от дисперсионной среды. Самым простым способом увеличения производительности емкостного оборудования является увеличение концентрации тех смесей, которые в них перерабатываются. Но именно при высоких концентрациях частиц различие скоростей их оседания относительно среды и и относительно стенок сосуда становится существенным вплоть до несовпадений направлений движения. Причина в том, что при оседании достаточно концентрированной взвеси на этот процесс влияет встречный поток среды, вытесняемой оседающими частицами из нижней части сосуда в верхнюю и, следовательно, замедляющий оседание частиц [12]. В монодисперсной суспензии единственным следствием этого эффекта является замедление процесса оседания, но в полидисперсных взвесях по этой причине происходит качественное изменение характера распределения частиц разного размера как в осадке, так и над ним.
Например, это может быть емкость для очистки промышленных стоков от взвешенных частиц. Различие между этими двумя скоростями можно не принимать во внимание (что обычно и делается) только в разбавленных суспензиях. В промышленных же условиях всегда актуален вопрос о рациональном использовании оборудования, в том числе емкостей для отделения дисперсной фазы от дисперсионной среды. Самым простым способом увеличения производительности емкостного оборудования является увеличение концентрации тех смесей, которые в них перерабатываются. Но именно при высоких концентрациях частиц различие скоростей их оседания относительно среды и и относительно стенок сосуда становится существенным вплоть до несовпадений направлений движения. Причина в том, что при оседании достаточно концентрированной взвеси на этот процесс влияет встречный поток среды, вытесняемой оседающими частицами из нижней части сосуда в верхнюю и, следовательно, замедляющий оседание частиц [12]. В монодисперсной суспензии единственным следствием этого эффекта является замедление процесса оседания, но в полидисперсных взвесях по этой причине происходит качественное изменение характера распределения частиц разного размера как в осадке, так и над ним. Действительно, скорость встречного потока феды может оказаться больше, чем скорость оседания частиц достаточно малого размера, и тогда они потоком среды будут переноситься навстречу основной массе более крупных оседающих частиц. Такая инверсия направления движения сохраняется толь- [c.641]
Действительно, скорость встречного потока феды может оказаться больше, чем скорость оседания частиц достаточно малого размера, и тогда они потоком среды будут переноситься навстречу основной массе более крупных оседающих частиц. Такая инверсия направления движения сохраняется толь- [c.641]
А. Увеличение концентрации взаимодействующих компонентов в исходном сырье повышает С и пропорционально скорость процесса. Способ увеличения концентрации взаимодействующих компонентов в исходном сырье зависит от агрегатного состояния материала. Увеличение содержания полезного составляющего в твердом сырье называется обогащением, а в жидком и газообразном— концентрированием. Увеличение концентрации взаимодействующих веществ — это один из самых распространенных приемов для интенсификации процессов. [c.65]
Важными технологическими показателями промышленных процессов служат равновесный выход продукта, определяемый равновесием при данных условиях, и фактический выход продукта, определяемый равновесием и скоростью процесса.
 Изыскание путей и способов увеличения равновесного и фактического выхода продукта химических процессов является важнейшей задачей химической технологии. Определение максимального равновесного выхода продукта гетерогенных процессов и возможностей его повышения основано на анализе равновесия в данной гетерогенной системе. На гетерогенные равновесия влияют температура, давление, концентрации реагентов и продуктов реакции. [c.151]
Изыскание путей и способов увеличения равновесного и фактического выхода продукта химических процессов является важнейшей задачей химической технологии. Определение максимального равновесного выхода продукта гетерогенных процессов и возможностей его повышения основано на анализе равновесия в данной гетерогенной системе. На гетерогенные равновесия влияют температура, давление, концентрации реагентов и продуктов реакции. [c.151]Для промышленного осуществления такого способа увеличения скорости фильтрации при депарафинизации остаточного рафината необходимо технологическую схему установки дополнить аппаратом для распыления петролатума. На распыление следует направлять часть петролатума после регенерации растворителя. Это мероприятие не связано с большими затратами и может обеспечить значительное повышение производительности установок депарафинизации. [c.128]
В общем случае для повышения скорости химического разложения, растворения и выщелачивания изыскивают способы увеличения константы скорости, движущей силы процесса или поверхности взаимодействия фаз. Затем выбирают наиболее рациональный путь, требующий наименьших производственных затрат. Константу скорости можно увеличить повышением температуры и усилением перемешивания пульпы, применением катализаторов. Движущая сила процесса возрастает при увеличении концентрации растворителя, давления в автоклаве, изменении температуры, отводе продуктов процесса из реакционного объема. Реакционную поверхность увеличивают, повышая интенсивность перемешивания пульпы, крупность измельчения рудного материала. В ряде случаев тонкое измельчение сопровождается механохимической активацией минерального вещества. [c.32]
Затем выбирают наиболее рациональный путь, требующий наименьших производственных затрат. Константу скорости можно увеличить повышением температуры и усилением перемешивания пульпы, применением катализаторов. Движущая сила процесса возрастает при увеличении концентрации растворителя, давления в автоклаве, изменении температуры, отводе продуктов процесса из реакционного объема. Реакционную поверхность увеличивают, повышая интенсивность перемешивания пульпы, крупность измельчения рудного материала. В ряде случаев тонкое измельчение сопровождается механохимической активацией минерального вещества. [c.32]
Способы увеличения скорости процесса. Как уже отмечалось выше, одной из основных задач технолога является использование всех путей для увеличения скорости технологического процесса или, что то же, интенсивности работы аппарата. Анализ путей производится с помощью уравнений (38) и (39), согласно которым для повышения скорости процесса следует найти способы увеличения определяющих величин АС, к и Р затем выбирают наиболее рациональные из этих способов, т. е. [c.77]
е. [c.77]
Способы увеличения относительной скорости перемещения растворяемого вещества и растворителя различны. Они сводятся либо к пропусканию жидкости через слой неподвижного или взвешенного твердого материала, либо к различным приемам перемешивания. [c.137]
Производительность абсорбционных и ректификационных аппаратов может быть значительно повышена двумя способами увеличением размеров (сечения) аппаратов или созданием принципиально новых контактных устройств, допускающих увеличение скорости пара и нагрузки по жидкости. [c.123]
Одним из основных способов увеличения скорости химического процесса является перемешивание реагентов. Причем перемешивание увеличивает коэффициент массопередачи или константу скорости процесса вследствие перехода от молекулярной диффузии к конвективной. При этом снижается диффузионное сопротивление, препятствующее взаимодействию компонентов. Наиболее целесообразно увеличивать степень перемешивания взаимодействующих веществ при осуществлении процессов, протекающих в диффузионной области. При этом увеличивать степень перемешивания можно до тех пор, пока общая константа скорости процесса не перестанет зависеть от коэффициентов переноса В, т. е. до перехода процесса из диффузионной области в кинетическую. Дальнейшее увеличение перемешивания в проточных аппаратах снижает движущую силу процесса и скорость реакции. [c.141]
При этом увеличивать степень перемешивания можно до тех пор, пока общая константа скорости процесса не перестанет зависеть от коэффициентов переноса В, т. е. до перехода процесса из диффузионной области в кинетическую. Дальнейшее увеличение перемешивания в проточных аппаратах снижает движущую силу процесса и скорость реакции. [c.141]
Рассмотрение таких спектров значительно сокращает продолжительность исследований подобного рода. Газ, выделяющийся из образца, может быть испытан различными способами, а получение более детального спектра необходимо лишь тогда, когда он претерпевает значительные изменения. На обсуждаемом рисунке приведено три спектра, полученных при повышении температуры нагрева исследуемого образца. Два из них записаны при той же скорости развертки, что и первый спектр это позволяет провести быстрое сравнение различных наблюдаемых пиков. Четвертый спектр записан при скорости развертки, увеличенной по сравнению с предыдущей на Р/з раза. При этом некоторые детали исчезают так, изотопный пик с массой 128 уже неразличим. [c.185]
[c.185]
ЧИСЛО пиков, как, например, при исследовании соединений высокого молекулярного веса, в тех случаях, когда величина пика может изменяться в процессе исследования, например при быстро протекающих реакциях или при исследовании очень малого количества образца, когда скорость введения его через натекатель поддерживается достаточно высокой для увеличения чувствительности. Однако обычно такие специальные проблемы обусловливают необходимость создания специальных регистрирующих систем некоторые из них будут описаны ниже. Иногда целесообразно использовать все возможные способы увеличения скорости развертки в других случаях малое время развертки не имеет значения для получения необходимой информации, особенно если оно мало по сравнению с временем введения образца или его удаления после исследования. В таких случаях нецелесообразно применять слишком сложные системы для незначительного увеличения скорости развертки. Высокая чувствительность и малая постоянная времени — требования несовместимые, и необходимый уровень чувствительности может ограничить скорость регистрации. [c.230]
[c.230]
Основной причиной размытия зон хорошо адсорбирующихся веществ ири обычных скоростях газа-носителя является внешняя диффузия (лишь ири адсорбции на цеолитах — молекулярных ситах — внутреннедиффузионная массопередача является более медленной стадией, так как поры адсорбента достаточно узки). Таким образом, расширение пор (и достижение их однородности)— эффективный способ увеличения четкости и сокращения продолжительности разделения. Из уравнений (1.53) и (2.4) следует, что в тех случаях, когда член Сг достаточно велик, степень разделения на колонке заданной длины зависит лишь от коэффициента селективности колонки и не изменяется при переходе от одного члена гомологического ряда к другому (при этом предполагается, что Г >1). При заданной продолжительности разделения [c.114]
Периодическое смачивание как способ увеличения скорости коррозии может быть применено при ускоренных испытаниях к тем металлам, коррозия которых контролируется в значительной степени скоростью доставки кислорода к металлу. [c.44]
[c.44]
В отношении техники безопасности каждый из рассмотренных способов транспортирования ацетилена не вызывает сомнений в надежности. Предпочтение тому или другому способу при выборе диаметра ацетилено-провода. может быть отдано лишь с учетом конкретных условий транспортирования ацетилена. На современных производствах приходится транспортировать большие количества ацетилена. В этом случае применение труб диаметром до 150 мм практически нецелесообразно. В отдельных случаях, когда транспортирование ацетилена в таких трубах при высоких скоростях вызывает увеличение сопротивления системы и, следовательно, увеличение давления С2Н2, этот способ не может счи таться приемлемым. Рассмотрим при.меры. [c.71]
Перенапряжение является проблемой, имеющей не только теоретическое, но и важнейшее практическое значение. Наличие перенапряжения приводит к тому, что при промышлеяном электролизе непроизводительно затрачиваются значительные количества электрической энергии. Следовательно, снижение перенапряжения на электроде — это одна из важнейших задач прикладной электрохимии. Решить эту задачу невозможно без установления истинного механизма сложного электрохимического процесса, без установления его лимитирующ( й стадии, малая скорость которой и приводит к возникновению перенапряжения. Поэтому задача электрохимической кинеп ки заключается в нахождении способов увеличения скорости этой наиболее медленной стадии. Ясно, что как решение проблемы перенапряжения, так и вообще создание современной те(зрии электродных процессов невозможно без выяснения истин1юго механизма элементарных актов, составляющих сложный электрохимический процесс. [c.629]
Следовательно, снижение перенапряжения на электроде — это одна из важнейших задач прикладной электрохимии. Решить эту задачу невозможно без установления истинного механизма сложного электрохимического процесса, без установления его лимитирующ( й стадии, малая скорость которой и приводит к возникновению перенапряжения. Поэтому задача электрохимической кинеп ки заключается в нахождении способов увеличения скорости этой наиболее медленной стадии. Ясно, что как решение проблемы перенапряжения, так и вообще создание современной те(зрии электродных процессов невозможно без выяснения истин1юго механизма элементарных актов, составляющих сложный электрохимический процесс. [c.629]
Как известно, многие химические реакции, для которых характерны высокие энергии активации, при обычных условиях протекают очень медленно, а при нагревании скорость реакции возрастает. Однако нагревание как способ увеличения скорости реакции не всегда возможно. Например, регулировать скорости химических реакций, протекающих в живых организ- -мах, изменяя температуру в широких пределах, вообще нельзя. К тому же для обратимых реакций, как было показано на примере реакции синтеза аммиака, повышение температуры приводит к сдвигу химического равновесия в сторону уменьшения выхода аммиака, что не выгодно для производства. Поэтому в практике для регулирования скоростей реакций используют катализаторы. [c.119]
К тому же для обратимых реакций, как было показано на примере реакции синтеза аммиака, повышение температуры приводит к сдвигу химического равновесия в сторону уменьшения выхода аммиака, что не выгодно для производства. Поэтому в практике для регулирования скоростей реакций используют катализаторы. [c.119]
Наиболее эффективный способ увеличения количества активных молекул — снижение энергии активации, достигаемое применением катализаторов, в чем и состоит сущность катализа. Неорганические катализаторы снижают энергию активации на 16—30 кДж- моль- , биологические —на 68—75 кДж-моль-. При гидролизе а-1,4-глюкозйдной связи в амилозе в пересчете на одинаковые с минеральными катализаторами концентрации катализаторов скорость реакции под действием, например, а-амилазы будет на 9—12 порядков выше. [c.178]
Очень простои способ увеличения скорости коагуляции аэрозоля— это турбулизация его с помощью вентиаятора Вихри уве личивают скорость частиц относительно друг друга, поэтому вероятность их столкновения а следовательно и скорость коагуля ции возрастает Скорость коагуляции однородных сферических ча стиц с радиусом г в ламинарном потоке жидкости с градиентом скорости ди1дг перпендикулярным линиям тока, равна [c. 160]
160]
Однако даже при благоприятных термодинамических характеристиках процесс может оказаться практически неприемлемым, если скорость его мала. Поэтому не менее важны кинетические характеристики реакций — знание скоростей и порядков реакций п умение влиять на эти показатели. Главный способ увеличения скорости реакции — применение катализаторов. Последние являются специфическими для каждого процесса, приготовление их требует специальных приемов, а активность зависит liaK от состава, так и от обработки готового катализатора. [c.171]
Струнную насадку можно размещать как в горизонтальном, так и в вертикальном сепараторах. В горизонтальном сепараторе насадку удобно расположить вертикально в сечении аппарата (рис. 19.11). При этом для сохранения безотрывного режима требуется разделить насадку на секции, исходя из рассчитанной критической высоты струн. Размещение насадки в вертикальном аппарате требует перестройки потока, что может привести к уменьшению рабочего сечения насадки и увеличению в ней скорости потока сверх критического значения. Одним из перспективных способов увеличения производительности и эффективности вертикального сепаратора — установка струнной секции на выходе сепаратора, как показано на рис. 19.12. Малые габариты струнного блока позволяют использовать его для переоборудования низконроизводительных и [c.502]
Одним из перспективных способов увеличения производительности и эффективности вертикального сепаратора — установка струнной секции на выходе сепаратора, как показано на рис. 19.12. Малые габариты струнного блока позволяют использовать его для переоборудования низконроизводительных и [c.502]
Один из способов увеличения прямотока — уменьшение сечения рабочего канала кристаллогенератора. Другой способ — расчленение увариваемого продукта поперечными перегородками на секции с сохранением перехода из секции в секцию через нижний канал в кристаллогенераторе. Концентрация увариваемого продукта постепенно повышается от секции к секции по длине КГ. В результате время пребывания в КГ уменьшается, так как генерация кристаллов может происходить не по всему КГ, а только в последних секциях, где более высокая концентрация раствора способствует более высокой скорости генерации кристаллов. [c.195]
Другой известный способ увеличения скорости растворения = >гсокомодульных стеклообразных силикатов заключается в их «Дратации. Умеренно гидратированные стекла сохраняют хруп- сть и могут быть приготовлены в виде порошков. Уже отмеча- сь, что силикаты щелочных металлов смешиваются с водой, принципе в самых разных соотношениях. Основная трудность включается в гомогенизации системы. Уже при грануляции без- Дных силикатов охлаждением расплавов в проточной воде на Верхности гранул образуется частично гидратированный слой, [c.177]
Умеренно гидратированные стекла сохраняют хруп- сть и могут быть приготовлены в виде порошков. Уже отмеча- сь, что силикаты щелочных металлов смешиваются с водой, принципе в самых разных соотношениях. Основная трудность включается в гомогенизации системы. Уже при грануляции без- Дных силикатов охлаждением расплавов в проточной воде на Верхности гранул образуется частично гидратированный слой, [c.177]
Увеличение концентрации взаимодействующих компонепточ в исходном сырье позволяет повысить начальные концентрации компонентов, т. е. скорость в начале реакции. Способ увеличения концентраций исходных реагентов зависит от агрегатного состояния материала. Увеличение полезного составляющего в твердом сырье называется обогащением, а в жидком или газообразном — к о н ц е н- [c.231]
Чтобы ускорить д >стижеиве состояния равновесия, требуется увеличить скорость реакции. Осиовиыми способами увеличения скорости реакции являются повышение температуры и введение катализатора. [c.242]
[c.242]
Регенерацию можно ускорить увеличением количества воздуха, подаваемого в аппарат, и концентрации в нем кислорода. Подводить много воздуха в верхние и нижние зоны регенератора не требуется, так как режим горения в этих зонах близок к кинетическому. Основное количество воздуха следует направлять в средние зоны. Таким путем достигается наибольшая скорость горения кокса в регенераторе при наименьшем общем коэффициенте избытка воздуха. При этом целесообразно увеличить площадь газовыводных устройств, особенно в средних зонах. Подача нагретого воздуха в верхнюю секцию регенератора позволяет сократить индукционный период горения кокса, и, следовательно, увеличить степень использования объема регенератора. Кроме того, обычно применяемый способ — увеличение объема регенератора — является доступным и достаточно эффективным путем для выжигания большего количества кокса с катализатора. [c.44]
Еще одна чрезвычайно важная проблема, которую приходится решать при сжигании природного газа, — это низкая светимость создаваемого обычными горелками факела. В стекловаренных печах используют несколько способов повышения степени черноты факела природного газа. Например, для получения светящегося факела выходное сечение газового сопла принимают достаточно большим (30-60 мм), что соответствует скорости истечения газа 30-35 м/с. При высоких температурах, характерных для стекловаренных печей, это позволяет обеспечить самокарбюрацию пламени и увеличение его излучательной способности. Однако при этом вследствие уменьшения начальной кинетической энергии газовых струй наблюдается некоторое у)ощше-ние жесткости факела. Кроме того, достигнутое при использовании указанного способа увеличение излучательной способности факела неизменно сопровождается снижением его температурного уровня и динамических характеристик. В итоге это может привести к повышению расхода топлива на процесс варки стекла. Следует подчеркнуть, что ограниченные возможности гибкого регулирования процесса горения при [c.582]
В стекловаренных печах используют несколько способов повышения степени черноты факела природного газа. Например, для получения светящегося факела выходное сечение газового сопла принимают достаточно большим (30-60 мм), что соответствует скорости истечения газа 30-35 м/с. При высоких температурах, характерных для стекловаренных печей, это позволяет обеспечить самокарбюрацию пламени и увеличение его излучательной способности. Однако при этом вследствие уменьшения начальной кинетической энергии газовых струй наблюдается некоторое у)ощше-ние жесткости факела. Кроме того, достигнутое при использовании указанного способа увеличение излучательной способности факела неизменно сопровождается снижением его температурного уровня и динамических характеристик. В итоге это может привести к повышению расхода топлива на процесс варки стекла. Следует подчеркнуть, что ограниченные возможности гибкого регулирования процесса горения при [c.582]
В зависимости от параметров процессов продолжительность работы между регенерациями изменяется в широких пределах. Продолжительность рабочего периода нри риформинге лигроина может быть увеличена следующими способами 1) повышением давления 2) примененнед сырья с высоким содержанием цикланов 3) снижением объемной скорости 4) увеличением кратности циркуляции газа 5) переключением на производство низкооктановых продуктов 6) снижением числа регенераций. [c.63]
Продолжительность рабочего периода нри риформинге лигроина может быть увеличена следующими способами 1) повышением давления 2) примененнед сырья с высоким содержанием цикланов 3) снижением объемной скорости 4) увеличением кратности циркуляции газа 5) переключением на производство низкооктановых продуктов 6) снижением числа регенераций. [c.63]
Скорость химических реакций. Факторы, влияющие на скорость химических реакций
Химическая кинетика – это раздел химии, изучающий скорость и механизмы химических реакций.
Химические реакции протекают с различными скоростями. Столетиями разрушаются лаки и краски на полотнах мастеров. Процесс ржавления также идёт достаточно медленно. Взрыв – мгновенная реакция, а процесс нейтрализации идёт на глазах.
Чтобы
прошла химическая реакция, нужно, чтобы взаимодействующие частицы были активными. Они должны
обладать повышенной энергией, чтобы преодолеть энергетический барьер,
называемый энергией активации. Если энергия активации мала, то и скорость
реакции будет высокой.
Если энергия активации мала, то и скорость
реакции будет высокой.
В химии рассматривается вещество или совокупность веществ, это так называемая система. В этой системе можно выделить часть, которая отделена от других частей − это фаза.
Если система состоит из одной фазы, то её называют гомогенной, или однородной. Гомогенными системами являются газовые смеси, растворы. Гетэрогенными, или неоднородными считаются системы, которые состоят из нескольких фаз. Например, это смеси из твёрдых веществ, смесь, состоящая из газа и твёрдого вещества, а также смесь, которая состоит из жидкости и твёрдого вещества.
Следовательно, реакции, которые протекают в гомогенных системах, называются гомогенными,
а реакции, которые идут в гетэрогенных системах, называются гетэрогенным. Сами
гомогенные реакции протекают во всём объёме смеси, а гетэрогенные – на
поверхности раздела фаз.
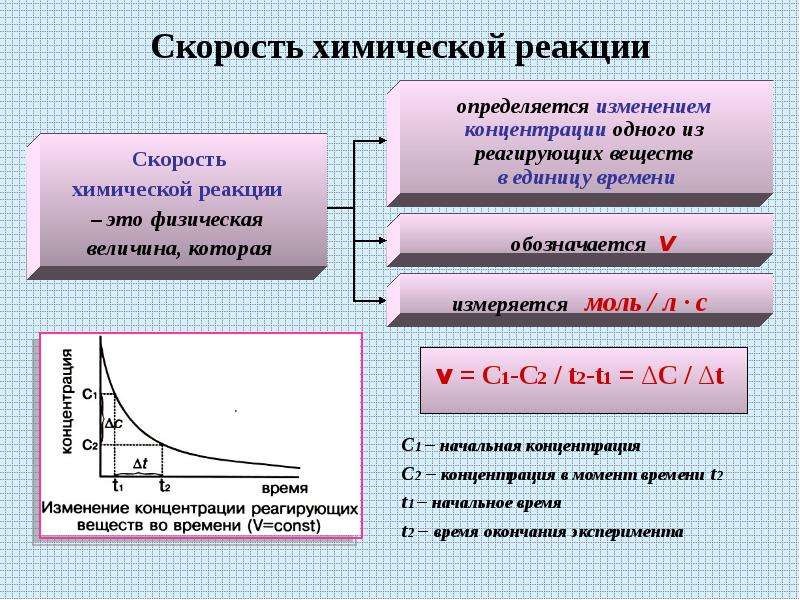
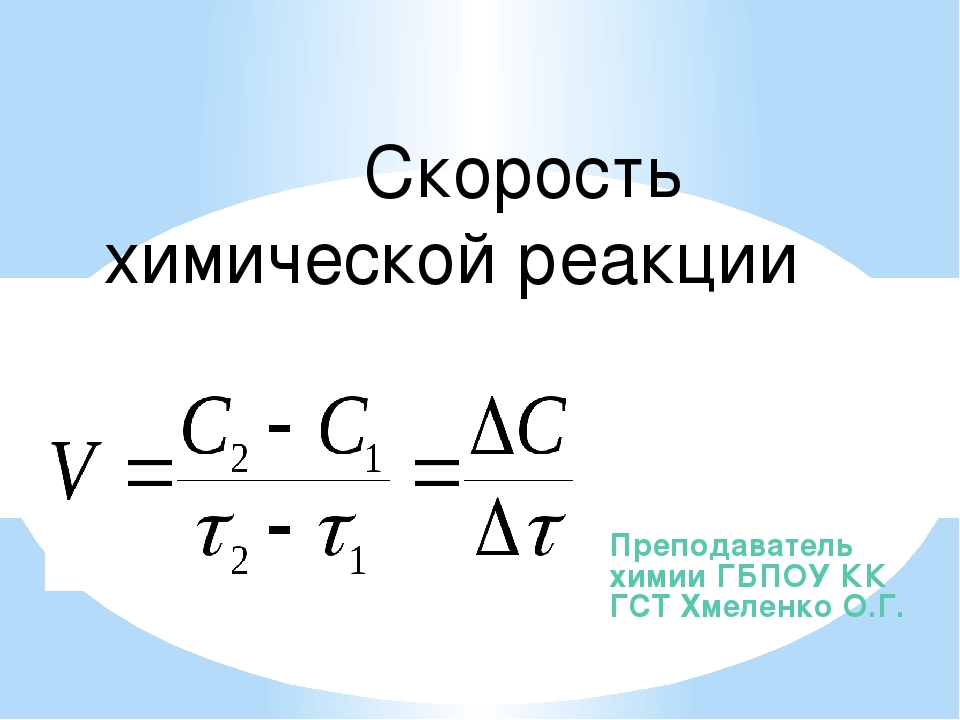
Скорость гомогенной реакции – это количество вещества, которое вступило в реакцию или образовалось в результате её за единицу времени в единице объёма системы.
В данной формуле эн – это число молей реагирующего вещества в данный момент времени; тэ – это время; а вэ – это объём системы.
Если учесть, что отношение числа молей к объёму реакционной смеси это молярная концентрация, то для определения скорости гомогенной реакции можно использовать формулу, где в числителе использована молярная концентрация. В этой формуле цэ – молярная концентрация реагирующего вещества в данный момент времени.
Следовательно, скорость гомогенной реакции равна изменению концентрации какого-либо из реагирующих веществ в единицу времени и выражается в моль на литр в секунду.
Так как скорость
химической реакции может быть только положительной, то знак «плюс» ставится тогда, когда молярная концентрация – это концентрация
продукта реакции, а знак «минус», если молярная концентрация – это концентрация исходного вещества.
Скорость же гетэрогенной реакции – это отношение числа количества вещества, которое вступает в химическую реакцию или которое образуется в результате реакции за единицу времени на единице поверхности раздела фаз. В этой формуле эс – это поверхность раздела фаз.
Скорость любой химической реакции зависит от ряда факторов.
Во-первых, скорость реакции зависит от природы реагирующих веществ. То есть при одинаковых условиях различные вещества взаимодействуют друг с другом иначе. Если взять уксусную и серную кислоту одинаковой концентрации и поместить туда гранулы цинка, то интенсивность выделения водорода в пробирке с серной кислотой будет больше.
Скорость химической реакции зависит от концентрации реагирующих веществ. Как правило, при увеличении концентрации реагирующих веществ скорость реакции увеличивается, так как увеличивается число столкновений между частицами реагирующих веществ.
Зависимость
скорости реакции от концентрации веществ количественно выражается законом
действующих масс, который сформулировали Гульберг и Вааге в 1867 году.
К. Гульдберг
(1836–1902)
Согласно этому закону скорость химической реакции пропорциональная произведению концентраций реагирующих веществ. Концентрации веществ при этом берутся в степенях, которые равны коэффициэнтам перед формулами веществ.
Например, для реакции двух веществ А и Б скорость реакции равна произведению концентрации вещества А на концентрацию вещества Б с учётом стереохимических коэффициэнтов.
A и Б – это концентрации исходных веществ, а ка – это константа скорости, которая равна скорости реакции, если концентрация вещества А и Б равны по одному моль на литр.
Константа скорости зависит от природы реагирующих веществ, температуры, но не зависит от концентрации веществ.
Чтобы образовался хлорид аммония должны столкнуться молекулы аммиака и соляной кислоты. Скорость этой реакции прямопропорциональна концентрации реагирующих веществ.
Если в
элементарном акте превращения участвует 2 молекулы, то такая реакция называется двухмолекулярной. Такой реакцией является реакция взаимодействия водорода
с йодом.
Такой реакцией является реакция взаимодействия водорода
с йодом.
Разложение азометана в газовой фазе обусловлено разложением одной молекулы. Такая реакция называется одномолекулярной. Все одномолекулярные реакции являются реакциями первого порядка.
Двухмолекулярные реакции являются реакциями второго порядка.
Зависимость скорости реакции от концентрации можно показать с помощью эксперимента. Если в пробирки налить растворы серной кислоты разной концентрации и поместить туда гранулы цинка, то интенсивность выделения водорода будет больше в той пробирке, где концентрация кислоты была больше.
Скорость химической зависит также от температуры. Так, при увеличении температуры скорость большинства химических реакций увеличивается.
Эта зависимость
подчиняется правилу Вант-Гоффа: при повышении температуры на 10
градусов по Цэльсию скорость большинства химических реакций
увеличивается в два-четыре раза.
Я. Вант-Гофф
(1852–1911)
Это можно изобразить в виде формулы, где гамма – это температурный коэффициэнт, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов по Цэльсию; вэ-один – скорость реакции при температуре тэ-один; вэ-два – скорость реакции при температуре тэ-два.
Вант-Гофф первый лауреат Нобелевской премии по химии в 1901году, он изучил зависимость скорости реакции от температуры. Своё правило он сформулировал в 1884 году. Кроме того, он создал теорию пространственного расположения атомов в молекуле, вывел основные уравнения химической тэрмодинамики. Заложил основы теории разбавленных растворов.
Зависимость скорости реакции от температуры можно показать с помощью эксперимента.
Если положить в
пробирку гранулу цинка и прилить раствор соляной кислоты, то можно заметить,
что водород выделяется интенсивно. Если содержимое пробирки нагреть, то
интенсивность выделения водорода увеличивается.
Молекулы сталкиваются друг с другом миллионы раз в секунду. Если бы все столкновения были эффективными, то все бы реакции заканчивались мгновенно.
Причины увеличения скорости реакции при увеличении температуры объясняется теорией активных молекул или теорией активации. Согласно теории, в реакции могут участвовать только те молекулы, энергия которых больше средней энергии молекул на какую-то определённую величину. Эта избыточная энергия, или энергия активации, необходима для разрыва или ослабления исходных связей в молекулах.
Соответственно, чем больше активных молекул, тем больше скорость реакции, а при повышении температуры количество этих активных молекул увеличивается.
Для газообразных веществ скорость реакции зависит от давления. Соответственно, при увеличении давления увеличивается концентрация вещества, а значит, увеличивается и скорость реакции.
Эта
закономерность отражена в уравнении Менделеева-Клайперона.
На скорость химических реакций влияет также наличие катализаторов, которые изменяют скорость химической реакции, но сами не расходуются. Реакции, которые идут в присутствии катализаторов, называются каталитическими.
Катализ может быть гомогенным и гетэрогенным. Если катализатор и реагирующие вещества находятся в одном агрегатном состоянии или являются компонентами одного раствора, то такой катализ называется гомогенным.
Если же реагирующие вещества и катализатор находятся в разных агрегатных состояниях, то тогда данный катализ считается гетэрогенным.
Так, реакция получения аммиака из азота и водорода в присутствии катализатора железа является гетэрогенным катализом, а реакция получения оксида шесть из оксида серы четыре и кислорода в присутствии катализатора оксида азота два является гомогенным катализом.
Если реакция
идёт в присутствии катализатора, то катализатор взаимодействует с одним из
исходных веществ и образуется промежуточное соединение. Затем это соединение
реагирует с другим исходным веществом и образуется конечный продукт, а
катализатор выделяется в свободном состоянии.
Затем это соединение
реагирует с другим исходным веществом и образуется конечный продукт, а
катализатор выделяется в свободном состоянии.
Таким образом, ускоряющее действие катализатора заключается в понижении энергии активации основной реакции. Каждая из промежуточных реакций с участием катализатора протекает с меньшей энергией активации, чем катализируемая реакция.
При нагревании муравьиная кислота разлагается на углекислый газ и воду. Энергия активации данной реакции велика, поэтому эта реакция идёт медленно.
Чтобы увеличить скорость реакции можно не только увеличить число активных молекул, но и уменьшить энергетический барьер. Для этого нужно нагреть муравьиную кислоту с сильными кислотами. В данном случае ион водорода будет катализатором, он уменьшить энэргетический барьер, препятствующий разложению муравьиной кислоты. Скорость реакции при этом увеличится.
Как правило,
катализаторы увеличивают скорость реакции. Но есть вещества – ингибиторы,
которые замедляют химические реакции.
Если в пробирку с серной кислотой и цинком прилить формалин, то интенсивность выделения водорода уменьшиться, потому что формалин, в данном случае – ингибитор.
Биологические катализаторы – это ферменты, или энзимы. По своей природе ферменты являются белками. Они осуществляют все биохимические процессы.
На скорость химической реакции влияет также площадь поверхности соприкосновения реагирующих веществ. Чем больше площадь соприкосновения, тем быстрее протекает реакция.
Если в две пробирки налить соляной кислоты одинаковой концентрации, но в одну поместить измельчённый мел, а в другую кусочек мела, то выделение углекислого газа более бурно происходит в пробирке с измельчённым мелом, то есть, где площадь соприкосновения с кислотой большая.
Тест ЕГЭ по химии. Скорость химической реакции. Ответы.
Скорость химической реакции и ее зависимость от различных факторов
1. Скорость гомогенной химической реакции пропорциональна изменению
Скорость гомогенной химической реакции пропорциональна изменению
1) концентрации вещества в единицу времени
2) количества вещества в единице объёма
3) массы вещества в единице объёма
4) объёма вещества в ходе реакции
2. При обычных условиях с наименьшей скоростью происходит взаимодействие между
1) железом и кислородом
2) магнием и 10%-ным раствором соляной кислоты
3) медью и кислородом
4) цинком и 10%-ным раствором
3. Для увеличения скорости химической реакции
2СО+O2=2CO + Q необходимо
1) увеличить концентрацию оксида углерода (II)
2) уменьшить концентрацию кислорода
3) понизить давление
4) понизить температуру
4. При комнатной температуре с наибольшей скоростью протекает реакция между
1) Zn и HCl (1 % р-р)
2) Zn и HCl (30 % р-р)
3) Zn и HCl (10 % р-р)
4) ZnCl2 (р-р) и AgNO3 (р-р)
5. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
1) концентрация кислоты
2) измельчение железа
3) температура реакции
4) увеличение давления
6. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
FeO(тв) + CO(г) ? Fe(тв) + СO2 (г) + 17 кДж
необходимо
1) увеличить концентрацию СО2
2) уменьшить концентрацию СО2
3) уменьшить температуру
4) увеличить степень измельчения FeO
7. Для увеличения скорости химической реакции
2CuS(тв) + 3О2(г) = 2CuO(тв) + 2SO2 (г) + 2920 кДж
необходимо
1) увеличить концентрацию SО2
2) уменьшить концентрацию SО2
3) уменьшить температуру
4) увеличить степень измельчения CuS
8. Для увеличения скорости химической реакции
Zn(тв) + 2Н+ ? Zn2+ + H2 (г) + 154 кДж
необходимо
1) уменьшить концентрацию ионов цинка
2) увеличить концентрацию ионов водорода
3) уменьшить температуру
4) увеличить концентрацию ионов цинка
9. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
Mg(тв) + 2Н+ ? Mg2+ + H2(г) + 462 кДж
необходимо
1) уменьшить концентрацию ионов водорода
2) увеличить концентрацию ионов водорода
3) понизить температуру
4) повысить давление
10. Для увеличения скорости химической реакции
Zn(тв) + 2НСl(г) = ZnCl2(тв) + H2(г) + 231 кДж
необходимо
1) увеличить концентрацию водорода
2) увеличить количество цинка
3) уменьшить температуру
4) увеличить концентрацию хлороводорода
11. Для увеличения скорости взаимодействия железа с хлороводородной кислотой следует
1) добавить ингибитор
2) понизить температуру
3) повысить давление
4) увеличить концентрацию соляной кислоты HCl
12. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно
1) разбавить кислоту
2) измельчить мрамор
3) добавить индикатор
4) проводить реакцию в атмосфере инертного газа
13. С наибольшей скоростью при обычных условиях взаимодействуют
С наибольшей скоростью при обычных условиях взаимодействуют
1) азот и водород
2) магний и вода
3) раствор гидроксида натрия и соляная кислота
4) сера и железо
14. С наибольшей скоростью при обычных условиях взаимодействуют
1) цинк и соляная кислота
2) натрий и вода
3) магний и вода
4) свинец и соляная кислота
15. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других — уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты столкновений частиц.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
16. C наибольшей скоростью реагирует с водородом
1) Сl2
2) F2
3) S
4) C
17. Оцените правильность утверждений.
А. Катализатор — это вещество, которое увеличивает скорость химической реакции, но при этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Для увеличения скорости реакции водорода с азотом
1) охлаждают азотоводородную смесь
2) снижают давление в системе
3) используют катализатор
4) используют циркуляцию азотоводородной смеси
19. При повышении давления увеличивается скорость реакции
1) кислорода с сернистым газом
2) цинка с серной кислотой
3) серы с железом
4) гидроксида натрия с хлоридом меди (II)
20. Катализатор требуется для проведения реакции
1) хлорирования алканов
2) нейтрализации фосфорной кислоты
3) пиролиза метана
4) этерификации уксусной кислоты
21. С наибольшей скоростью при обычных условиях взаимодействуют
1) аммиак и хлороводорода
2) азот и водород
3) азот и кислород
4) сернистый газ и кислород
22. Оцените правильность утверждений.
Оцените правильность утверждений.
А. При нагревании скорость многих реакций уменьшается.
Б. Катализатор — это вещество, которое увеличивает скорость химической реакции, но само в ней не расходуется
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
23. Давление влияет на скорость реакции между
1) гидроксидом цинка и азотной кислотой
2) цинком и серной кислотой
3) аммиаком и кислородом
4) серой и алюминием
24. Реакцию, уравнение которой
FeO + 2H+ = Fe2+ + H2O + Q,
можно ускорить, если
1) повысить давление
2) понизить давление
3) повысить температуру
4) понизить температуру
25. Скорость реакции
Zn + H2SO4 = ZnSO4 + H2 + Q
понизится при
1) повышении температуры
2) понижении давления
3) повышении давления
4) разбавлении раствора кислоты
26. Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
|
1) |
Na, Ca, Zn, Cr, Cu |
|
2) |
Mg, Na, Ni, Zn, Cu |
|
3) |
Na, Ba, Fe, Cu, Zn |
|
4) |
Ba, Na, Zn, Cu, Fe |
27. Оцените справедливость суждений.
А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия..
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
28. Скорость реакции
N2 + 3H2 = 2NH3 + Q
увеличится при
1) понижении температуры
2) понижении концентрации NH3
3) разбавление смеси аргоном
4) использовании катализатора
29. Какой металл реагирует с серной кислотой быстрее других?
Какой металл реагирует с серной кислотой быстрее других?
30. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, — это
1) нейтрализация серной кислоты раствором гидроксида натрия
2) горение водорода в кислороде
3) взаимодействие растворов хлорида меди и гидроксида калия
4) горение алюминия в кислороде
Ответ: 1-1, 2-3, 3-1, 4-4, 5-4, 6-4, 7-4, 8-2, 9-2, 10-4, 11-4, 12-2, 13-3, 14-2, 15-2, 16-2, 17-3, 18-3, 19-1, 20-4, 21-1, 22-2, 23-3, 24-3, 25-4, 26-1, 27-3, 28-4, 29-2, 30-4.
Тест ЕГЭ по химии. Скорость химической реакции. Ответы. на Сёзнайке.ру
Скорость химической реакции и ее зависимость от различных факторов
1. Скорость гомогенной химической реакции пропорциональна изменению
1) концентрации вещества в единицу времени
2) количества вещества в единице объёма
3) массы вещества в единице объёма
4) объёма вещества в ходе реакции
2. При обычных условиях с наименьшей скоростью происходит взаимодействие между
При обычных условиях с наименьшей скоростью происходит взаимодействие между
1) железом и кислородом
2) магнием и 10%-ным раствором соляной кислоты
3) медью и кислородом
4) цинком и 10%-ным раствором
3. Для увеличения скорости химической реакции
2СО+O2=2CO + Q необходимо
1) увеличить концентрацию оксида углерода (II)
2) уменьшить концентрацию кислорода
3) понизить давление
4) понизить температуру
4. При комнатной температуре с наибольшей скоростью протекает реакция между
1) Zn и HCl (1 % р-р)
2) Zn и HCl (30 % р-р)
3) Zn и HCl (10 % р-р)
4) ZnCl2 (р-р) и AgNO3 (р-р)
5. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
1) концентрация кислоты
2) измельчение железа
3) температура реакции
4) увеличение давления
6. Для увеличения скорости химической реакции
FeO(тв) + CO(г) ? Fe(тв) + СO2 (г) + 17 кДж
необходимо
1) увеличить концентрацию СО2
2) уменьшить концентрацию СО2
3) уменьшить температуру
4) увеличить степень измельчения FeO
7. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
2CuS(тв) + 3О2(г) = 2CuO(тв) + 2SO2 (г) + 2920 кДж
необходимо
1) увеличить концентрацию SО2
2) уменьшить концентрацию SО2
3) уменьшить температуру
4) увеличить степень измельчения CuS
8. Для увеличения скорости химической реакции
Zn(тв) + 2Н+ ? Zn2+ + H2 (г) + 154 кДж
необходимо
1) уменьшить концентрацию ионов цинка
2) увеличить концентрацию ионов водорода
3) уменьшить температуру
4) увеличить концентрацию ионов цинка
9. Для увеличения скорости химической реакции
Mg(тв) + 2Н+ ? Mg2+ + H2(г) + 462 кДж
необходимо
1) уменьшить концентрацию ионов водорода
2) увеличить концентрацию ионов водорода
3) понизить температуру
4) повысить давление
10. Для увеличения скорости химической реакции
Для увеличения скорости химической реакции
Zn(тв) + 2НСl(г) = ZnCl2(тв) + H2(г) + 231 кДж
необходимо
1) увеличить концентрацию водорода
2) увеличить количество цинка
3) уменьшить температуру
4) увеличить концентрацию хлороводорода
11. Для увеличения скорости взаимодействия железа с хлороводородной кислотой следует
1) добавить ингибитор
2) понизить температуру
3) повысить давление
4) увеличить концентрацию соляной кислоты HCl
12. Для увеличения скорости выделения углекислого газа при действии соляной кислоты на мрамор нужно
1) разбавить кислоту
2) измельчить мрамор
3) добавить индикатор
4) проводить реакцию в атмосфере инертного газа
13. С наибольшей скоростью при обычных условиях взаимодействуют
1) азот и водород
2) магний и вода
3) раствор гидроксида натрия и соляная кислота
4) сера и железо
14. С наибольшей скоростью при обычных условиях взаимодействуют
С наибольшей скоростью при обычных условиях взаимодействуют
1) цинк и соляная кислота
2) натрий и вода
3) магний и вода
4) свинец и соляная кислота
{module 54}
15. Оцените справедливость суждений о скорости химических реакций.
А. При нагревании скорость одних реакций увеличивается, а скорость других — уменьшается.
Б. Причиной увеличения скорости реакции при нагревании является увеличение частоты столкновений частиц.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
16. C наибольшей скоростью реагирует с водородом
1) Сl2
2) F2
3) S
4) C
17. Оцените правильность утверждений.
А. Катализатор — это вещество, которое увеличивает скорость химической реакции, но при этом не расходуется.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
18. Для увеличения скорости реакции водорода с азотом
Для увеличения скорости реакции водорода с азотом
1) охлаждают азотоводородную смесь
2) снижают давление в системе
3) используют катализатор
4) используют циркуляцию азотоводородной смеси
19. При повышении давления увеличивается скорость реакции
1) кислорода с сернистым газом
2) цинка с серной кислотой
3) серы с железом
4) гидроксида натрия с хлоридом меди (II)
20. Катализатор требуется для проведения реакции
1) хлорирования алканов
2) нейтрализации фосфорной кислоты
3) пиролиза метана
4) этерификации уксусной кислоты
21. С наибольшей скоростью при обычных условиях взаимодействуют
1) аммиак и хлороводорода
2) азот и водород
3) азот и кислород
4) сернистый газ и кислород
22. Оцените правильность утверждений.
А. При нагревании скорость многих реакций уменьшается.
Б. Катализатор — это вещество, которое увеличивает скорость химической реакции, но само в ней не расходуется
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
23. Давление влияет на скорость реакции между
Давление влияет на скорость реакции между
1) гидроксидом цинка и азотной кислотой
2) цинком и серной кислотой
3) аммиаком и кислородом
4) серой и алюминием
24. Реакцию, уравнение которой
FeO + 2H+ = Fe2+ + H2O + Q,
можно ускорить, если
1) повысить давление
2) понизить давление
3) повысить температуру
4) понизить температуру
25. Скорость реакции
Zn + H2SO4 = ZnSO4 + H2 + Q
понизится при
1) повышении температуры
2) понижении давления
3) повышении давления
4) разбавлении раствора кислоты
26. Скорость реакции простых веществ с хлороводородной кислотой уменьшается в ряду
|
1) |
Na, Ca, Zn, Cr, Cu |
|
2) |
Mg, Na, Ni, Zn, Cu |
|
3) |
Na, Ba, Fe, Cu, Zn |
|
4) |
Ba, Na, Zn, Cu, Fe |
27. Оцените справедливость суждений.
Оцените справедливость суждений.
А. Катализатор увеличивает скорость реакции, но не вызывает смещение химического равновесия..
Б. Увеличение давления реагирующих газов приводит к увеличению скорости реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
28. Скорость реакции
N2 + 3H2 = 2NH3 + Q
увеличится при
1) понижении температуры
2) понижении концентрации NH3
3) разбавление смеси аргоном
4) использовании катализатора
29. Какой металл реагирует с серной кислотой быстрее других?
30. Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, — это
1) нейтрализация серной кислоты раствором гидроксида натрия
2) горение водорода в кислороде
3) взаимодействие растворов хлорида меди и гидроксида калия
4) горение алюминия в кислороде
Ответ: 1-1, 2-3, 3-1, 4-4, 5-4, 6-4, 7-4, 8-2, 9-2, 10-4, 11-4, 12-2, 13-3, 14-2, 15-2, 16-2, 17-3, 18-3, 19-1, 20-4, 21-1, 22-2, 23-3, 24-3, 25-4, 26-1, 27-3, 28-4, 29-2, 30-4.
Скорость химических реакций — презентация онлайн
1. Скорость химических реакций
• Скорость химической реакции – это изменениеколичества реагирующего вещества в единицу
времени в единице объёма.
1 v C
r
V
r – скорость химической реакции,
V – объём м3, v – количество вещества в молях,
– промежуток времени сек.,
С – молярная концентрация ( v/ V)
3. Работа с книгой.
• Прочитайте § 15Стр.
• Ответьте на вопрос: От чего зависит
скорость химической реакции?
4. Природа реагирующих веществ
• Фактор Природа реагирующих веществ(прочность химических связей в веществе)
химическая реакция – процесс
перераспределения химических связей между
атомами, в результате которого образуются
новые вещества.
Чем прочнее внутренние химические связи в
веществе, тем труднее оно вступает в реакцию.
5. Температура
• Фактор температуры (энергии активации):Энергия активации – энергия промежуточного состояния,
выше которого суммарная энергия реагирующих частиц
больше энергии ещё не вступивших в реакцию
реагентов.
В промежуточном состоянии старые химические
связи уже разорваны, а новые, пока ещё не образованы.
Для реакций, происходящих при в диапазоне
273-373 градусов кельвина, выполняется правило ВантГоффа: при повышении температуры на 10 градусов –
скорость реакции увеличивается в 2-4 раза.
6. Скорость реакции, факторы:
• Правило Вант-Гоффа:rT2 rT1
(T2 T1 )
10
Здесь rТ2 и rТ1 – скорости реакции
соответственно при температурах T2 и T1
коэффициент Вант-Гоффа (или
температурный коэффициент скорости реакции)
Для каждой химической реакции своя.
7. Катализаторы
Катализатор – промежуточный реагент, понижающийэнергию активации химической реакции, за счёт
образования промежуточных соединений с меньшими
затратами энергии.
Катализатор — вещества или внешние воздействия
(например ультразвук или ионизирующие излучения),
которые ускоряют различные химические и физические
процессы (например полимеризация) в заданном
направлении.

Основная функция катализатора — образовывать с
исходными веществами более реакционно-способные
промежуточные соединения и комплексы, позволяющие
снизить энергию активации химической реакции.
8. Скорость реакции, факторы:
• Фактор Ингибитора:Ингибитор — вещество, замедляющие или
предотвращающие течение различных химических
реакций: окисления, полимеризации, коррозию металлов
и др. Например, гидрохинон — ингибитор окисления
бензальдегида; соединения технеция — ингибитор
коррозии сталей.
Основная функция ингибитора — образовывать с
исходными веществами менее реакционно-способные
промежуточные соединения и комплексы, позволяющие
увеличить энергию активации химической реакции.
9. Концентрация веществ
Закон действующих массЗакон действующих масс устанавливает соотношение
между массами реагирующих веществ в химических
реакциях при равновесии. Закон действующих масс
сформулирован в 1864—1867 гг.
 К. Гульдбергом и П.
К. Гульдбергом и П.Вааге.
Согласно этому закону скорость, с которой вещества
реагируют друг с другом, зависит от их концентрации.
Закон действующих масс используют при различных
расчетах химических процессов. Он позволяет решить
вопрос, в каком направлении возможно
самопроизвольное течение рассматриваемой реакции
при заданном соотношении концентраций реагирующих
веществ, какой выход нужного продукта может быть
получен.
10. Скорость реакции, факторы:
• Фактор Концентрации (Закон действующих масс)Константа равновесия – постоянная величина, полученная
из отношения произведения концентраций продуктов
реакции (в степенях их коэффициентов в уравнении
реакции) к произведению концентраций реагентов (также
в степенях их коэффициентов в уравнении реакции).
Данная константа не зависит от исходных концентраций
веществ и реакционной смеси.
Пример:
2 SO2 O2 2 SO3 197 кДж
2
const
C SO3
2
C SO2 C O2
11.
 Фактор поверхность соприкосновения реагирующих веществ. • Чем мельче твёрдые частицы, тем больше
Фактор поверхность соприкосновения реагирующих веществ. • Чем мельче твёрдые частицы, тем большеповерхность соприкосновения реагирующих
веществ, тем больше скорость химической
реакции. Т.к. реакция происходит лишь в
точке соприкосновенния веществ, если они
образуют гетерогенную систему.
12. Причиной увеличения скорости реакции при повышениии концентрации веществ является:
• 1) увеличение числа столкновениямолекул;
• 2)увеличение энергии активации
процесса;
• 3)увеличение энергии молекул;
• 4)увеличение массы или объёма
вещества.
13. Домашнее задание §15
Как ускорить химическую реакцию
На прошлой неделе мы провели простую химическую реакцию, чтобы исследовать реакцию щелочной сельтерской воды с водой. Мы также наблюдали реакцию между пищевой содой и уксусом раньше, оба из которых очень безопасны для наблюдения даже маленькими детьми.
Сделав еще один шаг вперед, мы собираемся исследовать, как ускорить химическую реакцию, оставаясь при этом очень простым и понятным.
Природа реагентов
Реагенты — это два вещества, которые вы комбинируете, чтобы получить реакцию.Некоторые реагируют медленно, а некоторые намного быстрее, в зависимости от связей, которые необходимо разорвать. Например, золото очень неактивно, а натрий и калий настолько реакционноспособны, что мгновенно тускнеют на воздухе.
Размер частиц
Чем мельче частицы, тем быстрее реакция, потому что имеется большая площадь поверхности, доступная для реакции с другим веществом.
Концентрация
Чем выше концентрация, тем быстрее реакция, потому что для реакции доступно больше реактивного вещества.В прошлом мы очень просто наблюдали это, добавляя больше алказельцера в лавовую лампу, что давало более сильную и быструю реакцию.
Температура
Чем выше температура, тем быстрее реакция, потому что, если вы нагреваете вещество, частицы имеют больше энергии и движутся быстрее, а это означает, что они больше контактируют с другим реактивным веществом.
Мы разработали очень простой эксперимент, чтобы продемонстрировать это, используя сельтерскую воду и горячую и холодную воду.
Пожалуйста, будьте осторожны, пробуя это дома, чтобы вода, которую вы используете, не была слишком горячей, так как она может выплеснуться или лопнуть воздушный шар, особенно если вы используете меньшую емкость.
Как ускорить химическую реакцию
Угадайте, в каком из этих четырех кувшинов была самая теплая вода?
Катализаторы
Катализатор — это вещество, которое ускоряет химическую реакцию, но само не изменяется в результате реакции и может быть использовано повторно.Примеры катализаторов включают платину, которая используется в автомобильных выхлопах для расщепления вредных выбросов, и дрожжи — биологический катализатор, ускоряющий процесс брожения.
Противоположный эффект демонстрируют продукты в холодильнике: более низкая температура замедляет реакцию между кислородом и бактериями, из-за которой продукты портятся. Сохранение свежести продуктов дольше.
Подходит для ключевой стадии 3 – химические реакции
Катализатор и скорость реакции | Глава 6: Химическое изменение
Покажите учащимся две демонстрации и попросите их найти доказательства того, что в результате химических реакций образуется газ.
Скажите учащимся, что вы покажете им видеозапись двух демонстраций, в которых водяной пар и газообразный кислород образуются в результате одной и той же химической реакции. Поскольку газы невидимы, попросите студентов внимательно следить за доказательствами образования газа.
Спроецируйте видео «Зубная паста слона».
Вспенивание показывает, что газы (кислород и водяной пар) образуются очень быстро. Количество пены, образующейся за определенный период времени, является способом измерения скорости реакции.
Проецируйте видео «Джинн в бутылке».
Пар, выходящий из бутылки, представляет собой водяной пар, который конденсируется на выходе из бутылки. Кислород тоже выходит из баллона, но его не видно.
Спросите студентов:
- Как определить, что в результате химической реакции образуется газ?
- Вспенивание зубной пасты для слонов означает, что выделяется газ. Выделение газа является признаком того, что произошла химическая реакция.Водяной пар в демонстрации джинна в бутылке также показывает производство газа.
Скажите учащимся, что этот урок посвящен ускорению химических реакций. Некоторые реакции протекают очень медленно, но можно добавить химические вещества, называемые катализаторами, чтобы ускорить их. Обе эти демонстрации опирались на катализатор.
Опишите, как при разложении перекиси водорода образуется газообразный кислород в обоих видеороликах.
Сообщите учащимся, что в обеих демонстрациях используется 30-процентный раствор перекиси водорода. Обычно перекись водорода, которую вы можете купить в магазине, содержит только 3% перекиси водорода. Объясните учащимся, что химическая формула перекиси водорода: H 2 O 2 . Укажите, что перекись водорода не очень стабильна и сама по себе распадается на воду и кислород. Такое изменение представляет собой химическую реакцию, называемую разложением. Разложение перекиси водорода происходит медленно и обычно незаметно.
Обычно перекись водорода, которую вы можете купить в магазине, содержит только 3% перекиси водорода. Объясните учащимся, что химическая формула перекиси водорода: H 2 O 2 . Укажите, что перекись водорода не очень стабильна и сама по себе распадается на воду и кислород. Такое изменение представляет собой химическую реакцию, называемую разложением. Разложение перекиси водорода происходит медленно и обычно незаметно.
Спроектируйте изображение Разложение перекиси водорода.
Объясните, что перекись водорода разлагается с образованием воды и кислорода в соответствии с этим химическим уравнением:
Скажите учащимся, что эта химическая реакция происходит сама по себе и что даже энергия света в комнате может ускорить разложение перекиси водорода. Вот почему перекись водорода продается в непрозрачных контейнерах.
Скажите учащимся, что в видеоролике вещество (перманганат калия или двуокись марганца) использовалось для ускорения разложения перекиси водорода. Несмотря на то, что это ускорило реакцию, само вещество не изменилось во время реакции. Вещество, увеличивающее скорость реакции, но не входящее в состав продуктов реакции, называется катализатором.
Несмотря на то, что это ускорило реакцию, само вещество не изменилось во время реакции. Вещество, увеличивающее скорость реакции, но не входящее в состав продуктов реакции, называется катализатором.
Спросите студентов:
- Ваш учитель показал вам демонстрацию, где к перекиси водорода добавляется катализатор, и образуется большое количество газообразного кислорода. Если катализатор участвует в химической реакции, то почему он не включен в химическое уравнение как продукт?
- Катализатор не попадает в продукты, поэтому не включается в химическую реакцию.
- Что делает катализатор в химической реакции?
- Катализаторы ускоряют реакцию, но не меняются в ходе реакции.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Предложите учащимся использовать дрожжи для катализа разложения перекиси водорода.
Вопрос для расследования
Может ли другое вещество катализировать разложение перекиси водорода?
Материалы для каждой группы
- Градуированный цилиндр
- Перекись водорода (3%)
- Дрожжи
- Палочка для эскимо
- Моющий раствор
- Пипетка
Подготовка учителей
Приготовьте раствор моющего средства, добавив 1 чайную ложку жидкого моющего средства на 2 столовые ложки воды.Разделите этот раствор моющего средства поровну на одну маленькую чашку для каждой группы.
Процедура
Добавьте 10 мл перекиси водорода в градуированный цилиндр. Добавьте 1 каплю раствора моющего средства. Осторожно встряхните и наблюдайте за раствором на наличие пузырьков.
Объясните учащимся, что моющее средство добавляется только для образования пузырей в случае образования газа.
 Поскольку при распаде перекиси водорода образуется газообразный кислород, появление пузырьков указывает на то, что перекись водорода разрушается или разлагается.Отсутствие пузырьков свидетельствует о том, что вырабатывается не так много газообразного кислорода.
Поскольку при распаде перекиси водорода образуется газообразный кислород, появление пузырьков указывает на то, что перекись водорода разрушается или разлагается.Отсутствие пузырьков свидетельствует о том, что вырабатывается не так много газообразного кислорода.Используйте конец палочки от эскимо, чтобы добавить небольшое количество дрожжей в перекись водорода в градуированном цилиндре и взболтать.
- Поместите градуированный цилиндр на стол и следите за пузырями.
- Держите градуированный цилиндр, чтобы увидеть, есть ли какие-либо изменения в температуре.
Ожидаемые результаты
До добавления дрожжей пузырьков не наблюдается.После добавления дрожжей пузырьки заставят пену двигаться вверх по градуированному цилиндру. Кроме того, градуированный цилиндр должен быть немного теплее, потому что при разложении перекиси водорода выделяется энергия. Изменения энергии в химических реакциях будут более подробно исследованы в главе 6, уроке 7.
Обсудите наблюдения учащихся.
Спросите студентов:
- Какие у вас есть признаки того, что в этом упражнении произошла химическая реакция?
- Бульканье.Скажите учащимся, что изменение температуры также является признаком возможной химической реакции. Эндотермические и экзотермические химические реакции будут рассмотрены в главе 6, уроке 7.
- Что является катализатором в этой деятельности?
- Вещество в дрожжах.
- Какие у вас есть доказательства того, что перекись водорода быстрее разлагается при добавлении дрожжей?
- После добавления дрожжей образовались пузырьки газообразного кислорода.
- Когда вы пишете химическое уравнение для этой реакции, должны ли дрожжи быть включены в химическое уравнение в качестве продукта?
- Объясните учащимся, что катализатор в дрожжах не попадает в продукты, а является веществом, которое ускоряет разложение. Иногда катализатор пишут над или под стрелкой в химическом уравнении, но он никогда не включается в состав реагентов или продуктов.

Как правило, катализаторы работают, создавая место, где реагенты могут собираться вместе для реакции.Объясните учащимся, что клетки дрожжей и других организмов содержат катализатор под названием каталаза . Благодаря нормальным клеточным процессам живые существа производят перекись водорода в своих клетках. Но перекись водорода — это яд, поэтому клеткам нужен способ очень быстро его расщепить. В клетках содержится каталаза, которая очень быстро расщепляет перекись водорода. Каждую секунду одна молекула каталазы может катализировать расщепление миллионов молекул перекиси водорода.
Студенты могут продолжить изучение влияния каталазы на перекись водорода, добавив кусочек сырого свежего картофеля в небольшое количество перекиси водорода.
Предложите учащимся назвать изменения, происходящие при взаимодействии сульфата меди II с кусочком алюминиевой фольги.
Примечание: это реакция между сульфатом меди II и алюминием. Медь называется «медь II», потому что медь может образовывать различные типы ионов. Он может потерять один электрон и быть просто Cu + или может потерять два электрона и стать Cu 2+ . Этот тип иона меди называется медью II.Также «сульфат» в сульфате меди II также является ионом. Этот ион состоит из более чем одного атома. Это один из многоатомных ионов, обсуждавшихся в главе 4, уроке 3. Ион сульфата состоит из атома серы, связанного с четырьмя атомами кислорода, и рассматривается как один ион (SO 4 2− ).
Медь называется «медь II», потому что медь может образовывать различные типы ионов. Он может потерять один электрон и быть просто Cu + или может потерять два электрона и стать Cu 2+ . Этот тип иона меди называется медью II.Также «сульфат» в сульфате меди II также является ионом. Этот ион состоит из более чем одного атома. Это один из многоатомных ионов, обсуждавшихся в главе 4, уроке 3. Ион сульфата состоит из атома серы, связанного с четырьмя атомами кислорода, и рассматривается как один ион (SO 4 2− ).
Есть несколько интересных аспектов реакции между сульфатом меди II и алюминием, но она отличается от других реакций, с которыми до сих пор сталкивались учащиеся. В этой реакции движение электронов, а не целых атомов, ионов или молекул вызывает реакцию.Этот тип реакции называется реакцией окисления/восстановления. Эту конкретную реакцию интересно проводить, потому что она экзотермическая, генерирует газ, и металлическая медь появляется, когда металлический алюминий исчезает.
Соль можно считать катализатором реакции, но она играет иную роль, чем большинство катализаторов. Сульфат меди II и алюминий реагируют очень медленно, потому что алюминий покрыт очень тонким слоем потускнения (оксид алюминия). Эту реакцию можно ускорить, если удалить или повредить слой оксида алюминия.Добавление соли делает это и позволяет электронам алюминия реагировать с ионами меди в растворе, превращая их в металлическую медь.
Вопрос для расследования
Что является катализатором в следующем упражнении?
Материалы для каждой группы
- Раствор сульфата меди II (в чашке)
- Прозрачный пластиковый стаканчик (пустой)
- Соль
- Кусок алюминиевой фольги
- Термометр
- Палочка для эскимо
Подготовка учителей
Приготовьте раствор сульфата меди II, добавив 20 г сульфата меди II в 200 мл воды.Налейте около 25 мл раствора сульфата меди II в чашку для каждой группы. Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину).
Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину).
Процедура
- Поместите кусок алюминиевой фольги в пустую чашку. Пальцами или палочкой от мороженого плотно прижмите фольгу, чтобы она лежала ровно и закрывала дно чашки.
- Добавьте весь раствор сульфата меди II в чашку с алюминиевой фольгой.
- Аккуратно взболтайте раствор в течение нескольких секунд и дайте ему постоять. Следите за алюминием на наличие пузырей или изменения цвета.
Используйте палочку от эскимо, чтобы поместить небольшое количество соли в раствор сульфата меди II. Аккуратно взболтайте раствор в течение нескольких секунд и дайте ему постоять. Следите за появлением пузырьков или изменением цвета.
- Осторожно поместите термометр в чашку и посмотрите, изменится ли температура.
Ожидаемые результаты
До добавления соли пузырьки и изменение цвета отсутствуют. После добавления соли цвет становится зеленоватым, и на алюминии начинают образовываться пузыри.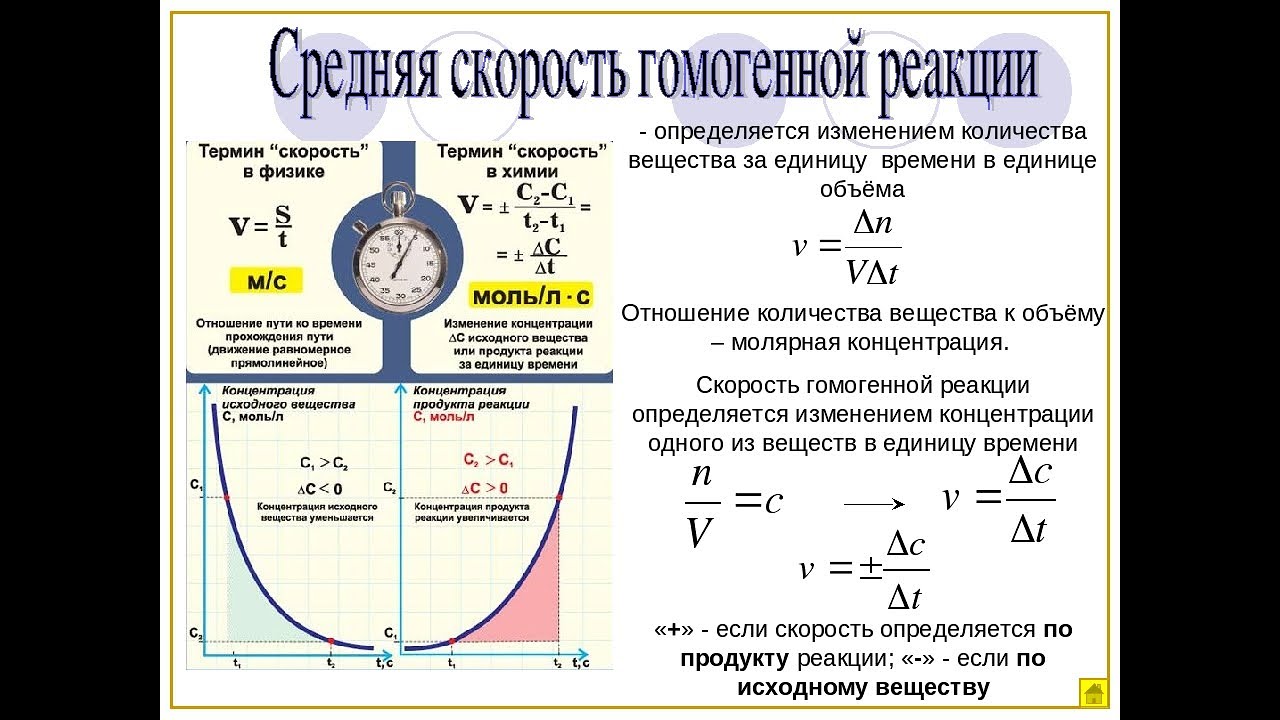 Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.
Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.
Обсудите наблюдения учащихся.
Спросите студентов:
- Откуда вы знаете, что при помещении куска алюминиевой фольги и хлорида натрия в раствор сульфата меди II происходит химическая реакция?
- Возникло пузырение, изменение цвета, повышение температуры и образование другого твердого вещества.
- Что является катализатором в этой деятельности?
- Соль.
- Чем добавление соли к алюминию похоже на добавление дрожжей к перекиси водорода?
- Оба могут рассматриваться как катализаторы.Добавление дрожжей помогает перекиси водорода быстрее разлагаться, а добавление соли помогает алюминию реагировать с сульфатом меди II.
Сообщите учащимся, что синий раствор содержит ионы меди (Cu2+). Добавление соли в раствор помогает удалить слой потускнения с куска алюминия, который был в растворе. Это обнажает часть алюминия и позволяет электронам алюминия реагировать с ионами меди. Эти отрицательные электроны притягиваются к положительным ионам меди. Когда электроны соединяются с ионами меди, ионы становятся нейтральными атомами меди и в растворе выглядят как металлическая медь.По мере того, как алюминий теряет свои электроны, он превращается в ионы алюминия, переходит в раствор и, кажется, исчезает.
Добавление соли в раствор помогает удалить слой потускнения с куска алюминия, который был в растворе. Это обнажает часть алюминия и позволяет электронам алюминия реагировать с ионами меди. Эти отрицательные электроны притягиваются к положительным ионам меди. Когда электроны соединяются с ионами меди, ионы становятся нейтральными атомами меди и в растворе выглядят как металлическая медь.По мере того, как алюминий теряет свои электроны, он превращается в ионы алюминия, переходит в раствор и, кажется, исчезает.
12.2 Факторы, влияющие на скорость реакции – Химия
Цели обучения
К концу этого раздела вы сможете:
- Описать влияние химической природы, физического состояния, температуры, концентрации и катализа на скорость реакции
Скорости расходования реагентов и образования продуктов в ходе химических реакций сильно различаются.Мы можем выделить пять факторов, влияющих на скорость химических реакций: химическая природа реагирующих веществ, степень разделения (один большой кусок против множества мелких частиц) реагентов, температура реагентов, концентрация реагентов, и наличие катализатора.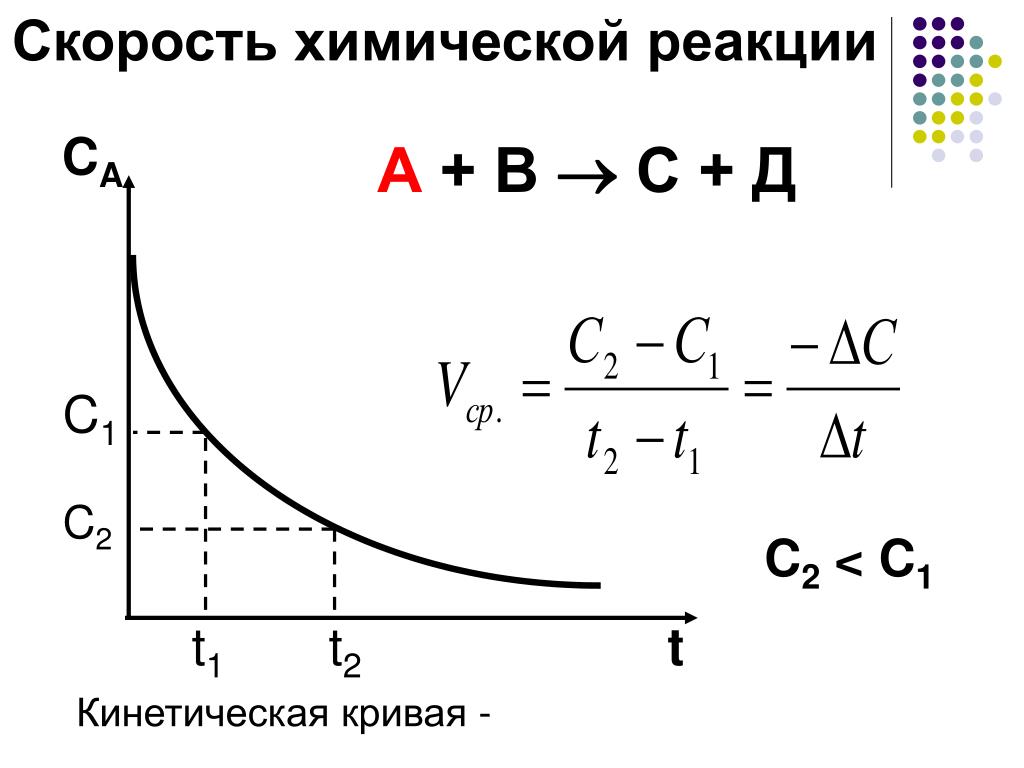
Скорость реакции зависит от природы участвующих веществ. Реакции, которые кажутся похожими, могут иметь разную скорость в одних и тех же условиях, в зависимости от идентичности реагентов.Например, когда небольшие кусочки металлов железа и натрия подвергаются воздействию воздуха, натрий полностью реагирует с воздухом в течение ночи, в то время как железо практически не изменяется. Активные металлы кальций и натрий реагируют с водой с образованием газообразного водорода и основания. Тем не менее, кальций реагирует с умеренной скоростью, тогда как натрий реагирует так быстро, что реакция почти взрывоопасна.
За исключением веществ в газообразном состоянии или в растворе, реакции происходят на границе или границе раздела двух фаз.Следовательно, скорость реакции между двумя фазами в значительной степени зависит от поверхности контакта между ними. Мелкодисперсное твердое вещество имеет большую площадь поверхности, доступную для реакции, чем один большой кусок того же вещества. Таким образом, жидкость будет быстрее реагировать с мелкоизмельченным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует гораздо быстрее (рис. 1). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
Таким образом, жидкость будет быстрее реагировать с мелкоизмельченным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует гораздо быстрее (рис. 1). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
Посмотрите это видео, чтобы увидеть реакцию цезия с водой в замедленной съемке и обсудить, как состояние реагентов и размер частиц влияют на скорость реакции.
Химические реакции обычно протекают быстрее при более высоких температурах. Еда может быстро испортиться, если ее оставить на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Мы используем горелку или электроплитку в лаборатории, чтобы увеличить скорость реакций, протекающих медленно при обычных температурах. Во многих случаях повышение температуры всего на 10 °С примерно удваивает скорость реакции в гомогенной системе.
Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Мы используем горелку или электроплитку в лаборатории, чтобы увеличить скорость реакций, протекающих медленно при обычных температурах. Во многих случаях повышение температуры всего на 10 °С примерно удваивает скорость реакции в гомогенной системе.
Скорость многих реакций зависит от концентрации реагентов. Скорость обычно увеличивается, когда увеличивается концентрация одного или нескольких реагентов. Например, карбонат кальция (CaCO 3 ) портится в результате его реакции с загрязняющим веществом диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе (рис. 2). Кислотный оксид, диоксид серы соединяется с водяным паром в воздухе с образованием сернистой кислоты в следующей реакции:
[латекс]\text{SO}_2(g)\;+\;\text{H}_2\text{O}(g)\;{\longrightarrow}\;\text{H}_2\text{SO }_3(водный)[/латекс]
Карбонат кальция реагирует с сернистой кислотой следующим образом:
[латекс]\text{CaCO}_3(s)\;+\;\text{H}_2\text{SO}_3(водн. )\;{\longrightarrow}\;\text{CaSO}_3(водн.) \;+\;\text{CO}_2(g)\;+\;\text{H}_2\text{O}(l)[/latex]
)\;{\longrightarrow}\;\text{CaSO}_3(водн.) \;+\;\text{CO}_2(g)\;+\;\text{H}_2\text{O}(l)[/latex]
В загрязненной атмосфере с высокой концентрацией диоксида серы карбонат кальция разлагается быстрее, чем в менее загрязненном воздухе.Точно так же фосфор сгорает гораздо быстрее в атмосфере чистого кислорода, чем в воздухе, который состоит всего лишь на 20% из кислорода.
Рисунок 2. Статуи, изготовленные из карбонатных соединений, таких как известняк и мрамор, обычно медленно выветриваются со временем из-за воздействия воды, а также теплового расширения и сжатия. Однако загрязняющие вещества, такие как диоксид серы, могут ускорить выветривание. По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (кредит: Джеймс П. Фишер III)Фосфор быстро горит на воздухе, но он будет гореть еще быстрее, если концентрация кислорода в нем выше.Посмотрите это видео, чтобы увидеть пример.
Растворы перекиси водорода пенятся при попадании на открытую рану, потому что вещества в открытых тканях действуют как катализаторы, увеличивая скорость разложения перекиси водорода. Однако при отсутствии этих катализаторов (например, во флаконе в аптечке) полное разложение может занять месяцы. Катализатор — это вещество, которое увеличивает скорость химической реакции за счет снижения энергии активации, но само при этом не расходуется в ходе реакции.Энергия активации – это минимальное количество энергии, необходимое для протекания химической реакции в прямом направлении. Катализатор увеличивает скорость реакции, предоставляя альтернативный путь или механизм реакции (рис. 3). Катализ будет обсуждаться более подробно позже в этой главе, так как он связан с механизмами реакций.
Однако при отсутствии этих катализаторов (например, во флаконе в аптечке) полное разложение может занять месяцы. Катализатор — это вещество, которое увеличивает скорость химической реакции за счет снижения энергии активации, но само при этом не расходуется в ходе реакции.Энергия активации – это минимальное количество энергии, необходимое для протекания химической реакции в прямом направлении. Катализатор увеличивает скорость реакции, предоставляя альтернативный путь или механизм реакции (рис. 3). Катализ будет обсуждаться более подробно позже в этой главе, так как он связан с механизмами реакций.
Химические реакции происходят, когда молекулы сталкиваются друг с другом и подвергаются химическому превращению.Прежде чем физически провести реакцию в лаборатории, ученые могут использовать молекулярное моделирование, чтобы предсказать, как параметры, обсуждавшиеся ранее, повлияют на скорость реакции. Используйте интерактивное приложение PhET Reactions & Rates, чтобы узнать, как температура, концентрация и природа реагентов влияют на скорость реакции.
Используйте интерактивное приложение PhET Reactions & Rates, чтобы узнать, как температура, концентрация и природа реагентов влияют на скорость реакции.
На скорость химической реакции влияют несколько параметров. Реакции с участием двух фаз протекают быстрее при большей площади контакта.Если температура или концентрация реагента увеличиваются, скорость данной реакции обычно также увеличивается. Катализатор может увеличить скорость реакции, обеспечивая альтернативный путь, который приводит к снижению энергии активации реакции.
Химия Упражнения в конце главы
- Опишите влияние каждого из следующих факторов на скорость реакции металлического магния с раствором соляной кислоты: молярность соляной кислоты, температура раствора и размер кусков магния.
- Объясните, почему яйцо варится в кипящей воде в Денвере медленнее, чем в Нью-Йорке. (Подсказка: учитывайте влияние температуры на скорость реакции и влияние давления на температуру кипения.
 )
) - Перейти к интерактивному разделу PhET Reactions & Rates. Используйте вкладку «Одиночное столкновение», чтобы представить, как столкновение между одноатомным кислородом (O) и монооксидом углерода (CO) приводит к разрыву одной связи и образованию другой. Потяните красный поршень назад, чтобы выпустить атом, и наблюдайте за результатами.Затем нажмите «Перезагрузить пусковую установку» и измените на «Угловой снимок», чтобы увидеть разницу.
(а) Что происходит при изменении угла столкновения?
(b) Объясните, какое отношение это имеет к скорости реакции.
- В интерактивном режиме PhET Reactions & Rates используйте вкладку «Много столкновений», чтобы наблюдать, как несколько атомов и молекул взаимодействуют в различных условиях. Выберите молекулу для закачки в камеру. Установите начальную температуру и выберите текущие количества каждого реагента.Выберите «Показать облигации» в разделе «Параметры». Как на скорость реакции влияют концентрация и температура?
- В интерактивном режиме PhET Reactions & Rates на вкладке Many Collisions настройте симуляцию с 15 молекулами A и 10 молекулами BC.
 Выберите «Показать облигации» в разделе «Параметры».
Выберите «Показать облигации» в разделе «Параметры».(a) Оставьте начальную температуру по умолчанию. Наблюдайте за реакцией. Скорость реакции высокая или низкая?
(b) Нажмите «Пауза», затем «Сбросить все», а затем еще раз введите 15 молекул А и 10 молекул ВС.Выберите «Показать облигации» в разделе «Параметры». На этот раз увеличивайте начальную температуру до тех пор, пока на графике линия полной средней энергии не окажется полностью над кривой потенциальной энергии. Опишите, что происходит с реакцией.
Глоссарий
- катализатор
- вещество, увеличивающее скорость реакции, но само не поглощающееся реакцией
Решения
Ответы на упражнения по химии в конце главы
1.Более высокая молярность увеличивает скорость реакции. Более высокая температура увеличивает скорость реакции. Меньшие кусочки металлического магния будут реагировать быстрее, чем более крупные, потому что существует более реактивная поверхность.
3. (а) В зависимости от выбранного угла атому может потребоваться много времени, чтобы столкнуться с молекулой, а когда столкновение произойдет, оно может не привести к разрыву связи и образованию другой. (b) Частицы реагента должны вступить в контакт друг с другом, прежде чем они смогут вступить в реакцию.
5. (а) очень медленный; б) при повышении температуры скорость реакции увеличивается. Количество реагентов уменьшается, а количество продуктов увеличивается. Через некоторое время в смеси появляется примерно равное количество BC , AB и C и небольшой избыток A .
Разработка и оценка алгоритмов ускорения для реактивного моделирования CFD-DEM реакторов с псевдоожиженным слоем
В этой работе мы предлагаем алгоритм ускорения агломерации частиц (PA) для снижения вычислительной стоимости структуры CFD-DEM на основе связанного решения (CP) переноса газа и твердого тела и гетерогенной реакции на уровне каждого частицы в реакторе с псевдоожиженным слоем.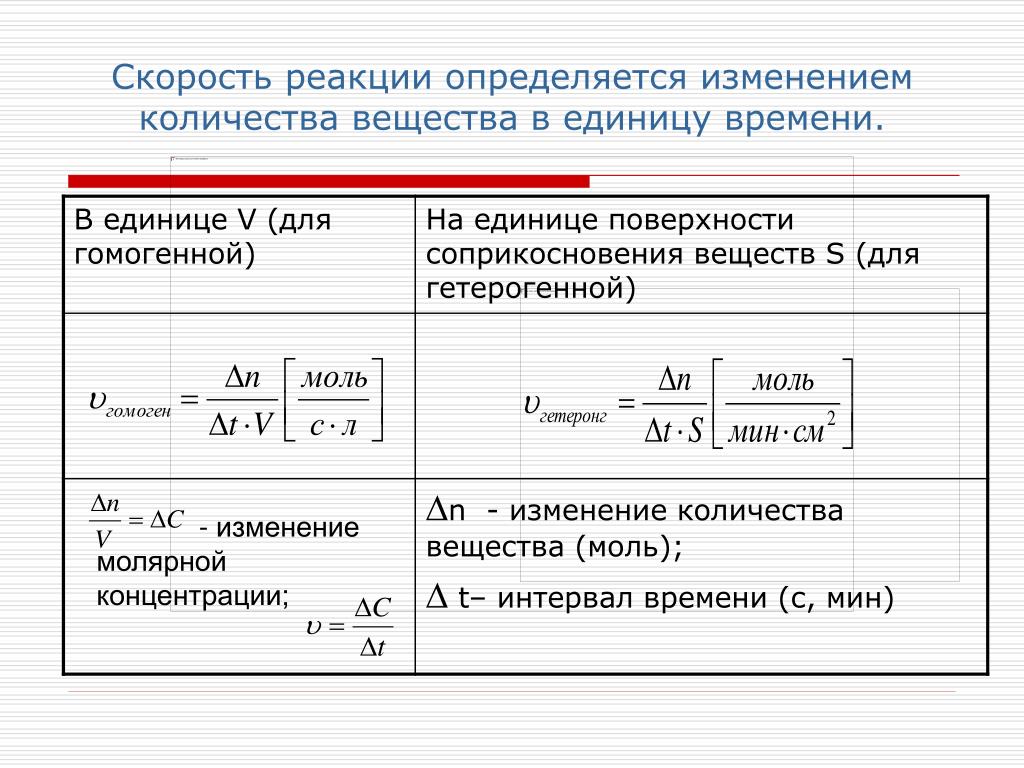 Производительность PA оценивается и сравнивается с производительностью, обеспечиваемой ранее предложенным алгоритмом ускорения разделения оператора (OS) и на месте адаптивного табулирования (ISAT). Анализ проводится на системах метанирования и парового риформинга для изучения различных реакций и характерного времени переноса при различных условиях эксплуатации. Результаты показали, что OS и ISAT, как правило, более эффективны в вычислительном отношении, обеспечивая более высокое ускорение химической реакции, чем CP и PA, как при метанировании (15 , так и 6) и паровой конверсии (13 против 4). Однако OS требует меньшего временного шага моделирования по сравнению с CP для достижения конвергентных результатов, когда рассматриваются явления быстрого переноса / реакции. Следовательно, общая стоимость вычислений может быть даже больше по сравнению с CP, несмотря на метод ISAT. Следовательно, выбор наилучшего алгоритма не является тривиальным и сильно зависит от характерного времени транспорта и реакции, которые являются функцией местных условий, испытываемых в постели.
Производительность PA оценивается и сравнивается с производительностью, обеспечиваемой ранее предложенным алгоритмом ускорения разделения оператора (OS) и на месте адаптивного табулирования (ISAT). Анализ проводится на системах метанирования и парового риформинга для изучения различных реакций и характерного времени переноса при различных условиях эксплуатации. Результаты показали, что OS и ISAT, как правило, более эффективны в вычислительном отношении, обеспечивая более высокое ускорение химической реакции, чем CP и PA, как при метанировании (15 , так и 6) и паровой конверсии (13 против 4). Однако OS требует меньшего временного шага моделирования по сравнению с CP для достижения конвергентных результатов, когда рассматриваются явления быстрого переноса / реакции. Следовательно, общая стоимость вычислений может быть даже больше по сравнению с CP, несмотря на метод ISAT. Следовательно, выбор наилучшего алгоритма не является тривиальным и сильно зависит от характерного времени транспорта и реакции, которые являются функцией местных условий, испытываемых в постели. Таким образом, мы предлагаем стратегию выбора наиболее адекватного алгоритма (, т.е. , CP и PA или OS и ISAT). Стратегия основана на моделировании испытательного реактора, характеризующегося небольшими вычислительными затратами, но задуманного как репрезентативное для химического и гидродинамического поведения целевого реактора. Это позволило смоделировать реактор метанирования на миллион частиц, экспериментально исследованный в литературе. Наблюдается хорошее совпадение модельных и экспериментальных концентраций на выходе (погрешность до 7% для основных частиц) при значительном 20-кратном химическом ускорении.
Таким образом, мы предлагаем стратегию выбора наиболее адекватного алгоритма (, т.е. , CP и PA или OS и ISAT). Стратегия основана на моделировании испытательного реактора, характеризующегося небольшими вычислительными затратами, но задуманного как репрезентативное для химического и гидродинамического поведения целевого реактора. Это позволило смоделировать реактор метанирования на миллион частиц, экспериментально исследованный в литературе. Наблюдается хорошее совпадение модельных и экспериментальных концентраций на выходе (погрешность до 7% для основных частиц) при значительном 20-кратном химическом ускорении.
Эта статья находится в открытом доступе
Подождите, пока мы загрузим ваш контент. ..
Что-то пошло не так. Попробуй снова?
..
Что-то пошло не так. Попробуй снова?Скорости химических реакций
Доктор Дуг Стюарт
Скорость реакции говорит нам, как быстро реагенты → продукты.
Вы знали?
Взрывы являются результатом очень высоких скоростей химических реакций. Взрывчатые вещества — это твердые химические вещества, которые очень быстро реагируют с выделением горячего газа, который выбрасывает все наружу.
Взрывчатое вещество
химические реакции
Не все химические реакции одинаковы.
Некоторые из них по своей природе быстры, например, когда вы поджигаете водород в присутствии кислорода во время взрыва.
Некоторые из них по своей природе медленные, например, ржавение железа в присутствии кислорода и воды.
Вещи, влияющие на скорость химических реакций
Можно ускорить или замедлить скорость реакции, изменив одну или несколько из трех вещей:
- температура
- размер частиц
- концентрация реагентов
Вы также можете ускорить реакцию, используя нечто, называемое катализатором , который мы рассмотрим позже на этой странице.
Примеры изменения скорости реакции
1.Повышение температуры
Если мы повысим температуру, химические реакции пройдут быстрее.
Например, шипучие таблетки реагируют с водой с выделением углекислого газа.
Вы можете увидеть эффект горячей воды против холодной воды в этом видео.
2. Уменьшение размера частиц
Если мы уменьшим размер частиц, химические реакции пройдут быстрее. Например, кусок стали не будет легко гореть.Стальная вата очень легко горит, как вы можете видеть на видео.
Например, кусок стали не будет легко гореть.Стальная вата очень легко горит, как вы можете видеть на видео.
Основная химическая реакция, которую вы видите в этом видео:
железо + кислород → оксид железа
3. Повышение концентрации
Если мы увеличим концентрацию реагентов, химические реакции пройдут быстрее.
Например, жидкий кислород примерно в 800 раз более концентрирован, чем газообразный кислород. Газообразный кислород составляет примерно 20 процентов воздуха, а это означает, что жидкий кислород примерно в 4000 раз более концентрирован, чем кислород в окружающем нас воздухе.
Влияние высокой концентрации кислорода на горение драматическое, как вы можете видеть на видео. Не пытайтесь повторить это дома!
Катализаторы
В дополнение к трем методам, показанным выше, катализ может быть использован для увеличения скорости реакции.
Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ходе реакции; следовательно, катализатор может быть восстановлен химически неизмененным в конце реакции, для ускорения которой он использовался, или катализирует .
Чтобы химические вещества вступили в реакцию, их связи должны быть перестроены, потому что очевидно, что связи в продуктах отличаются от связей в реагентах.
Самая медленная стадия перегруппировки связи приводит к тому, что называется переходным состоянием — химическим веществом, которое не является ни реагентом, ни продуктом, но является промежуточным звеном между ними.
Реагент ⇌ Переходное состояние ⇌ Продукт
Для формирования переходного состояния требуется энергия. Эта энергия называется энергией активации или E a .Реагенты с энергией ниже E a не могут пройти через переходное состояние и стать продуктами. Чтение приведенной ниже диаграммы слева направо показывает ход реакции, когда реагенты проходят через переходное состояние и становятся продуктами.
Чтение приведенной ниже диаграммы слева направо показывает ход реакции, когда реагенты проходят через переходное состояние и становятся продуктами.
Пересечение барьера
Энергию активации можно рассматривать как барьер для химической реакции, барьер, который необходимо преодолеть. Если барьер высокий, лишь немногие молекулы обладают достаточной кинетической энергией, чтобы столкнуться, сформировать переходное состояние и пересечь барьер.Реагенты с энергией ниже E a не могут пройти через переходное состояние, чтобы вступить в реакцию и стать продуктами.
Катализатор работает, обеспечивая другой путь, с более низким E a , для реакции. Катализаторы снижают энергетический барьер. Другой путь позволяет легче перегруппировывать связи, необходимые для превращения реагентов в продукты, с меньшими затратами энергии.
В любой заданный интервал времени присутствие катализатора позволяет большей части реагентов набрать достаточно энергии, чтобы пройти через переходное состояние и стать продуктами.
Пример 1: Процесс Габера
Процесс Габера, который используется для получения аммиака из водорода и азота, катализируется железом, которое обеспечивает атомные позиции, на которых реагентные связи могут легко перестраиваться.
N 2 (газ) + 3H 2 (газ) ⇌ 2NH 3 (газ)
Пример 2: Ферменты
В нашем организме и в других живых существах ферменты используются для ускорения биохимических реакций. Фермент — это тип катализатора.Сложная жизнь была бы невозможна без ферментов, обеспечивающих протекание реакций с подходящей скоростью. Формы ферментов вместе с местами на ферменте, которые связываются с реагентами, обеспечивают альтернативный путь реакции, позволяя определенным молекулам собираться вместе, чтобы сформировать переходное состояние с уменьшенным энергетическим барьером активации.
Фермент с длинной цепью обеспечивает места для соединения молекул реагентов с образованием переходного состояния с низкой энергией активации.
Катализаторы и равновесие
Катализаторы не могут сдвинуть положение химического равновесия — и прямая, и обратная реакции ускоряются, так что константа равновесия K eq не меняется.Однако, удаляя продукты из реакционной смеси по мере их образования, на практике можно увеличить общую скорость образования продукта.
Проверьте свои знания:
Вопрос 1
Тест на всплывание является примером очень быстрой химической реакции. Вы можете представить себе другую очень быструю химическую реакцию?
Покажи ответОдним из примеров является взрыв фейерверка. Еще один универсальный индикатор, меняющий цвет при добавлении к кислоте или щелочи.
Вопрос 2
С точки зрения скорости химических реакций, почему мы охлаждаем продукты?
Покажи ответ Бактерии и грибки растут и размножаются с помощью химических реакций.Снижение температуры замедляет эти химические реакции, замедляя рост организмов, из-за которых пища портится.
Вопрос 3
Ржавление — это медленная химическая реакция. Можете ли вы придумать другую медленную реакцию?
Покажи ответОдним из примеров является отверждение клея. Некоторым клеям требуется несколько часов для схватывания, хотя другие могут схватываться быстрее.
Другой пример: резиновые шланги и резиновые ленты со временем становятся хрупкими, поскольку резина медленно вступает в реакцию с кислородом и теряет свою эластичность.
исследователей в области энергетики преодолели каталитический предел скорости — ScienceDaily
Группа исследователей из Университета Миннесоты и Массачусетского университета в Амхерсте открыла новую технологию, которая может ускорить химические реакции в 10 000 раз быстрее, чем текущий предел скорости реакции. Эти результаты могут увеличить скорость и снизить стоимость тысяч химических процессов, используемых при разработке удобрений, продуктов питания, топлива, пластмасс и многого другого.
Исследование опубликовано в Интернете в ACS Catalysis , журнале Американского химического общества.
В химических реакциях ученые используют так называемые катализаторы для ускорения реакций. Реакция, протекающая на поверхности катализатора, например, на металле, будет ускоряться, но она может идти только настолько быстро, насколько это разрешено так называемым принципом Сабатье. Часто называемый «принципом Златовласки» катализа, наилучший возможный катализатор направлен на то, чтобы идеально сбалансировать две части химической реакции. Реагирующие молекулы должны прилипать к металлической поверхности, чтобы реагировать не слишком сильно и не слишком слабо, а «в самый раз».С тех пор, как этот принцип был установлен количественно в 1960 году, максимум Сабатье остался каталитическим пределом скорости.
Исследователи Центра катализа энергетических инноваций, финансируемого Министерством энергетики США, обнаружили, что они могут преодолеть ограничение скорости, применяя волны к катализатору для создания колеблющегося катализатора. Волна имеет верх и низ, и при ее применении обе части химической реакции могут протекать независимо с разной скоростью. Когда волна, воздействующая на поверхность катализатора, соответствовала собственной частоте химической реакции, скорость резко возрастала благодаря механизму, называемому «резонанс».»
Волна имеет верх и низ, и при ее применении обе части химической реакции могут протекать независимо с разной скоростью. Когда волна, воздействующая на поверхность катализатора, соответствовала собственной частоте химической реакции, скорость резко возрастала благодаря механизму, называемому «резонанс».»
«Мы рано поняли, что катализаторы должны меняться со временем, и оказалось, что частоты от килогерц до мегагерц резко увеличивают скорость катализатора», — сказал Пол Дауэнхауэр, профессор химической инженерии и материаловедения в Университете Миннесоты и один из авторы исследования.
Каталитический предел скорости, или максимум Сабатье, доступен только для некоторых металлических катализаторов. Другие металлы, имеющие более слабое или более сильное связывание, демонстрируют более низкую скорость реакции.По этой причине графики зависимости скорости реакции катализатора от типа металла были названы «графиками в форме вулкана» с лучшим статическим катализатором, существующим прямо посередине на пике вулкана.
«Лучшие катализаторы должны быстро переключаться между сильными и слабыми условиями связывания по обе стороны диаграммы вулкана», — сказал Алекс Арда, научный сотрудник Центра катализа энергетических инноваций. «Если мы достаточно быстро изменим силу связывания, катализаторы, которые перескакивают между сильным и слабым связыванием, фактически работают выше каталитического предела скорости.»
Способность ускорять химические реакции напрямую влияет на тысячи химических технологий и материалов, используемых для разработки удобрений, продуктов питания, топлива, пластмасс и многого другого. В прошлом веке эти продукты были оптимизированы с использованием статических катализаторов, таких как металлы на носителе. Повышение скорости реакции может значительно сократить количество оборудования, необходимого для производства этих материалов, и снизить общую стоимость многих повседневных материалов.
Значительное улучшение характеристик катализатора также может привести к уменьшению масштабов систем для распределенных и сельских химических процессов. Из-за экономии затрат на крупномасштабные традиционные каталитические системы большинство материалов производятся только в огромных централизованных местах, таких как нефтеперерабатывающие заводы. Более быстрые динамические системы могут представлять собой более мелкие процессы, которые могут располагаться в сельской местности, например, на фермах, заводах по производству этанола или военных объектах.
Из-за экономии затрат на крупномасштабные традиционные каталитические системы большинство материалов производятся только в огромных централизованных местах, таких как нефтеперерабатывающие заводы. Более быстрые динамические системы могут представлять собой более мелкие процессы, которые могут располагаться в сельской местности, например, на фермах, заводах по производству этанола или военных объектах.
«Это может полностью изменить способ производства почти всех наших основных химикатов, материалов и топлива», — сказал профессор Дионисиос Влахос, директор Центра катализа энергетических инноваций.«Переход от обычных катализаторов к динамическим будет таким же значительным, как переход от постоянного к электричеству переменного тока».
Источник истории:
Материалы предоставлены Университетом Миннесоты . Примечание. Содержимое можно редактировать по стилю и длине.
Изменение скорости реакции
Существует 4 метода увеличения скорости реакции:
1. Увеличение концентрации реагента.
Увеличение концентрации реагента.
2. Увеличить температуру реагентов.
3. Увеличение площади поверхности реагента.
4. Добавить в реакцию катализатор.
Прежде чем мы обнаружим причины, по которым вышеуказанное вызывает увеличение скорости, мы должны сначала посмотреть, что необходимо, чтобы вызвать реакцию!
Если взять реакцию между магнием и соляной кислотой, чтобы они прореагировали вместе:
1. Они должны столкнуться друг с другом
2. Столкновение должно быть с достаточной энергией.
Скорость реакции зависит от того, сколько успешных столкновений произошло в данную единицу времени.
Эффект концентрации
Если увеличить концентрацию кислоты (реагента), реакция пойдет быстрее.
В разбавленной кислоте меньше кислотных частиц. Это означает, что вероятность попадания частицы кислоты в частицу магния меньше по сравнению с кислотой более высокой концентрации.
Это означает, что вероятность попадания частицы кислоты в частицу магния меньше по сравнению с кислотой более высокой концентрации.
В концентрированной кислоте больше частиц кислоты, поэтому больше вероятность того, что частица кислоты ударится о частицу магния.
Помните: чем больше успешных столкновений, тем быстрее реакция.
На приведенном ниже графике показаны результаты двух экспериментов. В эксперименте А использовали концентрированную кислоту, а в эксперименте Б использовали разбавленную кислоту.
Как видите, чем выше концентрация кислоты, используемой в реакции, тем круче кривая и короче время реакции. Следовательно, эти результаты показывают, что увеличение концентрации увеличивает скорость реакции.
Влияние температуры
При низких температурах реагирующие частицы имеют меньшую энергию. Когда частицы нагреваются, они получают энергию. Получение энергии позволяет частицам двигаться быстрее, это увеличивает их вероятность столкновения, но также увеличение энергии увеличивает вероятность столкновения, происходящего при достаточной энергии.
 Поскольку при распаде перекиси водорода образуется газообразный кислород, появление пузырьков указывает на то, что перекись водорода разрушается или разлагается.Отсутствие пузырьков свидетельствует о том, что вырабатывается не так много газообразного кислорода.
Поскольку при распаде перекиси водорода образуется газообразный кислород, появление пузырьков указывает на то, что перекись водорода разрушается или разлагается.Отсутствие пузырьков свидетельствует о том, что вырабатывается не так много газообразного кислорода.
 )
) Выберите «Показать облигации» в разделе «Параметры».
Выберите «Показать облигации» в разделе «Параметры».