Гидролиз солей. Задача 23 на ЕГЭ по химии. Кислоты и основания. Основные факты о гидролизе
В первой части мы дали определение гидролиза, вспомнили некоторые факты о солях. Сейчас мы обсудим сильные и слабые кислоты и выясним, что «сценарий» гидролиза зависит именно от того, какой кислотой и каким основанием образована данная соль.
← Гидролиз солей. Часть I
Сильные и слабые электролитыНапомню, что все кислоты и основания можно условно разделить на сильные и слабые. Сильные кислоты (и, вообще, сильные электролиты) в водном растворе диссоциируют практически полностью. Слабые электролиты распадаются на ионы в незначительной степени.
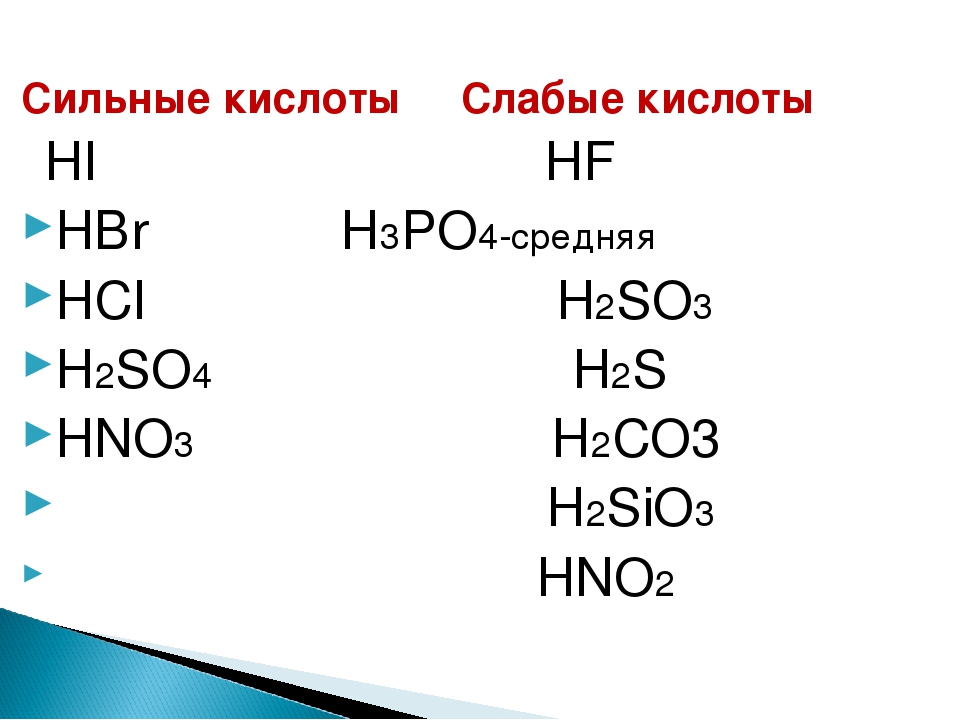
К сильным кислотам относятся:
- H2SO4 (серная кислота),
- HClO4 (хлорная кислота),
- HClO3 (хлорноватая кислота),
- HNO3 (азотная кислота),
- HCl (соляная кислота),
- HBr (бромоводородная кислота),
- HI (иодоводородная кислота).

Ниже приведен список слабых кислот:
- H2SO3 (сернистая кислота),
- H2CO3 (угольная кислота),
- H2SiO3 (кремниевая кислота),
- H3PO3 (фосфористая кислота),
- H3PO4 (ортофосфорная кислота),
- HClO2 (хлористая кислота),
- HClO (хлорноватистая кислота),
- HNO2 (азотистая кислота),
- HF (фтороводородная кислота),
- H2S (сероводородная кислота),
- большинство органических кислот, напр., уксусная (CH3COOH).
Естественно, невозможно перечислить все существующие в природе кислоты. Приведены лишь наиболее «популярные». Следует также понимать, что разделение кислот на сильные и слабые является достаточно условным.
Существенно проще обстоят дела с сильными и слабыми основаниями. Можно воспользоваться таблицей растворимости. К сильным основаниям относятся все растворимые в воде основания, кроме NH4OH. Эти вещества называют щелочами (NaOH, KOH, Ca(OH)2 и т. д.)
Можно воспользоваться таблицей растворимости. К сильным основаниям относятся все растворимые в воде основания, кроме NH4OH. Эти вещества называют щелочами (NaOH, KOH, Ca(OH)2 и т. д.)
Слабые основания — это:
- все нерастворимые в воде гидроксиды (напр., Fe(OH)3, Cu(OH)2 и т. д.),
- NH4OH (гидроксид аммония).
Гидролиз солей. Главные факты
Читающим эту статью может показаться, что мы уже забыли об основной теме разговора, и ушли куда-то в сторону. Это не так! Наша беседа о кислотах и основаниях, о сильных и слабых электролитах имеет прямое отношение к гидролизу солей. Сейчас вы в этом убедитесь.
Итак, позвольте изложить вам основные факты:
- Не все соли подвергаются гидролизу. Существуют гидролитически устойчивые соединения, например, хлорид натрия.
- Гидролиз солей может быть полным (необратимым) и частичным (обратимым).

- В ходе реакции гидролиза происходит образование кислоты или основания, изменяется кислотность среды.
- Принципиальная возможность гидролиза, направление соответствующей реакции, ее обратимость или необратимость определяются силой кислоты и силой основания, которыми образована данная соль.
- В зависимости от силы соответствующей кислоты и соотв. основания, все соли можно условно разделить на 4 группы. Для каждой из этих групп характерен свой «сценарий» гидролиза.
| Сильная кислота, слабое основание | Слабая кислота, сильное основание | Слабая кислота, слабое основание | Сильная кислота, сильное основание | |
| Направление гидролиза | По катиону | По аниону | По катиону и по аниону | Гидролиз не идет |
| Характер среды | Кислая | Щелочная | Близкая к нейтральной | Нейтральная |
| Продукты реакции | Кислота и основная соль | Основание и кислая соль | Довольно разнообразны | — |
Пример 4. Соль NaNO3 образована сильной кислотой (HNO3) и сильным основанием (NaOH). Гидролиз не идет, новых соединений не образуется, кислотность среды не изменяется.
Соль NaNO3 образована сильной кислотой (HNO3) и сильным основанием (NaOH). Гидролиз не идет, новых соединений не образуется, кислотность среды не изменяется.
Пример 5. Соль NiSO4 образована сильной кислотой (H2SO4) и слабым основанием (Ni(OH)2). Идет гидролиз по катиону, в ходе реакции образуются кислота и основная соль.
Пример 6. Карбонат калия образован слабой кислотой (H2CO3) и сильным основанием (KOH). Гидролиз по аниону, образование щелочи и кислой соли. Щелочная среда раствора.
Пример 7. Сульфид алюминия образован слабой кислотой (H2S) и слабым основанием (Al(OH)3). Идет гидролиз как по катиону, так и по аниону. Необратимая реакция. В ходе процесса образуются H2S и гидроксид алюминия. Кислотность среды меняется в незначительной степени.
Попробуйте самостоятельно:
Упражнение 2. К какому типу относятся следующие соли: FeCl3, Na3PO3, KBr, NH4NO2? Подвергаются ли эти соли гидролизу? По катиону или по аниону? Что образуется в ходе реакции? Как меняется кислотность среды? Уравнения реакций можно пока не записывать.
Нам осталось последовательно обсудить 4 группы солей и для каждой из них привести специфический «сценарий» гидролиза. В следующей части мы начнем с солей, образованных слабым основанием и сильной кислотой.
Гидролиз солей. Часть III →
Возможно, вам будут интересны следующие материалы:Гидролиз солей
Тема: «Гидролиз солей»
Предмет: химия.
Класс: 11 класс.
Условия для реализации данной методики: в классе должен быть компьютер, мультимедийный проектор, экран, по возможности интерактивная доска.
Цель: изучить сущность гидролиза солей в водных растворах.
Задачи:
Образовательная
Научиться объяснять химические процессы, протекающие в водных растворах солей, записывать уравнения реакций гидролиза;
Предсказывать и объяснять тип гидролиза, изменение кислотности среды и образование кислых и основных солей в этом процессе;
Формировать умение определять тип соли, тип гидролиза, реакцию среды растворов;
Показать биологическую роль гидролиза в процессах жизнедеятельности живых организмов.
Развивающая
Развивать познавательный интерес в процессе приобретения химических знаний, научить самостоятельно оценивать наблюдаемые явления;
Закрепить умения и навыки химического эксперимента, работы с таблицами и справочными материалами.
Воспитательная
Воспитывать убеждённость в необходимости химически грамотного отношения к своему здоровью.
Тип урока:
Урок совершенствования знаний, умений, навыков на основе проблемно-исследовательской технологии с использованием презентации.
Оборудование и реактивы:
Таблицы «Окраска индикаторов», «Растворимость солей, кислот и оснований в воде»; демонстрационные пробирки; растворы солей, индикатор лакмус, штатив для пробирок.
Планируемые результаты обучения.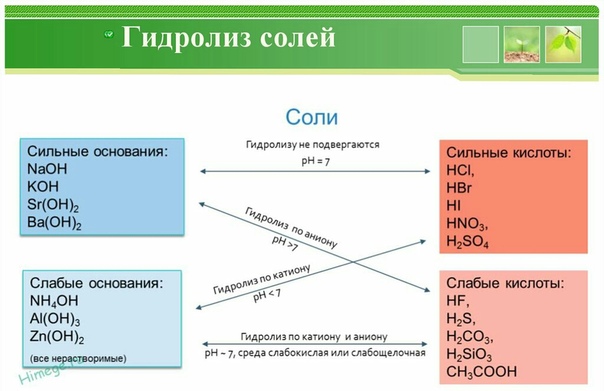
На изученных примерах уметь объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и определять, по какому иону протекает гидролиз;
Знать биологическую роль гидролиза в процессах жизнедеятельности живых организмов;
Уметь экспериментально подтверждать гидролиз соли слабого основания и сильной кислоты и соли сильного основания и слабой кислоты.
Описание работы:
Актуальность выбранной мною темы заключается в том, что понятие «гидролиза» сложное. Оно развивается на основе понятий о реакциях ионного обмена, обратимости реакций, химическом равновесии и способах го смещения, а также степени диссоциации электролитов, точнее, понятий о сильных и слабых электролитах (схема 1).
С
Реакции ионного обмена
Обратимые реакции Гидролиз солей Химическое равновесие
Сильные и слабые электролиты
хема 1. Взаимосвязь понятия «гидролиз» с опорными понятиями.
Взаимосвязь понятия «гидролиз» с опорными понятиями.
Исходя из опыта, именно из-за сложности этого понятия у обучающихся зачастую возникают трудности в его усвоении. Кроме того, в школьном курсе химии оно рассматривается как понятие теоретическое. Первое упоминание термин получает в теме «Электролитическая диссоциация» в курсе 9 класса, затем оно постепенно дополняется, эволюционирует во всех предыдущих темах и приобретает качественно новые характеристики в курсе органической химии. Поскольку сам термин «гидролиз» впервые вводится в курсе органической химии в 10 классе и рассматривается эпизодически в темах: жиры, белки, углеводы, углеводороды на примере единичных свойств отдельных соединений. Поэтому знания, получаемые обучающимися, не систематизированы. Как самостоятельная тема гидролиз рассматривается в 11 классе в разделе «Химические реакции». По программе базового уровня отводится 1 час.
Важность знаний этой темы обусловлена прежде всего тем, что все части ЕГЭ по химии содержат вопросы по гидролизу. Поэтому необходимо, чтобы ученики за короткое время усвоили знания по теме и легко ориентировались в ней. Кроме того, знания гидролиза важны для целостного представления природы человеческого организма и формирования осознанной здоровьесберегающей позиции учеников.
Все вышесказанное объясняет тот факт, что изучение данного понятия необходимо вести проблемно. В связи с этим в своей разработке использовала проблемную технологию.
Кроме того, нужно учитывать также и методические особенности преподавания химии – обеспечение практической ориентированности предметного знания. Это означает необходимость выявления тесной взаимосвязи между изучаемыми теоретическими положениями и практикой, демонстрации теоретических знаний по данной тематике. То есть я использовала проблемную технологию, в которой проблема ставиться с помощью химического эксперимента.
Для увеличения наглядности, понимания сущности процесса гидролиза урок сопровождается презентацией в формате Power Point, сопровождающая все его этапы.
Предлагаю вашему вниманию урок по теме «Гидролиз» в 11 классе с использованием ИКТ на основе проблемной технологий (Приложение 1).
Ход урока:
I этап урока — Постановка проблемы.
Учитель: Наш сегодняшний урок мы начнем с решения задачи, текст которой вы видите на своих столах (приложение 2). Внимательно прочитаем и решим у доски эту задачу.
Ученик записывает условия задачи и уравнения реакции обмена:
ν (FeCl3) =5 моль 2FeCl3 + 3Na2CO3 → 6NaCl + Fe2(CO)3
m(осадка)=?
Ученики констатируют факт, что среди продуктов нет газа. Учитель рекомендует проверить по таблице растворимости соль Fe2(CO)3.ученики устанавливают тот факт, что в таблице растворимости на месте этой соли стоит прочерк.
Учитель рекомендует проверить по таблице растворимости соль Fe2(CO)3.ученики устанавливают тот факт, что в таблице растворимости на месте этой соли стоит прочерк.
Учитель: может быть условия задачи ошибочны? Проверим это опытным путем.
Ученики выполняют химический эксперимент: сливают растворы хлорида железа (III) и карбоната натрия. Один из учеников напоминает при этом правила техники безопасности.
Учитель: Что мы наблюдаем? (выделяется бесцветный газ и выпадает осадок коричневого цвета, лакмусовая бумажка синеет)
Учитель: Таким образом, проведя эксперимент, мы пришли к выводу, что в условии задачи все сформулировано правильно. А вот мы при составлении уравнения реакции чем — то пренебрегли (взаимодействием солей с водой при получении раствора).
Учитель: Правильно! Мы этого не учли – поэтому, у нас не получается решение задачи. На этом уроке мы рассмотрим, как различные соли взаимодействуют с водой, а затем попробуем вернуться к решению этой задачи. Запишем тему урока.
Запишем тему урока.
II этап урока — Актуализация знаний и опыта, подготовка к изучению нового материала.
Содержание урока | Формы и методы работы учителя | Виды деятельности |
1.Опорные вопросы: Какие вещества называются электролитами и неэлектролитами? Их примеры? Что такое кислоты, основания с позиции ТЭД? Как опытным путем определить кислоту и основание? Как индикаторы изменяют свой цвет в различных средах? Какие ионы за это отвечают? | Фронтальный опрос в форме беседы со слайдами на экране. Слайд со схемой На экране показываем цвета индикаторов в разных средах | Устные ответы на вопросы учителя Делается вывод о том, какие ионы отвечают за цвет индикаторов |
2.Подготовка таблицы | Таблица заранее имеется на слайде | Построение таблицы 1 в тетради |
Таблица 1.Изменение окраски индикаторов в разных средах.
Ве-щество | Ионы | Индикаторы | Реакция среды | |||
катионы | Анио-ны | лакмус | Метил-оранж | Фенол-фталеин | ||
Кис-лота | Н+ | Крас-ный | Розо-вый | Бесцвет-ный | Кислая | |
Основа-ние | ОН— | синий | Жёл-тый | Малино-вый | Щелоч-ная | |
Вода | Фиоле-товый | Оран-жев | Бесцвет-ный | нейтральная | ||
AlCl3 | ? | ? | ? | ? | ? | ? |
Na2CO3 | ? | ? | ? | ? | ? | ? |
NaCl | ? | ? | ? | ? | ? | ? |
III этап урока — Изучение нового материала.
Учитель задает вопросы:
Есть ли эти ионы в солях?
Как образуются в растворе солей ионы Н+ и ОН-?
Является ли вода электролитом?
На какие ионы диссоциирует вода?
Учитель: Вспомним, что вода – слабый электролит и в чистой воде происходит процесс: НОН ↔ Н+ + ОН- и существует равенство концентрации: [H+] = [OH –] = 10 – 7 моль/л, и в этом случае pH = 7.
Обучающиеся знают, что они исследовали водные растворы солей и делают вывод, что вода участвует в гидролизе и дает ионы водорода и гидроксогруппы, избыток которых изменяет цвет индикаторов, поэтому исходный раствор окрасил лакмус в синий цвет.
Учитель формулирует вопрос: «Что же называется гидролизом?», если «гидро» — вода, «лизис» — разложение.
Делается вывод, что гидролиз солей – это обменное взаимодействие солей с водой, приводящее к их разложению (записывают определение в тетрадях).
IV этап урока – составление схем гидролиза солей, формулирование выводов
Учитель: любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости от силы основания и кислоты можно выделить 4 типа солей:
соли, образованные сильным основанием и слабой кислотой
соли, образованные слабым основанием и сильной кислотой
соли, образованные сильным основанием и сильной кислотой
соли, образованные слабым основанием и слабой кислотой
Рассмотрим, что же происходит при взаимодействии различных типов солей с водой?
На этом этапе урока учитель ставит экспериментальную задачу: исследовать реакцию среды растворов солей: NaCl, Na2CO3, AlСl3 , результаты занести в таблицу и на основании наблюдений сделайте вывод о типе соли, типе гидролиза (по какому иону) и образующейся среде.
Наблюдения ученики вносят в заранее подготовленные таблицы, дополняя предыдущую вместо вопросительных знаков:
Вещество | катионы | анионы | лакмус | Метил-оранж | Фенол-фталеин | Вывод |
Кислота | Н+ | красный | розовый | бесцветный | Кислая | |
Основание | ОН— | синий | жёлтый | малиновый | Щелочная | |
Вода | фиолет | оранжев | бесцветный | нейтральная | ||
NaCl | Na+ | Cl- | фиолет | оранжев | бесцветный | нейтральная |
Na2CO3 | К+ | CO32- | синий | жёлтый | малиновый | Щелочная |
Al2(SO4)3 | Mg2+ | Cl- | красный | розовый | бесцветный | Кислая |
А затем демонстрирует упрощенную схему пошагового составления уравнений гидролиза на экране компьютера с заранее созданными слайдами.
AlCl3
Al(OH)3 HCl
слабое основание сильная кислота
[ ОН]- < [H]+
Составим уравнение реакции: молекулярное, полное и сокращенное ионные.
AlCl3 + HOH ↔ HCl + AlOHCl2
Al3+ + 3Cl – + HOH ↔ H+ + Cl – + AlOh3+ + 2Cl –
Al3+ + HOH ↔ AlOh3+ + H+
pH<7,
[H+] > [OH –].
Ученики делают обобщение:
Гидролиз идёт по слабому иону
Реакция среды определяется по сильному иону.
Вывод: Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, так как в растворе избыток ионов водорода, гидролиз идет по катиону (выводы записывают в тетрадях).
Аналогично составляются схемы по другим солям и делаются соответствующие выводы.
Na2CO3
NaOH h3CO3
сильное основание слабая кислота
[ ОН]- > [H]+
Предлагаю одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
Na2CO3 + HOH ↔ NaOH + NaHCO3
2Na+ + CO32 – + HOH ↔ Na+ + OH – + Na+ + HCO3 –
CO32 – + HOH ↔ OH – + HCO3 –
pH>7,
[H+] < [OH –].
Вывод: Соль, образованная сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов, гидролиз идет по аниону .
Далее учитель просит ребят самостоятельно составить аналогичную схему для хлорида натрия.
NaCl
NaOH HCl
сильное основание сильная кислота
[H+] = [OH –].
Предлагаем одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
NaCl + HOH ↔ NaOH + HCl
Na+ + Cl – + HOH ↔ Na+ + OH – + H+ + Cl –
HOH ↔ OH – + H+
pH=7,
[H+] = [OH –].
Учащиеся делают вывод: силы электролитов равны и записывают определение: Раствор соли, образованной сильным основанием и сильной кислотой имеет нейтральную среду, т.к. равенство концентраций ионов водорода и гидроксид-ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются.
Можно сказать, что такие соли гидролизу не подвергаются.
Учитель: А какой еще может быть случай образования солей? (Соль может быть образованна слабым основанием и слабой кислотой)
Учитель: Обратимся к тексту учебника. (Учащиеся читают текст учебника и выписывают уравнение реакции гидролиза сульфида алюминия).
Учитель: Очевидно, такому же необратимому гидролизу подвергается соль карбонат железа (III):
Fe2(CO3)3 + 3HOH → 2Fe(OH)3↓+ 3CO2↑
Учащийся делает вывод:
Соли, образованные слабым основанием и слабой летучей кислотой, подвергаются необратимому гидролизу, т.е. полностью разлагаются с образованием осадка и выделением газа, гидролиз идет и по катиону и по аниону.
V этап урока — Разрешение проблемы (решение задачи).
Вернемся к задаче, в решении которой мы зашли в тупик. Что нужно изменить в написании уравнения реакции?
Что нужно изменить в написании уравнения реакции?
В левую часть добавить вещество h3O, в правой части соль карбонат железа (III) заменить на осадок гидроксида железа (III) и углекислый газ. Соль хлорид натрия образованна сильным основанием и сильной кислотой, поэтому гидролизу не подвергается, в уравнении реакции остается без изменений.
Приглашаем того же ученика закончить решение задачи.
Ученик изменяет уравнение реакции и производит расчеты:
2FeCl3 + 3Na2CO3 + 3h3O → 2Fe(OH)3↓+ 3CO2↑+ 6NaCl.
ν (Fe(OH)3) = ν (FeCl3) = 5 моль.
m (Fe(OH)3) = M* ν = 107г/моль*5моль = 535г.
Ответ: масса выпавшего осадка составляет 535г.
Вот мы и решили эту задачу, определили газ, наш массу осадка
VI этап урока – Закрепление («учимся говорить»).Подведение итогов.
Итак, сегодня мы познакомились с явлением гидролиза солей. Прошу дать краткие ответы на мои вопросы:
Что такое гидролиз?
На какие группы мы разделили все соли?
Как происходит гидролиз каждой группы?
(обучающиеся устно отвечают)
Проверим результативность нашей совместной исследовательской деятельности: определите тип соли, тип гидролиза, реакцию среды по алгоритму (находится на слайде):
Алгоритм выполнения задания | Примеры |
1. Определяем, каким основанием и какой кислотой образована соль | Al Cl3 Слабое осн. |
2. Выбираем слабый ион, т.к. гидролиз идёт по слабому иону | 3+ Al — катион |
3. Выбираем сильный ион, т.к. он определяет реакцию среды | Сильная кислота Кислая среда |
4. Формулируем вывод: соль образована слабым основанием и сильной кислотой, гидролизуется по катиону с образованием кислой среды. | |
Помните:
Тип гидролиза определяем по слабому иону (катион или анион)
Реакцию среды устанавливаем по сильному иону (кислая, щелочная, нейтральная)
Например: карбонат натрия Na2CO3 – соль образована сильным основанием и слабой кислотой, гидролизуется по аниону с образованием щелочной среды
Устные задания: AlCl3 Fe2S3 K2 SO4 FeBr2 CaCl2 Na3PO4 Сu(NO3)2
VI этап урока –Домашнее задание.
§18, упражнение №3, 7, 8 (письменно), подготовить небольшой доклад на тему «Роль гидролиза в природе и жизни человека»
Приложение 2.
Задача.
При сливании раствора, содержащего 5моль хлорида железа (III), с избытком раствора кальцинированной соды выделяется газ и выпадает осадок. Определить массу выпавшего осадка.
Гидролиз, подготовка к ЕГЭ по химии
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
 Абсолютно любая:
Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr,
CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4,
FeSO3, CaSO3.
Примеры: NaCl, KBr,
CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4,
FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4,
NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Примеры: K3PO4,
NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO
2)2, Al2S3, Cr2(SO3)3, CH3COONH4.Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2. Ниже вы найдете решение.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль,
вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
Индикаторы (лат. indicator — указатель)
Индикатор — вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды
раствора их окраска меняется, что отражает приведенная ниже таблица.
Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? :) От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет настроение ;)
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий —
Щелочь здесь, не будь разиней!
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это —
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки —
Здесь я оранжевый практически всегда!
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
КонСтанта слабых кислот и оснований
При титровании слабых кислот слабыми основаниями (или наоборот) кислотная часть кривой титрования отвечает титрованию слабой кислоты сильным основанием.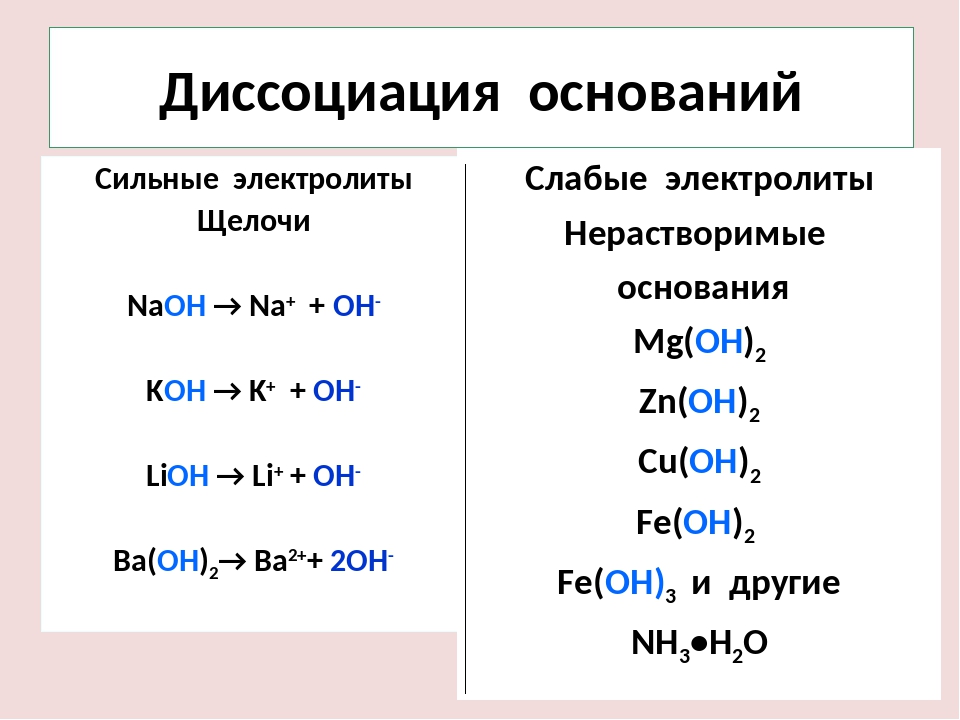 Щелочная часть кривой титрования совпадает с кривой титрования слабого основания сильной кислотой. Для точки эквивалентности величину pH находят из уравнения константы гидролиза соли следующим способом. [c.270]
Щелочная часть кривой титрования совпадает с кривой титрования слабого основания сильной кислотой. Для точки эквивалентности величину pH находят из уравнения константы гидролиза соли следующим способом. [c.270]
Катионы сильных оснований N3+, a +, Ва + и анионы сильных кислот С1, 505 не принимают участия в этих реакциях, поскольку не могут образовать с ионами воды и ОН малодиссоциированных соединений. Таким образом, водные растворы уксуснокислых солей (ацетатов), образованных сильными основаниями, имеют щелочную реакцию, а растворы аммониевых солей сильных кис лот — кислую реакцию. В случае ацетата аммония и катион, и анион принимают участие в реакции гидролиза, однако раствор сохраняет нейтральную реакцию, так как образующиеся уксусная кислота и гидроксид аммония — электролиты равной силы (с. 127), В других случаях, например при гидролизе Nh5 N, для определе ния характера раствора необходимо сопоставить константы диссоциации слабого основания и слабой кислоты, образующихся при гидролизе соли.
 [c.130]
[c.130]Соли слабых кислот и сильных оснований. Гидролиз. как константа гидролиза. [c.206]
КИСЛОТЫ и ее соли всегда больше, чем буферная емкость воды, раствора соли, раствора сильной кислоты или сильного основания, для которых справедлива формула (I-I7). Величина р в этом случае будет зависеть от константы диссоциации Л нл слабой кислоты. [c.42]
Поэтому при вычислении pH здесь исходят из уравнения константы ионизации соответствующей слабой кислоты. Для расчета кривой титрования необходимо вывести три формулы а) расчет [Н+] (pH) до титрования, т. е. в растворе слабой кислоты б) расчет [Н+] (pH) в процессе титрования, когда в растворе присутствует слабая кислота и ее соль и, наконец, в) расчет [Н+] (pH) в точке эквивалентности, когда в растворе находится только соль слабой кислоты и сильного основания. Прежде всего рассчитаем [Н+] и pH в растворе слабой кислоты НАп. Кислота ионизирует в растворе [c.261]
Эти соображения имеют общий характер, и, следовательно, для решения вопроса о том, какую реакцию будет иметь водный раствор гидросоли, образованной сильным основанием и двухосновной слабой кислотой, следует сопоставить константу гидролиза гидросоли и вторую константу диссоциации кислоты. [c.135]
[c.135]
Хлорсеребряный электрод хорошо воспроизводим и довольно прост в изготовлении. Он применяется как внутренний вспомогательный электрод в стеклянных электродах и реже как внешний вспомогательный электрод в элементах типа (IX. 1). Благодаря тому, что хлорсеребряный электрод мало подвержен побочным реакциям, он нашел широкое применение в элементах без жидкостного соединения, где используется не только для изучения термодинамических свойств растворов хлоридов, но также для точного определения констант диссоциации слабых кислот, оснований и амфолитов [137, глава 15]. Неизменность электродной реакции [c.247]
Ослабление силы кислот в уксусной кислоте обусловлено не только ее малой основностью, но и ее низкой диэлектрической проницаемостью. На это указывает то обстоятельство, что сила бромистоводородной кислоты больше, чем хлористоводородной, а также и то, что в муравьиной кислоте (диэлектрическая проницаемость равна 57), несмотря на ее еще более сильные протогенные свойства, галогеноводородные кислоты сильно ионизированы, даже при малых разбавлениях.
 В муравьиной кислоте, как в кислом растворителе, сильно диссоциированы также слабые основания. На такую роль диэлектрической проницаемости указывает близость констант диссоциации кислот, оснований и солей в уксусной кислоте (табл. 25). [c.280]
В муравьиной кислоте, как в кислом растворителе, сильно диссоциированы также слабые основания. На такую роль диэлектрической проницаемости указывает близость констант диссоциации кислот, оснований и солей в уксусной кислоте (табл. 25). [c.280]Гидролиз соли, образованной слабой кислотой НА и сильным основанием, характеризуется константой гидролиза Кг- [c.149]
Титрование сильной кислоты (щелочи) в присутствии слабой кислоты (основания) осуществимо с точностью, зависящей от константы диссоциации соответствующего слабого электролита. Расчетом можно показать, что константа диссоциации слабой кислоты должна быть равной 10 , чтобы была обеспечена при этом точность ( 0,1 7о), с которой определяется сильная кислота (при условии равенства их начальных концентраций 0,1 М). [c.125]
Кривая титрования смеси сильной и слабой кислот (оснований), представляющая сочетание кривых рис. Д.134, а и Д.134, в, изображена на рис. Д.134, г. На практике для дифференцированного титрования. кислот (оснований) в их смесях константы диссоциации кислот (оснований) должны существенно различаться. В противном случае на кривых наблюдаются большие плавные изгибы, что не иозволяет четко опре- целить точку эквивалентности. (Каким был бы ход кривой титровании слабой кислоты слабым основанием ) [c.325]
На практике для дифференцированного титрования. кислот (оснований) в их смесях константы диссоциации кислот (оснований) должны существенно различаться. В противном случае на кривых наблюдаются большие плавные изгибы, что не иозволяет четко опре- целить точку эквивалентности. (Каким был бы ход кривой титровании слабой кислоты слабым основанием ) [c.325]
Условия вытеснительного титрования такие же, как в прямом титровании смеси сильной и слабой кислот (оснований) константы диссоциации вытесняющей сильной кислоты (основания) и- вытесняемой слабой кислоты (основания) должны существенно различаться. [c.326]
В случае неполной нейтрализации слабой кислоты (слабого основания) pH вычисляют, пользуясь выражением для константы диссоциации слабой кислоты (основания) [c.60]
Если имеет место полная нейтрализация слабой кислоты (основания), то pH рассчитывают по константе диссоциации сопряженного основания (кислоты) [c. 61]
61]
Раздельное титрование смеси сильной и слабой кислот (оснований) возможно при условии, что константа диссоциации слабой кислоты (основания) находится в пределах (рис. 13.7). [c.221]
Таким образом, кислота или основание с рК, например, около 8 в разбавленных водных растворах, не содержащих других кислот или оснований, диссоциирует максимум на 9%. Удовлетворительное приближение к максимальной степени диссоциации наблюдается при концентрациях около 10 моль л, дальнейшее разбавление раствора (при рК 8) не способно заметно увеличить степень диссоциации. Это объясняется тем, что в очень разбавленных растворах диссоциация слабой кислоты (основания) подавляется водородными (гидроксильными) ионами воды. По отношению к разбавленным растворам слабых кислот (оснований) вода способна проявлять свои кислотные (или основные) свойства. Чем меньше концентрация слабого электролита в растворе и чем меньше его константа диссоциации, тем сильнее влияние воды на степень диссоциации. Степень диссоциации в очень разбавленных растворах можно изменить только путём изменения pH или температуры. [c.26]
Степень диссоциации в очень разбавленных растворах можно изменить только путём изменения pH или температуры. [c.26]Иной метод определения слабых кислот основан на их титровании растворами слабых оснований, но при условии, что величины констант ионизации определяемой кислоты и применяемого основания приблизительно равны f . При этом условии соль, находящаяся в растворе в точке эквивалентности, независимо от исходной концентрации кислоты, будет всегда сообщать раствору pH, близкое или равное 7. [c.177]
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации [c.259]
Способ определения константы распределения слабой кислоты основан на использовании уравнения [c.121]
Типичные кривые титрования слабыми кислотами оснований различной силы до точки эквивалентности аналогичны кривым титрования, полученным при использовании сильных кислот. Отличие заключается в том, что после точки эквивалентности электропроводность не изменяется. Значения констант диссоциации слабых электролитов, лимитирующие возможности определения, совпадают с данными, приведенными для случаев титрования кислот. Определения возможны, если сумма р/Сь титруемого основания и р/(а кислоты, используемой для нейтрализации, меньше или равна 12. [c.40]
Отличие заключается в том, что после точки эквивалентности электропроводность не изменяется. Значения констант диссоциации слабых электролитов, лимитирующие возможности определения, совпадают с данными, приведенными для случаев титрования кислот. Определения возможны, если сумма р/Сь титруемого основания и р/(а кислоты, используемой для нейтрализации, меньше или равна 12. [c.40]
Метод СФ-титрования позволяет использовать реакции образования малоустойчивых комплексов, реакции нейтрализации слабых кислот и оснований, реакции окисления — восстановления систем с малой константой равновесия, так как для нахождения К. Т. Т. можно применять экстраполяцию участков кривых, соответствующих избытку титруемого иона и реагента (полное смещение равновесия реакции в одну сторону, поэтому зависимость D — f ) прямолинейна). [c.478]
Сильные и слабые основания. Сопряженные пары кислота-основание. Константа диссоциации основания К . Соотношение [c.206]
Константа диссоциации основания К . Соотношение [c.206]
Концентрацию ионов водорода (гидроксила) в растворе слабой кислоты (основания) в присутствии ее соли можно вычислить по следующей приближенной формуле [Н ] = КС/а (для основания соответственно [ОН ) = КС/а), где К — константа диссоциации, С — концентрация кислоты (основания) и о — концентрация соли. Например, для 0,1 н. раствора уксусной кислоты, содержащего одновременно Доо нормального веса (Л =Л1=82) СНзСООНа в литре, концентрация иона водорода будет равна [№] = 0,1 — 2- Ю /0,01 = 2-10 , т. е. 0,0002 г-ион/л. Так как тот же 0,1 н. раствор уксусной кислоты в отсутствие соли содержит 0,0014 г-ион водорода (доп. 21), видим, что прибавление даже такого ничтожного количества соли, как [c.188]
Соответственно константа гидролиза соли, образованной сильным основанием н слабой трехосновной кислотой, равна ионному произведению воды, деленному на третью константу диссоциации кислоты [c. 134]
134]
Соотношения, связывающие константу гидролиза с константами диссоциа ции кислоты и основания, легко получить пз выражения константы гидролиза В .1ведем первое из них, относящееся к случаю слабой кислоты и сильного основания. Для этого учтем, что основание МОН, от которого образована сол МЛ, — сильное, т. е. диссоциирует нацело. Поэтому [c.260]
Благодаря отсутствию диффузионного потенциала цёпп без переноса широко применяются для определения многих свойств растворов электролитов. Во второй главе и частично в пятой и шестой главах мы ул е подробно рассмотрели применение цепей без переноса для оценки свойств сильных электролитов— концентрационных коэффициентов активности 7 и единых нулевых коэффициентов активности Уо. Кроме того, цепи без переноса широко применяются для определения свойств слабых электролитов. С их помощью определяются константы диссоциации кислот, оснований и солей, ионное произведение среды и т. д. [c.741]
Константа ионизации основания МеОН равна 1 10″ .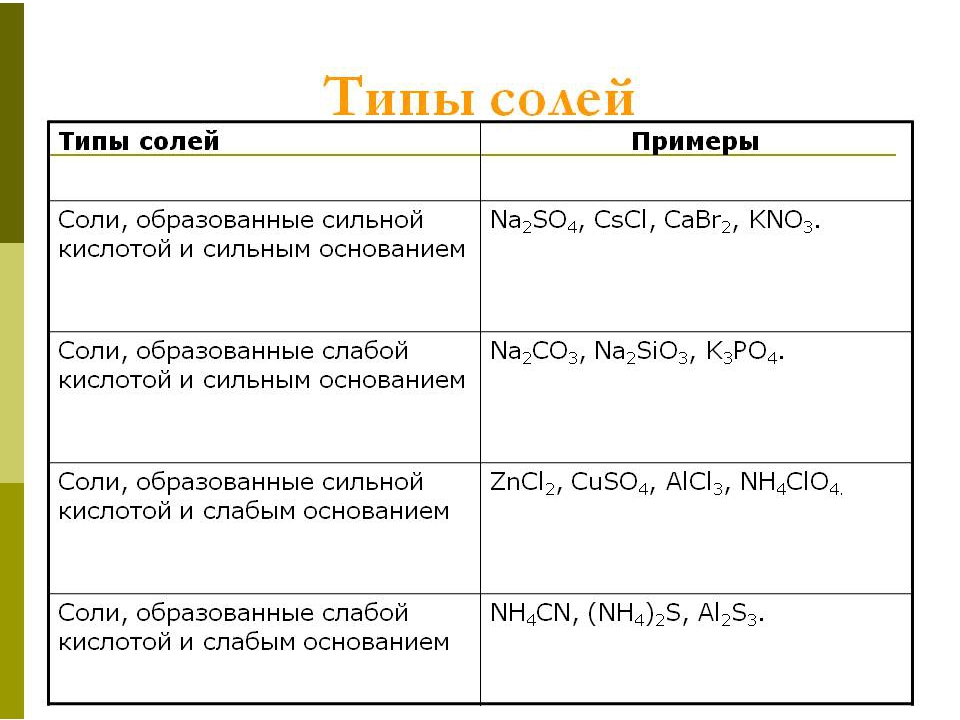 Pa twixarb и построить кривую титрования 0,1 н. раствора его соли МеС1 0,1 н. растворолГ ОН и сравнить полученную кривую с кривой титрования 0,1 н. раствора слабой кислоты НАп с константой ионизации I-10″ . С какими индикаторами можно прово.тить эти титрования [c.293]
Pa twixarb и построить кривую титрования 0,1 н. раствора его соли МеС1 0,1 н. растворолГ ОН и сравнить полученную кривую с кривой титрования 0,1 н. раствора слабой кислоты НАп с константой ионизации I-10″ . С какими индикаторами можно прово.тить эти титрования [c.293]
Изменение соотношения Кз/Кнап еще больше по сравнению с изменениями соотношений констант диссоциации кислот и оснований улучшает условия титрования, если соотношение Кз1Кнап уменьшается. Например, указанное соотношение может уменьшаться в десятки тысяч раз в растворителях, имеющих малые значения Кз (жидкий аммиак, диметилсульфоксид, диметилформамид, ацетонитрил). Сильное изменение соотношения Кз1Кнап позволяет осуществлять дифференцированное титрование смесей, не титруемых в других растворителях, а именно минеральных и органических кислот алифатических и ароматических кислот аминокислот фенолов и их смесей с карбоновыми кислотами сульфокислот сильных, слабых и очень слабых кислот (оснований) многокомпонентных смесей солей с кислотами и т. д. [c.198]
д. [c.198]
При химических взаимодействиях в растворах всегда образуются смеси электролитов и присутствуют различные ионы. Одни из них образуются в результате диссоциации сильных электролитов, другие — слабых электролитов. Некоторые ионы вступают в реакцию, при этом образуются новые малодиссоциированные соединения, малорастворимые осадки, комплексные соединения или продукты реакций окисления — восстановления. Таким образом, в процессе титрования растворы представляют собой сложные системы, в которых в ряде случаев имеется несколько химических равновесий, в том числе и автопротолиз растворителя. Концентрация ионов зависит от общего состояния системы в каждый момент титрования. Поскольку состояние системы определяется термодинамическими константами, характеризующими химические равновесия, эти величины могут служить критериями применимости методов. К ним относятся константы диссоциации кислот, оснований, амфолитов (в неводных растворах также константы диссоциации солей), константы автопротолиза растворителей, константы нестойкости комплексов, произведения активностей осадков, окислительновосстановительные потенциалы и т. д. Термодинамические величины характеризуют полноту протекания реакций, а следовательно, и значения равновесных концентраций ионов. Теоретические кривые титрования дают возможность устанавливать, при каких значениях указанных констант кривые кондуктометрического титрования имеют излом, позволяющий найти точку эквивалентности. При этом реакции не обязательно должны протекать практически до конца, так как смещение ионных равновесий происходит в продолжение всего процесса титрования. Поэтому в основу кондуктометрических определений могут быть положены реакции в какой-то мере обратимые, что недопустимо в ряде случаев при использовании классических химических методов и некоторых физико-химиче-ских методов анализа. [c.38]
д. Термодинамические величины характеризуют полноту протекания реакций, а следовательно, и значения равновесных концентраций ионов. Теоретические кривые титрования дают возможность устанавливать, при каких значениях указанных констант кривые кондуктометрического титрования имеют излом, позволяющий найти точку эквивалентности. При этом реакции не обязательно должны протекать практически до конца, так как смещение ионных равновесий происходит в продолжение всего процесса титрования. Поэтому в основу кондуктометрических определений могут быть положены реакции в какой-то мере обратимые, что недопустимо в ряде случаев при использовании классических химических методов и некоторых физико-химиче-ских методов анализа. [c.38]
I Нужно иметь в виду, что константы ионизации большинства слабых кислот и оснований мало изменяются с изменением тем- пературы. Это может быть отнесено и к индикаторам. Действительно, у индикаторов-кислот (Hind) с изменением температуры интервал перехода практически не изменяется, так как не изменяется /Сн1п(1 [c. 252]
252]
Из тождества кривых титрования можно сделать следующий важный вывод титрование солей слабых кислот типа NaAn сильными кислотами возможно только при условии, если соответствующая слабая кислота НАп имеет достаточно малую константу ионизации (т. е. достаточно большой рК). Действительно, выше указывалось, что если р/(нАп = 9, т. е. /Снап = Ю , то соответствующую соль можно точно оттитровать, подобно основанию с р осн = 5. [c.285]
Особенно глубоко протекает гидролиз солей, образованных с.пабой кислотой и слабым основанием. Согласно вышеприведенному выражению, константа гидролиза в этом случае обратно пропор[шональна произведению констант диссоциации кислоты и основания, т. е. ее значение особенно велико. Примером этого случая может служить гидролиз ацетата алюминия, протекающий до основных солей — ацетатов гидроксо- и дигидроксоалюминия [c.262]
Поскольку в формулу (XVIII, 92) для pH раствора в эквивалентной точке входят только константы, можно считать, что в первом приближении pH раствора соли слабой кислоты и слабого основания не зависит от концентрации. [c.508]
[c.508]
Для случая солн, образованной слабой кислотой и сильным основанием, константа гидролиза связана с константой диссоциации кислоты /Скнсл зависимостью [c.259]
Реакция растворов солей, образованных слабой кислотой и слабым основанием, зависит от соошошения констант диссоциации кислоты и основания, образующих соль. Если константа дис- [c.262]
Л гидр = Л и/Л кисл — 1соли сильного основания и слабой однрЗШ Й кислоты. К р = КуКас — -он ст ант а гидролиза соли сильной кислоты й слабого одн основания. Константа гидролиза ацетата аммония имеет вид [c.131]
Спектральный метод определения констант днссоциацип слабых органических кислот основан на различии в спектрах поглоитеиня аниона и молекулы кислоты, т. е. если какая-либо органическая ки- [c.74]
Сильные и слабые кислоты. Определения кислоты и основания по Аррениусу и по Бренстеду — Лаури. Полная и неполная диссоциация. Константа диссоциации кислоты К . Сопряженные основания. Выравни-ваюшее действие растворителей. [c.206]
Константа диссоциации кислоты К . Сопряженные основания. Выравни-ваюшее действие растворителей. [c.206]
Равновесия с участием слабых кислот и оснований. Уравнения материального баланса и баланса зарядов. Способы приближенного решения уравнений, включаюших константу диссоциации слабой кислоты или основания. [c.206]
Ca oh 2 сильное или слабое основание. Самая сильная кислота. Формула самой сильной кислоты. Что мы узнали
Немного теории
КислотыКислоты ― это сложные вещества, образованные атомами водорода, способными замещаться на атомы металла и кислотными остатками.
Кислоты — это электролиты, при диссоциации которых образуются только катионы водорода и анионы кислотных остатков.
Классификация кислот
Классификация кислот по составу
Классификация кислот по числу атомов водорода
Классификация кислот на сильные и слабые кислоты.
Химические свойства кислот
- Взаимодействие с основными оксидами с образованием соли и воды:
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
- Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации) :
- Взаимодействие с солями, если выпадает осадок или выделяется газ:
- Сильные кислоты вытесняют более слабые из их солей:
(в данном случае образуется неустойчивая угольная кислота , которая сразу же распадается на воду и углекислый газ)
— лакмус становится краснымМетилоранж становится красным.
Получение кислот
1. водород+неметаллH 2 + S → H 2 S
2. кислотный оксид+ вода
P 2 O 5 + 3H 2 O →2H 3 PO 4
Исключение :
2NO 2 + H 2 O →HNO 2 + HNO 3
SiO 2 + H 2 O -не реагирует
3. кислота+соль
В продукте реакции должен образовываться осадок, газ или вода. Обычно более сильные кислоты вытесняют менее сильные кислоты из солей. Если соль нерастворима в воде, то она реагирует с кислотой, если образуется газ.
Na 2 CO 3 + 2HCl →2NaCl + H 2 O + CO 2
K 2 SiO 3 + H 2 SO 4 → K 2 SO 4 + H 2 SiO 3 ↓ Основания Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
Классификация оснований
1. По растворимости в воде.
Растворимые основания
(щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
Практически нерастворимые основания
: Mg(OH)2, Ca(OH) 2 , Zn(OH) 2 , Cu(OH) 2
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
2. По количеству гидроксильных групп в молекуле.
— Однокислотные (гидроксид натрия NaOH)
— Двукислотные (гидроксид меди(II) Cu(OH) 2 )
— Трехкислотные (гидроксид железа(III) In(OH) 3 )
3. По летучести.
— Летучие : Nh4
— Нелетучие : щёлочи, нерастворимые основания.
4. По стабильности.
— Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2
— Нестабильные: гидроксид аммония Nh4·h3O (гидрат аммиака).
5. По степени электролитической диссоциации.

— Сильные (α > 30 %): щёлочи.
Слабые (α
Получение
- Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
- Также основание можно получить при взаимодействия щелочного или щелочноземельного металла с водой.
- Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
- Некоторые основания можно получить обменными реакциями:
Химические свойства
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
это изменение проявляется в цветах некоторых
кислотно-основных индикаторов :
лакмус становится синим,
метилоранж — жёлтым,
фенолфталеин приобретает цвет фуксии .

- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
Примечание:
реакция не идёт, если и кислота и основание слабые .
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Растворимые основания могут реагировать с амфотерными гидроксидами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Растворимые снования вступают в обменные реакции с растворимыми солями:
Основания | |||||
Средней силы | |||||
Гидроксиды
щелочных металлов (KOH,
NaOH,
ZiOH),
Ba(OH) 2
и
др. | Na 4 OH и нерастворимые в воде основания (Ca(OH) 2 , Zi(OH) 2 , AL(OH) 3 и др. | ||||
Константа гидролиза равна отношению произведения концентраций продуктов гидролиза к концентрации негидролизованной соли.
Пример 1. Вычислить степень гидролиза NH 4 Cl.
Решение: Из таблицы находим Кд(NH 4 ОН)=1,8∙10 -3 , отсюда
Кγ=Кв/Кд к = =10 -14 /1,8∙10 -3 = 5,56∙10 -10 .
Пример 2. Вычислить степень гидролиза ZnCl 2 по 1 ступени в 0,5 М растворе.
Решение: Ионное уравнение гидролиза Zn 2 + H 2 OZnOH + + H +
Kд ZnOH +1=1,5∙10 -9 ;
hγ=√(Кв/
[Кд осн ∙Cм])
= 10 -14 /1,5∙10 -9 ∙0,5=0,36∙10 -2
(0,36%).
Пример 3. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na 2 CO 3 ; в) ZnSO 4 . Определите реакцию среды растворов этих солей.
Решение: а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. I приложения) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К + и анионы CN — . Катионы К + не могут связывать ионы ОН — воды, так как КОН — сильный электролит. Анионы же CN — связывают ионы Н + воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
CN — + Н 2 О HCN + ОН —
или в молекулярной форме
KCN + Н 2 О HCN + КОН
В результате гидролиза в растворе появляется некоторый избыток ионов ОН — , поэтому раствор KCN имеет щелочную реакцию (рН > 7).
б)
Карбонат натрия Na 2 CO 3
— соль слабой многоосновной кислоты и
сильного основания. В этом случае анионы
соли СО 3 2- ,
связывая водородные ионы воды, образуют
анионы кислой соли НСО — 3
, а не молекулы Н 2 СО 3 ,
так как ионы НСО — 3
диссоциируют гораздо труднее, чем
молекулы Н 2 СО 3 . В обычных условиях гидролиз идет по
первой ступени. Соль гидролизуется по
аниону. Ионно-молекулярное уравнение
гидролиза
В обычных условиях гидролиз идет по
первой ступени. Соль гидролизуется по
аниону. Ионно-молекулярное уравнение
гидролиза
CO 2- 3 +H 2 OHCO — 3 +ОН —
или в молекулярной форме
Na 2 CO 3 + Н 2 О NaHCO 3 + NaOH
В растворе появляется избыток ионов ОН — , поэтому раствор Na 2 CO 3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO 4 — соль слабого многокислотного основания Zn(OH) 2 и сильной кислоты H 2 SO 4 . В этом случае катионы Zn + связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образование молекул Zn(OH) 2 не происходит, так как ионы ZnOН + диссоциируют гораздо труднее, чем молекулы Zn(OH) 2 . В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn 2+ + Н 2 ОZnOН + + Н +
или в молекулярной форме
2ZnSO 4 + 2Н 2 О (ZnOH) 2 SO 4 + H 2 SO 4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO 4 имеет кислую реакцию (рН
Пример
4. Какие
продукты образуются при смешивании
растворов A1(NO 3) 3
и К 2 СО 3 ?
Составьте ионно-молекулярное и
молекулярное уравнение реакции.
Какие
продукты образуются при смешивании
растворов A1(NO 3) 3
и К 2 СО 3 ?
Составьте ионно-молекулярное и
молекулярное уравнение реакции.
Решение. Соль A1(NO 3) 3 гидролизуется по катиону, а К 2 СО 3 — по аниону:
А1 3+ + Н 2 О А1ОН 2+ + Н +
СО 2- 3 + Н 2 О НСО — з + ОН —
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН — образуют молекулу слабого электролита Н 2 О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН) 3 и СО 2 (Н 2 СО 3). Ионно-молекулярное уравнение:
2А1 3+ + ЗСО 2- 3 + ЗН 2 О = 2А1(ОН) 3 + ЗСО 2
молекулярное уравнение: ЗСО 2 + 6KNO 3
2A1(NO 3) 3 + ЗК 2 СО 3 + ЗН 2 О = 2А1(ОН) 3
- Многие кислоты растворяются в воде, придавая ей кисловатый вкус. Чтобы узнать присутствие кислоты в растворе применяются индикаторы: лакмус и метиловый оранжевый окрашиваются в красный цвет.

- Со щелочами взаимодействуют сильные кислоты. Происходит реакция нейтрализации, из — за того, что кислая среда кислоты, а так же щелочная среда щелочи в сумме образуют нейтральную среду воды. Сокращенное ионное уравнение реакции нейтрализации имеет общий вид: Н + + ОН — → Н 2 О
- Взаимодействуют с основными и амфотерными основаниями и оксидами, образуя соли и воду. Данные реакции из-за образования электролита всегда проходят до конца. В них растворяются многие оксиды и нерастворимые основания.
- Возможно взаимодействие кислот с солями, при условии образования малорастворимых или газообразных веществ.
Взаимодействие кислот с металлами:
Классификаций кислот:
По составу кислотного остатка кислоты делятся на:
- кислородсодержащие — это гидроксиды. Они относятся к этой группе, так как содержат в своем составе ОН — группу. К ним относятся кислоты:
- серная — H 2 SO 4 ;
- сернистая — H 2 SO 3 ;
- азотная — HNO 3 ;
- фосфорная — H 3 PO 4 ;
- угольная — H 2 CO 3 ;
- кремниевая — H 2 SiO 3 .

- бескислородные — кислорода в своем составе не имеют. К ним относятся кислоты:
- фтороводородная HF;
- хлороводородная или соляная HCl;
- бромоводородная HBr;
- иодоводородная HI;
- сероводородная H 2 S.
По количеству атомов водорода в составе:
- одноосновные (HNO 3 ,HF и др.),
- двухосновные (H 2 SO 4 ,H 2 CO 3 и др.),
- трехосновные (H 3 PO 4).
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH) 2 – гидроксид кальция и др.
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH 4 + (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH 3 + H 2 O = NH 4 OH (гидроксид аммония).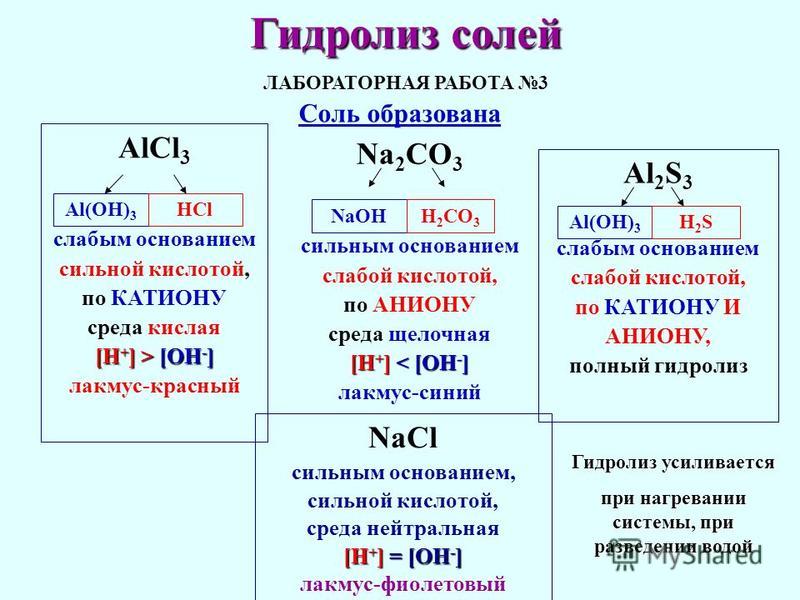
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH) 3 , Ca(OH) 2 , Fe(OH) 3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH) 2 , Sr(OH) 2 , Ba(OH) 2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.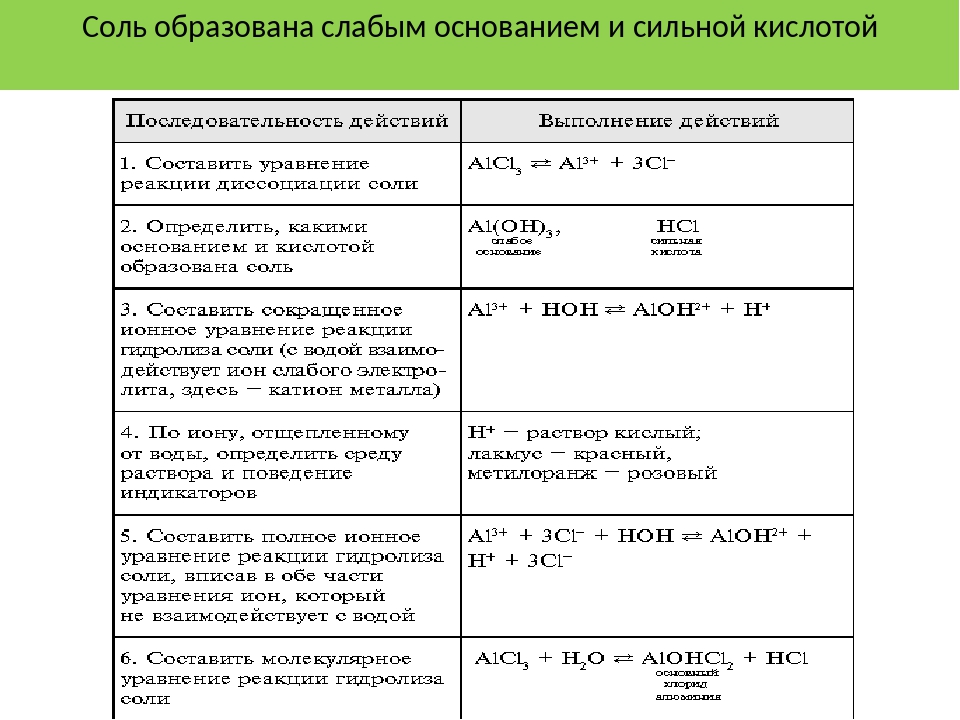
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы . Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO 2 → Na 2 SiO 3 + H 2 O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H 2 SO 4 → K 2 SO 4 + 2H 2 O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH) 2 = CuO + H 2 O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Все кислоты, их свойства и основания делятся на сильные и слабые. Но не смейте путать такие понятия как «сильная кислота» или «сильное основание» с их концентрацией. Например, нельзя сделать концентрированный раствор слабой кислоты или разбавленный раствор сильного основания. Например, соляная кислота, когда растворяется в воде то отдает каждой из двух молекул воды по одному своему протону.
Когда происходит химическая реакция в ионе гидроксония ион водорода очень прочно связывается с молекулой воды. Сама реакция будет происходит до тех пор, пока полностью не исчерпаются ее реагенты. Наша вода в этом случае играет роль основания, так как получает протон от соляной кислоты. Кислоты, которые диссоциируются нацело в водных растворах, называются сильными.
Кислоты, которые диссоциируются нацело в водных растворах, называются сильными.
Когда нам известно самая начальная концентрация сильной кислоты, то в данном случае не составляет труда подсчитать какая концентрация ионов гидроксония и хлорид-ионов в растворе. Например, если вы возьмете и в 1 литр воды растворите 0,2 моля газообразной соляной кислоты, концентрация ионов после диссоциации будет точно такой же.
Примеры сильных кислот:
1) HCl — соляная кислота;
2) HBr — бромводород;
3) HI — йодоводород;
4) HNO3 — азотная кислота;
5) HClO4 — хлорная кислота;
6) h3SO4 — серная кислота.
Все известные кислоты (за исключением серной кислоты), представлены в списке выше и являются монопротоновыми, так как их атомы отдают по одному протону; молекулы серной кислоты могут с легкостью отдавать два своих протона, именно поэтому серная кислота является дипротоновой.
К сильным основаниям относятся электролиты, они полностью диссоциируются в водных растворах с образованием гидроксид-иона.
Аналогично с кислотами, вычислить концентрацию гидроксид-иона очень просто, если вы узнаете исходную концентрацию раствора. Например, раствор NaOH с концентрацией 2 моль/л диссоциирует на такую же концентрацию ионов.
Слабые кислоты. Основания и свойства
Что касается слабых кислот, то они диссоциируются не полностью, то есть частично. Различать сильные и слабые кислоты очень просто: если в справочной таблице рядом с названием кислоты показана ее константа то эта кислота является слабой; если же константа не приведена то данная кислота является сильной.
Слабые основания также хорошо реагируют с водой с образованием равновесной системы. Слабые кислоты также характеризуются константой диссоциации К.
Сильные и слабые кислоты и основания
1. «Силачи» и «слабаки» в мире кислот и оснований
Выполнила учитель химии-экологииМОУ«СОШ с. Усть-Курдюм»
Филимонова И.В.
2. Кислоты сильные и слабые
Все кислоты, независимо от их происхождения,объединяет общее свойство – они содержат атомы
водорода, способные вступать в реакцию.
 В связи
В связис этим кислотам можно дать следующее
определение: «Кислота – это сложное вещество,
в молекуле которого имеется один или
несколько атомов водорода и кислотный
остаток».
3. Основание сильное и слабое
Основания – это сложные вещества,состоящие из ионов металлов и связанных с
ними гидроксид- ионов
KOH
4. Основание сильное и слабое
Сильное основание — неорганическое химическоесоединение, образованное гидроксильной группой ОН и щелочным (элементы I группы периодической
системы: Li, K, Na, RB, Cs) или щелочноземельным
металлом (элементы II группы Ba, Ca).
LiOH, KOH, NaOH, RbOH, CsOH, Са(ОН)₂, Ва(ОН)₂
Они растворимы в воде и называются щелочами
Наличие щелочей в растворе определяется по
изменению окраски индикаторной бумаги.
5. Кислоты сильные и слабые
Под их силой понимается способность отдаватьионы водорода. Если кислота легко отдает эти
ионы (вступает в химическую реакцию), то она
сильная.

HCl ↔ H+ + ClКак можно узнать, слабая кислота, или сильная?
6. Кислоты сильные и слабые
Самый простой и наглядный способ (хоть и не оченьточный) – это использование специальных
индикаторных полосок, которые можно
приобрести в магазине. Надо нанести на такую
полосу каплю кислоты и через некоторое время
сравнить цвет и интенсивность проявившейся
окраски с образцами, указанными на упаковке.
Чем более яркий, «насыщенный» краснобордовый цвет будет у образца – тем сильнее
кислота, и, наоборот.
7. «Силачи» и «слабаки» в мире кислот и оснований
Универсальнаяиндикаторная бумага
Изменение окраски в растворе
щелочи и кислоты
Светло-жёлтые полоски индикаторной бумаги в растворе щёлочи приобрели
синеватую окраску, а в растворе кислоты — бурую. Индикатор цветовым
сигналом отметил разные количества свободных ионов водорода в этих
жидкостях.
8. Полоску индикаторной бумаги обмакнуть в исследуемый раствор, затем быстро положить на белую подложку.
 Быстро нужно потому, что индикатор растворится в жидкости и
Быстро нужно потому, что индикатор растворится в жидкости ибумажка станет белой. Далее сравнить с эталоном цветной
шкалы.
9. Как проверить рыбу и мясо на свежесть с помощью индикаторной бумаги
На куске мяса или рыбы сделаем глубокие надрезы, в которые вложим смоченныедистиллированной водой индикаторные бумажки. Бумажки нужно прижать стеклянной
палочкой или зажать в надрезе. Минут через десять, вынув бумажки, посмотреть,
изменился ли их цвет.
Если бумажки указывают на нейтральную или слабокислую реакцию — мясо и рыба
хорошего качества. Если реакция кислая — продукт недоброкачественный.
10. В химии есть вещества, обладающие способностью менять свою окраску в присутствии кислот и щелочей. Эти вещества называются
индикаторами иприменяются для определения реакционной среды.
Существует много видов различных индикаторов.
Фенолфталеин
Метиловый оранжевый
Лакмус
(добывают из лишайников)
12. Действие кислот и щелочей на металлы
Молоток хранился вкладовке на одной полке с
соляной кислотой.

Покрылся ржавчиной.
13. Лабораторные опыты:
Испытание растворов соляной, лимоннойкислот, гидроксида натрия, соды, хлорида
алюминия индикаторами.
Взаимодействие соляной кислоты с
гидроксидом натрия
Как определить, является ли кислота сильной или слабой с помощью DAT
Как человек, изучающий DAT, вы уже сталкивались с этой распространенной проблемой: какая молекула кислоты является более сильной? При оценке силы кислоты важнее всего смотреть не на саму кислоту, а на сопряженное с ней основание. Руководящий принцип заключается в том, что чем стабильнее сопряженное основание А, тем сильнее соответствующая ему кислота НА.
Немного предыстории, прежде чем идти дальше: электроноакцепторные группы (EWG) — это заместители, которые притягивают электронную плотность соседних атомов.Электроноакцепторные группы включают такие вещества, как галогены, цианиды и производные карбоновых кислот. Они создают диполь, в котором ЭВГ имеет частичный отрицательный заряд, а атом углерода, к которому он присоединен, имеет частичный положительный заряд. Этот углерод с положительным зарядом помогает стабилизировать отрицательный заряд в сопряженном основании.
Этот углерод с положительным зарядом помогает стабилизировать отрицательный заряд в сопряженном основании.
1.) Резонанс
Если отрицательный заряд сопряженного основания можно распределить по большему числу атомов, тем стабильнее будет анион.
2.) Электроотрицательность атома с отрицательным зарядом
Сравнивая стабильность сопряженного основания, обратите внимание на атомы, имеющие отрицательный заряд, и сравните их относительную электроотрицательность. Чем больше электроотрицательность атома, тем сильнее удерживаются электроны. В результате это приводит к более стабильному аниону.
3.) Размер атома с отрицательным зарядом
Также посмотрите на размер атома с отрицательным зарядом. Если отрицательный заряд находится на более крупном атоме, заряд может быть распределен по большему пространству, создавая более стабильный анион.
4.) Индукционные эффекты
Наличие электроноакцепторных групп приводит к более стабильному аниону. Чем больше электроноакцепторных групп, тем устойчивее анион. Кроме того, чем ближе электроноакцепторная группа к отрицательному заряду, тем стабильнее анион.
Чем больше электроноакцепторных групп, тем устойчивее анион. Кроме того, чем ближе электроноакцепторная группа к отрицательному заряду, тем стабильнее анион.
5.) Гибридизация
При сравнении алканов, алкенов и алкинов как кислот важным принципом является природа орбитали, содержащей неподеленную пару электронов в сопряженном основании.Орбиталь с большим характером s имеет меньшую энергию и, следовательно, более устойчива. Алканы имеют sp3-орбиталь (25% s ), алкены имеют sp2-орбиталь (33% s ), а алкины имеют sp-орбиталь (50% s).
По повышению кислотности:
Алканы < Алкены < Алкины
Запоминание этих пяти определяющих факторов стабильности позволит вам быстро сравнивать молекулы и определять, какая кислота является более сильной.
Артикул
Браун, Уильям и др.Органическая химия. 6-е изд., Cengage Learning, 2012.
Слабые кислоты
Слабые кислоты
Почему кислоты слабые или сильные?
Любая кислота реагирует с водой. Когда он теряет протон, он передает этот протон воде. Вода действует как основание, когда она сольватирует протон. Конъюгатная кислота является протонированной водой, и она представлена как (H 3 O) + , (H 5 O 2 ) + , (H 2N O N ) + или просто H + (водн.).Сопряженное основание представляет собой кислоту без ее протона.
Когда он теряет протон, он передает этот протон воде. Вода действует как основание, когда она сольватирует протон. Конъюгатная кислота является протонированной водой, и она представлена как (H 3 O) + , (H 5 O 2 ) + , (H 2N O N ) + или просто H + (водн.).Сопряженное основание представляет собой кислоту без ее протона.Сильная кислота полностью диссоциирует в воде, в то время как слабая кислота находится в равновесии со своим сопряженным основанием в воде. Давайте посмотрим на реакцию сильной кислоты, азотной кислоты или HNO 3 , и более слабой кислоты, азотистой кислоты или HNO 2 , в воде.
Азотная кислота является более сильной кислотой, чем азотистая кислота, поскольку сопряженное с ней основание более стабильно. Ион NO 3 — имеет избыточный отрицательный заряд, распределенный по 3 атомам кислорода, в то время как избыточный отрицательный заряд в NO 2 — распределен по 2 атомам кислорода.
Сопряженное основание более стабильно, когда отрицательный заряд находится на электроотрицательном элементе и когда заряд делокализован по нескольким атомам. Чем стабильнее сопряженное основание, тем сильнее кислота. Стабильное сопряженное основание не является очень основным. Очень сильная кислота имеет очень слабое сопряженное основание, а очень слабая кислота имеет очень сильное сопряженное основание.
Равновесие слабой кислоты
Азотистая кислота находится в равновесии с протоном и его сопряженным основанием, NO 2 — .Поскольку концентрация воды постоянна, мы можем определить константу, равную произведению концентрации воды на константу равновесия. Эта константа K a равна 10 -3,29 для HNO 2 . Мы можем использовать K a для определения pH раствора азотистой кислоты. Например, определим рН раствора, приготовленного из 0,01 моль HNO 2 в 1,0 л воды.
Часть кислоты диссоциирует на H + и NO 2 — , но мы не знаем w=сколько.Мы назовем молярную концентрацию сольватированных протонов x, поэтому [H + ] = x. Это означает, что концентрация NO 2 — также должна быть равна x, поскольку они образуются в равных количествах при диссоциации кислоты. Концентрация
Всегда можно найти x, используя квадратное уравнение, но в большинстве случаев мы можем решить его, используя приближение. Если предположить, что степень диссоциации невелика, то равновесная концентрация кислоты не сильно изменится по сравнению с ее исходной концентрацией.Затем мы можем использовать исходную концентрацию кислоты в выражении K a .
В данном случае аппроксимация является хорошей, потому что с ее помощью мы получаем то же значение pH, что и из квадратного уравнения.
Реакция между слабыми кислотами и сильными основаниями
Сильные основания полностью реагируют со слабыми основаниями, образуя сопряженное основание слабой кислоты. Тогда наступит равновесие между слабой кислотой и сопряженным с ней основанием в воде.
Тогда наступит равновесие между слабой кислотой и сопряженным с ней основанием в воде.Например, давайте посмотрим на раствор, полученный при смешивании 0.010 моль HNO 2 и 0,004 моль NaOH в 1,0 л воды. Опять же, мы можем использовать приближение, чтобы решить это. Приближение верно, потому что степень диссоциации будет небольшой, когда уже присутствует некоторый продукт.
Слабые кислоты и сильные кислоты
Константы кислотной диссоциации ряда кислот приведены в таблицах. В таблице перечислены значения pKa. pK a = -log(K a )Очень сильные кислоты, которые полностью диссоциируют в воде, различают, исследуя равновесие их кислотной диссоциации в неводных растворителях и pK a для воды. оценивается.Константы равновесия для более слабых кислот (pK a >0) определяют из измерений рН растворов.
Назад Компас Показатель Столы Введение Следующий
Основания
Некоторые ионные соединения с другими анионами
чем гидроксид, являются слабыми основаниями Аррениуса. Ацетат натрия, NaC 2 H 3 O 2 ,
является примером. При растворении образует ионы натрия Na + ,
и ацетат-ионы, C 2 H 3 O 2 − .Последние обратимо реагируют с водой с образованием уксусной кислоты.
молекулы, HC 2 H 3 O 2 и гидроксид-ионы,
ОН — . В этой реакции ион Н + переносится
от каждой молекулы воды до ацетат-иона.
Ацетат натрия, NaC 2 H 3 O 2 ,
является примером. При растворении образует ионы натрия Na + ,
и ацетат-ионы, C 2 H 3 O 2 − .Последние обратимо реагируют с водой с образованием уксусной кислоты.
молекулы, HC 2 H 3 O 2 и гидроксид-ионы,
ОН — . В этой реакции ион Н + переносится
от каждой молекулы воды до ацетат-иона.
NaC 2 H 3 O 2 (с) → Na + (водн.) + C 2 H 3 O 2 − (водный)
C 2 H 3 O 2 − (водн.) + H 2 O(л)
→ HC 2 H 3 O 2 (водн.) + OH – (водн.)
Оба C 2 H 3 O 2 − ионы OH — сильно притягивают ионы H + достаточно, чтобы постоянно передавать их туда и обратно. В очень коротком
время скорость прямой реакции становится равной скорости
обратная реакция с выходом постоянного количества C 2 H 3 O 2 − ,
вода, HC 2 H 3 O 2 и OH − . То
ион гидроксида притягивает ионы H + сильнее, чем
ацетат-ион делает, поэтому реакция приводит к большему количеству C 2 H 3 O 2 − в конечном растворе, чем ОН — .В типичном решении
ацетат натрия, на каждые 100 000 добавленных ионов ацетата приходится 99 998
ионы ацетата, C 2 H 3 O 2 − ,
2 молекулы уксусной кислоты, HC 2 H 3 O 2 и 2
ионы гидроксида, ОН — .
В очень коротком
время скорость прямой реакции становится равной скорости
обратная реакция с выходом постоянного количества C 2 H 3 O 2 − ,
вода, HC 2 H 3 O 2 и OH − . То
ион гидроксида притягивает ионы H + сильнее, чем
ацетат-ион делает, поэтому реакция приводит к большему количеству C 2 H 3 O 2 − в конечном растворе, чем ОН — .В типичном решении
ацетат натрия, на каждые 100 000 добавленных ионов ацетата приходится 99 998
ионы ацетата, C 2 H 3 O 2 − ,
2 молекулы уксусной кислоты, HC 2 H 3 O 2 и 2
ионы гидроксида, ОН — .
Мы можем ожидать анионов в других водорастворимых
ионные соединения, содержащие катионы металлов 1 и 2 групп, реагирующие с
воды способом, аналогичным реакции в ацетате натрия.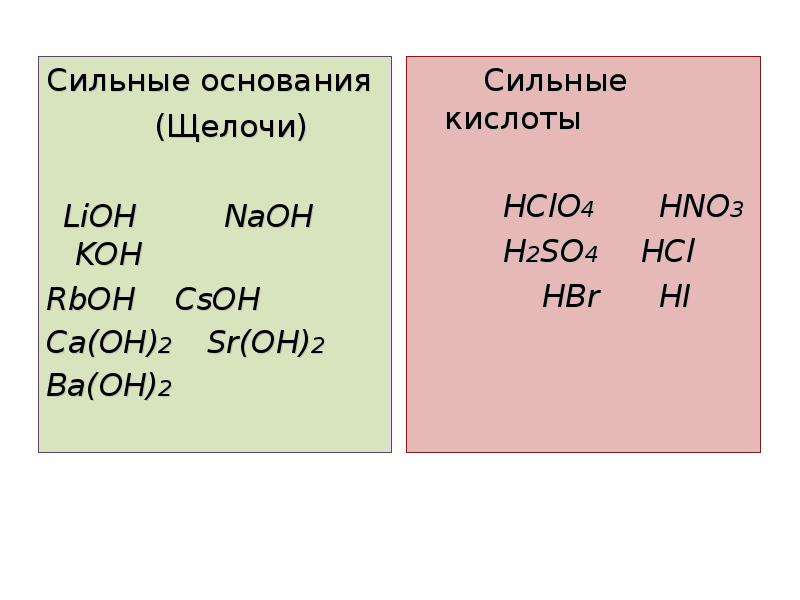 решение.
решение.
NaA(s) → Na + (водн.) + A − (водн.) A − = анион
А − (водн.) + H 2 О(л) ГК (водн.) + OH – (водный)
Некоторые анионы не реагируют с водой. Это анионы, образованные из сильных моноосновных кислот: Cl — , Br — , I — , NO 3 — и ClO 4 — .Они очень стабильны в водном растворе, поэтому практически не склонны для привлечения ионов H + . Ионные соединения, содержащие эти ионы не являются кислотами или основаниями в кислотно-основном смысле Аррениуса. Они не реагировать с водой с образованием H 3 O + или OH — . Мы называем их нейтральными в Кислотно-щелочное чувство Аррениуса.
NaCl(ы) → Na + (водн.
) + Cl — (водн.)
Cl − (водн.) + H 2 О(л) никакой реакции
Анионы, созданные в результате неполной потери реакции ионов водорода полипротонными кислотами могут быть кислыми или основными.это полезно помнить, что следующие два иона являются кислотными: водород сульфат (HSO 4 − ) и дигидрофосфат (H 2 PO 4 − ). Гидросульфат натрия применяют как дезинфицирующее средство и в производстве бумаги, мыла, парфюмерии, продуктов питания и промышленных чистящих средств. Котловая вода обрабатывается дигидрофосфатом натрия, чтобы свести к минимуму накопление накипь на стенках котла и NaH 2 PO 4 также используется в качестве пищевой добавки, а также в средствах для снятия краски и чистящих средствах.
NaHSO 4 (т) → Na + (водн.
) + HSO 4 − (водн.)
HSO 4 − (водн.) + H 2 O(л)
H 3 O + (водн.) + SO 4 2− (водн.)
NaH 2 PO 4 (s) → Na + (водн.) + H 2 PO 4 − (водн.)
H 2 PO 4 − (водн.) + Н 2 О(л)
H 3 O + (водн.) + HPO 4 2− (водн.)
ОСНОВ
ОСНОВОСНОВАНИЯ
Основания являются акцепторами протонов.Мы уже видели двоих, OH — .
и H 2 O. Когда мы сравниваем силу этих двух, должно быть ясно, что
OH – — более сильное основание, так как при отрицательном заряде оно с большей вероятностью
«принимать» положительный протон.
Рассмотрим водный раствор Na 2 O. Такой раствор, состоящий из ионов натрия и оксида, будет реагировать с водой, как показано ниже:
O 2- + H 2 O —> OH — + OH —
Оксидявляется более сильным основанием, чем ОН —, так как он имеет два отрицательные заряды, которые должны притягивать протон сильнее, чем даже ОН —.Поэтому мы можем ранжировать эти основания от более сильных к более слабым следующим образом:
O 2- > OH — > H 2 O.
Обратите внимание, что все эти основания могут вступать в реакцию с водой с образованием OH — . в растворе.
Основания могут быть прочными (например, O 2- и OH — ) — аналогичны сильным кислотам (азотная, серная, соляная) или слабым (типа H 2 O и аммиак — NH 3 ).
NH 3 — обычное слабое основание, как показано ниже.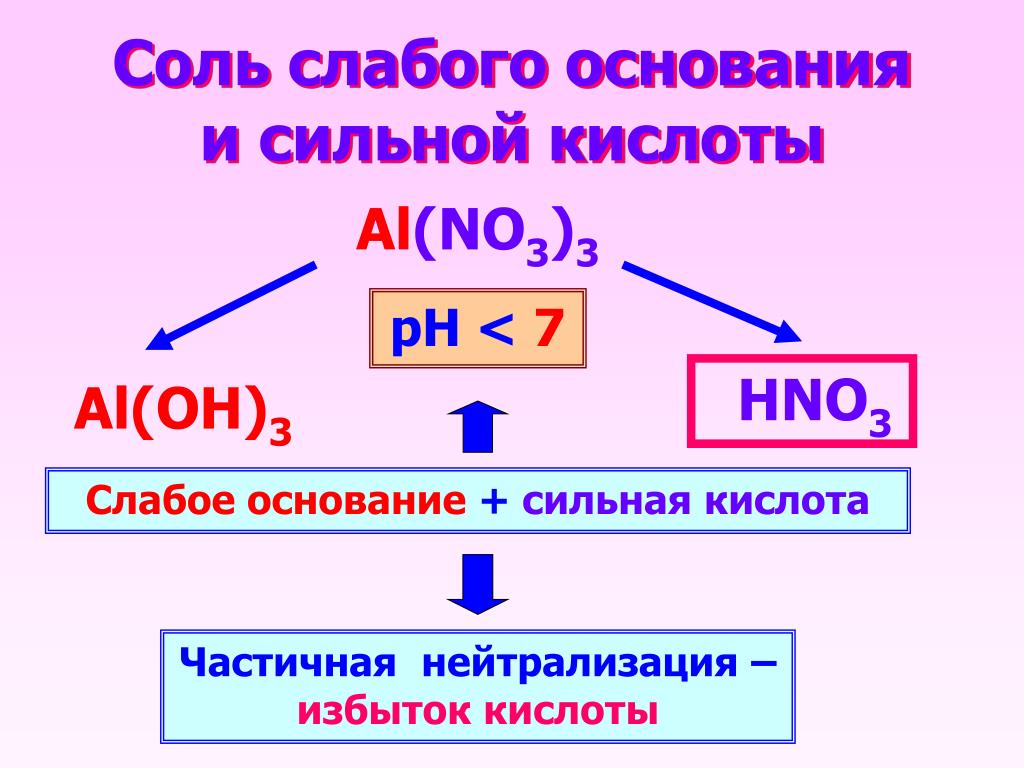 аммиак
принимает протон из воды, образуя другое основание, ОН — , которое явно является
более сильное основание, чем аммиак. Следовательно, с точки зрения устойчивости обратная реакция имеет вид
предпочтение (переход от более сильной кислоты и основания к более слабой кислоте и основанию):
аммиак
принимает протон из воды, образуя другое основание, ОН — , которое явно является
более сильное основание, чем аммиак. Следовательно, с точки зрения устойчивости обратная реакция имеет вид
предпочтение (переход от более сильной кислоты и основания к более слабой кислоте и основанию):
NH 3 + H 2 O —> NH 4 + + OH —
Сила основания может быть определена путем написания соответствующей кислоты/основы. реакция, и зная, какие кислоты являются сильными или слабыми.Например, ранжируйте следующее из от минимального до самого простого:
Cl —, NO 3 —, H 2 O и CH 3 COO .
Эти базы очень разные по структуре. Чтобы ранжировать их, напишите реакции кислот, которые производят эти основания, когда они реагируют в воде, и определяют относительная сила оснований в каждой реакции (s = сильный, w = слабый):
HCl(
sa ) + H 2 O( sb ) <==> H 3 O + ( wa ) + 905 9 — —HNO 3 ( SA ) + H 2 O ( SB ) <==> H 3 O + ( WA ) + NO 3 — ( WA )
CH 3 COOH ( WA ) + H 2 O ( WB ) <==> H 3 O + ( SA ) + CH 3 COO — ( са )
Из списка понятно, по базовой силе:
Cl — и NO 3 — < (менее основные) < H 2 O < CH 3 COO —
Для оснований, сходных по структуре, химическое
реактивность можно сравнивать напрямую. Используя следующие реакции, ранжируйте следующие
от наименее основного к наиболее основному: F-, Cl-, Br-, I-.
Используя следующие реакции, ранжируйте следующие
от наименее основного к наиболее основному: F-, Cl-, Br-, I-.
HF + H 2 O —> H 3 O + + F —
HCl + H 2 O —> H 3 O+ + Cl —
HBr + H 2 O —> H 3 O + +Бр —
Hl + H 2 O —> H 3 O + + Я —
Мы изучали этот пример ранее, где мы оценили HI как сильнейшего кислота и HF самые слабые в ряду (из-за разбавления отрицательного заряда на продукт).Следовательно, I — является наиболее стабильным и наименее основным, а F — — наиболее устойчивым. наименее стабильный и самый простой.
Сильные основания полностью взаимодействуют с сильными кислотами, такими как HCl, с
образуют соль и воду в реакции нейтрализации.
Пример: HCl + NaOH ———-> H 2 O + NaCl
Другими сильными основаниями являются растворимые оксиды, такие как Na 2 O и растворимые гидроксидные соли.Сильные основания являются сильными электролитами. Слабые основания не полностью взаимодействуют в воде (ионизуются) с образованием ОН — и положительный ион.
Пример. NH 3 + H 2 O ———-> NH 4 + +ОН —
Слабые основания полностью взаимодействуют с сильной кислотой, такой как HCl, с образуют соль.
Пример: NH 3 + HCl ———-> NH 4 Cl
Слабые основания являются слабыми электролитами.Основания имеют одну или несколько пар несвязанных электронов, которые они
использовать для образования связи с протоном (т.е. для принятия протона). Обратите внимание, что
аммиак является нашим прототипом слабого основания (по аналогии с уксусной кислотой). слабая кислота). Функциональная группа амина аналогична по структуре
аммиак с одной, двумя или тремя буквами H на аммиаке, замененными группой R. Амины,
если к ним не присоединены четыре R-группы (четвертичный амин), есть неподеленная пара
электронов, которые, как и неподеленная пара в аммиаке, могут принять протон.
Следовательно, амины, как и аммиак, являются слабыми основаниями. Карбоновые кислоты
слабые кислоты биохимии.
слабая кислота). Функциональная группа амина аналогична по структуре
аммиак с одной, двумя или тремя буквами H на аммиаке, замененными группой R. Амины,
если к ним не присоединены четыре R-группы (четвертичный амин), есть неподеленная пара
электронов, которые, как и неподеленная пара в аммиаке, могут принять протон.
Следовательно, амины, как и аммиак, являются слабыми основаниями. Карбоновые кислоты
слабые кислоты биохимии.
Сильные и слабые кислоты/основания — Химия колледжа
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно
или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному агенту, указанному ниже.Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно искажать информацию о том, что продукт или деятельность нарушают ваши авторские права.Таким образом, если вы не уверены, что содержимое находится на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
Сент-Луис, Миссури 63105
Или заполните форму ниже:
Слабые кислоты, слабые основания и буферы — видео и расшифровка урока
Сопряженные кислоты и основания
Важной кислотой в крови является угольная кислота, h3CO3. Угольная кислота может диссоциировать в воде с образованием ионов водорода и гидрокарбоната HCO3-. В этом случае угольная кислота служит кислотой, отдающей ионы водорода и оставляющей сопряженное основание , которое получают удалением иона водорода из конкретной кислоты. Точно так же гидрокарбонат, действующий как основание, может реагировать с ионом водорода с образованием угольной кислоты, которая представляет собой сопряженную кислоту , которая образуется путем добавления иона водорода к основанию.
Угольная кислота может диссоциировать в воде с образованием ионов водорода и гидрокарбоната HCO3-. В этом случае угольная кислота служит кислотой, отдающей ионы водорода и оставляющей сопряженное основание , которое получают удалением иона водорода из конкретной кислоты. Точно так же гидрокарбонат, действующий как основание, может реагировать с ионом водорода с образованием угольной кислоты, которая представляет собой сопряженную кислоту , которая образуется путем добавления иона водорода к основанию.
Константа кислотности и pKa
Не все слабые кислоты одинаковы.Некоторые слабые кислоты сильнее других, и мы можем измерить это, что называется константой кислотности . Для конкретной реакции с кислотой — в данном случае я назову ее НА, так что Н — это ион водорода, который она собирается отдать, — она может частично диссоциировать с образованием некоторого количества А- и некоторого количества ионов водорода.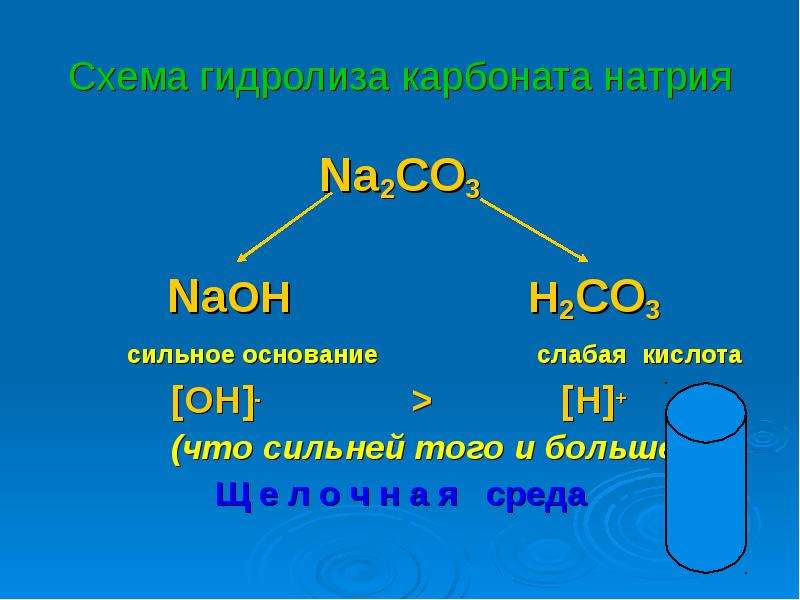 как его продукты. Чтобы выяснить, как далеко зашла эта реакция, мы можем взять концентрацию ионов водорода, умножить ее на концентрацию А- и разделить на концентрацию ГК, которая все еще остается в растворе.-7). Сейчас на эти цифры не очень приятно смотреть. Итак, аналогично pH, мы модифицируем его, и у нас есть нечто, называемое pKa, которое является отрицательным логарифмом Ka. Итак, в этом случае pKa угольной кислоты составляет 6,1, что является более сильным показателем. Вода имеет pKa 14, поэтому угольная кислота значительно более кислая, чем вода, что неудивительно, учитывая, что вода имеет нейтральный pH.
как его продукты. Чтобы выяснить, как далеко зашла эта реакция, мы можем взять концентрацию ионов водорода, умножить ее на концентрацию А- и разделить на концентрацию ГК, которая все еще остается в растворе.-7). Сейчас на эти цифры не очень приятно смотреть. Итак, аналогично pH, мы модифицируем его, и у нас есть нечто, называемое pKa, которое является отрицательным логарифмом Ka. Итак, в этом случае pKa угольной кислоты составляет 6,1, что является более сильным показателем. Вода имеет pKa 14, поэтому угольная кислота значительно более кислая, чем вода, что неудивительно, учитывая, что вода имеет нейтральный pH.
Буферы
Угольная кислота является важным компонентом крови и помогает регулировать ее рН.И вы можете задаться вопросом, почему он там, ведь у него pKa 6,1 и, похоже, он хочет отдать много ионов водорода. Оказывается, угольная кислота является частью того, что мы называем буферной системой . На самом деле в слабых кислотах и основаниях есть что-то действительно классное: мы можем поместить слабую кислоту и сопряженное с ней основание в раствор, чтобы получить раствор, рН которого не изменится при добавлении небольшого количества кислоты или основания.
Теперь кровь, pH которой должен быть около 7.4 с допустимым диапазоном от 7,35 до 7,45 имеет три буферные системы, помогающие держать его под контролем. Первая — это карбонатная буферная система, о которой мы уже говорили. В крови угольная кислота в первую очередь отвечает за удаление кислоты из окружающей среды, поэтому сопряженное с ней основание, гидрокарбонат, невероятно важно. Он реагирует с ионами водорода, которые образуются в нашем организме, например, когда мы занимаемся спортом. Он удаляет эти ионы водорода, реагируя с ними с образованием угольной кислоты.
Эта угольная кислота может затем перемещаться в нашей крови в легкие, где она может диссоциировать на воду и углекислый газ, а затем углекислый газ может быть выпущен через наши легкие в атмосферу.Это важная часть дыхания и помогает поддерживать рН нашей крови.
В дополнение к карбонату в качестве буферной системы в крови белки могут действовать как буферы, поскольку они могут принимать и отдавать ионы водорода. Другой важной буферной системой в нашей крови является фосфатная буферная система. Фосфатный буфер действительно хорошо диссоциирует, когда в систему добавляется основание, чтобы помочь увеличить концентрацию ионов водорода, чтобы помочь поддерживать рН крови на уровне около 7,4. pKa дигидрофосфата составляет около 7.1.
Наличие этих трех буферных систем в нашей крови невероятно важно, потому что они могут работать вместе, чтобы поддерживать стабильный рН нашей крови. Буферы действительно важны в биологии, в нашем организме, а также в лаборатории. В лаборатории ученые используют буферы в своих биологических экспериментах, чтобы помочь создать для клеток и белков среду, которую они находят там, где они были бы естественным образом.
Резюме урока
Напомним, что мы узнали, что кислоты выделяют ионы водорода и что они могут быть сильными кислотами , которые полностью диссоциируют в воде, или слабыми кислотами , которые диссоциируют частично. Мы узнали, что основания — это вещества, способные принимать ионы водорода. Эти основания могут быть сильными основаниями , которые полностью диссоциируют, или слабыми основаниями , которые лишь частично диссоциируют. Мы узнали, что сопряженная кислота основания представляет собой молекулу, которая образуется, когда это основание принимает ион водорода.
Мы узнали, что основания — это вещества, способные принимать ионы водорода. Эти основания могут быть сильными основаниями , которые полностью диссоциируют, или слабыми основаниями , которые лишь частично диссоциируют. Мы узнали, что сопряженная кислота основания представляет собой молекулу, которая образуется, когда это основание принимает ион водорода.
Мы также узнали, что сопряженное основание кислоты представляет собой молекулу, которая образуется, когда эта кислота отдает ион водорода.Мы узнали, что кровь содержит три важные буферные системы, и мы узнали, что константа кислотности и pKa могут сказать нам, насколько сильна или слаба кислота. Более низкая pKa является более сильной кислотой.
Результат обучения
После просмотра этого урока вы сможете:
- Сравнивать сильные и слабые кислоты и основания по отношению к крови человека
- Дайте определение сопряженным кислотам и основаниям
- Объясните, как константа кислотности и pKa влияют на то, насколько сильной или слабой является кислота
Слабые кислоты и основания — Кислотно-основные равновесия
Слабая кислота — это кислота, которая не полностью диссоциирует в растворе, а слабое основание — это химическое основание, которое не полностью ионизируется в водном растворе.
Слабые кислоты
A слабая кислота – это кислота, которая не полностью диссоциирует в растворе; это означает, что слабая кислота не отдает в растворе все свои ионы водорода (Н + ). Слабые кислоты имеют очень низкие значения K a (и, следовательно, более высокие значения pK a ) по сравнению с сильными кислотами, которые имеют очень большие значения K a (и слегка отрицательные значения pK a ).
Большинство кислот слабые.В среднем только около 1% раствора слабой кислоты диссоциирует в воде при концентрации 0,1 моль/л. Следовательно, концентрация ионов H + в растворе слабой кислоты всегда меньше, чем концентрация недиссоциированных частиц, HA. Примеры слабых кислот включают уксусную кислоту (CH 3 COOH), которая содержится в уксусе, и щавелевую кислоту (H 2 C 2 O 4 ), которая содержится в некоторых овощах.
Слабые кислоты ионизируются в водном растворе лишь в очень умеренной степени. Обобщенная реакция диссоциации представлена ниже, где HA представляет собой недиссоциированное соединение, а A – представляет собой сопряженное основание кислоты. Сила слабой кислоты представлена либо константой равновесия, либо процентом диссоциации. Равновесные концентрации реагентов и продуктов связаны выражением константы диссоциации кислоты K a.
Обобщенная реакция диссоциации представлена ниже, где HA представляет собой недиссоциированное соединение, а A – представляет собой сопряженное основание кислоты. Сила слабой кислоты представлена либо константой равновесия, либо процентом диссоциации. Равновесные концентрации реагентов и продуктов связаны выражением константы диссоциации кислоты K a.
Чем больше значение K a , тем более благоприятным является образование H + , что делает раствор более кислым; следовательно, высокое значение K a указывает на более низкий pH раствора.K a слабых кислот варьируется от 1,8×10 -16 до 55,5. Кислоты с K a менее 1,8×10 -16 являются более слабыми кислотами, чем вода. Если кислоты являются полипротонными, каждый протон будет иметь уникальный K a .
pH слабой кислоты можно найти, используя значение Ka. Но необходимо сделать ключевые предположения. Во-первых, концентрации диссоциированной кислоты и сопряженного основания Н + и А – равны. Кроме того, концентрация ГК такая же, как и заданная концентрация, из-за таких низких уровней диссоциации.Затем, используя уравнение Ка, мы можем преобразовать его, чтобы выделить концентрацию ионов Н+, и ввести в уравнение для рН.
Во-первых, концентрации диссоциированной кислоты и сопряженного основания Н + и А – равны. Кроме того, концентрация ГК такая же, как и заданная концентрация, из-за таких низких уровней диссоциации.Затем, используя уравнение Ка, мы можем преобразовать его, чтобы выделить концентрацию ионов Н+, и ввести в уравнение для рН.
Слабые основания
Основание — это вещество, которое может принимать ионы водорода (H + ) или, в более общем случае, отдавать пару валентных электронов. Слабое основание представляет собой химическое основание, которое не полностью ионизируется в водном растворе. Поскольку основания Бренстеда-Лоури являются акцепторами протонов, слабое основание также можно определить как химическое основание с неполным протонированием.Общая формула базового поведения выглядит следующим образом:
Основание может либо принимать протоны от молекул воды, либо отдавать раствору ионы гидроксида. Оба действия повышают pH раствора за счет снижения концентрации ионов H + . Это приводит к относительно низкому pH по сравнению с сильными основаниями. pH оснований в водном растворе колеблется от более 7 (pH чистой воды) до 14 (хотя некоторые основания имеют значения pH более 14). Формула рН:
Оба действия повышают pH раствора за счет снижения концентрации ионов H + . Это приводит к относительно низкому pH по сравнению с сильными основаниями. pH оснований в водном растворе колеблется от более 7 (pH чистой воды) до 14 (хотя некоторые основания имеют значения pH более 14). Формула рН:
pH = -log 10 [H + ]
Однако иногда удобнее ориентироваться на рОН оснований, а не на рН.Значение pOH более прямо указывает на [OH – ].
рОН = -log 10 [ОН – ]
Чтобы найти рН слабого основания, необходимо определить силу основания (данную в Kb) и концентрацию основания (молярность или количество молей основания на литр раствора):
- C 6 H 5 NH 2 (9,38)
- NH 3 (4,75)
- CH 3 NH 2 (3,36)
- CH 3 CH 2 NH 2 (3.27)
Меньшие значения pK b указывают на более высокие значения K b; это также указывает на более прочную базу.
Как и слабые кислоты, слабые основания имеют важное применение в биохимических исследованиях, химических реакциях и физиологических целях, особенно из-за их роли в буферных растворах. Слабые основания также могут быть использованы для катализа некоторых реакций.
Практические вопросы
Академия Хана
Официальная подготовка MCAT (AAMC)
Официальное руководство Раздел C/P Пассаж 5 Вопрос 21
Пакет вопросов по химии, отрывок 9, вопрос 50
Образец теста C/P Раздел 3, вопрос 11
Ключевые моменты
• Диссоциацию слабых кислот, которые являются наиболее популярным типом кислот, можно рассчитать математически и применить в экспериментальной работе.
• Если известны концентрация и K a слабой кислоты, можно рассчитать рН всего раствора. Точный метод расчета варьируется в зависимости от того, какие предположения и упрощения могут быть сделаны.
Точный метод расчета варьируется в зависимости от того, какие предположения и упрощения могут быть сделаны.
• Слабые кислоты и слабые основания необходимы для приготовления буферных растворов, которые имеют важные экспериментальные применения.
• Основание — это вещество, которое может принимать ионы водорода (H + ) или, в более общем смысле, отдавать пару валентных электронов; поэтому слабое основание не полностью ионизирует или полностью принимает ионы водорода в водном растворе.
• Основания повышают pH; слабые основания оказывают менее резкое влияние на рН.
• pOH иногда используется в качестве альтернативы pH для количественного определения относительной концентрации H + /гидроксида в растворе.
• Константа диссоциации основания, K b , математически представляет относительную силу основания и аналогична константе диссоциации кислоты; более слабые основания имеют меньшие значения K b .
• Как и слабые кислоты, слабые основания можно использовать для приготовления буферных растворов.
Основные термины
слабая кислота : Кислота, которая не полностью диссоциирует, отдавая в раствор только часть ионов водорода
Основание сопряжения : Вид, созданный после пожертвования протона.
Конъюгированная кислота : соединения, образующиеся, когда основание принимает протон
Енолят: Депротонированный енол
Энол : Органический спирт с функциональной группой -ОН, расположенной вне двойной связи
Слабое основание: Акцептор протонов, который не полностью ионизируется в водном растворе.
.



 Сильная к-та
Сильная к-та


 ) +
Cl — (водн.)
) +
Cl — (водн.) ) +
HSO 4 − (водн.)
) +
HSO 4 − (водн.)